KURIKULUM KTSP
KIMIA
TEKNOLOGI DAN INDUSTRI
SYAHRIAL, S.T
unt
uk
SM
K
KATA PENGANTAR
Syukur kehadirat Allah SWT atas segala kekuatan piker dan dzikir sehingga penyusun dapat menyelesaikan buku Kimia SMK kelas X bidang keahlian Teknologi dan Industri dengan segala kemudahan-Nya.
Buku Kimia SMK kelas X ini disusun berdasarkan kurikulum KTSP yang berfungsi membentuk peserta didik supaya memiliki dasar pengetahuan kimia yang luas dan kuat untuk menyesuaikan diri dengan perubahan yang terjadi di lingkungan social dan lingkungan kerja, serta mampu mengembangkan diri sesuai dengan perkembangan ilmu pengetahuan dan teknologi.
Buku Kimia SMK kelas X ini berisi materi-materi perubahan materi, lambang unsur, rumus kimia, konsep mol, struktur atom, sistem periodik dan ikatan kimia.
Penyusunan Buku Kimia SMK kelas X ini didasarkan pada kenyataan bahwa masih kurangnya sumber belajar pada mata pelajaran kimia bagi siswa kelas X SMK. Untuk itu penyusun selaku tenaga pengajar di SMK merasa perlu untuk segera memenuhi kebutuhan siswa tersebut demi kelancaran proses belajar mengajar di sekolah.
Pada kesempatan ini penyusun ingin menyampaikan ucapan terima kasih kepada semua pihak yang telah membantu penyusunan dan penerbitan buku ini. Secara khusus penyusun ingin menyampaikan ucapan terima kasih kepada Sandri Maulani, S.H (istri) atas segala dukungannya dalam memotivasi penyusun sampai selesainya buku ini.
Akhirnya tegur sapa, kritik dan saran dari kalangan akademisi dan pemakai buku ini sangat penyusun harapkan demi kemajuan bidang pendidikan.
Manggar, Pebruari 2010
DESKRIPSI PEMBELAJARAN
STANDAR
KOMPETENSI KOMPETENSI DASAR MATERI PEMBELAJARAN
1. Memahami
- Definisi dan deskripsi tentang materi
- Sifat dan jenis materi 1.2Mengelompokkan
perubahan materi
- Perubahan materi: perubahan fisika dan perubahan kimia
1.3 Mengklasifikasi materi - Klasifikasi materi: tunggal, campuran homogen dan
- Model atom Dalton, Thomson, Rutherford dan teori atom modern (kuantum)
- Penyusunan dan pengisian elektron (konfigurasi elektron)
- Nomor atom, nomor massa, simbol atom, isotop
- Pemanfaatan tabel periodik unsur kimia
- Sifat logam dan non logam.
- Periode dan golongan
- Ikatan kovalen dan kovalen koordinasi
STANDAR
KOMPETENSI KOMPETENSI DASAR MATERI PEMBELAJARAN
4. Memahami
- Penggunaan konsep mol dalam penentuan rumus kimia 5.2 Memahami
stoikiometri
- Stoikiometri dan perhitungan kimia
- Konsep dasar reaksi kimia
- Reaksi asam-basa
DAFTAR ISI
Interpretasikan data dalam tabel sistem periodik ……….
Ikatan van der Walls
……… ………
BAB IV
BAB V
Konsep
mol ... ...
Stoikiometri
……… ………..
BAB VI
Reaksi
kimia ... ...
Konsep oksidasi-
reduksi ... .
Daftar Pustaka
……… ………..
BAB I
SIFAT DAN JENIS MATERI
Materi adalah material fisik yang menyusun alam, yang bisa diartikan sebagai segala sesuatu yang mempunyai massa dan menempati ruang. Materi dapat berbentuk gas, cair, dan padat.
Contoh: udara, kapur, meja.
Kimia mempelajari komposisi, struktur dan sifat dari materi, serta perubahan kimia yang terjadi dari materi satu ke yang lainnya. Contoh: kayu terbakar menjadi arang.
Gambar di bawah menunjukkan sebagian permukaan bumi. Unsur aluminium, besi, oksigen, dan silikon merupakan 88% penyusun permukaan bumi dalam bentuk padatan. Air pada permukaan bumi dan dalam bentuk gas tersusun dari hidrogen dan oksigen. 99% udara tersusun dari nitrogen dan oksigen. Hidrogen, oksigen, dan karbon adalah 97% penyusun tubuh manusia.
Sifat yang tidak mengubah sifat kimia suatu materi. Karakteristik fisika bau, kekerasan, titik didih, wujud materi.
Sifat Kimia
Sifat yang mengubah sifat kimia suatu materi. Menerangkan bagaimana suatu materi bereaksi dengan materi yang lain membentuk suatu materi baru.
Ciri-ciri yang mengindikasikan adanya perubahan kimia : Perubahan warna
Perubahan bau Pembentukan gas Timbulnya cahaya
Pembentukan endapan baru Perubahan pH.
Contoh :
Gula adalah senyawa yang mudah terurai (dekomposisi) dengan pemanasan menjadi senyawa yang lebih sederhana, misalnya karbon hitam (arang), yang tidak dapat terurai lagi baik secara fisika maupun kimia, tetapi dapat berubah struktur dan sifatnya menjadi grafit dan intan.
PERUBAHAN MATERI
Perubahan materi adalah perubahan sifat suatu zat atau materi menjadi zat yang lain baik yang menjadi zat baru maupun tidak. Perubahan materi terbagi menjadi dua macam, yaitu :
1. Perubahan Materi Secara Fisika atau Fisis
Perubahan fisika adalah perubahan yang merubah suatu zat dalam hal bentuk, wujud atau ukuran, tetapi tidak merubah zat tersebut menjadi zat baru.
Contoh perubahan fisis : a. perubahan wujud
- es balok yang mencair menjadi air - air menguap menjadi uap
- kapur barus menyublim menjadi gas, dsb b. perubahan bentuk
- gandum yang digiling menjadi tepung terigu - benang diubah menjadi kain
- batang pohon dipotong-potong jadi kayu balok dan triplek, dll c. perubahan rasa berdasarkan alat indera
- perubahan suhu
- perubahan rasa, dan lain sebagainya 2. Perubahan Materi Secara Kimia
Adalah perubahan dari suatu zat atau materi yang menyebabkan terbantuknya zat baru. Perubahan
Contoh perubahan kimia :
a. bensin biodiesel sebagai bahan bakar berubah dari cair menjadi asap knalpot. b. proses fotosintesis pada tumbuh-tumbuhan yang merubah air, sinar matahari, dan sebagainya menjadi makanan
c. membuat masakan yang mencampurkan bahan-bahan masakan sesuai resep menjadi masakan yang dapat dimakan.
d. bom meledak yang merubah benda padat menjadi pecahan dan ledakan
KLASIFIKASI MATERI
Penyusun materi
Skema klasifikasi materi
Substansi murni :
Materi yang mempunyai sifat dan komposisi tertentu.
Unsur :
Substansi murni yang tidak dapat dipisahkan menjadi sesuatu yang lebih sederhana, baik secara fisika maupun kimia, mengandung satu jenis atom. Contoh: hidrogen, oksigen. Senyawa :
Terbentuk dari ikatan antara atom penyusunnya, dan dapat dipisahkan secara kimia menjadi unsur penyusunnya.
Contoh: air (H2O), gula, CaCO3.
Campuran :
Campuran homogen :
Mempunyai sifat dan komposisi yang seragam pada setiap bagian campuran, tidak dapat dibedakan dengan melihat langsung.
Contoh: garam dapur dan air.
Campuran heterogen :
Mempunyai sifat dan komposisi yang bervariasi pada setiap bagian campuran, dapat dibedakan dengan melihat langsung (secara fisik terpisah).
Contoh: gula dan pasir.
BAB II
PERKEMBANGAN TEORI
ATOM
Pengenalan Dasar Struktur Atom Proton, neutron dan elektron
massa relatif
muatan relatif
proton 1 +1
neutro n
1 0
elektro n
1/1836 -1
Nukleus
Pada hakekatnya, seluruh massa atom berpusat di nukleus, karena massa elektron sangat kecil.
Memahami jumlah proton dan neutron
Jumlah proton = NOMOR ATOM dari atom Nomor atom sering disebut juga nomor proton.
Jumlah proton + Jumlah neutron = NOMOR MASSA dari atom Nomor massa disebut juga nomor nukleon.
Informasi nomor atom dan nomor massa biasanya disingkat dalam bentuk :
Berapa banyaknya proton dan neutron yang dimiliki oleh atom tersebut di atas?
Nomor atom merupakan jumlah proton (9) dan nomor massa merupakan jumlah proton + neutron (19). Jika atom terdiri dari 9 proton, maka akan ada 10 neutron sehingga total keseluruhannya 19.
Nomor atom menandakan posisi dari suatu elemen pada tabel periodik dan karenanya jumlah proton memberitahukan elemen apa yang kita maksudkan. Jadi, jika atom memiliki 8 proton (nomor atom = 8), ini pasti oksigen. Jika atom memiliki 12 proton (nomor atom= 12), ini pasti magnesium.
Begitu juga, setiap atom klor (nomor atom = 17) memiiki 17 proton, dan setiap atom uranium (nomor atom = 92) memiliki 92 proton.
Isotop
Banyaknya neutron di dalam sebuah atom bisa bervariasi dalam skala kecil. Sebagai contoh, ada tiga variasi atom 12C, 13C, 14C. Mereka seluruhnya memiliki jumlah proton yang
sama, tetapi jumlah neutronnya berbeda. proto
Atom-atom ini disebut isotop, yaitu atom-atom yang memiliki nomor atom yang sama tetapi nomor massa yang berbeda. Mereka memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda.
Variasi jumlah neutron tidak mengubah reaksi kimia dari karbon. Elektron
Memahami jumlah elektron
Atom bermuatan netral. Ke-positif-an proton diseimbangkan dengan ke-negatif-an elektron. Hal ini menunjukkan bahwa di dalam atom netral :
banyaknya elektron = banyaknya proton
Jadi, jika sebuah atom oksigen (nomor atom = memiliki 8 proton, ia pasti memiliki 8
elektron; jika atom klor (nomor atom=17) memiliki 17 proton, ia pasti memiliki 17 elektron. Susunan dari elektron-elektron
Elektron-elektron berada pada jarak tertentu dari nukleus di dalam suatu rangkaian level yang disebut dengan level energi. Tiap level energi hanya dapat diisi elektron dalam jumlah tertentu. Level energi pertama (terdekat dengan nukleus) terdiri dari 2 elekton, level kedua 8, dan level ketiga juga akan penuh ketika terisi 8 elektron.
Level-level ini berada dalam jarak yang cukup jauh dari nukleus. Elektron-elektron akan selalu berada pada level energi serendah mungkin selama level tersebut belum terisi penuh.
Memahami susunan dari sebuah atom
* Susunlah elektron-elektron dalam level-level energi, selalu isi level terdalam sebelum mengisi level luar.
contoh. mencari susunan dari atom klor * Tabel periodik memberikan kita nomor atom 17
* Oleh karenanya atom klor terdiri dari 17 proton dan 17 elektron
* Susunan dari elektron-elektron tersebut adalah 2,8,7 ( 2 di level pertama, 8 di level kedua, dan 7 di level ketiga )
Susunan dari 20 elemen pertama
Setelah 20 elemen pertama ini kita akan memasuki elemen transisi tabel periodik. Dua hal penting yang perlu diperhatikan
Jika kita melihat susunan dalam tabel periodik:
* Jumlah elektron pada tingkat terluar (atau kulit terluar) sama dengan nomor golongan. (Kecuali helium yang hanya memiliki 2 elektron. Gas Mulia biasa disebut dengan golongan O bukan golongan 8). Hal ini berlaku di seluruh golongan elemen pada tabel periodik (kecuali elemen-elemen transisi).
Jadi, jika kita mengetahui bahwa barium terletak pada golongan 2, berarti ia memiliki 2 elektron pada tingkat terluar; yodium merupakan golongan 7 yang berarti ia memiliki 7 elektron pada tingkat terluar.
* Gas mulia memiliki elektron penuh pada tingkat terluar. Struktur dan diagram elektron
Dalam kimia dasar kita akan menemukan struktur elektronik dari hidrogen dan karbon, seperti gambar di bawah ini :
Lingkaran-lingkaran tersebut menggambarkan tingkat energi – yang sama dengan peningkatan jarak dari nukleus. Kita dapat membentangkan lingkaran tersebut dan menggambar struktur elektron tersebut dalam diagram elektron yang lebih sederhana. Penelitian-penelitian terbaru menyebabkan teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.
Model Atom John Dalton
Model atom John Dalton
Model Atom Joseph John Thompson
Joseph John Thompson merupakan penemu elektron. Thompson mencoba menjelaskan keberadaan elektron menggunakan teori dan model atomnya. Menurut Thompson, elektron tersebar secara merata di dalam atom yang dianggap sebagai suatu bola yang bermuatan positif. Model atom yang dikemukakan oleh Thompson sering disebut sebagai model roti kismis dengan roti sebagai atom yang bermuatan positif dan kismis sebagai elektron yang tersebar merata di seluruh bagian roti. Atom secara keseluruhan bersifat netral.
Model atom Joseph John Thompson
Model Atom Ernest Rutherford
Penelitian penembakan sinar alfa pada plat tipis emas membuat Rutherford dapat
mengusulkan teori dan model atom untuk memperbaiki teori dan model atom Thompson. Menurut Rutherford, atom mempunyai inti yang bermuatan positif dan merupakan pusat massa atom dan elektron-elektron mengelilinginya.
Rutherford berhasil menemukan bahwa inti atom bermuatan positif dan elektron berada diluar inti atom. Akan tetapi teori dan model atom yang dikemukakan oleh Rutherford juga masih mempunyai kelemahan yaitu teori ini tidak dapat menjelaskan fenomena kenapa elektron tidak dapat jatuh ke inti atom. Padahal menurut fisika klasik, partikel termasuk elektron yang mengorbit pada lintasannya akan melepas energi dalam bentuk radiasi sehingga elektron akan mengorbit secara spiral dan akhirnya jatuh ke iti atom.
Model Atom Ernest Rutherford Model Atom Niels Bohr
Niels Bohr selanjutnya menyempurnakan model atom yang dikemukakan oeh Rutherford. Penjelasan Bohr didasarkan pada penelitiannya tentang spektrum garis atom hidrogen. Beberapa hal yang dijelaskan oleh Bohr adalah
Elektron mengorbit pada tingkat energi tertentu yang disebut kulit
Tiap elektron mempunyai energi tertentu yang cocok dengan tingkat energi kulit Dalam keadaan stasioner, elektron tidak melepas dan menyerap energi
Model Atom Niels Bohr
Model Atom Mekanika Gelombang
Perkembangan model atom terbaru dikemukakan oleh model atom berdasarkan mekanika kuantum. Penjelasan ini berdasarkan tiga teori yaitu
Teori dualisme gelombang partikel elektron yang dikemukakan oleh de Broglie pada tahun 1924
Azas ketidakpastian yang dikemukakan oeh Heisenberg pada tahun 1927 Teori persamaan gelombang oleh Erwin Schrodinger pada tahun 1926
Menurut model atom ini, elektron tidak mengorbit pada lintasan tertentu sehingga lintasan yang dikemukakan oleh Bohr bukan suatu kebenaran. Model atom ini menjelaskan bahwa elektron-elektron berada dalam orbita-orbital dengan tingkat energi tertentu. Orbital merupakan daerah dengan kemungkinan terbesar untuk menemukan elektron disekitar inti atom.
Model Atom Mekanika Quantum
Model atom
a. Ukuran atom
Sperti telah disebutkan di bagian sebelumnya, ketakterbagian atom perlahan mulai dipertanyakan. Pada saat yang sama, perhatian pada struktur atom perlahan menjadi semakin besar. Bila orang mempelajari struktur atom, ukurannya harus dipertimbangkan. Telah diketahui bahwa sebagai pendekatan volume atom dapat diperkirakan dengan membagi volume 1 mol padatan dengan konstanta Avogadro.
Latihan 2.3 Volume satu molekul air
Dengan menganggap molekul air berbentuk kubus, hitung panjang sisi kubusnya. Dengan menggunakan nilai yang didapat, perkirakan ukuran kira-kira satu atom (nyatakan dengan notasi saintifik 10x).
Jawab: Volume 1 mol air sekitar 18 cm3. Jadi volume 1 molekul air: v = 18 cm3/6 x 1023 =
3×10-23 cm3 = 30 x 10-24 cm3. Panjang sisi kubus adalah (30 x 10-24)1/3 cm = 3,1 x 10-8 cm.
Nilai ini mengindikasikan bahwa ukuran atom sekitar 10-8 cm.
Thomson mengasumsikan bahwa atom dengan dimensi sebesar itu adalah bola seragam bermuatan positif dan elektron-elektron kecil yang bermuatan negatif tersebar di bola tersebut. Dalam kaitan ini model Thomson sering disebut dengan “model bolu kismis”, kismisnya seolah elektron dan bolunya adalah atom.
b. Penemuan inti atom
Setelah melakukan banyak kemajuan dengan mempelajari keradioaktifan, fisikawan Inggris Ernest Rutherford (1871-1937) menjadi tertarik pada struktur atom, asal radiasi radioaktif. Ia menembaki lempeng tipis logam (ketebalan 104 atoms) dengan berkas paralel partikel α
ZnS (Gambar 2.2). Hasilnya sangat menarik. Sebagian besar partikel melalui lempeng tersebut. Beberapa partikel terpental balik. Untuk menjelaskan hal yang tak terduga ini, Rutherford mengusulkan adanya inti atom .
Sangat aneh mendapati sebagian besar partikel berbalik, dan beberapa bahkan 180 derajat. Rutherford menyatakan bahwa dalam atom harus ada partikel yang massa cukup besar sehingga patikel α yang memiliki massa sebesar massa atom helium tertolak, dan yang jari-jarinya sangat kecil.
Menurut ide Rutherford, muatan positif atom terpusat di bagian pusat (dengan jari-jari terhitung sekitar 10-12 cm) sementara muatan negatifnya terdispersi di seluruh ruang atom.
Partikel kecil di pusat ini disebut dengan inti. Semua model atom sebelumnya sebagai ruang yang seragam dengan demikian ditolak.
Namun, model atom Rutherford yang terdiri atas inti kecil dengan elektron terdispersi di sekitarnya tidak dapat menjelaskan semua fenomena yang dikenal. Bila elektron tidak bergerak, elektron akan bersatu dengan inti karena tarikan elektrostatik (gaya Coulomb). Hal ini jelas tidak mungkin terjadi sebab atom adalah kesatuan yang stabil. Bila elektron mengelilingi inti seperti planet dalam pengaruh gravitasi matahari, elektron akan
mengalami percepatan dan akan kehilangan energi melalui radiasi elektromagnetik. Akibatnya, orbitnya akan semakin dekat ke inti dan akhirnya elektron akan jatuh ke inti. Dengan demikian, atom akan memancarkan spektrum yang kontinyu. Tetapi faktanya, atom yang stabil dan diketahui atom memancarkan spektrum garis (spektrum atom Bab 2.3(a) ) bukan spektrum kontinyu. Jelas diperlukan perubahan fundamenatal dalam pemikiran untuk menjelaskan semua fakta-fakta percobaan ini.
Konfigurasi elektron dari atom
Hubungan antara orbital dengan tabel periodik
Kita akan melihat bagaimana cara menuliskan konfigurasi elektron sampai pada orbital d. Halaman ini akan menjelaskan konfigurasi berdasarkan tabel periodik sederhana di atas ini dan selanjutnya pengaplikasiannya pada konfigurasi atom yang lebih besar.
Periode Pertama
Hidrogen hanya memiliki satu elektron pada orbital 1s, kita dapat menuliskannya dengan 1s1 dan helium memiliki dua elektron pada orbital 1s sehingga dapat dituliskan dengan 1s2
Periode kedua
Sekarang kita masuk ke level kedua, yaitu periode kedua. Elektron litium memenuhi orbital 2s karena orbital ini memiliki energi yang lebih rendah daripada orbital 2p. Litium memiliki konfigurasi elektron 1s22s1. Berilium memiliki elektron kedua pada level yang sama –
1s22s2.
B 1s22s22p
Elektron selanjutnya akan membentuk sebuah pasangan dengan elektron tunggal yang sebelumnya menempati orbital.
Kita dapat melihat di sini bahwa semakin banyak jumlah elektron, semakin merepotkan bagi kita untuk menuliskan struktur elektron secara lengkap. Ada dua cara penulisan untuk mengatasi hal ini dan kita harus terbiasa dengan kedua cara ini.
Cara singkat pertama : Seluruh variasi orbital p dapat dituliskan secara bertumpuk. Sebagai contoh, flor dapat ditulis sebagai 1s22s22p5, dan neon sebagai 1s22s22p6.
Penulisan ini biasa dilakukan jika elektron berada dalam kulit dalam. Jika elektron berada dalam keadaan berikatan (di mana elektron berada di luar atom), terkadang ditulis dalam cara singkat, terkadang dengan cara penuh.
Sebagai contoh, walaupun kita belum membahas konfigurasi elektron dari klor, kita dapat menuliskannya sebagai 1s22s22p63s23p
x23p y23pz1.
Perhatikan bahwa elektron-elektron pada orbital 2p bertumpuk satu sama lain sementara orbital 3p dituliskan secara penuh. Sesungguhnya elektron-elektron pada orbital 3p terlibat dalam pembentukan ikatan karena berada pada kulit terluar dari atom, sementara
elektron-elektron pada 2p terbenam jauh di dalam atom dan hampir bisa dikatakan tidak berperan sama sekali.
Cara singkat kedua : Kita dapat menumpukkan seluruh elektron-elektron terdalam dengan menggunakan, sebagai contoh, simbol [Ne]. Di dalam konteks ini, [Ne] berarti konfigurasi elektron dari atom neon -dengan kata lain 1s22s22p
x22py22p z2.
Berdasarkan cara di atas kita dapat menuliskan konfigurasi elektron klor dengan [Ne]3s23p
x23py23pz 1.
Periode ketiga
Mulai dari neon, seluruh orbital tingkat kedua telah dipenuhi elekton, selanjutnya kita harus memulai dari natrium pada periode ketiga. Cara pengisiannya sama dengan periode-periode sebelumnya, kecuali adalah sekarang semuanya berlangsung pada periode-periode ketiga. Sebagai contoh :
Sampai saat ini kita belum mengisi orbital tingkat 3 sampai penuh – tingkat 3d belum kita gunakan. Tetapi kalau kita melihat kembali tingkat energi orbital-orbital, kita dapat melihat bahwa setelah 3p energi orbital terendah adalah 4s – oleh karena itu elektron mengisinya terlebih dahulu.
K 1s22s22p63s23p6 4s1
Ca 1s22s22p63s23p6 4s2
Bukti kuat tentang hal ini ialah bahwa elemen seperti natrium ( 1s22s22p63s1 ) dan kalium (
1s22s22p63s23p64s 1 ) memiliki sifat kimia yang mirip.
Elektron terluar menentukan sifat dari suatu elemen. Sifat keduanya tidak akan mirip bila konfigurasi elektron terluar dari kalium adalah 3d1.
Elemen-elemen pada golongan 1 dari tabel periodik memiliki konfigurasi elektron terluar ns1 (dimana n merupakan nomor antara 2 sampai 7). Seluruh elemen pada golongan 2
memiliki konfigurasi elektron terluar ns2. Elemen-elemen di grup 1 dan 2 dideskripsikan
sebagai elemen-elemen blok s.
Elemen-elemen dari golongan 3 seterusnya hingga gas mulia memiliki elektron terluar pada orbital p. Oleh karenanya, dideskripsikan dengan elemen-elemen blok p.
Elemen blok d
Perhatikan bahwa orbital 4s memiliki energi lebih rendah dibandingkan dengan orbital 3d sehingga orbital 4s terisi lebih dahulu. Setelah orbital 3d terisi, elektron selanjutnya akan mengisi orbital 4p.
Elemen-elemen pada blok d adalah elemen di mana elektron terakhir dari orbitalnya berada pada orbital d. Periode pertama dari blok d terdiri dari elemen dari skandium hingga seng, yang umumnya kita sebut dengan elemen transisi atau logam transisi. Istilah “elemen transisi” dan “elemen blok d” sebenarnya tidaklah memiliki arti yang sama, tetapi dalam perihal ini tidaklah menjadi suatu masalah.
Elektron d hampir selalu dideskripsikan sebagai, sebagai contoh, d5 atau d8 – dan bukan ditulis dalam orbital yang terpisah-pisah. Perhatikan bahwa ada 5 orbital d, dan elektron akan menempati orbital sendiri sejauh ia mungkin. Setelah 5 elektron menempati orbital sendiri-sendiri barulah elektron selanjutnya berpasangan.
d5 berarti
d8 berarti
Perhatikan bentuk pengisian orbital pada level 3, terutama pada pengisian atom 3d setelah 4s.
Sc 1s22s22p63s23p6
3d14s2
Ti 1s3d222s4s222p63s23p6
V 1s3d232s4s222p63s23p6
3d54s1
Perhatikan bahwa kromium tidak mengikuti keteraturan yang berlaku. Pada kromium elektron-elektron pada orbital 3d dan 4s ditempati oleh satu elektron. Memang, mudah untuk diingat jikalau keteraturan ini tidak berantakan – tapi sayangnya tidak !
Mn 1s22s22p63s23p6 3d54s2 (kembali ke keteraturan semula)
Pada elemen seng proses pengisian orbital d selesai.
Pengisian sisa periode 4
Orbital selanjutnya adalah 4p, yang pengisiannya sama seperti 2p atau 3p. Kita sekarang kembali ke elemen dari galium hingga kripton. Sebagai contoh, Brom, memilki konfigurasi elektron 1s22s22p63s23p63d104s 24p
x24py24pz1.
Rangkuman
Menuliskan konfigurasi elektron dari hidrogen sampai kripton
Gunakan tabel periodik untuk mendapatkan nomor atom yang berarti banyaknya jumlah elektron.
Isilah orbital-orbital dengan urutan 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p sampai elektron-elektron selesai terisi. Cermatilah keteraturan pada orbital 3d ! Isilah orbital p dan d dengan elektron tunggal sebisa mungkin sebelum berpasangan.
Ingat bahwa kromium dan tembaga memiliki konfigurasi elektron yang tidak sesuai dengan keteraturan.
Menuliskan struktur elektron elemen-elemen “besar” pada blok s dan p
Pertama kita berusaha untuk mengetahui jumlah elektron terluar. Jumlah elektron terluar sama dengan nomor golongan. Sebagai contoh, seluruh elemen pada golongan 3 memiliki 3 elektron pada level terluar. Lalu masukkan elektron-elektron tersebut ke orbital s dan p. Pada level orbital ke berapa ? Hitunglah periode pada tabel periodik.
Sebagai contoh, Yodium berada pada golongan 7 dan oleh karenanya memiliki 7 elektron terluar. Yodium berada pada periode 5 dan oleh karenanya elekton mengisi pada orbital 5s dan 5p. Jadi, Yodium memiliki konfigurasi elektron terluar 5s25p
x25py25pz 1.
Bagaimana dengan konfigurasi elektron di dalamnya ? Level 1, 2, dan 3 telah terlebih dahulu terisi penuh, dan sisanya tinggal 4s, 4p, dan 4d. Sehingga konfigurasi seluruhnya adalah : 1s22s22p63s23p63d104s 24p64d105s25p
x25p y25pz1.
Jikalau kita telah menyelesaikannya, hitunglah kembali jumlah seluruh elektron yang ada apakah sama dengan nomor atom.
Contoh yang kedua, Barium , berada pada golongan 2 dan memiliki 2 elektron terluar. Barium berada pada periode keenam. Oleh karenanya, Barium memilki konfigurasi elektron terluar 6s2.
Konfigurasi keseluruhannya adalah : 1s22s22p63s23p63d104s 24p64d105s25p66s2.
Kita mungkin akan terjebak untuk mengisi orbital 5d10 tetapi ingatlah bahwa orbital d
selalu diisi setelah orbital s pada level selanjutnya terisi. Sehingga orbital 5d diisi setelah 6s dan 3d diisi setelah 4s.
ISOBAR, ISOTON DAN ISOTOP
Telah diketahui bahwa penemu sinar x adalah Rontgen. Sinar x terjadi ketika sinar katoda yang berupa elektron berkecepatan tinggi menumbuk elektroda tembaga. Akibat
tumbukan tersebut, tembaga melepaskan elektron terluarnya dan tempat elektron yang kosong ini selanjutnya diisi oleh elektron tembaga dari tingkat energi lain yang lebih tinggi. Pengisian tempat kosong oleh elektron tembaga dari tingkat energi yang lebih tinggi menyebabkan terjadinya pemancaran radiasi. Radiasi ini oleh Rontgen disebut sebagai sinar x.
penelitian menunjukkan bahwa setiap unsur memancarkan radiasi sinar x dengan panjang gelombang yang khas. Panjang gelombang yang dihasilkan tergantung pada jumlah ion positif didalam inti atom. Penelitian juga menunjukkan bahwa inti atom mempunyai muatan yang berharga kelipatan dari +1,6×10-9C. Moseley selanjutnya menyebut jumlah proton dalam atom adalah nomor atom.
Tabung sinar X
Wilhelm Conrad Rontgen
Nomor Atom dan Nomor Massa
Isotop
Isotop adalah atom unsur sama dengan nomor massa berbeda. Isotop dapat juga dikatakan sebagai atom unsur yang mempunyai nomor atom sama tetapi mempunyai nomor massa berbeda karena setiap unsur mempunyai nomor atom yang berbeda. Karbon merupakan contoh adanya isotop.
Setiap karbon mempunyai nomor atom 6 tetapi nomor massanya berbeda-beda. Dari contoh tersebut dapat dikatakan bahwa walaupun unsurnya sama belum tentu nomor massanya sama.
Isobar dan Isoton
Isobar adalah atom unsur yang berbeda tetapi mempunyai nomor massa sama. Isobar dapat dimengerti dengan melihat contoh berupa dengan yang memiliki nomor massa sebesar 24. Sedangkan isoton adalaha tom unsur yang berbeda
tetapi mempunyai jumlah netron yang sama. Contoh isoton adalah yang sama-sama memiliki jumlah neutron 20.
INTERPRETASI DATA DALAM
TABEL SISTEM PERIODIK
PERKEMBANGAN PENGELOMPOKAN UNSUR
Pada awalnya, unsur hanya digolongkan menjadi logam dan nonlogam. Dua puluh unsur yang dikenal pada masa itu mempunyai sifat yang berbeda satu dengan yang lainnya. Setelah John Dalton mengemukakan teori atom maka terdapat perkembangan yang cukup berarti dalam pengelompokan unsur-unsur. Penelitian Dalton tentang atom menjelaskan bahwa setiap unsur mempunyai atom-atom dengan sifat tertentu yang berbeda dari atom unsur lain. Hal yang membedakan diantara unsur adalah massanya.
Dobereiner, Newlands, mendeleev dan Lothar Meyer yang mengelompokkan unsur berdasarkan massa atom relatif.
Unsur klorin, bromin dan iodin
Triad Dobereiner
Johann Wolfgang Dobereiner pada tahun 1829 menjelaskan hasil penelitiannya yang menemukan kenyataan bahwa massa atom relatif stronsium berdekatan dengan massa rata-rata dua unsur lain yang mirip dengan stronsium yaitu kalsium dan barium. Hasil penelitiannya juga menunjukkan bahwa beberapa unsur yang lain menunjukkan kecenderungan yang sama. Berdasarkan hasil penelitiannya, Dobereiner selanjutnya mengelompokkan unsur-unsur dalam kelompok-kelompok tiga unsur yang lebih dikenal sebagai triad. Triad yang ditunjukkan oleh Dobereiner tidak begitu banyak sehingga berpengaruh terhadap penggunaannya.
Massa Atom Relatif Unsur Triad Dobereiner
Johann Wolfgang Dobereiner
Hukum oktaf Newlands
Hukum oktaf ditemukan oleh A. R. Newlands pada tahun 1864. Newlands mengelompok-kan unsur berdasarmengelompok-kan kenaimengelompok-kan massa atom relatif unsur. Kemiripan sifat ditunjukmengelompok-kan oleh unsur yang berseliih satu oktaf yakni unsur ke-1 dan unsur ke-8 serta unsur ke-2 dan unsur ke-9. Daftar unsur yang berhasil dikelompokkan berdasarkan hukum oktaf oleh Newlands ditunjukkan pada tabel berikut.
John Newlands
Tabel oktaf Newlands
Hukum oktaf Newlands ternyata hanya berlaku untuk unsur-unsur dengan massa atom relatif sampai 20 (kalsium). Kemiripan sifat terlalu dipaksakan apabila
pengelompokan dilanjutkan.
Sistem Periodik Mendeleev
Dmitri Ivanovich Mendeleev pada tahun 1869 melakukan pengamatan terhadap 63 unsur yang sudah dikenal dan mendapatkan hasil bahwa sifat unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akan berulang secara periodik apabila unsurunsur disusun berdasarkan kenaikan massa atom relatifnya. Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut periode. Sistem periodik yang disusun Mendeleev dapat dilihat pada tabel berikut:
Sistem Periodik Mendeleev
Mendeleev sengaja mengosong-kan beberapa tempat untuk menetapkan kemiripan sifat dalam golongan. Beberapa kotak juga sengaja dikosongkan karena Mendeleev yakin masih ada unsur yang belum dikenal karena belum ditemukan. Salah satu unsur baru yang sesuai dengan ramalan Mendeleev adalah germanium yang sebelumnya diberi nama ekasilikon oleh Mendeleev.
Sistem Periodik Moseley
Perkembangan terbaru mengenai atom menjelaskan bahwa atom dapat terbagi menjadi partikel dasar atau partikel subatom. Atom selanjutnya diketahui tersusun oleh proton, elektron dan netron. Jumlah proton merupakan sifat khas unsur. Setiap unsur mempunyai jumlah proton tertentu yang berbeda dari unsur lain. Jumlah proton suatu unsur dinyatakan sebagai nomor atom.
Henry G. Moseley yang merupakan penemu cara menentukan nomor atom pada tahun 1914 kembali menemukan bahwa sifat-sifat unsur merupakan fungsi periodik nomor atomnya. Pengelompokan yang disusun oleh Mendeleev merupakan susunan yang berdasarkan kenaikan nomor atomnya. Penyusunan telurium dan iodin yang tidak sesuai dengan kenaikan massa atom relatifnya ternyata sesuai dengan kenaikan nomor atomnya.
Henry G. Moseley
Periode dan Golongan
transisi. Golongan dapat dieri tanda nomor 1 sampai 18 berurutan dari kiri ke kanan. Berdasarkan penomoran ini, golongan transisi mempunyai nomor 3 sampai 12. Sistem periodik modern tersusun atas 7 periode dan 18 golongan yang terbagi menjadi 8 golongan utama atau golongan A dan 8 golongan transisi atau golongan B.
Sistem Periodik Modern Contoh soal :
Tentukan periode dan golongan unsur X, Y dan Z apabila diketahui konfigurasi elektronnya adalah
X = 2, 3 Y = 2, 8, 4 Z = 2, 8, 7 Jawab:
Unsur Periode Golongan X 2 IIIA
Y 3 IVA Z 3 VIIA
SIFAT PERIODIK UNSUR
Sifat yang berubah secara beraturan menurut kenaikan nomor atom dari kiri ke kanan dalam satu periode dan dari atas ke bawah dalam satu golongan disebut sifat periodik. Sifat periodik meliputi jari-jari atom, energi ionisasi, afinitas electron dan
keelektronegatifan.
Jari-jari Atom
Jari-jari atom adalah jarak elektron di kulit terluar dari inti atom. Jari-jari atom sulit untuk ditentukan apabila unsur berdiri sendiri tanpa bersenyawa dengan unsur lain. Jari-jari atom secara lazim ditentukan dengan mengukur jarak dua inti atom yang identik yang terikat secara kovalen. Pada penentuan jari-jari atom ini, jari- jari kovalen adalah setengah jarak antara inti dua atom identik yang terikat secara kovalen.
Hubungan jari-jari atom gengan nomor atom
Kurva hubungan jari-jari atom dengan nomor atom memperlihatkan bahwa jari-jari atom dalam satu golongan akan semakin besar dari atas ke bawah. Hal ini terjadi karena dari atas ke bawah jumlah kulit bertambah sehingga jari-jari atom juga bertambah.
Jari-jari atom unsur
Unsur-unsur dalam satu periode (dari kiri ke kanan) berjumlah kulit sama tetapi jumlah proton bertambah sehingga jari-jari atom juga berubah. Karena jumlah proton bertambah maka muatan inti juga bertambah yang mengakibatkan gaya tarik menarik antara inti dengan elektron pada kulit terluar semakin kuat. Kekuatan gaya tarik yang semakin meningkat menyebabkan jari-jari atom semakin kecil. Sehingga untuk unsur dalam satu periode, jari-jari atom semakin kecil dari kiri ke kanan.
Jari-jari ion digambarkan sebagai berikut:
Perbandingan jari-jari atom dengan jari-jari ion
Energi Ionisasi
atom mempengaruhi besarnya energi ionisasi. Semakin besar jari-jari atom maka gaya tarik antara inti dengan elektron pada kulit terluar semakin lemah. Hal ini berarti elektron pada kulit terluar semakin mudah lepas dan energi yang dibutuhkan untuk melepaskan elektron tersebut semakin kecil. Akibatnya, dalam satu golongan, energi ionisasi semakin kecil dari atas ke bawah. Sedagkan dalam satu periode, energi ionisasi semakin besar dari kiri ke kanan. Hal ini disebabkan dari kiri ke kanan muatan iti semakin besar yang
mengakibatkan gaya tarik antara inti dengan elektron terluar semakin besar sehingga dibutuhkan energi yang besar pula untuk melepaskan elektron pada kulit terluar.
Energi ionisasi
Hubungan energi ionisasi dengan nomor atom
Kurva tersebut menunjukkan unsur golongan 8A berada di puncak grafik yang mengindikasikan bahwa energi ionisasinya besar. Hal sebaliknya terjadi untuk unsur golongan 1A yang berada di dasar kurva yang menunjukkan bahwa energi ionisasinya kecil. Atom suatu unsur dapat melepaskan elektronnya lebih dari satu buah. Energi yang dibutuhkan untuk melepaskan elektron keua disebut energi ionisasi kedua dan tentu saja diperlukan energi yang lebih besar. Energi ionisasi semakin besar apabila makin banyak elektron yang dilepaskan oleh suatu atom.
Afinitas Elektron
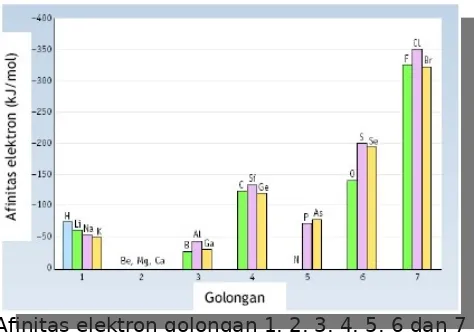
Afinitas elektron golongan 1, 2, 3, 4, 5, 6 dan 7
Gambar menunjukkan bahwa atom unsur golongan 2A dan 8A mempunyai afinitas elektron yang berharga positif. Hal ini mengindikasikan bahwa unsur golongan 2A dan 8A sulit menerima elektron. Afinitas elektron terbesar dimiliki oleh unsur golongan halogen karena unsur golongan ini paling mudah menangkap elektron. Jadi secara umum dapat dikatakan bahwa afinitas elektron, dalam satu periode, dari kiri ke kanan semakin negatif dan dalam satu golongan dari atas ke bawah, semakin positif.
Keelektronegatifan
Keelektronegatifan ada-lah skala yang dapat menjelaskan kecenderungan atom suatu unsur untuk menarik elektron menuju kepadanya dalam suatu ikatan. Keelektronegatifan secara umum, dalam satu periode, dari kiri ke kanan semakin bertambah dan dalam satu golongan, dari atas ke bawah keelekrnegatifan semakin berkurang. Hal ini dapat
dimengerti karena dalam satu periode, dari kiri ke kanan, muatan inti atom semakin bertambah yang mengakibatkan gaya tarik antara inti atom dengan elektron terluar juga semakin bertambah. Fenomena ini menyebabkan jari-jari atom semakin kecil, energi ionisasi semakin besar, afinitas elektron makin besar dan makin negatif dan akibatnya kecenderungan untuk menarik elektron semakin besar.
Elektronegatifitas
Terlihat dari gambar bahwa untuk unsur gas mulia tidak mempunyai harga
keelektronegatifan karena konfigurasi elektronnya yang stabil. Stabilitas gas mulia menyebabkan gas mulia sukar untuk menarik dan melepas elektron. Keelektronegatifan skala pauling memberikan nilai keelektronegatifan untuk gas mulia sebesar nol.
Sifat periodik unsur ENERGI IONISASI
Energi ionisasi pertama merupakan energi yang diperlukan untuk melepaskan elektron terluar (paling mudah lepas) dari satu mol atom dalam wujud gas untuk menghasilkan satu mol ion gas dengan muatan 1+.
Hal ini lebih mudah dipahami dalam bentuk simbol.
Pada penggambaran di atas, energi ionisasi pertama diartikan sebagai energi yang dibutuhkan untuk menghasilkan perubahan per mol X.
Yang perlu diperhatikan pada persamaan di atas
Simbol wujud zat – (g) – penting. Pada saat anda membahas energi ionisasi, unsurnya harus dalam wujud gas.
Energi ionisasi dinyatakan dalam kJ mol-1 (kilojoules per mole). Nilainya bervariasi dari 381
(yang sangat rendah) hingga 2370 (yang sangat tinggi).
Semua unsur memiliki energi ionisasi pertama – bahkan atom yang tidak membentuk ion positif pada tabung reaksi. Helium (E.I pertama = 2370 kJ mol-1) secara normal tidak
membentuk ion positif karena besarnya energi yang diperlukan untuk melepaskan satu elektron.
Pola energi ionisasi pertama pada tabel periodik 20 unsur pertama
Energi ionisasi pertama menunjukkanperiodicity. Itu artinya bahwa energi ionisasi bervarisi dalam suatu pengulangan jika anda bergerak sepanjang tabel periodik. Sebagai contoh, lihatlah pola dari Li ke Ne, dan kemudian bandingkan dengan pola yang sama dari Na ke Ar.
Variasi pada energi ionisasi pertama ini dapat dijelaskan melalui struktur dari atom yang terlibat.
Faktor yang mempengaruhi energi ionisasi
Energi ionisasi merupakan ukuran energi yang diperlukan untuk menarik elektron tertentu dari tarikan inti. Energi ionisasi yang tinggi menunjukkan tarikan antara elektron dan inti yang kuat.
Besarnya tarikan dipengaruhi oleh:
Makin banyak proton dalam inti, makin positif muatan inti, dan makin kuat tarikannya terhadap elektron.
Jarak elektron dari inti
Jarak dapat mengurangi tarikan inti dengan cepat. Elektron yang dekat dengan inti akan ditarik lebih kuat daripada yang lebih jauh.
Jumlah elektron yang berada diantara elektron terluar dan inti
Perhatikan atom natrium, dengan struktur elektron 2, 8, 1 (tak ada alasan mengapa anda tak dapat menggunakan notasi ini jika ini sangat membantu!)
ika elektron terluar mengarah ke inti, tidak akan terlihat oleh inti dengan jelas. Antara elektron terluar dan inti ada dua lapis elektron pada tingkat pertama dan kedua. Pengaruh 11 proton pada inti natrium berkurang oleh adanya 10 elektron yang lebih dalam. Oleh karena itu elektron terluar hanya merasakan tarikan bersih kira-kira 1+ dari pusat. Pengurangan tarikan inti terhadap elektron yang lebih dalam disebut dengan
penyaringan (screening) atau perlindunga (shielding).
Apakah elektron berdiri sendiri dalam suatu orbital atau berpasangan dengan elektron lain
Dua elektron pada orbital yang sama mengalami sedikit tolakan satu sama lain. Hal ini mengurangi tarikan inti, sehingga el ektron yang berpasangan dapat dilepaskan dengan lebih mudah dari yang anda perkirakan.
Menjelaskan pola pada sebagian unsur-unsur pertama
Hidrogen memiliki struktur elektron 1s1. Merupakan atom yang sangat kecil, dan elektron
tunggalnya dekat dengan inti sehingga dapat tertarik dengan kuat. Tidak ada elektron yang menyaring tarikan dari inti sehingga energi ionisasinya tinggi (1310 kJ mol-1).
Helium memiliki struktur 1s2. Elektron dilepaskan dari orbital yang sama seperti pada
contoh hidrogen. Elektronnya dekat dengan inti dan tidak tersaring. Energi ionisasinya (2370 kJ mol-1) lebih besar dari hidrogen, karena elektronnya ditarik oleh dua proton pada
inti, bukan satu seperti pada hidrogen.
Litium memiliki struktur 1s22s1. Elektron terluarnya berada pada tingkat energi kedua,
lebih jauh dari inti. Anda mungkin berpendapat akan lebih dekat dengan adanya tambahan proton pada inti, tetapi elektron tidak mengalami tarikan yang penuh dari inti – tersaring oleh elektron 1s2.
Anda dapat membayangkan elektron seperti merasakan tarikan bersih +1 dari pusat (3 proton dikurangi oleh dua elektron 1s2 electrons).
Jika anda membandingkan litium dengan hidrogen (bukan dengan helium), elektron
hidrogen juga mengalami tarikan 1+ dari inti, tetapi pada litium jaraknya lebih jauh. Energi ionisasi pertama litium turun menjadi 519 kJ mol-1 sedangkan hidrogen 1310 kJ mol-1.
Pola pada periode 2 dan 3
Membahas 17 atom pada saat bersamaan akan memakan waktu. Kita dapat melakukannya dengan lebih terarah dengan menjelaskan kecenderungan utama pada dua periode ini, dan kemudian menjelaskan pengecualian yang ada.
Menjelaskan kecenderungan umum pada periode 2 dan 3
Kecenderungan yang umum adalah energi ionisasi meningkat dalam satu periode dari kiri ke kanan.
Pada semua unsur periode 2, elektron terluar berada pada orbital tingkat 2 – 2s atau 2p. Semuanya memiliki jarak yang sama dari inti, dan tersaring oleh elektron 1s2.
Perbedaan pentingnya adalah terjadi kenaikan jumlah proton pada inti dari litium sampai neon. Hal itu menyebabkan makin kuatnya tarikan inti terhadap elektron sehingga menaikkan energi ionisasi. Pada kenyataannya kenaikan muatan inti menyebabkan
elektron terluar lebih dekat ke inti. Kenaikan energi ionisasi itu berada dalam satu periode. Pada periode 3, kecenderungannya sama. Semua elektron yang dilepaskan berada pada tingkat ketiga dan tersaring oleh elektron 1s22s22p6. Semuanya memiliki lingkungan yang
sama, tetapi muatan intinya makin meningkat.
Mengapa terjadi penurunan antara golongan 2 dan 3 (Be-B dan Mg-Al)?
Penjelasannya didasarkan pada struktur boron dan aluminium. Elektron terluar kedua atom ini lebih mudah dilepaskan dibandingkan dengan kecenderungan umum pada atom-atom periode 2 dan 3 lainnya.
B
Anda mungkin mengharapkan energi ionisasi boron lebih besar dari berilium karena adanya tambahan proton. Pada kenyataannya elektron terluar boron berada pada orbital 2p bukan pada 2s. Orbital 2p memiliki energi yang sedikit lebih tinggi daripada orbital 2s, dan elektronnya, rata-rata, berada lebih jauh dari inti. Hal ini memberikan dua pengaruh.
Bertambahnya jarak menghasilkan berkurangnya tarikan inti sehingga mengurangi energi ionisasi
Orbital 2p tidak hanya disaring oleh elektron 1s2 tetapi, sedikit, juga oleh elektron
2s2. Hal itu juga mengurangi tarikan dari inti sehingga energi ionisasinya lebih
rendah.
Penjelasan terhadap turunnya energi ionisasi antara magnesium dan aluminium sama, hanya saja terjadi pada tingkat ke-3 bukan tingkat ke-2.
Mg 1s22s22p63s2 E. I. pertama = 736 kJ
Elektron 3p pada aluminium sedikit lebih jauh dari inti dibandingkan 3s, dan sebagian tersaring oleh elektron 3s2 sebagai elektron yang lebih dalam. Kedua faktor ini mengurangi
pengaruh bertambahnya proton.
Mengapa terjadi penurunan diantara golongan 5 dan 6 (N-O dan P-S)?
Sekali lagi, anda mungkin mengharapkan energi ionisasi unsur golongan 6 akan lebih tinggi daripada golongan 5 karena adanya tambahan proton. Apa yang terjadi?
2pz1 mol-1
Penyaringannya sama (oleh 1s2 dan, sedikit, oleh elektron 2s2), dan elektron dilepaskan
dari orbital yang sama.
Perbedaannya adalah pada oksigen elektron dilepaskan dari salah satu pasangan 2px2.
Adanya tolakan antara dua elektron pada orbital yang sama menyebabkan elektron tersebut lebih mudah dilepaskan dibandingkan yang lain.
Penurunan energi ionisasi pada sulfur dijelaskan dengan cara yang sama.
Kecenderungan turunnya energi ionisasi dalam satu golongan
Jika anda bergerak ke bawah dalam satu golongan pada tabel period ik, energi ionisasi secara umum akan menurun. Anda telah melihat bukti untuk hal ini bahwa energi ionisasi pada periode 3 lebih rendah dari periode 2.
Sebagai contoh pada golongan 1:
Mengapa energi ionisasi natrium lebih rendah dari litium?
Pada atom natrium terdapat 11 proton, tetapi pada atom litium hanya 3. Jadi muatan inti natrium lebih besar. Anda mungkin memperkirakan energi ionisasi natrium lebih besar, tetapi kenaikan muatan inti tidak dapat mengimbangi jarak elektron dari inti yang makin jauh dan lebih tersaring.
Elektron terluar litium berada pada tingkat kedua, dan hanya memiliki elektron 1s2 yang
menyaringnya. Elektron 2s1 mengalami tarikan dari 3 proton dan disaring oleh 2 elektron –
tarikan bersih dari pusat adalah +1.
Elektron terluar natrium berada pada tingkat 3, dan terhalangi dari 11 proton pada inti oleh 10 elektron yang berada lebih dalam. Elektron 3s1 juga mengalami tarikan bersih 1+ dari
pusat atom. Faktor yang tersisa hanyalah jarak tambahan antara elektron terluar dan inti pada natrium. Sehingga energi ionisasi natrium lebih rendah.
Penjelasan yang sama berlaku jika anda bergerak ke bawah pada unsur lain pada golongan tersebut, atau, pada golongan yang lain.
Kecenderungan energi ionisasi pada golongan transisi
Selain seng pada bagian akhir, energi ionisasi semua unsur relatif sama.
Semua unsur memiliki struktur elektron [Ar]3dn4s2 (or 4s1 pada kromium dan tembaga).
Elektron yang terlepas selalu dari orbital 4s.
Jika anda bergerak dari kiri ke kanan, dari satu atom ke atom lainnya dalam deretan golongan transisi, jumlah proton pada inti meningkat, elektron pada 3d juga bertambah. Elektron 3d mengalami beberapa pengaruh penyaringan, proton tambahan dan elektron 3d tambahan dapat menambah atau mengurangi pengaruh tarikan dari pusat atom yang diamati.
C
Pada contoh di atas, elektron yang dilepaskan berasal dari orbital yang sama, dengan penyaringan yang sama, tetapi seng memiliki satu tambahan proton pada inti sehingga daya tariknya lebih besar. Pada seng terdapat tolakan antar pasangan elektron orbital 4s, tetapi pada kasus ini tolakannya tidak cukup untuk mengimbangi pengaruh bertambahnya proton.
Energi ionisasi dan reaktivitas
Pada energi ionisasi yang lebih rendah, perubahan ini lebih mudah terjadi:
Anda dapat menjelaskan kenaikan reaktivitas logam golongan 1(Li, Na, K, Rb, Cs) dari atas ke bawah dalam satu golongan karena turunnya energi ionisasi. Bereaksi dengan apapun, logam-logam tersebut akan membentuk ion positif, dengan energi ionisasi yang lebih rendah, ion lebih mudah terbentuk.
Bahaya dari pendekatan ini adalah pembentukan ion positif terjadi hanya satu tahap dalam beberapa langkah proses.
Sebagai contoh, anda tidak mungkin memulai dengan atom gas; tidak juga mengakhirinya dengan gas ion positif – anda akan mengakhiri dengan ion dalam padatan atau larutan. Perubahan energi pada proses ini juga bervariasi dari satu unsur ke unsur lainnya. Secara ideal anda perlu mempertimbangkan semua hal dan tidak hanya mengambil sebagian saja.
Namun demikian, energi ionisasi unsur merupakan faktor utama yang berperan dalam energi aktivasi suatu reaksi. Ingat bahwa energi aktivasi merupakan energi minimum yang diperlukan sebelum reaksi berlangsung. Dengan energi aktivasi yang lebih rendah, reaksi akan lebih cepat – tanpa mengabaikan seluruh energi yang berubah pada reaksi tersebut. Penurunan energi ionisasi dari atas ke bawah dalam satu golongan akan menyebabkan energi aktivasi lebih rendah dan reaksi menjadi lebih cepat.
AFINITAS ELEKTRON
Halaman ini menjelaskan apa yang dimaksud dengan afinitas elektron, dan mengamati faktor-faktor yang mempengaruhi besarnya afinitas elektron. Anda dianggap telah memahami tentang orbital atom sederhana, dan dapat menuliskan struktur elektronik untuk atom-atom sederhana.
Afinitas elektron pertama
Energi ionisasi selalu ditekankan pada pembentukan ion positif. Afinitas elektron ditekankan pada ion negatif, dan keduanya banyak dipakai untuk unsur-unsur pada golongan 6 dan 7 pada tabel periodik.
Mendefinisikan afinitas elektron pertama
Afinitas elektron pertama adalah energi yang dilepaskan ketika 1 mol atom gas mendapatkan satu elektron untuk membentuk 1 mol ion gas 1-.
Lebih mudah dipahami dalam bentuk simbol.
Pada penggambaran di atas, afinitas elektron pertama diartikan sebagai energi yang dilepaskan (per mol X) pada saat perubahan ini terjadi.
Afinitas elektron pertama memiliki harga negatif. Sebagai contoh, afinitas elektron pertama klor adalah -349 kJ mol-1. Berdasarkan perjanjian, tanda negatif menunjukkan pelepasan
energi.
Afinitas elektron pertama dari unsur-unsur golongan 7 F -328 kJ mol-1
Cl -349 kJ mol-1
Br -324 kJ mol-1
mol-1
Apakah ada polanya?
Ya − jika anda bergerak dari atas ke bawah dalam satu golongan, afinitas elektron pertama makin berkurang (artinya energi yang dilepaskan makin berkurang ketika ion negatif terbentuk). Fluor tidak mengikuti aturan itu, dan akan dijelaskan secara terpisah.
Afinitas elektron dihitung dari tarikan antara elektron yang datang dengan inti − tarikan yang lebih kuat, energi yang dilepaskan makin besar.
Faktor yang mempengaruhi tarikan ini sama dengan faktor yang berpengaruh pada energi ionisasi − muatan inti, jarak dan penyaringan (screening).
Bertambahnya muatan inti dari atas ke bawah dalam satu golongan terkurangi oleh tambahan penyaringan elektron. Masing-masing elektron terluar mengalami tarikan 7+ dari pusat atom, untuk semua atom golongan 7.
Sebagai contoh, atom fluor memiliki struktur elektron 1s22s22p
x22py22pz1. Terdapat 9 proton
dalam inti.
Elektron yang datang masuk ke tingkat-2, dan mengalami penyaringan dari inti oleh 2 elektron 1s2 electrons. Oleh karena itu tarikan bersih dari inti adalah 7+ (9 proton dikurangi
2 oleh penyaringan elektron).
Berbeda dengan klor yang memiliki struktur elektron 1s22s22p63s23p
x23py23pz1. Klor
memiliki 17 proton pada inti.
Tetapi sekali lagi elektron yang masuk merasakan tarikan bersih dari inti 7+ (17 proton dikurangi 10 oleh penyaringan elektron pada tingkat pertama dan kedua).
Faktor yang menentuka n adalah bertambahnya jarak antara elektron yang datang dengan inti dari atas ke bawah dalam satu golongan. Makin besar jarak, tarikan berkurang dan energi yang dilepaskan sebagai afinitas elektron juga berkurang.
Mengapa fluor tidak mengikuti kecenderungan yang ada?
Elektron yang datang, pada fluor akan lebih dekat dengan inti dibandingkan unsur lain, sehingga anda akan mendapatkan nilai afinitas elektron yang tinggi.
Namun demikian, karena fluor merupakan atom kecil, anda memasukkan elektron baru pada tempat yang sudah penuh sesak oleh elektron dan ada banyak tolakan. Tolakan ini mengurangi tarikan yang dirasakan elektron yang datang dan mengurangi afinitas elektron.
Perubahan yang sama dari kecenderungan yang diharapkan terjadi antara oksigen dan sulfur pada golongan 6. Afinitas elektron pertama oksigen (-142 kJ mol-1) lebih kecil dari
sulfur (-200 kJ mol-1) untuk alasan yang sama bahwa fluor lebih kecil dari klor.
Membandingkan afinitas elektron golongan 6 dan 7
Seperti yang anda perhatikan, afinitas elektron pertama oksigen (-142 kJ mol-1) lebih
rendah dari fluor (-328 kJ mol-1). Sama dengan sulfur (-200 kJ mol-1) yang lebih rendah dari
klor (-349 kJ mol-1). Mengapa?
Sederhana saja, unsur golongan 6 memiliki 1 proton pada inti yang lebih sedikit daripada tetangganya, golongan 7. Banyaknya penyaringan pada keduanya sama.
Itu artinya bahwa tarikan bersih dari inti pada golongan 6 lebih sedikit daripada golongan 7, sehingga afinitas elektron lebih rendah.
Afinitas elektron pertama dan reaktivitas
Reaktivitas unsur golongan 7 turun dari atas ke bawah dalam satu golongan − fluor merupakan unsur yang paling reaktif dan iod paling tak reaktif.
Seringkali pada reaksinya unsur-unsur ini membentuk ion negatif. Pada GCSE kadang-kadang ditunjukkan penurunan reaktivitas karena tarikan terhadap elektron yang datang berkurang kekuatannya dari atas ke bawah dalam satu golongan, sehingga pembentukan ion negatif kurang disukai. Penjelasan itu masih dapat diterima kecuali untuk fluor!
Reaksi keseluruhan terdiri dari banyak tahapan yang berbeda yang semuanya melibatkan perubahan energi, dan untuk menjelaskan kecenderungan yang ada tidak cukup hanya dengan mengamati salah satu tahap saja. Fluor lebih reaktif daripada klor (walaupun afinitas elektronnya lebih rendah) karena energi yang dilepaskan pada salah satu langkah reaksinya mengurangi energi yang dilepaskan sebagai afinitas elektron.
Afinitas elektron kedua
Anda hanya akan ditunjukkan pada unsur golongan 6, oksigen dan sulfur yang keduanya membentuk ion 2-.
Afinitas elektron kedua adalah energi yang diperlukan untuk menambah satu elektron pada masing-masing ion dari 1 mol ion gas 1- untuk menghasilkan 1 mol ion gas 2-. Lebih mudah dipahami dalam bentuk simbol.
Pada penggambaran di atas, afinitas elektron kedua diartikan sebagai energi yang dibutuhkan untuk membawa perubahan per mol X-.
Mengapa untuk melakukannya diperlukan energi?
Anda mendorong elektron ke dalam ion negatif. Hal ini tidak terjadi dengan serta-merta! EA ke-1 = -142 kJ
mol-1
EA ke-2 = +844 kJ mol-1
Tanda positif menunjukkan bahwa anda memerlukan energi untuk terjadinya perubahan ini. Afinitas elektron kedua oksigen tinggi, karena elektron dipaksa masuk ke dalam ion yang kecil, elektronnya sangat rapat.
BAB III
IKATAN KIMIA
Ikatan Ion
Pembentukan Ikatan Ion
Telah diketahui sebelumnya bahwa ikatan antara natrium dan klorin dalam narium klorida terjadi karena adanya serah terima elektron. Natrium merupakan logam dengan reaktivitas tinggi karena mudah melepas elektron dengan energi ionisasi rendah sedangkan klorin merupakan nonlogam dengan afinitas atau daya penagkapan elektron yang tinggi. Apabila terjadi reaksi antara natrium dan klorin maka atom klorin akan menarik satu elektron natrium. Akibatnya natrium menjadi ion positif dan klorin menjadi ion negatif. Adanya ion positif dan negatif memungkinkan terjadinya gaya tarik antara atom sehingga terbentuk natrium klorida. Pembentukan natrium klorida dapat digambarkan menggunakan penulisan Lewis sebagai berikut:
Pembentukan NaCl
Pembentukan NaCl dengan lambang Lewis
Ikatan ion hanya dapat tebentuk apabila unsur-unsur yang bereaksi mempunyai perbedaan daya tarik electron (keeelektronegatifan) cukup besar. Perbedaan
keelektronegati-fan yang besar ini memungkinkan terjadinya serah-terima elektron. Senyawa biner logam alkali dengan golongan halogen semuanya bersifat ionik. Senyawa logam alkali tanah juga bersifat ionik, kecuali untuk beberapa senyawa yang terbentuk dari berilium.
Susunan Senyawa Ion
Aturan oktet menjelaskan bahwa dalam pembentukan natrium klorida, natrium akan melepas satu elektron sedangkan klorin akan menangkap satu elektron. Sehingga terlihat bahwa satu atom klorin membutuhkan satu atom natrium. Dalam struktur senyawa ion natrium klorida, ion positif natrium (Na+) tidak hanya berikatan dengan
satu ion negatif klorin (Cl-) tetapi satu ion Na+ dikelilingi oleh 6 ion Cl- demikian juga
Struktur kristal kubus NaCl
IKATAN KOVALEN
Ikatan kovalen dapat terjadi karena adanya penggunaan elektron secara bersama. Apabila ikatan kovalen terjadi maka kedua atom yang berikatan tertarik pada pasangan elektron yang sama. Molekul hidrogen H2 merupakan contoh pembentukan
ikatan kovalen.
Pembentukan ikatan kovalen atom-atom hidogen
Masing-masing atom hidrogen mempunyai 1 elektron dan untuk mencapai konfigurasi oktet yang stabil seperti unsur golongan gas mulia maka masing-masing atom hidrogen memerlukan tambahan 1 elektron. Tambahan 1 elektron untuk masing-masing atom hidrogen tidak mungkin didapat dengan proses serah terima elektron karena keelekronegatifan yang sama. Sehingga konfigurasi oktet yang stabil dpat dicapai dengan pemakaian elektron secara bersama. Proses pemakaian elektron secara bersama terjadi dengan penyumbangan masing-masing 1 elektron ari atom hidrogen untuk menjadi pasangan elektron milik bersama. Pasangan elektron bersama ditarik oleh kedua inti atom hidrogen yang berikatan.
Pembentukan Ikatan Kovalen
Ikatan kovalen biasanya terjadi antar unsur nonlogam yakni antar unsur yang
mempunyai keelektronegatifan relatif besar. Ikata kovalen juga terbentuk karena proses serah terima elektron tidak mungkin terjadi. Hidrogen klorida merupakan contoh lazim pembentukan ikatan kovalen dari atom hidrogen dan atom klorin. Hidrogen dan klorin merupakan unsur nonlogam dengan harga keelektronegatifan masing-masing 2,1 dan 3,0. Konfigurasi elektron atom hidrogen dan atom klorin adalah H : 1
Cl : 2 8 7
Berdasarkan aturan oktet yang telah diketahui maka atom hidrogen kekurangan 1 elektron dan atom klorin memerlukan 1 elektron untuk membentuk konfigurasi stabil golongan gas mulia. Apabila dilihat dari segi keelektronegatifan, klorin mempunyai harga
Pembentukan HCl
Ikatan Kovalen Rangkap dan Rangkap Tiga
Dua atom dapat berpasangan dengan mengguna-kan satu pasang, dua pasang atau tiga pasang elektron yang tergantung pada jenis unsur yang berikatan. Ikatan dengan sepasang elektron disebut ikatan tunggal sedangkan ikatan yang menggu-nakan dua pasang elektron disebut ikatan rangkap dan ikatan dengan tiga pasang elektron disebut ikatan rangkap tiga. Ikatan rangkap misalnya dapat dijumpai pada molekul oksigen (O2) dan molekul karbondiksida (CO2) sedangkan ikaran rangkap tiga misalnya dapat dilihat
untuk molekul nitrogen (N2) dan etuna (C2H2).
IKATAN LOGAM
Halaman ini memperkenalkan ikatan yang terjadi pada logam. Halaman ini menjelaskan bagaimana munculnya ikatan logam dan kenapa ikatan tersebut kekuatannya bervariasi dari logam yang satu dengan logam yang lain.
Apakah ikatan logam itu? Ikatan logam pada natrium
Logam cenderung memiliki titik leleh dan titik didih yang tinggi sehingga memberikan kesan kuatnya ikatan yang terjadi antara atom-atomnya. Secara rata-rata logam seperti natrium (titik leleh 97.8°C) meleleh pada suhu yang sangat jauh lebih tinggi dibanding unsur (neon) yang mendahuluinya pada tabel periodik.
SNatrium memiliki struktur elektronik 1s22s22p63s1. Ketika atom-atom natrium datang
secara bersamaan, elektron pada orbital atom 2s dari satu atom natrium membagi ruang dengan elektron yang bersesuaian pada atom tetangganya untuk membentuk sebuah orbital molekul ? kebanyakan sama atau serupa dengan cara pembentukan ikatan kovalen. Perbedaannya, bagaimanapun, tiap atom natrium tersentuh oleh delapan atom natrium yang lainnya ? dan terjadi pembagian (sharing) antara atom tengah dan orbital 3s di semua delapan atom yang lain. Dan tiap atom yang delapan ini disentuh oleh delapan atom natrium, yang kesemuanya disentuh oleh delapan atom natrium, terus dan terus sampai kamu memperoleh seluruh atom dalam bongkahan natrium.
Semua orbital 3s dalam semua atom saling tumpang tindih untuk memberikan orbital molekul dalam jumlah yang sangat banyak yang memeperluas keseluruhan tiap bagian logam. Terdapat jumlah orbital molekul yang sangat banyak, tentunya, karena tiap orbital hanya dapat menarik dua elektron.
Elektron dapat bergerak dengan leluasa diantara orbital-orbital molekul tersebut, dan karena itu tiap elektron manjdi terlepas dari atom induknya. Elektron tersebut disebut
terdelokalisasi. Logam terikat bersamaan melalui kekuatan dayatarik yang kuat antara inti positif dengan elektron yang terdelokalisasi.
Hal ini kadang-kandang dilukisakan sebagai "susunan inti positif di lautan elektron". Jika kamu menggunakan tinjauan ini, hati-hati! Apakah logam merupakan atom atau ion? Jawabannya adalah logam merupakan atom.
Ikatan logam pada magnesium
Jika kamu menyusun argumentasi yang sama dengan magnesium, kamu akhirnya akan memperoleh ikatan yang lebih kuat dan tentunya titik leleh yang lebih tinggi.
Magnesium memiliki struktur elektronik terluar 3s2. Diantara elektro-elektronnya terjadi
delokalisasi, karena itu "lautan" yang ada memiliki kerapatan dua kali lipat daripada yang terdapat pada natrium. Sisa "ion" juga memiliki muatan dua kali lipat (jika kamu
menggunakan tinjauan ikatan logam) dan tentunya akan terjadi dayatarik yang lebih banyak antara "ion" dan "lautan". Lebih realistis, tiap atom magnesium memiliki satu proton lebih banyak pada intinya dibandingkan yang dimiliki oleh natrium, dan karena itu tidak hanya akan terdapat jumlah elektron yang terdelokalisasi tetapi juga akan terjadi lebih banyak dayatarik yang terjadi diantara mereka. Atom-atom magnesium memiliki jari-jari yang sedikit lebih kecil dibandingkan atom-atom natrium dan karena itu elektron yang terdelokalisasi lebih dekat ke inti. Tiap atom magnesium juga memiliki 12 atom terdekat dibandingkan delapan yang dimiliki natrium. Faktor-faktor inilah yang meningkatkan kekuatan ikatan secara lebih lanjut.
Ikatan logam pada unsur-unsur transisi
Logam transisi cenderung memiliki titik leleh dan titik didih yang tinggi. Alasannya adalah logam transisi dapat melibatkan elektron 3d yang ada dalam kondisi delokalisasi seperti elektron pada 4s. Lebih banyak elektron yang dapat kamu libatkan, kecenderungan dayatarik yang lebih kuat akan kamu peroleh.
Ikatan logam pada leburan logam
Pada leburan logam, ikatan logam tetap ada, meskipun susunan strukturnya telah rusak. Ikatan logam tidak sepernuhnya putus sampai logam mendidih. Hal ini berarti bahwa titik didih merupakan penunjuk kekuatan ikatan logam dibandingkan dengan titik leleh. Pada saat meleleh, ikatan menjadi longgar tetapi tidak putus
Ikatan Van der Waals
Dalam kimia fisik, van der Waals (atau van der Waals interaksi), setelah ilmuwan Belanda bernama Johannes Diderik van der Waals, adalah menarik atau gaya tolak antara molekul (atau antara bagian-bagian molekul yang sama) selain dari yang disebabkan oleh kovalen obligasi atau ke interaksi elektrostatik ion dengan satu sama lain atau dengan molekul netral. [1] Istilah meliputi:
* Gaya antara dipol permanen dan yang sesuai dipol terinduksi * Seketika induced induced dipol-dipol (gaya Dispersi London).
BAB IV
LAMBANG UNSUR, SENYAWA
DAN BENTUK MOLEKUL
Alam semesta ini mengandung zat yang jumlahnya tak terhitung. Ternyata semua zat tersebut tersusun dari zat-zat dasar yang disebut dengan unsur. Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat-zat lain yang lebih sederhana dengan reaksi kimia biasa (bukan reaksi nuklir).
Nama unsur
Dilingkungan kita banyak terdapat unsur yang mudah dikenal dan didapatkan. Arang yang berwarna hitam, biasanya digunakan pensil dan untuk elektroda bateri merupakan unsur yang diberi nama karbon. Beberapa logam yang ada disekitar anda merupakan unsur, seperti: emas, besi, perak, aluminium, seng, tembaga. Hingga saat ini sudah ditemukan 110 buah unsur.
Kalau kita perhatikan, nama-nama unsur tersebut sangat menarik. Nama unsur diambil dari nama suatu daerah, seperti germanium (Jerman), polonium (Polandia), Fransium (Perancis), europium (Eropa), amerisium (Amerika), kalifornium (Kalifornia), stronsium (Strontia, Scotlandia).
Beberapa nama diambil dari nama ilmuan, seperti: einstenium (Eistein), curium (Marie dan Pierre Curie), fermium (Enrico Fermi), nobelium (Alfred Nobel). Beberapa nama diambil dari astronomi, seperti: uranium (Uranus), plutonium (Pluto), neptunium (Neptunus), helium (helios= matahari).
Nama unsur mulai nomor 104 menggunakan akar kata yang menyatakan nomor atom, yaitu:
nil = 0, un = 1, bi = 2, tri = 3, quad =4, pent = 5, hex = 6, sept = 7, okt = 8, enn = 9. Misalnya unsur dengan nomor 107:
1 = un 0 = nil 7 = sept
107 = un nil sept + ium = unilseptium (Uns)
Lambang Unsur
Untuk memudahkan mengingat dan menuliskan senyawa kimia, pada tahun 1813 Jons Jacob Berzelius mengusulkan pemberian lambang berupa huruf untuk masing-masing unsur.
Apakah huruf C, Au, Al, dan O memiliki arti bagi anda? Setiap huruf atau pasangan huruf tersebut merupakan lambang kimia, yang digunakan untuk menuliskan sebuah unsur secara singkat. Bahan hitam setelah kayu dibakar adalah karbon, lambangnya C. Emas yang bayak digunakan sebagai perhiasan mempunyai lambang kimia Au. Beberapa Alat dapur terbuat dari aluminium yang mempunyai lambang kimia Al.
dari emas “Aurum”. Fe merupakan lambang unsur besi yang diambil dari “Ferum”, Ag merupakan lambang perak yang diambil dari kata “Argentum”.
Tabel Unsur-unsur yang sudah ditemukan
Aturan dalam menuliskan lambang unsur:
1. Jika suatu unsur dilambangkan dengan satu huruf, maka harus digunakan huruf kapital, misalnya oksigen (O), hidrogen (H), karbon (C).
2. Jika suatu unsur dilambangkan lebih satu huruf, maka huruf pertama menggunakan huruf kapital dan huruf berikutnya menggunakan huruf kecil, misalnya seng (Zn), emas (Au), tembaga (Cu). Kobalt dilambangkan Co, bukan CO. CO bukan lambang unsur, tetapi lambang senyawa dari karbon monoksida yang tersusun dari unsur karbon (C) dan oksigen (O).
1. Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat-zat lain yang lebih sederhana dengan reaksi kimia biasa.
2. Nama ilmiah unsur mempunyai asal usul yang bermacam-macam, misalnya nama benua, nama tokoh, nama negara dan sebagainya.
3. Lambang unsur ditetapkan oleh International Union of Pure and Applied Chemistry (IUPAC).
Bentuk-bentuk Molekul dan Ion
Halaman ini menjelaskan bagaimana caranya menyusun bentuk molekul dan ion yang hanya mengandung ikatan tunggal.
Teori tolakan pasangan elektron
Bentuk molekul dan ion ditentukan oleh penataan pasangan elektron disekeliling atom pusat. Semua yang kamu butuhkan untuk menyusunnya adalah seberapa banyak pasanganelektron yang berada pada tingkat ikatan, dan kemudian tertatanya untuk menghasilkan jumlah tolakan minimum antara pasangan elektron. Kamu juga perlu memasukkan pasangan elektron ikatan dan pasangan elektron mandiri.
Bagaimana cara menyusun jumlah pasangan elektron
Kamu dapat melakukannya dengan menggambar titik-silang, atau dengan menyusun atom-atom dengan menggunakan elektron dalam kotak dan mengkhawatirkan tentang promosi, hibridisasi dan yang lainnya. Akan tetapi hal ini sangat membosankan! Kamu dapat memperoleh informasi yang sama dengan tepat dengan cara yang lebih mudah dan cepat untuk contoh-contoh yang akan kamu temukan.
Hal pertama yang perlu kamu susun adalah seberapa banyak elektron yang terdapat pada sekeliling atom pusat:
Tuliskan jumlah elektron pada tingkat terluar dari atom pusat. Hal ini akan sama dengan nomor grup pada tabel periodik, kecuali pada kasus gas mulia yang membentuk senyawa, ketika jumlah elektron terluar menjadi delapan.
Tambahkan satu elektron untuk tiap ikatan yang terbentuk. (Hal ini diperbolehkan untuk elektron yang berasal dari atom yang lain).
Berikan muatan untuk tiap ion. Sebagai contoh, jika ion memiliki muatan 1-, tambahkan satu kelebihan elektron. Untuk muatan 1+, hilangkan satu elektron Sekarang susun seberapa banyak pasangan elektron ikatan dan pasangan elektron mandiri yang ada:
Dengan membagi dua untuk menemukan jumlah total pasangan elektron disekeliling atom pusat.
Susun seberapa banyak pasangan ikatan, dan seberapa banyak pasangan elektron mandiri. Kamu tahu seberapa banyak pasangan elektron ikatan yang ada karena kamu mengetahui seberapa banyak atom yang lain yang bergabung dengan atom pusat (dengan asumsi bahwa hanya terbentuk ikatan tunggal).
Sebagai contoh, jika kamu mempunyai 4 pasangan elektron tetapi hanya terdapat 3 ikatan, hal itu harus ada 1 pasangan elektron mandiri selain tiga pasangan elektron ikatan
Akhirnya, kamu dapat menggunakan informasi ini untuk menyusun bentuk molekul atau ion:
Susunlah semua pasangan elektron pada jarak yang mengalami tolakan minimum. Bagaimana caranya melakukan hal ini akan menjadi jelas pada contoh-contoh berikut.
Dua pasangan elektron disekeliling atom pusat
Kasus yang paling sederhana adalah berilium klorida, BeCl2. Perbedaan elektronegatifitas
antara berilium dan klor tidak cukup untuk menghasilkan pembentukan ion.