154 UJI EFEKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL 70 %, EKSTRAK DAN ISOLAT SENYAWA FLAVONOID DALAM UMBI BINAHONG (Anredera cordifolia
(Ten.) Steenis)
Putri Rizkia, Akyunul Jannah, Hafidatul Hasanah
Jurusan Kimia, Fakultas Sains dan Teknologi, UIN Maulana Malik Ibrahim Malang
ABSTRACT
Binahong (Anredera cordifolia (Ten.) Steenis) tuber is known to have potential as an antioxidant. Allah says in Quran surah Asy Syu’ara verse 7, Taha verse 53 and Luqman verse 10 that Allah has created good plants which can be used by man. One of the utilizations is being a medicine. The aims of this research are determining the effectiveness of antioxidant in 70 % ethanol extract and extract flavonoid of Binahong tuber, and determining antioxidant effectiveness of isolated flavonoid fraction of binahong tuber.
Extraction of active compounds from binahong tuber was conducted by maceration method using 70 % ethanol. Result of extraction was hydrolyzed with HCl 2 N and partitioned to obtain the flavonoid compound. The flavonoid compound and 70 % ethanol extract of binahong tubers were tested their antioxidant effectiveness using various concentration of DPPH (1,1-diphenyl-2-pikrilhidrazil). Identification classes of the active compounds were carried out using reagent test and qualitative observation. Flavonoid was separated using thin layer chromatography (TLC) technique. The eluents was n-butanol-acetic acid-water (4:1:5). Then the isolated flavonoid fraction was tested its antioxidant effectiveness.
The results showed that flavonoid has antioxidant effectiveness better than 70 % ethanol extract. EC50 values of flavonoid is 178,68 mg/L and 70 % ethanol extract is 298,10 mg/L. Separation with TLC resulted 4 isolate fractions and the highest antioxidant effectiveness was given by the third isolate that is 7,16 %.
Keywords : Binahong tubers (Anredera cordifolia (Ten.) Steenis), antioxidants, flavonoids
ABSTRAK
Tanaman Binahong (Anredera cordifolia (Ten.) Steenis) diketahui memiliki potensi sebagai antioksidan. Salah satunya bagian umbi tanaman binahong. Sebagaimana firman Allah SWT dalam QS. Asy Syu’Araa’; 7, QS. Thaha; 53 dan QS. Luqman; 10 bahwasannya Allah menciptakan tumbuhan baik yang dapat dimanfaatkan oleh manusia. Salah satu pemanfaatan umbi binahong adalah sebagai obat. Penelitian ini bertujuan untuk mengetahui efektivitas antioksidan dalam ekstrak etanol 70 %, ekstrak dan isolat senyawa flavonoid umbi binahong Anredera cordifolia (Ten.) Steenis.
Ekstraksi senyawa aktif umbi tanaman binahong dilakukan dengan metode maserasi menggunakan etanol 70 %. Hasil ekstraksi dihidrolisis dengan HCl 2N dan dipartisi untuk mendapatkan ekstrak senyawa flavonoid. Ekstrak etanol 70 % dan ekstrak senyawa flavonoid umbi binahong diuji efektivitas antioksidannya menggunakan metode DPPH (1,1-difenil-2-pikrilhidrazil) dengan variasi konsentrasi. Identifikasi golongan senyawa aktif dilakukan dengan penambahan reagen dan diamati secara kualitatif. Ekstrak flavonoid dipisahkan dengan metode KLT menggunakan eluen n-butanol-asam asetat-air (4:1:5) selanjutnya isolat diuji antioksidan kembali.
Hasil penelitian menunjukkan bahwa ekstrak flavonoid memiliki efektivitas antioksidan lebih baik daripada ekstrak etanol 70 %. Nilai EC50 ekstrak flavonoid sebesar 178,60 mg/L dan ekstrak etanol 70 % umbi binahong sebesar 298,10 mg/L. Hasil pemisahan KLT Preparatif didapatkan empat isolat, efektivitas antioksidan fraksi aktif senyawa flavonoid tertinggi terdapat pada isolat ketiga sebesar 7,16 %.
Kata Kunci: Umbi Binahong (Anredera cordifolia (Ten.) Steenis), antioksidan, flavonoid.
I. PENDAHULUAN
Senyawa antioksidan memiliki peranan penting dalam kesehatan karena mampu meredam radikal bebas. Manusia memiliki antioksidan endogen dalam tubuhnya yang mampu meredam radikal
155
Antioksidan sintetik seperti BHT (Butylated ydroxytoluen), BHA(Butilated Hydroxyanisole) dan TBHQ (Terbutylhydroxyquinone) mempunyai aktifitas biologis meredam radikal bebas. Namun, penggunaannya dibatasi karena BHA dan BHT dapat mengubah stabilitas genomik sel (Tran, 2013). Antioksidan alami seperti asam askorbat, tokoferol, karetonoid, senyawa fenol dan flavonoid menjadi alternatif pemenuhan antioksidan yang aman (Nunes dkk., 2012).
Umbi binahong Anredera cordofolia (Ten.) Stennis merupakan salah satu antioksidan alami. Kandungan golongan senyawa aktif umbi tanaman binahong terdiri dari fenol, flavonoid, saponin, terpenoid, steroid dan alkaloid (Astuti, 2013). Saleh dkk., (2013) melakukan pengujian fitokimia reagen dalam ekstrak etanol umbi binahong didapatkan golongan senyawa flavonoid, steroid dan fenolik.
Flavonoid telah terbukti memperlihatkan efektivitas penangkal berbagai macam senyawa oksigen reaktif seperti anion superoksida dan radikal hidroksil. Flavonoid juga bertindak sebagai peredam singlet oksigen (Harbone dan Williams, 1992).
Ekstraksi senyawa flavonoid umbi binahong menggunakan metode maserasi dengan pelarut etanol 70 % (Makalalag, 2013). Ekstrak etanol 70 % yang didapatkan selanjutnya dihidrolisis menggunakan HCl 2 N (Tensiska dkk., 2007) untuk mendestruksi ikatan glikosida (Bimakra dkk., 2010).
Proses ekstraksi senyawa flavonoid umbi binahong dilanjutkan dengan partisi menggunakan pelarut kloroform dan air dengan perbandingan 1:1 (Arishandy, 2010 dan Inayah, 2011). Pemisahan senyawa flavonoid menggunakan kromatografi lapis tipis (KLT) merupakan cara sederhana untuk pemisahan senyawa flavonoid berdasarkan perbedaan distribusi fasa diam dan fasa gerak sehingga akan didapatkan isolat senyawa flavonoid (Gandjar dan Rohman, 2007) .
Pengujian efektivitas antioksidan dilakukan menggunakan metode peredaman radikal DPPH. DPPH merupakan radikal bebas yang stabil, parameter yang digunakan untuk mengetahui aktivitas antioksidan ialah EC50 (konsentrasi sampel yang dapat menyebabkan berkurangnya 50 % aktivitas DPPH) (Molyneux, 2003). Metode DPPH dipilih karena sederhana, mudah, cepat dan peka serta hanya memerlukan sedikit sampel. Berdasarkan uraian diatas, perlu dilakukan penelitian untuk mengetahui keefektivan antioksidan ekstrak etanol 70 %, ekstrak dan isolat senyawa flavonoid dalam umbi binahong.
II. METODE PENELITIAN
Bahan
Bahan yang digunakan dalam penelitian diantaranya umbi binahong (Anredera cordifolia (Ten.) Steenis), aquades, DPPH (1,1-Diphenyl-2-picrylhydrazyl), BHT (Butylated hydroxytoluene) p.a, standar vitamin C, gas N2, HCl 2 N, etanol 70 %, etanol p.a, reagen Dragendroff, reagen Mayer, reagen Lieberman Burchard, metanol 50%, logam Mg, HCl 2%, HCl pekat, kloroform, asam asetat anhidrat, larutan FeCl3 1%, H2SO4, HCl 1 N, uap ammonia dan KLT Gel 60 F254.
Peralatan
Alat-alat yang digunakan dalam penelitian diantaranya seperangkat alat gelas, ayakan 60 mesh, blender, oven, cawan porselen, desikator, gelas arloji, neraca analitik, shaker, pipet tetes, lemari asam, bola hisap, pisau, kertas saring, corong buchner vacuum, inkubator, rotary evaporator vacuum, corong pisah, hot plate, stirer, botol larutan, bejana pengembang, plat silika gel F254, spektronik 20+ dan spektrofotometer UV-Vis Varian Carry.
Cara kerja
1. Preparasi Sampel
156 suhu 40 OC (Astuti, 2013). Umbi binahong
yang kering dilakukan pemblenderan dan dilakukan pengayakan dengan ayakan 60 mesh.
2. Analisis Kadar Air
Umbi binahong yang didapatkan dianalisis kadar airnya pda suhu 100-105º C sampai didapatkan berat yang konstan. Serbuk umbi binahong (Anredera cordifolia (Ten.) Steenis) yang digunakan
dalam ekstraksi harus memiliki kadar air ≤
10 %.
3. Ekstraksi Umbi Binahong
Menggunakan Etanol 70 %
Serbuk Umbi Binahong ukuran ≥
60 mesh ditimbang 600 gram dan dibagi menjadi 6 bagian masing-masing 100 gram kemudian masing-masing diekstraksi dengan menggunakan etanol 70 % (Bimakra dkk., 2010) sebanyak 300 mL selanjutnya dimaserasi selama 3 hari, setiap hari digojok menggunakan shaker selama 3 jam. Residu dilakukan maserasi kembali sampai didapatkan filtrat yang berwarna bening. Filtrat dipekatkan dengan vacuum rotary evaporator pada suhu tidak lebih dari 60 OC sampai diperoleh ekstrak pekat. Selanjutnya ekstrak pekat dialiri gas N2 dan ekstrak pekat yang diperoleh dihitung rendemennya.
4. Ekstraksi Senyawa Flavonoid Ekstrak pekat etanol 70 % sebanyak 10 gr dihidrolisis dengan menambahkan 20 ml asam klorida (HCl) 2N ke dalam ekstrak pekat selama 1 jam menggunakan magnetic stirrer hot plate pada suhu ruang (Tensiska dkk., 2007). Selanjutnya diekstraksi cair-cair dengan pelarut air : kloroform (1 :1) sebanyak (3x35 mL) (Arishandy, 2010; Inayah, 2011 dan Markham, 1988). Fraksi air dan fraksi organik yang diperoleh masing-masing dipisahkan dan dipekatkan menggunakan rotary evaporator dan dihitung nilai rendemennya. Hasil uji fitokimia reagen senyawa flavonoid yang positif dari kedua fraksi dilakukan pengujian antioksidan menggunakan DPPH, uji fitokimia reagen dan diidentifikasi menggunakan KLT.
5. Pemisahan Senyawa Flavonoid dengan KLTP
Pemisahan dengan KLT preparatif menggunakan plat silica Gel 60 F254 Ekstrak pekat flavonoid dilarutkan dalam etanol 70 %. Selanjutnya dielusi dengan menggunakan pelarut n-butanol-asam asetat-air (4:1:5) (Andrieyani dan Pradana, 2014). Noda-noda diperiksa di bawah sinar UV pada panjang gelombang 366 nm. Noda yang terbentuk, diukur harga Rf nya. Noda yang diperoleh dikerok dan dilarutkan dalam metanol kemudian disentrifugasi untuk mengendapkan silikanya. Filtrat hasil sentrifuge diuapkan pelarutnya dengan dimasukkan dalam desikator vakum kemudian dihitung rendemennya dan diuji efektivitas antioksidan dengan konsentrasi pada EC50 senyawa flavonoid.
6. Uji Efektivitas Antioksidan Metode DPPH
Pengujian efektivitas antioksidan diawali dengan penentuan panjang gelombang maksimum. Larutan DPPH dengan konsentrasi 0,2 mM sebanyak 1,5 mL dan ditambahkan etanol p.a sebanyak 4,5 mL selanjutnya diukur absorbansinya.
Pengujian waktu kestabilan dilakkan pada larutan ekstrak 800 ppm, sampel diinkubasi pada suhu 37 OC. Larutan dicari waktu kestabilan pada rentangan waktu 5-120 menit dengan interval 5 menit dan diukur pada anjang gelombang maksimum yang didapatkan.
Pengujian Efektivitas Antioksidan pada sampel diawali dengan pengukuran absorbansi kontrol selanjutnya sampel dilarutkan dalam etanol 70 % dengan konsentrasi 5, 10, 25, 50, 100, 200, 400 dan 800 ppm (Djamil dkk., 2012). Perbandingan larutan DPPH : ekstrak yang dilarutkan dengan konsentrasi tertentu 1:3 selanjutnya diinkubasi dengan suhu 37 OC pada waktu kestabilan dan diukur
absorbansinya pada λmaks. Data
157
% Efektivitas Antioksidan = A0A- A1
0 ×100 %
Ket: A0 = Absorbansi kontrol A1 = Absorbansi sampel
Setelah didapatkan persen (%) efektivitas antioksidan, selanjutnya masing-masing ekstrak dihitung nilai EC50 dengan memperoleh persamaan regresi menggunakan program “GraphPad prism5 software, Regression for analyzing dose-response data”. Pembanding BHT dan asam askorbat (Vitamin C) diperlakukan seperti sampel akan tetapi sampel diganti dengan larutan BHT dan asam askorbat (vitaminC).
7. Uji Fitokimia
Ekstrak etanol 70 % dan ekstrak senyawa flavonoid diuji fitokimia dengan dilakukan uji alkaloid, flavonoid, tanin, saponin, dan terpenoid.
III. HASIL DAN PEMBAHASAN Hasil preparasi sampel didapatkan serbuk kering umbi tanaman Binahong (Anredera cordifolia Ten. Steenis) berwarna coklat muda disimpan dalam wadah bersih, kering dan terlindung dari cahaya.
Hasil analisis kadar air umbi tanaman binahong (Anredera cordifolia (Ten.) Steenis) sebesar 5,38 %. Nilai kadar air yang diperoleh kurang dari 10 %, hal ini menunjukkan bahwa sampel umbi tanaman Binahong (Anredera cordifolia (Ten.) Steenis) dapat disimpan dalam jangka waktu panjang dan cukup baik untuk dilakukan ekstraksi.
Ekstrak pekat umbi binahong 70 % berwarna coklat tua dengan rendemen sebesar 8, 62 %. Ekstraksi senyawa flavonoid didapatkan dua fraksi yaitu fraksi organik (kloroform) dan fraksi air dengan rendemen 42,58 % dan 18,39 %. Kedua fraksi memiliki persentase rendemen yang cukup tinggi. Persentase rendemen fraksi kloroform lebih banyak daripada fraksi air. Hal ini menunjukkan bahwa terdapat banyak senyawa kurang polar daripada senyawa polar dalam
tanaman umbi binahong (Anredera cordifolia (Tenn.) Stenis). Hasil penelitian menunjukkan bahwa fraksi kloroform mengandung senyawa flavonoid. Aglikon flavonoid hasil hidrolisis memiliki sifat kurang polar terbukti bahwa senyawa flavonoid larut pada fraksi kloroform yang bersifat kurang polar. Senyawa flavonoid dimungkinkan dari jenis isoflavon, flavanon, flavon serta flavonol (Markham, 1988).
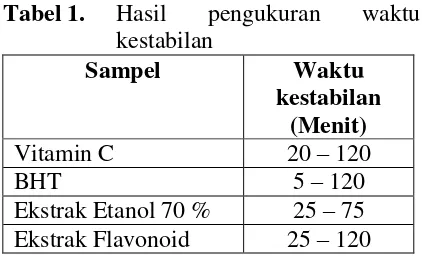
Pengujian fitokimia reagen dilakukan pada ekstrak etanol 70 %, fraksi organik (kloroform) dan fraksi air dari hasil partisi untuk mendapatkan senyawa flavonoid. Ekstrak ekat etanol 70 dan fraksi organik (ekstrak senyawa flavonoid) memiliki kandungan senyawa alkaloid, flavonoid, saponin, tanin dan terpenoid. Ekstak pekat fraksi air memiliki kandungan senyawa alkaloid dan saponin. Pengujian efektifitas antioksidan diawali dengan pengukuran panjang gelombang maksimum, berdasarkan hasil penelitian didapatkan panjang gelombang maksimum sebesar 517 nm. Pengujan waktu kestabilan dilakukan pada empat sampel diantaranya vitamin C dan BHT sebagai pembanding dan ekstrak etanol 70 % dan ekstrak fraksi senyawa flavonoid. Berikut ini hasil dari pengukuran waktu kestabilan:
Tabel 1. Hasil pengukuran waktu kestabilan
Sampel Waktu
kestabilan (Menit)
Vitamin C 20 – 120
BHT 5 – 120
Ekstrak Etanol 70 % 25 – 75 Ekstrak Flavonoid 25 – 120
158 sampel. Selisih antara absorbansi DPPH
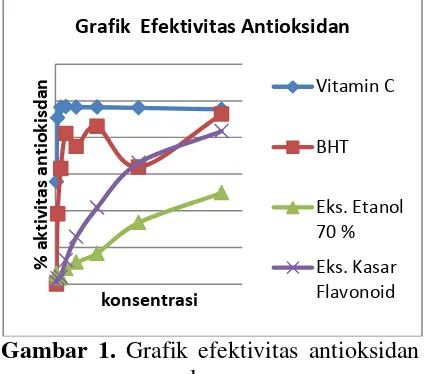
yang telah direduksi sampel dan absorbansi kontrol merupakan sisa radikal DPPH yang terbaca pada spektrofotometer UV-Vis. Semakin besar selisihnya semakin besar efektivitas antioksidan sampel. Berikut ini grafik pengukuran efektivitas antioksidan sampel :
Gambar 1. Grafik efektivitas antioksidan sampel
Semakin besar persentase efektivitas antioksidan sampel maka semakin berpotensi sebagai antioksidan. Grafik diatas dapat dijelaskan persentase efektivitas antioksidan tertinggi terdapat pada vitamin C diikuti BHT, ekstrak senyawa flavonoid dan ekstrak etanol 70 % umbi binahong. Ekstrak senyawa flavonoid dan ekstrak etanol 70 % mengalami kenaikan efektivitas antioksidan seiring dengan naiknya konsentrasi. Ekstrak senyawa flavonoid memiliki nilai efektivitas antioksidan yang lebih besar daripada ekstrak etanol 70 % sehingga dapat disimpulkan ekstrak senyawa flavonoid lebih efektif dalam meredam radikal bebas DPPH.
Parameter lain yang digunakan untuk mengetahui kekuatan antioksidan ialah EC50 (Efficient Concentration 50 Value). EC50 merupakan konsentrasi sampel yang dapat menyebabkan berkurangnya 50 % aktivitas DPPH (Molyneux, 2003). Berikut ini merupakan nilai EC50 dari masing – masing sampel :
Tabel 2. Nilai EC50 masing-masing ekstrak
Ekstrak Nilai EC50
(mg/L) menandakan semakin besar efektivitas antioksidan sehingga konsentrasi yang dibutuhkan untuk meredam radikal DPPH sebesar 50 % semakin kecil (Widyaningsih, 2010). Nilai EC50 pada ekstrak flavonoid dan ekstrak etanol 70 % lebih besar berturut-turut 178,60 mg/L dan 298,10 mg/L dibandingkan dengan EC50 Vitamin C dan BHT. Suatu sampel memiliki kemampuan meredam radikal bebas jika menyamai nilai EC50 vitamin C dan BHT. Ekstrak senyawa flavonoid digolongkan memiliki tingkat antioksidan lemah dan ekstrak etanol 70 % umbi binahong digolongkan sebagai antioksidan sangat lemah.
Namun, kedua ekstrak tersebut dapat digunakan sebagai antioksidan walaupun memiliki tingkat antioksidan yang lemah dan sangat lemah. Secara kualitatif efektivitas antioksidan sampel dapat dilihat dari perubahan warnanya dari ungu menjadi kuning. Hasil pengukuran masing-masing ekstrak ketika ditambahkan larutan DPPH tidak mengalami perubahan warna dari ungu menjadi kuning, melainkan hanya terjadi pemudaran warna dari ungu menjadi ungu kemerahan pada konsentrasi 800 mg/L.
Efektivitas antioksidan dalam sampel berkorelasi dengan kandungan bioaktifnya. Berdasarkan pengujian fitokimia di dalam ekstrak senyawa flavonoid terkandung senyawa alkaloid, flavonoid, saponin, triterpenoid dan tanin begitu juga pada ekstrak etanol 70 % umbi binahong. Perbedaannya terdapat pada kemampuan zat bioaktif yang terdapat pada masing-masing ekstrak dalam menangkal radikal bebas DPPH. Adanya
%
Grafik Efektivitas Antioksidan
159
gugus gula dalam senyawa bioaktif ekstrak etanol 70 % mengurangi kemampuan dalam menangkal radikal bebas DPPH.
Diantara kelima senyawa bioaktif dalam umbi binahong, flavonoid dikenal mempunyai efektivitas antioksidan yang tinggi. Hasil pengujian fitokimia ekstrak senyawa flavonoid menunjukkan perubahan warna kuning yang tajam disertai timbulnya gelembung. Flavonoid yang terglikosilasi menyebabkan flavonoid menjadi kurang reaktif dalam meredam radikal bebas. Senyawa flavonoid dan senyawa gula dihubungkan dengan ikatan glikosidik sehingga terbentuk glikosida flavonoid.
Penambahan HCl sebagai katalis asam dapat memutus ikatan glikosidik pada glikosida flavonoid sehingga akan terbentuk aglikon flavonoid dengan penambahan gugus hidroksil dan glikon dalam bentuk hemiasetal siklik. Penambahan gugus hidroksil dalam aglikon flavonoid mampu meningkatkan keefektifan antioksidan dalam flavonoid. Aglikon flavonoid tanpa glikon dapat mendonorkan lebih banyak elektronnya kepada radikal bebas. Albulescu dan Puscau (2008) membandingkan efektivitas antioksidan dari ekstrak glikosida kedelai dan aglikon isoflavon kedelai didapatkan nilai efektivitas antioksidan aglikon isoflavon kedelai lebih besar yaitu 82 % dibandingkan dengan ekstrak glikosida kedelai sebesar 75 %.
Pemisahan senyawa flavonoid menggunakan KLT preparatif didapatkan empat isolat. Keempat noda yang terbentuk pada hasil KLT Preparatif diduga merupakan senyawa flavonoid. Berikut ini hasil identifikasi KLT Preparatif :
Tabel 3. Hasil Identifikasi KLTP
Isol at Rf
Warna noda dengan sinar UV Tanpa NH3 Dengan
Koirewoa dkk. (2014) menyatakan noda yang disinari dengan lampu UV 366 nm positif flavonoid dari golongan flavonol jika berwarna hijau dan terjadi perubahan warna sedikit dari warna hijau setelah diuapi NH3. Selain itu, noda standar quersetin yang disinari lampu UV 366 nm berwarna kuning dan tidak mengalami perubahan warna setelah diuapi dengan NH3. Keempat isolat tersebut selanjutnya diukur efektivitas antioksidannya. Berikut ini efektivitas antioksidan isolat hasil KLTP:
Tabel 4. Hasil efektivitas antioksidan isolat KLT Preparatif pada konsentrasi 178,60 mg/L Isolat % Efektivitas
Antioksidan
Perubahan warna larutan setelah uji efektivitas antioksidan pada isolat tidak terjadi. Berdasarkan penelitian tersebut, isolat senyawa flavonoid pada konsentrasi 178,60 mg/L belum mampu meredam 50 % radikal bebas DPPH. Vitamin C dan BHT digunakan sebagai pembanding untuk mengetahui keefektifan isolat flavonoid dalam meredam radikal bebas DPPH. Nilai pengujian efektivitas antioksidan vitamin C dan BHT tersaji dalam Tabel 5:
Tabel 5. Hasil Uji efektivitas antioksidan Vitamin C dan BHT pada konsentrasi 178,60 mg/L
Sampel % Efektivitas
Antioksidan
Vitamin C 96,418
BHT 88,187
160 antioksidan kuat akan dihasilkan oleh
senyawa flavonoid yang memiliki jumlah gugus hidroksil lebih banyak pada inti flavonoidnya. Senyawa flavonoid pada isolat diduga memiliki gugus hidroksil dalam jumlah sedikit sehingga peredaman radikal bebas DPPH tidak berjalan maksimal. Semakin banyak gugus hidroksil bebas yang dapat menyumbangkan hidrogen maka semakin banyak juga reduksi yang dapat dilakukan terhadap DPPH (Rahayu dkk., 2014). Berikut ini dugaan reaksi peredaman radikal bebas DPPH oleh flavonoid :
DPPH* DPPH-H
Nilai persentase efektivitas antioksidan tiap isolat senyawa flavonoid memiliki nilai lebih rendah daripada ekstrak etanol 70 % dan ekstrak flavonoid pada konsentrasi 100-200 mg/L beturut-turut sebesar 11,94-16,74 dan 25,67-41,70. Isolat flavonoid merupakan hasil pemisahan senyawa flavonoid yang terdapat pada ekstrak flavonoid. Keempat isolat senyawa flavonoid diduga memiliki efek sinergis yaitu beberapa senyawa memiliki efektivitas yang lebih besar daripada masing-masing senyawa secara individual. Efektivitas antioksidan isolat senyawa flavonoid berkurang ketika masing-masing senyawa flavonoid terpisah namun keefektifannya bertambah ketika senyawa flavonoid berkerja secara sinergis pada ekstrak senyawa flavonoid. Keefektifan masing-masing isolat senyawa flavonoid berkurang karena semakin sedikit atom hidrogen yang dapat didonorkan kepada radikal DPPH.
IV. KESIMPULAN DAN SARAN
Kesimpulan
Ekstrak senyawa flavonoid memiliki efektivitas antioksidan lebih baik daripada ekstrak etanol 70 %. Ekstrak senyawa flavonoid memiliki nilai EC50 sebesar 178,60 mg/L dan ekstrak etanol 70 % umbi binahong sebesar 298,10 mg/L, keduanya memiliki efektivitas antioksidan yang lemah. Hasil efektivitas antioksidan isolat senyawa flavonoid paling tinggi terdapat pada isolat ketiga sebesar 7,16 %. Saran
Diperlukan penelitian lebih lanjut untuk menguji efektivitas antioksidan pada bagian lain tanaman umbi binahong (Anredera cordifolia (Ten.) Steenis) yang berpotensi sebagai antioksidan.
Hasil pengujian fitokimia reagen menunjukkan bahwa umbi binahong memiliki kandungan alkaloid dengan terbentuknya perubahan warna yang tajam. Maka, diperlukan penelitian lebih lanjut untuk isolasi alkaloid pada umbi binahong (Anredera cordifolia (Ten.) Steenis).
V. DAFTAR PUSTAKA
Albulescu, A. Puscau D. 2008. Antioxidant Activity of Natural Extracts Containing Isoflavones. Jurnal Series Chemistry 17 (1) (2008) 131-138.
Andrieyani. 2014. Identifikasi Senyawa Flavonoid dan Efek Terapi Ekstrak Etanol 70 % Umbi Binahong (Anredera cordifolia (Ten.) Steenis) Terhadap Kadar Glukosa Darah dan Aktivitas Sod Pada Jantung Tikus (Rattus novergicus) yang Diinduksi Aloksan. Skripsi.
Malang: Jurusan Kimia Fakultas Sains dan Teknologi Universitas Islam Negeri Maulana Malik Ibrahim.
161
Teknologi Universitas Islam Negeri Maulana Malik Ibrahim.
Astuti, M.S. 2013. Skrining Fitokimia dan Uji Aktifitas Antibiotika Ekstrak Etanol Daun, Batang, Bunga dan Umbi Tanaman Binahong (Anredera cordifolia (Ten) Steenis).
Jurnal Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan
(BBPMSOH) dan Fakulti
Kejuteraan Kimia dan Sumber Asli (Bioproses). Indonesia-Malaysia, 1-13.
Bimakra, M; Rahman, R.A; Taip, F.S; Ganjloo, A; Salleh, L.M; Selamat, J; Hamid, A; Zaidul, I.S.M. 2010. Comparisson of Different Extraction Methods for the Extraction of Major Bioactive Flavonoid Compounds from Spearmint (Mentha spicata L.)
Leaves. Jurnal Food and
Bioproducts Procesing. Malaysia. Djamil, R., Wahyudi, Wahono, dan Hanafi,
M. 2012. Antoxidant Activity of Flavonoid From Anredera cordifolia (Ten.) Steenis Leaves. International Research Journal of Pharmacy. Jakarta: Universitas Indonesia.
Gandjar, I.B., dan Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar.
Harbone, J.B dan Williams, C.A. 2000. Advances in Flavonoid Reseach in 1992. Jurnal Phitochemistry
Hal.481-500. Derpatement of Botany, School of Plant Sciences. Inayah, F. 2011. Isolasi Dan Identifikasi
Senyawa Flavonoid Dari Ekstrak Methanol Tanaman Anting-Anting (Achalypha indica linn). Skripsi Tidak Diterbitkan. Malang: Jurusan Kimia Fakultas Sains dan Teknologi Universitas Islam Negri (UIN) Maliki Malang.
Koirewoa, Y. A., Fatimawali, Wiyono, W. I. 2014. Isolasi dan Identifikasi Senyawa Flavonoid Dalam Daun Beluntas (Pluchea indica L.).
Jurnal. Manado: Program Studi Farmasi FMIPA UNSRAT. (Rattus norvegicus) yang Diinduksi Sukrosa. Manado. Pharmacon Jurnal Ilmiah Farmasi Volume. 2 No. 01 Februari ISSN 2302 – 2493: 29-34.
Markham, K.R. 1988. Cara mengidentifikasi Flavonoid. Bandung: ITB.
Molyneux, P. 2003. The Use of the Stable fre radical diphenyilpicrylhdrazyl (DPPH) for estimating antioxidant activity. Article. Songklanakarin J. Sci. Technol.
Nunes, X.P; Silva, F.S; Almeida, J.R.G.S; Junior, L.J.Q; Filho, J.M.B. 2012. Biological Oxidations and Antioxidant Actyvity of Natural Products. Jurnal Phytochemicals as
Nutraceuticals.
Brazil-Universidade federal do Vale do Sao Francisco.
Pradana, Fery. 2014. Identifikasi Flavonoid Dengan Pereaksi Geser dan Pengaruh Ekstrak Etanol 70 % Umbi Binahong (Anredera cordifolia (Ten.) Steenis) Terhadap Kadar Glukosa Darah Tikus Induksi Aloksan. Skripsi. Malang: Jurusan Kimia Fakultas Sains dan Teknologi Universitas Islam Negeri Maulana Malik Ibrahim.
Rahayu, D.S., Dewi, K., Enny, F. 2010.
Penentuan Aktivitas Antioksidan
dari Ekstrak Etanol Daun
Ketapang (Terminalia catappa L) dengan Metode 1,1 difenil 2 Pikrilhidrazil (DPPH). Skripsi
Diterbitkan. Semarang: Jurusan Kimia FMIPA Universitas Diponegoro
Tensiska, Marsetio, Silvia, O.N.Y. 2007.
162
Kasar Isoflavon Dari Ampas Tahu. Hasil Penelitian Dosen Jurusan Teknologi Industri Pangan. Bandung: Universitas Padjadjaran. Tran, A.V. 2013. Do BHA and BHT
Induce Morphological Changes and DNA Double-Strand Breaks in Shizosaccharomyces Pombe?.
Scripps Senoir Theses. Claremont. Science Departement.