TK4082 PENELITIAN
TB 1
Semester II Tahun 2012/2013
Judul
PENGEMBANGAN PROSES FERMENTASI XILITOL
DARI HIDROLISAT TANDAN KOSONG SAWIT
Kelompok B.1213.B.07
Arti Murnandari
(13010036)
Jasmiandy`
(13010063)
Pembimbing
Dr. Made Tri Ari Penia Kresnowati
Prof. Dr. Tjandra Setiadi
PROGRAM STUDI TEKNIK KIMIA
FAKULTAS TEKNOLOGI INDUSTRI
LEMBAR PENGESAHAN
TK4082 PENELITIAN TB 1
Semester II Tahun 2012/2013
PENGEMBANGAN PROSES FERMENTASI XILITOL
DARI HIDROLISAT TANDAN KOSONG SAWIT
Kelompok B.1213.B.07
Arti Murnandari (13010036)
Jasmiandy (13010063)
Catatan
Bandung, Mei 2013 Disetujui Pembimbing
SURAT PERNYATAAN
TK4082 PENELITIAN TB 1
Semester II Tahun 2012/2013
Kami yang bertanda tangan di bawah ini:
Kelompok : B.1213.B.07
Nama (NIM) : Arti Murnandari (13010036) Nama (NIM) : Jasmiandy (13010063)
dengan ini menyatakan bahwa laporan dengan judul:
PENGEMBANGAN PROSES FERMENTASI XILITOL
DARI HIDROLISAT TANDAN KOSONG SAWIT
adalah hasil penelitian kami sendiri di mana seluruh pendapat dan materi dari sumber lain telah dikutip melalui penulisan referensi yang sesuai.
Surat pernyataan ini dibuat dengan sebenar-benarnya dan jika pernyataan dalam lembar pernyataan ini di kemudian hari diketahui keliru, kami bersedia menerima sangsi sesuai peraturan yang berlaku.
Bandung, 20 Mei 2013
Tanda tangan
Arti Murnandari
Tanda tangan
TK4082 PENELITIAN TB 1
Pengembangan Proses Fermentasi Xilitol Dari Hidrolisat Tandan Kosong Sawit
Kelompok B.1213.B.07
Arti Murnandari (13010036) dan Jasmiandy (13010063) Pembimbing
Dr. Made Tri Ari Penia Kresnowati Prof. Dr. Tjandra Setiadi
ABSTRAK
Tandan kosong kelapa sawit (TKKS) merupakan salah satu limbah industri kelapa sawit yang memiliki banyak potensial. Limbah TKKS yang dihasilkan dari industri CPO hingga tahun 2011 jumlahnya mencapai 22 juta ton per tahun. Pada kenyataannya, potensi TKKS tidak dimanfaatkan secara optimal. TKKS memiliki kandungan lignoselulosa tinggi yang berpotensi untuk diolah menjadi berbagai produk bernilai jual tinggi, salah satunya adalah xilitol. Xilitol merupakan gula alkohol yang memiliki banyak kegunaan, sebagai gula diabetes, pencegah karies gigi, dan memiliki tingkat kemanisan yang sama dengan sukrosa. Selama ini, produksi xilitol dilakukan dengan dua cara, yaitu secara kimiawi dan biologis. Proses secara biologis memiliki banyak kelebihan dibandingkan dengan produksi secara sintesis kimia. Kondisi yang lunak dan pretreatment yang tidak sulit merupakan contoh dari kelebihan proses secara biologis yaitu dengan fermentasi menggunakan mikroorganisme.
Xilosa diperoleh dari hidrolisis secara enzimatik TKKS, kemudian digunakan sebagai substrat dalam fermentasi. Hasil fermentasi akan dianalisis dengan metode HPLC untuk diketahui konsentrasi xilitol dan xilosa di dalam sampel. Sampel dari hasil fermentasi juga diambil untuk dihitung konsentrasi biomassa yang terbentuk dengan interpolasi menggunakan kurva baku. Data-data yang didapat digunakan untuk menghitung perolehan xilitol dan biomassa terhadap substrat, serta produktivitas xilitol masing-masing hasil fermentasi.
Tujuan dari penelitian ini adalah menentukan konfigurasi fermentasi terbaik untuk optimasi produksi xilitol dari TKKS melalui perbandingan perolehan dan produktivitas masing-masing fermentasi, yaitu fermentasi batch, fed-batch, kontinyu dengan sel bebas dan kontinyu dengan sel teramobilisasi. Mikroorganisme yang digunakan adalah
TK4082 RESEARCH PROJECT OF TB 1
Optimalization Xylitol Fermentation From Empty Palm Fruit Bunch
Group B.1213.B.07
Arti Murnadari (13010036) and Jasmiandy (13010063) Advisor
Dr. Made Tri Ari Penia Kresnowati Prof. Dr. Tjandra Setiadi
ABSTRACT
Crude Palm Oil (CPO) Industry produces 22 millions tons per year empty palm fruit bunch (EPFB) as waste. Until now, EPFB waste is not treated well so its potential not optimally utilized. Many products can be made from EPFB. EPFB is one of potential material because it has lignocelullose. Lignocellulose can be converted into high level commercial product such as xylitol. Xylitol is one of alcohol sugar which has many use. It can be used as diabetic sugar, prevent dental caries, and its glycemic index (GI) equivalent with sucrose. Xylitol has been produced in two ways, chemically and biologically. Biological process is preffered because it has more advantages than chemical process. Biological process used microbial fermentation as biocatalyst, it can be
occured in soft condition and doesn’t need special treatment for EPFB.
Xylose is obtained from enzymatic hydrolysis EPFB. Xylose then used as substrate for fermentation. The result from fermentation process is analyzed by HPLC to know the concentration of xylose and xylitol in sample. Biomass concentration also analyzed with standard curve method. Xylose, Xylitol and Biomass concentration are used to count yield and productivity of fermentations.
The purpose of this research is to find the best fermentation configuration to obtain xylitol from EPFB by comparing yield and productivity of batch, fed-batch, continuous with free cell, and continuous with immobilized cell fermentation. Debaryomyces hansenii is used as biological catalyst. Synthetic xylose used as substrate in fermentation medium. The best configuration obtained will be selected and tested with EPFB hydrolysate as data validation.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena berkat dan rahmat-Nya, penulis dapat menyelesaikan laporan penelitian awal yang berjudul
“Pengembangan Proses Fermentasi Xilitol Dari Hidrolisat Tandan Kosong Sawit”. Pada kesempatan ini, penulis ingin menyampaikan rasa terima kasih kepada:
1. Dr. Made Tri Ari Penia Kresnowati dan Prof. Dr. Tjandra Setiadi selaku pembimbing karena telah bersedia membimbing, membantu, dan mengarahkan penulis dalam proses pembuatan laporan awal penelitian.
2. Efri Mardawati, sebagai mahasiswa S3 yang turut membantu penulis dengan memberikan informasi yang mendukung penulis dalam proses pembuatan laporan awal penelitian.
3. Andi Trirakhmadi, S.T. sebagai mahasiswa S2 yang turut membantu penulis dengan memberikan informasi yang mendukung penulis dalam proses pembuatan laporan awal penelitian.
4. Tan Mellisa Tantra dan David, sebagai mahasiswa S1 yang turut membantu penulis dengan memberikan informasi yang mendukung penulis dalam proses pembuatan laporan awal penelitian.
5. Pihak-pihak lain yang turut membantu dan mendukung penulis untuk menyelesaikan pembuatan laporan ini.
Penulisan laporan penelitian ini merupakan salah satu bagian dari tugas akhir untuk memenuhi syarat kelulusan pada Program Sarjana Program Studi Teknik Kimia Institut Teknologi Bandung. Laporan ini diharapkan dapat membantu penelitian lebih lanjut mengenai penggunaan tandan kosong kelapa sawit sebagai bahan baku dalam produksi xilitol.
Laporan penelitian ini masih jauh dari sempurna sehingga saran dan kritik sangat diharapkan oleh penulis. Penulis meminta maaf atas kesalahan yang terdapat pada laporan ini. Semoga laporan ini bermanfaat bagi pembaca.
DAFTAR ISI
LEMBAR PENGESAHAN ... i
ABSTRAK ... iii
ABSTRACT ... iv
KATA PENGANTAR ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 2
1.3. Tujuan ... 3
1.4. Ruang Lingkup ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1. Kelapa Sawit ... 5
2.2. Proses Pengolahan Kelapa Sawit ... 7
2.3. Tandan Kosong Kelapa Sawit (TKKS) ... 8
2.4. Komposisi TKKS ... 11
2.4.1. Selulosa ... 11
2.4.2. Hemiselulosa ... 12
2.4.3. Lignin ... 15
2.5. Hidrolisis ... 16
2.5.1. Hidrolisis Asam ... 16
2.5.2. Hidrolisis enzimatik ... 17
2.7. Teknologi Produksi Xilitol ... 18
2.7.1. Ekstraksi padat-cair ... 18
2.7.2. Sintesis Kimia ... 18
2.8. Bioteknologi ... 19
2.9. Debaryomyces hansenii ... 23
2.10. Faktor yang Mempengaruhi Pertumbuhan Mikroorganisme ... 26
2.10.1. Konsentrasi Awal Sel ... 26
2.10.2. Waktu Inkubasi ... 26
2.10.3. Oksigen Terlarut... 26
2.10.4. pH ... 28
2.10.5. Konsentrasi Awal Substrat ... 28
2.10.6. Ko-Substrat ... 29
2.10.7. Campuran gula ... 30
2.10.8. Pengaruh Xilitol ... 31
2.10.9. Komposisi Kultur Media ... 32
2.10.10. Pengaruh Imobilisasi Sel ... 34
2.11. Jenis Fermentasi ... 37
2.11.1. Fermentasi batch ... 37
2.11.2. Fermentasi Fedbatch ... 38
2.11.3. Fermentasi Kontinu ... 39
2.12. Penentuan Kadar Xilitol ... 40
2.12.1. Metode Beutler & Becker ... 40
2.12.2. Metode HPLC ... 40
BAB III RANCANGAN PENELITIAN ... 42
3.1. Metodologi ... 42
3.2.2. Alat ... 44
3.2.3. Prosedur ... 46
3.2.3.1 Persiapan Sel Ragi... 47
3.2.3.1.1 Peremajaan Sel Ragi ... 48
3.2.3.1.2 Proses Inokulasi ... 49
3.2.3.1.2 Imobilisasi Sel ... 50
3.2.3.2 Proses Fermentasi... 51
3.2.3.2.1 Fermentasi Batch ... 52
3.2.3.2.2 Fermentasi Fed-batch ... 53
3.2.3.2.3 Fermentasi Kontinyu ... 54
3.2.3.3 Tahap Analisis Hasil Penelitian ... 55
3.2.3.3.1 Pembuatan Kurva Baku Sel... 55
3.2.3.3.2 Pembuatan Kurva Pertumbuhan Sel ... 56
3.2.3.3.3 Analisis menggunakan HPLC ... 57
3.2.4. Variasi ... 57
3.3. Interpretasi Data ... 58
3.4. Jadwal... 60
LAMPIRAN A ... 69
Prosedur Operasi Alat Percobaan dan MSDS ... 70
Prosedur Operasi Alat Percobaan ... 70
A.1. Autoklaf ... 70
A.2. Biological safety cabinet ... 71
A.3. Fermentor ... 72
A.4. HPLC ... 73
A.5. Inkubator Shaker ... 74
A. 6. Mikroskop ... 75
A.7. Sentrifuga ... 76
A.9. Wet test meter... 78
MSDS ... 79
INSTRUKSI KERJA ... 83
HAZOP (Hazard and Operability) Alat Percobaan ... 85
JOB SAFETY ANALYSIS ... 87
LAMPIRAN B ... 88
PRODUKSI HIDROLISAT TANDAN KOSONG SAWIT ... 89
B.1. Produksi Enzim Xilanase ... 89
B.1.1. Penyediaan Jamur Penghasil Enzim Xilanase ... 89
B.1.2. Penyiapan Substrat Tandan Kosong Kelapa Sawit ... 90
B.1.3. Kultivasi Padat... 90
B.1.1.3 Ekstraksi Enzim ... 90
DAFTAR TABEL
Tabel 2.1. Komposisi Berat Kering Senyawa Kimiawi Tandan Kosong Kelapa Sawit
dalam Persen ... 9
Tabel 2.2. Kemampuan D. hansenii Mengutilisasi Substrat ... 23
Tabel 2.3. Produksi Xilitol Pada Berbagai Kecepatan Pengocokan Dengan Menggunakan Candida athensensis SB18 ... 27
Tabel 2.4. Perbandingan Kultur Medium Inokulum Berbagai Mikoorganimse ... 33
Tabel 2.5. Perbandingan Kultur Medium Fermentasi Debaromyces Hansenii ... 33
Tabel 2.6. Efek Imobilisasi Sel dalam Produksi Xilitol dengan C.tropicalis ... 36
Tabel 2.7. Jenis Fermentasi yang Telah Digunakan dalam Produksi Xilitol ... 39
Tabel 3.1. Bahan yang Digunakan Pada Penelitian ... 43
Tabel 3.2. Komposisi dari Glucose Yeast Extract (Yeast Extract Pepton Glucose) ... 43
Tabel 3.3. Komposisi dari 500 mL Medium Fermentasi ... 43
Tabel 3.4. Komposisi TKKS ... 44
Tabel 3.5. Alat yang Digunakan Pada Penelitian ... 44
Tabel 3.6. Jadwal Penelitian ... 60
Tabel A.1. MSDS Penelitian ... 79
Tabel B.1. Komposisi Medium Agar Dekstrosa Kentang ... 89
DAFTAR GAMBAR
Gambar 2.1. Kelapa Sawit ... 5
Gambar 2.2. Jenis Kelapa Sawit Berdasarkan Ketebalan Tempurung dan Daging Buah ... 6
Gambar 2.3. Peta Sebaran Kelapa Sawit ... 7
Gambar 2.4. Proses Pengolahan Tandan Buah Segar (TBS) ... 8
Gambar 2.5. Tandan Kosong Kelapa Sawit ... 9
Gambar 2.6. Kompos Hasil Pemanfaatan TKKS ... 10
Gambar 2.7. Papan Serat Berkerapatan Sedang Hasil Olahan Kayu Sawit ... 10
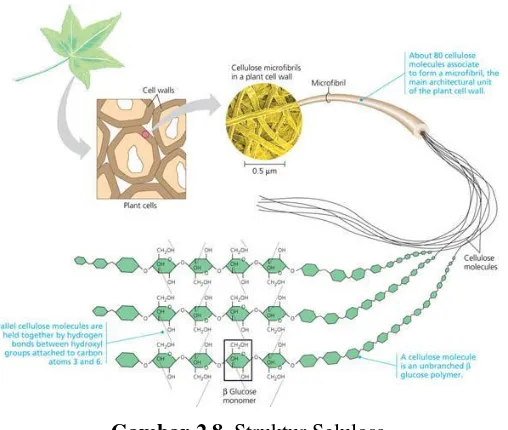
Gambar 2.8. Struktur Selulosa ... 11
Gambar 2.9. Penampang Membujur Hemiselulosa ... 12
Gambar 2.10. Struktur Molekul Monosakarida Penyusun Hemiselulosa ... 13
Gambar 2.11. Xilan sebagai komponen penyusun hemiselulosa ... 14
Gambar 2.12. Struktur Kimia Xilan ... 15
Gambar 2.13. Struktur Lignin ... 15
Gambar 2.14. Perbedaan Struktur Xilitol dan Xilosa ... 18
Gambar 2.15. Sintesis Xilitol secara kimiawi ... 19
Gambar 2.16. Metabolisme xilosa oleh khamir ... 22
Gambar 2.17. Debaromyces Hansenii ... 23
Gambar 2.18. Jalur Metabolisme xilosa oleh D.hansenii ... 25
Gambar 2.19. Fase Pertumbuhan Pada Fermentasi Batch ... 38
Gambar 3.1. Fermentor BioFlo/Celligen 115 New Brunswick ... 45
Gambar 3.2. Rangkaian Alat Fermentasi Xilitol Secara Batch ... 45
Gambar 3.3. Rangkaian Alat Fermentasi Xilitol Secara Fed-batch ... 46
Gambar 3.4. Rangkaian Alat Fermentasi Xilitol Secara Kontinyu ... 46
Gambar 3.5. Prosedur Penelitian ... 47
Gambar 3.6. Peremajaan Sel Ragi ... 48
Gambar 3.7. Proses Inokulasi ... 49
Gambar 3.8. Proses Imobilisasi Sel ... 50
Gambar 3.9. Proses Fermentasi ... 52
Gambar 3.10 Proses Fermentasi Fed-batch ... 53
Gambar 3.14. Analisis Menggunakan HPLC ... 57
Gambar A. Autoklaf ... 70
Gambar B. Biological Safety Cabinet ... 71
Gambar C. Fermentor ... 72
Gambar D. HPLC ... 73
Gambar E. Inkubator shaker ... 74
Gambar F. Mikroskop ... 75
Gambar H. Spektrofotometer ... 77
BAB I
PENDAHULUAN
1.1. Latar Belakang
Kelapa sawit merupakan tumbuhan yang mudah hidup dan tumbuh di daerah tropis seperti Indonesia. Di Indonesia, kelapa sawit telah banyak dimanfaatkan untuk menghasilkan CPO (crude palm oil) dan CPKO (Crude Palm Kernel Oil). Harga produk yang dihasilkan dari kelapa sawit cukup mengiurkan kalangan masyarakat baik dari golongan bawah maupun golongan atas. Harga yang cukup menggiurkan membuat banyak petani berminat untuk menanam pohon kelapa sawit. Menurut data dari Badan Pusat Statistik (BPS., 2012), perkiraan luas lahan kebun kelapa sawit pada tahun 2012 mencapai 5,4 juta hektar. Selain petani, berbagai kalangan masyarakat juga tertarik pada peluang pemanfaatan kelapa sawit. Hal ini dapat dilihat dari jumlah CPO yang dihasilkan pada tahun 2009 mencapai 14 juta ton dan sekitar 60% diekspor keluar negeri (BPS., 2012). Karena itu, kelapa sawit telah menjadi salah satu komoditi ekspor unggul Indonesia.
Meningkatnya produksi minyak kelapa sawit juga berbanding lurus dengan limbah yang dihasilkan. Limbah ini menimbulkan masalah bagi lingkungan jika tidak ditangani dengan tepat. Limbah kelapa sawit terdiri dari tandan kosong kelapa sawit (TKKS), padatan basah, cangkang, serabut, limbah cair dan air kondensat dengan presentasi masing-masing 23%, 4%, 6,5%, 13%, 50% dan 3,5% (Ditjen PPHP.,2006). TKKS merupakan bagian limbah yang memiliki presentasi yang cukup besar. Kandungan dari TKKS meliputi selulosa, Hemiselulosa, Lignin, kadar abu, dan kadar air (Darnoko., 1992).
TKKS berpontensi besar untuk dimanfaatkan di industri gula xilitol.
Xilitol adalah salah satu gula alkohol yang memiliki banyak manfaat di bidang pangan dan kesehatan. Salah satu contoh pemanfaatan xilitol dibidang kesehatan adalah gula yang cocok untuk penderita diabetes karena gula ini memiliki tingkat kemanisan yang setara dengan sukrosa namun nilai kalorinya 40% lebih rendah dan GI (Glycemic Index) yang rendah yaitu 7 (Anastasia., 2012). Untuk industri pangan, xilitol cocok untuk dijadikan permen karet. Hal ini disebabkan xilitol memiliki sifat yang tidak dapat difermentasi oleh bakteri penyebab kerusakan gigi.
Xilitol kini sudah diproduksi secara batch dengan bioteknologi. Karena saat ini jenis fermentasi yang digunakan baru sebatas fermentasi batch, maka jenis fermentasi yang lain masih perlu diujikan untuk mengetahui perolehan terbaik dalam proses produksi xilitol. Dengan mengetahui jenis fermentasi terbaik diharapkan industri mampu memproduksi xilitol dengan harga yang murah, mencukupi kebutuhan dalam negeri, bahkan dapat menjadi negara pengekspor xilitol. Selain itu, TKKS yang semulanya merupakan limbah dapat dimanfaatkan secara optimal.
1.2. Rumusan Masalah
Teknologi pengolahan tandan kosong kelapa sawit (TKKS) saat ini masih sebatas dijadikan pupuk dan bahan mebel yang tidak memerlukan proses yang sulit. Hal ini disebabkan oleh belum diterapkannya proses pengolahan yang menggunakan sintesis secara kimiawi. Pengolahan secara kimia sebenarnya cukup mahal mengingat diperlukan pemurnian tingkat tinggi untuk bahan baku sehingga industri tidak melirik pengolahan TKKS dengan cara ini. Padahal dengan jumlah TKKS yang dihasilkan di Indonesia, pengubahan menjadi produk-produk lain yang berguna sangat dibutuhkan.
lingkungan, biaya yang diperlukan untuk produksinya juga lebih rendah dibandingkan secara kimiawi.
Penelitian ini melanjutkan penelitian dari Tan Melissa Tantra (13009024) dan David (13010053) yang telah berhasil mendapatkan mikroba yang menghasilkan yield terbesar dalam produksi xilitol, yaitu Debaryomyces hansenii. Melalui data dan kondisi optimum yang telah didapatkan, penelitian ini akan dilanjutkan dengan mencari jenis fermentasi yang akan mendukung peningkatan yield subtrat yang diubah menjadi xilitol. Jenis fermentasi yang akan diteliti adalah fermentasi secara batch, fed-batch, dan kontinyu.
Fermentasi secara batch merupakan fermentasi yang paling sederhana. Fermentasi dengan cara ini mudah namun pada saat fermentasi, produk tidak dapat diambil secara bersamaan. Dalam proses industri, waktu produksi merupakan salah satu hal yang penting, sehingga sedapatnya produk dihasilkan terus menerus. Fermentasi secara kontinyu merupakan fermentasi yang dapat menghasilkan produk saat bioreaktor masih melakukan proses fermentasi. Bila menggunakan fermenatsi secara kontinyu, waktu tinggal di dalam reaktor harus sangat diperhitungkan agar tidak terjadi wash-out, yaitu saat mikroorganisme terbawa keluar bersama produk saat sebelum mencapai fasa stasionernya. Fermentasi secara fed-batch merupakan gabungan dari fermentasi batch dengan fermentasi kontinyu. Fermentasi jenis ini menggabungkan kedua prinsip fermentasi tersebut.
Dalam fermentasi xilitol, penting untuk menyiapkan medium fermentasi yang tepat. Kandungan xilosa yang terdapat dalam medium harus disesuaikan dengan volume larutan dalam bioreaktor yang akan digunakan untuk fermentasi. Kesterilan dalam melakukan fermentasi juga penting agar tidak terdapat mikroorganisme lain yang menjadi penghambat pertumbuhan Debaryomyces hansenii sebagai biokatalis yang digunakan.
khusus yang akan dicapai dari penelitian ini adalah untuk mendapatkan jenis fermentasi yang menghasilkan perolehan terbaik. Jenis fermentasi yang akan dilaksanakan meliputi fermentasi batch, fedbatch dan kontinyu
1.4. Ruang Lingkup
BAB II
TINJAUAN PUSTAKA
2.1. Kelapa Sawit
Kelapa sawit bukan merupakan tanaman asli Indonesia. Menurut Loebis (1992), tanaman ini berasal dari Guinea, pantai barat Afrika. Tanaman ini memiliki batang lurus dan daun yang menyerupai bulu ayam atau burung. Diujung sisi daun terdapat duri yang keras dan tajam. Tanaman ini akan menghasilkan bunga ketika telah berumur tiga tahun. Bunga yang dihasilkan berupa bunga jantan yang berbentuk lonjong atau bunga betina yang berbentuk agak bulat. Bagian yang lainnya adalah buah. Buah memiliki kulit yang licin dan keras. Warna buah dari yang paling muda sampai matang adalah hijau pucat, hijau kehitaman, dan merah kuning (oranye). Ketika buah telah berwarna oranye maka buah mulai lepas dari tandan kelapa sawit.Pohon dan buah kelapa sawit dapat dilihat pada Gambar 2.1.
Gambar 2.1. Kelapa Sawit
J/cm2/hari. Salah satu negara yang memiliki kondisi seperti yang telah disebutkan diatas adalah negara Indonesia. Oleh sebab itu, tanaman kelapa sawit banyak dibudidaya di Indonesia.
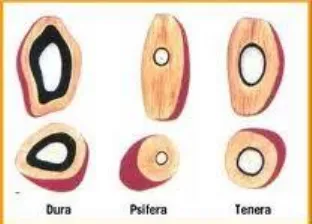
Kelapa sawit memiliki beberapa jenis, seperti dura, pisifera, dan tenera. Pembagian jenis tersebut berdasarkan ketebalan tempurung dan daging buah seperti yang terlihat pada Gambar 2.2. Dura memiliki tempurung dan daging buah yang tebal. Ketebalannya adalah 2 sampai 8 mm. Jenis ini dikenal sebagai pohon induk betina dan memiliki kandungan minyak sebesar 18% per tandannya. Pisifera memiliki tempurung yang sangat tipis, bahkan tidak memiliki tempurung. Selain itu, jenis ini memiliki daging buah yang tipis. Pisifera dikenal sebagai pohon induk jantan karena bunga betina yang dihasilkan jarang menjadi buah. Jenis terakhir adalah tenera. Jenis ini merupakan persilangan dari dura dan pisifera dengan harapan mendapatkan sifat unggul dari kedua induknya (dura dan pisifera). Kandungan minyak dari tenera lebih besar dari dura yaitu 28% per tandannya.
Gambar 2.2. Jenis Kelapa Sawit Berdasarkan Ketebalan Tempurung dan Daging Buah
(Sumber: 2.bp.blogspot.com)
Gambar 2.3. Peta Sebaran Kelapa Sawit
(Sumber: http://regionalinvestment.bkpm.go.id)
2.2. Proses Pengolahan Kelapa Sawit
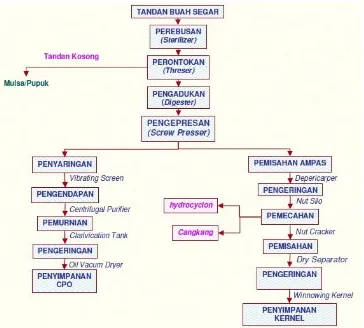
dan crude kernel palm oil (CPKO). Kualitas dan kuantitas minyak yang dihasilkan sangat bergantung pada kandungan minyak dan kadar garam asam lemak bebas dari TBS. TBS yang belum matang memiliki kandungan minyak dan kadar garam asam lemak bebas yang rendah dan sebaliknya. Minyak berkualitas tinggi dihasilkan dari TBS yang memiliki kandungan minyak yang tinggi namun rendah kadar garam asam lemak bebas. Sehingga TBS yang dipanen adalah TBS yang matang dan setelah dipanen harus segera mungkin untuk diangkut ke pabrik untuk diproses lebih lanjut untuk menghasilkan CPO dan CPKO.
Gambar 2.4. Proses Pengolahan Tandan Buah Segar (TBS)
(Sumber: B3olahlimbahkelapasawit)
2.3. Tandan Kosong Kelapa Sawit (TKKS)
28% dari tandan buah segar yang diolah, sedangkan presentase serat dan cangkang biji masing-masing adalah 13% dan 5,5% dari tandan buah segar (Peni, 1995). Limbah padat kelapa sawit terutama terdiri dari selulosa dan lignin. TKKS yang merupakan limbah padat kelapa sawit terdiri dari selulosa dan hemiselulosa yang disebut juga holoselulosa (Darnoko, 1992). Kedua komponen ini menempati 70% dari komposisi total TKKS dan kandungan lignin 17%(Peni, 1995). Komposisi kimiawi tandan kosong kelapa sawit berbagai literatur disajikan pada Tabel 2.1.
Gambar 2.5. Tandan Kosong Kelapa Sawit
(Sumber: http://alfonsorodriguezpenadelcastillo.blogspot.com)
Tabel 2.1. Komposisi Berat Kering Senyawa Kimiawi Tandan Kosong Kelapa Sawit dalam Persen
KANDUNGAN MENURUT
DARNOKO(1992)
LASURE DAN ZHANG, M.(2004)
MENURUT HAMBALI, DKK(2007)
Selulosa 45,95 40-50 36,81
Hemiselulosa 22,84 20-30 27,01
Lignin 16,94 15-20 15,70
Kadar Abu 1,23 6,04
TKKS saat ini di Indonesia kebanyakan dijadikan pupuk kompos. Pupuk kompos seperti pada Gambar 2.6 ini diolah dengan cara fermentasi menggunakan mikroba. Selain dijadikan kompos, beberapa produsen membakar TKKS. Cara pembakaran ini kini sudah dilarang karena dapat mencemari lingkungan. Pemanfaatan yang lebih modern adalah dengan dijadikan papan serat berkerapatan sedang (MDF) seperti pada Gambar 2.7. Menurut referensi dari Safii dan Sudohadi, dewasa ini terdapat enam pabrik MDF yang produksinya mencapai 550.000 m3 per tahun diambil dari jurnal “Kemungkinan Pemanfaatan Tandan Kosong Kelapa Sawit sebagai Bahan Baku Pembuatan Papan Serat
Berkerapatan Sedang”. MDF banyak digunakan untuk bahan baku mebel, peralatan listrik, bahan konstruksi dan produk-produk panel lainnya.
Gambar 2.6. Kompos Hasil Pemanfaatan TKKS
(Sumber : http://bumi_sriwijaya_sejahtera.en.ecplaza.net/main.jpg)
Gambar 2.7.Papan Serat Berkerapatan Sedang Hasil Olahan Kayu Sawit
Selain pupuk dan bahan baku mebel, ternyata TKKS dapat juga dimanfaatkan sebagai bahan bakar. Pada Januari 2011 telah diresmikan pembangkit listrik dengan kapasitas 3 MW di Unit Kebun Pabatu yang telah menggunakan bahan bakar TKKS (www.bumn.go.id, 2011). Sebagai bahan bakar, biasanya TKKS diolah dahulu menjadi berbentuk serabut dan briket (Irawan, 2012).
2.4. Komposisi TKKS
Sebelum memanfaatkan TKKS, terlebih dahulu harus diketahui komposisi dari TKKS. Komposisi tersebut akan dijelaskan dalam subbab-subbab berikut ini.
2.4.1. Selulosa
Selulosa dapat dibagi menjadi tiga bagian, α-selulosa, β-selulosa dan γ-selulosa. α -selulosa bersifat tidak larut dalam larutan alkali kuat (NaOH). β-selulosa dapat larut
dalam media alkali dan mengendap jika larutan dinetralkan, sedangkan γ-selulosa adalah bagian selulosa yang dapat larut dalam alkali dan tetap berbentuk larutan saat dinetralkan (Fengel dan Wegener, 1995).
2.4.2. Hemiselulosa
Hemiselulosa terdiri dari monomer polisakarida heterogen. Monomer penyusun hemiselulosa adalah D-glukosa, D-manosa, L-arabinosa, dan D-xilosa (Sukarta, 2008). Hemiselulosa merupakan salah satu komponen penyusun TKKS yang juga banyak terdapat pada dinding sel tanaman. Penampang membujur hemiselulosa dalam jaringan tanaman dapat dilihat pada Gambar 2.9. Menurut Fengel dan Wegener (1995), hemiselulosa bersifat tidak tahan terhadap temperatur yang terlalu tinggi. Selain itu, hemiselulosa berstruktur amorf dan mudah diresapi oleh pelarut (Sjostrom, 1995). Pengekstraksian hemiselulosa dapat menggunakan alkali sehingga ikatan pada hemiselulosa menjadi lemah dan dapat dengan mudah dihidrolisis (Winarno, 1994).
Gambar 2.9. Penampang Membujur Hemiselulosa
(Sumber : http://bp2.blogger.com/)
1. Glukomanan, yaitu hemiselulosa yang tersusun dari β-D-glukopiranosa dan β -D-manopiranosa.
2. Arabinogalaktan, yaitu hemiselulosa yang tersusun dari β-D-galaktopiranosa dan α -L-arabinosa.
3. Xilan, yaitu hemiselulosa yang tersusun adalah β-Dxilopiranosa.
Hemiselulosa tanaman Angiospermae pada umumnya terdiri dari komponen glukomanan (2-5 %), xilan (15-30 %) dan sejumlah kecil asam galakturonat (Fengel dan Wegener, 1995). Struktur molekul monosakarida sebagai monomer penyusun hemiselulosa diperlihatkan pada Gambar 2.10.
Gambar 2.10. Struktur Molekul Monosakarida Penyusun Hemiselulosa
(Sumber: http://www.rpi.edu)
Gambar 2.11. Xilan sebagai komponen penyusun hemiselulosa
(Sumber :http://isroi.files.wordpress.com)
Xilan banyak ditemukan pada dinding sel tanaman, yaitu sekitar 30-35 % dari total berat kering (Joseleau dkk, 1992). Komponen xilan pada tanaman tersebut lebih banyak ditemukan pada kayu keras golongan angiospermae (15-30 %, b.k) dibandingkan pada kayu lunak golongan gymnospermae (7-12 %, b.k) (Subramaniyan dan Prema, 2002).
Menurut Sjostrom (1995), xilan merupakan polimer dari xilosa yang berikatan β -1,4-xilopiranosa dengan jumlah monomer 150 sampai 200 unit. Xilan memiliki rantai cabang dan strukturnya tidak berbentuk kristal sehingga lebih mudah dimasuki pelarut dibanding selulosa. Struktur asli xilan sangat kompleks dan dapat disubstitusi dengan grup asetil, L-arabinofuranosil dan glukoronosil pada rantai sampingnya (Whistler, 1950). Struktur kimia xilan dapat dilihat pada Gambar 2.12.
Gambar 2.12. Struktur Kimia Xilan (Eriksson dkk, 1990)
2.4.3. Lignin
Lignin adalah polimer tiga dimensi yang terdiri dari unit fenil propana yang diikat dengan ikatan eter (C-O-C) dan ikatan karbon (C-C). Lignin tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Judoamidjojo dkk, 1989), dan tidak larut dalam air, larutan asam dan larutan hidrokarbon (Krik dan Othmer 1952).Sjostrom (1995) menyatakan reaktivitas lignin sangat dipengaruhi oleh gugus-gugus fungsi yang terdapat pada polimer lignin itu sendiri.Polimer lignin mengandung gugus metoksil, gugus hidroksil fenol dan beberapa gugus aldehid pada rantai sampingnya. Menurut Achmadi (1989), gugus fungsi yang sangat mempengaruhi reaktivitas lignin adalah gugus hidroksil fenolik dan gugus karbonil. Struktur molekul lignin dan monomer penyusunnya diperlihatkan pada Gambar 2.13.
Gambar 2.13. Struktur Lignin
2.5. Hidrolisis
Dari komposisi TKKS, hemiselulosa merupakan bahan yang sangat potensial untuk dimanfaatkan karena jumlahnya sangat besar di TKKS. Sebelum dimanfaatkan, hemiselulosa terlebih dahulu harus dipecah menjadi monomer, dan salah satu caranya adalah pemanfaatan proses hidrolisi. Hidrolisis adalah proses pemecahan molekul kompleks menjadi molekul yang lebih kecil dengan bantuan asam atau enzim sebagai katalis. Contoh proses hidrolisis adalah pemecahan hemiselulosa menjadi xilosa baik dengan menggunakan asam maupun enzim.
2.5.1. Hidrolisis Asam
Hidrolisis asam adalah proses penambahan molekul air pada polimer untuk memutuskan ikatan glikosidik secara acak oleh asam menjadi monomer-monomer penyusunnya. Asam yang digunakan adalahasam sulfat (H2SO4), asam klorida (HCl), dan asam fosfat (H3PO4). Hidrolisis ini dapat dilakukan dengan 2 cara, yaitu hidrolisis pada temperatur tinggi dan hidrolisis pada konsentrasi asam yang tinggi.
Pada penelitian Yani(2008), hidrolisis hemiselulosa dilakukan pada kondisi 105°C, tekanan 0,05mPa dan konsentrasi hemiselulosa 20%. Variasi yang dilakukan pada penelitian ini adalah variasi konsentrasi HCl ( 0,3%; 0,5%; dan 0,7%) dan waktu hidrolisis(1, 2, 3, 4, dan 5 jam). Berdasarkan keseluruhan hasil hidrolisis, diketahui bahwa kondisi optimal hidrolisis hemiselulosa dengan HCl tercapai pada konsentrasi HCl 0,3% (v/v) dan waktu hidrolisis selama 4 jam. Pada kondisi tersebut dihasilkan xilosa dengan rendemen sebesar 57,36%. Selain variasi diatas, peneliti juga membandingkan rendemen xilosa yang diperoleh dengan hidrolisis asam lain yaitu H2SO4 pada kondisi optimum penggunaan HCl. Hasil hidrolisis dengan H2SO4 tersebut tidak berbeda secara signifikan dengan hasil hidrolisis HCl. Jadi dapat disimpulkan bahwa selain H2SO4, HCl juga berpotensi untuk digunakan karena selain memberikan hasil yang sama juga harganya lebih murah dibandingkan dengan menggunakan H2SO4.
sulfat (H2SO4) 2 sampai 6% dan waktu reaksi sampai 90 menit. Konsentrasi xilosa tertinggi yang diperoleh adalah 31.1g/l pada konsentrasi asam yang digunakan adalah 6% dan waktu reaksi 15 menit. Keuntungan dari hidrolisis asam ini adalah biaya yang lebih kecil dibandingkan dengan hidrolisis enzimatik.
2.5.2. Hidrolisis enzimatik
Hidrolisis enzimatik memerlukan aktivitas sinergi enzim endo-β-xilanase dengan exo-β -xilosidase (Saddler, 1993). Enzim endo-β-xilanase berfungsi dalam memutus ikatan β -1,4 pada bagian dalam dari rantai xilan sehingga dihasilkan xilooligosakarida (baik bercabang maupun tidak) yang meliputi xilopentosa, xilotetraosa, xilotriosa dan xilobiosa. Sedangkan enzim exo-b-xilosidase berfungsi dalam menghidrolisis xilooligosakarida rantai pendek menjadi xilosa.Enzim ini bekerja dengan memutus ujung-ujung nonpereduksi dari rantai xilooligosakarida (Saha, 2000).
Rendemen yang dihasilkan dari hidrolisis enzimatik dipengaruhi oleh pH, temperatur, waktu reaksi, dan perlakuan awal yang diberikan. Rendemen terbesar diperoleh pada pH 4,8 (Caminal dkk, 1985), waktu reaksi 24 jam (Sinitsyn dkk, 1991), dan perlakuan awal berupa delignifikasi dengan 1% NaOH dan dilanjutkan dengan 79% H3PO4 (Sinitsyn dkk, 1991). Perlakuan awal lain yang dapat memberikan rendemen terbesar adalah dengan perlakuan awal pada suhu 160°C selama 20 menit.
2.6. Xilitol
Gambar 2.14. Perbedaan Struktur Xilitol dan Xilosa
(Sumber: http://www.chem.umass.edu)
Xilitol memiliki sifat mudah larut dalam air, tahan terhadap panas sehingga tidak mudah terkaramelisasi,memberikan sensasi dingin seperti mentol, tingkat kemanisan setara dengan sukrosa (gula tebu) namun kalori yang lebih rendah (40%), dan glikemiks indeks (GI) yang rendah (7). Dari sifat GI yang rendah, gula ini tidak cepat meningkatkan kadar gula sehingga dalam metabolismenya tidak melibatkan hormon insulin. Oleh karena itu, gula ini dapat dikonsumsi oleh penderita diabetes.Keunggulan lainnya adalah xilitol aman untuk kesehatan gigi karena gula ini tidak dapat difermentasi oleh bakteri penyebab karies gigi yaitu bakteri Streptococcus mutans.Karena sifat-sifat diatas, gula ini banyak dimanfaatkan dalam di bidang pangan dan farmasi.
2.7. Teknologi Produksi Xilitol
Xilitol pada saat ini telah dapat diproduksi dengan cara ekstraksi padat-cair, sintesis kimia, dan bioteknogi.
2.7.1. Ekstraksi padat-cair
Xilitol dapat diperoleh dari buah-buahan dan sayuran dengan cara ekstraksi padat-cair. Cara ini tidak dianjurkan karena kandungan xilitol pada buah-buahan dan sayur-sayuran tergolong rendah yaitu kurang dari 1%( Vandeska dkk, 1996; Sampaio dkk, 2003).
Proses produksi xilitol secara komersial yang ada pada saat ini dilakukan secara sintesis kimia, yaitu proses hidrogenasi xilosa pada suhu dan tekanan tinggi (suhu 80-140oC, tekanan 50 atmosfer) dengan bantuan katalis. Proses hidrogenasi xilosa ditunjukkan oleh Gambar 2. 15.
Gambar 2.15. Sintesis Xilitol secara kimiawi
(Sumber: Affleck RP. 2000. Recovery of xilitol from fermentation of model hemicelluloses hydrolysates using membrane technology [tesis]. Blacksburg: Master of Science, Virigina Polytechnic Institute)
Kelemahan dari sintesis kimia adalah bahan baku (xilosa) yang akan digunakan harus dalam keadaan murni dan xilitol yang dihasilkan juga harus dimurnikan lebih lanjut sebelum dimanfaatkan di industri makanan dan obat-obatan. Karena proses pemurnian tersebut, produksi xilitol sintesis kimia memerlukan biaya yang cukup tinggi (Rao dkk, 2006).
2.8. Bioteknologi
tebu, dan tanda kosong kelapa sawit (TKKS) (Vandeska dkk, 1996).
Pendekatan bioteknologi lainnya dengan memanfaaatkan mikroba sebagai alternatif untuk menggantikan proses produksi secara kimia sehingga diharapkan lebih ekonomis dan efisien. Mikroba yang terlibat dalam biokonversi xilosa menjadi xilitol adalah khamir, bakteri, serta fungi.
Bakteri galur Corynebacterium dan Enterobacter memiliki sistem enzimatik oksido-reduktif yang dapat mereduksi xilosa menjadi xilitol. Penelitian yang telah dilakukan oleh Yoshitake dkk (1973) (diacu dalam Parajo dkk, 1998) menggunakan galur Enterobacter
menghasilkan xilitol sebesar 33g/L dan produktivitas xilitol 0,35 g/l/h dengan konsentrasi awal xilosa 100g/L.
Fungi dapat memetabolisme xilosa melalui konversi oskido-reduktif menjadi xilulosa. Produksi xilitol oleh fungi dalam konsentrasi yang masih rendah, seperti yang dilaporkan oleh Chiang dan Knight (1961) (diacu dalam Parajo dkk, 1998) saat mengkulturkan fungi
Penicillium, Aspergillus, Rhizopus, Gliocladium, Byssochlamy, Myrothecium, dan
Neurospora pada media xilosa. Xilitol dihasilkan sebesar 39.8 g/L dan II.8 g/L setelah 10 hari oleh Petromyces albertensis pada media kulktur yang mengandung 100 g/L berdasarkan penelitian Dahiya (1991) (diacu dalam Parajo dkk. 1998).
Salah satu mikroba yang berperan dalam biokonversi xilosa menjadi xilitol adalah khamir, terutama dari genus Candida. Candida merupakan kelompok makhluk hidup eukariot bersel tunggal (uniseluler) yang umumnya melakukan reproduksi vegetatif dengan tunas (Pelczar dkk, 2005). Xilitol diproduksi oleh khamir dan fungi pengasimilasi xilosa seperti Pachysolen tannophilus, Candida guilliermondii, Candidaparapsilosis, dan
Candida tropicalis. Khamir dari genus lain telah diteliti dapat menghasilkan xilitol yaitu
xilosa reduktase (XR) dan xilitol dehidrogenase (XDH) (Parajo dkk. 1998).
Candida tropicalis termasuk ke dalam kingdom Fungi, filum Deuteromycotina, famili
Tarulopsidaceae, genus Candida, dan spesies Candida tropicalis. Candida tropicalis
tergolong khamir patogen dan bagian dari flora normal manusia. Penggunaannya di industri makanan menjadi kendala karena sifatnya yang patogen namun berpotensi karena kemampuannya dalam konversi xilosa, produksi xilitol, dan degradasi alkana dan asam lemak di dalam peroksisomnya (Granstrom 2002). Candida tropicalisdimanfaatkan untuk produksi asam dikarboksilat, yaitu bahan mentah untuk pembuatan parfum, polimer, dan antibiotik karena khamir tersebut menggunakan alkana dan asam lemak sebagai sumber karbon (Ko dkk. 2006). Menurut Gong dkk. (1981), dari 10 jenis khamir ditemukan bahwa Candida tropicalis adalah penghasil xilitol terbaik yang berasal dari xilosa. Begitu juga dengan penelitian yang dilakukan oleh Barbosa dkk. (1988) (diacu dalam Santos dkk. 2008), dari 44 golongan khamir yang berperan dalam biokonversi xilosa menjadi xilitol, diantaranya Candida guilliermondiidan Candida tropicalis sebagai penghasil xilitol terbaik.
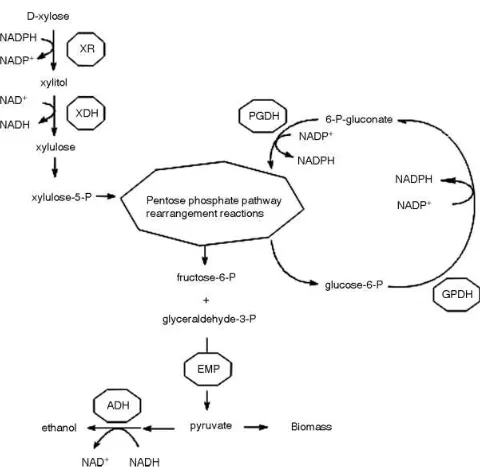
Metabolisme xilosa oleh khamir ditunjukkan pada Gambar 2. 16. Xilitol reduktase mengkatalisis reduksi xilosa menjadi xilitol dan xilitol dehidrogenase mengoksidasi xilitol menjadi D-xilulosa. Kemudian D-xilulosa dikonversi menjadi D-xilulosa 5-fosfat oleh xilulosa kinase dan memasuki jalur pentosa fosfat. XDH menggunakan NAD sebagai koenzim sedangkan XR koenzimnya adalah NAD(P)H (Ko dkk. 2006). Jalur pentosa fosfat terdiri atas tahap oksidatif dan nonoksidatif. Tahap oksidatif mengubah heksosa fosfat menjadi pentosa fosfat yang memerlukan NADPH dalam biosintesisnya.
Tahap nonoksidatif mengubah pentosa fosfat menjadi heksosa fosfat (fruktosa-6-fosfat) dan trigliserida (Granstrom 2002). Kedua senyawa ini akan masuk ke dalam Lintasan
Hasil yang diperoleh yaitu rendeman sebesar 0.82 g/g dan produktivitas xilitol 4.94 g/L jam.
Horitsu dkk. (1992) mencapai produksi xilitol yang maksimal dengan menggunakan konsentrasi awal xilosa sebesar 172 g/L dan konsentrasi ekstrak khamir 21 g/L. Oh dan Kim (1998) melakukan percobaan dengan menambahkan xilosa dan glukosa pada rasio yang berbeda dan melihat pengaruhnya pada produksi xilitol oleh C.tropicalis. Hasil yang diperoleh dari 300 g/L xilosa dengan rasio glukosa/xilosa 15% adalah 91% sedangkan produksi volumetrik diperoleh sebesar 3.98 g/L dengan rasio glukosa/xilosa 20%. Penelitian yang dilakukan oleh Yahashi dkk. (1996) menggunakan fed batch pada produksi xilitol oleh Candida tropicalis memperoleh rendemen sebesar 0.82 g/g dan produktivitas volumetrik sebesar 3.26 g/L jam dengan penambahan glukosa sebagai kosubstrat.
Gambar 2.16. Metabolisme xilosa oleh khamir
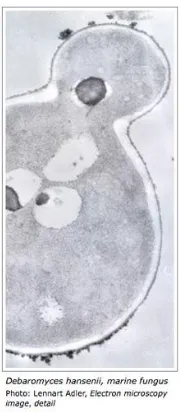
2.9. Debaryomyces hansenii
Gambar 2.17. Debaromyces Hansenii
(Sumber: http://www.cemeb.science.gu.se/)
Debaromyceshansenii merupakan ragi yang dapat hidup pada kondisi salinitas yang tinggi. Menurut Onishi (1963), D. hansenii dapat hidup pada media yang mengandung 4 M NaCl, sedangkan S.cerevisiae hanya mampu hidup pada media dengan konsentrasi garam di bawah 1,7 M. Ragi ini biasanya terdapat dalam kondisi haploid dan bersifat non patogen . D. hansenii dapat mengakumulasi lipid atau disebut juga ragi oleaginous. Bakteri jenis ini mampu mengakumulasi lipid hingga 70% dari biomassa keringnya (Ratledge dan Tan K H, 1990). Selain dapat hidup dalam media dengan konsentrasi garam 10% dan gula 5% (Kurtzmann, 1998), Tabel X menunjukkan substrat yang dapat diutilisasi oleh ragi ini.
Tabel 2.2. Kemampuan D. hansenii Mengutilisasi Substrat (Nakase dkk,1998)
Glukosa +
N-Asetil-D-Glukosamin
V
Galaktosa + Metanol -
L-Sorbosa V Etanol +/W
Sukrosa + Gliserol +
Perkembangbiakkan D.hansenii berlangsung secara vegetatif dan generatif. Secara vegetatif dengan tunas multilateral, secara generatif dengan konjugasi heterogami. Pada tahap reproduksi seksualnya ini, terjadi fasa diploid singkat yang diikuti dengan meiosis dan pembentukan askospora (Forrest SI, dkk, 1987).
Ragi jenis ini dapat mensintesis toksin untuk melindungi dirinya dari ragi lain. Penelitian dari Llorente dkk, aktivitas toksin yang disebut myocin ini terjadi apabila terdapat NaCl atau KCl (Breuer and Harms, 2006). Myocin efektif untuk membunuh ragi patogen pada 37°C. Makin tinggi konsentrasi NaCl dan KCl, makin tinggi pula efektivitas toksin dalam membunuh ragi lain (Breuer and Harms, 2006).Penelitian lain menunjukkan bahwa D. hansenii dapat hidup dalam larutan yang mengandung ClO2 yang tinggi, keuntungannya adalah D.hansenii dapat ditumbuhkan pada media yang nonsteril, karena ClO2 merupakan biosida (Breuer and Harms, 2006).
Beberapa karakter D. hansenii yang sangat baik bagi industri bioteknologi adalah sifat
Trehalosa + Galacitol V
2-Keto-D-Glukonat + 5-Keto-D-Glukonat V Saccharate -
oleaginous dan halotolerant. Sifat oleaginous ini hanya terdapat pada 30 dari 600 spesies (Ratledge, 2002). Kemampuan ini disebabkan oleh adanya enzim ATP-sitrat liase(Ratledge, 1986). Enzim tersebut memproduksi asetil Ko-A yang merupakan substrat kunci untuk pembentukan asam lemak di sitoplasma (Breuer and Harms,2006). Dengan sifat ini, produksi minyak dan lemak komersial dapat dilakukan melalui rekayasa genetika. Sifat halotolerant D.hansenii dapat digunakan untuk menumbuhkan ragi ini dalam berbagai media seperti daging, bir, anggur, dan keju.
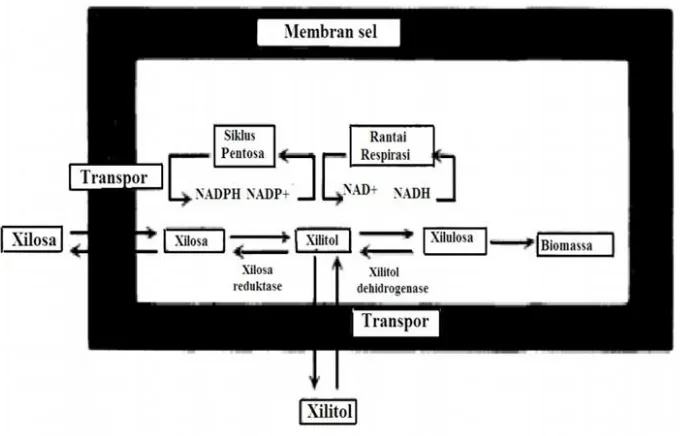
Produksi xilitol oleh D. hansenii telah diminati selama beberapa dekade terakhir karena ragi ini mampu menghasilkan xilitol dibandingkan etanol dengan rasio lebih dari empat (>4) (Breuer and Harms, 2006). Gambar 2.18 menunjukkan jalur metabolisme xilitol dari xilosa oleh D.hansenii (Breuer and Harms, 2006). Menurut Vongsuvanlert dan Tani (1998), xylitol dapat diproduksi melalui dua jalur metabolism oleh sel khamir. Xilosa akan diproduksi menjadi xilitol oleh NADH atau NADPH dependent xylose reductase, seperti pada Gambar 2.18, atau melalui isomerasi xilosa menjadi xilulosa oleh D-xilosa isomerase baru kemudian D-xilulosa akan direduksi menjadi xylitol oleh NADH dependent xylitol dehydrogenase.
D. hansenii mensintesis produk bergantung pada substrat yang digunakan.D. hansenii
dapat memproduksi arabinitol dan xilitol sebaik memproduksi etanol dari gula pentosa. Pada fermentasi menggunakan kemostat dalam keadaan oksigen berlebih, D. hansenii
tidak memproduksi xilitol maupun etanol (Breuer and Harms, 2006). Dalam keadaan Oksigen terbatas, maka yield biomassa akan berkurang, sedangkan yield xilitol akan bertambah seiring juga dengan terbentuknya gliserol (Breuer and Harms, 2006).
2.10. Faktor yang Mempengaruhi Pertumbuhan Mikroorganisme
2.10.1. Konsentrasi Awal Sel
Produksi xilitol tertinggi dicapai dengan menggunakan konsentrasi awal Candida tropicalis sebesar 2,5g/L. Penelitian ini membandingkan hasil dari penggunaan konsentrasi awal sel dari 1 sampai 2,5g/l (Windarti, 2010). Hasil ini sesuai dengan hasil yang dilaporkan oleh Parejo dkk, 1998 bahwa semakin tinggi konsentrasi sel maka semakin tinggi xilitol yang dihasilkan.
2.10.2. Waktu Inkubasi
Hasil penelitian pendahuluan dan penelitian yang dilakukan oleh Vandeska dkk. (1995), dengan menggunakan Candida boidinii dan Silva dkk. (1996), dengan menggunakan
Candida guillermondii menunjukkan produksi xilitol menjadi konstan atau menurun setelah mencapai fase pertumbuhan stasioner. Fasa stasioner ini akan tercapai setelah 7 hari, sehingga xilitol paling tinggi yang dihasilkan adalah pada hari ke-7 (Wisnu, 2001). Literatur lain (Windarti, 2010) melaporkan bahwa produksi xilitol paling tinggi dihasilkan pada waktu inkubasi 96 jam.
2.10.3. Oksigen Terlarut
menghasilkan produktivitas optimum. Untuk mengetahui pengaruh oksigen dan jumlah oksigen optimum, Zhang dkk. (2012) melakukan penelitian dengan menvariasikan kecepatan agitator dari 100 hingga 200 rpm. Penelitian tersebut dilakukan pada labu Erlenmeyer 100mL yang berisi xilosa awal sebesar 150 g L-1. Fermentasi dilakukan pada 30°C selama 108 jam. Selain dilakukan variasi kecepatan, penelitian tersebut juga melakukan variasi jumlah tahap fermentasi dan hasil dapat dilihat pada Tabel 2. 3. Dari tabel tersebut dapat disimpulkan bahwa proses fermentasi dengan kecepatan pengocokan yang tinggi (fermentasi I: 250 dan fermentasi II: 250 rpm) menghasilkan konsentrasi biomassa sel yang tinggi ( 21.25 g L-1) dengan perolehan xilitol yang rendah (0,61 g g-1). Disisi lain, pada pengocokan rendah (fermentasi I: 150 dan fermentasi II: 100 rpm) konsentrasi biomassa yang dihasilkan paling rendah (10,52 g L-1) dan peroleh xilitol yang cukup tinggi (0,75 g g-1).
Tabel 2.3. Produksi Xilitol Pada Berbagai Kecepatan Pengocokan Dengan Menggunakan Candida athensensis SB18 (Zhang dkk. 2012)
Kocok (rpm) Residu xilosa (g L-1)
Pengaruh konsentrasi oksigen terlarut akan berbeda pada sel bebas dan sel amobil. Parajó
dkk. (1998) melaporkan penelitian Peschke dkk. (1992) dengan sel C. guilliermondii
Pada fermentasi menggunakan kemostat dalam keadaan oksigen berlebih, D. hansenii
tidak memproduksi xilitol maupun etanol (Breuer and Harms, 2006). Dalam keadaan Oksigen terbatas, maka yield biomassa akan berkurang, sedangkan yield xilitol akan bertambah seiring juga dengan terbentuknya gliserol (Breuer and Harms, 2006). Pembentukan xylitol terjadi di bawah kondisi okigen terbatas dengan tujuan untuk mengakumulasi NADH karena keberadaan oksigen dapat menurunkan aktivitas NADH yang berakibat pada menurunnya aktivitas akumulasi produksi xylitol (Winkelhausen dan Kuzmanova, 1998).
2.10.4. pH
Dari laporan penelitian Wisnu, 2001, kecepatan produksi volumetrik tertinggi(0,314g/l/h) diperoleh pada pH 5. Variasi pH yang digunakan pada penelitian ini dari pH 4 sampai 7 dengan menggunakan Candida shehatee WAY 08. pH selama proses fermentasi berlangsung mengalami peningkatan dan penurunan pH. Penurunan pH dapat disebabkan oleh terbentuknya asam-asam organik seperti asam asetat, sedangkan peningkatan pH disebabkan oleh terbentuknya ammonia dari reaksi deaminasi terhadap substrat berprotein atau berpolipeptida sebagai sumber nitrogennya (Prior el al, 1989; Forage dkk, diacu dalam Moo-Young, 1985). Naik turunnya pH kultur tersebut dipengaruhi oleh besar kecilnya perbandingan antara senyawa organic yang bersifat asam dengan ammonia yang bersifat basa (Wisnu, 2001).
Dari berbagai literatur, kadar xilitol tertinggi dicapai pada pH awal 5,3 oleh Candida guiliermondii, pH 4 oleh Candida tropicalis dan pH 7 oleh Candida boidinii.
2.10.5. Konsentrasi Awal Substrat
Dari hasil penelitian, kecepatan produksi volumetrik tertinggi Candida shehatee WAY 08 (0,314g/l/h) diperoleh pada substrat yang menggunakan konsetrasi awal xilosa sebesar 150g/L. Selain itu juga, dari hasil penelitian Wisnu, (2001) dapat disimpulkan bahwa peningkatan konsentrasi awal xilosa dari 50 sampai 150 g/l pada pH media awal yang sama menunjukkan peningkatan konsentrasi xilitol yang dihasilkan. Dominguez dkk (1996) melaporkan kecepatan produksi volumetrik xilitol dari xilosa awal sekitar 150g/l oleh Candida parapsilosis, C. guilliermondii, C. guilliermondii 20118, C. guillermondii 42050, Pachysolen tannophilus, Mutan Candida sp. Dan D hansenii berturut-turut adalah 0,19; 0,72; 0,14; 0,01; 0,99 dan 0,90 g/l/h.
2.10.6. Ko-Substrat
Ko-substrat yang digunakan pada penelitian Windarti, 2001, adalah arabinosa. Variasi yang dilakukan pada penelitian ini adalah rasio xilosa dan arabinosa. Rasio yang digunakan 6:1%; 6:2%; dan 6:3%. Penelitian ini menggunakan Candida tropicalis yang dijebak di Ca-alginat dan proses fermentasi berlangsung secara batch. Pada penelitian ini, kecepatan produksi volumetric yang tercapai adalah 4,2g/l/h pada kondisi rasio xilosa dan arabinosa adalah 6:3%.
Menurut penelitian Mussato dkk, 2006 yang menggunakan rasio xilosa dan arabinosa sebesar 10:1 dan 2:1 sudah dapat menghambat kerja enzim yang memetabolisme arabinose pada C.guillierrmondii sedangkan pada D.hansenii, asimilasi arabinose dihambat pada media yang mengandung xilosa dan arabinose dengan rasio 4:1 (Girio dkk, 2000, diacu dalam Mussato dkk, 2006).
7349 0,4g/g, C.parapsilosis 0,4g/g, Candida kefyr 0,29g/g dan C.utilis 0,18g/g (Sirisansanee yakul dkk, 1995). Literatur lain menyebutkan Candida sp L 102 dapat memberikan perolehan sebesar 0,877g/g.
Selain menggunakan arabinosa, Wisnu (2001) menggunakan glukosa juga sebagai ko-substrat. Penelitian yang dilakukan menggunakan Candida shehatee WAY 08 pada variasi glukosa yang digunakan dari 0 sampai 4%. Dari hasil penelitian, disimpulkan bahwa penambahan glukosa sebagai ko-substrat dari 1 sampai 4% pada media xilosa awal 150g/L dapat menghambat produksi xilitol (kadar dan kecepatan produksi volumetrik xilitol), tetapi mampu menigkatkan perolehan xilitol. Selain itu, penelitian Felipe dkk. (1993), dan Rosa dkk. (1998), (diacu dalam Mussato dkk, 2006) melaporkan penambahan glukosa dengan rasio lebih kecil dari 1:10 tidak akan menyebabkan penurunan produksi xilitol.
Penelitian yang dilakukan Mussato dkk, (2006) dengan menggunakan sel
C.guilliermondii melaporkan bahwa penambahan glukosa ke dalam media yang mengandung xilosa dapat menurunkan rendemen xilitol sebesar 10% sedangkan penambahan arabinose meningkatkan rendemen xilitol sebesar 8%. Hasil ini sejalan dengan pendapat peneliti terdahulu (Hsiao dkk, Meyrial dkk, diacu dalam Nigam dan Singh, 1995) yang menyatakan glukosa menghambat penggunaan xilosa oleh Candida
dan Schizosaccharomyces, dan dilaporkan bahwa C. guillermondii mampu mengkonsumsi glukosa, manosa, galaktosa, dan arabinosa secara cepat hanya untuk pertumbuhan dan pembentukan etanol, tetapi senyawa poliol (salah satunya adalah xilitol) tidak terdeteksi di dalam media kultur.
Penelitian Silva dkk. (1996), melaporkan bahwa efisiensi konversi xilosa menjadi xilitol sebesar 45% pada media yang mengandung glukosa dan xilosa, tetapi meningkat sampai 66% jika tanpa adanya glukosa.
2.10.7. Campuran gula
adalah media xilosa dan glukosa, xilosa dan arabinose, serta xilosa, glukosa, dan arabinosa. Metode penelitian yang digunakan adalah penjebakan C.tropicalis di matriks Kalsium alginat. Kecepatan produksi volumetrik xilitol dan peroleh xilitol tertinggi dari fermentasi batch ini adalah 4,2g/l/h dengan media yang digunakan adalah campuran berupa xilosa, glukosa, dan arabinosa. Glukosa dalam media fermentasi diketahui menurunkan produksi xilitol sebesar 20% dibandingkan dengan media kontrol.
Hasil penelitian Windarti, (2010) tidak sesuai dengan fermentasi oleh C.guilliermondii
yang dilakukan pada penelitian Mussato dkk, (2006). Hasil penelitian Mussato dkk, (2006), produksi xilitol tertinggi diperoleh pada media campuran xilosa dan arabinosa. Data hasil penelitiannya adalah media xilosa (kontrol) menghasilkan xilitol sebesar 0,68 g/l. Sedangkan pada media xilosa dan glukosa sebesar 0,68 g/l, media campuran xilosa dan arabinosa sebesar 0,74g/L, dan media campuran xilosa, glukosa, dan arabinose sebesar 0,67 g/l.
Campuran gula memberikan perolehan xilitol yang lebih besar dibandingkan hanya menggunakan xilosa murni (Rao dkk, 2004; Kim dkk, 1999). Media yang menggunakan campuran dua substrat dalam produksi xilitol oleh C.tropicalis meberikan perolehan xilitol sebesar 0,81g/g dan produktivitas sebesar 0,49 g/l/h. Sedangkan, media yang menggunakan xilosa murni hanya dapat menghasilkan xilitol dengan perolehan sebesar 0,78 g/g.
2.10.8. Pengaruh Xilitol
melaporkan bahwa produk samping yang terbentuk dalam jumlah kecil, seperti etanol, gliserol, arabitol atau ribitol, dapat digunakan sebagai sumber karbon ketika xilosa habis dikonsumsi.
2.10.9. Komposisi Kultur Media
Komposisi kultur media dan salinitas akan mempengaruhi produk yang dihasilkan. Sumber dan konsentrasi Nitrogen merupakan salah satu faktor penting pada fermentasi xilitol, efeknya akan tergantung pada strain mikroorganisme yang digunakan. Dari beberapa hasil penelitian yang dilaporkan Parajó dkk. (1998), seperti hasil penelitian Vandeska dkk. (1995) dan Barbosa dkk. (1988), umumnya sumber nitrogen organik akan meningkatkan produktivitas dan yield produksi xilitol. Hasil penelitian Vandeska dkk.
(1995) menunjukkan peningkatan perolehan xilitol oleh C. boldinii dengan sumber nitrogen urea dibandingkan dengan sumber nitrogen amonium sulfat. Barbosa dkk.
(1988) juga melaporkan hasil yang sama dengan hasil penelitian Vandeska dkk. (1995).
Vitamin dan oligoelemen dibutuhkan oleh beberapa ragi untuk pertumbuhan atau meningkatkan produktivitas. Hasil penelitian Lee dkk. (1988) menggunakan C. guilliermondii yang dilaporkan oleh Parajó dkk. (1998) menunjukkan peningkatan
produktivitas dari 0,002 g/l.h menjadi 0,009 g/l.h dengan penambahan 0,05 μg biotin/l
dan menjadi 0,044 g/l.h dengan penambahan 0,25 μg biotin/l. Penambahan 1% (v/v) metanol meningkatkan produktivitas C. boidinii dari 0,25 g xilitol/l.h menjadi 0,6 g xilitol/l.h (hasil penelitian Vongsuvanlert & Tani (1989) yang dilaporkan oleh Parajó dkk.
(1998)).
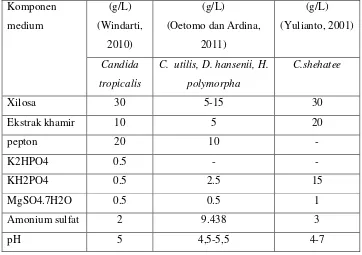
produksi xilitol, namun tidak menghambat pembentukan xilitol, sedangkan dinitrofenol di atas 20 μM dapat benar-benar menghambat pertumbuhan dan penggunaan xilosa. Tabel 2.4 dan Tabel 2. 5 menunjukkan perbandingan kultur media yang digunakan dalam beberapa penelitian untuk produksi xilitol.
Tabel 2.4. Perbandingan Kultur Medium Inokulum Berbagai Mikoorganimse Komponen
yeast
Komposisi Fermentasi - FeSO4.7H
2O
0,011 D-biotin 0,000 1
2.10.10. Pengaruh Imobilisasi Sel
Imobilisasi sel adalah pengikatan sel secara fisik maupun kimia pada matriks berpori atau secara adsorbsi (Shuler dan Kargi, 2002). Matriks berpori yang digunakan biasanya berupa polimer berpori, poliuretan, gel silika, polistirena dan selulosa triasetat. Polimer berpori misalnya agar, alginat, karaginan, poliakrilamida, chitosan, gelatin, dan kolagen. Keuntungan dari mengimobilisasi sel adalah (Shuler dan Kargi, 2002) :
1. Meningkatkan konsentrasi sel.
3. Kombinasi dari konsentrasi sel yang tinggi dan laju alir yang tinggi (tanpa terjadi
washout) menyebabkan produktivitas yang tinggi. 4. Masalah washout teratasi.
5. Menyediakan lingkungan yang sesuai bagi mikroorganisme (contoh : kontak antar sel, nutrien, pH) yang meningkatkan performansi biokatalis.
6. Dalam beberapa kasus, meningkatkan stabilitas sel.
7. Pada beberapa jenis mikroorganisme, adanya imobilisasi baik untuk perlindungan dari kerusakan akibat geseran (shear damage).
Pada penelitian yang dilakukan oleh Batal dan Khalaf(2004) dalam jurnal “Xilitol Production from Corn Cobs Hemicellulosic Hydrolysate by Candida tropicalis
Immobilized Cells in Hydrogel Copolymer Carrier”, semakin tinggi konsentrasi sel
C.tropicalis amobil yang ditanam pada media, maka semakin besar juga utilisasi xilosa dan produksi xilitol.
Dengan menggunakan sel amobil, fasa lag dapat dihindari. Semakin besar konsentrasi sel yang ditanam pada matriks, maka Oksigen yang dialirkan juga harus dipertimbangkan agar sel amobil tetap dapat menggunakan Oksigen. Pada penelitian Batal dan Khalaf (2004), konsentrasi sel amobil untuk produksi xilitol dengan yield terbesar adalah 15 gram hidrogel per 40 mL medium kultur dalam labu 125 mL dan 150 rpm kecepatan adukan.
Metode yang digunakan dalam percobaan oleh Windarti (2010) untuk mengimobilisasi sel C.tropicalis, dimodifikasi dari metode Carvalho dkk (2007), yaitu suspensi sel yang diperoleh sebelumnya dari sentrifugasi medium inokulum diresuspensi dengan 1 mL akuades steril kemudian ditambahkan dalam 9 mL larutan natrium alginat yang disterilisasi pada suhu 121oC selama 15 menit hingga diperoleh konsentrasi alginat akhir 20 g/L. Butiran diperoleh dengan cara yang sama dengan metode Carvalho dkk (2007). Pencucian Kristal dilakukan untuk menghilangkan larutan kalsium klorida yang tersisa pada butiran Kristal. Pencucian dilakukan sebanyak tiga kali kemudian ditambahkan ke dalam media fermentasi.
Metode yang digunakan oleh Batal dan Khalaf (2004) adalah metode imobilisasi dengan hidrogel Polivinil alcohol (PVA) dan Hidroksimetil Metaakrilat (HEMA). Metode pembuatan Hidrogel dilakukan dengan radiasi kopolimer. Dari metode yang dilakukan oleh Mostafa dan El-Hadi (2009), pembuatan hidrogel PVA dilakukan dengan melarutkan PVA ke dalam akuades steril kemudian dipanaskan dalam waterbath pada suhu 90oC selama 50 menit. PVA kemudian digabungkan pada polivinilpyrrolidone (PVP) dan HEMA. Campuran dipisahkan ke dalam tabung uji dan dialirkan Nitrogen selama 24 jam untuk menghilangkan oksigen terlarut. Hidrogel yang terbentuk kemudian diautoklaf pada 121oC selama 2 jam (Razzak dkk, 1999). Penelitian Batal dan Khalaf (2004) juga dilaporkan perbandingan produksi xilitol dengan sel terimobilisasi dan sel tidak diimobilisasi. Hasil tersebut dapat dilihat pada Tabel 2.6.
Dari penelitian Batal dan Khalaf (2004) ditemukan bahwa semakin tinggi konsentrasi sel yang diimobilisasi dalam hidrogel, konsumsi xilosa semakin besar dan produksi xilitol semakin besar. Namun pada konsentrasi 20 g/50mL kultur produksi xilitol menurun. Hal ini disebabkan bahwa pada media yang mengandung densitas sel yang besar, terjadi reduksi ketersediaan Oksigen. Hal ini menyebabkan berkurangnya yield dan produktivitas. Dapat dikatakan dari penelitian Batal dan Khalaf (2004), bahwa produksi xilitol dengan konsentrasi sel terimobilisasi dalam hidrogel 15 g lebih besar daripada produksi xilitol dengan sel bebas dengan waktu inkubasi empat hari dan pH medium awal 6.
2.11. Jenis Fermentasi
2.11.1. Fermentasi batch
Fermentasi batch juga disebut sistem tertutup karena selama proses fermentasi berlangsung tidak ada input (substrat) atau output (campuran substrat, produk, dan biomassa). Proses fermentasi batch seperti yang dijelaskan Crueger(1998) adalah reaktor yang diisi dengan nutrien substrat dan inokulum mikroorganisme. Proses fermentasi dihentikan jika tidak ada lagi produk yang dihasilkan. Selama proses fermentasi batch,
Parameter Sel bebas Sel terimobilisasi (g Hidrogel/50 mL
kultur)
5 10 15 20
Xilosa terkonsumsi (g/L) 42.1 33.1 48.5 53.2 56.7
Konsentrasi xilitol (x) 21.2 16.0 26.2 30.7 27.8
Yield xilitol Yx/s (g/g) 0.50 0.48 0.54 0.58 0.49
% yield xilitol dari hasil teoretis 56.0 53.7 60.0 64.1 54.5
Massa kering akhir (mg massa kering per g hidrogel)
- 32.3 30.8 30.5 30.4
Massa kering bebas (mg sel/mg kultur)
kematian seperti yang ditunjukkan pada Gambar 2.19.
Gambar 2.19. Fase Pertumbuhan Pada Fermentasi Batch
(Sumber: http://www.hypertextbookshop.com)
Fase lag merupakan fase yang tidak mengalami peningkatan jumlah sel meski berat sel mengalami perubahan. Selama fase ini, sel beradaptasi dengan kondisi lingkungan baru. Lamanya fase lag bergantung pada kondisi fisiologi dan konsentrasi inokulum (Saarela dkk, 2003). Setelah akhir fase lag, sel akan beradaptasi kembali dengan kondisi pertumbuhan baru yang disebut fase log. Pertumbuhan massa sel meningkat dua kali lipat karena selain meningkat berat biomassa sel, jumlah sel per unit waktu juga mengalami peningkatan.
Saat substrat telah dimetabolisme dan senyawa toksik mulai terbentuk, pertumbuhan sel menurun bahkan terhenti total.Fase ini disebut fase stasioner.Biomassa hanya bertambah sedikit atau konstan selama fase ini.Fase terakhir pertumbuhan adalah fase kematian.Cadangan energi pada fase ini sangat terbatas sehingga pertumbuhan sel menurun dan sel mulai lisis (Saarela dkk. 2003). Waktu yang diperlukan dari fase stasioner menuju fase kematian tergantung pada organisme dan proses fermentasi yang digunakan.
2.11.2. Fermentasi Fedbatch
Oleh sebab itu, substrat ditambahkan dalam jumlah sedikit secara kontinu selama proses produksi. Proses produksi yang menggunakan fermentasi ini adalah penisilin.
2.11.3. Fermentasi Kontinu
Fermentasi kontinu disebut sebagai sistem terbuka karena selama proses fermentasi berlangsung terdapat aliran masuk reaktor berupa substrat dan aliran keluar reaktor berupa campuran substrat, biomassa, dan produk. Kelebihan dari fermentasi kontinu adalah fermentasi dapat dikerjakan pada jangka waktu yang panjang tanpa adanya kontaminasi sehingga produktivitas dapat ditingkatkan dan tingkat pertumbuhan sel dapat diatur untuk memperoleh produk optimum.Karena kelebihan tersebut, fermentasi jenis ini telah dikembangkan untuk produksi protein sel tunggal, antibiotik, pelarut organik, kultur starter, dan dekomposisi selulosa (Crueger & Crueger 1982).
Tabel 2.7. Jenis Fermentasi yang Telah Digunakan dalam Produksi Xilitol Mikroorganisme Xilosa di acu dalam Zhang dkk. (1999)
Batch
C. sp.559-9 300 210 0,87 0,73 Ikeuchi dkk. (1999) yang di acu dalam Zhang dkk. (1999)
C. tropicalis KCTC 10457
350 228 0,65 2,07 Kwon dkk. (2006) yang di acu dalam Zhang dkk. (1999)
yang di acu dalam Zhang dkk. (1999)
Fed-batch
C. tropicalis KCTC 10457
260 234 0,90 4,88 Kwon et al.m (2006) yang di acu dalam Zhang dkk. (1999)
C.
guilliermondii
79 34 0,79 0,65 Rodrigues dan Silva
(1998) Continous
2.12. Penentuan Kadar Xilitol
2.12.1. Metode Beutler & Becker
Pengukuran kadar xilitol dilakukan berdasarkan metode Beutler dan Becker (1977). Empat jenis larutan digunakan dalam metode ini, yaitu buffer kalium fosfat/ trietanolamin (larutan 1), diaphorase (larutan 2), iodonitrotetrazolium klorida (larutan 3), dan enzim sorbitol dehidrogenase/SDH (larutan 4).
Sebanyak 0.6 mL larutan 1 dimasukkan ke dalam tabung Eppendorf kemudian ditambahkan larutan 2 sebanyak 0.2 mL, larutan 3 sebanyak 0.2 mL, sampel yang telah diencerkan sebesar 100 kali sebanyak 0.1 mL, akuabides sebanyak 1.9 mL, divorteks agar homogen. Setelah itu,dibiarkan selama 2 menit, kemudian diukur absorbansinya pada λ 492 nm. Setelah 2 menit dilakukan pengukuran kembali.Pengukuran pertama yang dilakukan disebut sebagai Absorban pertama (A1).Selanjutnya, ditambahkan larutan 4 yang berisi enzim sorbitol dehidrogenase dan dibiarkan selama 30 menit.Setelah itu 30 menit, diukur absorbansinya dengan interval 5 menit hingga menit ke-50, terhitung dari 5 menit pertama. Pengukuran kedua ini disebut Absorbansi kedua (A2). Konsentrasi xilitol yang terukur akan diperoleh sesuai dengan perhitungan yang terdapat di Kit.
2.12.2. Metode HPLC
1. Alat yang diperlukan
a) High Performance Liquid Chromatography (HPLC) b) Microsyringe 25μL
2. Reagen
a) Acetonitrile
b) Larutan Standar yang mengandung xilitol, sorbitol, arabinatol, galactitol, mannitol.
a) Fasa gerak: larutan acetonitrile 35%
b) Kolom kromatografi: HPX-87C300×7.8mm c) Laju alir: 0.6-0.8mL/min
d) Temperatur Kolom: 75oC
BAB III
RANCANGAN PENELITIAN
3.1. Metodologi
Tujuan dari penelitian ini adalah memperoleh konfigurasi fermentor terbaik untuk optimasi produksi xilitol dari tandan kosong kelapa sawit dengan bantuan mikroorganisme Debaryomyces hansenii. Untuk memperoleh konfigurasi terbaik ini, maka diperlukan data perolehan (yield) dan produktivitas dari masing-masing fermentasi. Perolehan dan produktivitas diperoleh setelah mendapatkan data konsentrasi substrat dan produk, laju pertumbuhan maksimal dan waktu yang diperlukan pada sekali fermentasi.
Pendekatan-pendekatan yang dilakukan untuk memperoleh data ini adalah melakukan percobaan dengan variasi-variasi sebagai berikut, yang pertama adalah memvariasikan ketiga jenis fermentasi, yaitu fermentasi batch, fed-batch, dan kontinyu. Pada fermentasi kontinyu, dilakukan fermentasi dengan sel bebas dan dengan mengimobilisasi sel
Debaryomyces hansenii.
Sampel diambil dalam rentang waktu tertentu selama masa fermentasi untuk pengujian pertumbuhan sel dan produk yang terbentuk. Untuk pengambilan sampel pada fermentasi batch, sampel dari dalam fermentor tidak diambil dengan volum lebih dari 10% volum total untuk menjaga asumsi volum tetap. Pengujian sampel menggunakan HPLC (High Performance Liquid Chromatography) dilakukan untuk memperoleh konsentrasi xilosa (substrat) dan xilitol (produk) di dalam fermentor. Dari data tersebut maka yield dan produktivitas dapat diperoleh dengan memasukkan data yang ada ke persamaan yang tersedia.
hasil konfigurasi fermentor terbaik dengan fermentasi yang dilakukan pada konfigurasi proses yang sama menggunakan substrat/media hidrolisat tandan kosong kelapa sawit.
3.2. Percobaan
3.2.1. Bahan
Mikroba yang digunakan adalah Debaryomyces hansenii ITB CC R85.
Bahan-bahan yang digunakan pada penelitian ini dapat dilihat pada tabel 3.1, tabel 3.2, tabel 3.3, dan tabel 3.4. Tabel 3.2 menampilkan bahan-bahan penyusun agar miring. Tabel 3.3 menampilkan bahan-bahan yang digunakan sebagai medium fermentasi dengan volume kerja 500 mL.
Tabel 3.1. Bahan yang Digunakan Pada Penelitian
Alkohol CaCl2
Agar H2SO4/HCl
Aqua dm NaOH/KOH
Bacto-malt extract Polivinil alkohol Bacto-peptone Ca-Alginat Bacto-yeast extract Spiritus
Tabel 3.2. Komposisi dari Glucose Yeast Extract (Yeast Extract Pepton Glucose) Yeast extract 5 g
Peptone 10 g Glucose 20 g Aqua dm 1 L Agar-agar 20 g
Tabel 3.3. Komposisi dari 500 mL Medium Fermentasi
Komponen Jumlah (g) Komponen Jumlah (g)
CaCl2.2H2O 0,05 MnSO4.4H2O 0,0092
Calcium-pamthotenate 0,02 Myo-inositol 0,1 CoCl2.6H2O 0,002 Na2MoO4.2H2O 0,0013
CuSO4.5H2O 0,001 Nicotinic acid 0,005
D-biotin 0,0001 Pyridoxal
hydrochloride 0,005
FeSO4.7H2O 0,035
Thiamine
hydrochlorine 0,005
H3BO3 0,002 ZnSO4.7H2O 0,011
Kompisisi gula sebagai sumber karbon pada media hidrolisat TKKS sintetik disajikan pada tabel 3.4.
Tabel 3.4. Komposisi TKKS
Komponen Jumlah (g/L)
Xilosa 10
Glukosa 5
3.2.2. Alat
Alat-alat yang digunakan pada penelitian ini disajikan pada tabel 3.5.
Tabel 3.5. Alat yang Digunakan Pada Penelitian
Aqua dm Filter Kuvet Spektrofotometer
Autoklaf HPLC Mikropipet Stopwatch
Biological safety cabinet
Inkubator shaker, T
controlled Mikrotube syringe
Bunsen Jarum ose Mikroskop syringe filter
Counting chamber Kapas steril Neraca analitis Tabung reaksi steril
Erlenmeyer 1L Kertas saring Pipet tetes Vial
Fermentor yang digunakan pada penelitian ini adalah BioFlo/Celligen 115 New Brunswick yang dilengkapi dengan sistem pengendalian temperatur, pH, level cairan, dan
foam (Gambar 3.1). Rangkaian bioreaktor untuk proses fermentasi batch, fed-batch, dan kontinyu secara berturut-turut seperti pada Gambar 3.2, 3.3, dan 3.4.