BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL
OLEH ACETOBACTER XYLINUM DENGAN METODE
FERMENTASI SISTEM BATCH CULTURE
TERADUK KONTINU
TESIS
Oleh
ENGELLINA
107006005/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL
OLEH ACETOBACTER XYLINUM DENGAN METODE
FERMENTASI SISTEM BATCH CULTURE
TERADUK KONTINU
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains dalam Program Studi Ilmu Kimia pada Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Sumatera Utara
Oleh
ENGELLINA
107006005/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Judul Tesis :
BIOSINTESIS VITAMIN C DARI
SUBSTRAT D-SORBITOL OLEH
ACETOBACTER XYLINUM DENGAN
METODE FERMENTASI SISTEM
BATCH CULTURE TERADUK
KONTINU
Nama Mahasiswa : ENGELLINA
Nomor Pokok : 107006005
Program Studi : Magister Ilmu Kimia
Menyetujui, Komisi Pembimbing
(Dr.Yuniarti Yusak,M.S) (
Ketua Anggota
Dr.Ribu Surbakti,M.S)
Ketua Program Studi Dekan
(Prof.Basuki Wirjosentono,M.S,Ph.D) (Dr.Sutarman,M.Sc)
Telah diuji pada
Tanggal : 23 Januari 2013
PANITIA PENGUJI TESIS
Ketua : Dr.Yuniarti Yusak, M.S
Anggota : 1. Dr.Ribu Surbakti, M.S
2. Dr.Rumondang Bulan, M.S
3. Dr. Hamonangan Nainggolan, M.Sc
PERNYATAAN ORISINALITAS
BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL OLEH
ACETOBACTER XYLINUM
DENGAN METODE FERMENTASI
SISTEM BATCH CULTURE TERADUK KONTINU
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya tesis ini adalah hasil karya saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan sumbernya dengan benar
Medan, 23 Januari 2013
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai Sivitas Akademis Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Engellina NIM : 107006005
Program Studi : Magister Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas Tesis saya yang berjudul :
BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL OLEH
ACETOBACTER XYLINUM
DENGAN METODE FERMENTASI
SISTEM BATCH CULTURE TERADUK KONTINU
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya
Medan, 23 Januari 2013
RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap : Engellina
Tempat dan Tanggal Lahir : Medan, 16 Oktober 1986
Alamat Rumah : Jl. Sun Yat Sen No. 18/30 Medan Telepon / HP : (061) 7343877 / 08126496319
Email :
DATA PENDIDIKAN
KATA PENGANTAR
Puji dan syukur penulis kepada Tuhan Yang Maha Pemurah dan Maha
Penyayang, dengan limpahan karunia-Nya sehingga tesis ini berhasil diselesaikan
dalam waktu yang ditetapkan.
Dengan rasa hormat, penulis mengucapkan terima kasih kepada :
1. Ibu Dr.Yuniarti Yusak,M.S dan Bapak Dr.Ribu Surbakti,M.S selaku pembimbing I
dan pembimbing II yang telah meluangkan waktunya untuk membimbing dan
mengarahkan serta memberikan motivasi kepada penulis selama melakukan
penelitian hingga penyusunan tesis ini.
2. Bapak Prof.Basuki Wirjosentono,M.S,Ph.D dan Bapak Dr.Hamonangan
Nainggolan,M.Sc selaku Ketua dan Sekretaris Program Studi Magister Ilmu Kimia
Pascasarjana USU.
3. Ibu Dra.Nunuk Priyani,M.Sc selaku Kepala Laboratorium Mikrobiologi
FMIPA-USU.
4. Bapak Dekan dan Pembantu Dekan FMIPA-USU.
5. Bapak Dekan dan Pembantu Dekan Fakultas Farmasi-USU.
6. Seluruh teman-teman Mahasiswa Magister Ilmu Kimia Stambuk 2010 yang telah
membantu penulis selama kuliah dan penelitian.
7. Asisten Laboratorium Mikrobiologi FMIPA-USU stambuk 2008, 2009 khususnya
Mirza dan Ria; Asisten Laboratorium Biokimia FMIPA-USU khususnya Dian
Pratiwi dan Putri; Asisten Laboratorium Sentral Biologi FMIPA-USU khususnya
Imam dan Asisten Laboratorium Pusat Penelitian Fakultas Farmasi-USU; Bapak
Alhamra selaku Kepala Laboratorium MMH Balai Riset dan Standarisasi Industri
Medan yang telah banyak membantu dengan memberikan informasi dan saran
Dan akhirnya, penulis mengucapkan terima kasih kepada keluargaku yang sangat
kukasihi dan kucintai : Ayahku Edy Susanto dan Ibuku Lidyawati yang telah banyak
membantu dengan dukungan doa, moral dan dana kepada penulis; Adik-adik Darwin
Susanto dan Selviani yang memberikan dukungan doa kepada penulis; Rizky dan Bang
Sianturi yang telah membantu dan memberikan saran kepada penulis; Kak Sugiatik
yang telah membantu penulis; Sahabat-sahabatku Kartika Eberta dan Jenny yang
memberikan dukungan doa kepada penulis; Kak Lely Ratnawati selaku pegawai
administrasi program studi ilmu kimia Pascasarjana USU yang telah membantu penulis
selama kuliah; Suandi yang memberikan dukungan doa kepada penulis.
Semoga Tuhan Yang Maha Pengasih melimpahkan berkat dan rahmat-Nya
kepada kita semua.
Medan, 23 Januari 2013
Hormat Saya,
BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL
OLEH ACETOBACTER XYLINUM DENGAN METODE
FERMENTASI SISTEM BATCH CULTURE
TERADUK KONTINU
ABSTRAK
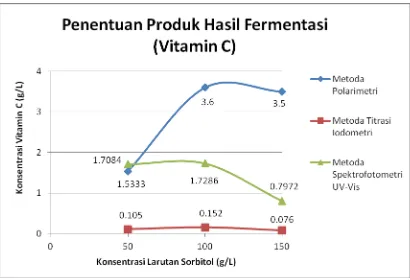
Telah dilakukan penelitian tentang biosintesis vitamin C dari substrat D-sorbitol oleh Acetobacter xylinum dengan metode fermentasi sistem batch culture teraduk kontinu. Dalam penelitian ini, digunakan D-sorbitol sebagai substrat dan sumber makanan bagi bakteri Acetobacter xylinum. Penentuan kadar vitamin C dilakukan dengan metoda Polarimetri, Titrasi Iodometri, Spektrofotometri UV-Visible dan untuk menghitung jumlah bakteri yang digunakan dilakukan dengan metode Hitungan Cawan. Dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible untuk larutan sorbitol 50 g/L setelah fermentasi diperoleh vitamin C sebesar 1,5333 g/L ; 0,105 g/L dan 1,7084 g/L. Hasil fermentasi larutan 100 g/L sorbitol setelah diuji dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible kadar vitamin C yang diperoleh sebesar 3,6 g/L ; 0,152 g/L dan 1,7286 g/L. Dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible untuk konsentrasi larutan sorbitol 150 g/L setelah fermentasi diperoleh vitamin C sebesar 3,5 g/L ; 0,076 g/L dan Spektrofotometri UV-Visible 0,7972 g/L. Dari hasil penelitian, diketahui bahwa sudut putar bidang polarisasi D-sorbitol telah berubah tanda (+) sebelum fermentasi menjadi (-) setelah fermentasi sehingga diperoleh asam L-askorbat.
BIOSYNTHESIS VITAMIN C FROM D-SORBITOL SUBSTRATE BY
ACETOBACTER XYLINUM WITH FERMENTATION
METHOD BATCH CULTURE CONTINUOUS
MIXING SYSTEM
ABSTRACT
The research of biosynthesis vitamin C from D-sorbitol substrate by Acetobacter xylinum with fermentation method of batch culture continuous mixing system is done. In this research, I used D-sorbitol as substrate and food supply for Acetobacter xylinum. The determination quantity of vitamin C using Polarimetri method, Iodometri Titration, Spectrophotometri UV-Visible and for accounting quantity of bacteria using Plate Count method. By using Polarimetri method ; Iodometri Titration and Spectrophotometri UV-Visible for 50 g/L sorbitol solution after the fermentation gave 1,5333 g/L ; 0,105 g/L and 1,7084 g/L of vitamin C. The result of 100 g/L sorbitol solution after it tested with Polarimetri method, Iodometri Titration and Spectrophotometri UV-Visible of vitamin C gave 3,6 g/L ; 0,152 g/L and 1,7286 g/L. By using Polarimetri method ; Iodometri Titration and Spectrophotometri UV-Visible for 150 g/L sorbitol solution after the fermentation gave 3,5 g/L ; 0,076 g/L and 0,7972 g/L of vitamin C From this research, it is known that turning angle of D-sorbitol polarization already changed from (+) marked before fermentation became (-) marked after fermentation with the result of L-ascorbic acid.
DAFTAR ISI 2.2 Sorbitol, Struktur dan Sifat-Sifatnya 11
2.3 Sorbosa 12
2.4 Fermentasi Vitamin C 12
2.5 Kinetika Pertumbuhan Mikroba 20 2.6 Kinetika Pembentukan Produk 24
2.7 Pemilihan Bioreaktor 25
2.8 Acetobacter Xylinum 29
2.9 Enzim 30
2.10 Metoda Hitungan Cawan 31
BAB 3 METODOLOGI 42
3.1 Alat 42
3.2 Bahan 43
3.3 Prosedur Penelitian 44
3.3.1 Preparasi Media dan Pembuatan Larutan Pereaksi untuk Identifikasi Bakteri Acetobacter xylinum 44 3.3.1.6 Pembuatan Larutan Triple Sugar Iron Agar (TSIA) 45 3.3.1.7 Pembuatan Larutan Simmons Citrate Agar (SCA) 45 3.3.1.8 Pembuatan Larutan SIM (Sulfide Indole Motility Medium) 45 3.3.1.9 Pembuatan Larutan Gelatin 45 3.3.1.10 Pembuatan Media Starch 45 3.3.1.11 Larutan Asam Asetat Glasial 1,96% 45 3.3.1.12 Pembuatan Larutan Vitamin C Standar 45 3.3.2 Perlakuan terhadap Sampel dan Metode Pengukuran Sampel 46
3.3.2.1 Identifikasi Bakteri Acetobacter xylinum dengan Metoda
Pewarnaan Gram 46 3.3.2.2 Penentuan Jumlah Koloni Bakteri dengan Metoda Hitungan
Cawan 46
3.3.2.3 Pembuatan Starter 46 3.2.2.4 Fermentasi Larutan Fermentasi D-Sorbitol menjadi Vitamin C 47 3.3.2.5 Penentuan Vitamin C dengan Metoda Polarimetri 47 3.3.2.6 Pemanenan Hasil Larutan Fermentasi dengan Metoda Sentrifuge 47 3.3.2.7 Penentuan Vitamin C dengan Metoda Spektrofotometri
UV-Visible 48 3.3.2.8 Penentuan Vitamin C dengan Metode Titrasi Iodometri 48
3.4 Bagan Penelitian 49
BAB 4 HASIL DAN PEMBAHASAN 55
4.1 Hasil Penelitian 55
4.2 Perhitungan 55 4.2.1 Penentuan Vitamin C dengan Metoda Polarimetri 55 4.2.2 Penentuan Vitamin C dengan Metoda Titrasi Iodometri 56 4.2.3 Penentuan Vitamin C dengan Metoda Spektrofotometri UV-Vis 58 4.2.4 Penentuan Jumlah Koloni Bakteri dengan Metoda Hitungan Cawan 58
BAB 5 KESIMPULAN DAN SARAN 63
5.1 Kesimpulan 63
5.2 Saran 63
DAFTAR PUSTAKA 64
DAFTAR TABEL
Nomor Judul Halaman
Tabel 4.2.1 Penentuan Vitamin C dengan Metoda Polarimetri 55
Tabel 4.2.2 Penentuan Vitamin C dengan Metoda Titrasi Iodometri 56
Tabel 4.2.3 Penentuan Vitamin C dengan Metoda Spektrofotometri
UV-Visible 58
Tabel 4.2.4 Penentuan Jumlah Koloni Bakteri dengan Metoda
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar 1 Metode Pewarnaan Gram pada Bakteri Acetobacter xylinum 68
Gambar 2 Media Hassid Barker Agar (HBA) 68
Gambar 3 Identifikasi Bakteri Acetobacter xylinum 69
Gambar 4 Uji Kualitatif Vitamin C pada Larutan Fermentasi 50 g/L;
BIOSINTESIS VITAMIN C DARI SUBSTRAT D-SORBITOL
OLEH ACETOBACTER XYLINUM DENGAN METODE
FERMENTASI SISTEM BATCH CULTURE
TERADUK KONTINU
ABSTRAK
Telah dilakukan penelitian tentang biosintesis vitamin C dari substrat D-sorbitol oleh Acetobacter xylinum dengan metode fermentasi sistem batch culture teraduk kontinu. Dalam penelitian ini, digunakan D-sorbitol sebagai substrat dan sumber makanan bagi bakteri Acetobacter xylinum. Penentuan kadar vitamin C dilakukan dengan metoda Polarimetri, Titrasi Iodometri, Spektrofotometri UV-Visible dan untuk menghitung jumlah bakteri yang digunakan dilakukan dengan metode Hitungan Cawan. Dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible untuk larutan sorbitol 50 g/L setelah fermentasi diperoleh vitamin C sebesar 1,5333 g/L ; 0,105 g/L dan 1,7084 g/L. Hasil fermentasi larutan 100 g/L sorbitol setelah diuji dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible kadar vitamin C yang diperoleh sebesar 3,6 g/L ; 0,152 g/L dan 1,7286 g/L. Dengan metoda Polarimetri ; Titrasi Iodometri dan Spektrofotometri UV-Visible untuk konsentrasi larutan sorbitol 150 g/L setelah fermentasi diperoleh vitamin C sebesar 3,5 g/L ; 0,076 g/L dan Spektrofotometri UV-Visible 0,7972 g/L. Dari hasil penelitian, diketahui bahwa sudut putar bidang polarisasi D-sorbitol telah berubah tanda (+) sebelum fermentasi menjadi (-) setelah fermentasi sehingga diperoleh asam L-askorbat.
BIOSYNTHESIS VITAMIN C FROM D-SORBITOL SUBSTRATE BY
ACETOBACTER XYLINUM WITH FERMENTATION
METHOD BATCH CULTURE CONTINUOUS
MIXING SYSTEM
ABSTRACT
The research of biosynthesis vitamin C from D-sorbitol substrate by Acetobacter xylinum with fermentation method of batch culture continuous mixing system is done. In this research, I used D-sorbitol as substrate and food supply for Acetobacter xylinum. The determination quantity of vitamin C using Polarimetri method, Iodometri Titration, Spectrophotometri UV-Visible and for accounting quantity of bacteria using Plate Count method. By using Polarimetri method ; Iodometri Titration and Spectrophotometri UV-Visible for 50 g/L sorbitol solution after the fermentation gave 1,5333 g/L ; 0,105 g/L and 1,7084 g/L of vitamin C. The result of 100 g/L sorbitol solution after it tested with Polarimetri method, Iodometri Titration and Spectrophotometri UV-Visible of vitamin C gave 3,6 g/L ; 0,152 g/L and 1,7286 g/L. By using Polarimetri method ; Iodometri Titration and Spectrophotometri UV-Visible for 150 g/L sorbitol solution after the fermentation gave 3,5 g/L ; 0,076 g/L and 0,7972 g/L of vitamin C From this research, it is known that turning angle of D-sorbitol polarization already changed from (+) marked before fermentation became (-) marked after fermentation with the result of L-ascorbic acid.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Pengetahuan manusia tentang bioteknologi berawal dari pembuatan makanan dan
minuman secara fermentasi. Minuman khas Jepang seperti sake, bir, anggur, makanan
keju, yoghurt, tempe, oncom, acar dan lain-lain merupakan contoh kecil proses
bioteknologi tradisional yang sudah lama dikenal.
Pada tahun 1929 s/d 1944 bioteknologi tahap kedua (lebih modern) telah
dikemukakan oleh Flemming Yi telah ditemukannnya penelitian dengan cara
fermentasi. Sejak itu berkembanglah kegiatan bioteknologi untuk menghasilkan
antibiotik, vitamin-vitamin serta asam-asam organik seperti aseton, butanol, asam sitrat
dengan metode fermentasi (Higgins, 1985).
Struktur asam askorbat pertama sekali dikemukakan oleh Haworth. Asam
askorbat disintesa secara komersial dengan bantuan bakteri berlangsung sebagai
berikut :
red oks
D-glukosa D-sorbitol L-sorbosa Vitamin C
Acetobacter
(West, 1966).
Isolasi kristalin asam askorbat pada tahun 1928 dilakukan oleh Szent-Gyorgyi
yang dilanjutkan dengan identifikasi vitamin C oleh Waugh dan King serta Svirbely
dan Szent-Gyorgyi pada tahun 1932.
Laporan pertama tentang oksidasi D-sorbitol menjadi L-sorbosa oleh bantuan
bakteri ditemukan Bertrand pada tahun 1896. Bakteri tersebut diidentifikasi dengan
Pada tahun 1953 dibuat beberapa studi dimana proses fermentasi vitamin C
dengan bantuan mikroorganisme hanya terjadi dalam 2 langkah. Hori dan Nakatani
mengubah glukosa oleh Acetobacter suboxydans menjadi asam 5-keto-D-glukonat, yang selanjutnya oleh bantuan katalis enzim dirubah menjadi asam L-idonat.
Fermentasi dengan Pseudomonas, Acetobacter, atau Aerobacter inversi senyawa akhir menjadi asam 2-keto-L-gulonat, dimana intermediat yang lazim dikenal menjadi
asam L-askorbat (Hori, 1953).
Boudrant menyatakan bahwa dengan menggunakan metoda Reichstein dan
glukosa sebagai substrat, pembentukan asam askorbat dengan metoda fermentasi oleh
bakteri Acetobacter xylinum atau Acetobacter suboxyydans hanya berlangsung dengan
5 tahap reaksi (Boudrant, 1990).
Hancock menyatakan bahwa dengan menggunakan Saccharomyces cerevisiae
dan substrat L-galaktosa, L-galaktono-1,4-lakton dan L-gulono-1,4-lakton akan
dihasilkan asam askorbat sedangkan bila menggunakan substrat glukosa,
D-galaktosa atau D-manosa akan dihasilkan asam D-erithroaskorbat (Hancock, 2000).
Running menyatakan bahwa fermentasi aerobik dari D-glukosa dan pemilihan
strain yang tepat akan dihasilkan asam askorbat ekstraseluler sebesar 76 mg/L
(Running, 2002).
Rewatkar menyatakan bahwa dengan menggunakan 5 gram sorbitol; 0,5 gram
ekstrak yeast dan 2 gram agar yang dilarutkan dalam 100 mL H2
Dengan cara yang sama tetapi menggunakan bakteri Pseudomonas aeruginosa
akan dihasilkan 3,217 mg/L (4,0213%). Sedangkan bila digunakan Saccharomyces cerevisiae akan dihasilkan 1,882 mg/L (2,3525%) asam askorbat (Rewatkar, 2010).
O setelah difermentasi
selama 7 hari oleh Acetobacter suboxydans akan diperoleh sebanyak 4,997 mg/L (6,2213%) asam askorbat.
Manusia tidak dapat mensintesis vitamin C karena tidak mempunyai fungsi gen
penghasil L-gulono-1,4-lactone oxidase, dimana enzim tersebut diperlukan di dalam
Oleh karena itu, peneliti tertarik untuk melakukan proses biosintesis vitamin C
dari D-sorbitol dengan bantuan bakteri Acetobacter xylinum dalam pengembangan bioteknologi.
1.2 Perumusan Masalah
Seberapa besar kemampuan Acetobacter xylinum mensintesis D-sorbitol menjadi vitamin C (asam askorbat) dengan pengaturan pH 4-4,5 dalam jangka waktu fermentasi
72 jam dengan menggunakan alat fermentor jenis Batch Culture teraduk kontinu.
1.3 Pembatasan Masalah
Dalam penelitian ini objek masalah dibatasi sebagai berikut :
1. D-sorbitol digunakan sebagai bahan pengganti glukosa.
2. Proses fermentasi vitamin C dari D-sorbitol dengan bantuan bakteri
Acetobacter xylinum.
3. Waktu fermentasi yang dilakukan adalah 72 jam dengan pengaturan kondisi
yang telah disesuaikan antara lain pH, temperatur serta pengadukan yang
teratur dan kontinu.
4. Metoda fermentasi yang digunakan adalah metoda Batch Culture teraduk
kontinu.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
1. Untuk membuktikan bahwa vitamin C dapat dibuat dengan cara fermentasi dari
bahan baku D-sorbitol.
2. Untuk mengetahui kadar vitamin C yang diperoleh dengan proses fermentasi
3. Untuk mensosialisasikan metoda-metoda bioteknologi.
4. Untuk memproduksi bahan dan jasa dengan biaya relatif murah, aman,
terbarukan dan sekaligus dapat mengurangi pencemaran lingkungan.
1.5 Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan sumbangan informasi pada
bidang Biokimia/KBM (Kimia Bahan Makanan) dimana D-sorbitol dapat
dimanfaatkan sebagai sumber biosintesis vitamin C dengan bantuan bakteri
Acetobacter xylinum.
1.6 Metodologi Penelitian
Adapun langkah-langkah analisisnya sebagai berikut :
1. Penelitian ini adalah eksperimental laboratorium.
2. Sampel yang digunakan adalah D-sorbitol sebagai bahan pengganti glukosa.
3. Waktu fermentasi oleh bakteri Acetobacter xylinum selama 72 jam. 4. Metoda fermenter yang digunakan adalah metoda Batch Culture teraduk
kontinu.
5. Sampel yang mengandung bakteri Acetobacter xylinum dilakukan pengaturan pH 4-4,5 pada suhu kamar dan diatur pengadukan yang teratur dan kontinu di
dalam wadah yang telah dipreparasi.
6. Hasil fermentasi diuji dengan Polarimeter, Spektrofotometer UV-Visible,
Titrasi Iodometri dan Metoda Hitungan Cawan.
1.7 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi FMIPA USU; Uji Sentrifuge
dilakukan di Laboratorium Penelitian Farmasi USU dan Laboratorium Sentral Biologi
Medan; Uji Spektrofotometer UV-Visible dilakukan di Laboratorium Biologi Dasar
(LIDA) USU; dan Uji Titrasi Iodometri dilakukan di Laboratorium Biokimia FMIPA
BAB 2
TINJAUAN PUSTAKA
2.1 Struktur dan Sifat - Sifat Vitamin C
Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus
molekul C6H8O6
Pada pH rendah vitamin C lebih stabil daripada pH tinggi. Vitamin C mudah
teroksidasi, lebih-lebih apabila terdapat katalisator Fe, Cu, enzim Askorbat oksidase,
sinar, temperatur yang tinggi. Larutan encer vitamin C pada pH kurang dari 7,5 masih
stabil apabila tidak ada katalisator seperti di atas. Oksidasi vitamin C akan terbentuk
asam dihidroaskorbat. Vitamin C dengan iodin akan membentuk ikatan dengan atom C
normor 2 dan 3 sehingga ikatan rangkap hilang (Sudarmadji, 1989).
. Dalam bentuk kristal tidak berwarna, titik cair 190-192°C. Bersifat
larut dalam air sedikit larut dalam aseton atau alkohol yang mempunyai berat molekul
rendah. Vitamin C sukar larut dalam kloroform, eter dan benzen. Dengan logam
membentuk garam. Sifat asam ditentukan dengan ionisasi enol grup pada atom C
nomor tiga.
Vitamin C merupakan senyawa turunan gula yang sangat penting. Banyak
dijumpai dalam berbagai tanaman seperti sitrus, Hungarian Paprika, Green Wallnuts
serta beberapa jaringan hewan. Vitamin C diperlukan di dalam diet (diet essensial)
Struktur asam askorbat pertama sekali dikemukakan oleh Haworth. Asam
askorbat disintesa secara komersial dengan bantuan bakteri berlangsung sebagai
berikut :
red oks
Acetobacter
red oks
D-glukosa D-sorbitol L-sorbosa Vitamin C
Acetobacter
Vitamin C merupakan asam kuat dengan nilai pKa 4,21 dalam bentuk kristal,
cukup stabil tetapi sangat mudah teroksidasi bila dalam bentuk larutan dan di udara
terbuka. Tes iodin dan 2,6-dichlorophenolindophenol adalah merupakan tes kuantitatif
yang spesifik untuk menentukan konsentrasi asam askorbat (West, 1966).
Asam askorbat (vitamin C) adalah suatu zat organik yang merupakan ko-enzim
atau ko-faktor pada berbagai reaksi biokimia di dalam tubuh. Salah satu peran utama
asam askorbat adalah proses hidroksilasi prolin dan lisin pada pembentukan kolagen.
Kolagen adalah komponen penting jaringan ikat, oleh sebab itu vitamin C
penting untuk kelangsungan hidup jaringan ikat. Dengan demikian vitamin C berperan
penting pada proses penyembuhan luka, adaptasi tubuh terhadap trauma dan infeksi.
Vitamin C ini harus tersedia secara kontinu dalam makanan sehari-hari agar tidak
sampai timbul gejala defisiensi. Khususnya pada manusia (juga pada binatang jenis
tubuh. Defisiensi vitamin C ini disebut sebagai skorbut. Kebutuhan yang dianjurkan
untuk orang dewasa di Indonesia adalah 30 mg/hari. Vitamin C adalah sebuah reduktor,
di mana sangat berperan pada proses respirasi jaringan.
Vitamin C akan diekskresikan bila berlebihan, tetapi apabila hal ini berjalan terus,
khususnya pada pemberian vitamin C dosis tinggi secara intravena dapat meningkatkan
kadar keasaman darah. Ekskresi vitamin C melalui urine yang berlebihan akan
meningkatkan kadar keasaman urine, ini mungkin tidak mengganggu, tetapi dalam
keadaan tertentu, penurunan pH darah, tidak diharapkan.
Pada binatang tertentu, vitamin C ini dapat langsung diubah menjadi CO2 dan
H2
Telah diketahui bahwa manusia dan marmut tak mempunyai enzim gulonalakton
oksidase, yang mengoksidasi 1-gulonalakton menjadi 2-keto-1-gulonalakton. Evolusi
ini terjadi 25 sampai 60 juta tahun yang menyebabkan hilangnya kemampuan manusia
dan kelompok hewan tersebut di atas untuk mensintesis vitamin C sendiri. Apakah
rekayasa genetika dapat memperbaiki ketidakmampuan tersebut di masa mendatang
sehingga dapat memasukkan kembali enzim tersebut dalam sel manusia
(Goodman,1996).
O, sehingga kelebihan vitamin C ini tidak akan menimbulkan masalah. Dilihat dari
sudut gizi, pemasukan vitamin C itu harus disesuaikan dengan pemasukan zat-zat gizi
lainnya (baik dalam jumlah maupun proporsinya) agar kesehatan dapat terbina
(Tjokronegoro, 1985).
Sudah sejak dahulu kala orang telah mengenal penyakit skorbut (Scurvy).
Gejala-gejala penyakit yang kemudian dikenal sebagai gejala defisiensi vitamin C
(asam askorbat) ini, sudah dilaporkan sejak zaman Mesir kuno, Yunani kuno dan
zaman Romawi. Gejala-gejala penyakit tadi terutama timbul pada mereka yang sedang
melakukan pelayaran jarak jauh, atau mereka yang sedang melakukan
Pengobatan dan pencegahan penyakit ini baru tampak setelah James Lind,
seorang tabib Inggris pada pertengahan abad 18, memberikan jeruk segar pada
penderita-penderita penyakit skorbut ini.
Kini vitamin C sudah sangat dikenal masyarakat luas, sebagai vitamin populer
yang selalu dikaitkan dengan faktor-faktor kesehatan, dan kesegaran jasmani seseorang.
Umumnya pada binatang, gejala defisiensi vitamin C ini sukar sekali terjadi,
karena vitamin C ini dapat disintesa sendiri di dalam tubuh mereka. Tetapi pada
manusia, marmut, primata, jenis kelelawar dan jenis burung tertentu tidak dapat
membuat vitamin C sendiri. Oleh karena itu manusia harus mendapat vitamin C dalam
makanan sehari-hari.
Jumlah masukan vitamin C yang diperlukan pada orang dewasa agar jangan
sampai terjadi gejala defisiensi adalah 10 mg/hari. Sedangkan di Indonesia, kebutuhan
yang dianjurkan adalah 30 mg/hari.
Apabila dosis vitamin C yang diberikan berlebihan, maka vitamin C yang
berlebih ini akan diekskresikan melalui urine. Sebagian dari vitamin C tadi akan
diubah menjadi garam-garam oksalat, dan pada keadaan fisiologis, kira-kira 40-50 mg
garam oksalat yang diekskresikan berasal dari vitamin C, yakni kira-kira setengah dari
seluruh ekskresi oksalat.
Apabila dosis vitamin terus ditinggikan maka proporsi vitamin C yang diubah
menjadi oksalat ternyata akan menurun. Tetapi apabila orang tersebut memang
menderita gangguan metabolisme oksalat, hal ini dapat menimbulkan masalah.
Kelebihan vitamin C juga dapat menaikkan kadar keasaman darah khususnya
yang mendapat vitamin C dosis tinggi secara intravena. Pada keadaan tertentu,
penurunan pH darah tidak diharapkan. Kelebihan vitamin C akan meningkatkan
keasaman urine. Pada keadaan tertentu (gangguan metabolisme urat dan/atau oksalat
dan lain-lain) dapat meningkatkan kemungkinan terjadinya batu saluran kemih.
Defisiensi vitamin C menimbulkan penyakit skorbut. Gejala-gejala klinik antara
daerah epiphisis, pendarahan dan pembengkakan gusi dan lain-lain. Penderita dengan
gejala-gejala skorbut yang jelas kini sudah jarang dijumpai. Apabila pengobatan
terlambat dilakukan, skorbut ini dapat menimbulkan kematian.
Sumber vitamin C dapat kita jumpai pada sayuran dan buah-buahan segar. Atau
dapat pula dengan tablet-tablet vitamin C yang sekarang banyak dipasarkan. Perubahan
primer yang terjadi pada skorbut disebabkan karena fungsi vitamin C ialah dalam hal
pembentukan dan mempertahankan bahan interseluler dan kolagen.
Pada defisiensi vitamin C kolagen menghilang, pendarahan timbul karena
kerusakan bahan semen dan kapiler. Gejala utama penyakit skorbut timbul akibat
kelainan tulang dan pembuluh darah. Terjadi pendarahan subperiosteal, resorpsi dentin
dan degenerasi odon-toblast.
Fragilitas dinding kapiler meningkat dan terjadi pendarahan pada trauma,
misalnya pada kulit, otot tulang, gusi. Gejala ini sulit dikenal bila defisiensi hanya
marginal, sehingga perlu diketahui tanda-tandanya, sehingga dapat diambil tindakan
yang efisien. Tanda marginal defisiensi nutrien dibagi beberapa tahap, yaitu :
1. Tahap permulaan : penurunan cadangan nutrien dalam jaringan karena
penurunan masukan, penyerapan dan metabolisme yang abnormal. Juga terjadi
penurunan ekskresi nutrien tersebut.
2. Tahap biokimia : penurunan aktivitas enzim, perubahan metabolisme dan tak
terlihat ekskresi urin.
3. Tahap fisiologik : kehilangan nafsu makan, penurunan berat badan, tak dapat
tidur, mudah marah. Metabolisme obat terganggu.
4. Tahap klinik : terlihat tanda-tanda klinik defisiensi.
5. Tahap morfologik : perubahan bentuk jaringan yang dapat menimbulkan
kematian, kecuali diobati dengan nutrien tersebut.
Koreksi pada tahap dini tentu lebih menguntungkan dibanding pengobatan pada tahap
2.2 Sorbitol, Struktur dan Sifat-Sifatnya
Glukosa mempunyai 6 jumlah rantai atom C, 4 diantaranya merupakan atom C
asimetris sehingga banyak isomer yang dapat digambarkan dari molekul glukosa
tersebut. Salah satu isomer yang penting adalah isomer D-sorbitol karena merupakan
prekursor di dalam fermentasi vitamin C oleh Acetobacter xylinum.
Konversi struktur D-sorbitol ke dalam bentuk L-sorbosa sangatlah penting
karena L-sorbosa merupakan prekursor dari sintetis L-asam askorbat dengan
menggunakan larutan sorbitol 15% setelah difermentasi selama 24 jam oleh bakteri
Acetobacter suboxydans akan dihasilkan 93% L-sorbosa melalui reaksi di bawah ini :
CH2OH CH2
Pada tahap awal fermentasi, senyawa D-sorbitol akan berubah menjadi bentuk
L-sorbosa dengan adanya enzim yang dihasilkan oleh bakteri. Perubahan bentuk
D-sorbitol menjadi bentuk L-sorbosa dapat diuji dengan alat polarimeter yaitu dari
putaran sudut polarisasi dari kanan [D(+)] ke kiri [L(-)].
Gugus alkohol dari senyawa-senyawa gula dapat dioksidasi menjadi bentuk
ketosa oleh beberapa jenis bakteri dengan adanya oksigen. Sebagai contoh, D-sorbitol
dioksidasi oleh bakteri Acetobacter suboxydans sebagai berikut :
D-sorbitol + O2 → L-sorbosa + H2
2.3 Sorbosa
L-sorbosa adalah zat antara dalam produksi industri vitamin C dan L-sorbosa oleh
enzim invertase yang dihasilkan oleh mikroba maka terjadi inversi D-sorbitol menjadi
L-sorbosa yang merupakan prekursor di dalam biosintesis vitamin C. Sejak ditemukan
reaksi inversi ini maka industri pembentukan L-sorbosa (prekursor dalam biosintesis
vitamin C) berkembang pesat guna memenuhi bahan baku industri vitamin C. Produksi
sorbosa ditunjukkan dengan menggunakan inhibisi substrat dan produk secara
bersamaan. Angka oksidasi menurun secara drastis dengan penambahan konsentrasi
awal sorbitol dalam bioreaktor batch (Giridhar, 2000).
2.4 Fermentasi Vitamin C
Metode untuk mendapatkan vitamin C secara sintesis dengan urutan langkah yang
diperlukan dengan bantuan mikroba. Perkembangan vitamin C dianggap penting sekali.
Isolasi kristalin asam askorbat pada tahun 1928 dilakukan oleh Szent-Gyorgyi yang
dilanjutkan dengan identifikasi vitamin C oleh Waugh dan King serta Svirbely dan
Szent-Gyorgyi pada tahun 1932.
Vitamin C pertama kali diperoleh secara sintetis. Berbagai jenis sintetis vitamin
C diklasifikasikan menjadi empat metoda yang terpenting.
Metoda pertama dimana secara industri meliputi konversi D-glukosa menjadi
asam askorbat atau vitamin C. Langkah dari metoda tersebut meliputi oksidasi
mikrobiologi dari gugus hidroksil kedua 2,3,4,6-diisopropylidene derivative menjadi
gugus karbonil L-ascorbic acid (Vitamin C). Konfigurasi lanjutan yang penting adalah
L-sorbose, suatu senyawa gula yang jarang ditemukan. L-Sorbose dihasilkan dalam
skala besar dari D-glucitol (sorbitol) dengan pertumbuhan Acetobacter suboxydans. Penggunaan 15% larutan sorbitol, dihasilkan L-sorbose sebesar 93% setelah
difermentasi selama 24 jam dari waktu inokulasi yang ditemukan oleh Wells, Stubbs,
Sorbitol ditemukan secara umum dalam skala besar dengan cara hidrogenasi
katalitik dari D-glukosa. Laporan pertama tentang oksidasi D-sorbitol menjadi
L-sorbosa oleh enzim yang dihasilkan oleh bakteri yang ditemukan Bertrand pada tahun
1896. Bakteri tersebut diidentifikasi dengan bakteri Acetobacter xylinum.
D-glucose D-glucitol (D-sorbitol) L-sorbose
2,3,4,6-diisopropylidene derivative
2,3,4,6-diisopropylidene-2-keto-L-gulonic acid
L-ascorbic acid (Vitamin C)
Untuk menyelesaikan sintetis tersebut, L-sorbosa diubah menjadi derivat
2,3,4,6-diisopropilidena. Gugus hidroksil pertama derivat tersebut dioksidasi oleh ion
permanganat dalam larutan alkali menghasilkan asam
2,3,4,6-diisopropilidena-2-keto-L-gulonat berdasarkan Reichstein dan Grussner. Asam 2-keto-2,3,4,6-diisopropilidena-2-keto-L-gulonat atau derivat
diisopropilidena diubah menjadi asam L-askorbat dengan bermacam teknik untuk
mendapatkan hasil sempurna (Robinson, 1976).
Pada tahun 1953 dibuat beberapa studi dimana proses fermentasi vitamin C
dengan bantuan mikroorganisme hanya terjadi dalam 2 langkah. Hori dan Nakatani
mengubah glukosa oleh Acetobacter suboxydans menjadi asam 5-keto-D-glukonat, yang selanjutnya oleh bantuan katalis enzim dirubah menjadi asam L-idonat.
Fermentasi dengan Pseudomonas, Acetobacter, atau Aerobacter inversi senyawa akhir menjadi asam 2-keto-L-gulonat, yaitu suatu senyawa antara (intermediat) yang lazim
dikenal menjadi asam L-askorbat (Hori, 1953).
Pada tahun 1990, Boudrant menyatakan bahwa dengan menggunakan metode
fermentasi hanya berlangsung dengan 5 tahap reaksi sebagai berikut : reduksi glukosa
menjadi sorbitol dengan menggunakan katalis nikel; oksidasi sorbitol menjadi
L-sorbosa; hasil diaseton sorbosa atau 2,3:4,6-diisopropilidena-L-xylo-2-heksofuranosa
setelah perlakuan dengan aseton dan asam sulfat; oksidasi
2,3,4,6-diisopropilidena-L-xylo-2-heksofuranosa menjadi asam 2-keto-L-gulonat dengan menggunakan katalis
platinium; enolisasi dan laktonisasi internal asam 2-keto-gulonat menjadi asam
L-askorbat.
Asam L-askorbat seperti jalur di bawah ini :
Pada zaman sekarang, ditemukan ada enam proses fermentasi bakteri untuk
menghasilkan vitamin C. Semua proses tersebut memperlihatkan prekursor langsung
dari asam L-askorbat, asam gulonat, dimana dinamakan asam
2-keto-L-idonat. Perbedaan keenam jalur ini ditandai dari senyawa intermediat yang terbentuk
selama proses fermentasi.
Keenam jalur tersebut dapat dilihat sebagai berikut :
1.Jalur Sorbitol
2.Jalur asam L-idonat
3.Jalur asam L-gulonat
4.Jalur asam 2-keto-D-glukonat
5.Jalur asam 2,5-diketo-D-glukonat
Diagram jalur biosintesis vitamin C oleh berbagai jenis mikroorganisme :
(Boudrant, 1990).
1. Jalur Sorbitol
Biosintesis ini dinyatakan pertama kali oleh Motizuki. Sorbitol ditransformasikan
dengan cara fermentasi menjadi asam 2-keto-L-gulonat. Transformasi diperoleh dari
beberapa genus Pseudomonas dan Acetobacter, tetapi jenis metabolisme ini belum dikenal secara umum.
Hasil transformasi dari sorbitol menjadi asam 2-keto-gulonat tidak melampaui
10%, walaupun hasil 70% dicatat dari Acetobacter cerenusote. Selain asam 2-keto-L-gulonat, produk lain juga terbentuk. Okazaki menyarankan jalur biosintesis sebagai
Sorbitol
L-sorbose
L-idose
L-idonic acid
2-keto-L-gulonic acid
2. Jalur asam L-idonat
Biosintesis menggunakan asam L-idonat sebagai zat antara adalah transformasi
multistep. Metabolisme multistep dikenal adalah asam D-glukonat, asam
5-keto-D-glukonat, asam L-idonat, dan asam 2-keto-L-idonat.
Oksidasi pertama, transformasi D-glukosa menjadi asam D-glukonat, tidak
dijelaskan secara terperinci.
3. Jalur asam L-gulonat
Jalur asam L-gulonat terdapat pada jalur L-idonat yang meliputi dua langkah
(oksidasi asam D-glukonat dan reduksi asam 5-keto-D-glukonat). Tetapi reaksi ini
berkembang menjadi asam L-gulonat, prekursor asam 2-keto-D-idonat. Oksidasi asam
L-gulonat disampaikan oleh Kita. Menurut Kita, transformasi asam 5-keto-D-glukonat
4. Jalur asam 2-keto-D-glukonat
Ada tiga langkah pada jalur ini :
1.Oksidasi asam D-glukonat
Kebanyakan akan mentransformasi D-glukosa menjadi asam D-glukonat dengan
menggunakan jalur ini. Transformasi D-glukosa menjadi asam
2,5-diketo-gulonat yang diidentifikasikan oleh Katznelson dalam Acetobacter melanogenum
dan Pseudomonas albosesamae.
Dikenal bahwa Acetobacter suboxydans, untuk sintesis asam 5-keto-D-glukonat dari asam D-glukonat, dapat mensintesis asam 2-keto-D-glukonat.
Pada tahun 1982, Sonoyama menjelaskan kemampuan pertama kali Erwinia spp,
untuk akumulasi asam D-glukonat dan asam 2-keto-D-glukonat.
2.Oksidasi asam 2-keto-D-glukonat
Oksidasi ini diselesaikan oleh Bacterium hoshigaki dan Bacterium glucunicum
dengan produk asam 2,5-D-diketo-D-glukonat. Juga dibiosintesis oleh
Acetobacter spp khususnya Acetobacter melanogenum. Ilustrasi biokonversi glukosa dengan asam D-glukonat dan asam 2-keto-D-glukonat sebagai zat antara.
Proses transformasi langsung D-glukosa menjadi asam 2,5-diketo-D-glukonat
menggunakan Acetobacter fragum atau Acetomonas albosesamae yang diumumkan secara luas.
3.Reduksi asam 2,5-diketo-D-glukonat
Pada tahun 1975, Sonoyama menjelaskan proses yang menghasilkan asam
2-keto-D-gulonat dari asam 2,5-diketo-D-glukonat, dapat dilakukan oleh genus
Brevibacterium, Arthrobacter, Micrococcus, Staphylococcus, Pseudomonas, dan
Bacillus. Dengan Brevibacterium ketosporum, hasilnya mencapai 15% ketika konsentrasi substrat 50 g L-1. Dengan mikroorganisme lain, hasilnya tidak lebih
menghasilkan hasil produk asam 2-keto-L-gulonat sekitar 10%. Pada masa kini,
diperoleh hasil mendekati 80%. Proses lain juga dijelaskan dengan menggunakan
Citrobacter. Dapat dikatalisis hanya dengan transformasi asam 2,5-diketo-D-gulonat, dan permulaan digunakan Acetobacter cerenus. Dengan beberapa mikroorganisme, hasilnya sekitar 30%, dengan konsentrasi substrat 100 g L-1.
5.Jalur asam 2.5-diketo-D-glukonat
Proses produksi asam 2,5-diketo-D-glukonat pada langkah utama. Genus
Erwinia dijelaskan pada transformasi ini. Dijelaskan bahwa konsentrasi glukosa 200 g L-1
Proses fermentasi dengan menggunakan Acetobacter cerenus memberikan hasil sekitar 90%.
dan waktu fermentasi 20 jam yang memberikan hasil sekitar 75%.
6.Jalur asam 2-keto-L-gulonat
Jalur ini rupanya terjadi secara langsung, dan menghasilkan asam
2-keto-L-gulonat, prekursor langsung asam L-askorbat dari glukosa. Jalur ini kemungkinan
terjadi dengan pengembangan yang baru.
Beberapa diantaranya :
1.Kultur tingkat kedua atau campuran
2.Seleksi mutan
3.Isolasi reduksi asam 2,5-diketo-D-glukonat pada Corynebacterium
4.Transfer gen reduksi asam 2,5-diketo-D-glukonat pada Corynebacterium dan
Erwinia (Boudrant, 1990).
Hancock menyatakan bahwa dengan menggunakan Saccharomyces cerevisiae
dan substrat L-galaktosa, L-galaktono-1,4-lakton dan L-gulono-1,4-lakton akan
dihasilkan asam askorbat sedangkan bila menggunakan substrat glukosa,
Running menyatakan bahwa fermentasi aerobik dan pemilihan strain yang tepat
akan dihasilkan asam askorbat ekstraseluler sebesar 76 mg/L. Dengan mutagen klasik
dan metoda seleksi, kami menciptakan mutan Prototheca moriformis ATCC 75669 yang menghasilkan kuantitas asam askorbat terbesar daripada strain tipe alamiah (78,4
vs 21,9 mg AA/g sel) (Running, 2002).
Rewatkar menyatakan bahwa dengan menggunakan 5 gram sorbitol; 0,5 gram
ekstrak yeast dan 2 gram agar yang dilarutkan dalam 100 mL H2
Salah satu aspek yang penting dari proses-proses fermentasi adalah cara
pemanenan dan memurnikan hasil produk fermentasi atau bioproduk. Proses ini
dikenal dengan proses hilir (Kroner, 1984).
O setelah difermentasi
selama 7 hari oleh Acetobacter suboxydans akan diperoleh sebanyak 4,997 mg/L (6,2213%) asam askorbat. Dengan cara yang sama tetapi menggunakan bakteri
Pseudomonas aeruginosa akan dihasilkan 3,217 mg/L (4,0213%). Sedangkan bila
2.5 Kinetika Pertumbuhan Mikroba
Mikroba dapat tumbuh lebih baik pada media yang memenuhi persyaratan untuk
pertumbuhannya. Apabila suatu sel mikroba (misalnya bakteri) ditumbuhkan pada
suatu medium yang memenuhi syarat untuk tumbuh, maka mikroba tersebut akan
mengadakan multiplikasi secara aseksual dengan pembelahan sel menjadi dua sel
vegetatif yang serupa dan selanjutnya proses tersebut berlangsung terus-menerus
selama nutrisi, energi, dan persyaratan lingkungan lain masih memenuhi syarat tumbuh.
Waktu antara yang ditentukan sel untuk membelah disebut waktu generasi(g).
Waktu generasi masing-masing pembelahan sel berbeda-beda tergantung dari spesies
dan kondisi lingkungan. Namun demikian, sebagian besar bakteri mempunyai waktu
generasi antara 10-60 menit.
Kurva pertumbuhan mikroba dalam kultur :
1. Fase Adaptasi
Jika mikroba ditumbuhkan pada suatu media, pada awalnya akan mengalami
fase adaptasi (fase lag), yaitu fase untuk menyesuaikan dengan substrat dan
kondisi lingkungan sekitarnya. Pada fase ini belum terjadi pembelahan sel
karena beberapa enzim mungkin belum disintesis. Jumlah sel pada fase ini
mungkin tetap, tetapi kadang-kadang menurun. Lamanya fase adaptasi setiap
jenis mikroba sangat bervariasi. Hal ini dipengaruhi oleh beberapa faktor,
antara lain media dan lingkungan pertumbuhan serta jumlah inokulum.
a. Media dan lingkungan pertumbuhan
Mikroba yang ditumbuhkan pada media dan lingkungan pertumbuhan yang
berbeda dengan media dan lingkungan pertumbuhan sebelumnya akan
melakukan adaptasi selama beberapa waktu. Akan tetapi, perlu diketahui
bahwa selama adaptasi ini mikroba juga mensintesis enzim-enzim yang
dibutuhkan dalam metabolisme. Kecuali jika media dan lingkungannya sama
seperti media dan lingkungan sebelumnya, mungkin tidak diperlukan waktu
adaptasi. Kalaupun memerlukan waktu, ini tidak akan berlangsung lama
melainkan sangat singkat.
b. Jumlah inokulum
Jumlah sel (mikroba) awal yang semakin tinggi akan memperlambat waktu fase
adaptasi.
2. Fase Pertumbuhan Awal
Setelah penyesuaian diri, maka sel mikroba mulai membelah dengan kecepatan
rendah.
Pada fase ini pertumbuhan mencapai kecepatan maksimum. Selama fase
pertumbuhan logaritmik, tumbuh sel-sel muda yang mendominasi sebagian
besar fase ini, dimana pertambahan jumlah sel-sel muda ini mengikuti kurva
logaritmik. Kecepatan pertumbuhan sangat dipengaruhi oleh media (sering kali
disebut medium) tempat tumbuhnya, seperti pH dan kandungan nutrisi, juga
kondisi lingkungan termasuk suhu dan kelembaban udara relatif. Pada fase ini
sel membutuhkan energi lebih banyak dibandingkan fase lainnya, tetapi pada
fase ini justru sel-selnya sangat sensitif terhadap keadaan lingkungan.
4. Fase Pertumbuhan Lambat
Pada fase ini pertumbuhan populasi mikroba diperlambat, karena nutrisi di
dalam media mulai berkurang dan adanya hasil-hasil metabolisme yang
barangkali beracun atau dapat menghambat pertumbuhan mikroba itu sendiri.
Pada fase ini pertumbuhan sel tidak stabil, tetapi populasi mikroba tetap naik
karena jumlah sel yang tumbuh masih lebih banyak daripada sel yang mati.
5. Fase Pertumbuhan Tetap (Statis)
Pada fase ini jumlah sel yang mati seimbang dengan sel yang tumbuh. Hal ini
disebabkan komposisi media tidak memenuhi syarat pertumbuhan dan
kemungkinan adanya racun yang diproduksi oleh mikroba itu sendiri. Ukuran
sel pada fase ini menjadi lebih kecil karena sel tetap membelah meskipun
kekurangan nutrisi.
6. Fase Menuju Kematian dan Fase Kematian
Pada fase ini sebagian populasi mikroba mulai mengalami kematian yang
disebabkan karena tiadanya nutrisi di dalam media dan habisnya energi
umurnya. Kecepatan kematian ini dipengaruhi oleh kondisi nutrisi, lingkungan,
dan jenis mikroba (Nurwantoro, 1997).
Setiap bahan pangan (biasa disebut pangan) selalu mengandung mikroba yang
jumlah dan jenisnya berbeda. Beberapa jenis mikroba yang banyak terdapat dalam
bahan pangan adalah bakteri, kapang, dan khamir.Pertumbuhan mikroba sangat
dipengaruhi oleh berbagai faktor antara lain : faktor fisika, kimia dan biologis.
Faktor-faktor tersebut meliputi:
1. Faktor intrinsik, merupakan sifat-sifat fisika, kimia, dan struktur yang dimiliki
oleh bahan pangan itu sendiri. Faktor intrinsik dalam bahan pangan berupa
kandungan nutrisi, pH pangan, aktivitas air(aw) pangan, potensial reduksi
oksidasi, senyawa antimikroba alamiah dalam pangan, dan struktur biologi;
2. Faktor ekstrinsik, yaitu kondisi lingkungan pada penanganan dan penyimpanan
bahan pangan, seperti suhu kelembaban, susunan gas di atmosfer. Faktor-faktor
ekstrinsik yang berpengaruh terhadap kehidupan mikroba, antara lain suhu,
kelembaban, dan susunan gas di atmosfer;
3. Faktor implisit, yang merupakan sifat-sifat yang dimiliki oleh mikroba itu sendiri.
Faktor ini sangat dipengaruhi oleh susunan biotik mikroba dalam bahan pangan.
Faktor-faktor implisit yang berpengaruh terhadap pertumbuhan mikroba adalah
sinergisme dan antagonisme;
4. Faktor pengolahan, karena perubahan mikroba awal sebagai akibat pengolahan
bahan pangan (misalnya pemanasan, pendinginan, irradiasi, penambahan bahan
pengawet). Mikroba spesifik yang terdapat di dalam bahan-bahan pangan dapat
dikurangi jumlahnya oleh berbagai jenis metode pengolahan atau pengawetan
pangan. Jenis-jenis pengolahan/pengawetan pangan yang berpengaruh terhadap
kehidupan mikroba antara lain suhu tinggi, suhu rendah, penambahan bahan
pengawet, dan irradiasi (pengaruh berbagai metoda pengolahan/pengawetan
2.6 Kinetika Pembentukan Produk
Sangat jarang dijumpai bioproses yang menghasilkan produk tunggal. Setiap
pertumbuhan mikroba selalu diikuti dengan pembentukan produksi satu atau beberapa
metabolit maka reaksi secara keseluruhan selalu stoikiometri serta mengikuti hukum
kekekalan massa. Selain pemantauan biomassa secara serentak juga dilakukan
pengukuran produk metabolit serta berkurangnya substrat persatuan waktu. Hubungan
ini umumnya disajikan dalam bentuk kurva. Hubungan kinetika pertumbuhan dan
pembentukan produk metabolit tergantung pada peranan produk di dalam metabolisme
sel.
Ada tiga pola yang dikenal dalam hubungan tersebut
a.Pola pertumbuhan yang berasosiasi dengan pembentukan produk
Pada umumnya dijumpai pada proses yang produknya merupakan hasil langsung
pada suatu jalur katabolik, misalnya pada fermentasi gula menjadi etanol
b.Pola pembentukan produk yang tidak berasosiasi dengan pertumbuhan
Pada pembentukan produk yang tidak berasosiasi dengan pertumbuhan
umumnya terjadi pada fermentasi yang menghasilkan metabolit sekunder
misalnya pada fermentasi antibiotik dimana pembentukan produk terjadi pada
akhir fermentasi
c.Pola campuran pertumbuhan berasosiasi dan tak berasosiasi
Pada beberapa fermentasi pertumbuhan dan pembentukan produk mempunyai
hubungan sebagian misalnya pada fermentasi asam laktat, pululan dan xanthan.
Pola ini disebut campuran pertumbuhan berasosiasi dan tak berasosiasi, dan laju
pembentukan produk berbanding lurus baik dengan konsentrasi sel maupun laju
pertumbuhan. Model ini dikemukakan oleh Leudeking dan Piret (1959) sehingga
disebut dengan model kinetika Leudeking Piret (Bailey, 1986).
Bioreaktor adalah suatu unit alat yang digunakan untuk tempat berlangsungnya suatu
proses biokimia dari bahan mentah menjadi bahan jadi atau zat tertentu yang
dikehendaki, dikatalisis oleh suatu enzim yang terdapat pada mikroorganisme hidup
atau enzim-enzim terisolasi. Suatu bioreaktor harus dapat memberikan kondisi
optimum kepada mikroba penghasil enzim ataupun enzim terisolasi agar produksi
bahan yang dikehendaki memperoleh hasil maksimum. Untuk itu umumnya suatu
bioreaktor memerlukan pengatur-pengatur suhu, pH dan oksigen terlarut. Di samping
itu diperlukan bahan baku, bahan nutrisi yang cukup dan serasi dengan sifat enzimnya
(Muljono, 1992).
Reaktor biokimia atau bioreaktor diklasifikasikan menjadi dua kategori utama :
1) Fermenter mikrobial
2) Reaktor enzim (Rao,2005).
Dalam kegiatan bioproses terdapat 2 komponen penting yaitu biokatalis enzim
atau sel hayati penghasil enzim dan kondisi lingkungan. Kedua komponen tersebut
sangat penting dan berguna agar katalis dapat bekerja secara optimal. Lingkungan
optimal ini dapat dicapai dengan menempatkan biokatalis dalam wahana yang disebut
bioreaktor atau biofermentor.
Oleh karena itu bioreaktor dan seluruh sistem dalam bioreaktor harus dirancang
sebaik mungkin agar proses yang dilakukan oleh biokatalis dapat berlangsung
seoptimal mungkin. Selama proses suasana reaksi harus dapat dipantau dan
dikendalikan.
Bioreaktor harus memberikan lingkungan fisik sehingga biokatalis dapat
melakukan interaksi dengan lingkungan dan bahan nutrisi yang dimasukkan ke
dalamnya. Dalam praktek dikenal 2 sistem bioreaktor yakni bioreaktor monoseptik
misalnya dalam pembuatan ragi roti (yeast) dimana pembuang limbah (sisa fermentasi)
dari dalam bioreaktor dapat dilakukan tanpa sterilisasi tapi cukup dicuci saja.
Bioreaktor aseptis misalnya dalam pembuatan antibiotik asam-asam amino,
autoklaf. Optimasi pertumbuhan biokatalis dan pembentukan produk dalam bioreaktor
harus memperhatikan faktor-faktor berikut ini
1.PH
2.Suhu
3.Media/Sumber Energi
4.Inhibitor
5.Inokulum yang baik
6.Kondisi fisiko kimiawi yang baik yang optimal
Bioreaktor sebagai wahana proses memegang peran penting dalam industri yang
mendayagunakan reaksi-reaksi biokimia yang dilakukan oleh sel (mikroba, tanaman
atau hewan) sebagai penghasil enzim (Aiba, 1973). Alat atau perlengkapan yang
memberi kondisi untuk berlangsungnya bioreaksi dinamakan pula fermentor. Alat ini
dapat dibuat dalam berbagai tipe. Menurut Denbigh dan Turner, jenis fermentor dapat
digolongkan dalam tipe berikut :
1.Fermentor Batch (FB)
2.Fermentor Teraduk Kontinu (FTK)
3.Fermentor Tubular (FT)
4.Fermentor Bed Cair (FBC)
Perkembangan terciptanya tipe-tipe tersebut sebagian besar dipengaruhi
sifat-sifat dasar mikroorganisme yang sangat bervariasi. Salah satu sifat-sifat mikroorganisme
yang menguntungkan adalah pada umumnya kadar airnya cukup tinggi sekitar
60-95% sehingga kerapatannya hanya berbeda sedikit dari air. Jadi untuk menjaga
suspensi bakteri hanya diperlukan gerakan hidrodinamik yang kecil, antara lain dapat
dilakukan dengan menggerakkan perlahan-lahan cairan sekitarnya dengan alat
pengaduk atau mekanik mengalirkan udara melalui media atau mengoncangnya.
Fermentor tipe batch (FB) adalah jenis yang asli yang mempunyai kelemahan
terutama dalam kecepatan produksi. Kondisi bahan maupun mikroorganisme dalam
sampai pada tingkat tertentu saat pemanenan harus dilakukan untuk proses lebih lanjut,
seperti pemurnian dan lain sebagainya.
Pada fermentor teraduk kontinu terdiri dari deretan bejana silindrik yang
dilengkapi masing-masing dengan alat pengaduk. Pemasukan bahan diberikan ke
dalam bejana secara periodik. Bahan terfermentasi sebagian dipindahkan ke bejana
selanjutnya dalam periode yang sama dalam pemberian pertama. Setelah melalui
bejana, bahan terfermentasi dipanen untuk diproses lebih lanjut. Fermentor demikian
mudah mengontrol pH dan suhunya.
Fermentor tubular terdri dari suatu tabung yang biasanya agak memanjang untuk
menjamin berlangsungnya fermentasi secukupnya selama proses dalam tabung untuk
dipanen pada terminal terakhir. Fermentor demikian umumnya lebih sulit untuk
dilengkapi dengan sarana kontrol kondisi dan penyiapan alatnya sedemikian rupa
sehingga menjamin homogenitas untuk seluruh ruangan dan mengurangi pengaruh
perubahan fisik terhadap waktu proses (Muljono, 1992).
Sistem bioreaktor bagi pertumbuhan mikroorganisme dapat diklasifikasikan
sebagai sistem tertutup atau terbuka. Suatu sistem dipandang tertutup bila bagian
esensial sistem tersebut tidak dapat memasuki atau meninggalkan sistem tersebut. Jadi,
dalam sistem batch tradisional atau sistem fermentasi tertutup, semua komponen
nutrien ditambahkan pada awal proses fermentasi dan sebagai hasilnya, laju
pertumbuhan organisme yang ada di dalamnya akhirnya akan berkurang hingga
mencapai jumlah nol karena penurunan jumlah nutrien atau pemupukan limbah yang
beracun.
Karena alasan inilah, metabolisme organisme dalam proses batch tertutup selalu
berada dalam keadaan berubah-ubah. Akan tetapi, sebagian besar sistem bioteknologi
yang mutakhir akan bekerja sebagai proses batch dengan kondisi yang dibuat optimal
untuk menghasilkan pembentukan maksimal produk yang dikehendaki, misalnya
Ukuran bioreaktor produksi dalam industri berkisar antara 10.000 hingga 20.000
liter walaupun sebuah bioreaktor raksasa yang berukuran 4 juta liter baru-baru ini
diizinkan pembangunannya. Bioreaktor yang berukuran kecil terutama digunakan
untuk menghasilkan produk dengan volume rendah dan harga tinggi, seperti enzim
serta zat-zat kimia tertentu, sementara bioreaktor yang berukuran besar digunakan
secara luas untuk menghasilkan antibiotik, asam-asam organik, dan lain-lain.
Modifikasi pada proses batch tersebut adalah sistem fed-batch dan dalam sistem
ini dapat ditambahkan sejumlah nutrien selama proses fermentasi untuk mengatasi
deplesi nutrien, atau ditambahkan sejumlah senyawa yang baru sebagai aktivator
selektif, misalnya dalam proses membuat ragi untuk industri pembuatan roti. Namun
demikian, sistem tersebut tetap tertutup karena tidak ada aliran keluar yang kontinu.
Berbeda dengan sistem di atas, suatu sistem fermentasi dianggap terbuka bila
semua komponen pada sistem tersebut (seperti organisme dan nutrien) dapat
terus-menerus memasuki dan meninggalkan bioreaktor. Jadi, sistem bioreaktor terbuka atau
aliran kontinu mempunyai masukan media nutrien yang baru dan keluaran biomassa
serta produk lainnya secara kontinu (Smith, 1995).
Dari penelitian yang dilakukan, digunakan alat pengaduk pada proses fermentasi
untuk memutuskan proses terbentuknya asam asetat dengan bantuan bakteri
Acetobacter xylinum sehingga diperoleh hasil vitamin C. Peneliti juga mengatur pH 4-4,5 pada suhu kamar dengan menjaga kondisi optimal bakteri dalam proses biosintesis
vitamin C.
2.8 Acetobacter Xylinum
Acetobacter mempunyai sel-sel yang terbentuk elips atau tongkat yang melengkung.
Acetobacter merupakan bakteri aerob, yang memerlukan respirasi dalam metabolisme.
pada buah-buahan dan sayur-sayuran. Bakteri inilah yang menyebabkan pengasaman
jus buah-buahan dan minuman beralkohol (bir dan anggur) (Banwart,1981).
Spesies Acetobacter yang telah dikenal antara lain : A.aceti, A.orleanensis,
A.liquefasiensis, dan A.xylinum. Meskipun ciri-ciri yang dimiliki hampir sama dengan spesies lainnya. A.xylinum dapat dibedakan dengan spesies yang lainnya karena sifatnya yang unik.
Bila A.xylinum ditumbuhkan pada medium yang mengandung gula, bakteri itu dapat memecah komponen gula dan mampu membentuk suatu polisakarida yang
dikenal dengan selulosa ekstraseluler. Selain itu mempunyai aktivitas oksidasi lanjutan
atau “over oxydizer” yaitu mampu mengoksidasi lebih lanjut asam asetat menjadi CO2
dan H2
Sifat inilah yang umumnya mempunyai sifat “under oxydizer” yaitu hanya
mengubah alkohol menjadi asam asetat. Dalam medium cair Acetobacter xylinum
mampu membentuk suatu lapisan yang dapat mencapai ketebalan beberapa sentimeter.
Bakteri terperangkap dalam massa benang-benang yang dibuatnya. Untuk
menghasilkan massa yang kokoh, kenyal, tebal, putih dan tembus pandang perlu
diperhatikan suhu fermentasi (inkubasi), komposisi medium dan pH medium. O.
Menurut Warisno, biakan murni Acetobacter xylinum digunakan sebagai starter yang bisa mensintesa air kelapa hingga menjadi nata de coco. Biakan murni ini bisa
diperbanyak menjadi bibit atau starter. Bibit atau starter berisi mikroba dengan jumlah
dan kondisi fisiologis yang siap diinokulasi ke dalam media fermentasi (Daulay,2003).
Berdasarkan metabolisme di atas, terjadi reaksi enzimatis dimana substrat glukosa
dapat diubah menjadi D-sorbitol melalui proses hidrogenasi dengan pengaturan
tekanan pada 80-125 atm, suhu 140°C - 150°C dan penggunaan katalis Ni. Selanjutnya
D-sorbitol diubah menjadi L-asam askorbat dengan bantuan enzim yang dihasilkan
oleh bakteri. Adapun enzim-enzim yang dihasilkan oleh bakteri dalam proses
biosintesis vitamin C sebagai berikut :
1. Enzim D-sorbitol dehydrogenase pada proses perubahan D-sorbitol menjadi
2. Enzim sorbose dehydrogenase pada proses perubahan sorbose menjadi
L-sorbosone
3. Enzim L-sorbosone dehydrogenase pada proses perubahan L-sorbosone menjadi
2-keto-L-gulonic acid
Selanjutnya melalui proses esterifikasi/laktonisasi, 2-keto-L-gulonic acid dapat diubah
menjadi L-asam askorbat (Hancock, 2002).
2.10 Metoda Hitungan Cawan
Metoda hitungan cawan didasarkan pada anggapan bahwa setiap sel yang dapat hidup
akan berkembang menjadi suatu koloni. Jumlah koloni yang muncul pada cawan
merupakan suatu indeks jumlah mikroba yang hidup terkandung dalam sampel. Hal
yang perlu dikuasai dalam hal ini adalah teknik pengenceran. Setelah inkubasi, jumlah
koloni masing-masing cawan diamati. Untuk memenuhi persyaratan statistik, cawan
yang dipilih untuk dihitung mengandung 30-300 koloni. Untuk memenuhi persyaratan
tersebut harus melakukan sederetan pengenceran dan pencawanan. Jumlah mikroba
dalam sampel ditentukan dengan mengalikan jumlah koloni dengan faktor pengenceran
pada cawan yang bersangkutan.
Prinsip dari metoda hitungan cawan adalah bila sel mikroba yang masih hidup
ditumbuhkan pada medium, maka mikroba tersebut akan berkembang biak dan
membentuk koloni yang dapat dilihat langsung, dan kemudian dihitung tanpa
menggunakan mikroskop. Metoda ini merupakan cara yang paling sensitif untuk
menentukan jumlah jasad renik, dengan alasan :
- Hanya sel mikroba yang hidup yang dapat dihitung
- Beberapa jasad renik dapat dihitung sekaligus
- Dapat digunakan untuk isolasi dan identifikasi mikroba, karena koloni yang
terbentuk mungkin berasal dari mikroba yang mempunyai penampakan spesifik
Selain keuntungan-keuntungan tersebut di atas, metoda hitungan cawan juga memiliki
- Hasil perhitungan tidak menunjukkan jumlah sel yang sebenarnya, karena
beberapa sel yang berdekatan mungkin membentuk koloni
- Medium dan kondisi inkubasi yang berbeda mungkin menghasilkan jumlah yang
berbeda pula
- Mikroba yang ditumbuhkan harus dapat tumbuh pada medium padat dan
membentuk koloni yang kompak, jelas, tidak menyebar
- Memerlukan persiapan dan waktu inkubasi relatif lama sehingga pertumbuhan
koloni dapat dihitung
Dalam metoda hitungan cawan, bahan yang diperkirakan mengandung lebih dari
300 sel mikroba per ml atau per gram atau per cm (jika pengambilan sampel dilakukan
pada permukaan), memerlukan perlakuan pengenceran sebelumnya ditumbuhkan pada
medium agar di dalam cawan petri. Setelah inkubasi, akan terbentuk koloni pada
cawan tersebut dalam jumlah yang dapat dihitung, di mana jumlah yang terbaik adalah
di antara 30 sampai 300 koloni. Pengenceran biasanya dilakukan secara desimal, yaitu
1:10, 1:100, 1:1000, dan seterusnya. Larutan yang digunakan untuk pengenceran dapat
berupa larutan buffer fosfat, 0,85% NaCl atau larutan Ringer. Metoda hitungan cawan
dibedakan atas dua cara, yakni metoda tuang (pour plate) dan metoda permukaan
(surface/spread plate) (Waluyo,L.,2010).
2.11 Metoda Analisa Vitamin C
Metoda analisa vitamin C dalam bahan pangan dapat dikelompakkan menjadi beberapa
metoda.
1. Metoda fisika
a. Metoda spektroskopi
Metoda ini berdasarkan pada kemampuan vitamin C yang terlarut dalam air untuk
menyerap sinar ultraviolet, dengan panjang gelombang maksimum 265 nm. Karena
dengan cara ini harus dilakukan secepat mungkin. Untuk memperbaiki hasil
pengukuran, sebaiknya ditambahkan senyawa pereduksi yang lebih kuat dari vitamin C.
Hasil terbaik diperoleh dengan menambahkan sejumlah ekuimolar (kira-kira) larutan
KCN (sebagai stabilizer) ke dalam larutan vitamin.
b. Metoda polarografik
Metoda ini berdasarkan pada potensial oksidasi asam askorbat dalam larutan asam atau
bahan pangan yang bersifat asam, misalnya ekstrak buah-buahan dan sayuran.
2. Metoda Kimia
Metoda kimia merupakan cara pengukuran vitamin C paling banyak macamnya dan
paling sering digunakan. Sebagian besar metode kimia didasarkan pada kemampuan
vitamin C karena senyawa dehidro asam askorbat (memiliki aktivitas vitamin C
sebesar 80%) tidak bersifat pereduksi, maka untuk mengukur vitamin C dalam bahan
pangan terlebih dahulu harus dilakukan perlakuan pendahuluan menggunakan senyawa
pereduksi seperti H2S untuk mengubah dehidro asam askorbat menjadi asam askorbat.
Di samping itu, terdapat sejumlah vitamin C yang terikat dengan komponen protein
dan bersifat non pereduksi. Bentuk terikat ini harus dibebaskan lebih dahulu dalam
penentuan kandungan vitamin C dalam suatu bahan.
3. Metoda Biokimia (Metoda asam askorbat oksidase)
Metoda ini berdasarkan kemampuan enzim asam askorbat oksidase untuk
mengoksidasi asam askorbat. Reaksi oksidasi ini ternyata tidak bersifat spesifik untuk
menghasilkan hasil yang memuaskan karena enzim tersebut dapat juga mengoksidasi
komponen-komponen organik lain yang terdapat dalam ekstrak jaringan hewan,
terutama senyawa organik yang dapat mereduksi biru metilen (methyken blue). Lebih
lanjut dibuktikan bahwa enzim asam askorbat yang diisolasi dari labu tidak bereaksi
4. Metoda Biologi
Walaupun banyak diganti dengan metoda fisika dan kimia untuk menentukan vitamin
C, metoda biologi tetap merupakan metoda penentuan vitamin C yang paling realistis
dan paling mendekati kebenaran
5. Larutan 2,6-diklorofenol indofenol dalam suasana netral atau basis akan berwarna
biru sedang dalam suasana asam akan berwarna merah muda. Apabila 2,6-diklorofenol
indofenol direduksi oleh asam askorbat maka akan menjadi tidak berwarna, dan bila
semua asam askorbat sudah mereduksi 2,6-diklorofenol indofenol maka kelebihan
larutan 2,6-diklorofenol indofenol sedikit saja sudah akan terlihat dengan terjadinya
pewarnaan. Untuk perhitungan maka perlu dilakukan standarisasi larutan dengan
vitamin C standar (Sudarmadji, 1989).
Dalam metoda biologi untuk mengukur vitamin C, hewan percobaan yang
digunakan hanya marmot (guinea pigs). Jika mereka diberi ransum tanpa vitamin C,
dalam waktu 2-3 minggu akan menderita Scurvy.
Terdapat 3 cara pengukuran biologis dengan menggunakan guinea pigs yaitu:
a. Metoda preventif, untuk mengukur jumlah terkecil vitamin C yang dapat mencegah
timbulnya tanda-tanda Scurvy secara makro, misalnya penurunan berat badan.
b. Metoda kuratif, untuk mengukur jumlah vitamin C terkecil untuk menyembuh
guinea pigs yang menderita Scurvy
c. Metoda histology, memeriksa gigi guinea pigs, lapisan odontoblas tidak teratur,
terjadi pengapuran predentive dan terbentuk lapisan tulang yang tidak beraturan di
antara odontoblast dan predentive
2.12 Penentuan Vitamin C secara Metoda Spektroskopi Ultraviolet-Sinar Tampak
Prinsip spektroskopi didasarkan adanya interaksi dari energi radiasi elektromagnetik
dengan zat kimia. Dengan mengetahui interaksi yang terjadi, dikembangkan
teknik-teknik analisis kimia yang memanfaatkan sifat-sifat dari interaksi tersebut. Hasil
interaksi tersebut bisa menimbulkan satu atau lebih peristiwa seperti : pemanasan,
pembiasan, interferensi, difraksi, penyerapan (absorpsi), fluoresensi, fosforiensi dan
ionisasi. Dalam analisis kimia, peristiwa absorpsi merupakan dasar dari cara
spektroskopi karena proses absorpsi tersebut bersifat unik/spesifik untuk setiap zat
kimia atau segolongan zat kimia (aplikasi kualitatif). Di samping itu adalah kenyataan
bahwa banyaknya absorpsi berbanding lurus dengan banyaknya zat kimia (aplikasi
kuantitatif) (Sudarmadji, 1989).
Radiasi ultraviolet dan sinar tampak diabsorpsi oleh molekul organik aromatik,
molekul yang mengandung elektron-π terkonjugasi dan/atau atom yang mengandung
elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat energi
elektron dasar ke tingkat energi elektron tereksitasi lebih tinggi. Besarnya absorban
radiasi tersebut sebanding dengan banyaknya molekul analit yang mengabsorpsi dan
dapat digunakan untuk analisa kuantitatif. Frekuensi radiasi ultraviolet dan sinar
tampak, terletak antara 1,5x108 Hz sampai 4,28x107 Hz, dengan panjang gelombang
antara 200 nm sampai 700 nm, serta energi yang besarnya antara 9,939x10-26 joule
sampai 2,836x10-26
aromatik, molekul yang mengandung elektron-π terkonjugasi dan/atau molekul
heterosiklik mengandung atom dengan elektron-n, untuk meningkatkan elektron dalam
orbit molekul terluarnya ke tingkat tereksitasi. Kegunaan spektrofotometri ultraviolet
dan sinar tampak dalam analisis kualitatif sangat terbatas, karena rentang daerah
radiasi yang relatif sempit (500 nm) hanya dapat mengakomodasi sedikit sekali puncak
absorpsi maksimum dan minimum, karena itu identifikasi senyawa yang tidak
diketahui, tidak memungkinkan.