ANALISIS KERAGAMAN GENETIK BAKTERI
Xanthomonas
oryzae
pv.
oryzae
DENGAN TEKNIK
AMPLIFIED rDNA
RESTRICTION ANALYSIS
(ARDRA) GEN 16S-rRNA
SHERRYN SUNNY ALBANNY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Keragaman Genetik Bakteri Xanthomonas oryzae pv. oryzae dengan Teknik Amplified rDNA Restriction Analysis (ARDRA) Gen 16S-rRNA adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Sherryn Sunny Albanny
ABSTRAK
SHERRYN SUNNY ALBANNY. Analisis Keragaman Genetik Bakteri
Xanthomonas oryzae pv. oryzae dengan Teknik Amplified rDNA Restriction Analysis (ARDRA) Gen 16S-rRNA. Dibimbing oleh I MADE ARTIKA dan YADI SURYADI.
Xanthomonas oryzae pv. oryzae (Xoo) merupakan penyebab penyakit hawar daun bakteri (HDB) pada padi. Sebanyak lima belas isolat Xoo yang berasal dari beberapa daerah di Indonesia, dianalisis keragaman genetiknya menggunakan teknik amplified rDNA restriction analysis (ARDRA) gen 16S-rRNA. Analisis keragaman genetik ini bertujuan mengidentifikasi kekerabatan Xoo secara genetik sehingga dapat dijadikan acuan bagi pengembangan tanaman tahan hawar daun bakteri (HDB). Gen 16S-rRNA diamplifikasi dari genom Xoo, kemudian dipotong dengan enzim restriksi RsaI sehingga membentuk pola ARDRA. Pola ARDRA dijadikan data biner sebagai input untuk konstruksi pohon filogenetika. Berdasarkan pohon filogenetik yang terbentuk, berbagai isolat memiliki kekerabatan yang cukup dekat. Isolat 1/96 dan 61 memiliki kekerabatan yang cukup dekat dengan isolat 29D, 59, dan 60 meskipun berasal dari daerah yang berbeda-beda. Isolat lain yang memiliki kekerabatan cukup dekat yaitu isolat 5 dengan isolat 23D, 28D, 10, 8, dan isolat 6 dengan isolat 3 dan 2. Kelompok kekerabatan tersebut menunjukkan keragaman genetik isolat Xoo yang diuji cukup tinggi.
Kata kunci: keragaman genetik, Xanthomonas oryzae, 16S-rRNA, ARDRA
ABSTRACT
SHERRYN SUNNY ALBANNY. Genetic Diversity Analysis of Xanthomonas oryzae pv. oryzae by Using Amplified rDNA Restriction Analysis (ARDRA) Technique 16S-rRNA Gene. Supervised by I MADE ARTIKA and YADI SURYADI.
Xanthomonas oryzae pv. oryzae (Xoo) causes bacterial leaf blight (BLB) of rice. Fifteen Xoo from several regions in Indonesia were analyzed their genetic diversity by using amplified rDNA restriction analysis (ARDRA) technique of 16S-rRNA gene. The aim of this analysis is to identify the genetic diversity of
Xoo and can be used as a reference for HDB-resistance plant research. An amplified 16S-rRNA gene from Xoo was cut by using RsaI restriction enzyme and formed ARDRA pattern. ARDRA pattern was further used as the binary data for the construction of phylogenetics tree. Phylogenetics tree showed that the genetic relationship of the isolates was quite close. Isolate of 1/96 and 61 are close enough to 29D, 59, and 60 isolates although they are from different regions. Other isolates showed close relation are isolate 5 to 23D, 28D, 10, 8, and isolate 6 to 3 and 2 isolates. The genetic cluster quantity showed the genetic diversity of Xoo analyzed is quite high.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ANALISIS KERAGAMAN GENETIK BAKTERI
Xanthomonas
oryzae
pv.
oryzae
DENGAN TEKNIK
AMPLIFIED rDNA
RESTRICTION ANALYSIS
(ARDRA) GEN 16S-rRNA
SHERRYN SUNNY ALBANNY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Keragaman Genetik Bakteri Xanthomonas oryzae pv. oryzae dengan Teknik Amplified rDNA Restriction Analysis
(ARDRA) Gen 16S-rRNA Nama : Sherryn Sunny Albanny NIM : G84090028
Disetujui oleh
Dr Ir Made Artika, M.App.Sc Pembimbing I
Ir Yadi Suryadi, M.Sc Pembimbing II
Diketahui oleh
Dr Ir Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Februari 2013 ini adalah Analisis Keragaman Genetik Bakteri Xanthomonas oryzae pv. oryzae dengan Teknik
amplified rDNA restriction analysis (ARDRA) Gen 16S-rRNA.
Terima kasih penulis ucapkan kepada Bapak Dr Ir I Made Artika, M.App.Sc dan Bapak Ir Yadi Suryadi, M.Sc selaku pembimbing, serta Ibu Dwi N. Susilowati yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Jajang, Ibu Aminah beserta staf Konservasi Mikrobiologi BB-Biogen yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN ... 1
METODE ... 2
Bahan ... 2
Alat ... 3
Prosedur Analisis ... 3
HASIL DAN PEMBAHASAN ... 5
Hasil ... 5
Pembahasan ... 9
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
LAMPIRAN ... 15
DAFTAR TABEL
1 Isolat Xanthomonas oryzae pv. oryzae dari beberapa wilayah di Indonesia 2
2 Pengelompokkan ukuran pola pita hasil pemotongan dengan enzim restriksi RsaI 7
3 Data biner pola pita hasil pemotongan dengan enzim restriksi RsaI 8
DAFTAR GAMBAR
1 Hasil peremajaan Xanthomonas oryzae pv. oryzae dalam Wakimoto agar miring 52 Elektroforegram hasil isolasi DNA Xoo 5
3 Amplikon Gen 16S-rRNA Xanthomonas oryzae pv. oryzae 6
4 Hasil pemotongan gen 16S-rRNA Xoo dengan enzim restriksi RsaI 6
5 Interpretasi elektroforegram hasil pemotongan gen 16S-rRNA dengan enzim restriksi RsaI dan pola ARDRA yang terbentuk 7
PENDAHULUAN
Bakteri Xanthomonas oryzae pv. oryzae (Xoo) merupakan penyebab penyakit hawar daun bakteri (HDB) pada padi. Bakteri ini merupakan bakteri Gram negatif yang berbentuk batang pendek, bersifat aerob, tidak membentuk spora, dan mempunyai satu flagel di ujung yang berfungsi sebagai alat gerak. Koloni Xoo berlendir, bentuk koloni pada medium biakan adalah bulat, cembung dan berdiameter 1-3 mm, menghasilkan pigmen berwarna kuning yang merupakan pigmen xanthomonadin (Liu et al. 2006). Lendir yang dihasilkan bakteri ini dapat mengeras menjadi butiran kecil pada permukaan daun yang terinfeksi. Suhu optimum untuk pertumbuhan bakteri Xoo berkisar antara 25-30 ºC dan suhu minimumnya berkisar 5-10 ºC. Permukaan daun yang lembab akan mensuspensikan sel bakteri sehingga sel bakteri tersebut dapat tersebar bebas. Bakteri Xoo dapat bertahan dalam tanah selama 1-3 bulan, sedangkan dalam benih selama 7-8 bulan (CABI 2008).
Bakteri Xoo merupakan patogen terbawa benih pada padi. Bakteri ini menyebabkan penyakit hawar daun bakteri (HDB) yang dapat diawali dari benih padi yang telah terinfeksi Xoo. Benih atau tanaman muda yang terinfeksi Xoo
hingga layu (kresek) mirip dengan kerusakan awal oleh penggerek batang. Namun, serangan penggerek gejalanya lebih dahulu timbul pada daun muda, sedangkan HDB pada daun-daun tua. Beberapa kerugian yang ditimbulkan patogen terbawa benih tersebut diantaranya menjadi sumber patogen bagi benih lain yang belum terinfeksi, media penyebaran patogen ke lokasi yang baru, dan merupakan awal perkembangan penyakit pada tanaman yang sedang berkembang (Semangun 2007).
Penyakit HDB dapat menyebabkan kehilangan hasil panen sampai 60% jika terjadi serangan yang parah, dalam kondisi lingkungan dengan angin kencang, dan lembab. Wilayah tropis dan beriklim sedang pada umumnya sering mendapat serangan HDB (Sakthivel et al. 2001). Pada tingkat keparahan 20%, sebulan sebelum panen, penyakit sudah mulai menurunkan hasil. Hasil padi turun 4% setiap kali penyakit bertambah parah 10%. Serangan HDB dapat terjadi pada fase benih, tanaman muda, dan tanaman dewasa. Serangan ini menyebabkan turunnya produksi padi. Lahan yang terserang penyakit HDB sangat luas, khususnya di Indonesia. Tahun 2006, luas lahan di Indonesia yang terserang HDB sebesar 74.243 ha. Tahun 2010, luas lahan yang terserang HDB sebesar 54.796 ha, dan serangan ini meningkat pada masa tanam 2010-2011 menjadi sebesar 64.123 ha (Direktorat Perlindungan Tanaman 2011).
2
Penggunaan teknik molekuler untuk karakterisasi patogen tumbuhan perlu dikembangkan karena cepat dan sensitif. Salah satu teknik dalam karakterisasi DNA patogen yaitu teknik hibridisasi DNA secara radioaktif. Namun, teknik tersebut memiliki kendala dalam hal penanganan limbah radioaktif. Teknik molekuler yang lebih aman dalam deteksi patogen tumbuhan yaitu menggunakan primer spesifik dan PCR yang dikembangkan dari sekuen 16S-rRNA. Analisis polimorfik DNA secara langsung lainnya merupakan teknik untuk deteksi patogen tertentu dari berbagai wilayah (Pangastuti 2006).
Analisis keragaman genetik menggunakan gen 16S-rRNA dapat dilakukan dengan metode restriction fragment length polymorphism (RFLP). Metode RFLP adalah analisis pengukuran perbedaan panjang fragmen DNA yang dihasilkan oleh pemotongan enzim restriksi. Analisis RFLP pada gen 16S-rRNA disebut
amplified rDNA restriction analysis (ARDRA). PCR 16S-rRNA ini berguna untuk membedakan antara organisme prokariot dengan eukariot. Organisme prokariot akan menghasilkan pita amplifikasi gen 16S-rRNA sedangkan eukariot tidak. Pemotongan dengan enzim restriksi dilakukan setelah PCR 16S-rRNA tersebut. Berdasarkan pola pita yang dihasilkan dari pemotongan enzim restriksi dapat direkonstruksi pohon filogenetik yang akan mengelompokkan bakteri berdasarkan jarak kekerabatannya (Sari 2007).
Penelitian ini bertujuan mengidentifikasi keragaman genetik isolat bakteri
Xanthomonas oryzae pv. oryzae dari beberapa daerah di Indonesia dengan teknik
amplified rDNA restriction analysis (ARDRA) gen 16S-rRNA. Hasil identifikasi keragaman genetik isolat bakteri Xoo dari berbagai daerah di Indonesia, diharapkan dapat membantu pengembangan varietas padi tahan HDB dalam rangka pengendalian penyakit HDB.
METODE
Bahan
Bahan-bahan yang digunakan adalah 15 isolat bakteri Xoo yang berasal dari beberapa daerah di Indonesia (Tabel 1), kentang, pepton, agar, Ca(NO3)2.4H2O, Na2HPO4.12H2O, sukrosa, media Nutrient Broth, bufer STE, larutan SDS 10%, Proteinase-K, larutan fenol, kloroform, EtOH 95%, bufer TE, bufer TAE 0.5x pH 7.5, agarosa, akuades steril, pewarna blue juice, marker 100bp DNA ladder, EtBr, Go Taq master mix (Kappa), primer 63F (5’ CAG GCC TAA CAC ATG CAA GTC 3’) dan 1387R (5’ GGG CGG WGT GTA CAA GGC 3’), enzim restriksi
RsaI, bufer tango, dan nuclease free water (ddH2O).
Alat
Alat-alat yang digunakan adalah tabung reaksi, tabung ulir, shaker, jarum ose, tabung eppendorf, labu Erlenmeyer, pipet mikro, tip, pengaduk magnetik, neraca analitik OHAUS GA 200, laminar air flow cabinet, pH meter, autoklaf,
3
Tabel 1 Isolat Xanthomonas oryzae pv. oryzae dari beberapa wilayah di Indonesia
Kode Isolat Asal Isolat Lokasi
1 Inpari 18 Jatisari, Karawang
2 Inpari 18 Cikalong wetan, Karawang
3 C4 Gantar, Indramayu
4 Mentikwangi Pabelan, Magelang
5 Lokal Kaliduren, Doroyudan
6 Ciherang Kepanjen, Klaten
8 Ciherang Mayudan
10 Ciherang Sukamandi Jaya, Subang
23D Inpari10 Pusakaratu, Subang yang berisi 100 mL akuades. Kentang dimasukkan ke dalam microwave pada suhu ± 100 ºC sampai kentang tersebut empuk untuk diambil sarinya. Sari kentang disaring kemudian ditambahkan kedalam 150 mL akuades. Sebanyak 0.125 g Ca(NO3)2.4H2O, 0.5 g Na2HPO4.12H2O, 3.75 g sukrosa, dan 1.25 g pepton dicampurkan kedalam campuran akuades dan sari kentang. Campuran tersebut diaduk menggunakan pengaduk magnetik sampai semua bahan larut. Selanjutnya pH larutan diukur menggunakan pH meter dan dibuat bernilai 7-8. Jika nilai pH dibawah 7 maka larutan ditambahkan NaOH 1N. Jika nilai pH diatas 8 maka larutan ditambahkan HCl 1N. Setelah nilai pH konstan, sebanyak 7.5 g agar ditambahkan ke dalam larutan tersebut kemudian dipanaskan dalam microwave hingga larut. Media yang telah larut dimasukkan ke dalam tabung reaksi sebanyak 8 mL kemudian disterilisasi dalam autoklaf pada tekanan 1 atm dan suhu 121 ºC selama 2 jam. Tabung reaksi kemudian dimiringkan dan didiamkan satu malam.
Peremajaan Isolat Xoo (IRRI 1996)
Isolat Xoo yang berada di agar miring diremajakan dengan cara dipindahkan sebanyak satu ose penuh ke dalam WA agar miring yang telah dibuat sebelumnya. Peremajaan ini dilakukan secara steril. Isolat bakteri yang telah berada di agar miring kemudian dibiarkan tumbuh selama kurang lebih 3-5 hari pada suhu ± 25 ºC sampai muncul koloni berwarna kuning dan berlendir.
Isolasi DNA Genom (Lazo et al. modifikasi 1987)
4
STE kemudian ditambahkan 40 µL larutan SDS 10%. Suspensi diinkubasi dalam oven pada suhu 65 ºC selama 1 jam 30 menit lalu didinginkan pada suhu ruang. Suspensi ditambahkan 4 µL 10 mg/mL Proteinase-K lalu diinkubasi dalam oven pada suhu 37 ºC selama minimal 4 jam.
Suspensi ditambahkan 200-400 µL bufer STE. Selanjutnya suspensi tersebut ditambahkan larutan fenol dan kloroform masing-masing sebanyak 120 µL. Tahap ini dilakukan secara perlahan sampai terbentuk emulsi. Suspensi yang telah teremulsi lalu disentrifus pada kecepatan 12000 rpm selama 15 menit atau 8000 rpm selama 15 menit. Supernatan mengandung DNA dipindahkan ke tabung mikro steril dan dipresipitasi dengan menambahkan EtOH 95% dingin sebanyak 2x volume supernatan. Suspensi selanjutnya diinkubasi pada suhu -20 ºC selama 30 menit. Suspensi disentrifus pada kecepatan 8000 rpm selama 2 menit lalu supernatannya dibuang. Pelet dikeringudarakan selama kurang lebih 2 jam. DNA hasil pengeringan pelet diresuspensi dalam 20 µL bufer TE yang mengandung 10 µg/mL RNase. DNA disimpan pada suhu -20 ºC untuk digunakan pada tahap selanjutnya.
Amplifikasi Gen 16S-rRNA (Wahyudi et al. 2011)
Sebanyak 2 µL DNA ditambahkan dengan 10 µL nuclease free water. Volume total reaksi PCR sebanyak 20 µL. Campuran bahan-bahan untuk PCR atau cocktail terdiri dari 2 µL DNA, 12,5 µL Go Taq master mix, masing-masing 1 µL primer 63F dan 1387R, dan 8,5 µL ddH2O. Amplifikasi dilakukan pada kondisi suhu denaturasi awal 94 ºC selama 5 menit dengan 1 siklus, denaturasi 94 ºC selama 1 menit 30 detik, annealing 55 ºC selama 45 detik, dan ekstensi 72 ºC selama 1 menit dengan 30 siklus, ekstensi akhir 72 ºC selama 1 menit dengan 1 siklus, dan ditahan 15-4 ºC selama beberapa menit.
Digesti dengan Enzim Restriksi RsaI (Susilowati et al. 2010)
Hasil amplifikasi gen 16S-rRNA dari masing-masing sampel dipotong dengan enzim restriksi RsaI (5’-GTAC). Reaksi pemotongan terdiri atas 10 µL produk PCR, 18 µL ddH2O, 2 µL 10x buffer tango, dan 1 µL enzim restriksi. Campuran tersebut diinkubasi pada suhu 37 ºC selama ± 20 jam. Hasil pemotongan dielektroforesis lalu divisualisasi di bawah UV transiluminator.
Elektroforesis gel agarosa (Susilowati et al. 2010)
Elektroforesis gel agarosa dimulai dengan pembuatan gel agarosa yang terdiri dari campuran 1.8 g agarosa dan 100 mL bufer TAE 0.5x. Campuran tersebut kemudian dipanaskan dalam microwave hingga larut. Setelah larut, campuran tersebut dituang ke dalam cetakan pembuat gel elektroforesis lalu disisipi dengan sisir atau comb untuk membentuk sumur. Gel agarosa ditunggu sampai mengeras selama kurang lebih satu jam. Setelah mengeras, gel agarosa diangkat dan dipindahkan ke dalam tangki elektroforesis. Sebanyak masing-masing 3 µL loading dye dan produk PCR 16S-rRNA hasil digesti enzim restriksi dimasukkan ke dalam sumur gel. Marker VC 100 bp + DNA ladder sebanyak 2 µL dicampur dengan loading dye lalu dimasukkan ke dalam sumur gel. Hasil elektroforesis divisualisasi dengan EtBr di bawah UV transiluminator. Elektroforegram dijadikan data biner terhadap pola pita yang terbentuk dan dibuat pohon filogenetiknya menggunakan program MVSP 3.2 dengan metode
5
HASIL DAN PEMBAHASAN
Hasil
Hasil Peremajaan Xanthomonas oryzae pv. oryzae (Xoo)
Sebanyak 15 isolat Xoo kultur koleksi Konservasi Mikrobiologi BB-Biogen yang berasal dari beberapa daerah di Indonesia, diremajakan ke media Wakimoto agar miring. Isolat kemudian diinkubasi pada suhu ruang selama 3-5 hari sehingga menghasilkan lendir berwarna kuning seperti pada Gambar 1.
Gambar 1 Hasil peremajaan Xanthomonas oryzae pv. oryzae dalam Wakimoto agar miring
Hasil Isolasi DNA
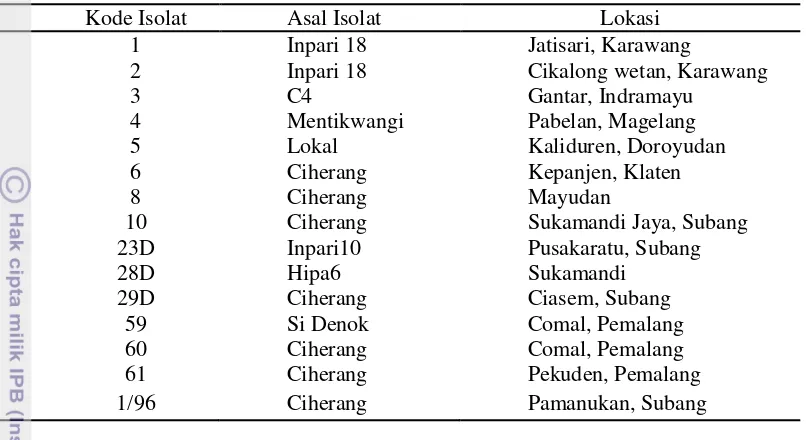
Isolat Xoo yang telah diremajakan selanjutnya diisolasi DNA genomnya menggunakan metode Lazo et al. modifikasi (1987). Elektroforegram hasil isolasi DNA ditunjukkan pada Gambar 2.
Gambar 2 Elektroforegram hasil isolasi DNA Xoo. Kode isolat 1 (Karawang), 2 (Karawang), 3 (Indramayu), 4 (Magelang), 5 (Doroyudan), 6 (Klaten), 8 (Mayudan), 10 (Subang), 23D (Subang), 28D (Sukamandi), 29D (Subang), 59 (Pemalang), 60 (Pemalang), 61 (Pemalang), 1/96 (Subang).
6
Amplikon Gen 16S-rRNA
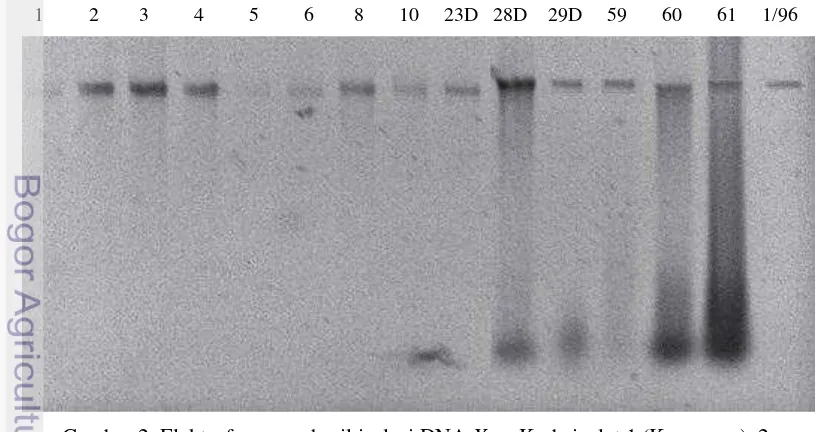
Pita-pita DNA dalam elektroforegram menunjukkan bahwa DNA tersebut dapat digunakan sebagai cetakan untuk amplifikasi. Gen 16S-rRNA diamplifikasi dengan PCR sehingga menghasilkan produk PCR yang berada pada kisaran 1400-1500 bp (Gambar 3).
Gambar 3 Amplikon Gen 16S-rRNA Xanthomonas oryzae pv. oryzae. Kode isolat 1 (Karawang), 2 (Karawang), 3 (Indramayu), 4 (Magelang), 5 (Doroyudan), 6 (Klaten), 8 (Mayudan), 10 (Subang), 23D (Subang), 28D (Sukamandi), 29D
(Subang), 59 (Pemalang), 60 (Pemalang), 61 (Pemalang), 1/96 (Subang).
Amplified rDNA Restriction Analysis (ARDRA)
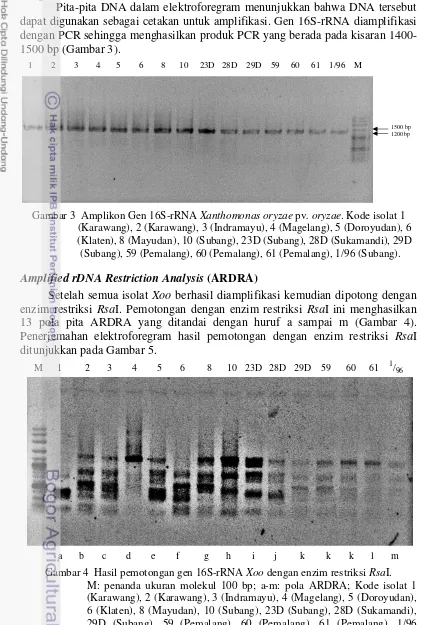
Setelah semua isolat Xoo berhasil diamplifikasi kemudian dipotong dengan enzim restriksi RsaI. Pemotongan dengan enzim restriksi RsaI ini menghasilkan 13 pola pita ARDRA yang ditandai dengan huruf a sampai m (Gambar 4). Penerjemahan elektroforegram hasil pemotongan dengan enzim restriksi RsaI ditunjukkan pada Gambar 5.
Gambar 4 Hasil pemotongan gen 16S-rRNA Xoo dengan enzim restriksi RsaI. M: penanda ukuran molekul 100 bp; a-m: pola ARDRA; Kode isolat 1 (Karawang), 2 (Karawang), 3 (Indramayu), 4 (Magelang), 5 (Doroyudan), 6 (Klaten), 8 (Mayudan), 10 (Subang), 23D (Subang), 28D (Sukamandi), 29D (Subang), 59 (Pemalang), 60 (Pemalang), 61 (Pemalang), 1/96 (Subang).
1 2 3 4 5 6 8 10 23D 28D 29D 59 60 61 1/96 M
1500bp 1200 bp
M 1 2 3 4 5 6 8 10 23D 28D 29D 59 60 61 1/96
7
Gambar 5 Penerjemahan elektroforegram hasil pemotongan gen 16S-rRNA dengan enzim restriksi RsaI dan pola ARDRA yang terbentuk
Penghitungan ukuran pita hasil pemotongan dengan enzim restriksi dilihat berdasarkan marker yang digunakan. Ukuran pita terbesar 3000 bp terdapat pada kode isolat 4 sedangkan pita terkecil 200 bp terdapat pada hampir setiap kode isolat (Tabel 2). Sebanyak 13 pola ARDRA yang terbentuk dari hasil pemotongan dengan enzim restriksi dijadikan data biner sebagai input data untuk pembentukan pohon filogenetik (Tabel 3).
Tabel 2 Pengelompokkan ukuran pola pita hasil pemotongan dengan enzim restriksi RsaI
Pola pita Ukuran basa (bp)
a 200, 700, 400
b 200, 500, 600, 900, 1300-1400
c 200, 400, 500, 600, 900, 1300-1400
d 1300-1400, 3000
e 200, 400, 500, 700, 900, 1300-1400
f 200, 500, 600, 900
g 200, 500, 600, 700, 900, 1200, 1300-1400
h 200, 500, 900, 1200, 1300-1400
i 200, 700, 900, 1200, 1300-1400
j 200, 400, 700, 900, 1200, 1300-1400
k 200, 600, 900, 1300-1400
l 200, 900, 1300-1400
m 600, 900, 1300-1400
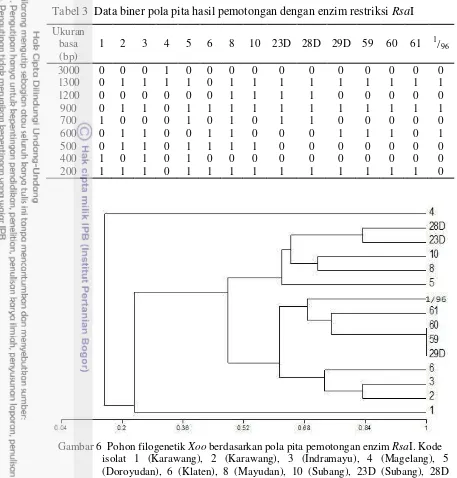
Data biner selanjutnya dimasukkan ke dalam software MVSP 3.2 dengan metode unweighted pair group method arithmetic mean (UPGMA) untuk pembentukan pohon filogenetik. Pohon filogenetik berdasarkan pola pita ARDRA yang terbentuk menunjukkan dua klaster dari 15 isolat Xoo yang diuji. Satu isolat masuk ke dalam klaster pertama yaitu 4 sedangkan isolat lainnya masuk ke dalam klaster kedua yaitu 1, 2, 3, 5, 6, 8, 10, 23D, 28D, 29D, 59, 60, 61, dan 1/96. Klaster kedua memiliki beberapa percabangan kecil yang menunjukkan hubungan kekerabatan antar isolat (Gambar 6).
8
Tabel 3 Data biner pola pita hasil pemotongan dengan enzim restriksi RsaI
Ukuran basa (bp)
1 2 3 4 5 6 8 10 23D 28D 29D 59 60 61 1/96
3000 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0
1300 0 1 1 1 1 0 1 1 1 1 1 1 1 1 1
1200 0 0 0 0 0 0 1 1 1 1 0 0 0 0 0
900 0 1 1 0 1 1 1 1 1 1 1 1 1 1 1
700 1 0 0 0 1 0 1 0 1 1 0 0 0 0 0
600 0 1 1 0 0 1 1 0 0 0 1 1 1 0 1
500 0 1 1 0 1 1 1 1 0 0 0 0 0 0 0
400 1 0 1 0 1 0 0 0 0 0 0 0 0 0 0
200 1 1 1 0 1 1 1 1 1 1 1 1 1 1 0
Gambar 6 Pohon filogenetik Xoo berdasarkan pola pita pemotongan enzim RsaI. Kode isolat 1 (Karawang), 2 (Karawang), 3 (Indramayu), 4 (Magelang), 5 (Doroyudan), 6 (Klaten), 8 (Mayudan), 10 (Subang), 23D (Subang), 28D (Sukamandi), 29D (Subang), 59 (Pemalang), 60 (Pemalang), 61 (Pemalang), 1/96 (Subang).
9 Selanjutnya, isolat 5 memiliki satu percabangan dengan isolat 23D, 28D, 10 dan 8. Isolat 23D dan 28D berada dalam satu percabangan kecil. Kedua isolat tersebut berada dalam daerah yang berbeda namun memiliki kekerabatan yang cukup dekat. Isolat 10 dan 8 juga berada dalam satu percabangan kecil yang lain. Kedua isolat ini juga berasal dari daerah yang berbeda namun memiliki kekerabatan yang cukup dekat. Percabangan lain yang terbentuk yaitu isolat 6, 3, dan 2. Isolat 6 berasal dari Klaten, 3 dari Indramayu, dan 2 dari Karawang. Ketiga isolat ini memiliki kekerabatan yang juga cukup dekat meskipun berasal dari daerah yang berbeda. Isolat 1 yang berasal dari daerah yang sama dengan isolat 2 terdapat dalam percabangan yang berbeda, namun masih dalam satu klaster besar yang sama. Isolat 4 terdapat dalam klaster yang berbeda dengan isolat lain yang diuji. Hal ini menunjukkan kekerabatan isolat 4 dengan yang lainnya cukup jauh.
Pembahasan
Hasil Peremajaan Xanthomonas oryzae pv. oryzae (Xoo)
Xanthomonas oryzae pv. oryzae (Xoo) merupakan bakteri Gram negatif yang menyebabkan penyakit hawar daun bakteri (HDB). Perkembangan penyakit HDB sangat dipengaruhi oleh kelembaban tinggi dan suhu relatif tinggi. Pada musim hujan yang hari-harinya berawan, penyakit berkembang sangat baik. Daun-daun yang menunjukkan gejala hawar, dalam keadaan lembab terutama di pagi hari dapat dengan mudah ditemukan yaitu berupa koloni bakteri berupa butiran berwarna kuning keemasan. Mekanisme kerusakan pada daun yang diakibatkan
Xoo diawali dengan masuknya patogen melalui bagian daun yang luka, membukanya hidatoda atau stomata pada daun. Patogen akan memperbanyak diri di sel epitel dan menyebar melalui xilem. Patogen di dalam xilem akan berinteraksi dengan sel parenkim. Dalam beberapa hari, sel bakteri dan polisakarida ekstraseluler (EPS) mengisi pembuluh xilem dan ooze keluar dari hidatoda sehingga membentuk bulatan-bulatan pada permukaan daun. Hidatoda merupakan struktur epidermis daun yang terspesialisasi untuk mengeluarkan air saat daun terbuka (Liu et al. 2005).
Menurut Semangun (2004), bakteri Xoo berbentuk batang, 0,7-2,4 μm x 0,3-0,45 μm, tunggal atau berpasangan, berkapsul, tidak berspora, bergerak dengan satu bulu cambuk (flagel) di ujung. Xoo menghasilkan pigmen kuning berlendir yang bernama pigmen xanthomonadin (Liu et al. 2006). Isolat Xoo yang digunakan merupakan kultur koleksi dari BB-Biogen, Bogor. Isolat Xoo yang diremajakan dalam media agar miring dan diinkubasi selama 3-5 hari dalam suhu ruang, menghasilkan warna kuning pada permukaan bagian agar (Gambar 1). Hal ini menunjukkan adanya pigmen xanthomodin yang dihasilkan Xoo tersebut. Xoo
10
Bakteri Xoo agak sulit jika diisolasi langsung dari tumbuhan atau benih yang sudah terinfeksi. Hal ini disebabkan pertumbuhan yang lambat dari Xoo itu sendiri dan pertumbuhan yang lebih cepat pada kontaminan atau bakteri jenis lain. Kontaminan tersebut dapat berupa bakteri jenis lain yang berwarna kuning juga seperti Pantoea agglomerans dan bakteri saprofit mirip Xanthomonas (Zhao et al.
2007). Bakteri Xoo ini dapat ditumbuhkan dalam berbagai media seperti peptone sucrose agar (PSA), nutrient broth yeast extract (NBY), growth factoragar (GF), dan Wakimoto agar (WA) (Sakhtivel et al. 2001). Xoo tidak cocok ditumbuhkan di dalam nutrient agar (NA) karena menghasilkan pertumbuhan yang sangat lambat (EPPO 2007).
Klasifikasi Xoo adalah sebagai berikut: Filum : Prokaryota
Kelas : Scizomycetes
Ordo : Pseudomonadales
Famili : Pseudomonadaceae
Genus : Xanthomonas
Spesies : Xanthomonas oryzae pv. oryzae
(EPPO 2007) Hasil Isolasi DNA
Isolasi DNA genom sangat penting dalam teknik molekuler yang berhubungan dengan amplifikasi gen target. Konstruksi pustaka genom dan pengklonan DNA membutuhkan DNA yang utuh agar fragmen DNA berasal dari proses pemotongan enzimatik yang sangat spesifik. Oleh sebab itu isolasi DNA genom yang utuh sangat diperlukan bila DNA tersebut akan diproses untuk konstruksi filogenetik dan juga pengklonan (Suharsono et al. 2006). Isolasi DNA yang tepat dapat menghasilkan DNA yang terbebas dari kontaminan sehingga dapat digunakan dalam berbagai analisis molekuler lanjutan (Restu et al. 2012).
Prinsip isolasi DNA genom yaitu memisahkan DNA kromosom atau DNA genom dari komponen-komponen sel lain. Langkah awal yang dilakukan adalah memecah dinding sel dengan cara menambahkan detergen. Detergen yang biasa digunakan dalam isolasi ini adalah sodium dodesyl sulfate (SDS). Ekstrak sel ditambahkan protease untuk mendegradasi protein. Protein yang tersisa dipresipitasi menggunakan fenol dan kloroform. Penambahan RNase pada tahap selanjutnya bertujuan untuk mendegradasi RNA (Susanto 2012). Beberapa metode yang digunakan untuk isolasi DNA diantaranya metode cetyl trimethyl ammonium bromide (CTAB), metode Lazo et al. modifikasi 1987, dan isolasi menggunakan kit. Metode CTAB digunakan untuk mengisolasi DNA dari tanaman yang mengandung karbohidrat yang tinggi. Metode Lazo modifikasi bermanfaat untuk mengisolasi DNA bakteri Gram negatif. Metode dengan menggunakan kit bersifat cepat dan sederhana tetapi biaya yang yang harus dikeluarkan lebih mahal. Metode ini dapat digunakan isolasi DNA bakteri Gram negatif dan Gram positif (Surzycki 2000).
11 oleh pengotor. Hal ini dapat terlihat dari smear yang terdapat pada elektroforegram hasil isolasi DNA. Pengotor ini dapat disebabkan oleh protein atau RNA. Penambahan protease dan RNase yang tidak tepat dapat menyebabkan hasil isolasi DNA belum murni sehingga pengotor tersebut muncul dalam elektroforegram. Beberapa isolat lain seperti isolat dengan kode 1, 5, dan 6 memiliki pita yang tipis. Hal ini disebabkan kode isolat tersebut memiliki pertumbuhan yang lebih lambat pada saat ditumbuhkan dalam nutrient broth (NB) sehingga pelet yang dihasilkan pada proses sentrifugasi hanya sedikit.
Amplikon Gen 16S-rRNA
Teknik yang akurat untuk identifikasi molekular prokariot khususnya bakteri yaitu identifikasi terhadap gen penyandi 16S-rRNA yang dikenal juga dengan sebutan ribotyping atau riboprinting. Identifikasi tersebut didasarkan pada tingkat kesamaan dalam sekuens gen 16S-rRNA sebagai sidik jari genetik bakteri atau disebut sekuens sidik jari (fingerprinting). Beberapa keuntungan dalam analisis terhadap gen penyandi 16S-rRNA ini yaitu RNA secara umum dimiliki semua bakteri dan merupakan unit yang konstan. Jika terdapat kemiripan atau sedikit perbedaan basa pada sekuens nukleotida gen 16S-rRNA dari dua jenis organisme maka kedua organisme tersebut memiliki hubungan kekerabatan yang dekat ditinjau dari kedekatan secara evolusinya (Pangastuti 2006).
Identifikasi molekular dalam menganalisis keragaman genetik Xoo
menggunakan identifikasi terhadap gen penyandi 16S-rRNA. Sebanyak 15 isolat
Xoo dari beberapa daerah di Indonesia, dapat diamplifikasi gen penyandi 16S-rRNAnya menggunakan primer 63F dan 1387R. Proses amplifikasi ini menghasilkan produk pada kisaran ukuran 1400-1500 bp (Gambar 3). Hampir setiap isolat menghasilkan pita tunggal yang cukup tebal kecuali isolat dengan kode 1/96. Pita yang tebal tersebut menunjukkan bahwa DNA isolat teramplifikasi dengan baik. Hal ini dapat disebabkan oleh beberapa faktor yang mempengaruhi PCR diantaranya optimasi PCR dan kesesuaian primer yang digunakan.
Optimasi PCR menyangkut suhu denaturasi DNA dan annealing
(penempelan) primer pada DNA cetakan. Suhu denaturasi yang terlalu rendah dapat menyebabkan belum terbukanya DNA utas ganda sehingga tidak memungkinkan terjadinya polimerisasi DNA baru. Proses penempelan primer pada utas DNA yang sudah terbuka memerlukan suhu optimum karena suhu yang terlalu tinggi dapat menyebabkan amplifikasi tidak terjadi. Sebaliknya, suhu yang terlalu rendah menyebabkan primer menempel pada sisi lain genom yang bukan sisi homolognya sehingga dapat teramplifikasi daerah-daerah yang tidak spesifik dalam genom tersebut. Suhu penempelan primer ini ditentukan berdasarkan primer yang digunakan yang dipengaruhi oleh panjang dan komposisi primer. Suhu penempelan sebaiknya sekitar 5 °C di bawah suhu leleh (Tm) (Stackebrandt 2002).
12
daerah genom yang teramplifikasi. Primer yang digunakan adalah primer spesifik 63F dan 1387R. Primer 63F memiliki panjang sekuen 21 nukleotida dan 1387R sebanyak 18 nukleotida. Primer ini tidak membentuk struktur dupleks dengan ujung 5’ yang dapat dikenali enzim eksonuklease dan tidak terdapat nukleotida yang terpotong pada ujung 5’. Hal ini dapat mempengaruhi suhu annealing
(penempelan) primer (Pangastuti 2006).
Amplified rDNA Restriction Analysis (ARDRA)
Amplified rDNA Restriction Analysis (ARDRA) merupakan teknik RFLP yang digunakan untuk membedakan jenis bakteri misalnya berdasarkan gen ribosomal DNA seperti 16S-rRNA. Teknik ini menggunakan enzim restriksi untuk melihat polimorfisme dalam genom organisme. Situs enzim restriksi dari genom suatu kelompok organisme yang kemudian berubah karena mutasi atau berpindah karena genetic rearrangement dapat menyebabkan situs tersebut tidak lagi dikenali oleh enzim atau enzim restriksi akan memotong daerah lain yang berbeda. Proses ini menyebabkan terbentuknya fragmen-fragmen DNA yang berbeda ukurannya antara satu organisme dengan organisme lainnya. Polimorfisme ini selanjutnya digunakan untuk membuat pohon filogenetik atau dendogram kekerabatan kelompok (Sasaki et al. 2004).
Pohon filogenetik yang dibentuk berdasarkan pola pita ARDRA menunjukkan dua klaster dari 15 isolat Xoo yang diuji. Kode isolat 4 memiliki klaster yang berbeda sendiri atau berada pada satu klaster tersendiri. Klaster besar lainnya berisikan isolat-isolat lain. Beberapa isolat memiliki kekerabatan yang cukup dekat meskipun berasal dari daerah yang berbeda. Beberapa isolat tersebut diantaranya 29D dengan 59 dan 60, isolat 1/96 dan 61 dengan 29D, 59 dan 60, isolat 5 dengan 23D, 28D, 10 dan 8, isolat 6, 3, dan 2.
Enzim restriksi yang digunakan untuk memotong produk PCR 16S-rRNA dari Xoo yaitu RsaI. Enzim RsaI merupakan enzim endonuklease restriksi tetramerik atau memiliki sisi pengenalan empat basa sehingga bila penyebaran nukleotida terjadi secara acak pada organisme dengan G+C sekitar 50% maka setiap sekitar 256 pasang basa dapat diharapkan memiliki satu sisi pengenalan. enzim restriksi tersebut menghasilkan sejumlah besar fragmen yang bervariasi ukurannya (Susilowati et al. 2010). Enzim restriksi RsaI memotong dengan sifat
blunt end pada situs 5’...GT↓AC...3’ dan 3’...CA↑TG...5’. Pemotongan dengan
RsaI pada isolat Xoo yang diuji menghasilkan 13 pola pita ARDRA yang berbeda. Pengelompokkan tersebut berdasarkan kesamaan di situs pemotongan enzim restriksi RsaI pada setiap spesies.
13
SIMPULAN DAN SARAN
Simpulan
Sebanyak 15 isolat Xoo yang diuji yang berasal dari beberapa daerah di Indonesia, secara genetik menunjukkan keragaman yang cukup tinggi. Hal ini terlihat dari banyaknya pola pita ARDRA yang terbentuk yaitu 13 pola. Analisis pohon filogenetik menunjukkan antara satu isolat dengan isolat yang lain memiliki kekerabatan yang cukup dekat meskipun berasal dari daerah yang berbeda. Beberapa isolat tersebut diantaranya 29D (Subang) dengan 59 (Pemalang) dan 60 (Pemalang), isolat 1/96 (Subang) dan 61 (Pemalang) dengan 29D (Subang), 59 (Pemalang) dan 60 (Pemalang), isolat 5 (Doroyudan) dengan 23D (Subang), 28D (Sukamandi), 10 (Subang) dan 8 (Mayudan), isolat 6 (Klaten), 3 (Indramayu), dan 2 (Karawang).
Saran
Identifikasi molekuler yang cepat dan mudah seperti teknik ARDRA perlu dikembangkan lagi untuk analisis keragaman genetik patogen lainnya. Selain itu, setelah dilakukan analisis keragaman genetik Xoo diperlukan penelitian lebih lanjut untuk membantu mengembangkan varietas padi tahan HDB dalam rangka pengendalian penyakit HDB sehingga dapat diterapkan oleh petani.
DAFTAR PUSTAKA
[CABI] Commonwealth Agricultural Bureau International. 2008. Xanthomonas oryzae pv. oryzae. Wallingford (UK): CABI.
[Ditjen TP] Direktorat Perlindungan Tanaman Pangan. 2011. Prakiraan Serangan BLB pada Padi di Indonesia Masa Tanam Tahun 2011. Jakarta (ID): Ditjen TP. [EPPO] European and Mediterranean Plant-Protection Organization.
2007. Xanthomonas oryzae. Bull OEPP/EPPO. 37: 543-553.
[IRRI] International Rice Research Institute. 2004. Bacterial leaf streak. Rice Fact Sheet [Internet]. [6 September 2004]. Manila (PH): IRRI. hlm 1; [diunduh 2013 Okt 8]. Tersedia pada: http://www.knowledgebank.irri.org.
Keshavarz K, Sijam K, Abidin MHZ, Habibudin H, Nazerian E. 2011. Rapid identification and differentiation of Xanthomonas oryzae pv. oryzae strain with primer 16S-23S rDNA from the rice fields in Peninsular Malaysia. Asian Journal of Plant Pathology. 5(2): 93-99. doi: 10.3923/ajppaj.2011.93.99. Liu DO, Ronald PC, Bogdanove AJ. 2005. A simple method of mass inoculation
of rice effective for both pathovars of Xanthomonas oryzae, and the construction of comparable sets of host cDNA libraries spanning early stages of bacterial leaf blight and bacterial leaf streak. Journal of Phytopathology.
153: 500-504.
14
Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16S rRNA dan gen penyandi protein. Biodiversitas. 3(7): 292-296. Restu M, Mukrimin, Gusmiaty. 2012. Optimalisasi teknik ekstraksi dan isolasi
DNA tanaman suren (Toona sureni Merr.) untuk analisis keragaman genetik berdasarkan random amplified polymorphic DNA (RAPD). J Natur Indonesia.
14(2): 138-142.
Sakthivel N, Mortensen CN, Mathur SB. 2001. Detection of Xanthomonas campestris pv. oryzae in artificially inoculated and naturally infected rice seeds and plants by molecular techniques. Appl Microbiol Biotechnol. 56: 435-441. doi: 10.1007/s002530100641.
Sari IP. 2007. Keragaman genetik bakteri endofitik dan filosfer dari tanaman padi (Oryza sativa). [tesis]. Bogor (ID): Institut Pertanian Bogor.
Sasaki E, Osawa R, Nishitani Y, Whiley RA. 2004. ARDRA and RAPD analysis of human and animal isolates of Streptococcus gallolyticus. J Vet Med Sci. 66: 1467-1470. doi: 10.1292/jvms.66.1467.
Semangun H. 2007. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Yogyakarta (ID): Gadjah Mada University Pr.
Schlegel L, Grimont F, Grimont PAD, Bouvet A. 2003. Identification of Major Streptococcal species by rrn-amplified ribosomal DNA restriction analysis. J Clin Microbiol. 41: 657-666. doi: 10.1128/JCM.41.2.657-666.2003.
Stackebrandt E. 2002. Report of the ad hoc committee for the re-evaluation of the species definition in bacteriology. International Jurnal of Systematic and Evolution Microbiology. 52: 1043-1047.
Suharsono, Widyastuti U. 2006. Pelatihan Teknik Pengklonan Gen. Bogor (ID): Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB.
Surzycki S. 2000. Basic Techniques in Molecular Biology. New York (US): Springer-Verlag.
Susanto AH. 2012. Bahan Ajar Biologi Molekuler. Purwokerto (ID): Universitas Jenderal Soedirman.
Susilowati DN, Nurul H, Tasliah, K Mulya. 2010. Keragaman bakteri endofitik diisolasi dari empat varietas padi dengan metode ARDRA. Berita Biologi.
10(2): 241-248.
15
Peremajaan isolat Xanthomonas oryzae pv. oryzae
Isolasi DNA genom
Analisis data biner dengan software MVSP
PCR 16S-rRNA
Profil setiap isolat dibandingkan Lampiran 1 Diagram alir penelitian
Elektroforesis gel agarosa
Digesti dengan enzim restriksi RsaI
16