PENGARUH AIR PERASAN KULIT JERUK MANIS (
Citrus
aurantium sub spesies sinensis)
TERHADAP TINGKAT
KEMATIAN LARVA
Aedes aegypti
INSTAR III
IN VITRO
SKRIPSI
Untuk Memenuhi Persyaratan
Memperoleh Gelar Sarjana Kedokteran
FATNA ANDIKA WATI
G0007069
FAKULTAS KEDOKTERAN
UNIVERSITAS SEBELAS MARET
PENGESAHAN SKRIPSI
Skripsi dengan judul : Pengaruh Air Perasan Kulit Jeruk Manis (Citrus
aurantium sub spesies sinensis) terhadap Tingkat Kematian Larva
Aedes aegypti Instar III in vitro
Fatna Andika Wati, NIM : G0007069, Tahun : 2010
Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi
Fakultas Kedokteran Universitas Sebelas Maret
Pada Hari Rabu , Tanggal 24 November 2010
Pembimbing Utama
Nama : Darukutni, dr., Sp. Par K
NIP : 19470809 197603 1 001 ( ...)
Pembimbing Pendamping
Nama : Ipop Syarifah, Dra., M. Si
NIP :19560328 198503 2 001 (...)
Penguji Utama
Nama : Sri Haryati, Dra., M. Kes
NIP : 19610120 198601 2 001 (...)
Anggota Penguji
Nama : Balqis, dr., CMFM, Sp. Ak
NIP : 19640719 199903 2 003 (...)
Surakarta, ...
Ketua Tim Skripsi Dekan FK UNS
PERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah
diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan
sepanjang pengetahuan penulis juga tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, 24 November 2010
Fatna Andika Wati
ABSTRAK
Fatna Andika Wati, G0007069, 2010. Pengaruh Air Perasan Kulit Jeruk Manis (Citrus aurantium sub spesies sinensis) terhadap Tingkat Kematian Larva Aedes aegypti Instar III In vitro, Fakultas Kedokteran Universitas Sebelas Maret, Surakarta.
Tujuan Penelitian : Penelitian ini bertujuan untuk mengetahui pengaruh air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis) terhadap tingkat kematian larva Aedes aegypti instar III in vitro dan konsentrasi yang dapat mematikan larva Aedes aegypti sebesar 50% (LC50) dan 99% (LC99).
Metode Penelitian : Jenis penelitian ini adalah eksperimental laboratorik. Subjek penelitian adalah larva Aedes aegypti instar III sejumlah 1.025 ekor. Teknik pengambilan sampel dengan metode simple random sampling. Subjek dibagi dalam 1 kelompok kontrol dan 5 kelompok perlakuan, masing-masing berisi 25 ekor larva dan dilakukan 5 kali pengulangan. Kelompok kontrol adalah 100 ml air keran sedangkan kelompok perlakuan menggunakan air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis) yang ditambah air keran sampai konsentrasi 0,5%, 1%, 1,5%, 2% dan 2,5%. Pengumpulan data dilakukan dengan cara menghitung jumlah kematian larva Aedes aegypti instar III setelah pemaparan selama 24 jam. Data diolah dengan uji analisis regresi linier dan analisis probit.
Hasil Penelitian : Dari hasil uji analisis regresi linier, nilai R Square model ~ 1 menunjukan bahwa konsentrasi air perasan merupakan merupakan variabel yang sangat baik untuk menjelaskan variabel jumlah kematian larva. Dengan uji Anova pada analisis regresi didapatkan F hitung > F tabel dengan taraf signifikansi 0.02, maka Ho ditolak, atau dengan kata lain terdapat pengaruh air perasan kulit jeruk manis terhadap tingkat kematian larva Aedes aegypti instar III. Taraf signifikansi < 0.05 menunjukan bahwa variabel konsentrasi air perasan kulit jeruk manis dalam penelitian ini memberikan pengaruh yang signifikan terhadap tingkat kematian larva Aedes aegypti instar III. Dari analisis probit didapatkan LC50 sebesar 0,946% dan LC99 sebesar 4,064%.
Simpulan Penelitian : Berdasarkan hasil penelitian di atas, dapat disimpulkan bahwa air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis) berpengaruh terhadap tingkat kematian larva Aedes aegypti instar III in vitro dengan LC50 sebesar 0,946% dan LC99 sebesar 4,064%.
ABSTRACT
Fatna Andika Wati, G0007069, 2010. The Influence of Sweet Orange (Citrus aurantium sub spesies sinensis) Peel’s Squeezed Water for Third Instar Aedes aegypti Larva’s Death Level In vitro, Faculty of Medicine, University of Sebelas Maret, Surakarta.
Objectives : The aims of this study are to determine the influence of sweet orange (Citrus aurantium sub spesies sinensis) peel’s squeezed water for third instar Aedes aegypti larva’s death level in vitro and the 50% death concentration (LC50) and 99% death concentration (LC99).
Method : This study was laboratory experimental. The subject of research was 1.025 third instar Aedes aegypti larvas. The sampling method was simple random sampling. The sample was divided into 1 control group and 5 experimental groups, each had 25 larvas and had 5 repetitions. The control group was 100 ml water and the experimental groups used sweet orange (Citrus aurantium sub spesies sinensis) peel’s squeezed water which added with water until the concentration reached 0,5%, 1%, 1,5%, 2%, 2,5%. The results were achieved with count the third instar Aedes aegypti death sum after 24 hour. The results were analyzed by linear regression analysis and probit analysis.
Results : By linear regression analysis, the R Square model ~ 1, shows that the sweet orange peel’s squeezed water is a very good variable for explaining the larva death sum. F count > F table has been obtained by the Anova test in regression model with 0.02 significancy, which means H0 is rejected, or in the other words, it shows that the influence of sweet orange peel’s squeezed water for third instar Aedes aegypti larva’s death level in vitro was present. The level of significance < 0.05 shows that the concentration of sweet orange peel’s squeezed water in this study has a significant influence on the third instar Aedes aegypti larva’s death level. The LC50 is 0,946% and LC99 is 4,064% by probit analysis.
Conclusions : This study shows that the sweet orange (Citrus aurantium sub spesies sinensis) peel’s squeezed water have influence for third instar Aedes aegypti larva’s death level in vitro with LC50 0,946% and LC99 4,064%.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan karunia kesehatan dan limpahan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Pengaruh Air Perasan Kulit Jeruk Manis (Citrus aurantium sub spesies sinensis) terhadap Tingkat Kematian Larva Aedes aegypti Instar III In vitro”ini.
Penulis ingin menyampaikan terima kasih kepada :
1. Prof. Dr. H. A A. Subijanto, dr., M.S., selaku Dekan Fakultas Kedokteran UNS.
2. Tim skripsi yang telah membantu kelancaran pembuatan skripsi ini.
3. Darukutni, dr., Sp. Par K sebagai pembimbing utama yang telah berkenan memberikan waktu, bimbingan, saran dan motivasi bagi penulis.
4. Ipop Syarifah, Dra., M.Si sebagai pembimbing pendamping yang telah berkenan memberikan waktu, bimbingan, saran dan motivasi bagi penulis. 5. Sri Haryati, Dra., M.Kes sebagai penguji utama yang telah memberikan
nasihat, koreksi, kritik dan saran untuk menyempurnakan penyusunan skripsi. 6. Balqis, dr., CMFM, Sp. Ak sebagai anggota penguji yang telah memberikan
nasihat, koreksi, kritik dan saran untuk menyempurnakan penyusunan skripsi. 7. Hasan Boesri, Drs., M.S selaku Kepala Bidang Pelayanan Penelitian di Balai
Besar Pengembangan Vektor dan Reservoir Penyakit (B2P2VRP) Salatiga, beserta semua staf B2P2VRP yang telah membantu terlaksananya penelitian ini.
8. Bapak , ibu dan Fata yang telah memberikan dorongan dan doa kepada penulis.
9. Teman-temanku angkatan 2007 khususnya Kiki, Andra, Elisa, Anggie, Galuh, Esti yang telah sama-sama berjuang di Parasitologi dan Cheppy yang selalu memberi semangat.
10.Semua pihak yang telah membantu penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini tidak lepas dari kekurangan. Oleh karena itu, kritik dan saran yang membangun sangat penulis harapkan. Semoga skripsi ini bermanfaat bagi semua pihak.
Surakarta, 13 November 2010
DAFTAR ISI
BAB II LANDASAN TEORI A. Tinjauan Pustaka ... 6
1. Aedes aegypti ... 6
2. Jeruk Manis (Citrus aurantium sub spesies sinensis) …………... 12
3. Saponin ... 14
BAB III METODE PENELITIAN A. Jenis Penelitian ... 24
B. Lokasi dan Waktu Penelitian ... 24
C. Objek Penelitian ... 24
D. Teknik Sampling ... 24
E. Rancangan Penelitian ... 25
G. Definisi Operasional Variabel Penelitian ... 27
H. Alat dan Bahan Penelitian ... 28
I. Cara kerja ... 29
J. Teknik Analisis Data ... 32
BAB IV HASIL PENELITIAN A. Hasil Penelitian ... 33
B. Analisis Data ... 37
BAB V PEMBAHASAN ... 41
BAB VI SIMPULAN DAN SARAN A. Simpulan ... 44
B. Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
halaman
Tabel 1. Komposisi air perasan kulit jeruk manis dan air keran pada konsentrasi
0%, 1%, 2%, 3%, 4% dan 5%...30
Tabel 2. Jumlah kematian larva Aedes aegypti setelah diuji dengan air perasan
kulit jeruk manis dalam berbagai konsentrasi pada uji pendahuluan …33
Tabel 3. Jumlah kematian larva Aedes aegypti pada berbagai konsentrasi air
perasan kulit jeruk manis setelah 24 jam perlakuan ………..34
Tabel 4. Jumlah kematian larva Aedes aegypti pada larutan Abate 1 mg dalam
100 ml air setelah 24 jam perlakuan ……...………... 37
DAFTAR GAMBAR
halaman
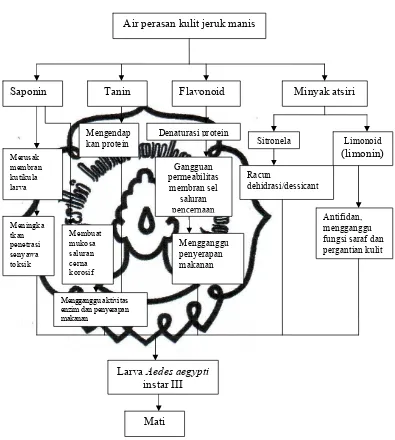
Gambar 1. Skema Kerangka Pemikiran ………..………... 23
Gambar 2. Garis Regresi Linier antara Konsentrasi Air Perasan Kulit Jeruk
DAFTAR LAMPIRAN
Lampiran 1. Hasil Uji probit
Lampiran 2. Tabel F (α = 0,05) untuk Uji ANOVA
Lampiran 3.Surat Keterangan telah Melakukan Penelitian di Balai Besar
Penelitian dan Pengembangan Vektor dan Reservoir Penyakit
Salatiga
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Masalah besar yang dihadapi Indonesia saat ini adalah banyaknya warga
yang menderita penyakit Demam Berdarah Dengue (DBD) atau Dengue
Hemorrhagic Fever (DHF) (Suirta et al., 2007 cit Rukmana, 2002). Awal
tahun 2005, tercatat 28.224 kasus demam berdarah terjadi di seluruh
Indonesia, dengan jumlah kematian 348 orang. Kasus ini meningkat hingga
awal Oktober 2005, di mana di 33 provinsi kasus ini mencapai 50.196 kasus,
dengan 701 di antaranya meninggal dunia. Akhir tahun 2006 hingga awal
tahun 2007 kasus demam berdarah terjadi lagi di beberapa daerah di Indonesia
(Suirta et al., 2007).
Penyakit DBD disebabkan oleh virus dengue yang ditularkan melalui
gigitan nyamuk Aedes aegypti dan Aedes albopictus. Sejak pertama kali
ditemukan, jumlah kasus DBD menunjukkan kecenderungan meningkat baik
dalam jumlah maupun luas wilayah yang terjangkit dan secara sporadis selalu
terjadi Kejadian Luar Biasa (KLB) setiap tahun (Kristina et al., 2004).
Kebijakan penanggulangan penyebaran penyakit DBD oleh pemerintah
Indonesia telah dilakukan dengan berbagai upaya yaitu dengan memutuskan
rantai penularan penyakit dari penderita ke vektor kemudian dari vektor
kepada orang sehat yaitu dengan cara pemberantasan nyamuk Aedes aegypti
Kewaspadaan dini penyakit DBD, hal ini berguna untuk mencegah dan
membatasi terjadinya KLB atau wabah penyakit dengan kegiatan bulan bakti
gerakan 3M (menguras tempat-tempat penampungan air, menutup rapat-rapat
tempat penampungan air dan mengubur atau menyingkirkan barang bekas
yang dapat menampung air), 2. Pemberantasan vektor yang dapat dilakukan
dengan cara : a. Penyemprotan (fogging) yang difokuskan pada lokasi dimana
ditemui kasus b. Penyuluhan gerakan masyarakat dalam PSN (Pemberantasan
Sarang Nyamuk) DBD melalui penyuluhan dengan pemanfaatan berbagai
jalur komunikasi dan informasi yang ada melalui kerjasama lintas program
dan sektor serta dikoordinasi oleh Kepala daerah atau Wilayah c. Abatisasi
dan d. Kerja bakti dengan melakukan 3M (Asiah, 2008 cit Suroso dan Umar,
2002).
Saat ini larvasida yang paling luas digunakan untuk mengendalikan larva
Aedes aegypti adalah temefos (Gafur et al., 2006 cit Ponlawat et al., 2005).
Namun, penggunaan larvasida dalam waktu lama dapat menyebabkan
resistensi. Menurut suatu penelitian (Raharjo, 2006) telah terjadi resistensi
larva Aedes aegypti di Surabaya, Palembang dan beberapa wilayah di
Bandung terhadap temefos. Resistensi larva Aedes aegypti terhadap temefos
juga telah dilaporkan terjadi di Brazil (Braga et al., 2004), Bolivia dan
Argentina (Llinas et al., 2010), Venezuela, Kuba (Gafur et al., 2006 cit
Rodriguez et al., 2001), French Polynesia (Gafur et al., 2006 cit Failloux et
al., 1994), India (Tikar et al., 2009), Karibia (Gafur et al., 2006 cit Rawlins &
al., 2006 cit Ponlawat et al., 2005). Selain itu, air yang ditaburi temefos
menjadi berbau kurang sedap (Gafur et al., 2006 cit Mulla et al., 2004).
Temefos juga tidak ramah lingkungan karena temefos dan produk
degradasinya sangat persisten (Lacorte, 1996) dan dapat membunuh
zooplankton (Hanazato et al., 1989).
Hal ini mendorong untuk dikembangkannya alternatif lain dengan
menggunakan bahan alami, misalnya bahan dari tumbuhan sebagai larvasida
nabati yang relatif lebih aman karena akan lebih mudah terurai (bio
-degradable) di alam sehingga tidak mencemari lingkungan dan relatif aman
bagi manusia dan ternak karena residunya mudah hilang (Asiah, 2008 cit
Dinas Pertanian dan Kehutanan, 2002). Penggunaan toksin yang berasal dari
tanaman dapat digunakan untuk pemberantasan larva nyamuk Aedes aegypti
karena dalam suatu ekstrak tumbuhan selain beberapa senyawa aktif utama
biasanya juga banyak terdapat senyawa lain yang kurang efektif, tapi
keberadaannya dapat meningkatkan aktivitas ekstrak secara keseluruhan
(sinergi), hal ini memungkinkan serangga tidak mudah menjadi resisten
(Utariningsih dan Purwanti, 2010).
Beberapa penelitian telah memanfaatkan tanaman sebagai larvasida, di
antaranya ekstrak daun jeruk purut (Hayati, 2006), ekstrak kulit jeruk manis
(Sari, 2008), ekstrak biji jeruk siam (Al-Anshori, 2006 cit Puri, 2001) dan
lain-lain. Ekstrak kulit jeruk manis memiliki efek larvasida dengan nilai LD
50 sebesar 0,55 % dan LD 100 sebesar 1,1 % (Sari, 2008). Selain dari ekstrak
air perasan buah mengkudu (Frihartini, 2008) dan belimbing wuluh (Nopianti,
2008) yang terbukti dapat berfungsi sebagai larvasida. Pemakaian air perasan
lebih mudah dibuat daripada ekstrak karena hanya melalui proses pelumatan
dan pelarut yang digunakan adalah air. Selain itu, kulit jeruk yang biasanya
dibuang begitu saja dan menjadi sampah dapat dimanfaatkan sebagai larvasida
oleh masyarakat. Air perasan kulit jeruk manis lebih jernih daripada
ekstraknya maupun air perasan buah mengkudu dan belimbing wuluh.
Buah mengkudu mengandung alkaloid, triterpenoid, saponin, polifenol
dan flavonoid (Frihartini, 2008). Buah belimbing wuluh mengandung alkaloid,
saponin dan flavonoid (Nopianti, 2008). Kulit jeruk manis mengandung
saponin, flavonoid, tanin dan triterpenoid (Sari, 2008). Dengan demikian
terdapat beberapa kandungan kimia yang sama antara buah mengkudu,
belimbing wuluh dan kulit jeruk manis yang diperkirakan dapat berfungsi
sebagai larvasida.
Berdasarkan uraian di atas maka penulis ingin mengadakan penelitian
mengenai pengaruh air perasan kulit jeruk manis (Citrus aurantium sub
spesies sinensis) terhadap tingkat kematian larva Aedes aegypti instar III In
vitro.
B. Rumusan Masalah
Adakah pengaruh air perasan kulit jeruk manis (Citrus aurantium sub
spesies sinensis) terhadap tingkat kematian larva Aedes aegypti instar III In
vitro dan berapa besar konsentrasi yang dapat mematikan larva Aedes aegypti
C. Tujuan Penelitian
Tujuan dilaksanakannya penelitian ini adalah untuk mengetahui
pengaruh air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis)
terhadap tingkat kematian larva Aedes aegypti instar III In vitro dan
konsentrasi yang dapat mematikan larva Aedes aegypti sebesar 50% (LC50)
dan 99% (LC99).
D. Manfaat Penelitian
1. Manfaat teoritis
Penelitian ini dapat memberikan informasi ilmiah mengenai
pengaruh air perasan kulit jeruk manis terhadap tingkat kematian larva
Aedes aegypti instar III In vitro dan konsentrasi yang dapat mematikan
larva Aedes aegypti sebesar 50% (LC50) dan 99% (LC99) .
2. Manfaat aplikatif
Penelitian ini dapat menjadi dasar untuk penelitian lebih lanjut.
Penelitian lebih lanjut tersebut dapat berupa uji toksisitas air perasan
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Aedes aegypti
a.. Klasifikasi
Kedudukan nyamuk Aedes aegypti dalam klasifikasi hewan
menurut Soegijanto (2006) adalah :
Filum : Arthropoda
Kelas : Insekta
Ordo : Diptera
Sub Ordo : Nematocera
Infra Ordo : Culicomorpha
Superfamili : Culicoidea
Famili : Culicidae
Sub famili : Culicinae
Genus : Aedes
Spesies : Aedes aegypti
b. Tinjauan umum
Nyamuk Aedes aegypti dikenal dengan sebutan black white
mosquito atau tiger mosquito karena tubuhnya memiliki ciri yang khas,
atas dasar warna hitam. Ciri khas utamanya adalah dua garis lengkung
yang berwarna putih keperakan di kedua sisi lateral dan dua buah garis
lengkung sejajar di garis median dari punggungnya yang berwarna
dasar hitam (lyre shaped marking) (Soegijanto, 2006).
Aedes aegypti dalam siklus hidupnya mengalami empat
stadium yaitu telur, larva, pupa dan dewasa. Stadium telur, larva dan
pupa hidup di genangan air tawar tenang. Genangan air yang disukai
sebagai tempat perindukannya adalah genangan air yang terdapat di
suatu wadah atau kontainer, bukan genangan di tanah. Larva nyamuk
Aedes aegypti dalam pertumbuhan dan perkembangannya mengalami
empat kali pergantian kulit (ecdysis) yang dipengaruhi oleh hormon
ekdison (Soegijanto,2006).
Larva mengambil makanan di dasar kontainer sehingga disebut
pemakan makanan di dasar (bottom feeder). Dalam posisi istirahat
membentuk sudut 45° dengan garis pemukaan air dengan bagian
kepala berada di bawah. Larva mengambil oksigen dari udara dengan
menempatkan siphon-nya tepat pada permukaan air (Hayati, 2006).
Pada stadium larva dikenal empat tingkat jentik yang
masing-masing tingkatan dinamakan instar. Larva instar I berukuran paling
kecil yaitu 1-2 mm atau satu sampai dua hari setelah telur menetas,
duri-duri (spinae) pada dada belum jelas dan corong pernapasan
(siphon) belum menghitam. Larva instar II berukuran 2,5-3,5 mm
belum jelas, corong pernapasan sudah mulai menghitam. Larva instar
III berukuran 4-5 mm berumur tiga sampai empat hari setelah telur
menetas, duri-duri dada mulai jelas dan corong pernapasan berwarna
coklat kehitaman. Larva instar IV berukuran paling besar yaitu 5-6 mm
berumur empat sampai enam hari setelah telur menetas dengan warna
kepala gelap (Asiah, 2008 cit Hoedojo, 1993). Larva stadium III atau
IV lebih mudah diamati dari stadium lain (Asiah, 2008), alat-alat
tubuhya sudah terbentuk lengkap (Nurcahyati, 2008) dan bersifat
relatif stabil terhadap pengaruh luar (Sari, 2008). Peneliti memilih
larva instar III dengan alasan waktu yang dibutuhkan untuk perubahan
instar III menjadi pupa lebih lama dibandingkan instar IV menjadi
pupa sehingga dikhawatirkan sewaktu diberi perlakuan ada larva instar
IV yang berubah menjadi pupa. Pada pupa lapisan kulitnya tebal
sehingga senyawa-senyawa aktif larvasida akan sulit masuk. Selain itu,
pupa tidak makan sehingga senyawa aktif larvasida dalam air perasan
kulit jeruk manis tidak akan efektif.
Ciri-ciri larva Aedes aegypti antara lain
1) Corong udara terdapat pada segmen terakhir, pada segmen-segmen
abdomen tidak dijumpai rambut-rambut berbentuk kipas (palmate
hairs).
2) Pada corong udara terdapat pecten.
3) Sepasang rambut dijumpai pada corong udara (siphon).
5) Bentuk individu dari comb scale seperti duri (Hayati, 2006).
Semua instar memiliki struktur yang mirip. Perubahan
morfologi selama perkembangan larva terlihat pada palatal brush,
pecten, comb scales dan ventral brush dari segmen abdominal sepuluh.
Larva instar III dan IV menunjukkan struktur yang mirip dengan hanya
sedikit variasi. Palatum dan setae-nya mudah dibedakan. Palatal brush
dibagi menjadi 3 golongan, bagian tengah yang muncul dari palatum
dengan posisi dorsoventral dari kepala dan kelompok lateral yang
terletak pada bagian laterofrontal dari kepala, muncul dari
labiopalatum. Palatal brush dari larva instar I dan II tampak sebagai
filamen-filamen yang berbentuk uniform. Filamen-filamen ini nampak
sebagai struktur yang langsing dan panjang dengan barisan dari
gigi-gigi yang uniform. Pada instar IV, lateral brush memiliki susunan
yang lebih kompleks dan tersebar berumbai-rumbai. Ujung distal
filamen palatal brush pada instar III dan IV berbentuk seperti
penggaruk terdapat 4-6 gigi yang menonjol dengan panjang kira-kira 9
µm. Filamen palatal brush dari instar III dan IV lebih banyak, lebih
kompleks dan tersebar berumbai-rumbai. Ujung distalnya membentuk
sudut 90º terhadap barisan filamen yang lebih kecil (Schaper dan
Chavarria, 2006).
Adanya perubahan dalam jumlah dan bentuk ini mungkin
penting karena berkaitan dengan penyediaan makanan karena dengan
mencengkeram partikel makanan larva yang mencakup bakteri dan
protozoa. Perubahan filamen ini juga berkaitan dengan perubahan diet
selama maturasi larva. Larva instar I dan II lebih banyak memakan
bakteri sedangkan instar III dan IV memakan patikel organik yang
besar (Schaper dan Chavarria, 2006).
Ventral brush dari segmen sepuluh pada instar II dibentuk oleh
3 pasang setae yang tipis sedangkan pada instar III dan IV disusun
oleh 4 pasang setae yang kuat. Jumlah dari comb scale dan
kompleksitasnya meningkat dari instar I hingga IV. Instar I hanya
memiliki 5 comb scale yang pada ujung tiap comb scale-nya terdapat
19-21 duri yang uniform. Instar II, III dan IV memiliki 7,8 dan 10
comb scale di mana strukturnya lebih kompleks dari instar I karena
comb scale pada instar-instar akhir memiliki sebuah denticle median
yang panjang dan sedikit melengkung dan ujung yang lebih prominen.
Pada instar II setiap comb scale memiliki 12-14 subapical denticle,
instar III ada 14-17 subapical denticle dan instar IV memiliki 10-14
subapical denticle (Schaper dan Chavarria, 2006).
Setiap stadium instar juga menunjukkan adanya modifikasi
pecten dalam hal jumlah dan kompleksitasnya. Pecten pada instar I
hanya dibentuk oleh 2 duri pecten yang menyangga 7 denticle kecil
sementara pada instar lain biasanya ada lebih dari 10 denticle. Salah
satu denticle pada duri pecten instar II ternyata lebih prominen dengan
subapical denticle dan instar IV memiliki 15-16 duri di mana setiap
duri terdapat 1 denticle prominen dan 2-3 subapical denticle (Schaper
dan Chavarria, 2006).
Langkah pertama dalam respon fisik keracunan pada larva
Aedes aegypti adalah respon fisik dan tingkah lakunya. Secara khas,
keracunan racun saraf menimbulkan empat tahap gejala, yaitu eksitasi,
kejang (konvulsi), kelumpuhan (paralisis) dan kematian. Pada tahap
eksitasi serangga menunjukkan perilaku ”membersihkan badan” . Pada
tahap ini tampak bahwa serangga membersihkan antena atau bagian
tubuh lainnya dengan mulut. Larva yang keracunan akan menggulung
badannya dan melakukan gerakan teleskopik yaitu gerakan turun naik
dari permukaan air dengan cepat (Utariningsih dan Purwanti, 2010 cit
Tarumingkeng, 1992).
Telur nyamuk Aedes aegypti di dalam air dengan suhu 20-40°C
akan menetas menjadi larva dalam waktu 1-2 hari. Kecepatan
pertumbuhan dan perkembangan larva dipengaruhi oleh beberapa
faktor yaitu temperatur, tempat, keadaan air dan kandungan zat
makanan yang ada dalam tempat perindukan. Pada kondisi optimum,
larva berkembang menjadi pupa dalam waktu 2-3 hari. Pertumbuhan
dan perkembangan telur, larva, pupa, sampai dewasa memerlukan
2. Jeruk manis (Citrus aurantium sub spesies sinensis)
Jeruk manis mempunyai nama ilmiah Citrus aurantium sub spesies
sinensis. Jeruk manis ini termasuk di dalam klasifikasi berikut ini :
a. Kingdom : Plantae
b. Subkingdom : Tracheobionta
c. Divisi : Magnoliophyta
d. Subdivisi : Angiospermae
e. Kelas : Magnoliopsida
f. Subkelas : Rosidae
g. Ordo : Rutales
h. Famili : Rutaceae
i. Ordo : Rutales
j. Genus : Citrus
k. Spesies : Citrus aurantium sub spesies sinensis
Secara umum uraian makroskopik kulit jeruk manis antara lain:
a. Kepingan berbentuk spiral dan ada pula yang bentuknya panjang.
b. Permukaan luar berwarna coklat agak kekuning-kuningan sampai
coklat jingga, tebal ± 3 mm, keras dan rapuh.
c. Permukaan dalam rata, berwarna coklat jingga.
d. Terdapat sedikit jaringan bunga karang, apabila kulit ini dipatahkan
akan tampak dengan jelas rongga-rongga minyaknya yang bergaris
Kulit buah jeruk manis tebalnya 0,3-0,5 cm, dari tepi berwarna
kuning atau oranye tua dan makin ke dalam berwarna putih kekuningan
sampai putih, berdaging dan kuat melekat pada dinding buah (Rini et al.,
2009 cit Pracaya, 2001). Kandungan kimia dalam kulit jeruk manis adalah
saponin, tanin, flavonoid dan triterpenoid (Sari, 2008). Kulit buah jeruk
manis memiliki bau yang khas aromatik dan rasa pahit, yang mengandung
: minyak atsiri 90% yang berisikan limonin, glukosida-glukosida
hesperidina, isohesperinda, aurantiamarina dan damar (Rini et al., 2009 cit
Kartasapoetra, 2001). Senyawa yang mengandung saponin, flavonoid,
triterpenoid, alkaloid dapat berfungsi sebagai larvasida (Mawuntyas dan
Tjandra, 2006; Ginting, 2006).
Senyawa bioaktif sebagai zat toksik yang terkandung dalam
tanaman dapat masuk melalui dinding tubuh dan mulut larva karena larva
mengambil makanan dari tempat hidupnya (Yunita et al., 2009). Dinding
tubuh merupakan bagian tubuh serangga yang dapat menyerap zat toksik
dalam jumlah besar (Yunita et al., 2009 cit Sastrodihardjo, 1979). Zat
toksik relatif lebih mudah menembus kutikula dan selanjutnya masuk ke
dalam tubuh serangga karena pada umumnya serangga berukuran kecil
sehingga luas permukaan luar tubuh yang terpapar relatif lebih besar
(terhadap volume) dibandingkan mamalia. Selain itu, kutikula bersifat
hidrofob dan lipofilik sehingga senyawa bioaktif yang bersifat non polar
3. Saponin
Saponin adalah suatu glikosida yang banyak ditemukan pada
tanaman. Saponin ada pada seluruh tanaman dengan konsentrasi tinggi
pada bagian-bagian tertentu, dan dipengaruhi oleh varietas tanaman dan
tahap pertumbuhan. Fungsi dalam tumbuh-tumbuhan tidak diketahui,
mungkin sebagai bentuk penyimpanan karbohidrat, atau merupakan waste
product dari metabolisme tumbuh-tumbuhan. Kemungkinan lain adalah
sebagai pelindung terhadap serangan serangga. Struktur kimia saponin :
Sifat-sifat Saponin adalah
a. Mempunyai rasa pahit
b. Dalam larutan air membentuk busa yang stabil
c. Menghemolisa eritrosit
d. Merupakan racun kuat untuk ikan dan amfibi
e. Membentuk persenyawaan dengan kolesterol dan hidroksisteroid
lainnya
f. Sulit untuk dimurnikan dan diidentifikasi
g. Berat molekul relatif tinggi, dan analisis hanya menghasikan formula
h. Toksisitasnya mungkin karena dapat menurunkan tegangan permukaan
(surface tension). Dengan hidrolisis lengkap akan dihasilkan sapogenin
(aglikon) dan karbohidrat (hexose, pentose dan saccharic acid).
Saponin mengandung gugus gula terutama glukosa, galaktosa,
xylosa, rhamnosa atau methilpentosa yang berikatan dengan suatu aglikon
hidrofobik (sapogenin) berupa triterpenoid, steroid atau steroid alkaloid.
Aglikon dapat mengandung satu atau lebih ikatan C-C tak jenuh. Rantai
oligosakarida umumnya terikat pada posisi C3 (monodesmosidic), tetapi
beberapa saponin mempunyai gugus gula tambahan pada C26 atau C28
(bidesmosidic). Struktur saponin yang sangat kompleks terjadi akibat
bervariasinya struktur aglikon, sifat dasar rantai dan posisi penempelan
gugus gula pada aglikon. Steroid saponin tersusun atas inti steroid (C27)
dengan molekul karbohidrat. Hidrolisis steroid saponin akan memberikan
aglikon yang dikenal sebagai sarsaponin. Beberapa contoh steroid saponin
adalah Asparagosides, Avenocosides, Disogenin (C23H22O6), Ecdysterone
(C27H44O7), Tigogenin (C27H44O3). Saponin triterpenoid tersusun atas
suatu triterpen (C30) dengan molekul karbohidrat. Hidrolisis saponin
triterpenoid akan memberikan aglikon yang dikenal sebagai sapogenin.
Tipe saponin ini merupakan derivat dari β-amyrine. Beberapa contoh
saponin triterpenoid adalah Asiaticoside (C48H78O18), Bacoside Cyclamin
(C58H94O27), Glychyrhizin (C42H62O16), Panaxadiol and panaxatriol.
Kematian pada ikan, mungkin disebabkan oleh gangguan pernafasan.
dimakan. Tidak toksiknya untuk manusia dapat diketahui dari minuman
seperti bir yang busanya disebabkan oleh saponin (Oey Kam Nio, 1999).
Saponin sebagai bahan yang mirip deterjen mempunyai
kemampuan untuk merusak membran tubuh larva (Yunita et al., 2009 cit
Hopkins dan Huner, 2004). Bahan deterjen dapat meningkatkan penetrasi
senyawa toksik karena dapat melarutkan bahan-bahan lipofilik dengan air.
Deterjen tidak hanya mengganggu lapisan lipoid dari epikutikula tetapi
juga mengganggu lapisan protein endokutikula sehingga senyawa toksik
dapat masuk dengan mudah ke dalam tubuh larva (Yunita et al., 2009 cit
Matsumura, 1976; Tarumingkeng, 1992). Saponin dapat menyebabkan
destruksi saluran pencernaan larva dengan cara menurunkan tegangan
permukaan sehingga selaput mukosa saluran pencernaan menjadi korosif
(Nurcahyati, 2008 cit Aminah et al., 2001). Hal tersebut akan
menyebabkan menurunnya aktivitas enzim pencernaan dan penyerapan
makanan (Nopianti, 2008).
4. Tanin
Tanin merupakan substansi yang tersebar luas dalam tanaman,
seperti kulit buah, daun, buah yang belum matang , batang dan kulit kayu.
Tanin dikatakan sebagai sumber asam pada buah. Tanin terdiri dari
golongan tanin yang dapat terhidrolisis, golongan yang tak dapat
terhidrolisis dan pseudotanin. Salah satu contohnya adalah asam galat
(gallic acid) yang memiliki rumus molekul C6H2(OH)3COOH dengan
Sifat-sifat tanin:
a. Dalam air membentuk larutan koloidal yang bereaksi asam dan sepat
b. Mengendapkan larutan gelatin dan larutan alkaloid
c. Tidak dapat mengkristal
d. Larutan alkali mampu mengoksidasi oksigen
e. Mengendapkan protein dari larutannya dan bersenyawa dengan protein
tersebut sehingga tidak dipengaruhi oleh enzim proteolitik.
Sifat kimia tanin:
a. Merupakan senyawa kompleks dalam bentuk campuran polifenol yang
sukar dipisahkan sehingga sukar mengkristal.
b. Tanin dapat diidentifikasi dengan kromotografi.
c. Senyawa fenol dari tanin mempunyai aksi adstrigensia, antiseptik dan
pemberi warna.
Mekanisme kerja tanin hampir sama dengan saponin yaitu
sama-sama dapat menurunkan aktivitas enzim pencernaan dan penyerapan
makanan sehingga tanin dan saponin bersifat sebagai racun perut (Asiah,
2008 cit Nursal dan Pasaribu, 2003). Tanin dapat mengganggu serangga
dalam mencerna makanan karena tanin akan mengendapkan protein dalam
tersebut mengakibatkan proses penyerapan protein dalam sistem
pencernaan menjadi terganggu (Yunita et al., 2009 cit Hopkins dan Huner,
2004).
5. Flavonoid
Senyawa flavonoid adalah suatu kelompok senyawa fenol yang
terbesar yang ditemukan di alam. Senyawa-senyawa ini merupakan zat
warna merah, ungu dan biru dan sebagai zat warna kuning yang ditemukan
dalam tumbuh-tumbuhan. Struktur kimia flavonoid :
flavonoid isoflavon
neoflavonoid
Flavonoid mempunyai kerangka dasar karbon yang terdiri dari 15
atom karbon, di mana dua cincin benzen (C6) terikat pada suatu rantai
propana (C3) sehingga membentuk suatu susunan C6-C3-C6. Susunan ini
dapat menghasilkan tiga jenis struktur senyawa flavonoid yaitu flavonoid
atau 1,3-diarilpropana, isoflavonoid atau 1,2-diarilpropana dan
neoflavonoid atau 1,1-diarilpropana. Flavonoid seperti quersetin memiliki
C15H12O2. Sebagian besar senyawa flavonoid alam ditemukan dalam
bentuk glikosida, di mana unit flavonoid terikat pada suatu gula. Glikosida
adalah kombinasi antara suatu gula dan suatu alkohol yang saling
berikatan melalui ikatan glikosida. Pada prinsipnya ikatan glikosida
terbentuk apabila gugus hidroksil dari alkohol beradisi kepada gugus
karbonil dari gula. Flavonoid dapat ditemukan sebagai mono-, di-, atau
triglikosida di mana satu, dua atau tiga gugus hidroksil dalam molekul
flavonoid terikat oleh gula. Poliglikosida larut dalam air dan sedikit larut
dalam pelarut organik seperti eter, benzen, kloroform dan aseton (Lenny,
2006).
Flavonoid yang merupakan golongan fenol dapat menyebabkan
penggumpalan protein. Denaturasi protein tersebut menyebabkan
permeabilitas dinding sel dalam saluran pencernaan menurun. Hal ini akan
mengakibatkan transpor nutrisi terganggu sehingga perumbuhan terhambat
dan akhirnya larva nyamuk akan mati (Hayati, 2006). Selain itu, menurut
Dinata (tanpa tahun) flavonoid merupakan salah satu jenis senyawa yang
bersifat racun. Flavonoid mempunyai sifat yang khas yaitu bau yang
sangat tajam, dapat larut dalam air dan pelarut organik serta mudah terurai
pada temperatur tinggi. Flavonoid digunakan sebagai bahan aktif dalam
pembuatan insektisida nabati. Flavonoid masuk ke dalam mulut
serangga/lubang alami di tubuh serangga dan menimbulkan kelayuan pada
6. Limonoid
Senyawa dengan golongan terpenoid yaitu limonoida yang
berfungsi sebagai larvasida (Utariningsih dan Purwanti, 2010 cit Ferguson,
2002). Senyawa limonoida terdapat dalam 2 bentuk yaitu limonoida
aglicones (LA) dan limonoida glucosida (LG). Limonoida aglicones (LA)
menyebabkan rasa pahit pada jeruk dan tidak larut dalam air. Sedangkan
limonoida glucosoida tidak menyebabkan rasa pahit pada jeruk dan dapat
larut dalam air. Limonoida aglicones selama proses maturasi (pemasakan)
dari buah proses ini disebut natural debithoring process (Utariningsih dan
Purawnti cit Jiaxing, 2001). Limonoida aglycones dibagi lagi menjadi 4
golongan yaitu limonin, colamin, ichangensin dan 7a-acetate limonoida.
Di antara empat golongan tersebut yang paling dominan dan menyebabkan
rasa pahit pada jeruk dan mempunyai efek larvasida paling potensial
adalah limonin. Kandungan senyawa limonoida paling tinggi pada
tanaman jeruk didapatkan pada bagian biji yaitu 927 µg/100 mg, pada
bagian daun tanaman adalah 36,6 µg/100 mg, pada bagian kulit 2,5 µg/100
mg, dan yang paling sedikit pada buah yaitu hanya 0,7 µg/100 mg.
Limonoid adalah salah satu jenis senyawa yang bersifat racun. Limonoid
dinyatakan sebagai modifikasi triterpenes, yang mempunyai 4,4,8
trimethyl-17 furanyl steroid. Susunan sub grup dan struktur ikatan itu
mempengaruhi karakteristik sifat dasar yang dibentuk selama pertumbuhan
pada produk tanaman yang menghasilkannya. Rumus molekul limonin
Sifat dasar limonoid mencakup: kegunaannya sebagai insektisida,
regulasi pertumbuhan insek, insek antifidan dan pengaruh medis terhadap
binatang dan manusia seperti antibakteri, viral dan antifungi (Utariningsih
dan Purawanti, 2010). Berpotensi sebagai antifidan terhadap serangga, zat
pengatur tumbuh dan zat toksik pada kutu beras, larvasida, anti mikroba,
penolak serangga (repellent) dan penghambat reproduksi (Utariningsih dan
Purwanti, 2010 cit Jiaxing, 2001). Senyawa limonoida merupakan analog
hormon juvenille pada serangga yang berfungsi sebagai pengatur
pertumbuhan kutikula larva (Ruberto, 2002).
Sebagai racun perut, limonoid dapat masuk ke dalam tubuh larva
Aedes aegypti melalui sistem pencernaan dan menyebabkan mekanisme
penghambatan makan (Mendel et al., 1991; Ruberto et al., 2002;
Utariningsih dan Purwanti, 2010 cit Jiaxing, 2001). Saraf pusat pada larva
Aedes aegypti terdiri dari sepasang rantai saraf yang terdapat di sepanjang
tubuh bagian ventral. Pada tiap segmen terjadi suatu pengumpulan saraf
yang disebut ganglion. Limonoid dapat menyebar ke jaringan saraf dan
Selain itu limonoid dapat masuk ke dalam tubuh larva Aedes
aegypti melalui kulit atau dinding tubuh dengan cara osmosis karena kulit
atau dinding tubuh larva bersifat permeable terhadap senyawa yang
dilewati. Limonoid tersebut akan masuk ke sel-sel epidermis yang selalu
mengalami pembelahan dalam proses pergantian kulit, sehingga sel-sel
epidermis mengalami kelumpuhan (paralisis) dan akhirnya mati
(Utariningsih dan Purwanti, 2010 cit Sastrodiarjo, 1984).
7. Sitronela
Senyawa sitronela yang terdapat dalam minyak atsiri mempunyai
sifat racun dehidrasi (desiccant). Racun tersebut merupakan racun kontak
yang dapat masuk ke dalam tubuh serangga melalui kulit, celah atau
lubang alami pada tubuh atau langsung mengenai mulut serangga serta
dapat menyebabkan kematian larva Aedes aegypti karena kehilangan
cairan terus-menerus (Aryanto, 2008 cit Abidillah, 2007). Mekanisme
kerja sitronela menghambat enzim asetilkolinesterase dengan melakukan
fosforilasi asam amino serin pada pusat asteratik enzim yang
bersangkutan. Gejala keracunannya, karena adanya penimbunan
asetilkolin yang menyebabkan terjadinya gangguan sistem saraf pusat,
kejang, kelumpuhan pernafasan dan kematian (Yanur et al., 2007 cit
Mutchler, 1991). Rumus molekul sitronela adalah C10H18O dengan
B. Kerangka Pemikiran
Gambar 1. Skema Kerangka Pemikiran
C. Hipotesis
Air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis)
berpengaruh terhadap tingkat kematian larva Aedes aegypti instar III In vitro. Air perasan kulit jeruk manis
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini termasuk jenis penelitian eksperimental laboratorium,
yaitu penelitian dengan memberikan perlakuan atau manipulasi kepada subjek
penelitiannya dan observasi dilakukan untuk membuktikan adanya efek dari
perlakuan yang dilakukan di laboratorium (Murti, 2006).
B. Lokasi dan Waktu penelitian
Penelitian dilakukan di Laboratorium Balai Besar Penelitian dan
Pengembangan Vektor dan Reservoir Penyakit (B2P2VRP) Salatiga, Jawa
Tengah. Penelitian dilakukan pada tanggal 15-17 Juni 2010.
C. Objek Penelitian
Objek penelitian adalah air perasan kulit jeruk manis (Citrus aurantium
sub spesies sinensis) yang digunakan sebagai larvasida terhadap Aedes aegypti
instar III.
D. Teknik Sampling
Pengambilan sampel larva Aedes aegypti dilakukan secara Simple
Random Sampling (SRS) yaitu pengambilan sampel yang dilakukan dengan
cara sedemikian rupa sehingga setiap anggota sampel memiliki kesempatan
yang sama untuk dipilih sebagai sampel (Taufiqqurahman, 2003). Besar
P2 : perlakuan 2 dengan konsentrasi air perasan kulit jeruk
manis 1%
P3 : perlakuan 3 dengan konsentrasi air perasan kulit jeruk
manis 1,5%
P4 : perlakuan 4 dengan konsentrasi air perasan kulit jeruk
manis 2%
P5 : perlakuan 5 dengan konsentrasi air perasan kulit jeruk
manis 2,5%
F. Identifikasi Variabel Penelitian
1. Variabel bebas
Variabel bebas adalah variabel yang mempengaruhi atau yang
menyebabkan berubahnya nilai dari variabel terikat dan merupakan
variabel pengaruh yang paling diutamakan. Variabel bebas dalam
penelitian ini adalah air perasan kulit jeruk manis (Citrus aurantium sub
spesies sinensis).
2. Variabel terikat
Variabel terikat adalah variabel yang diduga nilainya akan berubah
karena adanya pengaruh dari variabel bebas. Variabel terikat dalam
penelitian ini adalah jumlah kematian larva Aedes aegypti instar III.
3. Variabel kendali
Variabel kendali adalah variabel yang diduga berpengaruh terhadap
variabel terikat, tetapi dalam penelitian ini diupayakan agar mempunyai
pengaruh sama terhadap variabel terikat. Variabel kendali dalam penelitian
a. Stadium larva : instar III
b. Media hidup, dikendalikan dengan menggunakan air dari tempat dan
waktu yang sama. Gelas plastik yang digunakan terbuat dari bahan dan
ukuran yang sama.
c. Kepadatan larva, dikendalikan dengan menyamakan jumlah larva
dalam satuan volume air tiap kelompok uji.
d. Lama pemaparan : selama 24 jam.
e. Makanan larva : selama penelitian, pada semua kelompok uji tidak
diberikan bahan makanan.
4. Variabel pengganggu
Variabel pengganggu adalah variabel pengaruh yang tidak termasuk
kelompok variabel bebas dan variabel kendali yang juga berpengaruh
terhadap variabel terikat tetapi dalam penelitian ini tidak dapat
dikendalikan. Variabel pengganggu dalam penelitian ini adalah kesehatan
larva Aedes aegypti instar III.
G. Definisi Operasional Variabel Penelitian
1. Air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis)
Air perasan adalah larutan dalam air dan memiliki seluruh bahan
yang terkandung dalam tumbuhan segarnya, sebanding dengan material
awalnya, yang tetap tinggal hanyalah bahan yang tidak terlarut
dilakukan dengan maksud agar larutan yang diperas dapat terpisahkan
dari bahan padat pengotor. Cairan yang diperoleh melalui cara perasan
umumnya dibebaskan dari partikel-partikel kecil pengotor melalui cara
penyaringan. 100 gr kulit jeruk manis yang sudah dibersihkan dan diiris
kecil dilarutkan dengan 100 ml aquades, diblender dan diperas. Hasil
tersebut dianggap sebagai konsentrasi 100%. Skala pengukuran yang
digunakan adalah skala interval.
2. Jumlah kematian larva
Jumlah kematian larva adalah jumlah larva yang mati dalam setiap
kelompok uji, skala variabel rasio.
Kematian larva, larva dianggap mati apabila :
a. Larva diberi rangsangan gerakan air tidak ada respon gerakan.
b. Larva disentuh dengan lidi tidak ada respon gerakan.
3. Tingkat kematian larva
Tingkat kematian larva adalah jumlah larva uji yang masuk dalam
kriteria mati.
H. Alat dan Bahan Penelitian
1. Instrumen penelitian
a. Pisau
b. Blender merk Miyako
d. Timbangan jarum merk Camry
e. Gelas plastik ukuran 240 ml
f. Gelas ukur 100 ml
g. Pipet ukur 10 ml
h. Pipet tetes 5 ml
2. Bahan penelitian
a. Larva Aedes aegypti instar III
b. Kulit jeruk manis (Citrus aurantium sub spesies sinensis)
c. Air keran
d. Aquades
I. Cara kerja
1. Tahap pembuatan air perasan kulit jeruk manis
a. 100 gr kulit jeruk manis dicuci bersih dengan air mengalir untuk
menghilangkan kotoran yang menempel dan diangin-anginkan
b. Kulit tersebut kemudian diiris kecil-kecil untuk mempermudah dalam
memperoleh hasil perasan.
c. Irisan itu dilarutkan dengan 100 ml aquades dan dilumatkan dengan
blender
d. Hasil blenderan diperas dan disaring dengan saringan plastik yang dilapisi
kain, kemudian berikutnya dengan kertas saring
2. Tahap uji pendahuluan
a. Ditentukan konsentrasi air perasan kulit jeruk manis yang akan digunakan.
mengacu pada penelitian tentang toksisitas ekstrak kulit jeruk manis
sebagai larvasida nabati pembasmi larva nyamuk Aedes aegypti.
b. Air perasan kulit jeruk manis diambil dengan pipet ukur lalu dimasukkan
ke dalam gelas ukur. Volume air perasan kulit jeruk manis yang diambil
dihitung dengan rumus pengenceran sebagai berikut :
(Kitti, 1996 dalam Wijaya, 2009)
Keterangan :
V1 : Volume larutan mula-mula
M1 : Konsentrasi larutan mula-mula
V2 : Volume larutan sesudah diencerkan
M2 : Konsentrasi larutan sesudah diencerkan
Tabel 1 : Komposisi air perasan kulit jeruk manis dan air keran pada
konsentrasi 0%, 1%, 2%, 3%, 4% dan 5%.
Konsentrasi (%) Komposisi
Air perasan kulit
d. Pengamatan dilakukan dengan menghitung persentase kematian larva
pada jam ke-24.
3. Tahap uji penelitian
a. Ditentukan konsentrasi air perasan kulit jeruk manis yang akan digunakan
setelah dilakukan uji pendahuluan.
b. Air perasan kulit jeruk manis diambil dengan pipet ukur lalu dimasukkan
ke dalam gelas ukur. Volume air perasan kulit jeruk manis yang diambil
dihitung dengan rumus :
(Kitti, 1996 dalam Wijaya, 2009)
Keterangan :
V1 : Volume larutan mula-mula
M1 : Konsentrasi larutan mula-mula
V2 : Volume larutan sesudah diencerkan
M2 : Konsentrasi larutan sesudah diencerkan
c. Setiap konsentrasi dilakukan 5 kali ulangan dengan mengacu pada rumus
Federer :
(t - 1) (r - 1) ≥ 15
(5 – 1) (r – 1) ≥ 15
4r – 4 ≥ 15
r ≥ 4,6 Æ 5 x ulangan
di mana t : jumlah perlakuan
r : jumlah pengulangan
15 : konstanta (bilangan tetap)
d. Dibuat kontrol positif sebagai pembanding dengan Abate, yaitu Abate 1
mg dicampurkan ke dalam 100 ml air dengan pengulangan 5 kali.
e. Jumlah larva yang mati dihitung pada jam ke-24 jam setelah perlakuan
diberikan (Wijaya, 2009 cit Calvacanti et al., 2004).
J. Teknik Analisis Data
Data yang diperoleh dari penelitian akan dianalisis secara statistik
menggunakan :
1. Uji Analisis Regresi Linier
Untuk mengetahui apakah ada hubungan antara jumlah kematian
larva dengan air perasan kulit jeruk manis.
2. Analisis Probit
Untuk mengetahui daya bunuh air perasan kulit jeruk manis terhadap
larva Aedes aegypti instar III yang dinyatakan dalam Lethal Concentration
BAB IV
HASIL PENELITIAN
A. Hasil Penelitian
1. Uji pendahuluan
Setelah dilaksanakan uji pendahuluan pada tanggal 15-16 Juni 2010
selama 24 jam, diperoleh hasil sebagai berikut.
Tabel 2 : Jumlah Kematian Larva Aedes aegypti pada Berbagai
Konsentrasi Air Perasan Kulit Jeruk Manis setelah 24 Jam
Perlakuan.
Hasil uji pendahuluan, sebagaimana tercantum dalam tabel 2,
selanjutnya dilakukan analisis probit, didapatkan LC50 pada konsentrasi
1,038 % dengan interval antara 0,723 % dan 1,278 % . Sedangkan LC99
Hasil ini yang mendasari penentuan konsentrasi percobaan sesungguhnya.
Kisaran konsentrasi yang akan digunakan untuk uji sesungguhnya dengan
menggunakan deret hitung sebanyak 6 konsentrasi yaitu 0% (kontrol),
0,5%, 1%, 1,5%, 2% dan 2,5%. Pada uji sesungguhnya dilakukan ulangan
sebanyak 5 kali dengan jumlah larva pada masing-masing perlakuan
sebanyak 25 ekor sehingga jumlah larva yang dibutuhkan adalah 750 ekor.
2. Uji penelitian
Penelitian yang telah dilakukan pada tangal 16-17 Juni 2010 di
Laboratorium Balai Besar penelitian dan Pengembangan Vektor dan
Reservoir Penyakit (B2P2VRP) Salatiga, didapatkan hasil sebagai berikut.
Tabel 3 : Jumlah Kematian Larva Aedes aegypti pada Berbagai
Konsentrasi Air Perasan Kulit Jeruk Manis setelah 24 Jam
Perlakuan.
pada ulangan ke- (ekor)
Berdasarkan data pada tabel 3 dapat diketahui bahwa pada kelompok
kontrol tidak ditemukan adanya kematian larva pada semua ulangan. Pada
kelompok perlakuan rata-rata kematian larva terendah terdapat pada
konsentrasi 0,5 % yaitu 19,2 % sedangkan rata-rata kematian larva
tertinggi terdapat pada konsentrasi 2,5 % yaitu 93,6 %. Selain itu dapat
diketahui bahwa jumlah kematian larva meningkat seiring dengan
peningkatan konsentrasi. Berdasarkan jumlah kematian larva pada setiap
perlakuan dapat dibuat grafik jumlah kematian larva yang dapat dilihat
pada grafik berikut.
Grafik 1. Grafik Jumlah Kematian Larva Aedes aegypti pada Berbagai
Konsentrasi setelah 24 Jam Perlakuan.
Berdasarkan grafik 1 dapat diketahui bahwa semakin tinggi
konsentrasi maka semakin tinggi pula persentase kematian larva Aedes
larva sebesar 100%, tetapi penelitian ini masih dapat diterima karena
menurut Purwanto et al. (1997) larvasida dinyatakan efektif bila memiliki
daya bunuh antara 50-100%.
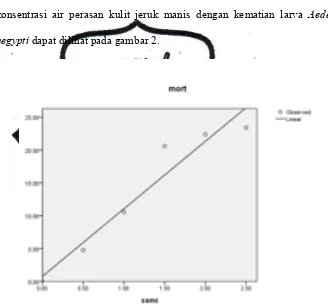
Garis regresi linier untuk menggambarkan hubungan antara
konsentrasi air perasan kulit jeruk manis dengan kematian larva Aedes
aegypti dapat dilihat pada gambar 2.
Gambar 2. Garis Regresi Linier Antara Konsentrasi Air Perasan Kulit
Jeruk Manis dengan Kematian Larva Aedes aegypti instar III.
Pada gambar 2, garis regresi linier dengan persamaan y = 0,790 +
10,274x menggambarkan hubungan antara konsentrasi air perasan kulit
jeruk manis dengan kematian larva Aedes aegypti instar III. Semakin tegak
garis regresi berarti dengan penambahan konsentrasi sedikit saja akan
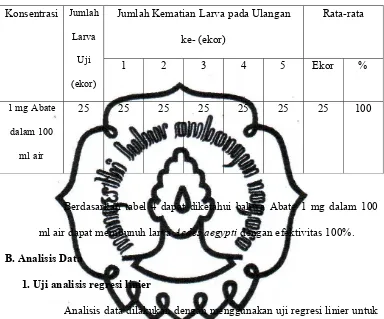
Tabel 4 : Jumlah Kematian Larva Aedes aegypti pada Larutan Abate 1 mg
dalam 100 ml Air setelah 24 Jam Perlakuan
Konsentrasi Jumlah
Larva
Uji
(ekor)
Jumlah Kematian Larva pada Ulangan
ke- (ekor)
Berdasarkan tabel 4 dapat diketahui bahwa Abate 1 mg dalam 100
ml air dapat membunuh larva Aedes aegypti dengan efektivitas 100%.
B. Analisis Data
1. Uji analisis regresi linier
Analisis data dilakukan dengan menggunakan uji regresi linier untuk
mencari hubungan antara variabel bebas dengan variabel terikat. Model
regresi linier sederhana dari populasi adalah :
Dengan
X adalah variabel bebas
Y adalah variabel terikat
β0 adalah intercept
β1adalah slope
(Suharjo, 2008)
Dari hasil analisis regresi linier didapatkan hasil bahwa terdapat
hubungan antara jumlah kematian larva Aedes aegypti instar III dan air
perasan kulit jeruk manis. Model persamaan regresi linier yang didapatkan
adalah y = 0,790 + 10,274 x.
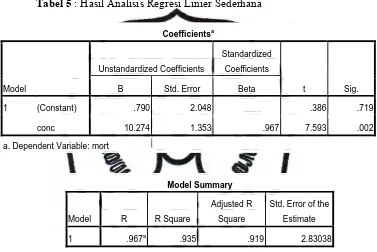
Tabel 5 : Hasil Analisis Regresi Linier Sederhana
Coefficientsa
a. Dependent Variable: mort
ANOVAb
Model Sum of Squares df Mean Square F Sig.
1 Regression 461.829 1 461.829 57.649 .002a
Residual 32.044 4 8.011
Total 493.873 5
a. Predictors: (Constant), conc
b. Dependent Variable: mort
Kualitas persamaan hasil analisis regresi linier tersebut dapat dinilai
dengan melihat hasil uji ANOVA dan Model Summary. Tampak bahwa Model Summary
nilai R Square model sebesar 0,935. Artinya bahwa variabel bebas
konsentrasi air perasan dapat menjelaskan variabel terikat jumlah kematian
larva secara linier sebesar 93,5%. Atau ada sebesar 6,5% yang tidak dapat
dijelaskan secara linier oleh konsentrasi air perasan. Dengan demikian
maka variabel konsentrasi merupakan variabel yang sangat baik untuk
menjelaskan variabel jumlah kematian larva. Semakin mendekati 100%
maka persamaan yang diperoleh semakin baik. Pada hasil uji anova
tersebut menunjukkan bahwa nilai F hitung sebesar 57,649 dengan taraf
signifikansi sebesar 0,002. Nilai ini kemudian dibandingkan dengan nilai F
tabel yang dihitung pada derajat bebas pembilang (df pembilang) sebesar 1
dan derajat bebas penyebut (df penyebut) sebesar 4 pada sebesar 0,05 yang
nilainya adalah 7,71. Tampak sangat jelas bahwa nilai F hitung = 57,649
lebih besar dari pada F tabel sebesar 7,71. Sehingga dapat disimpulkan
bahwa model yang dihasilkan adalah baik dan variabel jumlah kematian
larva dapat dijelaskan secara bersama oleh variabel konsentrasi air perasan
dan intercept-nya. Kemudian, makna yang dapat diambil adalah bahwa
jumlah larva yang mati bila konsentrasinya 0% maka larva yang mati
mencapai 0,790. Sedangkan penambahan konsentrasi air perasan akan
berpengaruh terhadap jumlah kematian larva dengan laju perubahan
jumlah sebesar 10,274 setiap penambahan konsentrasi air perasan sebesar
2. Analisis probit
Data dari penelitian dianalisis Probit dengan program SPSS 16.0 for
Windows dengan tingkat kepercayaan 95% didapatkan LC50 pada
konsentrasi 0,946 % dengan interval antara 0,763 % dan 1,117 %.
Sedangkan LC99 pada konsentrasi 4,064 % dengan interval antara 2,933 %
dan 7,333 %. Hasil analisis Probit selengkapnya dapat dilihat pada
BAB V
PEMBAHASAN
Berdasarkan tabel 3 dapat dilihat bahwa terjadi peningkatan rata-rata
kematian larva Aedes aegypti seiring dengan peningkatan konsentrasi air perasan
kulit jeruk manis. Hal ini sesuai dengan pendapat Adam (2005) yang menyatakan
bahwa semakin tinggi konsentrasi larvasida yang digunakan maka semakin tinggi
pula rata-rata kematian larva Aedes aegypti. Dengan demikian dapat diasumsikan
bahwa kematian pada larva uji disebabkan karena kandungan senyawa kimia
dalam air perasan kulit jeruk manis. Menurut komisi pestisida (1995), kriteria
pengujian insektisida yang diuji berdasarkan kematian dalam suatu periode, harus
mencapai paling sedikit 90% dalam waktu 24 jam. Hasil uji penelitian pada tabel
3 didapatkan persentase kematian tertinggi adalah 93,6% dengan konsentrasi 2,5%
sehingga hasil tersebut masih memenuhi kriteria pengujian.
Analisis probit digunakan untuk mengetahui daya bunuh air perasan kulit
jeruk manis terhadap kematian larva Aedes aegypti yang dinyatakan dengan LC
(Lethal Concentration). Pada penelitian ini dipilih istilah LC dan tidak LD atau
Lethal Dose karena sulit untuk menentukan dosis (jumlah air perasan kulit jeruk
manis yang masuk ke dalam tubuh larva) sehingga dipilih LC yang secara tepat
menggambarkan konsentrasi air perasan kulit jeruk manis pada media percobaan
(Matsumura, 1975).
LC50 adalah estimasi besar konsentrasi air perasan kulit jeruk manis yang
%. Pada penelitian lain terhadap larva Aedes aegypti dengan menggunakan
ekstrak kulit jeruk manis didapatkan LD50 sebesar 0,55%, pada penelitian dengan
air perasan buah belimbing wuluh didapatkan hasil LC50 sebesar 1,580% dan
dengan air perasan buah mengkudu didapatkan hasil LC50 sebesar 13,218%.
Semakin rendah nilai LC50 suatu zat berarti zat tersebut mempunyai aktivitas yang
lebih tinggi dalam membunuh hewan coba. Karena dengan zat tersebut perlu
konsentrasi yang lebih rendah untuk mematikan hewan coba dalam waktu yang
sama (Chang, 2004). Oleh karena itu, dapat disimpulkan bahwa air perasan kulit
jeruk manis mempunyai aktivitas larvasida yang lebih rendah dibandingkan
dengan ekstrak kulit jeruk manis tetapi lebih tinggi dibandingkan dengan air
perasan buah mengkudu maupun buah belimbing wuluh.
Estimasi besar LC99 air perasan kulit jeruk manis terhadap larva Aedes
aegypti didapatkan pada konsentrasi 4,064%. Sedangkan LD100 dari ekstrak kulit
jeruk manis sebesar 1,1%, LC99 air perasan buah belimbing wuluh 5,502% dan air
perasan buah mengkudu 25,751%. Dengan demikian, air perasan kulit jeruk manis
mempunyai aktivitas larvasida yang lebih rendah dari ekstrak kulit jeruk manis
tetapi lebih tinggi dari air perasan buah belimbing wuluh maupun buah
mengkudu.
Estimasi konsentrasi larvasida yang diperlukan untuk mendapatkan probabilitas
0,99 untuk membunuh seekor serangga (LC99) sangat penting karena
menggunakan dosis yang lebih besar dari nilai estimasi ini dapat berbahaya bagi
lingkungan, kehidupan binatang lain dan kehidupan manusia. Sedangkan
mungkin akan berakibat adanya resistensi terhadap insektisida tersebut (Wijaya,
2009 cit Payton et al., 2003).
Menurut data pada tabel 4 dapat disimpulkan bahwa untuk membunuh
larva Aedes aegypti sebesar 100% diperlukan abate sejumlah 1mg dalam 100 ml
air sedangkan untuk air perasan kulit jeruk manis dibutuhkan sebesar 4,064 ml
dalam 100 ml air. Dengan kata lain, abate memiliki efektivitas yang lebih tinggi
dalam membunuh larva Aedes aegypti. Namun, bukan berarti air perasan kulit
jeruk manis lebih buruk secara keseluruhan karena air perasan kulit jeruk manis
memiliki kebaikan-kebaikan tersendiri dalam penggunaannya, yaitu tidak
mencemari lingkungan karena mudah diuraikan oleh alam dan tidak mudah
menimbulkan resistensi pada larva. Selain itu, dari data tabel 4 juga dapat
disimpulkan bahwa larva yang digunakan dalam penelitian ini belum resisten
BAB VI
SIMPULAN DAN HASIL
A. SIMPULAN
Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa
air perasan kulit jeruk manis (Citrus aurantium sub spesies sinensis)
berpengaruh terhadap tingkat kematian larva Aedes aegypti instar III In vitro
dengan LC50 sebesar 0,946% dan LC99 sebesar 4,064%.
B. SARAN
Mengingat keterbatasan dalam penelitian ini maka peneliti ingin
menyarankan sebagai berikut :
1. Perlu adanya penelitian lebih lanjut tentang berapa lama efek air perasan
kulit jeruk manis (Citrus aurantium sub spesies sinensis) dalam
membunuh larva Aedes aegypti.
2. Perlu adanya penelitian lebih lanjut tentang efek toksik air perasan kulit
jeruk manis (Citrus aurantium sub spesies sinensis) terhadap
binatang-binatang dengan tingkatan yang lebih tinggi.
3. Perlu adanya penelitian lebih lanjut tentang zat dalam air perasan kulit jeruk