KARYA TULIS ILMIAH
PENAPISAN FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETILASETAT DAN N-HEKSAN DAUN JARAK PAGAR
(Jatropa curcas Linn) TERHADAP Shigella flexneri ATCC 12022
HALAMAN JUDUL
Disusun Untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun Oleh : NURUL NURAINI
20120350068
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
i
(Jatropa curcas Linn) TERHADAP Shigella flexneri ATCC 12022
HALAMAN JUDUL
Disusun Untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun Oleh : NURUL NURAINI
20120350068
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
ii
iii
Nama : Nurul Nuraini
NIM : 20120350068
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Menyatakan dengan sebenarnya bahwa Karya Tulis Ilmiah yang saya tulis ini benar-benar merupakan hasil karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum pada Daftar Pustaka dibagian akhir Karya Tulis Ilmiah ini.
Apabila dikemudian hari terbukti atau dibuktikan Karya Tulis Ilmiah ini hasil jiplakan, maka saya bersedia menerima sanksi atas perbuatan tersebut.
Yogyakarta, 29 Agustus 2016 Yang membuat pernyataan,
Tanda Tangan
iv MOTTO
Niscaya Allah akan mengangkat (derajat) orang-orang yang beriman
diantaramu dan orang-orang yang diberi ilmubeberapa derajat (QS :
Al-Mujadilah 11)
Maka nikmat Tuhanmu yang manakah yang kamu dustakan ?
(QS : Ar-Rahman 13)
Sebaik-baik manusia adalah yang paling bermanfaat bagi manusia
lainnya.
(HR. Tabrani)
v
nasehat dan kasih sayang serta pengorbanan. Jazakallahu khoiron katsir, Jazakillahu khoiron katsir untuk Bapak & Ibu. Maaf belum bisa memberikan
apa-apa untuk Bapa-apak dan Ibu. Semoga ini menjadi langkah awal anakmu ini bisa membanggakan Bapak dan Ibu.
Kepada kakakku (Zainur Ikhsanudin) dan kedua adikku (Ahmad Zainur Rohman dan Arfa Nur Yusuf ) Jazakallahu khoiron katsir untuk canda tawa, dukungan dan
vi
KATA PENGANTAR
Assalamu’alaikum Wr.Wb.
Puji syukur penulis panjatkan atas ke hadirat Allah SWT, atas segala petunjuk dan rahmat-Nya, sehingga penulis dapat menyelesaikan karya tulis ilmiah yang
berjudul “Penapisan Fitokimia Dan Uji Efektivitas Antibakteri Ekstrak Etilasetat
dan N- Heksan Daun J. curcas (Jatropa Curcas Linn) Terhadap Shigella flexneri ATCC 12022” sebagai salah satu syarat untuk menyelesaikan studi tingkat Sarjana
pada Program Studi Farmasi Universitas Muhammadiyah Yogyakarta.
Penyusunan Karya Tulis Ilmiah ini tidak terlepas dari bantuan berbagai pihak, maka dalam kesempatan ini penulis mengucapkan terimakasih kepada : 1. Bapak dr. H. Ardi Pramono, Sp.An., M.Kes selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta. 2. Ibu Sabtanti Harimurti, M.Sc., Ph.D., Apt selaku ketua Program Studi Farmasi
Universitas Muhammadiyah Yogyakarta.
3. Bapak Hari Widada, M.Sc., Apt selaku dosen pembimbing yang telah membantu dan membimbing dalam mengerjakan Karya Tulis ini.
4. Bapak Rifki Febriansah, M.Sc., Apt dan selaku dosen penguji 1 dan Ibu Sri Tasminatun, M.Sc., Apt selaku dosen penguji 2
vii saya seperti anak dan kakak sendiri.
8. Sahabat-sahabat kos mayasri (Indriyani, Myaditya, Eka F, Eka Novidah, Eka Muji, mbak Nova, dan Rosiana) terima kasih untuk kebaikan, dan kegilaannya selama di kos, terima kasih telah menjadi keluarga selama merantau di Jogja dan maaf kalau penulis punya banyak salah kepada kalian semua.
9. Kepada Waralita, Mustika, Usfi yang selalu mengingatkan untuk mengerjakan karya Tulis Ilmiah ini.
10.Sedulur KAMAGAYO (Keluarga Mahasiswa Grobogan Yogyakarta) yang menjadi keluarga dan teman selama di Jogja, yang membuat saya lebih kenal dengan daerah asal dan mengajak berkontribusi untuk daerah kita tercinta. 11.Teman-teman KKN kelompok 21 ( Reza, Wawan, Adi, Dindin, Erik, Fauzi,
Rangga, Rima, Sekar, Ziana, Mbak Nur, Nita, Fika, Usfi).
12.Teman-teman satu dosen pembimbing (Nazila, Tamam, Mita, Firza, Tri dan Aditya Dwi), kakak-kakak angkatan 2011 dan teman-teman angkatan 2012 untuk semua bantuannya.
13.Kepada semua pihak-pihak yang telah membantu, memberikan saran dan masukan kepada penulis.
viii
penulis, pembaca, serta kemajuan ilmu pengetahuan di bidang kesehatan pada umumnya dan menambah pengetahuan di bidang kesehatan masyarakat pada khususnya.
Aamiin ya Robbal’alamin….
Wassalamu’alaikum Wr. Wb
Yogyakarta, 29 Agustus 2016 Penulis
ix
C. Keaslian Penelitian………..
D. Tujuan Penelitian………
E. Manfaat Penelitian………..
BAB II TINJAUAN PUSTAKA………....
D. Ekstraksi dan Maserasi………..
E. Zat Antibakteri………
F. Uji Potensi Antibiotik……….
G. Kerangka Konsep………
H. Hipotesis……….
BAB III METODE PENELITIAN……….
A. Desain Penelitian………
B. Tempat dan Waktu Penelitian………. C. Populasi dan Sampel Penelitian……….. D. Variabel Penelitian dan Definisi Operasional………
1. Variabel Penelitian………
2. Definisi Operasional……….
E. Instrumen Penelitian………...
1. Alat………
2. Bahan………
F. Cara Kerja………...
1. Determinasi Tanaman………..
x
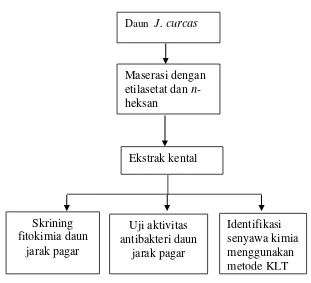
3. Ekstraksi………...
4. Analisis Kandungan Kimia Metode KLT………. 5. Uji Aktivitas Antibakteri………...
G. Skema Langkah Kerja……….
H. Analisis Data………...
1. Analisis Kandungan Kimia Metode KLT………. 2. Analisis Data Uji Antibakteri………
BAB IV HASIL PENELITIAN DAN PEMBAHASAN………
A. Hasil Penelitian………...
1. Identifikasi Tanaman……….
2. Pembuatan Ekstrak………
3. Kromatografi Lapis Tipis……….. 4. Analisis Penapisan Fitokimia……… 5. Uji Aktivitas Antibakteri………...
xi
Tabel 2 Rendemen ekstrak……… 29
Tabel 3 Nilai Rf Steroid ekstrak n-heksan dan etilasetat daun J. curcas…. 32 Tabel 4 Hasil analisis penapisan fitokimia ekstrak etilasetat dan n-heksan
daun J. curcas………. 33
xii
DAFTAR GAMBAR
Gambar 1 Shigella flexneri………... 11
Gambar 2 Jatropha curcas………. 12
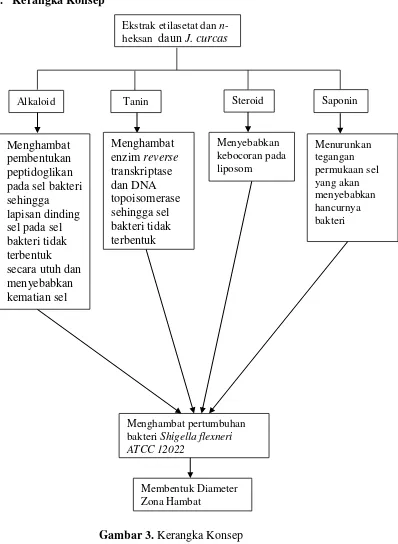
Gambar 3 Kerangka Konsep………. 17
Gambar 4 Skema penelitia……… 26
Gambar 5 Profil kromatogram steroid sebelum penyemprotan……… 30
Gambar 6 Profil Kromatogram steroid setelah penyemprotan………. 30
Gambar 7 Penapisan Fitokimia ekstrak etilasetat daun J.curcas (1) Uji Alkaloid dengan pereaksi Dragendorff (2) Uji Steroid dengan pereaksi Liberman Burcard (3) Uji Saponin dengan air (4) Uji Tanin dengan FeCl3……… 32
Gambar 8 Penapisan Fitokimia ekstrak n-heksan daun J.curcas Penapisan Fitokimia ekstrak etilasetat daun J.curcas (1) Uji Alkaloid dengan pereaksi Dragendorff (2) Uji Steroid dengan pereaksi Liberman Burcard (3) Uji Saponin dengan air (4) Uji Tanin dengan FeCl3……….. 32
Gambar 9 Diameter zona inhibisi ekstrak etilasetat daun J.curcas……….. 34
Gambar 10 Diameter zona inhibisi ekstrak n-heksan daun J. curcas………. 34
Gambar 11 Reaksi uji Dragendorff………. 40
Gambar 12 Reaksi perkiraan tannin dengan FeCl3……… 41
Gambar 13 Reaksi perkiraan uji Saponin………... 42
xiii
xiv
alkaloid, steroid dan saponin yang mempunyai efek antibakteri. Penelitian ini bertujuan untuk mengetahui kandungan senyawa dan efektivitas antibakteri etilasetat dan n-heksan daun Jatropha curcas dalam menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022.
Daun Jatropha curcas diekstraksi secara maserasi menggunakan pelarut etilasetat dan n-heksan. Ekstrak yang diperoleh kemudian dilakukan penapisan fitokimia dan uji KLT. Uji aktivitas antibakteri dilakukan dengan metode difusi cakram Kirby-Bauer menggunakan 5 konsentrasi yaitu 5%, 15%, 25%, 50% dan 75%. Kontrol positif menggunakan siprofloksasin 5 μg/ml. Diameter zona hambat yang terbentuk oleh ekstrak dibandingakan dengan diameter zona hambat Siprofloksasin.
Ekstrak etilasetat dan n-heksan daun Jatropha curcas mengandung senyawa streroid, saponin dan tanin. Ekstrak etilasetat daun Jatropha curcas juga mengandung senyawa alkaloid. Aktivitas antibakteri ekstrak etilasetat dan n-heksan daun Jatropha curcas terhadap bakteri Shigella flexneri ATCC 12022 termasuk dalam kategori lemah.
xv ABSTRACT
Diarrhea is a disease that commonly found in the digestive tract. A severe diarrhea is occurred when the blood was found in the stool (shigellosis). Jatropha curcas leaves identified containing some compounds such as tannin, alkaloid, steroid and saponin which has the effect of antibacterial. This assay aims to investigate the compounds and the antibacterial activity of ethyl acetat and n-hexane extract of Jatropha curcas leaves in inhibiting the growth of Shigella flexneri ATCC 12022.
Jatropha curcas leaves was extract using maceration method with ethyl acetat and n-hexane as the solvent. The extract was tested by TLC and phytochemical screening. Antibacterial activity assay was conducted by Kirby Bauer diffusion disc method using 5 concentration (5%, 15%, 25%, 50% and 75%). Ciprofloxacin 5mg/ml was used as positive control. The inhibition zone diameter of the extract was compared with the inhibition zone diameter of Ciprofloxacin.
The result showed that ethylasetat and n-hexane extract of Jatropha curcas containing steroid, saponin, tannin and alkaloid. The antibacterial activity of the extract as an inhibitor of Shigella flexneri ATCC 12022 growth had low activity.
1 A. Latar Belakang Penelitian
Diare merupakan salah satu penyakit saluran pencernaan yang umum ditemukan (CDC, 2014). Frekuensi kejadian diare pada negara berkembang lebih banyak 2-3 kali lipat dibandingkan dengan negara maju (Simadibrata & Daldiyono, 2009). Sebagai negara berkembang Indonesia tidak luput dari masalah diare. Tingginya angka kesakitan diare dihubungkan dengan kepadatan penduduk dan kebersihan yang masih kurang. Penyakit diare dapat menjadi lebih parah jika terjadi diare berdarah atau disebut juga Shigellosis (Nafianti & Sinuhaji, 2005).
Penelitian yang dilakukan Herwana, et al., (2010) pada Februari 2005 sampai September 2007 di Jakarta Selatan terhadap 612 anak usia 0-12 tahun yang mengalami diare menunjukkan 9,3% pasien disebabkan oleh Shigella sp dan Shigella flexneri merupakan spesies yang paling sering ditemukan dengan prevalensi sebesar 63,2%.
2
antibiotik antara lain disebabkan oleh penggunaan antibiotik yang tidak tepat
(Todar, 2009). Oleh karena itu perlu adanya alternatif untuk mengatasi resistensi
tersebut.
Pengobatan menggunakan senyawa tumbuhan merupakan salah satu alternatif untuk mengatasi hal tersebut. Salah satu tanaman yang sering dimanfaatkan adalah J. curcas. Di Indonesia pemanfaatan daun jarak sebagai antibakteri sudah banyak dilakukan.
Menurut Duke (dalam Sumarni, 2008), daun jarak mengandung senyawa metabolit sekunder seperti β-amyrin, β-sitosterol, stigmasterol, campesterol, 7-keto- β-sitosterol, isovitoksin dan viteksin. Daun J. curcas teridentifikasi mengandung senyawa tanin, alkaloid, steroid dan saponin (Akinpelu et al. 2009).
Mekanisme kerja tanin sebagai antibakteri adalah menghambat enzim reverse transkriptase dan DNA topoisomerase sehingga sel bakteri tidak terbentuk
(Nuria., et al., 2009). Alkaloid dapat menghambat pembentukan peptidoglikan pada sel bakteri sehingga lapisan dinding sel pada sel bakteri tidak terbentuk secara utuh dan menyebabkan kematian sel (Siregar, 2012).
Salah satu golongan terpenoid yang berpotensi sebagai antimikroba adalah triterpenoid. Senyawa triterpenoid yang terdapat pada tumbuhan tingkat tinggi
memiliki sifat antibiotik dan antifungi. Mekanisme kerja steroid sebagai antibakteri menyebabkan kebocoran pada liposom (Madduluri, 2013).
Mekanisme kerja saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel dan mengakibatkan senyawa intraseluler akan keluar berdifusi melalui membran luar dan dinding sel yang rentan kemudian mengikat membran sitoplasma sehingga mengganggu dan mengurangi kestabilan membrane sel. Hal ini menyebabkan kematian sel (Nuria, et al., 2009).
Dari hasil penelitian yang telah dilakukan, menunjukkan bahwa ekstrak etanol daun J. curcas dapat menghambat pertumbuhan bakteri Escherichia coli dengan tingkat konsentrasi 20% nilai DZI 18,125 mm, 40% nilai DZI 18,3 mm, 60% nilai DZI 18,375 mm, 80% nilai DZI 18,55 mm, dan 100% nilai DZI 18,675 mm (Hasibuan., 2016)
4
Yang artinya :
“Dengan air hujan itu Dia menumbuhkan untuk kamu tanam-tanaman; zaitun,
kurma, anggur dan segala macam buah-buahan. Sesungguhnya pada yang demikian itu benar-benar ada tanda (kebesaran Allah) bagi orang yang berpikir” (QS An Nahl : 11).
Yang artinya :
“Kemudian makanlah dari tiap-tiap (macam) buah-buahan dan tempuhlah
ajaran Tuhanmu yang telah dimudahkan (bagimu). Dari perut lebah itu keluar minuman (madu) yang bermacam-macam warnaya, di dalamnya terdapat obat yang menyembuhkan bagi manusia. Sesungguhnya pada yang demikian itu benar-benar terdapat tanda (kebesaran Tuhan) bagi orang-orang yang memikirkan” (QS. An-Nahl:69).
mengenai kegunaan dari tanaman daun J. curcas dan menambah nilai guna tanaman daun J. curcas di masyarakat.
B. Perumusan Masalah
1. Apa saja kandungan senyawa yang terdapat pada ekstrak etilasetat dan n-heksan daun J. curcas ?
2. Apakah ekstrak daun J. curcas mempunyai aktivitas antibakteri terhadap bakteri Shigella flexneri ATCC 12022 ?
3. Berapa diameter zona hambat ekstrak etilasetat dan n-heksan daun J. curcas dalam menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022 ?
C. Keaslian Penelitian
Telah ada penelitian mengenai aktivitas antibakteri ekstrak etanol daun J. curcas yang dilakukan oleh Sisunandar, et al., (2002). Hasil dari penelitian
tersebut adalah ekstrak etanol daun J. curcas mampu menghambat pertumbuhan bakteri S.aureus dengan konsentrasi 8% dan bakteri E.coli dengan konsentrasi 5%.
Windarwati (2011) melakukan penelitian tentang fraksi etilasetat dari ekstrak daun jarak berpotensi sebagai zat antimikroba dengan diameter penghambatan terhadap S.aureus.
Hasibuan (2016) melakukan penelitian tentang ekstrak etanol daun J. curcas terhadap bakteri Escherichia coli. Hasilnya ekstrak etanol daun J. curcas
6
konsentrasi 20% nilai DZI 18,125 mm, 40% nilai DZI 18,3 mm, 60% nilai DZI 18,375 mm, 80% nilai DZI 18,55 mm, dan 100% nilai DZI 18,675 mm.
Penelitian ini berbeda dengan penelitian yang pernah dilakukan sebelumnya. Pada penelitian Windarwati menggunakan fraksi etilasetat, penelitian Sisunandar dan Hasibuan menggunakan pelarut etanol untuk ekstraksi. Sedangkan pada penelitian ini menggunakan etilasetat dan n-heksan untuk melakukan ekstraksi. Selain itu pada penelitian Windarwati bakteri yang digunakan S.aureus, penelitian Sisunandar bakteri yang digunakan S.aureus dan bakteri E.coli dan pada penelitian Hasibuan bakteri yang digunakan E.coli. Pada penelitian ini bakteri yang digunakan adalah Shigella flexneri ATCC 12022.
D. Tujuan Penelitian
1. Mengetahui kandungan senyawa yang terdapat di dalam ekstrak etilasetat dan n-heksan daun J. curcas.
2. Mengetahui efektivitas ekstrak etilasetat dan n-heksan daun J. curcas. dalam menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022. 3. Mengetahui diameter zona hambat ekstrak etilasetat dan n-heksan daun J. curcas dalam menghambat pertumbuhan bakteri Shigella flexneri
ATCC 12022. E. Manfaat Penelitian.
1. Bagi Ilmu Pengetahuan
2. Bagi Masyarakat
Memberikan informasi pada masyarakat luas tentang kegunaan tanaman J. curcas, yang selama ini belum banyak diketahui manfaatnya.
3. Bagi Praktisi Kesehatan
8 BAB II
TINJAUAN PUSTAKA A. Disentri Basiler
1. Definisi
Shigellosis atau disentri basiler merupakan penyakit infeksi saluran pencernaan yang ditandai dengan diare cair akut atau dan disentri (tinja bercampur darah, lender, dan nanah), pada umumnya disertai demam dan nyeri perut (Krugman, et al., 1992; Levine, 2000). Penyakit ini ditularkan melalui jalan fekal-oral dengan masa inkubasi 1-7 hari, untuk terjadinya penularan tersebut diperlukan dosis minimal penularan 100 bakteri Shigella sp. ( Lima, et al., 1997; Zinner, et al., 2000; Sack, et al., 2014).
Berdasarkan aspek biokimia dan serologi, Shigella sp. dibagi menjadi 4 spesies, yaitu S.dysentriae (serogroup A), S.flexneri (serogroup B), S.boydii (serogroup C) dan S.sonei (serogroup D) (Krugman, et al., 1992; Guerrant, et al., 2000, Jawetz, et al., 1995).
Golongan Shigella yang sering menyerang manusia ialah S.dysenteriae, S.flexneri, S.boydii dan S.sonnei. Di daerah tropis yang sering ditemukan ialah
S.dysenteriae dan S.flexneri, sedangkan S.sonnei lebih sering dijumpai di daerah
sub tropis atau daerah industri (Abuhammour, 2002).
tersebut, 82,8% merupakan S. flexneri; 15,0% adalah S. sonnei; dan 2,2% merupakan S. Dysenteriae (Tjaniadi, et al.,. 2003).
2. Epidemiologi
Laporan epidemiologi menunjukkan bahwa 600.000 dari 140 juta pasien shigellosis meninggal setiap tahun di seluruh dunia (Iwalokun, et al., 2001). Setiap tahun, ada sekitar 500.000 kasus shigellosis di Amerika Serikat (Scallan, et al., 2011). Pada tahun 2013 rata-rata kejadian tahunan shigellosis di Amerika
Serikat adalah 4,82 kasus per 100.000 orang (Crim, et al., 20014). Data di Indonesia memperlihatkan 29% kematian diare terjadi pada umur 1 sampai 4 tahun disebabkan oleh disentri basiler (Edmundson, 2014). Tingginya insiden dan mortalitas dihubungkan dengan status sosial ekonomi yang rendah, kepadatan penduduk dan kebersihan yang kurang (Subekti, et al., 2001).
3. Etiologi
Disentri basiler disebabkan oleh bakteri genus Shigella. Di Indonesia, Shigella sp merupakan penyebab tersering ke-2 dari diare yang dirawat di rumah
sakit, yakni sebesar 27,3%. Dari keseluruhan Shigella sp tersebut, 82,8% merupakan S. flexneri; 15,0% adalah S. sonnei; dan 2,2% merupakan S. Dysenteriae (Tjaniadi, et al., 2003).
10
4. Pengobatan
Penanganan pertama pada penderita shigellosis adalah rehidrasi penderita. Pada shigellosis dehidrasi ringan sampai sedang dapat teratasi dengan larutan rehidrasi oral. Sedangkan pada dehidrasi yang berat, cairan infus diberikan dengan cepat (cairan isotonik 20-30 ml/kg berat badan dalam waktu satu jam) (Dzen, et al., 2003)
Secara umum infeksi yang disebabkan oleh bakeri dapat diobati dengan menggunakan antibiotik (Ashutoh, 2008). Antibiotik yang digunakan adalah Ampicillin sebagai drug of choice, tetapi banyak yang sudah resisten terhadap obat ini sehingga digunakan antibiotik lain. Trimethoprim-Sulfamethoxazole (Kotrimoksasol) merupakan pilihan efektif untuk Shigellosis. Obat golongan Sefalosporin generasi ketiga seperti Seftriakson ataupun Cefiksime bagi pasien yang mempunyai kontraindikasi terhadap pemberian Kotrimoksasol (Nafianti & Sinuhaji., 2005).
Obat golongan Quinolone generasi pertama (Nalidixic acid) juga efektif bagi pasien yang alergi terhadap Sulfas dan Sefalosporin (Farthing, et al., 2008). Berdasarkan penelitian yang telah dilakukan Trimetroprim dan Sulfametoxazol telah banyak mengalami resistensi. Mekanisme terjadinya resistensi yang paling banyak dianut adalah teori pembentukan enzim baru oleh Shigella (Nafianti & Sinuhaji, 2005).
meningkatkan risiko epidemiologi shigellosis, tidak terkecuali di Indonesia (Nafianti & Sinuhaji, 2005).
Bakteri Shigella sonnei resisten terhadap antibiotik Siprofloksasin, pada 243 orang di 32 negara bagian dan Puerto Rico antara Mei 2014 dan Februari 2015. California dan Pennsylvania menemukan bahwa hampir 90 % dari kasus yang diuji, resisten terhadap Siprofloksasin ,yang merupakan pilihan pertama untuk mengobati shigellosis pada orang dewasa di Amerika Serikat (CDC, 2015).
B. Shigella flexneri
Secara taksonomi klasifikasi Shigella flexneri dapat dilihat di bawah : Kerajaan : Bacteria
Divisio : Proteobacteria
Kelas : Gammaproteobacteria Bangsa : Enterobacteriales
Suku : Enterobacteriaceae Marga : Shigella
Jenis : Shigella flexneri
(Castellani & Chalmers, 1919)
Shigella flexneri merupakan salah satu bakteri penyebab diare dari genus
Shigella. Bakteri ini merupakan bakteri gram negatif berbentuk batang/basil
dan bersifat anaerob fakultatif. Shigella termasuk dalam suku Enterobacteriaceae, gram negatif berbentuk batang dan tidak berkapsul
(Lebenthal, 1989; Gomez, et al., 2001)
12
C. J. curcas (Jatropha curcas L.) 1. Klasifikasi
Secara Taksonomi klasifikasi tanaman J. curcas (Jatropa curcas L) dapat dilihat di bawah:
Kerajaan : Plantae
Subkerajaan : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Subkelas : Rosidae
Order : Euphorbiales Familia : Euphorbiaceae
Spesies : Jatropa curcas Linn (Sumber : Duke 1983)
2. Sifat Kimia Daun Jarak
Komponen kimia J. curcas dari daun dan ranting muda adalah stigmasterol triterpen siklik, stigmasterol-5-en-3b, 7b-diol, kholesterol-5-en-3b,
7b-diol, flavonoid apigenin, viteksin, dan dimer dari triterpen alkohol C
63H17O9
dan glikosida flavonoid. Beragam senyawa fitokima yang terdiri dari saponin, steroid, tanin, glikosida, alkaloid, dan flavonoid teridentifikasi pada kulit batang (Igbinosa, et al., 2009).
Penelitian yang dilakukan Sharma, et al., (2012) melaporkan adanya senyawa bioaktif seperti alkaloid, saponin, tanin, terpenoid, steroid, glikosida, fenol dan flavonoid dalam ekstrak akar, batang dan daun tanaman dalam satu pelarut metanol. Daun J. curcas teridentifikasi mengandung senyawa tanin, alkaloid, steroid dan saponin (Akinpelu et al. 2009).
Pada ekstrak daun dan kulit batang, senyawa dengan aktivitas antimikroba seperti sterol, steroid, dan triterpenoid relatif bisa ditemukan dibandingkan pada ekstrak bungkil jarak (Windarwati, 2011).
D. Ekstraksi dan Maserasi
14
Metode dalam ekstraksi umumnya dibedakan menjadi 2, yaitu dengan cara panas dan cara dingin. Metode cara panas misalnya adalah refluks, soxhletasi, digesti, infus, dan dekok. Sedangkan cara dingin meliputi maserasi dan perkolasi (Ditjen POM, 2000).
Metode maserasi adalah metode yang paling sering digunakan karena dianggap lebih mudah dan sederhana meskipun diperlukan waktu yang cukup lama dan membutuhkan cairan penyari yang lebih banyak. Maserasi adalah salah satu metode ekstraksi simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (Ditjen POM, 2000).
E. Zat Antibakteri
Antibakteri adalah senyawa yang digunakan untuk mengendalikan pertumbuhan bakteri yang bersifat merugikan. Pengendalian pertumbuhan mikroorganisme bertujuan untuk mencegah penyebaran penyakit dan infeksi, membasmi mikroorganisme pada inang yang terinfeksi, dan mencegah pembusukan serta perusakan bahan oleh mikroorganisme (Sulistyo, 1971).
Menurut Madigan, et al (2000), berdasarkan sifat toksisitas selektifnya, senyawa antimikrobia mempunyai 3 macam efek terhadap pertumbuhan mikrobia yaitu:
1. Bakteriostatik memberikan efek dengan cara menghambat pertumbuhan tetapi tidak membunuh.
3. Bakteriolitik menyebabkan sel menjadi lisis atau pecah sel sehingga jumlah sel berkurang atau terjadi kekeruhan setelah penambahan antimikrobia.
Mekanisme penghambatan antibakteri dapat dikelompokkan menjadi lima, yaitu menghambat sintesis dinding sel mikrobia, merusak keutuhan dinding sel mikrobia, menghambat sintesis protein sel mikrobia, menghambat sintesis asam nukleat, dan merusak asam nukleat sel mikrobia (Sulistyo, 1971).
F. Uji Potensi Antibiotik
Aktivitas antibakteri ditentukan oleh spektrum kerja (spektrum kerja luas, maupun sempit), cara kerja (bakterisida atau bakteriostatik) dan ditentukan pula oleh Konsentrasi Hambat Minimum (KHM) serta potensi hambatan pada KHM.
Uji aktivitas antibakteri dapat dilakukan dengan dua metode, yaitu uji difusi dan uji dilusi (Pratiwi, 2008).
a. Uji difusi : Metode disc diffusion, E-test, Dicth-plate technique, Cup-plate technique, Gradient-Cup-plate technique
b. Uji Dilusi : Metode dilusi cair, dan metode dilusi padat (Qaiyumi, 2007).
1) Metode disc diffusion
16
Beberapa koloni kuman dari pertumbuhan 24 jam diambil, disuspensikan ke dalam 0,5 ml BHI cair, kemudian diinkubasikan 5-8 jam pada 37°C. Suspensi ditambah akuades steril hingga kekeruhan tertentu sesuai dengan standar konsentrasi bakteri 108 CFU per ml. Kapas lidi steril dicelupkan ke dalam suspensi bakteri lalu ditekan-tekan pada dinding tabung hingga kapasnya tidak terlalu basah, kemudian dioleskan pada permukaan media agar hingga rata. Kemudian cakram kertas yang mengandung antibakteri diletakkan di atasnya, diinkubasi pada 37° selama 18-24 jam. Hasil yang dapat dilihat :
a) Zona radikal yaitu suatu daerah di sekitar disk dimana sama sekali tidak ditemukan adanya pertumbuhan bakteri. Potensi antibakteri diukur dengan mengukur diameter dari zona radikal.
18
H. Hipotesis
Berdasarkan landasan teori dan tinjaun pustaka yang telah dikumpulkan, maka hipotesis dari penelitian ini adalah
1. Ekstrak etilasetat dan n-heksan daun J. curcas mengandung senyawa alkaloid, tanin, saponin dan steroid.
2. Ekstrak etilasetat dan n-heksan daun J. curcas menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022.
19
Penelitian yang dilakukan menggunakan metode eksperimental laboratorium, mengenai uji potensi antibakteri ekstrak etilasetat dan n-heksan daun J. curcas terhadap Shigella flexneri ATCC 12022.
B. Tempat dan Waktu Penelitian
1. Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Laboratorium Penelitian Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Muhammadiyah Yogyakarta.
2. Waktu yang digunakan untuk penelitian ini adalah dimulai September 2015 sampai bulan Juni 2016.
C. Populasi dan Sampel Penelitian
1. Subyek penelitian ini adalah biakan murni bakteri Shigella flexneri ATCC 12022
2. Bahan Uji yang digunakan adalah daun J. curcas yang berasal dari Wirosari, Grobogan, Jawa Tengah.
D. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
20
Variabel Tergantung : Nilai Rf pada plat KLT
Variabel Terkendali : Waktu eluen mencapai batas plat b. Uji Aktivitas Antibakteri
Variabel Bebas : Konsentrasi ekstrak daun J. curcas pada variasi pelarut.
Variabel Tergantung : Nilai DZI masing-masing ekstrak daun J. curcas
Variabel Terkendali : Media pertumbuhan bakteri c. Variabel Pengganggu : Kontaminasi mikroba lain
Ketelitian pada pengamatan 2. Definisi Operasional
a. Rf atau faktor retardasi adalah jarak yang ditempuh sampel dengan jarak yang ditempuh fase gerak. Nilai Rf ini kemudian dibandingkan dengan nilai Rf senyawa.
b. DZI adalah diameter yang menunjukkan hambatan suatu senyawa antibakteri terhadap bakteri yang diuji dan dinyatakan dalam satuan mm.
E. Instrumen Penelitian 1. Alat
analitik (Mettler Toledo®), tabung reaksi (Pyrex®), penjepit dan rak tabung reaksi, cawan porselen, labu takar (Pyrex®), gelas ukur 100 mL (Pyrex®), gelas beker 100 mL dan 250 mL (Pyrex®), pipet tetes, pipet ukur (Pyrex®) jarum ose, bunsen, Hot Plate, autoklaf (ALP®), tip dan mikropipet (Transferpette®), cawan petri (Pyrex®), Biological Safety Cabinet (BSC) (Biobase®), lemari pendingin (LG®), jangka sorong (Mitutoyo®), dan spektrofotometri (Genesys 6®).
2. Bahan
Bahan yang digunakan pada penelitian ini antara lain daun J. curcas, air suling (Brataco®), alumunium foil, span 80 (Brataco®), kertas cakram steril, aseton (Brataco®), Siprofloksasin 2mg/ml (Oxoid®), tween 80, kertas saring, etilasetat (Brataco®), n-heksan (Brataco®), pereaksi Mayer (Merck®), pereaksi Dragendorff (Merck®), asam klorida (HCl) pekat (Merck®), (FeCl3) (Merck®), Anhidrida asetat (Merck®), H2SO4 pekat
(Merck®), Media Mac Conkey (Pronadisa®), (NaCl) 0,9%.
F. Cara Kerja
1. Determinasi Tanaman
Determinasi daun J. curcas dilakukan di laboratorium Biologi Farmasi, Fakultas Farmasi UGM.
2. Penyiapan Bahan
22
3. Ekstraksi
Pembuatan ekstrak dilakukan dengan metode maserasi. Simplisia daun J. curcas yang sudah kering dihaluskan hingga memenuhi derajat halus yang sesuai. Serbuk halus 350 gram diekstraksi menggunakan etilasetat dan 250 gram serbuk diekstraksi menggunakan n-heksan dalam bejana dengan perbandingan antara serbuk simplisia dan pelarut adalah 1:7 b/v. Proses maserasi dilakukan selama 4 hari dan dilanjutkan remaserasi selama 2 hari. Sari diserkai dan ampas diperas menggunakan kain flanel dan kertas saring. Filtrat yang diperoleh selanjutnya diuapkan dengan rotary evaporator hingga terbentuk ekstrak kental.
4. Analisis Kandungan Kimia Metode KLT
Ekstrak kental yang diperoleh dari maserasi diencerkan dengan masing-masing pelarut, yaitu etilasetat dan n-heksan. Selanjutnya plat KLT diberikan 2 penotolan, yaitu ekstrak etilasetat dan n-heksan. Plat KLT yang telah diberi perlakuan tersebut kemudian dimasukkan secara vertikal ke dalam bejana yang telah jenuh dengan fase gerak. Setelah fase gerak mencapai batas atas yang telah ditentukan pada plat KLT, selanjutnya plat dikeluarkan dari bejana dan dibiarkan mengering. Deteksi bercak hasil pemisahan dapat dilihat menggunakan lampu UV 254. Bercak pada larutan ekstrak yang telah terpisah kemudian dibandingkan dengan bercak pada larutan pembanding melaui perhitungan nilai Rf. Fase gerak dan fase diam yang digunakan pada pengujian ini adalah sebagai berikut :
Fase Diam : Silika gel 60 F 254 5. Uji Aktivitas Antibakteri
a. Sterilisasi Alat dan Bahan
alat yang akan digunakan disterilisasi terlebih dahulu. Alat-alat gelas disterilkan menggunakan oven dengan suhu 170°C selama 2 jam, media Mac Conkey disterilkan dengan autoklaf pada suhu 121°C selama 15 menit. Sedangkan ose dan pinset disterilkan dengan menggunakan bunsen. Pengerjaan uji mikrobiologi dilakukan secara aseptis di dalam LAF yang sebelumnya telah dibersihkan dengan alkohol 70%, lalu lampu UV dinyalakan selama 15 menit.
b. Pembuatan Kontrol Positif
Kontrol positif yang digunakan adalah siprofloksasin. Siprofloksasin yang digunakan untuk pengujian adalah 5 µg/ml dengan konsentrasi 5 µg/ml untuk satu cakram kertas. Untuk memperoleh larutan uji tersebut, maka sebanyak 1 ml sediaan siprofloksasin 2 mg/ml dimasukkan ke dalam labu takar 10 ml, kemudian ditambahkan air suling hingga volume mencapai 10 ml. Selanjutnya diambil 1 ml dan dimasukkan pada labu takar dan ditambahkan air suling hingga volume 10 ml. Diambil lagi 1 ml dan dimasukkan pada gelas ukur dan ditambahkan air suling hingga volume 4 ml.
c. Pembuatan Kontrol Negatif
24
d. Pembuatan Larutan Uji
Larutan uji dibuat variasi konsentrasi 5%, 10%, 25%, 50%, dan 75% v/v. Sebelumnya masing-masing ekstrak ditambahkan tween 80 10% b/v. Ekstrak etilasetat dan n-heksan daun J. curcas dibuat larutan induk dengan konsentrasi 75% dengan cara melarutkan 7,5 gram masing-masing ekstrak dengan air suling hingga volume 10 ml. Untuk membuat konsentrasi 50%, diambil 6,7 ml dari konsentrasi 75% dan di tambahkan air suling sampai 10 ml. Konsentrasi 25%, diambil dari 5 ml konsentrasi 50% yang ditambahkan air suling sampai 10 ml. Konsentrasi 15% , diambil dari 6 ml konsetrasi 25% yang ditambahkan air suling sampai 10 ml. Konsentrasi 5%, diambil dari 3,3 ml konsentrasi 15% yang ditambhakan air suling sampai 10 ml.
e. Pembuatan Media Agar
Media agar yang digunakan berasal dari Mac Conkey yang dilarutkan dalam air suling. Sebanyak 20 gram serbuk agar Mac Conkey dilarutkan dalam 385 ml air suling. Selanjutnya dimasukkan ke dalam alat gelas dan disterilkan menggunakan autoklaf pada suhu 121° C selama 15 menit. Kemudian media Mac Conkey tersebut dituangkan pada cawan petri dalam kondisi aseptik dalam Laminar Air Flow dan ditunggu hingga mengeras.
f. Preparasi Bakteri
0,9%. Kekeruhan yang diperoleh kemudian disetarakan dengan standar Mc Farland 0,5 dengan bantuan spektrofotometer dengan absorbansi
0,08-0,1 yaitu setara dengan jumlah pertumbuhan 1,5 x 108 sel bakteri/mL. Setelah itu larutan suspensi bakteri tersebut diambil sebanyak 1 ml dan ditambahkan dengan menggunakan nutrien BHI dengan perbandingan 1 : 9 sambil dihomogenkan dengan vortek.
g. Uji Daya Antibakteri
26
G. Skema Langkah Kerja
Gambar 1. Skema penelitian
H. Analisis Data
1. Analisis Kandungan Kimia Metode KLT
Analisis kandungan senyawa aktif dari ekstrak daun J. curcas dilakukan dengan cara membandingkan kesesuaian warna bercak dan harga Rf antara ekstrak daun J. curcas dan senyawa yang timbul setelah dilakukan elusi pada plat KLT.
2. Analisis Data Uji antibakteri
Penentuan aktivitas daya hambat antimikroba mengacu pada tabel kategori kekuatan aktivitas antibakteri. Data hasil pengukuran diameter zona hambat dibandingkan dengan Tabel 1.
Daun J. curcas
Maserasi dengan etilasetat dan n-heksan
Ekstrak kental
Identifikasi senyawa kimia menggunakan metode KLT Uji aktivitas
antibakteri daun jarak pagar Skrining
Tabel 1. Klasifikasi Respon Zona Hambat Bakteri.
Diameter zona hambat Respon hambatan pertumbuhan > 20 mm
16 - 20 mm < 15 mm
28
28 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN A. Hasil Penelitian
1. Identifikasi Tanaman
Determinasi tanaman yang dilakukan di Laboratorium Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada, menunjukkan bahwa simplisia yang digunakan dalam penelitian ini adalah daun J. curcas (Jatropha curcas L) yang termasuk dalam suku Euphorbiaceae. (Lampiran 1)
2. Pembuatan Ekstrak
Tabel 2. Rendemen ekstrak
Sampel Rendemen ekstrak kering
Daun daun J. curcas pelarut etilasetat
Daun daun J. curcas pelarut n-heksan
6% 3,6%
3. Kromatografi Lapis Tipis
Pada penelitian ini analisis dilakukan untuk memastikan adanya kandungan senyawa steroid yang terdapat dalam daun J. curcas secara kualitatif. Analisis kromatografi lapis tipis terhadap ekstrak etilasetat dan n-heksan daun J. curcas dilakukan dengan menggunakan fase diam silika GF254
dan fase gerak n-heksan dan etilasetat (7:3) v/v. Totolan ekstrak n-heksan dan etilasetat daun J. curcas pada plat silika menggunakan pipa kapiler. Untuk mengidentifikasi senyawa golongan steroid pada ekstrak etilasetat dan n-heksan daun J. curcas digunakan pereaksi semprot 10% H2SO4 dan
anhidridaasetat (Mittal, 2013).
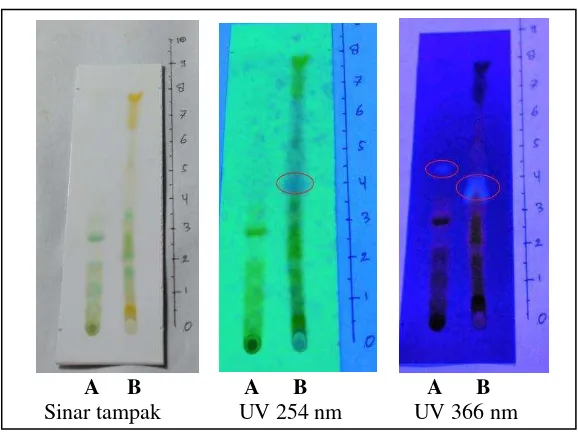
Bercak yang dihasilkan pada KLT lalu dideteksi dengan sinar tampak, sinar UV254, dan UV366 . Agar bercak pada lempeng KLT terlihat jelas dan
30
A B A B A B
Sinar tampak UV 254 nm UV 366 nm
Gambar 1. Profil kromatogram steroid sebelum penyemprotan (A)Ekstrak etilasetat, (B) ekstrak n-heksan
A B A B A B Sinar tampak UV 254 nm UV 366 nm
Gambar 2. Profil Kromatogram steroid setelah penyemprotan (A)Ekstrak etilasetat, (B) ekstrak n-heksan
Tabel 3. Nilai Rf Steroid ekstrak n-heksan dan etilasetat daun J. curcas Bercak Rf Warna Hasil Kromatografi Lapis Tipis
Tampak UV 254 nm UV 366 nm
1 0,52 - - 0,52
Pada pengukuran menggunakan lampu UV 254 nm bercak menunjukkan warna ungu, sedangkan pada pengukuran lampu 366 bercak berfluoresensi. Bercak pada ekstrak etilasetat menunjukkan Rf 0,52 dan pada n-heksan 0,50. Selanjutnya dilakukan penyemprotan dengan perekasi Libermann-Burcard. Pengamatan di bawah sinar UV 254 nm terlihat warna ungu dan di bawah sinar UV 366 nm terlihat bercak yang mengalami fluoresensi. Bercak pada ekstrak etilasetat menunjukkan Rf 0,52 dan pada n-heksan Rf 0,50.
4. Analisis Penapisan Fitokimia
Komponen yang terdapat di dalam ekstrak etilasetat dan n-heksan daun J. curcas dianalisis golongan senyawanya dengan tes uji warna menggunakan
beberapa pereaksi untuk golongan senyawa alkaloid, terpenoid, steroid, tanin dan saponin. Penapisan fitokimia adalah metode analisis untuk menentukan jenis metabolit sekunder yang terdapat dalam tumbuh-tumbuhan karena sifatnya yang dapat bereaksi secara khas dengan pereaksi tertentu. Penapisan fitokimia dilakukan melalui serangkaian pengujian dengan menggunakan pereaksi tertentu.
32
Tabel 4. Hasil analisis penapisan fitokimia ekstrak etilasetat dan n-heksan daun J. curcas
Uji fitokimia Pereaksi Hasil uji ekstrak Hasil uji ekstrak Etilasetat n-heksan Alkaloid Dragendroff (+) (-) Steroid anhidrida asetat-H2SO4 (+) (+)
Saponin air suling (+) (+)
Tanin FeCl3 (+) (+)
1 2 3 4
Gambar 3. Penapisan Fitokimia ekstrak etilasetat daun J.curcas (1) Uji Alkaloid dengan pereaksi Dragendorff (2) Uji Steroid dengan pereaksi Liberman
Burcard (3) Uji Saponin dengan air (4) Uji Tanin dengan FeCl3.
1 2 3 4
Gambar 4. Penapisan Fitokimia ekstrak n-heksan daun J.curcas Penapisan Fitokimia ekstrak etilasetat daun J.curcas (1) Uji Alkaloid dengan pereaksi
Dragendorff (2) Uji Steroid dengan pereaksi Liberman Burcard (3) Uji Saponin dengan air (4) Uji Tanin dengan FeCl3.
5. Uji aktifitas antibakteri
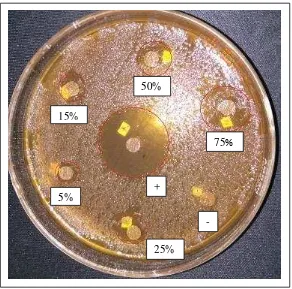
Uji aktivitas antibakteri ekstrak etilasetat dan n-heksan daun J. curcas
dilakukan dengan berbagai variasi konsentrasi ekstrak yaitu 5%, 15%, 25%,
50%, dan 75%. Sebelumnya ekstrak ditambahkan dengan tween 80 10% agar
bisa menyatu dengan air suling. Masing-masing variasi konsentrasi dilakukan
replikasi sebanyak 3 kali. Metode yang digunakan untuk pengujian adalah
metode difusi agar Kirby Bauer. Hasil pengujian aktivitas antibakteri bisa
dilihat pada Tabel 5 dan Gambar 9 & 10.
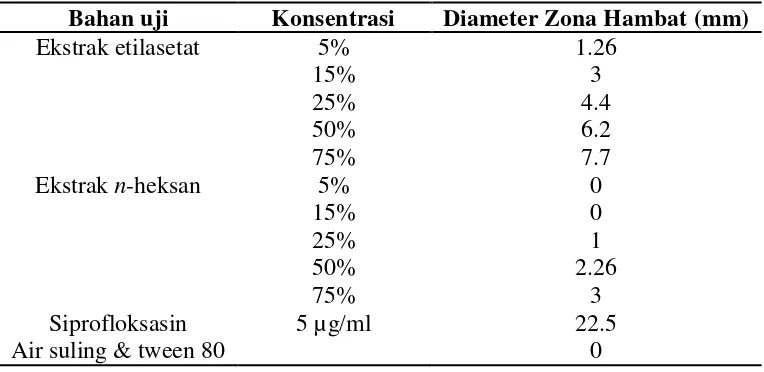
Tabel 5. Diameter zona hambat hasil pengujian
Bahan uji Konsentrasi Diameter Zona Hambat (mm) Ekstrak etilasetat
Ekstrak n-heksan
Siprofloksasin Air suling & tween 80
34
Gambar 5. Diameter zona inhibisi ekstrak etilasetat daun J.curcas
Gambar 6. Diameter zona inhibisi ekstrak n-heksan daun J. curcas 50%
75%
+
-
25% 15%
5%
+
50%
75%
- 25%
15%
B. Pembahasan
Langkah awal yang dilakukan pada penelitian ini adalah menetapkan kebenaran sampel yang di uji yaitu dengan cara determinasi tanaman. Uji determinasi tanaman dimaksudkan untuk memastikan kebenaran tanaman yang digunakan sehingga tidak terjadi kesalahan dalam pengambilan jenis sampel penelitian. Berdasarkan hasil uji determinasi tanaman, diperoleh informasi bahwa tanaman yang digunakan dalam penelitian ini adalah benar-benar daun J. curcas (Jatropha curcas L).
Untuk melakukan proses ekstraksi, daun J. curcas terlebih dahulu disortir untuk memisahkan daun yang tidak bagus dan muda. Selanjutnya daun J. curcas dikeringkan untuk menghilangkan kadar air pada sampel tumbuhan, agar kandungan senyawa yang diduga agen antibakteri tidak rusak oleh reaksi enzimatik dan juga mencegah terjadinya proses pembusukan selama proses penyimpanan (Katno, 2008). Setelah kering, simplisia dihaluskan dengan blender hingga menjadi serbuk. Penyerbukan dimaksudkan untuk memperluas daerah penarikan senyawa kimia, sehingga pada saat proses ekstraksi kontak antara pelarut dan sampel lebih efektif dan senyawa dapat terdesak dengan optimal. Proses pembuatan serbuk simplisia dapat mempengaruhi kualitas ekstrak, sehingga harus dilakukan dengan hati-hati (Depkes RI, 2000).
36
senyawa yang memiliki aktivitas antimikroba seperti sterol dan terpenoid, saponin, tanin, flavanoid serta senyawa fenol (Oyi et al. 2007). Sedangkan n-heksan dipilih sebagai pelarut, karena n-heksana bersifat stabil dan mudah menguap, selektif dalam melarutkan zat dan akan melarutkan senyawa seperti lilin, lemak, dan terpenoid yang bersifat nonpolar (Houghton dan Raman, 1998).
Maserasi dilakukan selama 4 hari dan dilanjutkan dengan 2 hari remaserasi. Proses maserasi dengan pengulangan (remaserasi) akan lebih efisien dibandingkan dengan maserasi tunggal, hal ini terjadi karena ada kemungkinan sejumlah besar senyawa aktif dalam sampel masih tertinggal dari proses maserasi yang pertama sehingga hasil esktraksi yang didapatkan optimal. Menurut Ditjen POM (2000) menyatakan bahwa proses ekstraksi suatu tanaman harus dilakukan secara berulang agar bisa mendapatkan kadar zat aktif yang maksimal sehingga dapat dicapai potensi terapi yang maksimal.
Proses maserasi sangat menguntungkan dalam isolasi senyawa bahan alam, karena dengan perendaman sampel tumbuhan akan mengalami pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam dan di luar sel sehingga metabolit sekunder yang berada di dalam sitoplasma akan terlarut dalam pelarut organik, dan ekstraksi senyawa akan sempurna karena dapat diatur lama perendaman yang dilakukan (Darwis, 2000).
hasil yang diperoleh dari proses maserasi tersebut. Selama proses maserasi dilakukan pengadukan secara periodik yang dimaksudkan untuk memberi kemudahan pelarut untuk melarutkan senyawa yang terdapat dalam sel tanaman (Baraja, 2008).
Selanjutnya dilakukan identifikasi senyawa steroid menggunakan kromatografi lapis tipis. Kromatografi lapis tipis (KLT) adalah suatu metode analisis yang digunakan untuk memisahkan suatu campuran senyawa secara cepat dan sederhana. Analisis kromatografi lapis tipis terhadap ekstrak etilasetat dan n-heksan daun J. curcas dilakukan dengan menggunakan fase diam GF254 dan fase
gerak menggunakan campuran n-heksan dan etilasetat (7:3). Campuran antara n-heksan dan etilasetat digunakan karena memberikan pemisahan yang baik (Heble et al., 1968; Kaul and Staba, 1968).
Plat KLT disemprot dengan pereaksi Liberman-Burcard dan dilihat di bawah lampu UV. Bila plat dilihat di bawah lampu UV bercak akan memberikan karakteristik fluoresensi dan nilai-nilai Rf dibandingkan dengan masing-masing senyawa (Mittal, 2013). Hasilnya, di bawah lampu UV 366 nm bercak memberikan karakteristik fluoresensi. Terlihat bercak n-heksan berfluoresensi pada Rf 0.50 dan Rf 0.52 pada ekstrak etilasetat daun J. curcas. Berdasarkan Rf yang terbentuk, ekstrak n-heksan dan ekstrak etilasetat mengandung senyawa steroid. Bercak pada ekstrak semakin terlihat jelas setelah dilakukan penyemprotan menggunakan pereaksi Liberman-Burcard.
38
Liberman-Burcard. Namun bercak pada ekstrak etilasetat terlihat setelah
dilakukan penyemprotan menggunakan pereaksi Liberman-Burcard yang dilakukan pengamatan di bawah lampu UV 366 nm, bercak terlihat berfluoresensi. Bercak ekstrak n-heksan menunjukkan warna ungu yang jelas dan berfluoresensi lebih jelas dan terang dibandingkan dengan bercak dari ekstrak etilasetat.
Prinsip reaksi dalam mekanisme uji steroid adalah kondensasi atau pelepasan H2O dan penggabungan dengan karbokation. Reaksi ini diawali dengan
proses asetilasi gugus hidroksil menggunakan asam asetat anhidrida. Gugus asetil yang merupakan gugus pergi yang baik akan lepas, sehingga terbentuk ikatan rangkap. Selanjutnya terjadi pelepasan gugus hidrogen beserta elektronnya, mengakibatkan ikatan rangkap berpindah. Senyawa ini mengalami resonansi yang bertindak sebagai elektrofil atau karbokation. Serangan karbokation menyebabkan adisi elektroϐilik, diikuti pelepasan hidrogen. Kemudian gugus hidrogen beserta elektronnya dilepas, akibatnya senyawa mengalami perpanjangan konjugasi (Siadi, 2012).
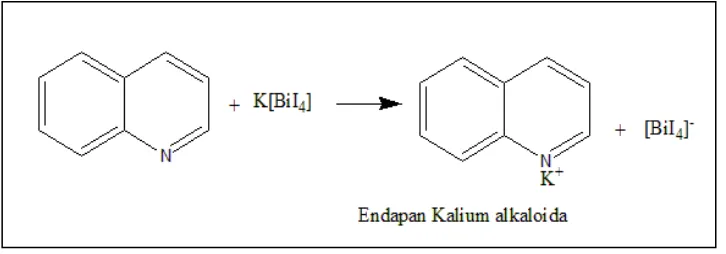
Penapisan fitokimia dilakukan untuk mengidentifikasi keberadaan golongan senyawa yang terdapat dalam ekstrak etilasetat dan n-heksan daun J. curcas. Pada uji keberadaan alkaloid, terlebih dahulu ekstrak dilarutkan dalam HCl. Alkaloid bersifat basa, sehingga penambahan HCl akan menyebabkan terbentuknya garam. Penambahan air suling bertujuan untuk melarutkan garam alkaloid dan pemanasan dilakukan untuk memecah alkaloid dengan asam klorida, sehingga diperoleh alkaloid yang bukan dari garamnya (Lilies & Nanik, 2012). Identifikasi alkaloid dilakukan dengan 2 pereaksi yaitu Dragendorff dan Mayer. Hasil uji dinyatakan mengandung alkaloid apabila ekstrak etilasetat dan n-heksan daun J. curcas yang direaksikan dengan pereaksi Dragendorff ditandai dengan terbentuknya endapan berwarna coklat muda sampai kuning, sedangkan apabila direaksikan dengan pereaksi Mayer akan membentuk endapan putih.
Dari hasil penapisan fitokimia yang dilakukan hanya ekstrak etilasetat daun J. curcas yang direaksikan dengan pereaksi Dragendorff menghasilkan endapan berwarna coklat. Endapan tersebut adalah kalium alkaloid. Alkaloid dapat ditemukan dalam berbagai bagian tanaman, tetapi sering kali kadar alkaloid dalam jaringan tumbuhan kurang dari 1% (Kristanti, et al., 2008).
40
Gambar 7. Reaksi uji Dragendorff (Sumber: Miroslave, 1971)
Alkaloid dapat menghambat pembentukan peptidoglikan pada sel bakteri sehingga lapisan dinding sel pada sel bakteri tidak terbentuk secara utuh dan menyebabkan kematian sel (Siregar, 2012). Mekanisme lain alkaloid sebagai antibakteri yaitu komponen alkaloid diketahui sebagai interkelator DNA dan menghambat enzim topoisomerase sel bakteri (Karou, 2005).
Pada percobaan identifikasi tanin menggunakan pereaksi besi (III) klorida. Hasil yang diperoleh pada ekstrak etilasetat dan n-heksan daun J. curcas positif mengandung tanin dengan memberikan warna hijau kehitaman. Terjadinya pembentukan warna hijau ini karena terbentuknya senyawa kompleks antara logam Fe dan tanin. Senyawa kompleks terbentuk karena adanya ikatan kovalen koordinasi antara ion atau atom logam dengan atom nonlogam (Effendy, 2007). Terjadinya warna biru kehitaman menunjukkan adanya tanin galat sedang warna hijau kehitaman menunjukkan adanya tanin katekol (Praptiwi, et al., 2006). Pada penambahan larutan FeCl3 diperkirakan larutan ini bereaksi dengan salah satu
gugus hidroksil yang ada pada senyawa tanin. Pereaksi FeCl3 dipergunakan secara
Gambar 8. Reaksi perkiraan tannin dengan FeCl3 (Sumber: Soerya, et al., 2005)
Mekanisme kerja tanin sebagai antibakteri adalah menghambat enzim reverse transkriptase dan DNA topoisomerase sehingga sel bakteri tidak dapat
terbentuk (Nuria, et al.,2009)
42
mempunyai kemampuan membentuk buih dalam air yang terhidrolisis menjadi glukosa dan senyawa lainnya (Marliana, et al., 2005). Menurut Robinson (1995) senyawa yang memiliki gugus polar dan nonpolar bersifat aktif permukaan sehingga saat dikocok dengan air, saponin dapat membentuk misel. Pada struktur misel, gugus polar menghadap ke luar sedangkan gugus nonpolarnya menghadap ke dalam. Keadaan inilah yang tampak seperti busa. Reaksi pada uji saponin bisa dilihat pada gambar berikut :
Gambar 9. Reaksi perkiraan uji Saponin (Sumber: Santos, et al., 1979).
Mekanisme kerja saponin sebagai antibakteri adalah menurunkan tegangan permukaan sehingga mengakibatkan naiknya permeabilitas atau kebocoran sel dan mengakibatkan senyawa intraseluler akan keluar berdifusi melalui membran luar dan dinding sel yang rentan kemudian mengikat membran sitoplasma sehingga mengganggu dan mengurangi kestabilan membran sel. Hal ini menyebabkan kematian sel (Nuria, et al., 2009).
dan steroid adalah reaksi Lieberman-Burchard (anhidrida asetat-H2SO4 pekat)
(Harborne, 1987). Hasil uji yang telah dilakukan menunjukkan ekstrak etilasetat dan n-heksan positif mengandung steroid. Karena adanya perubahan warna menjadi biru. Menurut Robinson (1995), ketika senyawa triterpenoid ditetesi pereaksi Lieberman-Burchard melalui dindingnya akan memberikan reaksi terbentuknya warna cincin kecoklatan, sedangkan steroid akan menghasilkan warna hijau kebiruan. Reaksi yang terjadi antara steroid dengan asam asetat anhidrat adalah reaksi asetilasi gugus OH pada steroid yang akan menghasilkan kompleks asetil steroid (Sriwahyuni, 2010).
44
Salah satu golongan terpenoid yang berpotensi sebagai antimikroba adalah triterpenoid. Senyawa triterpenoid yang terdapat pada tumbuhan tingkat tinggi
adalah fitosterol yang terdiri dari sitosterol (- sitosterol), stigmasterol, dan
kampesterol. Menurut Duke (dalam Sumarni, 2008), daun jarak mengandung senyawa metabolit sekunder seperti β-amyrin, β-sitosterol, stigmasterol, campesterol, 7-keto- β-sitosterol, isovitoksin dan viteksin.
Steroid telah dilaporkan memiliki sifat antibakteri (Okwu, 2001). Selain itu penelitian yang dilakukan oleh Mwime dan Damme (2011) menyatakan bahwa steroid yang merupakan golongan triterpenoid memiliki sifat antibiotik dan antifungi. Mekanisme kerja steroid sebagai antibakteri menyebabkan kebocoran pada liposom (Madduluri, 2013).
Senyawa kimia yang bermanfaat dari tumbuhan adalah hasil dari metabolit sekunder yang berupa alkaloid, steroida/terpenoida, flavonoid atau fenolik. Senyawa ini diantaranya berfungsi sebagai pelindung terhadap serangan atau gangguan yang ada disekitar, sebagai antibiotik dan juga sebagai antioksidan (Atmoko & Ma‟ruf, 2009).
dengan air. Tujuan dibuat variasi konsentrasi untuk mengetahui perbedaan nilai diameter zona hambat antar perlakuan.
Metode yang digunakan dalam penelitian ini adalah Kirby-Bauer. Metode Kirby-Bauer digunakan untuk menentukan sensitifitas bakteri patogen, baik yang
aerob maupun anaerob fakultatif terhadap berbagai senyawa antimikroba (Hudzicki, 2013). Pada penelitian ini, sebelum melakukan pengujian antibakteri, dilakukan pembuatan media Mac Conkey pada cawan petri yang selanjutnya diinokulasi dengan bakteri uji Shigella flexneri ATCC 12022. Penggunaan Mac Conkey sebagai media karena media ini spesifik terhadap bakteri gram negatif
sehingga selain bakteri gram negatif tidak dapat berkembang (Hale & Keusch, 1996).
46
Media yang telah diinolukasi dengan bakteri selanjutnya dilakukan aplikasi cakram kertas ke dalam media. Dan di inkubasi selama 24 jam untuk melihat zona hambat yang terbentuk. Selama inkubasi agen antibakteri berdifusi ke dalam media agar dan menghambat pertumbuhan bakteri (Rahmah, 2012).
Penelitian aktivitas antibakteri ini digunakan kontrol positif dan negatif sebagai pembanding. Kontrol positif berfungsi sebagai kontrol dari zat uji (ekstrak etilasetat dan n-heksan daun J. curcas dengan membandingkan diameter zona hambat yang terbentuk oleh zat uji dengan antibiotik. Kontrol positif yang digunakan adalah siprofloksasin 5 µg/ml. Siprofloksasin berguna dalam mengobati infeksi-infeksi yang disebabkan oleh bakteri Enterobacteriaceae dan basil negatif yang lainnya (Mycek, 2001). Kontrol negatif yang digunakan campuran antara air suling dan tween 80, kontrol negatif berfungsi untuk mengetahui ada tidaknya pengaruh pelarut terhadap pertumbuhan bakteri Shigella flexneri sehingga dapat diketahui bahwa yang mempunyai aktivitas antibakteri adalah zat uji bukan pelarut.
mengganggu aktivitas lain yang terkait dengan DNA pada bakteri (Prescott, et al., 2005).
Selian itu hasil pengujian ekstrak etilasetat dan n-heksan mempunyai diameter zona hambat tertinggi 7,7 mm. Menurut Tabel 1 apabila diameter zona hambat kurang dari 15 mm, dikatakan kedua ekstrak lemah dalam menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022. Sehingga ekstrak etilasetat dan n-heksan daun J. curcas tidak dapat digunakan sebagai rujukan pengobatan untuk infeksi yang disebabkan oleh bakteri Shigella flexneri.
Windarwati (2011) melakukan penelitian tentang fraksi etilasetat dari ekstrak daun jarak dengan diameter penghambatan terhadap S.aureus 12,5 mm. Sedangkan berdasarkan penelitian yang saya lakukan, ekstrak etilasetat daun J. curcas menghambat bakteri Shigella flexneri ATCC 12022 dengan diameter tertinggi 7,7 mm. Meskipun kedua penelitian menunjukkan hasil diameter zona hambat dalam kategori lemah, namun fraksi etilasetat daun J. curcas mempunyai diameter zona hambat yang lebih tinggi dalam menghambat bakteri S.aureus dibandingkan ekstrak etilasetat daun J. curcas dalam menghambat Shigella flexneri ATCC 12022. Perbedaan diameter zona hambat pada kedua penelitian
48
Terlihatnya aktivitas penghambatan mikroba oleh suatu senyawa sangat dipengaruhi oleh konsentrasi bahan dan mikroba uji (Windarwati, 2011). Ketahanan suatu bakteri terhadap senyawa antibakteri berkaitan erat dengan struktur dinding selnya. Hasan, et al. (2013) yang menyatakan bahwa senyawa aktif yang berasal dari tanaman sering menunjukkan aktivitas yang lebih baik terhadap bakteri gram positif tetapi tidak terhadap bakteri gram negatif. Bakteri gram negatif memiliki barrier permeabilitas yang efektif. Adanya barrier permeabilitas inilah yang kemungkinan besar menyebabkan aktivitas antibakteri dari senyawa aktif ekstrak etilasetat dan n-heksan daun J. curcas menjadi tidak cukup efektif.
49 A. Kesimpulan
Berdasarkan hasil penelitian yang dilakukan terhadap ekstrak etilasetat dan n-heksan daun J. curcas dapat disimpulkan bahwa :
1. Pada analisis identifikasi menggunakan metode penapisan fitokimia menunjukkan bahwa ekstrak etilasetat daun J. curcas mengandung senyawa alkaloid, steroid, saponin dan tannin. Hasil berbeda ditunjukkan oleh ekstrak n-heksan daun J. curcas yang mengandung senyawa steroid, saponin dan tanin.
2. Ekstrak etilasetat dan n-heksan daun J. curcas menghambat pertumbuhan bakteri Shigella flexneri ATCC 12022. Tetapi diameter zona hambatnya dalam kategori lemah.
50
B. Saran
1. Perlu dilakukan penelitian lanjutan untuk menguji efektivitas antibakteri ekstrak n-heksan dan etilasetat daun J. curcas terhadap bakteri gram positif dan negatif lainnya.
51
roots, International. J. Pharmacol. 3(1): 106-110.
Akinpelu D.A., Kolawole D.O., (2004), Phytochemical and antimicrobial activity of leaf extract of Piliostigma thonningii (Schum), Sci, Focus J. 7: 64-70. Ashutoh, K., 2008, Pharmaceutical Microbiology, New Age International (LtD:
New Delhi.
Atmoko, T. dan A. Ma‟ruf., 2009, Uji Toksisitas dan Skrining Fitokimia Ekstrak Tumbuhan Sumber Pakan Orangutan Terhadap Larva Artemia Salina L, Jurnal Penelitian dan Konservasi Alam. 6(1): 37-45
Baraja, M., 2008, Uji Toksisitas Ekstrak Daun Ficus elastic Nois ex Blume terhadap Artemia salina Leach dan Profil Kromatografi Lapis Tipis, Skripsi, Fakultas Farmasi Universitas Muhammadiyah Surakarta: Surakarta. Brooks, Geo F; Butel, Janet S; Morse, Stephen A., 2008, Mikrobiologi
Kedokteran Jawetz, Melnick, & Adelberg, EGC, Jakarta.
Brooks G. F., Janet, S., Butel., Stephen, A. M., 2007. Mikrobiologi Kedokteran : Jawetz, Melnick, and Adelberg. Edisi 23. Alih Bahasa oleh Mudihardi, E., et al. Jakarta : Penerbit Buku Kedokteran EGC.
Castellani, A., Chalmers, A.J. (1919). Manual of Tropical Medicine, 3rd ed. Williams, Wood and Co., New York. P.937.
CDC., (2015), Shigellosis, Retrieved Thursday, April 2, 2015 from
http://www.cdc.gov/media/releases/2015/p0402-multidrug-resistant-shigellosis.html
Crim SM, Iwamoto M, Huang JY, Griffin PM, Gilliss D, Cronquist AB, Cartter M, Tobin-D'Angelo M, Blythe D, Smith K, Lathrop S, Zansky S, Cieslak PR, Dunn J, Holt KG, Lance S, Tauxe R, Henao OL. Incidence and trends of infection with pathogens transmitted commonly through
food--Foodborne Diseases Active Surveillance Network, 10 U.S. sites, 2006-2013. MMWR Morb Mortal Wkly Rep. 2014;63(15):328-32.
Darwis, D., 2000, Teknik Dasar Laboratorium Dalam Penelitian Senyawa Bahan Alam Hayati, Workshop Pengembangan Sumber Daya Manusia Dalam Bidang Kimia Organik Bahan Alam Hayati FMIP A Universitas Andalas. Padang
Depkes RI., (2000), Parameter Standar Umum Ekstrak Tumbuhan Obat, Cetakan Pertama. Jakarta : Depkes RI.
Ditjen POM., (2000), Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: Departemen Kesehatan RI. Halaman 3-5, 10-11.
52
Edmundson SA, Edmundson WC. Diarrhoea in India and Indonesia.Didapat dari: URL: http://www.midcoast.com.au/edmundsons/c8
Effendy., 2007, Kimia Koordinasi Jilid I, Malang:Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Malang (UNM).
Gomez H.F., Cleary T.G. Shigella. Dalam: Behrman RE, Kliegman RM, Jenson HB, penyunting. Nelson Text-book of pediatrics. Edisi ke-16. Pjiladelphia:WB Saunders; 2001. h. 848-50
Greenwood, D., Finch, R., Davey, P., Wilcox, M. 2003. Antibiotics sensitivity test, in antimicrobial and chemotherapy. 5th revisi edition Oxford University Press. Page 99- 108
Guerrant R.L., Lima A.A.M. Inflamatory Enteritidies. Dalam: Mandel GL Bennet JE, Dolin R, penyunting. Principles and Practice Of Infectious Diseases. Bagian Pertama. Edisi ke-5. New york: Churchill Livingstone; 2000. H. 1126-31
Hale, T.L., Keusch, G.T. 1996. Shigella: Structure, Classification, and Antigenic Types. In Baron, Samuel. Medical microbiology (4 ed.). Galveston, Texas: University of Texas Medical Branch.
Harborne, J.B. (1987). Metode Fitokimia : Penuntun Cara Modern Menganalisis Tumbuhan. Penerbit ITB Bandung. Bandung
Hasan, N.A; Nawahwi, M.Z; Malek,H.A; 2013, Antimicrobial Activity of Nigella sativa Seed Extract, Sains Malaysiana 42(2):143–7.
Hasibuan, Siti Aminah. 2016. Perbandingan Daya Hambat Ekstrak Daun J. curcas (Jatropha curcas Linn) Terhadap Pertumbuhan Bakteri Staphylococcus Aureus Dan Escherichia Coli Secara In Vitro, Skrips, Fakultas Kedokteran Universitas Lampung.
Henning, K., 1997, Fuel production improves food production: the jatropha project in Mali. Di dalam: Gubitz, G.M., Mittelbach, M., Trabi, M., editor. Biofuels and Industrial Products from Jatropha curcas. pp: 92-97. DBV Graz.
Herwana, E; Indriani, N; Lesmana, M; Paul, B; Salim, O.C; Surjawidjaja, J.E; 2010, Shigella-Associated Diarrhea in Children in South Jakarta, Indonesia, Southeast Asian J Trop Med Public Health, 2 (41): 418-25.
Houghton,P.J. dan Raman, A. 1998. Laboratory Handbook for The Fractionation of Natural Extracts. London : Thomson Science.
Igbinosa, O.O., E.O. Igbinosa dan O.A. Aiyegoro. 2009. Antimicrobial activity and phytochemical screening of stem bark extracts from Jatropha curcas (Linn). African J Pharmacy Pharmacol 3(2) : 058-062.
Iwalokun BA, Gbenle GO, Smith SI, Ogunledun A, Akisinde KA, Omonigbehin EA. Epidemiology of Shigellosis in Lagos, Nigeria: Trends in antimicrobial resistance. J Health Popul Nutr 2001; 19:183-90.
Jawetz E, Melnick JL, Adelberg E. Medical microbilogy. Edisi ke-20. Stamford: Appleton dan Lange; 1995. H. 212-4
Jones A.C.C., Farthing M.J.G., Management of infectious diarrhoea. Gut 2004; 53:296-305.
Karou, Damintoti., & Savadago, Antibacterial activity of alkaloid from sida acuta. African Journal of Biotechnology. 2005. 4(12): 1452-1457.
Katno., 2008, Tingkat Manfaat, Keamanan dan Efektifitas Tanaman Obat dan Obat Tradisional. Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan RI. Karanganyar.
Kementerian Kesehatan RI, 2011. Profil Kesehatan Indonesia 2010. http://www.depkes.go.id.
Kenna, Mc. (2015). CDC Alert: Drug-Resistant Foodborne Illness Spreads in
US.Retrivied April 4, 2015, from
http://phenomena.nationalgeographic.com/2015/04/04/cdc-resistant-shigella/ Kusumaningtyas, E., Astuti, E., Darmono, 2008, Sensitivitas Metode Bioautografi Kontak dan Agar Overlay dalam Penentuan Senyawa Antikapang , Jurnal Ilmu Kefarmasian Indonesia, 6 (2), 75-79
Kristanti, A. N., N. S. Aminah, M. Tanjung, dan B. Kurniadi, 2008, Buku Ajar Fitokimia. Surabaya: Airlangga University Press. Hal. 23, 47.
Krugman S, Katz SL, Gershon AA, Wilfert CM. Infec-tious disease of children. Edisi ke-9. St.Louis: Mosby Year Book; 1992.h.109-19.
Lebenthal E, penyunting. Textbook of Gastroenterology and nutrition in infancy. Edisi ke-2. New York: Raven Press; 1989. H. 1127-8.
Levine MM. Shigellosis. Dalam :Strickland GT. Hunters‟ Tropical Medicine and emerging Infectious Diseases. Edisi ke-8. Philadelphia: W.B Saunders Company;2000.h.319-323.
Lima A.A.M., Lima N.L., Pinho M.C.N., High frequency of strain multiply resistant to ampicillin, trimetopim strain multiply resistant to ampicillin, trimethoprim and metracycline isolated from patient with shigellosis in Northeastern Brazil during the period 1988 to 1993. Antimicrobial Agents and Chemotherapy 1995:256-259.
Madduluri, Suresh. Rao, K. Babu. Sitaram, B. In Vitro Evaluation Antibacterial Activity of Five Indegenous Plants Extract Against Five Bacterial Pathogens of Human. International Journal of Pharmacy and Pharmaceutical Sciences. 2013:5(4):679-684.
Madigan. M. T., Martinko, J. M., dan Parker, J. 2000. Brock Biology of Microorgansims, 9th Edition. Prentice – Hall Inc. New Jersey.
Mahmud. Z, 2007. J. curcas (Jatropha Curcas L.). Info Tek J. curcas, Bogor.
Marliana, D.S., Venty, S., dan Suyono,(2005), Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq.Swartz.) dalam esktrak Etanol. Jurnal Biofarmasi. 3(1):29
Mittal, Sandhya.(2013). Thin Layer Chromatography And High Pressure Liquid Chromatography Profiling Of Plant Extracts Of Viola Odorata Linn. Int J Pharm Bio Sci 2013 Jan; 4(1): (B) 542 - 549