PATOGENISITAS TIGA ISOLAT
Helicoverpa armigera
NUCLEOPOLYHEDROVIRUS (
Hear
NPV) TERHADAP
PENGGEREK BUAH KAPAS
Helicoverpa armigera
HÜBNER
(LEPIDOPTERA: NOCTUIDAE)
FARRIZA DIYASTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis ini berjudul Patogenisitas Tiga Isolat Helicoverpa armigera Nucleopolyhedrovirus (HearNPV) terhadap Penggerek
Buah Kapas Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae) adalah benar
karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun ke perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
RINGKASAN
FARRIZA DIYASTI. Patogenisitas Tiga Isolat Helicoverpa armigera Nucleopolyhedrovirus (HearNPV) terhadap Penggerek Buah Kapas Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae). Dibimbing oleh TEGUH SANTOSO dan R. YAYI MUNARA KUSUMAH.
Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae) merupakan salah satu hama utama kapas di Indonesia. H. armigera merusak tanaman kapas dengan cara menggerek kuncup bunga, bunga, dan buah kapas. Satu individu larva H. armigera dapat menghabiskan 40-57% kuncup, bunga dan buah kapas dalam satu pohon selama fase hidupnya. Teknik pengendalian yang selama ini diterapkan oleh petani yaitu menggunakan insektisida kimiawi, namun hal tersebut menimbulkan dampak negatif bagi lingkungan. Beberapa bahan aktif insektisida dilaporkan telah menyebabkan resistansi terhadap hama ini. Dengan demikian, alternatif pengendalian yang ramah lingkungan sangat diperlukan untuk mengurangi kehilangan hasil akibat serangan hama ini. NPV merupakan virus dari golongan Baculovirus yang memiliki inang spesifik, aman bagi vertebrata dan tumbuhan, serta mudah dalam rekayasa genetik. Beberapa faktor yang mempengaruhi keberhasilan infeksi Baculovirus di antaranya biologi inang, virulensi virus, dan ekologi virus. Isolat Baculovirus yang diperoleh dari spesies yang sama di lokasi geografis yang berbeda sering menunjukkan variasi genetik dan perbedaan dalam biologinya.
Negara besar seperti Indonesia memiliki variasi agroklimat yang beragam, sehingga memungkinkan ditemukan variasi strain virus. Karakterisasi molekuler melalui teknik PCR merupakan salah satu cara untuk mengidentifikasi suatu gen. Gen Late expression factor-8 (lef-8) merupakan primer universal untuk menganalisis DNA Lepidoptera NPV. Penelitian ini bertujuan untuk mengkaji perbedaan isolat HearNPV dari beberapa wilayah sentra perkebunan kapas di Indonesia. Tiga isolat dari Provinsi Jawa Tengah, Jawa Timur, dan Sulawesi Selatan dipilih untuk dikaji terkait patogenisitas dan karakterisasi molekulernya.
Pipilan jagung muda dicelupkan pada tiap suspensi isolat dengan kerapatan 2.5x103, 2.5x104, 2.5x105, 2.5x106, dan 2.5x107 POBs/mL serta kontrol menggunakan aquabides kemudian diberikan pada larva H. armigera instar-1. Setiap perlakuan terdiri atas 20 larva uji dengan empat ulangan. Peubah yang diamati adalah nilai LC50, LC90, LT50, dan LT90 menggunakan analisis probit
dengan software SAS for Windows versi 9.1 untuk mengukur patogenisitas ketiga isolat HearNPV tersebut. Morfologi polihedra dari tiap isolat diamati menggunakan Scanning Electron Microscopy (SEM). Karakterisasi molekuler dilakukan dengan teknik PCR menggunakan primer gen lef-8 pada DNA total, kemudian dilakukan analisis penjajaran dengan program Bioedit, dan analisis filogeni dengan program Mega-5.
Pada 7 hari setelah inokulasi (HSI), isolat HearNPV Jawa Timur menunjukkan persentase mortalitas tertinggi dengan nilai LC50 dan LC90 terendah
yaitu 6.38 POBs/mL dan 6.56x103 POBs/mL. Pada kerapatan 2.5x107 POBs/mL, isolat HearNPV Sulawesi Selatan menunjukkan nilai LT50 dan LT90 terendah dan
Pengamatan dengan SEM menunjukkan tidak adanya perbedaan bentuk dan ukuran polihedra di antara ketiga isolat HearNPV tersebut. Begitu pula dengan hasil pengurutan DNA menunjukkan kesamaan nukleotida, serta tanda dan gejala yang tampak pada larva yang terinfeksi HearNPV tidak berbeda di antara ketiga isolat HearNPV tersebut.
SUMMARY
FARRIZA DIYASTI. Pathogenicity of Three Helicoverpa armigera Nucleopolyhedrovirus (HearNPV) Isolates against Cotton Bollworm, Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae). Supervised by TEGUH SANTOSO and R. YAYI MUNARA KUSUMAH.
Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae) is a major pest of cotton in Indonesia. H. armigera damages cotton plant by eating the flower buds, flowers, and bolls. One larva of H. armigera can consume 40-57% buds, flowers and bolls in one cotton plant during its life. Farmers use chemical insecticides to control this pests, but they cause negative impacts on the environment. Some insecticide active ingredients are reported to cause resistance to these pests. Thus, alternative method is needed to minimize yield losses due to these pests, and to prevent the environmental degradation. Nucleopolyhedrovirus is a virus from the Baculovirus group that has specific host, safe for vertebrates and plants, and easy to manipulate in genetic engineering. Some factors that influence the success of Baculovirus infection of the host are the pathogenicity and the virus ecology. Baculovirus isolates obtained from the same species from different geographic locations often shows genetic variations and differences in biology.
A large country like Indonesia with diverse agroclimatic, may have virus strain variations. Molecular characterization by polymerase chain reaction (PCR) technique is one way to identify a gene. Late expression factor-8gene (lef-8) is a universal primer for analyzing DNA of Lepidoptera NPV. This study aims to assess the difference among HearNPV isolates from different cotton plantation areas in Indonesia. Three isolates from Central Java, West Java, and South Sulawesi province are choosen to study their pathogenicity, and molecular character.
Shelled of young corn cob was dipped in each HearNPV isolate suspension at a density of 2.5x103, 2.5x104, 2.5x105, 2.5x106, 2.5x107 POBs /mL and control, then fed to the first instar larvae of H. armigera. Each treatment consisted of 20 larvae test with four replicates. Probit analysis was used to determine LC50 and
LC90. The process of identification based on molecular character consists of DNA
total extraction, amplification by using PCR, visualization, sequencing, and data analysis. Probit analysis with SAS software for Windows version 9.1 has been applied to measure the pathogenicity of three isolates HearNPV. Polyhedra morphology of each isolates were observed using Scanning Electron Microscopy (SEM). Molecular characterization performed by PCR using primers lef-8 gene in total DNA, then analysis alignment with Bioedit program, and phylogeny analysis with Mega-5 program.
The result showed that in 7 days post infection, HearNPV isolate from East Java was the most virulent isolates with the lowest LC50 and LC90 values, which
are 6.38 POBs/mL and 6.56x103 POBs/mL respectively. HearNPV isolate from South Sulawesi showed lowest LT50 and LT90 that had no significant to HearNPV
three HearNPV isolates. Neither different signs nor symptoms were detected between three viral isolates.
Keywords: Density, homology, lef-8 gene, mortality, phylogeny. .
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
PATOGENISITAS TIGA ISOLAT
Helicoverpa armigera
NUCLEOPOLYHEDROVIRUS (
Hear
NPV) TERHADAP
PENGGEREK BUAH KAPAS
Helicoverpa armigera
HÜBNER
(LEPIDOPTERA: NOCTUIDAE)
FARRIZA DIYASTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Patogenisitas Tiga Isolat Helicoverpa armigera
Nucleopolyhedrovirus (HearNPV) terhadap Penggerek Buah Kapas Helicoverpa armigera HÜBNER
(Lepidoptera: Noctuidae) Nama : Farriza Diyasti
NIM : A351130251
Disetujui oleh Komisi Pembimbing
Dr Ir Teguh Santoso, DEA Dr Ir R Yayi Munara Kusumah, MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi Entomologi Dekan Sekolah Pascasarjana
Dr Ir Pudjianto, MSi Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: Tanggal Lulus:
PRAKATA
Alhamdulillah, puji syukur kehadirat Allah Yang Maha Esa, karena limpahan rahmat dan hidayahNya penulis dapat menyelesaikan tesis yang berjudul Patogenisitas Tiga Isolat Helicoverpa armigera Nucleopolyhedrovirus
(HearNPV) terhadap Penggerek Buah Kapas Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae). Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Master Sains di Sekolah Pascasarjana Program Studi Entomologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Teguh Santoso, DEA dan Bapak Dr Ir R Yayi Munara Kusumah, MSi selaku komisi pembimbing yang telah banyak memberikan bimbingan, arahan, dan motivasi kepada penulis. Kepada Dr Ir Pudjianto, MSi selaku penguji luar komisi dan Dr Ir Idham Sakti Harahap, MSi diucapkan terima kasih atas saran dan penyempurnaannya. Ucapan terima kasih juga disampaikan kepada pihak instansi Direktorat Jenderal Perkebunan dan Badan Penyuluhan dan Pengembangan Sumber Daya Manusia (BPPSDM) Kementerian Pertanian yang telah memberikan kesempatan dan kepercayaan kepada penulis untuk mengikuti pendidikan Magister Sains di IPB. Kepada semua pihak yang telah membantu kelancaran proses penelitian diucapkan banyak terima kasih, di antaranya Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBP2TP) Surabaya, Dinas Perkebunan Provinsi Jawa Tengah, Dinas Perkebunan Provinsi Sulawesi Selatan, Prof Dr Ir Sri Hendrastuti Hidayat, MSc, Sari Nurulita, rekan-rekan laboratorium Virologi Tumbuhan-IPB, rekan-rekan laboratorium Patologi Serangga-IPB (Bu Silvi, Bu Sempurna, Agung, Ferdika, Susilawati, Umami, Amel, Saka), rekan-rekan Entomologi 2013, Hafsah, Indah, Nia, Uche, sahabat setia penulis Haeriyah, aceu, USB family, dan pihak lainnya yang tidak sempet disebutkan satu per satu.
Ungkapan terima kasih juga disampaikan kepada orang tua terkasih, ayah dan ibunda yang tidak henti-hentinya memanjatkan doa, mertua, serta kakak dan adik yang secara tidak langsung membantu kelancaran penelitian, suami dan ananda tercinta Ashalina Syifa Prawira atas motivasi yang tak ternilai harganya sehingga penulis dapat menyelesaikan tugas akhir ini.
Pada akhirnya besar harapan penulis agar karya ilmiah ini dapat bermanfaat dan menjadi sumber semangat untuk terus berkarya. Aamiin yaa rabbal alamiin.
Bogor, April 2016
DAFTAR ISI
Biologi Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae) 6
Nucleopolyhedrovirus (NPV) 8
Bioassai NPV terhadap H. armigera 13
Penampang Polihedra Isolat HearNPV melalui
Scanning Elecron Microscopy (SEM) 14
Karakterisasi Molekuler 14
Pemurnian Virion dan Ekstraksi DNA 14
Amplifikasi DNA HearNPV menggunakan PCR 15
Analisis Data 16
Bioassai HearNPV 16
Pengurutan DNA dan Analisis Filogeni 16
DAFTAR GAMBAR
7 Ilustrasi tabung kolom VB yang digunakan dalam ekstraksi DNA 15 8 Mortalitas probit (lethal concentration) tiga isolat HearNPVterhadap H. armigera pada 3 HSI 19
9 Mortalitas probit (lethal concentration) tiga isolat HearNPV
terhadap H. armigera pada 7 HSI 20
10 Mortalitas probit (lethal time) tiga isolat HearNPV terhadap
H. armigera pada kerapatan 2.5x103 POBs/mL 21 11 Mortalitas probit (lethal time) tiga isolat HearNPV terhadap
H. armigera pada kerapatan 2.5x107 POBs/mL 22 12 Tanda dan gejala larva H. armigera terinfeksi oleh tiga isolat
HearNPV pada 4 HSI 23
13 Tanda dan gejala pupa H. armigera terinfeksi HearNPV 23 14 Polihedra HearNPV di bawah mikroskop cahaya (400x) 24 15 Polihedra tiga isolat HearNPV melalui SEM 5000x 24 16 Hasil visualisasi DNA HearNPV menggunakan primer gen lef-8 25 17 Pohon filogeni Lepidoptera NPV diolah dengan program Mega-5 27
DAFTAR TABEL
1 Pengaruh tiga isolat HearNPV terhadap mortalitas kumulatif larva
H. armigera (%) 18
2 Nilai virulensi tiga isolat HearNPV terhadapmortalitas larva
H. armigera pada 3 HSIa 19
3 Nilai virulensi tiga isolat HearNPV terhadapmortalitas larva
H. armigera pada 7 HSIa 19
4 Kecepatan membunuh tiga isolat HearNPV terhadap
larva H. armigera pada kerapatan 2.5 x 103 POBs/mL 21 5 Kecepatan membunuh tiga isolat HearNPV terhadap
larva H. armigera pada kerapatan 2.5 x 107 POBs/mL 21 6 BLASTN gen lef-8, genom penuh (www.ncbi.nlm.nih.gov) 25 7 Homologi HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur
gen lef-8 dengan sampel dari GenBank 26
8 Spesies Lepidoptera NPV gen lef-8 sebagai pembanding Helicoverpa
PENDAHULUAN
Latar Belakang
Kapas (Gossypium hirsutum L.) merupakan tanaman perdu semusim dari famili Malvaceae, ordo Malvales yang menjadi salah satu komoditas andalan sub sektor perkebunan. Kapas dapat menghasilkan serat alam untuk bahan baku industri tekstil dan produk tekstil (ITPT) serta bidang kesehatan dan kecantikan. Seiring dengan meningkatnya jumlah penduduk, maka permintaan bahan baku kapas pun meningkat. Kebutuhan serat kapas mencapai 1.5 juta ton kapas berbiji atau sekitar 1.2 juta ha pertanaman kapas pada tingkat produksi 1 250 kg/ha (Ditjenbun 2013). Produksi serat kapas dalam negeri hanya mencukupi 0.5% kebutuhan nasional, sebagian besar diperoleh melalui impor. Luas areal kapas didominasi oleh perkebunan rakyat (PR), mencapai 6 486 ha dengan nilai produksi 1 871 ton pada tahun 2013. Nilai ini mengalami penurunan dari tahun sebelumnya dengan luas lahan 10 750 ha dan nilai produksi 2 275 ton (Ditjenbun 2014). Penurunan produksi sangat mungkin disebabkan oleh turunnya produktivitas tanaman. Pada tahun 2008 produktivitas kapas masih berada pada kisaran 3.9 kuintal per ha, namun pada tahun 2012 produktivitasnya menurun menjadi 2.8 kuintal per ha. Impor kapas mencapai 611 800 ton. Hal ini sangat mengkhawatirkan karena kebutuhan serat kapas terus mengalami peningkatan 3% per tahun. Pemerintah melakukan berbagai upaya untuk mengurangi impor serat kapas, di antaranya melalui penerapan program intensifikasi kapas rakyat (IKR) dan pengelolaan hama terpadu (PHT) perkebunan rakyat, namun upaya ini mengalami hambatan karena sulitnya pengelolaan hama (Subiyakto 2010). Biaya pengelolaan hama pada tanaman kapas tergolong tinggi, mencapai 41% dari biaya produksi (Basuki et al. 2002). Salah satu hama utama pada tanaman kapas yaitu penggerek buah Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae) yang dapat menyebabkan kehilangan hasil produksi hingga 70% (Indrayani et al. 2013). Hama ini merusak tanaman kapas dengan cara menggerek kuncup bunga, bunga, dan buah kapas, sehingga menyebabkan badan buah kapas tersebut tidak dapat berkembang dan gugur. Satu individu larva H. armigera dapat menghabiskan 40-57% kuncup bunga dan buah kapas dalam satu pohon selama fase hidupnya (Nasreen et al. 2004). Selain kapas, hama ini juga menyerang kacang-kacangan, jagung, tembakau, tomat, kentang, dan beberapa jenis gulma (Ditlinbun 2004).
menjadi tanggung jawab masyarakat dan pemerintah. Salah satu alternatif pengelolaan hama H. armigera yang sejalan dengan prinsip PHT tersebut yaitu dengan memanfaatkan Nucleopolyhedrovirus (NPV) (Arifin et al. 2006). Virus ini memiliki inang spesifik, tidak membahayakan lingkungan, dan kompatibel dengan komponen PHT lainnya (Starnes et al. 1993).
NPV merupakan virus dari famili Baculoviridae yang mampu menginfeksi lebih dari 400 spesies serangga dan menyebabkan epizootic pada hama Lepidoptera. NPV mudah dideteksi melalui mikroskop cahaya, sehingga penelitian mengenai virus ini cukup berkembang pesat. NPV termasuk golongan virus yang memiliki kerja cepat dalam menginfeksi serangga yaitu 4-7 hari (Grzywacz et al. 2011). Pada skala lapangan, NPV dapat menekan kerusakan buah kapas, sehingga mengurangi kehilangan hasil produksi kapas berbiji rata-rata 21.37% (255.2 kg/ha) (Indrayani et al. 1998). Aplikasi NPV di laboratorium mampu menurunkan konsumsi makan H. armigera antara 25-50% dari berat kering pakan normal (Rustama & Niloperbowo 2009). Penggunaan NPV secara berulang tidak mengakibatkan kemunculan respon kekebalan pada H. armigera (Sanjaya 2000).
Beberapa faktor yang memengaruhi keberhasilan infeksi Baculovirus yaitu biologi inang, virulensi virus dan ekologi virus (Trevor et al. 2005). Isolat Baculovirus yang diperoleh dari spesies yang sama di lokasi geografis yang berbeda sering menunjukkan variasi genetik dan perbedaan dalam virulensi (Cory et al. 2005). Variasi genetik virus dari beberapa wilayah geografis yang berbeda dapat dikarakterisasi berdasarkan siklus hidup, patogenisitas, kecepatan membunuh dan kondisi lapangan (Hodgson et al. 2001). Menurut Guo et al. (2006), dua isolat Helicoverpa armigera NPV (HearNPV) asal Cina menunjukkan patogenisitas yang berbeda, isolat HearNPV G4 menunjukkan hasil yang lebih baik dibandingkan isolat HearSNPV C1. Secara mikroskopis, penampang kedua isolat tersebut tidak jauh berbeda, baik dari ukuran maupun jumlah polihedra. Penelitian yang dilakukan Mehrvar et al. (2008) pada tujuh isolat HearNPV asal India menunjukkan perbedaan virulensi maupun genetik. Isolat NPV dengan virulensi tinggi berpotensi besar sebagai agens pengendali hayati. Teknik rekayasa genetika virus saat ini sedang berkembang dalam rangka meningkatkan toksisitas virus sebagai pestisida hayati (Inceoglu et al. 2001). Dengan demikian, evolusi Baculovirus dan mekanisme molekuler yang terjadi di dalamnya mencakup replikasi dan infeksi, serta sekuen dari genom merupakan hal yang sangat penting untuk dikaji (Zhang et al 2004). Secara garis besar pengetahuan akan hubungan genetik di antara Baculovirus belum diperoleh secara lengkap (Woo et al. 2006).
Tenggara, Nusa Tenggara Timur (NTT), Nusa Tenggara Barat (NTB), dan Bali. Karakterisasi molekuler melalui teknik polymerase chain reaction (PCR) merupakan salah satu cara untuk mengidentifikasi suatu gen. Dengan menggunakan primer gen late expression factor 8 (lef-8) yang dapat mengamplifikasi DNA NPV pada Lepidoptera diharapkan dapat memberikan informasi karakter molekuler dari isolat HearNPV di Indonesia.
Tujuan Penelitian
a. Mengukur tingkat patogenisitas isolat HearNPV dari wilayah yang berbeda di Indonesia.
b. Membandingkan karakter molekuler melalui urutan nukleotida tiap isolat HearNPV dengan menggunakan primer gen lef-8.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai isolat HearNPV pada sentra perkebunan kapas di Indonesia yang memiliki perbedaan patogenisitas maupun genetik, sehingga strain dengan virulensi tinggi dapat dimanfaatkan sebagai agens pengendali hayati hama penggerek buah kapas yang efektif dan ramah lingkungan.
Hipotesis
a. Paling tidak satu isolat HearNPV menunjukkan patogenisitas lebih tinggi dibandingkan isolat lainnya.
TINJAUAN PUSTAKA
Tanaman Kapas
Kapas (Gossypium hirsutum L.) merupakan kelompok tanaman semusim yang menjadi salah satu komoditas andalan sub sektor perkebunan. Serat yang dihasilkan oleh kapas bermanfaat bagi industri tekstil. Dalam proses pengolahan serat kapas, hanya sekitar 10% dari berat kotor (bruto) produk yang hilang berupa lemak, protein, malam (lilin), dan residu lainnya, sisanya adalah polimer selulosa murni dan alami. Selulosa ini tersusun sedemikian rupa sehingga memberikan kekuatan, daya tahan (durabilitas), dan daya serap yang tinggi pada kapas. Selain industri tekstil, serat kapas juga dimanfaatkan oleh industri kertas, kosmetik, dan kesehatan. Oleh karena itu, kebutuhan akan serat kapas cukup tinggi setara dengan 1.5 juta ton kapas berbiji atau sekitar 1.2 juta ha pertanaman kapas pada tingkat produksi 1 250 kg/ha (Ditjenbun 2013).
Adapun klasifikasi tanaman kapas menurut Fryxell (1965), sebagai berikut: Dunia : Plantae
Divisi : Spermatophyta Kelas : Angiospermae Subkelas : Dycotyledonae Ordo : Malvales
Tanaman kapas umumnya dikembangbiakkan dari biji. Biji berbentuk bulat telur, berwarna cokelat kehitaman dengan berat 0.06 – 0.17 gram bergantung pada varietas. Serat melekat erat pada biji berwarna putih yang disebut fuzz (kabu-kabu). Kulit biji menebal membentuk lapisan serat berderet pada kulit bagian dalam. Kapas mempunyai akar tunggang yang panjang dan dalam, dapat mencapai lebih dari 15 cm bergantung pada umur, besarnya tanaman, aerasi, dan stuktur tanah. Dari setiap ruas batang tumbuh cabang dan daun. Cabang buah yang pertama biasanya dihasilkan pada ketiak daun ke-6 sampai ke-8 pada batang pokok. Jumlah cabang generatif 8 sampai 20 cabang (Edmisten 2010).
Tanaman kapas mulai berbunga pada umur 30 sampai 45 hari dan mulai mekar 45 sampai 60 hari bergantung pada jenis dan varietas kapas. Tiap cabang generatif dapat tumbuh 6 sampai 8 bunga. Kuncup bunga berbentuk piramid kecil ada pula yang melintir (frego) dan berwama hijau. Bunga mulai mekar pada pagi hari (pukul 6-7) dan layu pada siang hari, kemudian kepala putik membuka (reseptit). Bagian tangkai yang mengandung tepung sari juga segera membuka dan menghamburkan tepung sarinya. Tepung sari dapat melekat pada kepala putik dan mampu bertahan sampai 12 jam. Tepung sari berkecambah dalam waktu yang singkat dan mencapai bakal buah dalam waktu 12 sampai 30 jam setelah penyerbukan. Setelah terjadi penyerbukan, buah segera terbentuk. Dari bunga sampai menjadi buah masak membutuhkan 40 sampai 70 hari. Buah yang masak akan retak dan terbuka (Gambar 1). Sebagian besar buah terdiri atas 3-5 ruang (Mauney 1984).
memiliki kapasitas tukar kation (KTK) tinggi dengan pH 5.5–8.5, serta kadar bahan organik > 3.5% (nisbah C/N 10–12). Penyerapan hara N, P dan K terjadi mulai fase perkecambahan sampai pemasakan buah. Serapan hara terbanyak (lebih dari 80%) terjadi sejak pembentukan bunga sampai waktu pembentukan dan pemasakan buah (umur 35–120 hari). Pada awal pertumbuhan kapas, serapan hara kurang dari 20%. Walaupun kebutuhan NPK pada awal pertumbuhan kecil, tapi hara tersebut perlu tersedia, Kekurangan N pada periode ini akan menghambat pertumbuhan dan mengurangi pembentukan kuncup bunga. Kekurangan P dapat menghambat perkembangan akar, dan kekurangan K dapat mengurangi vigor tanaman, mengurangi ketahanan kapas terhadap kekeringan dan penyakit. Dengan demikian kekurangan hara pada fase pertumbuhan akan berpengaruh langsung pada produksi (Ditjenbun 2011).
Curah hujan optimal yang dibutuhkan kapas berada pada kisaran 500-1 500 mm. Kapas memerlukan air sekitar 6 000 – 9 000 m3/ha selama 140-150 hari pertumbuhannya. Kebutuhan air cukup besar saat setelah pembentukan kuncup bunga dan mencapai maksimal (8-10 mm/hari) pada periode pembungaan dan pengisian buah. Pada periode ini kapas sangat rentan terhadap kekeringan, karena akan menyebabkan keguguran kuncup bunga, bunga, dan buah muda. Kebutuhan air mulai berkurang setelah buah pertama merekah. Namun demikian tetap membutuhkan air, dan kekurangan air pada periode ini dapat menurunkan kualitas serat. Panjang serat bervariasi bergantung pada jenis dan varietas kapas. Panjang serat yang dikembangkan di Indonesia sekitar 26-29 mm. Satu buah kapas dapat menghasilkan serat sebanyak ± 3.5 – 4 gram. Keterbatasan air pada periode pemanjangan serat dapat mengurangi panjang serat (Ditjenbun 2011).
Selain faktor ketersediaan air, kehadiran organisme pengganggu juga dapat memengaruhi produktivitas kapas. Beberapa hama utama pada tanaman kapas antara lain hama penggerek buah kapas, Helicoverpa armigera (Lepidoptera : Noctuidae); hama penggerek pucuk kapas, Earias sp. (Lepidoptera : Noctuidae); hama penggulung daun, Pectinophora gossypiela (Lepidoptera : Gelechiidae); hama pemakan daun, Agrotis sp. (Lepidoptera : Noctuidae); ulat grayak, Spodoptera litura (Lepidoptera : Noctuidae); hama penghisap daun, Sundapteryx biguttula (Hemiptera : Jassidae); kutukebul, Bemisia tabaci (Hemiptera : Aleyrodidae); kutudaun, Aphis gossypii (Hemiptera : Aphididae); dan tungau, Tetranychus sp. (Acarina : Tetranychidae). Biaya pengendalian hama pada
tanaman kapas tergolong tinggi, mencapai 41% dari biaya produksi (Basuki et al. 2002).
Agribisnis kapas diharapkan dapat memberikan kontribusi pada industri TPT sekitar 30% dari kebutuhan bahan baku kapas saat ini hingga tahun 2025. Tantangan yang dihadapi oleh pengembangan kapas Indonesia cukup kompleks, berawal dari ketidaktersediaan benih bermutu, adanya serangan organisme pengganggu tumbuhan (OPT) sampai dengan kelangkaan modal petani. Ketersediaan sumber daya alam terutama lahan kering masih cukup luas di luar Jawa, seperti Sulawesi Selatan, Nusa Tenggara Barat, dan Nusa Tenggara Timur yang memberikan peluang bagi pengembangan kapas nasional. Oleh karena itu, komoditas kapas merupakan salah satu komoditas yang diprioritaskan untuk dikembangkan dalam mendukung revitalisasi perkebunan (Balittas 2008).
Biologi Helicoverpa armigera HÜBNER (Lepidoptera: Noctuidae)
Hama penggerek buah kapas, H. armigera HÜBNER (Lepidoptera: Noctuidae) merupakan salah satu hama utama tanaman kapas yang serangannya berpotensi merusak dan mengakibatkan produksi buah kapas menurun hingga 70% (Indrayani et al. 2013). Serangan hama ini ditemukan hampir di seluruh pertanaman kapas pada setiap musim tanam. Serangan biasanya dimulai saat pembentukan kuncup bunga kapas yaitu pada 30-35 hari setelah tanam (HST) dan berakhir hingga menjelang panen. Hama ini dapat merusak mulai dari daun muda, kuncup bunga, bunga, buah muda, hingga buah tua yang masih berwarna hijau. Buah yang terserang sering menjadi busuk dan berlubang (Nasreen et al. 2004).
Berdasakan kunci taksonomi (CABI 2015), H. armigera termasuk dalam : Dunia : Animalia / Metazoa
Prapupa masih dalam bentuk larva, aktivitas makan mulai berkurang. Larva kelihatan lemah dan pucat, cenderung membenamkan di dalam pasir atau tanah. Pupa berwarna coklat kekuningan, dan berwarna coklat gelap pada akhir fase. Panjang pupa 1.5-2 cm. Stadia pupa berada dalam tanah, kadang-kadang dapat ditemukan juga pada tanaman. Imago berupa ngengat dengan panjang tubuh ± 2 cm dengan rentang sayap ± 2.5 cm. Pada sayap depan terdapat garis memanjang berbercak gelap pada bagian tengah. Ngengat jantan berwarna coklat cerah sampai suram, sedangkan betina berwarna coklat cerah. Ngengat betina mulai meletakkan dalam waktu 3 hari setelah kawin. Satu individu imago betina dapat meletakkan telur lebih dari 1 000 butir telur (Ditlinbun 2004). Lama siklus hidup H. armigera dari fase telur hingga imago yaitu sekitar 31-47 hari (Subiyakto 2000) (Gambar 2).
Nucleopolyhedrovirus (NPV)
Baculoviridae adalah kelompok utama virus yang menyerang arthropoda (Herniou & Jehle 2007). Nucleopolyhedrovirus merupakan genus terpenting dari Gambar 2 Siklus hidup H. armigera, (a) telur, (b) larva instar pertama (neonate),
(c) larva instar akhir, (d) prapupa, (e) pupa, (f) imago betina (atas) dan jantan (bawah).
d= 0.05 cm
p = 0. 1 cm
p = 2 cm
p=1.8 cm p = 3.5 cm
♀ Rentang sayap = 2.5 cm
♂ Rentang sayap = 2.1 cm
a
b
c
d
e
famili Baculoviridae, karena sekitar 40% jenis virus yang dikenal menyerang serangga termasuk dalam genus ini. NPV paling banyak pada ordo Lepidoptera (86%) dan sedikit pada ordo Hymenoptera (7%) serta ordo Diptera (3%). Selain itu, NPV juga telah diketahui menyerang ordo Coleoptera, Trichoptera, dan Neuroptera. Beberapa keunggulan penggunaan NPV antara lain memiliki inang sangat spesifik, mampu menginfeksi serangga yang telah resistan terhadap insektisida, relatif persisten di pertanaman dan tanah, serta tidak meninggalkan residu di alam. Umumnya NPV menginfeksi stadia larva Lepidoptera, sedikit sekali laporan yang menyebutkan bahwa NPV dapat menginfeksi pupa dan imago (Koul & Dhaliwal 2002). Penamaan NPV disesuaikan dengan nama inang dimana pertama kali diisolasi dan diidentifikasi (CABI 2000). NPV yang menyerang larva Helicoverpa armigera (Lepidoptera : Noctuidae) disebut Helicoverpa armigera NPV (HearNPV). Secara taksonomi (ICTV 2014), HearNPV termasuk ke dalam :
Famili : Baculoviridae Subfamili : Eulobaculovirinae Genus : Alphabaculovirus
Klasifikasi virus didasarkan pada materi genetik penyusun dan ada tidaknya amplop/kapsid penyelubung virion. NPV merupakan virus golongan I dengan materi genetik DNA untai ganda yang memproduksi dua tipe virion, yaitu occlussion derived virus (ODV), dan budded virus (BV) (Jehle et al. 2006). ODV diproduksi dalam matriks protein kristal yang disebut badan oklusi (OB), bertanggung jawab pada infeksi primer serta untuk penyebaran virus di antara serangga (Szewczyk et al. 2006). ODV disebarkan melalui kotoran serangga yang terinfeksi (Vasconcelos 1996). BV diproduksi setelah infeksi primer selesai, berfungsi untuk menularkan virus ke jaringan lain dalam serangga yang terinfeksi. Secara filogenetis, NPV terbagi menjadi NPV tipe I yang mengandung fusi protein Gp64, diperlukan agar virus mudah masuk ke dalam sel, sedangkan NPV tipe II tidak mengandung fusi protein Gp64, namun memiliki F protein yang memiliki peran yang sama dengan Gp64. Protein ini juga dapat ditemukan beberapa virus vertebrata (Szewczyk et al. 2006). Menurut Li & Blissard (2009) gen gp64 yang terdapat pada badan oklusi NPV memegang peranan penting sebagai reseptor pengikat sel serangga inang dan memudahkan virus masuk ke dalam sel inang melalui proses endositosis. Virion terbungkus dalam protein kristalin berupa badan oklusi (occlusion bodies) yang disebut dengan polihedra. Polihedra berukuran 0.5-15 µm (Vega & Kaya 2012), dapat dengan mudah diamati dengan menggunakan mikroskop cahaya, berbeda dengan jenis virus lainnya yang cenderung sulit terlihat (Grzywacz et al. 2011). Virion NPV memiliki nucleocapsid tunggal (SNPV) atau nukleokapsid jamak (MNPV). Pada SNPV tiap envelope berisi satu nuckleokapsid, sedangkan pada MNPV berisi lebih dari satu sampai 39 nukleokapsid (Kalmakoff & Ward 2003). Pada umumnya SNPV mempunyai inang yang lebih spesifik dibandingkan dengan MNPV (Ignoffo & Couch 1981). Nukleokapsid berbentuk batang yang mengandung untaian ganda asam deoksiribonukleat (DNA) sirkular dengan panjang 250 – 400 nm dan lebar 40 – 70 nm (Tinsley & Kelly 1985).
pada keturunannya melalui telur (transovarial), maupun telur yang terkontaminasi oleh virus dari lingkungannya (transovum). Apabila virus telah masuk ke dalam tubuh serangga, polihedra NPV akan larut dan pecah serta melepaskan virion pada sel-sel saluran pencernaan tengah (mesenteron) yang bersuasana alkalin (pH 9.0-10.5). Virion menembus dinding saluran pencernaan untuk masuk ke rongga tubuh, kemudian menginfeksi sel-sel yang rentan hingga syaraf. Dalam waktu 1-2 hari setelah polihedra tertelan, hemolimfa yang semula jernih berubah menjadi keruh. Tahap ini disebut infeksi primer. Replikasi virion terjadi di dalam inti sel (nukleus). Nukleus lama-kelamaan akan membengkak karena dipenuhi oleh massa padat virus yang disebut viroplan. Pada tahap selanjutnya (infeksi sekunder) virus akan menyerang sel-sel dari organ tubuh yang lain, namun sebelumnya untuk menembus keluar dari dinding sel, virus membentuk BV dengan tunas pada bagian ujungnya yang disebut peplomer. Pembentukan badan oklusi (polihedra) terjadi sebagai hasil infeksi sekunder pada jaringan sel hemolimf, trakea, hypodermis, dan badan lemak. Larva yang terinfeksi NPV pada umumnya ditandai dengan berkurangnya kemampuan makan, gerakan yang lambat, dan tubuh membengkak akibat replikasi atau perbanyakan partikel-partikel virus. Integumen larva mengalami lisis sehingga menjadi lunak, rapuh sehingga mudah sobek (Vega & Kaya 2012). Pada akhirnya tubuh larva pecah dan mengeluarkan cairan kental berwarna coklat susu yang mengandung milyaran polihedra NPV dengan bau yang sangat menyengat (Gambar 3). Larva serangga inang yang terinfeksi NPV akan mengalami abnormalitas secara morfologi, fisiologi dan perilakunya (Pionar & Thomas 1984). Hoffmann & Frodsham (1993) menyatakan bahwa virus yang berbeda akan menimbulkan tanda dan gejala yang berbeda pula. Di lapangan, kematian larva akibat terinfeksi NPV sering ditemukan dengan tanda tubuh larva menggantung dengan tungkai semu menempel pada daun atau ranting tanaman. Kematian larva muda (instar-1 sampai 3) terjadi dalam 2 hari, sedangkan larva tua (instar-4 sampai 6) dalam 4-9 hari setelah polihedra tertelan (Vega & Kaya 2012).
Beberapa cara yang dapat dilakukan untuk mempercepat daya bunuh, antara lain (a) mengaplikasikan NPV pada saat larva masih muda (Okada 1977), (b) mendapatkan strain NPV dengan virulensi tinggi, (c) mengkombinasikan NPV dengan insektisida, dan (d) mengembangkan NPV rekombinan yang memiliki daya bunuh 2-3 hari. Teknik DNA rekombinan dilakukan dengan cara menyisipkan gen spesifik ke dalam genom NPV (Starnes et al. 1993). Treacy (1999) menyatakan bahwa untuk mengatasi kelemahan kinerja NPV secara
bioteknologi telah dilakukan melalui dua pendekatan, yaitu dengan menghilangkan gen (gene deletion) tertentu dari genom virus dan menyisipkan gen (gene insertion) yang mengekspresikan protein yang bersifat virulen pada genom virus.
Gen late expression factor 8 (Lef-8)
Keanekaragaman genetik merupakan variasi gen dalam satu spesies di antara individu dalam satu populasi atau di antara populasi yang terpisah secara geografis (Indrawan et al. 2007). Hal ini dapat terjadi karena adanya perubahan nukleotida penyusun deoxyribonucleic acid (DNA) (Suryanto 2003). Variasi alel dari gen dapat memengaruhi fisiologi dan perkembangan suatu individu. Tingkat keanekaragaman genetik ini berperan dalam proses adaptasi terhadap lingkungan (Indrawan et al. 2007). Besarnya tingkat keanekaragaman di dalam suatu spesies bergantung pada jumlah individu, penyebaran wilayah geografis, dan sistem genetiknya (Elrod & Stansfield 2007). Informasi keanekaragaman genetik ini bermanfaat untuk mendapatkan spesies dengan beberapa sifat unggul, dalam hal ini diperlukan informasi mengenai strain NPV dengan virulensi tinggi. Berdasarkan spesifik inangnya, famili Baculoviridae dibagi menjadi empat genus, yaitu Alphabaculovirus yang merupakan spesifik Lepidoptera terbagi atas sub grup I dan II, Betabaculovirus yang merupakan golongan granulovirus spesifik Lepidoptera, Gammabaculovirus yang merupakan spesifik Hymenoptera, dan Deltabaculovirus yang merupakan spesifik Diptera (Jehle et al. 2006). Perbedaan antara urutan genom yang terdapat pada Baculovirus ini menjadi sumber kunci identifikasi yang disebut dengan gen inti (core gene). Gen inti ini dapat menunjukkan beberapa fungsi biologi di antaranya gen ekspresi virus, struktur produksi virion, mekanisme perkembangan infeksi maupun pembatalan infeksi terhadap inang (Van Oers et al. 2007).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan September 2014 – Agustus 2015. Sampel isolat HearNPV diperoleh dari perkebunan kapas di Kabupaten Gowa-Provinsi Sulawesi Selatan, Kab. Wonogiri-Prov. Jawa Tengah dan Kab. Situbondo-Prov. Jawa Timur. Uji bioassai dan pengolahan data dilakukan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Karakterisasi molekuler dilakukan di laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Pengamatan morfologi polihedra dilakukan di laboratorium Zoologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI)-Cibinong.
Prosedur Penelitian
Uji Patogenisitas HearNPV
Perbanyakan Serangga Uji. Larva H. armigera diperoleh dari pertanaman jagung di Kelurahan Ciparigi, Kecamatan Bogor Utara dan dipelihara secara individual dalam mangkok plastik berdiameter 5.5 cm dan tinggi 4.7 cm menggunakan pakan tongkol jagung muda. Pupa yang terbentuk dipindahkan ke wadah plastik berdiameter 34 cm dan tinggi 35 cm yang bagian dasarnya diisi dengan serbuk gergaji. Bagian atas wadah ditutup dengan kain kasa sebagai tempat peletakan telur. Ngengat diberi pakan larutan madu 10% yang diresapkan pada kapas. Telur yang diletakkan pada kain kasa dipanen setiap hari (Gambar 4). Setelah 24 jam, dilakukan sterilisasi terhadap permukaan telur menggunakan sodium hypoclorite 0.1%. Larva yang diperoleh digunakan untuk tahap penelitian selanjutnya.
Gambar 4 Wadah peletakan telur oleh imago H. armigera
Serbuk kayu
Larutan madu 10% diresapkan pada kapas
Penutup kain kasa,
Isolasi dan Perbanyakan NPV. Sampel cadaver ulat H. armigera yang menunjukkan gejala terserang NPV dari ketiga wilayah (Provinsi Sulawesi Selatan, Jawa Tengah, dan Jawa Timur), dikumpulkan kemudian dimurnikan di laboratorium. Cadaver digerus dengan mortar dalam larutan SDS 0.1 %, kemudian disaring menggunakan kain kasa berukuran 100 mesh. Filtrat dituang ke dalam tabung mikro 2 mL, kemudian disentrifugasi dengan kecepatan 2 000 rpm selama 1 menit. Pelet yang terbentuk dibuang, supernatan diambil dan disentrifugasi kembali dengan kecepatan 5 000 rpm selama 20 menit. Pelet yang terbentuk ditambahkan beberapa tetes aquabides (Cheng 1998). Irisan jagung dicelupkan ke dalam suspensi tersebut untuk selanjutnya digunakan sebagai pakan larva instar-3 H. armigera. Ulat yang mati setelah mengonsumsi pakan tersebut, dikumpulkan dan diproses dengan metode yang sama untuk mendapatkan NPV yang diperlukan untuk tahap penelitian selanjutnya.
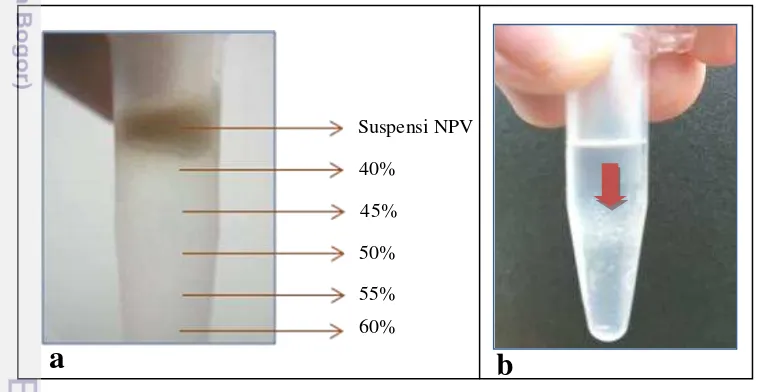
Bioassai NPV terhadap H. armigera. Pemurnian virus dilakukan dengan
metode gradien sukrosa yang dibuat secara kontinyu pada tabung mikro 2 mL (Grzywacz et al.2011). Selanjutnya disentrifugasi dengan kecepatan 13 000 rpm selama 99 menit. Pita putih yang terbentuk diambil dengan menggunakan pipet pasteur dan disuspensikan kembali dengan menambahkan beberapa tetes aquabides (Gambar 5). Suspensi tersebut disentrifugasi kembali pada 7 000 rpm selama 20 menit. Endapan yang terbentuk diambil dan ditambahkan aquabides, kemudian kerapatan polihedra HearNPV dalam suspensi tersebut ditentukan dengan menggunakan haemacytometer. Kerapatan yang digunakan yaitu 2.5x103, 2.5x104, 2.5x105, 2.5x106, dan 2.5x107 POBs/mL. Pipilan jagung muda dicelupkan ke dalam masing-masing suspensi HearNPV dan diberikan pada larva H. armigera instar-1 sebanyak 20 individu tiap perlakuan. Perlakuan diulang sebanyak empat kali. Kontrol menggunakan pipilan jagung muda yang dicelupkan ke dalam aquabides.
Penampang Polihedra Isolat HearNPV melalui Scanning Elecron Microscopy
(SEM)
Suspensi polihedra murni ditempatkan pada coverglass sebanyak satu lup inokulasi kemudian dikeringanginkan. Setelah kering, coverglass tersebut ditempelkan pada stub dengan menggunakan double tape carbon. Sampel kemudian dilapisi (coated) dengan emas menggunakan ion sputtering device (JEOL FINE COAT tipe JFC-1100 E) selama 4 menit dengan arus listrik sebesar 10 A untuk memperoleh lapisan setebal 30 Ǻ (Gambar 6). Hal tersebut dilakukan untuk meningkatkan jumlah elektron yang masuk dan memantul dari sampel sehingga dapat ditangkap dengan alat penginderaan. Setelah pelapisan, sampel tersebut diamati dengan menggunakan SEM (Tipe JEOL JSM-5200) pada perbesaran 5000 kali. Gambar yang diperoleh kemudian diabadikan dengan menggunakan kamera Polaroid.
Gambar 6 Alat pelapis emas pada sampel preparasi SEM, tampak samping (kiri) dan tampak atas (kanan)
Karakterisasi Molekuler
Pemurnian virion dan ekstraksi DNA. Polihedra yang telah dimurnikan menggunakan gradien sukrosa pada metode sebelumnya diresuspensi dengan larutan sodium karbonat (Na2CO3, pH 11), dan didiamkan pada suhu 37 oC selama
30 menit, kemudian disentrifugasi kembali menggunakan tabung mikro 2 mL pada 13 000 rpm selama 1 jam hingga terbentuk pelet yang merupakan kumpulan virion NPV. Virion dimurnikan dengan metode yang sama pada pemurnian polihedra (Cheng 1998), selanjutnya dilakukan ekstraksi DNA dengan menggunakan Viral nucleic acid extraction kit II (Geneaid VR050). Proses ekstraksi DNA genom virus meliputi beberapa tahapan sebagai berikut:
1. Lisis : Proses ini bertujuan mengeluarkan isi sel dengan cara merusak/menghancurkan dinding sel. Sebanyak 200 µl virion murni dimasukkan ke dalam tabung mikro kemudian ditambahkan 400 µl VB lysis buffer. Suspensi tersebut dikocok menggunakan vortex kemudian diinkubasi pada suhu ruangan selama 10 menit.
3. Pencucian : Sebanyak 400 µl W1 Buffer ditambahkan pada tabung kolom VB, kemudian disentrifugasi pada kecepatan 13 000 rpm selama 1 menit. Cairan yang tertampung pada dasar tabung balance dibuang. Pada tabung kolom VB ditambahkan 600 µl wash buffer yang berfungsi mencuci DNA dari pengotor, kemudian disentrifugasi kembali pada 13 000 rpm selama 1 menit. Cairan yang tertampung pada dasar tabung mikro dibuang, kemudian disentrifugasi kembali pada 13 000 rpm selama 3 menit hingga dasar tabung kolom VB kering.
4. Elusi asam nukleat: Pindahkan tabung kolom VB ke dalam tabung mikro yang baru, kemudian ditambahkan 50 µl RNAase free water yang berfungsi mengikat RNA yang termasuk dalam pengotor, setelah itu didiamkan selama 3 menit. Setelah itu disentrifugasi pada kecepatan 13 000 rpm selama 1 menit. Cairan akhir yang tertampung di dasar tabung mikro merupakan DNA hasil ekstraksi (fungsi semua bahan)
Gambar 7 Ilustrasi tabung kolom VB yang digunakan dalam ekstraksi DNA
Amplifikasi DNA HearNPV menggunakan PCR. Amplifikasi menggunakan primer gen lef-8 dengan urutan oligonukleotida primer forward 5’ -ATGAATTGCAAACTCTCCGCCCAG-3’ dan reverse3’ -TCGACTGCAGACC-GCCGAAGA-5’ (Kaur et al. 2014). Untuk amplifikasi tiap isolat HearNPV, sebanyak 2 μl DNA hasil ekstraksi dicampur dengan reagen yang terdiri atas 8 μl ddH2O, 12.5 μl Taq DNA polymerase, masing-masing 1 μl primer, 0.5 μl MgCl
hingga volume akhir yang digunakan dalam amplifikasi sebanyak 25 μl. Amplifikasi dilakukan pada mesin PCR (gene amp system 9700). Satu siklus amplifikasi meliputi tiga tahapan utama yaitu: pradenaturasi 94 oC selama 5 menit, denaturasi 94 oC selama 1 menit, penempelan 61 oC selama 1 menit, ekstensi 72 oC selama 1 menit, dan pasca ekstensi 72 oC selama 7 menit, serta 4
oC untuk suhu akhir penyimpanan. Siklus diulangi sebanyak 35 kali. Proses
elektroforesis dilakukan dengan memasukan 5 μl DNA hasil amplifikasi ke dalam sumur gel agarose 1% yang direndam dalam larutan Tris Borate EDTA (TBE) kemudian dialiri dengan arus listrik 50 volt selama 50 menit. Selanjutnya direndam dalam larutan Ethidium Bromida (EtBr) selama 30 menit. Visualisasi DNA dilakukan dengan cara meletakkan gel agarose pada UV-transiluminator.
Tabung kolom VB
Tabung mikro
Analisis Data
Bioassai HearNPV
Pengamatan dilakukan terhadap mortalitas, tanda, serta gejala penyakit yang muncul tiap hari hingga seluruh larva uji mati.
Persentase larva yang mati (P) dihitung dengan rumus:
Keterangan:
n = jumlah larva yang mati pada tiap perlakuan N = jumlah larva keseluruhan pada tiap perlakuan
Apabila terdapat mortalitas pada perlakuan kontrol (tidak lebih dari 20%), maka mortalitas larva dikoreksi dengan formula Abbott (1925) dengan rumus sebagai berikut:
Keterangan :
P = mortalitas terkoreksi (%)
P’ = mortalitas hasil pengamatan pada setiap perlakuan HearNPV (%) C = mortalitas pada kontrol (%)
Data diolah dengan menggunakan probit (Finney 1971) pada program statistical analysis system (SAS) untuk memperoleh nilai lethal concentration (LC50 dan LC90), dan lethal time (LT50 dan LT90).
Pengurutan DNA dan analisis filogeni
HASIL DAN PEMBAHASAN
Hasil
Patogenisitas HearNPV
Uji bioassai menunjukkan bahwa pada satu hari setelah inokulasi (1 HSI) telah terjadi mortalitas larva uji pada kerapatan 2.5x107 POBs/mL oleh perlakuan isolat HearNPV Sulawesi Selatan yaitu sebesar 3.8%, dan isolat HearNPV Jawa Timur sebesar 2.5%, sedangkan isolat HearNPV Jawa Tengah belum menunjukkan adanya kematian. Mortalitas larva uji oleh isolat HearNPV Jawa Tengah baru terlihat pada 2 HSI dengan kerapatan 2.5x103 POBs/mL yaitu sebesar 5.1%, namun pada isolat HearNPV Sulawesi Selatan justru belum menunjukkan adanya kematian larva uji pada kerapatan tersebut (Tabel 1). Isolat HearNPV Sulawesi Selatan pada kerapatan tinggi (>2.5x105 POBs/mL) mampu menyebabkan mortalitas larva uji tertinggi dibandingkan dengan kedua isolat lainnya, namun tidak demikian halnya pada kerapatan rendah (≤2.5x105 POBs/mL). Isolat HearNPV Jawa Timur pada kerapatan rendah justru menunjukkan mortalitas larva uji lebih tinggi dibandingkan dengan kedua isolat lainnya.
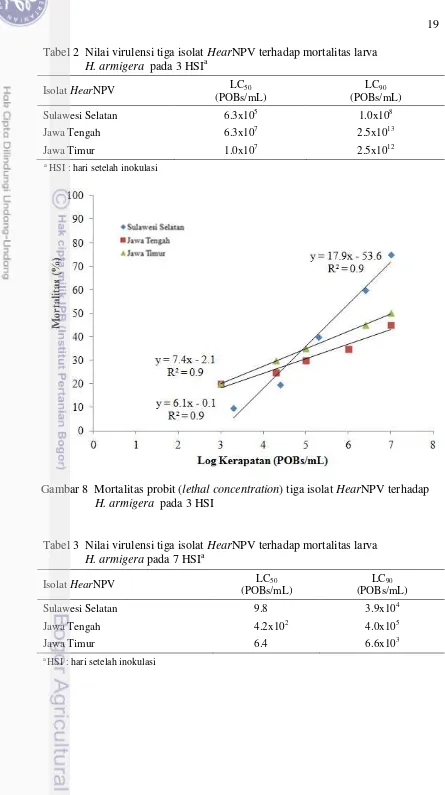
Analisis lanjutan dengan probit diperoleh nilai lethal concentration (LC) pada 3 HSI yaitu LC50 sebesar 6.3x105 POBs/mL dan LC90 sebesar 1.0x108
POBs/mL oleh isolat HearNPV Sulawesi Selatan (Tabel 2). Nilai ini merupakan nilai LC terendah dibandingkan dua isolat lainnya, dengan persamaan regresi y = 17.9x - 53.6 yang menunjukkan hubungan antara logaritma kerapatan dan probit persentase mortalitas larva. Nilai kemiringan (slope) yang terbentuk sebesar 17.9. Nilai slope yang positif menunjukkan hubungan yang berbanding lurus, artinya semakin tinggi nilai X maka semakin besar pula nilai Y. Ketiga isolat HearNPV memiliki nilai R2 mendekati 1, artinya koefisien korelasi antara variabel X dan Y sangat erat. Hal ini juga menunjukkan keragaman data yang cukup baik (Gambar 8).
Pada 7 HSI, isolat HearNPV asal Jawa Timur menunjukkan nilai LC50 dan
LC90 terendah yaitu pada kerapatan 6.4 POBs/mL dan 6.6x103 POBs/mL, disusul
oleh isolat HearNPV Sulawesi Selatan dengan kerapatan 9.8 POBs/mL pada LC50
dan 3.9x104 POBs/mL pada LC90, selanjutnya isolat HearNPV Jawa Tengah
dengan kerapatan 4.2x102 POBs/mL pada LC50 dan 4.0x105 POBs/mL pada LC90.
Tabel 2 Nilai virulensi tiga isolat HearNPV terhadapmortalitas larva H. armigera pada 3 HSIa
Isolat HearNPV LC50
(POBs/mL)
LC90 (POBs/mL)
Sulawesi Selatan 6.3x105 1.0x108
Jawa Tengah 6.3x107 2.5x1013
Jawa Timur 1.0x107 2.5x1012
a
HSI : hari setelah inokulasi
Tabel 3 Nilai virulensi tiga isolat HearNPV terhadapmortalitas larva H. armigera pada 7 HSIa
Isolat HearNPV LC50
(POBs/mL)
LC90 (POBs/mL)
Sulawesi Selatan 9.8 3.9x104
Jawa Tengah 4.2x102 4.0x105
Jawa Timur 6.4 6.6x103
a
HSI : hari setelah inokulasi
Gambar 9 Mortalitas probit (lethal concentration) tiga isolat HearNPV terhadap H. armigera pada 7 HSI
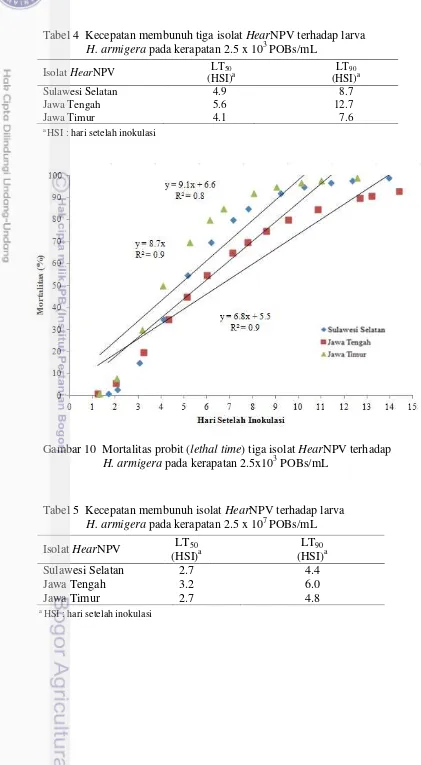
Isolat HearNPV Jawa Timur menunjukkan kemampuan membunuh lebih cepat dibandingkan kedua isolat lainnya pada kerapatan 2.5x103 POBs/mL, hal ini terlihat dengan rendahnya nilai LT50 dan LT90 yaitu 4.1 dan 7.6 HSI (Tabel 4).
Nilai koefisien regresi variabel rentang waktu setelah inokulasi (X) sebesar 9.1, artinya jika ada penambahan rentang waktu 1 hari setelah isolat HearNPV Jawa Timur diinokulasikan, maka mortalitas H. armigera (Y) akan mengalami peningkatan sebesar 9.1 (Gambar 10). Pada kerapatan 2.5x107 POBs/mL, isolat HearNPV Sulawesi Selatan dan Jawa Timur menunjukkan nilai LT50 dan LT90
a HSI : hari setelah inokulasi
Tabel 4 Kecepatan membunuh tiga isolat HearNPV terhadaplarva H. armigera pada kerapatan 2.5 x 103 POBs/mL
a
HSI : hari setelah inokulasi
Gambar 10 Mortalitas probit (lethal time) tiga isolat HearNPV terhadap H. armigera pada kerapatan 2.5x103 POBs/mL
Tabel 5 Kecepatan membunuh isolat HearNPV terhadaplarva H. armigera pada kerapatan 2.5 x 107 POBs/mL Isolat HearNPV LT50
(HSI)a (HSI)LT90 a
Sulawesi Selatan 4.9 8.7
Jawa Tengah 5.6 12.7
Jawa Timur 4.1 7.6
Isolat HearNPV LT50 (HSI)a
LT90
(HSI)a
Sulawesi Selatan 2.7 4.4
Jawa Tengah 3.2 6.0
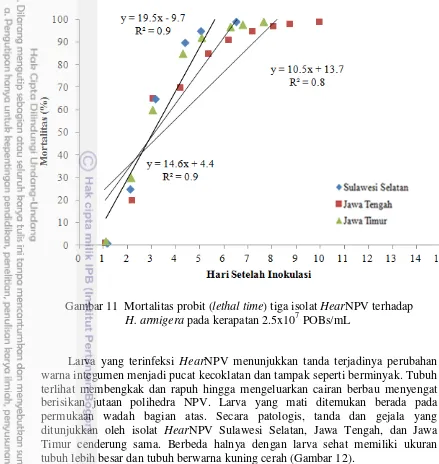
Gambar 11 Mortalitas probit (lethal time) tiga isolat HearNPV terhadap H. armigera pada kerapatan 2.5x107 POBs/mL
Larva yang terinfeksi HearNPV menunjukkan tanda terjadinya perubahan warna integumen menjadi pucat kecoklatan dan tampak seperti berminyak. Tubuh terlihat membengkak dan rapuh hingga mengeluarkan cairan berbau menyengat berisikan jutaan polihedra NPV. Larva yang mati ditemukan berada pada permukaan wadah bagian atas. Secara patologis, tanda dan gejala yang ditunjukkan oleh isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur cenderung sama. Berbeda halnya dengan larva sehat memiliki ukuran tubuh lebih besar dan tubuh berwarna kuning cerah (Gambar 12).
Gambar 12 Tanda dan gejala larva H. armigera terinfeksi oleh tiga isolat HearNPV pada 4 HSI, (a) Sulawesi Selatan, (b) Jawa Tengah, (c) Jawa Timur, dan (d) kontrol.
Gambar 13 Tanda dan gejala pupa H. armigera terinfeksi HearNPV, (a) pupa sakit, (b) Kontrol (sehat)
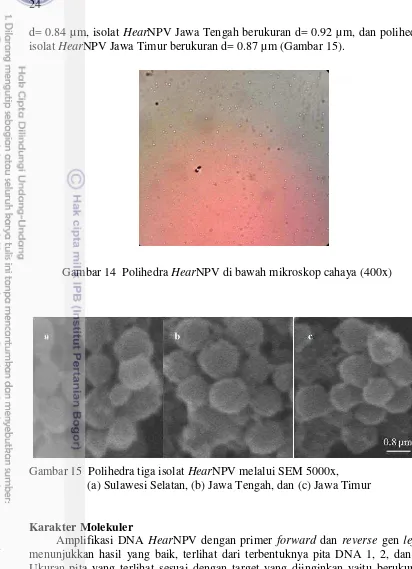
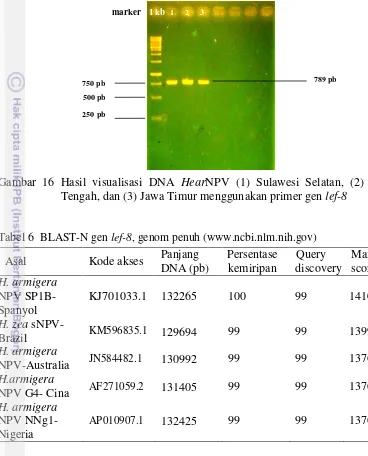
Bentuk dan Ukuran Polihedra
Pada perbesaran 400x, polihedra HearNPV yang diamati menggunakan mikroskop cahaya nyaris sama di antara ketiga isolat berbentuk seperti butiran-butiran kecil (Gambar 14). Pengamatan lebih lanjut menggunakan Scanning Electron Microscopy (SEM), juga menunjukkan bentuk polihedra pada isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur dengan ukuran yang tidak jauh berbeda pula. Polihedra isolat HearNPV Sulawesi Selatan berukuran
a
b
c
d
d= 0.84 µm, isolat HearNPV Jawa Tengah berukuran d= 0.92 µm, dan polihedra isolat HearNPV Jawa Timur berukuran d= 0.87 µm (Gambar 15).
Gambar 14 Polihedra HearNPV di bawah mikroskop cahaya (400x)
Gambar 15 Polihedra tiga isolat HearNPV melalui SEM 5000x,
(a) Sulawesi Selatan, (b) Jawa Tengah, dan (c) Jawa Timur
Karakter Molekuler
Amplifikasi DNA HearNPV dengan primer forward dan reverse gen lef-8 menunjukkan hasil yang baik, terlihat dari terbentuknya pita DNA 1, 2, dan 3. Ukuran pita yang terlihat sesuai dengan target yang diinginkan yaitu berukuran sekitar 789 pb (pasang basa) (Gambar 16).
strain HearNPV yang sama dengan homologi 100%. Hasil ini kemudian diblast melalui situs online www.ncbi.nlm.nih.gov diperoleh beberapa spesies NPV yang memiliki kemiripan cukup tinggi dengan isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur (Tabel 7).
Gambar 16 Hasil visualisasi DNA HearNPV (1) Sulawesi Selatan, (2) Jawa Tengah, dan (3) Jawa Timur menggunakan primer gen lef-8
Tabel 6 BLAST-N gen lef-8, genom penuh (www.ncbi.nlm.nih.gov) Asal Kode akses Panjang
Brazil KM596835.1 129694 99 99 1399/1399
H. armigera
spanyol (No. akses KJ701033.1) dengan persentase kemiripan 100%, dan query discovery 99%.
Tabel 7 Homologi HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur gen lef-8 dengan sampel dari GenBank
1 2 3 4 5 6 7 8 9
1 ID
2 1 ID
3 1 1 ID
4 1 1 1 ID
5 1 1 1 1 ID
6 0.987 0.987 0.987 0.987 0.987 ID
7 0.989 0.989 0.989 0.989 0.989 0.992 ID
8 0.987 0.987 0.987 0.987 0.987 1 0.992 ID
9 0.984 0.984 0.984 0.984 0.984 0.982 0.979 0.982 ID Ket : 1. HearNPV Sulawesi Selatan, 2. HearNPV Jawa Tengah, 3. HearNPV
Jawa Timur, 4. HearNPV Spanyol, 5. HezeNPV Brazil, 6. HearNPV Australia, 7. HearNPV Nigeria, 8. HearNPV Cina, 9. HearNPV India Ketiga isolat HearNPV asal Indonesia ini menunjukkan kekerabatan tinggi dengan homologi 100% pada isolat Helicoverpa zea NPV asal Brazil (No. akses: KM596835.1), dan H. armigera NPV Spanyol (No. akses: KJ701033.1), serta homologi >98% pada HearNPV India (No. akses: FJ157286.1), Nigeria (No. akses: AP010907.1), Australia (No. akses: JN584482.1), dan Cina (No. akses: AF271059.2). Selain kelima spesies HearNPV dan HezeNPV hasil blast, juga digunakan spesies pembanding yang merupakan NPV dari Lepidoptera lainnya (Tabel 8). Hal ini bertujuan untuk melihat jarak genetik/kekerabatan antara isolat HearNPV dan spesies Lepidoptera NPV lainnya.
Tabel 8 Spesies Lepidoptera NPV gen lef-8 sebagai pembanding Helicoverpa NPV hasil BLASTN, genom sebagian (www.ncbi.nlm.nih.gov)
Kode akses Spesies Lepidoptera NPV Panjang (pb)
AY706558.1 Hemerocampa vetusta nucleopolyhedrovirus isolate A24-5 lef-8 gene, partial cds., Jerman
699 AB451187.1 Spodoptera litura NPV lef-8 gene for late
expression factor 8, isolate: Act-1, Jepang
446 JX454582.1
AY729809.1
Spodoptera littoralis NPV isolate 3032 late expression factor 8 (lef-8) gene, Columbia Leucoma salicis nucleopolyhedrovirus late expression factor 8(lef-8) gene, partial cds., Polandia
715
479 KT149869.1 Spilarctia obliqua nucleopolyhedrovirus isolate
IISR-NPV-02 lef-8 (lef-8) gene, India
688
Gambar 17 Pohon filogeni Lepidoptera NPV diolah dengan software Mega 5
Pembahasan
Uji patogenisitas menunjukkan bahwa isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur virulen terhadap larva uji, H. armigera. Kerapatan polihedra berkorelasi positif terhadap persentase mortalitas larva uji. Dengan meningkatnya kerapatan HearNPV yang diinokulasikan pada larva instar pertama H. armigera, maka semakin tinggi pula persentase mortalitas H. armigera. Hal ini disebabkan oleh semakin banyak jumlah polihedra yang tertelan oleh larva yang dapat meningkatkan peluang terjadinya infeksi pada sel-sel jaringan tubuh,
sebaliknya pada kerapatan polihedra yang rendah akan memperpanjang periode laten bagi virus dalam tubuh serangga (Laoh et al. 2003). Pada kerapatan rendah (2.5x103 POBs/mL), rerata ketiga isolat mampu mematikan seluruh populasi larva uji setelah 10 HSI. Pada kerapatan tinggi (2.5x107 POBs/mL), rerata ketiga isolat mampu mematikan seluruh populasi larva uji pada 7 HSI. Percobaan yang dilakukan oleh Gundannavar et al. (2004) pada isolat HearNPV dengan kerapatan 106 POBs/mL dapat menyebabkan mortalitas H. armigera sebesar 50-100% dalam kurun waktu 5-8 HSI. Pada kerapatan yang lebih rendah yaitu 103 POBs/mL, mortalitas larva uji mencapai 66.67% pada 10 HSI. Narayanan dan Jayaraj (2002) menunjukkan analisis regresi hubungan antara berat larva pada tiap instar yang berbeda dan jumlah polihedra; kerapatan 3.5x105 POBs/mL diperoleh waktu mematikan sebagian populasi larva uji yaitu 3.5 HSI untuk instar awal dan 8 HSI untuk instar-5. Isolat HearNPV asal Yogyakarta dengan kerapatan 2x108 POBs/mL dapat menyebabkan mortalitas H. armigera sebesar 85% dalam kurun waktu satu minggu, pada kerapatan yang lebih rendah yaitu 2x105 POBs/mL dapat memakan waktu 2 minggu (Asri et al. 2003).
Kerapatan infektif untuk NPV bervariasi terhadap usia larva, semakin tua larva uji yang digunakan maka kerapatan yang diperlukan juga semakin meningkat. Apabila dihubungkan dengan berat larva, dapat diasumsikan bahwa untuk infeksi optimal menggunakan larva instar-3 atau 4 dengan berat 40-70 mg, dapat digunakan dosis 105 OB (occlusion body) per serangga (dosis permukaan) dengan hasil saat pemanenan HearNPV dapat mencapai 3x109 OB per larva. Pada larva uji instar awal (<instar-3) dengan berat larva berkisar 20 mg mudah terinfeksi dengan dosis lebih rendah namun cenderung mati pada ukuran larva yang masih kecil dengan produksi OB yang sedikit, sehingga sangat sulit untuk mencapai 1 x 109 OB per larva saat panen HearNPV. Hal yang berbeda terjadi pada larva instar akhir (instar-5 sampai 6) sulit untuk menginfeksi dan diperlukan jumlah inokulum yang diperlukan sangat besar. Selanjutnya periode larva cukup pendek menjadi pupa, OB yang diproduksi jarang melebihi 1x108 OB per larva (Grzywacz et al 2011). Menurut Pourmirza et al. (2000), tidak ada perbedaan kerentanan yang signifikan antar instar larva dalam mengekspresikan polihedra/mg dalam masing-masing berat larva. Dengan demikian, penggunaan instar-1 (neonate) sebagai larva uji dapat dilakukan dengan pertimbangan kebugaran larva yang seragam mudah diperoleh, jumlah larva uji yang dibutuhkan cukup besar, dan kemudahan dalam memperoleh larva uji bebas kontaminan cukup praktis dilakukan melalui sterilisasi permukaan telur (Grzywacz et al. 2011).
yang dalam hal ini juga memiliki virion merupakan faktor yang sangat diperlukan virus dalam proses infeksi primer pada tubuh serangga inang yang menyebabkan terikatnya virion tersebut ke reseptor mikrovili dan terjadinya fusi antara membran ODV dan mikrovili pada sel mesenteron (Simon et al. 2013). Replikasi virion terjadi di dalam inti sel (nukleus) mesenteron. Nukleus lama-kelamaan akan membengkak karena dipenuhi oleh massa padat yang disebut viroplan. Selama infeksi berlangsung di luar mesenteron, proses perbanyakan nukleokapsid berjalan dengan cepat sehingga membentuk banyak polihedra yang memenuhi seluruh sel tubuh serangga akhirnya mengakibatkan kematian. Proses ini membutuhkan waktu 4 hari sampai 3 minggu bergantung pada jenis virus, serangga inang, jumlah polihedra yang masuk, instar larva yang mulai terinfeksi dan keadaan suhu. Menurut Ignoffo & Couch (1981), dalam waktu 1-2 hari setelah polihedra tertelan, hemolimfa yang semula jernih berubah menjadi keruh. Pada tahap selanjutnya (sekunder) akan menyerang sel-sel organ tubuh. Pembentukan badan oklusi (polihedra) terjadi sebagai hasil infeksi sekunder pada jaringan sel hemolimf, trakea, hipodermis,dan badan lemak.
Isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur menunjukkan pola perkembangan dalam hal menginfeksi serangga uji yang berbeda. Pada kerapatan rendah, perlakuan isolat HearNPV Jawa Timur cukup baik memberikan hasil yang maksimal, sedangkan pada kerapatan tinggi perlakuan isolat HearNPV Sulawesi Selatan mampu menjadi pilihan yang tepat dalam menurunkan populasi larva uji dalam jumlah yang cukup besar, dan waktu yang lebih singkat. Brown (1982) menyatakan virus yang berasal dari spesies inang yang sama namun dari lokasi geografis yang berbeda menunjukkan variasi dalam virulensi, karakter biologi, dan perbedaan dalam susunan DNA. Isolat HearNPV Sulawesi Selatan cenderung memiliki kemampuan mematikan inang secara cepat. Hal ini ditunjukkan oleh nilai LC50 dan LC90 yang rendah pada hari
ketiga setelah inokulasi virus dilakukan. Namun kerapatan virus yang digunakan untuk mematikan lebih dari 50% populasi larva uji ini minimal berada pada kisaran 2.5x105 POBs/mL. Pada kerapatan dibawah nilai ini, isolat HearNPV Sulawesi Selatan kurang memberikan hasil yang maksimal. Sebaliknya terjadi pada isolat HearNPV Jawa Timur yang bekerja secara konstan, dimulai pada kerapatan rendah telah mampu menurunkan populasi larva uji dengan cukup baik walaupun cenderung lebih lamban yaitu pada 6 HSI. Hasil percobaan ini sesuai dengan pendapat Starnes et al. (1993) bahwa kematian ulat akibat NPV mulai terjadi pada 3-4 HSI, bergantung pada strain virus, jenis inang, stadia inang, banyaknya polihedra, dan suhu. Variasi beberapa fenotip isolat virus HearNPV dari beberapa wilayah geografis dapat dikarakterisasi berdasarkan tiga sifat dalam siklus hidupnya yaitu patogenisitas, kecepatan membunuh, dan jenis virion yang dihasilkan (Hodgson et al. 2001).
pada delapan jam setelah infeksi. Setelah itu progeni virus membentuk tunas disebut peplomer (budded virus) untuk bermigrasi di luar sel. Produksi polihedra ini biasa nya memakan waktu 48 jam. Pada tahap ini siklus primer telah selesai dan selanjutnya memulai siklus kedua dengan menginfeksi jaringan tubuh lainnya. Derajat patogenisitas (virulensi) virus ini didasarkan pada kemampuan virus membunuh organisme sasaran dalam waktu yang singkat, dalam hal ini nilai LC dan LT yang rendah digunakan sebagai parameter pengujian. Isolat HearNPV Jawa Timur mampu mematikan larva uji dalam jumlah cukup besar pada kerapatan minimum, serta dalam waktu yang cukup singkat. Selanjutnya disusul oleh isolat HearNPV Sulawesi Selatan, kemudian Jawa Tengah.
Menurut Fuxa (1994), larva yang terinfeksi virus masih tetap menunjukkan aktivitas makan karena energi yang dihasilkan dari aktivitas makan tersebut diperlukan untuk bertahan hidup. Infeksi virus akan menyebabkan metabolisme sel larva serangga terganggu, sehingga menurunkan potensi energi yang dihasilkan larva yang seharusnya digunakan untuk tumbuh dan berkembang (Bong & Sikorowski 1991). Infeksi virus ini menyebabkan perpanjangan waktu menuju pupa yang berarti menghabiskan energi larva (Sanjaya 2000). Secara umum, gejala awal pada serangga yang terinfeksi NPV ditandai dengan perubahan warna tubuh dan perubahan perilaku serangga tersebut. Pada penelitian ini, ketiga isolat menunjukkan tanda dan gejala infeksi yang sama. Larva yang terinfeksi NPV memiliki gejala aktifitas makan yang cenderung berkurang dan gerakan tubuh yang berangsur-angsur menjadi lambat, tekstur tubuh lunak, dan integumen berubah warna, serta hemolimfa menjadi keruh, selanjutnya mengakibatkan kematian. Di lapangan larva yang terinfeksi NPV sering terlihat menggantung dengan kedua tungkai semu menempel pada daun atau ranting tanaman membentuk huruf “V” terbalik atau terkulai pada helaian daun (Samsudin 2011). Toprak et al. (2005) menambahkan bahwa gejala infeksi virus pada serangga akan menunjukkan adanya perubahan bertingkat dalam warna integumen yang semakin bertambah gelap dan tampak berminyak. Kutikula larva yang terinfeksi NPV menipis dan menjadi rapuh akibat kinerja gen cathepsin dan enzim kitinase yang terdapat dalam genom Baculovirus. Adapun perkembangan fase larva yang terinfeksi NPV cenderung lebih lamban dan lama. Hal ini disebabkan oleh adanya fungsi gen ecdysteroidglucosyl transferase (egt) yang dimiliki oleh NPV (Etebari et al. 2007) yang berfungsi menonaktifkan hormon ecdysteroid serangga inang sehingga stadia larva dari serangga yang terinfeksi virus akan semakin panjang (Koul & Dhaliwal 2002).
Pada pengamatan dengan menggunakan SEM, ukuran polihedra dari ketiga isolat HearNPV cenderung sama, tidak menunjukkan perbedaan yang nyata. Cheng (1998) mengemukakan ukuran dan bentuk polihedra (OB) cukup bervariasi bergantung pada spesies. Beberapa bentuk polihedra yang pernah dilaporkan yaitu berbentuk kuboid, dodecahedral, tetrahedral dan bentuk tidak beraturan. Lima isolat HearNPV dari wilayah geografis yang berbeda di India menunjukkan variasi dalam ukuran, virulensi dan pemotongan situs restriksi pada pita DNA elektroforesis. Diameter rerata dari polihedra 1.9 µm dan tidak berbeda secara segnifikan di antara kelima isolat tersebut. Hasil visualisasi elektroforesis dengan SDS-PAGE menunjukkan pola polihedrin yang sama. Namun demikian, virulensi kelimanya cukup berbeda signifikan dengan nilai LC50 terendah ditunjukkan oleh
dari Coimbatore (Somasekar et al. 1993). Menurut Guo et al 2006, bentuk dan ukuran polihedra tidak berkontribusi dalam hal patogenisitas dan kecepatan isolat HearNPV dalam membunuh larva H. armigera. Secara patologis, pembentukan badan oklusi menghasilkan keturunan virus untuk menginfeksi individu serangga lain. Penelitian yang dilakukan Guo et al. (2006) pada dua isolat HearNPV asal Cina menunjukkan patogenisitas yang berbeda, namun secara mikroskopis, penampang kedua isolat tersebut tidak jauh berbeda, baik dari ukuran maupun jumlah polihedra. Patogenisitas dan kecepatan membunuh isolat HearNPV terhadap larva H. armigera tidak berkorelasi dengan bentuk dan ukuran polihedra melainkan berpengaruh terhadap produksi occlusion derived virus (ODV).
Ekspresi gen pada Baculovirus diklasifikasi ke dalam empat fase, yaitu ekspresi awal-cepat, awal-tunda, lambat, dan sangat lambat. Beberapa penelitian menghubungkan ekspresi gen ini untuk mengidentifikasi karakterisasi molekuler NPV di dunia. Pendekatan metode polymerase chain reaction (PCR) sangat sensitif untuk mengklasifikasikan Baculovirus. Gen late expression factor-8 ( lef-8) dapat mengamplifikasi DNA NPV Lepidoptera (Acharya & Gopinathan 2002). Gen lef-8 merupakan gen ekspresi pada NPV yang cukup stabil mengkode subunit DNA dan menempel langsung pada RNA polimerase virus secara spesifik (Herniou et al. 2003). Pada penelitian ini, gen lef-8 mengamplifikasi isolat HearNPV Sulawesi Selatan, Jawa Tengah, dan Jawa Timur pada satu strain yang sama dengan tingkat homologi 100%. Li et al. (2009) mengemukakan bahwa suatu spesies dikatakan identik apabila persentase kemiripan >73%.