TEKSI CEPAT VIRUS AVIAN INFLUENZA
DENGAN ANIGEN® DAN PENENTUAN SUBTIPE H5 MENGGUNAKAN REVERSE TRANSCRIPTION-PCR(POLYMERASE CHAIN REACTION)
IRDHAM KUSUMAWARDHANA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Penentuan Subtipe H5 Menggunakan Reverse Transcription-PCR (Polymerase Chain Reaction). Dibimbing oleh DJAROT SASONGKO HAMI SENO, MUHARAM SAEPULLOH dan AGUS WIYONO.
Highly Pathogenic Avian Influenza (HPAI) atau yang biasa disebut flu burung merupakan penyakit yang disebabkan virus influenza tipe A yang menyerang burung. Virus ini memiliki inang alami pada burung liar. Flu burung tidak membuat burung liar sakit, tetapi mampu membuat unggas domestik/piaraan seperti ayam dan bebek sakit bahkan mati. Penyakit ini menular dari burung ke burung, tetapi dapat juga menular ke manusia. Sedangkan penularan dari manusia ke manusia sam pai saat ini belum ditemukan.
Deteksi AvianInfluenza (AI) dapat dilakukan dengan cara konvensional, seperti isolasi virus pada telur SPF (Specific Pathogen Free) kemudian dilanjutkan dengan tes serologi. Deteksi AI juga dapat dilakukan dengan mendeteksi virus AI secara molekuler. Penelitian ini menggunakan sebelas sampel dari swab kloaka dan feses dari berbagai macam burung. Sebagai kontrol positif digunakan virus HPAI subtipe H5 yang telah dikarakterisasi. Sampel dideteksi dini dengan kit komersial Anigen®, diikuti dengan RT-PCR untuk mengetahui subtipe dari virus
tersebut.
ABSTRACT
IRDHAM KUSUMAWARDHANA. Rapid Detection Avian Influenza Virus With Anigen® and Determination Subtype H5 With Reverse Transcription-PCR (Polymerase Chain Reaction). Under the Direction of DJAROT SASONGKO HAMI SENO, MUHARAM SAEPULLOH and AGUS WIYONO.
Highly Pathoghenic Avian Influenza (HPAI) known as bird flu is a disease caused by an Avian Influeza Virus (AIV) subtype H5 or H7. Water fowl are though to serve as the reservoir for influenza A viruses in nature. Although, the Avian influenza viruses infect water fowl, without clinical signs. In chicken, this disease can develop to clinical symptomps and even death. This disease not only sprread among birds, but also can be transmitted to human. While infection from human to human to date has not been found.
The diagnosis Avian Influenza (AI) is based on virus isolation in Specific Pathogen Free (SPF) of embryonated eggs followed by serological test. Alternatively the diagnosis can be done by detection of virus with molecular method. In this study a total 11 samples of cloacal swabs and feces from a variety of birds were collected and tested. While a positive well characterized HPAI H5 subtype viruses was used as a positive control. Commercial kits of Anigen® was used to detect
AIV from the samples then followed by RT -RT-PCR for sub typing of the virus.
The results show that all samples (100%) eleven, were positive influenza A by rapid test (Anigen®), eight (73%) were positive using RT-PCR Matrix primer, and six (55%) samples were positive using RT -PCR pimer H5. It is concluded that the Anigen® kit and RT-PCR has been
MENGGUNAKAN
REVERSE TRANSCRIPTION–
PCR
(
POLYMERASE CHAIN REACTION)
IRDHAM KUSUMAWARDHANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Fakultas Matematika Dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
1
Judul
: Deteksi Cepat Virus
Avian Influenza
dengan Anigen
®dan Penentuan
Subtipe H5 Menggunakan
Reverse Transcription -
PCR
(
Polymerase
Chain Reaction
)
Nama
: Irdham Kusumawardhana
NIM
: G44101039
Disetujui
Komisi Pembimbing
Dr. Djarot Sasongko Hami Seno, M.S
Ketua
Muharam Saepulloh, S.Si. M.Sc. drh. Agus Wiyono, Ph.D.
Anggota Anggota
Diketahui
Dekan
Fakultas Matematika Dan Ilmu Pengetahuan Alam
Dr. Ir. Yonny Koesmaryono, MS
NIP: 131 473 999
PRAKATA
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT, Dzat
penguasa semesta alam, bahwa atas rahmat, ridho dan pertolongan-Nya sehingga
penelitan ini dapat terselesaikan. Penelitian ini berjudul Deteksi Cepat Virus
Avian Influenza
dengan Anigen
®dan Penentuan Subtipe H5 Menggunakan
Reverse Transcription-
PCR
(
Polymerase Chain Reaction
). Penelitian ini
merupakan bagian dari proyek penelitian a.n drh. Agus Wiyono Ph.D, yang
didanai oleh Departemen Pertanian dan dilaksanakan di Laboratorium Virologi
Balai Penelitian Veteriner (Balitvet) dari bulan Oktober 2005-Januari 2006.
Dalam penyusunan karya ilmiah ini penulis mengucapkan terima kasih kepada
Bapak drh. Agus Wiyono, Ph.D selaku peneliti di Laboratorium Virologi
Balitvet, yang telah memberikan jalan awal kepada penulis untuk dapat
melaksanakan penelitian, juga bimbingan di tengah-tengah kesibukannya
yang luar biasa. Juga terima kasih penulis ucapkan kepada Bapak
Muharam Saepulloh S.Si, M.Sc atas waktu yang disediakan dan
kesabarannya untuk membimbing langsung penulis di laboratorium.
Terima kasih kepada Bapak Dr. Djarot Sasongko Hami Seno, MS selaku
pembimbing utama tugas akhir atas saran dan kemudahan yang diberikan.
Penulis juga mengucapkan terima kasih untuk teknisi di laboratorium
Virologi, Balitvet, pak Pudji, pak Ace dan Mas songko. Juga kepada
teman-temanku seperjuangan di Bogor tengah dan Biokimia IPB 38.
Terakhir penulis juga berterima kasih kepada keluarga, Papa, Mama, mba
Jelly dan adikku yang manis, Vinan, atas dukungan dan doanya yang tidak
pernah putus.
Penulis menyadari karya ilmiah ini masih banyak kekurangan, dan semoga
karya ilmiah ini bermanfaat bagi pihak yang membaca dan memerlukannya.
Bogor, Januari 2006
3
RIWAYAT HIDUP
Irdham Kusumawardhana dilahirkan di Surabaya pada 8 Oktober 1983
sebagai anak kedua dari tiga bersaudara, putra dari pasangan Drs.Achmad Nikmat
dan Dra. Henrika Maria Chrismina.
Tahun 2001 penulis lulus dari SMU Negeri 5 Surabaya dan pada tahun yang sama masuk IPB pada program studi Biokimia melalui jalur Penelusuran minat dan Kemampuan (USMI). Pada Juli-September 2004 penulis melaksanakan praktik lapangan di Lembaga Biologi Molekuler Eijkman, Jakarta. Pada tahun 2005 penulis melaksanakan penelitian di Laboratorium Virologi, Balai Penelitian Veteriner (Balitvet) Bogor.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Kimia Dasar I, Kimia Dasar II, Kimia Fisik, Mikrobiologi Dasar dan Fisika Dasar.
Penulis juga aktif sebagai pengurus dalam berbagai organisisasi internal dan
eksternal kampus, di antaranya pernah menjadi Ketua Komisi Internal Dewan
Perwakilan Mahasiswa (DPM) FMIPA IPB, Staf Badan Eksternal Badan
Kerohanian Islam Mahasiswa (BKIM) IPB, Staf Departemen Keilmuan Ikatan
Mahasiswa Kimia (IMASIKA) FMIPA IPB, DKM HA-Alumni IPB dan Ketua
Gerakan Mahasiswa Pembebasan (Gema) Wilayah Bogor Raya. Pada bulan
Februari 2005, penulis menjadi salah seorang finalis pada
Hewlett Packard
Indonesian Youth Leadership Award
(HPIYLA) 2005, yang merupakan suatu
kegiatan untuk menjaring calon pemimpin bangsa. Pada tahun terakhirnya
menempuh studi di IPB, penulis mendapatkan beasiswa dari Yayasan
Goodwill
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN... 1
TINJAUAN PUSTAKA
Flu Burung ... 1
Virus Influenza ... 3
Cara Mendeteksi Virus AI ... 6
BAHAN DAN METODE
Bahan dan Alat... 8
Metode ... 8
HASIL DAN PEMBAHASAN
Deteksi Cepat Sampel dengan Kit Anigen
®... 10
Spesifisitas Anigen
R... 11
Sensitivitas Anigen
R... 11
Perbandingan Sensitivitas Anigen
Rdengan HA ... 11
Isolasi RNA... 12
Deteksi
Avian Influenza
dengan RT-PCR... 12
SIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 14
5
DAFTAR TABEL
Halaman
1
Beberapa sub tipe influenza A ... 5
2
Hasil pengujian sampel swab kloaka dan feses asal unggas
dengan uji cepat (Anigen) dan RT-PCR ... 13
DAFTAR GAMBAR
Halaman
1 Oseltamivir dengan merk dagang Tami Flu ... 3
2 Struktur dan organisasi genom virus influenza ... 4
3 Siklus hidup virus influenza ... 4
4 Virus influenza tipe A ... 4
5 Tahapan reaksi RT-PCR... 8
6 Program RT-PCR untuk deteksi virus AI pada sampel... 10
7 Program RT-PCR untuk deteksi virus HPAI sub tipe H5 pada sampel ... 10
8 Hasil deteksi cepat virus AI dengan kit komersial Anigen
®... 11
9 Hasil uji sensitivitas Anigen terhadap berbagai konsentrasi virus ... 11
10 Hasil uji cepat HA dengan SDM ayam ... 11
11 Marka RT-PCR Matriks dan RT-PCR H5 ... 12
12 Hasil deteksi sampel
Avian Influenza
dengan RT-PCR Matriks ... 13
13 Hasil deteksi Sampel
Avian Influenza
sub tipe H5 dengan RT-PCR ... 13
DAFTAR LAMPIRAN
Halaman
1
Diagram alir penelitian ... 17
2
Daftar primer yang digunakan... 18
3
Komposisi reagen yang digunakan ... 19
PENDAHULUAN
Wabah Highly Pathogenic Avian Influenza
(HPAI) H5N1 atau yang biasa disebut flu
burung telah terjadi di beberapa negara di Asia. Menurut Utama (2005) selama 2004, wabah yang sangat patogen (H PAI) itu merebak di setidaknya sembilan negara Asia yaitu China, Indonesia, Jepang, Kamboja, Korea Selatan, Laos, Malaysia, Thailand dan Vietnam (Hien et al 2004). Wabah tersebut tidak hanya mengakibatkan kematian 100 juta lebih ternak unggas di kawasan itu, tetapi juga membawa korban manusia. Wabah virus H5N1
tersebut merupakan yang terbesar sejak munculnya wabah H5N1 pertama di Hongkong
pada bulan Mei 1997. Bahkan sekarang virus itu telah merambat ke benua Eropa yakni di Kroasia, Rumania, dan Turki.
Semakin luasnya wilayah penyebaran virus ini menyebabkan kekhawatiran para ahli akan terjadinya pandemi HPAI subtipe H5N1
di dunia. Sejarah mencatat, wabah penyakit influenza ini beberapa kali muncul dengan varian virus yang berbeda, yaitu berturut-turut pada tahun 1890, 1900, 1918 -1919 (H1N1), 1957 (H2N2), 1968 (H3N2), 1977 (H1N1) (Capua & Alexander 2002). Wabah tersebut bersifat epidemik dan bahkan pandemi. Pandemi influenza pada tahun 1918-1919 yang dikenal sebagai “influenza Spanyol” dianggap sebagai wabah terbesar dengan korban jiwa 20-30 juta orang di seluruh dunia (Oxford JS 2000; Taubenberger et al 2005; Claas et al 1998). Pandemi pada tahun 1957 dikenal sebagai pandemi Asia, pada tahun 1968 pandemi Hongkong, sedangkan pada tahun 1997 pandemi Hongkong dan Rusia.
Wabah HPAI subtipe H5N1 di Indonesia
pertama kali muncul pada 25 Januari 2004, saat itu Departemen Pertanian (Deptan) mengumumkan secara resmi ditemukannya virus HPAI subtipe H5N1 di Indonesia. Juga berdasarkan data Deptan, sejak muncul pertama kali hingga akhir Desember 2004, virus Avian Influenza (AI) telah tersebar di 158 kabupaten/kota di 23 provinsi Indonesia.
Berdasarkan hal tersebut, maka pada penelitian ini akan dilakukan deteksi virus AI pada sampel cotton swab (kapas bertangkai) dari kloaka atau feses berbagai hewan dengan kit antigen rapid Avian Influenza (Anigen®)
kemudian dikonfirmasi dengan RT-PCR. Penelitian ini bertujuan untuk mendet eksi
virus AI tipe A dan subtipe H5 dari berbagai unggas di lokasi pengambilan sampel. Deteksi dilakukan dengan cara diagnosis molekuler
dan akan dibandingkan keefektifannya dengan cara konvensional.
Hipotesis dari penelitian ini yaitu penyebaran penyakit AI dapat ditanggulangi secara dini apabila dilakukan pendeteksian virus secara cepat dan akurat terhadap unggas-unggas yang rentan terhadap penyakit AI. Untuk itu diperlukan suatu teknik diagnostik yang dapat digunakan secara cepat, akurat dan mempunyai tingkat spesifitas serta sensitivitas yang baik, sehingga keberadaan penyakit dapat diketahui secara dini. Untuk itu, deteksi virus AI tipe A dengan menggunakan rapid diagnostic kit yang dapat mendiagnosa penyakit di lapangan dan dilanjutkan dengan deteksi terhadap subtipe H5 menggunakan teknik biologi molekuler (RT-PCR) merupakan salah satu upaya dan langkah yang tepat dalam penanggulangan penyakit AI. Hasil penelitian ini diharapkan dapat memberikan informasi awal bahwa untuk mendeteksi kasus flu burung di Indonesia, dapat ditangani dengan cepat dan akurat apabila dilakukan dengan diagnosis cepat di lapangan yang diperkuat dengan deteksi virus yang memanfaatkan teknik biologi molekuler seperti RT-PCR
.
TINJAUAN PUSTAKA Flu Burung
Avian Influenza (Flu Burung) adalah penyakit yang disebabkan virus influenza tipe A yang menyerang unggas. Virus ini memiliki inang alami pada burung liar. Infeksi HPAI tidak membuat burung liar sakit, tetapi mampu membuat unggas domestik/piaraan seperti ayam dan bebek sakit bahkan mati (Swayne et al 1998). Penyakit ini tidak hanya menular dari unggas ke unggas, tetapi dapat juga menular ke manusia. Sedangkan penularan dari manusia ke manusia, pada subtipe H5N1 sampai saat ini belum
ditemukan. Walaupun menurut Ungchusak et al 2005 ada dugaan bahwa virus ini dapat menular antar manusia, setelah dilakukan penelitian terhadap satu sampel satu keluarga yang terserang HPAI subtipe H5N1 di
Thailand.
Cara Penularan Flu Burung
Pada bebek liar virus influenza bereplikasi pada saluran pencernaan, dengan tidak menyebabkan penyakit dan melepaskannya dalam feses dengan konsentrasi tinggi sampai 108.7 EID5 0 (50% dosis telur yang terinfeksi)
(Webster 1998). Burung yang terinfeksi melepas virus tersebut melalui air liur, sekresi hidung dan kotoran. Kemudian virus-virus ini menyebar diantara burung-burung bila mereka kontak dengan material hidung, pernafasan, dan kotoran yang terkontaminasi dari burung-burung yang terinfeksi. Penyebaran melalui kotoran ke mulut adalah model yang paling umum terjadi. Menurut Foni (2003) dan Horimoto (2001), penyebaran virus ini ke manusia dihipotesiskan terjadi melalui inang perantara yaitu babi, karena hewan ini diduga ini mampu bertindak sebagai mixing vessels
(inang perantara) baik untuk virus flu asal manusia maupun virus flu asal unggas.
Gejala Klinis HPAI
Unggas (seperti ayam) yang terinfeksi virus AI diantaranya menunjukkan gejala pembengkakan di bagian kepala, bintik merah di kaki serta bintik dan pendarahan pada lapisan lemak. Juga ditandai dengan menurunnya nafsu makan ayam dan produksi telor. Akan tetapi menurut panduan Departemen Kesehatan, mengkonsumsi ayam dan telur ayam tidak berisiko terhadap penularan penyakit HPAI subtipe H5N1. Virus
HPAI subtipe H5N1 akan mati jika daging
ayam dimasak dengan panas 80 derajat Celsius dan telur ayam pada pemanasan 60 derajat Celsius. Penyakit berbahaya ini juga tidak ditularkan melalui makanan (Hasibuan 2005).
Sedangkan gejala (symptom) manusia yang terkena infeksi HPAI sama seperti gejala flu biasa, yaitu demam di atas 380C, sakit tenggorokan, batuk mengeluarkan ingus, nyeri otot, dan sakit kepala. Pada beberapa kasus dalam waktu singkat dapat menjadi berat dengan timbulnya demam tinggi, infeksi paru-paru (pneumonia), gagal pernafasan, diikuti kegagalan fungsi organ lainnya dan akhirnya dapat berakibat kematian. Masa inkubasi virus AI asal manusia dapat terjadi satu hari sebelum atau tiga sampai lima hari setelah munculnya gejala. Pada anak -anak, masa inkubasi dapat mencapai 21 hari (KU & Chan 1999).
Pencegahan HPAI
Menurut Horimoto et al (2004) sampai saat ini cara yang paling efektif untuk
mencegah penularan HPAI subtipe H5N1 adalah dengan vaksinasi. Setidaknya ada empat keunggulan apabila vaksinasi telah dilaksanakan secara baik yakni (i) unggas yang telah divaksinasi dengan vaksin H5N1
sangat kecil kemungkinannya untuk terinfeksi virus HPAI subtipe H5N1, (ii) unggas yang
telah divaksin secara baik mengeluarkan virus dalam jumlah seratus kali lebih sedikit dibandingkan dengan unggas yang tidak divaksin, (iii) akan mengurangi resiko penularan lebih lanjut, karena tingkat resistensi terhadap infeksi meningkat (iv) dapat mengurangi terjadinya mutasi alamiah (reassorment) melalui pengurangan jumlah virus yang bersikulasi ( Hasibuan 2005).
Vaksin influenza dibuat dari galur influ enza yang sesuai dengan kebutuhan di lapang, sehingga tidak akan menimbulkan penyakit. Lalu, vaksin-vaksin ini ditumbuhkan dalam telur bebek, yang bebas patogen spesifik (Specific Pathogen Free), dalam jumlah besar untuk membuat vaksin pada manusia. Saat ini Badan Kesehatan Dunia (WHO) sedang menyiapkan vaksin baru dari galur Vietnam dengan teknik pembalikan genetik (reverse genetic). Teknik ini merekayasa gen virus ganas galur Vietnam menjadi virus yang lebih jinak, dengan cara menggantikan motif multiple basic amino acid
pada cleavage site menjadi single basic amino acid. Walaupun saat ini vaksinasi merupakan cara yang paling efektif untuk mencegah infeksi HPAI, masih terdapat beberapa halangan untuk memproduksi vaksin secara massal, yaitu kesulitan penyediaan telur bebek dalam jumlah banyak dalam waktu singkat untuk menumbuhkan vaksin. Badan Pengawas Obat juga akan menolak keras penggunaan vaksin flu manusia yang dibuat melalui teknik
reverse genetics apabila belum dilakukan uji klinis terhadap vaksin-vaksin tersebut.
Apabila sudah terjangkit infeksi HPAI, terutama pada kasus akut, maka dapat digunakan obat-obatan anti viral seperti Amantidine, Rimantidine, Olsetavimir dan Zanavir. Namun sejak tahun 2004, virus H5N1
3
dengan merek dagang Tami Flu (Gambar 5). Obat ini masuk dalam kelompok obat yang disebut penghambat neuraminidase (neuraminidase Blocker). Akibatnya obat ini mampu menekan virus AI supaya tidak menyebar dan menginfeksi sel lain. Tami Flu mampu mengurangi 38 persen tingkat keparahan gejala, 67 persen pengurangan komplikasi sekunder seperti bronkhitis, pneumonia dan sinusitis, 37 persen meredakan rasa sakit dan 89 persen melawan serangan influenza (Hidayat 2005).
Gambar 1 Oseltamivir dengan merk dagang Tami Flu
Pemusnahan Massal. Selain dengan vaksinasi untuk mencegah penyebaran virus HPAI dapat dilakukan pemusnahan unggas secara menyeluruh (stamping out) di seluruh wilayah yang terkena hingga radius tertentu dari sumber infeksi. Prasyarat yang penting untuk melakukan tindakan stamping out yang efektif adalah apabila kejadian penyakit mampu terdeteksi secara dini, sistem pelaporan penyakit berjalan secara efektif dan tersedianya dana kompensasi yang memadai yang tepat waktu (Hasibuan 2005). Sementara dari rekomendasi pertemuan Organisasi Pangan dan Pertanian (FAO)/Office International des Epizooties (OIE)/WHO tanggal 24 Februari 2004 di Roma dinyatakan bahwa stamping out hanya akan sangat efektif apabila penyebaran penyakit masih terbatas dan tingkat terinfeksi kembali rendah.
Kebersihan Lingkungan. Upaya pencegahan lain yang dapat dilakukan masyarakat antara lain dengan senantiasa menjaga kebersihan lingkungan, menerapkan
bio security pada hewan peliharaan seperti kotoran hewan peliharaan yang harus dibersihkan dan dikubur secara reguler, serta melakukan desinfeksi dengan desinfektan.
Virus Influenza
Virus influenza menyerang manusia dan banyak jenis hewan (Horimoto 2001). Mamalia lain yang dapat terserang infeksi
influenza adalah ikan paus, babi, kuda, cerpelai, dan anjing laut (Whittaker 2001).
Virus influenza termasuk virus famili Orthomyxoviridae. Virus ini mempunyai asam nukleat RNA dan berstruktur membran kompleks yang mengelilingi nukleokapsid. Virus ini merupakan virus beramplop. Genom virus ini terdiri atas satu utas RNA negatif (ss RNA) (Brock et al 1994; Whittaker 2001).
Menurut Swayne et al (1998) dan Foni et al (2003), virus influenza dibagi dalam tiga kategori yaitu tipe A, B dan C berdasarkan dua komponen utama internal yaitu protein matriks (M) dan ribonukleoprotein (RNP). Virus Influeza tipe A dapat menginfeksi manusia, burung, babi, kuda, anjing laut, paus dan hewan lainnya, namun inang alami bagi virus ini adalah burung liar. Virus tipe ini dibagi dalam subtipe-subtipe berdasarkan protein pada permukaan virus tersebut. Semua Influenza tipe A hanya menyerang unggas.
Sedangkan virus influenza tipe B pada umumnya ditemukan pada manusia, tidak seperti pada virus influenza tipe A, virus tipe ini tidak diklasifikasikan berdasarkan subtipe. Walaupun virus tipe ini dapat menyebabkan epidemi namun tidak sampai pandemi. Virus Influenza tipe C dapat menyebabkan demam ringan pada manusia, tetapi tidak dapat menyebabkan epidemi maupun pandemi. Sama seperti halnya virus tipe B, virus tipe C juga tidak diklasifikasikan berdasarkan subtipe (Swayne et al 1998).
Struktur & Organisasi Genom Virus Influenza
Menurut Whittaker (2001) virus influenza mampunyai amplop dan bersifat pleiomorfik. Virus yang diisolasi dari kultur sel berbentuk sperik dengan diameter yang konstan ~ 100 nm. Tetapi virus ini juga bisa berbentuk filamen dengan diameter yang konstan tetapi dengan panjang yang berbeda-beda. Virus influenza A memproduksi sepuluh protein dari delapan segmen RNA negatif. Kedelapan segmen RNA negatif ini adalah Polimerase A (PA), PB1, PB2, Nukleoprotein (NP), Hemaglutinin (HA), Neuraminidase (NA), Non struktural (NS), dan Matriks (M) (Gambar 2).
influenza mempunyai komponen internal yang sama, dan hanya berbeda pada bagian permukaan amplop saja (Whittaker 2001). Seperti terlihat pada gambar 2, virus influenza B mempunyai alternatif kanal ion yaitu NB, yang diproduksi dari aktivitas over lapping kerangka baca sebagai pengawal alternatif dari gen yang mengkode NA. Sedangkan virus influenza tipe C hanya mempunyai satu glikoprotein yang disebut The Hemagglutinin-esterase-fusion (HEF) dan berfungsi untuk menggantikan HA dan NA. Virus influenza C juga mempunyai kanal ion yang berbeda yaitu CM2 dan genomnya hanya mempunyai tujuh segmen RNA (Whittaker 2001).
Gambar 2 Struktur dan organisasi genom virus influenza (Whittaker 2001)
Replikasi Virus Influenza
Siklus replikasi virus influenza terbagi dalam banyak tahap (Gambar 3). Tahap pertama yaitu pengikatan virus pada reseptor di permukaan sel, disusul kemudian internalisasi ke dalam endosom (cytoplasmic vesicles). Kondisi ini terjad`i dalam keadaan pH lingkungan sel yang rendah, dan memicu peleburan virus dan pelepasan selubung virus (uncoating). Pada tahapan kedua setelah virus berendositosis dan memasuki membran plasma, virus akan masuk ke dalam nukleus dan memulai proses replikasinya. Virus yang telah memperbanyak diri selanjutnya akan keluar dari nukleus melalui pori-pori inti, dan pada tahap terakhir tejadi proses pelepasan (budding) virus dari membran plasma untuk kemudian menginfeksi sel yang lain (Horimoto 2001, Whiitaker 2001).
Gambar 3 Siklus hidup virus influenza (Horimoto 2001)
Komponen Virus Influenza Tipe A
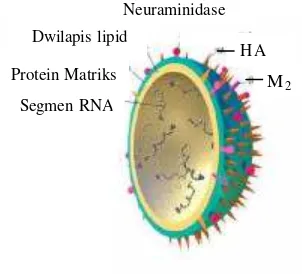
Berdasarkan kandungan protein -protein permukaan membran selnya yang dinamakan hemaglutinin (HA) dan neuraminidase (NA), virus influenza tipe A (AIV) dibagi menjadi subtipe-subtipe. Saat ini telah diketahui 15 subtipe hemaglutinin (H1-H15) dan sembilan Neuraminidase (N1-N9), sedangkan kombinasi keduanya biasa ditulis HxNy.
(Capua & Alexander 2002; Swayne et al 1998 Claas ECJ et al 1998; Claas et al 1997). Selubung virus (envelope) dari virus influenza tipe A ini disusun oleh tiga protein yaitu Hemaglutinin (HA), Neuraminidase (NA) dan M2 (Gambar 4).
```
Gambar 4 Virus influenza tipe A (Whittaker 2001, Horimoto 2001)
Influenza A
Influenza C
Influenza B
Neuraminidase
Dwilapis lipid
Protein Matriks
Segmen RNA
HA
5
Protein Hemaglutinin (HA) adalah molekul glikoprotein selubung virus yang berfungsi untuk mengikatkan virus ke reseptor sel target dan menginisiasi infeksi. Dengan kata lain, protein HA merupakan mediator interaksi antara virus dan sel inang. Protein ini berukuran besar dan merupakan faktor yang penting bagi virulensi virus. Protein ini juga berperan dalam proses masuknya virus ke dalam sel (cell entry) (Horimoto 2001).
Protein HA virus HPAI pada bagian situs pembelahan (cleavage site) diantara HA1 dan HA2, ditandai dengan adanya motif asam amino yang berulang (Nguyen et al 2005; Zhou et al 1999; Whittaker 2001; Katz et al
2000; Guan et al 2002; Senne et al 1996).
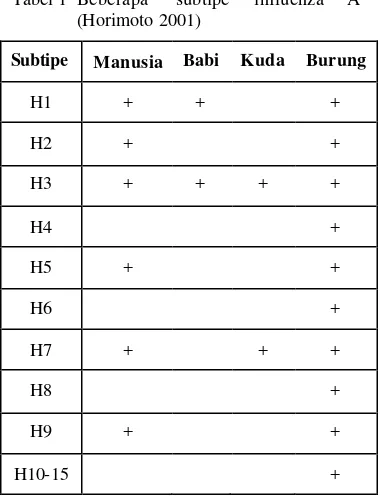
Keberadaan asam amino yang berulang ini diduga untuk mengaktifkan kerja HA dengan pelepasan enzim protease dari jaringan tubuh (KU 1999). Saat ini ada 6 subtipe HA dari 15 yang ditemukan pada manusia yaitu H1, H2, H3, H5, H7 dan H9, sedangkan subtipe HA yang lainnya menyerang unggas, babi dan hewan lainnya (Tabel 1).
Protein kedua yang menyusun selubung virus influenza A adalah Neuraminidase (NA). Protein ini berukuran lebih kecil dari pada HA dan membentuk knob pada permukaan sel dan berfungsi pada proses keluarnya virus yang telah berkembang biak di dalam sel untuk keluar sel untuk selanjutnya menyebar ke sel lainnya. Virus baru dapat keluar dari sel karena NA merupakan enzim (katalisator reaksi) glikosidase yang bekerja dengan menghidrolisis ikatan α-2,3-, α-2,6, dan α-2,8 glukosidik yang menghubungkan ujung non reduksi residu-residu N- atau O-asilneuraminil terasilasi pada oligosakarida, glikoprotein atau glikolipid dari sel inang dan selubung virus sel influenza (Horimoto 2001).
Sementara itu protein M2 adalah protein yang membentuk saluran ion (ion channel) pada membran sel inang yang diperlukan untuk proses keluarnya gen (viral RNA) dari selubung virus (uncoating) yang berlanjut pada proses replikasi gen virus. Karena fungsi dan peranannya yang penting serta tingkat konservatifnya yang tinggi, ketiga protein tersebut sering dijadikan patokan untuk melihat karakter virus, seperti tingkat evolusi virus itu sendiri (Horimoto 2001, Utama 2005).
Virulensi Virus Influenza A
Berdasarkan kemampuannya untuk menginfeksi inang sehingga menyebabkan
Tabel 1 Beberapa subtipe influenza A (Horimoto 2001)
Subtipe Manusia Babi Kuda Burung
H1 + + +
H2 + +
H3 + + + +
H4 +
H5 + +
H6 +
H7 + + +
H8 +
H9 + +
H10-15 +
timbulnya penyakit, virus influenza A dapat diklasifikasikan menjadi dua yaitu virus influenza yang sangat patogen atau Highly Pathogenic Avian Influenza (HPAI) yang dapat menyebabkan kematian inang yang diinfeksi hingga 100% dan virus influenza yang kurang patogen/Low Pathogenic Avian Influenza (LPAI) yang hanya menyebabkan demam ringan dengan tingkat kematian yang rendah. Virus tipe LPAI khususnya H5 dan H7 mempunyai kemampuan untuk bermutasi menjadi HPAI (Nguyen et al 2005).
Evolusi Virus Avian Influenza
Penelitian terhadap ekologi virus influenza menghasilkan hipotesis bahwa setiap virus influenza pada manusia merupakan turunan (derivat) dari virus flu pada unggas (Webster 1998). Virus influenza termasuk virus HPAI mempunyai kemampuan untuk selalu bermutasi dan berevolusi. Kemampuan evolusi virus AI tampak dengan kemampuan virus ini untuk melakukan antigenic drift
(penyimpangan antigenik) dan antigenic shift
(perubahan antigenik).
inilah manusia dapat terserang flu lebih dari satu kali.
Perubahan lain yang terjadi pada virus influenza adalah antigenic shift. Perubahan ini terjadi secara tiba-tiba dan merupakan perubahan utama yang terjadi pada virus influenza type A. Sejak 1918, penelitian tentang virus influenza pada manusia dipusatkan untuk mengetahui bagaimana mekanisme terjadinya perubahan antigenik, dan juga untuk memprediksikan bagaimana dan kapan penyimpangan ini terjadi (Capua & Alexander 2002).
Antigenic shift terjadi apabila dua tipe virus menginfeksi sel inang yang sama, segmen-segm en RNA dan protein-protein HA/NA dari kedua tipe virus itu dapat bercampur aduk saat partikel -partikel virus dirangkaikan. Akibatnya muncul subtipe virus baru yang pada awalnya hanya dapat menginfeksi unggas itu telah berevolusi menjadi virus yang mampu menginfeksi manusia. Padahal secara ilmiah ada perbedaan yang jelas antara reseptor virus AI asal unggas dan virus AI asal manusia. Virus AI asal unggas hanya berikatan secara spesifik dengan reseptor α-2,3 N-Acetyl Neuraminic Acid
(Asam Sialat) yang terekspresi di permukaan sel burung (Nguyen et al 2005). Sedangkan virus AI asal manusia hanya berikatan secara spesifik dengan reseptor α-2,6-asam sialat pada permukaan sel manusia (Webster 1998;
Matrosovich et al 1999). Perbedaan
pengikatan dalam reseptor ini tergantung jenis asam amino spesifik pada posisi 226 dari HA. Apabila asam amino itu berupa leusin, virus tersebut akan berikatan pada reseptor α-2,3 sedangkan apabila glutamin berikatan pada reseptor α-2,6 (Webster 1998).
Apabila virus AI yang tadinya hanya dapat menginfeksi unggas kemudian dapat menginfeksi manusia, artinya telah terjadi evolusi pada virus tersebut. Virus yang semula hanya dapat berinteraksi dengan α-2,3 asam sialat telah berevolusi menjadi virus yang dapat berinteraksi baik dengan α-2,3 asam sialat maupun α-2,6-asam sialat (Horimoto 2001; Utama 2005). Evolusi ini terus terjadi, sehingga suatu saat tidak tertutup kemungkinan akan muncul virus yang mampu menular antar manusia, tidak hanya dalam kluster keluarga tetapi juga pada masyarakat luas. Kalau hal ini sampai terjadi artinya pandemi HPAI subtipe H5N1 hanya tinggal
menunggu waktu (Horimoto 2001).
Menurut Utama (2005) bukti terjadinya evolusi virus HPAI subtipe H5N1 semakin
diperkuat dengan hasil analisis ketiga gen
virus influenza yang mempunyai peranan penting serta tingkat konservatifnya yang tinggi, yaitu HA, NA dan M2. Dari hasil analisis ketiga gen tersebut, ditemukan bahwa virus H5N1 yang mewabah pada 2004 sampai
2005 terdiri atas dua kelompok (clade). Kelompok pertama yaitu virus yang berasal dari Kamboja, Laos, Malaysia, Thailand dan Vietnam. Sedangkan kelompok kedua terdiri atas virus dari China, Indonesia, Jepang dan Korea Selatan. Data tersebut membuktikan bahwa semua virus H5N1 masih virus HPAI
subtipe H5N1 asli dan belum terjadi mutasi
alamiah (reassortment) dengan virus flu manusia.
Cara Mendeteksi Virus AI
Virus Influenza dapat dideteksi dengan beragam cara yang secara garis besar dapat dibedakan dalam dua kelompok besar, yaitu cara konvensional dan cara molekuler. Pendeteksian secara konvensional dilakukan dengan beberapa cara seperti (i) isolasi virus baik dengan kultur jaringan pada sel ginjal primer monyet atau pada sel ginjal anjing
madindarbycanine kidney (MDCK), maupun dengan telur SPF, dan (ii) tes serologi (Lee MS et al 2001). Akan tetapi cara ini tidak praktis dan membutuhkan waktu cukup lama untuk mengetahui hasilnya yaitu sekitar dua hari sampai dua minggu. Disamping itu cara ini kurang efektif untuk segera melakukan terapi dan tindakan untuk mengatasi infeksi (Ng KOE et al 2005; Hindiyeh et al 2005). Prosedur rutin untuk mendeteksi virus influenza tipe A pada manusia seperti isolasi virus in vitro, immunofluoresen (IF) memang cukup efektif tetapi menjadi kurang efektif saat mendeteksi virus influenza dari unggas dan babi (Fouchier RAM et al 2000). Menurut Ng KOE (2005) tes antigen cepat komersial yang tersedia sekarang seperti Directigen Flu A+B (Becton Dickinson, Sparks, NJ, USA) atau Binax NOW (Binax Inc., Portland, ME, USA) memang cukup sensitif dan sederhana tetapi tes ini tidak mampu untuk mendeteksi berbagai macam subtipe virus. Oleh karena itu, pada saat ini dibutuhkan tes diagnostik virus flu yang sangat sensitif, akurat, cepat dan mampu mendeteksi berbagai macam tipe virus.
7
kemampuannya untuk mendeteksi virus
influenza A dari spesies yang berbeda. Dengan metode ini dapat dideteksi banyak virus influenza A dari sampel unggas yang tidak bisa dideteksi dengan kultur sel mamalia ataupun pada telur embrionasi tertunas (TET). (Lee MS et al 2001; Fouchier RAM et al
2000; Chan 2002; Ng KOE et al 2005).
Reaksi Berantai Polimerase (PCR)
Teknik PCR pertama kali ditemukan oleh Kary B. Mullis pada pertengahan tahun 1980. Teknik ini mampu mengatasi masalah penelitian suatu genom, yaitu keterbat asan jumlah sampel yang akan dianalisis. Erlich (1989) diacu dalam Pebriana (2003) juga menjelaskan bahwa PCR adalah suatu metode
in vitro untuk mensintesis sekuen DNA spesifik secara enzimatis dengan menggunakan dua oligonukleotida sebagai
primer yang berhibridisasi secara berlawanan pada sisi daerah target utas DNA yang diinginkan. Metode ini sangat cocok untuk memperbanyak DNA untuk prosedur pemeriksaan klinis atau forensik karena hanya diperlukan sampel DNA yang sangat sedikit sebagai bahan awal. Bahkan DNA dapat diperbanyak oleh reaksi berantai polimerase dari sehelai rambut atau setetes darah atau semen (Marks 1996).
Bahan awal untuk PCR adalah DNA yang mengandung sekuens yang akan diamplifikasi. Jumlah DNA yang diperlukan untuk proses PCR sangat kecil, biasanya lebih kecil dari 1 mikrogram. Selain itu diperlukan juga dua oligonukleotida primer untuk inisiasi target DNA, enzim DNA polimerase tahan panas, dan campuran keempat deoksinukleotida trifosfat (dNTPs) sebagai prekursor (Watson
et al 1992 diacu dalam Pebriana 2003). Konsentrasi Mg2+ pada buffer PCR yang cukup juga diperlukan untuk meningkatkan hasil dan spesifitas amplifikasi.
Proses amplifikasi melibatkan tiga tahap, yaitu (1) denaturasi DNA oleh panas, sehungga struktur DNA utas ganda mengudar menjadi utas tunggal (2) penempelan primer pada sekuens DNA komplementer (annealing)
yangakan diperbanyak dan (3) pemanjangan primer oleh DNA polimerase (ekstensi) (Saiki
et al 1998 diacu dalam Pebriana 2003).
Reverse Transcription–PCR (Polymerase Chain Reaction)
Reverse Trancription-PCR (Polymerase Chain Reaction) adalah metode invitro untuk amplifikasi sekuen RNA sehingga menghasilkan DNA secara enzimatis. RT
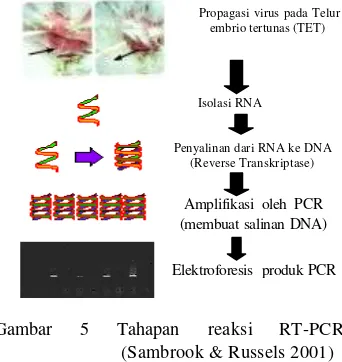
-PCR merupakan kombinasi dari sintesis cDNA dengan PCR sehingga mampu mensintesis DNA dari RNA. Berbeda dengan PCR, template untuk RT -PCR adalah RNA total atau RNA yang mengandung poli (A)+. Sedangkan primer yang digunakan dapat berupa primer acak, oligo (dT) atau primer spesifik. Tahap pertama dari RT-PCR adalah transkripsi balik sampel RNA menjadi cDNA (tahap sintesis cDNA) dengan bantuan enzim
reverse transcriptase. Pada tahap ini terjadi pra denaturasi yang dilakukan pada 42 ºC selama 45 menit, dan enzim ini kemudian dinonaktifkan dengan denaturasi cDNA pada 95 ºC selama 3 menit. Kemudian dilanjutkn dengan amplifikasi eksponensial cDNAdalam reaksi PCR (gambar 5). Kedua reaksi tersebut dapat dilakukan secara terpisah (dua enzim/dua tabung) atau dalam satu kali reaksi (dua enzim/satu tabung) (Bustin 2000 diacu dalam Kurniawan 2004).
Kegunaan lain dari RT -PCR adalah mampu mendeteksi virus dengan genom RNA, menganalisis ekspresi gen, dan menyeleksi gen tanpa perlu mengkonstruksi pustaka cDNA juga dapat diperoleh dengan RT-PCR. Salah satu tahap yang penting dalam RT-PCR adalah isolasi RNA. RNA dapat diisolasi dengan berbagai metode, diantaranya metode trizol LS yang digunakan dalam penelitian ini.
Metode trizol LS cocok digunakan mengisolasi RNA dari sampel cairan manusia, tanaman, ragi, bakteri maupun virus. Terdapat empat tahap dalam metode ini yaitu (i) homogenisasi, (ii) pemisahan fase, (iii) presipitasi RNA dan (iv) pencucian pelet RNA yang terbentuk. Tahap pertama, sampel swab dari kolaka atau feses dihomogenisasi dengan reagen Trizol LS. Reagen ini merupakan campuran larutan fenol dan guanidin isotiosianat. Fenol berfungsi untuk memisahkan dan memurnikan RNA dari protein. Pelarut organik ini dapat
mengendapkan protein tetapi tetap
membiarkan asam nukleat (DNA dan RNA) berada dalam larutan (Brown 1995). Akan tetapi sekalipun fenol dapat mendenaturasikan protein dengan baik, namun fenol tidak dapat menghambat aktivitas RNAse. Sehingga digunakan guanidin isotiosianat untuk menghambat aktivitas RNAse (Sambrook & Russel 2001).
terdapat pada fase organik dan akan tertinggal sebagai endapan putih pada pertemuan kedua fase tersebut (Brown 1995). Sementara asam nukleat terdapat pada fase air. Kloroform merupakan pelarut semi polar yang digunakan untuk memastikan agar residu protein benar -benar tidak ada pada fase air (Sambrook & Russel 2001). Tahap ketiga yaitu presipitasi RNA, dengan penambahan iso propanol (2-metil propanol). RNA pada fase air akan mengendap setelah ditambahkan isopropanol, karena kandungan air pada RNA ditarik oleh isopropanol. Tahap keempat, merupakan tahap pemurnian (purifikasi) yaitu dengan penambahan etanol 75%, yang dimaksudkan untuk mencuci endapan RNA yang terbentuk, dengan menghilangkan sisa-sisa pengotor organik yang ada. Alkohol dengan konsentrasi tinggi juga dapat menarik air yang berinteraksi dengan RNA sehingga RNA beragregasi dengan molekul RNA sejenis lainnya dan akhirnya mengendap.
Gambar 5 Tahapan reaksi RT-PCR
(Sambrook & Russels 2001)
BAHAN DAN METODE Bahan dan Alat
Bahan yang diperlukan untuk deteksi cepat virus AI adalah kit Rapid Avian Influenza virus (Anigen®, Korea) yang diperoleh secara komersial dari PT. Indofarma. Kit ini terdiri atas tabung penampung sampel mengandung 1 ml assay diluent, swab untuk mengambil sampel dari lubang kloaka rektum dan
disposable droppers untuk meneteskan cairan sampel ke tabung diluent.
Bahan-bahan yang diperlukan untuk isolasi RNA adalah cotton swab (kapas bertangkai) yang mengandung cairan kloaka rektum atau feses dari berbagai jenis unggas yang diambil dari daerah sekitar kota Jakarta,
Bekasi dan Tangerang. Penelitian ini juga menggunakan media transpor (Sigma Aldr ich), Trizol LS (Gibco), kloroform, isopropanol, etanol 75%, DEPC (Diethylpyrocarbonate) 0,1 % dan dH2O ultra pure (Gibco). Untuk RT-PCR digunakan RNA template dan kit dari Invitrogen yang terdiri atas 2X campuran reaksi, enzim
Reverse Transkriptase Platinum Taq Mix, primer forward dan reverse (Lampiran 2).
Bahan yang digunakan untuk elektroforesis gel agarosa adalah agarosa (Sigma Aldrich), marka DNA 100 bp ladder
(Promega, Fermentas), loading buffer sebagai
tracking dye, larutan bufer Tris Borate EDTA, (TBE ) dan etidium bromida (Lampiran 3).
Peralatan yang digunakan untuk RT -PCR adalah tabung PCR 50 µl, Thermalcycler PCR (Hybaid). Untuk elektroforesis gel agarosa digunakan perangkat elektroforesis (Biorad),
oven microvawe (Nasional), dan kamera UV (UV transiluminator). Peralatan lain yang digunakan tabung eppendorf 1,5 ml, vorteks (Thermolyne), tip ART (RNA se and DNA se-free, Molecular BioProducts), sentrifuse (mini spin), laminar air flow cabinet (Biohazard),
freezer (Sansio), Shaker (Thermolyne), inkubator (Thermolyne), penangas air (Forma Scientific), pipet mikro (Pipetman, Gilson), autoklaf (Electric pressure steam sterilizer
model no 25X) dan peralatan gelas lainnya.
Metode
Deteksi Cepat Sampel dengan Kit Anigen®
Metode deteksi cepat AI menggunakan kit dari Anigen® (Korea), dilakukan dengan cara pengambilan feses ataupun melalui kloaka menggunakan kapas bertangkai sebagai berikut: bagian dalam kedua sayap unggas dipegang dengan tangan kiri dan ujung atas kapas bertangkai dipegang dengan tangan kanan. Kapas bertangkai dimasukkan ke dalam lubang kloaka rektum unggas. Kemudian swab spesimen diputar di dalam kloaka beberapa kali, selanjutnya swab spesimen ditarik keluar. Untuk prosedur tes, dilakukan sebagai berikut; swab spesimen yang telah mengandung feses dimasukkan ke dalam tabung spesimen yang mengandung
assay diluent, kemudian swab spesimen diaduk sehingga seluruh sampel spesimen larut didalam assay diluent. Kemudian diambil larutan supernatan dari dalam tabung dengan disposable dropper yang tersedia. Sebagai langkah terakhir, diteteskan larutan supernatan sebanyak 4-5 tetes ke dalam lubang sampel pada kit tes dengan disposable Propagasi virus pada Telur
embrio tertunas (TET)
Isolasi RNA
Penyalinan dari RNA ke DNA (Reverse Transkriptase)
Amplifikasi oleh PCR (membuat salinan DNA)
9
dropper. Pembacaan hasil diamati dengan munculnya pita pada kit tes yang tersedia.
Spesifisitas Anigen®
Sebelum digunakan pada pemakaian lapang, kit Anigen® perlu diuji terlebih dahulu
tingkat spesifisitas dan sensitivitas terhadap virus AI tipe A. Sehingga hasil deteksi virus AI oleh kit tersebut benar -benar akurat.
Tingkat spesifisitas kit Anigen® dapat diketahui dengan melakukan pendeteksian oleh kit Anigen® terhadap sejumlah virus unggas yang biasa terdapat di lapangan dan sering menginfeksi unggas. Tujuan dari uji ini adalah untuk membuktikan bahwa kit Anigen® hanya dapat mendeteksi virus AI tipe A, sementara itu virus unggas lain yang terdapat pada sampel tidak akan terdeteksi oleh kit tersebut.
Untuk keperluan uji spesifisitas maka telah dilakukan pendeteksian terhadap sejumlah virus unggas baik berupa vaksin maupun isolat lokal. Virus -virus yang digunakan utuk mengetahui spesifisitas Anigen® adalah Newcastle Disease Virus
(NDV)/tetelo, Infectious Bronchitis (IB), Infectious Laryngiotracheitis (ILT), Infectious Bursal Disease (IBD) / Gumboro, Egg Drop Syndrome (EDS) dan Chicken Anemia Virus
(CAV). Masing-masing virus diteteskan sebanyak 5 tetes ke dalam tabung spesimen yang mengandung assay diluen, kemudian swab spesimen diaduk sehingga seluruh sampel spesimen larut didalam assay diluen. Langkah selanjutnya sama dengan deteksi cepat sampel dengan Anigen®.
Sensitivitas Anigen®
Selanjutnya, untuk mengetahui tingkat sensitivitas Kit Anigen®, maka telah dilakukan pengujian terhadap kemampuan kit tersebut dalam mendeteksi virus AI. Untuk itu, digunakan isolat virus AI (Balitvet) yang telah dikarakterisasi sebelumnya dan termasuk ke dalam tipe A subtipe H5N1. Isolat virus AI yang telah ditumbuhkan dalam chorio allantoic cavity (CAC) dan memiliki titer 107 EID50/0,1 mL (Egg Infectious Doses)
diencerkan secara seri dengan kelipatan 10 mulai dari 10-1 sampai dengan 10-3. Selain itu
digunakan pula virus yang tidak diencerkan. Untuk isolat virus yang tidak diencerkan (undiluted) diambil 1 ml AIV dan tanpa dicampur dengan larutan penyangga PBS (Phospat Buffer Saline), sedangkan untuk pengenceran 10-1 dari campuran undiluted
sebelumnya diambil sebanyak 0,1 ml, dan
ditambah 0,9 ml PBS. Pengenceran 10--2, diperoleh dengan mengambil sebanyak 0,1 ml dari pengenceran 10-1 dan ditambah 0,9 ml P B S. Hal yang sama juga dilakukan untuk mendapatkan pengenceran 10-3. Kemudian dari masing-masing campuran AIV dan PBS dengan berbagai konsentrasi tadi, sebanyak 100 µL dimasukkan ke dalam tabung spesimen yang mengandung assay diluent
yang diaduk sehingga isolat AIV larut didalam assay diluent. Langkah selanjutnya sama dengan deteksi cepat sampel dengan
Anigen® dan diamati sampai dengan
konsentrasi berapa Anigen® tetap mampu mendeteksi AIV.
Tingkat sensitivitas Kit Anigen® dapat dibandingkan dengan metoda uji cepat lainnya, maka dilakukan pula pengujian dengan Hemagglutinasi (HA) cepat (Rapid test), yang biasa digunakan oleh laboratorium diagnostik untuk mendeteksi adanya virus unggas. Uji HA cepat dilakukan terhadap enceran virus AI di atas, yaitu: virus AI yang telah diencerkan dengan kelipatan 10, masing-masing enceran diteteskan pada lempeng porselei n, kemudian ditambahkan satu tetes sel darah merah (SDM) ayam 0,5% (v/v). Diamati terjadinya aglutinasi SDM ayam akibat virus AI pada setiap enceran virus.
Isolasi RNA Metode Trizol LS
Metode ini menggunakan kit Trizol LS (Gibco, Life Technology) dengan modifikasi. Sampel asal swab feses ataupun kloaka yang telah disegarkan dalam media transpor diambil sebanyak 250 µL. Kemudian dipindahkan ke dalam tabung eppendorf 1,5 ml (Tabung sebelumnya telah direndam dalam DEPC 0,1% selama satu malam dan di sterilisasi dengan cara di autoclave pada suhu 121 °C selama 15 menit). Ke dalam tabung ditambahkan larutan Trizol LS sebanyak 750 µL. Selanjutnya divorteks dan diinkubasi selama 5 menit pada suhu ruang. Kemudian ke dalam tabung ditambahkan klorofom 250 µL. Larutan dikocok pelan dan didinginkan selama 10-15 menit pada suhu ruang. Kemudian dilakukan sentrifugasi dengan kecepatan 12.000 rpm selama 15 menit pada 4
0C. Setelah disentrifugasi, supernatan diambil
terbentuk dicuci dengan 1 ml etanol 75% dalam DEPC (dingin), kemudian divorteks dan disentrifugasi kembali pada 12000 rpm selama 20 menit pada 4 0C. Etanol dibuang dan pelet yang dihasilkan dibiarkan mengering selama 60 menit, untuk selanjutnya ditambah air destiasi (dH2O) sebanyak 10 µL
dan dilakukan pemekatan secara serial. Pada tahap ini sampel telah siap untuk dilakukan RT-PCR.
Deteksi Avian Iinfluenza dengan RT -PCR
Metode RT -PCR yang digunakan adalah sesuai dengan Fouchier et al (2000) dengan kit SuperScriptTM One-Step RT-PCR with Platinum® Taq (Invitrogen) dengan modifikasi. Pereaksi-pereaksi sebagai berikut; 2X campuran reaksi sebanyak 25 µL, primer
forward (M52C) dan reverse (M253R) sebanyak 2 µl atau dengan konsentrasi akhir masing-masing 0,8 µM, 10 µL sampel (RNA template) , enzim RT platinum taq mix 1 µL dan akuabides steril dimasukkan ke dalam tabung PCR sampai volume 50 µL. Pada gambar 6 menunjukkan bahwa tahapan RT -PCR yang terdiri atas reverse transcription
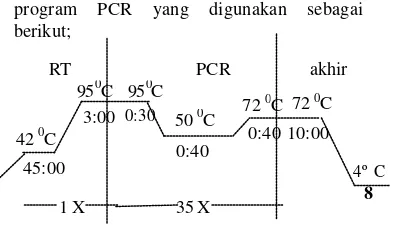
(RT), PCR dan akhir dengan program PCR yang digunakan sebagai berikut;
Gambar 6 Program RT -PCR untuk deteksi virus AI pada sampel
Deteksi Virus AI Subtipe H5 dengan RT -PCR
Metode RT -PCR yang digunakan adalah sesuai dengan Lee MS et al (2001) dengan kit
Super ScriptTM One-Step RT-PCR with Platinum® Taq dari Invitrogen dengan modifikasi. Pereaksi-pereaksi sebagai berikut; 2X campuran reaksi sebanyak 25 µL, primer
forward (H5F) dan reverse (H5R) sebanyak 1 µl atau dengan konsentrasi akhir masing-masing 0,8 µM, 10 µL sampel (RNA template), enzim RT platinum taq mix 1 µL dan akuabides steril, dimasukkan ke dalam tabung PCR sampai volume 50 µL. Pada gambar 7 menunjukkan bahwa tahapan RT -PCR terdiri atas RT, -PCR dan akhir dengan
program PCR yang digunakan sebagai berikut;
Gambar 7 Program RT -PCR untuk deteksi virus HPAI subtipe H5 pada sampel
Elektroforesis Gel Agarosa
Produk RT -PCR diperiksa dengan teknik elektroforesis gel agarosa (Sigma Aldrich). Gel agarosa 2 % dibuat dengan cara melarutkan 2,0 g agarosa dalam 100 ml buffer TBE melalui pemanasan dengan microvawe. Sebelum larutan gel dituang dalam wadah cetakan horizontal dengan sejumlah sumur tempat aplikasi sampel, ke dalam larutan ditambahkan 0,5 µL etidium bromida. Kemudian gel dituang dan dibiarkan membeku selama setengah jam atau lebih. Setelah beku, gel dimasukkan ke dalam perangkat elektroforesis yang berisi larutan TBE 1X Sebanyak 10 µL sampel (DNA) dicampur dengan 0,5 µL loading buffer, kemudian dimasukkan ke dalam sumur-sumur tempat aplikasi sampel. Elektroforesis dijalankan pada tegangan 50 V selama 120 menit. Untuk membandingkan hasil yang diperoleh digunakan marka DNA 100 bp
ladder. Visualisasi pita DNA dilakukan dengan lampu UV pada panjang gelombang 300 nm.
HASIL DAN PEMBAHASAN Deteksi Cepat Sampel dengan Kit Anigen®
Anigen® merupakan kit yang dapat mendeteksi virus AI hidup maupun yang telah diinaktifkan (contoh vaksin AI, antigen AI). Oleh karena itu pada penelitian ini digunakan Anigen® untuk mendeteksi AI pada berbagai unggas.
Deteksi sampel swab kloaka dan feses dengan Anigen® (Gambar 8) menunjukkan hasil yang positif, sampel mengandung AIV tipe A terlihat dari munculnya dua pita, K dan S. Jika hanya satu pita pada K saja sampel yang diuji negatif. Hasil pengamatan menunjukkan juga bahwa pengujian AIV lebih baik dilakukan dengan sampel dari feses,
72 0C 72 0C
0:40 10:00 950C 950C
50 0C
0:40 3:00 0:30
8 4º C
RT PCR akhir
42 0C
1 X 35 X
45:00
8
72 0C
3:00 950C 950C
45 0C
1:00 4:00 1:00
RT PCR akhir
30:00 42 0C
11
S K
karena mempunyai konsentrasi virus yang lebih tinggi dari pada sampel dari kloaka. Saat diteteskan pada kit, sampel dari feses pita S muncul terlebih dahulu dari pada pita K.
Gambar 8 Hasil deteksi cepat AI dengan Anigen® (K = pita kontrol, S = pita sampel )
Spesifisitas Anigen®
Kit Anigen® yang digunakan pada penelitian ini hanya untuk deteksi cepat virus influenza tipe A. Oleh karena itu sebelas sampel yang positif (Tabel 2) akan diuji lebih lanjut dengan RT-PCR untuk mengetahui subtipe dari virus AI tersebut.
Uji spesifisitas Anigen® bertujuan untuk mengetahui kespesifisitasan dan keakuratan dari Anigen® dalam mendeteksi AIV. Uji ini diperlukan karena unggas di alam bebas dapat diserang oleh bermacam-macam virus yang kemudian menyebabkan penyakit Hasil percobaan terhadap virus selain AI seperti
Newcastle Disease Virus (NDV)/tetelo,
Infectious Bronchitis (IB), Infectious Laryngiotracheitis (ILT), Infectious Bursal Disease (IBD)/Gumboro, Egg Drop Syndrome
(EDS) dan Chicken Anemia Virus (CAV) menunjukkan hasil yang negatif, dimana hanya terlihat satu pita K (Lampiran 4). Hasil Negatif tersebut menunjukkan bahwa uji cepat Anigen® mempunyai tingkat spes ifisitas yang cukup tinggi terhadap virus infuenza tipe A penyebab AI. Hal ini disebabkan karena kit ini menggunakan nukleoprotein virus monoklonal anti virus AI umum yang di lekatkan (coating) pada kertas kromatografi yang berfungsi untuk menangkap dan mendeteksi virus influenza tipe A secara kualitatif berdasarkan prinsip uji kekebalan (immunoasay) (Anigen® 2005).
Sensitivitas Anigen®
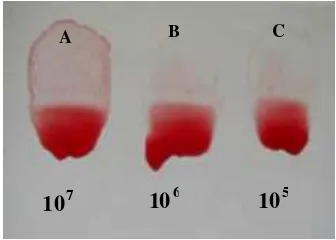
Hasil uji sensitivitas Anigen® terhadap berbagai konsentrasi AIV (gambar 9) menunjukkan bahwa Anigen® hanya mampu
mendeteksi isolat virus AI (IPA -Balitvet) hingga 105 EID/0.1ml. Apabila konsentrasi
virus dibawah 105 EID/0.1ml akan
memberikan hasil yang negatif.
Gambar 9 Hasil uji sensitivitas Anigen® terhadap berbagai konsentrasi virus AI (K dan S seperti pada
gambar 9, 107: tanpa
pengenceran, 106:pengenceran
10X, 105: pengenceran 100X, 104: pengenceran 1000X dan 103: pengenceran 10000X)
Perbandingan Sensitivitas Anigen® dengan HA
Hasil uji sensitivitas Anigen® dengan SDM ayam (gambar 10), memperlihatkan bahwa metode ini hanya mampu mendeteksi konsentrasi virus yang tidak diencerkan (107 EID/0.1 ml). Aglutinasi tampak dengan munculnya pasir-pasir halus pada permukaan pelat uji. SDM ayam sudah tidak mampu lagi untuk mendeteksi virus AI pada konsentrasi 106 EID/0.1 ml. Hasil ini menunjukkan bahwa uji cepat AI dengan HA kurang sensitif dibandingkan Anigen®. Prinsip uji HA adalah bahwa sel yang terinfeksi AIV akan mengandung protein HA, yang merupakan glikoprotein dan terdapat pada permukaan virus untuk mengikatkan virus pada reseptor sel target, sehingga dapat dikenali oleh residu asam sialat dalam SDM ayam dan terjadi aglutinasi (Cloud 1998).
Gambar 10 Hasil uji cepat HA dengan SDM Ayam (A= tanpa pengenceran, B= pengenceran 10X, C= pengenceran 100X, konsentrasi SDM ayam 0,5 %
10
610
710
5A B C
10
610
510
4Isolasi RNA
Isolasi RNA dengan metode trizol LS mendapatkan RNA yang cukup tinggi untuk dijadikan template RT-PCR. Hasil ini diperoleh setelah dilakukan modifikasi metode, dengan melakukan pemekatan serial.
Pemekatan serial perlu dilakukan karena hasil dari metode trizol relatif kurang pekat, yang kemungkinan disebabkan oleh: (i) terdegradasinya sebagian RNA, hilang selama proses isolasi yang melalui banyak tahap atau (ii) konsentrasi virus dalam sampel relatif kurang sehingga demikian pula RNA dalam sampel.
Deteksi Avian Influenza dengan RT-PCR
Deteksi virus influenza dengan RT-PCR dapat dilakukan dengan berbagai strategi, diantaranya seperti yang dilakukan pada penelitian ini, menggunakan RT-PCR Matriks dan RT -PCR H5. RT-PCR Matriks berdasarkan gen Matriks (M) sedangkan RT -PCR H5 berdasarkan gen Nukleoprotein (NP) pada virus AI. Kedua sekuen gen ini dipakai sebagai acuan untuk pembuatan primer. Dua metode RT-PCR ini mempunyai tujuan yang berbeda tetapi saling menunjang satu sama lain. RT-PCR Matriks untuk mendeteksi virus AI dan RT-PCR H5 untuk mendeteksi subtipe H5 dari virus AI.
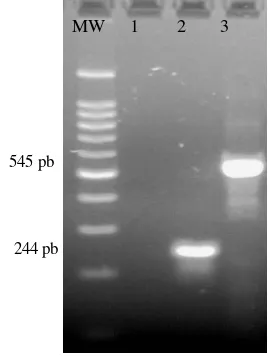
Produk (amplicon) spesifik yang dihasilkan dari RT -PCR Matriks dan RT-PCR H5 dapat diketahui dari kontrol positif (Marka) yang digunakan. Marka t ersebut adalah organ ayam proventriculus, yang telah lengkap dikarakterisasi, dan diketahui mengandung virus AI subtipe H5. Gambar 11 menunjukkan produk RT-PCR Matriks sebesar 244 pb (Fouchier 2000) dan RT-PCR H5 sebesar 545 pb (Lee et al 2001).
Sebelas sampel positif AI berdasarkan Anigen® (Tabel 2) dideteksi lebih lanjut dengan RT-PCR terhadap gen Matriks dan gen Nukleoprotein virus AI. Hasil uji RT-PCR Matriks (Tabel 2 dan gambar 12) mendapatkan delapan sampel positif (nomer 1-8) dan tiga sampel negatif uji PCR Matriksnya yaitu sampel (nomer 9, 10 dan 11).
Kemungkinan ketiga sampel yang negatif disebabkan karena RNA dari virus tersebut telah terdegradasi sehingga tidak teramplifikasi dengan PCR. Walaupun PCR merupakan uji yang sangat sensitif dan
spesifik, namun proses ekstraksi RNA yang digunakan sebagai template sangat rawan terhadap enzim-enzim pendegradasi RNA (RNAse). Faktor lain yang kemungkinan juga berpengaruh pada keberhasilan proses PCR adalah waktu lama penyimpanan sampel . Walaupun RT-PCR sangat spesifik dan sensitif, selang waktu analisis dengan pengambilan sampel tidak boleh terlalu lama (kurang dari satu minggu), karena dikhawatirkan virus telah terdegradasi sehingga saat dideteksi dengan RT -PCR tidak akan terdeteksi. Pada penelitian ini seluruh sampel yang diuji dalam keadaan segar (fresh) dengan waktu penyimpanan sampel kurang dari 2 hari. Saat dilakukan pengujian pada sampel yang waktu penyimpanannya sudah terlalu lama (lebih dari 7 hari), semua sampel yang diuji memberikan hasil uji negatif (data tidak ditampilkan).
Hasil uji RT-PCR H5 (Tabel 2 dan gambar 13) mendapatkan enam sampel (nomer 1-6) positif dan lima sampel (nomer 7-11) negatif. Hasil ini menunjukkan sampel nomer 1-6 mengandung virus AI subtipe H5. Data lapangan juga menunjukkan pada sampel 1-3, mempunyai tanda-tanda klinis (symptomatic) yang ditandai dengan kematian banyak unggas pada daerah tersebut.
Gambar 11 Marka RT -PCR Matriks dan RT-PCR H5 (MW=Marka DNA 100 bp, lajur 1: Kontrol negatif (air) lajur 2: Kontrol positif RT -PCR Matriks, lajur 3: Kontrol positif RT-PCR H5).
MW 1 2 3
MW - 1 2 3 4 5 6
Tabel 2 Hasil pengujian sampel swab kloaka dan feses asal unggas dengan uji cepat (Anigen®) dan RT-PCR
Gambar 12 Hasil deteksi sampel Avian Influenza dengan RT-PCR Matriks (MW=Marka DNA 100 pb, - : kontrol negatif (air), +: Kontrol positif (Ayam Blitar), S1-S8: sampel seperti tertera pada tabel 2).
Gambar 13 Hasil deteksi Sampel Avian Influenza subtipe H5 dengan RT PCR (MW=Marka DNA 100 pb, - : kontrol negatif (air), +: Kontrol positif (Ayam Blitar), 3-5: Puyuh Bekasi, 6-7: Merpati Jakarta Selatan, 8: Merpati Tanah Sareal Bogor).
Sampel nomer 1-6 positif uji RT-PCR H5 nya. Berarti sampel ini mengandung virus AI dengan subtipe H5. Subtipe ini, bersama subtipe H7, termasuk dalam virus AI yang bersifat HPAI. Virus AI yang sangat patogen ini ditandai dengan keberadaan asam amino yang berulang pada situs pembelahan (cleavage site) protein HA nya. Motif asam amino yang berulang ini diduga melakukan aktivasi agar protein HA membelah. Aktivitas pembelahan ini dibutuhkan untuk fusi dari virus ke membran endosom dari inang, sehingga virus mampu melakukan penetrasi dan menginisiasi terjadinya infeksi (Senne et al 1996).
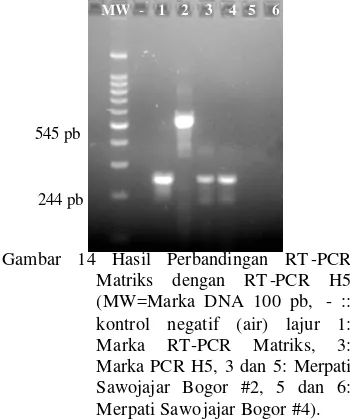
Sampel nomer 7 dan 8 positif pada PCR Matriksnya, tetapi negatif pada uji PCR H5 nya (gambar 14). Hasil ini menunjukkan bahwa kedua merpati ini terinfeksi virus AI yang bukan subtipe H5.
Gambar 14 Hasil Perbandingan RT -PCR Matriks dengan RT -PCR H5 (MW=Marka DNA 100 pb, - :: kontrol negatif (air) lajur 1: Marka RT-PCR Matriks, 3: Marka PCR H5, 3 dan 5: Merpati Sawojajar Bogor #2, 5 dan 6: Merpati Sawo jajar Bogor #4).
No. Spesies Sampel Asal Sampel Jenis Sampel
Hasil Uji
Anigen® RT-PCR Matriks
RT -PCR H5
1. Burung Puyuh Bekasi Swab Kloaka + + +
2. Burung Puyuh Bekasi Swab Kloaka + + +
3. Burung Puyuh Bekasi Swab Kloaka + + +
4. Burung Merpati Jakarta Selatan Swab Kloaka + + +
5. Burung Merpati Jakarta Selatan Swab Kloaka + + +
6. Burung Merpati Tanah Sareal Bogor Feses + + +
7. Burung Merpati Sawo Jajar Bogor Feses + + -
8. Burung Merpati Sawo Jajar Bogor Feses + + -
9. Burung Merpati Sawo Jajar Bogor Feses + - -
10. Burung Merpati Jakarta Selatan Swab Kloaka + - -
11. Burung Puter Tanah Sareal Bogor Feses + - -
MW - + S1 S2 S3 S4 S5 S6 S7 S8
244 pb
244 pb 545 pb
MW - + S1 S2 S3 S4 S5 S6
diketahui. Metode konvensional seperti isolasi virus ke dalam TET yang dilanjutkan dengan tes serologi (uji HI) setidaknya membutuhkan waktu tujuh hari untuk mengetahui hasilnya. Kelebihan lain dari RT -PCR adalah mampu mengidentifikasi subtipe virus langsung dari organ, tanpa propagasi atau isolasi virus terlebih dahulu. Hal ini disebabkan PCR mempunyai tingkat sensitifitas yang sangat tinggi. Sekuen dari produk PCR juga dapat dibandingkan dan dilakukan analisis filogenetik, sehingga dapat menyediakan informasi tambahan tentang asal usul (origin) virus tersebut (Lee et al 2001).
Mengingat PCR merupakan pengujian yang sangat sensitif maka kemungkinan terjadinya kontaminasi terbawa (carry-over contamination) cukup besar. Oleh karena itu dalam pengerjaannya diperlukan beberapa ruangan, dan setidaknya dilakukan dalam empat ruangan yang berbeda. Pertama ruangan tempat proses isolasi RNA, kedua tempat pencampuran sampel (template), ketiga ruang proses amplifikasi, dan keempat ruang tempat elektroforesis. Hal ini dilakukan
untuk menghindari kontaminasi yang
mungkin dapat terjadi.
Proses RT-PCR memerlukan beberapa komponen, selain cetakan DNA (template) dan primer, juga diperlukan bufer PCR, dan dNTPs. Di dalam 2X campuran reaksi (2X
reaction mix) terdapat bufer PCR yang
mengandung dNTP dan MgSO4. Bufer
berfungsi untuk mempertahankan pH larutan agar reaksi berlangsung optimum. Sementara dNTPs sebagai sumber nukleotida untuk membentuk polinukeotida, sedangkan ion Mg2+ pada MgSO4 diperlukan sebagai
kofaktor enzim Taq polimerase, karena semua enzim DNA polimerase termostabil memerlukan kation divalen bebas untuk aktivitasnya (Sambrook & Russel 2001).
SIMPULAN DAN SARAN
Simpulan
Kit Anigen® sebagai alat diagnostik cepat untuk virus Avian Influenza lebih sensitif 100 kali dibandingkan metoda HA. Sampel yang diperiksa berdasarkan RT-PCR Matriks mengandung virus AI dan sebagian lainnya positif terinfeksi virus AI subtipe H5.
yang lebih banyak, untuk dapat lebih mengetahui kondisi epidemiologi penyebaran virus Avian Influenza di Indonesia.
.
DAFTAR PUSTAKA
Anigen. 2005. Anigen Manual Instruction.
Korea: Anigen.
Brock TD, Madigan MT, Martinko JM, Parker J. 1994. Biology of Microorganism. Ed ke-7.Ed-ke8. New Jersey: Prentice-Hall.
Brown TA. 1995. Gene Cloning an
Introduction. London: Chapman & Hall. Capua I dan Dennis JA. 2002. Avian
Influenza and human health. Acta Tropica
83:1-6.
Chan PKS. 2002. Outbreak of avian influenza A (H5N1) virus infection in Hong Kong in 1997. Clin Infect Diseases Supl 2:558-564.
Claas ECJ, Jan C de J, Ruud VB, Guus FR, , Albert DMEO. 1998. Human influenza virus A/ hongkong/156/97 (H5N1) infection. Vaccine 16:977-978.
Claas ECJ et al. 1998. Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. The Lancet
351:472-477.
Cloud SS. 1998. Antigen detection system.. Di dalam: David ES, John RG, Mark WJ, James EP, Willie MR. A Laboratory Manual For The Isolation And Identification of Avian Pathogens. Ed ke-4. Florida: Rose Printing. hlm 270-277. Foni E et al. 2003. Detection of swine
influenza virus by RT-PCR and standard methods. 4th International Symposium on
Emerging and Re-emerging Pig Diseases. hlm 270 -271.
Fouchier RA M et al. 2000. Detection of Influenza A viruses from different species by PCR amplification of conserved sequences in the matrix gene. J Clin Microb 38:1 -13.
Guan Y et al. 2002. Emergence of multiple genotypes of H5N1 avian influenza
viruses in Hongkong SAR. PNAS
99:8950-8955.
Hasibuan TSPN. Kenali musuhmu. Kompas 1 Oktober 2005:35 (kolom 1-7)
14
Hien TT et al. 2004. Avian influenza A (H5N1) in 10 patients in vietnam. New Engl J Med 350:1179-1188.
Hindiyeh M et al. 2005. Evaluation of multiplex real-time reverse transcriptase
PCR assay for detection and
differentiation of influenza viruses A and B during the 2001-2002 Influenza Season in Israel. J Clin Microb 43:589-595.
Horimoto T et al. 2004. Antigenic differences between H5N1 human influenza viruses isolated In 1997 and 2003. J. Vet Med. Sci 66:3 03-305.
Horimoto T, Yoshihiro K. 2001. Pandemic threat posed by avian influenza A viruses.
Clin Microb Reviews 14:130-145. Jong JC de, Claas ECJ, Osterhaus, Robert
WG, WL Lim. 1997. A pandemic warning. Nature 89: 554.
Katz JM et al. 2000. Pathogenesis of and immunity to avian influenza A H5 viruses. Biomed&Pharmacoter 54:178-187.
Kurniawan W. 2004. Induksi reproduksi kedelai var.kawi dengan retardan dan identifikasi awal gen MADS-Box Tanaman Tembakau [skripsi]. Bogor: Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
KU ASW, LTW Chan. 1999. The first case of H5N1 avian influenza infection in a human with complications of adults respiratory distress syndrome and Reye’s syndrome. J. Paediatr. Child Health
35:207-209.
Lee MS, Poa-Chun C, Jui-Hung S. Ming-Chu C, dan Happy KS. 2001. Identification and subtyping of avian influenza viruses by Reverse Transcription-PCR. J. Virol Methods 97:13-22.
Matrosovich M, Nannan Z, Yoshihiro K, Robert W. 1999. The surface glycoprotein of H5 influenza viruses isolated from humans, chickens, and wild aquatic birds, have distinguishable Properties. J. Virol 73:1146-1155. Ng EKO, Peter KCC, Antia YY Ng, TL
Hoang, Wilina WLL. 2005. Influenza A
H5N1 detection. Emerg Infect
Diseases.11:1303 -1305.
Nguyen DC et al. Isolation and
characterization of avian influenza viruses, including highly pathogenic H5N1, from poultry in live bird markets in hanoi, vietnam, in 2001. J. Virol 79: 4201-4212.
Oxford JS. 2000. Influenza A pandemics of the 20th century with special reference to 1918: virology, pathology and epidemiology. Rev.Med.Virol. 10:119-133.
Pebriana R. 2003. Kloning dan ekspresi daerah determinan “a” gen s virus hepatitis B subtipe ADR [skripsi]. Bogor: Fakultas Matematika Dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sambrook J, DW Russels. 2001. Molecular Cloning A Laboratory Manual. Ed.ke-3. New York: Cold Spring Harbor Laboratory Press.
Senne DA et al. 1996. Survey of the hemaglutinin (HA) cleavage site sequence of H5 and H7 avian influenza viruses: amino acid sequence at The HA cleavage site as a marker of pathogenicity potential. Avian Diseases 40:425-437. Shu LL, WJ Bean, Robert GW. 1993.
Analysis of the evolution and variation of the human influenza A virus nucleoprotein gene from 1933 to 1990. J Virol 67:2723-2729.
Swayne DE, Dennis AS, Charles WB. 1998. Avian influenza, hlm 150-155. Di dalam: Swayne DE John GR, Mark WJ, James EP, Willie MR. A Laboratory Manual For The Isolation And Identification Of Avian Pathogens. Ed ke-4. Florida: Rose Printing, hlm 150-155.
Taubenberger JK et al. 2005. Characterization of the 1918 influenza virus polymerase genes. Nature 437:889-893.
Ungchusak K et al. 2005. Probable person-to-person transmission of avian influenza A (H5N1). N Engl J Of Med. 352:333-340. Utama A. 2005. Evolusi virus flu burung
H5N1. http//www.suara karya.com. [9 November 2005]
Webster RG. 1998. Influenza: an emerging disease. Emerg Infect Diseases 4:436-441.
Whittaker GR. 2001. Intracellular trafficking of Influe nza virus:clinical implications for molecular medicine [ulas balik].
Exp.Rev.Mol.Med:1-8.
Zhou NN, Kennedy FS, Eric CJC, Scott LK, Robert RG. 1999. Rapid evolution of H5N1 influenza viruses in chickens in Hong Kong. J.virol 73:3336-3374.
17
Lampiran 1 Diagram alir penelitian
Sampel swab kloaka atau
feses dari berbagai unggas
Bila Positif AI
Deteksi virus
Avian Influenza
Tipe A
dengan uji cepat Anigen
®RT-PCR pada gen Matriks
virus AI
RT-PCR pada gen Nukleoprotein
(NP) virus AI
Isolasi RNA
RT-PCR H5 untuk mengetahui
sub-tipe virus Avian Influenza
Visualisasi dengan elektroforesis
Optimasi primer PCR H5
Konfirmasi
Lampiran 2 Daftar primer yang digunakan
No
Nama
Primer
Sekuens primer
Ukuran
Primer
(pb)
Produk
PCR
(pb)
Kegunaan
1
M52C
5’-CTT CTA ACC GAG GTC
GAA ACG-3’
21
244
Deteksi AI
tipe A
2
M253R
5’- AGG GCA TTT TGG
ACA AAG/T CGT CTA-3’
24
244
Deteksi AI
tipe A
3
H5-155f
5’-ACA CAT GO
Y
CA
R
GAC ATA CT-3’
20
545
Deteksi
virus AI
sub tipe
H5
4
H5-699r
5’-CTY TG
R
TT
Y
AGT GTT
GAT GT -3’
20
545
Deteksi
virus AI
sub tipe
H5
19
Lampiran 3 Komposisi reagen yang digunakan
Media Transpor
Medium Dulbecous’s Minimal Essential Medium (DMEM)
2% (v/v) Fetal Calf Serum (FCS)
Penicilin (10000 IU/ml)
Streptomycin (2000 – 10.000 ug/ml)
Amphotericin B (5-20 ug/ml)
Gentamycin sulfate (1000 ug/ml)
Kanamycin sulfat (650 ug/ml)
Phospat Buffer Saline (PBS)
Natrium Klorida (NaCl)
8 gram
Kalium Hidrofosfat (KH
2PO
4)
0,2 gram
Natrium Hidrofosfat (N
2HPO
4)
1,15 gram
Kalium Klorida (KCl)
0,2 gram
dilarutkan dalam 1000 ml air destilasi (dH
2O)
Etidium Bromida
1 gram Etidium bromida
dilarutkan dalam 100 ml air destilasi (dH
2O)
Penyangga TBE (Tris Boric EDTA) 10 X
Tris
108 gram
Asam Borat
55 gram
0.5 M EDTA 40 ml
dilarutkan dalam 1000 ml air destilasi (dH
2O)
Loading Buffer
0.25 % (w/v) Bromfenol Biru
40 % (w/v) Sukrosa dalam air destilasi (dH
2O)
Lampiran 4 Uji spesifisitas Anigen
®terhadap berbagai jenis virus unggas
No. Nama Virus
Nama
Penyakit
Jenis Inang
Hasil
1
Avian Influenza Virus
(AIV)
Influenza
unggas
Burung liar,
unggas, Babi
Positif
2
Newcastle Disease Virus
(NDV)
Tetelo
Ungga s
Negatif
3
Infectious Bronchitis
Virus
(IBV)
Bronkhitis
menular
Unggas
Negatif
4
Infectious
Laryngotracheitis
(ILT)
Laryngo
Trakeitis
menular
Unggas
Negatif
5
Infectious Bursal
Diseases
(IBD)
Gumboro
Unggas
Negatif
6
Eggs Drop Syndrome
(EDS)
Kerabang
telur lembek
Unggas
Negatif
7
Chicken Anemia Virus
(CAV)
Anemia pada