SINTESIS 9-n-PENTOKSI 10-HIDROKSI n-PENTIL STEARAT
CAMPURAN DARI ASAM OLEAT
SKRIPSI
ASPRIADI TARIGAN
NIM : 060802059
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS 9-n-PENTOKSI 10-HIDROKSI n-PENTIL STEARAT
CAMPURAN DARI ASAM OLEAT
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ASPRIADI TARIGAN
NIM : 060802059
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Persetujuan
Judul : SINTESIS 9-n-PENTOKSI 10-HIDROKSI n-PENTIL STEARAT CAMPURAN DARI ASAM OLEAT
Kategori : SKRIPSI
Nama : ASPRIADI TARIGAN
Nomor Induk Mahasiswa : 060802059
Program Studi : SARJANA (S-1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Maret 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Mimpin Ginting, M.S Drs. Adil Ginting, M.Sc
NIP. 195510131986011001 NIP. 195307041980031002
Diketahui/Disetujui oleh : Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
SINTESIS 9-n-PENTOKSI 10-HIDROKSI n-PENTIL STEARAT CAMPURAN
DARI ASAM OLEAT
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2011
PENGHARGAAN
Puji dan syukur saya panjatkan kehadirat Tuhan Yang Maha Esa yang telah memberikan berkat dan rahmatNya kepada saya sampai selesainya penelitian dan penulisan skripsi ini sebagai salah satu persyaratan untuk meraih gelar Sarjana Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Selanjutnya saya menyampaikan penghargaan dan rasa cinta kasih setinggi-tingginya kehadapan Ayahanda T. Tarigan dan Ibunda E. br. Ginting, yang dengan doa dan cintanya mengorbankan banyak hal untuk membesarkan, mendidik saya, dan mengajarkan banyak hal dengan penuh kesabaran dalam kehidupan saya, serta tak lupa terima kasih kepada abang saya Valentinus Tarigan dan adik-adik saya Dewi Hiasinta br Tarigan dan Eranika br Tarigan yang telah memberikan dorongan yang tulus, sehingga selesainya penulisan skripsi ini. Serta seluruh keluarga yang telah memberikan banyak dukungannya.
Dengan segala kerendahan hati, saya mengucapkan terima kasih yang sebesar-besarnya kepada yang terhormat :
1. Bapak Drs.Adil Ginting,M.Sc dan Bapak Dr.Mimpin Ginting,M.S selaku pembimbing 1 dan pembimbing 2 yang telah banyak memberikan pengarahan dan bimbingannya dengan penuh kesabaran hingga terselesaikannya skripsi ini.
2. Ibu Dr.Rumondang Bulan,M.S dan Bapak Drs.Albert Pasaribu,M.Sc selaku ketua dan sekretaris Jurusan Kimia FMIPA USU yang telah membantu urusan administrasi dan sekaligus mensyahkan skripsi ini.
3. Staf Ahli Laboratorium Kimia Organik/Proses Kimia FMIPA USU Bapak Prof.Dr.Jamaran Kaban,M.Sc, Bapak Drs.Darwis Surbakti,M.S, Ibu Dra Herlince Sihotang,M.Si, Ibu Juliati Tarigan,S.Si,M.Si, Ibu Cut Fatimah Zuhra, S.Si,M.Si, Ibu Helmina Sembiring S.Si,M.Si yang telah banyak membantu dan memberikan arahan selama melakukan peneltian.
4. Ibu Sofia Lenny,S.Si,M.Si selaku dosen wali saya yang telah mengarahkan saya selama masa perkuliahan.
1. Seluruh asisten Laboratorium Kimia Organik/Proses Kimia FMIPA USU : Robi Janto Bangun, Yemima Paskaulina S. Merry Echaristy Ginting, Christy Halomoan Ginting, Silorida Tarigan, Denny Anta Pinem, Bayu Kasogi Ginting, Ronald Samuel, Mutiara Saragih dan Sion Olivia S, atas dukungan dan bantuannya selama melakukan penelitian dan penulisan skripsi.
2. Sahabat-sahabat seperjuangan : Robi Janto Bangun, Marcel R.Pasaribu, Felly Hawer Sinurat, Agusmanto Sihombing, dan seluruh kimia Stambuk 2006 yang tidak dapat saya sebutkan satu per satu namanya yang telah banyak memberikan bantuan dan semangat kepada saya dalam penyelesaian skripsi ini.
3. Segala pihak yang telah membantu saya menyelesaikan skripsi ini. Untuk itu semua, semoga Tuhan membalasnya dengan segala yang terbaik. Amin.
Saya menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan saya baik dalam literatur maupun pengetahuan. Oleh karena itu saya mengharapkan kritik dan saran yang membangun demi skripsi ini.
Kiranya Tuhan Yang Maha Esa selalu melimpahkan rahmat dan karuniaNya kepada kita dan semoga skripsi ini dapat bermanfaat bagi kita bersama.
Medan, Maret 2011 Penulis
Abstrak
Senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran yang merupakan turunan asam lemak dan dapat digunakan untuk berbagai keperluan seperti pelumas, biodiesel, surfaktan, maupun pembuatan bahan polimer menggunakan bahan dasar asam oleat melalui esterifikasi, epoksidasi, diikuti alkoksilasi.
SYNTHESIS 9-n-PENTHOXY 10-HIDROXY n-PENTYL STEARIC MIXTURE FROM OLEIC ACID
Abstract
Compound of 9-n-penthoxy 10-hidroxy n-pentyl stearic mixture which is derivative of fatty acid and can be used for some activities such as lubricant, biodiesel, surfactan,or manufacture of polymeric materials by using oleic acid as substrat through esterification, epoxidation, followed by alcoxylation.
DAFTAR ISI
1.6.1. Eterifikasi Asam Oleat dengan n-Pentanol ... 3
1.6.2. Epoksidasi n-Pentil Oleat Menjadi Epoksida ... 3
1.6.3. Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 3
BAB 2. Tinjauan Pustaka
2.6.Penggunaan Alkil Ester ... 15
2.7.Spektroskopi Inframerah ... 19
2.8.Resonansi Magnet Inti Proton ... 20
BAB 3. Metode Penelitian 3.1.Alat-alat yang digunakan ... 22
3.3.Prosedur Penelitian ... 24
3.3.1. Pembuatan Reagensia dan Standarisasi ... 24
3.3.1.1.Pembuatan Larutan KI 10% ... 24
3.3.1.2.Pembuatan Larutan Indikator Amilum ... 24
3.3.1.3.Pembuatan Larutan Standart Natrium Tiosulfat ... 24
3.3.1.4.Pembuatan Larutan K2Cr2O7 ... 24
3.3.2. Esterifikasi Asam Oleat dengan n-Pentanol ... 24
3.3.3. Epoksidasi n-Pentil Oleat Menjadi Epoksida ... 25
3.3.4. Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi
9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 25
3.4.Analisa Hasil Reaksi ... 26
3.4.1. Analisa dengan Spektroskopi FT-IR ... 26
3.4.2. Analisa dengan Spektroskopi 1H-NMR... 26
3.4.3. Penentuan Asam Lemak Secara Kromatografi Gas ... 26
3.4.4. Penentuan Bilangan Iodium ... 27
3.4.5. Penentuan Nilai Indeks Bias ... 27
3.5.Bagan Penelitian ... 28
3.5.1. Esterifikasi Asam Oleat dengan n-Pentanol ... 28
3.5.2. Epoksidasi n-Pentil Oleat Menjadi Epoksida ... 29
3.5.3. Alkoksilasi Senyawa Epoksida dengan n-pentanol Menjadi 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 30
BAB 4. HASIL DAN PEMBAHASAN 4.1.Hasil ... 31
4.1.1. Esterifikasi Asam Oleat dengan n-Pentanol ... 31
4.1.2. Epoksidasi n-Pentil Oleat Menjadi Epoksida ... 32
4.1.3. Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 33
4.2.Pembahasan ... 36
4.2.1. Esterifikasi Asam Oleat dengan n-Pentanol ... 36
4.2.2. Epoksidasi n-Pentil Oleat Menjadi Epoksida ... 37
4.2.3. Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 38
BAB 5. KESIMPULAN DAN SARAN 5.1.Kesimpulan ... 41
5.2.Saran ... 41
DAFTAR TABEL
Tabel 2.1. Diagram Alur Oleokimia ... 5
Tabel 2.2. Contoh Asam Lemak Tidak Jenuh dan Sumbernya ... 7
DAFTAR GAMBAR
Gambar 2.1. Reaksi Epoksida dengan Berbagai Senyawa Kimia ... 11
Gambar 2.2. Reaksi Epoksidasi dan Hidrolisis ... 12
Gambar 2.3. Reaksi Esterifikasi dengan Berbagai Macam Katalis ... 14
Gambar 2.4. Senyawa Monoester dari Minyak Jojoba ... 16
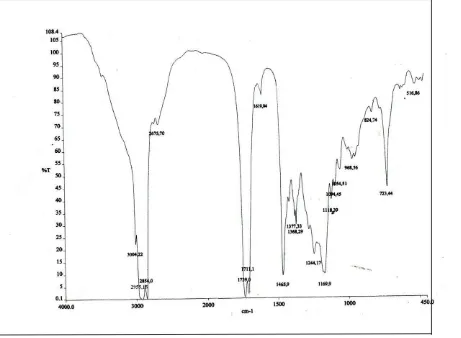
Gambar 4.1. Spektrum FT-IR n-Pentil Oleat ... 32
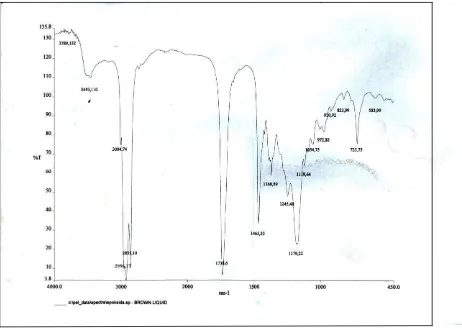
Gambar 4.2. Spektrum FT-IR dari Epoksi n-Pentil Oleat ... 33
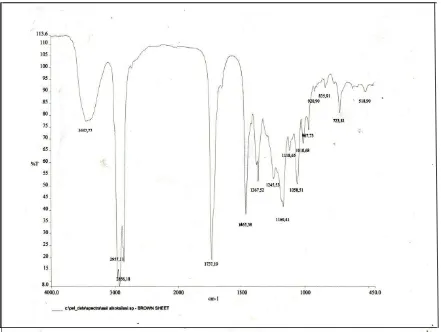
Gambar 4.3. Spektrum FT-IR 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 34
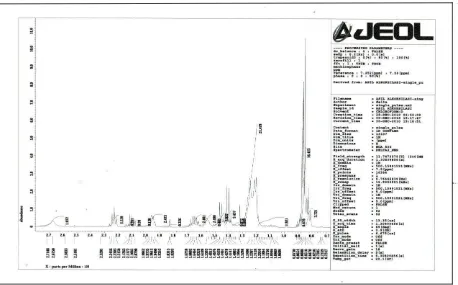
Gambar 4.4.a. Spektrum 1H-NMR 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran ... 35
Gambar 4.4.b. Spektrum 1H-NMR 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran Ekspan ... 35
Gambar 4.4.c. Spektrum 1H-NMR 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran Ekspan ... 36
DAFTAR LAMPIRAN
Lampiran A. Kromatogram Asam Oleat ... 46
Lampiran B. Harga Bilangan Iodin Metode Wijs ... 47
Lampiran C. Spektrum FT-IR Asam Oleat ... 48
Abstrak
Senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran yang merupakan turunan asam lemak dan dapat digunakan untuk berbagai keperluan seperti pelumas, biodiesel, surfaktan, maupun pembuatan bahan polimer menggunakan bahan dasar asam oleat melalui esterifikasi, epoksidasi, diikuti alkoksilasi.
SYNTHESIS 9-n-PENTHOXY 10-HIDROXY n-PENTYL STEARIC MIXTURE FROM OLEIC ACID
Abstract
Compound of 9-n-penthoxy 10-hidroxy n-pentyl stearic mixture which is derivative of fatty acid and can be used for some activities such as lubricant, biodiesel, surfactan,or manufacture of polymeric materials by using oleic acid as substrat through esterification, epoxidation, followed by alcoxylation.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Epoksidasi terhadap ikatan rangkap asam lemak tidak jenuh dari beberapa minyak nabati telah dilakukan dan juga telah diterapkan dalam skala industri. Saat ini epoksidasi minyak yang paling banyak dikembangkan adalah epoksidasi terhadap minyak nabati yang memiliki kandungan asam lemak tidak jenuh tinggi seperti minyak kedelai (Goud, 2006).
Salah satu produk epoksida yang dapat dihasilkan menggunakan minyak nabati sebagai bahan bakunya adalah senyawa polihidroksi trigliserida. Polihidroksi trigliserida merupakan senyawa turunan dari minyak atau lemak yang memiliki gugus hidroksil lebih dari 2. Senyawa polihidroksi trigliserida ini banyak digunakan sebagai bahan untuk
pembuatan poliuretan, bahan aditif untuk plastik, pelumas, surfaktan dan lain-lain sehingga kebutuhan akan senyawa ini menjadi sangat tinggi.
Senyawa polihidroksi trigliserida ini dihasilkan melalui reaksi hidroksilasi. Reaksi hidroksilasi meliputi dua tahap reaksi, yaitu reaksi epoksidasi pembentukan cincin epoksida (oksiran) dan diikuti reaksi pembukaan cincin oksiran. Senyawa trigliserida tidak jenuh yang terkandung dalam minyak nabati ini diepoksidasi menggunakan asam peroksi (yang terbuat dari asam karboksilat dan hidrogen peroksida), dan akan menghasilkan senyawa epoksida yang jumlahnya dapat dinyatakan dalam bilangan oksiran.
Epoksida minyak dapat digunakan secara langsung sebagai pemlastis dalam matriks polimer untuk menghasilkan suatu material yang sesuai untuk polivinil klorida (PVC), hal ini sangat penting sekali untuk mengendalikan kekentalan PVC selama proses
Adanya ikatan π pada metil risinoleat telah berhasil diepoksidasi dilanjutkan dengan alkoksilasi terhadap epoksida metil risinoleat untuk menghasilkan senyawa metil [9-(2,3-dihidroksipropoksi)-10,12-dihidroksioktadekanoat] (Ocha,2009).
Esterifikasi asam organik dengan alkohol merupakan salah satu reaksi yang paling mendasar dan penting dalam industri kimia. Produk-produk esternya secara luas
dimanfaatkan sebagai pelarut dan pengemulsi dalam industri makanan, farmasi serta kosmetik ataupun pelumas dalam pengolahan logam, industri tekstil dan plastik (Arismunandar, 2006).
Sebagai bahan bakar (biodiesel) ester asam lemak seperti metil maupun etil ester asam lemak telah banyak diteliti untuk dikembangkan, demikian juga ester antara alkohol rantai panjang dengan asam oleat telah banyak dikembangkan sebagai bahan pelumas dasar bio (biolubricant) (Susanto, 2008).
Dari uraian ini peneliti tertarik memodifikasi asam oleat melalui esterifikasi
dilanjutkan epoksida dan alkoksilasi untuk sintesis 9-n-pentoksi 10-hidroksi n-pentil stearat campuran.
1.2. Permasalahan
Berdasarkan latar belakang yang telah diuraikan diatas, maka sebagai permasalahan dalam penelitian ini adalah :
- Apakah senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran dapat dihasilkan melalui alkoksilasi dengan pentanol terhadap epoksida dari turunan n-pentil oleat.
1.3. Tujuan Penelitian
1.4. Manfaat Penelitian
Hasil penelitian ini dapat dijadikan sebagai sumber informasi terhadap industri oleokimia bahwa hasil alkoksilasi dari epoksida n-pentil oleat dengan n-pentanol yang diharapkan dapat dijadikan sebagai bahan pelumas berbasis oleokimia.
1.5. Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Organik FMIPA-USU Medan. Analisa Kromatografi Gas dilakukan di salah satu industri oleokimia Sumatera Utara, Analisa FT-IR dilakukan di salah satu Perusahaan Swasta di Medan, dan analisa 1H-NMR dilakukan di laboratorium LIPI Serpong Tangerang.
1.6. Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. OLEOKIMIA
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun.
Pada saat ini industri oleokimia masih berbasis kepada minyak/trigliserida sebagai bahan bakunya. Asam lemak bersama-sama dengan gliserol, merupakan penyusun utama minyak nabati atau lemak dan merupakan bahan baku untuk semua lipida pada makhluk hidup. Asam lemak ini mudah dijumpai dalam minyak masak (minyak goreng), margarin, atau lemak hewan dan menentukan nilai gizinya.
Secara alami, asam lemak bisa berbentuk bebas (karena lemak yang terhidrolisis) maupun yang terikat dengan gliserida. Asam lemak merupakan salah satu basic oleochemical (Tambun, 2006).
Oleokimia merupakan turunan gliserol dengan asam lemak yang berubah dalam bentuk turunannya yang digunakan baik sebagai surfaktan, deterjen, polimer, aditif bahan bakar dan sebagainya. Bahan dasar oleokimia seperti gliserol, asam lemak, amina asam lemak dan alkohol asam lemak dapat diperoleh dengan mengubah lipida baik yang berasal dari hewan maupun tumbuhan menjadi gliserol dan turunan asam lemak.
Tabel 2.1. Diagram Alur Oleokimia
Bahan Dasar Bahan Dasar Oleokmia Turunan Oleokimia
Minyak/ Lemak
Asam lemak adalah asam karboksilat yang diperoleh dari hidrolisis suatu lemak atau minyak, umumnya memiliki rantai hidrokarbon panjang dan tidak bercabang. Dan kebanyakan trigliserida alami adalah trigliserida campuran, yaitu triester dengan komponen asam lemak yang berbeda (Wilbraham, 1992). Asam lemak merupakan asam monokarboksilat yang memiliki rantai atom karbon yang lurus, mulai dari atom C-4 yang terdapat didalam lemak (C1-C3 biasanya tidak terdapat dalam lemak) dan ditemukan
Asam lemak dapat dibedakan menjadi asam lemak jenuh dan asam lemak tak jenuh. Asam lemak jenuh hanya memilki ikatan tunggal diantara atom-atom karbon penyusunnya, sementara asam lemak tak jenuh memilki paling sedikit satu ikatan ganda diantara satu atom-atom karbon penyusunnya (Tambun, 2006).
Asam-asam lemak tidak jenuh berbeda dalam jumlah dan posisi ikatan rangkapnya, dan berbeda dengan asam lemak jenuh dalam bentuk molekul keseluruhannya. Asam lemak tidak jenuh biasanya terdapat dalam bentuk cis, walaupun sebagian kecil dalam bentuk trans. Asam lemak bentuk cis mempunyai titik cair yang lebih rendah dibandingkan dengan bentuk trans dengan panjang rantai yang sama. Panjang rantai karbon juga mempengaruhi titik cair. Pada asam lemak jenuh, titik cair akan semakin meningkat dengan semakin panjangnya rantai karbon. Pada asam lemak tidak jenuh, titik cair akan semakin menurun dengan bertambahnya ikatan rangkap, sehingga asam lemak jenuh mempunyai titik cair yang lebih tinggi dibandingkan dengan asam lemak tidak jenuh dengan jumlah atom karbon yang sama. Posisi asam lemak pada molekul trigliserida juga mempengaruhi titik cair minyak dan lemak. Posisi asam lemak yang simetris dalam molekul trigliserida mempunyai titik cair yang lebih tinggi dibandingkan dengan posisi yang tidak simetris.
Asam lemak yang tidak mempunyai ikatan rangkap antara atom C dengan atom C lainnya adalah lurus, sedangkan asam lemak yang mempunyai ikatan rangkap bentuk ikatan antara atom C dengan atom C lainnya agak membengkok (Seager,1994).
Asam lemak dengan jumlah atom C lebih dari 12 tidak larut dalam air dingin maupun air panas, tetapi dengan jumlah rantai atom karbon yang pendek bersifat larut dalam air, demikian juga sifat kelarutan garam dari asam lemak yang mempunyai berat molekul rendah dan tak jenuh lebih mudah larut dalam alkohol dari pada garam dari asam lemak yang mempunyai berat molekul tinggi dan jenuh (Winarno, 1984). Asam oleat mempunyai rantai karbon yang sangat panjang dengan asam stearat, tetapi suhu kamar, asam oleat berupa zat cair. Disamping itu, makin banyak jumlah ikatan rangkap makin rendah titik leburnya (Poedjiadi,1994)
rendah, serta asam lemak yang berstruktur trans mempunyai titik cair yang lebih tinggi dari pada yang berstruktur cis (Ketaren, 1986).
Keberadaan ikatan ganda pada asam lemak tak jenuh menjadikannya memiliki dua bentuk cis dan trans. Semua asam lemak nabati alami hanya memiliki bentuk cis. Asam lemak trans hanya diproduksi oleh sisa metabolisme hewan atau dibuat secara sintetis. Akibat polarisasi atom H, asam lemak cis memiliki rantai yang melengkung. Asam lemak trans karena atom H-nya berseberangan tidak mengalami efek polarisasi yang kuat dan rantainya tetap relatif lurus (Tambun, 2006)
Sebagian besar minyak nabati berbentuk cair karena mengandung sejumlah asam lemak tidak jenuh, yaitu asam oleat asam linoleat, asam linolenat dengan titik cair yang rendah. Lemak hewani pada umumnya berbentuk padat pada suhu kamar karena banyak mengandung asam lemak jenuh, misalnya asam palmitat dan stearat yang mempunyai titik cair yang lebih tinggi. Secara alamiah asam lemak jenuh yang mengandung atom karbon C1
sampai C8 berwujud cair, sedangkan jika lebih besar dari C8 akan berwujud padat (Ketaren,
1986). Berbagai jenis asam lemak dan sumbernya ditunjukkan pada tabel 2.2. dan tabel 2.3.
Tabel 2.2. Contoh asam lemak tidak jenuh dan sumbernya
Nama Asam Struktur Sumber
Palmitoleat CH3(CH2)5CH=CH(CH2)7CO2H Lemak hewani
Tabel 2.3. contoh asam lemak jenuh dan sumbernya
Nama Asam Struktur Sumber
Butirat CH3(CH2)2CO2H Lemak susu
Palmitat CH3(CH2)14CO2H Lemak hewani dan nabati
Stearat CH3(CH2)16CO2H Lemak hewani dan nabati
2.3. Asam Oleat
Asam oleat atau asam heptadekana-8,1-karboksilat merupakan penyusun dari lemak-lemak tanaman atau hewan. Asam oleat dapat dipisahkan dari zat tersebut dengan cara hidrolisis, sebagian asam oleat berada bersama-sama dengan asam stearat dan asam palmitat. Struktur asam oleat adalah CH3(CH2)7CH=CH(CH2)7COOH. Asam lemak yang
tidak jenuh ini masing-masing mempunyai bentuk cis yaitu asam oleat dan trans dari asam elaidat sering juga disebut asam allooleat. Asam oleat membentuk cis karena mempunyai titik lebur yang rendah dan mempunyai panas pembakaran yang lebih tinggi (Hardjono, 2005).
Asam oleat dapat dioksidasi dengan oksidator KMnO4 maupun ozon untuk
menghasilkan asam azelat (asam 1,9-nonanadioat) dan asam pelargonat (asam nonanoat). Asam azelat tersebut bila diamidasi dengan menggunakan amonium ataupun urea dapat membentuk senyawa amida azelat (Tarigan,1998).
Asam oleat, asam linoleat dan linolenat biasanya terdapat bersama dengan asam lemak lain seperti asam laurat, asam miristat, asam palmitat, asam stearat dan asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai bentuk turunanya antara lain dalam pembentukan ester asam lemak dengan poliol seperti sorbitol, manitol dan sebagainya untuk membentuk surfaktan. Ester asam lemak dengan poliol tersebut memiliki sifat surfaktan karena disamping memiliki gugus ester juga masih memiliki gugus hidroksil sehingga terjadi keseimbangan antara gugus yang bersifat lipofil dengan gugus yang bersifat hidrofil (Tarigan, 2005).
Penelitian tentang asam oleat telah banyak dikembangkan, misalnya dalam pembuatan bahan bakar alternatif (biodiesel). Asam oleat dikonversi menjadi produk biodiesel di unit reaksi dengan penambahan alkohol dan katalis, kemudian dimurnikan di unit pemisahan (Kusmiyati, 2008).
2.5. Epoksida
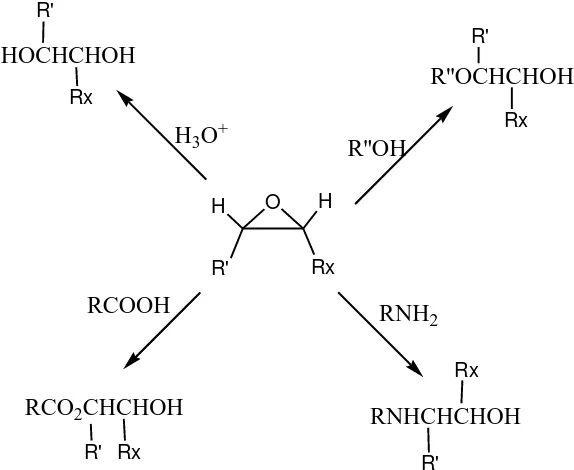
Epoksida terdiri dari tiga lingkar cincin yang mengandung oksigen dan memiliki tarikan tinggi akibat sudut ikatannya yang tajam. Eposida ini mudah terkena serangan nukleofilik karena elektronegativitas oksigen yang menyebabkan terpolarisasinya ikatan C-O (Bresnick,2002). Penamaan epoksida disebut dengan oksirana. Epoksida sederhana disebut dengan etilena oksida.
Senyawa epoksi merupakan produk komersial yang dapat diaplikasikan untuk beberapa kegunaan seperti pelentur (plasticizer), stabilizer dan coating pada resin polimer, serta merupakan anti oksidan pada pengolahan karet alam. Yamamura (1989) menyebutkan senyawa epoksi juga dapat digunakan sebagai surfaktan dan agen anti korosi, aditif pada minyak pelumas (Sadi, 1995), bahan baku pestisida (Ahmad,1984), dan meningkatkan fleksibilitas, elastisitas kekuatan dan untuk mempertahankan stabilitas polimer, dimana senyawa epoksi bertindak sebagai penerima asam HCl yang terbentuk mengkatalisa lebih jauh pemecahan polimer (thermal, fotokimia, dan oksidatif). Oleh sebab itu epoksida dalam kombinasi dengan logam alkoksida lainnya menggantikan atom klorin yang aktif sebagai ligannya. Vinyl klorida mempolimerisasi dengan mekanisme radikal bebas dan sebaiknya memberikan struktur kepala hingga ekor yang biasa, tetapi karena tidak efisiennya penyebaran dan pengakhiran, titik mulai dari degradasi lebih jauh akan terjadi. Terdapat hubungan baik antara ketidakstabilan PVC dan temperature tertinggi yang dapat diraih. Beberapa penyidik menemukan 0,9 ikatan rangkap per PVC makromolekul tetapi tehnik brominasi mengindikasikan bahwa nilai tersebut kebih rendah (Bhatnagar,M.S.2004)
mengoksidasi ikatan rangkap, sehingga terjadi pemutusan ikatan rangkap dan pembentukan gugus oksiran (Nasution,S.,2006).
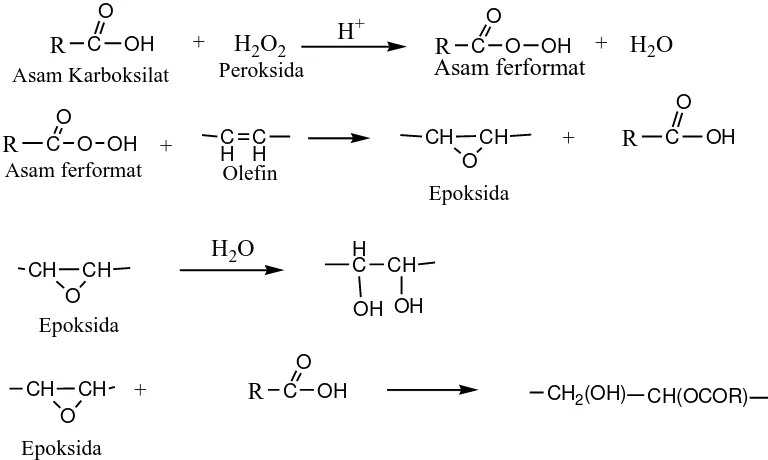
Metode yang umum digunakan untuk mensintesis epoksida adalah reaksi alkena dengan asam peroksida dan prosesnya dinamakan epoksidasi (Riswiyanto, 2002). Peroksida merupakan sumber elektrofilik oksigen dan bereaksi dengan nukleofilik ikatan dari alkena.
Alkena dapat dioksidasi menjadi aneka ragam produk, bergabung pada regensia yang digunakan. Reaksi yang melibatkan oksidasi ikatan rangkap karbon-karbon dapat dikelompokkan menjadi dua gugus umum :
1. Oksidasi ikatan π tanpa memutuskan ikatan sigma 2. Oksidasi ikatan π yang memutuskan ikatan sigma
Produk oksidasi tanpa pemutusan ikatan sigma ialah suatu epoksida atau 1,2 diol. Regensia yang paling populer dipakai untuk mengubah alkena menjadi 1,2 diol adalah larutan kalium permanganat (dalam air) basa dan dingin (meskipun biasanya reagensia ini memberikan rendemen yang rendah). Osmium tetraoksida (OsO4) diikuti dengan regensia
seperti Na2SO3 atau NaHSO3 menghasilkan diol dengan rendemen yang lebih baik, tetapi
penggunaan terbatas karena mahal dan bersifat racun (Fessenden, 1997).
Senyawa epoksida pada sintesa organik merupakan zat antara yang potensial dimanfaatkan untuk beragam bentuk senyawa dengan berbagai keperluan sehingga keperluan tentang oksidasi maupun kondisi reaksi, keberlanjutan hasil reaksi maupun manfaat hasil reaksi terus dikembangkan(Wisewan,1978).
O
Gambar 2.1. Reaksi Epoksida dengan Berbagai Senyawa Kimia
Ada empat teknik yang dapat digunakan untuk menghasilkan epoksida dari molekul olefin :
1. Epoksida dengan asam perkarboksilat yang sering digunakan dalam industri dan dapat dipercepat dengan bantuan katalis atau enzim.
2. Epoksida dengan peroksida organik dan anorganik, termasuk epoksidasi alkali dengan hidrogen peroksida nitril dan epoksida yang dikatalisis logam transisi 3. Epoksida dengan halohidrin, menggunakan asam hipohalogen (HOX) dengan
garamnya sebagai reagen, dan epoksida olefin dengan defisiensi elektron ikatan rangkap.
4. Epoksida dengan menggunakan molekul oksigen, untuk minyak nabati jarang digunakan karena dapat menyebabkan degradasi dari minyak menjadi senyawa yang lebih kecil seperti aldehid dan keton atau asam karboksilat berantai pendek sehingga oksidasi dengan O2 merupakan metode yang efisien untuk epoksida
Secara umum reaksi epoksidasi dan dilanjutkan dengan hidrolisis dituliskan sebagai
Gambar 2.2. Reaksi Epoksidasi dan Hidrolisis
2.4. Ester Asam Lemak
Ester asam lemak di alam terdapat dalam bentuk ester antara gliserol dengan asam lemak ataupun terkadang ada gugus hidroksilnya teresterkan tidak dengan asam lemak tetapi dengan phosphat seperti pada phospholipid. Disamping itu ada juga ester antara asam lemak dengan alkoholnya yang membentuk monoester seperti yang terdapat dalam minyak jojoba. Dalam hal ester asam lemak yang dimaksud adalah ester hasil sintesis ataupun transformasi maupun polialkohol.
a. Esterifikasi
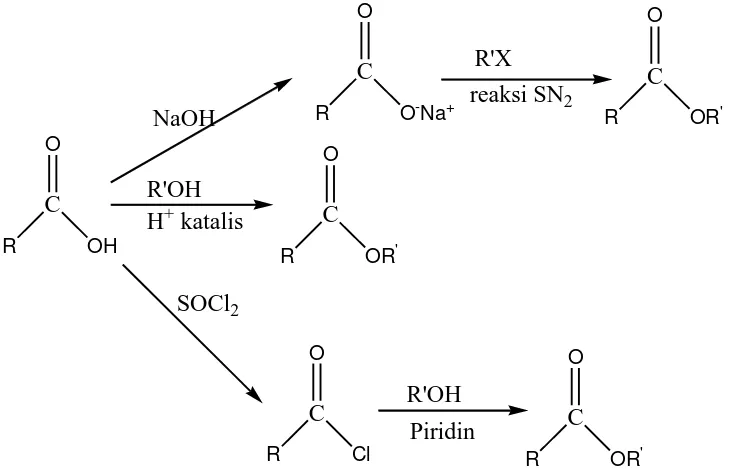
Ester merupakan turunan dari asam karboksilat, dimana dapat dibentuk melalui reaksi langsung antara suatu asam karboksilat dengan alkohol yang disebut dengan reaksi esterifikasi (Shreve,1956).
Yang dikelompokkan sebagai ester asam lemak meliputi:
1. Ester karboksilat tunggal dengan panjang rantai karbon mulai dari C6 sampai
C20
2. Ester asam lemak yang hanya mengandung karbon, hidrogen dan oksigen 3. Ester alkohol daari asam lemak tersebut diatas termasuk juga dalam kelompok ester asam lemak
Ester diturunkan dari asam dengan mengganti gugus –OH dan gugus –OR. Ester dinamai dengan cara yang sama dengan garam asam karboksilatnya. Bagian R dari gugus – OR ditulis dahulu, diikuti dengan nama asam dengan akhiran –at. Bila asam karboksilat dan alkohol dipanaskan dengan kehadiran katalis asam (biasanya HCl atau H2SO4)
kesetimbangan tercapai dengan ester dan air, proses ini disebut dengan esterifikasi Fischer (Hart, 2003).
Ester biasanya dipreparasi dari asam atau klorida asam. Asam karboksilat diubah secara langsung menjadi ester melalui reaksi substitusi nukleofilik (SN2) garam karboksilat
dengan alkil halida primer atau melalui reaksi asam dengan alkohol. Klorida asam dikonversikan menjadi ester melalui reaksi dengan alkohol dalam suasana basa (Murry, 1994).
Gambar 2.3. Reaksi Esterifikasi dengan Berbagai Macam Katalis
Banyak senyawa ester yang terdapat di alam memiliki aroma, seperti metil butanoat yang merupakan minyak dalam buah nanas dan isopentil asetat yang terdapat dalam buah pisang. Senyawa ester sintesis dalam industri digunakan untuk berbagai macam produk, seperti dialkil ftalat sebagai plastilizer (menjadikan plastik rapuh) pelarut dan sebagainya (Riswiyanto, 2002).
sebagai reaksi antara asam karboksilat dan alkohol (Gandhi, 1997). Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam klorida), dengan berbagai variasi alkohol biasanya metanol, etanol, 1-propanol, 1-butanol, amyl alkohol, dan lain-lain (Ozgulsun, 2008). Asam anorganik yang digunakan sebagai katalis akan menyebabkan asam karboksilat mengalami konjugasi sehingga asam konjugat dari asam karboksilat tersebutlah yang akan berperan sebagai substrat.
Cara lain dalam pembentukan ester adalah dengan melewatkan HCl kedalam campuran reaksi tersebut dan direfluks. Cara ini dikenal dengan nama metode Fischer-Speier. Esterifikasi tanpa katalis dapat juga dilakukan dengan satu molekul asam karboksilat dan satu pereaksi secara berlebih. Pertambahan hasil juga dipengaruhi oleh dehidrasi yang artinya menarik air yang terbentuk sebagai hasil samping reaksi. Air dapat dipisahkan dengan cara menambahkan pelarut yang bersifat non polar seperti misalnya benzen dan kloroform sehingga air yang terbentuk akan segera terikat pada pelarut yang digunakan atau dengan manambahkan molekular sieves (Yan, 2001).
Esterifikasi asam karboksilat dengan asam alkohol merupakan reaksi reversibel. Bila asam karboksilat diesterkan, digunakan alkohol berlebih. Untuk membuat reaksi kebalikannya, yakni hidrolisis berkataliskan asam dari ester menjadi asam karboksilat digunakan air berlebihan. Kelebihan air akan menggeser kesetimbangan ke arah sisi asam karboksilat (Fessenden, 1999).
2.6. Penggunaan Alkil Ester
Dengan bertambah majunya ilmu pengetahuan, senyawa ester asam lemak sudah banyak diperoleh secara sintesis, misalnya alkil ester sederhana, ester dari alkohol, ester
aromatik, ester dari polihidroksi alkohol dan ester kompleks seperti selulosa, tepung dan senyawa-senyawa yang sejenis (Markley, 1961).
proses destilasi fraksinasi dibandingkan dengan asam lemak karena alkil ester mempunyai titik didih yang lebih rendah (Farris, 1979).
Ester asam lemak telah memulai peranan penting dari segi komersial. Karena merupakan bahan yang penting dalam industri kosmetik, tekstil, karet, plastik dan minyak pelumas (Rain, 1995).
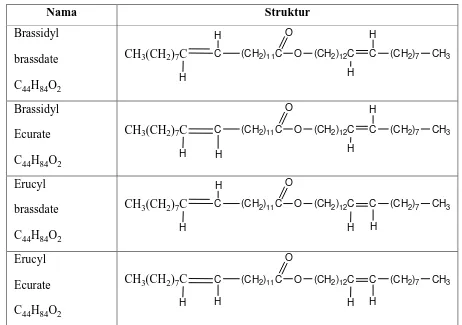
Sebagai contoh yang dikenal populer adalah monoester dari minyak jojoba. Beberapa monoester dari minyak tersebut adalah sebagai tertera pada gambar dibawah ini :
Nama Struktur
Gambar 2.4. Senyawa monoester dari minyak jojoba (Galun shaubi,1984)
Minyak jojoba yang berasal dari biji tumbuhan semak dari tanah gurun yang dikenal sebagai tumbuhan Simmoadsia. Minyak jojoba yang bersal dari tumbuhan ini sangat stabil terhadap oksidasi dan memiliki rasa yang lembut serta rasa yang nyaman pada permukaan kulit tanpa adanya bekas sinar bahan berminyak (Wilson, 1992).
yang mendekati sifat lilin minyak alam tersebut. Diantaranya dengan mereaksikan oleil alkohol dengan asam oleat dengan adanya katalis zeolit-y untuk monoester oleil oleat (Sanches, 1992).
Oleil oleat juga telah di esterifikasi dengan cara mereaksikan oleil klorida dengan natrium oleat yang menggunakan tridodekilamina hidroklorida sebagai katalis perpindahan dua fase (Brahmana, 1993). Ester asam lemak banyak juga digunakan sebagai surfaktan seperti ester sukrosa, glukosa, sorbitol, fruktosa dengan menggunakan pelarut dimetil formamida pada suhu tinggi (Hajime, 1984).
Ester-ester asam lemak merupakan grup yang sangat besar dari senyawa-senyawa yang terdiri dari ester alam dan sintesis. Ester sintesis ini termasuk alkil ester sederhana ester dari alkohol aromatik, ester dari alkohol polihidrat dan ester yang lebih kompleks seperti selulosa dan pati.
Metil ester asam lemak dapat ditransformasikan menjadi beberapa senyawa kimia lain yang banyak kegunaannya dan juga bahan baku untuk sintesis lanjut seperti
penggunaan metil ester sebagai bahan untuk memproduksi alkanolamida yang digunakan langsung sebagai surfaktan non ionik, emulsifier, pengental dan bahan pembantu dalam pembuatan sifat plastis. Sedangkan asam lemak alkohol digunakan sebagai aditif dalam bidang farmasi dan kosmetik (C16-C18), sebagai pelumas dan bahan pembantu dalam
pembuatan sifat plastis, tergantung pada panjang rantai karbonnya. Sedangkan isopropil ester juga digunakan sebagai bahan pembantu dalam pembuatan plastis dan emolien. Metil ester asam lemak lebih lanjut digunakan dalam pembuatan ester asam lemak karbohidrat (sukrosa polyester) yang diaplikasikan sebagai surfaktan non ionik atau minyak makan non kalori. Disamping itu, ester asam lemak karbohidrat juga dapat digunakan sebagai bahan bakar alternatif pengganti atau substituen untuk mesin diesel (Manurung, 2006)
Ester alkil dari asam-asam lemak yang berasal dari minyak nabati atau lemak hewani yang mengandung trigliserida dapat digunakan sebagai bahan bakar alternatif dengan reaksi esterifikasi atau reaksi transesterifikasi ( Joelianingsih, 2006). Saat ini perhatian atas rekayasa pada reaksi esterifikasi dan produk esternya telah semakin meningkat, terutama setelah alkil ester (metil ester, etil ester dan profil ester) memiliki karakteristik sebagai solar bio, sehingga dapat menggantikan bahan bakar fosil (Susanto,2008). Secara kimia
biodiesel merupakan mono alkil ester atau metil ester dengan jumlah rantai atom C antara 12 sampai dengan 20 ( Darnoko, 2001 ).
Biodiesel memiliki persamaan sifat fisis dan sifat kimia dengan petroleum diesel (solar) sehingga biodiesel dapat juga dijadikan salah satu campuran solar yang digunakan untuk bahan bakar mesin-mesin diesel (Bustaman, 2009).
Biodiesel adalah salah satu jenis bahan bakar nabati (BBN) yang diperoleh melalui
proses transesterifikasi minyak dengan bantuan metanol dan natrium hidroksida (NaOH)
sebagai katalis. Biodiesel dapat diperoleh melalui suatu reakasi yang disebut reaksi
esterifikasi asam lemak bebas atau reaksi transesterifikasi trigliserida dengan alkohol dengan bantuan katalis asam atau basa. Reaksi transesterifikasi minyak nabati dapat dilakukan dengan mereaksikan minyak yang merupakan trigliserida dengan alkohol dengan katalis asam atau basa, dan dihasilkan alikil ester asam lemak dengan hasil samping gliserol. Perbedaan bahan baku minyak atau lemak yang digunakan dalam pembuatan biodiesel berpengaruh pada jalannya reaksi yang ditempuh dan kualitas serta rendemen metil ester atau biodiesel yang dihasilkan.
H2C
Sumber utama minyak/lemak (trigliserida) yang potensial untuk dikembangkan sebagai bahan baku biodiesel adalah minyak sawit atau crude palm oil (CPO), minyak jarak pagar atau Crude Jatropha Curcas Oil (CJCO) (Hariadi, 2005) dan juga dari limbah dapat limbah industri sawit yang disebut minyak parit atau CPO-parit (Wirawan,2004)
2.7. Spektrofotometri Inframerah
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah vibrasi molekul yang di deteksi dan diukur pada spektrofotometer inframerah. Spektra di daerah merah dapat dipergunakan untuk mempelajari sifat-sifat bahan, perubahan struktur yang sedikit saja dapat memberikan perubahan yang dapat diamati pada spektrogram panjang gelombang vs transmitansi. Perubahan ini sangat spesifik dan merupakan sidik jari suatu molekul dengan membandingkan spektogram yang dihasilkan oleh bahan yang diuji terhadap bahan yang sudah diketahui secara kualitatif.
Penerapan secara kualitatif dapat dilakukan dengan membandingkan fungsi peak (% transmitan) pada panjang gelombang terkait yang dihasilkan oleh zat-zat yang diuji dan zat standart. Spektra inframerah terutama ditujukan untuk senyawa organik yaitu gugus fungsi yang dimiliki oleh senyawa tersebut.
Spektra inframerah biasanya merupakan spektrofotometer berkas ganda dan terdiri dari empat bagian utama yaitu sumber cahaya, monokromator, kisi difraksi, dan detektor. 1. Sumber cahaya berfungsi untuk memberikan panjang gelombang yang diperlukan untuk
2. Monokromator berfungsi untuk mengurangi spektrum sinar menjadi berbagai spektra sesuai dengan urutan panjang gelombang yang dianalisa yang diperoleh melalui sebuah slit (celah) panjang gelombang.
3. Contoh ditempatkan pada sebuah sel yang dibuat khusus. Syarat umum dari sel untuk contoh ini adalah transparan terhadap panjang gelombang yang digunakan. Berarti sel untuk inframerah harus transfaran terhadap sinar inframerah. Umumnya sel ini terbuat dari NaCl yang memiliki sifat kekerasan yang mudah larut dalam air.
4. Detektor yang digunakan juga bermacam-macam sesuai dengan tipe instrumenya. Untuk spektrofotometer infra double beam, data pengukuran transmitans dari sampel diolah dan ditampilkan dalam betuk spektogram (grafik) yang menggambarkan hubungan antara frekuensi dan persen (%) transmitans. Spektogram ini berguna untuk identifikasi secara kualitatif. Alat-alat yang modern kebanyakan menggunakan detektor
“Thermopile”. Dasar kerja thermopile adalah sebagai berikut : jika 2 kawat logam yang
berbeda dihubungkan antara ujung kepala dan ekor akan menyebabkan adanya arus yang mengalir dalam kawat. Arus yang mengalir akan sebanding dengan intensitas radiasi yang jatuh dalam thermopile (Braun, 1987).
2.8. Resonansi Magnet Inti Proton
Resonansi magnetik inti proton tipe NMR merupakan suatu metode analisa penentuan susunan dari gugus fungsi yang pertama sekali diterima dan digunakan secara luas dalam analisa kimia dan hingga sekarang merupakan bentuk NMR yang paling luas pemakaiannya.
Perubahan dari frekuensi spektral peak antara yang terobsevasi untuk semua inti atom dalam suatu senyawa referensi dengan yang terobsevasi untuk inti atom yang diselidiki adalah merupakan pergeseran kimia (chemical shift) dan merupakan karakteristik dari elektron di sekeliling proton yang dipengaruhi oleh efek induksi berbagai gugus yang bekerja melalui ikatan kimia yang terdapat dalam proton, oleh medan magnet yang bekerja melalui ruang. Medan magnet yang dihasilkan oleh ikatan kimia bersifat anisotrop yang menentang medan magnet akan mengakibatkan resonansi proton bergeser ke arah medan magnet yang lebih tinggi (efek perisai). Sedangkan efek anisotrop yang memperkuat medan magnet yang digunakan mengakibatkan pergeseran resonansi proton ke arah medan magnet yang lebih rendah (efek awan perisai).
Senyawa referensi dipakai dalam pengukuran NMR karena perubahan dalam intensitas magnetik flux yang dibutuhkan untuk mengabsorbsi dari inti atom yang identik dalam lingkungan yang berbeda adalah kecil. Untuk studi proton, senyawa referensi tetra metil silan [Si(CH3)4]. TMS (tetra metil silan) dipilih karena semua proton dalam senyawa
BAB 3
METODE PENELITIAN
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah : - Spektroskopi 1H-NMR Jeol - Spektrofotometer FT-IR Shimadzu - Refraktometer
- Rotarievaporator Heidolph - Alat Vakum Fisons - Hotplate Stirrer Fisons
- Neraca Analitis Mettler PM 480 - Gelas Erlenmeyer 250 ml Pyrex
- Gelas Ukur 100 ml Pyrex - Gelas Beaker 250 ml Pyrex - Tabung CaCl2 Pyrex
- Corong Pisah Pyrex - Corong Penetes Pyrex - Botol Akuades
- Magnetik Bar
3.2 Bahan-Bahan
Bahan – bahan yang digunakan dalam penelitian adalah:
- Natrium Sulfat Anhidrous p.a.(E.Merck) - Asam Sulfat 98% p.a.(E.Merck) - Akuades
- Asam Formiat 90% p.a.(E.Merck)
- Hidrogen Peroksida 30% p.a.(E.Merck)
- Dietil Eter p.a.(E.Merck) - Propanon p.a.(E.Merck)
- CaCl2 anhidrous p.a.(E.Merck)
- Asam oleat Teknis
- n-pentanol p.a.(E.Merck) - Benzena p.a.(E.Merck)
- Amilum p.a.(E.Merck)
- K2Cr2O7 p.a.(E.Merck)
- Na2S2O3 p.a.(E.Merck)
- Larutan Wijs p.a.(E.Merck)
- Sikloheksan p.a.(E.Merck)
3.3. Prosedur Penelitian
3.3.1. Pembuatan Reagen dan Standarisasi
3.3.1.1. Pembuatan Larutan KI 10%
Kristal kalium iodida (KI) ditimbang sebanyak 10 gram, kemudian dilarutkan dengan
aquadest dalam labu takar 100 ml hingga garis batas.
3.3.1.2. Pembuatan Larutan Indikator Amilum
Ditimbang 1 gram serbuk amilum dan dilarutkan dengan 100 ml akuades dan dipanaskan sambil diaduk di atas pemanas hingga mendidih dan disaring dalam keadaan panas.
3.3.1.3. Pembuatan Larutan Standart Natrium Tiosulfat 0,1 N
Ditimbang 6,25 gram kristal Na2S2O3.5H2O dilarutkan dengan akuades dan
diencerkan dalam labu takar 250 ml sampai garis tanda lalu distandarisasi dengan larutan K2Cr2O7 0,1 N menggunakan indikator amilum mengikuti titrasi secara iodometri
3.3.1.4. Pembuatan Larutan K2Cr2O7 0,1 N
Ditimbang 7,7 gram serbuk K2Cr2O7 dilarutkan dengan aquadest dan diencerkan dalam
labu takar 250 ml sampai garis tanda.
3.3.2 Esterifikasi Asam Oleat dengan n-Pentanol
Kedalam labu leher dua 500 ml dimasukkan sebanyak 50 ml asam oleat,
ditambahkan 25 ml n-pentanol dan diikuti dengan 50 ml benzen. Kemudian sambil diaduk dalam keadaan dingin (es batu), melalui corong penetes ditambahkan secara perlahan-lahan 2 ml H2SO4 pekat. Campuran kemudian direfluks pada suhu 80o C selama 5 jam. Hasil
reaksi kemudian diuapkan dengan rotarievaporator, residu dilarutkan dengan 100 ml dietil eter. Lapisan eter dicuci dengan 10 ml aquadest sebanyak 2 kali. Hasil pencucian
dikeringkan dengan CaCl2 anhidrous selanjutnya setelah disaring diikuti pengeringan
menggunakan Na2SO4 anhidrous kemudian disaring kembali. Filtrat hasil penyaringan
3.3.3 Epoksidasi n-Pentil Oleat Menjadi Epoksida
Kedalam labu leher dua 500 ml, dimasukkan sebanyak 30 ml asam formiat (HCOOH 90%) dan ditambahkan 30 ml H2O2 30 % secara perlahan-lahan kemudian sambil diaduk
melalui corong penetes ditambahkan 2 ml H2SO4 pekat, kemudian dipanaskan pada suhu
40-45oC selama satu jam. Selanjutnya melalui corong penetes ditambahkan secara perlahan-lahan n-pentil oleat sebanyak 25 ml. Dipertahankan suhu pemanasan pada temperatur 40-45oC sambil diaduk selama 2 jam. Hasil reaksi (epoksida n-pentil oleat) dipisahkan dari fase air dan dilakukkan analisa spektroskopi FT-IR.
3.3.4 Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi
10-Hidroksi n-Pentil Stearat Campuran
Kedalam labu leher dua 500 ml yang dihubungkan dengan penangas air, pengaduk magnit dan kondensor bola dimasukkan sebanyak 15 ml n-pentanol, kemudian sambil diaduk dalam keadaaan dingin melalui corong penetes ditambahkan 1 ml H2SO4 pekat.
Kedalam campuran ini sambil diaduk dalam keadaan dingin secara perlahan-lahan
ditambahkan 30 ml propanon (aseton) dan dilanjutkan penambahan epoksida n-pentil oleat melalui corong penetes. Campuran direfluks selama 5 jam. Hasil reaksi kemudian diuapkan dengan rotarievaporator, residu dilarutkan dalam 80 ml dietil eter. Lapisan eter dicuci dengan 25 ml aquadest sebanyak 3 kali. Hasil pencucian dikeringkan dengan CaCl2
anhidrous kemudian disaring diikuti pengeringan dengan Na2SO4 anhidrous kemudian
3.4 Analisa Hasil Reaksi
3.4.1 Analisa dengan Spektroskopi FT-IR
Masing-masing cuplikan dari asam oleat, n-pentil oleat, epoksida n-pentil oleat, dan senyawa 9 n-pentoksi 10-hidroksi n-pentil stearat campuran dioleskan pada plat KBr hingga terbentuk lapisan tipis yang transparan, selanjutnya diukur spektrumnya dengan alat spektrofotometer FT-IR model I.R-420.
3.4.2 Analisa dengan Spektroskopi 1H-NMR
Cuplikan senyawa 9 n-pentoksi 10-hidroksi n-pentil stearat campuran hasil sintesa dilarutkan dalam CDCl3, selanjutnya diukur spektrumnya dengan spektrofotometer
resonansi magnet inti proton model Delta2-NMR 500 MHz, serta digunakan tetra metil silan (TMS) sebagai pembanding.
3.4.3 Penentuan Asam Lemak Secara Kromatografi Gas
Metil oleat yang diperoleh dari reaksi antara asam oleat dengan metanol
menggunakan katalis H2SO4 diinjeksikan melalui injektor alat kromatografi gas merek
Shimadzu GC-02, untuk pemisahan dan identifikasi serta penentuan kuantitatif asam lemak melalui kromatogram. Kondisi kromatografi gas yang sesuai untuk pemisahan ini adalah sebagai berikut :
- Panjang kolom : Packed Glass 3,1 Meter - Diameter kolom : 3 mm
- Fase diam : Dietilen Glikol Suksinat (DEGS) - Fase gerak : Gas Nitrogen
- Suhu Kolom : 190o C - Suhu injektor : 220o C - Suhu detektor : 230o C
- Detektor : Flame Ionization Detector (FID) - Tekanan Nitrogen : 300 Kpa
3.4.4 Penentuan Bilangan Iodium
Analisis ini dilakukan terhadap n-pentil oleat dan senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran.
Ditimbang sampel sebanyak ± 0,2 gram ke dalam gelas Erlenmeyer 250 ml yang bertutup lalu ditambahkan 20 ml sikloheksana kemudian dikocok/diguncang untuk memastikan sampel telah benar-benar larut. Ditambahkan 25 ml larutan Wijs kedalamnya kemudian ditutup dan dikocok agar campuran telah benar-benar bercampur dan disimpan bahan tersebut dalam ruang gelap selama ± 30 menit. Diambil bahan tersebut dari tempat penyimpanan dan ditambahkan 25 ml larutan KI 10% dan 150 ml air suling. Dititrasi dengan larutan Na2S2O3 0,1 N sampai warna kuning hampir hilang (kuning pucat).
Ditambahkan 1-2 ml indikator amilum ke dalamnya dan dititrasi kembali sampai warna biru hilang.
Dilakukan hal yang sama terhadap larutan blanko dan dihitung dengan:
Bilangan iodin =
Dimana: B = Volume Titrasi Blanko(ml) S = Volume Titrasi Sampel(ml) N = Normalitas Na2S2O3
M = massa
3.4.5 Penentuan Nilai Indeks Bias
3.5 Bagan Penelitian
3.5.1 Esterifikasi Asam Oleat dengan n-Pentanol
50 ml asam oleat
ditambahkan 25 ml pentil alkohol
ditambahkan 50 ml benzen
ditambahkan 2 ml H2SO4 pekat setetes demi setetes melalui corong penetes sambil di dinginkan
dipanaskan pada suhu 80o C selama 5 jam
dirotarievaporator
residu filtrat
dilarutkan dengan 100 ml dietil eter
dicuci dengan 10 ml aquadest sebanyak dua kali
dikeringkan dengan CaCl2 anhidrous
filtrat residu
dikeringkan dengan Na2SO4 anhidrous disaring
filtrat residu
diuapkan dengan rotarievaporator
residu filtrat
analisa FT-IR
dimasukkan ke dalam labu leher dua
analisa bilangan iodin
3.5.2 Epoksidasi n-Pentil Oleat Menjadi Epoksida
30 ml asam formiat 90%
ditambahkan 30 ml H2O2 30% secara perlahan-lahan sambil diaduk
ditambahkan H2SO4 pekat secara perlahan-lahan
ditambahkan 25 ml pentil oleat secara perlahan-lahan
dipanaskan pada suhu 40-45o C selama 2 jam dipanaskan selama satu jam pada suhu 40-45oC
dipisahkan dari fase air
lapisan atas lapisan bawah
analisa FT-IR
3.5.3 Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi 10-
Hidroksi n-Pentil Stearat Campuran
15 ml n-pentanol
dimasukkan kedalam labu leher dua
ditambahkan 1 ml H2SO4 setetes demi setetes melalui corong penetes sambil didinginkan
ditambahkan 30 ml propanon secara perlahan-lahan ditambahkan secara perlahan-lahan epoksida pentil oleat melalui corong penetes
campuran direfluks selama 5 jam pada suhu 60oC diuapkan dengan rotarievaporator
dilarutkan dengan dietil eter sebanyak 80 ml dicuci dengan aquadest 25 ml sebanyak tiga kali
lapisan atas lapisan bawah
dikeringkan dengan CaCl2 anhidrous disaring
filtrat residu
dikeringkan dengan Na2SO4 anhidrous disaring
filtrat residu
hasil
diuapkan
analisa 1H-NMR analisa bilangan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Esterifikasi Asam Oleat dengan n-Pentanol
Asam oleat yang digunakan masih tercampur dengan asam lemak lainnya diperoleh dari salah satu industri oleokimia di Sumatera Utara dengan kemurnian berdasarkan hasil analisa kromatografi gas memberikan kromatogram kandungan asam lemak yang terdiri dari C12 = 0,1085%; C14 = 0,4827%; C16 = 9,3635%; C18 = 3,2038; C18:1 = 82,00%, C18:2
= 1,7801%; C18:3 = 1,6814%; dan C20 = 0,1989% (Lampiran A). n-Pentil Oleat dari hasil
Gambar 4.1. Spektrum FT-IR n-Pentil Oleat
4.1.2 Epoksidasi n-Pentil Oleat Menjadi Epoksida
Gambar 4.2. Spektrum FT-IR dari Epoksi n-Pentil Oleat
4.1.3. Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi
10-Hidroksi n-Pentil Stearat Campuran
Epoksida dari pentil oleat yang diperoleh kemudian di alkoksilasi dengan n-pentanol menggunakan pelarut aseton dan katalis asam sulfat melalui pemanasan pada 600 C selama 5 jam akan diperoleh senyawa 9-n-Pentoksi 10-Hidroksi n-pentil stearat
Gambar 4.3. Spektrum FT-IR 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran
Gambar.4.4.a. Spektrum 1H-NMR 9-n-Pentoksi 10-hidroksi n-Pentil Stearat Campuran
Gambar 4.4. c. Spektrum 1H-NMR 9-n-Pentoksi 10-hidroksi n-Pentil Stearat Campuran Ekspansi
4.2Pembahasan
4.2.1 Esterifikasi Asam Oleat dengan n-Pentanol
Pentil oleat diperoleh dari reaksi antara asam oleat dengan n-pentanol menggunakan katalis H2SO4 dengan reaksi sebagai berikut :
H3C (CH2)7 CH CH (CH2)7 C O
OH
+ H3C (CH2)4 OH
H2SO4
Benzen
H3C (CH2)7 CH CH (CH2)7 C O
O (CH2)4 CH3
n-Pentil Oleat
+ H2O
Asam Oleat n-Pentanol
Hasil analisa dengan menggunakan spektroskopi FT-IR memberikan puncak serapan pada daerah bilangan gelombang 3004,22 cm-1 merupakan puncak serapan untuk –C–H sp2 dari gugus –CH=CH– dan di dukung dengan serapan pada bilangan gelombang 1619,94 cm-1 yang merupakan serapan khas dari ikatan C=C. Pada bilangan gelombang 1739,0 cm-1 merupakan serapan khas gugus karbonil (C=O) dari ester dan didukung dengan puncak vibrasi C–O–C pada daerah bilangan gelombang 1169.9 cm-1, sehingga dapat disimpulkan adanya gugus ester. Serapan pada daerah bilangan gelombang 2854,0 cm-1 menunjukkan adanya vibrasi streching daari C–H sp3 yang didukung vibrasi bending C–H sp3 pada bilangan gelombang 1465,9 cm-1. Pada daerah bilangan gelombang 723 cm
-1
merupakan vibrasi CH2 pada –(CH2)n–dimana n ≥4
4.2.2. Epoksidasi n-Pentil Oleat Menjadi Epoksida
Hasil epoksidasi dari n-pentil oleat dengan asam ferformat (HCOOOH)
menggunakan katalis H2SO4 untuk menghasilkan senyawa epoksida memberikan reaksi
sebagai berikut :
ester dan didukung dengan puncak vibrasi C-O-C pada daerah bilangan gelombang 1179,22 cm-1. Pada daerah bilangan gelombang 2855,10 cm-1 menunjukkan adanya vibrasi streching dari C-H sp3 yang didukung vibrasi bending C-H sp3 pada bilangan gelombang 1465,33 cm-1. Hilangnya puncak vibrasi pada daerah bilangan gelombang 1619,94 cm-1 menunjukkan bahwa ikatan π pada ikatan rangkap (–CH=CH–) telah dioksidasi membentuk epoksida.
4.2.3 Alkoksilasi Senyawa Epoksida dengan n-Pentanol Menjadi 9-n-Pentoksi 10-
Hidroksi n-Pentil Stearat Campuran
Epoksida yang terdiri dari tiga lingkar cincin yang mengandung oksigen dan memiliki elektronegatifitas oksigen menyebabkan epoksida mudah diserang oleh nukleofil, sehingga alkoksilasi dilakukan secara in-situ.
Alkoksilasi dengan n-pentanol terhadap senyawa epoksida n-pentil oleat menggunakan katalis asam Bronsted yang mana mula-mula terjadi protonasi terhadap epoksida yang selanjutnya senyawa epoksida yang terprotonasi diserang nukleofil dari pentil alkohol mengikuti reaksi SN2, dan secara hipotesis berdasarkan keberadaan aliran elektron (electron flow) gugus pentoksi (n-C5H11O) akan terikat pada atom C9 dan reaksi
yang terjadi digambarkan sebagai berikut :
Terbentuknya perubahan dari n-pentil oleat menjadi 9-n-pentoksi 10-hidroksi n-pentil stearat secara kualitatif memberikan hasil pemeriksaan nilai indeks bias terjadi perubahan dimana untuk senyawa pentil oleat n = 1,4552; sedangkan 9-pentoksi 10-hidroksi n-pentil stearat campuran n = 1,4422. Demikian juga didukung atas hasil pemeriksaan masing-masing nilai bilangan iodin dimana untuk senyawa n-pentil oleat sebesar = 60,77; sedangkan 9-n-pentoksi 10-hidroksi n-pentil stearat campuran sebesar 20,27.
Senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran yang diperoleh dianalisa dengan spektroskopi FT-IR menghasilkan spektrum seperti pada gambar 4.3 memberikan puncak serapan pada daerah bilangan gelombang 3447,77 cm-1 yang merupakan serapan khas gugus OH. Pada daerah ini puncak serapan semakin melebar yang menunjukkan gugus hidroksil semakin banyak. Pada bilangan gelombang 2957,11-2856,18 menunjukkan serapan khas dari vibrasi bending CH sp3. Pada bilangan gelombang 1058,51 menunjukkan serapan khas dari gugus C-O-C dan pada bilangan gelombang 1737,19 cm-1 menunjukkan serapan khas karbonil (C=O) menunjukkan adanya gugus ester, dan pada 722 cm-1 menunjukkan gugus –(CH2)n–dimana n ≥ 4
S
elanjutnya dukungan hasil analisa spektroskopi 1H-NMR memberikan spektrum (gambar 4.4.) dengan puncak-puncak pergeseran kimia (δ) pada daerah 0,8-0,9 ppm puncak triplet menunjukkan 9 buah proton masing-masing pada 3 buah gugus –CH3 (A),pergeseran kimia (δ) pada daerah 1,18-1,3 ppm puncak multiplet menunjukkan 24 buah
proton dari sebanyak 12 buah gugus metilen (-CH2-) (B). Pergeseran kimia (δ) = 1,33 ppm
puncak triplet menunjukkan 4 buah proton dari sebanyak 2 buah gugus -CH2- (C),
pergeseran kimia (δ) = 1,4 ppm puncak quartet menunjukkan 4 buah proton dari sebanyak
2 buah gugus -CH2- yang masing-masing berikatan dengan -CH- yang mengikat atom –O–.
Pergeseran kimia (δ) pada daerah 1,45 ppm puncak quartet menunjukkan 4 buah proton
dari 2 buah gugus –(CH2)– yang masing-masing berikatan dengan –CH– (E), pergeseran
kimia(δ) pada daerah 1,6-1,7 ppm puncak multiplet juga menunjukkan 2 buah proton pada
–(CH2)– (F). Selanjutnya pergeseran kimia (δ) = 2,2-2,3 ppm puncak triplet menunjukkan 2
buah proton –(CH2)–α yang berikatan dengan gugus C=O (G), pergeseran kimia (δ) pada
(I), pergeseran kimia (δ) pada daerah 3,59 ppm puncak triplet menunjukkan 1 buah proton pada –CH– yang terikat pada gugus –OH (J). Puncak pergeseran kimia (δ) = 4,1 ppm puncak triplet menunjukkan 2 buah proton pada –(CH2)– yang berikatan dengan atom –O–
pada gugus pentil (K) dan pergeseran kimia (δ) pada daerah 5,1 ppm menunjukkan 1 buah proton dari gugus hidroksil (Gambar 4.5).
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran dapat disintesis dari asam oleat melalui reaksi esterifikasi, epoksidasi yang diikuti dengan reaksi alkoksilasi dengan n-pentanol
2. Dari 50 ml (44,75 gram, 0,1584 mol) asam oleat yang digunakan diperoleh 23,58 gram (58,10%) senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran.
5.2. Saran
Daftar Pustaka
Ahmad,S.,F.Ahmad, and S.M.Osman.1984.Derivatization of Keto Fatty Acids: V.Synthesis and Characterization of 1,3-Dioxolan. J.Am.Oil.Chem.Soc.61(9).
Arismunandar,W.2006.P elumas dan P erkembangnnya Pada The First Inonesia Fuel and Lubes Conference & Exhibition.
Bambang,S.2006. Inovasi dan teknologi biodiesel.edisi 1.trubus agrisarana.jakarta. Bhatnagar,M.S.2004.A Textbook of Polymers.Volume 3.First Edition.New Delhi.
Brahmana,H.R.,1993.Reaksi Esterifikasi Alkil Klorida dengan Garam Asam Lemak Berantai Panjang yang Menggunakan Tridodekilamin Hidroklorida Sebagai Katalis Perpindahan Dua Fasa. Dalam Komunikasi Penelitian 5,170.
Brahmana,H.R.,Ginting,M.,Ginting,A., dan Tarigan,M.1994.Sintesis Alkil Ester dan Ester Sellulosa Turunan Asam Lemak Kelapa Sawit (CPO) dan Inti Sawit (CPKO) dengan Natrium Sellulosa Pinus Merkusi. Artikel Ilmiah Hibah Bersaing I/2 Perguruan Tinggi.
Braun,R.D.,1987. Introduction to Instrumental Analysis, USA, Mc Graw Hill Book Co,465-541.
Bresnick.S.2002.Kimia Organik.Jakarta Erlangga:Hipokrates
Bustaman,S.2009.Strategi Pengembangan Industri Biodiesel.Bogor : Balai Pengkajian dan Pengembangan Teknologi Pertanian.
Christie,W.W.,1992.Lipid Analysis. New York :Pergoman Press
Darnoko, and Cheryan,M.,2000.Continous Production of Palm Methyl Esters. J.Am.Oil.Chem.Soc.No.77.
Davidek,J.J.Valisel and Pokorny.1990.Chemical Changes During Food Processing Devolepment In Food Science 21.Elsevier.
Endo,Y.H.Sanae dan F.Kenshiro.,1997.Autooksidation of Synthetic Isomers of Tryacylglicerol Containing Escosapentaenoic acid. J.Am.Oil.Chem.Soc.77,11 Fangrui,M.A.,1999.Biodiesel Fuel: The Transesterification of Beef Tallow. The University
Of Nebrasca.Lincoln.
Gan,L.H.,S.H.Goh, dan K.S.Ooi.1992.Kinetics Studies of epoxidation and oxirane cleavage of palm olein Methyl Ester.J.Am.Oil Chem.Soc.69 :347-351.
Ghandi, N.N. 1997. Application of Lipase. J. Am.Oil Chem. Soc. 74, 6.
Goud.V.V.,Pradhan,N.C.,dan Patwardan,A.V.2006.Epoxidation Of Karanja Oil by H2O2.USA:J.Am.Oil.Chem.Soc.Vol.83.635.
Hajime,S dan Uchibori, T.,1984.Enzimatic Synthesis of Carbohydrate Ester of Fatty Acids Estherification of Sucrosa, Glukosa, Fruktosa and Sorbitol. Jaoca,64
Hariadi.M.S.2005.Budidaya Tanaman Jarak Sebagai Bahan Alternatif dalam Forum Diskusi Tema prespektif Sumber Daya Lokal Bioenergi Bidang Siteknas.
Harry.O’kuru,R.G.,Gordon,S.H.,and Blawos.A.2005.A Facile Synthesis of Aminihidroxy
Triglyserides From New Crop Oil.USA:J.Am.Oils.Chem.Soc.Vol.82.207. Hart.H.2003.Kimia Organik.Edisi Kesebelas.Jakarta.Erlangga.
Joelianingsih.2006.Perkembangan Proses Pembuatan Biodiesel Sebagai Bahan Bakar Nabati.Jurnal Keteknikan Pertanian IPB.
Ketaren,S.1986.P engantar Teknologi Lemak dan Minyak Pangan.Edisi I.Jakarta:UI-Press. Kusmiyati.2008. Reaksi Katalitis Esterifikasi Asam Oleat dan Metanol Menja di Biodiesel
dengan Metode Destilasi Reaktif. Surakarta: Teknik Kimia Fakultas Teknik Universitas Muhammadiyah. Reaktor, Vol. 12 No.2.
Manurung,R.2006.Transesterifikasi Minyak Nabati.Jurnal Teknologi Proses.Departemen Teknik Kimia.Fakultas Teknik USU.
Markley,S.K.1961.Fatty Acid.Part 1,2.Interscience Publisher Inc.New York.London. Meffert.A.1984.Technical Uses of Fatty Acid Ester.J.Am.Oil.Chem.Soc.
Mukhozim,F.2006.Pemanfaatan Asam Olest dari Minyak Kelapa Sawit Sebagai Bahan Dasar Dalam Sintesis Poliuretan.
Murry.1994.Fundamental of Organic Chemistry.California:Cole Publishing Company. Nasution,s.,2006.Pembuatan Senyawa Epoksi dari Metil Ester Asam Lemak Sawit Destilat
Menggunakan Katalis Amberlite.Tesis. FT-Kimia.USU.
Ocha,D.2009.Studi Alkoksilasi dengan Gliserol Terhadap Hasil Epoksidasi Metil Risinoleat yang diperoleh dari Minyak Jarak. Medan.SkripsiDepartemen Kimia FMIPA USU. Ozgul,Y, and Turkay ,S.,1993.In Situ Esterification of Rice Bran Oil With Methanol and
Ozgulsun,A.,F.Karaosmanoglu, dan M.Tuter.2000.Esterification Reaction of Oleic Acid With a Fusel Oil Fraction for Production of Lubricating Oil. J.Am.Oil.Chem.Soc. 77,11
Poedjiadi.A.1994.Dasar-Dasar Biokimia. Jakarta:UI-Press.
Rain,A,G.,1995.Sintesis Lauril Stearat Hasil Esterifikasi Antara Lauril Klorida dan Kalium Stearat dengan Menggunakan Katalis Tridodekilamin Hidroklorida.Sikripsi Jurusan Kimia.FMIPA USU.Medan.
Richtler,M.J.,Knaut,J.1984. Challenges to Nature Industry, Marketing and Economics of Oleochemical in Western Europe. USA : J.Am.Oil.Chem.Soc. Vol.61.160. Riswiyanto.2002.Kimia Organik.Jakarta:Erlangga
Sadi,S.,K.Pamin and Darnoko.1995. Preparation of Butyl Epoxy Stearat from Palm Oil and Palm Fatty Acid.Paper is Presented at 21st Word Conggres and Exhibition of The International, Society for Fat Research 1-6 October.The Hagua Netherland.
Sastrohamidjojo,H.,2005.Kimia Organik.Yogyakarta: Universitas Gadjah Mada-press. Sanchez,N.,Martinez,M.,Aracil,I., dan Corma,A.,1992.Synthesis of Oleil Oleat as a Jojoba
Oil Analogi.Jaocs,72,1150.
Santoso,A.Kajian Produk Agroindustri Yang Potensial dan Feasibel untuk di Kembangkan Sebagai Bahan Baku Biodiesel.Malang : FMIPA UM Malang.
Seager,S.L, dan Slabough,M.R.1994. Organic ang Biocgemistry for Today.Second Edition.New York:West Publishing Company.
Shreve,R.M.1956.Chemical Engineering Series,The Cemical Process Industries.Second Edition.New York:Mc Graw-Hill,Inc.
Sukirno,dan Bismo,S,2006.Formulasi Pelumas Berbasis Minyak Sawit.Laporan Penelitian RUSNAS Industri Hilir Kelapa Sawit.
Susanto,B.H.,Nasikin,M., dan Sukirno.,2008. Penggunaan Katalis HP W/Zeolit pada Esterifikasi Asam Oleat untuk Produksi Pelumas Dasar Bio. Prosiding Seminar Nasional Fundamental dan Aplikasi. Surabaya :Teknik Kimia FTI-ITS.
Tambun,R.2006.Teknologi Oleokimia.Medan:USU-Press.
Tarigan, D. 2005. P embuatan Surfaktan dari Minyak Kemiri Melalui Reaksi Interesterifikasi Diikuti Reaksi Amidasi. Jurnal Sains Kimia. Vol. 9, No. 1, 2005 : 1-7.
Wilbraham,A.C.1992.Pengantar Kimia Organik dan Hayati.Bandung:ITB-Press.
Winarno.1997.Kimia Pangan dan Gizi.Jakarta:Gramedia.
Wirawan,S.S.,2004.Perkiraan Reference Energy System Biodiesel BPPT.
Wisewan,P.1983.An Introduction to Industrial Organic Chemistry.Second Edition .England: Applied Science Publishers ltd.
Yamamura,S.,M.Nakamura, and T.Takeda.,1989. Synthesis and Properties and Destructible Anionic and Cationic Surfactant With a 1,3-Dioxolane Ring. J.Am.Oil.Chem.Soc. Yan,Y.,U.T.Born Scheuer.,G.Stadler.,S.Lutz-Wahl.,M.Reuss, dan R.D.Schmid,2001.
Lampiran B : Harga Bilangan Iodin Metode Wijs
Sampel Massa Sampel Volum Titrasi Bilangan
Iodin
M1 M2 M3 M V1 V2 V3 V
Blanko - - - - 46,19 46,21 46,20 46,20 -
Pentil Oleat 0,2059 0,2061 0,2057 0,2059 36,70 36,72 36,74 36,72 60,77 9-n-Pentoksi
10-Hidroksi n-Pentil Stearat Campuran
0,2050 0,2056 0,2053 0,2053 42,94 42,90 42,92 42,92 20,27
Perhitungan bilangan iodin dengan Metode Wijs
Bilangan iodin =
2. Senyawa 9-n-Pentoksi 10-Hidroksi n-Pentil Stearat Campuran
LAMPIRAN D : PERHITUNGAN RENDEMEN HASIL
1. Perhitungan rendemen n-pentil oleat
%
2. Perhitungan rendemen senyawa 9-n-pentoksi 10-hidroksi n-pentil stearat campuran dari n-pentil oleat