PENGARUH MINUMAN IONIK TERHADAP EFEK ANTIPIRETIK
PARASETAMOL PADA MERPATI JANTAN
(Columba livia)
SKRIPSI
OLEH:
FEBRI ISKANDAR SAMOSIR
NIM 071501056
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH MINUMAN IONIK TERHADAP EFEK ANTIPIRETIK
PARASETAMOL PADA MERPATI JANTAN
(Columba livia)
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
FEBRI ISKANDAR SAMOSIR
NIM 071501056
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2011
iii
PENGESAHAN SKRIPSI
PENGARUH MINUMAN IONIK TERHADAP EFEK ANTIPIRETIK
PARASETAMOL PADA MERPATI JANTAN
(Columba livia)
OLEH:
FEBRI ISKANDAR SAMOSIR NIM 071501056
Dipertahankan di Hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: September 2011
Pembimbing I, Panitia Penguji,
Drs. Rasmadin Mukhtar, MS., Apt. Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt. NIP 194909101980031002 NIP 195212041980021001
Pembimbing II, Drs. Rasmadin Mukhtar, MS., Apt.
NIP 194909101980031002
Prof. Dr. Rer. nat. Effendy De Lux Putra, SU.,Apt Dr. Edy Suwarso, SU., Apt NIP 195306191983031001 NIP 130935857
Dr. Kasmirul Ramlan Sinaga, MS., Apt.
NIP 195504241983031003
Dekan,
iv
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa, karena limpahan rahmat kasih dan karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini yang
berjudul “PENGARUH MUNUMAN IONIK TERHADAP EFEK
ANTIPIRETIK PARASETAMOL PADA MERPATI JANTAN (Columba
livia)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Terimakasih dan penghargaan yang tulus kepada Ayahanda dan Ibunda tercinta, Ir. M. Samosir dan K. Br. Manurung, yang tiada pernah ada hentinya berkorban dengan tulus ikhlas bagi kesuksesan penulis, juga kepada kakak dan abangku Corry Nova Samosir. S.P dan dr. Ganda M.L Samosir yang selalu setia memberi doa, dorongan dan semangat.
Pada kesempatan ini penulis juga mengucapkan terima kasih yang tulus dan ikhlas kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
v
3. Bapak Drs. Wiryanto, MS. Apt. selaku penasehat akademik yang telah memberikan bimbingan kepada penulis selama masa perkuliahan.
4. Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt., Bapak Dr. Edy Suwarso, SU., Apt., dan Bapak Dr. Kasmirul Ramlan Sinaga, MS., Apt. selaku dosen penguji yang telah memberikan kritik, saran, dan arahan kepada penulis dalam menyelesaikan skripsi ini.
5. Ibu kepala Laboratorium Farmakologi Farmasi USU dan Bapak kepala Laboratorium Pusat Penelitian Kelapa Sawit Medan yang telah memberikan bantuan dan fasilitas selama penulis melakukan penelitian.
6. Sahabat-sahabatku ”Aluska 07”, panitia ”Rejoicing in Love”, ”HMF 2009”,
”The Upper: Riwandi, Martin, Sandro”, bang Mula, Juwita, Ernal, Novalina,
Billy, Kristian, Gazali, rekan seperjuangan bang Damos dan teman-teman lain yang tidak dapat disebutkan satu per satu serta adikku terkasih Ani Junita Manihuruk terima kasih atas doa, dukungan, dan motivasinya.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan kefarmasian.
Medan, Agustus 2011
Penulis
vi
Pengaruh Minuman Ionik Terhadap Efek Antipiretik Parasetamol pada Merpati Jantan (Columba livia)
ABSTRAK
Telah dilakukan uji efek antipiretik dari minuman ionik (terutama mengandung natrium dan kalium) yang beredar di pasaran, terhadap merpati jantan (Columba livia) yang dikondisikan dalam keaadaan demam dengan pemberian secara injeksi larutan 2,4-dinitrofenol dosis 8 mg/Kg BB secara intramuskular pada daerah otot dada. Minuman ionik yang diuji, sebelumnya ditentukan kandungan natrium dan kalium menggunakan spektrofotometer serapan atom dengan lampu katoda Na dan K. Analisis kuantitatif natrium dan kalium dilakukan pada panjang gelombang berturut-turut 589,6 nm dan 769,9 nm. Hasil penetapan kadar natrium untuk minuman ionik merek dagang PW adalah 465,216 ± 2,433 mcg/ml, untuk minuman ionik merek dagang MZ adalah 325,425 ± 1,723 mcg/ml, untuk minuman ionik GR adalah 380,425 ± 5,030 mcg/ml. Hasil penetapan kadar kalium untuk minuman ionik merek dagang PW adalah 169,936 ± 2,002 mcg/ml, untuk minuman ionik merek dagang MZ adalah 320,298 ± 3,338 mcg/ml, untuk minuman ionik GR adalah 265,616 ± 1,560 mcg/ml. Merpati jantan (Columba livia) yang dikondisikan dalam keadaan demam dengan dehidrasi diberikan secara oral suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB tunggal, minuman ionik dosis 4,28 ml/Kg BB tunggal yang dilakukan secara berulang-ulang dengan selang waktu 30 menit selama 120 menit, kombinasi minuman ionik dosis 4,28 ml/Kg BB yang dilakukan secara berulang-ulang dengan selang waktu 30 menit selama 120 menit dengan suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB. Parameter efek antipiretik ditentukan dengan mengukur suhu tubuh merpati pada bagian rektal. Hasil pengujian efek antipiretik menunjukkan bahwa pemberian minuman ionik secara tunggal maupun kombinasi dengan parasetamol menunjukkan perbedaan efek antipiretik yang tidak bermakna secara statistik. Tetapi untuk pemberian suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB tunggal memberikan efek antipiretik yang lebih baik.
Kata kunci: minuman ionik, parasetamol, antipiretik dan merpati jantan.
vii
THE INFLUENCE OF IONIC BEVERAGE TO THE EFFECT OF PARACETAMOL ANTIPIRETIC AT MALE DOVE (Coloumba livia)
ABSTRACT
It has been done antipiretic test of ionic beverage (its contains of sodium and potassium) that revolve from brand for the male dove (Columba livia) which was conditioned in fever as inducer was used 2.4-dinitrophenol by intramuscular injection doses 8 mg/kg BB at thorax muscle. Ionic baverage has been done determine of ion consentration of sodium and potassium by using atomic absorption spectroscopy with sodium and potassium katode lamp. The quantitative analysis of sodium and potassium was done with the wavelength at 589.6 nm for sodium and at 769.9 nm for potassium. The determine of sodium concentration for PW brand is 465.216 ± 2.433 mcg/ml, for MZ brand is 325.425 ± 1.723 mcg/ml, and for GR brand is 380.425 ± 5.030 mcg/ml. The determine of potassium concentration for PW brand is 169.936 ± 2.002 mcg/ml, for MZ brand is 320.298 ± 3.338 mcg/ml, and for GR brand is 265.616 ± 1.560 mcg/ml. The male dove (Columba livia) was conditioned in fever followed dehydration, then it was given orally suspension of paracetamol tablet powder with single dose 300 mg/kg BB, ionic beverage with single dose 4.28 ml/kg BB that was given repeatedly at interval 30 minutes for 120 minutes, the concentration of ionic beverage doses 4.28 ml/kg BB with suspension of paracetamol tablet powder doses 300 mg/kg BB that was given repeatedly at interval 30 minutes for 120 minutes. The parameter of antipiretic effect was determined by measuring the temperature of dove’s body at the rectal. The result of examination of antipiretic effect showed that presenting ionic beverage singularly as well as combination with paracetamol gave the unmeaningful difference statistically. But, if it compared with present of suspension of paracetamol tablet powder doses 300 mg/kg BB singularly gave the antipiretic effect better.
viii
DAFTAR ISI
Halaman
JUDUL…. ... i
HALAMAN PENGESAHAN... ii
ABSTRAK...iii
ABSTRACT... iv
DAFTAR ISI... v
DAFTAR TABEL...viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN... x
BAB I PENDAHULUAN... 1
1.1 Latar Belakang…... 1.2 Perumusan Masalah... 2
1.3 Hipotesis ... 2
1.4 Tujuan Penelitian... 3
1.5 Manfaat Penelitian... 3
1.6 Kerangka Konsep Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Pengaturan Suhu ... 5
2.2 Demam ... 6
2.3 Dehidrasi ... 8
2.4 Parasetamol ... 9
ix
BAB III METODE PENELITIAN... 12
3.1 Alat-alat ... 12
3.2 Bahan-bahan ... 12
3.3 Hewan Percobaan ... 13
3.4 Pengambilan Sampel ... 13
3.5 Pembuatan Pereaksi... 13
3.5.1 Pereaksi Natrium Hidroksida 0,1 N ... 13
3.5.2 Air bebas Karbondioksida... 13
3.6 Pembuatan Sediaan Bahan Uji ... 13
3.6.1 Pembuatan Larutan 2,4-dinitrofenol 0,5% (b/v) ... 13
3.6.2 Pembuatan Suspensi CMC 0,5% (b/v)... 14
3.6.3 Pembuatan Suspensi Serbuk Parasetamol 10% (b/v) ... 14
3.7 Prosedur Kerja ... 14
3.7.1 Pembuatan Kurva Kalibrasi Natrium ... 14
3.7.2 Pembuatan Kurva Kalibrasi Kalium ... 15
3.7.3 Pemeriksaan Natrium ... 15
3.7.4 Pemeriksaan Kalium... 15
3.7.5 Pengujian Farmakologi ... 16
a. Penentuan Dosis Optimum 2,4-dinitrofenol ... 16
b. Perlakuan ke Hewan Coba ... 16
c. Analisis Data ... 18
BAB IV HASIL DAN PEMBAHASAN... 19
4.1 Hasil Pengumpulan Sampel... 19
x
4.2.1 Kurva Kalibrasi Natrium dan Kalium ... 19
a. Batas Deteksi dan Batas Kuantitasi ... 19
b. Uji Perolehan Kembali ... 19
4.3 Orientasi Dosis Optimum 2,4-dinitrofenol ... 22
4.4 Hasil Pengamatan Efek Antipiretik ... 22
a. Perbandingan Pemberian Minuman Ionik Tunggal dengan Pemberian Parasetamol Tunggal ... 25
b. Perbandingan Pemberian Kombinasi Minuman Ionik dan Parasetamol dengan Pemberian Parasetamol Tunggal ... 25
c. Hasil Uji Statistik………... ……….26
BAB V KESIMPULAN DAN SARAN... 29
5.1 Kesimpulan…... 29
5.2 Saran………… ... 30
DAFTAR PUSTAKA…... 31
xi
DAFTAR TABEL
Halaman
Tabel 1 Data Hasil Pengukuran Kadar Natrium dan Kalium (mcg/ml)
Dalam Sampel dan Kadar pada Etiket ... 20
Tabel 2 Data Perubahan Suhu Tubuh Rata-rata Merpati (oC SD) setelah Pemberian Larutan 2,4-dinitrofenol 0,5% dosis 7, 8
dan 9 mg/kg BB Selama 120 Menit……….23
xii
DAFTAR GAMBAR
Halaman
Gambar 1. Grafik Perubahan Suhu Tubuh Rata-rata Merpati (oC SD) Setelah Pemberian Larutan 2,4-dinitrofenol 0,5% dosis 7, 8
dan 9 mg/kg BB Selama 120 Menit……….……...23
Gambar 2. Grafik Pengaruh Pemberian Minuman Ionik Tunggal Terhadap Perubahan Suhu Tubuh Rata-rata Merpati (oC SD) setelah diinduksi dengan Larutan 2,4-dinitrofenol 0,5%
dosis 8 mg/kg BB………24
Gambar 3. Grafik Pengaruh Pemberian Kombinasi Minuman Ionik dan Parasetamol Terhadap Perubahan Suhu Tubuh Rata-rata Merpati (oC SD) setelah diinduksi dengan Larutan 2,4-dinitrofenol
0,5% dosis 8 mg/kg BB... 24
Gambar 4. Kurva Kalibrasi Larutan Standar Na ... 36
xiii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Pengukuran Absorbansi Larutan Standar Natrium ... 33
Lampiran 2. Perhitungan Persamaan Garis Regresi dan Koefisien
Korelasi (r) dari Data Kalibrasi Natrium... 34
Lampiran 3. Hasil Pengukuran Absorbansi Larutan Standar Kalium... 35
Lampiran 4. Perhitungan Persamaan Garis Regresi dan Koefisien
Korelasi (r) dari Data Kalibrasi Kalium ... 36
Lampiran 5. Perhitungan Batas Deteksi dan Batas Kuantitasi Natrium ... 37
Lampiran 6. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalium... 39
Lampiran 7. Contoh Perhitungan Hasil Penetapan Kadar Natrium
Dalam Sampel ... 42
Lampiran 8. Data Hasil Berat Sampel, Absorbansi, Konsentrasi dan
Kadar Logam Natrium... 43
Lampiran 9. Contoh Perhitungan Hasil Penetapan Kadar Kalium
Dalam Sampel ... 44
Lampiran 10. Data Hasil Berat Sampel, Absorbansi, Konsentrasi dan
Kadar Logam Kalium ... 45
Lampiran 11. Perhitungan Kadar Natrium dan Kalium ... 46
Lampiran 12. Perhitungan Statistik Kadar Natrium dan Kalium ... 51
Lampiran 13. Perhitungan Kadar Natrium Dalam Sampel PW
Untuk Recovery ... 63
Lampiran 14. Perhitungan Uji Perolehan Kembali Untuk Natrium... 64
Lampiran 15. Perhitungan Kadar Kalium Dalam Sampel PW
Untuk Recovery ... 65
Lampiran 16. Perhitungan Uji Perolehan Kembali Untuk Kalium ... 67
Lampiran 17. Perubahan Suhu Rata-rata Merpati Setelah Penyuntikan
Larutan 2,4-dinitrofenol 0,5% dan Pemberian Bahan Uji ... 68
Lampiran 18. Tabel Perubahan Suhu Rata-rata Merpati (oC SD) Setelah Penyuntikan Larutan 2,4-dinitrofenol 0,5%
xiv
Lampiran 19. Deskripsi dari Tiap Kelompok Hewan ... 80
Lampiran 20. Anava Untuk Tiap Waktu Pengamatan ... 84
Lampiran 21. Hasil uji Post Duncan Untuk Tiap Waktu Pengamatan... 88
Lampiran 22. Perhitungan Pemberian Larutan 2,4-dinitrofenol 0,5%
Pada Burung Merpati Secara IM... 93
Lampiran 23. Perhitungan Pemberian Bahan Uji ... 94
Lampiran 24. Surat Keterangan Melakukan Analisis di Laboratorium
Pusat Penelitian Kelapa Sawit... 95
Lampiran 25. Alat Spektrofotometer Serapan Atom ... 96
vi
Pengaruh Minuman Ionik Terhadap Efek Antipiretik Parasetamol pada Merpati Jantan (Columba livia)
ABSTRAK
Telah dilakukan uji efek antipiretik dari minuman ionik (terutama mengandung natrium dan kalium) yang beredar di pasaran, terhadap merpati jantan (Columba livia) yang dikondisikan dalam keaadaan demam dengan pemberian secara injeksi larutan 2,4-dinitrofenol dosis 8 mg/Kg BB secara intramuskular pada daerah otot dada. Minuman ionik yang diuji, sebelumnya ditentukan kandungan natrium dan kalium menggunakan spektrofotometer serapan atom dengan lampu katoda Na dan K. Analisis kuantitatif natrium dan kalium dilakukan pada panjang gelombang berturut-turut 589,6 nm dan 769,9 nm. Hasil penetapan kadar natrium untuk minuman ionik merek dagang PW adalah 465,216 ± 2,433 mcg/ml, untuk minuman ionik merek dagang MZ adalah 325,425 ± 1,723 mcg/ml, untuk minuman ionik GR adalah 380,425 ± 5,030 mcg/ml. Hasil penetapan kadar kalium untuk minuman ionik merek dagang PW adalah 169,936 ± 2,002 mcg/ml, untuk minuman ionik merek dagang MZ adalah 320,298 ± 3,338 mcg/ml, untuk minuman ionik GR adalah 265,616 ± 1,560 mcg/ml. Merpati jantan (Columba livia) yang dikondisikan dalam keadaan demam dengan dehidrasi diberikan secara oral suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB tunggal, minuman ionik dosis 4,28 ml/Kg BB tunggal yang dilakukan secara berulang-ulang dengan selang waktu 30 menit selama 120 menit, kombinasi minuman ionik dosis 4,28 ml/Kg BB yang dilakukan secara berulang-ulang dengan selang waktu 30 menit selama 120 menit dengan suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB. Parameter efek antipiretik ditentukan dengan mengukur suhu tubuh merpati pada bagian rektal. Hasil pengujian efek antipiretik menunjukkan bahwa pemberian minuman ionik secara tunggal maupun kombinasi dengan parasetamol menunjukkan perbedaan efek antipiretik yang tidak bermakna secara statistik. Tetapi untuk pemberian suspensi serbuk tablet parasetamol dosis 300 mg/Kg BB tunggal memberikan efek antipiretik yang lebih baik.
Kata kunci: minuman ionik, parasetamol, antipiretik dan merpati jantan.
vii
THE INFLUENCE OF IONIC BEVERAGE TO THE EFFECT OF PARACETAMOL ANTIPIRETIC AT MALE DOVE (Coloumba livia)
ABSTRACT
It has been done antipiretic test of ionic beverage (its contains of sodium and potassium) that revolve from brand for the male dove (Columba livia) which was conditioned in fever as inducer was used 2.4-dinitrophenol by intramuscular injection doses 8 mg/kg BB at thorax muscle. Ionic baverage has been done determine of ion consentration of sodium and potassium by using atomic absorption spectroscopy with sodium and potassium katode lamp. The quantitative analysis of sodium and potassium was done with the wavelength at 589.6 nm for sodium and at 769.9 nm for potassium. The determine of sodium concentration for PW brand is 465.216 ± 2.433 mcg/ml, for MZ brand is 325.425 ± 1.723 mcg/ml, and for GR brand is 380.425 ± 5.030 mcg/ml. The determine of potassium concentration for PW brand is 169.936 ± 2.002 mcg/ml, for MZ brand is 320.298 ± 3.338 mcg/ml, and for GR brand is 265.616 ± 1.560 mcg/ml. The male dove (Columba livia) was conditioned in fever followed dehydration, then it was given orally suspension of paracetamol tablet powder with single dose 300 mg/kg BB, ionic beverage with single dose 4.28 ml/kg BB that was given repeatedly at interval 30 minutes for 120 minutes, the concentration of ionic beverage doses 4.28 ml/kg BB with suspension of paracetamol tablet powder doses 300 mg/kg BB that was given repeatedly at interval 30 minutes for 120 minutes. The parameter of antipiretic effect was determined by measuring the temperature of dove’s body at the rectal. The result of examination of antipiretic effect showed that presenting ionic beverage singularly as well as combination with paracetamol gave the unmeaningful difference statistically. But, if it compared with present of suspension of paracetamol tablet powder doses 300 mg/kg BB singularly gave the antipiretic effect better.
xv
BAB I
PENDAHULUAN
1.1 Latar Belakang
Demam adalah suatu gejala dan bukan merupakan penyakit tersendiri. Para ahli berpendapat bahwa demam adalah suatu reaksi perlawanan yang berguna dari tubuh terhadap infeksi atau penyakit. Pada suhu diatas 37 C limfosit dano makrofag menjadi lebih aktif. Bila suhu melampaui 40-41 C, terjadi situasio kritis yang bisa menjadi fatal, karena tidak terkendalikan lagi oleh tubuh (Tjay dan Rahardja, 2002).
Saat demam set-point meningkat, dan non-steroidal
antiinflamatory drugs (NSAID) mendorongnya kembali ke keadaan normal.
Obat ini tidak mempengaruhi suhu tubuh naik oleh faktor seperti olahraga atau meningkatnya suhu lingkungan. Semua NSAID merupakan antipiretik, analgesik, dan antiradang. Satu pengecualian adalah parasetamol, yang merupaan antipiretik dan analgesik tetapi tidak mempunyai aktivitas antiradang (Goodman dan Gilman, 2007).
xvi
Pencegahan dehidrasi dapat dilakukan dengan pemberian asupan cairan secara berkala selama keadaan sakit atau melakukan aktifitas berat. Intervalnya adalah 20 sampai 30 menit mengonsumsi minuman. Sedangkan mengatasi dehidrasi sendiri yaitu dengan memberikan minuman yang mengandung gula dan elektrolit (garam) atau juga asupan makanan (Cronan, 2010). Terjadi dehidrasi harus segera diambil tindakan yang tepat untuk mempertahankan keseimbangan cairan (Ganong, 2008).
Demam sering dikaitkan dengan dehidrasi. Keluarnya banyak cairan tubuh selama demam memang dapat menyebabkan tubuh dehidrasi. Walau demam yang normal seringkali tidak membahayakan, namun kondisi dehidrasi yang diakibatkannya dapat membahayakan bila tidak diatasi dengan tepat (Guyton, 1994).
Berdasarkan pertimbangan uraian di atas, penulis tertarik meneliti pengaruh minuman ionik untuk terapi mengatasi demam akibat dehidrasi. Penggunaan minuman ionik dilakukan dengan pemberian secara berulang-ulang pada merpati jantan (Columba livia) yang telah dikondisikan demam disertai dehidrasi dengan penginduksian 2,4 dinitrofenol.
1.2 Perumusan Masalah
xvii
1. Apakah minuman ionik memiliki pengaruh antipiretik pada merpati jantan yang demam?
2. Apakah minuman ionik mempengaruhi efek antipiretik parasetamol pada merpati jantan yang demam?
1.3Hipotesis
Berdasarkan perumusan masalah di atas maka dibuat hipotesis, yaitu:
1. Minuman ionik memiliki pengaruh antipiretik pada merpati jantan 2. Penggunaan minuman ionik mampu mempengaruhi efek antipiretik
parasetamol
1.4Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. untuk meneliti apakah ada pengaruh efek antipiretik minuman ionik, efek antipiretik minuman ionik bila dikombinasikan dengan parasetamol
1.5Manfaat Penelitian
Untuk memberikan informasi tentang manfaat penggunaan minuman ionik sebagai antipiretik pada demam dehidrasi.
1.6 Kerangka Konsep Penelitian
Variabel bebas Variabel terikat
xviii
Pemberian minuman ionik tunggal, parasetamol tunggal, kombinasi minuman ionik dan parasetamol
Suhu tubuh merpati jantan Penginduksian
xix
BAB II
TINJAUAN PUSTAKA
2.1 Pengaturan Suhu
Suhu jaringan dalam tubuh (core temperature, suhu inti) tetap konstan
dalam kisaran 1 oF ( 0,6 oC) meskipun suhu lingkungan berfluktuasi tajam.
Suhu tubuh normal rerata diperkirakan antara 98oF dan 98,6 oF jika diukur melalui mulut dan sekitar 1oF lebih tinggi di rektum (Guyton dan Hall, 2009).
Biasanya, nilai normal untuk suhu oral manusia adalah 37 C (98,6 oF), tetapi pada sebuah penelitian besar terhadap orang-orang muda normal, suhu oral pagi hari rerata adalah 36,7 C dengan simpang baku 0,2 C. Suhu rektum dapat mencerminkan suhu pusat tubuh (core temperature). Suhu oral pada keadaan normal 0,5 C lebih rendah daripada suhu rektum, tetapi suhu ini dipengaruhi oleh banyak faktor, termasuk makanan/minuman panas atau dingin, mengunyah permen karet, merokok, dan bernafas melalui mulut (Ganong, 2008).
Dalam tubuh, panas dihasilkan oleh gerakan otot asimilasi makanan dan oleh semua proses vital yang berperan dalam tingkat metabolisme basal. Panas dikeluarkan tubuh melalui radiasi, konduksi (hantaran), dan penguapan air di saluran napas dan kulit. Sejumlah panas juga dikeluarkan melalui urine dan feses. Keseimbangan antara pembentukan dan pengeluaran panas menentukan suhu tubuh (Ganong, 2008).
Menurut Guyton dan Hall (2009), pengeluran panas terjadi melalui:
xx
b) Pengeluaran panas secara konduksi terjadi melalui kontak langsung dengan suatu benda
c) Pengeluaran panas secara konveksi terjadi karena gerakan udara d) Penguapan adalah mekanisme penting pengeluaran panas ketika
suhu sangat tinggi
Area preoptik dari hipotalamus memiliki kemampuan yang berfungsi sebagai termostatik pusat pengaturan suhu tubuh. Walupun sinyal yang ditimbulkan oleh reseptor suhu di hipotalamus sangat kuat dalam mengatur suhu tubuh, reseptor suhu di bagian lain dari tubuh mempunyai peranan tambahan dalam pengaturan suhu. Hal ini terjadi pada reseptor suhu di kulit dan beberapa jaringan khusus di tubuh bagian dalam. Suhu inti tubuh, sekitar 37,1oC atau 36,5oC sampai 37,5oC, disebut “set-point” (Guyton dan Hall, 2007).
2.2 Demam
Demam adalah suhu tubuh di atas normal (Ganong 2008). Demam yang berarti suhu tubuh di atas batas normal biasa dapat disebabkan oleh kelainan dalam otak sendiri atau oleh zat toksik yang mempengaruhi pusat pengaturan suhu, penyakit-penakir bakteri, tumor otak, atau dehidrasi (Guyton dan Hall 2009). Walaupun demam biasanya berhubungan dengan infeksi, bukan berarti ada hubungan yang eksklusif. Demam dapat merupakan manisfestasi penyakit neoplastik, gangguan-gangguan peradangan noninfeksi atau katabolisme berlebihan pada keadaan-keadaan metabolik tertentu (Sodeman dan Sodeman, 1995).
xxi
Demam terjadi karena penyesuaian (resetting) set point untuk kontrol suhu, penyesuaian ini dapat disebabkan oleh protein, produk penguraian protein, atau toksin bakteri (lipopolisakarida), yang secara kolektif dinamai pirogen. Sebagian pirogen bekerja secara langsung pada pusat pengaturan, tetapi sebagian besar bekerja tidak lansung (Guyton dan Hall 2009).
Sebagian besar protein, hasil pemecahan protein dan beberapa zat tertentu lainnya, terutama toksin liposakarida yang dilepaskan dari membran sel bakteri, dapat menyebabkan peningkatan set-point pada thermostat hipotalamus (Guyton dan Hall, 2007). Ketika partikel virus atau bakteri muncul di tubuh, partikel tersebut difagositosis leukosit, makrofag jaringan, dan limfosit pembunuh granular besar. Sel ini melepaskan interleukin-1 sebagai respon terhadap partikel fagosit. Interlekuin-1 menginduksi pembentukan prostaglandin E2 yang bekerja pada hipotalamus untuk mencetuskan reaksi demam. Ketika pembentukan prostaglandin dihambat oleh obat-obatan, demam sepenuhnya menghilang atau setidaknya berkurang. Ini diduga pada aspirin dan antipiretik lainnya untuk menurunkan tingkat demam, dan hal ini menjelaskan mengapa senyawa ini tidak menurunkan suhu tubuh pada orang normal dan sehat (yang tidak mengalami peningkatan kadar interleukin-1) (Guyton dan Hall 2009). NSAID menekan respon demam dengan cara menghambat sintesis PGE2 ( Goodman dan Gilman, 2007).
xxii
yang baru tersebut, yang bersangkutan tidak lagi merasa kedinginan, dan suhu tubuh meningkat diatas normal. Jika pirogen telah dibersihkan dari tubuh, set point untuk kontrol suhu kembali ke normal. Pada tahap ini, suhu tubuh menjadi terlalu hangat dan timbul perasaan gerah sehingga mekanisme saraf terpicu untuk menyebabkan vasolidasi pembulu darah kulit dan berkeringat. (Guyton dan Hall, 2009)
2.3 Dehidrasi
Tubuh harus mendapat cukup air untuk menjalankan fungsinya dengan tepat untuk menyaring racun-racun keluar melalui ginjal, dan untuk memelihara jumlah mineral (elektrolit) secara normal. Dehidrasi terjadi ketika tubuh kehilangan cairan lebih cepat daripada ketika akan digantikan. Seseorang harus meminum cairan dengan cukup untuk menggantikan cairan yang keluar dari tubuhnya (Elsevier, 2007).
Dehidrasi dihasilkan dari kehilangan air dan elektrolit penting dalam tubuh termasuk kalium, natrium, klorida dan banyak mineral lainnya. Organ-organ esensial yang sangat berperan seperti otak, ginjal, jantung dan sistem saraf tidak dapat berfungsi tanpa air atau mineral yang cukup.
Menurut Elete 1990 Penyebab dehidrasi didasarkan pada 4 dasar, yaitu : a) Berkeringat : demam, latihan (gerakan), pembuangan panas berlebihan b) Muntah : ulser, keracunan makanan, flu
c) Diare : flu, keracunan makanan, gastroenteritis
d) Pemasukan kalori yang tidak cukup, dapat terjadi karena tidak mengkonsumsi mineral dan air yang cukup
xxiii
a) Minum cairan yang cukup, mengkonsumsi 8 gelas air sehari
b) Membatasi atau menghindari minuman berkafein dan beralkohol karena kandungan keduanya meningkatkan dehidrasi
c) Menghindari minuman berkarbonat yang dapat membengkak dan memberi sensasi penuh pada tubuh karena membatasi pemasukan cairan
d) Menggunakan penangkal cahaya matahari, menjaga diri tetap dingin dan mencari perlindungan/naungan dimanapun berada (Elete, 1990).
Dehidrasi dapat terjadi sebagai komplikasi dari beberapa penyakit dimana tubuh mengeluarkan atau kehilangan air dalam jumlah yang berlebihan seperti :
a) Diare b) Muntah
c) Demam tinggi yang menyebabkan tubuh kehilangan lebih banyak air sehingga dehidrasi dapat terjadi lebih mudah
d) Penyakit yang menyebabkan pengeluaran urin secara berlebihan seperti diabetes juga dapat menyebabkan dehidrasi
2.4 Parasetamol
Rumus bangun : NHCOCH3
OH
Gambar :Parasetamol
Sinonim : Acetaminophen, p-acetaminophenol, n-acetyl-p-amino- phenol.
Rumus melekul : C8H9NO2
Berat molekul : 151,16
Titik leleh : 169-172oC (Connors, dkk., 1986)
Pemerian : Serbuk hablur, putih ; tidak berbau; rasa sedikit pahit (Ditjen POM, 1995).
Kelarutan : Larut dalam air mendidih dan dalam natrium hidroksida 1 N; mudah larut dalam etanol (Ditjen POM, 1995). 1 g dapat larut dalam kira-kira 70 ml air suhu 25oC, 1 g larut dalam 20 ml air mendidih, dalam 7 ml alkohol, dalam 13 ml aseton, dalam 50 ml kloroform, dalam 40 ml gliserin dan dalam 9 ml propilen glikol. Tidak larut dalam benzene dan eter (Connors, dkk., 1986).
Parasetamol merupakan senyawa yang sangat stabil dalam larutan air dan pKa = 9,51 (Connors, dkk., 1986 ), dan absorpsi obat dalam saluran cerna cepat
xxv
dan hampir sempurna (Siswandono dan Soekardjo, 2000). Asetaminofen adalah
salah satu obat yang terpenting untuk pengobatan nyeri ringan sampai sedang, bila efek anti-inflamasi tidak diperlukan. Asetaminofen merupakan metabolik fenasetin yang bertanggung jawab atas efek analgesiknya. Obat ini adalah penghambat prostaglandin yang lemah pada jaringan perifer dan tidak memiliki efek anti-inflamasi yang bermakna (Katzung, 1998). Parasetamol merupakan obat lain pengganti aspirin yang efektif sebagai obat analgesik-antipiretik; namun, tidak seperti aspirin, aktivitas antiradangnya lemah sehingga bukan merupakan oabt yang berguna untuk menangani kondisi radang. Ketidak mampuan parasetamol memberikan efek antiradang mungkin berkaitan dengan fakta bahwa parasetamol hanya merupakan inhibitor siklooksigenase yang lemah dengan adanya peroksida konsentrasi tinggi yang ditemukan pada lesi radang. Sebaliknya, efek antipiretiknya dapat dijelaskan dengan kemampuannya menghambat siklooksigenase di otak, yang tonus peroksidanya rendah. Selain itu, parasetamol tidak menghambat aktivitas neutrofil, sedangkan NSAID lain menghambat aktivitas tersebut. Parasetamol merupakan antiradang yang sangat lemah dan inhibitor siklooksigenase yang lemah. Selain itu parasetamol tampak menghambat enzim tersebut hanya di lingkungan yang kadar peroksidanya rendah, yang sebagian dapat menjelaskan lemahnya aktivitas antiradang parasetamol karena pada tempat peradangan biasanya terjadi peningkatan konsentrasi peroksida yang dibentuk oleh leukosit (Goodman dan Gilman, 2007). Asetaminofen diberikan
xxvi
mikrosom hati dan diubah menjadi asetaminofen sulfat dan glukuronida, secara farmakologi tidak aktif. Kurang dari 5 % diekskrasikan dalam bentuk tidak berubah. Suatu metabolik minor tetapi sangat aktif (N-asetil-p-benzo-kuinon), penting pada dosis besar, karena toksisitasnya terhadap hati dan ginjal. Waktu paruh asetaminofen 2-3 jam dan relatif tidak dipengaruhi oleh fungsi ginjal. Pada jumlah toksis atau adanya penyakit hati, waktu paruhnya bisa meningkat 2 kali lipat atau lebih (Katzung, 1998).
2.5 Metabolisme Parasetamol
xxvii 1. Reaksi fase 1
Reaksi ini meliputi biotransformasi suatu obat menjadi yang lebih polar melalui pemasukan atau pembukaan suatu gugus fungsional. Metabolisme fase 1 meliputi reaksi oksidasi, reduksi, hidrolisis dan hidrasi, juga isomerisasi dan reaksi-reaksi lain yang lebih jarang (Gibson dan Skett, 1991). Oksidasi merupakan reaksi yang paling umum dan reaksi ini dikatalisis suatu kelas enzim yang penting yang disebut oksidase dengan fungsi campuran (sitokrom P-450).
2. Reaksi fase 2
Yang sangat menarik dalam antar hubungan dari berbagai rute metabolik adalah reaksi kompetisi dari substrat untuk enzim-enzim fase 2. Banyak bukti mengungkapkan bahwa reaksi-reaksi fase 1 menciptakan gugus fungsional reaksi pada molekul sehingga dapat diserang oleh enzim-enzim fase 2. Jadi reaksi fase 2 merupakan jalur detoksifikasi yang sebenarnya dan memberikan produk-produk yang berarti terhadap curah dari produk tidak aktif yang dieskresikan dari suatu obat (Gibson dan Skett, 1991). Banyak produk-produk fase 1 tidak segera dieliminasi dan mengalami reaksi berikutnya dimana suatu substrat endogen seperti glucuronic acid,
sulfuric acid, acetic acid, atau amino acid bergabung dengan gugus
fungsional yang baru terjadi membentuk konjugat yang sangat polar. Reaksi-reaksi konjugasi atau reaksi-reaksi sintesis yang demikian adalah tanda-tanda metabolisme fase 2 (Katzung, 2002).
xxviii
xxix
BAB III
METODOLOGI PENELITIAN
Metodologi penelitian ini meliputi pengambilan sampel, penetapan kadar sampel dan uji efek antipiretik terhadap burung merpati. Hasil uji efek antipiretik dianalisis secara Anava (analisis variansi) dan dilanjutkan dengan uji beda rata-rata Duncan menggunakan program statistical and product service solution (SPSS).
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas laboratorium, neraca analitik (Boeco Germany), Spektrofotometer Serapan Atom (GBC Avanta ∑, Australia), neraca hewan (Presica Geniweigher, GW-1500), termometer rektal digital (COX recorder), autoklaf, syringe 1 ml dan 3 ml (York),
oral sonde, kertas saring, mortir dan stamfer, alat penangas air, indikator universal
dan stopwatch.
3.2 Bahan-Bahan
Bahan-bahan yang digunakan adalah tablet Panadol (PT. Sterling), minuman ionik “PW” Pocari Sweat (PT. Amerta Indah Otsuka), “MZ” Mizone (PT. Tirta Investama), “GR” Gatorade (PT. Pepsi Cola), karboksi metil selulosa (CMC, Brataco chemika PA), natrium hidroksida pellet (Merck, PA),
2,4-®
® ®
xxx
dinitrofenol (Merck, PA), larutan standar kalium 1000 mcg/ml (Merck, PA), larutan standar natrium 1000 mcg/ml (Merck, PA), asam nitrat 65% (Merck, PA), aqua proinjeksi (Ikapharmindo Putramas) dan air suling (Lokal).
3.3 Hewan Percobaan
Hewan yang digunakan dalam penelitian ini adalah burung merpati jantan
(Columba livia) dewasa yang sehat dengan berat badan 250 – 340 gram sebanyak
48 ekor, dibagi dalam 8 kelompok dimana dalam setiap kelompok terdiri dari 6 ekor burung merpati. Pemilihan hewan dilakukan secara random.
3.4 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif dengan cara mengambil sampel dari pasaran yaitu salah satu hypermaket dan apotek di kota Medan.
3.5. Pembuatan Pereaksi
3.5.1 Pereaksi Natrium Hidroksida 0,1 N
xxxi
3.5.2 Air bebas Karbondioksida
Air suling yang telah dididihkan selama 5 menit atau lebih dan didiamkan sampai dingin dan tidak boleh menyerap karbon dioksida dari udara (Ditjen POM, 1995).
3.6 Pembuatan Sediaan Bahan uji
Pembutan sediaan bahan uji meliputi pembuatan larutan 2,4-dinitrofenol 0,5%, pembuatan suspensi CMC 0,5%, pembuatan suspensi serbuk parasetamol 10%
3.6.1 Pembuatan Larutan 2,4-dinitrofenol 0,5% (b/v)
Sebanyak 125 mg 2,4-dinitrofenol ditimbang kemudian dimasukkan ke dalam labu tentukur 25 ml, ditambahkan larutan NaOH 0,1 N sedikit demi sedikit hingga larut sempurna, lalu ditambahkan aqua proinjeksi sampai mendekati garis tanda, pH dicek sekitar 6, lalu dicukupkan dengan aqua proinjeksi sampai garis tanda, dikocok hingga homogen. Kemudian disaring, beberapa tetes pertama dibuang dan tetesan selanjutnya ditampung, lalu dimasukkan ke dalam wadah dan disterilkan.
3.6.2 Pembuatan Suspensi CMC 0,5% (b/v)
xxxii
diencerkan dengan sedikit air suling. Kemudian dimasukkan ke dalam labu takar 100 ml. Volumenya dicukupkan dengan air suling hingga 100 ml.
3.6.3 Pembuatan Suspensi Serbuk Tablet Parasetamol 10% (b/v)
Timbang seksama setara dengan 2,5 g parasetamol zat aktif lalu digerus dalam lumpang, ditambahkan suspensi CMC sedikit demi sedikit sambil digerus sampai homogen. Kemudian dimasukkan ke dalam labu tentukur 25 ml. Volumenya dicukupkan dengan suspensi CMC hingga 25 ml.
3.7 Prosedur Kerja
3.7.1 Pembuatan Kurva Kalibrasi Natrium
Larutan baku Natrium (1000 mcg/ml) sebanyak 1 ml dimasukkan
ke dalam labu tentukur 100 ml lalu diencerkan dengan air suling hingga garis tanda, didapat larutan 10 mcg/ml.
Dari larutan 10 mcg/ml masing-masing di pipet 0 ml; 1,5 ml; 3 ml;
4,5 ml; 6 ml; dan 7,5 ml dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan air suling hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 0,00 mcg/ml; 0,3 mcg/ml; 0,6 mcg/ml; 0,9 mcg/ml; 1,2 mcg/ml; dan 1,5 mcg/ml.
Dilakukan pengukuran pada panjang gelombang 589,6 nm bersama
xxxiii
3.7.2Pembuatan Kurva Kalibrasi Kalium
Dilakukan prosedur yang sama seperti pada natrium namun pada konsentrasi 10 mcg/ml dilakukan pemipetan 0 ml; 5 ml; 7,5 ml; 10 ml; 12,5 ml; dan 15 ml dan diencerkan dengan air suling hingga garis tanda sehingga diperoleh konsentrasi 0,00 mcg/ml; 1,0 mcg/ml; 1,5 mcg/ml; 2,0 mcg/ml; 2,5 mcg/ml; dan 3,0 mcg/ml . Pada pengukuran absorbansinya dilakukan pada panjang gelombang 766,5 nm.
3.7.3 Pemeriksaan Natrium
Dipipet sebanyak 20 ml sampel dan masukkan ke dalam
erlenmeyer ukuran 250 ml lalu ditambahkan 10 mL HNO3 65%. Kemudian dipanaskan selama ±30 menit pada hot plate.
Hasil pemanasan di tuangkan ke labu tentukur 50 ml, dan
diencerkan dengan aquabides hingga garis tanda.
Disaring dengan kertas saring Whatman no 42, dan 5 ml filtrat
pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung ke dalam botol (Badan Standarisasi Nasional,2006).
3.7.4 Pemeriksaan Kalium
Dilakukan prosedur yang sama seperti pemeriksaan natrium diatas, namun pada pengukuran absorbansinya dengan panjang gelombang 766,5 nm. Cara dan hasil perhitungan garis regresi kadar natrium dan kalium dapat dilihat pada
xxxiv
3.7.5 Pengujian Farmakologi
a. Penentuan Dosis Optimum 2,4-dinitrofenol
Merpati ditimbang beratnya, diukur suhu tubuhnya dengan cara mengukur suhu rektalnya dengan selang waktu 10 menit sebanyak tiga kali dan dihitung suhu rata-ratanya. Kemudian disuntikkan 2,4-dinitrofenol secara intramuskular pada bagian dada dengan variasi dosis 7, 8 dan 9 mg/Kg BB. Suhu rektal diukur dengan selang waktu 10 menit. Pengukuran suhu dilanjutkan sampai menit ke-120. Setiap percobaan dilakukan pengulangan sebanyak enam kali.
b. Perlakuan ke hewan coba
Hewan dibagi menjadi 8 kelompok terdiri dari :
Kelompok I : Pemberian Suspensi CMC Sebagai Kontrol
Kelompok II : Pemberian Suspensi Parasetamol Dosis 300 mg/kg BB
Kelompok III : Pemberian Minuman Ionik PW dosis 4,28 ml/kg BB
Kelompok IV : Pemberian Minuman Ionik MZ dosis 4,28 ml/kg BB
Kelompok V : Pemberian Minuman Ionik GR dosis 4,28 ml/kg BB
Kelompok VI : Pengujian Pengaruh Penggunaan Kombinasi Minuman Ionik PW dosis 4,28 ml/kg BB dan Parasetamol dosis 300 mg/kg BB
xxxv
Kelompok VIII : Pengujian Pengaruh Penggunaan Kombinasi Minuman Ionik GR dosis 4,28 ml/kg BB dan Parasetamol dosis 300 mg/kg BB
Sebelum perlakuan hewan ditimbang berat badannya dan diukur suhu
normal rektalnya dengan pengulangan sebanyak tiga kali, selang waktu 10 menit.
Semua hewan disuntikkan 2,4-dinitrofenol secara intramuskular pada
bagaian dada dengan dosis 8 mg/Kg BB.
Kelompok I, setelah disuntikkan 2,4-dinitrofenol kemudian diukur suhu
rektalnya dengan selang waktu 10 menit. Pada menit ke-20 diberikan suspensi CMC secara oral. Pengukuran suhu dilanjutkan sampai menit ke-120. Setiap percobaan dilakukan pengulangan sebanyak enam kali.
Kelompok II, perlakuannya sama dengan kelompok I namun diberikan
suspensi parasetamol dosis 300 mg/kg BB.
Kelompok III, IV dan V setelah disuntikkan 2,4-dinitrofenol kemudian
diukur suhu rektalnya dengan selang waktu 10 menit. Pada menit ke-20, ke-50, ke- 80, ke- 110 diberikan minuman ionik dosis 4,28 ml/kg BB secara oral. Pengukuran suhu dilanjutkan sampai menit ke-120. Setiap percobaan dilakukan pengulangan sebanyak enam kali.
Kelompok VI, VII dan VIII setelah disuntikkan 2,4-dinitrofenol kemudian
xxxvi
80, 110 secara oral. Pengukuran suhu dilanjutkan sampai menit ke-120. Setiap percobaan dilakukan pengulangan sebanyak enam kali.
Hasil percobaan dapat dilihat pada lampiran 17, halaman 68.
c. Analisis Data
Untuk membandingkan penurunan suhu tubuh dari pemberian suspensi CMC, serbuk tablet parasetamol dosis 300 mg/Kg BB, minuman ionik PW, MZ, GR dosis 4,28 ml/kg BB, kombinasi minuman ionik PW, MZ, GR dosis 4,28 ml/kg BB dan parasetamol dosis 300 mg/Kg BB, dianalisis secara statistik menggunakan Anava dengan taraf kepercayaan 95%. Uji lanjutan yang digunakan untuk melihat perbedaan yang nyata antar perlakuan adalah uji rata-rata Duncan. Analisis statistik menggunakan program SPSS (Statistical Product Service
xxxvii
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengumpulan Sampel
Minuman ionik yang beredar di Indonesia sebanyak 83 produk dengan 31 merek dagang, 10 merek dagang beredar di kota Medan. Penelitian ini menggunakan tiga minuman ionik, dua diantaranya (sampel MZ dan GR) ditentukan secara undian. Sedangkan satu sampel (sampel PW) ditetapkan karena minuman ini paling laris di seluruh Indonesia (Anonim, 2010). Tablet parasetamol yang diambil adalah tablet Panadol .®
4.2 Pemeriksaan Kuantitatif
4.2.1 Kurva Kalibrasi Natrium dan Kalium
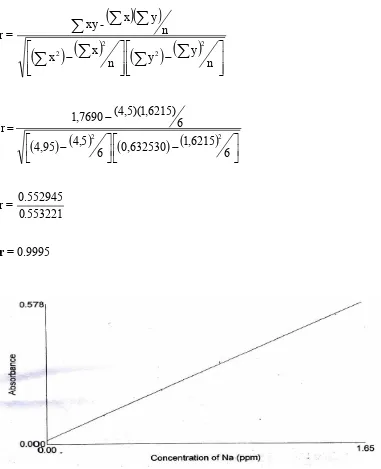
Dari hasil pengukuran absorbansi larutan standar natrium yang berada dalam konsentrasi rentang kerja natrium pada panjang gelombang 589 nm diperoleh persamaan garis regresi y = 0,35108x + 0,00694 dengan koefisien korelasi r = 0,9995
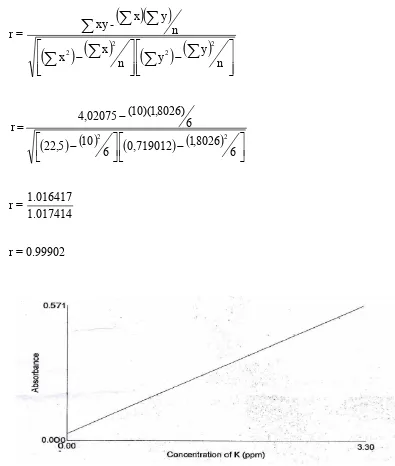
Sedangkan untuk hasil pengukuran absorbansi larutan standar kalium yang berada dalam konsentrasi rentang kerja kalium pada panjang gelombang 766,5 nm diperoleh persamaan garis regresi y = 0,17424x + 0,01003 dengan koefisien korelasi r = 0,9990. Data dan perhitungan dapat dilihat pada lampiran 1-4,
xxxviii
Kadar natrium dan kalium diperoleh dari persamaan garis regresi larutan standarnya. Hasil analisis kuantitatif natriium dan kalium kemudian dilanjutkan ke uji validasi untuk menyatakan penetapan kadar dapat diukur secara cermat dan akurat:
a) Batas Deteksi dan Batas Kuantitasi
Hasil pengujian sampel untuk pemeriksaan natrium diperoleh konsentrasi 0,93870 mcg/ml, sedangkan LOD 0,05953 mcg/ml dan LOQ 0,19843 mcg/ml. Kemudian pengujian sampel untuk pemeriksaan kalium diperoleh konsentrasi 1,3789 mcg/ml, dimana LOD kalium 0,1606 mcg/ml dan LOQ 0,53534 mcg/ml. Dari hasil perhitungan di atas dapat dilihat bahwa, hasil yang diperoleh pada pengukuran sampel diatas batas deteksi dan batas kuantitasi. Sehingga penetapan kadar natrium dan kalium memenuhi persyaratan. Data dan perhitungan dapat dilihat pada lampiran 5-6 halaman 37.
b) Uji Perolehan Kembali
xxxix
[image:41.595.108.524.276.467.2]Berdasarkan hasil analisis kuantitatif diatas maka didapatkan kadar natrium dan kalium (mcg/ml) dalam sampel juga disertakan kadar natrium dan kalium (mcg/ml) yang tertera pada etiket masing-masing. Data dapat dilihat pada tabel 1
Tabel 1 Data hasil pengukuran kadar natrium dan kalium (mcg/ml) dalam sampel dan kadar dalam etiket
No. Sampel Kadar natrium (mcg/ml) hasil pengukuran Kadar kalium (mcg/ml) hasil pengukuran Kadar natrium (mcg/ml) pada etiket Kadar kalium (mcg/ml) pada etiket 1. 2. 3. PW MZ GR 465,216 ± 2,433 325,425 ± 1,723 380,425 ± 5,030 169,936 ± 2,002 320,298 ± 3,338 265,616 ± 1,560 450 220 454 110 190 212
Keterangan : Hasil pengukuran yang diperoleh merupakan rata-rata dari 6 kali ulangan
xl
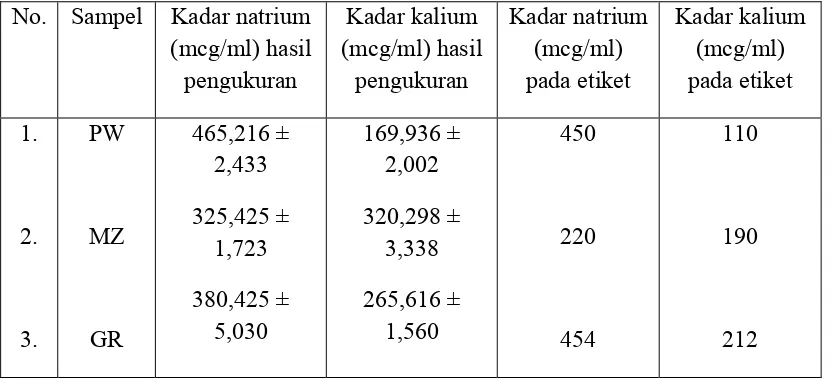
4.3 Orientasi Dosis Optimum 2,4-dinitrofenol
Pengujian penginduksi demam dengan menggunakan larutan 2,4-dinitrofenol yang disuntikkan secara intramuskular pada daerah otot dada dengan variasi dosis 7 mg/kg BB, 8 mg/kg BB dan 9 mg/kg BB. Perubahan suhu tubuh rata-rata merpati setelah pemberian 2,4-dinitrofenol dapat dilihat tabel 2 dan
gambar 1.
Tabel 2 Data perubahan suhu tubuh rata-rata merpati (oC SD) setelah pemberian larutan 2,4-dinitrofenol 0,5% dosis 7, 8 dan 9 mg/kg BB selama 120 menit
Suhu tubuh rata-rata merpati (oC ± SD) setelah pemberian larutan 2,4-Dnf 0,5%
Waktu
(menit) 2,4-Dnf 7 mg/kg BB 2,4-Dnf 8 mg/kg BB 2,4-Dnf 9 mg/kg BB 0 10 20 30 40 50 60 70 80 90 100 110 120
41,63 ± 0,35 42,46 ± 0,56 42,71 ± 0,66 42,66 ± 0,55 42,68 ± 0,39 42,80 ± 0,15 42,71 ± 0,09 42,55 ± 0,24 42,41 ± 0,31 42,33 ± 0,32 42,25 ± 0,41 42,08 ± 0,31 42,13 ± 0,34
41,52 ± 0,16 42,61 ± 0,52 42,68 ± 0,66 42,76 ± 0,39 42,83 ± 0,15 42,91 ± 0,13 42,93 ± 0,20 42,88 ± 0,30 42,73 ± 0,36 42,53 ± 0,37 42,48 ± 0,30 42,31 ± 0,39 42,26 ± 0,39
41,27 ± 0,16 42,08 ± 0,24 42,16 ± 0,28 42,21 ± 0,36 42,41 ± 0,16 42,60 ± 0,14 42,73 ± 0,23 42,66 ± 0,33 42,48 ± 0,43 42,41 ± 0,39 42,35 ± 0,40 42,41 ± 0,64 42,21 ± 0,51
Gambar 1. Grafik perubahan suhu tubuh rata-rata merpati (oC SD) setelah pemberian larutan 2,4-dinitrofenol 0,5% dosis 7, 8 dan 9 mg/kg BB selama 120 menit
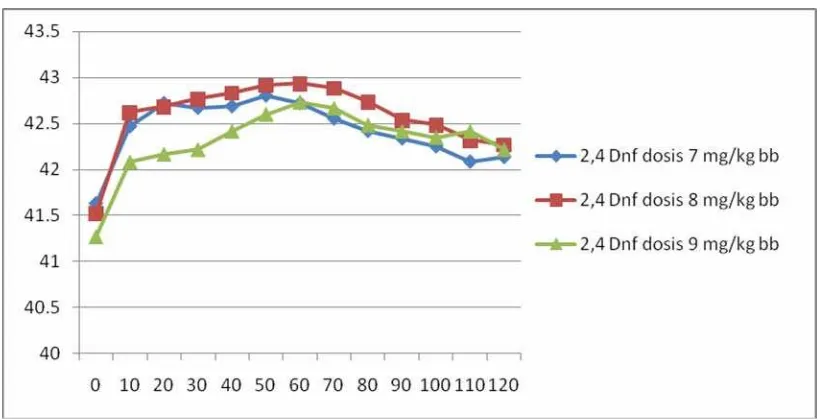
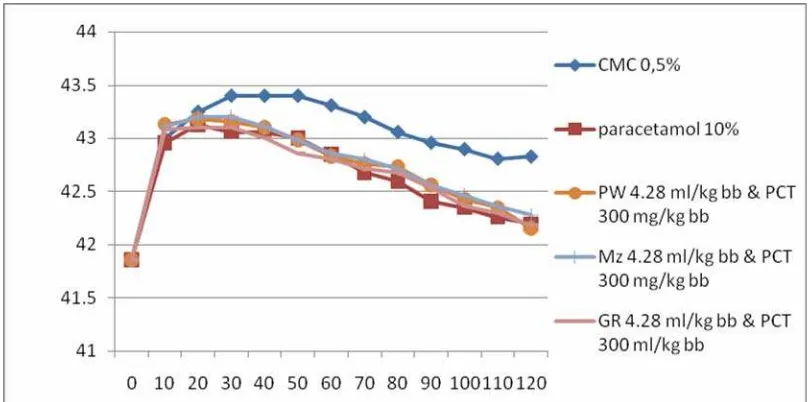
[image:43.595.113.523.436.646.2]4.4 Hasil pengamatan efek Antipiretik
Perlakuan farmakologi menunjukkan hasil berbeda untuk beberapa kelompok hewan yang terlihat pada gambar 2 dan gambar 3.
[image:44.595.113.519.187.385.2]
Gambar 2. Grafik pengaruh pemberian minuman ionik tunggal terhadap perubahan suhu tubuh rata-rata merpati (oC SD) setelah diinduksi
dengan larutan 2,4-dinitrofenol 0,5% dosis 8 mg/kg BB
Gambar 3. Grafik pengaruh pemberian kombinasi minuman ionik dan parasetamol terhadap perubahan suhu tubuh rata-rata merpati (oC SD) setelah diinduksi dengan larutan 2,4-dinitrofenol 0,5% dosis 8
mg/kg BB
[image:44.595.113.519.463.664.2]xliii
Data setelah penginduksian larutan 2,4-dinitrofenol dan pemberian bahan uji dapat dilihat pada lampiran 17 dan 18, halaman 68.
a) Perbandingan pemberian minuman ionik tunggal dengan pemberian parasetamol tunggal
Setelah penginduksian larutan 2,4-dinitrofenol dan pemberian minuman ionik dosis 4,28 ml/kg BB secara berulang-ulang, terlihat kenaikan suhu dimulai dari menit ke-10 sampai menit ke-50 untuk minuman ionik PW dan MZ dan sampai menit ke-40 untuk minuman ionik GR. Penurunan suhu mulai terjadi pada menit ke-60 sampai menit ke-120, namun penurunannya juga tidak sampai pada batas suhu normal seperti pada kelompok pemberian parasetamol tunggal yang mampu menurunkan sampai batas normal, tetapi lebih baik dari kelompok pemberian suspensi CMC. Hal ini membuktikan parasetamol berfungsi sebagai antipiretik dengan kemampuan menghambat siklooksigenase di otak (Goodman dan Gilman, 2007) dan juga menggambarkan minuman ionik hanya berfungsi menjaga keseimbangan cairan tubuh dan memberikan manfaat positif dalam mengoptimasi proses rehidrasi (Irawan, 2007). Disini juga mencerminkan minuman ionik berfungsi untuk mengatasi keparahan gejala demam.
b) Perbandingan pemberian kombinasi minuman ionik dan suspensi parasetamol dengan pemberian parasetamol tunggal
xliv
sampai menit ke-40. Penurunan suhunya terjadi dimulai pada menit ke-50 sampai pada menit ke-120, namun tidak sampai menurunkan ke batas suhu normal seperti pemberian parasetamol tanpa kombinasi dengan minuman ionik walaupun lebih baik dari pemberian suspensi saja. Hal ini membuktikan minuman ionik memberikan pengaruh kepada efek antipiretik parasetamol dalam hal ini memperlambat kerja dari parasetamol.
c) Hasil uji statistik
Pada hasil analisis variansi (Anava) secara SPSS pada menit pertama (menit 0) untuk semua perlakuan menunjukkan nilai signifikan 0,085 dan menit 10 menunjukkan nilai signifikan 0,077. Ini menunjukkan tidak adanya perbedaaan yang bermakna antara perlakuan karena nilai signifikansi lebih besar dari 0,05, sedangkan pada menit 20 menunjukkan nilai signifikansi 0,026, pada menit 30 menunjukkan nilai signifikansi 0,002 dan pada menit 40 menunjukkan nilai signifikansi 0,005. Dari nilai signifikansi pada menit 20 sampai menit 120 menunjukkan bahwa terdapat perbedaan antar perlakuan karena nilai signifikansi lebih kecil dari 0,05 pada tingkat kepercayaan 95%. Data dapat dilihat pada lampiran 20, halaman 78.
xlv
ke dalam sirkulasi sistemik dan dapat memberikan efek (Goodman dan Gilman, 2007).
Pemberian kombinasi minuman ionik PW, MZ, GR dosis 4,28 ml/Kg BB secara berulang-ulang dengan suspensi parasetamol dosis 300 mg/Kg BB, dengan taraf nyata (α = 0.05) pada menit 40 sampai menit 90 menunjukkan bahwa tidak memiliki perbedaan yang bermakna dengan pemberian minuman ionik PW, MZ, GR dosis 4,28 ml/Kg BB tunggal secara berulang-ulang, tetapi menunjukkan perbedaan yang bermakna dengan kelompok pemberian suspensi CMC. Disini tampak pemberian kombinasi minuman ionik dengan parasetamol dan pemberian minuman ionik tunggal mempunyai efek yang hampir sama sebagai antipiretik dan pencegahan dehidrasi.
xlvi
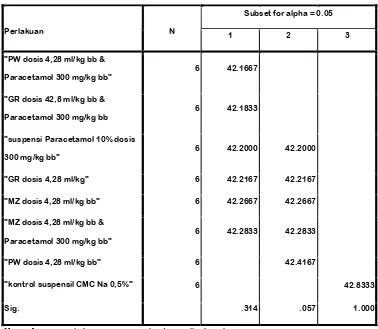
[image:48.595.111.489.260.589.2]BB tunggal secara berulang-ulang mempunyai efek antipiretik yang berbeda dengan pemberian kombinasi minuman ionik PW secara berulang-ulang dengan suspensi parasetamol dosis 300 mg/kg BB. Dalam hal ini menggambarkan pengaruh untuk pemberian minuman ionik terhadap parasetamol.
Tabel 3 Hasil Uji Duncan pada menit 120
Duncan
Subset for alpha = 0.05
Perlakuan N 1 2 3
"PW dosis 4,28 ml/kg bb &
Paracetamol 300 mg/kg bb"
6 42.1667
"GR dosis 42,8 ml/kg bb &
Paracetamol 300 mg/kg bb
6 42.1833
"suspensi Paracetamol 10% dosis
300 mg/kg bb"
6 42.2000 42.2000
"GR dosis 4,28 ml/kg" 6 42.2167 42.2167
"MZ dosis 4,28 ml/kg bb" 6 42.2667 42.2667
"MZ dosis 4,28 ml/kg bb &
Paracetamol 300 mg/kg bb"
6 42.2833 42.2833
"PW dosis 4,28 ml/kg bb" 6 42.4167
"kontrol suspensil CMC Na 0,5%" 6 42.8333
Sig. .314 .057 1.000
Means for groups in homogeneous subsets are displayed.
xlvii
xlviii
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil uji efek antipiretik menunjukkan bahwa pemberian minuman ionik dosis 4,28 ml/kg BB tunggal secara berulang-ulang mempunyai efek antipiretik yang lebih kecil dari pemberian suspensi serbuk tablet parasetamol dosis 300 mg/kg BB secara tunggal. Pemberian kombinasi minuman ionik dosis 4,28 ml/kg BB secara berulang-ulang dengan suspensi serbuk tablet parasetamol dosis 300 mg/kg BB dapat mempengaruhi efek antipiretik dari parasetamol. Hal ini terlihat dari perbandingannya dengan pemberian suspensi serbuk tablet parasetamol dosis 300 mg/kg BB secara tunggal yang lebih cepat menurunkan suhu tubuh ke batas normal.
xlix
5.2 Saran
l
DAFTAR PUSTAKA
Anonim, (2010), Top brand index. http://www.topbrand-award. com/index ....tator&Itemid=1
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Utama. Halaman. 228-231.
Badan Standarisasi Nasional. (2006). Cara Uji Air Minum Dalam Kemasan. SNI 01-3554-2006. Halaman 33.
Connors, K.A., et al. (1986). Stabilitas Kimiawi Sediaan Farmasi. Edisi II. Jilid Kedua. Jakarta: Jhon willey and Sons. Halaman 180, 197-201.
Cronan, K.M. (2010). Dehydration. The Neumours Foundation-kids health. Halaman 1-3.
Day, R.A. and Underwood,J.R. (1980). Analisis Kimia Kuantitatif. Penerjemah : Soendoro, R.,dkk. Edisi keempat. Jakarta: Erlangga. Halaman 384-386. Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Departemen Kesehatan RI.
Jakarta: Halaman 748.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI. Jakarta: Halaman 112
Ganong, W.F. (2008). Buku Ajar Fisiologi Kedokteran. Edisi XXII. Penerjemah: M. Djuhari Widjajakusumah. Jakarta: Penerbit EGC. Halaman 253-266. Gibson, G.G dan Skett, P. (1991). Pengantar Metabolisme Obat. Penerjemah: Iis
Aisyah. Jakarta: Penerbit EGC. Halaman 164-164, 187-190.
Goodman dan Gilman. (2007). Dasar Farmakologi Terapi. Volume 2. Penerjemah: Cucu Aisyah. Jakarta: Penerbit EGC. Halaman 669, 1736-1737.
Guyton, A.(1994). Buku Ajar Fisiologi Kedokteran. Edisi VII. Bagian 3. Penerjemah: Ken Ariata. Jakarta: Penerbit EGC. Halaman 180-191.
Guyton, A dan Hall, J.E. (2007). Buku Ajar Fisiologi Kedokteran. Edisi XI. Penerjemah: Irawati. Jakarta: Penerbit EGC. Halaman 936-948.
li
Katzung, B. G. (2001). Farmakologi Dasar dan Klinik. Edisi II. Penerjemah: Dripa Sjabana. Jakarta: Salemba Medika. Halaman 484-485.
Neal, M.J. (2005). At A Galnce Farmakologi Medis. Edisi V. Penerjemah Juwalita Surapsari. Jakarta: Penerbit Erlangga. Halaman 8-15.
Rohman, A. (2007). Kimia Farmasi Analisis, Pustaka Pelajar Universitas Islam Indonesia, Halaman 298.
Sherwood, Lauralee. (2001). Fisiologi Manusia dari Sel ke Sistem. Edisi II. Penerjemah: Pendit. Jakarta: Penerbit EGC. Halaman 597-601.
Sodeman, W.A dan Sodeman T.M. (1995). Sodeman Patofisiologi. Edisi 7. Jilid II. Penerjemah: Andry Hartono. Jakarta: Hipokrates. Halaman 177-196 SPSS for Windows. (2010). Anova One Way ( Computer Program). Version 16.0:
Computerized system.
Tjay, T.H. dan Kirana Raharja. (2002). Obat-obat penting, khasiat, penggunaan,
dan efek-efek sampingnya. Edisi 5. cetakan II. Jakarta: Penerbit PT Elex
Media Komputindo. Halaman 295.
Wibisono,Y. (2005). Metode Statistik. Cetakan 1. Yogyakarta: Gadjah Mada University Press. Halaman 451-452.
Lampiran 1. Hasil Pengukuran Absorbansi Larutan Standar Natrium dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) dari Data Kalibrasi Natrium
No Konsentrasi (mcg/ml) Absorbansi
1 0,0 0,0000
2 0,3 0,1158
3 0,6 0,2181
4 0,9 0,3319
5 1,2 0,4293
6 1,5 0,5264
No X Y X2 Y2 XY
1 0,0 0,0000 0,00 0,00000000 0,00000
2 0,3 0,1158 0,09 0,01340964 0,03474
3 0,6 0,2181 0,36 0,04756761 0,13086
4 0,9 0,3319 0,81 0,11015761 0,29871
5 1,2 0,4293 1,44 0,18429849 0,51516
6 1,5 0,5264 2,25 0,27709696 0,78960
∑X = 4,5 ∑Y = 1,6215 ∑X2 = 4,95 ∑Y2=0,632530 XY = 1,76907 X = 0,75 Y= 0,27025
a =
n x x n y x -xy 2 2
a = 6 4,5 95 , 4 6 ) 6215 , 1 )( 5 , 4 ( 1,76907 2 a = 0.35108
b = y- ax
= 0,27025 – (0.35108)(0,75) = 0.00694
Persamaan Regresinya adalah Y = 0,35108x + 0,00694
Lampiran 1. Lanjutan r =
n y y n x x n y x -xy 2 2 2 2
6 6215 , 1 632530 , 0 6 5 , 4 95 , 4 6 ) 6215 , 1 )( 5 , 4 ( 7690 , 1 r 2 2 r = 0.553221 0.552945 [image:55.595.115.496.103.572.2]r = 0.9995
Gambar 4. Kurva Kalibrasi Larutan Standar Na
Lampiran 2. Hasil Pengukuran Absorbansi Larutan Standar Kalium dan Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) dari Data Kalibrasi Kalium
No Konsentrasi (mcg/ml) Absorbansi
1 0,0 0,0000
2 1,0 0,1918
3 1,5 0,2775
4 2,0 0,3627
5 2,5 0,4490
6 3,0 0,5216
No X Y X2 Y2 XY
1 0,0 0,0000 0,00 0,000000 0,00000
2 1,0 0,1918 1,00 0.036787 0.19180
3 1,5 0,2775 2.25 0.077006 0.41625
4 2,0 0,3627 4,00 0.131551 0.72540
5 2,5 0,4490 6.25 0.201601 1.12250
6 3,0 0,5216 9,00 0.272067 1.56480
∑X = 10 ∑Y = 1,8026 ∑X2 =22,5 ∑Y2=0,719012 XY = 4,02075 X =1,6667 Y= 0,30043
a =
n x x n y x -xy 2 2
a = 6 10 5 , 22 6 ) 8026 , 1 )( 10 ( 4,02075 2 a = 0.17424
b = y- ax
= 0,300433 – (0,174243)(1,6667) = 0.01003
= 0.01003
Persamaan Regresinya adalah y = 0,17424x + 0,01003
Lampiran 2. Lanjutan r =
n y y n x x n y x -xy 2 2 2 2
6 8026 , 1 0,719012 6 10 5 , 22 6 ) 8026 , 1 )( 10 ( 02075 , 4 r 2 2 r = 1.017414 1.016417 [image:57.595.105.500.115.581.2]r = 0.99902
Gambar 5. Kurva Kalibrasi Larutan Standar K
lv
Lampiran 3. Perhitungan Batas Deteksi dan Batas Kuantitasi Natrium Persamaan
garis regresi : Y = 0,35108x + 0,00694
No
Konsentrasi (X)
Absorbansi
(Y) Yi Y – Yi (Y – Yi)2 . 10 -4
1 0,0 0,0000 0,00694 -0,00694 0,481636
2 0,3 0,1158 0,11226 0,00354 0,125316
3 0,6 0,2181 0,21758 0,00052 0,002704
4 0,9 0,3319 0,32290 0,00900 0,810000
5 1,2 0,4293 0,42822 0,00108 0,011664
6 1,5 0,5264 0,533545 -0,00714 0,510510
n = 6 ∑ (Y – Yi)2 = 1,9413
x 10-4
SD =
2 -n Yi Y 2
= 4 0,00019413= 6,9665 x 10-3
RSD = X SD
x 100% =
0,75 0,0069665
= 9,2886 x 10-3
LOD = Slope SD x 3 LOD = 0,35107 0,0069665 x 3
= 0,05953 mcg/ml
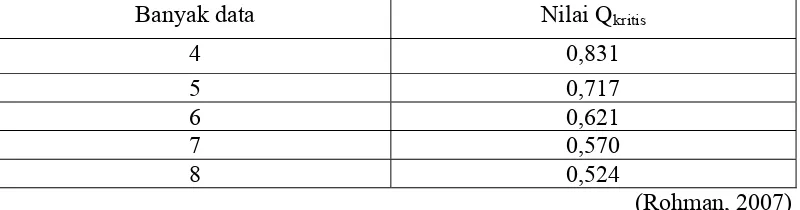
LOQ = Slope SD x 10 (Rohman, 2007) LOQ = 0,35107 0,0069665 x 10
= 0,19843 mcg/ml
Lampiran 4. Perhitungan Batas Deteksi dan Batas Kuantitasi Kalium Persamaan garis regresi : Y = 0,17424x + 0,01003
No
Konsentrasi (X)
Absorbansi
(Y) Yi Y – Yi (Y – Yi)2 . 10 -4
1 0,0 0,0000 0,01002 -0,01002 1,00580
2 1,0 0,1918 0,18427 0,00753 0,57009
3 1,5 0,2775 0,27139 0,00611 0,37332
4 2,0 0,3627 0,35851 0,00418 0,17514
5 2,5 0,4490 0,44563 0,00337 0,11356
6 3,0 0,5216 0,53275 -0,01115 1,24322
n = 6
∑ (Y – Yi)2 = 3,48113 10
x -4
SD =
2 -n Yi Y 2
= 4 3 0,00034811= 9,328 X 10-3
RSD = X SD
X 100% =
1,6667 0,009328
= 5,5966 X 10-3
LOD = Slope SD x 3 LOD = 0,174243 0,009328 x 3
= 0,1606 mcg/ml
LOQ = Slope SD x 10 LOQ = 0,174243 0,009328 x 10
= 0,53534 mcg/ml
Lampiran 5. Contoh Perhitungan Hasil Penetapan kadar natrium dalam Sampel dan Data Hasil Volume Sampel, Absorbansi, Konsentrasi, Kadar Logam Natrium pada Setiap sampel dengan 6 kali Replikasi
Dengan Menggunakan Persamaan Garis Regresi Contoh perhitungan konsentrasi natrium dalam sampel yang volume pemipetannya 20,00 ml dan 0,3365 absorbansi
X = Konsentrasi sampel
Y = Absorbansi sampel
Persamaan garis regresi yang diperoleh dari kurva kalibrasi adalah
Y = 0,35108X + 0,00694
X =
35108 , 0
00694 , 0 3365 ,
0
X = 0,9387 mcg/ml
Maka konsentrasi sampel tersebut adalah 0,9387 mcg/ml
Kadar = W CxVxFp
Keterangan : C = Konsentrasi larutan sampel (mcg/ml)
V = Volume larutan sampel (ml)
Fp = Faktor pengenceran
W = Volume pemipetan sampel (ml)
Untuk Natrium Faktor pengencerannya 200, diperoleh dari pemipetan dari larutan sampel sebanyak 10 ml lalu dituang ke labu tentuukur 100 ml dan diencerkan dengan akuabides sampai garis tanda (pengenceran 10 kali). Dari larutan dengan pengenceran 10 kali, dipepet lagi 10 ml lalu dituang ke labu tentu ukur 100 ml dan diencerkan dengan akubides sampai garis tanda (pengenceran 100 kali). Dari larutan dengan pengenceran 100 kali dipipet 50 ml lalu dituang ke labu tentu ukur 100 ml dan diencerkan dengan akuabides sampai garis tanda. Didapat larutan sampel dengan pengenceran 200 kali.
Kadar =
ml mlx mlx mcg
00 , 20
200 50
/ 9387 , 0
= 469,35 mcg/ml
Maka kadar natrium yang terkandung dalam sampel adalah 469,35 mcg/ml
lx
Data Hasil Volume Sampel, Absorbansi, Konsentrasi, dan Kadar Logam Natrium pada Setiap sampel dengan 6 kali Replikasi
No Sampel Volume Sampel
(ml)
Absorbansi Konsentrasi (mcg/ml)
Kadar (mcg/ml)
20,00 0,3365 0,93870 469,35
20,00 0,3339 0,93130 465,65
20,00 0,3338 0,93101 465,50
20,00 0,3332 0,92930 464,65
20,00 0,3322 0,92645 463,20
1 PW
20,00 0,3320 0,92589 462,95
20,00 0,2363 0,65330 326,65
20,00 0,2355 0,65102 325,50
20,00 0,2358 0,65187 325,90
20,00 0,2375 0,64672 323,35
20,00 0,2342 0,64732 323,65
2 MZ
20,00 0,2369 0,65501 327,50
20,00 0,2763 0,76723 382,60
20,00 0,2772 0,76980 384,90
20,00 0,2712 0,75271 376,35
20,00 0,2699 0,74900 374,50
20,00 0,2724 0,75612 378,05
3 GR
20,00 0,2781 0,77236 386,15
Lampiran 6. Contoh Perhitungan Hasil Penetapan kadar Kalium dalam Sampel dan Data Hasil Volume Sampel, Absorbansi, Konsentrasi, Kadar Logam Kalium pada Setiap Sampel dengan 6 kali Replikasi
Dengan Menggunakan Persamaan Garis Regresi Contoh perhitungan konsentrasi kalium dalam sampel yang volumenya pemipetannya 20 ml dan absorbansi 0,2503.
X = Konsentrasi sampel
Y = Absorbansi sampel
Persamaan garis regresi yang diperoleh dari kurva kalibrasi adalah
Y = 0,17424x + 0,01003
X =
17424 , 0
01003 , 0 2503 ,
0
X = 1,37896 mcg/ml
Maka konsentrasi sampel tersebut adalah 1,3789 mcg/ml
Kadar = W CxVxFp
Keterangan : C = Konsentrasi larutan sampel (mcg/ml)
V = Volume larutan sampel (ml)
Fp = Faktor pengenceran
W = Volume pemipetan sampel (ml)
Untuk Kalium Faktor pengencerannya 50, diperoleh dari pemipetan dari larutan sampel sebanyak 10 ml lalu dituang ke labu tentuukur 100 ml dan diencerkan dengan akuabides sampai garis tanda (pengenceran 10 kali). Dari larutan dengan pengenceran 10 kali, dipepet lagi 20 ml lalu dituang ke labu tentu ukur 100 ml dan diencerkan dengan akubides sampai garis tanda. Didapat larutan sampel dengan pengenceran 50 kali.
Kadar = ml mlx mlx mcg 00 , 20 50 50 / 3789 , 1
= 172,3625 mcg/ml
Maka kadar kalium yang terkandung dalam sampel adalah 172,36 mcg/ml
Data Hasil Volume Sampel, Absorbansi, Konsentrasi, dan Kadar Logam Kalium pada Setiap Sampel dengan 6 kali Replikasi
No Sampel Volume Sampel (ml) Absorbansi Konsentrasi (mcg/l) Kadar (mcg/ml)
20,00 0,2503 1,37896 172,36
20,00 0,2461 1,35485 169,35
20,00 0,2501 1,37781 172,21
20,00 0,2462 1,35543 169,42
20,00 0,2441 1,34338 167,91
1 PW
20,00 0,2448 1,34739 168,37
20,00 0,4593 2,57845 322,30
20,00 0,4589 2,57616 322,01
20,00 0,4624 2,59624 324,52
20,00 0,4520 2,53655 317,06
20,00 0,4512 2,53197 316,48
2 MZ
20,00 0,4553 2,55550 319,42
20,00 0,3823 2,13653 267,06
20,00 0,3798 2,12219 265,26
20,00 0,3774 2,10841 263,53
20,00 0,3829 2,13997 267,48
20,00 0,3805 2,12620 265,76
3 GR
20,00 0,3789 2,11702 264,61
lxiii
Lampiran 7. Perhitungan Kadar Natrium dan Kalium
1. Natrium
A. Konsentrasi
y = 0,35108x + 0,00694
y = absorbansi, x = konsentrasi
A.1 Sampel PW
1. 0,3365 = 0,35108x + 0,00694
x = 0,93870 mcg/ml
2. 0,3339 = 0,35108x + 0,00694
x = 0,93130 mcg/ml
3. 0,3338 = 0,35108x + 0,00694
x = 0,93101 mcg/ml
4. 0,3332 = 0,35108x + 0,00694
x = 0,92930 mcg/ml
5. 0,3322 = 0,35108x + 0,00694
x = 0,92645 mcg/ml
6. 0,3320 = 0,35108x + 0,00694
lxiv Lampiran 7. Lanjutan
A.2 Sampel MZ
1. 0,2363 = 0,35108x + 0,00694
x = 0,65330 mcg/ml
2. 0,2355 = 0,35108x + 0,00694
x = 0,65102 mcg/ml
3. 0,2358 = 0,35108x + 0,00694
x = 0,65187 mcg/ml
4. 0,2375 = 0,35108x + 0,00694
x = 0,65672 mcg/ml
5. 0,2342 = 0,35108x + 0,00694
x = 0,64732 mcg/ml
6. 0,2369 = 0,35108x + 0,00694
x = 0,65501 mcg/ml
A.3 Sampel GR
1. 0,2763 = 0,35108x + 0,00694
2. 0,2772 = 0,35108x + 0,00694
x = 0,76980 mcg/ml
3. 0,2712 = 0,35108x + 0,00694
x = 0,75271 mcg/ml
4. 0,2699 = 0,35108x + 0,00694
x = 0,74900 mcg/ml
5. 0,2724 = 0,35108x + 0,00694
x = 0,75612 mcg/ml
6. 0,2781 = 0,35108x + 0,00694
x = 0,77236 mcg/ml
B. Kadar
Kadar (mcg/ml) =
W Fp x V x C
Keterangan : C = Konsentrasi larutan sampel (mcg/ml)
V = Volume larutan sampel (ml)
Fp = Faktor pengenceran
W = Volume pemipetan sampel (ml)
Lampiran 7. Lanjutan
B.1 Sampel PW
1. Kadar (mcg/ml) =
20,00 50 x
0,93870 x 200
= 469,35 mcg/ml
2. Kadar (mcg/ml) =
20,00 50 x
0,93130 x 200
= 465,65 mcg/ml
3. Kadar (mcg/ml) =
20,00 50 x
0,93101 x200
= 465,50 mcg/ml
4. Kadar (mcg/ml) =
20,00 50 x
0,92930 x 200
= 464,65 mcg/ml
5. Kadar (mcg/ml) =
20,00 50 x
0,92645 x 200
= 463,20 mcg/ml
6. Kadar (mcg/ml) =
20,00 50 x
0,92589 x 200
= 462,95 mcg/ml
B.2 Sampel MZ
1. Kadar (mcg/ml) =
20,00 50 x
0,65330 x 200
= 326,65 mcg/ml
2. Kadar (mcg/ml) =
20,00 50 x
0,65102 x 200
= 325,50 mcg/ml
3. Kadar (mcg/ml) =
20,00 50 x
0,65187 x 200
= 325,90 mcg/ml
4. Kadar (mcg/ml) =
20,00 50 x
0,64672 x 200
= 323,35 mcg/ml
5. Kadar (mcg/ml) =
20,00 50 x
0,64732 x 200
= 323,65 mcg/ml
6. Kadar (mcg/ml) =
20,00 50 x
0,65501 x 200
= 327,50 mcg/ml
B.3 Sampel GR
1. Kadar (mcg/ml) =
20,00 50 x
0,76723 x 200
= 382,60 mcg/ml
2. Kadar (mcg/ml) =
20,00 50 x
0,76980 x 200
= 384,90 mcg/ml
3. Kadar (mcg/ml) =
20,00 50 x
0,75271 x 200
= 376,35 mcg/ml
4. Kadar (mcg/ml) =
20,00 50 x
0,74900 x 200
= 374,50 mcg/ml
5. Kadar (mcg/ml) =
20,00 50 x
0,75612 x 200
= 378,05 mcg/ml
6. Kadar (mcg/ml) =
20,00 50 x
0,77236 x 200
= 386,15 mcg/ml
2. Kalium
A. Konsentrasi
y = 0,17424x + 0,01003
y = absorbansi, x = konsentrasi
lxviii Lampiran 7. Lanjutan
A.1 Sampel PW
1. 0,2503 = 0,17424x + 0,01003
x = 1,37896 mcg/ml
2. 0,2461 = 0,17424x + 0,01003
x = 1,35485 mcg/ml
3. 0,2501 = 0,17424x + 0,01003
x = 1,37781 mcg/ml
4. 0,2462 = 0,17424x + 0,01003
x = 1,35543 mcg/ml
5. 0,2441 = 0,17424x + 0,01003
x = 1,34338 mcg/ml
6. 0,2448 = 0,17424x + 0,01003
x = 1,34739 mcg/ml
A.2 Sampel MZ
1. 0,4593 = 0,17424x + 0,01003
lxix Lampiran 7. Lanjutan
2. 0,4589 = 0,17424x + 0,01003
x = 2,57616 mcg/ml
3. 0,4624 = 0,17424x + 0,01003
x = 2,59624 mcg/ml
4. 0,4520 = 0,17424x + 0,01003
x = 2,53655 mcg/ml
5. 0,4512 = 0,17424x + 0,01003
x = 2,53197mcg/ml
6. 0,4553 = 0,17424x + 0,01003
x = 2,55550 mcg/ml
A.3 Sampel GR
1. 0,