TOKSISITAS MERKURI DAN PENGARUHNYA TERHADAP
HISTOPATOLOGI IKAN NILA (Oreochromis niloticus)
ILHAM ZULFAHMI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Toksisitas Merkuri dan Pengaruhnya Terhadap Histopatologi Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Ilham Zulfahmi
RINGKASAN
ILHAM ZULFAHMI. Toksisitas Mekuri dan Pengaruhnya Terhadap Histopatologi Ikan Nila (Oreochromis niloticus). Dibimbing oleh RIDWAN AFFANDI dan DJAMAR T. F. LUMBAN BATU.
Ikan Nila (Oreochromis niloticus) merupakan salah satu spesies ikan yang sangat berpeluang terkontaminasi merkuri. Efek dari bahan pencemar, dapat berakibat pada kerusakan organ-organ pada makhluk hidup dan dapat menyebabkan kematian. Efek yang diakibatkan oleh merkuri ini bersifat akut atau bersifat kronik. Tujuan dari penelitian ini adalah untuk menentukan ambang batas dan toksisitas akut merkuri klorida (HgCl2) pada ikan nila, (Oreochromis niloticus) mengkaji pengaruh merkuri klorida (HgCl2) pada beberapa parameter biometrik (kelangsungan hidup, laju pertumbuhan bobot rata-rata harian kondisi hati dan empedu, keragaan reproduksi dan mengkaji tingkat kerusakan struktur histologis insang, hati dan ginjal ikan nila (Oreochromis niloticus) akibat paparan merkuri klorida (HgCl2).
Penelitian ini dilaksanakan dari bulan Februari sampai dengan Juni 2013. Ikan nila (Oreochromis niloticus) yang digunakan pada penelitian ini adalah berjenis kelamin betina dengan bobot rata-rata 20 gram atau kisaran panjang 11-13 cm sebanyak 400. Bahan toksikan yang digunakan pada penelitian ini adalah merkuri klorida (HgCl2). Wadah pemeliharan ikan uji yang digunakan adalah akuarium berukuran 60x40x30 cm dengan volume air sebanyak 43.2 liter. Masa pemeliharaan ikan uji dilakukan selama 56 hari. Penelitian ini terdiri atas tiga tahapan yaitu uji pendahuluan, uji akut, dan uji sub kronik. Untuk mengetahui perubahan yang terjadi pada kondisi biometrik ikan nila didekati dengan mengukur tingkat kelangsungan hidup (SR), laju pertumbuhan bobot rata-rata harian (LPBRH), kandungan merkuri pada organ ikan, hepatosomatik indeks (HSI), volume empedu relatif (VER), indeks kematangan gonad (IKG), fekunditas dan diameter telur, sedangkan kerusakan jaringan yang ditimbulkan merkuri pada organ ikan didekati dengan melakukan analisa gambaran kerusakan histologis pada preparat histologis dengan menggunakan pewarnaan Hematoksilin dan Eosin.
Hasil penelitian menunjukkan bahwa nilai LC50-96 jam merkuri klorida adalah sebesar 1.64 mgL-1. Tingkat kelangsungan hidup tertinggi terdapat pada perlakuan 0 mgL-1 (46.67 %) dan terendah pada perlakuan 0.196 mgL-1 (40.00 %). Merkuri klorida dengan konsentrasi 0.196 mgL-1 memberikan pengaruh yang nyata terhadap nilai HSI dan volume empedu relatif serta ukuran diameter telur ikan Nila(p < 0,05), namun pada konsentrasi 0.164 mgL-1 dan 0.196 mgL--1 tidak berpengaruh nyata terhadap laju pertumbuhan bobot, Indeks kematangan gonad (IKG) dan fekunditas ikan Nila (Oreochromis niloticus) (p>0,05). Merkuri klorida menyebabkan kerusakan pada organ insang (hyperplasia, hypertrophy, proliferation dan neukrosis), hati (hyperplasia, hemorhage, shrinkage of hepatocytes, proliferation dan neukrosis) dan ginjal (hyperplasia, hemorrhage, shrinkage of glomerulus, proliferation dan neukrosis).
SUMMARY
ILHAM ZULFAHMI. Mercury Toxicity and It’s Effect on Histopathology Change of Nile Tilapia (Oreochromis niloticus). Supervised by RIDWAN AFFANDI and DJAMAR T. F. LUMBAN BATU.
Nile tilapia (Oreochromis niloticus) is one of fish species that oportunity to contaminated with mercury. The effects of pollutants can damage living organisms organs and can cause death. The effects caused mercury had acute or chronic character. The aims of this study are to determine threshold and acute toxicity of mercury chloride (HgCl2) of Nile tilapia (Oreochromis niloticus), to assess the effect of mercury chloride (HgCl2) on several biometric parameters (survival, growth rate of average daily weighted, liver condition, bile and reproductive variability of Nile tilapia (Oreochromis niloticus), assess the level of damage to the histological structure of the gills, liver and kidney of Nile tilapia
(Oreochromis niloticus) caused mercury chloride (HgCl2) exposure.
This study was conducted from February to June 2013. Nile Tilapia
(Oreochromis niloticus) were used in this study were female with average weight 20 grams or 11-13 cm length range. Toxicant materials used in this study was mercury chloride (HgCl2). Fish were reared in each aquarium 60x40x30 containing 48 liters of water. This study consists of three stages: a preliminary test, acute test, and sub-chronic test. To determine the changes in biometric condition of tilapia approximated by measuring the survival rate (SR), the growth rate of average daily weight , the content of mercury in the fish organs, hepatosomatic index (HSI), the relative bile volume (VER), gonadal soamtic index (IKG), fecundity and oocit diameter, tissue damage caused by mercury in fish organs by making histological preparations stained with hematoxylin and eosin.
The median lethal concentration (96 hr, LC50) of Mercury Chloride was calculated as 1,64 mgL--1.The survival rate was highest in the control treatment (46,67 %) . Mercury chloride with concentration 0.196 mgL--1 show significant effect to changes HSI and relative bile volume, and oocyte diameter of Nile tilapia (p < 0,05). Mercury chloride with a concentration of 0,164 mgL-1 and 0,196 mgL-1 have not a significant effect on the growth rate of weight, gonadal somatic index and fecundity of Nile tilapia (p > 0,05). Mercury chloride cause damage to gills (hyperplasia, hypertrophy, proliferation and neukrosis), liver (hyperplasia, hemorhage, shrinkage of hepatocytes, proliferation and neukrosis) and kidney (hyperplasia, hemorrhage, shrinkage of the glomerulus, proliferation and neukrosis).
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
TOKSISITAS MERKURI DAN PENGARUHNYA TERHADAP
HISTOPATOLOGI IKAN NILA (Oreochromis niloticus)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Toksisitas Merkuri dan Pengaruhnya Terhadap Histopatologi Ikan Nila (Oreochromis niloticus)
Nama : Ilham Zulfahmi
NIM : C251110091
Disetujui oleh Komisi Pembimbing
Dr Ir Ridwan Affandi, DEA Ketua
Prof Dr Ir Djamar T.F.Lumban Batu, M.Agr Anggota
Diketahui oleh
Ketua Program Studi Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Haryadi, M.Sc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih pada penelitian yang dilaksanakan sejak bulan Februari 2013 ini ialah Pencemaran Lingkungan, dengan judul Toksisitas Merkuri dan Pengaruhnya Terhadap Histopatologi Ikan Nila (Oreochromis niloticus).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Ridwan Affandi DEA dan Bapak Prof Dr Ir Djamar TF Lumban Batu M.Agr selaku pembimbing. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Klasifikasi dan Morfologi Ikan Nila 3
Merkuri (Hg) 4
Toksisitas Merkuri Terhadap Organisme 4
Insang 6
Hati 7
Ginjal 9
3 METODE 9
Bahan 9
Alat 9
Tahapan Penelitian 10
Uji Pendahuluan 10
Uji Toksisitas Akut 12
Uji Sub Kronik 12
4 HASIL DAN PEMBAHASAN 16
Uji Pendahuluan 16
Uji Toksisitas Akut 17
Uji Sub Kronik 18
Parameter Fisika Kimia Air 18
Tingkat Kelangsungan Hidup 18
Laju Pertumbuhan Bobot 19
Kandungan Merkuri Pada Organ Hati dan Ginjal 20
Kondisi Hati dan Empedu 20
Indeks Kematangan Gonad 21
Fekunditas dan Diameter Telur 22
Histopatologi 23
Pembahasan 29
5 SIMPULAN 33
DAFTAR TABEL
1 Parameter fisika-kimia air yang akan di ukur 16 2 Data mortalitas ikan nila Pada uji nilai kisaran 16 3 Kisaran parameter fisika kimia air selama penelitian 18 4 Laju pertumbuhan bobot rata-rata harian ikan nila 19 5 Kandungan merkuri klorida (HgCl2) pada organ hati dan ginjal ikan nila 20 6 Pengaruh merkuri klorida (HgCl2) terhadap IKG ikan nila 21 7 Pengaruh merkuri klorida (HgCl2) terhadap fekunditas ikan nila 22 8 Pengaruh merkuri klorida (HgCl2) terhadap perubahan struktur
histologis insang nila (Oreochromis niloticus) 24 9 Pengaruh merkuri korida (HgCl2) terhadap perubahan struktur
histologis ginjal ikan nila (Oreochromis niloticus) 24 10 Pengaruh merkuri klorida (HgCl2) terhadap perubahan struktur
histologis hati ikan nila (Oreochromis niloticus) 26
DAFTAR GAMBAR
1 Ikan nila (Oreochromis niloticus) 3
2 Struktur histologis insang (Lagler et al.,1977) 7 3 Struktur histologis hati ikan (Camargo et al., 2007) 8 4 Struktur histologis ginjal ikan (Camargo et al., 2007) 9 5 Mortalitas kumulatif ikan Nila (Oreochromis niloticus) setelah
pemaparan merkuri klorida (HgCl2) selama 96 jam 17 6 Tingkat kelangsungan hidup ikan uji pada tingkatan sub kronik 19 7 Pengaruh merkuri klorida (HgCl2) terhadap HSI ikan nila 20
8 Pengaruh merkuri klorida (HgCl2) terhadap VER ikan nila 21
9 Pengaruh merkuri klorida terhadap distribusi diameter telur ikan nila 23 10 Perubahan struktur histologis insang ikan Nila (Oreochromis niloticus)
selama 56 hari pemaparan HgCl2. (a) perlakuan kontrol (0 mgL -1). (b, d, f, h) perlakuan 1 (0,164 mgL-1) pada hari ke 14, 28, 42 & 56. (c, e, g, i) perlakuan 2 (0,196 mgL-1) pada hari ke 14, 28,42 & 56. 25 11 Perubahan struktur histologis yang terjadi pada ginjal ikan Nila
(Oreochromis niloticus) selama 56 hari pemaparan HgCl2. (a)
perlakuan kontrol (0 mgL-1). (b, d, f, h) perlakuan 1 (0,164 mgL-1) pada hari ke 14, 28, 42 & 56. (c, e, g, i) perlakuan 2 (0,196 mgL-1) pada hari
ke 14, 28,42 & 56 27
12 Perubahan struktur histologis yang terjadi pada hati ikan nila (Oreochromis niloticus) selama 56 hari pemaparan HgCl2. (a)
perlakuan kontrol (0 mgL-1). (b, d, f, h) perlakuan 1 (0,164 mgL-1) pada hari ke 14, 28, 42 & 56. (c, e, g, i) perlakuan 2 (0,196 mgL-1) pada hari
1
PENDAHULUAN
Latar Belakang
Permasalahan lingkungan perairan timbul sejak manusia mulai memanfaatkan lingkungan perairan untuk memenuhi kebutuhan hidupnya. Salah satu permasalahan lingkungan tersebut adalah pencemaran perairan. Sumber pencemar yang berasal dari kegiatan manusia memiliki dampak yang lebih besar bila dibandingkan dengan pencemar yang berasal dari fenomena alam. Hal ini akibat semakin tingginya aktivitas manusia yang berdampak pada meningkatnya volume limbah domestik maupun industri (Kristanto 2002).
Merkuri (Hg) merupakan salah satu kontaminan yang paling banyak ditemukan di perairan dan sedimen (Ullrich et al., 2001). Meskipun terjadi secara alami, aktivitas manusia telah memobilisasi meningkatnya kuantitas merkuri dan telah menjadi sumber masalah kesehatan bagi masyarakat (Clarkson & Magos, 2006; Díez, 2009). Kontaminan ini sangat signifikan dalam hal daya racunnya. Selain itu, merkuri tidak terdegradasi oleh bakteri sehingga tetap berada secara permanen di lingkungan perairan (Clark 2001).
Ikan sangat sensitif terhadap perubahan di lingkungan perairan dan memainkan peran penting dalam menilai potensi risiko yang terkait dengan pencemaran di lingkungan hidupnya (Lakra dan Nagpure, 2009). Ikan sangat rentan terhadap toksikan logam karena ikan terus-menerus terpapar di media hidupnya dan toksiskan ini dapat masuk melalui insang dan asupan pakan yang terkontaminasi. Efek dari bahan pencemar ini, dapat berakibat pada kerusakan organ-organ tubuh ikan baik bersifat akut maupun bersifat kronik.
Salah satu jenis ikan yang sangat berpeluang terkontaminasi merkuri adalah ikan nila (Oreochromis niloticus). Hal ini disebabkan karena Ikan Nila (Oreochromis niloticus), merupakan ikan yang memiliki penyebaran cukup luas dan banyak dibudidayakan, selain itu, ikan nila (Oreochromis niloticus) merupakan ikan konsumsi penting bagi sebagian masyarakat Indonesia. Ikan Nila (Oreochromis niloticus) pada dasarnya mempunyai kemampuan menghindarkan diri dari pengaruh bahan pencemar yang mencemari lingkungan perairan (Roberts, 1978). Namun demikian, ikan yang hidup di habitat terbatas (seperti sungai, danau, dan teluk), sulit menghindarkan diri dari pengaruh pencemaran tersebut. Akibatnya, unsur-unsur pencemar masuk ke dalam tubuh ikan.
Ikan nila (Oreochromis niloticus) memiliki banyak keunggulan untuk dibudidayakan dibanding dengan jenis ikan lainnya karena sifat biologi yang menguntungkan seperti mudah berkembang biak, pertumbuhannya cepat, pemakan segala bahan makanan (omnivora), daya adaptasi tinggi, dan memiliki toleransi tinggi terhadap berbagai kondisi lingkungan (Ishikawa et al. 2007 & Pullin 1997). Kemampuan adaptasi yang tinggi terhadap lingkungan alami dan sistem budidaya intensif, menyebabkan usaha budidaya ikan nila menyebar secara luas di dunia, terutama di negara-negara Asia (FAO 2004).
Menurut Palar (2004) merkuri masuk kedalam jaringan tubuh melalui
2
membran sel. Merkuri yang bergabung dengan lemak pada akhirnya akan menumpuk (terakumulasi) di dalam organ, terutama organ respirasi (insang), organ detoksikasi (hati) dan organ ekskresi (ginjal).
Efek dari bahan pencemar, dapat berakibat pada kerusakan organ-organ pada makhluk hidup dan dapat menyebabkan kematian. Adapun efek yang diakibatkan oleh bahan pencemar dapat bersifat akut dan bersifat kronik. Untuk mengetahui sejauh mana efek dari bahan pencemar merkuri, maka dilakukan uji toksisitas. Uji toksisitas dapat menjelaskan keterikatan atau hubungan antara besarnya konsentrasi merkuri di dalam air dengan perubahan struktur sel pada berbagai organ ikan. Investigasi histopatologi dilakukan untuk mendeteksi efek langsung dari senyawa kimia pencemar pada organ target. Beberapa penelitian terkait toksisitas suatu bahan pencemar terhadap ikan yang dilakukan sebelumnya hanya tertuju pada tingkatan untuk melihat perubahan yang terjadi pada reaksi enzimatik dan perubahan komposisi sel darah pada ikan uji akibat adanya toksikan. Adapun penelitian ini dilakukan untuk melihat pengaruh dari pada bahan toksikan (merkuri klorida) terhadap perubahan yang terjadi pada parameter biometrik ikan uji.
Tujuan Penelitian
Penelitian ini dilaksanakan dengan tujuan sebagai berikut:
1. Menentukan ambang batas dan toksisitas akut merkuri klorida (HgCl2) pada ikan nila (Oreochromis niloticus).
2. Mengkaji pengaruh merkuri klorida (HgCl2) terhadap beberapa parameter biometrik (kelangsungan hidup, laju pertumbuhan bobot rata-rata harian, kondisi hati dan empedu serta keragaan reproduksi) ikan nila (Oreochromis niloticus).
3. Mengkaji tingkat kerusakan struktur histologis insang, hati dan ginjal ikan nila (Oreochromis niloticus) akibat dari paparan merkuri klorida (HgCl2)
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Klasifikasi dan Morfologi Ikan Nila (Oreochromis niloticus)
Klasifikasi ikan nila menurut Trewavas (1982): Filum : Chordata
Subfilum : Vertebrata Kelas : Osteichthyes
Subkelas : Acanthoptherygii Ordo : Percomophi
Subordo : Percoidea Famili : Cichlidae
Genus : Oreochromis
Spesies : Oreochromis niloticus
Gambar 1 Ikan nila (Oreochromis niloticus)
Secara umum, bentuk tubuh nila memanjang dan ramping, dengan sisik berukuran besar. Ukuran matanya besar dan menonjol dengan tepi berwarna putih. Gurat sisi (linea lateralis) terputus di bagian tengah tubuh, kemudian berlanjut lagi, tetapi letaknya lebih ke bawah dibandingkan dengan letak garis yang memanjang di atas sirip dada. jumlah sisik pada gurat sisi 34 buah. Sirip punggung, sirip perut, dan sirip duburnya memiliki jari-jari keras berupa duri. Sirip punggung dan sirip dada berwarna. hitam. Pinggir sirip punggung berwarna abu-abu atau hitam
(Trewavas 1982.).
Panjang tubuhnya dua kali tingginya. sirip punggung terdiri atas 16-17 jari-jari keras dan 11-15 jari-jari-jari-jari lunak dan pada bagian sirip anal terdapat 3 duri dan 8-11 jari-jari. Tubuh berwarna kehitaman atau keabuan dengan beberapa pita hitam belang yang semakin memudar atau samar-samar kelihatan pada saat ikan dewasa. (Hasni 2008).
Nila (Oreochromis niloticus) memiliki lima buah Sirip, yaitu sirip punggung
(dorsal fin), sirip data (pectoral fin) sirip perut (venteral fin), sirip anal (anal fin),dan sirip ekor (caudal fin). Sirip punggungnya memanjang dari bagian atas tutup ingsang hingga bagian atas sirip ekor. Terdapat juga sepasang sirip dada dan sirip perut yang berukuran kecil dan sirip anal yang panjang. Sementara itu, bentuk
4
Untuk membedakan antara ikan jantan dan betina dapat dilihat dari bentuk alat kelamin yang ada pada bagian ventral tubuh ikan. Ikan jantan memiliki sebuah alat kelamin yang bentuknya memanjang dan menonjol. Berfungsi sebagai alat untuk mengeluarkan sperma dan air seni, warnanya merah, terutama pada saat matang gonad. Ikan betina memiliki dua lubang kelamin di dekat anal, berbentuk seperti bulan sabit dan berfungsi sebagai tempat keluarnya telur. Lubang yang kedua berada di belakang saluran telur dan berbentuk bulat dan berfungsi sebagai
tempat keluarnya air seni (Trewavas 1982).
Merkuri (Hg)
Merkuri (Hg) berasal dari bahasa Latin hydrargyyrum yang berarti menguap, sedangkan dalam bahasa Indonesia diterjemahkan sebagai raksa. Namun demikian, di kalangan masyarakat dikenal dengan nama merkuri. (Hutagalung 1984).
Penggunaan Hg dalam bidang industri cukup banyak, seperti industri pertanian, alat-alat elektronik, industri cat dan sebagainya, selain itu juga digunakan dalam industri pertambangan emas, Hg ini biasanya digunakan untuk memisah emas dari batuan, umumnya digunakan oleh penambang liar di sekitar daerah pertambangan yang limbahnya dibuang ke sungai yang kemudian bermuara ke laut.
Sebagai unsur, pada suhu kamar merkuri (Hg) berbentuk cair keperakan. Merkuri membentuk berbagai persenyawaan baik anorganik (seperti oksida, klorida, dan nitrat) maupun organik. Merkuri dapat menjadi senyawa anorganik melalui oksidasi dan kembali menjadi unsur merkuri (Hg) melalui reduksi. Merkuri anorganik menjadi merkuri organik melalui kerja bakteri anaerobic tertentu dan senyawa ini secara lambat terdegradasi menjadi merkuri anorganik. Produksi air raksa diperoleh terutama dari biji sinabar (86,2 % air raksa) melalui pemanasan dengan suhu 8000C dengan menggunakan O2 (Halida 2002).
Di antara semua unsur logam berat, Hg menduduki urutan pertama dalam hal daya racunnya. Diikuti oleh logam berat lainnya yaitu Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn. Merkuri di air akan dikonversi menjadi metil merkuri (Hikmawati dan Sulistyorini, 2006). Merkuri, baik logam maupun metil merkuri (CH3Hg+), masuk ke dalam tubuh melalui pernapasan, penetrasi dari kulit dan makanan. Sebagian besar dapat diekresikan, sisanya akan menumpuk pada ginjal dan sistem saraf, yang suatu saat akan mengganggu bila akumulasinya semakin tinggi. Merkuri dalam bentuk metil merkuri, sebagian besar akan terakumulasi di otak. Tingginya penyerapan merkuri, dalam waktu singkat dapat menyebabkan berbagai gangguan mulai dari rusaknya keseimbangan tubuh, tidak dapat berkonsentrasi, tuli, dan berbagai gangguan lain (Hutagalung dan manik 2002).
Toksisitas Merkuri Terhadap Organisme
Toksisitas adalah kemampuan suatu molekul atau senyawa kimia dalam menimbulkan kerusakan pada bagian yang peka di bagian dalam maupun di bagian luar tubuh makhluk hidup (Tandjung 1995). Tolok ukur pengujian efek bahan pencemar yang saat ini dianggap paling tepat adalah derajat toksisitas dengan metode Bioassay. Menurut Connel (1995), respon makhluk hidup yang diuji dapat dimasukkan dalam kategori-kategori sebagai berikut:
5 b. Subakut, yang merupakan respon makhluk hidup terhadap suatu kondisi yang
kurang parah dan biasanya terjadi setelah waktu yang lebih lama.
c. Kronis, yang merupakan respon makhluk hidup terhadap suatu kondisi yang berkesinambungan yang terjaga tetap.
Merkuri masuk ke dalam tubuh organisme hidup terutama melalui makanan yang dimakannya, karena hampir 90% logam berat (merkuri) masuk ke dalam tubuh melalui jalur makanan. Logam merkuri masuk pada jalur tersebut melalui dua cara, yaitu lewat air (minuman) dan bahan makanan. Sisanya akan masuk secara difusi atau perembesan lewat jaringan dan melalui pernafasan (insang) (Palar 2004). Merkuri anorganik di perairan akan mengalami metilasi oleh bakteri anaerob yang menghasilkan methyl merkuri yang kemudian akan dilepas ke perairan. Darmono (1995) mengemukakan, bahwa merkuri yang dapat diakumulasi melalui makanan oleh ikan atau shellfish adalah bentuk methyl merkuri. Methyl merkuri yang terbentuk, bersifat tidak stabil sehingga mudah dilepaskan.
Makanan yang telah terkontaminasi merkuri akan dikonsumsi oleh ikan dan masuk ke dalam saluran pencernaan. Pada saluran pencernaan (gastrointestinal) melalui dinding-dindingnya, merkuri akan menuju ke cairan sirkulatori Bahan-bahan kimia (senyawa merkuri) dalam cairan sirkulatori akan teroksidasi menjadi Hg2+ dan akan terakumulasi dalam hati. Di organ hati merkuri akan dimetabolisme dan di nonaktifkan oleh enzim-enzim di dalam hati sehingga terjadi biotransformasi zat-zat berbahaya menjadi zat-zat yang tidak berbahaya yang kemudian diekskresikan oleh ginjal.
Senyawa-senyawa kimia selain masuk melalui saluran pencernaan, juga dapat masuk melalui saluran pernafasan (insang). Senyawa kimia tersebut akan masuk melalui insang yang langsung bersentuhan dengan lingkungan air. Setelah melewati insang, bahan-bahan kimia termasuk merkuri akan ikut ke dalam sistem pernafasan, akhirnya akan menembus sel endothelial kapiler darah untuk masuk ke dalam cairan darah. Selanjutnya akan terbawa aliran darah dan ikut dalam proses metabolisme (Connel 1995).
Beberapa pengaruh toksisitas logam pada ikan yang telah terpapar logam berat yaitu pada insang, alat pencernaan dan ginjal. Jumlah merkuri yang terakumulasi pada tubuh ikan tergantung dari ukuran, umur dan kondisi ikan. Distribusi dan akumulasi logam tersebut sangat berbeda-beda untuk organisme air. Hal ini tergantung pada spesies, konsentrasi logam dalam air, pH, fase pertumbuhan dan kemampuan untuk pindah tempat (Darmono 1995).
Darmono (2008) mengemukakan bahwa terjadinya proses akumulasi merkuri di dalam tubuh hewan air terjadi karena kecepatan pengambilan merkuri (uptake rate) pada organisme air lebih cepat dibandingkan dengan proses ekskresi. Merkuri merupakan logam yang terlibat dalam proses enzimatik, terikat dengan protein (ligan binding). Ikatan merkuri dengan protein jaringan membentuk senyawa
metallotionein. Metallotionein merupakan protein aditif yang berperan dalam proses homeostatis organisme dalam mentolelir logam berat.
6
HgCl2 lebih banyak terdapat pada lingkungan yang konsentrasi Cl rendah dibandingkan konsentrasi Cl- yang tinggi. Hal ini menyebabkan toksisitas merkuri akan meningkat seiring menurunnya salinitas. Selanjutnya dikemukakan bahwa menurut prinsip Asam Basa Kuat dan Lemah (HSAB), merkuri adalah asam lemah dan dapat bereaksi lebih cepat dengan basa lemah terutama ligan yang mengandung unsur N dan S tetapi jauh lebih kuat bereaksi dengan ligan yang mengandung unsur S dari pada unsur N. Jadi dari mekanisme ini dapat diketahui bahwa Hg cenderung membentuk kompleks yang kuat dengan kelompok sulfhidril (-SH) yang ada dalam protein dibandingkan dengan Cl-. Ikan mengandung banyak protein, oleh karenanya maka jumlah kelompok sulfhidril yang terkandung dalam jaringan ikan dapat menentukan jumlah Hg yang dapat terabsorpsi.
Senyawa-senyawa kimia yang telah berikatan dengan protein dan membentuk
metallotionein tersebut akan dibawa oleh darah (Darmono, 1995). Senyawa merkuri yang masuk bersama makanan, akan masuk ke dalam alur pencernaan, setelah mengalami absorbsi di usus, senyawa merkuri akan dibawa ke hati melalui vena porta hepatik. Selanjutnya di dalam hati senyawa merkuri mengalami metilasi lambat menjadi Hg2+, dan kemudian akan masuk ke dalam darah dan akan teroksidasi sempurna menjadi merkuri bivalensi (Hg2+). Bersama peredaran darah, Hg2+ yang masuk ke hati akan mengalami metabolisme, terdegradasi dan melepaskan Hg2+, sehingga dapat menghambat enzim proteolitik dan menyebabkan kerusakan sel (Lu 1995). Merkuri yang tadinya masuk ke dalam hati akan terbagi dua yaitu sebagian akan terakumulasi pada hati, sedangkan sebagian lainnya akan dikirim ke empedu. Dalam kantong empedu, akan dirombak menjadi senyawa merkuri anorganik yang kemudian akan dibawa ke ginjal melalui darah.(Palar, 2004).
Insang
Beberapa pengaruh toksisitas logam pada ikan yang telah terpapar logam berat yaitu pada insang, alat pencernaan, hati dan ginjal. Insang merupakan organ yang dimiliki ikan sebagai alat utama pernafasan. Insang selain sebagai alat pernafasan ikan, juga digunakan sebagai pengatur tekanan osmotik dalam tubuh ikan (Fernandez & Mazon 2003)
Insang merupakan organ yang penting pada ikan. Sebagian besar kematian ikan yang disebabkan oleh bahan pencemar terjadi karena kerusakan pada bagian insang dan organ-organ yang berhubungan dengan insang. Karena letaknya di luar dan berhubungan langsung dengan air sebagai media hidupnya, maka organ inilah yang pertama kali mendapat pengaruh apabila lingkungan air tercemar oleh bahan pencemar baik yang terlarut maupun yang tersuspensi. Insang merupakan organ yang langsung berhubungan dengan air, sehingga apabila air mengandung polutan akan mengakibatkan kerusakan pada organ ini dan organ-organ yang berhubungan dengan insang. Hal inilah yang menyebabkan ikan mati di perairan.
7 disebut hemibranchium. Dua hemibranchium dan septum interbranchia membentuk insang lengkap disebut holobranchia (Lagler et al.1977). Struktur insang ikan dapat dilihat pada Gambar 2.
Keterangan: 1. Eritrosit 2. Epitelium 3. Sel pillar 4. Lumen kapiler 5. Lamella
6. Sel sel interlamella 7. Sel mucus
8. Tulang rawan penopang
Gambar 2 Struktur histologis insang (Lagler et al. 1977).
Pada filamen insang terdapat sejumlah besar lamella. Tepi-tepi bebas lamella sangat tipis ditutupi epithelium berisi jaringan kapiler yang disokong oleh sel pilaster. Sel pilaster berfungsi membatasi sel epithelium dengan kapiler darah. Lamella sekunder kaya akan eritrosit. Lamella sekunder insang berupa lipatan lembaran melintang, tipis, dinding luarnya terdiri atas selapis sel epithelium pipih dan di bawahnya terdapat lapisan sub epithelium yang sangat tipis dan terdiri atas jaringan ikat. Selubung epithelium dibungkus oleh lapisan vaskuler medial, merupakan anyaman kapiler darah dari arteri brachialis efferent sel-sel pilaster dari eritrosit (Lagler et al.1977).
Hati
Hati merupakan organ terbesar dalam tubuh yang terletak dalam rongga peritoneal dan melingkupi viscera. Hati memiliki bentuk seperti huruf U dan berwarna merah kecoklatan. Struktur utama hati adalah sel hati atau hepatosit. Hepatosit (sel parenkim hati) bertanggung jawab terhadap peran sentral hati dalam metabolisme. Sel-sel ini terletak diantara sinusoid yang berisi darah dan saluran empedu. Sel kupffer melapisi sinusoid hati dan merupakan bagian penting dalam sistem retikuloendotelial tubuh (Lu 1995). Sel kupffer merupakan sistem monositmakrofag dan fungsi utamanya adalah menelan bakteri dan benda asing lain dalam darah. Sehingga hati merupakan salah satu organ utama sebagai pertahanan terhadap invasi bakteri dan agen toksik (Anderson 1995).
8
percabangan dari vena porta dan arteri hepatika. Tidak seperti kapiler lain, sinusoid dibatasi oleh sel fagositik atau sel kupffer (Anderson 1995).
Kerusakan hepatosit menurut Ressang (1984) dapat dibagi menjadi dua yaitu taksohepatik dan trofohepatik. Kerusakan akibat taksopatik disebabkan oleh pengaruh langsung dari agen yang toksik, baik berupa zat kimia maupun kuman. Kerusakan akibat trofopatik disebabkan adanya kekurangan faktor-faktor penting untuk kehidupan sel seperti oksigen atau zat makanan, baik secara langsung maupun tidak langsung. Hati sangat rentan terhadap pengaruh berbagai zat kimia dan sering menjadi organ sasaran utama dari efek racun zat kimia. Oleh karena itu, hati merupakan organ tubuh yang paling sering mengalami kerusakan.
Hati merupakan organ yang banyak berhubungan dengan senyawa kimia sehingga mudah terkena efek toksik (Loomis 1978). Diantara berbagai zat yang masuk ke dalam hati bersama darah, kemungkinan ada zat yang mampu menginduksi kerusakan hati. Zat yang dimaksud antara lain logam berat dan salah satunya adalah logam merkuri (Hg). Darmono (1995) menyatakan bahwa kongesti dan hemoragi atau pendarahan terlihat pada hepatopankreas yang terakumulasi oleh logam berat.
Gambar 4 Struktur histologis hati ikan (Camargo et al. 2007). Keterangan gambar: a. inti sel, b. granular sitoplasma
Tingkat kerusakan hati menurut Darmono (1995), dibagi menjadi tiga yaitu ringan, sedang dan berat. Perlemakan hati termasuk dalam tingkat ringan yang ditandai dengan pembengkakan sel. Tingkat kerusakan sedang yaitu kongesti dan hemoragi, sedangkan tingkat berat adalah kematian sel atau nekrosis. Kerusakan hati akibat logam berat Hg disebabkan aktifitas logam tersebut dalam mempengaruhi kerja enzim proteolitik (Lu 1995).
9 tidak mampu malukan fungsi-fungsi dektoksifikasi, maka hati akan mengalami kerusakan.
Ginjal
Pada ikan, tubulus ginjal merupakan bentuk berpasangan yang terletak memanjang pada dinding dorsal rongga tubuh. Setiap tubule ginjal menuju ke ureter yang masuk ke kandung kemih. Urine kemudian dikeluarkan lewat lubang urogenital pada bagian bawah tubuh ikan (Lagler et al.1977).
Gambar 4 Struktur histologis ginjal ikan (Camargo et al. 2007). Keterangan gambar: a. kapsul Bowman, b. distal tubulus, c. proximal tubulus
Menurut (Lagler et al.,1977), ginjal Cyprinidae terbagi menjadi 2 bagian yaitu kepala ginjal dan tubule ginjal. Tubule ginjal air tawar terdiri atas glomerulus, segmen leher terbuka (proximal convoluted tubule) yang terdiri atas 2 segmen cytologis yang berbeda (distal convoluted tubule) dan tubule pengumpul. Urine terbentuk oleh saringan glomerulus ke dalam tubuli ginjal. Khususnya ikan mas (Cyprinus sp. dan Carassius sp.). Jumlah nitrogen yang dikeluarkan insang 6-10 kali lebih banyak daripada ginjal ikan pada umumnya. Ginjal ikan air tawar yang berglomeruli gunanya untuk mengeluarkan kembali air yang secara osmotis diserap. Karena konsentrasi cairan tubuhnya lebih besar daripada lingkungan, maka fungsi ginjal ikan air tawar adalah sebagai regulator hiperosmotik.
3
METODE
10
Bahan
Bahan yang digunakan untuk penelitian ini adalah merkuri klorida (HgCl2) sebagai bahan toksik yang sudah ditentukan konsentrasinya. Merkuri klorida (HgCl2) mempunyai bentuk formulasi seperti tepung halus (soluble powder) berwarna putih dan mudah larut dalam air. Ikan uji adalah ikan nila (Oreochromis niloticus) dengan jenis kelamin betina dengan bobot rata-rata 20 gram atau kisaran panjang 11-13 cm sebanyak 400 ekor. Ikan Nila (Oreochromis niloticus) tersebut diaklimatisasi selama tujuh hari pada kolam aklimatisasi sebelum dijadikan sebagai ikan uji. Bahan-bahan lainnya meliputi larutan yang digunakan dalam pembuatan preparat histologis yaitu Buffered Neutral Formalin (BNF), NaCl fisiologis 0.65%, akuades dan HCl 0.1 N, xylol, paraffin, alkohol 50%, alkohol 70%, alkohol 80%, alkohol 90%, alkohol 95% , alkohol 100%, hematoksilin, dan eosin.
Alat
Alat yang digunakan pada penelitian adalah mikroskop, timbangan digital, seperangkat alat bedah untuk mengambil organ dalam ikan uji, seperangkat alat untuk pembuatan preparat histologi, Spektrofotometer penyerap atom (Atomic Absorption Spectrophotometer, AAS). Alat yang digunakan untuk mengukur kualitas air in situ meliputi Termometer, pH meter dan DO meter. Wadah pemeliharan yang digunakan adalah akuarium ukuran 60x40x30 cm3 sebanyak 12 buah, saringan/serokan, peralatan aerasi, gelas beker, labu ukur, dan peralatan gelas lain yang digunakan di Laboratorium
Tahapan Penelitian
Penelitian ini terdiri atas tiga tahapan yaitu uji pendahuluan, uji akut dan uji subkronik. Uji pendahuluan dilakukan untuk mengetahui konsentrasi pada ambang batas atas (N) dan ambang batas bawah (n). Hasil dari uji ini akan dijadikan dasar dalam melakukan uji toksisitas akut. Sedangkan uji subkronik yaitu pemeliharaan ikan Nila pada media yang tercemar mercuri pada konsentrasi yang berbeda.
Uji pendahuluan
Tujuan Uji Pendahuluan.
Uji pendahuluan dilakukan dengan tujuan untuk menentukan ambang batas atas (N) dan ambang batas bawah (n) yang kemudian akan digunakan dalam uji toksisitas akut. Konsentrasi ambang batas atas (N) adalah konsentrasi terendah dari bahan uji yang menyebabkan semua ikan uji mati selama pemaparan 24 jam, sedangkan konsentrasi ambang batas bawah (n) adalah konsentrasi tertinggi dari bahan uji yang menyebabkan semua hewan uji hidup setelah pemaparan 48 jam (APHA 1980).
Rancangan Penelitian Uji Pendahuluan
11
��� !��!=� ��� (
�
� )
�/� =�/� =�/�= �/� = �/�
tidak diperoleh hasil yang diharapkan pada batas ambang bawah dan batas ambang atas dari konsentrasi merkuri klorida (HgCl2) yang digunakan, maka nilai konsentrasi merkuri klorida (HgCl2) yang dipakai akan diturunkan atau ditingkatkan.
Prosedur Kerja Uji Pendahuluan
Prosedur kerja uji pendahuluan diawali dengan mempersiapkan wadah uji, kemudian diberikan merkuri klorida (HgCl2) dengan konsentrasi yang berbeda sesuai dengan metode Range Finding Test, untuk setiap konsentrasi dilakukan dua kali ulangan. Wadah uji yang digunakan bervolume 43.2 liter dan pada setiap wadah uji dimasukkan ikan uji sebanyak 10 ekor dalam waktu yang relatif bersamaan. Selama uji pendahuluan, setiap unit wadah uji diberi aerasi namun tidak dilakukan pergantian air dan pemberian pakan. Pengamatan mortalitas hewan uji dilakukan pada jam ke-0, 6, 12, 24, dan 48. Penentuan ambang batas atas dilakukan dengan melakukan pengamatan terhadap mortalitas ikan uji hingga jam ke 24. Sedangkan penentuan ambang batas bawah dilakukan dengan melakukan pengamatan terhadap mortalitas ikan uji hingga jam ke 48.
Parameter yang Diamati dan Analisa Data
Hasil yang diperoleh pada uji pendahuluan digunakan sebagai ambang batas bawah dan ambang batas atas untuk mendapatkan konsentrasi yang akan diujikan pada uji toksisitas akut. Persamaan untuk mendapatkan konsentrasi merkuri klorida (HgCl2) yang akan digunakan pada uji toksisitas akut adalah sebagai berikut:
Keterangan: N = konsentrasi ambang atas n = konsentrasi ambang bawah a = konsentrasi terkecil dalam deret konsentrasi yang ditentukan k = jumlah konsentrasi yang di uji
Selanjutnya dilakukan analisis terhadap hasil yang diperoleh dari persamaan diatas untuk mendapatkan konsentrasi konsentrasi merkuri klorida yang akan diujikan pada uji toksisitas akut. Adapun persamaan yang digunakan untuk mendapatkan konsentrasi-konsentrasi tersebut yaitu:
Keterangan : n : konsentrasi ambang bawah
a : nilai konsentrasi terkecil dalam uji toksisitas akut
12
Uji Toksisitas Akut
Tujuan Uji Toksisitas Akut.
Uji toksisitas akut ini bertujuan untuk mengetahui derajat toksisitas akut merkuri (Hg) yang dinyatakan dengan LC50 (Lethal Concentration). LC50-96 jam merupakan konsentrasi yang dapat mematikan hewan uji sebanyak 50 % hingga jam ke 96. Uji Toksisitas akut akan memberikan petunjuk tentang dosis yang sebaiknya digunakan dalam pengujian Sub Kronik (Lu 2006).
Rancangan Penelitian Uji Toksiitas Akut
Metode uji toksisitas akut pada penelitian ini mengacu pada US–EPA (1991).Pengujian toksisitas akut dilakukan dengan menggunakan empat konsentrasi berbeda dengan ulangan sebanyak dua kali. Jumlah ikan pada masing masing wadah uji adalah sebanyak 10 ekor.
Prosedur Kerja Uji Toksisitas Akut
Prosedur kerja uji toksisitas akut dilakukan dengan menyiapkan wadah uji yang telah diberikan merkuri klorida dengan konsentrasi yang ditentukan. Selama uji toksisitas, setiap unit akuarium diberi aerasi namun tidak dilakukan pergantian air dan pemberian pakan. Pengamatan mortalitas hewan uji dilakukan berdasarkan interval waktu logaritma (logarithmic time interval) pada jam ke-12, 24, 48, 72 dan 96.
Parameter yang diamati dan analisa data
Hasil pengamatan mortalitas ikan uji yang diperoleh digunakan sebagai acuan dalam menentukan LC50-96 jam dari merkuri klorida (HgCl2). Penentuan nilai LC50-96 jam dilakukan dengan analisis probit menggunakan perangkat lunak EPA Probit Analysis Version 1.5. LC50-96 jam yang diperoleh digunakan sebagai dasar dalam menentukan konsentrasi merkuri klorida (HgCl2) pada batas aman bagi ikan uji. Konsentrasi merkuri klorida (HgCl2) pada batas aman yang diperoleh kemudian dijadikan acuan dalam menentukan konsentrasi merkuri klorida (HgCl2) pada uji sub kronik. Konsentrasi merkuri klorida (HgCl2) pada batas aman diperoleh berdasarkan persamaan berikut (Finney 1971).
����� ���� =10 % � ��!"
Uji Sub Kronik
Tujuan Uji Sub kronik.
13 Rancangan Penelitian Uji sub kronik
Konsentrasi merkuri klorida (HgCl2) yang digunakan pada uji sub kronik terdiri dari tiga konsentrasi yaitu kontrol (0 mgL-1 HgCl2), konsentrasi batas aman, dan nilai interval + 20% dari konsentrasi batas aman, untuk pengamatan biometrik ikan uji dilakukan 3 ulangan dengan jumlah ikan uji sebanyak 10 ekor untuk setiap wadah uji, sedangkan untuk pengamatan tingkat kerusakan jaringan ikan uji tidak dilakukan ulangan, jumlah ikan uji yang digunakan sebanyak 15 ekor per wadah uji .
Prosedur Kerja Uji Sub kronik
Prosedur kerja uji subkronik diawali dengan menyiapkan wadah uji sebanyak 12 buah yang telah diberikan merkuri klorida (HgCl2) dengan konsentrasi yang ditentukan. Pengukuran bobot awal dilakukan sebelum ikan uji dimasukkan kedalam wadah uji. Bahan anastesi yang digunakan dalam proses pengukuran bobot awal ikan uji yaitu minyak cengkeh dengan dosis 3 ml untuk setiap 1liter air.
Selama uji subkronik, setiap unit akuarium diberi aerasi pemberian pakan sebanyak 2 kali sehari dengan FR 2% dari bobot ikan uji (Solomon & Boro, 2010). sedangkan pergantian air dilakukan setiap 14 hari sekali. Pengamatan terhadap perubahan komponen/ parameter biometrik ikan uji dilakukan pada akhir masa pemeliharaan sedangkan pengamatan tingkat kerusakan struktur histologis pada hewan uji (insang, hati dan ginjal) dilakukan setiap 14 hari sekali.
Metode yang digunakan pada pengamatan struktur histologis adalah metode histoteknik dengan tahapan kerja meliputi pengambilan sampel, fiksasi, dehidrasi, penjernihan, infiltrasi, penanaman, proses pemotongan, penempelan sayatan pada gelas objek, deparafinasi dan pewarnaan. Pengambilan sampel insang, hati dan ginjal dilakukan dengan menggunakan pisau bedah, potongan tersebut kemudian diletakkan dalam wadah yang telah ditambahkan pengawet Buffered Neutral Formalin (BNF).
Proses pengawetan dilakukan agar tidak terjadinya perubahan pada jaringan, dan melindungi sel dari proses pengerutan saat dimasukkan dalam alkohol dan parafin panas serta meningkatkan kemampuan jaringan untuk diwarnai. Proses penghilangan air dilakukan dengan cara merendam jaringan dalam alkohol mulai dari alkohol 80%, 90%, 95% sampai ke alkohol absolut.
Proses penjernihan dilakukan untuk menghilangkan pengaruh alkohol dalam jaringan dengan merendam jaringan tersebut ke dalam xylol. Setelah dilakukan perjernihan jaringan nampak lebih tranparan dan gelap. Selanjutnya proses infiltrasi dilakukan dengan merendam jaringan dalam parafin secara bertingkat pada suhu 600C. Hal ini dilakukan agar jaringan dapat dipotong dengan tipis.
Proses penanaman yaitu meletakkan jaringan dalam wadah sedemikian rupa sehingga memudahkan pada saat dipotong dan pengenalan kembali jaringan. Wadah kemudian dicampur dengan parafin dan kemudian didinginkan selama 6 jam untuk mengeraskan parafinnya. Poses pemotongan blok dilakukan dengan menggunakan mikrotom. Ketebalan jaringan ditetapkan setebal 5 mikron. Hasil sayatan kemudian diapungkan dalam air hangat (400C), lalu diletakkan dalam gelas objek. Gelas objek kemudian diletakkan di atas hotplate selama 10-15 menit hingga seluruh air menguap. Gelas obyek kemudian disimpan dalam inkubator selama satu malam sebelum digunakan pada proses sebelumnya.
14
��=
��
�� � 100
dilanjutkan dengan eosin selama 3 menit dan dicuci kembali dengan menggunakan aquades.
Parameter yang diamati dan analisa data
Parameter biometrik yang diamati pada uji sub kronik ini, yaitu tingkat kelangsungan hidup, laju pertumbuhan bobot rata-rata harian, kandungan merkuri pada organ hati dan ginjal, Hepato somatic indeks (HSI) dan Volume empedu relatif (VER), indeks kematangan gonad, fekunditas dan sebaran diameter telur. Pengamatan terhadap tingkat kerusakan jaringan histologis dilakukan pada organ insang, hati dan ginjal. Penilaian terhadap kerusakan struktur jaringan tersebut dilakukan dengan cara melakukan analisa terhadap perubahan struktur sel yang terjadi pada jaringan tersebut.
Tingkat Kelangsungan Hidup (SR) dan Laju Pertumbuhan Bobot
Pengukuran tingkat kelangsungan hidup ikan bertujuan untuk mengetahui pengaruh merkuri (Hg) terhadap kelangsungan hidup ikan uji. Sedangkan pengukuran laju pertumbuhan bobot bertujuan untuk melihat pengaruh merkuri (Hg) terhadap pertumbuhan bobot ikan. Tingkat kelangsungan hidup ikan uji dihitung dengan menggunakan persamaan (Effendie 1979), sebagai berikut:
Keterangan :SR : Tingkat kelangsungan hidup (%) Nt : Jumlah ikan akhir
No : Jumlah ikan awal
Sedangkan untuk menghitung laju pertumbuhan bobot digunakan persamaan Steffens (1989), sebagai berikut:
Keterangan: LPBRH : Laju pertumbuhan (%)
Wt : Bobot rata-rata akhir (gram) Wo : Biomassa rat-rata awal (gram)
t : Lama pemeliharaan (hari)
Hepatosomatik Indeks (HSI) dan Volume Empedu Relatif (VER)
Pengamatan terhadap Hepato Somatik Indeks (HSI) dan Volume Empedu Relatif (VER) juga dilakukan untuk melihat perubahan kondisi hati dan empedu akibat paparan merkuri yang masuk ke dalam tubuh ikan uji. Adapun persamaan yang digunakan untuk menghitung HSI menurut Htun-Han (1978) yaitu:
15
���= ��
�� � 100
�=
� � �
� ��� =
��
�� � 100
Keterangan:HSI : Hepato Somatik Indeks (%) Bh : Berat Hati (gram)
Bt : Berat tubuh termasuk hati (gram)
Persamaan yang digunakan untuk menghitung Volume Empedu relatif (VER) yaitu:
Keterangan : VER : Volume Empedu Relatif (%) Ve : Volume empedu (ml)
Vt : Volume hati termasul empedu (ml) Indeks Kematangan Gonad (IKG)
Untuk mengetahui pengaruh merkuri (Hg) terhadap perkembangan reproduksi ikan uji maka dilakukan pengukuran terhadap beberapa parameter reproduksi yang meliputi Indeks Kematangan Gonad, Fekunditas dan Diameter telur ikan uji. Indeks Kematangan Gonad dihitung dengan menggunakan persamaan (Effendie 1979), sebagai berikut:
Keterangan: IKG : Indeks kematangan gonad (%) Bg : Berat Gonad (gram)
Bt : Berat tubuh termasuk gonad (gram) Fekunditas dan Sebaran Diameter Telur
Fekunditas diukur pada ikan uji dengan tingkat kematangan gonad III. Pengukuran fekunditas dilakukan dengan cara mengambil contoh telur dari masing masing ovari (anterior, tengah, posterior), selanjutnya ditimbang dan dihitung jumlah telur di dalamnya. Fekunditas dihitung dengan menggunakan persamaan (Effendi 1979), sebagai berikut:
Keterangan : F : Fekunditas (butir) G : Berat gonad (gram)
Q : Berat gonad contoh (gram) X : Jumlah telur contoh (Butir)
16
Pengukuran Parameter fisika-kimia air
Pengukuran sifat fisika kimia air dilakukan secara in situ dan ek situ. Pengukuran sifat fisika kimia air yang dilakukan secara in situ meliputi: Suhu, DO, dan pH, sedangkan untuk amoniak dilakukan pengukuran secara ek situ di laboratorium. Pengukuran parameter fisika kimia air dilakukan setiap 14 hari sekali.
Tabel 1 Parameter fisika-kimia air yang di ukur
Parameter Unit Alat/ Metode Lokasi
Suhu ºC Termometer In situ
DO mgL-1 DO meter In situ
pH - pH meter In situ
NH3- mgL-1 Spektrofotometrik Laboratorium
Analisis Statistik
Analisis stastistik yang digunakan untuk melihat pengaruh dari paparan merkuri terhadap laju pertumbuhan bobot rata-rata harian, kondisi hati dan empedu, indeks kematangan gonad, fekunditas serta ukuran diameter telur ikan nila (Oreochromis niloticus) ditentukan dengan menggunakan ANOVA satu arah. Kriteria berbeda nyata yang digunakan dalam penelitian ini adalah pada tingkat kepercayaan 95% (P <0.05).
4 HASIL DAN PEMBAHASAN
Uji Pendahuluan
Hasil uji nilai kisaran (Range finding test) menunjukkan pengaruh yang signifikan terhadap mortalitas ikan nila (Oreochromis niloticus) pada deretan konsentrasi yang diuji. Berdasarkan respon mortalitas selama pengamatan 48 jam dapat ditentukan nilai ambang batas atas (N) dan ambang batas bawah (n) HgCl2 terhadap ikan Nila (Oreochromis niloticus) masing masing sebesar 10 mgL-1 HgCl2 dan 0.1 mgL-1 HgCl2 Tabel 2 menunjukkan persentase mortalitas kumulatif ikan Nila (Oreochromis niloticus) pada konsentrasi yang berbeda selama 48 jam waktu pemaparan.
Tabel 2 Data mortalitas ikan nila pada uji nilai kisaran
17
0 25 50 75 100
0 12 24 48 72 96
Mortalitas (%)
Waktu Pemaparan (jam)
Mortalitas kumulatif ikan Nila (Oreochromis niloticus) pada jam ke 24 dengan konsentrasi 1 mgL-1 HgCl2 adalah sebesar 40% dan meningkat menjadi 50% pada jam ke 36 dan 48. Mortalitas kumulatif ikan Nila (Oreochromis niloticus) 100% terjadi pada konsentrasi 10 mgL-1 HgCl2 dimulai sejak pengamatan pada jam ke 6. Pada perlakuan kontrol (0 mgL-1HgCl2) tidak ditemukan kematian ikan.
Uji Toksisitas Akut
Uji toksisitas akut diamati selama 96 jam dengan konsentrasi yang diperoleh berdasarkan analisis uji nilai kisaran. Konsentrasi HgCl2 yang digunakan pada uji toksisitas akut yaitu perlakuan A 0.37 mgL-1 HgCl2 (0.273 mgL--1 Hg), perlakuan B 1.64 mgL--1 HgCl2 (0.742 mgL-1 Hg), perlakuan C 3.15 mgL-1 HgCl2 (2.331 mgL-1 Hg) dan perlakuan D 9.92 mgL-1 HgCl2 (7.34 mgL-1 Hg). Pengamatan respon mortalitas dilakukan pada jam ke- 12, 24, 48, 72, dan 96 jam setelah pemaparan HgCl2 (Gambar 5)
Gambar 5 Mortalitas kumulatif ikan nila (Oreochromis niloticus) setelah pemaparan HgCl2 selama 96 jam
Mortalitas ikan nila (Oreochromis niloticus) meningkat secara signifikan pada jam ke-24. Pada konsentrasi 3.15 mgL-1 dan 9.92 mgL-1 mortalitas meningkat menjadi 100%, mortalitas pada konsentrasi 1.64 mgL-1 meningkat menjadi 55 %. Mortalitas ikan nila (Oreochromis niloticus) pada konsentrasi 1.64 mgL-1 meningkat menjadi 60% pada jam ke 48, sedangkan pada jam ke-96 tidak terjadi mortalitas ikan uji pada seluruh konsentrasi yang diujikan. Berdasarkan analisis probit diperoleh nilai LC50-96 jam sebesar 1.64 mgL-1 HgCl2.
18
Tubuh ikan nila (Oreochromis niloticus) terlihat berlendir dikarenakan sekresi mokus yang terlalu banyak. Pergerakan operkulum yang cepat melambat secara signifikan seiring dengan meningkatnya waktu pemaparan. Beberapa ikan Nila (Oreochromis niloticus) yang mati ditemukan pada dasar wadah uji dengan mulut terbuka. Ikan nila (Oreochromis niloticus) yang berada pada perlakuan dengan konsentrasi terendah (0.37 mgL-1) tetap hidup dan aktif serta tidak menunjukkan perubahan tingkah laku.
Nilai LC50-96 jam yang diperoleh dari uji toksisitas akut selanjutnya dijadikan dasar dalam menentukan konsentrasi merkuri pada uji sub kronik . Uji sub kronik pada penelitian ini menggunakan tiga konsentrasi yaitu 0 mgL-1 HgCl2, 0.164 mgL-1 HgCl2 (0.121 mgL-1 Hg) dan 0.196 mgL-1 HgCl2 (0.145 mgL-1 Hg).
Uji Sub Kronik
Parameter Fisika Kimia Air
Pengukuran parameter fisika kimia yang diukur meliputi suhu, oksigen terlarut, pH dan Amoniak. Pengukuran parameter kualitas air dilakukan setiap 14 hari. Nilai kisaran parameter fisika kimia yang diamatati selama penelitian disajikan pada Tabel 3
Tabel 3 Kisaran parameter fisika kimia air selama penelitian
Parameter Satuan Waktu Pengamatan (hari)
14 28 42 56
Suhu oC 29-29.4 28.9-29.3 27-28.1 28.3-29.1
DO mgL-1 5.6-6.6 5.7-7.2 5.3-6.1 5.8-6.3
pH - 6.1-7.6 6.4-7.4 6-6.3 6-6.3
NH3 mgL-1 0.01-3.14 0.12-0.25 0.01-0.43 0.009-0.1
Hasil pengukuran suhu di media pemeliharaan selama penelitian berkisar antara 27-29 oC Kisaran suhu tidak menunjukkan perbedaan yang menonjol selama waktu penelitian dan masih mendukung untuk kehidupan ikan uji (Boyd 1990). Derajat Keasaman (pH) selama penelitian berkisar antara 5-8 satuan pH, nilai ini masih cukup baik untuk menunjang kehidupan ikan (Hickling 1971)
Kandungan oksigen terlarut merupakan faktor pembatas dalam mendukung optimalisasi kehidupan organisme perairan. Kandungan oksigen terlarut yang diperoleh selama penelitian berkisar antara 4.5-6.5 mgL-1. Kisaran kandungan Oksigen terlarut ini masih mendukung untuk kehidupan ikan uji (Effendi 2003).
Hasil pengukuran amoniak selama penelitian cenderung fluktuatif pada setiap pengamatannya. Pada 14 hari pengamatan pertama kandungan amoniak dalam akuarium tergolong tinggi yakni berkisar antara 0.01 – 3.144 mgL-1 dan cenderung menurun pada minggu minggu berikutnya. Pada akhir pengamatan nilai amoniak berada pada kisaran 0.009 – 0.114 mgL-1.
Tingkat Kelangsungan Hidup
19
0 25,00 50,00 75,00 100,00
0 hari 14 hari 28 hari 42 hari 56 hari
Kelangsungan Hidup (%)
Hari Pengamatan
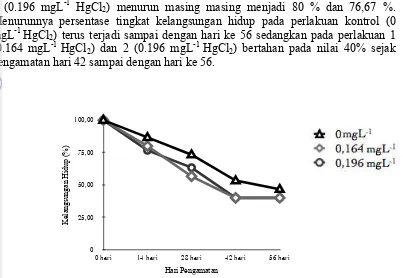
Pada dua minggu pertama setelah pemaparan, tingkat kelangsungan hidup ikan nila (Oreochromis niloticus) padaperlakuan kontrol (0 mgL-1 HgCl2) menurun menjadi 86.67 % sedangkan untuk perlakuan 1 (0.164 mgL-1 HgCl2) dan perlakuan 2 (0.196 mgL-1 HgCl2) menurun masing masing menjadi 80 % dan 76,67 %. Menurunnya persentase tingkat kelangsungan hidup pada perlakuan kontrol (0 mgL-1 HgCl2) terus terjadi sampai dengan hari ke 56 sedangkan pada perlakuan 1 (0.164 mgL-1 HgCl2) dan 2 (0.196 mgL-1 HgCl2) bertahan pada nilai 40% sejak pengamatan hari 42 sampai dengan hari ke 56.
Gambar 6 Tingkat kelangsungan hidup ikan uji pada tingkatan sub kronik
Laju Pertumbuhan Bobot
Pengamatan laju pertumbuhan bobot rata-rata harian dilakukan selama selang waktu 56 hari.Tabel 4 menunjukkan bahwa laju pertumbuhan ikan nila
(Oreochromis niloticus) tertinggi terdapat pada perlakuan kontrol (0.270 %) diikuti dengan perlakuan 2 (0.238 %) dan perlakuan 1 (0.250 %).
Tabel 4 Laju Pertumbuhan bobot rata rata harian ikan nila Konsentrasi
HgCl2 (mgL-1)
Wo (g) Wt (g) LPBRH (%)
0 21.0867 24.5325 0.270
±1.31 ±6.80
0.164 21.5733 24.6455 0.238
±2.07 ±4.69
0.196 20.8033 23.9250 0.250
±0.55 ±0.29
W0 : bobot rata-rata awal ikan uji, Wt : bobot rata-rata akhir ikan uji
Pengaruh merkuri terhadap perubahan laju pertumbuhan bobot ikan Nila
20
menjelaskan bahwa laju pertumbuhan bobot juga sangat dipengaruhi oleh kualitas dan kuantitas pakan, umur serta kualitas air media pemeliharaan.
Kandungan Merkuri Pada Organ Hati dan Ginjal
Pengamatan kandungan merkuri dalam organ hati dan ginjal ikan Nila
(Oreochromis niloticus) dilakukan pada akhir waktu pemaparan merkuri. Hasil analisis laboratorium menunjukkan organ hati ikan nila (Oreochromis niloticus)
pada perlakuan 2 memiliki kandungan merkuri tertinggi (1105.24 μg/kg) dibandingkan dengan perlakuan 1 dan perlakuan kontrol. Kandungan merkuri pada organ hati dan ginjal pada ikan nila (Oreochromis niloticus) disetiap perlakuan disajikan pada Tabel 5.
Tabel 5 Kandungan merkuri klorida (HgCl2) pada organ hati dan ginjal ikan nila
Kandungan merkuri tertinggi pada organ ginjal tertinggi terdapat pada perlakuan 1 (8196.78 μg/kg) diikuti dengan perlakuan 2 (490.13 μg/kg) dan perlakuan kontrol (<0.20 μg/kg).)
Kondisi Hati dan Empedu
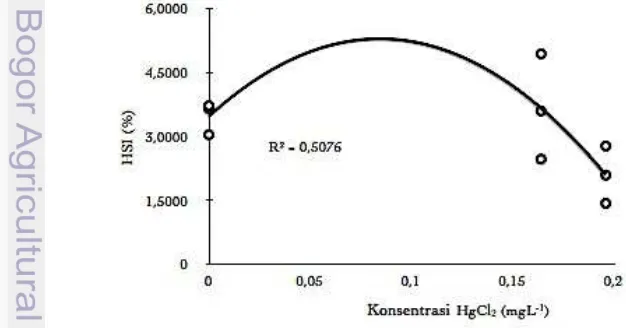
Nilai rata-rata Hepatosomatic Indeks (HSI) ikan nila (Oreochromis niloticus)
pada perlakuan kontrol (0 mgL-1) yaitu sebesar 3.4685 %. Nilai rata-rata HSI cenderung meningkat pada perlakuan 1 (0.164 mgL-1) yaitu sebesar 3.666 %, sedangkan pada perlakuan 2 (0.196 mgL-1) menurun menjadi 2.097 %. Pengaruh merkuri klorida (HgCl2) terhadap HSI disajikan pada Gambar 7.
Perbedaaan nilai rata-rata HSI pada perlakuan 1 (3.666 %) dibandingkan dengan perlakuan kontrol (3.4685 %) tidak memberikan perbedaan yang nyata (p > 0.05) akan tetapi rendahnya nilai rata-rata HSI yang terdapat pada perlakuan 2 (2.097 %) memberikan perbedaan yang nyata (p < 0.05) jika dibandingkan dengan nilai rata-rata HSI pada perlakuan kontrol.
Gambar 7 Pengaruh merkuri klorida (HgCl2) terhadap HSI ikan nila
Organ sampel Kandungan merkuri (μg/kg)
P.kontrol P.1 P.2
Hati < 0.20 638.29 1105.24
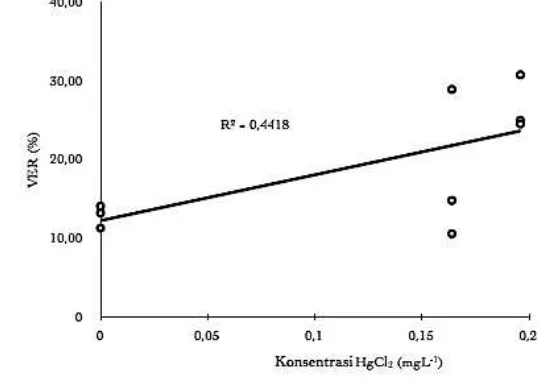
21 Rata-rata nilai Volume Empedu Relatif (VER) ikan nila (Oreochromis niloticus) menunjukkan terjadinya peningkatan seiring dengan meningkatnya konsentrasi merkuri (Gambar 8). Nilai VER tertinggi terdapat pada perlakuan 2 (0.196 mgL-1) yaitu sebesar 26.6510 % diikuti dengan perlakuan 1 (0.164 mgL-1) dan perlakuan kontrol (0 mgL-1) yaitu masing masing sebesar 17.9982 % dan 12.2673 %. Pengaruh merkuri terhadap peningkatan VER pada perlakuan kontrol (12.2673 %) dan perlakuan 2 (26.6510 %) menunjukkan perbedaan yang nyata (p < 0.05).
Gambar 8 Pengaruh merkuri klorida (HgCl2) terhadap VER ikan nila
Indeks Kematangan Gonad (IKG)
Nilai rata-rata IKG ikan nila (Oreochromis niloticus) pada perlakuan 2 (0.196 mgL-1) menunjukkan nilai yang tertinggi, yaitu 1.3364%, dibandingkan dengan perlakuan kontrol (0 mgL-1) dan perlakuan 2 (0.196 mgL-1) yaitu 0.7151 % dan 0.9372 %. Pengaruh merkuri terhadap indeks kematangan gonad ikan nila
(Oreochromis niloticus) tidak menunjukkan perbedaan yang signifikan (p > 0,05). Pengaruh merkuri klorida (HgCl2) terhadap IKG ikan nila disajikan pada Tabel 6.
Tabel 6 Pengaruh merkuri klorida (HgCl2) terhadap IKG ikan nila
Ulangan IKG (%)
P.kontrol P.1 P.2
1 0.4265% 0.3932% 0,4394%
2 0.6243% 1.0192% 2.9218%
3 1.0945% 1.3993% 0.6482%
Rata-Rata 0.7151%ns 0.9372%ns 1.3364%ns
STD ±0.5910 ±2.7434 ±1.4897
22
0,188-0,313 0,313-0,438 0,438-0,563 0,563-0,688 0,688-0,813 0,813-0,938 0,938-1,063 1,063-1,188 1,188-1313
Frekuensi (butir)
Diameter telur (mm)
0 mgL-1
Fekunditas dan Diameter Telur
Nilai fekunditas ikan nila (Oreochromis niloticus) pada Tingkat Kematangan Gonad (TKG) III yang diperoleh pada tiga perlakuan secara keseluruhan berkisar 222 – 475 butir/individu.. Hasil perhitungan nilai rataan fekunditas ikan Nila
(Oreochromis niloticus) yang diperoleh selama penelitian dapat dilihat pada Tabel 7.
Tabel 7 Pengaruh merkuri klorida (HgCl2) terhadap fekunditas ikan nila
Ulangan Fekunditas (butir)
Tabel 7 menunjukkan bahwa rataan fekunditas ikan Nila (Oreochromis niloticus) tertinggi teradpat pada perlakuan 1 (0.164 mgL-1) yaitu sebesar 358 butir/individu, diikuti dengan perlakuan kontrol dan perlakuan 2 (0.196 mgL-1) yaitu sebesar 335 butir/individu dan 301 butir/individu. Hasil uji statistik menunjukkan bahwa tidak ada perbedaan yang nyata terhadap fekunditas akibat pemaparan merkuri pada konsentrasi uji (p > 0.05).
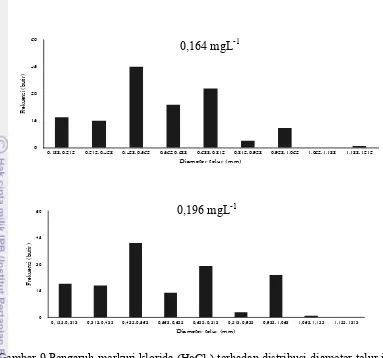
Sebaran diameter telur ikan nila (Oreochromis niloticus) pada TKG III menyebar pada kisaran diameter 0,250 –1,250 mm. Gambar 11 menunjukkan bahwa pemaparan merkuri pada ikan uji tidak menyebabkan terjadinya perubahan pada tipe pemijahan. Dari Gambar 9 terlihat bahwa tipe pemijahan ikan Nila
(Oreochronis niloticus) adalah partial spawning.
23
0,188-0,313 0,313-0,438 0,438-0,563 0,563-0,688 0,688-0,813 0,813-0,938 0,938-1,063 1,063-1,188 1,188-1313
Frekuensi (butir)
0,188-0,313 0,313-0,438 0,438-0,563 0,563-0,688 0,688-0,813 0,813-0,938 0,938-1,063 1,063-1,188 1,188-1313
Frekuensi (butir)
Diameter telur (mm) 0,164 mgL-1
Gambar 9 Pengaruh merkuri klorida (HgCl2) terhadap distribusi diameter telur ikan
nila
Histopatologi
Insang
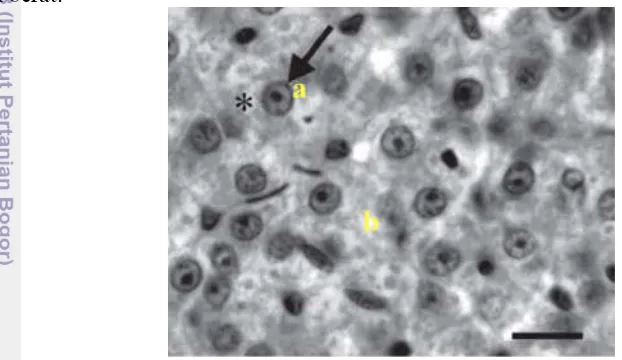
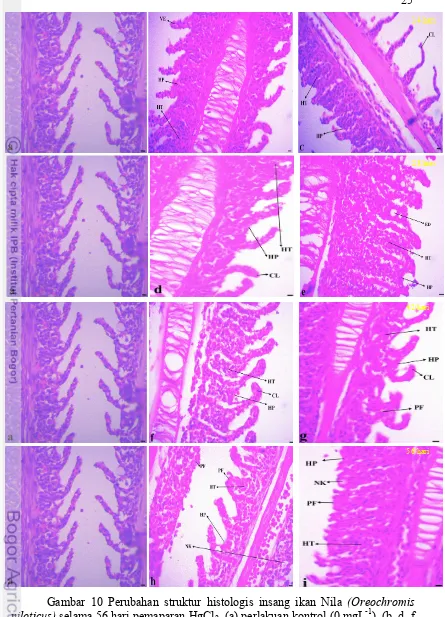
Insang merupakan organ yang bersentuhan langsung dengan sistem perairan, sehingga jika air di suatu perairan mengandung logam berat maka akan memberikan dampak langsung pada organ tersebut. Kerusakan pada jaringan insang dapat mengakibatkan terganggunya mekanisme pernapasan pada ikan. Connel & Miller (1995) menyatakan bahwa kerusakan pada insang dapat menyebabkan terhambatnya sistem transport elektron dan fosforilasi oksidatif pada rantai pernapasan yang pada akhirnya mempengaruhi metabolisme dan pertumbuhan. Kerusakan pada jaringan insang terjadi karena adanya akumulasi merkuri yang semakin tinggi seiring bertambahnya dosis dan waktu pemaparan.
Struktur jaringan insang pada perlakuan kontrol (0 mgL-1) terlihat normal, dengan deretan lamella primer dan lamella sekunder yang teratur. Sel-sel insang terdiri dari dua atau tiga lapis sel epitel yang rata dan terletak di membrane basal, jarak antar lamella sekunder terlihat jelas. Struktur jaringan insang pada perlakuan kontrol (0 mgL-1) tidak menunjukkan adanya perubahan histopatologi (Gambar 10a). Perubahan struktur jaringan insang mulai terlihat pada hari ke 14, stuktur jaringan insang pada perlakuan 1 (0,164 mgL-1) mengalami hipertropi, hyperplasia dan vakuolalisasi pada lamella sekunder (Gambar 12b). perubahan histopalogi yang terjadi pada perlakuan 2 (0,196 mgL-1) diantararanya adalah hipertropi, hyperplasia dan ketidaklurusan pada lamella sekunder (curling of secondary lamella).
24
waktu pemaparan (Tabel 8). Pada hari ke 28 (Gambar 10d), kerusakan jaringan insang pada perlakuan 1 (0.164 mgL-1) terlihat dengan meluasnya penambahan sel
(hyperplasia) dan pembesaran sel yang berlebihan (hipertropi). Pada perlakuan dengan dosis yang lebih tinggi (0.196 mgL-1) penambahan jumlah sel (hyperplasia)
dan pembesaran sel yang berlebihan (hipertropi) terlihat semakin meluas dan hampir menutupi lamella sekunder (Gambar 10e).
Berhimpitnya lamella sekunder (Proliferasi) mulai terlihat pada perlakuan 2 (0.196 mgL-1) dalam waktu 42 hari pemaparan (Gambar 10g) sedangkan untuk perlakuan 1 (0.164 mgL-1) berhimpitnya lamella sekunder (Proliferasi) mulai terlihat pada hari ke 52 pemaparan merkuri (Gambar 10h). Kematian sel (Nekrosis)
mulai terlihat pada hari ke 56 dari pemaparan merkuri. Perlakuan 2 (0.196 mgL-1) menunjukkan gejala kematian sel yang lebih besar dibandingkan dengan perlakuan 1 (0.164 mgL-1).
Tabel 8 Pengaruh merkuri klorida (HgCl2) terhadap perubahan struktur histologis insang ikan nila (Oreochromis niloticus)
Keterangan: tingkat kerusakan (-) Tidak ada, (+) ringan, (++) Sedang, (+++) Berat HP, Hyperplasia, HT, Hipertropi, CL, Curling of Secondary Lamella,
PF, Proliferasi, NK, Neukrosis.
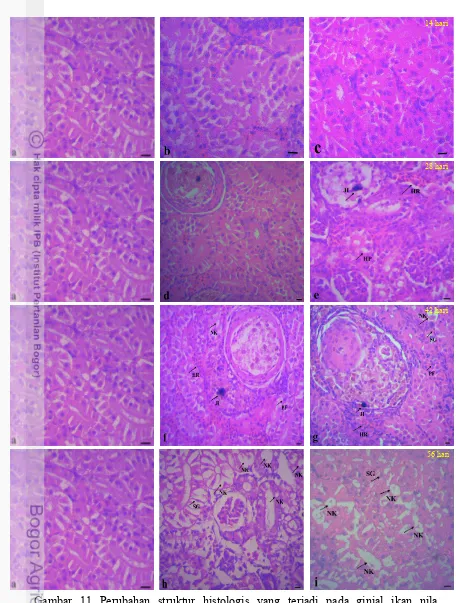
Ginjal
Struktur jaringan ginjal pada perlakuan kontrol (0 mgL-1) terlihat normal, dan tidak menunjukkan adanya perubahan histologis (Gambar 11a), hal ini tampak dengan ada adanya glomelurus dan tubuli tubuli ginjal serta adanya jaringan hematopoietic (pembentuk sel darah merah) dalam kondisi normal. Perubahan struktur jaringan ginjal mulai terlihat pada hari ke 28, stuktur jaringan ginjal pada perlakuan 2 (0,196 mgL-1) yang lain juga mulai terjadi penciutan sel ginjal (shrinkage) terutama pada pelakuan) mengalami hyperplasia, hemorage dan mulai terdapatnya jaringan ikat (Gambar 11e). Pengaruh Merkuri Klorida (HgCl2) terhadap perubahan struktur histologis ginjal ikan nila (Oreochromis niloticus)
terlihat pada Tabel 9.
Tabel 9 Pengaruh merkuri klorida (HgCl2) terhadap perubahan struktur histologis ginjal ikan Nila (Oreochromis niloticus)
Keterangan: tingkat kerusakan (-) Tidak ada, (+) ringan, (++) Sedang, (+++) Berat HP, Hyperplasia, HG, Hemorage, JI, Terbentuknya Jaringan ikat, SG,
Shrinkage, PF, Proliferasi, NK, Neukrosis.
Jenis Kerusakan
Waktu Pemaparan (hari)
14 28 42 56
0 0.164 0.196 0 0.164 0.196 0 0.164 0.196 0 0.164 0.196
25
Gambar 10 Perubahan struktur histologis insang ikan Nila (Oreochromis niloticus) selama 56 hari pemaparan HgCl2. (a) perlakuan kontrol (0 mgL-1). (b, d, f, h) perlakuan 1 (0.164 mgL-1) pada hari ke 14, 28, 42 & 56. (c, e, g, i) perlakuan 2 (0.196 mgL-1) pada hari ke 14, 28,42 & 56. HT, hipertropi, HP, hyperplasia, CL,
curling of secondary lamella, ED, Edema, PF, Proliferasi, NK, neukrosis. Skala bar = 20 µm, pembesaran 100x
14 hari
28 hari
42 hari
26
Pengamatan histologis pada hari ke 42 (Gambar 11g) menunjukkan bahwa ginjal mulai mengalami perubahan letak (distorsi) hingga menyebabkan terjadinya penghimpitan pada sel ginjal antar satu dan lainnya (Proliferasi), selain itu pada yang lain juga mulai terjadi penciutan sel ginjal (shrinkage) terutama pada pelakuan 2.Kematial sel (Nekrosis) mulai terlihat baik pada perlakuan 1(0.146 mgL-1) maupun pada perlakuan 2 (0.196 mgL-1). Kematian sel (Nekrosis) pada ginjal semakin meluas pada hari ke 56 hari pemaparan merkuri. Pada perlakuan 2 (0.196 mgL-1), kematian sel (Nekrosis) terlihat hampir di setiap sisi pengamatan (Gambar 11i).
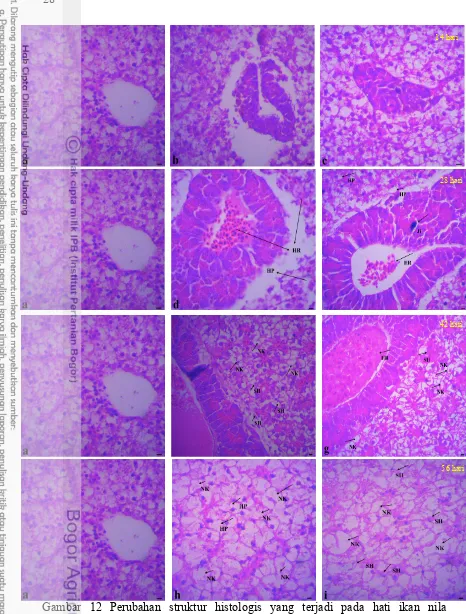
Hati
Hati ikan terdiri dari sel hati (hepatosit) dikelilingi oleh sinusoid. Hepatosit terdiri dari vakuola, eosinophilic sitoplasma dan nucleus (inti) berbentuk bulat bulat. Hati menerima 89% suplai darah dari vena portal yang mengalirkan darah dari sistem gastrointestinal. Substansi zat-zat toksik tyang bersumber dari tumbuhan, fungi, zat logam, mineral dan zat-zat kimia lainnya yang diserap ke dalam portal ditransportasikan ke hati. Hati menghasilkan enzim-enzim yang mempunyai kemampuan untuk melakukan biotransformasi terhadap berbagai macam zat eksogen dan endogen. Kerusakan pada hati menyebabkan terganggunya berbagai fungsi hati. Connell & Millner (1995) menyatakan bahwa toksikan dapat menyebabkan gangguan pada metabolism protein, lemak dan karbohidrat, serta enzim mikrosomial.
Kerusakan pada jaringan hati mulai terlihat pada hari ke 28 dari waktu pemaparan (Gambar 12d dan Gambar12e). Pada perlakuan 1 (0.164 mgL-1) dan perlakuan 2 (0.196 mgL-1) mulai tampak terjadinya penambahan jumlah sel
(Hyperplasia) dan pendarahan (Hemorage). Kerusakan jaringan hati semakin meluas pada hari ke 42 dari waktu pemaparan merkuri (Gambar 12f). Pada perlakuan 1 (0.164 mgL-1) mulai tampak adanya kematian sel hati (Neukrosis) dan penciutan inti sel hati (shrinkage of hepatocyte) akibat vakuolalisasi sitoplasma. Pada perlakuan 2 (0.198 mgL-1) kematian sel hati (Neukrosis) terlihatlebih meluas. Pengamatan histologis pada jaringan hati pada hari ke 56 menunjukkan tingkat kematian sel yang parah (Tabel 10). Pada perlakuan 2 (0.196 mgL-1) kematian sel terlihat hampir di seluruh sel yang diamati (Gambar 12i).
Tabel 10 Pengaruh merkuri klorida (HgCl2) terhadap perubahan struktur histologis hati ikan nila (Oreochromis niloticus)
Keterangan: tingkat kerusakan (-) Tidak ada, (+) ringan, (++) Sedang, (+++) Berat HP, Hyperplasia, HG, Hemorage, SG, Shrinkage of Hepatocite, NK,
Neukrosis
Parameter
Waktu Pemaparan (hari)
14 28 42 56
0 0.164 0.196 0 0.164 0.196 0 0.164 0.196 0 0.164 0.196 HP - - - - + ++ - +++ +++ - +++ +++
HR - - - - + + - + ++ - - -
27
Gambar 11 Perubahan struktur histologis yang terjadi pada ginjal ikan nila
(Oreochromis niloticus) selama 56 hari pemaparan HgCl2. (a) perlakuan kontrol (0 mgL-1). (b, d, f, h) perlakuan 1 (0.164 mgL-1) pada hari ke 14, 28, 42 & 56. (c, e, g, i) perlakuan 2 (0.196 mgL-1) pada hari ke 14, 28,42 & 56. HP, hyperplasia, SG,
Shrinkage (Penciutan sel), IT, Intersitial inflammation (hemorage), JI, terbentuknya Jaringan Ikat, PF, Poliferasi, NK, Neukrosis. Skala bar = 20 µm, pembesaran 100x
14 hari
28 hari
42 hari
28