EFEKTIVITAS MIKROENKAPSULAT EKSTRAK AIR KULIT BUAH
MANGGIS (KBM) UNTUK MENURUNKAN KADAR MDA HATI TIKUS
AKIBAT KONSUMSI MINYAK SAWIT TEROKSIDASI
BLASIUS ADITYA PUTRA PERMANA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Efektivitas Mikroenkapsulat Ekstrak Air Kulit Buah Manggis (KBM) untuk Menurunkan Kadar MDA Hati Tikus Akibat Konsumsi Minyak Sawit Teroksidasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
BLASIUS ADITYA PUTRA PERMANA. Efektivitas Mikroenkapsulat Ekstrak Air Kulit Buah Manggis (KBM) untuk Menurunkan Kadar MDA Hati Tikus Akibat Konsumsi Minyak Sawit Teroksidasi. Dibimbing oleh PUSPO EDI GIRIWONO dan SUTRISNO KOSWARA.
Kulit buah manggis (KBM) diketahui memiliki kandungan antioksidan yang tinggi namun memiliki karakter sensori yang getir, pahit dan sepat. Aplikasi teknologi mikroenkapsulasi merupakan solusi untuk mengurangi intensitas sensori dan melindungi senyawa bioaktif KBM. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian mikroenkapsulat ekstrak KBM terhadap kadar MDA hati tikus. KBM direndam dengan air destilata selama 24 jam pada suhu ruang, kemudian dikeringkan menggunakan freeze dryer dan dibuat mikroenkapsulat KBM. Tikus percobaan dibagi dalam lima kelompok, yaitu: kelompok K(-) yang diberikan minyak sawit tanpa oksidasi, kelompok K(+) diberikan minyak sawit teroksidasi, kelompok KBM1 diberikan minyak sawit teroksidasi dan ekstrak KBM kering 100 mg/kg BB, KBM2 diberikan minyak sawit teroksidasi dan mikroenkapsulat ekstrak KBM 100 mg/kg BB, dan kelompok KBM3 diberikan minyak sawit teroksidasi dan mikroenkapsulat KBM 200 mg/kg BB. Mikroenkapsulasi menurunkan kapasitas antioksidan dari IC50 44.704 ppm (ekstrak) menjadi IC50102.896 ppm (mikroenkapsulat). Aplikasi teknologi mikroenkapsulasi mampu menutupi rasa pahit KBM dan meningkatkan konsumsi pakan tikus. Tidak teramati adanya perbedaan berat badan dan berat organ ginjal, hati, limpa, dan jaringan adiposa akibat pemberian mikroenkapsulat KBM. Terjadi penurunan kadar MDA hati KBM1 sebesar 53.49%, KBM2 sebesar 32.56%, dan KBM3 sebesar 48.84%. Pemberian mikroenkapsulat ekstrak KBM mampu menurunkan kadar MDA pada hati tikus.
ABSTRACT
BLASIUS ADITYA PUTRA PERMANA. Effectiveness of Microencapsulated Mangosteen Pericarp Water Extract (KBM) to Lower MDA Value of Rat Liver Due to Consumption of Oxidized Palm Oil. Supervised by PUSPO EDI GIRIWONO and SUTRISNO KOSWARA.
The pericarp of Mangosteen (KBM) is known to have strong antioxidant properties but has constraints in its bitter sensory character. Application of microencapsulation technology is a solution to reduce the intensity of this bitterness and help to protect bioactive compounds of KBM. This study aims to determine the effect of microencapsulated KBM water extracts in protecting rat liver from consumtion of oxidized palm oil. KBM extract obtained by the technique of immersion in water solvent and then made microencapsulated extract. Rats were divided into five groups: group K (-) are given non-oxidized palm oil, the group K (+) given oxidized palm oil, KBM1 group was given oxidized palm oil and dried extract 100 mg/kg BW, KBM2 group given oil oxidized oil and mikroencapsulated of KBM extracts 100 mg/kg BB, and KBM3 group was given oxidized palm oil and and mikroencapsulated of KBM extracts 200 mg/kg BW. Microencapsulation process decreases the extract antioxidant capacity from IC50 44.704 ppm (extract) to IC50 102.896 ppm (microcapsulate). The bitter taste of mangosteen pericarp could be masked by microencapsulation processes, thus increase the feed intake of rat. Addition of KBM extract and microencapsulate are proven to reduce liver disfunction that can be seen from the decrease in rat’s liver MDA levels. The decrease of MDA levels on KBM 1, KBM 2, and KBM 3 respectively are 53.49%, 32.56%, and 48.84%. Giving mikroenkapsulated of KBM extract could reduce levels of MDA in rat liver effectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
EFEKTIVITAS MIKROENKAPSULAT EKSTRAK AIR KULIT BUAH
MANGGIS (KBM) UNTUK MENURUNKAN KADAR MDA HATI TIKUS
AKIBAT KONSUMSI MINYAK SAWIT TEROKSIDASI
Judul Skripsi : Efektivitas Mikroenkapsulat Ekstrak Air Kulit Buah Manggis (KBM) untuk Menurunkan Kadar MDA Hati Tikus Akibat Konsumsi Minyak Sawit Teroksidasi
Nama : Blasius Aditya Putra Permana NIM : F24100104
Disetujui oleh
Dr Ir Dewi Apri Astuti, MS Pembimbing I
Ir. Sutrisno Koswara M.Si. Pembimbing II
Diketahui oleh
Dr. Ir. Feri Kusnandar, M.Sc. Ketua Departemen
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga tugas akhir ini berhasil diselesaikan. Penelitian dilakukan di Laboratorium Departemen ITP IPB. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2013 ialah peningkatan kualitas pangan dalam bentuk bahan tambahan pangan untuk pencegahan dan penanganan gangguan akibat stres oksidatif (radikal bebas) dengan judul Kajian Efektifitas Mikroenkapsulat Ekstrak Air Kulit Buah Manggis (KBM) untuk Menurunkan Kadar MDA Hati Tikus Akibat Konsumsi Minyak Sawit Teroksidasi.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak, Ibu, dan adik yang selalu memberi dukungan, doa, dan kasih sayang. Terima kasih penulis ucapkan kepada Bapak Dr. Puspo Edi Giriwono, STP, M.Agr. dan Bapak Ir. Sutrsino Koswara, M.Si. selaku dosen pembimbing dan Ibu Dr. Nur Wulandari, STP, M.Si. yang selalu memberikan saran, pengarahan, dan bimbingan selama kuliah, penelitian, hingga tersusunnya skripsi ini. Terima kasih untuk DIKTI selaku pemberi dana melalui skema Penelitian Unggulan Perguruan Tinggi tahun 2013-2014. Terima kasih kepada rekan selama penelitian Nesya Nova Febriane yang telah bekerjasama dengan sangat baik. Terima kasih untuk laboran dan teknisi Bapak Rojak, Bapak Gatot, Ibu Antin, Mbak Nurul, Mbak Vera, dan Mbak Irin yang membantu dalam kegiatan analisis. Terima kasih teman-teman ITP 47 yang saya sayangi dan saya banggakan. Terima kasih kepada staf UPT ITP Mbak Anie, Mbak Darsih, Bu Novie, Bu Fitri serta Ibu dan Bapak UPT lainnya untuk informasi dan pelayanan yang ramah.
Penulis mengharapkan segala masukan dan kritik yang membangun. Semoga skripsi tugas akhir ini bermanfaat bagi semua pihak yang membutuhkan terutama untuk perkembangan teknologi pangan. Terima kasih.
DAFTAR ISI
PRAKATA ix
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Bahan 2
Alat 3
Prosedur Penelitian 3
Prosedur Analisis Data 6
HASIL DAN PEMBAHASAN 6
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 22
DAFTAR TABEL
1. Komposisi pakan tikus perobaan 5
2. Tabel hasil penelitian pendahuluan 6
DAFTAR GAMBAR
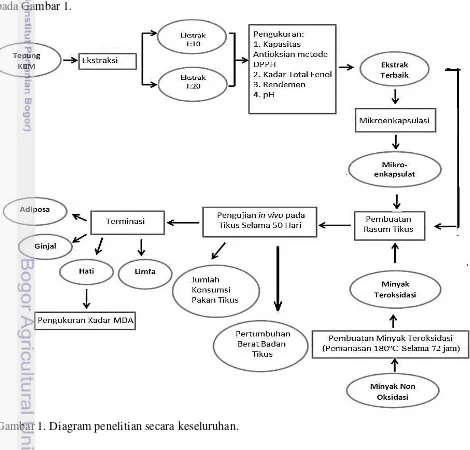
1. Diagram penelitian secara keseluruhan. 3
2. Data bilangan asam minyak 9
3. Data bilangan peroksida minyak 10
4. Rata-rata konsumsi pakan tikus selama 50 hari 11
5. Grafik perubahan berat badan tikus selama 50 hari 11
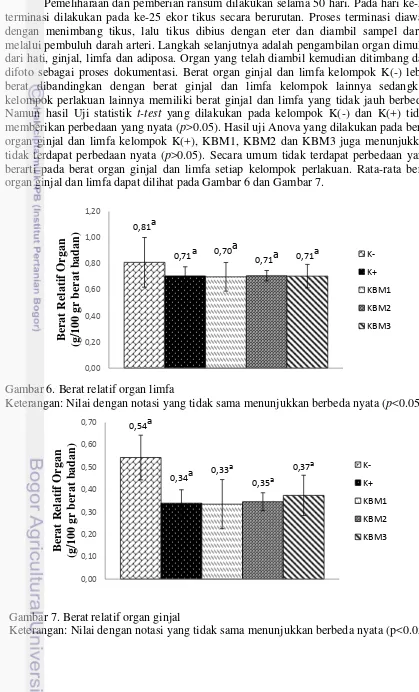
6. Berat relatif organ limfa 12
7. Berat relatif organ ginjal 12
8. Berat relatif organ hati. 13
9. Berat relatif jaringan adiposa. 13
10. Kadar MDA pada organ hati tikus 14
11. Data penurunan kadar MDA dibandingkan kelompok K(+) 16
DAFTAR LAMPIRAN
1. Foto organ hati 22
2. Uji t-test pH ekstrak 23
3. Uji t-test rendemen ekstrak 24
4. Uji t-test total kadar fenol 25
5. Analisis keragaman (ANOVA) kadar total fenol 26
6. Uji t-test kapasitas antioksidan 28
7. Analisis keragaman (ANOVA) kapasitas antioksidan (IC50) 29
8. Uji t-test kadar asam lemak bebas minyak 31
9. Uji t-test peroksida minyak 32
10. Uji t-test berat badan tikus 33
11. Analisis keragaman (ANOVA) berat badan tikus 34
12. Uji t-test konsumsi pakan tikus 36
13. Analisis keragaman (ANOVA) konsumsi pakan tikus 37
14. Uji t-test organ tikus 38
15. Analisis keragaman (ANOVA) hati relatif tikus 40
16. Analisis keragaman (ANOVA) ginjal tikus 42
17. Analisis keragaman (ANOVA) adiposa tikus 44
18. Analisis keragaman (ANOVA) limfa tikus 46
19. Uji t-test kadar mda hati tikus 48
PENDAHULUAN
Penyakit degeneratif merupakan masalah kesehatan yang disebabkan menurunnya fungsi dari jaringan maupun organ tubuh. Salah satu pemicu munculnya penyakit degeneratif adalah radikal bebas. Radikal bebas merupakan atom, molekul atau senyawa tidak stabil karena memiliki elektron yang tidak berpasangan. Kadar radikal bebas yang berlebihan di dalam tubuh menyebabkan kondisi stres oksidatif, yaitu tidak seimbangnya kadar radikal bebas dengan kadar antioksidan (Wu dan Cederbaum 2010). Radikal bebas bersifat destruktif dan memicu berbagai penyakit. Radikal bebas merupakan patogenesis banyak penyakit degeneratif seperti: arteriosklerosis, stroke, dan diabetes. (Rohman dan Riyanto 2005).
Kebiasaan merokok, pola makan tidak seimbang, konsumsi alkohol, serta kurangnya aktivitas fisik menjadi penyebab utama penyakit-penyakit degeneratif (WHO 2013). Salah satu kebiasaan yang tidak sehat adalah kegemaran makan makanan yang digoreng. Makanan yang digoreng disukai oleh banyak orang karena memiliki flavour yang khas, mudah dalam proses pembuatan, dan relatif murah. Minyak goreng seringkali digunakan secara berulang-ulang sehingga meningkatkan tingkat oksidasi, ditandai dengan kenaikan bilangan asam dan peroksida (Rahayu dan Purnavita 2014). Pemanasan berulang minyak goreng juga menyebabkan perubahan fisik minyak goreng seperti: warna menjadi kehitaman, keruh, dan berbau tengik (Winarno 2002). Konsumsi makananan hasil penggorengan berulang akan meningkatkan stres oksidatif pada tubuh, terutama pada hati. Radikal bebas menyebabkan terjadinya reaksi oksidasi yang berbahaya karena dapat merusak jaringan tubuh, memicu penyakit degeneratif seperti kanker, tekanan darah tinggi, jantung koroner, diabetes mellitus, katarak, dan penuaan dini. (Supiyati et al 2010). Diperlukan antioksidan eksogen yang dapat mengeliminasi radikal bebas dan menurunkan stres oksidatif. Antioksidan merupakan senyawa yang dapat mencegah reaksi oksidasi dari radikal bebas dengan mendonorkan atom hidrogen (Chang, et al. 2002). Antioksidan berperan dalam menghambat reaksi berantai radikal bebas dan melindungi tubuh dari serangan radikal bebas (Windono et al. 2001).
Perumusan Masalah
Senyawa antioksidan pada KBM yang sangat potensial ini tidak dimanfaatkan dengan baik, terlihat dari kulitnya yang menjadi limbah. Antioksidan KBM bermanfaat untuk meredam radikal bebas pada tubuh. Pemanfaatan KBM sebagai sumber antioksidan memiliki kendala sensori rasa pahit dan getir sehingga tidak memungkinkan untuk dikonsumsi langsung. Oleh karena itu, proses mikroenkapsulasi dapat menjadi solusi terbaik untuk mengatasi masalah yang ada. Proses pembuatan mikroenkapsulat melibatkan penyalutan ekstrak KBM dengan bahan penyalut yang dapat menutupi rasa sepat dan getir KBM sehingga lebih mudah dikonsumsi oleh konsumen. Proses ini juga akan menghasilkan ekstrak KBM dalam bentuk serbuk yang lebih mudah ditangani, mudah diaplikasikan sebagai ingredien tambahan pada berbagai macam produk pangan ataupun sebagai suplemen serta mudah disimpan. Namun hingga saat ini belum diketahui pengaruh proses mikroenkapsulasi terhadap aktivitas antioksidan pada produk yang dihasilkan. Penelitian ini memiliki peran penting bagi masyarakat umum karena dapat menghasilkan produk alternatif berbasis pangan lokal yang kaya akan antioksidan, baik untuk kesehatan, serta mudah untuk disimpan dan didistribusikan
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi efektivitas perlakuan mikroenkapsulasi terhadap ekstrak KBM menggunakan air destilata, serta mengevaluasi efektivitasnya dalam mencegah kerusakan fungsi hati pada hewan percobaan akibat konsumsi minyak sawit teroksidasi.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah mengetahui efektivitas mikroenkapsulat ekstrak air KBM dalam menangkal radikal bebas.
METODE
Bahan
Alat
Alat-alat yang digunakan dalam penelitian ini adalah deep fat fryer, botol, gelas ukur, kain saring, pipet mohr, bulb, vacuum rotary evaporator, termometer, freeze dryer, hot plate, homogenizer, spray dryer, blender, vorteks, sentrifusa, tabung sentrifus, spektrofotometer, mikropipet, penangas air, aluminium foil yang telah dilaminasi, kandang tikus putih, neraca analitik, alat penggerus, alat bedah hewan, mikrotip, tabung reaksi, dan tabung mikrosentrifus.
Prosedur Penelitian
Penelitian terdiri dari beberapa tahap yang diawali dengan penentuan perbandingan pelarut dengan sampel terbaik, penentuan kadar asam lemak bebas dan bilangan peroksida minyak, pembuatan tepung kulit buah manggis, pembuatan ekstrak tepung manggis dengan media air destilata, pembuatan mikroenkapsulat ekstrak tepung kulit buah manggis dan tahap analisis. Analisis yang dilakukan adalah analisis kapasitas antioksidan menggunakan metode DPPH, dan analisis pengaruh antioksidan secara in vivo pada tikus percobaan. Adapun tahapan penelitian secara keseluruhan dapat dilihat pada Gambar 1.
Tahap Pembuatan Ekstrak Tepung KBM (Wijaya 2010)
Pembuatan ekstrak tepung kulit buah manggis cair dilakukan dengan cara mengekstrak tepung KBM menggunakan pelarut air dengan perbandingan tepung KBM:air adalah 1:10 dan 1:20 pada suhu ruang selama 24 jam dalam wadah gelap bertutup. Lalu campuran disaring menggunakan kain saring dilanjutkan dengan filtrasi menggunakan pompa vakum dan kertas saring. Filtrat yang diperoleh dipindahkan dalam wadah gelap bertutup, dibekukan kemudian dikeringkan dengan freeze dryer. Ekstrak KBM yang diperoleh dari kedua perbandingan lalu diukur rendemen, pH, kapasitas antioksidan dan kadar total fenolnya. Selanjutnya ditentukan perbandingan terbaik yang akan digunakan dalam uji in-vivo.
Tahap Pembuatan Mikroenkapsulat Ekstrak Tepung KBM (Wijaya 2010)
Tahap pembuatan mikroenkapsulat ekstrak tepung KBM melibatkan penambahan bahan-bahan penyalut yaitu maltodekstrin (7.7%), gelatin (2.9%), CMC (0.9%) dan air (77%) lalu kemudian dilakukan homogenisasi pada suhu ruang. Lalu ditambahkan ekstrak KBM (10.6%) kemudian dihomogenisasi kembali dan dikeringkan dengan spray dryer pada suhu inlet 140oC dan suhu outlet 80oC
Tahap Analisis Kandungan Antioksidan
Uji Kapasitas Antioksidan dengan Metode DPPH (Rohman dan Riyanto 2005) Analisis dilakukan dengan metode penelitian yang dilakukan oleh Rohman dan Riyanto (2005). Analisis diawali dengan mengambil 100 µL sampel (dengan berbagai konsentrasi). Kemudian ditambah 1,0 mL DPPH 0,4 mM dan etanol sampai 5,0 mL. Vitamin C digunakan sebagai blanko, menggantikan sampel dengan etanol. Semua larutan selanjutnya divorteks dan didiamkan selama 30 menit. Larutan ini selanjutnya diukur absorbansinya pada panjang gelombang 517 nm.
� � � % = [ − ] × %
Selain kapasitas antioksidan, ditentukan pula nilai IC50, konsentrasi sampel yang menghasilkan penghambatan radikal DPPH sebesar 50%.
Uji Kadar Total Fenol dengan Metode Folin (Prangdimurti et al. 2013)
Sebanyak 100 mg sampel kering ditambah 5 mL etanol 95% lalu divorteks selama 3 menit dalam tabung tertutup. Campuran selanjutnya disentrifus pada 4000 rpm selama 5 menit. Supernatan lalu diambil dan dipindahkan ke dalam tabung reaksi bersih dan ditambahkan 0.5 mL etanol 95%, 2.5 mL akuades, dan 2.5 mL reagen Folin Ciocalteau 50%. Campuran didiamkan selama 5 menit lalu ditambahkan 0.5 mL Na2CO3 5% dan divorteks. Selanjutnya campuran disimpan di ruang gelap selama 1 jam dan diukur absorbansinya pada panjang gelombang 725 nm (Prangdimurti et al. 2013).
Tahap Analisis Kualitas Minyak Sawit (Prangdimurti et al. 2013)
Penentuan Bilangan Peroksida
Bilangan peroksida ( � � � ) = V Na S O sampel-blanko x N Na S O xgram contoh
Uji Bilangan Asam
Air yang digunakan pada penentuan bilangan asam adalah air bebas CO2. Sebanyak 5 g contoh dilarutkan dalam 25 mL etanol 96% netral. Selanjutnya ditambahkan sebanyak 2 mL phenolftalein sebagai indikator reaksi. Setelah itu larutan digoyang agar homogen dan dittrasi dengan menggunakan NaOH 0.1 N sambil digoyang hingga muncul warna merah.-muda permanen selama 30 detik. Bilangan asam lalu dihitung dengan rumus:
� � � � � �⁄ = � Na�� Na � �
Desain Percobaan dan Dosis Penggunaan Sampel
Analisis pengaruh mikroenkapsulat secara in vivo menggunakan tikus putih jantan berusia 8 minggu galur Sprague Dawley (SD). Pakan standar yang digunakan sesuai dengan AIN-93G dengan 10% protein, yang ditujukan untuk tikus pada masa pertumbuhan (growth). Formula pakan tikus yang digunakan dapat dilihat pada Tabel 1. Tikus dibagi menjadi 5 kelompok diberi pakan dan air minum standar secara tidak terbatas (ad libitum) selama satu minggu untuk adaptasi. Kemudian tikus dibagi secara acak menjadi 5 kelompok perlakuan. Kelompok kontrol negatif (K(-)) akan dipapar dengan minyak sawit tanpa perlakuan oksidasi, sedangkan kelompok kontrol positif (K+) diberi minyak sawit yang teroksidasi. Kelompok perlakuan satu (KBM1) adalah kelompok yang dipapar dengan minyak sawit teroksidasi dan diberi ekstrak KBM sebesar 100 mg/kg berat badan selama 50 hari. Kelompok perlakuan dua (KBM2) adalah kelompok yang dipapar dengan minyak sawit teroksidasi dan diberi mikroenkapsulat KB M sebesar 100 mg/kg berat badan selama 50 hari. Kelompok perlakuan tiga (KBM3) adalah kelompok yang dipapar dengan minyak sawit teroksidasi dan diberi mikroenkapsulat KBM sebesar 200 mg/kg berat badan selama 50 hari. Setelah masa pemberian pakan, tikus diterminasi, organ hati diambil dan dilakukan analisis kadar MDA.
Tabel 1 Komposisi pakan tikus perobaan untuk 1 kg pakan. (gram) Kasein Minyak
Kedelai
Minyak Sawit tanpa oksidasi
Minyak Sawit
dengan oksidasi Mineral Vitamin CMC Air Maizena Ekstrak Mikro-
Analisis Tingkat Stress Oksidatif pada Hati Tikus (Prangdimurti et al 2013)
mengandung trichloroacetic acid (TCA), thiobarbituric acid (TBA), dan BHT pada suhu ruang. Larutan lalu divortex dan dipanasakan 80oC dengan water bath selama 1 jam. Larutan lalu didinginkan dan sentrifuse 3500 rpm selama 15 menit pada suhu ruang. Langkah terkahir adalah mengukur absorbansi supernatant pada panjang gelombang 532 nm. Kurva standar TEP (Tetraetoksi Propana) diperlukan untuk mengetahui kadar MDA sampel. Pembuatan kurva standar TEP mengikuti di atas dengan mengganti 1 mL sampel dengan 1 mL TEP.
Prosedur Analisis Data
Analisis statistik dilakukan dengan menggunakan program SPSS Seri 17.1 pada p≤0,05. Uji t-test dilakukan untuk melihat perbandingan antara kedua kontrol. Untuk melihat perbedaan antara perlakuan dan kontrol dilakukan analisis sidik ragaman (Analysis of Variance) dengan uji lanjut Dunnet. Sedangkan perbandingan signifikansi antar perlakuan dilihat dengan uji lanjut Duncan.
.
HASIL DAN PEMBAHASAN
PENELITIAN PENDAHULUAN
Penelitian pendahuluan dilakukan pada dua perbandingan tepung KBM:air, yaitu perbandingan 1:10 dan 1:20 yang direndam (maserasi) selama 24 jam. Ekstrak cair lalu dikeringkan menggunakan freeze dryer hingga ekstrak kering. Rangkuman hasil penelitian pendahuluan berupa perbandingan pH, rendemen, kapasitas IC50, dan kadar total fenol dari kedua proses ekstraksi dapat dilihat pada (Tabel 2). Hasil pengamatan menunjukkan bahwa rendemen Ekstrak 1:10 dan Ekstrak 1:20 tidak berbeda nyata secara statistik (p>0.05). Kadar total fenol Ekstrak 1:10 lebih kecil dibandingkan Ekstrak 1:20 dengan perbedaan yang nyata (p<0.05). Ekstrak 1:10 memiliki kapasitas antioksidan yang lebih kuat dibandingkan Ekstrak 1:20, terlihat dari nilai IC50 yang lebih rendah dengan perbedaan yang nyata (p<0.05). Ekstrak 1:10 lebih efektif dibandingkan Ekstrak 1:20 untuk menghilangkan radikal bebas karena dibutuhkan jumlah yang lebih sedikit untuk menurunkan 50% kadar radikal bebas. Atas pertimbangan kesamaan hasil rendemen, efisiensi alat dan bahan, serta kapasitas antioksidan yang lebih kuat, dipillihlah perbandingan 1:10 pada tahap penelitian pengujian secara in-vivo.
Tabel 2 Tabel hasil penelitian pendahuluan
Ekstraksi KBM (Tepung KBM:Air) 1:10 1:20
pH
IC50 Ekstrak (ppm) 44.704a 59.177b
Kadar Total Fenol Ekstrak ( mg GAE/g ekstrak) 10.826a 12.246b
IC50 Mikroenkapsulat (ppm) 102.896 -
Kadar Total Fenol Mikroenkapsulat
(mg GAE/g mikroenakpsulat) 7.495 -
Retensi Senyawa Fenol Mikroekapsulat (%) 69.23
Pengujian kapasitas antioksidan dilakukan mengunakan metode DPPH, reaksi reduksi DPPH (2,2-diphenyl-1-picrylhydrazil atau 1,1-diphenyl-2-picrylhydrazil) oleh senyawa aktif yang terdapat pada substrat/sampel. Kemampuan antioksidan mereduksi radikal bebas dinyatakan dengan nilai IC50. Nilai IC50 menyatakan besarnya konsentrasi antioksidan yang diperlukan untuk menurunkan 50% konsentrasi DPPH (Lannang 2005). Semakin kecil nilai IC50 maka semakin kuat aktivitas antioksidan tersebut. Suatu senyawa dikatakan antioksidan sangat kuat jika nilai IC50 kurang dari 50 ppm, kuat jika IC50 bernilai 50 ppm sampai 100 ppm, sedang jika IC50 bernilai 100 ppm sampai 150 ppm dan lemah jika IC50 bernilai 151 ppm sampai 200 ppm (Supiyanti 2010). Kapasitas antioksidan dari yang terkuat adalah Ekstrak 1:10, Ekstrak 1:20 dan Mikroenkapsulat dengan nilai 44.704 ppm, 59.177 ppm dan 102.896 ppm. Ekstrak 1:10 tergolong dalam antioksidan sangat kuat, Ekstrak 1:20 tergolong kuat dan mikroenkapsulat tergolong sedang. Analisis kandungan total fenol juga dilakukan sebab senyawa fenol memiliki potensi sebagai antioksidan dan kemampuan menetralkan radikal bebas (Tian et al. 2004). Kadar total fenol dari yang tertinggi adalah Ekstrak 1:20. Ekstrak 1:10 dan mikroenkapsulat dengan nilai 12.246, 10.826 dan 7.495 mgGAE/g ekstrak. Retensi senyawa fenol merupakan perbandingan kadar senyawa fenol di ekstrak KBM dengan mikroekapssulat KBM. Retensi senyawa fenol mikroekapsulat KBM cukup baik, yaitu sebesar 69.23%. Retensi senyawa fenol juga menunjukkan proporsi senyawa fenol yang tidak hilang setelah proses pengolahan. Hasil penelitian pendahuluan dapat dilihat pada Tabel 2.
Mikroenkapsulasi adalah proses memasukkan partikel/komponen kecil berbentuk cairan atau gas ke dalam lapisan penyalut atau ke dalam sebuah matriks (Thies 1996). Mikroenkapsulasi dilakukan untuk mencegah degradasi bahan inti akibat kontak dengan faktor eksternal seperti panas, air, oksigen, dan cahaya, meningkatkan umur simpan produk, menutupi rasa, warna dan aroma yang tidak diinginkan serta memudahkan penangan produk (Sobel et al. 2014). Mikroenkapsulasi menghasilkan produk berbentuk padat sehingga lebih mudah dibandingkan dalam bentuk cair serta lebih mudah diproses atau dicampurkan menjadi produk akhir (Sobel et al. 2014). Menurut Vasisht (2014), konsentrasi bahan aktif mempengaruhi ukuran bahan aktif. Konsentrasi bahan aktif rendah memiliki perlidungan yang lebih baik dibandingkan dengan konsentrasi bahan aktif tinggi karena ketebalan matriks penyalut berkurang seiring meningkatnya konsentrasi bahan aktif. Hasil penelitian Vasisht (2014) menunjukkan mikroenkapsulat dengan konsentrasi bahan aktif 10% memiliki kestabilan yang lebih baik dibandingkan konsentrasi 50% dan 90% bahan aktif setelah 60 hari penyimpanan. Konsentrasi ekstrak KBM, sebagai bahan aktif pada mikroenkapsulat KBM sebesar 10.6% persen, menawarkan perlindungan yang baik terhadap faktor eksternal serta kestabilan yang baik.
meningkatkan viskositas dan membantu kestabilan bahan inti (Simanjuntak 2007). Kombinasi ketiga bahan inti tersebut diperlukan untuk menghasilkan mikroenkapsulat KBM yang stabil dan tidak memiliki rasa pahit.
Hasil kapasitas antioksidan dan kadar total fenol menunjukkan adanya penurunan nilai kapasitas antioksidan Mikroenkapsulat dibandingan Ekstrak. Penurunan tersebut disebabkan akibat adanya proses pemanasan pada tahap pengeringan dengan spray dryer. Panas merusak komponen bioaktif ekstrak sehingga menjadi tidak aktif lagi sebagai antioksidan. Selain adanya panas, nilai antioksidan yang lebih rendah disebabkan adanya komponen bioaktif terikat dengan kompleks matriks penyalut. Hal lain yang diduga menyebabkan penurunan nilai IC50 dan kadar total fenol adalah ekstrak KBM telah mengalami purifikasi ekstraksi sedangkan komponen bioaktif pada proses pembuatan mikroenkapsulat sebesar 10.6% dari berat formulasi mikroenkapsulat. Adanya panas, terikat dengan matriks penyalut, dan perbedaan konsentrasi komponen bioaktif yang diduga menyebabkan penurunan aktivitas antioksidan dan kadar total fenol mikroenkapsulat dibandingkan dengan ekstrak KBM. Terdapat perbedaan hasil analisis kapasitas antioksidan dan kadar total fenol hasil penelitian ini dengan literatur penelitian lainnya. Penelitian yang dilakukan oleh Weecharangsan et al. (2006) menggunakan pelarut air memiliki nilai IC50 34.98 ppm, penelitian oleh Permana et al. (2012) ekstrak KBM memiliki kadar fenol sebesar 237.44 mg GAE/g dan kadar fenol mikroenkapsulat KBM sebesar 188.40 mg GAE/g. Adanya perbedaan hasil analisis dapat disebabkan perbedaan prosedur dalam menganalisis dan proses ekstraksi. Perbedaan sumber bahan dan tingkat kematangan buah manggis juga diduga mempengaruhi perbedaan hasil analisis. Penelitian ini menggunakan kulit manggis matang yang dikeringkan dan ditepungkan sehingga telah mengalami proses pemanasan dan penyimpanan dahulu, bukan menggunakan hancuran kulit buah manggis segar. Analisis Kualitas Minyak Sawit
Bilangan asam dan bilangan peroksida merupakan indikator kerusakan dan oksidasi minyak. Bilangan asam merupakan bilangan yang menunjukkan jumlah asam lemak bebas terdapat pada minyak (lemak). Bilangan asam pada minyak merupakan indikator kualitas lemak karena bilangan asam yang tinggi dapat menandakan adanya oksidasi lemak/minyak (Alyas et al. 2006). Bilangan peroksida merupakan bilangan yang menyatakan jumlah peroksida yang terkandung pada minyak, sebagai pertanda awal kerusakan lemak. Peroksida merupakan produk oksidasi lemak yang bersifat radikal dan terbentuk pada awal oksidasi. Reaksi oksidasi pembentukan radikal bebas melalui tiga tahap, yaitu: inisiasi, propagasi, dan terminasi. Pada tahap inisiasi, terjadi pengambilan satu atom hidrogen dari gugus oleofin yang menghasilkan radikal bebas peroksi (peroksida dan hidrogen peroksida). Radikal bebas peroksi akan mengambil molekul hidrogen dari gugus tak jenuh lain menghasilkan peroksida dan radikal bebas yang lain (deMan 1999; Ericson 2002).
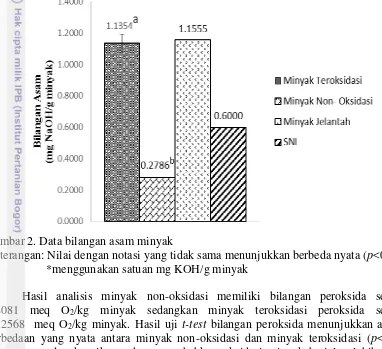
bebas yang lebih mudah teroksidasi dibandingkan dengan bentuk esternya. (Kusnandar 2010). Bilangan asam minyak non-oksidasi masih memenuhi syarat SNI 3471:2013 tentang Minyak Goreng, yaitu sebesar tidak melebihi 0.6 mg KOH/g minyak serta masih lebih rendah dibandingkan bilangan asam minyak jelantah penelitan Rahayu dan Purnavita (2014) sebesar 1.155 mg KOH/g minyak. Sebaliknya, bilangan asam minyak teroksidasi pada penelitian ini telah melebihi SNI 3471:2013 tentang Minyak Goreng dan mendekati bilangan asam minyak jelantah. Berdasarkan nilai bilangan asam dapat diasumsikan bahwa minyak teroksidasi dapat menjadi sumber radikal bebas pada penelitian ini. Data bilangan asam minyak dapat dilihat pada Gambar 2.
Gambar 2. Data bilangan asam minyak
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05). *menggunakan satuan mg KOH/g minyak
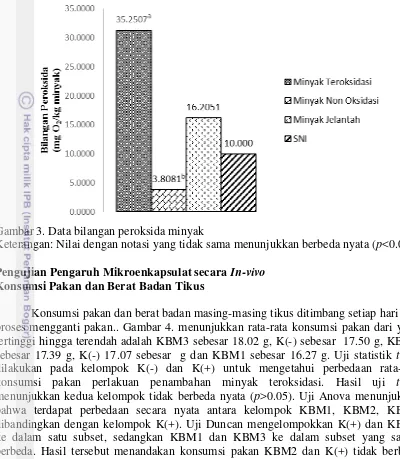
Hasil analisis minyak non-oksidasi memiliki bilangan peroksida sebesar 3.8081 meq O2/kg minyak sedangkan minyak teroksidasi peroksida sebesar 31.2568 meq O2/kg minyak. Hasil uji t-test bilangan peroksida menunjukkan adanya
berdasarkan nilai bilangan peroksida dan bilangan asam yang tinggi serta telah teramati. Data bilangan peroksida minyak dapat dilihat pada Gambar 3.
Gambar 3. Data bilangan peroksida minyak
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05).
Pengujian Pengaruh Mikroenkapsulat secara In-vivo
Konsumsi Pakan dan Berat Badan Tikus
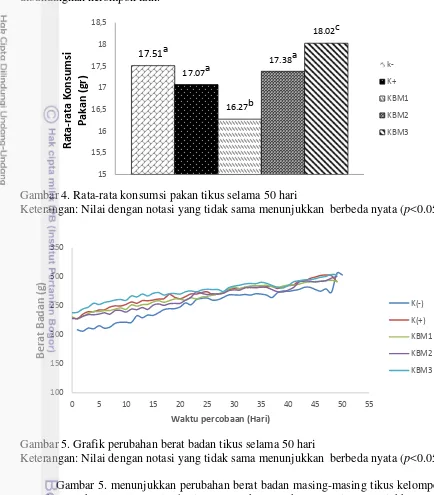
Konsumsi pakan dan berat badan masing-masing tikus ditimbang setiap hari saat proses mengganti pakan.. Gambar 4. menunjukkan rata-rata konsumsi pakan dari yang tertinggi hingga terendah adalah KBM3 sebesar 18.02 g, K(-) sebesar 17.50 g, KBM2 sebesar 17.39 g, K(-) 17.07 sebesar g dan KBM1 sebesar 16.27 g. Uji statistik t-test dilakukan pada kelompok K(-) dan K(+) untuk mengetahui perbedaan rata-rata konsumsi pakan perlakuan penambahan minyak teroksidasi. Hasil uji t-test menunjukkan kedua kelompok tidak berbeda nyata (p>0.05). Uji Anova menunjukkan bahwa terdapat perbedaan secara nyata antara kelompok KBM1, KBM2, KBM3 dibandingkan dengan kelompok K(+). Uji Duncan mengelompokkan K(+) dan KBM2 ke dalam satu subset, sedangkan KBM1 dan KBM3 ke dalam subset yang saling berbeda. Hasil tersebut menandakan konsumsi pakan KBM2 dan K(+) tidak berbeda nyata satu sama lain dan berbeda nyata dengan konsumsi pakan KBM1 dan KBM3.
yang menyebabkan konsumsi pakan kelompok KBM2 dan KBM3 lebih tinggi dibandingkan kelompok lain.
Gambar 4. Rata-rata konsumsi pakan tikus selama 50 hari
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05)
Gambar 5. Grafik perubahan berat badan tikus selama 50 hari
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05) Gambar 5. menunjukkan perubahan berat badan masing-masing tikus kelompok setelah perlakuan selama 50 hari, Semua kelompok teramati menunjukkan tren pertambahan berat badan yang relatif sama. Hasil uji t-test dilakukan pada kelompok K(-) dan K(+) untuk mengetahui pengaruh pemberian minyak pemanasan terhadap pertumbuhan. Hasil uji t-test menyebutkan berat badan kelompok K(-) dan K(+) tidak berbeda nyata (p>0.05). Uji statistik Dunnett yang dilakukan dengan membandingkan kelompok KBM1, KBM2, dan KBM3 menunjukkan tidak ada perbedaan rata-rata berat badan antar perlakuan. Kenaikan konsumsi pakan tidak menaikkan berat badan tikus. Contoh hal ini dapat terlihat pada kelompok KBM3 yang rata-rata konsumsi pakan tertinggi namun tidak memiliki pertambahan berat badan tertinggi. Analisis berat badan tidak dapat secara langsung menjelaskan pengaruh percobaan perlakuan sebab hewan percobaan sendiri bertumbuh, variasi antar subjek cenderung meningkat yang mengarah pada hetrogenitas dan kecepatan pertumbuhan tidak independen.
0,81a
Gambar 7. Berat relatif organ ginjal
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05). Berat Relatif Organ
Pemeliharaan dan pemberian ransum dilakukan selama 50 hari. Pada hari ke-50 terminasi dilakukan pada ke-25 ekor tikus secara berurutan. Proses terminasi diawali dengan menimbang tikus, lalu tikus dibius dengan eter dan diambil sampel darah melalui pembuluh darah arteri. Langkah selanjutnya adalah pengambilan organ dimulai dari hati, ginjal, limfa dan adiposa. Organ yang telah diambil kemudian ditimbang dan difoto sebagai proses dokumentasi. Berat organ ginjal dan limfa kelompok K(-) lebih berat dibandingkan dengan berat ginjal dan limfa kelompok lainnya sedangkan kelompok perlakuan lainnya memiliki berat ginjal dan limfa yang tidak jauh berbeda. Namun hasil Uji statistik t-test yang dilakukan pada kelompok K(-) dan K(+) tidak memberikan perbedaan yang nyata (p>0.05). Hasil uji Anova yang dilakukan pada berat organ ginjal dan limfa kelompok K(+), KBM1, KBM2 dan KBM3 juga menunjukkan tidak terdapat perbedaan nyata (p>0.05). Secara umum tidak terdapat perbedaan yang berarti pada berat organ ginjal dan limfa setiap kelompok perlakuan. Rata-rata berat organ ginjal dan limfa dapat dilihat pada Gambar 6 dan Gambar 7.
Gambar 6. Berat relatif organ limfa
4,49a
Berat organ hati pada setiap perlakuan relatif tidak jauh berbeda. Uji t-test yang dilakukan pada kelompok K(-) dan K(+) menunjukkan tidak terdapat perbedaan secara nyata (p>0.05). Kelompok KBM3 memiliki berat organ paling rendah dibandingkan kelompok K(+), KBM1, dan KBM2. Namun berdasarkan uji Anova yang dilakukan pada kelompok K(+), KBM1, KBM2, dan KBM3 menunjukkan tidak terdapat perbedaan berat yang nyata antar kelompok perlakuan. Rata-rata berat organ hati dapat dilihat pada Gambar 8.
Berat jaringan adiposa kelompok K(+) paling berat dibandingkan kelompok KBM1, KBM2, dan KBM3. Namun berdasarkan uji Anova pada berat jaringan adiposa kelompok K(+), KBM1, KBM2, dan KBM3 tidak terdapat perbedaan berat yang nyata (p>0.05). Berat jaringan adiposa kelompok K(+) juga lebih berat dibandingkan dengan kelompok K(-). Meskipun demikian, berdasarkan uji t-test tidak terdapat perbedaan yang nyata (p<0.05). Rata-rata berat jaringan adiposa setiap kelompok perlakuan dapat dilihat pada Gambar 9.
Gambar 9. Berat relatif jaringan adiposa.
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05) Gambar 8. Berat relatif organ hati.
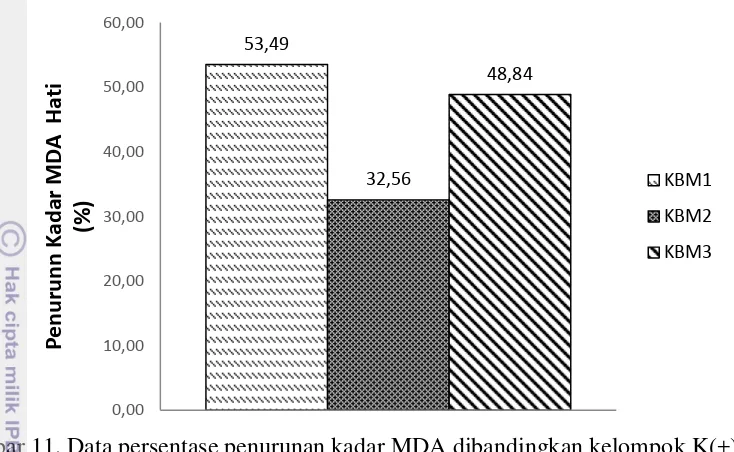
Gambar 10 Kadar MDA pada organ hati tikus
Keterangan: Nilai dengan notasi yang tidak sama menunjukkan berbeda nyata (p<0.05). Kadar MDA Hati Tikus
Peroksidasi lemak merupakan penyebab utama terjadinya stres oksidatif dalam tubuh. Salah satu produk hasil peroksidasi lemak yang bersifat toksik adalah malonandehida (MDA). MDA sendiri menyusun sekitar 15% dari keseluruhan dekomposisi lemak. (Esterbauer et al. 1990, Kappus 1991). MDA bersifat racun terhadap membran sel dan sel-sel tubuh. MDA dapat membentuk ikatan kovalen dengan protein, DNA. Reaksi antara protein, DNA dengan MDA memicu terjadinya mutasi genetik sel yang menyebabkan penyakit kanker (Houglum et al. 1991). MDA telah banyak digunakan sebagai parameter status antioksidan dan tingkat peroksidasi lemak di hati. Ketika terjadi peningkatan kadar MDA menandakan terdapat kenaikan produksi radikal bebas (Kiziltunc dan Cerrahoglu 1998).
Kadar MDA diukur dengan cara membandingkannya dengan standar tetraetoksipropana (TEP) (Konig dan Berg 2002). Pemberian minyak teroksidasi secara nyata meningkatkan kadar MDA hati tikus, terlihat pada kadar MDA kelompok K(+)
sebesar 0.004γ μL/mL yang jauh lebih tinggi dibandingkan kelompok K(-) sebesar
0.0014 μL/mL. Uji t t-test kadar MDA organ hati kelompok K(-) dan K(+) memiliki perbedaan yang nyata (p<0.05). Pemberian ekstrak dan mikroenkapsulat KBM menurunkan kadar MDA pada hati tikus. Kadar MDA hati tikus kelompok KBM1 turun menjadi 0.00β0 μL/mL, KBMβ turun menjadi 0.00β9 μL/mL dan kelompok KBMγ turun menjadi 0.00ββ μL/mL. Uji anova yang dilakukan pada kelompok KBM1, KBM2 dan KBM3 dibandingkan dengan K(+) menunjukkan adanya perbedaan nyata (p<0.05). Minyak teroksidasi mengandung banyak radikal bebas, terutama hidroperoksida. Kadar MDA hati tikus dapat dilihat pada Gambar 10.
Konsumsi minyak sawit teroksidasi menurunkan kadar high density lipoprotein cholestrol (HDL), meningkatkan kadar trigliserida dan low density lipoprotein cholestrol (LDL) (Leong et al. 2009; Nurul-Iman et al. 2013). Hal tersebut menandakan bahwa konsumsi minyak sawit teroksidasi memiliki efek negatif bagi kesehatan. Stres oksidatif pada hati merupakan konsekuensi dari peningkatan konsumsi radikal bebas minyak teroksidasi dan penurunan kapasitas sistem pertahanan antioksidan dalam hepatosit. Meningkatnya kadar radikal bebas yang tidak diimbangi dengan proses degradasinya menciptakan kondisi stres oksidatif. Stres oksidatif
menyebabkan peningkatan modifikasi oksidatif biomolekul, karena itu stres oksidatif memiliki kaitan kuat dengan mekanisme patogenesis beberapa penyakit, seperti aterosklerosis, kanker, diabetes melitus, gagal jantung, hipertensi, penyakit inflamasi, obesitas serta proses penuaan. Stres oksidatif dapat mengubah morfologi mitokondria sehingga menyebabkan disfungsi mitokondria. Perubahan (kerusakan mitokondria) menurunkan produksi adenosine triphosphate (ATP) yang menyebabkan apoptopsis sel dan penurunan bioavaibilitas nitric oxide (NO) (Ren et al. 2010). NO menghasilkan vasodilatasi dan poten antiatherogenik, seperti penghambatan agregasi platelet, pencegahan proliferasi sel, penurunan peroksidasi lemak. (Landmesser dan Harrison 2001).
Bagian tubuh yang banyak dipelajari untuk mengkaji stres oksidatif adalah hati, karena perannya dalam metabolisme produk endogen dan eksogen. Hati sendiri merupakan organ internal terbesar yang dimiliki vertebrata dan memiliki fungsi penting seperti metabolisme lemak dan karbohidrat, sintesis protein dan asam empedu, penyimpanan vitamin A, zat besi dan lemak. Hati berperan penting dalam proses detoksifikasi senyawa racun dan xenobiotik. Perananan hati pada metabolisme senyawa aromatik, obat-obatan, alkohol, hidrokarbon karsinogenik membuat terbentuknya radikal bebas dalam jumlah besar, sehingga menghasilkan enzim antioksidan untuk mengendalikan stres oksidatif (Gomez et al 2012). Oleh karena itu kerusakan sel hati dapat berakibat sangat fatal bagi kelancaran metabolisme tubuh. Peroksidasi lemak terjadi sebagai akibat keberadaan radikal bebas. Peroksidasi lemak melalui tiga tahap, yaitu inisiasi, propagasi dan terminasi. Tahap inisiasi meliputi abstraksi atom hidrogen oleh radikal bebas seperti: hidroksil (-OH), alkoksil (RO-), peroksil (ROO-), dan mungkin HO2-. Fosfolipid yang mengandung asam lemak tidak jenuh pada membran sel/lemak merupakan bagian yang mudah mengalami peroksidasi. Hal ini disebabkan abstraksi dari grup metilen (CH2-), menyisakan satu elektron tidak berpasangan. Ikatan ganda pada asam lemak melemahkan ikatan C-H disekitarnya, dengan demikian memfasilitasi pengambilan H. Molekul lemak radikal (L -) dihasilkan saat –OH bereaksi dengan asam lemak tidak jenuh. Lemak radikal lalu bereaksi dengan molekul oksigen membentuk radikal lemak peroksil (lipid peroxy radical (LOO-)). Keduanya menghasilkan reactive oxygen spesies (ROS) radikal dan mengoksidasi lipoprotein. Oksidasi lipoprotein menstimulasi pembentukan sel busa (foam cell) dan apoptosis sel endotelial, yang kemudian menyebabkan pertumbuhan plak, erosi dan pemecahan. (Hulsman et al. 2011).
Peroksidasi lemak merusak sel hati dan menggangu kerja hati. Kerusakan sel hati oleh serangan radikal bebas menyebabkan menurunnya peroxisome proliferator-activated receptors (PPARs) yang memiliki berperan penting dalam metabolisme lemak
dan homeostasis energi. PPARs terdiri dari PPAR yang berperan dalam penyimpanan
energi (lemak) dengan meningkatkan adipogenesis dan reaksi biokimia insulin sensitization, PPARα dan PPAR /δ berperan dalam pembentukan energi dengan
mengaktivasi reaksi -oksidasi asam lemak dalam mitokondria dan peroxisome.
PPARα banyak terdapat pada hati tikus, menurunnya PPARα akan menyebabkan reaksi
-oksidasi asam lemak terhambat sehingga asam lemak terakumulasi pada hati dan
berujung pada steatosis hingga steatohepatitis. PPAR banyak terdapat di jaringan
53,49
Gambar 11. Data persentase penurunan kadar MDA dibandingkan kelompok K(+) Kadar radikal bebas yang tinggi menyebabkan stres oksidatif yang memiliki efek negatif bagi kesehatan. Untuk mengurangi efek negatif akibat radikal bebas dibutuhkan antioksidan. Antioksidan adalah senyawa yang mampu menghambat proses oksidasi substrat pada konsentrasi rendah (Vaya dan Aviram 2001). Ekstrak dan mikroenkapsulat KBM berperan secara efektif sebagai sumber antioksidan. Antioksidan dalam KBM mampu mendonorkan elektron pada senyawa radikal menjadi senyawa yang tidak berbahaya yang dapat dibuang secara aman. Hal ini juga akan diikuti dengan menurunnya peroksidasi lemak oleh radikal bebas. Terlihat pada Gambar 11. terjadi penurunan kadar MDA hati tikus pada kelompok KBM1, KBM2 dan KBM3 dibandingkan dengan kadar MDA kelompok K(+). Penurunan kadar MDA dari yang tertinggi terjadi pada kelompok KBM1 sebesar 53.49%, KBM3 sebesar 48.84%, dan KBM2 sebesar 32.56%. KBM1 menurunkan kadar MDA paling tinggi diduga karena ekstrak KBM yang diberikan memiliki puritas yang tinggi sebagai hasil ekstraksi, sedangkan pada mikroenkapsulat kadar ekstrak KBM yang diberikan hanya sebesar 10.6% dari formulasi mikroenkapsulat. Kandungan ekstrak KBM pada KBM1 dengan KBM2 dan KBM3 tidak sama. Kandungan ekstrak pada KBM2 dan KBM3 lebih rendah dibandingkan KBM1 disebabkan adanya bahan penyalut pda . KBM1 mengandung seluruhnya ekstrak (100% ekstrak KBM), sedangkan untuk KBM2 hanya mengandung sekitar 10 gram ekstrak KBM dan pada KBM3 mengandung sekitar 20 gram ekstrak KBM. Walaupun memiliki kadar ekstrak KBM yang lebih rendah, KBM3 yang diberikan 200 mg mikroenkapsulat/ kg BB tikus mampu menurunkan kadar MDA mendekati penurunan KBM1 yang diberikan 100 mg ekstrak/kg BB tikus. Mikroekapsulasi memberikan lapisan penyalut yang melindungi komponen bioaktif KBM dari proses pencernaan. Degradasi komponen bioaktif oleh enzim pencernaan dan pH di saluran pencernaan diminimalisir oleh lapisan penyalut yang berfungsi sebagai pelindung sehingga komponen bioaktif dapat diserap lebih banyak oleh tubuh.
SIMPULAN DAN SARAN
Simpulan
Ekstrak air KBM tergolong antioksidan kuat sedangkan mikroenkapsulat KBM tergolong antioksidan sedang dengan nilai IC50 sebesar 44.704 ppm dan 102.896 ppm. Kadar total fenol ekstrak KBM dan mikroenkapsulat KBM sebesar 10.826 mg GAE/g ekstrak dan 7.495 mg GAE/g mikroenkapsulat. Terjadi penurunan kapasitas antioksidan dan kadar total fenol mikroenkapsulat yang diduga disebabkan perbedaan konsentrasi ekstrak KBM dan proses pemanasan saat membuat mikroekapsulat. Aplikasi teknologi mikroenkapsulasi mampu menutupi rasa pahit KBM dan meningkatkan konsumsi pakan tikus. Tidak teramati adanya perbedaan berat badan dan berat organ ginjal, hati, limfa, dan jaringan adiposa akibat pemberian mikroenkapsulat KBM. Penurunan kadar MDA hati KBM1 sebesar 53.49%, KBM2 sebesar 32.56%, dan KBM3 sebesar 48.84%. Pemberian mikroenkapsulat ekstrak KBM mampu menurunkan kadar MDA secara nyata pada hati tikus.
Saran
DAFTAR PUSTAKA
[SNI] Standar Nasional Indonesia. 2013. Minyak goreng. Badan Standarisasi Nasional: Jl. Jend Gatot Subroto Senayan, Jakarta, Indonesia.
[WHO] World Health Organization. 2013. Global Action Plan for The Prevention and Control of Noncommunicable Diseases 2013-2020. Geneva: WHO Press.
Alyas SA., Abdullah A, Idris NA. β006. Change of -Caretene Content During Heating of Red Palm Olein. J of Oil Research 409: 99-120.
Barroso I, Gurnell M, Crowley VE, Agostini M, Schwabe JW, Soos MA, Maslen GL, Williams TD, Lewis H, Schafer AJ, Chatterjee VK, O’Rahilly S. 1999. Dominant negative Transcriptional Control of Adipogenesis and Fat Cell Gene Expression mutations in human PPAR gamma associated with severe insulin resistance, diabetes mellitus and hypertension. J Nature 402:880–883.
Chang L, Yen W, Huang SC, Duh P.2002. Antioxidant activity of sesamecoat. J Food Chemistry 78: 347-354.
deMan, M.J. 1999. Principles of Food Chemistry 3rd Edition. Gaithersburg (US): Aspen Publicer Inc.
Ericson MC. 2002. Lipid Oxidation of Muscle Foods. Dalam Akoh CC dan Min BD. 2002. Food Lipid: Chemistry, Nutrition, and Biotechnology 2nd Edition. New York(US): Marcel Dekker Inc. Hal 21-32.
Esterbauer H, Dieber-Rotheneder M, Waeg G, Striegl G, Jurgens G. 1990. Biochemical, structural, and functional properties of oxidized low-density lipoprotein. Chem Res Toxicol 3:77–92.
Gharsallaoui A, Roudaut G, Chambin O, Voilley A, Saurel R. 2007. Application of spray drying in microencapsulation of food ingredients: An overview. Food Research International 40:1107-1121
Gomez IG, Tang J, Wilson CL, Yan W, Heinecke JW, Harlan JM, Raines EW. 2012. Metalloproteinase-mediated Shedding of Integrin beta2 promotes macrophage efflux from inflammatory sites. J Biol Chem 287:4581–4589.
Houglum K, Filip M, Witztum JL, Chojkier M.1991. Malondialdehyde and 4-hydroxynonenal protein adducts in plasma and liver of rats with iron overload. J Clin Invest 86:50-59.
Hulsmans M. De Keyzer D. Holvoet P. 2011. MicroRNAs regulating oxidative stres and inflammationin relation to obesity and atherosclerosis. FASEB J 8:2515-2527. Kappus H. 1991. Lipid peroxidation: mechanism and biological relevance. Dalam
Aruoma OI dan Halliwell B. 1992. Free Radicals and Food Additives. London:Taylor & Francis. Hal 59-75.
Keraten. S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta:UI Press. Kiziltunc A dan Cerrahoglu L. 1998. Carnitine and antioksidant level in patients Alt
rematoid arthritis. Scand J Rheumatol 27: 441-445.
Konig D dan Berg A. 2002. Exercise and Oxidative Stress: is there a need for additional antioxidant. J Fur Sportmedizin 3: 6-15.
Korte G, Dreiseitel A, Schreier P, Oehme A, Locher S, Hajak G, Sand PG. 2009. An examination of anthocyanins and anthocyanidins affinity for aannabinoid receptors. J of Medicinal Food 12(6):1407–1410.
Kusnandar F. 2010. Kimia Pangan Komponen Makro. Jakarta(ID): Dian Rakyat
Lannang AM, Komguem J, Ngninzeko FN, Tangmouo JG, Lontsi D, Ajaz A, Choudhary MI, Ranjit R, Devkota KP, Sodengam BL 2005. Bangang xantone A and B, two xantones from the stembark of Garcinia polyantha. Phytochemisry 66:2351-2363
Leong XF, Najib NM, Das S, Mustafa MR, dan Jaarin K. 2009. Intake of repeatedly heated palm oil cause elevation blood pressure with impaired vasorelaxationin rats. Tohoku J Exp Med 219:71-78.
Maliana Y, Khotimah S, Farah D. 2013. Aktivitas antibakteri kulit Garcinia mangostana Linn. terhadap pertumbuhan Flavobacterium dan Enterobacter dari Coptotermes curvignathus Holmgren. J Protobiont 2(1):7-11.
Ngawhirunpat T, Praneet O, Monrudee S, Chavalit S, Atsushi K, Isao A. 2010. Antioxidant, free radical-scavenging activity and cytotoxicity of different solvent extracts and their phenolic constituents from the fruit hull of mangosteen (Garcinia mangostana). Informa Healthcare 48(1):55-62.
Nurul-Iman BS, Kamisah Y, Jaarin K, Qodriyah HMS. 2013. Virgin coconut oil prevents blood pressure elevation and improves endothelial functions in ras fed with repeatedly heated palm oil. Evidence-Based Complementary and Alternative Medicine 13:15-21.
Orozco FG. dan Faila ML. 2013. Biological activities and bioavailability of mangosteen xanthones: a critical review of the current evidence. Nutrients 5:3163-3183.
Papadakis SE, Gardeli C, Tzia C. 2006. Spray drying of raisin juice concentrate. Drying Technology 24: 173-180.
Permana AW, Siti MW, Sulusi PDA. 2012. Sifat antioksidan bubuk kulit buah manggis (Garcinia Mangostana L.) instan dan aplikasinya untuk minuman fungsional berkarbonasi. J, Pasca Panen 9:88–95.
Prangdimurti E, Zakaria FR, Palupi NS, Koswara S, Hartoyo A. 2013. Penuntun Praktikum Evaluasi Biologis Komponen Pangan. Departemen Ilmu dan Teknologi Pangan. Fakultas Teknologi Pertanian. Institut Pertanian Bogor
Rahayu LH dan Purnavita S. 2014. Regenerasi minyak jelantah secara adsorbsi menggunakan ampas pati aren dan bentonit pada berbagai variasi absorben. Prosiding Seminar Nasional Hasil Penelitian dan Pengabdian Universitas Muhammadiah Semarang, Semarang. 2014.
Rao MS dan Reddy J. 2004. PPARα in the patogenesis of fatty liver disease. Hepatology. 40:783-786.
Ren J, Pulakat L, Whaley-Connell A, Dan S. 2010. Mitochondrial biogenesis in The metabolic syndrome and cardiovascular disease. J Mol Med 88:993-1001.
Robards K. 1998. Phenolic compounds in olives. Analyst. 123.31R-44R
Rohma A dan Riyanto S. 2005. Aktivitas antioksidan ekstrak buah mengkudu (Morinda citrifolia). Agritech. 25:3-12
Simanjuntak M. 2007. Optimasi formula mikroenkapsulat minyak sawit merah menggunakan maltodekstrin, gelatin dan carboxymethyl cellulose dengan proses thin layer drying. Skripsi. Departemen Ilmu dan Teknologi Pangan. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Souza SM, Aquino LC, Milach JA, Bandeira MA, Nobre ME, Viana GS. 2006. Anti-inflammatory and antiulcer properties of tannins from Myracrodruon urundeuva Allemão in rodents. Phytotherapy Research 21:220–225.
Supiyanti W, Wulansari ED, Lia K. 2010. Uji aktifitas antioksidan dan penentuan antosianin total kulit buah manggis (Garcinia mangostana L.). Maj Obat Tradisional 15:64-70.
Thies C. 1996. A survey of microencapsulation processes. Dalam Microencapsulation and industrial applications. New York:Maecel Dekker Imp. Hal 34-56.
Tian S, Nakamura K, Kayahara H. 2004. Analysis of phenolic compounds in white rice, brown rice, and germinated brown rice. J Agric Food Chem. 52. 4808-4813.
Vasisht N. 2014. Factors and mechanisms in microencapsulation. Dalam: Anilkum G, Gaonkar N, Vasisht A, Ramesh K, Robert S, editor. Microencapsulation in the food industry. Hal 15-24.
Vaya J dan Aviram. 2001. Nutritional antioxidants: mechanism of action, analyses of activities and medical applications. Curr. Med. Chem.-Imm.. Endoc. & Metab. Agents 1:99-117.
Weecharangsan W, Opanasopit P, Sukma M, Ngawhirunpat T, Sotanaphun U, Siripong P. 2006. Antioxidative and neuroprotective activities of extracts fromthe fruit hull of mangosteen (Garcinia mangostana Linn.). J Med. Princ. Pract 15:281–287
Weyant MJ, Carothers AM, Dannenberg AJ, Bertagnolli MM . 2001. (+)-Catechin inhibits intestinal tumor formation and suppresses focal adhesion kinase activation in the min/+ mouse. Cancer Res 6 (1):118–25.
Wijaya, LA. 2010. Kandungan antioksidan ekstrak tepung kulit buah manggis (Garcinia mangistana L.) pada berbegai pelarut, suhu, dan waktu ekstraksi. Skripsi. Departemen Ilmu dan Teknologi Pangan. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Widayanti SM, Permana, AW, Kusumaningrum, HD. 2010. Kadar dan kapasitas antioksidan ekstrak tepung kulit buah manggis (Garcinia mangostana L.) pada berbagai pelarut dengan metode maserasi. J. Pascapanen 6(2):60-68
Williams P, Ongsakul M, Proudfoot J, Croft K, Beilin L. 1995. Mangostin inhibits the oxidative modification of human low density lipoprotein. Free Radical Research. 23(2):175-184.
Winarno FG. 2002. Kimia Pangan dan Gizi. Jakarta(ID): Penerbit Gramedia.
Windono T, Soediman Y, Ermawati S,Erowati. 2001. Uji perendam radikal bebas terhadap 1,1 -diphenyl 1 -2-picrylhidrazyl (DPPH) dari ekstrak kulit buah dan biji anggur (Vitis vinifera L.) probolinggo biru dan bali. Artocarpus Surabaya. 1(1): 34-4. Wu, Defeng dan Cederbaum, Arthur. 2003.alcohol, oxidative stress, ana free radical
damage. J of Alcohol Research & Health. 27:277-288.
LAMPIRAN
Lampiran 1. Foto organ hati
Perlakuan Gambar Organ Hati
K (-)
K (+)
KBM1
KBM2
Lampiran 2. Uji t-test pH ekstrak
Group Statistics
perlakuan N Mean Std.
Deviation
Std. Error
Mean
pH
Ekstrak
1:10 6 4.6467 .05785 .02362
Ekstrak
1:20 6 4.6333 .03141 .01282
Independent Samples Test
Levene's Test for
Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
(2-tailed)
Mean
Differenc
e
Std. Error
Differenc
e
95% Confidence
Interval of the
Difference
Lower Upper
pH
Equal variances
assumed 2.163 .172 .496 10 .631 .01333 .02687 -.04655 .07321
Equal variances
Lampiran 3. Uji t-test rendemen ekstrak
Group Statistics
perlakuan N Mean Std.
Deviation
Std. Error
Mean
Rendeme
n
Ekstrak
1:10 3 3.1000 .07810 .04509
Ekstrak
1:20 3 3.0200 .01000 .00577
Independent Samples Test
Levene's Test for
Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
(2-tailed)
Mean
Differenc
e
Std. Error
Difference
95% Confidence
Interval of the
Difference
Lower Upper
Rende
men
Equal
variances
assumed
11.636 .057 1.7
60 4 .153 .08000 .04546 -.04622 .20622
Equal
variances not
assumed
1.7
60 2.0
Lampiran 4. Uji t-test total kadar fenol
Group Statistics
perlakuan N Mean Std. Deviation Std. Error
Mean
fenol Ekstrak 1:10 2 10.82625 .298753 .211250
Ekstrak 1:20 2 12.24580 .130815 .092500
Independent Samples Test
Levene's Test for Equality of
Variances
t-test for Equality of Means
Lampiran 5 Analisis keragaman (ANOVA) kadar total fenol
Tests of Between-Subjects Effects
Dependent Variable: fenol
Source Type III Sum of
Squares
df Mean Square F Sig.
Corrected Model 23.788a 2 11.894 212.883 .001
Intercept 622.896 1 622.896 11148.657 .000
perlakuan 23.788 2 11.894 212.883 .001
Error .168 3 .056
Total 646.852 6
Corrected Total 23.956 5
a. R Squared = .993 (Adjusted R Squared = .988)
fenol
perlakuan N Subset
1 2 3
Duncana,b
Mikroenkapsulat 2 7.49500
Ekstrak 1:10 2 10.82625
Ekstrak 1:20 2 12.24580
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = .056.
Multiple Comparisons
Dependent Variable: fenol
(I) perlakuan (J) perlakuan Mean
Differenc
Ekstrak 1:10 -3.33125* .27432
0
Ekstrak 1:20 -4.75080* .19794
3
Ekstrak 1:20 Ekstrak 1:10 1.41955* .23637
2
The error term is Mean Square(Error) = .056.
*. The mean difference is significant at the 0.05 level.
Lampiran 6 Uji t-test kapasitas antioksidan
Levene's Test for Equality of
Variances
t-test for Equality of Means
Lampiran 7 Analisis keragaman (ANOVA) kapasitas antioksidan (IC50)
Tests of Between-Subjects Effects
Dependent Variable: ic50
Source Type III Sum of Squares df Mean Square F Sig.
Corrected Model 3553.561a 2 1776.780 123.481 .001
Intercept 28309.347 1 28309.347 1967.421 .000
perlakuan 3553.561 2 1776.780 123.481 .001
Error 43.167 3 14.389
Total 31906.075 6
Corrected Total 3596.728 5
a. R Squared = .988 (Adjusted R Squared = .980)
Multiple Comparisons
Dependent Variable: ic50
(I) perlakuan (J) perlakuan Mean
Difference
Ekstrak 1:20 -14.46900 3.396276.239 -84.11920 55.18120
Mikroenkapsulat -57.31600 3.180974.057
-122.27501 7.64301
Ekstrak 1:20
Ekstrak 1:10 14.46900 3.396276.239 -55.18120 84.11920
Mikroenkapsulat
-42.84700* 4.638307.024 -72.39874 -13.29526
MikroenkapsulatEkstrak 1:10 57.31600 3.180974.057 -7.64301 122.27501 Ekstrak 1:20 42.84700* 4.638307.024 13.29526 72.39874
Dunnett
t
(2-sided)b
Ekstrak 1:20 Ekstrak 1:10 14.46900 3.793292.052 -.19780 29.13580
MikroenkapsulatEkstrak 1:10 57.31600* 3.793292.001 42.64920 71.98280
Based on observed means.
The error term is Mean Square(Error) = 14.389.
*. The mean difference is significant at the 0.05 level.
Homogeneous Subsets
ic50
perlakuan N Subset
1 2 3
Duncana,b
Ekstrak 1:10 2 44.76100
Ekstrak 1:20 2 59.23000
Mikroenkapsulat 2 102.07700
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 14.389.
a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 8 Uji t-test kadar asam lemak bebas minyak Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
kadar_asam tanpa oksdasi 2 .1700 .01414 .01000
dengan oksidasi 2 .7900 .00000 .00000
Independent Samples Test
Levene's Test
for Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
(2-tailed)
Mean
Difference
Std. Error
Difference
95%
Confidence
Interval of the
Difference
Lower Upper
kadar_asam Equal
variances
assumed
. .
-62.000 2 .000 -.62000 .01000
-.66303
-.57697
Equal
variances not
assumed
-62.000 1.000 .010 -.62000 .01000
-.74706
Lampiran 9 Uji t-test peroksida minyak
Levene's Test for Equality
of Variances
t-test for Equality of Means
Lampiran 10 Uji t-test berat badan tikus
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
bb50hr
k+ 50 269,0850 19,43045 2,74788
K(-) 50 252,8460 25,91816 3,66538
Independent Samples Test
Levene's
Test for
Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
(2-tailed)
Mean
Difference
Std. Error
Difference
95% Confidence
Interval of the
Difference
Lower Upper
bb50hr Equal
variances
assumed
6,879 ,010 3,545 98 ,001 16,23900 4,58103 7,14809 25,32991
Equal
variances
not
assumed
Lampiran 11 Analisis keragaman (ANOVA) berat badan tikus
Tests of Between-Subjects Effects
Dependent Variable: bb_50hr_kmiuns
Source Type III Sum of
Squares
df Mean Square F Sig.
Corrected Model 3570.420a 3 1190.140 3.224 .024
Intercept 14423820.500 1 14423820.500 39069.994 .000
perlakuan2 3570.420 3 1190.140 3.224 .024
Error 72359.080 196 369.179
Total 14499750.000 200
Corrected Total 75929.500 199
a. R Squared = .047 (Adjusted R Squared = .032)
Berat Badan Tikus
perlakuan2 N Subset
1 2
Duncana,b
kbm2 50 263.80
kbm1 50 266.14
k+ 50 269.18 269.18
kbm3 50 275.08
Sig. .189 .126
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 369.179.
a. Uses Harmonic Mean Sample Size = 50.000.
Multiple Comparisons
Dependent Variable: bb_50hr_kmiuns
(I)
perlakuan2 (J)
perlakuan2
Mean
Difference (I-J) Std.
Error
Sig. 95% Confidence
Interval
Lower
Bound
Upper
Bound
Dunnett T3
k+
kbm1 3.04 3.910.967 -7.45 13.53
kbm2 5.38 4.054.706 -5.50 16.26
kbm3 -5.90 3.594.476 -15.55 3.75
kbm1
k+ -3.04 3.910.967 -13.53 7.45
kbm2 2.34 4.077.993 -8.60 13.28
kbm3 -8.94 3.620.088 -18.66 .78
kbm2
k+ -5.38 4.054.706 -16.26 5.50
kbm1 -2.34 4.077.993 -13.28 8.60
kbm3 -11.28* 3.774.021 -21.42 -1.14
kbm3
k+ 5.90 3.594.476 -3.75 15.55
kbm1 8.94 3.620.088 -.78 18.66
kbm2 11.28* 3.774.021 1.14 21.42
Dunnett t
(2-sided)b
kbm1 k+ -3.04 3.843.768 -12.14 6.06
kbm2 k+ -5.38 3.843.363 -14.48 3.72
kbm3 k+ 5.90 3.843.291 -3.20 15.00
Based on observed means.
The error term is Mean Square(Error) = 369.179.
*. The mean difference is significant at the .05 level.
Lampiran 12 Uji t-test konsumsi pakan tikus
Group Statistics
Perlakuan N Mean Std. Deviation Std. Error Mean
Pakan50hr k+ 50 17.0700 1.83989 .26020
k- 50 17.5076 2.45488 .34717
Independent Samples Test
Levene's
Test for
Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
(2-tailed)
Mean
Difference
Std. Error
Difference
95%
Confidence
Interval of the
Difference
Lower Upper
Pakan50hr Equal
variances
assumed
1.764 .187
-1.009 98 .316 -.43760 .43386
-1.29858 .42338
Equal
variances
not
assumed
-1.009 90.845 .316 -.43760 .43386
Lampiran 13 Analisis keragaman (ANOVA) konsumsi pakan tikus
Tests of Between-Subjects Effects
Dependent Variable: pakan_kmin
Source Type III Sum of
Squares
df Mean Square F Sig.
Corrected Model 79.220a 3 26.407 10.332 .000
Intercept 59077.219 1 59077.219 23114.079 .000
perlakuan2 79.220 3 26.407 10.332 .000
Error 500.956 196 2.556
Total 59657.395 200
Corrected Total 580.176 199
a. R Squared = .137 (Adjusted R Squared = .123)
Konsumsi Pakan Tikus
perlakuan2 N Subset
1 2 3
Duncana,b
kbm1 50 16.2744
k+ 50 17.0700
kbm2 50 17.3784
kbm3 50 18.0244
Sig. 1.000 .336 1.000
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 2.556.
a. Uses Harmonic Mean Sample Size = 50.000.
38
kbm1 .7956 .34256 .125 -.1238 1.7150
kbm2 -.3084 .36304 .950 -1.2823 .6655
kbm3 -.9544* .30121 .013 -1.7663 -.1425
kbm1
k+ -.7956 .34256 .125 -1.7150 .1238
kbm2 -1.1040* .33726 .009 -2.0090 -.1990
kbm3 -1.7500* .26957 .000 -2.4751 -1.0249
kbm2
k+ .3084 .36304 .950 -.6655 1.2823
kbm1 1.1040* .33726 .009 .1990 2.0090
kbm3 -.6460 .29517 .172 -1.4413 .1493
kbm3
k+ .9544* .30121 .013 .1425 1.7663
kbm1 1.7500* .26957 .000 1.0249 2.4751
kbm2 .6460 .29517 .172 -.1493 1.4413
Dunnett t
(2-sided)b
kbm1 k+ -.7956* .31974 .037 -1.5525 -.0387
kbm2 k+ .3084 .31974 .650 -.4485 1.0653
kbm3 k+ .9544* .31974 .009 .1975 1.7113
Based on observed means.
The error term is Mean Square(Error) = 2.556.
*. The mean difference is significant at the .05 level.
b. Dunnett t-tests treat one group as a control, and compare all other groups against it.
Lampiran 14 Uji t-test organ tikus
Group Statistics
perlakuan N Mean Std. Deviation Std. Error Mean
hati k+ 4 .0399 .00174 .00078
k- 5 .0501 .01074 .00480
Ginjal k+ 4 .7080 .07662 .03426
k- 5 .8120 .21615 .09666
Adiposa k+ 4 1.8680 .66582 .29777
k- 5 1.7540 1.52756 .68314
Limfa k+ 4 .3380 .06058 .02709
k- 5 .5420 .19357 .08657
Levene's
Test for
Equality of
Variances
t-test for Equality of Means
F Sig. t df Sig.
2.080 8 .071 -.01012 .00487 -.02134 .00110
Equal
variances
not
assumed
-2.0804.211 .103 -.01012 .00487 -.02337 .00313
ginjal
Equal
variances
assumed
5.103 .054
-1.014 8 .340 -.10400 .10256 -.34050 .13250
Equal
variances
not
assumed
-1.0144.990 .357 -.10400 .10256 -.36780 .15980
adiposa Equal
variances
assumed
1.667 .233 .153 8 .882 .11400 .74522
-1.60448 1.83248
Equal
variances
not
assumed
.153 5.467 .884 .11400 .74522
-1.75346 1.98146
2.249 8 .055 -.20400 .09071 -.41317 .00517
Equal
variances
not
assumed
Lampiran 15 Analisis keragaman (ANOVA) hati relatif tikus
Tests of Between-Subjects Effects
Dependent Variable: hati
Source Type III Sum of
Squares
df Mean
Square
F Sig. Partial Eta
Squared
Corrected
Model 1.095E-005
a 3 3.650E-006 .179 .909 .032
Intercept .031 1 .031 1536.858 .000 .990
perlakuan 1.095E-005 3 3.650E-006 .179 .909 .032
Error .000 16 2.041E-005
Total .032 20
Corrected
Total .000 19
a. R Squared = .032 (Adjusted R Squared = -.149)
hati
perlakuan N Subset
1
Duncana,b
kbm3 5 .0383
kbm1 5 .0399
k+ 4 .0399
kbm2 5 .0402
Sig. .554
Means for groups in homogeneous
subsets are displayed.
Based on observed means.
The error term is Mean Square(Error)
= 2.041E-005.
a. Uses Harmonic Mean Sample Size =
5.000.