ISOLASI DAN UJI GENOTOKSISITAS INHIBITOR
TOPOISOMERASE I DARI DAUN Ipomoea pes-caprae
AGUS WIJATMOKO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi dan Uji Genotoksisitas Inhibitor Topoisomerase I dari Daun Ipomoea pes-caprae adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2008
ABSTRACT
AGUS WIJATMOKO. Isolation and Genotoxicity Test of Topoisomerase I Inhibitor from leaves of Ipomoea pes-caprae. Supervised by LINAWATI HARDJITO and PURWANTININGSIH SUGITA.
DNA topoisomerase enzyme is a nuclear essential enzyme that organized DNA replication inside a cell. There is a huge amount of this topoisomerase enzyme inside the cancer cell than any other healthy cells. It makes topoisomerase inhibitor one of the target for anticancer discovery. This paper reported bioactive compounds from leaves of Ipomoea pes-caprae that can inhibit the activity of topoisomerase I enzyme, genotoxicity test from selected extract (chloroform), and determined compound classification of active extract. Dried samples of I. pes-caprae was collected from Pari island.
This research was started by extracting dried leaves using various organic solvents, that were hexane, chloroform, ethyl acetate, acetone, and methanol. The extracts were tested phytochemically and assayed as topoisomerase I inhibitor by topoisomerase I Drugs screening kit from TopoGen. The selected extract then was tested its genotoxicity. The selected active extract was fractionated by TLC (thin layer chromatography) and column chromatography. Furthermore the selected fraction was identified by GCMS (gas chromatography mass spectrometry).
AGUS WIJATMOKO. Isolasi dan Uji Genotoksisitas Inhibitor Topoisomerase I dari Daun Ipomoea pes-caprae. Dibimbing oleh LINAWATI HARDJITO dan PURWANTININGSIH SUGITA.
Enzim DNA topoisomerase merupakan enzim nuclear essensial yang mengatur replikasi DNA di dalam sel. Enzim topoisomerase ditemukan dalam kelimpahan yang sangat tinggi pada sel kanker dibandingkan sel sehat/normal sehingga inhibitor topoisomerase menjadi salah satu target penemuan antikanker. Tesis ini melaporkan senyawa bioaktif dari Ipomoea pes-caprae yang dapat menghambat kerja dari enzim topoisomerase I, uji genotoksisitas dari ekstrak terpilih (kloroform) dan menentukan golongan senyawa dari ekstrak aktif. Sampel daun I. pes-caprae berasal dari kepulauan seribu (pulau Pari).
Penelitian dimulai dengan proses ekstraksi daun kering menggunakan pelarut organik, yaitu heksana, kloroform, etil asetat, aseton dan metanol. Kemudian ekstrak yang didapat diuji fitokimia dan aktivitas inhibitor topoisomerase I dengan Topoisomerase I Drug Screening Kit dari TopoGen. Ekstrak terpilih diuji genotoksisitas. Ekstrak terpilih dipisahkan dengan KLT (kromatografi lapis tipis) dan kromatografi kolom. Kemudian fraksi terpilih di identifikasi dengan GCMS (gas kromatografi spektrometri massa).
ISOLASI DAN UJI GENOTOKSISITAS INHIBITOR
TOPOISOMERASE I DARI DAUN Ipomoea pes-caprae
AGUS WIJATMOKO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
©
Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan, karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b Pengutipan tidak merugikan kepentingan yang wajar IPB.
Judul Tesis : Isolasi dan Uji Genotoksisitas Inhibitor Topoisomerase I dari Daun Ipomoea pes-caprae.
Nama : Agus Wijatmoko NIM : C351050051
Menyetujui :
Komisi Pembimbing
Dr. Ir. Linawati Hardjito, M.Sc. Dr. Dra. Purwantiningsih Sugita, MS. Ketua Anggota
Diketahui :
Ketua Program Studi Teknologi Dekan Sekolah Pascasarjana Hasil Perairan
Dr. Ir. Sri Purwaningsih, M.Si. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya akhirnya tesis ini dapat diselesaikan. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Departemen Teknologi Hasil Perairan. Judul tesis ini adalah ”Isolasi dan Uji Genotoksisitas Inhibitor Topoisomerase I dari Daun Ipomoea pes-caprae”
Dalam kesempatan ini penulis mengucapkan tarima kasih yang
sebesar-besarnya kepada :
1. Dr. Ir. Linawati Hardjito M.Sc. selaku ketua komisi pembimbing dan Dr. Dra. Purwantiningsih Sugita MS. selaku anggota komisi pembimbing yang telah membimbing dan memberikan saran serta kritikan selama penyusunan tesis ini.
2. Prof. Dr. Ir. Suminar S. Achmadi selaku dewan penguji yang telah memberikan saran serta kritikan selama penyusunan tesis ini.
3. Tak lupa juga penulis mengucapkan banyak terimakasih kepada Hibah Penelitian Tim Pascasarjana–HPTP (Hibah Pasca) 2006-2007 atas nama Dr. Ir. Linawati Hardjito M.Sc. dengan judul ”Screening, isolasi dan
identifikasi inhibitor topoisomerase untuk target penemuan anti kanker dari organisme pesisir/laut yang telah digunakan sebagai obat tradisional” yang telah mendanai penelitian ini.
4. Lulut Dwi Sulistyaningsih, S.Si. yang telah membantu uji topoisomerase I.
5. Bapak, Ibu, Mas Iwan, Adik Ida, Adik Uli tersayang yang selalu memberikan doa, dukungan materi serta kasih sayang yang tiada henti-hentinya.
6. Adik Naraini Putri Kurata Ayuni S.Pi yang selalu mendampingi dengan penuh kesabaran dan kasih sayang selama kuliah.
7. Bapak, mama dan seluruh keluarga besar H. M. Nasor MM.
8. Keluarga besar Agus Fitrianto S.Pi, Bonita, Rajaswa dan Latisha, Mama Neneng dan Ibu Siti yang telah menjalin persaudaraan dengan indah.
10.Adik-adik angkatan 39, 40, 41 Departemen Teknologi Hasil Perikanan S1 atas kebersamaannya selama ini.
11. Semua pihak yang telah memberikan bantuan dan motivasi kepada penulis.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan tesis ini. Oleh karena itu saran dan kritik untuk perbaikan dan penyempurnaan tesis ini sangat diharapkan. Semoga tulisan ini bermanfaat bagi mereka yang memerlukannya.
Bogor, Januari 2008
Penulis dilahirkan di Sumenep pada tanggal 7 Agustus 1981 dari ayah bernama H. Salehodin dan ibu Hj. Mujiatun. Penulis merupakan anak ke dua dari empat bersaudara. Tahun 1999 penulis lulus SMA Negeri 1 Kalianget dan pada tahun yang sama penulis masuk IPB melalui jalur
seleksi masuk IPB (PMDK). Pada tahun 2004 penulis menyelesaikan pendidikan sarjana dengan gelar sarjana perikanan (S.Pi) jurusan Teknologi Hasil Perikanan, fakultas Perikanan dan Ilmu kelautan.
Tahun 2005 penulis melanjutkan kuliah di Sekolah Pascasarjana IPB
dengan program studi Teknologi Hasil Perairan spesialisasi bioteknologi hasil perairan. Selama mengikuti perkuliahan, penulis aktif sebagai ketua organisasi daerah (OMDA) di IPB. Sebagai syarat untuk mendapat gelar Master di program studi Teknologi Hasil Perairan, penulis melakukan penelitian dengan judul
Identifikasi dan uji genotoksisitas inhibitor topoisomerase I dari daun
ix
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN... xii
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Tujuan dan Manfaat Penelitian ... 2
1.4 Hipotesis Penelitian ... 2
2. TINJAUAN PUSTAKA 2.1 Deskripsi dan Klasifikasi Ipomoea pes-caprae (Katang-katang) .... 3
2.2 Kemajuan Penelitian Katang-katang... 5
2.3 Enzim Topoisomerase... 6
2.4 Inhibitor Topoisomerase ... 7
2.5 Ekstraksi... 8
2.6 Pengujian Genotoksisitas dengan Seratia marcescens... 11
3. METODE 3.1Waktu dan Tempat Penelitian ... 12
3.2Alat dan Bahan... 12
3.3 Tahapan Penelitian ... 13
4. HASIL DAN PEMBAHASAN 4.1 Ekstrak Bahan Aktif Daun Katang-katang... 25
4.2 Ekstrak Kasar Daun Katang-katang ... 26
4.3 Fitokimia Ekstrak Kasar Daun Katang-katang ... 27
4.4 Aktivitas Ekstrak Kasar Sebagai Inhibitor Topoisomerase I ... 31
x 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 45
5.2 Saran... 45
DAFTAR PUSTAKA... 46
xi
DAFTAR TABEL
Halaman
1. Beberapa pelarut dan sifat-sifat fisiknya ... 9
2. Hasil pengamatan ekstrak daun katang-katang ... 25
3. Rendemen ekstraksi daun katang-katang ... 25
4. Rendemen hasil pencucian ekstrak daun katang-katang... 26
5. Kandungan fitokimia ekstrak kasar daun katang-katang ... 27
6. Hasil uji inhibitor enzim topoisomerase I dari ekstrak heksana, kloroform, aseton dan metanol pada konsentrasi 50µg/ml ... 31
7. Kriteria ekstrak daun katang-katang terpilih (ekstrak kloroform) ... 33
8. Hasil uji inhibitor enzim topoisomerase I dari ekstrak kloroform pada berbagai konsentrasi ... 33
9. Nilai Rf, warna spot secara visual dan warna di bawah UV ekstrak kloroform dengan eluen toluen : etil asetat (7 : 3) ... 37
10 Hasil penotolan fraksi kromatografi kolom dengan eluen 7 : 3 (toluen : etil asetat)... 40
DAFTAR GAMBAR Halaman 1. Ipomoea pes-caprae... 4
2. Struktur senyawa inhibitor topoisomerase I... 8
3. Cara umum ekstraksi jaringan tumbuhan segar dan fraksinasi ke dalam golongan yang berlainan berdasarkan kepolaran... 10
4. Serratia marcescens... 11
5. Skema alur proses penelitian... 14
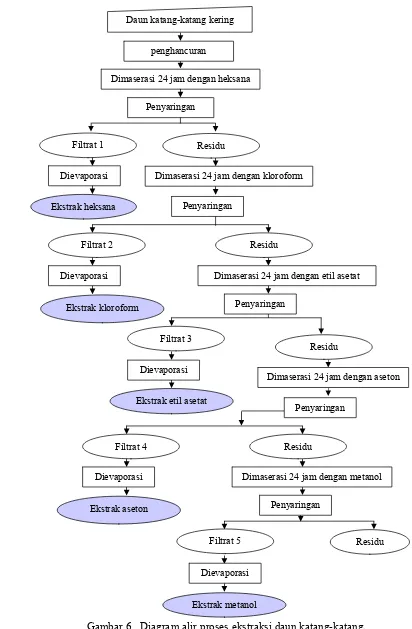
6. Diagram alir proses ekstraksi daun katang-katang... 16
7. Diagram alir uji aktivitas inhibitor topoisomerase I ... 19
8 . Uji genotoksisitas ekstrak koloroform daun katang-katang terhadap S. marcescens... 20
9. Teknik kromatografi lapis tipis ... 21
10. Sediaan kolom kromatografi ... 23
xii
14. Hasil pengamatan uji fitokimia (tanin) ... 30
15. Hasil pengamatan uji fitokimia (saponin) ... 31
16. Hasil elektroforesis uji inhibitor enzim topoisomerase I dari berbagai ekstrak ... 32
17. Hasil elektroforesis uji inhibitor enzim topoisomerase I dari ekstrak kloroform pada berbagai konsentrasi ... 34
18. Bakteri Serratia marcescens... 35
19. Hasil uji genotoksisitas bakteri Serratia marcescens ... 36
20. Spot hasil KLT ekstrak kloroform dengan eluen toluen : etil asetat (7 : 3) ... 38
21. Hasil tampungan fraksi ekstrak kloroform... 39
22. Komponen senyawa dalam fraksi dari kromatografi kolom ... 41
23. GC-Kromatogram fraksi 1 (F1) ekstrak kloroform daun katang-katang ...42
24. Struktur molekul dietilheksil ester benzendikarboksilat ... 42
25. Struktur Antrakuinon ... 43
26. Hasil uji GCMS fraksi 1 (F1) ekstrak kloroform daun katang-katang... 44
DAFTAR LAMPIRAN Halaman 1. Road map penelitian Ipomoea pes-caprae... 50
2. Contoh perhitungan rendemen ekstrak katang-katang... 51
3. Prinsip kerja reaksi terjadinya warna dan endapan uji fitokimia ... 52
4. Pereaksi untuk pengujian ekstrak kasar daun katang-katang sebagai inhibitor topoisomerase I... 56
1. PENDAHULUAN
1.1Latar Belakang
Sejak nenek moyang kita ada, secara tidak langsung mereka telah menggunakan bioaktif dari alam sebagai obat tradisional yang mampu mengobati penyakit ringan maupun penyakit yang ganas seperti tumor dan kanker. Meskipun pada era globalisasi ini sudah banyak jenis obat-obatan modern yang dapat mengobati penyakit tersebut namun sebagian masyarakat masih mempertahankan
penggunaan obat-obatan alami dari alam.
Secara umum penggunaan obat tradisional yang digunakan di Indonesia merupakan jamu-jamuan yang berasal dari tumbuhan yang hidupnya di pesisir laut seperti bakau dan tumbuhan pesisir. Salah satu contoh tumbuhan pesisir adalah katang-katang (Ipomoea pes-caprae). Katang-katang telah dikenal secara luas oleh masyarakat kita sebagai obat reumatik/nyeri persendian, myalgia (sakit otot/pegal-pegal), perdarahan pada wasir (haemorrhoid), pembengkakan gusi, dan sakit gigi, sedangkan Pangrayoon et al. (1989) mengatakan bahwa tumbuhan katang-katang merupakan tumbuhan obat yang telah digunakan di berbagai negara untuk mengobati penyakit seperti peradangan (inflammatori), penyakit perut,
diare dan migran atau sakit kepala. Katang-katang dikenal dengan nama lokal yang berbeda-beda, seperti tang katang, daun katang, alere, leleri, dalere, batata pantai, tapak kuda, andah arana, daredei, watata-ruruan, dolodoi, tilalade, mari-mari, wedor, tati raui, ngemir ngamir, loloro, bulalingo, wedule, ma an teng
(China) (BPPT 2005).
Souza et al. (1999) meneliti katang-katang sebagai antinociceptive, sedangkan hasil penelitian Hardjito dan Kingston (2004) telah membuktikan bahwa ekstrak daun katang-katang memiliki aktivitas sitotoksik terhadap sel kanker rahim. Selain itu Agustiningrum (2004) meneliti daun katang-katang
sebagai antioksidan, Teramachi et al. (2005) meneliti katang-katang sebagai inhibitor kolagenase, Road map penelitian daun katang-katang dapat dilihat pada Lampiran 1.
inhibitor suatu enzim lainnya, dalam hal ini enzim topoisomerase I, sebab enzim topoisomerase I banyak ditemukan dalam kelimpahan yang sangat tinggi pada sel kanker dibandingkan sel sehat/normal. Dari hasil penelitian ini diharapkan
tumbuhan katang-katang dapat dijadikan sebagai inhibitor enzim topoisomerase I yang dapat diaplikasikan untuk pengobatan penyakit kanker.
1.2 Perumusan Masalah
Dalam usaha mengembangkan obat tradisional, salah satu tumbuhan pesisir yang menarik perhatian karena memiliki aktivitas antioksidan dan diduga
mempunyai aktivitas antikanker adalah katang-katang. Namun kandungan kimia zat aktif dan tingkat keamanannya belum diketahui. Untuk itu perlu dilakukan penelitian terhadap ekstrak katang-katang secara ilmiah.
1.3Tujuan dan Manfaat Penelitian
Tujuan dari penelitian ini adalah mendapatkan ekstrak bahan aktif dari daun
katang-katang, mengetahui golongan senyawa dalam daun katang-katang, mendapatkan ekstrak sebagai inhibitor topoisomerase I dari daun katang-katang, mendapatkan nilai minimum inhibitory concentration (MIC) ekstrak yang aktif sebagai inhibitor topoisomerase I, mendapatkan dosis efektif genotoksik ekstrak
yang memiliki aktivitas inhibitor topoisomerase I terhadap Seratia marcescens, mendapatkan fraksi aktif dan mengetahui senyawa fraksi murni.
1.4 Hipotesis Penelitian
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ipomoea pes-caprae (Katang-katang)
Ipomoea pes-caprae atau katang-katang merupakan tumbuhan liar di daerah pantai atau di tempat-tempat yang tanahnya berbatu-batu dan mengandung pasir. Tumbuhan berbatang basah, licin, merambat atau merayap di tanah, warna batang hijau kecoklatan. Tinggi tumbuhan ini sekitar 6 inci, batangnya merambat sepanjang 75 kaki, lebar daun sekitar 2.5 sampai 4 inci (Edward 1999), sedangkan Devall (1992) mengatakan bahwa tumbuhan ini memiliki diameter daun sekitar 2.5 sampai 12 cm, daun berbentuk lonjong, memiliki bunga berbentuk terompet dengan diameter antara 3 sampai 16 cm (1.2–5.5 inci), dan mahkota bunga memiliki panjang 3 sampai 6 cm (1.2–2.4 inci) berbentuk corong berwarna merah muda keunguan atau bunga violet. I. pes-caprae memiliki nama lokal katang-katang, tang katang-katang, daun katang-katang, alere, leleri, dalere, batata pantai, tapak kuda, andah arana, daredei, watata-ruruan, dolodoi, tilalade, mari-mari, wedor, tati raui, ngemir ngamir, loloro, bulalingo, wedule, dan ma an teng (China) (BPPT 2005).
Katang-katang tersebar luas di sepanjang pantai tropis dan subtropis di seluruh dunia. Tumbuhan ini terdapat di sepanjang pantai, pesisir pantai, dan pulau-pulau tropis di Utara dan Selatan Amerika, Afrika Timur, Afrika Barat, India, dan Australia. Penyebaran tumbuhan ini terletak diantara 30 oLU – 30 oLS. Menurut Khazali et al. (1999) terdapat beberapa jenis Ipomoea yaitu I. pes-caprae spp. dengan cuping daun yang dalam dan I. pes-caprae spp. brasilliensis yang memiliki takik pada ujung daun. Keduanya terdapat di Indonesia, meskipun jenis I. pes-caprae spp. brasilliensis hanya ditemukan di Sumatera Barat dan Pulau Krakatau.
katang-katang yang dipublikasikan dari Pulau Pari Kepulauan Seribu dapat dilihat pada Gambar 1.
Beberapa manfaat katang-katang adalah sebagai obat reumatik/nyeri persendian, myalgia (sakit otot/pegal-pegal), pendarahan pada wasir, pembengkakan gusi, dan sakit gigi. Selain itu Pangrayoon et al. (1989) mengatakan bahwa tumbuhan katang-katang merupakan tumbuhan obat yang telah digunakan di berbagai negara untuk mengobati penyakit peradangan (inflammatori), penyakit perut, diare, dan migran atau sakit kepala.
Gambar 1. Ipomoea pes-caprae (Agustiningrum 2004).
Klasifikasi Ipomoea pes-caprae (Backer dan Van Den Brink 1963) adalah sebagai berikut:
Kingdom : Plantae – Plants
Subkingdom : Tracheobionta – Vascular plants Superdivision : Spermatophyta – Seed plants Division : Magnoliophyta – Flowering plants Class : Magnoliopsida – Dicotyledons
Subclass : Asteridae
Order : Solanales
Family : Convolvulaceae – Morning-glory family Genus : Ipomoea L. – morning-glory
5
2.2 Kemajuan Penelitian Katang-katang
Katang-katang merupakan tumbuhan pesisir yang banyak digunakan sebagai bahan baku obat-obatan tradisional di berbagai belahan dunia dan telah banyak diteliti sebagai bahan baku obat modern karena khasiat yang terkandung di dalamnya masih merupakan misteri yang perlu diungkap. Bahan yang memiliki khasiat sebagai bahan baku obat tersebut biasanya sering disebut sebagai zat bioaktif.
Zat bioaktif adalah zat yang termasuk metabolit sekunder yang bersifat aktif secara biologi dan memiliki aktivitas sebagai zat yang dapat dijadikan sebagai obat maupun bahan tambahan pada pembuatan makanan suplemen. Menurut Vickery (1981) zat bioaktif dari tumbuhan dapat berasal dari golongan terpenoid, fenolik dan alkaloid.
Beberapa tahun lalu telah banyak yang meneliti kandungan dan manfaat dari tumbuhan katang-katang. Souza et al. (1999) mengemukakan bahwa tumbuhan katang-katang mengandung senyawa aktif steroid, alkaloid, terpenoid, dan flavonoid yang dihasilkan oleh fraksi dari ekstrak etil asetat, sedangkan ekstrak air mengandung saponin dan tanin. Tumbuhan ini memiliki aktivitas antinociceptive yang menghambat neurogenic dan inflamasi pada ekstrak metanol sedangkan ekstrak etanol memiliki aktivitas hypoglycemic dan insulinogenic. Menurut kamus Dorland (2000) antinociceptive adalah suatu zat yang mempunyai efek analgesik; menurunkan sensitivitas terhadap stimulus nyeri. Neurogenic adalah berkenaan dengan pembentuk jaringan saraf yang berasal dari dalam sistem saraf. Hypoglycemic adalah (1) berkenaan dengan, ditandai dengan/menimbulkan hipoglikemia, (2) agen yang bekerja untuk menurunkan kadar glukosa dalam darah. Hipoglikemia adalah fenomena penurunan konsentrasi glukosa dalam darah secara abnormal, yang dapat menimbulkan gemetar, keringat dingin, hipotermia, dan sakit kepala. Insulinogenic adalah berkenaan dengan, ditandai oleh, atau memacu insulinogenesis. Insulinogenesis adalah pembentukan dan pelepasan insulin oleh pankreas.
berturut-turut sebesar 78.09%, 61.42%, dan 58.33%. Hasil fraksinasi dengan kromatografi kolom menghasilkan tiga kelompok fraksi. Fraksi I diduga pigmen antrakuinon (golongan pigmen kuinon), fraksi II diduga kumarin, dan fraksi III diduga furanokumarin dengan aktivitas antioksidan berturut-turut adalah 47.04%, 68.52%, dan 60.00%. Pada tahun yang sama Hardjito dan Kingston (2004) membuktikan bahwa ekstrak aseton dari tumbuhan katang-katang (daun) memiliki aktivitas sitotoksik terhadap sel kanker rahim (A2780) dengan IC50 sebesar 18 μg/ml, namun belum diketahui jenis zat aktif tersebut.
Teramachi et al. (2005) mengemukakan bahwa ekstrak dari daun katang-katang memiliki aktivitas inhibitor enzim kolagenase tipe V (EC 3.4.21.7), senyawa tersebut adalah caffeoyl dan coumaroyl yang didapatkan dari proses ekstraksi menggunakan pelarut etil asetat. Senyawa ini sangat berpotensi untuk dikembangkan sebagai bahan baku obat modern karena memiliki nilai IC50 di bawah 35 μM/mL.
2.3 Enzim Topoisomerase
Enzim adalah molekul protein tak hidup yang dihasilkan oleh setiap sel hidup (eukariota dan prokariota). Dapat dikatakan semua reaksi kehidupan hanya bisa dimungkinkan oleh adanya enzim. Di dalam sel, protein enzim melangsungkan ribuan reaksi kimia yang membuat sel dapat hidup, mengekstrak energi dari lingkungan, mengubah sumber energi menjadi molekul yang bermanfaat, memperbaiki dan membangun diri sendiri, melakukan pembuangan hasil samping, dan melakukan replikasi diri (Suhartono 1989).
7
Topoisomerase adalah enzim yang mengatur perubahan topologi DNA yang dilakukan dengan cara meningkatkan atau menurunkan jumlah pilinan pada heliks ganda. Terdapat dua golongan topoisomerase, golongan I dan II yang berbeda pada fungsi dan mekanisme kegiatannya. Enzim golongan I (topo I EC 5.99.1.2) bekerja dengan melakukan pemutusan sementara (transient break) dari satu utas DNA dalam DNA dan membebaskan tekanan pilinan, mengubah nomor mata rantai dengan langkah satu. Enzim golongan II (topo II EC 5.99.1.3) bekerja dengan melakukan pemutusan sementara kedua utas dari satu molekular DNA yang tersedia pada bagian rangkap dua DNA melalui suatu celah, merubah nomor mata rantai dengan langkah ganda. Enzim-enzim ini penting sekali untuk proses genetik sel seperti replikasi DNA, transkripsi, rekombinasi, dan pemisahan kromosom pada saat mitosis.
Enzim DNA topoisomerase dapat dijadikan target untuk penemuan beberapa antibiotik dan antikanker. Mekanisme atau cara kerja obat tersebut adalah menghambat kerja dari DNA topoisomerase atau menginaktifkan enzim DNA topoisomerase dengan cara memutus atau membelah (merusak) sebelum DNA melakukan replikasi/memperbanyak diri (Brutlag 2000).
2.4 Inhibitor Topoisomerase
Aktivitas enzim dipengaruhi oleh berbagai faktor lingkungan seperti pH, suhu, pelarut, kekuatan ion, dan adanya inhibitor atau aktivator. Secara kimia, suatu inhibitor tidak dapat dibedakan dari aktivator. Setelah mereka berinteraksi dengan enzim, barulah kita dapat melihat perbedaannya. Aktivator, berkaitan dengan enzim dan menyebabkan kenaikan kecepatan reaksi enzim, sedangkan inhibitor, berkaitan dengan enzim dan menyebabkan penurunan kecepatan reaksi enzim (Suhartono 1989).
banyak hal yang berharga, misalnya spesifikasi enzim, sifat-sifat fisik, kimia, dan molekular sisi aktif enzim tersebut, serta mekanisme kerja enzim (Suhartono 1989).
Enzim topoisomerase banyak ditemukan dalam kelimpahan yang sangat tinggi pada sel kanker dibandingkan sel sehat/normal dan diduga enzim ini merupakan enzim yang mempercepat pertumbuhan sel kanker. Banyak penelitian yang dilakukan untuk mencari inhibitor topoisomerase sebagai salah satu alternatif target penemuan obat baru pada penyakit kanker. Dewasa ini banyak senyawa dari bahan alam yang diisolasi dan dijadikan bahan baku obat kanker karena memiliki efek samping yang tidak berbahaya. Salah satu contoh obat antikanker dan berfungsi sebagai inhibitor topoisomerase I yang berasal dari bahan alam adalah Kamptotekin. kamptotekin dihasilkan oleh tumbuhan Camptotheca acuminata dari Famili Nyssaceae. Gambar 2 menyajikan gambar struktur senyawa inhibitor topoisomerase I kamptotekin dan topotekan.
kamptotekin topotekan
Gambar 2. Struktur senyawa inhibitor topoisomerase I (Brutlag 2000). 2.5 Ekstraksi
Ekstraksi adalah suatu istilah yang digunakan untuk memisahkan suatu komponen atau zat dari suatu bahan dengan menggunakan pelarut. Teknik ekstraksi didasarkan pada kenyataan bahwa jika suatu zat dapat larut dalam dua lapisan (fase) yang tidak dapat bercampur, maka zat itu dapat dialihkan dari satu lapisan (fase) kelapisan (fase) lain dengan mengocoknya bersama-sama (Achmadi 1992). Tingkat kemudahan ekstraksi bahan kering ditentukan oleh ukuran partikel bahan. Bahan yang diekstrak sebaiknya berukuran seragam untuk
9
mempermudah kontak antara bahan dengan pelarut sehingga ekstraksi berlangsung dengan baik (Sudarmadji dan Suhardi 1996).
Ada berbagai macam jenis pelarut yang dapat digunakan untuk proses ekstraksi. Jenis dan mutu pelarut yang digunakan sangat menentukan keberhasilan proses ekstraksi. Pelarut yang digunakan harus mempunyai persyaratan antara lain harus dapat melarutkan zat yang diinginkan, mempunyai titik didih yang cukup rendah, murah, tidak toksik, dan tidak mudah terbakar.
Pertimbangan yang harus diperhatikan terkait dengan sifat pelarut antara lain pelarut polar akan melarutkan senyawa polar, demikian sebaliknya pelarut non polar akan melarutkan senyawa nonpolar. Pelarut organik akan cenderung melarutkan senyawa organik, pelarut air cenderung melarutkan senyawa anorganik dan garam dari asam maupun basa organik. Asam-asam organik dapat diekstraksi ke dalam larutan air dengan mengunakan basa (Achmadi 1992). Tabel 1 menunjukkan beberapa jenis pelarut dan sifat-sifat fisiknya.
Tabel 1 Beberapa pelarut dan sifat-sifat fisiknya
Pelarut Titik Didih (oC) Titik Beku (oC) Konstanta Dielektrik
Sumber: Nur dan Adijuwana 1989.
fraksinasi ke dalam golongan senyawa yang berlainan berdasarkan kepolaran dapat dilihat pada Gambar 3 (Harborne 1987).
Secara umum ekstraksi dilakukan secara berturut-turut mulai dengan pelarut non-polar (heksana) lalu dengan pelarut yang semi polar (etil asetat), kemudian dengan pelarut polar (metanol). Dengan demikian akan diperoleh ekstrak kasar yang mengandung berturut-turut senyawa non-polar, semi polar, dan senyawa polar (Hostetmann et al. 1997). Ekstraksi dengan pelarut non-polar ditujukan untuk penghilangan lemak sebelum diekstraksi dengan pelarut yang sesuai, sehingga diperoleh ekstrak yang bebas lemak (Harborne 1987).
Gambar 3. Cara umum ekstraksi jaringan tumbuhan segar dan fraksinasi ke dalam golongan yang berlainan berdasarkan kepolaran (Harborne 1987).
Daun atau bunga segar
dimaserasi 5 menit dalam
MeOH-H2O (4:1) (10 x vol, atau bobot), filtrasi KKt atau KLT pada silika
dikeringkan, diuapkan diekstraksi dengan CHCl3 (3x)
- dibasakan sampai pH 10 dengan
NH4OH
- diekstraksi dengan CHCl3- MeOH
11
2.6 Pengujian Genotoksisitas dengan Seratia marcescens
Uji genotosisitas oleh Hayes (1997) dan Johnson et al. (1998) dalam Anita (2005) dikategorikan dalam tiga macam, yaitu mutasi gen, perubahan struktur kromosom, dan efek terhadap DNA. Dalam penelitian ini menggunakan metode mutasi gen yang diartikan sebagai kerusakan genetik/(genotoksisitas, mutagenisitas). Uji ini merupakan salah satu cara untuk menentukan apakah suatu senyawa tidak beracun dan berbahaya. Uji mutasi gen bisa menggunakan bakteri tertentu seperti Serratia marcescens, Vibrio luminescens, Salmonella typhimurium. Pada penelitan ini digunakan bakteri S. marcescens seperti disajikan pada Gambar 4.
Gambar 4. Serratia marcescens (Anonim 2007).
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2006–Februari 2007, bertempat di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Pengujian GC-MS dilakukan di Laboratorium Terpadu Universitas Islam Negeri Syarif Hidayatullah.
3.2Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini meliputi alat-alat dan bahan-bahan untuk ekstraksi, identifikasi fitokimia, uji aktivitas inhibitor topoisomerase I, uji genotoksisitas, fraksinasi ekstrak aktif daun katang-katang, dan identifikasi senyawa aktif.
3.2.1 Alat
Alat-alat yang digunakan untuk menyiapkan bahan baku adalah evaporator putar vakum (IKA), mixer (vortex), pelat kromatografi lapis tipis, sentrifuse, UV kabinet dengan panjang gelombang 254 nm dan 365 nm, seperangkat alat uji fitokimia, seperangkat alat uji inhibitor topoisomerase I (seperangkat alat elektroforesis), seperangkat kromatografi kolom, dan alat GCMS merek Shimadzu (HP) tipe QP 2010 Japan.
3.2.2 Bahan
Bahan utama yang digunakan pada penelitian ini adalah daun katang-katang yang dikoleksi di Laboratorium Bioteknologi Hasil Perairan, THP, IPB. Daun berasal dari Pulau Pari, Kepulauan Seribu. Daun dipisahkan dari ranting dan akar yang masih segar tanpa membedakan daun tua maupun daun muda. Daun katang-katang yang disediakan di Laboratorium telah dikeringkan dengan cara diangin-anginkan dan dihancurkan dengan blender sehingga berbentuk bubuk halus. Bubuk daun katang-katang tersebut disimpan dalam keadaan kering.
13
enzim topoisomerase I, substrat DNA supercoiled ditambah buffer reaksi, dan kamptotekin sebagai kontrol inhibitor topoisomerase I..
Pada uji genotoksisitas digunakan Serratia marcescens sebagai bakteri target yang diperoleh dari Laboratorium Mikrobiologi, Sekolah Tinggi Ilmu Hayati, Institut Teknologi Bandung. Media yang digunakan untuk penyegaran dan pertumbuhan bakteri meliputi pepton, beef extract, dan NaCl. Proses fraksinasi menggunakan seperangkat bahan kromatografi lapis tipis dan seperangkat kromatografi kolom, seperti lempeng lapis tipis silika gel 60 F254, pelarut sebagai eluen, dan lain-lain.
3.3 Tahapan Penelitian
Metode penelitian yang dilakukan terdiri dari tujuh tahap, yaitu (1) ekstraksi bahan aktif dari daun katang-katang, (2) pencucian ekstrak kasar,
Gambar 5. Skema alur proses penelitian. Keterangan : : input
: proses : output
: diagram alir proses ekstraksi (dapat dilihat pada Gambar 6)
Ekstraksi senyawa aktif
Uji inhibitor Topo I Uji fitokimia
ekstrak kasar (1,2,3,4,5) bersih
Uji genotoksisitas
Fraksinasi ekstrak aktif KLT
Kromatografi Kolom
Ekstrak aktif
Pencucian ekstrak kasar (1, 2, 3, 4, 5)
Ekstrak kasar (1,2,3,4,5) bersih Bubuk kering sampel daun katang-katang
Fraksi ekstrak aktif
Identifikasi Fraksi murni
Nama senyawa
15
3.3.1 Ekstraksi bahan aktif daunkatang-katang
Proses ekstraksi bahan aktif dilakukan dengan lima jenis pelarut dengan tingkat kepolaran yang berbeda yaitu heksana (bersifat non polar), kloroform (bersifat semi polar), etil asetat (bersifat semi polar), aseton (bersifat polar) dan metanol (bersifat polar). Proses ekstraksi dilakukan secara bertingkat dimulai dari pelarut heksana, kloroform, etil asetat, aseton dan metanol. Sebelum ekstraksi dilakukan, sampel daun katang-katang dibersihkan selanjutnya dikeringkan dengan cara diangin-anginkan. Sampel daun katang-katang yang telah kering diiris kecil-kecil kemudian dihaluskan dengan blender dan ditimbang (±150 g). Ke dalam sampel yang telah ditimbang ditambahkan pelarut heksana sampai terendam (±300 ml) dan dilakukan proses maserasi selama 24 jam.
Gambar 6. Diagram alir proses ekstraksi daun katang-katang. penghancuran
Dimaserasi 24 jam dengan heksana
Ekstrak heksana
Residu
Filtrat 2
Ekstrak kloroform
Filtrat 3
Ekstrak etil asetat
Dievaporasi Dimaserasi 24 jam dengan kloroform
Penyaringan
Penyaringan Dievaporasi
Dievaporasi
Dimaserasi 24 jam dengan etil asetat Filtrat 1
Penyaringan
Residu Daun katang-katang kering
Residu
Filtrat 4
Ekstrak aseton
Residu Filtrat 5
Ekstrak metanol
Dimaserasi 24 jam dengan aseton
Penyaringan
Penyaringan Dievaporasi
Dievaporasi
17
Setelah mendapatkan ekstrak, dilakukan pengukuran rendemen. Contoh pengukuran rendemen disajikan pada Lampiran 2. Rendemen diperlukan untuk mengetahui dan membandingkan jumlah senyawa atau ekstrak yang dapat terambil oleh pelarut. Banyak ekstrak dihitung berdasarkan rumus:
3.3.2 Pencucian ekstrak kasar
Ekstrak dicuci untuk menghilangkan bahan-bahan pengotor yang terdapat dalam ekstrak kasar dan zat yang tidak larut dalam pelarut aslinya. Ekstrak kasar dicuci dengan merendam ekstrak dengan pelarut aslinya dilanjutkan dengan pengocokan agar tercampur semua dan disimpan dalam lemari es selama semalam. Filtrat dipisahkan dengan supernatan atau endapan yang terbentuk, selanjutnya filtrat dipekatkan dengan cara evaporasi. Proses ini dilanjutkan beberapa kali sampai tidak terjadi endapan.
3.3.3 Uji fitokimia
Analisis fitokimia merupakan uji untuk mengetahui keberadaan senyawa kimia spesifik seperti alkaloid, senyawa fenol (termasuk flavonoid), steroid, saponin, dan terpenoid. Uji fitokimia yang dilakukan berdasarkan pada reaksi yang menghasilkan warna atau endapan (Harborne 1987). Prinsip kerja reaksi terjadinya warna dan endapan dapat dilihat dalam Lampiran 3.
A) Alkaloid
Sebanyak 1 gram ekstrak kasar ditambah 10 ml heksana dan beberapa tetes amoniak. Fraksi heksana dipisahkan dan diasamkan dengan 10 tetes H2SO4 2 M. Fraksi asam diambil kemudian ditambahkan pereaksi Dragendorff, Mayer, dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan putih oleh pereaksi Mayer, endapan merah oleh pereaksi Dragendorff, dan endapan cokelat oleh pereaksi Wagner.
B) Flavonoid dan Fenolik Hidrokuinon
Sebanyak 1 gram ekstrak kasar ditambahkan metanol 30% sampai terendam lalu dipanaskan. Filtratnya ditaruh ke dalam spot plate (papan uji) dan kemudian
ditambahkan NaOH 10% (b/v) atau H2SO4 pekat. Terbentuknya warna merah karena penambahan NaOH menunjukkan adanya senyawa fenolik hidrokuinon sedangkan warna merah yang terbentuk akibat penambahan H2SO4 pekat menunjukkan adanya flavonoid.
C) Saponin
Sebanyak 1 gram ekstrak kasar ditambah air secukupnya dan dipanaskan pada air mendidih selama 5 menit. Larutan tersebut didinginkan kemudian dikocok. Timbulnya busa yang bertahan lebih dari 10 menit menunjukkan adanya saponin.
D) Tanin
Sebanyak 1 gram ekstrak kasar ditambahkan air kemudian didihkan selama beberapa menit, lalu disaring. Filtratnya ditambahkan FeCl3 (b/v). Warna biru tua atau hitam kehijauan menunjukkan adanya tanin.
E) Triterpenoid dan Steroid
Sebanyak 1 gram ekstrak kasar ditambahkan 25 ml etanol 30% lalu dipanaskan dan disaring. Filtratnya diuapkan kemudian ditambah eter. Lapisan eter dipipet dan diujikan pada papan uji dengan menambahkan pereaksi Liebermen Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2SO4 pekat). Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau menunjukkan adanya steroid.
3.3.4 Uji aktivitas inhibitor topoisomerase I (TopoGen 2006)
19
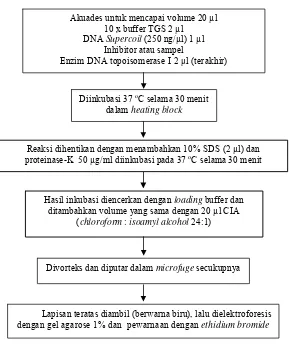
Gambar 7. Diagram alir uji aktivitas inhibitor topoisomerase I
Pereaksi harus dibuat dalam tabung mikrosentrifuse dalam es. Setelah penambahan enzim, tabung diinkubasi pada suhu 37 oC selama 30 menit, reaksi dihentikan dengan 1/10 volume dari 10% SDS. Selanjutnya ditambahkan dengan proteinase-K atau pronase (untuk menghancurkan ikatan protein) dan diinkubasi kembali pada suhu 37 oC selama 30 menit. Hasil inkubasi diencerkan dengan larutan penyangga kemudian diekstraksi dengan CIA (chloroform : isoamyl alcohol = 24 : 1) dan dilanjutkan sentrifugasi. Lapisan atas dari hasil sentrifugasi yang berwarna biru dianalisis elektroforesis dengan gel agarosa. Gel agarosa yang telah dielektroforesis selanjutnya diwarnai dengan etidiumbromida.
Kualitatif bentuk DNA nick dan supercoil ditentukan dengan melihat hasil gel agarosa yang telah dielektroforesis di bawah sinar UV. Aktivitas inhibisi enzim ditentukan dengan kemampuan enzim untuk mengubah bentuk DNA supercoil menjadi DNA bentuk nick atau relaks untuk topoisomerase I. Enzim DNA topoisomerase I yang digunakan adalah human topoisomerase I dari
Diinkubasi 37 oC selama 30 menit dalam heating block
Akuades untuk mencapai volume 20 µl 10 x buffer TGS 2 µl
DNA Supercoil (250 ng/µl) 1 µl
Inhibitor atau sampel Enzim DNA topoisomerase I 2 μl (terakhir)
Reaksi dihentikan dengan menambahkan 10% SDS (2 µl) dan proteinase-K 50 µg/ml diinkubasi pada 37 oC selama 30 menit
Hasil inkubasi diencerkan dengan loading buffer dan ditambahkan volume yang sama dengan 20 µl CIA
(chloroform : isoamyl alcohol 24:1)
Divorteks dan diputar dalam microfuge secukupnya
TopoGen. Sebagai kontrol positif digunakan kamptotekin pada konsentrasi 100 µM (34.84 µg/ml).
3.3.5 Uji genotoksisitas dengan bakteri Seratia marcescens
Tahap awal melakukan uji genotoksisitas adalah proses penyegaran bakteri S. marcescens dalam agar miring. Media yang digunakan adalah pepton, beef extract, NaCl, bacto agar, dan akuades pH 7 (Lampiran 5), sedangkan untuk pengujian genotoksisitasnya menggunakan cawan petri.
Perlakuan yang digunakan adalah kontrol (tanpa ekstrak) dan ekstrak berturut-turut dengan konsentrasi 20, 200, 2 000, 20 000, 30 000, 40 000, dan 50 000 µg/ml. Proses pengujian genotoksisitas dimulai dengan persiapan media steril bervolume 15 ml. Setelah tersedia media steril maka dilakukan penambahan ekstrak pada berbagai konsentrasi yang telah ditentukan. Proses penambahan ekstrak dilakukan dengan kondisi agar yang tidak terlalu panas untuk menghindari kerusakan senyawa aktif pada ekstrak, selanjutnya campuran dituang ke dalam cawan petri. Media yang telah berisi ekstrak dalam petri didinginkan dan tidak boleh ada uap air dalam cawan petri. Setelah itu S. marcescens digores di atas agar dan diinkubasikan selama 24 jam pada suhu ruang. Alur proses pengujian genotoksisitas ekstrak kloroform daun katang-katang terhadap S. marcescens dapat dilihat pada Gambar 8.
Gambar 8. Uji genotoksisitas ekstrak koloroform daun katang-katang terhadap S. marcescens.
Ekstrak kloroform dengan konsentrasi 20, 200, 2 000, 20 000, 30 000, 40 000 dan 50 000 µg/ml dimasukkan dalam 15 ml
media
Dihomogenkan
Pendinginan agar + ekstrak
S. marcescens digores di atas agar
Diinkubasi selama 24 jam suhu ruang
21
Setelah diinkubasi 24 jam dilakukan pengamatan secara visual dengan melihat hasil goresan yang terbentuk. Apabila hasil goresan berwarna putih maka ekstrak tersebut bersifat genotoksik, namun apabila tetap terbentuk warna merah sebagaimana warna bakteri S. marcescens maka ekstrak tidak bersifat genotoksik atau aman untuk digunakan sebagai bahan obat.
3.3.6 Fraksinasi dan isolasi senyawa inhibitor topoisomerase I 3.3.6.1 Kromatografi Lapis Tipis (KLT)
Pemisahan senyawa inhibitor topoisomerase I dilakukan dengan kromatografi lapis tipis (KLT) dengan mencari eluen yang cocok untuk pemisahan komponen aktif dari ekstrak kloroform daun katang-katang. Eluen yang terbaik dalam kromatografi lapis tipis akan digunakan dalam proses kromatografi kolom.
Proses awal KLT adalah persiapan lempeng lapis tipis silika gel 60 F254 dengan ukuran panjang 10 cm dan lebar 2 cm, diberi tanda garis dengan pensil pada jarak 1 cm pada kedua ujung lempeng. Ekstrak katang-katang ditimbang sebanyak 0.02 g dan dilarutkan dalam 0.5 ml pelarut asalnya. Eluen yang akan digunakan dimasukkan ke dalam tabung kromatografi hingga tingginya sekitar 1 cm dari dasar tabung dan ditutup rapat agar jenuh dengan uap eluen. Larutan ekstrak sampel diteteskan dengan pipa kapiler pada lempeng silika gel. Penetesan dilakukan pada jarak 1 cm dari salah satu ujung tersebut. Ujung lempeng yang terdekat pada tempat penetesan dicelupkan ke dalam tabung kromatografi yang sudah jenuh dengan eluen. Tabung kemudian ditutup rapat dan dibiarkan pelarut naik sampai batas yang ditentukan (1 cm dari batas atas) (Gambar 9).
Gambar 9. Teknik kromatografi lapis tipis.
Batas atas
Setelah elusi pada batas tertentu, lempeng diangkat dan selanjutnya dikering udarakan selama beberapa menit, kemudian dideteksi dengan sinar ultraviolet pada panjang gelombang 254 dan 365 nm.
Pemilihan pelarut (eluen) pada proses KLT dilakukan dengan kombinasi pelarut yang berbeda yaitu sistem B yang terdiri dari pelarut toluen : etil asetat (7 : 3). Terpilihnya sistem B dengan perbandingan tersebut didasarkan atas penelitian sebelumnya yang dilakukan oleh Agustiningrum (2004). Hasil KLT ekstrak kloroform dengan sistem B diamati dengan sinar UV pada panjang gelombang 365 nm, selanjutnya dihitung nilai Rf dari masing-masing spot yang terbentuk.
3.3.6.2 Kromatografi kolom
Prosedur kerja fraksinasi dengan kromatografi kolom (KK) adalah sebagai berikut:
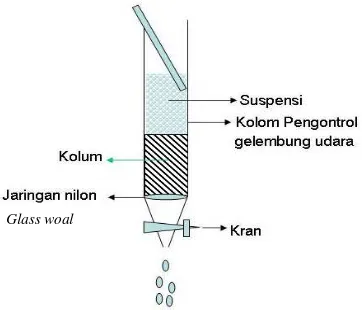
1) Kolom dipasang pada statif secara tegak lurus, pada bagian dasar kolom diberi glass wool dan diisi dengan pelarut sampai sepertiganya sebagai eluen. Kemudian dimasukkan silika gel yang telah disuspensikan dengan eluen. Campuran silika gel dimasukkan ke dalam kolom sedikit demi sedikit agar diperoleh lapisan yang seragam (Gambar 10).
2) Sebelum ekstrak dimasukkan dalam kolom, ekstrak dilarutkan dengan pelarut asalnya. Eluen yang digunakan pada KLT menjadi acuan untuk menentukan eluen pada kolom namun tidak sesederhana itu harus melalui tata kerja yang agak empiris dengan mengurangi komponen pelarut polar sampai harga Rf lebih kecil dari 0.3 pada KLT (Gritter et al. 1991).
23
Gambar 10. Sedian kolom kromatografi.
4) Setelah mendapatkan fraksi yang telah dipisahkan melalui kromatografi kolom, maka pelarutnya diuapkan hingga mendapatkan fraksi bebas pelarut. Selanjutnya dilakukan proses penotolan menggunakan teknik KLT untuk melihat pemisahan fraksi hasil kolom. Alur proses uji kromatografi kolom dapat dilihat pada Gambar 11.
Gambar 11. Alur proses uji kromatografi kolom.
3.3.7 Identifikasi fraksi hasil kromatografi kolom dengan analisis GCMS Fraksi yang didapat dalam proses kromatografi kolom diencerkan dengan jenis pelarutnya (kloroform), dianalisis komponen kimianya menggunakan GCMS (Shimadzu QP2010, Japan) dengan volume injeksi 2 µl dan kondisi alat yang telah diprogram.
Ekstrak dilarutkan dalam pelarut asalnya
Fraksinasi dengan komatografi kolom (silika gel dengan sistem terpilih)
Fraksi dievaporasi
Penotolan menggunakan kromatografi lapis tipis
Glass woal
Kolom yang digunakan jenis RTX 1 metil polisiloksan yang bersifat non polar, dengan gas pembawa adalah helium dengan suhu oven kolom 70 oC, suhu injeksi 230 oC dengan tekanan 160 kPa, total aliran 31.4 ml/detik, aliran kolom 2.58 ml/detik. Dalam analisis fraksi kloroform ini suhu kolom diprogram dari 70 oC sampai 280 oC dengan 2 tahap kenaikan. Pada tahap awal suhu kolom dibuat konstan 70 ºC selama 2 menit dan kemudian dinaikkan sampai suhu 280 oC dengan kecepatan rata-rata sebesar 5 oC/menit. Suhu 280 oC dipertahankan konstan selama 20 menit. Suhu injektor diprogram konstan pada suhu 230 oC, sedangkan suhu detektor (quadrupol) diprogram konstan pada suhu 250 oC.
4. HASIL DAN PEMBAHASAN
4.1 Ekstrak Bahan Aktif Daun Katang-katang
Kriteria daun katang-katang yang dipilih sebelum dikeringkan dan diekstraksi adalah daun yang masih segar dan berwarna hijau. Kelima filtrat ekstrak hasil ekstraksi daun katang-katang yang dihasilkan berwarna hijau tua (Tabel 2).
Ekstrak heksana dan ekstrak kloroform memiliki warna ekstrak hijau tua yang lebih pekat dibandingkan ekstrak etil asetat, aseton, dan metanol. Hal ini disebabkan karena klorofil dapat terekstraksi oleh pelarut lipid seperti kloroform, aseton dan eter (Harborne 1987). Ekstrak etil asetat, aseton, dan metanol memiliki warna hijau tua namun tidak terlalu pekat karena dimungkinkan klorofil sudah banyak terekstraksi pada proses sebelumnya yang menggunakan heksana dan kloroform.
Tabel 2 Hasil pengamatan ekstrak daun katang-katang
Ekstrak Warna ekstrak Wujud fisik
Heksana Hijau tua (***) Pasta
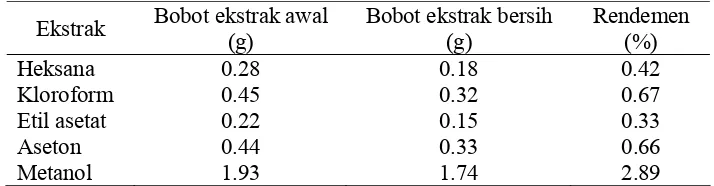
Kelima ekstrak daun katang-katang ditimbang bobotnya dan ditentukan rendemennya dalam satuan persen (%). Contoh perhitungan rendemen ekstrak daun katang-katang dapat dilihat pada Lampiran 2. Rendemen ekstrak daun katang-katang ditampilkan pada Tabel 3.
Tabel 3 Rendemen ekstraksi daun katang-katang Bobot sampel
Kloroform 0.45 0.67
Tabel 3 menunjukkan rendemen ekstrak heksana, ekstrak kloroform, ekstrak etil asetat, ekstrak aseton dan ekstrak metanol yang besarnya berturut-turut adalah 0.42%, 0.67%, 0.33%, 0.66%, 2.89%. Ekstrak terbanyak diperoleh dari pelarut polar, yaitu metanol sebesar 2.89% dan paling kecil adalah ekstrak etil asetat sebesar 0.33%. Data di atas membuktikan bahwa daun katang-katang mengandung berbagai senyawa dengan tingkat kepolaran yang berbeda-beda. Ekstrak metanol memiliki jumlah terbanyak karena pelarut metanol memiliki nilai konstanta dielektrik tinggi dibandingkan dengan pelarut lainnya kecuali air (Tabel 1) sehingga dapat membuka dinding sel yang mengakibatkan hampir semua senyawa tertarik keluar dari dalam sel. Selain itu pelarut metanol mampu mengekstraksi senyawa organik, sebagian lemak serta tanin (Heath dan Reineccius 1987).
4.2 Ekstrak Kasar Daun Katang-katang
Kelima ekstrak yang didapat dari proses ekstraksi tersebut selanjutnya dicuci dengan pelarut asalnya. Proses ini bertujuan membersihkan ekstrak kasar dari pengotor ataupun senyawa-senyawa yang larut namun tidak sempurna. Ekstrak yang dihasilkan dari proses pencucian ini disebut sebagai ekstrak kasar bersih daun katang-katang dan ekstrak kasar bersih ini yang akan digunakan untuk uji selanjutnya yaitu uji fitokimia dan uji aktivitas inhibitor topoisomerase I. Hasil pencucian ekstrak daun katang-katang ditampilkan pada Tabel 4.
Tabel 4 Rendemen hasil pencucian ekstrak daun katang-katang Ekstrak Bobot ekstrak awal
(g)
27
4.3 Fitokimia Ekstrak Kasar Daun Katang-katang
Pengujian fitokimia dilakukan terhadap kelima ekstrak daun katang-katang untuk menelusuri golongan senyawa metabolit sekunder yang dikandungnya. Pengujian ini hanya memperlihatkan hasil kualitatif berdasarkan warna dan endapan yang terbentuk. Hasil rekapitulasi uji fitokimia terhadap kelima ekstrak daun katang-katang ditampilkan pada Tabel 5.
Tabel 5 Kandungan fitokimia ekstrak kasar daun katang-katang
Jenis/Ekstrak Heksana Kloroform Etil asetat Aseton Metanol
Alkaloid
Pemeriksaan kualitatif uji alkaloid terhadap ekstrak heksana, kloroform, etil asetat, aseton, dan metanol daun katang-katang menunjukkan adanya endapan berwarna merah, cokelat, dan putih yang bervariasi. Hasil pengamatan secara visual uji alkaloid dapat dilihat pada Gambar 12.
relatif kecil, karena hanya dua dari tiga pengujian yang dilakukan menunjukkan hasil positif.
Keterangan : A = Ekstrak heksana 1 = Pereaksi Dragendorff B = Ekstrak kloroform 2 = Pereaksi Mayer C = Ekstrak etil asetat 3 = Pereaksi Wagner D = Ekstrak aseton
E = Ekstrak metanol
Gambar 12. Hasil pengamatan uji fitokimia (alkaloid).
Pada ekstrak kloroform (B1, B2, B3), dan ekstrak metanol (E1, E2, E3) menunjukkan adanya senyawa golongan alkaloid dengan kuantitas tinggi, karena dengan penggunaan ketiga pereaksi menunjukkan hasil positif. Hasil penelitian Souza et al. (1999) menunjukkan bahwa ekstrak etil asetat memiliki kandungan senyawa alkaloid, sedangkan ekstrak metanol dan air menunjukkan hasil negatif yang berbeda dengan hasil penelitian ini. Perbedaan hasil tersebut disebabkan banyak faktor, di antaranya adalah asal sampel, umur sampel, jumlah sampel, dan perlakuan proses ekstraksi.
4.3.2 Flavonoid
Hasil penelitian menunjukkan bahwa ekstrak daun katang-katang memiliki kandungan senyawa flavonoid yang dominan, terbukti dalam pemeriksaan secara kualitatif sederhana menggunakan pereaksi NaOH dan H2SO4 pekat semua ekstrak dari daun katang-katang membentuk endapan berwana merah, meskipun pada ekstrak etil asetat membentuk endapan yang tipis pada penambahan pereaksi NaOH dan tidak ada endapan pada pereaksi H2SO4 pekat. Lebih jelasnya dapat dilihat pada Gambar 13.
E1 E2 E3 B1 B2 B3
D2 D3
29
Keterangan : 1= Ekstrak heksana A = NaOH 10% 2 = Ekstrak kloroform B = H2SO4 pekat 3 = Ekstrak etil asetat
4 = Ekstrak aseton 5 = Ekstrak metanol
Gambar 13. Hasil pengamatan uji fitokimia (flavonoid).
Hasil penelitian ini didukung oleh penelitian Agustiningrum (2004) yang menduga ekstrak kloroform dari daun katang-katang memiliki senyawa kumarin yang termasuk ke dalam golongan fenilpropanoid. Souza et al. (1999) juga membuktikan bahwa ekstrak etil asetat daun katang-katang memiliki kandungan senyawa flavonoid. Dengan adanya senyawa flavonoid ini diharapkan daun katang-katang dapat dijadikan bahan baku antioksidan yang mampu melindungi tubuh dari radikal bebas yang dapat menyebabkan kanker.
4.3.3 Tanin
Tanin merupakan salah satu golongan bahan polimer penting dalam tumbuhan yang masuk ke dalam senyawa polifenol. Senyawa ini cenderung mudah larut dalam air karena umumnya sering berikatan dengan gula sebagai glikosida. Sebagian besar tumbuhan yang banyak bertanin dihindari oleh hewan pemakan tumbuhan karena rasanya yang sepat. Tanin dapat dideteksi langsung dengan mendidihkan ekstrak dan menambahkan FeCl3.
Pada Gambar 14 dapat dilihat bahwa dari kelima ekstrak katang-katang hanya ekstrak metanol yang memiliki senyawa tanin. Ini terbukti terbentuknya warna hitam kehijauan pada ekstrak yang dilarutkan dalam pelarut metanol 30%. Hal ini didukung oleh penelitian Souza et al. (1999) yang melaporkan bahwa daun katang-katang yang diekstrak menggunakan air memiliki kandungan senyawa tanin. Senyawa tanin dalam dunia kedokteran tidak banyak digunakan sebagai
A
B
bahan baku obat, namun senyawa tanin juga memiliki khasiat astringent yang dapat mengurangi pembengkakan, radang, dan antidiare (Stahl 1985).
Keterangan : A = Ekstrak heksana D = Ekstrak aseton B = Ekstrak kloroform E = Ekstrak metanol C = Ekstrak etil asetat
Gambar 14. Hasil pengamatan uji fitokimia (tanin).
4.3.4 Saponin
Dalam penelitian ini uji saponin yang diamati secara visual terbentuk busa pada ekstrak yang dilarutkan dalam air yang dipanaskan. Hasil uji saponin dapat dilihat pada Gambar 15.
Keterangan : A = Ekstrak heksana D = Ekstrak aseton B = Ekstrak kloroform E = Ekstrak metanol C = Ekstrak etil asetat
Gambar 15. Hasil pengamatan uji fitokimia (saponin).
31
etil asetat daun katang-katang memiliki kandungan senyawa saponin. Perbedaan hasil tersebut disebabkan banyak faktor, di antaranya adalah asal sampel, umur sampel, jumlah sampel, dan perlakuan proses ekstraksi.
4.4 Aktivitas Ekstrak Kasar Sebagai Inhibitor Topoisomerase I
Ekstrak kasar yang sudah dibersihkan dalam proses pencucian diuji aktivitas inhibitor enzim topoisomerase I dengan konsentrasi ekstrak sebesar 50 µg/ml. Uji ini dilakukan terhadap empat ekstrak bioaktif terpilih yang rendemennya relatif besar yaitu ekstrak heksana, kloroform, aseton, dan metanol dengan kontrol positif senyawa kamptotekin. Adanya aktivitas inhibitor ditandai dengan perubahan bentuk substrat DNA supercoil menjadi bentuk DNA nick complex, dan band dari DNA hasil reaksi dapat dicocokkan dengan band kontrol (Topo I + DNA, Marker DNA supercoil, Topo I + DNA + Pelarut, Marker DNA relaks, Topo I + DNA + kamptotekin). Hasil positif sebagai inhibitor enzim topoisomerase I ditandai dengan cocoknya bentuk band dari hasil ekstrak dengan band Marker DNA supercoil (aktivitas bersifat katalitik) dan band Topo I + DNA + kamptotekin (aktivitas bersifat poison).
Keempat ekstrak yang diujikan pada konsentrasi 50 µg/ml terhadap aktivitas enzim topoisomerase I menunjukkan hasil positif menghambat aktifitas enzim topoisomerase I (Tabel 6). Ekstrak etil asetat dari daun katang-katang tidak diuji karena pada uji fitokimia ekstrak etil asetat memiliki kuantitas rendah pada senyawa golongan alkaloid dan flavonoid, sedangkan pada senyawa golongan tanin, saponin, dan triterpenoid/steroid menunjukkan hasil negatif. Selain itu ekstrak etil asetat memiliki rendemen paling kecil di antara kelima ekstrak daun katang-katang. Hal ini dilakukan karena dengan jumlah ekstrak yang banyak akan lebih mudah melakukan pengujian lanjut.
Tabel 6 Hasil uji inhibitor enzim topoisomerase I dari ekstrak heksana, kloroform, aseton dan metanol pada konsentrasi 50 µg/ml
Sampel Aktivitas Inhibitor
Topoisomerase I
Ekstrak heksana +
Ekstrak kloroform +
Ekstrak aseton +
1 2 3 4 5 6 7 8 9
Keterangan : 1.Relaks DNA hasil reaksi (Topo I + DNA), 2. Marker DNA supercoil, 3. Relaks DNA hasil reaksi (Topo I + DNA + DMSO), 4. Marker DNA relaks, 5. Topo I + DNA + kamptotekin, 6. Ekstrak Heksana, 7. Ekstrak Kloroform, 8. Ekstrak Aseton, 9. Ekstrak Metanol
Gambar 16. Hasil elektroforesis uji inhibitor enzim topoisomerase I dari berbagai ekstrak.
Gambar 16 menunjukkan ekstrak heksana (sumur no 6), ekstrak kloroform (sumur no 7), ekstrak aseton (sumur no 8), dan ekstrak metanol (sumur no 9) mampu menghambat aktivitas katalitik topo I, terlihat dengan tidak terbentuknya relaks DNA seperti pada kontrol (sumur no 2) (Marker DNA supercoil). Hal ini menunjukkan enzim topoisomerase I tidak dapat bekerja karena dihambat oleh senyawa ekstrak daun katang-katang. Aktivitas keempat ekstrak daun katang-katang sebagai inhibitor topoisomerase I diduga karena adanya senyawa fitokimia yang terkandung di dalam daun katang-katang dalam hal ini adalah alkaloid, flavonoid, dan tanin. Seperti yang dinyatakan oleh Sukardiman et al. (2002) bahwa senyawa golongan alkaloid, glikosida, dan flavonoid memiliki aktivitas antikanker dengan salah satu target molekul enzim DNA topoisomerase. Salah satu obat antikanker komersial dari jenis alkaloid dengan aktivitas inhibitor topoisomerase I adalah kamptotekin (Gambar 2).
33
antioksidan tertinggi dibandingkan dengan ekstrak metanol. Dengan dasar ini maka ekstrak kloroform digunakan untuk melihat hubungan antara aktivitas antioksidan dengan aktivitas antikanker dari daun katang-katang. Kriteria ekstrak daun katang-katang terpilih (ekstrak kloroform) dapat dilihat pada Tabel 7.
Tabel 7 Kriteria ekstrak daun katang-katang terpilih (ekstrak kloroform)
Kriteria Keterangan
Bobot sampel (g) 150
Jenis pelarut Kloroform
Volume pelarut (ml) 300
Bobot ekstrak (g) 0.45
Rendemen (%) 0.67
Warna ekstrak (visual) Hijau tua
Bentuk fisik Pasta
Polaritas ekstrak Semipolar
Aktivitas antioksidan (%)* 76.21
Keterangan : * = Agustiningrum (2004)
4.5 Konsentrasi Penghambatan Minimum Aktivitas Ekstrak Kasar Sebagai Inhibitor Topoisomerase I
Penentuan konsentrasi minimum aktivitas senyawa inhibitor topoisomerase I dilakukan dengan melakukan pengenceran ekstrak senyawa aktif dengan konsentrasi 50 µg/ml, 40 µg/ml, dan 30 µg/ml. Hasil uji inhibitor enzim topoisomerase I dari ekstrak kloroform dengan berbagai konsentrasi dapat dilihat pada Tabel 8.
Tabel 8 Hasil uji inhibitor enzim topoisomerase I dari ekstrak kloroform pada berbagai konsentrasi
Ekstrak Konsentrasi µg/ml Aktivitas Inhibitor Topoisomerase I
50 + 40 - Kloroform
1 2 3 4 5 6 7 8
Keterangan : 1. Relaks DNA hasil reaksi (Topo I + DNA), 2. Marker DNA supercoil, 3. Relaks DNA hasil reaksi (Topo I + DNA + DMSO), 4. Marker DNA relaks, 5. Topo I + DNA + kamptotekin, 6. ekstrak 50 µg/ml, 7. ekstrak 40 µg/ml, 8. ekstrak 30 µg/ml.
Gambar 17. Hasil elektroforesis uji inhibitor enzim topoisomerase I dari ekstrak kloroform pada berbagai konsentrasi.
Nilai MIC merupakan dosis atau konsentrasi terkecil dari suatu bahan aktif yang masih memiliki aktivitas menghambat kerja suatu enzim dalam hal ini menghambat enzim topoisomorase I. Hasil uji konsentrasi penghambatan minimum aktivitas ekstrak kasar sebagai inhibitor topoisomerase I menunjukkan bahwa ekstrak kloroform daun katang-katang memiliki nilai MIC sebesar 50 µg/µl seperti disajikan pada Gambar 17. Pada sumur no 6 terlihat tidak terbentuk relaks DNA yang artinya ekstrak kloroform dengan konsentrasi 50 µg/ml memiliki aktivitas inhibitor topoisomerase I secara katalitik. Pada konsentrasi di bawah 50 µg/ml ekstrak tidak memiliki aktivitas inhibitor topoisomerase I karena pada sumur no 7 dan 8 terbentuk relaks DNA seperti pada kontrol (sumur no 4) (marker DNA linear/open circular).
35
4.6 Genotoksisitas Ekstrak Kloroform dari Daun Katang-katang
Uji genotoksisitas merupakan salah satu cara untuk melihat kerusakan genetik (genotoksisitas, mutagenisitas) pada organisme dan untuk menentukan apakah dapat diteruskan dengan uji pada manusia (Sukandar 2006). Hasil penyegaran bakteri S. marcescens dapat dilihat pada Gambar 18.
Gambar 18. Bakteri Serratia marcescens (Dokumentasi pribadi)
Gambar 19. Hasil uji genotoksisitas bakteri Serratia marcescens. Keterangan : A = 0 μg/ml D = 2000 μg/ml G = 40 000 μg/ml
B = 20 μg/ml E = 20 000 μg/ml H = 50 000 μg/ml C = 200 μg/ml F = 30 000 μg/ml
Hasil pengujian genotoksisitas ekstrak klorofom katang-katang dengan konsentrasi 20, 200, 2000, 20 000, 30 000 μg/ml terhadap bakteri S. marcescens menunjukkan bahwa bakteri tetap tumbuh dan tetap memproduksi pigmen prodigiosin. Hal ini menunjukkan ekstrak kloroform tidak mempengaruhi pertumbuhan bakteri secara genetik (mutasi gen), karena bakteri S. marcescens tetap memproduksi pigmen berwarna merah. Pada konsentrasi 40 000 μg/ml bakteri tumbuh namun tidak berkembang dengan baik dan sebagian koloni ada yang berwarna putih dan transparan (mutasi genetik), hal ini dikarenakan pada konsentrasi tersebut ekstrak diduga mempengaruhi produksi pigmen prodigiosin. Sebaliknya pada konsentrasi 50 000 μg/ml bakteri tidak dapat tumbuh, hal ini diasumsikan bahwa ekstrak kloroform dengan konsentrasi 50 000 μg/ml sudah
A B C
D E F
37
bersifat racun terhadap bakteri (sitotoksik). Dari hasil uji genotoksisitas dapat disimpulkan bahwa nilai MIC untuk uji genotoksisitas adalah 40 000 μg/ml.
4.7 Fraksi Senyawa Inhibitor Topoisomerase I
Fraksinasi dilakukan terhadap ekstrak kasar katang-katang yang telah melewati pengujian aktivitas inhibitor topoisomerase dan uji genotoksisitas dalam hal ini adalah ekstrak kloroform. Fraksinasi bertujuan memisahkan ekstrak daun katang-katang terpilih menjadi fraksi-fraksi yang berbeda tingkat polaritasnya. Fraksinasi dilakukan dengan melakukan KLT untuk mencari jenis eluen yang sesuai yang akan digunakan untuk Kromatografi Kolom.
4.7.1 Fraksi dari kromatografi lapis tipis (KLT)
Fraksinasi dengan KLT bertujuan memisahkan ekstrak daun katang-katang menjadi fraksi-fraksi yang berbeda tingkat polaritasnya, sehingga perlu memilih jenis pelarut yang memiliki tingkat polaritas yang sesuai dengan komponen yang ada dalam ekstrak yang akan difraksinasi.
Hasil KLT ekstrak kloroform dengan eluen toluena : etil asetat (7 : 3) dapat dilihat pada Gambar 20. Pengamatan dengan sinar UV pada panjang gelombang 365 nm menghasilkan fraksi dengan nilai Rf seperti tercantum pada Tabel 9.
Tabel 9 Nilai Rf, warna spot secara visual dan warna di bawah UV ekstrak kloroform dengan eluen toluena : etil asetat (7 : 3)
Fraksi Rf Warna visual Warna UV ( =365)
1 0.95 Kuning Kuning
2 0.83 Hijau tua Merah tua
3 0.72 Kuning muda Merah muda
4 0.43 Hijau Merah muda
5 0.38 Kuning Biru pendar
Gambar 20. Spot hasil KLT ekstrak kloroform dengan eluen toluena : etil asetat (7 : 3).
Berdasarkan Gambar 20 dapat dilihat bahwa spot hasil KLT ekstrak kloroform dengan perbandingan eluen toluena : etil asetat (7 : 3) memiliki 6 spot/fraksi dengan warna berbeda dan memisah hampir sempurna. Oleh karena itu kombinasi pelarut ini digunakan untuk memfraksinasi ekstrak kloroform pada kromatografi kolom.
Spot hasil KLT yang diamati secara visual dan menggunakan UV pada panjang gelombang 365 nm memiliki warna yang berbeda, dimana warna hijau secara visual menunjukkan warna merah pada pengamatan UV. Warna hijau pada pengamatan visual tersebut diduga adalah klorofil. Hal ini diperkuat oleh pernyataan Harborne (1987) yaitu warna hijau klorofil bila diamati di bawah sinar UV akan menjadi warna merah (fluoresensi merah).
4.7.2 Fraksi dari kromatografi kolom
39
Gambar 21. Hasil tampungan fraksi ekstrak kloroform.
Setelah mendapatkan ekstrak hasil kromatografi kolom maka dilanjutkan dengan penotolan pada kromatografi lapis tipis. Hasil penotolan menunjukan bahwa ada sembilan fraksi hasil kromatografi kolom dengan eluen 7 : 3 (toluena : etil asetat). Dari kesembilan fraksi hanya dua fraksi yang memiliki satu noda (spot) yang artinya ekstrak tersebut diduga sudah mengandung senyawa tunggal, sedangkan sisa fraksi masih memiliki beberapa noda (spot) yang artinya masih ada beberapa senyawa yang belum terpisahkan. Hasil penotolan dari kromatografi kolom dapat dilihat pada Tabel 10 dan Gambar 22.
Tabel 10 Hasil penotolan fraksi kromatografi kolom dengan eluen 7 : 3 (toluena : etil asetat)
41
20 19 18 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
30 29 28 27 26 25 24 23 22 21 Keterangan : 1 = F1 11-17 = F4 24 = F7
2-7 = F2 18-20 = F5 25-26 = F8 8-10 = F3 21-23 = F6 27-30 = F9
Gambar 22. Komponen senyawa dalam fraksi dari kromatografi kolom.
4.7.3 Identitas fraksi I dengan GCMS
Hasil kromatogram GC-MS (Gambar 23) memperlihatkan adanya satu puncak dengan waktu retensi sebesar 16.050 menit, yang artinya fraksi 1 (F1) diduga merupakan senyawa tunggal, dengan pola fragmentasi m/z adalah 43; 57; 71; 84; 104; 113; 132; 149; 167; 168, dengan puncak dasar 149. Berdasarkan kemiripan yang mencapai 97% dengan data base yang ada pada alat GCMS (WILEY.LIB) komponen tersebut diduga dietilheksil ester benzendikarboksilat (Gambar 24) dengan berat molekul 390. Hasil GCMS dapat dilihat pada Gambar 25.
Gambar 23. GC-Kromatogram fraksi 1 (F1) ekstrak kloroform daun katang-katang.
43
Hasil penelitian sebelumnya yang dilakukan oleh Agustiningrum (2004), menduga daun katang-katang mengandung tiga kelompok fraksi yaitu antrakuinon, kumarin, dan furanokumarin. Ketiga kelompok fraksi yang diduga oleh Agustiningrum (2004) dan memiliki nilai Rf (0.96) sama dengan hasil penelitian ini adalah fraksi antrakuinon. Perlakuan yang tidak tepat misalnya kondisi dan lama penyimpanan mengakibatkan tumbuhnya jamur dan mikroba sehingga terjadi degradasi dari senyawa tersebut. Selain itu suhu proses uji GC-MS yang tidak sesuai, menyebabkan terjadinya penguraian/degradasi atau pemutusan satu ikatan atau lebih pada ion molekul dan terbentuk ion fragmen baru (Sudjadi 1983).
Hasil dugaan analisis GC-MS pada penelitian ini yang diberikan oleh data komputer dengan library WILEY yaitu dietilheksil ester benzendikarboksilat diduga senyawa hasil penguraian/degradasi senyawa kelompok antrakuinon (Gambar 26) yang disebabkan oleh aktivitas mikroba pada saat penyimpanan atau senyawa sesungguhnya yang terdegradasi oleh panas karena proses GC-MS. Dugaan ini berdasarkan adanya dua gugus karboksil yang terikat langsung dengan cincin aromatik pada senyawa dietilheksil ester benzendikarboksilat.
Antrakuinon merupakan golongan pigmen kuinon yang masuk ke dalam senyawa fenolik. Senyawa fenolik alam telah banyak diketahui, salah satunya adalah flavonoid yang merupakan golongan terbesar dibandingkan dengan senyawa golongan lignin, melanin, dan tanin (Harborne 1987). Berdasarkan hasil dan pembahasan sub bab 4.3 dan sub bab 4.3.2, diduga senyawa kelompok antrakuinon dalam penelitian ini merupakan senyawa fenolik yang masuk dalam golongan senyawa flavonoid.
C
G am bar 25. S truktur A ntrakuinon
Gambar 26. Hasil Uji GCMS fraksi 1 (F1) ekstrak kloroform daun katang-katang.
Dalam penelitian Haswirna (2006) senyawa dietilheksil ester benzendikarboksilat terdapat dalam fraksi etil asetat 3 dan dilaporkan memiliki aktivitas antibakteri. Berbagai literatur yang diperoleh menunjukkan bahwa senyawa dietilheksil ester benzendikarboksilat dapat menghambat perkembangan tumor, hal ini telah dibuktikan pada percobaan terhadap tikus selama 77 minggu (U.S. EPA 1995 dalam Haswirna 2006). Sedangkan senyawa kelompok antrakuinon merupakan antioksidan karena mampu memutuskan rantai pembentukan radikal bebas, selain itu antrakuinon juga memiliki aktivitas antivirus (Pokorny et al. 2001 dan Sydiskis 1991 dalam Agustiningrum 2004).
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian menunjukkan rendemen ekstrak terbanyak dari daun katang-katang adalah ekstrak metanol yaitu 2.89%. Uji fitokimia kelima ekstrak menunjukkan adanya kandungan senyawa golongan alkaloid, flavonoid, sedangkan senyawa tanin hanya terdapat pada ekstrak metanol. Keempat ekstrak terpilih memiliki aktivitas inhibitor enzim topoisomerase I, dengan nilai MIC
ekstrak kloroform sebesar 50 µg/ml.
Uji genotoksisitas ekstrak kloroform bersifat genotoksik terhadap bakteri Serratia marcesscen pada konsentrasi 40 000 µg/ml, sehingga ekstrak kasar diharapkan tidak berbahaya apabila digunakan sebagai obat atau bahan dasar di bidang farmasi.
Hasil kromatografi lapis tipis ekstrak kloroform terpisah menjadi 6 fraksi, namun pada proses kromatografi kolom didapat dua fraksi yang terpisahkan dengan sempurna. Hasil dugaan analisis GC-MS pada penelitian ini yang diberikan oleh data komputer dengan library WILEY yaitu dietilheksil ester benzendikarboksilat yang diduga senyawa hasil penguraian/degradasi senyawa
kelompok antrakuinon.
5.2 Saran
Perlu dilakukan uji inhibitor topoisomerase I dari fraksi murni serta pemurnian yang sempurna dan penentuan struktur kimia menggunakan parameter LC-MS, IR, UV, dan NMR agar dapat mengetahui jenis senyawa struktur kimia
Achmad SA. 1986. Kimia Organik Bahan Alam. Jakarta; Depdikbud Universitas Terbuka.
Achmadi SS. 1992. Teknik Kimia Organik. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Jurusan Kimia, Institut Pertanian Bogor.
Agustiningrum D. 2004. Isolasi dan uji aktifitas antioksidan senyawa bioaktif dari daun Ipomoea pes-caprae [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Anonim 2007. Penicillin löst die Bakterien auf Bakterienwachstum. Bakterienkolonien auf Agarplatten. http://www.univie.ac.at/hygiene-aktuell/sem.jpg.
Anita Y. 2005. Genotoksisitas resin akrilik jenis rapid heat cured dengan lama kuring berbeda. Research Report dari JIPTUNAIR / 2005-04-29 10:18:49 Faculty of Dentistry Airlangga University. Email: library@lib.unair.ac.id; library@unair.ac.id.
Backer CA, Van Den Brink Jr RCB. 1963. Flora of Java. Vol 1, Netherlands: Auspices of the Rusksherbarium, NVP Noordhoff-Groningen.
[BPPT] Badan Pusat Penelitian Tanaman, Tanaman obat Indonesia. 2005. Tapak Kuda (Ipomoea pes-caprae (L.) Sweet). http://www.IPTEKnet. html [20 Maret 2006].
Brutlag D. 2000. DNA Topoisomerase. Biochemistry 201, Advenced Molecular Biology. [Januari 7, 2000].
Darusman LK, D Sajuthi, Komar, Pamungkas. 1995. Naskah Seminar. Ekstraksi Komponen Bioaktif sebagai Obat dari Kerang-kerangan, Bunga Karang dan Ganggang Laut di Perairan Pulau Pari Kepulauam seribu. Buletin Kimia. Bogor. FMIPA. IPB.
Devall, M.S. 1992. The biological flora of coastal dunes and wetlands. 2. Ipomoea pes-caprae (L.) Roth. Journal of Coastal Research 8(2): 442-456
Dorland, Newman W.A. 2000. Dorland’s illustrated medical dictionary. Philadelphia: Pennsylvania. W.B. Saunders Company.
Edward F. 1999. Ipomoea pes-caprae. University of Florida. Cooperative Extension Service. Institute of Food and Agricultural Sciences.