AKTIVITAS ANTIFUNGI EKSTRAK DAUN SIRIH HIJAU
(
Piper betle
L.) TERHADAP
Candida tropicalis
PUJI RAHMADANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antifungi Ekstrak Daun Sirih Hijau (Piper betle L.) Terhadap Candida tropicalis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
ABSTRAK
PUJI RAHMADANI. Aktivitas Antifungi Ekstrak Daun Sirih Hijau (Piper betle L.) Terhadap Candida tropicalis. Dibimbing oleh SYAEFUDIN dan MARIA BINTANG.
Daun sirih (Piper betle L.) merupakan tanaman obat yang banyak digunakan dalam mengobati berbagai penyakit, termasuk kandidiasis vaginalis. Salah satu penyebab kandidiasis vaginalis yaitu Candida tropicalis. Penelitian ini bertujuan untuk menentukan konsentrasi efektif ekstrak daun sirih hijau (Piper betle L.) sebagai anti-kandidiasis (in vitro) terhadap Candida tropicalis. Optimasi konsentrasi efektif menggunakan metode difusi sumur dan analisis senyawa menggunakan GC-MS. Daun sirih hijau diekstraksi menggunakan tiga pelarut yaitu air, etanol 70%, dan aseton. Nilai rendemen ekstrak aseton lebih besar dari ekstrak air dan etanol yaitu 19.64%. Hasil analisis fitokimia diketahui bahwa ekstrak aseton mengandung senyawa saponin, tanin, triterpenoid dan steroid. Uji aktivitas antibakteri menunjukkan adanya daya hambat semua ekstrak pada Candida tropicalis. Berdasarkan hasil penelitian pendahuluan, ekstrak aseton dengan konsentrasi 6.25 mg/mL dipilih sebagai konsentrasi efektif. Komponen kimia ekstrak aseton daun sirih hijau yang berpotensi sebagai anti Candida tropicalis adalah asam benzoat; 2-hexadecen-1-ol, 3,7,11,15-tetrametil dan neofitadiena.
Kata kunci: Piper betle L., Candida tropicalis, Anti-kandidiasis
ABSTRACT
PUJI RAHMADANI. Antifungal Activity of Green Betel Leaf Extract (Piper betle L.) Againts Candida tropicalis. Supervised by SYAEFUDIN and MARIA BINTANG.
Betel leaf (Piper betle L.) is a medicinal plant that is widely used in treating various diseases, including vaginal candidiasis. One of the causes of this disease is Candida tropicalis. The aim of this study was to decide the effective concentration of the green betel leaf extract (Piper betle L.) as an anti-candidiasis (in vitro) against Candida tropicalis. Optimization of the effective concentration used the well diffusion method and analysis of the compounds used GC-MS. Green betel leaves were extracted using three solvents : water, ethanol 70%, and acetone. The percentage yield of acetone extract was greater than the water and the ethanol extracts, that was 19.64 %. From the result of phytochemical analysis, it was known that the acetone extract contains saponins, tannins, triterpenoids and steroids. Antibacterial activity test showed that all extracts have inhibitory effect on Candida tropicalis. Based on research data, acetone extract at 6.25 mg/mL is chosen as the effective concentration. The chemical components of green betel leaf acetone extract that have potential as anti-Candida tropicalis were benzoic acid; 2-hexadecen-1-ol, 3,7,11,15-tetramethyl and neophytadiene.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS ANTIFUNGI EKSTRAK DAUN SIRIH HIJAU
(
Piper betle
L.) TERHADAP
Candida tropicalis
PUJI RAHMADANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Antifungi Ekstrak Daun Sirih Hijau (Piper betle L.) Terhadap Candida tropicalis
Nama : Puji Rahmadani NIM : G84100085
Disetujui oleh
Syaefudin, SSi, MSi Pembimbing I
Prof Dr drh Maria Bintang, MS Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan dengan baik penulisan karya ilmiah dengan judul “Aktivitas Antifungi Ekstrak Daun Sirih Hijau (Piper betle L.) Terhadap Candida tropicalis”. Karya ilmiah ini disusun berdasarkan kegiatan penelitian yang dilaksanakan selama kurang lebih lima bulan yang dimulai pada bulan Desember 2013 sampai April 2014 di Laboratorium Departemen Biokimia FMIPA IPB dan Laboratorium Bakteriologi FKH IPB.
Penulis mengucapkan terima kasih kepada Syaefudin, SSi, MSi dan Prof Dr drh Maria Bintang, MS selaku pembimbing yang telah memberikan bimbingan dan arahan serta motivasi selama penulisan karya tulis ini. Ungkapan terima kasih juga disampaikan kepada orang tua, seluruh keluarga dan sahabat atas doa dan kasih sayangnya. Terima kasih juga penulis sampaikan kepada mahasiswa Biokimia 47, khususnya Nazula, Nita, Dwi, Zia, Rini, Eva, Tuchin, Eni, Anes, Lia, Ukdiah, Natasya, dan Safirah yang banyak membantu selama penulisan karya ilmiah ini. Di samping itu, penghargaan penulis sampaikan kepada Bapak Agus dari Laboratorium Bakteriologi bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan dan laboran Biokimia yang telah membantu selama pengumpulan data. Semoga tulisan ini dapat berguna bagi penulis maupun semua pihak demi kemajuan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN 6
Hasil 6
Pembahasan 10
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1 Kadar air dan kadar abu simplisia daun sirih hijau 6
2 Uji fitokimia daun sirih hijau 7
DAFTAR GAMBAR
1 Rendemen ekstrak sirih hijau 6
2 Uji KHTM ekstrak air daun sirih hijau terhadap Candida tropicalis 7 3 Zona hambat ekstrak air daun sirih hijau terhadap Candida tropicalis 8 4 Uji KHTM ekstrak etanol 70% daun sirih hijau terhadap Candida
tropicalis 8
5 Zona hambat ekstrak etanol 70% daun sirih hijau terhadap Candida
tropicalis 9
6 Uji KHTM ekstrak aseton daun sirih hijau terhadap Candida tropicalis 9 7 Zona hambat ekstrak aseton daun sirih hijau terhadap Candida
tropicalis 10
8 Komponen ekstrak aseton daun sirih hijau dengan GC-MS 10
DAFTAR LAMPIRAN
1 Tahapan penelitian 21
2 Kadar air serbuk daun sirih 21
3 Kadar abu serbuk daun sirih 22
4 Rendemen daun sirih hijau 22
5 Uji fitokimia daun sirih hijau 23
6 Uji KHTM ekstrak air daun sirih hijau terhadap Candida tropicalis 24 7 Uji ANOVA nilai KHTM ekstrak air daun sirih hijau terhadap Candida
tropicalis 24
8 Uji Tukey pada nilai KHTM ekstrak air daun sirih hijau terhadap
Candida tropicalis 24
9 Uji KHTM ekstrak etanol 70% daun sirih hijau terhadap Candida
tropicalis 25
10Uji ANOVA nilai KHTM ekstrak etanol 70% daun sirih hijau terhadap
Candida tropicalis 25
11Uji Tukey pada nilai KHTM ekstrak etanol 70% daun sirih hijau
terhadap Candida tropicalis 25
12Uji KHTM ekstrak aseton daun sirih hijau terhadap Candida tropicalis 26 13Uji ANOVA nilai KHTM ekstrak aseton daun sirih hijau terhadap
Candida tropicalis 26
14Uji Tukey pada nilai KHTM ekstrak aseton daun sirih hijau terhadap
Candida tropicalis 26
PENDAHULUAN
Organ reproduksi merupakan salah satu organ tubuh yang sensitif terhadap serangan penyakit. Salah satu penyakit pada organ reproduksi adalah keputihan. Keputihan dapat terjadi pada perempuan dan laki-laki, dimana sebagian besar dialami oleh wanita (Mohammadi 2013). Wanita dewasa sebanyak lebih dari 70-75% pernah mengalami keputihan sepanjang siklus hidupnya, dimana 40-50% dari 70-75% tersebut mengalami infeksi berulang dua kali atau lebih (Sobel 2008).
Keputihan berdasarkan penyebabnya terdiri atas dua keadaan yaitu fisiologis dan patologis. Keputihan dalam keadaan normal tidak berpotensi mengganggu, lendir vagina berbentuk cairan bening dan tidak berbau, jumlah sedikit dan tanpa rasa gatal. Keputihan dalam keadaan patologis berpotensi mengganggu, lendir vagina berbentuk cairan bewarna dan berbau, jumlah banyak dan timbul rasa gatal atau nyeri. Kasus keputihan terbanyak saat ini yaitu kandidiasis vagina (Sobel 2008).
Kandidiasis vagina merupakan infeksi yang disebabkan oleh jamur Candida yaitu Candida albicans dan non-Candida albicans. Candida albicans merupakan mikroorganisme penyebab utama kandidiasis, sedangkan non-Candida albicans seperti Candida glabrata, Candida tropicalis, Candida kefyr, Candida krusei, Candida orthopsilosis, Candida guilliermondii dan Candida parapsilosis ditemukan dalam jumlah sedikit (Mohammadi 2013). Meskipun non-Candida albicans ditemukan dalam jumlah sedikit, presentasi infeksi Candida ini di Indonesia meningkat pada tahun 2004 dan 2005 yaitu mencapai jumlah 41.18% (Ervianti et al. 2011).
Upaya pengobatan kandidiasis dapat dilakukan dengan menggunakan obat-obat antifungi sintetik yang secara komersil telah dikenal dan diandalkan dalam penanggulangan penyakit. Obat-obat antifungi sintetik tersebut seperti amfoterisin, griseofulvin, nistatin dan ketokonazol (Gholib 2009). Pemakaian obat sintetis dapat menimbulkan efek negatif seperti kemandulan dan ketidakteraturan siklus menstruasi. Salah satu upaya pemecahan masalah tersebut adalah dengan mencari alternatif obat dari tanaman yang dapat mengobati kandidiasis tanpa membawa efek negatif. Penghambatan pertumbuhan Candida oleh ekstrak tanaman diduga disebabkan oleh komponen bioaktif yang dimiliki seperti flavonoid, saponin dan alkaloid (Bidarigh et al. 2011) sehingga diduga daun sirih hijau dapat dijadikan pula sebagai obat alami kandidiasis.
2
METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah daun sirih hijau (Piper betle L.) segar yang diperoleh dari wilayah Dramaga, Bogor. Bahan untuk ekstraksi terdiri dari tiga pelarut yaitu akuades, etanol 70%, dan aseton. Bahan analisis fitokimia berupa akuades, kloroform, amoniak, H2SO4 2M, pereaksi
Dragendorf, pereaksi Meyer, pereaksi Wagner, metanol, FeCl3 1%, etanol 30%, eter dan asam asetat anhidrat. Kultur yang digunakan dalam uji anti-Candida adalah khamir Candida tropicalis INACC Y53 yang diperoleh dari koleksi Bidang Mikrobiologi, Puslit Biologi, LIPI. Bahan pengujian anti Candida tropicalis berupa akuades steril, serbuk PDA, DMSO, Nistatin, serta beberapa konsentrasi ekstrak akuades, ekstrak etanol 70%, dan ekstrak aseton.
Alat-alat yang digunakan pada penelitian ini antara lain gelas piala, gelas ukur, labu Erlenmeyer, cawan Petri, ose, oven, tanur, neraca analitik, cawan porselen, desikator, gegep kayu, sudip, kertas saring, alumunium foil, shaker, pompa vakum, corong, rotary evaporator, autoklaf, pipet mikro dan GC-MS (Irwan 2011; Purwatresna 2012). Pembuatan sediaan daun sirih kering meliputi proses sortasi, pengeringan daun sirih, dan penggilingan daun hingga berbentuk serbuk. Proses sortasi diawali dengan daun sirih yang telah dipetik, dibersihkan dari kotoran yang menempel, kemudian dicuci sampai tidak ada lagi kotoran yang menempel dan ditiriskan. Daun sirih diangin-anginkan pada suhu ruang, kemudian dikeringkan dalam oven dengan suhu 50oC sampai diperoleh kadar air ≤ 10%. Daun sirih yang telah kering selanjutnya dihaluskan sampai diperoleh serbuk daun sirih kering berukuran 100 mesh.
Analisis Kadar Air (AOAC 2005)
Cawan porselen dikeringkan dalam oven bersuhu 105oC selama 30 menit, didinginkan dalam eksikator dan ditimbang bobotnya. Sebanyak dua gram sampel dimasukkan ke dalam cawan porselen, kemudian dimasukkan ke dalam oven bersuhu 105oC selama 3 jam. Cawan beserta isinya diangkat dan didinginkan dalam desikator dan ditimbang bobotnya. Prosedur ini dilakukan hingga diperoleh bobot yang tetap. Pekerjaan dilakukan triplo. Kadar air dihitung dengan rumus sebagai berikut:
Kadar air (%) = - - Keterangan:
A = Berat cawan dan sampel setelah dikeringkan (gram) B = Berat sampel awal (gram)
3
Analisis Kadar Abu (AOAC 2005)
Penentuan kadar abu menggunakan metode gravimetri. Cawan porselen yang bersih dan kering dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam eksikator, cawan ditimbang. Sebanyak 2 gram sampel dimasukkan ke dalam cawan dan dipanaskan sampai tidak berasap lagi, kemudian dibakar dalam tanur dengan suhu 600oC selama 6 jam. Pemanasan sampai diperoleh abu berwarna putih keabu-abuan dan memiliki bobot konstan. Abu beserta cawan didinginkan dalam desikator, kemudian ditimbang. Pekerjaan dilakukan dengan cara triplo. Kadar abu dapat dihitung dengan persamaan:
Kadar abu (%) = -
- x 100 %
Keterangan:
A = Bobot cawan kosong (gram)
B = Bobot cawan dan sampel sebelum ditanur (gram) C = Bobot cawan dan sampel setelah ditanur (gram)
Ekstraksi Daun Sirih Hijau
Ekstraksi Etanol 70% dan Aseton (BPOM 2004). Serbuk daun sirih hijau diekstraksi dengan metode yang mengacu pada Badan Pengawas Obat dan Makanan atau BPOM (2004) yaitu maserasi. Maserasi dengan etanol 70% dilakukan dengan merendam sampel dalam pelarut etanol 70% dengan perbandingan 1:10. Maserasi dilakukan selama 24 jam sambil digoyang pada kecepatan 135 rpm. Filtrat yang diperoleh dipisahkan dari residu menggunakan kertas saring. Residu direndam kembali dengan etanol melalui prosedur yang sama, hingga diperoleh proses ekstraksi sebanyak 3 kali. Ekstrak dari 3 kali perendaman digabungkan kemudian dipekatkan menggunakan rotary evaporator dengan suhu 50oC dan disimpan di dalam oven bersuhu 50oC selama 2-3 hari sampai diperoleh sampel ekstrak etanol 70% daun sirih hijau berbentuk pasta. Ekstraksi dilakukan triplo. Maserasi dengan pelarut aseton dilakukan dengan metode yang sama dengan pelarut etanol 70%.
Ekstraksi Air (BPOM 2010). Ekstrak air daun sirih hijau dilakukan dengan metode perebusan serbuk daun sirih kering menggunakan pelarut akuades dengan perbandingan 1:10. Perebusan simplisia daun sirih hijau dilakukan dengan suhu 100oC hingga mendidih. Filtrat yang diperoleh dipisahkan dari residu menggunakan kertas saring. Residu direndam kembali dengan akuades melalui prosedur yang sama, hingga diperoleh proses ekstraksi sebanyak 3 kali. Ekstrak dari 3 kali perendaman digabungkan kemudian dipekatkan menggunakan oven dengan suhu 50oC sampai diperoleh sampel ekstrak akuades daun sirih hijau berbentuk pasta. Ekstraksi dilakukan triplo.
Analisis Fitokimia (Harborne 1987)
Uji fitokimia merupakan uji kualitatif untuk mengetahui kandungan senyawa spesifik dalam ekstrak sampel. Identifikasi yang dilakukan adalah uji alkaloid, triterpenoid, steroid, saponin, flavonoid, dan tanin.
4
dibagi menjadi 3 tabung dan masing-masing tabung ditambahkan dengan pereaksi Dragendorf, Meyer, dan Wagner. Sampel positif mengandung alkaloid ditandai dengan terbentuknya endapan putih untuk pereaksi Mayer, endapan merah untuk pereaksi Dragendorf, dan endapan coklat untuk pereaksi Wagner.
Uji Flavonoid. Sebanyak 0.05 gram sampel dimasukkan ke dalam tabung reaksi dan ditambahkan dengan 5 mL metanol 30%, kemudian dipanaskan selama 5 menit. Filtrat yang terbentuk ditambahkan 1 tetes H2SO4. Uji positif flavonoid
ditandai dengan munculnya warna merah pada filtrat.
Uji Saponin. Sebanyak 0.05 gram sampel dimasukkan ke dalam tabung reaksi dan ditambah 5 mL akuades, kemudian didihkan selama 5 menit. Larutan disaring dan filtratnya dikocok kuat-kuat. Timbulnya buih yang stabil selama 10 menit setelah pengocokan menunjukkan terdapat saponin.
Uji Tanin. Sebanyak 0.05 gram sampel dimasukkan ke dalam tabung reaksi dan ditambahkan dengan 5 mL akuades, kemudian didihkan selama 5 menit. Larutan selanjutnya disaring, filtrat yang diperoleh ditambahkan dengan 5 tetes FeCl3 1% (b/v). Adanya warna biru tua atau hitam yang terbentuk menunjukkan
adanya tanin.
Uji triterpenoid dan Steroid. Sebanyak 0.05 gram sampel dimasukkan ke dalam tabung reaksi dan ditambah 5 mL etanol 30% lalu dipanaskan selama 5 menit dan disaring. Filtratnya diuapkan lalu ditambah eter. Lapisan eter ditambah pereaksi Lieberman Buchard. Warna merah atau ungu menunjukkan triterpenoid. Warna hijau atau biru menunjukkan steroid.
Pengujian Anti Candida tropicalis
Pembuatan Media Potato Dektrose Agar (PDA). Komposisi media PDA terdiri dari 4 g/L sari kentang, 20 g/L dekstrosa, dan 15 g/L agar. Media PDA dibuat dari 39 gram serbuk PDA dicampurkan dengan 1000 mL akuades dan didihkan sampai larut sempurna, kemudian disterilisasi. Sterilisasi dilakukan dalam autoklaf pada suhu 121oC dengan tekanan 1 atm selama 15 menit. Media PDA untuk peremajaan kultur dimasukkan ke dalam tabung reaksi sebanyak 5 mL. Tabung diletakkan pada posisi miring dengan sudut 150o dan dibiarkan dingin sampai agar-agar memadat. Media PDA untuk pengujian dimasukkan ke dalam cawan petri sebanyak 20 mL dan dibiarkan dingin sampai agar-agar memadat.
Peremajaan Kultur Candida tropicalis (modifikasi Rao et al. 2006).
Biakan murni khamir Candida tropicalis digoreskan dalam media PDA miring dan diinkubasi pada suhu 37oC selama 18-24 jam sampai terbentuk koloni bulat putih dengan latar belakang kekuningan. Biakan Candida tropicalis disimpan dalam ruangan pendingin bersuhu 4oC dan siap digunakan untuk penelitian selanjutnya.
Penyiapan suspensi Candida tropicalis. Tabung reaksi berisi 9 mL larutan klorida steril 0.9% disiapkan sebanyak dua tabung. Koloni Candida tropicalis disuspensikan dalam tabung pertama berisi larutan klorida steril 0.9%, kemudian dibandingkan dengan kepekatan McFarland 3. Suspensi tersebut memiliki konsentrasi 109 CFU/mL. Suspensi diencerkan kembali hingga memiliki konsentrasi akhir sebesar 106 CFU/mL.
5 dilubangi dengan tabung kaca sehingga membentuk tujuh sumur. Ekstrak dengan konsentrasi awal 400 mg/mL diencerkan dengan pengenceran bertingkat menjadi variasi konsentrasi yaitu 200 mg/mL, 100 mg/mL, 50 mg/mL dan 25 mg/mL. Sebanyak 50 µL dari masing-masing konsentrasi tersebut diinjeksikan ke dalam sumur. Kontrol negatif dalam penelitian ini adalah air pada ekstrak air dan DMSO pada ekstrak etanol 70% dan aseton, sedangkan kontrol positif adalah nistatin. Cawan petri diinkubasi pada suhu 37oC selama 18-24 jam. Zona bening yang terbentuk di sekitar sumur menunjukkan uji positif. Zona bening diukur dengan alat jangka sorong secara diagonal dua kali pengukuran, hasil pengukuran dirata-ratakan. Pengujian setiap ekstrak dilakukan sebanyak dua ulangan. Acuan diameter hambat sebesar 1 mm untuk mendapatkan keseragaman uji. Jika zona bening yang terbentuk ˃ mm, maka percobaan diulang kembali dengan menggunakan variasi konsentrasi ekstrak yang dipersempit. Konsentrasi terkecil bahan ekstrak uji yang memberikan hambatan dengan diameter 1 mm merupakan KHTM.
Identifikasi Senyawa dengan GC-MS
Ekstrak aseton daun sirih hijau sebagai ekstrak terbaik yang memiliki konsentrasi penghambatan terkecil dianalisis senyawa yang terkandung dalam ekstrak tersebut dengan GC-MS. Penentuan kandungan ekstrak aseton menggunakan alat GC-MS Shimadzu QP 2010, yang dilengkapi dengan detektor FID yang terhubungkan dengan kolom kapiler Rtx-5MS (panjang kolom 60 m, diameter 0.25 mm) menggunakan helium sebagai gas pembawa (laju alir 0.85 mL/menit). Temperatur injektor sebesar 280oC, temperatur kolom sebesar 50oC dan temperatur pirolisis sebesar 280oC. Interpretasi spektrum massa hasil analisis dilakukan dengan membandingkan spektrum massa pada data Wiley 7.
Analisis Data
Analisis statistik yang digunakan adalah rancangan acak percobaan dua faktor dalam Rancangan Acak Lengkap (RAL). Model rancangannya:
Yijk= µ + αi+ βj+ αβ ij+ εijk
Keterangan:
Yijk = diameter zona hambat pada kosentrasi ke-i, ekstrak ke-j dan ulangan ke-k
µ = pengaruh rataan umum
ε = pengaruh acak pada konsentrasi ke-i, ekstrak ke-j, dan ulangan ke-k
6
HASIL DAN PEMBAHASAN
Hasil
Kadar Air, Kadar Abu dan Rendemen Ekstrak Daun Sirih Hijau
Simplisia daun sirih hijau terlebih dahulu ditentukan kadar air dan kadar abu. Data hasil pengukuran kadar air dan kadar abu rata-rata dari ketiga ulangan sampel dapat dilihat pada Tabel 1. Kadar air simplisia daun sirih hijau pada penelitian ini sebesar 5.99%, nilai kadar air yang didapatkan lebih kecil dari 10%. Kadar abu simplisia daun sirih hijau pada penelitian ini sebesar 10.57%, nilai kadar abu yang didapatkan lebih kecil dari standar Materika Medika Indonesia yaitu 14%.
Tabel 1 Kadar air dan kadar abu simplisia daun sirih hijau
Sampel Kadar Air (%) Kadar Abu (%)
Daun sirih hijau 5.99 ± 0.48 10.57 ± 0.09
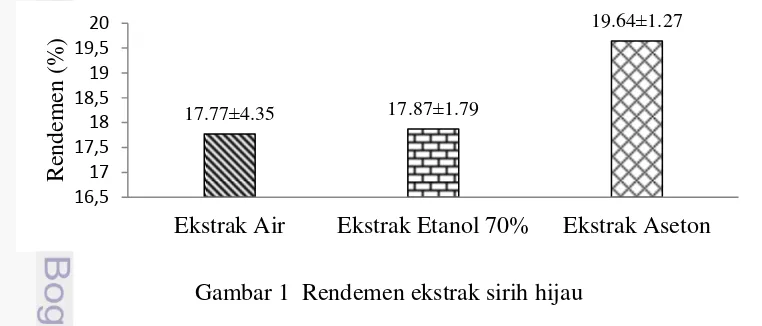
Rendemen ekstrak merupakan bioaktif daun sirih hijau yang terekstrak pada pelarut yang digunakan. Rendemen ekstrak dihitung dengan membagi bobot ekstrak dengan bobot sampel kering. Hasil rendemen ekstrak daun sirih dapat dilihat pada Gambar 1. Rendemen ekstrak daun sirih hijau dengan pelarut aseton tertinggi dibanding ekstrak dengan pelarut air dan etanol 70%. Rendemen ekstrak dengan pelarut air sebesar 17.77%, pelarut etanol 70% sebesar 17.87%, dan pelarut aseton sebesar 19.64%. Hal ini menunjukkan bahwa bioaktif daun sirih hijau terekstrak lebih banyak menggunakan aseton dibandingkan air dan etanol 70%.
Gambar 1 Rendemen ekstrak sirih hijau
Komponen Fitokimia Daun Sirih Hijau
Uji fitokimia meliputi uji alkaloid, flavonoid, saponin, tanin, dan triterpenoid/steroid. Hasil pengujian menunjukkan senyawa alkaloid tidak ditemukan pada pelarut air, etanol 70% dan aseton. Senyawa flavonoid positif terdapat pada ekstrak dengan pelarut air. Senyawa saponin positif terdapat pada semua ekstrak. Senyawa tanin positif pada ekstrak dengan pelarut air dan aseton. Senyawa steroid dan triterpenoid positif terdapat pada ketiga ekstrak (Tabel 2). Hasil positif berdasarkan reaksi warna yang terbentuk dari pereaksi yang digunakan (Lampiran 5).
Ekstrak Air Ekstrak Etanol 70% Ekstrak Aseton
R
ende
men
(%
7 Tabel 2 Uji fitokimia daun sirih hijau
Uji Ekstrak
- tidak mengandung metabolit sekunder + mengandung sedikit metabolit sekunder ++ mengandung banyak metabolit sekunder +++ mengandung banyak sekali metabolit sekunder
Konsentrasi Hambat Tumbuh Minimum Ekstrak Air Daun Sirih Hijau terhadap Candida tropicalis
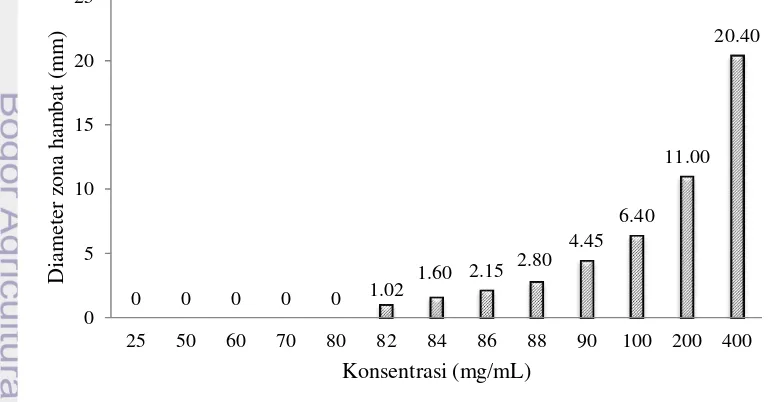
Penetapan KHTM dilakukan dengan metode difusi sumur yaitu menguji sederetan konsentrasi ekstrak yang dibuat dengan cara pengenceran. Ekstrak air diuji dengan variasi konsentrasi 25, 50, 60, 70, 80, 82, 84, 86, 88, 90, 100, 200 dan 400 mg/mL. Hasil pengamatan KHTM ekstrak air daun sirih hijau dapat dilihat pada Gambar 2. Ekstrak air pada konsentrasi 25, 50, 60, 70 dan 80 tidak menunjukkan penghambatan pada pertumbuhan Candida tropicalis. Ekstrak air dapat menghambat pertumbuhan Candida tropicalis pada konsentrasi 82, 84, 86, 88, 90, 100, 200 dan 400 mg/mL yang ditunjukkan dengan terbentuknya daerah zona bening di sekitar sumur (Gambar 3). Semakin besar konsentrasi akan menghasilkan diameter zona hambat yang semakin besar. Nilai KHTM ekstrak akuades sebesar 82 mg/mL dengan rata-rata diameter zona hambat sebesar 1.02 mm.
Gambar 2 Uji KHTM ekstrak air daun sirih hijau terhadap Candida tropicalis
8
Gambar 3 Zona hambat ekstrak air daun sirih hijau terhadap Candida tropicalis: (a) 0 mg/mL; (b) nistatin; (c) 400 mg/mL; (d) 200 mg/mL; (e) 100 mg/mL; (f) 90 mg/mL; (g) 88 mg/mL; (h) 86 mg/mL; (i) 84 mg/mL; (j) 82 mg/mL; (k) 80 mg/mL; (l) 70 g/mL; (m) 60 mg/mL; (n) 50 mg/mL; (o) 25 mg/mL
Konsentrasi Hambat Tumbuh Minimum Ekstrak Etanol Daun Sirih Hijau terhadap Candida tropicalis
9
Gambar 5 Zona hambat ekstrak etanol 70% daun sirih hijau terhadap Candida tropicalis: (a) 0 mg/mL; (b) nistatin; (c) 400 mg/mL; (d) 200 mg/mL; (e) 100 mg/mL; (f) 98 mg/mL; (g) 96 mg/mL; (h) 94 mg/mL; (i) 92 mg/mL; (j) 90 mg/mL; (k) 80 mg/mL; (l) 70 mg/mL; (m) 60 mg/mL; (n) 50 mg/mL; (o) 25 mg/mL
Konsentrasi Hambat Tumbuh Minimum Ekstrak Aseton Daun Sirih Hijau terhadap Candida tropicalis
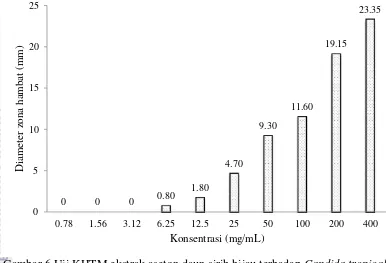
Ekstrak aseton diuji dengan variasi konsentrasi 0.78, 1.56, 3.12, 6.25, 12.5, 25, 50, 100, 200 dan 400 mg/mL. Hasil pengamatan KHTM ekstrak aseton dapat dilihat pada Gambar 6. Ekstrak etanol pada konsentrasi 0.78, 1.56 dan 3.12 mg/mL tidak menunjukkan penghambatan pada pertumbuhan Candida tropicalis. Ekstrak etanol dapat menghambat pertumbuhan Candida tropicalis pada konsentrasi 6.25, 12.5, 25, 50, 100, 200 dan 400 mg/mL yang ditunjukkan dengan terbentuknya daerah zona bening di sekitar sumur (Gambar 7). Semakin besar konsentrasi akan menghasilkan diameter zona hambat yang semakin besar. Nilai KHTM ekstrak aseton sebesar 6.25 mg/mL dengan rata-rata diameter zona hambat sebesar 0.80 mm.
Gambar 6 Uji KHTM ekstrak aseton daun sirih hijau terhadap Candida tropicalis
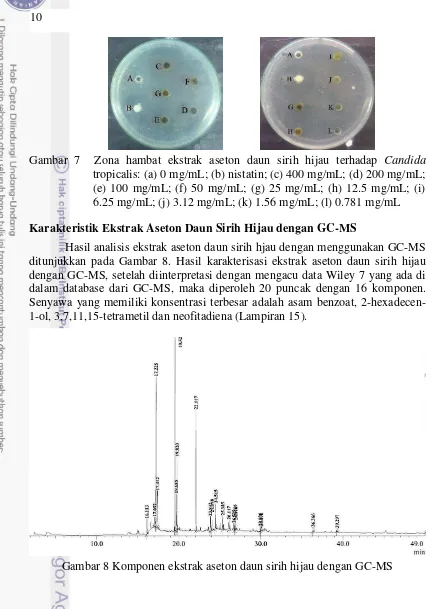
10
Gambar 7 Zona hambat ekstrak aseton daun sirih hijau terhadap Candida tropicalis: (a) 0 mg/mL; (b) nistatin; (c) 400 mg/mL; (d) 200 mg/mL; (e) 100 mg/mL; (f) 50 mg/mL; (g) 25 mg/mL; (h) 12.5 mg/mL; (i) 6.25 mg/mL; (j) 3.12 mg/mL; (k) 1.56 mg/mL; (l) 0.781 mg/mL
Karakteristik Ekstrak Aseton Daun Sirih Hijau dengan GC-MS
Hasil analisis ekstrak aseton daun sirih hjau dengan menggunakan GC-MS ditunjukkan pada Gambar 8. Hasil karakterisasi ekstrak aseton daun sirih hijau dengan GC-MS, setelah diinterpretasi dengan mengacu data Wiley 7 yang ada di dalam database dari GC-MS, maka diperoleh 20 puncak dengan 16 komponen. Senyawa yang memiliki konsentrasi terbesar adalah asam benzoat, 2-hexadecen-1-ol, 3,7,11,15-tetrametil dan neofitadiena (Lampiran 15).
Gambar 8 Komponen ekstrak aseton daun sirih hijau dengan GC-MS
Pembahasan
Kadar Air dan Kadar Abu Simplisia Daun Sirih Hijau
11 perbandingan berat air bebas yang terikat pada membran matriks bahan dengan air yang menguap akibat pemanasan (Winarno 2008).
Kadar air simplisia diperoleh melalui pengeringan. Pengeringan sampel bertujuan untuk menghilangkan sebagian air agar dapat memperpanjang masa simpan suatu bahan, sehingga kemungkinan kerusakan bahan yang terjadi karena mikroba saat penyimpanan sangat kecil. Pengeringan yang tepat akan menghasilkan mutu simplisia yang tahan lama dalam proses penyimpanan serta tidak merubah kandungan bahan aktif yang terdapat dalam simplisia (Manoi 2006).
Kadar air rerata serbuk daun sirih hijau yang diperoleh pada pengujian adalah 5.99% (Tabel 1). Kadar air yang didapatkan sesuai dengan standar yang diberikan oleh Farmakope Herbal Indonesia yaitu dibawah 10% (Depkes 2008). Kadar air dengan nilai kurang dari 10% ini menunjukkan bahwa serbuk daun sirih hijau kering dapat disimpan dalam jangka waktu lama sehingga dapat digunakan untuk penelitian lebih lanjut.
Kadar abu menunjukkan residu dari bahan-bahan anorganik yang tersisa dari suatu sampel yang telah mengalami pembakaran dan biasanya erat kaitannya dengan mineral dari suatu sampel (Arifin 2009). Kadar abu simplisia daun sirih hijau sebesar 10.57% (Tabel 1). Penelitian Puspadewi et al. (2012) menyebutkan kadar abu daun sirih hijau sebesar 12.8% dengan standar dari Materika Medika Indonesia yaitu kurang dari 14%. Hal ini menunjukkan nilai kadar abu yang diperoleh memenuhi persyaratan karena tidak melebihi kadar maksimal.
Rendemen Ekstrak Daun Sirih Hijau
Metode ekstraksi daun sirih hijau yang digunakan pada penelitian ini yaitu maserasi dengan pelarut etanol 70% atau aseton dan ekstraksi cara panas dengan pelarut air. Ekstrak air daun sirih hijau dibuat dengan metode perebusan pada suhu 100oC hingga mendidih. Metode ini dipilih berdasarkan pada kebiasaan masyarakat Indonesia dalam mengonsumsi obat tradisional, yaitu direbus (Dalimartha 2006). Ekstraksi dengan pelarut air dilakukan secara panas bertujuan untuk menghindari kerusakan oleh jamur dikarenakan perendaman dalam air dalam kurun waktu tertentu. Air merupakan salah satu bahan yang diperlukan oleh mikroba untuk dapat hidup, sehingga penggunaan air sebagai pelarut untuk merendam serbuk daun sirih hijau pada suhu ruang rentan terhadap kontaminasi mikroba. Selain itu, perlakuan panas diharapkan meningkatkan interaksi antara air dan komponen bioaktif pada sampel karena air yang telah didihkan mempunyai kalor yang lebih tinggi untuk meningkatkan reaktivitas komponen bioaktif (Kresnawaty dan Zainuddin 2009).
Metode maserasi merupakan teknik ekstraksi yang dilakukan dengan cara merendam sampel dalam pelarut selama waktu tertentu dan dalam suhu ruangan. Pemilihan etanol 70% sebagai pelarut karena sifat etanol sebagai disinfektan sehingga potensi kerusakan oleh jamur selama masa perendaman tergolong kecil. Pemilihan etanol 70% juga berdasarkan peraturan yang dikeluarkan oleh BPOM (2010) mengenai cairan penyari untuk keperluan farmakologi hanya boleh menggunakan air atau etanol.
12
tidak berbeda jauh dengan nilai rendemen etanol lebih besar dibandingkan ekstrak air. Rendemen ekstrak daun sirih hijau dengan pelarut aseton tertinggi dibanding ekstrak dengan pelarut air dan etanol 70%. Berdasarkan nilai kepolarannya, aseton (indeks polaritas 5.1) cenderung kurang polar dibandingkan pelarut etanol 70% (indeks polaritas 5.2) dan air (indeks polaritas 9.0) (Watson 2007). Hal ini menunjukkan bahwa komponen yang terdapat pada daun sirih hijau terekstrak lebih banyak menggunakan pelarut aseton dibandingkan air dan etanol 70%. Kuantitas rendemen ini dapat digunakan untuk pemilihan pelarut yang tepat saat ekstraksi metabolit sekunder yang diharapkan (Kresnawaty dan Zainuddin 2009).
Komponen Fitokimia
Analisis fitokimia bertujuan mengetahui senyawa metabolit yang berpotensi sebagai senyawa antimikroba. Analisis fitokimia yang dilakukan tergolong kualitatif karena hanya dapat mengidentifikasi senyawa aktif suatu ekstrak tanpa mengetahui kadar senyawa aktif tersebut. Senyawa-senyawa yang diuji adalah alkaloid, flavonoid, saponin, tanin, triterpenoid dan steroid.
Hasil uji fitokimia menunjukkan hasil yang berbeda pada ekstrak dengan pelarut yang berbeda. Perbedaan senyawa yang dapat terekstraksi bergantung pada beberapa faktor, salah satunya kepolaran pelarut. Prinsip kelarutan adalah like dissolve like, yaitu senyawa yang polar akan terikat (terekstraksi) oleh pelarut yang polar, begitu juga dengan senyawa non polar akan terikat pada pelarut non polar (Anslyn dan Dougherty 2006). Berdasarkan hasil penelitian (Tabel 2), diperoleh informasi bahwa senyawa alkaloid tidak terdeteksi dalam ekstrak air, etanol 70% dan aseton yang ditandai dengan tidak adanya endapan putih pada pereaksi Meyer, endapan coklat pada pereaksi Wagner, dan endapan merah pada pereaksi Dragendroff. Hal ini sesuai dengan penelitian Puspadewi et al. (2012) yang menyebutkan bahwa senyawa alkaloid tidak terdeteksi pada serbuk simplisia dan ekstrak etanol daun sirih hijau.
Hasil uji fitokimia pada Tabel 2 juga menunjukkan bahwa komponen flavonoid hanya terdapat ekstrak dengan pelarut air ditandai dengan terbentuknya filtrat yang bewarna merah kecoklatan. Senyawa saponin positif pada ketiga ekstrak ditandai dengan terbentuknya buih atau busa yang stabil. Senyawa tanin positif pada ekstrak dengan pelarut air dan aseton ditandai dengan terbentuknya filtrat hitam kehijauan. Senyawa steroid dan triterpenoid positif terdapat pada ketiga ekstrak yang ditandai dengan terbentuknya lapisan hijau pada steroid dan lapisan ungu pada triterpenoid.
Penelitian Puspadewi et al. (2012) menunjukkan bahwa ekstrak etanol daun sirih hijau hanya mengandung senyawa tanin, steroid/triterpenoid, dan flavonoid. Penelitian lainnya menunjukkan bahwa ekstrak air dan etanol mengandung senyawa flavonoid, tanin, saponin dan steroid/triterpenoid (Serlahwaty 2011). Hasil uji fitokimia pada ekstrak etanol (Tabel 2) jika dibandingan dengan data fitokimia yang telah dilakukan oleh Puspadewi et al. (2012) dan Serlahwaty (2011) menunjukkan perbedaan kandungan senyawa pada daun sirih hijau. Hal ini dapat disebabkan karena adanya asal tanaman, letak geografis, umur tanaman dan proses ekstraksi sehingga komponen metabolit sekunder yang terkandung dalam masing-masing sampel juga berbeda (Kusumaningtyas et al. 2008).
13 dengan air. Saponin tersebar luas pada tanaman tingkat tinggi dan telah dideteksi pada 70 keluarga tanaman (Daniel 2006). Saponin ditemukan sebagai antimikroba di alam. Saponin juga memiliki fungsi aktivitas biologi seperti antikanker, antiinflamasi dan antijamur (Kalaisezhiyen dan Sasikumar 2012; Senthilkumar dan Vijayakumari 2013). Mekanisme saponin sebagai antifungi yaitu adanya pembentukan kompleks antara saponin dengan sterol pada membran plasma fungi, kemudian menghancurkan sel semipermeabel dan menyebabkan kematian pada sel fungi (Hoffmann 2003).
Tanin adalah senyawa polifenol yang bersifat asam dengan rasa sepat. Tanin dapat ditemukan dalam banyak tumbuhan dan tersebar di berbagai organ tanaman seperti batang, daun dan buah. Tanin bersifat antibakteri dan antijamur. Tanin sebagai antifungi berkontribusi banyak pada tanaman untuk menyerang fungi dan mikroorganisme lain (Daniel 2006). Mekanisme tanin sebagai antijamur yaitu menghambat sintesis khitin yang digunakan untuk pembentukan dinding sel pada fungi dan merusak membran sel sehingga pembentukan fungi terhambat (Watson dan Preedy 2007).
Senyawa-senyawa golongan triterpenoid dan steroid diketahui memiliki aktifitas fisiologi tertentu, seperti antijamur, antibakteri, antivirus, kerusakan hati, gangguan menstruasi dan mengatasi penyakit diabetes. Aktivitas antimikroba dari terpenoid melalui cara mengganggu pertumbuhan dan perkembangan spora jamur akibat sifat toksik yang dimiliki senyawa triterpenoid (Ismaini 2011).
KHTM Ekstrak Daun Sirih Hijau pada Candida tropicalis
Uji aktivitas antimikroba dalam penelitian ini menggunakan metode difusi. Metode difusi dilakukan dengan mengukur diameter zona bening yang merupakan petunjuk adanya respon penghambatan pertumbuhan mikroba oleh suatu senyawa antimikroba dalam ekstrak (Hermawan et al. 2007). Metode difusi dapat dilakukan dengan dua cara yaitu metode sumur dan metode cakram kertas. Metode sumuran yaitu membuat lubang pada agar padat yang telah diinokulasi dengan kultur. Jumlah dan letak lubang disesuaikan dengan variasi konsentrasi, kemudian ekstrak yang akan diuji diinjeksikan ke dalam lubang. Setelah dilakukan inkubasi, pertumbuhan mikroba diamati untuk melihat ada tidaknya daerah hambatan di sekeliling lubang bewarna bening (Kusmiyati dan Agustini 2007).
Konsentrasi minimum yang dibutuhkan untuk menghambat mikroorganisme dikenal sebagai konsentrasi hambat tumbuh minimum (KHTM). Suatu antikandidiasis dikatakan memiliki aktivitas bila KHTM terjadi pada konsentrasi terendah suatu ekstrak tetapi mempunyai daya hambat terhadap Candida. Hasil uji terhadap ketiga jenis ekstrak menunjukkan semua ekstrak berpotensi sebagai antikandidiasis, khususnya kandidiasis yang disebabkan oleh Candida tropicalis. Kemampuan sebagai antikandidiasis ditunjukkan dengan adanya zona bening yang tidak ditumbuhi Candida tropicalis. Aktivitas anti Candida tropicalis akan memberikan diameter zona hambat yang besar pada konsentrasi yang tinggi dan sebaliknya. Pelarut dan variasi konsentrasi yang digunakan menghasilkan aktivitas anti Candida tropicalis yang berbeda-beda.
14
Soemiati dan Elya (2002) menyebutkan bahwa ekstrak air daun sirih dapat menghambat pertumbuhan Candida albicans pada konsentrasi 62.5 mg/mL. Hal ini menunjukkan bahwa konsentrasi ekstrak air untuk menghambat Candida tropicalis lebih besar dibandingkan pada Candida albicans.
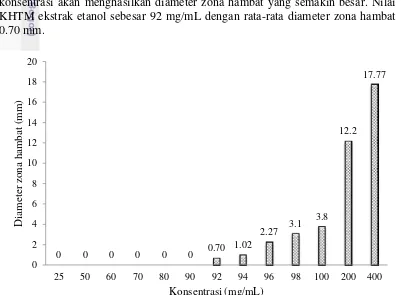
Ekstrak etanol dapat menghambat Candida tropicalis pada konsentrasi 400, 200, 100, 98, 96, 94 dan 92 mg/mL (Gambar 4). Nilai KHTM ekstrak etanol yaitu pada konsentrasi 92 mg/mL dengan diameter zona hambat 0.70 mm. Penelitian Nanayakkara et al. (2011) menyebutkan bahwa ekstrak etanol dapat menghambat Candida albicans pada konsentrasi 1.6 mg/mL. Hal ini menunjukkan bahwa konsentrasi ekstrak etanol untuk menghambat Candida tropicalis lebih besar dibandingkan pada Candida albicans.
Ekstrak aseton merupakan ekstrak yang efektif sebagai anti Candida tropicalis dibanding ekstrak air dan etanol. Ekstrak aseton dapat menghambat pertumbuhan Candida tropicalis pada konsentrasi 400, 200, 100, 50, 25, 12.5 dan 6.25 mg/mL (Gambar 6). Nilai KHTM ekstrak aseton yaitu pada konsentrasi 6.25 mg/mL dengan diameter zona hambat 0.8 mm.
Tingkat kekuatan antikandidiasis ekstrak daun sirih hijau dalam menghambat pertumbuhan Candida tropicalis ditentukan dari ukuran diameter zona hambat. Daya hambat tergolong sangat kuat (>20 mm), kuat (10-20 mm), sedang (5-10 mm) dan lemah (<5 mm) (Yadav dan Bishe 2004). Zona hambat yang terbentuk pada ekstrak aseton sebesar 0.8 mm menunjukkan daya hambat yang tergolong lemah dalam menghambat pertumbuhan Candida tropicalis. Nistatin yang berperan sebagai kontrol positif memberikan daya penghambatan yang tergolong kuat dengan diameter 15-20 mm terhadap Candida tropicalis.
nalisis statistika menggunakan NOV α = . 5 menunjukkan bahwa masing-masing konsentrasi pada masing-masing ekstrak memiliki diameter zona hambat yang berbeda nyata (nilai P<0.05). Artinya terdapat perbedaan aktivitas satu konsentrasi dengan konsentrasi lainnya mengakibatkan perbedaan nyata dalam mempengaruhi pertumbuhan Candida tropicalis. Uji perbandingan ganda (Tukey) menunjukkan bahwa semakin tinggi konsentrasi ekstrak daun sirih maka akan semakin besar kemampuan ekstrak ini dalam menghambat pertumbuhan Candida tropicalis.
Tanaman yang berpotensi sebagai antikandidiasis selain daun sirih hijau adalah daun tespong (Oenanthe javanica). Tanaman ini berkhasiat sebagai antikandidiasis yang disebabkan oleh Candida albicans, sedangkan penelitian antikandidiasis terhadap Candida tropicalis masih terbatas pada tanaman daun sirih hijau. Penelitian terhadap ekstrak etanol daun tespong menunjukkan bahwa nilai KHTM terhadap Candida albicans yaitu pada konsentrasi 60 mg/mL (Rostinawati 2010). Nilai KHTM ekstrak daun tespong bila dibandingkan dengan daun sirih hijau dalam penghambatan Candida albicans menunjukkan daun tespong lebih efektif sebagai obat antikandidiasis.
Komponen Ekstrak Aseton Daun Sirih Hijau dengan GC-MS
15 Pemisahan terjadi di kolom GC, kemudian dianalisis pada detektor MS dan dicatat dalam bentuk kromatogram. Sebuah GC-MS berintegrasi dengan variasi database MS dalam berbagai komponen yang diacu dengan kapabilitas pencarian yang dapat digunakan untuk spektra yang cocok sehingga dapat mengidentifikasi komponen yang terpisah (Sarker et al. 2006).
Spektrometri massa merupakan teknik analisis yang mampu memberikan informasi struktur suatu senyawa dengan jumlah analit yang sedikit. Spektrometri massa memberikan informasi baik secara kualitatif maupun kuantitatif (Patnaik 2004). Kromatografi gas merupakan teknik pemisahan yang penting untuk analisis senyawa yang mudah menguap, stabil terhadap panas dan analit nonpolar (Kellner et al. 2004).
Hasil analisis ekstrak aseton dengan GC-MS menghasilkan kromatogram dengan 20 puncak seperti yang ditunjukkan pada Gambar 8. Komponen kimia yang teridentifikasi dari kromatogram tersebut diuraikan pada Lampiran 15, berdasarkan data dari pustaka Wiley 7. Berdasarkan hasil penelitian, kandungan senyawa kimia yang terindentifikasi menggunakan GC-MS dengan konsentrasi tinggi yaitu asam benzoat (28.78%), 2-hexadecen-1-ol, 3, 7, 11, 15-tetrametil (23.65%) dan neofitadiena (15.76%) (Lampiran 15). Senyawa asam merupakan senyawa yang berpotensi sebagai antifungi dengan cara menghancurkan dinding sel dan menghambat sintesis dinding sel (Kim et al. 2004). Asam benzoat selain berfungsi sebagai antifungi, juga berfungsi sebagai antiseptik, antipiretik dan anti penyumbatan. Senyawa 2-hexadecen-1-ol, 3, 7, 11, 15-tetrametil merupakan komponen yang tergolong dalam senyawa fitol. Senyawa fitol merupakan senyawa yang masuk dalam golongan terpenoid. Penelitian Kalaisezhiyen dan Sasikumar (2012) menyebutkan bahwa senyawa ini berpotensi sebagai antikanker, antiinflamasi dan antimikroba. Neofitadiena tergolong senyawa terpenoid yang berfungsi sebagai antimikroba, antipiretik, analgesik, antioksidan dan antiinflamasi (Raman et al. 2012).
SIMPULAN DAN SARAN
Simpulan
16
Saran
Saran untuk penelitian selanjutnya adalah penelitian dapat dilakukan dengan menggunakan spesies tanaman sirih lain. Selain itu perlu pemilihan metode ekstraksi untuk meningkatkan rendemen. Ekstrak dapat diuji terhadap Candida lainnya yang menyebabkan kandidiasis, sehingga dapat dibandingkan daya hambat ekstrak. Ekstrak aseton dapat diuji pada konsentrasi yang lebih tinggi dari 400 mg/mL sehingga dapat diketahui aktivitas penghambatannya terhadap Candida tropicalis. Selain itu, dapat dilakukan pemurnian senyawa aktif yang berpotensi sebagai senyawa anti-kandidiasis.
DAFTAR PUSTAKA
Anslyn EV, Dougherty DA. 2006. Modern physical organic chemistry. Sausalito (US) : University Science Books.
Arifin M. 2009. Analisis mikroskopis dan kandungan mineral semanggi air Marsilea crenata Presl. (Marsileaceae) [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
[AOAC] Association of Official Analytical Chemist. 2005. Official Methods of Analysis. 18th ed. Marylan (US): Association of Official Analytical Chemists inc.
Bidarigh S, Khoshkholgh PMRM, Issazaddeh KMA. 2011. In vitro anti-Candida activity of Ficus lyrata L. Athyl acetate latex extract and Nystatin on clinical Isolates and Standard strains of Candida albicans. IPCBEE 18: 115-119.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan dan Obat Indonesia. Jakarta (ID): BPOM RI.
[BPOM] Badan Pengawas Obat dan Makanan. 2010. Acuan Sediaan Herbal. Volume 5 edisi 1. Jakarta (ID): Direktorat OAI BPOM RI.
Dalimartha S. 2006. Resep Tumbuhan Obat untuk Asam Urat. Bogor (ID) : Penebar Swadaya.
Daniel M. 2006. Medicinal Plants: Chemistry and Properties. New Hompshire (US): Science Publishers.
[Depkes]. 2008. Farmakope Herbal Indonesia Edisi 1. Jakarta (ID) : Departemen Kesehatan Republik Indonesia.
Ervianti E, Sawitri, Murtiastutik D, Agustini RI. 2011. The shifting pattern of Candida sp. Causing vulvovaginal candidiasis and recurrent vulvovaginal candidiasis. Media Berkala Ilmu Kesehatan Kulit dan Kelamin 23(3).
17 Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung: ITB. Terjemahan dari: Phytochemical Method.
Hermawan A, Hana W, Wiwiek T. 2007. Pengaruh ekstrak daun sirih (Piper betle L.) terhadap pertumbuhan Staphylococcus aureus dan Escherichia coli dengan metode difusi [skripsi]. Surabaya (ID) : Universitas Erlangga.
Hoffmann D. 2003. Medical Herbalism: The Science and Practice of Herbal Medicine. Rochester (US) : Healing Art Press.
Irwan F. 2011. Aktivitas antidiabetes dan analisis fitokimia ekstrak air dan etanol daun wungu (Graptophyllum pictum (L.) Griff) [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Ismaini L. 2011. Aktivitas antifumgi ekstrak (Centella asiatica L.) urban terhadap fungi patogen pada daun anggrek (Bulbophyllum flavidiflorumCarr). Jurnal Penelitian Sains 14(1):47-50.
Jackson, Agboke A, Nwoke V. 2009. In vitro evaluation of antimicrobial activity of combinations of nystatin and Euphorbia hirta leaf extract against Candida albicans by the checkerboard method. Journal of Medicinal Plants Research 3(9) : 666-669.
Kalaisezhiyen P, Sasikumar V. 2012. GC-MS evaluation of chemical constituents from methanolic leaf extract of Kedrostis foetidissima (Jacq.) Cogn. Asian Journal of Pharmaceutical and Clinical Research. Vol 5(4): 77-81.
Kellner R, Mermet JM, Otto M, Valcarcel M, Widmer HM. 2004. Analytical Chemistry. Berlin : PhotoDisc inc.
Kim TK, MJ Garson., and J A Fuerst. 2005. Marine actinomycetes related to the Salinospora group from the Great Barrier Reef sponge Pseudoceratina clavata. Environ. Microbiol., 7:509-518.
Kresnawaty I, Zainuddin A. 2009. Aktivitas antioksidan dan bakteri dari derivat metil ekstrak etanol daun gambir (Uncaria Gambir). Jurnal Littri. 15(4):145-151.
Kusmiyati, Agustini NWS. 2007. Uji aktivitas senyawa antibakteri dari mikroalga Porphyridium cruentum. Biodiversitas. 8: 48-53.
Kusumaningtyas E, Widiati RR, Gholib D. 2008. Uji daya hambat ekstrak dan krim ekstrak daun sirih (Piper betle) terhadap Candida albicans dan Trichophyton mentagrophytes. Seminar Nasional Teknologi Peternakan dan Veteriner. 805-812
Manoi F. 2006. Pengaruh pengeringan terhadap mutu simplisia sambiloto. Bul. Littro. 17(1):1-5.
Mohammadi R. 2013. Molecular identification and distribution profile of Candida spesies isolated from Iranian patients. Med Mycol 51(6): 657-663.
18
negundo and Jasminum grandiflorum. Proceeding of The Peradeniya University Research Sessions; Sri Lanka. Vol. 16.
Patnaik P. 2004. Dean’s Analytical Chemistry Handbook. New York (US) : McGraww-Hill.
Purwatresna E. 2012. Aktivitas antidiabetes ekstrak air dan etanol daun sirsak secara in vitro melalui inhibisi enzim α-Glukosidase [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Puspadewi R, Adirestuti P, Nine Z. 2012. Aktivitas anti mikroba ekstrak etanol daun sirih (Piper betle Linn) terhadap bakteri Streptococcus mutans dan Candida albicans. Kartika Wijaya Kusuma 20(1):1-13.
Raman V, Samuel LA, Saradhi P, Rao N, Krishna NV, Sudhakar, Radhakhrishnan TM. 2012. Antibacterial, antioxidant activity and GC-MS analysis of Eupatorium odoratum. Asian J Pharm Clin Res 5(2):99-106.
Rao RS, Jyothi ChP, Prakasham RS, Sarma PN, Rao LV. 2006. Xylitol production from corn fiber and sugarcane bagasse hydrolysates by Candida tropicalis. Bioresource Technology 97:1974-1978.
Rostinawati T. 2010. Aktivitas antimikroba ekstrak herba tespong (Oenanthe javavica D.C) terhadap Eschericia coli, Staphylococcus aureus dan Candida albicans. Jatinangor (ID) : Universitas Padjadjaran.
Sarker SD, Latif Z, Gray AI. 2006. Natural product isolation. Totowa (US) : Humana Press Inc.
Senthilkumar S, Vijayakumari K. Comparative studies on phytochemical and GC-MS analysis of Cassia auriculata L. Dan Cardiospermum halicacabum L. Leaf extract traditional valuable plants. International Journal of Pharmaceutical Research and Bio-Science 2(6):95-104.
Serlahwaty D. 2011. Aktivitas antioksidan ekstrak air dan etanol 70% daun sirih hijau (Piper betle L.) dan sirih merah (Piper cf. Fragile Benth.) dengan metode peredaman radikal bebas DPPH. Jurnal Ilmu Kefarmasian Indonesia 9(2): 143-146.
Sobel JD. 2008. Vulvovaginal candidiasis in: Sexually Transmitted Diseases. New York (USA): McGraw Hill. Edisi ke-4.
Soemiati A, Elya B. 2002. Uji pendahuluan efek kombinasi antijamur infus daun sirih (Piper betle L.), kulit buah delima (Punica granatum L.) dan rimpang kunyit (Curcuma domestica Val.) terhadap jamur Candida albicansi. Makara 6(3):149-154.
Utami OY. 2011. Komponen minyak atsiri daun sirih (Piper betle L.) dan potensinya dalam mencegah ketengikan minyak kelapa [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Watson DG. 2010. Analisis Farmasi. Jakarta (ID) : EGC.
Watson RR, Preedy VR. 2007. Botanical Medicine in Clinical Practice. Cambridge (UK) : Cromwell Press.
19 Yadav AV, Bishe SB. 2004. Chitosan: a potensial biomaterial affective against
20
21 Lampiran 1 Tahapan penelitian
Lampiran 2 Kadar air serbuk daun sirih
Ulangan Bobot pelarut air, aseton dan etanol 70%
22
Lampiran 3 Kadar abu serbuk daun sirih
Ulangan Bobot
Lampiran 4 Rendemen daun sirih hijau
23 Lampiran 5 Uji fitokimia daun sirih hijau
Uji Ekstrak
Air Etanol 70% Aseton
Alkaloid Dragendorf
Wagner
Meyer
Flavonoid
Saponin
Tanin
24
Lampiran 6 Uji KHTM ekstrak air daun sirih hijau terhadap Candida tropicalis
Konsentrasi (mg/mL) Diameter zona hambat (mm)
26
27 Lampiran 15 Karakteristik Ekstrak Aseton Daun Sirih Hijau dengan GC-MS
Puncak Nama senyawa Waktu
retensi
3 Benzoic acid, 2,3-dimethyl- (CAS)
2,3-dimethylbenzoic acid
17.225 277693474 28.78
4 4-allyl-1,2-diacetoxybenzene 17.412 56435936 5.85
5, 7 2-hexadecen-1-ol,
3,7,11,15-9, 11 2-allyl-6-methoxyphenol 23.842,
28
RIWAYAT HIDUP
Penulis dilahirkan di Sumatera Utara pada tanggal 11 Maret 1992 dari ayah Sardi dan ibu Esni. Penulis adalah putri kedua dari dua bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Pekanbaru dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Biokimia Hewan Program Keahlian Paramedik Veteriner Program Diploma IPB pada tahun ajaran 2014, Struktur dan Fungsi Subseluler pada tahun ajaran 2014, dan Pengantar Penelitian Biokimia tahun 2014. Penulis pernah melaksanakan Praktik Lapang (PL) di Balai Besar Pasca Panen (BB – Pasca Panen) Bogor dengan judul “Penentuan Umur Simpan dan Mutu Fisik eras rtifisial erbasis Sorgum”.
Penulis juga aktif dalam berbagai organisasi kampus. Tahun 2010-2011 penulis aktif sebagai staf Departemen Kajian Strategis BEM TPB IPB. Tahun 2011-2012 penulis aktif sebagai sekretaris Departemen Komunikasi dan Informasi BEM FMIPA IPB. Tahun 2012-2013 penulis aktif sebagai staf Kementrian Sosial dan Masyarakat BEM KM IPB 2013. Kepanitiaan yang diikuti penulis selama perkuliahan yaitu Masa Perkenalan Kampus Mahasiswa Baru (MPKMB) 48 sebagai Komisi Penegak Kedisiplinan, Masa Perkenalan Fakultas (MPF) Matematika dan Ilmu Pengetahuan Alam angkatan 48 sebagai sekretaris umum, SPIRIT 2012 sebagai bendahara umum, dan IPB Social and Health Care (I-SHARE) 2013 sebagai sekretaris umum.