APLIKASI PREBIOTIK MELALUI PAKAN TERHADAP
GAMBARAN DARAH IKAN MAS
Cyprinus carpio
YANG
DIINFEKSI
Aeromonas hydrophila
FIERCO FAQIH BAHARIANSYAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Aplikasi Prebiotik Melalui Pakan terhadap Gambaran Darah Ikan Mas Cyprinus carpio yang Diinfeksi Aeromonas hydrophila“ adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Fierco Faqih Bahariansyah
ABSTRAK
FIERCO FAQIH BAHARIANSYAH. Aplikasi Prebiotik Melalui Pakan terhadap Gambaran Darah Ikan Mas Cyprinus carpio yang Diinfeksi Aeromonas hydrophila. Dibimbing oleh WIDANARNI dan SUKENDA.
Penyakit motile aeromonad septicemia (MAS) merupakan kendala yang sering dialami dalam budidaya ikan mas. Salah satu alternatif yang dapat dilakukan untuk mengatasi kendala tersebut yaitu dengan aplikasi prebiotik. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian prebiotik melalui pakan terhadap gambaran darah ikan mas yang diinfeksi Aeromonas hydrophila. Sebanyak 15 ekor ikan mas dengan bobot rata-rata 8,94±0,28 g dipelihara di akuarium dengan volume 72 liter. Perlakuan yang diberikan yaitu kontrol negatif, kontrol positif (A dan B; tanpa prebiotik), dan perlakuan penambahan 2% prebiotik (C). Setelah 45 hari, semua perlakuan (kecuali kontrol negatif) diuji tantang dengan menyuntikkan A. hydrophila sebanyak 100 µL/ekor pada konsentrasi 107 CFU/ml secara intraperitonial, kemudian diamati mortalitasnya selama 7 hari. Hasil penelitian menunjukkan bahwa penambahan prebiotik memberikan kelangsungan hidup yang lebih tinggi (87,5%) dibandingkan dengan perlakuan kontrol positif (50%) serta memberikan pengaruh yang lebih baik terhadap gambaran darah ikan mas pasca infeksi A. hydrophila.
Kata kunci: Aeromonas hydrophila, hematologi, ikan mas, prebiotik
ABSTRACT
FIERCO FAQIH BAHARIANSYAH. Application of Dietary Prebiotic on Hematology of Common Carp Cyprinus carpio Infected by Aeromonas hydrophila. Supervised by WIDANARNI and SUKENDA.
Motile aeromonad septicemia often becomes problem for common carp culture. One of the solution is using prebiotics. This study aimed to determine the effects of dietary prebiotic on hematology of common carp that infected by A. hydrophila. Fifteen fish with mean weight 8.94±0.28 g cultured in 72 L. The treatment in this study were negative and positive control (A and B; without prebiotic), and 2% prebiotic supplementation (C). Rearing was carried out for 45 days, and then all treatment (except negative control) were injected intraperitoneally (ip) with 100 µL A. hydrophila at a concentration 107 CFU/ml and then the mortality was observed for 7 days. The result showed that the supplementation of prebiotics (C) increased survival of common carp (87.5%) higher than control (50%), and gave positive influence on hematology common carp after infected by A. hydrophila.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
APLIKASI PREBIOTIK MELALUI PAKAN TERHADAP
GAMBARAN DARAH IKAN MAS
Cyprinus carpio
YANG
DIINFEKSI
Aeromonas hydrophila
FIERCO FAQIH BAHARIANSYAH
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Aplikasi Prebiotik Melalui Pakan terhadap Gambaran Darah Ikan Mas Cyprinus carpio yang Diinfeksi Aeromonas hydrophila
Nama : Fierco Faqih Bahariansyah
NIM : C14090069
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr. Ir. Widanarni, M.Si Pembimbing I
Dr. Ir. Sukenda, M.Sc Pembimbing II
Diketahui oleh
Dr. Ir. Sukenda, M.Sc Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul ”Aplikasi Prebiotik Melalui Pakan terhadap Gambaran Darah Ikan Mas Cyprinus carpio yang Diinfeksi Aeromonas hydrophila ". Penelitian ini dilakukan pada bulan Maret-Agustus 2013 di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Dalam kesempatan ini, penulis mengucapkan terima kasih kepada :
1. Ibu Dr. Ir. Widanarni, M.Si dan Bapak Dr. Ir. Sukenda, M.Sc selaku dosen pembimbing skripsi yang telah banyak memberikan bimbingan selama pengerjaan penelitian ini.
2. Bapak Dr. Alimuddin, S.Pi, M.Sc selaku dosen pembimbing akademik dan Komisi Pendidikan yang telah banyak memberikan masukan, semangat, dan motivasi.
3. Bapak Dr. Eddy Supriyono, M.Sc selaku dosen penguji yang telah banyak memberikan masukan dalam penyusunan skripsi ini
4. Keluargaku tercinta ayahanda Hermanto, ibunda Hanny Rohmiyatni, Fieza, Fierda, Fiena, Fieaulia, dan Fies serta keluarga besar yang telah banyak memberikan semangat dan motivasi kepada penulis.
5. Bapak Ricky Djauhari yang telah banyak mendukung dalam penelitian ini, Bapak Ranta, Bapak Marjanta, Mba Yuli, Mba Ovi, Ka Rahman, Kang Adna, serta semua staf Departemen Budidaya Perairan.
6. Reza, Devi, Seto, Wahyu, Zubed, Wiwik, Ulfatul, Fahrul, Sharah, Arli, Arif, Iin, Soya, Chacha, Ferdianto, Rizki, Via, Ikhsan, Ka Dendi, Ka Titi, Ka Jeni, Ka Nurlita, serta rekan-rekan BDP 45, 46, dan 47 yang telah banyak memberikan pengalaman-pengalaman indah selama penulis menempuh pendidikan di Institut Pertanian Bogor.
Penulis berharap penelitian yang dituangkan dalam sebuah skripsi ini dapat memberikan banyak manfaat sesuai dengan yang diharapkan.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
METODE ... 2
HASIL ... 6
Kelangsungan hidup ... 6
Total Eritrosit ... 7
Kadar Hemoglobin ... 7
Kadar Hematokrit ... 8
Total Leukosit ... 8
Limfosit ... 9
Monosit ... 9
Neutrofil ... 10
Trombosit ... 10
Aktivitas Fagositik ... 11
Kualitas Air ... 11
PEMBAHASAN ... 11
KESIMPULAN DAN SARAN ... 16
DAFTAR PUSTAKA ... 16
LAMPIRAN ... 20
DAFTAR GAMBAR
1 Kelangsungan hidup ikan mas pasca perlakuan ... 6
2 Kelangsungan hidup ikan mas pascauji tantang dengan A. hydrophila ... 6
3 Total eritrosit ikan mas pada perlakuan kontrol dan prebiotik ... 7
4 Kadar hemoglobin ikan mas pada perlakuan kontrol dan prebiotik ... 7
5 Kadar hematokrit ikan mas pada perlakuan kontrol dan prebiotik ... 8
6 Total leukosit ikan mas pada perlakuan kontrol dan prebiotik ... 8
7 Jumlah limfosit ikan mas pada perlakuan kontrol dan prebiotik ... 9
8 Jumlah monosit ikan mas pada perlakuan kontrol dan prebiotik ... 9
9 Jumlah neutrofil ikan mas pada perlakuan kontrol dan prebiotik ... 10
10 Jumlah trombosit ikan mas pada perlakuan kontrol dan prebiotik ... 10
11 Jumlah aktivitas fagosit ikan mas pada perlakuan kontrol dan prebiotik .... 11
DAFTAR TABEL
1 Rancangan percobaan ... 32 Satuan dan alat ukur parameter kualitas air ... 6
3 Kualitas air selama pemeliharaan ... 11
DAFTAR LAMPIRAN
1 Komposisi Pakan ... 202 Data statistik uji ANOVA masing-masing perlakuan ... 20
1
PENDAHULUAN
Ikan mas merupakan ikan air tawar yang memiliki konsumen cukup besar, terutama di Jawa, Sumatera, dan Sulawesi Utara. Minat masyarakat untuk mengkonsumsi ikan mas semakin besar seiring dengan peningkatan konsumsi ikan yang saat ini terus dicanangkan pemerintah dalam rangka peningkatan konsumsi ikan oleh masyarakat. Budidaya ikan mas semakin berkembang dan diminati masyarakat karena ikan mas termasuk ikan konsumsi yang tergolong mudah dalam pemeliharaannya. Produksi ikan mas telah mengalami peningkatan, pada tahun 2008 total produksi ikan mas mencapai 243.000 ton dan produksi ikan mas pada tahun 2011 mencapai 332.206 ton (KKP 2011).
Salah satu kendala dalam budidaya ikan mas yaitu penyakit motile aeromonad septicemia yang disebabkan oleh Aeromonas hydrophila. Eidman et al.
(1981) menjelaskan bahwa wabah penyakit ini menyerang ikan mas berbagai ukuran, dijelaskan lebih jauh bahwa angka kematian dapat mencapai 90%-94% dari ikan yang menunjukkan gejala klinis. Usaha yang umumnya dilakukan untuk mengatasi penyakit tersebut, baik pencegahan maupun pengobatan yaitu penggunaan antibiotik. Namun penggunaan antibiotik dapat memberikan beberapa efek negatif, yaitu adanya residu antibiotik dalam tubuh ikan sehingga tidak aman untuk dikonsumsi manusia dan penggunaan senyawa antibiotik secara terus-menerus dapat meningkatkan terjadinya mutasi, sehingga melahirkan generasi bakteri baru yang resisten terhadap antibiotik tersebut (Lewis 2001). Salah satu alternatif yang dapat digunakan yaitu penggunaan prebiotik untuk meningkatkan dan mengoptimalkan peran mikroflora dalam saluran pencernaan sehingga menekan jumlah patogen dalam tubuh ikan dan meningkatkan imunitas (Mazurkiewiecz et al. 2008).
Prebiotik merupakan zat yang terkandung dalam makanan (atau ditambahkan ke makanan) yang dapat meningkatkan pertumbuhan atau aktivitas bakteri yang menguntungkan pada saluran pencernaan. Prebiotik yang berupa oligosakarida biasanya merupakan derivat dari fruktosa (inulin, oligofruktosa, fruktooligosakarida) dan derivat dari glukosa (maltooligosakarida) (Mazurkiewiecz et al. 2008). Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang namun dapat dimetabolisme oleh bakteri menguntungkan sehingga dapat meningkatkan kesehatan inang (Ringo et al. 2010).
Ubi jalar mengandung karbohidrat yang tinggi namun memiliki kandungan protein serta lemak yang rendah. Setiap varietas ubi jalar memiliki kandungan pati yang berbeda. Menurut Dwiari (2008) ubi jalar varietas sukuh (Ipomoea batatas
2
Bakteri A. hydrophila merupakan bakteri yang organ target infeksinya adalah hati dan ginjal (Cipriano 2001). Organ ini merupakan organ yang memiliki peran penting dalam sistem sirkulasi darah dalam tubuh ikan. Darah merupakan cairan tubuh yang memiliki fungsi sebagai pembawa nutrisi, transportasi oksigen, membawa hasil-hasil metabolisme tubuh seperti karbon dioksida, serta menjaga keseimbangan suhu tubuh. Angka et al. (2004) menyatakan bahwa hematologi dan patologi merupakan salah satu cara diagnostik penting untuk menentukan status kesehatan ikan. Penyimpangan fisiologis ikan akan menyebabkan terjadinya perubahan pada komponen-komponen darah sehingga perlu dilakukan pemeriksaan hematologi untuk mengetahui kondisi atau status kesehatan ikan. Tujuan penelitian ini yaitu mengetahui pengaruh pemberian prebiotik melalui pakan terhadap gambaran darah ikan mas yang diinfeksi Aeromonas hydrophila.
METODE
Materi Uji
Ekstraksi Oligosakarida/ Prebiotik
Prebiotik yang digunakan dalam penelitian diekstraksi dari ubi jalar varietas sukuh (Ipomoea batatas L.). Ekstraksi prebiotik dilakukan dengan menggunakan metode ekstraksi etanol 70% sebagai pelarutnya (Muchtadi 1989). Sebanyak 10 gram tepung kukus ubi jalar varietas sukuh dilarutkan ke dalam etanol 70% sebanyak 100 ml dan diaduk dengan menggunakan magnetic stirer
selama 15 jam pada suhu ruang. Setelah proses ekstraksi selesai kemudian larutan disaring dengan menggunakan kertas saring steril. Filtrat yang diperoleh dipekatkan dengan menggunakan evaporator vacuum pada suhu 40oC. Cairan hasil pemekatan disentrifugasi selama 10 menit pada kecepatan 5000 rpm untuk mengendapkan sisa residu yang tertinggal. Hasil pemekatan diencerkan dengan akuades steril dengan jumlah yang ditentukan melalui perhitungan total padatan terlarut (TPT).
Perhitungan Total Padatan Terlarut
3
TPT =c−a
b−ax 100%
Keterangan:
a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan setelah diisi ekstrak oligosakarida dan dioven 24 jam
Persiapan Wadah dan Ikan Uji
Wadah yang digunakan dalam penelitian ini adalah akuarium yang berukuran 60 cm x 40 cm x 40 cm sebanyak 15 buah dengan sistem resirkulasi. Pada masing-masing akuarium diberi aerasi serta dipasang heater untuk menjaga kondisi suhu tetap stabil. Sebelum digunakan, akuarium dicuci dan dikeringkan, kemudian setiap akuarium diisi air sebanyak 72 liter. Ikan yang digunakan dalam penelitian ini adalah ikan mas strain Majalaya yang berasal dari BBPBAT Sukabumi dengan bobot rata-rata 8,94±0,28 g dan dipelihara dengan kepadatan 15 ekor/akuarium. Bagian atas akuarium ditutup dengan kasa agar ikan tidak keluar dari wadah. Sebelum diberi perlakuan, ikan diadaptasikan terlebih dahulu terhadap lingkungan selama 1 minggu, lalu ikan dipuasakan selama 1 hari sebelum diberi pakan perlakuan.
Rancangan Percobaan
Penelitian ini dibagi menjadi dua tahap. Tahap I yaitu pemberian prebiotik pada ikan mas melalui pakan selama 45 hari. Pakan yang digunakan dalam penelitian ini adalah pakan buatan (Lampiran 1). Setelah perlakuan penambahan prebiotik melalui pakan dilanjutkan tahap II yaitu berupa uji tantang dengan A. hydrophila. Isolat A. hydrophila diperoleh dari Balai Penelitian Pengembangan Budidaya Air Tawar (BPPBAT) Bogor. Ikan uji diinjeksi bakteri A. hydrophila
sebanyak 100 µL/ekor pada konsentrasi 107 CFU/ml secara intraperitonial (Selvaraj et al. 2009), kemudian kematian ikan diamati selama 7 hari. Selama penelitian dilakukan pengambilan sampel darah dari masing-masing perlakuan pada awal pemeliharaan (H0), setelah perlakuan penambahan prebiotik (H46), 3 hari pascauji tantang (H50) dan 6 hari pascauji tantang (H53). Penelitian ini terdiri dari 3 perlakuan dengan 3 ulangan (Tabel 1).
Tabel 1. Rancangan percobaan pemberian prebiotik melalui pakan pada ikan mas
Perlakuan Keterangan
A : Pemberian pakan tanpa penambahan prebiotik dan tanpa diuji tantang dengan A. hydrophila
B : Pemberian pakan tanpa penambahan prebiotik dan diuji tantang dengan A. hydrophila
4
Parameter Uji
Kelangsungan Hidup (KH)
Kematian ikan diamati setiap hari dari awal hingga akhir perlakuan. Kelangsungan hidup ikan dihitung pada akhir perlakuan prebiotik dan akhir uji tantang dengan menggunakan rumus berdasarkan Effendie (1997):
KH = Nt
Nox 100%
Keterangan :
KH = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan pada akhir perlakuan No = Jumlah ikan pada awal perlakuan
Total Eritrosit
Total eritrosit dihitung berdasarkan Blaxhall dan Daisley (1973). Darah dihisap dengan pipet bulir merah sampai skala 0,5. Kemudian ditambahkan larutan Hayem’s dengan cara dihisap sampai skala 101, lalu campuran tersebut dihomogenkan dengan cara pipet digerakan membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan di atas hemasitometer yang sudah ditutup dengan cover glass, Selanjutnya dilakukan perhitungan sel darah merah pada 5 kotak besar hemasitometer. Total sel darah merah didapatkan berdasarkan rumus berikut:
∑ Eritrosit = rataan sel terhitung � 1
Volume kotak besar� faktor pengencer
Kadar Hemoglobin (Hb)
Kadar hemoglobin diukur melalui metode Sahli dengan menggunakan Sahlinometer (Wedemeyer dan Yasutake 1977). Darah dihisap dengan pipet Sahli sampai skala 20 mm3 atau 0,2 ml, kemudian darah di dalam pipet dimasukkan ke dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 (skala merah), lalu diaduk dan didiamkan selama 3-5 menit. Setelah itu ditambahkan akuades sedikit demi sedikit sampai warna campuran darah dan HCl sama dengan warna larutan standar yang ada di dalam Hb-meter. Selanjutnya kadar hemoglobin dibaca dengan melihat permukaan cairan dan dicocokkan dengan angka pada skala yang berwarna kuning. Kadar hemoglobin yang terbaca menunjukkan banyaknya hemoglobin dalam satuan gram per 100 ml darah.
Kadar Hematokrit (He)
5 (b) di dalam tabung mikro hematokrit. Kadar hematokrit dinyatakan sebagai % volume padatan sel darah yang dihitung dengan rumus berikut:
Hematokrit = a
bx 100%
Total Leukosit
Total leukosit dihitung berdasarkan Blaxhall dan Daisley (1973). Darah dihisap dengan pipet bulir putih sampai skala 0,5. Kemudian ditambahkan larutan Turk’s dengan cara dihisap sampai skala 11, lalu campuran tersebut dihomogenkan dengan cara pipet digerakan membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan di atas hemasitometer yang sudah ditutup dengan cover glass.
Selanjutnya dilakukan perhitungan sel darah putih pada 5 kotak kecil hemasitometer. Total sel darah putih didapatkan berdasarkan rumus berikut:
∑ Leukosit = rataan sel terhitung � 1
Volume kotak besar� faktor pengencer
Diferensial Leukosit
Perhitungan diferensial leukosit ditentukan berdasarkan Amlacher (1970). Perhitungan dilakukan dengan cara mengamati preparat ulas darah. Darah diteteskan di atas gelas objek yang telah dibilas alkohol, lalu ujung gelas objek kedua diletakkan di atas gelas objek yang telah ditetesi darah dengan membentuk
sudut sebesar 30˚. Kemudian gelas objek kedua digeser kearah berlawanan hingga terbentuk lapisan tipis darah. Preparat dikeringanginkan dan difiksasi dengan metanol selama 5 menit. Selanjutnya preparat dikeringanginkan kembali dan dilakukan pewarnaan dengan Giemsa selama 15 menit. Setelah itu preparat dibilas dengan air mengalir dan dikeringanginkan, lalu preparat ulas diamati dengan mikroskop, kemudian dihitung jenis-jenis leukosit dan dihitung persentase dari masing-masing jenis leukosit tersebut.
Aktivitas Fagositosis
6
Kualitas Air
Parameter kualitas air yang diukur dalam penelitian meliputi suhu, pH, DO, dan TAN. Tabel 2 di bawah ini adalah satuan dan alat pengukuran dari parameter kualitas air yang diukur.
Tabel 2. Satuan dan alat ukur parameter kualitas air Parammeter Satuan Alat Ukur
Suhu oC Termometer
pH - pH meter
DO mg/l DO meter
TAN mg/l Spektrometer
Analisis Data
Rancangan percobaan berupa rancangan acak lengkap dengan 3 perlakuan dan 3 ulangan. Data dianalisis menggunakan SPSS 17.0 dan dilakukan uji lanjut dengan uji Duncan. Parameter yang dianalisis secara statistik yaitu kelangsungan hidup, sedangkan parameter gambaran darah dan kualitas air dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil
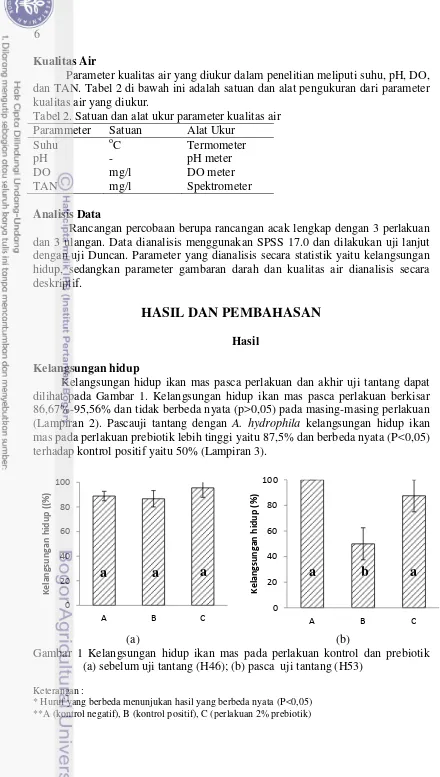
Kelangsungan hidup
Kelangsungan hidup ikan mas pasca perlakuan dan akhir uji tantang dapat dilihat pada Gambar 1. Kelangsungan hidup ikan mas pasca perlakuan berkisar 86,67%-95,56% dan tidak berbeda nyata (p>0,05) pada masing-masing perlakuan (Lampiran 2). Pascauji tantang dengan A. hydrophila kelangsungan hidup ikan mas pada perlakuan prebiotik lebih tinggi yaitu 87,5% dan berbeda nyata (P<0,05) terhadap kontrol positif yaitu 50% (Lampiran 3).
(a) (b)
Gambar 1 Kelangsungan hidup ikan mas pada perlakuan kontrol dan prebiotik (a) sebelum uji tantang (H46); (b) pasca uji tantang (H53)
Keterangan :
* Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05) **A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
7
Total Eritrosit
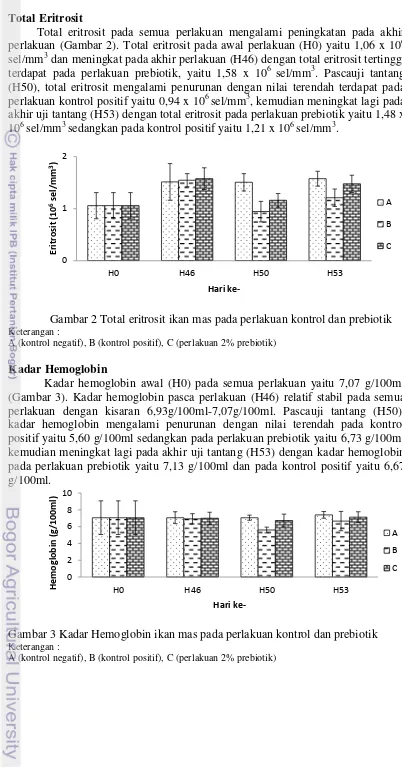
Total eritrosit pada semua perlakuan mengalami peningkatan pada akhir perlakuan (Gambar 2). Total eritrosit pada awal perlakuan (H0) yaitu 1,06 x 106 sel/mm3 dan meningkat pada akhir perlakuan (H46) dengan total eritrosit tertinggi terdapat pada perlakuan prebiotik, yaitu 1,58 x 106 sel/mm3. Pascauji tantang (H50), total eritrosit mengalami penurunan dengan nilai terendah terdapat pada perlakuan kontrol positif yaitu 0,94 x 106 sel/mm3, kemudian meningkat lagi pada akhir uji tantang (H53) dengan total eritrosit pada perlakuan prebiotik yaitu 1,48 x 106 sel/mm3 sedangkan pada kontrol positif yaitu 1,21 x 106 sel/mm3.
Gambar 2 Total eritrosit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
Kadar Hemoglobin
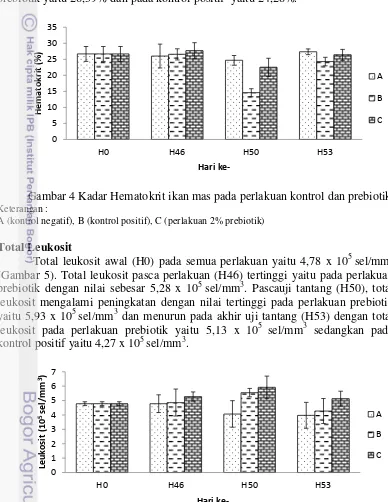
Kadar hemoglobin awal (H0) pada semua perlakuan yaitu 7,07 g/100ml (Gambar 3). Kadar hemoglobin pasca perlakuan (H46) relatif stabil pada semua perlakuan dengan kisaran 6,93g/100ml-7,07g/100ml. Pascauji tantang (H50), kadar hemoglobin mengalami penurunan dengan nilai terendah pada kontrol positif yaitu 5,60 g/100ml sedangkan pada perlakuan prebiotik yaitu 6,73 g/100ml, kemudian meningkat lagi pada akhir uji tantang (H53) dengan kadar hemoglobin pada perlakuan prebiotik yaitu 7,13 g/100ml dan pada kontrol positif yaitu 6,67 g/100ml.
Gambar 3 Kadar Hemoglobin ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
8
Kadar Hematokrit
Kadar hematokrit awal (H0) pada semua perlakuan yaitu 26,67% (Gambar 4). Kadar hematokrit pasca perlakuan (H46) tertinggi yaitu pada perlakuan prebiotik dengan nilai sebesar 27,68%. Pascauji tantang (H50), kadar hematokrit mengalami penurunan dengan nilai terendah pada kontrol positif yaitu 14,57% sedangkan pada perlakuan prebiotik yaitu 22,50%, kemudian meningkat lagi pada akhir uji tantang (H53) dengan kadar hematokrit pada perlakuan prebiotik yaitu 26,39% dan pada kontrol positif yaitu 24,28%.
Gambar 4 Kadar Hematokrit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
Total Leukosit
Total leukosit awal (H0) pada semua perlakuan yaitu 4,78 x 105 sel/mm3 (Gambar 5). Total leukosit pasca perlakuan (H46) tertinggi yaitu pada perlakuan prebiotik dengan nilai sebesar 5,28 x 105 sel/mm3. Pascauji tantang (H50), total leukosit mengalami peningkatan dengan nilai tertinggi pada perlakuan prebiotik yaitu 5,93 x 105 sel/mm3 dan menurun pada akhir uji tantang (H53) dengan total leukosit pada perlakuan prebiotik yaitu 5,13 x 105 sel/mm3 sedangkan pada kontrol positif yaitu 4,27 x 105 sel/mm3.
Gambar 5 Total leukosit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
9
Diferensial Leukosit Limfosit
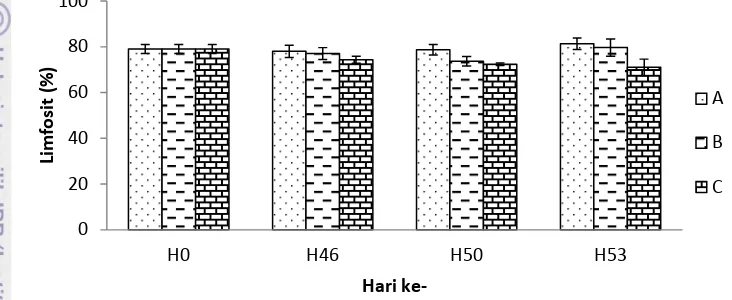
Jumlah limfosit awal (H0) pada semua perlakuan yaitu 79% (Gambar 6). Jumlah limfosit pasca perlakuan (H46) pada semua perlakuan berkisar 74,33-78%. Pascauji tantang (H50) jumlah limfosit terendah terdapat pada perlakuan prebiotik yaitu 72,33 % sedangkan pada akhir uji tantang (H53) jumlah limfosit pada perlakuan prebiotik yaitu 71,00% dan pada kontrol positif yaitu 79,67%.
Gambar 6 Jumlah limfosit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebioti)
Monosit
Jumlah monosit awal (H0) pada semua perlakuan yaitu 7,33% (Gambar 7). Jumlah monosit pasca perlakuan (H46) tertinggi terdapat pada perlakuan prebiotik dengan nilai sebesar 11%. Pascauji tantang (H50), jumlah monosit mengalami peningkatan dengan nilai tertinggi pada perlakuan prebiotik yaitu 14,67%, kemudian mengalami penurunan pada akhir uji tantang (H53) dengan jumlah monosit pada perlakuan prebiotik yaitu 13,33% sedangkan pada kontrol positif yaitu 7,67%.
Gambar 7 Jumlah monosit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
10
Neutrofil
Jumlah neutrofil awal (H0) pada semua perlakuan yaitu 10% (Gambar 8). Jumlah neutrofil pasca perlakuan (H46) tertinggi terdapat pada perlakuan prebiotik dengan nilai sebesar 11,67%. Pascauji tantang (H50) jumlah neutrofil mengalami penurunan, dengan jumlah neutrofil terendah terdapat pada perlakuan kontrol positif yaitu 7,33% sedangkan pada perlakuan prebiotik yaitu 7,67%, kemudian jumlah neutrofil pada akhir uji tantang (H53) pada perlakuan prebiotik yaitu 10% dan pada kontrol positif yaitu 7%.
Gambar 8 Jumlah neutrofil ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
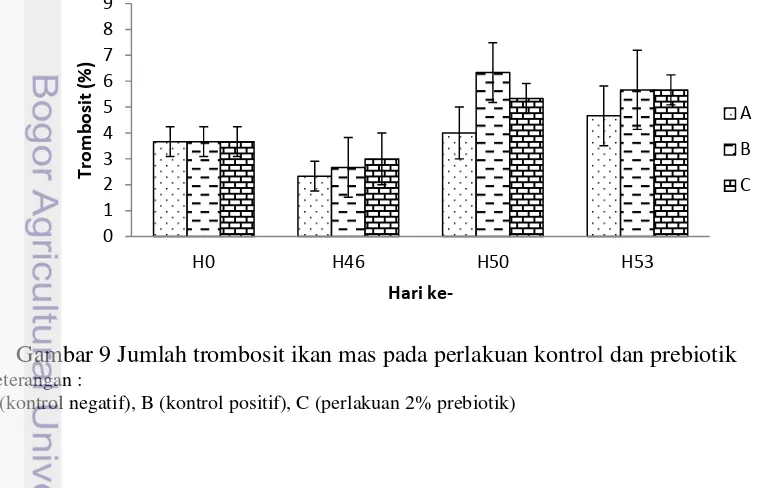
Trombosit
Jumlah trombosit awal (H0) pada semua perlakuan yaitu 3,67% (Gambar 9). Pasca perlakuan (H46) tombosit ikan mas mengalami penurunan dengan jumlah trombosit berkisar 2,33%-3,00%. Pascauji tantang (H50) jumlah trombosit mengalami peningkatan, jumlah trombosit tertinggi terdapat pada kontrol positif yaitu 6,33% sedangkan pada akhir uji tantang (H53) jumlah trombosit baik pada perlakuan prebiotik maupun kontrol positif yaitu 5,67%.
Gambar 9 Jumlah trombosit ikan mas pada perlakuan kontrol dan prebiotik Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
11
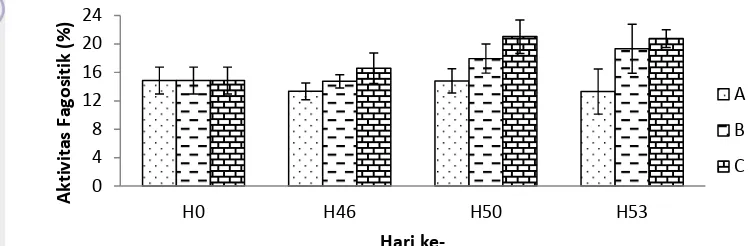
Aktivitas Fagositik
Aktivitas fagositik awal (H0) pada semua perlakuan yaitu 14,86% (Gambar 10). Aktivitas fagositik pasca perlakuan (H46) tertinggi terdapat pada perlakuan penambahan prebiotik yaitu 16,58% sedangkan pada kontrol positif yaitu 14,74%. Pascauji tantang (H50), aktivitas fagositik mengalami peningkatan dengan nilai tertinggi pada perlakuan prebiotik yaitu 21,01%, sedangkan pada akhir uji tantang (H53) aktivitas fagositik pada perlakuan prebiotik yaitu 20,77% dan pada kontrol positif 19,32%.
Gambar 10 Jumlah aktivitas fagositik ikan mas pada perlakuan kontrol dan prebiotik
Keterangan :
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
Kualitas Air
Kisaran kualitas air selama perlakuan disajikan pada tabel 3 dibawah ini. Nilai kualitas air yang diperoleh masih dalam kisaran normal dalam pemeliharaan. Tabel 3. Kualitas air selama pemeliharaan
Perlakuan pH Suhu (oC) DO(mg/l) NH3 (mg/l)
A 6,95-7,11 29-30 7,5-7,6 0,73-0,76
B 6,99-7,05 29-29,5 7,5-7,8 0,39-0,43
C 7,40-7,48 29-29,5 8,3-8,5 0,22-0,38
Keterangan:
A (kontrol negatif), B (kontrol positif), C (perlakuan 2% prebiotik)
Pembahasan
Prebiotik merupakan bahan pangan yang tidak dapat dicerna, memiliki efek menguntungkan terhadap inang dengan menstimulir pertumbuhan secara selektif terhadap aktivitas satu atau lebih bakteri di dalam usus (Lactobacilli dan
Bifidobacteria), sehingga meningkatkan kesehatan inang (Gibson 2004; Manning
et al. 2004). Prebiotik umumnya berupa karbohidrat yang tidak dicerna, yaitu bentuk oligosakarida dan serat pangan seperti inulin (Reddy 1999). Collins dan Gibson (1999) menyatakan beberapa jenis prebiotik antara lain frukto oligosakarida (FOS), inulin, galakto oligosakarida (GOS), laktulosa, dan laktitol. Manning dan Gibson (2004) melengkapi pernyataan tersebut dengan beberapa bahan potensi prebiotik lainnya yaitu rafinosa, galaktosil laktosa, laktusukrosa, isomalto oligosakarida, gluko oligosakarida, xylo oligosakarida.
12
Beberapa jenis ubi jalar yang telah banyak digunakan sebagai sumber prebiotik diantaranya ubi jalar varites sukuh, jago, dan putih. Menurut Dwiari (2008) kandungan pati ubi jalar varietas sukuh yaitu 27,7% lebih besar dibandingkan dengan varietas jago sebesar 22,9%. Kandungan gula yang terdapat pada ubi jalar varietas sukuh adalah rafinosa, maltosa, sukrosa, dan maltotriosa (Adijuwana 2005). Hasil analisa HPLC pada penelitian Putra (2010) menunjukkan bahwa ubi jalar varietas sukuh memiliki kandungan rafinosa sebesar 64,5 ml/L, oligofruktosa sebesar 64,5 ml/L, dan maltotriosa sebesar 55,5 ml/L. Konsumsi prebiotik mempunyai beberapa manfaat, yaitu dapat menghambat pertumbuhan bakteri patogen, meningkatkan penyerapan kalsium, mencegah kanker usus, memberikan pengaruh terhadap sistem imun, dan dapat menurunkan kolesterol (Manning dan Gibson 2004).
Berdasarkan hasil yang diperoleh, kelangsungan hidup ikan mas pasca perlakuan berkisar 86,67%-95,56% dan tidak berbeda nyata (P>0,05) antara perlakuan kontrol dan perlakuan prebiotik (Lampiran 2). Pascauji tantang menggunakan A. hidrophyla, kelangsungan hidup ikan mas pada perlakuan prebiotik lebih tinggi dibandingkan dengan kontrol positif. Hasil analisis statistik menunjukkan bahwa perlakuan prebiotik memiliki kelangsungan hidup sebesar 87,5% yang berbeda nyata (P<0,05) terhadap kontrol positif dengan nilai kelangsungan hidup 50% (Lampiran 3). Hal ini diduga prebiotik memberikan peran dalam menstimulus sistem imun serta menghambat patogen yang masuk ke dalam tubuh sehingga dapat meningkatkan kelangsungan hidup. Hasil ini sejalan dengan penelitian Tanbiyaskur (2011) bahwa penambahan prebiotik yang diekstraksi dari ubi jalar varietas sukuh dapat memberikan kelangsungan hidup yang lebih baik pada ikan nila pasca diinfeksi S. agalactiae. Hasil penelitian Mahious et al. (2006) penambahan oligofruktosa 2%, inulin 2%, dan rafinosa 2% melalui pakan, dapat meningkatkan nilai kelangsungan hidup ikan turbot.
Lict et al. (2012) menjelaskan beberapa mekanisme kerja prebiotik yang secara umum dibagi atas dua mekanisme yaitu secara langsung dan tidak langsung. Secara langsung prebiotik dapat menstimulus sistem imun serta dapat melapisi sel epitel saluran pencernaan. Sedangkan secara tidak langsung, prebiotik dapat menstimulus komposisi mikroflora usus untuk meningkatkan sitem imun dan menghasilkan mukus untuk melindungi permukaan sel epitel usus. Prebiotik juga dapat merangsang mikroflora usus untuk menghasilkan asam lemak rantai pendek atau short chain fatty acids (SCFA) yang dapat menekan jumlah patogen. Hasil penelitian He et al. (2003) menunjukkan bahwa penambahan mananoligosakarida (MOS) dapat meningkatkan kelangsungan hidup serta meningkatkan respon imun non spesifik pada hybrid tilapia. Akrami et al. (2013) dalam penelitiannya juga menjelaskan bahwa penambahan fruktooligosakarida (FOS) dapat meningkatkan pertumbuhan, komposisi probiotik, serta dapat menstimulus respon imun pada juvenil ikan stellate sturgeon.
13 Beberapa parameter yang dapat memperlihatkan perubahan kondisi tubuh pada darah yaitu total eritrosit, hematokrit (He), hemoglobin (Hb), dan total leukosit.
Eritrosit ikan umumnya berbentuk bulat atau oval dan memiliki inti terletak dibagian tengah serta terlihat jernih kebiruan dengan pewarnaan giemsa (Chinabut
et al. 1991). Berdasarkan hasil penelitian, total eritrosit ikan mas awal (H0) pada masing-masing perlakuan yaitu 1,06 x 106 sel/mm3, pasca perlakuan (H46) nilai ini mengalami peningkatan pada masing-masing perlakuan dengan nilai tertinggi terdapat pada perlakuan penambahan prebiotik (C) yaitu sebesar 1,58 x 106 sel/mm3. Pada tiga hari pascauji tantang (H50) total eritrosit ikan mas perlakuan kontrol positif (B) dan perlakuan penambahan prebiotik (C) mengalami penurunan, dengan total eritrosit terendah terdapat pada perlakuan kontrol positif (B) yaitu sebesar 0,94 x 106 sel/mm3, sedangkan pada perlakuan penambahan prebiotik (C) yaitu sebesar 1,16 x 106 sel/mm3. Hasil ini menunjukkan bahwa pada perlakuan dengan penambahan prebiotik nilai total eritrosit pasca uji tantang (H50) dapat dipertahankan lebih tinggi jika dibandingkan dengan perlakuan kontrol positif (B). Penurunan total eritrosit diduga terjadi karena adanya kerusakan pada ginjal akibat infeksi A. hidrophyla. Menurut Nabib dan Pasaribu (1989) rusaknya ginjal menyebabkan kemampuan ikan memproduksi eritrosit menurun. Selain itu bakteri
A. hidrophyla merupakan bakteri yang dapat menghasilkan enzim hemolisin sehingga melisis eritrosit inangnya. Hal ini juga dijelaskan oleh Cipriano (2001) bahwa faktor virulensi bakteri ini adalah enterotoksin dan hemolisin. Total eritrosit pada akhir uji tantang (H53) mengalami peningkatan, pada perlakuan penambahan prebiotik (C) sebesar 1,48 x 106 sel/mm3, dan perlakuan kontrol positif (B) yaitu 1,21 x 106 sel/mm3. Peningkatan pada kondisi ini diduga ikan berupaya mengembalikan kondisi tubuhnya pada kondisi normalnya. Tubuh ikan memproduksi sel darah lebih banyak untuk menggantikan eritrosit yang mengalami kerusakan akibat infeksi patogen.
14
Hematokrit merupakan persentase volume sel darah merah di dalam darah atau perbandingan antara volume sel darah merah dengan plasma darah (Bond 1979). Hasil penelitian menunjukkan kadar hematokrit ikan sebelum perlakuan (H0) yaitu 26,67%, sedangkan pasca perlakuan (H46) kadar hematokrit tertinggi terdapat pada perlakuan penambahan prebiotik (C) yaitu 27,68%. Pascauji tantang (H50) nilai kadar hematokrit pada semua perlakuan mengalami penurunan, kadar hematokrit pada perlakuan penambahan prebiotik (C) yaitu 22,50%, lebih tinggi dibandingkan dengan perlakuan kontrol positif (B) 14,57%. Penurunan kadar hematokrit diduga akibat infeksi A. hidrophyla, yang menyebabkan turunnya nafsu makan ikan. Rendahnya nafsu makan menyebabkan ikan mengalami kekurangan nutrisi didalam tubuhnya. Menurut Wedemeyer dan Yasutake (1977) menurunnya kadar hematokrit dapat dijadikan sebagai indikator mengenai rendahnya kandungan protein pakan, defisiensi vitamin atau ikan mendapat infeksi sehingga nafsu makan menurun. Kadar hematokrit pada akhir uji tantang (H53) masing-masing perlakuan mengalami peningkatan, kadar hematokrit pada perlakuan penambahan prebiotik (26,39%) dapat dipertahankan lebih tinggi dibandingkan dengan perlakuan kontrol positif ( 24,28%).
Total leukosit ikan mas sebelum perlakuan (H0) yaitu 4,78 x 105 sel/mm3. Setelah perlakuan (H46) total leukosit mengalami peningkatan dengan nilai berkisar 4,78 x 105 sel/mm3-5,28 x 105 sel/mm3. Pascauji tantang (H50) total leukosit mengalami peningkatan, dengan nilai tertinggi pada perlakuan prebiotik (C) sebesar 5,93 x 105 sel/mm3, sedangkan pada perlakuan kontrol positif (B) sebesar 5,55 x 105 sel/mm3. Hasil ini menunjukkan bahwa penambahan prebiotik dapat meningkatkan total leukosit lebih tinggi dibandingkan dengan perlakuan kontrol positif (B). Leukosit ikan merupakan bagian dari sistem pertahanan tubuh yang bersifat nonspesifik. Peningkatan total leukosit juga menunjukkan bahwa ikan sedang mengalami infeksi akibat serangan bakteri A. hidrophyla. Blaxhall (1971) menjelaskan bahwa perubahan nilai total leukosit dapat dijadikan indikator adanya infeksi penyakit tertentu pada ikan. Sukenda et al. (2008) menyatakan bahwa peningkatan jumlah leukosit disebabkan karena leukosit berfungsi sebagai pertahanan dalam tubuh yang bereaksi cepat terhadap masuknya antigen ke dalam tubuh ikan. Pada akhir pengamatan (H53) total leukosit pada masing-masing perlakuan mengalami penurunan, pada perlakuan prebiotik (C) yaitu 5,13 x 105 sel/mm3 sedangkan pada kontrol positif yaitu 4,27 x 105 sel/mm3. Penurunan diduga akibat kondisi ikan yang terinfeksi bakteri telah menunjukan tanda-tanda penyembuhan.
15 Monosit ikan berasal dari jaringan hematopoitik ginjal. Monosit merupakan sel darah putih yang berfungsi sebagai sel fagosit terhadap benda-benda asing termasuk antigen penyakit (Moyle dan Cech 1988). Berdasarkan hasil penelitian, jumlah monosit ikan mas sebelum perlakuan (H0) yaitu 7,33% sedangkan pasca perlakuan (H46) persentase jumlah monosit tertinggi terdapat pada perlakuan penambahan prebiotik (C) dengan nilai 11%. Pascauji tantang (H50) jumlah monosit pada semua perlakuan mengalami peningkatan. Jumlah monosit pascauji tantang (H50) pada perlakuan penambahan prebiotik (C) yaitu 14,67%, lebih tinggi dibandingkan dengan perlakuan kontrol positif (B) 12,67%. Menurut Angka et al. (2004) jumlah monosit akan mengalami peningkatan ketika terjadi radang. Pada akhir perlakuan (H53) jumlah monosit mengalami penurunan, pada perlakuan kontrol positif (7,67%) masih lebih rendah dibandingkan dengan perlakuan penambahan prebiotik (13,33%). Penurunan jumlah monosit yang cukup tinggi pada kontrol positif diduga karena jumlah sel yang dihasilkan tidak sebanding dengan jumlah sel yang menuju jaringan tubuh terinfeksi.
Chinabut et al. (1991) menyatakan bahwa neutrofil adalah sel darah putih yang dapat meninggalkan pembuluh darah, mengandung vakuola yang berisi enzim yang digunakan oleh sel tersebut untuk menghancurkan organisme yang dimakannya. Berdasarkan hasil penelitian, jumlah neutrofil ikan mas sebelum perlakuan (H0) yaitu 10%, sedangkan pasca perlakuan (H46) jumlah neutrofil cukup stabil berkisar 11%-11,67%. Pascauji tantang (H50) jumlah neutrofil mengalami penurunan, pada perlakuan penambahan prebiotik (C) sebesar 7,67%, lebih tinggi dibandingkan dengan perlakuan lainnya. Hal ini diduga penambahan prebiotik mampu meningkatkan jumlah neutrofil dalam tubuh ikan sehingga ketika terjadi infeksi, neutrofil dapat melawan antigen yang masuk ke dalam tubuh. Menurunnya jumlah neutrofil dalam darah dapat disebabkan oleh neutrofil berumur pendek dan telah melakukan aktivitas fagositosis didalam sel (Tizard 1988). Selain itu penurunan neutrofil diduga karena ketika pengukuran dilakukan, sel yang sedang aktif dalam sistem pertahanan adalah sel monosit. Bratawidjaja (2006) menjelaskan sel neutrofil hanya berada dalam sirkulasi kurang dari 48 jam sebelum bermigrasi dan berpindah sangat cepat ke daerah infeksi. Jumlah neutrofil pada akhir uji tantang (H53) masing-masing perlakuan mengalami peningkatan, namun pada perlakuan kontrol positif nilainya (7%) masih dibawah persentase neutrofil perlakuan penambahan prebiotik (10%).
Trombosit merupakan sel darah yang tidak berinti dan paling kecil ukurannya (Chinabut et al. 1991). Trombosit berperan penting dalam proses pembekuan darah dan juga berfungsi untuk mencegah kehilangan cairan tubuh pada kerusakan-kerusakan di permukaan (Nabib dan Pasaribu 1989). Jumlah trombosit ikan mas sebelum perlakuan (H0) dan pasca perlakuan (H46) cukup stabil, dengan persentase trombosit awal (H0) 3,67% dan pada pasca perlakuan (H46) berkisar 2,33%-3,33%. Pascauji tantang (H50) jumlah trombosit pada perlakuan kontrol psoitif (6,33%) lebih tinggi dibandingkan dengan perlakuan prebiotik (5,33%). Peningkatan jumlah trombosit diduga akibat infeksi A.
16
Fagositosis merupakan pertahanan pertama dari respon selular yang dilakukan oleh monosit (makrofag) dan granulosit (neutrofil). Fagositosis meliputi tahap kemotaksis, pelekatan, penelanan, dan pencernaan (Tizard 1988). Aktivitas fagositik ikan mas sebelum perlakuan (H0) yaitu 14,86%. Pasca perlakuan (H46) aktivitas fagositik pada perlakuan penambahan prebiotik adalah 16,58%, lebih tinggi dibandingkan dengan perlakuan kontrol positif (14,74%). Pascauji tantang (H50) akitivitas fagositik mengalami peningkatan, dengan nilai tertinggi terdapat pada perlakuan penambahan prebiotik (C) yaitu 21,01% sedangkan pada perlakuan kontrol positif (B) yaitu 17,94%. Peningkatan ini menunjukkan bahwa ikan memiliki kemampuan memproduksi sel fagosit yang lebih banyak sehingga tubuh ikan siap ketika terpapar oleh patogen. Hal ini sejalan dengan hasil penelitian Tanbiyaskur (2011) bahwa penambahan prebiotik ubi sukuh dapat meningkatkan aktivitas fagositik lebih baik dibandingkan dengan kontrol. Pada akhir perlakuan (H53) aktivitas fagositik perlakuan kontrol positif adalah 19,32%, lebih rendah dibandingkan dengan perlakuan penambahan prebiotik (20,77%). Carver (1994) menyatakan bahwa peningkatan kekebalan tubuh dapat diketahui dari peningkatan aktivitas sel fagositik.
Kualitas air berkaitan dengan komoditas perikanan yang dibudidayakan. Parameter kualitas air yang diamati meliputi suhu, pH, DO, dan NH3. Suhu dan
pH air selama perlakuan berada pada kisaran normal, yaitu masing-masing 25-30oC dan pH 6,5-8,5 (Khairuman dan Amri 2008). Oksigen terlarut selama perlakuan berkisar antara 7,20-8,12 mg/l. Effendi (2003) menyatakan bahwa oksigen terlarut yang direkomendasikan untuk budidaya ikan minimal 3 mg/l. Total amonia nitrogen (TAN) selama perlakuan berkisar antara 0,41-0,76 mg/l.
KESIMPULAN DAN SARAN
Kesimpulan
Penambahan prebiotik yang diekstraksi dari ubi jalar varietas sukuh menunjukkan kelangsungan hidup ikan mas yang lebih tinggi yaitu 87,5% dibandingkan dengan perlakuan kontrol positif yaitu 50% serta memberikan pengaruh yang lebih baik terhadap gambaran darah ikan mas pasca infeksi A. hydrophila.
Saran
17
DAFTAR PUSTAKA
Adijuwana NT. 2005. Pemanfaatan ubi jalar (Ipomoea batatas L.) untuk mendukung pertumbuhan bakteri asam laktat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Akrami R, Iri Y, Rostami HK, Mansour MR. 2013. Effect of dietary supplementation of fructooligosaccharide (FOS) on growth performance, survival, lactobacillus bacterial population and hemato-immunological parameters of stellate sturgeon (Acipenser stellatus) juvenile. Fish and Shellfish Imunology. 35(2013):1235-1239.
Amlacher E. 1970. Textbook of Fish Disease. New York (US): Neptune.
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health programs. Aquatic Animal Health and the Evironment. 4:24-342.
Angka SL, Priyosoeryanto BP, Lay BW, Haris E. 2004. Penyakit motile aeromonad septicemia pada ikan lele dumbo. Forum Pascasarjana. 27:339-350.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanti. 1989.
Petunjuk Laboratorium Pengujian Pangan. Bogor (ID): IPB Pr.
Bailey J, Blankenship L, Cox N. 1991. Effect of fructooligosaccharides on
Salmonella colonization of the chicken intestine. Poult. Sci. 70:2433-2438. Blaxhall PC. 1971. The haematological assessment of the health of fresh water
fish. A review of selected literature. Journal Fish Biology. 4:593-608. Blaxhall PC, Daisley KW. 1973. Routine hematological methods for use with fish
blood. Journal Fish Biology. 5:577-581
Bond CE. 1979. Biology of Fishes. Philadelphia (US): Saunders College Publishing.
Bratawidjaja KG. 2006. Imunologi Dasar. Edisi keenam. Jakarta (ID): UI Pr. Carver JD. 1994. Dietary nucleotides: cellular immune, intestinal and hepatic
system effects. Journal of Nutrition. 124:144-148.
Chinabut S, Limsuwan C, Sawat PK. 1991. Histology of the walking catfish Clarias batrachus. Department of Fisheries: Thailand.
Cipriano RG. 2001. Aeromonas hydrophila and motile aeromonad septicemia of Fish. Fish Disease leaflet of the US fish and wildlife sevice. US Department of the Interion. 68:1-24
Collins, Gibson GR. 1999. Prebiotic, probiotic, and synbiotic: approaches for modulating the microbial ecology of the gut. Am J Clin Nutr. 69(5):1052-1057.
Dellman HD, Brown EM. 1989. Buku Teks Histologi Veteriner. Hartono, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Textbook of Veteriner Histology.
Dwiari. 2008. Pengujian potensi prebiotik ubi garut dan ubi jalar serta hasil olahannya (cookies and sweat potato flakes) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Effendie MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
18
Eidman M, Sumawidjaja K, Hardjosworo S. Wabah Penyakit Bercak Merah Ikan.
Bogor (ID): IPB Pr
Fujaya Y. 2004. Fisiologi Ikan: Dasar Pengembangan Teknologi Perikanan. Jakarta (ID): Rineka Cipta.
Gibson GR. 2004. Fibre and effects on probiotics (diet prebiotic concept). Clinical Nutrition Supplements. 1:25-31.
He S, Xu G, Wu Y, Weng H, and Xie H. 2003. Effects of IMO and FOS on the growth performance and non-specific immunity in hybrid tilapia. Chin. Feed 23:14–15.
Khairuman, Amri K. 2008. Buku Pintar Budidaya 15 Ikan Konsumsi. Jakarta (ID): Agromedia Pustaka.
[KKP] Kementrian Kelautan dan Perikanan (ID). 2011. Statistik Kelautan dan Perikanan Tahun 2011. Jakarta (ID): Kementerian dan Kelautan Perikanan. Lagler KF, Bardach JE, Miller RR, Passino DRM. 1977. Ichthyology. New York
(US): John Wiley and Sonc
Lewis K. 2001. Riddle of biofilm resistance. Antimicrob Agents Chemother. 45:999-1007
Licth TR, Tine E, Hanne F. 2012. Prebiotics for prevention of gut infection. Food Science and Technology. 23(2):70-82.
Mahious, Getesoupe, Hervi M, Metailler R, Ollevier. 2006. Effect of dietary inulin and oligosaccharides as prebiotics for weaning turbot, Psetta maxima.
Aquaculture International. 14(3):219-229.
Manning TS, Gibson GR. 2004. Prebiotics. Best Practice & Research Clinical Gastroenterology.18(2):287-298.
Manning TS, Rastall R, Gibson G. 2004. Prebiotics and lactic acid bacteria. Di dalam : Salminen S, Wright A dan Ouwehand A, editor. Lactic Acid Bacteria Microbiological and Functional Aspects 3: 2004; New York. Marcel Dekker, Inc. hlm 407-418.
Mazurkiewicz J, Przybył A, Golski J. 2008. Usability of fermacto prebiotic in
feeds for common carp (Cyprinus carpio L.) fry. Nauka Przyr. Technol. 2(3):1-9.
Muchtadi D. 1989. Evaluasi Nilai Gizi Pangan. Depdikbud, Ditjen Dikti-PAU. Bogor (ID): IPB Pr.
Moyle PB, Cech JJ. 1988. Fishes: An Introduction to Ichtiology. Second edition. New York (US): Prentice Hall.
Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Bogor (ID): IPB Pr. Putra AN. 2010. Kajian probiotik prebiotik dan sinbiotik untuk pertumbuhan ikan
nila Oreochromis niloticus. [tesis]. Bogor (ID): Institut Pertanian Bogor. Reddy BS. 1999. Possible mechanism by which pro- and prebiotics influence
colon carcinogenesis and tumor growth. Br J Nutr. 129(7):1478-1482. Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre GI. 2010.
Prebiotics in aquaculture: a review. Aquaculture Nutrition. 16(2):117-136. Selvaraj V, Sampath K, Sekar V. 2009. Administration of lipopolysaccaride
19 Sukenda, Jamal L, Wahjuningrum D, Hasan A. 2008. Penggunaan kitosan untuk
pencegahan infeksi Aeromonas hydrophila pada ikan lele dumbo Clarias sp.
Jurnal Akuakultur Indonesia. 7(2):161-171.
Tanbiyaskur. 2011. Efektivitas pemberian probiotik, prebiotik, dan sinbiotik melalui pakan untuk pengendalian infeksi Sterptococcus agalactiae pada ikan nila Oreochromis niloticus [tesis]. Bogor (ID): Institut Pertanian Bogor. Tizard I. 1988. Pengantar Imunologi Veteriner. Edisi ke-2. Partodirejo M,
Hardjosworo S, penerjemah. Surabaya (ID): Airlangga University Pr.
Wedemeyer GA, Yasutake WT. 1977. Clinical methods for the assessment of the effect environmental stress on fish health. Technical Papers of the U.S. Fish and Wildfield Service. 89:1-17.
20
LAMPIRAN
Lampiran 1. Komposisi pakan Kadar protein : 33,36% Kadar lemak : 1,93% Kadar air : 5,89% Kadar abu : 12,83% Serat kasar : 6,57%
Lampiran 2. Data statistik uji ANOVA masing-masing perlakuan ANOVA
Sum of Squares df Mean Square F Sig.
KH Awal Between Groups 128.420 2 64.210 1.626 .273
Within Groups 236.874 6 39.479
Total 365.294 8
KH Akhir Between Groups 4062.500 2 2031.250 19.500 .002
Within Groups 625.000 6 104.167
Total 4687.500 8
Lampiran 3. Data statistik uji lanjut Duncan kelangsung hidup akhir KH Akhir
Perlakuan
N
Subset for alpha = 0.05
1 2
Duncana B 3 50.00
C 3 87.50
A 3 100.00
21
RIWAYAT KEHIDUPAN
Penulis dilahirkan di Indramayu pada tanggal 9 Maret 1992 dari ayah Hermanto dan ibu Hanny Rohmiyatni. Penulis adalah anak keempat dari enam bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Sindang Indramayu dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama mengikuti perkuliahan, penulis pernah mengikuti kegiatan IPB