MEMPELAJARI AKTIVITAS KERATINASE DAN
DISULFIDA REDUKTASE DARI Bacillus sp. MTS
DALAM DEGRADASI KERATIN
SRI RAHAYU
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini, saya menyatakan bahwa disertasi yang berjudul Mempelajari Aktivitas Keratinase dan Disulfida Reduktase dari Bacillus sp. MTS dalam Degradasi Keratin adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2010
ABSTRACT
SRI RAHAYU. Study on Keratinase and Disulphide Reductase Activity from
Bacillus sp. MTS in Keratin Degradation. Under guidance of MAGGY THENAWIDJAJA SUHARTONO, DAHRUL SYAH and ANTONIUS SUWANTO.
Keratin is insoluble and very stable protein. The disulphide bonds, hydrogen bonds and hydrophobic interaction within the polypeptide gives mechanical strength and also resistance to some protease enzyme. The main objective of this research was to study degradation of native chicken feather by keratinolytic enzymes from Bacillus sp., that is the role of keratinase and disulphide reductase, and this was conducted in four steps.
The first step was conducted to select Bacillus sp. which produced extracellular keratinase and disulphide reductase. The isolates used were B. licheniformis MB-2 and Bacillus sp. MTS. The first isolate was a thermophillic bacterium screened from hot springs water of Mount Tompaso-Manado and the latter was mesophillic bacterium from sulphuric soil of Mount Tangkuban Perahu-Bandung. The result showed that Bacillus sp.MTS was more effective than
B.licheniformis MB-2 for chicken feather degradation. A minimum medium which contained mineral salts was the best medium for Bacillus sp.MTS to secrete disulphide reductase, while the best medium for keratinase production was minimum medium with addition of 0.02% tripton and 0.02% yeast extract. Bacillus
sp.MTS was found to secrete intracellular and extracellular keratinase and disulphide reductase and it was selected for further study.
The second step was conducted to characterize the crude keratinase and disulphide reductase of Bacillus sp.MTS . The optimum temperature for keratinase and disulphide reductase were 55o
C and 28oC respectively. Optimum pHs for keratinase were 8.0, 10.0 and 11.0, and optimum pH for disulphide reductase was 9.0. SDS-PAGE analysis of the culture-free cell showed 17 – 60 kD protein bands. Zymography analysis of ammonium sulphate fraction (50% w/v) showed that Bacillus sp.MTS secreted multy fraction keratinases of 17, 25, 32, 53, 96 and > 97 kD. The 25 kD keratinase was the most stable enzyme at pH 8.0-11.0 and temperature 55-900
The third step was to purify keratinase and disulphide reductase. Purification with ammonium sulphate 50% (w/v), dialysis, Butyl sepharose FF chromatography dan Sephacryl S-200HR chromatography could increase keratinase and disulphide purities, and gave six active keratinase with specific activity of 10 to 37 U/mg and three active disulphide reductase with specific activity of 30 to 64 U/mg. SDS-PAGE analysis of the highest activities of keratinase fractions showed molecular weights of 53, 32 and 17 kD. The highest activities of disulphide reductase fractions showed of 29 and 17 kD molecular weight. The purified keratinase and disulphide reductase had optimum activity at alkaline pHs (8.0-12.0).
C while the 32 and 53 kD fractions were found as unstable.
In
t
he fourth step the role of disulphide reductase, reducing agent (DTTand BMT) and urea in hydrolysis of native chicken feather and sheep wool and NaOH prehydrolized chicken feather were studied. The activity of purified keratinase was increased by the presence of purified disulphide reductase.
RINGKASAN
SRI RAHAYU. Mempelajari Aktivitas Keratinase dan Disulfida Reduktase dari
Bacillus sp. MTS dalam Degradasi Keratin. Di bawah bimbingan MAGGY THENAWIDJAJA SUHARTONO, DAHRUL SYAH, dan ANTONIUS SUWANTO.
Keratin adalah suatu protein tidak larut dan sangat stabil karena tingginya ikatan disulfida. Ikatan hidrogen dan interaksi hidrofobik di dalam molekul yang memberikan kekuatan mekanik dan resistensi terhadap berbagai protease. Tujuan utama penelitian ini adalah mempelajari degradasi keratin bulu ayam oleh enzim enzim keratinolitik yang dihasilkan oleh Bacillus sp. khususnya keterlibatan disulfida reduktase ekstraseluler. Untuk mencapai tujuan tersebut maka penelitian ini dilaksanakan dalam empat tahap.
Tahap pertama penelitian bertujuan memilih isolat Bacillus sp. yang menghasilkan keratinase dan disulfida reduktase ekstraseluler yaitu Bacillus licheniformis MB-2 dan Bacillus sp. MTS. B. licheniformis MB-2 adalah bakteri termofilik yang diisolasi dari sumber air panas Gn. Tompaso-Manado. Bakteri mesofilik Bacillus sp. MTS diisolasi dari tanah belerang Gn. Tangkuban Perahu-Bandung. Hasil penelitian menunjukkan Bacillus sp. MTS lebih efektif dan efisien dalam menghancurkan bulu ayam utuh dibandingkan B. licheniformis MB-2. Medium terbaik bagi Bacillus sp. MTS dalam menghasilkan disulfida reduktase adalah medium minimal, yaitu medium berisi berbagai garam mineral dan tepung bulu ayam, sedangkan medium terbaik bagi produksi keratinase adalah medium minimal + 0.02% tripton + 0.02% ekstrak kamir. Bacillus sp. MTS ditemukan menghasilkan keratinase dan disulfida reduktase baik di dalam cairan intraseluler maupun ekstraselulernya. Bacillus sp. MTS dipilih untuk digunakan pada penelitian tahap selanjutnya.
Tahap kedua penelitian bertujuan melakukan karakterisasi keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS. Temperatur dan pH optimum aktivitas keratinase adalah 55oC dengan pH 8.0, 10.0, dan pH 11.0, sedangkan disulfida reduktase pada 28oC dan pH 9.0. Analisis SDS-PAGE kultur bebas sel menunjukkan beberapa pita protein berukuran 17–60 kDa. Analisis zymografi fraksi amonium sulfat (50% b/v) yang telah didialisis menunjukkan bahwa
Bacillus sp. MTS menghasilkan multi fraksi keratinase yang mampu menghidrolisis gelatin, yaitu protein berberat molekul 17, 25, 32, 53, 96, dan > 97 kDa. Molekul keratinase berukuran 25 kDa merupakan molekul yang paling stabil pada pH 8.0-11.0 dan temperatur 55-900
Tahap ketiga penelitian bertujuan melakukan pemurnian keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS. Tahapan pemurnian 50% (b/v) amonium sulfat, dialisis, kromatografi Butyl Sepharose FF, dan kromatografi
Sephacryl S-200HR dapat meningkatkan kemurnian keratinase dan disulfida reduktase. Diperoleh enam fraksi aktif keratinase dengan aktivitas spesifik bervariasi dari 10-37 U/mg dan tiga fraksi aktif disulfida reduktase dengan aktivitas 30-64 U/mg. Analisis SDS-PAGE fraksi dengan aktivitas keratinase tertinggi menampakkan tiga pita protein berukuran 53, 32, dan 17 kDa, sedangkan fraksi dengan aktivitas disulfida reduktase tertinggi dua pita berukuran 29 dan 17 kDa. Fraksi keratinase dan disulfida reduktase murni memiliki aktivitas optimum pada pH alkali (8.0-12.0).
C, sedangkan molekul berukuran 35 dan 53 kDa adalah molekul yang paling tidak stabil.
prehidrolisis NaOH. Aktivitas keratinase murni Bacillus sp. MTS dalam degradasi keratin ditingkatkan oleh keterlibatan disulfida reduktase murni. Aktivitas keratinase meningkat setelah substrat keratin direaksikan dengan disulfida reduktase; pada tepung bulu ayam prehidrolisis NaOH meningkat dari 5 U/mg menjadi 10.9 U/mg, tepung bulu ayam alami meningkat dari 4.5 U/mg menjadi 27.5 U/mg dan tepung bulu domba alami meningkat dari 8.7 U/mg menjadi 24.3 U/mg. Aktivitas bersama kedua enzim dari Bacillus sp. MTS lebih tinggi 10-20 kali dibandingkan dengan aktivitas bersama proteinase K dan disulfida reduktase, maupun proteinase K dengan senyawa pereduksi dan urea. Senyawa pereduksi 0.1 mM DTT meningkatkan kemampuan hidrolisis keratinase pada ketiga substrat keratin. Analisis Scanning Electron Microscopy (SEM) menampakkan lebih banyak kerusakan ditemukan pada permukaan selongsong bulu ayam yang diinkubasi dengan keratinase dan disulfida reduktase murni.
©
Hak cipta milik Institut Pertanian Bogor, tahun 2010
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik
atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar.
MEMPELAJARI AKTIVITAS KERATINASE DAN DISULFIDA
REDUKTASE DARI
Bacillus
sp
.
MTS DALAM DEGRADASI
KERATIN
SRI RAHAYU
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Departemen Ilmu dan Teknologi Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Mempelajari Aktivitas Keratinase dan Disulfida Reduktase dari Bacillus sp. MTS dalam Degradasi Keratin
Nama : SRI RAHAYU
NRP : F 261040031
Disetujui, Komisi Pembimbing
Ketua
Prof. Dr. Ir. Maggy T. Suhartono.
Dr. Ir. Dahrul Syah
Anggota Anggota
Prof. Dr. Ir. Antonius Suwanto, M.Sc.
Mengetahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S
.
Penguji Luar Komisi Sidang Tertutup
1. Dr. Tresnawati Purwadaria Balai Penelitian Ternak Bogor
2. Dr. Ir. Siswa Setyahadi
Badan Pengkajian dan Penerapan Teknologi Jakarta
Penguji Luar Komisi Sidang Terbuka
1. Emannuel Ramli, Ph.D, CPIM Fakultas Teknobiologi
Universitas Katolik Atma Jaya-Jakarta
2. Raymond R. Tjandrawinata, Ph.D.
PRAKATA
Penelitian yang berjudul Mempelajari Aktivitas Keratinase dan Disulfida Reduktase dari Bacillus sp. MTS Dalam Degradasi Keratin dilaksanakan dari bulan September 2006 sampai dengan Oktober 2009. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi dan Biokimia PPSHB-IPB dan Laboratorium Bioteknologi Pangan SEAFAST, dengan dukungan dana dari Proyek Hibah Bersaing 2007-2009 serta Proyek Hibah Doktor 2009.
Penulis menyampaikan terimakasih dan penghargaan yang tinggi kepada Prof. Dr. Ir. Maggy T Suhartono sebagai ketua komisi pembimbing yang telah mencurahkan waktu dan perhatian selama proses pembuatan proposal, bimbingan dalam penelitian, penulisan disertasi dan artikel ilmiah. Suatu kehormatan bagi penulis karena telah diajak bekerjasama dalam mengungkap enzim-enzim keratinolitik serta memahami karakteristik biokimia dan molekuler enzim tersebut. Terima kasih atas segala fasilitas yang diberikan kepada penulis untuk melakukan penelitian di Laboratorium Mikrobiologi dan Biokimia Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB)-IPB.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Dr. Ir. Dahrul Syah, M.Sc atas bimbingan dalam penelitian dan penulisan disertasi. Bapak telah mengarahkan penulis untuk memahami perilaku enzim dari struktur primernya. Terima kasih atas segala fasilitas yang diberikan kepada penulis unruk melakukan penelitian di Laboratorium Bioteknologi Pangan SEAFAST.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Prof. Dr. Ir. Antonius Suwanto, M.Sc atas bimbingan dalam penelitian dan penulisan disertasi. Terima kasih karena di awal penelitian Bapak telah mengarahkan dan mengingatkan penulis untuk memilih keratinase dan keratin sebagai materi kajian.
Terima kasih kepada Bapak/Ibu penguji Luar Komisi sidang tertutup dan sidang terbuka yang telah memberikan saran-saran untuk penyempurnaan disertasi ini.
Rekan-rekan dan sahabat seperjuangan di PPSHB-IPB, Prodi Ilmu Pangan maupun di prodi lain di lingkungan IPB, terima kasih atas persahabatan, dorongan semangat dan bantuan selama penelitian. Kepada Ibu Ika Malikha, S.TP., Ibu Eni Sumartini, mbak Mar, mbak Dewi , mbak Ari, Bi Sari dan pak Karsun yang selalu siap mengulurkan tangan.
Terima kasih atas kehadiran rekan-rekan dari Universitas Soedirman pada sidang terbuka: Wakil Dekan 3 Fapet UNSOED Dr. Drh. Moch. Samsi, MS., Kepala Lab. Nutrisi dan Makanan Ternak beserta staf Dr. Ir. Ning Iriyanti, MP., Dr. Ir. Sri Suhermiyati, MS., Dr. Ir. Moch. Bata, MS., Ir. Nur Hidayat, MS., serta kakanda Dr. Ir. Wardhana Suryapratama, MS. dan Prof. Dr. Ir. FM. Suhartati, MS.
Rasa terima kasih yang tak terhingga disampaikan kepada yang tercinta Ibunda Kartinah Rahadi, Bapak dan Ibu Prof. Dr. H. Nursid Sumaatmadja, kakak-kakak dan adik-adik yang senantiasa memberikan dukungan, doa dan dorongan semangat. Terima kasih kepada tiga aset berharga dalam hidup saya : suami dan anak-anak yang senantiasa menyejukan, menguatkan, dan sabar mendampingi penulis menjalani studi. Serta kenangan yang dalam kepada Almarhum Ayahanda Rahadi Adhikusumo atas doa dan kasih sayangnya yang tulus.
Semoga Allah yang Maha Pemurah membalas segala kebaikan yang telah diberikan dengan balasan yang lebih sempurna. Semoga pencapaian saya kali ini dapat menjadi pencerahan bagi kedua anak saya, 21 keponakan dan satu cucu keponakan.
Bogor, Juli 2010
RIWAYAT HIDUP
Penulis dilahirkan di Purwokerto pada tanggal 27 Oktober 1963 sebagai anak keenam dari sembilan bersaudara dari Bapak R. Rahadi Adhikusumo (alm) dan Ibu R. Ngt. Kartinah. Tahun 1988 penulis menikah dengan Drs. Mochamad Sabar dan dikaruniai dua orang anak, Ayesa Prameswari (1990) dan Fajarizky Mahendra (1994).
Pada tahun 1987 penulis menyelesaikan pendidikan strata satunya di Fakultas Peternakan UNSOED dengan skripsi yang bertema daun pegagan sebagai pakan ayam pedaging. Tahun 1997 penulis melanjutkan studi S2 pada Program Studi Bioteknologi IPB dan menulis thesis dengan topik enzim kitinase termostabil dari Bacillus sp. K29-14 di bawah bimbingan Prof. Dr. Ir. Maggy T Suhartono dan Dr. Ir. Dahrul Syah. Tahun 2004 penulis diterima sebagai mahasiswa S3 di Program Studi Ilmu Pangan dalam bidang peminatan Mikrobiologi dan Bioteknologi pada Sekolah Pascasarjana IPB. Selama mengikuti program S3, penulis pernah menyajikan karya ilmiah berjudul
Preliminary Study on Keratinolytic Enzymes from Two Indonesian Isolates pada acara The 4th
Sejak tahun 1988 penulis bekerja sebagai staf pengajar Fakultas Peternakan Universitas Jenderal Soedirman (UNSOED) Purwokerto dan ditempatkan di Laboratorium Nutrisi dan Makanan Ternak.
Indonesian Biotechnology Conference : “Biotechnology for better food, health and environment” di IPB International Convention Center Bogor, tanggal 5-7 Agustus 2008. Sebagian hasil penelitian ini telah diterbitkan di
DAFTAR ISI
Halaman
DAFTAR TABEL i
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN iv
PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 3
Hipotesis 4
Tujuan dan Manfaat Penelitian 4 Waktu dan Tempat Penelitian 4
TINJAUAN PUSTAKA
Keratin 5
Keratinase 7
Disulfida Reduktase 11 Pemurnian Enzim 13 Degradasi Keratin 20 Aplikasi Keratinase 22
BAHAN DAN METODE
Subyek Penelitian 26 Strategi Penelitian 26 Bagan Alir Penelitian 28 Metode Penelitian 29
HASIL DAN PEMBAHASAN
Seleksi Isolat 40 Karakterisasi Enzim 51
Pemurnian Enzim 61
Desain Aplikasi 73
KESIMPULAN 79
DAFTAR PUSTAKA 80
DAFTAR TABEL
Halaman
1. Komposisi asam amino keratin bulu ayam 6
2. Kandungan sistin rambut dan bulu beberapa spesies hewan 7
3. Total asam amino dan sistein keratinase yang dihasilkan
oleh beberapa bakteri 9
4. Karakteristik keratinase dari berbagai mikroorganisme 10
5. Karakteristik disulfida reduktase dari beberapa mikroorganisme 13
6. Metode pemurnian keratinase dan disulfida reduktase beberapa bakteri 17
7. Pendugaan berat molekul disulfida reduktase dari beberapa bakteri
menggunakan teknik SDS-PAGE 18
8. Pendugaan berat molekul keratinase dari beberapa bakteri
menggunakan teknik SDS-PAGE dan Zimografi 19
9. Prosedur analisis aktivitas keratinase 31
10. Komposisi gel penahan dan gel pemisah SDS-PAGE 34
11. Tabulasi data pengujian degradasi keratin 38
12. Penyusutan berat berbagai keratin alami setelah didegradasi oleh
B. licheniformis MB-2 and Bacillus sp. MTS 41
13. Kandungan asam amino R, H, N, dan Q keratinase dan subtilisin
dari beberapa spesies basilus. 57
14. Stabilitas panas dan suhu keratinase Bacillus sp. MTS 58
15. Pemurnian keratinase Bacillus sp. MTS 65
16. Pemurnian disulfida reduktase Bacillus sp. MTS 68
17. Perkiraan berat molekul pita-pita protein Bacillus sp. MTS
dari sumber enzim yang berbeda 69
18. Suhu dan pH optimal keratinase dan disulfida reduktase (DR) murni 71
19. Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase
Bacillus sp.MTS pada 1% tepung bulu ayam prehidrolisis dengan dan tanpa penambahan disulfida reduktase (DR) atau senyawa
pereduksi dan urea 73
20. Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase
urea 74
21. Perbandingan aktivitas keratinolitik Proteinase-K dengan keratinase
Bacillus sp.MTS pada 1% tepung bulu domba alami dengan dan tanpa penambahan disulfida reduktase (DR), senyawa pereduksi, dan
urea 75
22. Aktivitas enzim kasar Bacillus sp. MTS dengan dan tanpa
penambahan senyawa pereduksi dan urea 76
23. Aktivitas enzim murni Bacillus sp. MTS dengan dan tanpa
penambahan disulfida reduktase (DR), senyawa pereduksi, dan
DAFTAR GAMBAR
Halaman
1. Sekuen asam amino keratin bulu unggas 6
2. Sekuen asam amino keratinase Bacillus licheniformis PWD-1 8
3. Mekanisme aktivitas Thioredoxin Reduktase 12
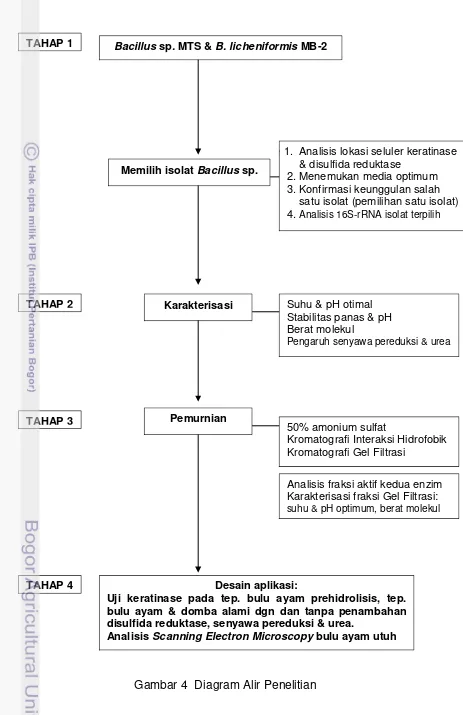
4. Diagram alir penelitian 28
5. Degradasi lengkap bulu ayam utuh oleh B. licheniformis MB-2 pada hari ke-0 (a) dan ke-12 inkubasi (b) dan Bacillus sp.MTS (c-d) pada hari ke-0 (c) dan ke-4 inkubasi (d). 40
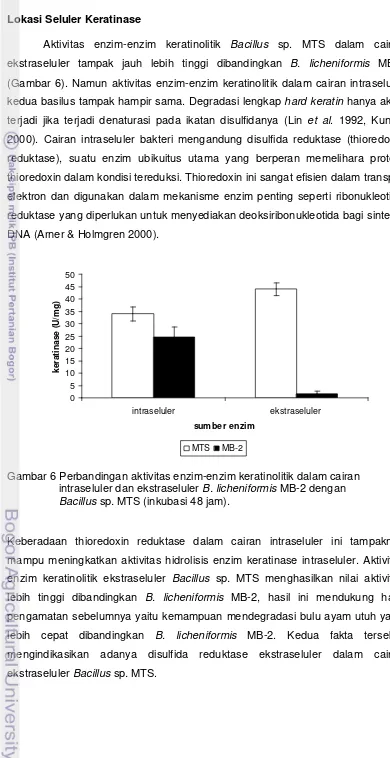
6. Perbandingan aktivitas keratinolitik enzim dalam cairan intraseluler dan ekstraseluler B. licheniformis MB-2
dengan Bacillus sp. MTS 43
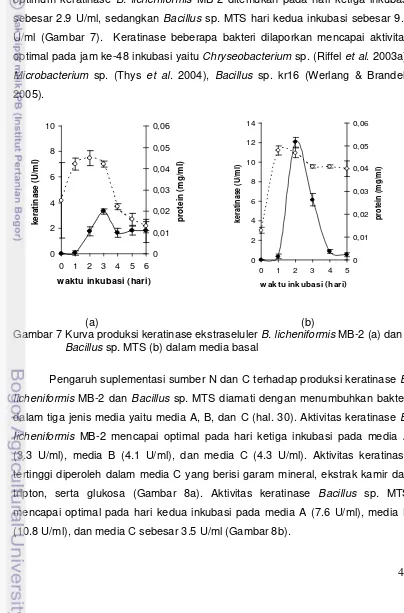
7. Kurva produksi keratinase ekstraseluler B. licheniformis MB-2 (a)
dan Bacillus sp. MTS (b) dalam media basal 44
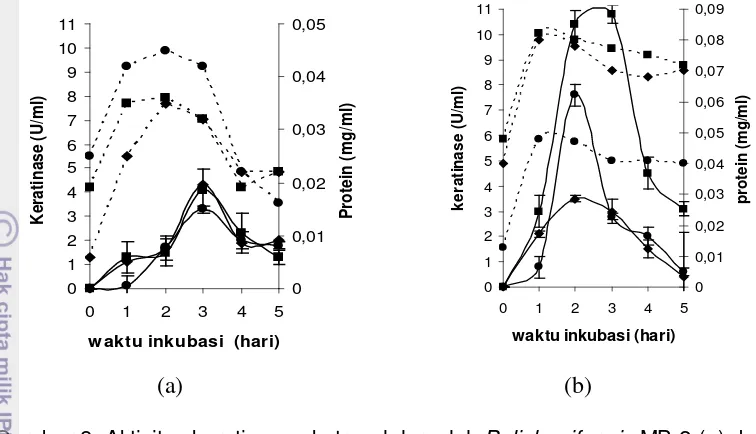
8. Aktivitas keratinase ekstraseluler oleh B. licheniformis MB-2 (a)
dan Bacillus sp. MTS (b) dalam berbagai media 45
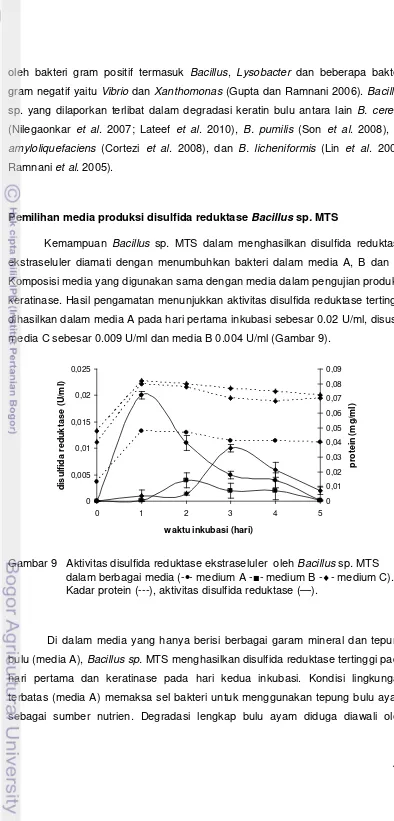
9. Aktivitas disulfida reduktase ekstraseluler oleh Bacillus sp. MTS
dalam berbagai media 47
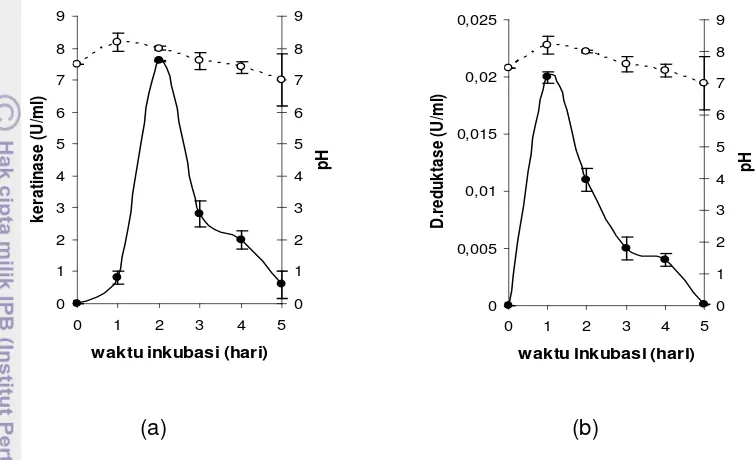
10. Aktivitas keratinase ekstraseluler (a) dan disulfida reduktase (b)
serta perubahan pH media produksi enzim 49
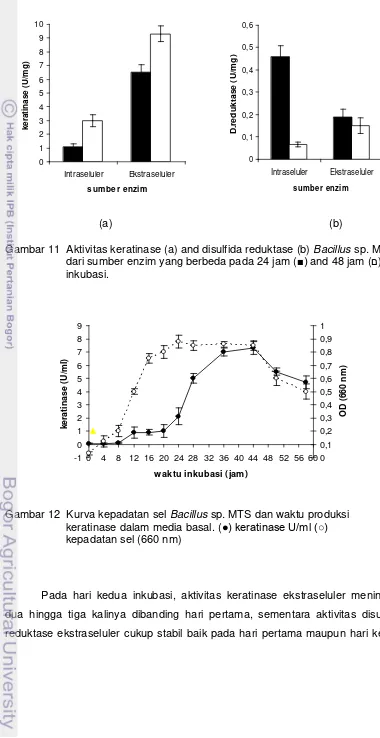
11. Aktivitas keratinase (a) and disulfida reductase (b) Badcillus sp.
MTS dari sumber enzim yang berbeda pd 24 dan 48 jam inkubasi 50
12. Kurva kepadatan sel Bacillus sp. MTS dan waktu produksi
keratinase dalam media basal 50
13. SDS-PAGE filtrat bebas sel Bacillus sp. MTS hari pertama
dan kedua inkubasi. 52
14. Analisis zymogram aktivitas keratinase Bacillus sp. MTS 52
15. Pengaruh suhu dan ketahanan panas keratinase kasar 54
16. Zymogram ketahanan panas keratinase 55
17. Pengaruh pH dan ketahanan pH keratinase kasar 56
18. Zymogram ketahanan pH keratinase 56
20. Pengaruh DTT, BMT dan urea terhadap aktivitas keratinase 60
21. Pengaruh pengendapan amonium sulfat terhadap aktivitas
keratinase dan disuldida reduktase 61
22. Profil elusi Butyl Sepharose FF dari keratinase 63
23. Profil elusi Butyl Sepharose FF dari disulfida reduktase 63
24. Profil elusi Sephacryl S-200HR dari keratinase 64
25. SDS-PAGE keratinase murni 65
26. Profil elusi Sephacryl S-200HR dari disulfida reduktase 67
27. SDS-PAGE disulfida reduktase murni 67
28. Native-PAGE fraksi dialisis enzim ekstraseluler 70
29. Pengaruh suhu dan pH terhadap aktivitas keratinase murni 71
30. Pengaruh suhu dan pH terhadap aktivitas disulfida reduktase murni 72
DAFTAR LAMPIRAN
Halaman
1. Pewarnaan Silver Metode Vorum 86
2. Kurva standar 87
3. Profil elusi DEAE Sephadex dan Butyl sepharose FF dari keratinase
Menggunakan Akta Purifier UNICORN 5.1 89
4. Sekuen DNA Bacillus sp. MTS hasil penggandaan primer reverse
dan forward 91
5. Sekuen allignment DNA Bacillus sp. MTS terhadap sekuen DNA
bakteri-bakteri lain 92
6. Keseluruhan pengamatan SEM bulu ayam utuh setelah diinkubasi dengan enzim murni dan kasar dari Bacillus sp. MTS 93
PENDAHULUAN
Latar Belakang
Populasi ayam pedaging di Indonesia pada tahun 2008 adalah 1.076 juta ekor (BPS 2008). Jika diasumsikan rerata berat ayam pedaging yang dipotong 1.5 kg dan sebesar enam persen dari bobot badan adalah bobot bulu, maka diperkirakan pada tahun tersebut dihasilkan 96.830 ton limbah bulu ayam. Bulu mengandung protein sebesar 70–80% terutama disusun oleh keratin, yaitu suatu protein tidak larut dan sangat stabil karena tingginya ikatan disulfida. Ikatan hidrogen dan interaksi hidrofobik antar-polipeptida memberikan kekuatan mekanik dan resistensi terhadap beberapa protease. Meskipun material keratin tidak larut dan sulit didegradasi, keratin dapat didegradasi oleh enzim keratinase dari mikroorganisme yang hidup di alam, misalnya bakteri dari genus Bacillus,
Streptomyces, Actinomycetes, saprofit, dan fungi dermatofilik. Degradasi keratin secara mekanik, kimia, dan enzimatik menggunakan protease keratinolitik menghasilkan berbagai produk yang dapat dimanfaatkan lebih lanjut, yaitu sebagai sumber protein dalam pakan ternak, pupuk, plastik, lem, biodegradable films atau untuk produksi asam amino serin, sistin, dan prolin.
Pada umumnya keratinase bersifat alkali dan memiliki spesifisitas substrat luas, karena selain mampu menghidrolisis keratin juga kasein, albumin, elastin, kolagen, gelatin, dan fibrin. Sifat tersebut menyebabkan aplikasi protease keratinolitik cukup luas di antaranya di bidang pakan ternak, industri kulit, industri sabun, bioteknologi, lingkungan, dan medis/kesehatan. Di bidang pakan ternak, ekstrak kasar keratinase terbukti mampu meningkatkan kualitas nutrisi tepung bulu ayam. Suplementasi preparat enzim protease dan keratinase ke dalam ransum dapat meningkatkan kinerja produksi ayam. Keratinase dapat membantu menghilangkan bulu dalam industri penyamakan kulit, sehingga dapat menggantikan peran natrium sulfida yang beracun dan berpolusi bagi lingkungan. Di bidang rekayasa genetika, gen keratinase (kerA) Bacillus licheniformis PWD-1 telah berhasil diklon ke dalam Bacillus subtilis untuk tujuan overekspresi serta difusikan dengan gen streptavidin untuk tujuan bioimobilisasi. Keratinase B. licheniformis PWD-1 yang diisolasi dari lokasi penguraian limbah ayam di Amerika (William & Shih 1989, William et al. 1990) dilaporkan secara in vitro
al. 2003). Hal tersebut memunculkan peluang bagi keratinase menjadi agens dekontaminasi peralatan medis dan produk-produk daging ternak. Di bidang industri pangan protease alkali digunakan untuk berbagai tujuan antara lain pada pembuatan keju sebagai koagulan protein dan hidrolisis ikatan peptida spesifik untuk menghasilkan para-α-kasein dan makropeptida; meningkatkan kelarutan protein gluten dan volume roti; meningkatkan kelarutan dan yield serta menurunkan rasa pahit produk kedelai; menurunkan rasa pahit pada hidrolisat protein; dan digunakan dalam sintesis aspartam (Rao et al. 1998).
Degradasi keratin menjadi molekul yang lebih sederhana merupakan proses yang kompleks dan memerlukan kerja sinergis enzim-enzim keratinolitik. Beberapa peneliti melaporkan bahwa hanya protease keratinolitik (keratinase) saja yang berperan dalam degradasi keratin, namun dewasa ini peneliti lain melaporkan adanya peran enzim lain yaitu disulfida reduktase yang meningkatkan efisiensi dan menyempurnakan proses degradasi tersebut. Mekanisme degradasi keratin diduga diawali oleh enzim disulfida reduktase yang beraksi pada ikatan disulfida yang menjaga kestabilan mekanik keratin. Proses tersebut memudahkan keratinase (protease) untuk melanjutkan proses degradasi bulu. Indikasi keterlibatandisulfida reduktase dalam degradasi keratin telah dilaporkan oleh beberapa peneliti. Dalam media cair yang berisi bulu ayam utuh, aktivitas keratinolitik ekstraseluler Bacillus licheniformis RG1 secara sinergis meningkat hampir tiga kalinya dengan penambahan disulfida reduktase intraseluler (Ramnani et al. 2005), sementara Vibrio sp.strain kr6 dilaporkan menghasilkan keratinase ekstraseluler dan senyawa thiol yang mengindikasikan adanya aktivitas disulfida reduktase (Riffel et al. 2003a). Yamamura et al.
(2002a) melaporkan, Stenotrophomonas sp. menghasilkan keratinase dan disulfida reduktase ekstraseluler yang berperan dalam degradasi bulu ayam.
B. licheniformis MB-2 dan Bacillus sp. MTS adalah dua isolat Basilus yang pada tahap awal penelitian ini menunjukkan kemampuan menghancurkan bulu ayam utuh. Bakteri termofilik B. licheniformis MB-2 diisolasi dari sumber air panas Gn. Tompaso-Manado Sulawesi Utara dan dilaporkan menghasilkan enzim kitinase (Toharisman et al 2005) dan kitosanase ekstraseluler (Chasanah
Bacillus sp. MTS memiliki kemampuan lebih cepat dalam menghancurkan bulu ayam utuh. Dalam penelitian ini, pada tahap awal dilakukan konfirmasi terhadap keunggulan Bacillus sp. MTS, dan penelitian selanjutnya berfokus pada isolat
Bacillus sp. MTS sebagai penghasil enzim keratinase dan disulfida reduktase. Sampai saat ini sebagian besar peneliti lebih memusatkan perhatian pada keratinase, padahal pemotongan pada ikatan sistin agaknya berpengaruh nyata dalam degradasi keratin. Sejauh ini kerja sinergis antara keratinase dan reduksi ikatan sistin pada bakteri keratinolitik masih terus dikaji dan keberadaan serta karakter disulfida reduktase ekstraseluler dari Bacillus sp. belum pernah dilaporkan. Berdasar latar belakang pemikiran tersebut maka sangatlah diperlukan untuk mengetahui karakteristik dan peranan enzim disulfida reduktase dari Bacillus sp. MTS dalam degradasi keratin bulu ayam.
Perumusan Masalah
Banyaknya ikatan disulfida (S-S), ikatan hidrogen, dan interaksi hidrofobik pada struktur keratin menyebabkan protein keratin sangat stabil, kaku, dan tidak dapat didegradasi oleh enzim proteolitik yang umum seperti tripsin, pepsin, dan papain. Kandungan sistein pada keratin berkisar antara 11–20% dan tidak dimiliki oleh jenis protein lainnya. Jembatan sistein adalah struktur penting keratin dan merupakan penghambat kerja enzim proteolitik dalam memecah keratin.
Hipotesis
Hipotesis penelitian ini adalah (1) Bacillus sp. menghasilkan enzim keratinase ekstraseluler, (2) Bacillus sp. menghasilkan disulfida reduktase ekstraseluler yang terlibat dalam degradasi keratin, (3) disulfida reduktase penting untuk efisiensi dan efektivitas degradasi struktur keratin bulu ayam.
Tujuan Penelitian
Tujuan penelitian ini adalah (1) memilih isolat Bacillus sp. yang menghasilkan keratinase dan disulfida reduktase, (2) mengetahui lokasi seluler kedua enzim, (3) melakukan karakterisasi dan pemurnian kedua enzim, (4) mempelajari aktivitas kedua enzim khususnya keterlibatan disulfida reduktase pada degradasi keratin alami, baik dengan ataupun tanpa penambahan senyawa pereduksi dan urea.
Manfaat Penelitian
Hasil penelitian ini diharapkan memberi informasi karakteristik enzim-enzim yang berperan dalam degradasi keratin bulu ayam yaitu keratinase dan disulfida reduktase. Informasi tersebut diperlukan untuk aplikasi yang efektif enzim-enzim keratinolitik Bacillus sp. khususnya di bidang pakan ternak, pangan, lingkungan, bioteknologi, dan medis/kesehatan.
Waktu dan Tempat Penelitian
Penelitian ini berlangsung dari bulan Februari 2006 sampai Oktober 2009 di (1) Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, IPB-Bogor, (2) Laboratorium Bioteknologi Balai Besar Riset dan Pengolahan Produk Perikanan (BBRP3) Departemen Kelautan dan
TINJAUAN PUSTAKA
Keratin
Keratin adalah produk pengerasan jaringan epidermal tubuh tersusun dari protein serat yang kaya akan sulfur. Keratin banyak ditemukan pada rambut, kuku, bulu, dan semua produk epidermal. Rantai keratin dikemas dengan kuat dalam bentuk
α-heliks (α-keratin) atau β-sheet (β-keratin) menjadi rantai polipeptida superkoil (Parry
& North 1998). Banyaknya ikatan disulfida (S-S), ikatan hidrogen dan interaksi hidrofobik pada struktur keratin menyebabkan protein keratin sangat stabil, kaku, dan tidak dapat didegradasi oleh enzim proteolitik yang umum seperti tripsin, pepsin, dan papain (Riffel et al. 2003a). Kandungan sistein pada keratin berkisar 8% dan tidak dimiliki oleh jenis protein lainnya. Jembatan sistein adalah struktur penting keratin dan merupakan penghambat kerja enzin proteolitik dalam memecah keratin (Presland etal. 1989).
Bulu ayam mengandung protein keratin dengan struktur α-helik, material lain yang kaya akan protein α-keratin adalah rambut, wool, sayap, kuku, cakar, duri, sisik, tanduk, kulit penyu, dan lapisan kulit sebelah luar, sedangkan material yang kaya dengan protein β-keratin adalah sutera, bulu, dan jaring laba-laba (Lehninger 1982). Berdasarkan tingkat kemudahan hidrolisis, keratin digolongkan menjadi soft keratin dan hard keratin. Kuku, sisik, bulu, atau wool lebih mudah dihidrolisis dibanding rambut manusia, kemudahan tersebut berkaitan dengan kandungan sistinnya (Kunert 2000).
residu sistein ini akan membentuk jembatan disulfida dan memberi kekekuatan mekanik pada bulu.
Tabel 1 Komposisi asam amino (g asam-asam amino/100 g protein) keratin bulu ayam
Asam Amino Konsentrasi (%) Asam amino Konsentrasi (%)
Serin 9.31 Asam aspartat 4.73 Glysin 6.18 Asam glutamat 7.65 Prolin 8.77 Histidin 0.43 Arginin 5.36 Leusin 7.04 Threonin 3.50 Tirosin 1.96 Alanin 3.56 Valin 6.94 Metionin 1.30 Sistein 7.63 Isoleusin 4.28 Lisin 0.53 Fenilalanin 4.20
Sumber : (Moore et al 2006)
10 20 30 40 50
MSCYDLCRPC GPTPLANSCN EPCVRQCQDS RVVIQPSPVV VTLPGPILSS
60 70 80 90
FPQNTAVGSS TSAAVGSILS EEGVPISCGG FGISGLGSRF SGRRCLPC
Gambar 1 Sekuen asam amino keratin bulu unggas (Presland et al. 1989)
Goddard dan Michaelis (2008) menyatakan bahwa beberapa senyawa kimia seperti asam tioglikolat, KCN, Na2S, dan Na2SO3
(1) R-S-S-R + 2HS-CH
mampu mereduksi ikatan disulfida pada sistein, secara sederhana reaksi kimianya digambarkan sebagai berikut :
2OOH 2R-SH + [S-CH2OOH]
(2) R-S-S-R + HCN R-SH + R-S-CN
2
(3) R-S-S-R + H2S R-SH + H2S
(4) R-S-S-R + H
2
2S03 R-SH + R-S-S-03
Sumber Kisaran (%) Rata-rata (%) H
Tabel 2 Kandungan sistin rambut dan bulu beberapa spesies hewan.
Rambut manusia dewasa 16.8-18.4 18.7 Bulu Kelinci 11.9-14.0 13.0 Rambut Tikus --- 14.1 Bulu Kucing --- 13.1 Rambut Anjing --- 19.0 Bulu Domba (wool) 8.0-10.9 9.5 Bulu Angsa --- 6.3 Kuku manusia --- 5.2 Membran telur --- 7.6 Tanduk rusa --- 6.8
Sumber: (Wilson & Lewis 2008)
Keratin dapat diubah menjadi protein larut oleh asam/basa pada pH tertentu (pH flokulasi) dengan demikian dapat dihidrolisis oleh tripsin atau pepsin (Goddard & Michaelis 2008).
Keratinase
protein globular yang terbentuk dari rantai polipeptida yang berlipat secara kompak. Konformasi tersier protein globular merupakan bentuk yang paling stabil karena ditunjang oleh berbagai ikatan yang menstabilkan struktur tersier protein. Jenis-jenis ikatan tersebut adalah: ikatan hidrogen yang terdapat di antara gugus R residu asam amino rantai samping yang berdekatan, ikatan ion di antara gugus R yang berlawanan, interaksi hidrofobik dari gugus R asam amino hidrofobik, dan ikatan kovalen berupa ikatan disulfida dari residu sistin (Copeland 2000; Creighton 1993).
Keratinase atau enzim keratinolitik adalah sebutan bagi enzim protease spesifik yang dapat memecah substrat protease keratin (EC 3.4.21 atau EC 3.4.24 atau EC 3.4.99). Enzim keratinase dihasilkan oleh mikroba baik secara intraseluler maupun ekstraseluler. Sebagian besar protease yang dihasilkan oleh mikroba tergolong protease serin yang memerlukan kofaktor kation Mg dan Ca untuk aktivitasnya dan sebagian lagi merupakan protease alkalin (Toni et al. 2002, Huang et al. 2003, Lee et al. 2002). Keratinase Bacillus licheniformis PWD-1 adalah protease serin alkali yang tersusun dari 379 residu asam amino (Gambar 2). Tidak ditemukan residu sistein (C) pada sekuen keratinase dari Bacillus sp. namun pada sekuen keratinase
Streptomyces sp.OWU dan Stenotrophomonas maltophilia ditemukan residu sistein (Tabel 3).
1 MMRKKSFWLG MLTAFMLVFT MAFSDSASAA QPAKNVEKDY IVGFKSGVKT
51 ASVKKDIIKE SGGKVDKQFR IINAAKAKLD KEALKEVKND PDVAYVEEDH
101 VAHALAQTVP YGIPLIKADK VQAQGFKGAN VKVAVLDTGI QASHPDLNVV
151 GGASFVAGEA YNTDGNGHGT HVAGTVAALD NTTGVLGVAP SVSLYAVKVL
201 NSSGSGSYSG IVSGIEWATT NGMDVINMSL GGASGSTAMK QAVDNAYARG
251 VVVVAAAGNS GSSGNTNTIG YPAKYDSVIA VGAVDSNSNR ASFSSVGAEL
301 EVMAPGAGVY STYPTNTYAT LNGTSMVSPH VAGAAALILS KHPNLSASQV
351 RNRLSSTATY LGSSFYYGKG LINVEAAAQ
Gambar 2 Sekuen asam amino keratinase Bacillus licheniformis PWD-1 (Lin et al. 1995)
protease serin yang disebut protease, protease ini memiliki pH optimal 12.3. M-protease memiliki jumlah asam amino bermuatan negatif (asam aspartat dan glutamat) dan residu lisin lebih sedikit, serta peningkatan arginin dan asam amino netral hidrofilik (histidin, asparagin, glutamin) lebih banyak dibanding asam amino pada protease subtilisin.
Tabel 3 Total asam amino dan sistein keratinase yang dihasilkan oleh beberapa bakteri
Bakteri Nama Gen ∑ asam amino ∑ Sistein No Akses GenBank
B. licheniformis kerA 379 - AAY82467.1
B. pumilus - 383 - ACM47735.1
B. subtilis - 354 - ABY65723.1
Streptomyces sp.OWU - 268 3 AAU94349.1
Stenotrophomonas kerD 634 5
Kedua residu asam aspartat (Asp/D) dan glutamat (Glu/E) bermuatan negatif, perbedaan keduanya hanya pada gugus metil yang dimiliki. Gugus karboksil pada rantai samping Asp dan Glu mengion pada pH 3.9-4.3 dan menjadi sangat polar. Sementara gugus amin pada rantai samping asparagin (Asn/N) dan glutamin (Gln/Q) tidak mengion dan tidak terlalu reaktif, namun bersifat polar, antara donor dan akseptor ikatan hidrogen. Gugus amin juga labil pada pH sangat ekstrem dan temperatur tinggi, dan residu ini dapat diaminasi menjadi residu Asp dan Glu. Residu lisin (lys/K) dan arginin (Arg/R) bersifat hidrofobik dan bermuatan positif karena adanya gugus amino pada rantai samping Lys mengion pada pH 11.1 dan Arg pH 12.0. Gugus amino pada rantai samping Lys berperan pada berbagai reaksi sehingga memungkinkan Lys berubah menjadi bermuatan positif, negatif, atau netral. Rantai samping imodazole pada residu histidin (His/H) mempunyai beberapa kelengkapan khusus yang membuat His sangat efektif sebagai katalis nukleofilik, yaitu gugus amin yang lebih reaktif dari ion hidroksida (Creighton 1993).
ACN82379.1
maltophilia
2003), Bacillus sp. SCB-3 (Lee et al. 2002), Burtt dan Ichida (1999) melakukan isolasi bakteri keratinolitik dari 134 ekor burung dalam 32 spesies, hasilnya adalah sembilan dari sebelas bakteri keratinolitik diidentifikasi sebagai B. licheniformis dan satu isolat sebagai B. pumilus.
Tabel 4 Karakteristik keratinase dari berbagai mikroorganisme
Mikroorganisme Karakteristik Biokimiawi Sumber
Thermoanaerobacter keratinophilus
Keratinase intraseluler, akt.opt.: 60oC, pH 7.0 Keratinase ekstra seluler, akt.opt.: 85o
Riessen &
Antranikian (2001) C, pH 8.0
Protease serin, BM 135 kDa
Fervidobacterium islandicum AW-1
BM > 200 kDa dan 97 kDa.. Aktivitas opt. 100oC pH 9.0. Half life 90 menit pada 100o
Nam et al. (2002.) C.
Protease serin.
Bakteri Termofilik L-23
Aktivitas opt pH 7.0 dan 12.0, pH 8.0 dan 12.0. Suhu 60–65oC dan 75–80o
Gumulya (2004) C.
BM: 67, 97, 69, 71, 80, 99, 120.68 kDa.
Inhibitor (0.1%): ditiotreitol (DTT) ß-merkaptoetanol, tioglikolat
Lysobacter NCIMB 9497
Protease Serin,. Aktivator Fe2+. Inhibitor EDTA BM 148 kDa Aktivitas opt suhu 50o
Allpress et al. (2002) C.
Vibrio sp. strain kr2 Aktivitas optimal suhu 55o Sangali & Brandelli (2000)
C, pH 8.0
Chryseobacterium
sp.strain kr6
Aktivitas opt pH 7.5 dan suhu 55o
Riffel et al. (2003a) C.
Aktivator Ca (2+)
Inhibitor EDTA, Hg(2+), Cu(2+), penantrolin
Microbacterium sp. Aktivitas opt pH 7.0 dan suhu 55o
Thys et al. (2004) C.
Inhibitor EDTA, Hg(2+), Cu(2+), Zn (2+), b-merkaptoetanol, penantrolin
Vibrio sp. kr2
Flavobacterium sp kr6
Bacillus sp kr10
Aktivtas optimal Kr2 : pH 8.0, suhu 55oC Kr6: pH 7.5, suhu 40- 55oC
kr 10: pH 8.0, suhu 65o
Riffel et al. (2003b) C
Bacillus sp. strain kr16 Aktivitas opt pH 8.0-11.0 dan suhu 45-65o Werlang & Brandelli (2005.)
C. Inhibitor EDTA, Hg 2+ dan Sn2+.
Xanthomonas
maltophilia strain POA-1
Protease serin. Aktivitas opt pH 9.0 dan suhu 60o
Toni et al. (2002.) C. BM 36 kDa
Inhibitor: PMSF, Hg (2+)
Bacillus pumilus UN-31-C-42
Protease serin alkali.
Aktivitas opt pH 10.0 dan suhu 55o
Huang et al. (2003) C. BM 32 kDa
Inhibitor PMSF dan DFP
Thermoactinomyces candidus
Aktivitas opt pH 8.6 dan suhu 70o Ignatova et al.
(1999) C. BM 30 kDa
Aktivator: Ca2+
Bacillus sp. strain SCB-3
Keratinase pada umumnya memiliki aktivitas optimal pada pH netral hingga alkali (pH 7.0 – 12). Beberapa spesies bakteri menghasilkan keratinase termostabil dengan aktivitas optimal pada kisaran suhu 60–80o
Disulfida Reduktase
C. Berat molekul keratinase yang dihasilkan mikroba sangat bervariasi, berkisar dari 30 kDa hingga lebih dari 200 kDa. Substrat yang banyak digunakan dalam berbagai pengujian keratinase adalah tepung bulu ayam dan bulu sapi dengan konsentrasi berkisar 0.1–10% (Tabel 4).
Keratinase yang dihasilkan oleh mikroba memiliki spesifisitas luas, keratinase mampu menghidrolisis berbagai protein larut misalnya kasein, gelatin, serum albumin, albumin telur, hemoglobin, mioglobin, dan protein yang tak larut seperti keratin, elastin, kolagen, fibrin, laminin, fibronektin (Letourneau et al. 1998).
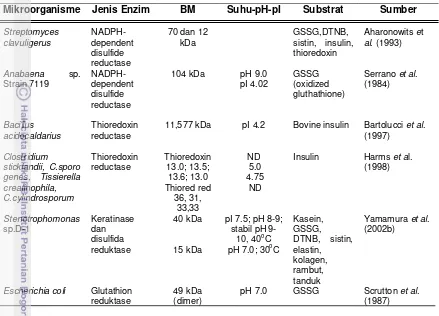
Thioredoxin reduktase (E.C. 1.6.4.5) dan glutathione reduktase (E.C. 1.6.4.2) merupakan dua jenis enzim yang aktif mengkatalisis reduksi ikatan disulfida dan keduanya termasuk golongan oksidoreduktase. Thioredoxin reduktase (TR atau TrxR) merupakan bagian dari sistem thioredoxin (Trx) yang berperan dalam berbagai fungsi biosintesis atau pelipatan protein. Sistem thioredoxin terdiri atas dua protein yaitu thioredoxin reduktase dan thioredoxin. Keduanya adalah protein redox-active dengan dua residu sistein yang terpisah oleh dua asam amino (glisin dan prolin) pada pusat katalitiknya (Rand & Grant 2006). Pada mikroorganisme, thioredoxin reduktase umumnya suatu dimer subunit identik dengan berat molekul 35 kDa, setiap subunit memiliki satu redox-active disulfida dan satu berikatan kuat dengan flavin adenin dinukleotida/FAD. Thioredoxin adalah protein ubikuitus dengan berat molekul 12 kDa dan nilai pI asam. Dua jenis aktivitas oksidoreduktase thioredoxin adalah: (a) sebagai pembawa elektron untuk proses-proses katalitik enzim-enzim biosintetik seperti ribonukleotida reduktase,(b) melindungi protein sel dari agregasi atau inaktivasi melalui pembentukan oksidatif disulfida (Arner & Holmgren 2000).
menjaga protein/asam amino dalam kondisi tereduksi. Mekanisme kerja thioredoxin tampak pada Gambar 3. Tiol-disulfida oxidoreduktase bakteri yang berada di luar membran sitoplasma terlibat dalam reaksi oksidasi, misalnya E. Coli DsbA, yang mengkatalisis pembentukan ikatan disulfida pada protein yang akan ditranspor melalui membran, reaksi isomerisasi ikatan disulfida misalnya E. Coli DsbC yang berfungsi dalam redistribusi ikatan disulfida di antara residu sistein protein target. ResA merupakan Tiol-disulfida oxidoreduktase yang terlibat dalam perakitan sitokrom c terletak pada sisi luar membran sitoplasma B. subtilis. ResA adalah protein terikat membran dengan domain C-terminal bermotif seperti thioredoxin yang terekspos pada sisi luar membran (Erlendsson et al. 2003).
Gambar 3 Mekanisme aktivitas thioredoxin reduktase (Leichert et al. 2003)
Terdapat dua jenis disulfida reduktase yaitu disulfida reduktase yang bersifat
dependent dan independent NADPH. Secara umum, berat molekul disulfida reduktase berukuran di bawah seratus kilodalton dan substrat untuk pengujian aktivitas disulfida reduktase antara lain glutation teroksidasi (GSSG), sistin, DTNB dan insulin. Namun informasi terkait suhu optimum reaksi katalitik disulfida reduktase masih sangat terbatas. Disulfida reduktase yang dipelajari sebagian besar diperoleh dari cairan intraseluler, kecuali disulfida reduktase yang berasal dari bakteri gram negatif
Tabel 5 Karakteristik disulfida reduktase dari beberapa mikroorganisme
Mikroorganisme Jenis Enzim BM Suhu-pH-pI Substrat Sumber
Streptomyces clavuligerus NADPH-dependent disulfide reductase
70 dan 12 kDa
GSSG,DTNB, sistin, insulin, thioredoxin
Aharonowits et
al. (1993)
Anabaena sp. Strain 7119 NADPH-dependent disulfide reductase
104 kDa pH 9.0 pI 4.02
GSSG (oxidized gluthathione)
Serrano et al. (1984)
Bacillus acidocaldarius
Thioredoxin reductase
11,577 kDa pI 4.2 Bovine insulin Bartolucci et al. (1997) Clostridium sticklandii, C.sporo genes, Tissierella creatinophila, C.cylindrosporum Thioredoxin reductase Thioredoxin 13.0; 13.5; 13.6; 13.0 Thiored red 36, 31, 33,33 ND 5.0 4.75 ND
Insulin Harms et al. (1998) Stenotrophomonas sp.D-1 Keratinase dan disulfida reduktase 40 kDa 15 kDa
pI 7.5; pH 8-9; stabil pH
9-10, 40oC pH 7.0; 30o
Kasein, GSSG, DTNB, sistin, elastin, kolagen, rambut, tanduk C
Yamamura et al. (2002b)
Escherichia coli Glutathion reduktase
49 kDa (dimer)
pH 7.0 GSSG Scrutton et al. (1987)
Pemurnian Enzim
Pemekatan Enzim
Pemekatan protein enzim merupakan tahap awal prosedur pemurnian enzim sebelum tahap berikutnya atau dapat pula digunakan untuk keperluan analisis enzim (Harris 1989). Ada dua metode pemekatan enzim yaitu analitik dan preparatif (penyiapan). Metode analitik menggunakan pengendapan asam (misalnya asam trikloroasetat), pengendapan organik (misalnya aseton atau etanol), dan imunopresipitasi dapat menyebabkan denaturasi protein. Berbeda dengan metode analitik, maka metode preparatif tetap mempertahankan aktivitas protein. Pemekatan protein dengan metode preparatif misalnya dengan menggunakan garam, pelarut organik, polimer organik, ultrafiltrasi, dan liofilisasi (Bollag & Edelstein 1991).
Prinsip pengendapan dengan garam berdasarkan pada kelarutan protein yang berinteraksi polar dengan molekul air, interaksi ionik protein dengan garam, dan daya tolak menolak protein yang bermuatan sama. Kelarutan protein pada pH dan suhu tertentu akan meningkat saat konsentrasi garam meningkat (salting in). Kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Pada saat penambahan garam dengan konsentrasi tertentu kelarutan protein akan mengalami penurunan (salting out). Molekul air yang berikatan dengan ion-ion garam akan semakin banyak sehingga menyebabkan penarikan selubung air yang mengelilingi permukaan protein. Peristiwa ini mengakibatkan protein saling berinteraksi, beragregasi, dan kemudian mengendap (Harris 1989, Scopes 1987). Amonium sulfat merupakan garam yang paling sering digunakan untuk mengendapkan protein karena memiliki sifat kelarutan tinggi di dalam air, relatif tidak mahal, dan kestabilan protein di dalam larutan amonium sulfat (2M – 3M) tahan bertahun-tahun (Scopes 1987).
struktur protein, kemudian akan merusak interaksi hidrofobik dan akhirnya akan terjadi denaturasi (Harris 1989, Scopes 1987).
Pengendapan protein dengan polimer organik, misalnya menggunakan polietilen glikol (PEG), memiliki mekanisme yang hampir sama dengan pengendapan pelarut organik, namun pada PEG hanya perlu konsentrasi yang lebih rendah dari 20%. PEG adalah polimer nonionik tidak larut dengan berat molekul berkisar 6000– 20000. Pengendapan dengan PEG tidak mempengaruhi tahap pemurnian berikutnya, misalnya dengan kromatografi penukar ion atau kromatografi afinitas (Harris 1989).
Garam yang berlebihan di dalam larutan enzim, setelah tahap fraksinasi dapat dihilangkan dengan cara dialisis. Pada tahap dialisis, protein ditempatkan di dalam kantung (membran) semipermeabel yang direndam di dalam larutan bufer tertentu. Molekul yang berukuran kecil akan keluar melalui membran dan molekul yang berukuran besar akan tertahan di dalam membran dialisis. Selain dengan dialisis, penghilangan garam dapat dilakukan dengan filtrasi gel. Metode ini biasa diterapkan pada sampel yang sedikit, yaitu tidak lebih dari 25-30% volume kolom untuk mendapatkan resolusi yang memadai antara protein dan garam. Matriks filtrasi gel memiliki pori yang berukuran kecil, misalnya Sephadex G-25. Kekurangan metode ini adalah terjadi pengenceran sampel protein (Harris 1989).
Kromatografi Kolom
Terdapat beberapa cara kromatografi kolom, antara lain kromatografi filtrasi gel, kromatografi penukar ion, kromatografi interaksi hidrofobik, kromatografi afinitas, dan kromatografi cair berkinerja tinggi.
Kromatografi filtrasi gel merupakan teknik pemisahan protein dan makromolekul biologi lain berdasarkan ukuran molekul. Matriks filtrasi gel berupa gel berpori yang dikemas di dalam kolom dan dielusi dengan fase cair-mobil. Pori-pori matriks dapat menampung molekul yang berukuran lebih kecil dan memisahkannya dari molekul yang berberat molekul tinggi. Kromatografi ini biasa digunakan untuk pendugaan berat molekul (Scopes 1987).
negatif tergantung pada rantai samping asam amino. Nilai pH pada saat protein memiliki jumlah muatan positif dan negatif sama disebut titik isoelektrik (pI). Nilai pI sebagian besar protein berada di antara pH 5 dan 9. Protein yang memiliki pH di atas pI akan bermuatan negatif, sedangkan protein dengan pH di bawah pI bermuatan positif.
Pengerjaan kromatografi penukar ion didahului dengan mengelusi protein enzim dengan pH bufer awal yang telah diatur. Protein diharapkan terikat kuat pada kolom, dan protein lain dibiarkan terelusi dulu. Protein yang terikat pada kolom dilepaskan dengan cara mengubah pH bufer atau kekuatan ion pelarut. Matriks penukar ion mengikat secara kovalen gugus fungsional yang bermuatan negatif pada penukar kation, atau gugus fungsional yang bermuatan positif pada penukar anion. Matriks berupa polimer elastis dan mengandung senyawa resin sintetik terbuat dari bahan dekstran, selulosa, atau sephadex. Contoh matriks penukar kation dan anion masing-masing adalah karboksimetil selulosa (CMC) dan dietilaminoetil (DEAE) selulosa (Scopes 1987).
Kromatografi interaksi hidrofobik banyak digunakan untuk pemisahan protein dan peptida. Pada kekuatan ion tinggi, protein akan terikat kuat pada matriks melalui interaksi hidrofobik karena matriks bersifat nonpolar. Campuran protein dialirkan ke dalam kolom dengan bufer yang mengandung konsentrasi garam tinggi. Protein yang tidak terikat keluar lebih dulu, sedangkan protein yang terikat selanjutnya dielusi menggunakan eluen yang polaritasnya diturunkan (konsentrasi garam rendah) (O’Farrel 1998).
Pemisahan protein dengan kromatografi afinitas berdasar pada prinsip interaksi spesifik di antara makromolekul biologi dengan pasangannya (ligan), sebagai contoh enzim dengan substrat atau inhibitornya dan antibodi dengan antigennya. Ligan akan terikat secara kovalen pada matriks sehingga komponen protein yang memiliki afinitas spesifik terhadap ligan akan diikat sedangkan komponen lainnya (protein kontaminan) yang tidak memiliki afinitas akan terelusi lebih dulu. Komponen protein yang terikat dapat dilepaskan dengan mengubah kondisi elusi, misalnya mengubah pH, menambahkan kofaktor atau substrat (Jack 1998).
peptida dan protein. Mekanisme teknik kromatografi ini adalah protein akan terikat berdasarkan karakter hidrofobiknya. Interaksi hidrofobik terjadi antara pelarut dengan ligan hidrofobik di pemukaan. Peningkatan muatan ion pelarut pada fase mobil akan mengurangi kekuatan ikatan dan akhirnya senyawa akan terelusi. Teknik kromatografi ini banyak digunakan dalam bioteknologi untuk mengamati tingkat kemurnian dan stabilitas protein (Neville 1998).
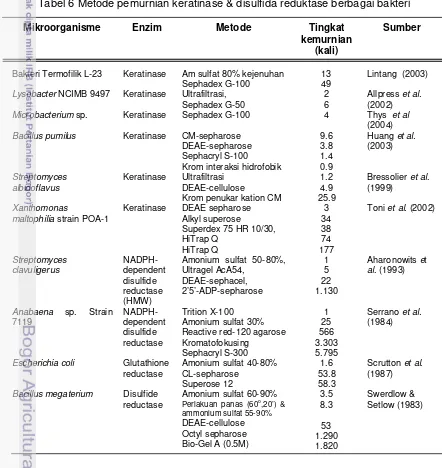
Tabel 6 Metode pemurnian keratinase & disulfida reduktase berbagai bakteri
Mikroorganisme Enzim Metode Tingkat
kemurnian (kali)
Sumber
Bakteri Termofilik L-23 Keratinase Am sulfat 80% kejenuhan Sephadex G-100
13 49
Lintang (2003)
Lysobacter NCIMB 9497 Keratinase Ultrafiltrasi, Sephadex G-50
2 6
Allpress et al.
(2002)
Microbacterium sp. Keratinase Sephadex G-100 4 Thys et al
(2004)
Bacillus pumilus Keratinase CM-sepharose DEAE-sepharose Sephacryl S-100 Krom interaksi hidrofobik
9.6 3.8 1.4 0.9
Huang et al.
(2003)
Streptomyces albidoflavus
Keratinase Ultrafiltrasi DEAE-cellulose
Krom penukar kation CM
1.2 4.9 25.9
Bressolier et al. (1999)
Xanthomonas
maltophilia strain POA-1
Keratinase DEAE sepharose Alkyl superose Superdex 75 HR 10/30, HiTrap Q HiTrap Q 3 34 38 74 177
Toni et al. (2002)
Streptomyces clavuligerus NADPH-dependent disulfide reductase (HMW)
Amonium sulfat 50-80%, Ultragel AcA54, DEAE-sephacel, 2’5’-ADP-sepharose 1 5 22 1.130
Aharonowits et
al. (1993)
Anabaena sp. Strain 7119 NADPH-dependent disulfide reductase Trition X-100 Amonium sulfat 30% Reactive red-120 agarose Kromatofokusing Sephacryl S-300 1 25 566 3.303 5.795
Serrano et al.
(1984)
Escherichia coli Glutathione reductase
Amonium sulfat 40-80% CL-sepharose
Superose 12
1.6 53.8 58.3
Scrutton et al. (1987)
Bacillus megaterium Disulfide reductase
Amonium sulfat 60-90%
Perlakuan panas (60o
3.5 8.3 53 1.290 1.820 ,20’) & ammonium sulfat 55-90%
DEAE-cellulose Octyl sepharose Bio-Gel A (0.5M)
Banyak peneliti telah melaporkan metode pemurnian berbagai jenis keratinase dan disulfida reduktase yang dihasilkan oleh mikroorganisme (Tabel 6). Pemekatan menggunakan amonium sulfat atau ultrafiltrasi banyak dipilih untuk memulai pemurnian, kemudian dilanjutkan dengan kromatografi gel filtrasi atau kromatografi penukar ion.
Elektroforesis dan Zimografi
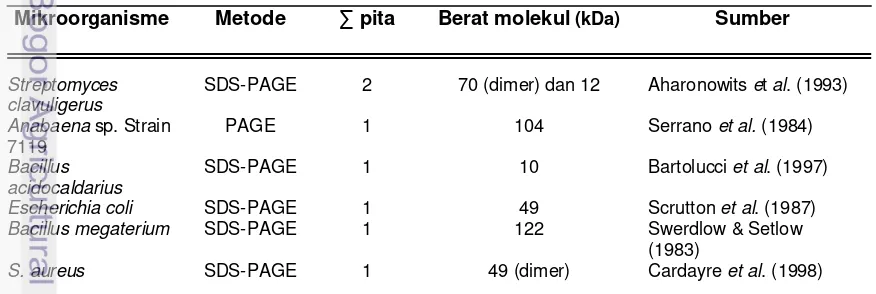
[image:36.612.90.528.553.700.2]Elektroforesis pada gel poliakrilamida adalah metode yang paling sering digunakan untuk karakterisasi protein dan campuran protein, karena prosedur ini relatif cepat dan sensitif. Elektroforesis didefinisikan sebagai perpindahan partikel-partikel bermuatan karena pengaruh medan listrik. Mekanisme pada elektroforesis gel poliakrilamida sodium dodesil sulfat (SDS-PAGE) adalah bahwa protein akan bereaksi dengan SDS yang merupakan detergen anionik membentuk kompleks yang bermuatan negatif. Protein akan terdenaturasi dan larut membentuk kompleks berikatan dengan SDS. Kompleks protein yang bermuatan negatif ini kemudian akan terpisahkan berdasar muatan dan ukurannya secara elektroforesis di dalam matriks gel. Berat molekul protein dapat diukur menggunakan protein standar yang telah diketahui berat molekulnya dengan cara membandingkan nilai mobilitas relatifnya (Rf) (Bollag & Edelstein 1991). Berbagai dislfida reduktase asal bakteri berhasil dideteksi menggunakan teknik SDS-PAGE dan hasilnya menginformasikan terdapat disulfida reduktase yang bersifat homodimer (Tabel 7).
Tabel 7 Pendugaan berat molekul beberapa disulfida reduktase asal bakteri menggunakan teknik SDS-PAGE
Mikroorganisme Metode ∑ pita Berat molekul (kDa) Sumber
Streptomyces clavuligerus
SDS-PAGE 2 70 (dimer) dan 12 Aharonowits et al. (1993)
Anabaena sp. Strain 7119
PAGE 1 104 Serrano et al. (1984)
Bacillus acidocaldarius
SDS-PAGE 1 10 Bartolucci et al. (1997)
Escherichia coli SDS-PAGE 1 49 Scrutton et al. (1987)
Bacillus megaterium SDS-PAGE 1 122 Swerdlow & Setlow (1983)
Elektroforesis gel native (nondenaturasi) memisahkan protein terlarut yang tidak mengendap atau beragregasi selama elektroforesis. Metode ini dapat pula diterapkan untuk protein dengan kelarutan rendah, seperti protein membran, dengan menambahkan detergen nonionik, misalnya 0.5% Triton X-100 ke dalam gel. Tidak seperti pada SDS-PAGE yang molekul-molekul protein yang telah terpisah dapat kehilangan aktivitas biologi dan biokimianya maka pada elektroforesis gel nondenaturasi aktivitas tersebut masih ada (Walker 2002). Tabel 8 menginformasikan teknik mendeteksi molekul protein keratinase yaitu dengan metode SDS-PAGE dan zymografi. Zimografi adalah teknik elektroforesis untuk menetapkan aktivitas enzim secara insitu. Berbeda dengan SDS-PAGE, gel pemisah zimografi mengandung substrat enzim yang akan dihidrolisis oleh enzim selama masa inkubasi. Enzim dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi. Penambahan detergen Triton X-100 akan melepaskan SDS sehingga protein kembali melipat (renaturasi). Gel selanjutnya diwarnai sehingga molekul protein yang memiliki aktivitas tampak sebagai pita bening. Metode zimografi bersifat mudah, sensitif, dan kualitatif dalam menganalisis aktivitas enzim (Leber & Balkwill 1997).
Tabel 8 Pendugaan berat molekul keratinase dari beberapa bakteri menggunakan teknik SDS-PAGE dan Zimografi.
Mikroorganisme Metode Jumlah pita Berat molekul (kDa)
Sumber
Bakteri Termofilik L-23 SDS-PAGE
Zimografi
6
2
98.5; 92.6; 82; 64.2; 56.8; 25.6
47 dan 64
Lintang (2003)
Streptomyces albidoflavus
SDS-PAGE 1 18 Bressolier et al.
(1999)
Fervidobacterium pennavorans
SDS-PAGE Zimografi
1 1
130 130
Friedrich & Antranikian (1996)
Bacillus pumilus SDS-PAGE 1 32 Huang et al.
(2003)
Lysobacter NCIMB 9497
SDS-PAGE 1 148 Allpress et al.
(2002.)
Xanthomonas maltophilia strain POA-1
SDS-PAGE 1 36 Toni et al. (2002)
Penggunaan gelatin sebagai substrat dalam teknik zimografi cukup bervariasi, pada bakteri termofilik L-23 (Lintang 2003) dan S. albidoflavus (Bressolier 1999) digunakan 2% gelatin sedangkan pada F. Pennavorans 0.1% (Friedrich & Antranikian 1996).
Degradasi Keratin
Laju dan kesempurnaan degradasi keratin oleh mikroorganisme sangat bergantung pada jenis substratnya, dan hal ini erat berkaitan dengan kandungan sistin. Substrat yang sering digunakan untuk mempelajari aktivitas hidrolisis keratinase adalah bulu ayam (Riffel et al. 2003a, Thys et al. 2004, Toni et al. 2002, Werlang & Brandelli 2005, Zerdani et al. 2004), rambut manusia (Takami et al. 1992, Macedo et al. 2005), bulu sapi (Riffel et al. 2003b) dan wool (Ignatova et al. 1999, Huang et al. 2003).
Pada fungi keratinolitik, konsentrasi rendah glukosa (0.1%) dan sedikit suplementasi asam amino, pepton atau ekstrak kamir mungkin akan memacu pertumbuhan saat fase awal. Namun nutrisi terlarut dengan konsentrasi tinggi akan menghambat hidrolisis substrat keratin. Degradasi keratin dalam medium cair ditandai dengan dilepaskannya produk-produk hidrolisis ke dalam medium. Produk utama adalah peptida berberat molekul satu hingga dua kilodalton, akan tetapi ditemukan juga asam-asam amino bebas dan protein berberat molekul tinggi. Indikator terbaik terjadinya keratinolisis adalah peningkatan pH medium (sedikitnya mencapai pH 8.0) yang menggambarkan penggunaan protein keratin, deaminasi, dan produksi amonia (Kunert 2000).
Streptomyces memulai aktivitas proteolitiknya dengan proses denaturasi (reduksi) jembatan disulfida (Bockle & Muller 1997). Namun pada fungi keratinolitik tidak terjadi reduksi keratin oleh enzim ekstraseluler dan atau Tiol. Pada fungi selain protease tampaknya alkalinisasi medium dan sulphitolysis merupakan faktor utama denaturasi keratin (Kunert 2000). Fungi mengeksresikan sulfit dan amonia, dalam kondisi alkali sulfit akan memotong jembatan disulfida substrat. Kemudian secara perlahan substrat akan terdenaturasi dan hal ini mempermudah kerja protease.
Sulphitolysis pada jembatan disulfida menghasilkan produk utama S-sulphocysteine
baik dalam bentuk bebas maupun kombinasi dengan peptida. Pada kultur yang sudah tua, sedikitnya 80% sulfur organik berupa S-sulphocysteine. Sulfit merupakan stimulator yang kuat bagi protease M. gypseum saat menghidrolisis keratin wool (Kunert 1989).
Cys-SS-cys + HSO
3-cys-SH + cys-SSO
3-Sistin Sulfit Sistein S-sulphocysteine
Menurut Kunert (2000), degradasi keratin pada fungi diduga merupakan hasil kerja tiga faktor yaitu “deaminasi” (menghasilkan lingkungan alkali yang dibutuhkan untuk pengembangan substrat, sulphitolysis, dan aksi proteolitik); “sulphitolysis”
(denaturasi substrat dengan memutus jembatan disulfida) dan “proteolisis” (pemotongan substrat yang telah terdenaturasi menjadi produk terlarut).
dihasilkan oleh Stenotrophomonas sp. dalam degradasi keratin bulu rusa. Mekanisme degradasi keratin yang diusulkan adalah :
K-S-S-K Dis-red like protein K-SH Protease Peptida/asam amino
Native keratin Reduced keratin
Penggunaan agens pereduksi (reduktan) untuk meningkatkan degradasi keratin telah dilaporkan oleh beberapa peneliti. Reduktan yang digunakan antara lain 2% sodium azide (Ramnani et al. 2005), 0.05% sodium azide dan 10 mM EDTA ((Bockle & Muller 1997), 10 mM sodium sulfit dan dithioerythritol (Letourneau et al. 1998).
Melekatnya sel/kolonisasi pada substrat merupakan hal yang penting dalam proses degradasi bulu ayam (Bockle & Muller 1997, Onifade et al. 1998). Degradasi lengkap bulu ayam utuh oleh B. Licheniformis RG1 terjadi hanya jika ada sel bakteri hidup, melekatnya sel pada bulu diduga secara kontinu menyediakan reduktan yang digunakan untuk memutus jembatan disulfida (Ramnani et al. 2005). Menurut Bockle dan Muller (1997), pada prokariot sistem redoks cell-bound untuk reduksi ikatan disulfida juga berperan dalam degradasi keratin.
Aplikasi Keratinase
Produksi Tepung Bulu Sebagai Pakan Tenak
Pembuatan tepung bulu sebagai pakan ternak diperoleh dengan cara pemanasan pada suhu dan tekanan tinggi. Perlakuan hidrotermal tersebut menyebabkan kerusakan pada asam-asam amino tertentu seperti metionin, lisin, dan triptofan, serta menghasilkan produk dengan kualitas nutrisi rendah (Wang & Parsons 1997). Penggunaan keratinase mikrobial dapat menjadi alternatif untuk hidrolisis bulu menjadi pakan ternak yang kaya nutrisi (Onifade et al. 1998).
(Apple et al. 2003) dan tepung bulu hasil hidrolisis mampu menggantikan bungkil kedelai hingga tujuh persen. Enzim kasar juga dapat digunakan sebagai produk
nutriceutical yang secara signifikan dapat meningkatkan performan broiler (Odetallah
et al. 2003). Ekstrak kasar keratinase Cunninghamella spp. yang digunakan dalam fermentasi tepung bulu ayam mampu meningkatkan kualitas protein dan energi metabolisnya (Ramli et al. 2001).
Perbaikan nutrisi bulu/tepung bulu juga dapat dilakukan dengan cara fermentasi menggunakan mikroorganisme keratinolitik. Fermentasi secara signifikan meningkatkan asam-asam amino esensial (metionin, arginin, dan lisin) dan biomassa merupakan sumber protein yang kaya. Percobaan pakan menggunakan biomassa
B.licheniformis PWD-1 mampu meningkatkan kurva pertumbuhan ayam pedaging sama baiknya dengan standar bungkil kedele (Williams et al. 1991). Guna memenuhi permintaan industri pakan ternak dan meningkatkan produksi keratinase, beberapa peneliti melakukan kloning, over-ekspresi, dan bioimobilisasi (Wang et al. 2003).
Produksi Tepung Bulu Sebagai Pupuk
Kandungan protein yang tinggi pada tepung bulu selain dimanfaatkan sebagai pakan ternak juga dapat diaplikasikan sebagai pupuk nitrogen semi-slow-release pada pertanian organik. Pertanian organik memerlukan pupuk organik yang kaya nitrogen untuk mendukung pertumbuhan tanaman dan aktivitas mikrobial dalam tanah. Guano, secara tradisional telah digunakan luas sebagai pupuk pada pertanian organik, namun harganya sangat mahal sehingga diperlukan upaya untuk mendapatkan alternatf lain (Gupta & Ramnani 2006). Tepung bulu adalah materi yang kaya nitrogen, murah, dan selalu tersedia. Selain dapat menyuplai nitrogen untuk tanaman dan aktivitas mikroba tanah, tepung bulu juga dapat menjaga struktur tanah dan meningkatkan kapasitas retensi air.
Aplikasi Pada Deterjen
Enzim-enzim proteolitik telah lama mendominasi pasar deterjen. Sekitar 89% enzim dalam deterjen adalah protease alkalin dengan pemasok utama Novo Nordisk
menghidrolisis substrat padatan. Hal ini merupakan sifat utama yang dibutuhkan enzim dalam deterjen karena enzim akan bekerja pada substrat protein yang menempel pada permukaan padat, sehingga enzim diperlukan sebagai aditif untuk pembersih pada permukaan yang keras. Keratinase membantu menghilangkan kotoran berkeratin yang sering ditemukan pada bagian leher kemeja yang tidak dapat dibersihkan oleh sebagian besar protease (Gupta & Ramnani 2006). Aplikasi terbaru keratinase dalam deterjen adalah penggunaan keratinase sebagai aditif untuk menghilangkan sumbatan akibat limbah berkeratin (Farag & Hasan 2004).
Degradasi Protein Prion
Prion adalah partikel protein penyebab penyakit neurodegeneratif yang dikenal sebagai transmissible spongiform encephalopathies (TSE) . Termasuk dalam golongan TSE adalah penyakit sapi gila, scrapie, kuru, dan Creutzfeld-Jacob. Sifat infektif prion berkaitan dengan perubahan protein prion PrPc menjadi protein prion infektif (PrPsc) yang difasilitasi oleh PrPsc itu sendiri (Gupta & Ramnani 2006).
Dewasa ini beberapa peneliti berusaha menggali potensi keratinase bakteri dalam menghancurkan protein prion abnormal pada produk asal ternak. Melalui perlakuan pemanasan di atas 100o
Pada industri kulit sebesar 70% polusi dihasilkan dari proses pre-tanning
Polutan utama dari industri kulit adalah sodium sulfida, kromium, asam, dan limbah padat; semua bahan tersebut akan meningkatkan biochemical oxygen demand (BOD),
chemical oxygen demand (COD), dan total padatan terlarut (TDS). Proses biokatalitik C dan penambahan deterjen Langeveld etal. (2003) berhasil mendegradasi prion abnormal pada jaringan otak sapi dan domba menggunakan keratinase yang dihasilkan oleh B. licheniformis PWD-1. Protein serupa prion yaitu protein Sup35NM-His6 yang dihasilkan oleh Saccharomyces cerevisae
diketahui dapat dihancurkan oleh subtilisin, proteinase K dan keratinase dari B. licheniformis PWD-1 namun tidak oleh kolagenase dan elastase (Wang et al. 2005). Keratinase juga dapat digunakan untuk dekontaminasi peralatan medis dan laboratorium (Langeveld etal. 2003).
kulit melibatkan enzim campuran antara lain protease, lipase, dan karbohidrase yang biasa digunakan pada berbagai tahap pre-tanning (Gupta & Ramnani 2006).
Protease keratinolitik yang tidak memiliki aktivitas kolagenase namun mempunyai cukup aktivitas elastase dapat membantu proses dehairing dengan memutus secara selektif jaringan keratin pada folikel kulit sehingga rambut akan terlepas tanpa memengaruhi kekuatan kulit. Penggunaan enzim dalam proses de-hairing kulit selain menghasilkan kulit dengan kualitas baik juga dapat mengurangi polutan (Macedo et al. 2005). Bacillus subtilis dan Bacillus amiloliquefaciens
menghasilkan enzim protease dengan aktivitas depilatory. Berdasar analisis mikroskopis, kulit sapi berambut yang direndam dalam kultur bebas sel selama semalam menunjukkan hilangnya epidermis, bulu, tidak adanya kelenjar kulit dan terbukanya struktur serat kulit (Riffel et al. 2003b). Strain mutan Bacillus pumilus UN-31-C-42 menghasilkan protease kasar dan murni yang memiliki aktivitas de-hairing
tinggi dan aktivitas kolagenase rendah sehingga diharapkan dapat menghasilkan kulit dengan kualitas baik (Huang et al. 2003). Dengan demikian proses penghilangan bulu secara kimiawi berbahan dasar sulfida yang dapat merusak lingkungan dapat digantikan dengan proses berbahan dasar enzim keratinase yang lebih ramah lingkungan.
Aplikasi Di Bidang Lain
Potensi aplikasi keratinase yang lain adalah fermentasi anaerobik limbah industri ternak unggas untuk menghasilkan gas alam, modifikasi serat seperti sutera dan wool, di bidang medis dan farmasi untuk menghilangkan jerawat atau psoriasis
BAHAN DAN METODE
Subyek Penelitian
Penelitian ini menggunakan dua isolat Bacillus sp. yaitu B. licheniformis
MB-2 dan Bacillus sp. MTS. B. licheniformis MB-2 adalah bakteri yang diisolasi dari sumber air panas Gn. Tompaso-Manado Sulawesi Utara yang tumbuh pada suhu 55oC dan pH 6.5. B. licheniformis MB-2 dilaporkan menghasilkan tiga fraksi kitosanase berukuran 75, 70.8 dan 55.9 kDa (Chasanah et al. 2006) dan kitinase berukuran 67 dan 102 kDa (Toharisman et al. 2005). Bacillus sp. MTS merupakan bakteri yang diisolasi dari tanah belerang Gn. Tangkuban Perahu-Bandung Jawa Barat yang tumbuh pada suhu 37oC dan pH 7.5. Bacillus sp. MTS dilaporkan menghasilkan enzim-enzim ekstraseluler yang mampu menghidrolisis berbagai substrat protein yaitu tepung bulu ayam, sarang laba-laba, kasein, albumin, gelatin, hemoglobin, kolagen, fibrinogen dan elastin (Ariesandi 2007).
Strategi Penelitian
Tahap 1 Memilih Isolat Bacillus sp. Pendegradasi Keratin serta Identifikasi 16S-rRNA Isolat Terpilih.
Tujuan penelitian tahap pertama adalah memilih dua isolat bakteri yaitu
B. licheniformis MB-2 dan Bacillus sp. MTS berdasar kemampuan mendegradasi keratin alami dan produksi enzim serta identifikasi 16S-rRNA isolat terpilih.
Metodologi yang digunakan adalah menumbuhkan kedua isolat dalam media cair berisi bulu ayam utuh, beberapa keratin alami dan dalam tiga jenis media produksi. Metode untuk identifikasi bakteri adalah isolasi DNA total, amplifikasi dan analisis 16S-rRNA isolat terpilih. Parameter yang diukur dan diamati yaitu kemampuan menghancurkan bulu ayam utuh, susut berat keratin alami, kemampuan produksi keratinase dan disulfida reduktase, lokasi seluler kedua enzim dan sekuen DNA isolat terpilih. Output tahap pertama adalah isolat
Tahap 2 Karakterisasi Keratinase dan Disulfida Reduktase.
Tujuan penelitian tahap kedua adalah melakukan karakterisasi keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS.
Metodologi yang digunakan adalah uji aktivitas enzim, SDS-PAGE dan zymografi. Parameter yang diukur dan diamati yaitu berat molekul, pH dan suhu optimum, ketahanan terhadap panas dan pH, pengaruh senyawa pereduksi dan urea. Output tahap ini adalah informasi karakteristik kedua enzim baik enzim kasar maupun enzim murni.
Tahap 3 Pemurnian Keratinase dan Disulfida Reduktase
Tujuan penelitian tahap ketiga adalah melakukan pemurnian keratinase dan disulfida reduktase ekstraseluler Bacillus sp. MTS serta karakterisasi kedua enzim murni.
Metodologi yang digunakan adalah pengendapan amonium sulfat, dialisis, kromatografi interaksi hidrofobik, gel filtrasi, dan uji aktivitas enzim. Parameter yang diukur dan diamati