SKRIPSI
Disusun oleh: Linda Kusumastuti
20120210112
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
i
KAJIAN ASOSIASI Rhizobium sp.-MIKORIZA-Rhizobacteri
INDIGENOUS MERAPI TERHADAP PERTUMBUHAN
DAN HASIL TIGA VARIETAS KEDELAI
DI TANAH PASIR PANTAI
SKRIPSI
Disusun oleh: Linda Kusumastuti
20120210112
Program Studi Agroteknologi
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
ii
KAJIAN ASOSIASI Rhizobium sp.-MIKORIZA-Rhizobacteri INDIGENOUS
MERAPI TERHADAP PERTUMBUHAN DAN HASIL
TIGA VARIETAS KEDELAI DI TANAH PASIR PANTAI
SKRIPSI
Diajukan kepada Fakultas Pertanian
Universitas Muhammadiyah Yogyakarta
sebagai syarat untuk memperoleh derajat Sarjana Pertanian
Oleh:
Linda Kusumastuti
20120210112
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
YOGYAKARTA
iii
Skripsi yang berjudul
KAJIAN ASOSIASI Rhizobium sp.- MIKORIZA-Rhizobacteri
INDIGENOUS MERAPI TERHADAP PERTUMBUHAN DAN HASIL
TIGA VARIETAS KEDELAI DI TANAH PASIR PANTAI
yang dipersiapkan dan disusun oleh :
Linda Kusumastuti 20120210112
Telah dipertahankan di depan Dewan Penguji Pada tanggal 19 Agustus 2016
Skripsi tersebut telah diterima sebagai syarat guna memperoleh derajat Sarjana Pertanian
Pembimbing Utama
Ir. Agung Astuti, M.Si.
NIK. 19620923199303133017
Anggota Penguji
Ir. Hariyono, M.P.
NIK. 1965033019940913302 Pembimbing Pendamping
Ir. Sarjiyah, M.S.
NIP. 196109181991032001
Yogyakarta, 19 Agustus 2016 Universitas Muhammadiyah Yogyakarta
Dekan Fakultas Pertanian
iv MOTTO
Hai orang-orang beriman, jadikanlah sabar dan sholatmu sebagai penolongmu, sesungguhnya Allah beserta orang-orang yang sabar
(Q. S. Al-Baqarah: 153)
Maka ingatlah Ku, Akupun akan ingat kepadamu. Bersyukurlah kepada-Ku dan janganlah kamu ingkar kepada-kepada-Ku
(Q. S. Al-Baqarah: 152)
Bertakwalah kepada Allah, maka Allah akan mengajarimu. Sesungguhnya Allah maha mengetahui segala sesuatu
(Q. S. Al-Baqarah 282)
Sesungguhnya, bersama kesulitan itu ada kemudahan, maka apabila kamu telah selesai (dari suatu urusan) maka bekerja keraslah (untuk urusan yang lain) dan
hanya kepada Allahlah kamu berharap (Q. S. Al-Insyirah 6-8)
Allah mengangkat derajat orang-orang yang beriman dan orang-orang yang berilmu beberapa derajat
v
HALAMAN PERSEMBAHAN
Karya ini penulis persembahkan untuk:
1. Ayah Muchamad Sucahyo dan Ibunda Pudji Astuti 2. Arif Nugroho dan Gunawan Tri Ashari, kakak dan adikku
3. Sahabatku Galuh Wahyuningtyas, Nadia Dwi Larasati dan Siti Safitri Nafi’ah 4. Sahabat, teman sekaligus kakak Siti Atikah
5. Ika Kusumawardani sahabatku 6. Dharend Lingga Wibisana
7. Teman-teman Agroteknologi UMY, Bagus A., Dena A., Shofiyah R.A., Dita J., Fauzia K., M. Badri, Fail Sajid, F. Ibnu S.S., Nur Rifatul C., Ika W., R.Ilham W., Imam S., Imanudin, Nazri F.D., Laode S., Pitoyo, Ririn E., Riska S., Septia H., Erningtyas S., Wisnu K., Fadli A., Shidik S., Rian W., Edy S., A. Ikhsanudin, Bolik H., Yakub S., Burhan A. G., Nofison K., J. Aditya, Shandy N. R., M. Toha, Febryan R., Ardiansyah, dan pihak lainnya yang tidak bisa penulis sebutkan satu per satu.
vi
PERNYATAAN
Dengan ini saya menyatakan:
1. Karya tulis saya, skripsi ini, adalah asli dan belum pernah diajukan untuk mendapatkan gelar akademik, baik di Universitas Muhammadiyah Yogyakarta maupun di perguruan tinggi lainnya.
2. Karya tulis ini murni gagasan, rumusan dan penilaian saya sendiri setelah mendapatkan arahan dan saran dari Tim Pembimbing. Oleh karena itu, saya menyetujui pemanfaatan karya tulis ini dalam berbagai forum ilmiah, maupun pengembangannya dalam bentuk karya ilmiah lain oleh Tim Pembimbing. 3. Dalam karya tulis ini tidak terdapat karya atau pendapat yang telah ditulis atau
dipublikasikan orang lain, kecuali secara tertulis dengan jelas dicantumkan sebagai acuan dalam naskah dengan disebutkan nama pengarang dan dicantumkan dalam daftar pustaka.
4. Pernyataan ini saya buat sesungguhnya dan apabila dikemudian hari terdapat penyimpangan dan ketidakbenaran dalam pernyataan ini, maka saya bersedia menerima sanksi akademik berupa pencabutan gelar yang telah saya peroleh karena karya tulis ini, serta sanksi lainnya sesuai dengan norma yang berlaku di perguruan tinggi ini.
Yogyakarta, 19 Agustus 2016 Yang membuat pernyataan,
vii
KATA PENGANTAR
Assalamualaikum wr. Wb.
Alhamdulillahirobbil’alamiin penulis panjatkan kehadirat Allah SWT
berkat limpahan rahmat, taufik dan hidayah-Nya penulis dapat menyelesaikan penelitian dan skripsi ini dengan lancar. Sholawat serta salam penulis haturkan kepada junjungan umat Islam, Nabi Muhammad SAW, kepada keluarga, sahabat dan pengikutnya hingga yaumul akhir.
Skripsi yang berjudul “KAJIAN ASOSIASI Rhizobium
sp.-MIKORIZA-Rhizobacteri INDIGENOUS MERAPI TERHADAP PERTUMBUHAN DAN
HASIL TIGA VARIETAS KEDELAI DI TANAH PASIR PANTAI” merupakan bagian dari proses dalam mendapatkan gelar sarjana dari Program Studi Agroteknologi, Fakultas Pertanian, Universitas Muhammadiyah Yogyakarta. Skripsi ini berisi tentang asosiasi Rhizobium, mikoriza dan Rhizobacteri indigenous
Merapi terhadap pertumbuhan dan hasil kedelai unggul yang dibudidayakan di tanah pasir pantai. Penelitian ini bertujuan untuk mendapatkan varietas kedelai dan inokulum yang sesuai untuk perkembangan kedelai di lahan pasir pantai.
Selama penelitian berlangsung tidak lepas dari dukungan dari berbagai pihak, oleh karena itu penulis menyampaikan terima kasih kepada:
viii
2. Ir. Sarjiyah, M. S. selaku Dekan Fakultas Pertanian UMY sekaligus dosen pembimbing pendamping dan Dosen Pembimbing Akademik yang telah memberikan bimbingan, pengetahuan, masukan dan dukungan dalam persiapan, pelaksanaan dan penyusunan skripsi serta bimbingan selama masa perkuliahan,
3. Ir. Hariyono, M.P. selaku penguji skripsi yang telah memberikan pengetahuan, masukan, saran dan motivasi kepada penulis,
4. Dr. Innaka Ageng Rinneksane, S.P., M.P. selaku kaprodi Agroteknologi UMY, 5. Ibu Sumarsih, Pak Sukirno, Pak Yuliantoro, Pak Samsuri dan semua laboran Fakultas Pertanian UMY, terima kasih atas bantuannya dalam pelaksanaan penelitian ini,
6. Seluruh dosen Fakultas Pertanian UMY, yang telah mendidik selama menduduki bangku perkuliahan,
7. PT. Indofood Sukses Makmur Tbk. yang telah mengadakan program Indofood Riset Nugraha (IRN) tahun 2015-2016 dan memberikan bantuan dana penelitian kepada penulis serta panitia IRN dan reviewernya.
Semoga ilmu, segala bentuk bantuan, bimbingan dan motivasi yang diberikan kepada penulis mendapat pahala dari Allah SWT. Penulis selalu terbuka untuk menerima saran dan kritik yang membangun dan berharap skripsi ini bermanfaat bagi penulis, pembaca dan masyarakat, aamiin.
Wassalamualaikum wr. Wb.
ix DAFTAR ISI
Halaman
KATA PENGANTAR ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
INTISARI... xiv
ABSTRACT ... xv
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 3
C. Tujuan Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
A. Budidaya Kedelai ... 6
B. Tanah Pasir Pantai ... 7
C. Asosiasi Rhizobium sp. pada Tanaman ... 9
D. Asosiasi Mikoriza pada Tanaman ... 10
E. Asosiasi Rhizobacteri pada Tanaman ... 12
F. Hipotesis... 13
III. TATA CARA PENELITIAN... 14
A. Tempat dan Waktu Penelitian ... 14
B. Bahan dan Alat ... 14
C. Metode Penelitian ... 15
D. Tahapan Penelitian ... 16
E. Variabel Pengamatan ... 27
F. Analisis Data ... 35
IV. HASIL DAN PEMBAHASAN ... 36
A. Pengaruh Inokulasi Rhizobium sp. ... 36
B. Identifikasi dan Pengaruh Inokulasi Mikoriza Vesikular Arbuskular (MVA) ... 46
x
D. Pertumbuhan Perakaran Tanaman ... 56
E. Pertumbuhan Tanaman ... 67
F. Komponen Hasil Tanaman Kedelai ... 79
V. KESIMPULAN DAN SARAN ... 89
A. Kesimpulan ... 89
B. Saran... 89
DAFTAR PUSTAKA ... 90
xi DAFTAR TABEL
Halaman Tabel 1. Rerata jumlah nodul total per tanaman, persentase nodul efektif, bobot
nodul dan diameter nodul pada minggu ke-9 ...37
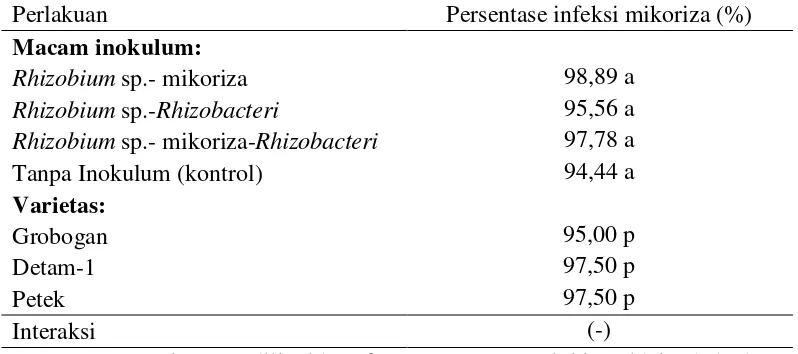
Tabel 2. Rerata persentase infeksi mikoriza pada minggu ke 9 ...48
Tabel 3. Rerata jumlah spora mikoriza (spora/ml) x104 pada minggu ke 9...50
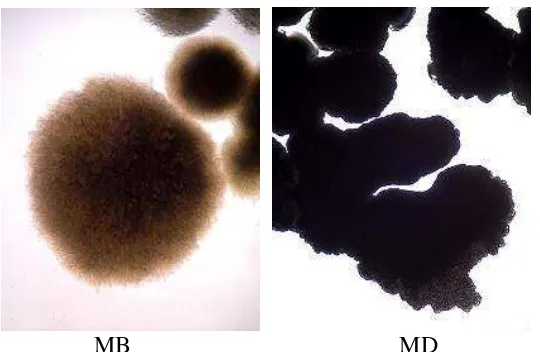
Tabel 4. Deskripsi Rhizobacteri indigenous Merapi MB dan MD ...53
Tabel 5. Rerata skoring proliferasi akar (maksimal 4) pada minggu ke-9 ...57
Tabel 6. Rerata panjang akar minggu ke-9 (cm) ...59
Tabel 7. Rerata bobot segar akar pada minggu ke-9 (gram) ...62
Tabel 8. Rerata bobot kering akar pada minggu ke-9 (gram) ...65
Tabel 9. Rerata tinggi tanaman, jumlah daun, bobot segar tajuk, bobot kering tajuk minggu ke-9 dan umur berbunga tanaman ...67
Tabel 10. Rerata luas daun pada minggu ke-9 (cm2) ...72
Tabel 11. Rerata jumlah polong per tanaman, persentase polong berisi, bobot kering polong per tanaman dan bobot 100 biji ...79
Tabel 12. Rerata bobot biji per tanaman (gram) ...84
xii DAFTAR GAMBAR
Halaman
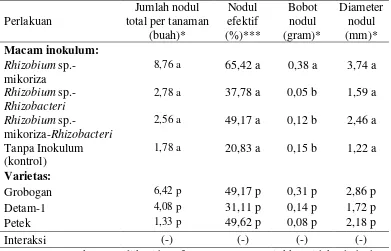
Gambar 1. Jumlah nodul total (a) faktor inokulum (b) faktor varietas ...38
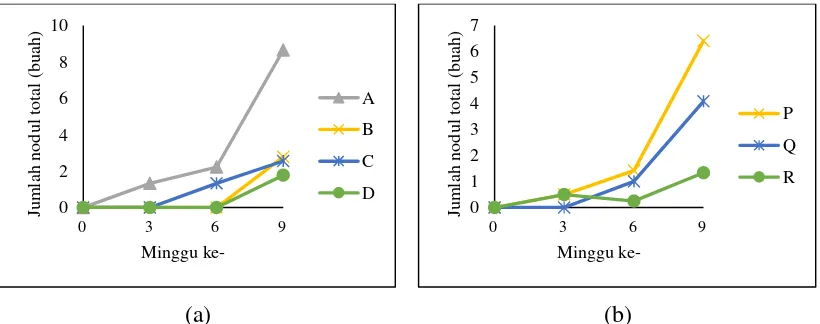
Gambar 2. Persentase nodul efektif (a) faktor inokulum (b) faktor varietas ...41
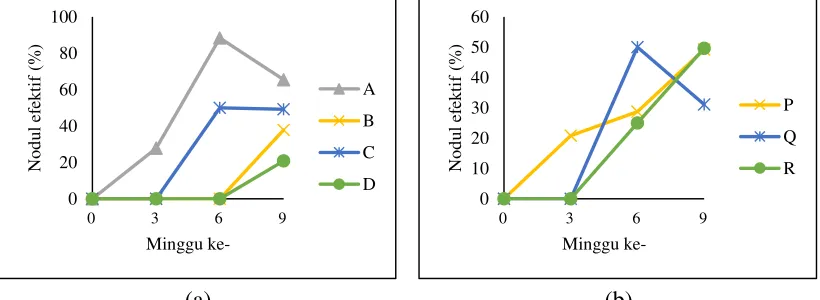
Gambar 3. Bobot nodul (a) faktor inokulum (b) faktor varietas ...44
Gambar 4. Diameter nodul (a) faktor inokulum (b) faktor varietas ...46
Gambar 5. Visualisasi mikoriza pada akar tanaman kedelai ...47
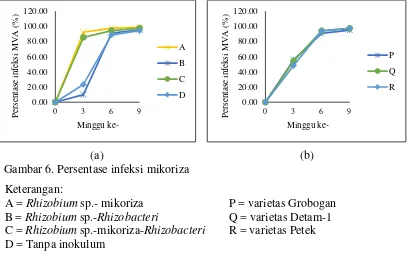
Gambar 6. Persentase infeksi mikoriza ...49
Gambar 7. Hasil surface platting isolat Rhizobacteri indigenous Merapi MB dan MD pada media LBA standar ...52
Gambar 8. Karakteristik koloni Rhizobacteri indigenous Merapi MB dan MD secara mikroskopis ...53
Gambar 9. Karakteristik sel Rhizobacteri indigenous Merapi MB dan MD secara mikroskopis ...53
Gambar 10. Dinamika populasi (a) bakteri total, (b) bakteri lain, (c) Rhizobacteri indigenous Merapi isolat MB dan (d) Rhizobacteri indigenous Merapi isolat MD ...55
Gambar 11. Proliferasi akar (a) faktor inokulum (b) faktor varietas ...58
Gambar 12. Panjang akar ...61
Gambar 13. Bobot segar akar ...63
Gambar 14. Bobot kering akar ...66
Gambar 15. Tinggi tanaman (a) faktor inokulum (b) faktor varietas ...68
Gambar 16. Jumlah daun (a) faktor inokulum (b) faktor varietas ...70
Gambar 17. Luas daun ...73
Gambar 18. Bobot segar tajuk (a) faktor inokulum (b) faktor varietas...75
xiii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Deskripsi kedelai varietas Grobogan ...96
Lampiran 2. Deskripsi kedelai varietas Petek ...97
Lampiran 3. Deskripsi kedelai varietas Detam-1 ...98
Lampiran 4. Lay Out Penelitian ...99
Lampiran 5. Skema Perbanyakan Rhizobacteri indigenous Merapi ...100
Lampiran 6. Penghitungan kebutuhan media tanam pasir pantai dan pupuk ...101
Lampiran 7. Penghitungan kebutuhan air kapasitas lapang ...103
Lampiran 8. Penghitungan kebutuhan benih kedelai ...104
Lampiran 9. Penghitungan kebutuhan inokulum mikoriza ...105
Lampiran 10. Penghitungan kebutuhan inokulum Rhizobium sp. ...106
Lampiran 11. Karakterisasi koloni Rhizobacteri indigenous Merapi pada medium LB tanpa stres ...107
Lampiran 12. Sidik ragam paramater pertumbuhan dan hasil kedelai ...108
xiv INTISARI
Penelitian ini bertujuan untuk mengetahui saling pengaruh antara macam inokulum dengan varietas kedelai, mengkaji asosiasi macam inokulum dan varietas terhadap pertumbuhan dan hasil kedelai di tanah pasir pantai serta menetapkan asosiasi inokulum dan varietas yang sesuai untuk pengembangan kedelai di tanah pasir pantai. Penelitian dilaksanakan di Laboratorium Agrobioteknologi, Laboratorium Penelitian dan lahan percobaan Fakultas Pertanian, Universitas Muhammadiyah Yogyakarta pada bulan September 2015 hingga Juni 2016.
Penelitian ini dilakukan dengan metode percobaan lapangan, menggunakan rancangan percobaan faktorial (4 x 3) yang disusun dalam Rancangan Acak Lengkap (RAL) dengan media tanam pasir pantai. Faktor pertama adalah macam inokulum yang terdiri dari 4 aras yaitu Rhizobium sp.-Mikoriza, Rhizobium
sp.-Rhizobacteri indigenous Merapi, Rhizobium sp.-Mikoriza-Rhizobacteri indigenous
Merapi dan tanpa inokulum. Faktor kedua adalah macam varietas kedelai yang terdiri dari 3 aras yaitu varietas Grobogan, varietas Detam-1 dan varietas Petek. Pengamatan dilakukan terhadap aktivitas nodulasi, pengaruh mikoriza, dinamika populasi Rhizobacteri, pertumbuhan perakaran, pertumbuhan vegetatif, dan hasil.
Hasil penelitian menunjukkan bahwa inokulasi Rhizobium sp.-mikoriza dengan varietas Petek nyata meningkatkan pertumbuhan perakaran, luas daun dan hasil biji (5,97 ton/h). Sedangkan inokulasi Rhizobium sp. - mikoriza hanya berpengaruh terhadap diameter nodul dan varietas kedelai terbaik di tanah pasir pantai adalah Petek.
Kata kunci: Kedelai varietas Grobogan, Detam-1, Petek, Rhizobium sp., mikoriza,
Linda Kusumastuti, Agung_Astuti dan Sarjiyah Program Studi Agroteknologi Fakultas Pertanian UMY
ABSTRACT
The experiment purposed to examine the effect of Rhizobium sp., mycorrhizae and Rhizobacteria indigenous of Merapi inoculation on the 3 of soybean cultivars, study the inoculum association and soybean cultivars to growth and yield which was planted on coastal sandy soil and decide which one the best inoculum and cultivars for soybean development on coastal sandy soil. The research was conducted in Agro-biotechnology and Research Laboratorium, experiment area of Agriculture Faculty, Universitas Muhammadiyah Yogyakarta at September 2015 until June 2016.
The research was conducted by field and 4 x 3 factorial experiment, arranged in completely randomize design and using coastal sandy soil as planting medium. The first factor is inoculation treatment which consist of 4 levels: Rhizobium sp.- mycorrhizae, Rhizobium sp.- Rhizobacteria indigenous of Merapi, Rhizobium sp.-mycorrhizae- Rhizobacteria indigenous of Merapi and without inoculation. The second factor is soybean cultivars which consist of 3 levels: Grobogan, Detam-1 and Petek. Observation was done to nodulation, mikoriza effect, Rhizobacteri population dynamics, plant growth and yield.
The result showed that Rhizobium sp.–mycorrhizae inoculated on Petek increased root growth, leaf area and yield (5,97 ton/ha). Rhizobium sp.–
mycorrhizaeinoculation only increased diameter of nodule and the best cultivar for coastal sandy soil is Petek.
1
I. PENDAHULUAN
A. Latar Belakang
Kedelai berperan penting di beberapa negara di dunia sebagai sumber protein nabati (Rahmat dan Yuyun, 1996). Menurut Badan Pusat Statistik (2015), produksi kedelai rata-rata menurun 5,38% setiap tahun dari 2009 hingga 2013. Pada tahun 2012 produksi kedelai nasional mencapai 850.000 ton, namun kebutuhan kedelai dalam negeri diperkirakan mencapai 2,4 juta ton. Menurut Adetama (2011), kebutuhan kedelai untuk tahu dan tempe mencapai 1,6 juta ton per tahun dan kebutuhan kedelai hitam untuk industri kecap sekitar 650 ribu ton. Artinya untuk memenuhi kebutuhan kedelai dalam negeri diperlukan tambahan produksi kedelai sekitar 1,55 juta ton, sehingga perlu adanya peningkatan produktivitas kedelai di Indonesia.
Kedelai hitam nasional yang potensial dikembangkan sebagai bahan baku industri kecap adalah varietas Detam-1. Varietas ini memiliki keunggulan yakni potensi hasilnya 3,45 ton per hektar dan kandungan proteinnya yang mencapai 45,36% (Balitkabi, 2008).
Upaya pemenuhan kebutuhan pangan dapat terwujud dengan adanya dukungan ketersediaan lahan pertanian dan optimalisasi lahan marginal yang ada di Indonesia. Salah satu lahan marginal yang ada di Indonesia adalah lahan pasir pantai yang memiliki potensi luas lahan 1.060.000 ha, termasuk lahan marginal. Di Yogyakarta, terdapat lahan marginal berupa lahan pasir pantai dengan luas 3.300 h (4% luas total wilayah Yogyakarta), terbentang antara 1-3 km dari garis pantai (Nasih, 2009). Menurut Gunawan (2014), lahan pasir pantai Yogyakarta memiliki kesuburan rendah yakni memiliki porositas tinggi, kandungan Nitrogen rendah, dan efisiensi pemupukan yang rendah akibat tingkat pelindian hara yang tinggi. Upaya perbaikan lahan pasir pantai dapat dimanfaatkan beberapa jasad mikro dalam tanah yang diterapkan melalui pupuk hayati (Gunawan, 2014). Beberapa mikrobia pendukung kesuburan tanah yakni Rhizobium sp., mikoriza dan Rhizobacteri indigenous Merapi. Rhizobium sp. dapat membantu tanaman dalam penyediaan Nitrogen, mikoriza membantu penyediaan Fosfor (Gunawan, 2014), sementara
Rhizobacteri indigenous Merapi membantu tanaman tahan cekaman kekeringan (Muhamad dkk., 2014; Murdianto dkk., 2014).
penelitian Lilik (2005), inokulasi mikoriza secara tunggal belum mampu meningkatkan bobot kering barangkasan dan luas daun. Inokulasi ganda Rhizobium
sp.-mikoriza dan inokulasi tunggal Rhizobium sp. berpengaruh sama terhadap variabel jumlah polong per tanaman, bobot biji per tanaman dan hasil biji per satuan luas lahan. Inokulasi ganda Rhizobium sp.- mikoriza untuk tanaman kedelai di lahan pasir pantai memiliki daya hasil yang sangat rendah, yakni hanya 25% dari potensi hasilnya. Pemberian inokulasi Rhizobacteri osmotoleran dan Rhizobium sp. tidak memberikan pengaruh positif bagi pertumbuhan dan produktivitas kedelai (Ngadiman dkk., 2014). Diduga asosiasi Rhizobium sp.-mikoriza-Rhizobacteri indigenous Merapi dengan kedelai varietas Grobogan memberikan pertumbuhan dan hasil terbaik di lahan pasir pantai. Oleh karena itu perlu pengkajian kombinasi inokulum Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapi untuk meningkatkan produktivitas kedelai di lahan pasir pantai, terutama tentang kompatibilitas dengan beberapa varietas kedelai unggul dan menetapkan macam inokulum dan macam varietas yang sesuai untuk pengembangan kedelai di lahan pasir pantai.
B. Perumusan Masalah
hara dan air. Adanya keterbatasan lahan pasir pantai dalam hal ketesediaan unsur hara dan air, diperlukan inovasi pemberian pupuk hayati berupa mikrobia yang mampu membantu tananaman dalam menyerap hara dan air. Penelitian sebelumnya didapatkan bahwa inokulasi ganda Rhizobium sp.- mikoriza dan Rhizobium
sp.-Rhizobacteri osmotoleran belum mencapai potensi hasil yang maksimal.
Sedangkan varietas kedelai sangat mempengaruhi kompatibilitas asosiasi antara tanaman dan inokulum. Oleh karena itu inokulasi Rhizobium sp. mikoriza
-Rhizobacteri indigenous Merapi pada tanaman kedelai varietas unggul di tanah pasir pantai diharapkan mampu mendukung pertumbuhan dan hasil kedelai sehingga dapat meningkatkan produksi kedelai nasional. Permasalahan utama yang akan dikaji dalam penelitian peningkatan produksi kedelai di tanah pasir pantai ini adalah:
1. Bagaimana asosiasi antara Rhizobium sp.- mikoriza -Rhizobacteri indigenous
Merapi terhadap pertumbuhan dan hasil tanaman kedelai?
2. Bagaimana saling pengaruh antara inokulasi Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapi dan varietas terhadap pertumbuhan dan hasil kedelai?
C. Tujuan Penelitian
1. Mengetahui saling pengaruh inokulasi inokulum Rhizobium sp.- mikoriza-
Rhizobacteri indigenous Merapi dan varietas terhadap pertumbuhan dan hasil tanaman kedelai.
2. Mengkaji asosiasi inokulum Rhizobium sp., mikoriza dan Rhizobacteri indigenous Merapi terhadap pertumbuhan dan hasil tanaman kedelai.
3. Mengetahui pengaruh varietas terhadap pertumbuhan dan hasil tanaman kedelai.
6
II. TINJAUAN PUSTAKA
A. Budidaya Kedelai
kedelai juga berpengaruh terhadap respon pemberian inokulum mikoriza (Ellia dkk., 2014).
Terdapat banyak varietas nasional yang telah dikembangkan di Indonesia. Menurut Erliana, dkk. (2009), varietas nasional yang baik untuk industri tempe dari segi ukuran dan kandungan protein, adalah varietas Grobogan (deskripsi terlampir pada lampiran 1). Varietas Grobogan juga termasuk cukup tahan kekeringan (Sri dkk, 2015a). Selain itu, terdapat varietas lokal, varietas petek yang cukup tahan cekaman kekeringan (Sri dkk, 2015a). Deskripsi varietas Petek terdapat pada lampiran 2.
Sedangkan kedelai hitam yang potensial untuk dikembangkan sebagai bahan baku industri kecap adalah varietas Detam-1. Varietas ini memiliki protein yang cukup tinggi yakni 45,36 %. Deskripsi kedelai varietas Detam-1 terlampir pada lampiran 3. Menurut Ardiansyah dkk. (2014), inokulasi mikoriza dapat meningkatkan pertumbuhan dan hasil kedelai verietas Grobogan dan varietas Detam-1 (Endang, 2013). Selain itu, inokulasi Rhizobium sp. dapat meningkatkan produksi kedelai varietas Petek (Okti dkk., 2012).
B. Tanah Pasir Pantai
Pada umumnya lahan yang terbentuk dari tanah berfraksi pasir memiliki produktivitas rendah karena memiliki kesuburan yang rendah. Kualitas kesuburan yang rendah disebabkan oleh sifat fisik dan kimia yang tidak dapat memberikan dukungan kepada pertumbuhan tanaman. Tanah pasir tidak memiliki kandungan air yang cukup untuk menopang pertumbuhan tanaman karena dominasi fraksi pasir, fraksi lempung rendah, dan tidak terbentuknya agregat tanah karena rendahnya kandungan bahan organik (Gunawan, 2014).
Lahan pasir pantai di Yogyakarta terhampar memanjang dari Pantai Parang Endok, Kabupaten Bantul hingga Pantai Glagah Kabupaten Kulon Progo. Bahan lahan pasir pantai ini didominasi fraksi pasir. Lahan pasir ini berasal dari proses deflasi abu volkanik dan materi pasir yang dibawa oleh aliran sungai yang bermuara di laut selatan. Lahan pasir pantai di Yogyakarta memiliki daya dukung lahan dan kesuburan yang rendah. Lahan tersebut tidak memiliki kemampuan menyimpan lengas karena dominasi fraksi pasir (Gunawan, 2014).
30, C-organik 0,12%, N-total 0,004%, K-total 0,012%, Kalium tersedia 0,044 me/100g, P2O5- 12,86 ppm, Ca 0,82 me/100g, Mg 0,37 me/100 g.
C. Asosiasi Rhizobium sp. pada Tanaman
Pemanfaatan jasad mikro yang mampu memfiksasi Nitrogen dari udara bebas dalam tanah sebagai pupuk hayati adalah bakteri nodul akar atau Rhizobium
sp. yang berasosiasi dengan akar tanaman legume (Gunawan, 2014). Menurut Novriani (2011), Rhizobium sp. merupakan istilah untuk kelompok bakteri yang memiliki kemampuan untuk menyediakan unsur hara bagi tanaman. Rhizobium sp. akan bersimbiosis dengan tanaman legume dengan membentuk nodul akar dan hanya dalam bentuk nodul akar Rhizobium sp. akan memfiksasi Nitrogen.
Rhizobium sp. mampu memberikan Nitrogen dalam bentuk asam amino kepada tanaman.
Rhizobium sp. menginfeksi tanaman melalui akar tanaman. Infeksi dimulai dari rambut akar menyebabkan pertumbuhannya yang keriting akibat adanya auksin yang dihasilkan bakteri. Benang infeksi berkembang hingga korteks dan mengadakan percabangan. Percabangan ini mengakibatkan jaringan korteks membesar. Inilah yang dilihat sebagai nodul akar (Novriani, 2011).
untuk menambat Nitrogen bebas melalui pembentukan enzim Nitrogenase (protein yang mengandung Fe dan Mo yang memerlukan Co sebagai aktivatornya). Enzim
Nitrogenase ini labil terhadap oksigen, sehingga dikontrol oleh leghemoglobin berwarna jingga. Enzim ini menambat Nitrogen di udara dan merubahnya menjadi gas Amoniak di dalam nodul bakteroid (Novriani, 2011).
Menurut Lilik (2005), interaksi yang terjadi antara sel Rhizobium sp. dengan sel jaringan akar tanaman kedelai akan membentuk nodul akar yang merupakan organ simbiosis. Organ ini mampu memfiksasi N2 dari udara sehingga tanaman kedelai mampu memenuhi sebagian besar kebutuhan Nitrogen untuk pertumbuhannya. Hubungan yang serasi antara Rhizobium sp. dengan tanaman kedelai menghasilkan organ simbiosis pemfiksasi N2 yang sangat efektif.
Inokulasi Rhizobium sp. terbukti efektif meningkatkan jumlah nodul akar pada minggu ke-3 hingga minggu ke-9. Aktivitas pembentukan nodul akar kedelai di lahan pasir pantai lebih panjang dibandingkan kedelai yang ditanam di lahan subur. Nodul akar yang efektif ditunjukkan oleh pigmen berwarna merah dalam nodul. Efektifitas nodul akar terjadi dari minggu ketiga sampai minggu ke enam, sedangkan sesudah minggu keenam mulai mengalami pelapukan (Lilik, 2005).
D. Asosiasi Mikoriza pada Tanaman
tanaman melalui spora. Mikoriza bermanfaat meningkatkan serapan hara tanaman terutama unsur P, mampu meningkatkan ketahanan terhadap kondisi kekeringan, penyakit maupun kondisi kurang menguntungkan lainnya. Mikoriza ini dapat dijadikan salah satu teknologi dalam membantu proses efisiensi pemupukan hara tanaman (Muhammad dkk., 2014).
Salah satu jenis mikoriza adalah endomikoriza yang sering disebut Mikoriza Vesikular Arbuskular (MVA) yang memiliki struktur vesikel, arbuskul dan hifa eksternal pada akar. Mikoriza ini dapat meningkatkan luasan penyerapan hara oleh miselium eksternal. Mikoriza juga bisa meningkatkan lingkungan mikrorisosfer yang dapat merubah komposisi dan aktivitas mikroba tanah. Hal ini karena adanya perubahan fisiologi akar dan produksi sekresi mikroba. Selain itu mikoriza juga dapat memanfaatkan karbohidrat akar sebelum dikeluarkan sehingga patogen tidak mendapat makanan (Muhammad dkk., 2014).
Berdasarkan penelitian Muhammad dkk. (2014), pemberian perlakuan mikoriza dapat memberikan pengaruh nyata terhadap panjang akar tanaman. Infeksi mikoriza berdampak pada perluasan area penyerapan unsur hara. Penambahan mikoriza pada tanaman berperan dalam penyerapan unsur P. Fosfor merupakan unsur hara yang dibutuhkan tanaman dalam jumlah lebih sedikit dibandingkan unsur N dan K. Tanaman memanfaatkan unsur P dalam pertumbuhan akar pada awal pertumbuhan. Selain itu mikoriza juga mampu memberikan unsur yang dibutuhkan tanaman untuk proses pertumbuhannya seperti N, P dan K.
dan untuk menjaga kelengasan dalam perakaran (Gunawan, 2014). Menurut Lilik (2005), inokulasi ganda Rhizobium sp. dan mikoriza dapat meningkatkan persentase nodul akar efektif secara nyata. Inokulasi ganda tesebut juga dapat meningkatkan bobot kering brangkasan dan luas daun.
E. Asosiasi Rhizobacteri pada Tanaman
Rhizobacteri adalah bakteri yang hidup di daerah perakaran (rhizosfer) dan berperan penting bagi pertumbuhan tanaman. Rhizobacteri dapat memacu pertumbuhan tanaman atau PGPR (Plant Growth-Promotting Rhizobacteria) dengan memproduksi hormon tumbuh (IAA), sehingga dapat membantu tanaman dalam pertumbuhan dan produksinya (Sri dkk., 2015b).
Rhizobacteri merupakan asosiasi bakteri yang bisa hidup pada perakaran tanah dan menghasilkan ZPT atau senyawa osmotoleran sehingga tahan terhadap cekaman kekeringan, Rhizobacteri mampu mensintesis senyawa organik dalam sitoplasma sebagai osmoregulator pada saat terjadi cekaman osmotik. Osmoprotektan berfungsi menjaga agar potensial osmotik sel selalu lebih tinggi daripada lingkungan, akibatnya akan terbentuk gradien konsentrasi antara sel dengan lingkungan sehingga air tetap mengalir dari lingkungan sel. Selain itu
Rhizobacteri berfungsi dalam menghasilkan ZPT sehingga tanaman tumbuh subur,
serta dapat menghasilkan fitoaleksin sehingga tanaman tahan terhadap penyakit. Isolat Rhizobacteri osmotoleran A1-19 mampu menghasilkan IAA sehingga secara signifikan telah meningkatkan proliferasi akar, selain mampu mendukung pertumbuhan tanaman pada keadaan cekaman kekeringan (Gatot, 2002).
menghasilkan ZPT atau senyawa osmotoleran sehingga tahan terhadap cekaman kekeringan.
Tanaman kedelai yang diinokulasi Rhizobacteri menunjukkan hasil yang lebih baik dari segi pertumbuhan dan produksi daripada tanaman yang tidak diinokulasi (Sri dkk., 2015b). Pemberian Rhizobacteri tahan cekaman kekeringan dapat memberikan pengaruh nyata terhadap tinggi tanaman, jumlah daun, luas daun, bobot basah dan kering brangkasan, bobot basah dan kering akar, jumlah polong, bobot 100 biji dan bobot kering biji (Doddy, 2005).
F. Hipotesis
III. TATA CARA PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Agrobioteknologi, Laboratorium Penelitian dan lahan percobaan Fakultas Pertanian Universitas Muhammadiyah Yogyakarta pada bulan September 2015 sampai Juni 2016.
B. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini yaitu : inokulum Rhizobium sp. (Legin) (lampiran 13.e), Rhizobacteri indigenous Merapi isolat MB dan MD (koleksi Ir. Agung Astuti, M.Si.) (lampiran 13.f), mikoriza dari perbanyakan rhizosfer tanaman jagung, benih jagung,benih kedelai varietas Grobogan (lampiran 13.a), varietas Petek (lampiran 13.c), varietas Detam-1 (lampiran 13.b), alkohol,
Acidfuchin, KOH 10%, HCl 1%, media platting LBA (Luria Bertani Agar), media perbanyakan isolat LBC (Luria Bertani Cair), aquades, cat gram A, cat gram B, cat gram C, cat gram D, kapur, kertas payung, kertas filter, kapas, tanah pasir pantai, pupuk kandang, pupuk Urea, SP-36, KCl dan pestisida.
plastik, cetok, gembor plastik, nampan, ayakan pasir, sprayer pestisida, dan plastik naungan.
C. Metode Penelitian
Penelitian dilakukan dengan metode percobaan lapangan, menggunakan rancangan perlakuan faktorial (4 x 3) yang disusun dalam Rancangan Acak Lengkap (RAL).
Faktor pertama adalah macam inokulum yang terdiri dari 4 aras yaitu: A : Rhizobium sp.- mikoriza
B : Rhizobium sp.-Rhizobacteri indigenous Merapi,
C : Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapidan D : Tanpa Inokulum (kontrol).
Faktor kedua adalah varietas kedelai yang terdiri dari 3 aras yaitu: P : varietas Grobogan,
Q : varietas Detam-1, dan R : varietas Petek.
Dari kedua faktor, diperoleh 12 kombinasi perlakuan yang diujikan yaitu: AP : Rhizobium sp.- mikoriza pada kedelai varietas Grobogan,
AQ : Rhizobium sp.- mikoriza pada kedelai varietas Detam-1, AR : Rhizobium sp.- mikoriza pada kedelai varietas Petek,
BP : Rhizobium sp.-Rhizobacteri indigenous Merapi pada kedelai varietas Grobogan,
BR : Rhizobium sp.-Rhizobacteri indigenous Merapi pada kedelai varietas Petek, CP : Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapi pada kedelai
varietas Grobogan,
CQ : Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapi pada kedelai varietas Detam-1,
CR : Rhizobium sp.- mikoriza -Rhizobacteri indigenous Merapi pada kedelai varietas Petek,
DP : Tanpa Inokulum pada kedelai varietas Grobogan, DQ : Tanpa Inokulum pada kedelai varietas Detam-1 dan DR : Tanpa Inokulum pada kedelai varietas Petek.
Masing-masing kombinasi perlakuan diulang 3 kali, sehingga diperoleh 36 unit percobaan. Setiap unit percobaan digunakan 7 tanaman, meliputi 3 tanaman sampel, 3 tanaman korban dan 1 tanaman cadangan, dengan demikian terdapat 252 polibag. Lay out penelitian terlampir pada lampiran 4.
D. Tahapan Penelitian
Dalam penelitian ini, terdiri dari beberapa tahapan, yakni tahapan pembuatan inokulum, tahap aplikasi dan penanaman, tahap pemeliharaan tanaman dan tahap panen dan pengamatan.
1. Tahap pembuatan inokulum
a. Perbanyakan inokulum mikoriza
Perbanyakan inokulum mikoriza dilakukan dengan cara kultur pot jagung dengan media tanah 3 kg (lampiran 13.g) sebanyak 6 polibag dan dipelihara selama 4 minggu. Setelah itu tanah dibongkar untuk diuji persentase infeksi mikoriza dan jumlah sporanya.
1. Pengamatan Persentase Infeksi Mikoriza
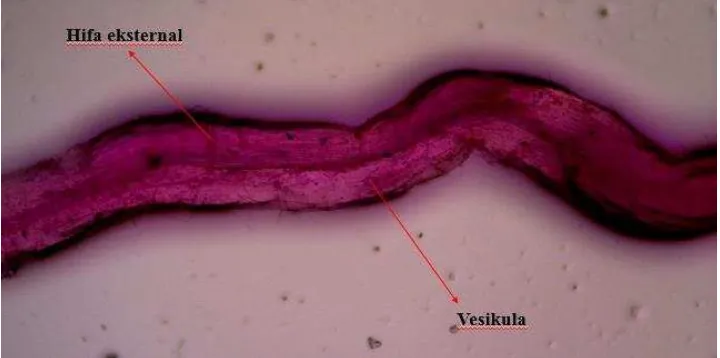
Pengamatan dilakukan dengan metode pengecatan Acid fuchsin yakni mengamati akar tersier yang dipotong 1 cm sebanyak 3 x 20 potong per tanaman, kemudian direndam dengan larutan KOH 10% selama 24 jam, setelah 24 jam akar dicuci dan direndam larutan HCl 1% selama 1 jam, dicuci dan direndam acid fuchsin selama 5 menit. Pengamatan ditujukan pada vesikula, hifa luaran, dan arbuskula dengan mikroskop perbesaran 40-400 kali (lampiran 13.i).
2. Pengamatan Jumlah Spora
Pengamatan dilakukan dengan mengambil tanah per polibag sebanyak 250 g, dilarutkan dalam 1 l aquades (1:4) (lampiran 13.h). Larutan dituang pada saringan, kemudian hasil saringan diamati dengan haemacytometer di bawah mikroskop. Berikut rumus penghitungan jumlah spora:
� = , × , × � ×
Keterangan:
S: jumlah spora (spora/ml)
a: jumlah spora yang teramati pada haemacytometer
Kemudian tanah dan akar jagung setiap polibag dikering anginkan selama 7 hari dan dapat digunakan sebagai crude inokulum mikoriza. Inokulum mikoriza dalam bentuk crude (campuran dari akar, tanah dan spora mikoriza) (lampiran 13.j) diberikan bersamaan waktu tanam sebanyak 40 gram apabila jumlah spora didapatkan 50-60 spora atau lebih/ml dan persentase infeksi lebih dari 80%. Apabila didapatkan kurang dari 50-60 spora, maka diinokulasikan 80 gram
crude/lubang tanam (Lukiwati and Simanungkalit, 2002). Hasil uji pendahuluan terhadap persentase infeksi mikoriza pada akar tanaman jagung sebesar 67% dengan jumlah spora terhitung sebesar 30,67x106 pada crude inokulum yang digunakan, sehingga digunakan crude inokulum mikoriza sebanyak 80 gram/polibag.
b. Perbanyakan isolat Rhizobacteri indigenous Merapi:
Isolat Rhizobacteri indigenous Merapi perlu dilakukan perbanyakan untuk aplikasi. Skema perbanyakan isolat terlampir pada lampiran 5. Dalam perbanyakan isolat, terdapat beberapa tahapan yakni:
i. Sterilisasi alat dan bahan (lampiran 13.k), setiap sebelum dilakukan tahapan perbanyakan Rhizobacteri, seluruh alat yang akan digunakan disterilkan dengan menggunakan autoklaf bertemperatur 121ºC tekanan 1 atm selama 30 menit. Untuk bahan yang digunakan dalam pembuatan inokulum juga perlu disterilisasi dengan autoklaf 121ºC tekanan 1 atm selama 15 menit,
Trypton 10 g, Yeast extract 5 g, NaCl 5 g dan Agar 15 g (khusus untuk LBA) untuk media 1000 ml. Seluruh bahan dicampur dengan aquades, kemudian keasaman media dicek dengan menggunakan pH stik (pH 6,5-7,2) dan dipanaskan hingga homogen. Setelah itu, masukkan media LBA pada Erlenmeyer steril, media LBC dimasukkan ke dalam tabung reaksi steril sebanyak 10 ml kemudian sterilisasi selama 15 menit. Untuk membuat LB miring, masukkan LBA pada tabung reaksi sebanyak 10 ml setiap tabung reaksi dan diletakkan dengan kemiringan 30-45º. Untuk platting, media disimpan di Erlenmeyer dan apabila akan digunakan, media padat dipanaskan hingga cair lalu dimasukkan petridish sesuai kebutuhan.
i. Peremajaan isolat, dibutuhkan 2 stok isolat MB dan MD serta 4 LBA miring. Peremajaan isolat dilakukan dengan menginokulasi isolat stok MB dan MD Rhizobacteri indigenous Merapi pada LBA miring. Masing-masing diulang 2 kali, artinya setiap isolat diinokulasi pada dua LBA miring. Setelah inokulasi, inkubasi selama 48 jam.
ii. Screening pada media stres 2,75 M NaCl (lampiran 13.r), dilakukan setelah peremajaan. Screening ini dilakukan dengan metode streak platting. Setelah tumbuh, koloni tunggal diplatting kembali pada media standar, dan dilakukan identifikasi. Pada tahap ini didapatkan isolate MB dan MD tahan cekaman NaCl 2,75 M.
pada LBA dalam petridish dengan metode permukaan (surface platting method) dan goresan (streak platting method) dari pengenceran 10-6 serta arbobisitas pada media LBC (lampiran 13.m). Dalam inokulasi ini dilakukan dua kali ulangan setiap isolat. Kemudian inkubasi selama 48 jam hingga didapatkan koloni tunggal. Dari koloni tunggal tersebut, diamati karakteristiknya dengan menggunakan mikroskop. Pengamatan yang dilakukan terhadap warna, diameter, bentuk koloni, bentuk tepi, elevasi, struktur dalam koloni (lampiran 13.n dan 13.o), bentuk sel dan sifat gram Rhizobacteri indigenous. Bentuk sel dan sifat gram diamati dengan pengecatan gram.
terakhir ditetesi cat gram D selama 2 menit, dicuci, dikeringkan dan diamati di bawah mikroskop. DIdapatkan bahwa MB berbentuk bacil negatif (lampiran 13.p) dan MD berbentuk coccus negatif (lampiran 13.q). Hasil identifikasi terdapat pada tabel 4.
v. Pembuatan biakan murni isolat Rhizobacteri indigenous Merapi untuk kultur stok (lampiran 13.s), dilakukan dengan cara mengambil satu ose isolat hasil identifikasi. Masing-masing isolat MB dan MD diinokulasikan pada dua LBA miring kemudian diinkubasi selama 48 jam. Hasil inkubasi masing-masing isolat diplatting pada dua media LBA secara surface platting method dari pengenceran 10-6 dan diinkubasi 48 jam. Apabila sudah seragam hasilnya, maka dianggap murni. Kemudian dibuat kultur murninya pada LBA miring sebanyak 2 ulangan dari koloni tunggal. Selanjutnya inokulasikan kultur murni pada LBC (10 ml tiap tabung reaksi) dan diinkubasi selama 48 jam.
vii. Uji viabilitas, dilakukan dengan mengencerkan 1 ml sampel pada botol suntik (10-2; 10-4; 10-6) dan 2 tabung reaksi (10-7;10-8), sehingga didapat seri pengenceran hingga 10-8. Setiap 0,1 ml pada seri 10-6;10-7;10-8 diinokulasikan dengan metode permukaan atau surface platting method
dan setiap seri pengenceran yang diujikan (10-7;10-8;10-9) dengan seri pengenceran 10-7; 10-8; 10-9 sebanyak 3 kali ulangan. Uji kemampuan hidup mikroba berdasarkan daya viabilitas dan jumlah koloni populasi bakteri. Penghitungan populasi bakteri ini dengan metode Total Plate Count (TPC). Jumlah bakteri per mL dapat ditentukan dengan menghitung koloni yang tumbuh dari masing-masing pengenceran. Penentuan jumlah bakteri per mililiter dengan menggunakan rumus : Jumlah bakteri per ml sampel (CFU/ml) = Jumlah koloni
Faktor pengenceran
Penentuan jumlah jumlah bakteri per mililiter dengan menggunakan cara TPC harus memenuhi syarat sebagai berikut:
i. Jumlah koloni tiap cawan petri antara 30 – 300 koloni
ii. Tidak ada koloni yang menutup lebih besar dari setengah luas cawan petri
(Spreader)
iv. Jika dengan ulangan setelah memenuhi syarat hasilnya dirata-rata (Agung_Astuti dkk, 2014).
Dari hasil uji viabilitas Rhizobacteri indigenous Merapi, didapatkan populasi Rhizobacteri sebesar 8,45 x 108 CFU/ml, sehingga bisa dilanjutkan untuk aplikasi.
c. Inokulum Rhizobium sp.
Inokulum Rhizobium sp. yang digunakan adalah inokulum komersial dagang Legin. Legin merupakan pupuk bio-hayati yang bermanfaat dalam meningkatkan penyediaan Nitrogen bagi tanaman melalui pengikatan N udara oleh Rhizobium sp., memperbaiki kesuburan dan keseimbangan hara dalam tanah. Dosis pemberian Legin untuk benih kedelai adalah 3 gram/1 kg benih (Ramadhani, 2015).
2. Tahap aplikasi inokulum dan uji efektifitasnya terhadap pertumbuhan
kedelai
a. Pembuatan Naungan
Pemberian naungan di lahan perlu dilakukan mengingat tanaman kedelai tidak suka terhadap banyak air sementara penelitian dilakukan ketika musim penghujan serta pemberian air harus sama. Naungan dibuat dengan bambu dan dilapisi plastik PE pada bagian atapnya.
b. Penyiapan media tanam dan pemupukan dasar
dan pupuk kandang sebanyak 70,75 gram (perhitungan terlampir pada lampiran 6). Kemudian seluruh polibag diberi air hingga kapasitas lapang. Penghitungan kebutuhan air kapasitas lapang terlampir pada lampiran 7. c. Uji perkecambahan
Pengujian dilakukan dengan cara mengambil 100 benih setiap varietas secara acak kemudian benih disemai pada petridish yang sudah diberikan kapas atau kertas saring yang telah dibasahi (lampiran 13.d). Pengujian dilakukan 3 kali ulangan dan diamati selama 7 hari. Rumus daya kecambah (DK):
DK=jumlah biji yang dikecambahkanjumlah biji berkecambah x 100%
Dari hasil uji perkecambahan didapatkan daya berkecambah varietas Grobogan sebesar 98%, varietas Detam-1 sebesar 81,6% dan varietas Petek sebesar 93,3%.
d. Aplikasi inokulum pada berbagai varietas sesuai perlakuan
Kebutuhan benih varietas Grobogan 30,24 gram, varietas Detam-1 24,93 gram dan varietas Petek 13,94 gram (penghitungan kebutuhan benih terlampir pada lampiran 8).
i. Aplikasi Rhizobacteri indigenous Merapi (lampiran 13.y), dilakukan dengan merendam benih pada starter campuran sebelum tanam selama 10 menit, dilanjutkan dengan aplikasi inokulum Rhizobium.
22,68 gram diberi Legin 0,07 gram, varietas Detam-1 18,69 gram diberi Legin 0,03 gram dan varietas Petek 10,44 gram diberi Legin 0,06 gram (penghitungan terlampir pada lampiran 10). Kemudian dikering anginkan, lalu benih ditanam pada lubang tanam (masing-masing 2 benih) yang sebelumnya telah diinokulasi mikoriza.
iii. Aplikasi crude inokulum mikoriza (lampiran 13.aa) dengan cara memasukkan crude mikoriza sebanyak 80 gram/polibag ke dalam lubang tanam sebelum dilakukan penanaman. Kebutuhan crude
mikoriza adalah 10.080 gram (penghitungan terlampir pada lampiran 9).
e. Penanaman
Penanaman dilakukan dengan cara tanam 2 benih dalam 1 lubang untuk mengurangi resiko jika ada tanaman yang tidak tumbuh. Cara aplikasi dan penanaman yaitu pertama inokulasi Rhizobacteri kemudian inokulum
Rhizobium sp. pada benih, kemudian inokulasi mikoriza pada lubang tanam. Penanaman dilakukan dengan cara membuat lubang tanam yang ada di polibag (lay out penanaman terlampir pada lampiran 4). Pada saat penanaman juga dilakukan pemupukan yang pertama (penghitungan terlampir pada lampiran 6).
3. Tahap pemeliharaan tanaman
a. Penyiraman
Penyiraman kapastitas lapang dilakukan setelah pemupukan dasar dengan pupuk kandang 7 hari sebelum tanam dan sehari sebelum tanam. Penghitungan kebutuhan air pada kondisi kapasitas lapang terlampir pada lampiran 7. Setelah penanaman, penyiraman dilakukan sesuai kebutuhan (kelembaban tanah rendah) dan volume penyiraman diusahakan sama.
b. Pemupukan susulan
Pemupukan (lampiran 13.ab) dilakukan 2 kali yakni pada saat penanaman (Urea 0,12 g; SP-36 0,18 g; dan KCl 0,23 g) dan 2 minggu setelah tanam yakni Urea 0,12 (penghitungan dosis pemupukan terlampir pada lampiran 6) dengan cara
ring placement. c. Penyiangan
Penyiangan gulma dilakukan setiap ada tumbuhan yang tidak dikehendaki tumbuh. Pengendalian gulma dilakukan secara manual, yakni dengan cara mencabut langsung karena area tanam yang tidak terlalu luas.
d. Pengendalian hama dan penyakit
Pengendalian hama belalang, ulat daun dengan menggunakan pestisida sistemik dan penyakit yang disebabkan oleh cendawan, pengendalian dengan fungisida kontak dan sistemik (lampiran 13.ac).
4. Tahap kelima: panen dan pengamatan
dengan masak morfologis tanaman. Setelah dipanen, kemudian kedelai dikering mataharikan hingga kering.
E. Variabel Pengamatan
Dalam penelitian ini variabel pengamatan yang diamati meliputi pertumbuhan bakteri, pertumbuhan vegetatif dan generatif. Pengamatan parameter pertumbuhan dan hasil tanaman dilakukan mulai dari minggu pertama hingga minggu ke 6 setelah tanam.
1. Viabilitas total Rhizobacteri indigenous Merapi pada starter
Pengamatan dilakukan pada starter campuran isolat MB dan MD sebelum tanam dengan cara mengambil 1 ml starter campuran, kemudian dimasukkan pada botol suntik (10-2; 10-4; 10-6) dan 2 tabung reaksi (10-7;10-8), sehingga didapat seri pengenceran hingga 10-8. Setiap 0,1 ml pada seri 10-6;10-7;10-8 diinokulasikan dengan metode permukaan atau surface platting method dan setiap seri pengenceran yang diujikan (10-7;10-8;10-9) dengan seri pengenceran 10-7; 10-8; 10 -9 sebanyak 3 kali ulangan. Dinamika Rhizobacteri indigenous Merapi didasarkan pada populasi koloni bakteri dengan menggunakan metode TPC (Total Plate Count), dengan syarat:
i. Jumlah koloni tiap cawan petri antara 30 – 300 koloni
ii. Tidak ada koloni yang menutup lebih besar dari setengah luas cawan petri
(Spreader)
atau lebih kecil dari 2 maka hasilnya dirata-rata, dan jika lebih besar dari 2 maka yang dipakai adalah jumlah koloni dari hasil pengenceran sebelumnya iv. Jika dengan ulangan setelah memenuhi syarat hasilnya dirata-rata
(Agung_Astuti dkk., 2014).
2. Pengamatan Pertumbuhan Tanaman
a. Tinggi tanaman (cm)
Tinggi tanaman sampel diukur dari permukaan tanah sampai dengan titik tumbuh tanaman. Alat yang digunakan adalah penggaris atau meteran dengan satuan cm. Pengamatan dilakukan setiap minggu hingga masa vegetatif maksimal dimulai satu minggu setelah tanam.
b. Jumlah daun
Jumlah daun dihitung untuk menentukan tingkat kemampuan tanaman untuk berfotosintesis. Pengamatan dilakukan setiap satu minggu sekali hingga masa vegetatif maksimal dimulai satu minggu setelah tanam. 3. Pengamatan tanaman korban Minggu ke-3, ke-6 dan ke-9
a. Dinamika populasi total bakteri selama masa tanam (cfu/ml)
Pengamatan dilakukan pada minggu ke-3, 6 dan 9 setelah tanam dengan cara membuat suspensi rhizosfer tanaman dengan aquades, diencerkan pada botol suntik (10-2; 10-4; 10-6) dan 2 tabung reaksi (10-7;10-8). Setiap 0,1 ml pada seri 10-6;10-7;10-8 diinokulasikan dengan metode permukaan atau
bakteri dengan menggunakan metode TPC (Total Plate Count), dengan syarat:
i. Jumlah koloni tiap cawan petri antara 30 – 300 koloni
ii. Tidak ada koloni yang menutup lebih besar dari setengah luas cawan petri (Spreader)
iii. Perbandingan jumlah koloni dari pengenceran yang berturut-turut antara pengenceran yang lebih besar dengan pengenceran sebelumnya. Jika sama atau lebih kecil dari 2 maka hasilnya dirata-rata, dan jika lebih besar dari 2 maka yang dipakai adalah jumlah koloni dari hasil pengenceran sebelumnya
iv. Jika dengan ulangan setelah memenuhi syarat hasilnya dirata-rata (Agung_Astuti dkk., 2014).
b. Pengaruh inokulasi Rhizobium sp.
1. Jumlah nodul akar total
Jumlah nodul akar dihitung secara manual setelah tanaman dicabut, akar dibersihkan lalu dihitung jumlah nodul seluruhnya, baik efektif maupun tidak efektif.
2. Bobot nodul (g)
Setelah nodul dihitung, maka nodul ditimbang dengan timbangan analitik. Hasil timbangan dinyatakan dengan satuan gram.
3. Diameter nodul akar (mm)
nodul diambil secara acak, lalu diukur dengan menggunakan jangka sorong. Pengamatan dilakukan 3 kali ulangan.
4. Persentase keefektifan nodul (%)
Persentase nodul efektif dihitung dengan rumus J
� �ℎ � �� � ��� � �× % dan dinyatakan dalam satuan persen.
Caranya 20 nodul diambil secara acak, lalu dipotong dengan cutter, dan mengamati warna nodul. Bila berwarna merah berarti efektif, dan bila berwarna hitam tidak efektif. Pengamatan dilakukan 3 kali ulangan.
c. Pengaruh inokulasi mikoriza
1. Persentase infeksi mikoriza (%)
Pengamatan infeksi mikoriza dilakukan dengan metode pengecatan Acid fuchsin yakni:
i. Mengambil sampel akar sesuai perlakuan, kemudian dibersihkan dari kotoran kemudian akar halus dipotong 0,5-1 cm sebanyak 3 x 20 potong per tanaman ii. Akar yang telah terpotong, dimasukkan ke dalam botol kecil dan direndam
dengan KOH 10% sebanyak 2 ml selama 24 jam. Setelah itu dibilas dengan air hingga bersih
iii. Kemudian akar direndam HCl 1% sebanyak 2 ml selama 1 jam. Selanjutnya dibilas dengan air hingga bersih
iv. Selanjutnya akar direndam acid fuchsin selama 5 menit
vi. Penghitungan persentase infeksi dilakukan dengan rumus J
� �ℎ � �� � × % dan dinyatakan dalam satuan persen.
2. Jumlah spora (spora/ml)
Penghitungan spora dilakukan pada minggu ke 9 dengan metode penyaringan basah dan dekantasi, dengan cara:
i. Tanah per perlakuan inokulum mikoriza diambil 250 gram dan dilarutkan dalam 1 liter aquades (1:4) dan biarkan hingga partikel kasar mengendap ii. Cairan (dekantasi) dituang melalui saringan kasar 90 MM/170 mesh hingga 38
MM/400 mesh
iii. Bahan yang tertahan pada saringan dipindahkan ke dalam botol dan kemudian diteteskan cairan pada haemacytometer
iv. Mengamati jumlah spora yang ada pada kotak sampel haemacytometer di bawah mikroskop dengan perbesaran 400 kali. Berikut rumus penghitungan jumlah spora:
S = , mm × , mm × a × f ml
Keterangan:
S: jumlah spora (spora/ml)
a: jumlah spora yang teramati pada haemacytometer
f: faktor pengenceran d. Proliferasi akar
dengan harkat (++++) untuk perakaran yang memiliki percabangan rumit serta banyak akar horizontal dan vertikal, (+++) untuk perakaran yang memiliki percabangan akar banyak, (++) untuk perakaran yang memiliki percabangan sedang dan (+) untuk perakaran yang memiliki percabangan akar sedikit serta (-) untuk perakaran yang tidak memiliki percabangan. e. Panjang akar (cm)
Pengukuran panjang akar tanaman menggunakan penggaris dari pangkal batang hingga ujung akar terpanjang. Pengamatan panjang akar dilakukan pada minggu ke-3, 6 dan 9 setelah tanam pada tanaman korban dan hasilnya dinyatakan dalam satuan cm.
f. Bobot segar dan kering akar (gram)
Pengamatan bobot segar akar dilakukan dengan cara mencabut tanaman korban minggu ke-3, 6 dan 9, kemudian potong bagian pangkal batang dan menimbang bagian akar yang telah dibersihkan. Selanjutnya akar dikering anginkan selama 24 jam kemudian dioven dengan temperatur 60oC hingga bobotnya konstan. Pengamatan bobot kering akar dilakukan dengan menimbang akar yang telah kering oven dengan menggunakan timbangan analitik dan dinyatakan dalam satuan gram.
g. Bobot segar dan kering tajuk (gram)
perlakuan kemudian dioven dengan temperatur 60oC hingga bobotnya konstan. Pengamatan bobot kering tajuk dilakukan dengan menimbang tajuk yang telah kering oven dengan menggunakan timbangan analitik dan dinyatakan dalam satuan gram.
h. Luas daun (cm2)
Luas daun diukur dengan menggunakan LAM (Leaf Area Meter). Daun yang akan diukur, dipotong terlebih dahulu, lalu diukur menggunakan LAM dan dinyatakan dalam satuan cm2. Pengamatan dilakukan pada minggu ke-3, 6 dan 9 setelah tanam pada tanaman korban.
4. Pengamatan Tanaman Sampel Menjelang Panen dan Setelah Panen
a. Umur berbunga (HST)
Dalam menentukan umur berbunga dilakukan saat kedelai mulai mengalami pembungaan per tanaman dan dinyatakan dalam satuan HST (hari setelah tanam).
b. Jumlah polong
Polong dihitung jumlahnya per tanaman per perlakuan. Pengamatan dilakukan setelah panen.
c. Bobot kering polong (g)
d. Bobot biji per tanaman (g)
Bobot biji diamati dengan memisahkan biji dengan polong kering terlebih dahulu, kemudian menimbang biji tanaman sampel tiap unit dan dinyatakan dalam satuan gram dan dilakukan pengukuran kadar airnya. Bobot biji dikonversi pada kadar air 10% dengan menggunakan rumus sebagai berikut: Bobot biji = −��
− %� �
Keterangan:
C : bobot biji per tanaman (g) Ka : kadar air biji terukur e. Bobot 100 biji (gram)
Pengamatan bobot 100 biji dilakukan dengan menimbang bobot biji kedelai sebanyak 100 biji kering matahari dari setiap sampel tanaman yang telah diketahui kadar airnya. Kemudian bobot dikonversikan pada kadar air 10% dengan rumus: a = −��
− %��
Keterangan:
a : bobot 100 biiji pada kadar air 10% b : bobot 100 biji pada kadar air terukur Ka : kadar air terukur
f. Hasil (ton/h)
Pengamatan ini dilakukan dengan mengkonversikan hasil bobot biji per tanaman pada kadar air 10% pada ton/h dengan rumus :
H = � �� Keterangan:
H : hasil kedelai/ha pada kadar air 10% (ton/h) A : luas lahan dalam satuan ha (10.000 m2) B : jarak tanam (m2)
F. Analisis Data
Data hasil pengamatan secara periodik disajikan dalam bentuk grafik dan histogram, sedangkan hasil akhir dianalisis dengan menggunakan sidik ragam (Analisis of Variance) pada tingkat α 5%. Untuk perlakuan yang berbeda nyata
36
IV. HASIL DAN PEMBAHASAN
Berdasarkan hasil analisis, tiga varietas tanaman kedelai memiliki respon yang berbeda-beda atas inokulasi macam inokulum. Komponen pengamatan pengaruh inokulum terhadap pertumbuhan dan hasil tiga varietas kedelai terdiri dari pengamatan nodulasi sebagai pengaruh inokulasi Rhizobium sp., pengaruh inokulasi mikoriza, dinamika populasi Rhizobacteri indigenous Merapi, pertumbuhan perakaran kedelai, pertumbuhan tanaman kedelai dan komponen hasil.
A. Pengaruh Inokulasi Rhizobium sp.
Nitrogen termasuk unsur yang paling berperan bagi pertumbuhan tanaman, namun lahan marjinal pasir pantai memiliki ketersediaan N tergolong rendah. Inokulasi Rhizobium sp. dilakukan sebagai teknologi penambatan N secara biologis untuk memenuhi kebutuhan N tanaman kedelai. Interaksi Rhizobium sp. dengan tanaman kedelai akan membentuk organ baru yang disebut dengan nodul akar, dimana Rhizobium sp. bersatu secara intraseluler ke dalam inang dan menambat Nitrogen dari atmosfer untuk digunakan oleh tanaman inang (Armiadi, 2009).
Untuk mengetahui pengaruh inokulasi Rhizobium sp. ke tanaman, maka dapat dilihat dari aktivitas nodulasi tanaman. Aktivitas nodulasi akibat inokulasi
Rhizobium sp., dapat dilihat dari jumlah nodul total, persentase nodul efektif, bobot nodul dan diameter nodul. Rerata komponen pengamatan pengaruh
Tabel 1. Rerata jumlah nodul total per tanaman, persentase nodul efektif, bobot nodul dan diameter nodul pada minggu ke-9
Perlakuan
Keterangan: angka yang diikuti huruf yang sama menunjukkan tidak ada beda nyata berdasarkan uji F taraf α 5% dan uji DMRT
(-) menunjukkan tidak ada interaksi antar perlakuan * data ditransformasi akar
*** data ditransformasi arc sin dan akar 1. Jumlah Nodul Total
Jumlah nodul merupakan indikator keberhasilan inokulasi inokulum
Rhizobium sp. dan digunakan untuk menilai pengaruhnya terhadap pertumbuhan dan hasil tanaman kedelai. Semakin banyak nodul yang terbentuk, semakin banyak N2 yang terfiksasi dan N yang dihasilkan, sehingga kandungan klorofil pada daun akan meningkat dan proses fotosintesis juga meningkat. Dengan demikian asimilat yang dihasilkan lebih banyak, akibatnya pertumbuhan tanaman lebih baik (Lamina, 1989 dalam Jumari, 2006; Ramdana dan Retno, 2015).
macam inokulum berpengaruh sama terhadap jumlah nodul total pada minggu ke-9 (lampiran 12.a). Terbentuknya nodul akar mengindikasikan bahwa inokulum
Rhizobium sp. yang digunakan memiliki kesesuaian strain dengan tanaman
inangnya. Pada minggu ke-9, inokulasi mikoriza maupun Rhizobacteri sp. tidak mempengaruhi jumlah nodul sedangkan pada minggu ke-3 hingga ke-6 inokulasi
Rhizobium sp.-mikoriza mampu meningkatkan jumlah nodul. Berdasarkan
penelitian ini, diperoleh informasi bahwa inokulasi mikoriza-Rhizobium dapat mempercepat pembentukan nodul di tanah pasir pantai. Sedangkan macam varietas tidak mempengaruhi pembentukan nodul secara signifikan karena masing-masing varietas memiliki respon yang sama terhadap inokulasi Rhizobium sp. Artinya spesies Rhizobium sp. tersebut efektif dengan tanaman kedelai secara umum (Ramdana dan Retno, 2015). Perkembangan pembentukan nodul akar selama 9 minggu ditunjukkan pada gambar 1.
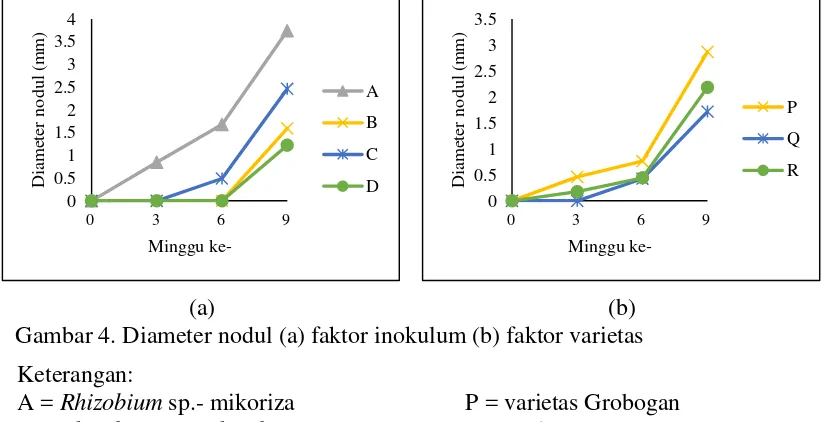
(a) (b)
Gambar 1. Jumlah nodul total (a) faktor inokulum (b) faktor varietas Keterangan:
A = Rhizobium sp.- mikoriza P = varietas Grobogan
B = Rhizobium sp.-Rhizobacteri Q = varietas Detam-1
C = Rhizobium sp.-mikoriza-Rhizobacteri R = varietas Petek
Gambar 1 (a), menunjukkan bahwa jumlah nodul perlakuan macam inokulum mengalami peningkatan dari minggu ke 3 hingga minggu ke-9. Nodul pada Rhizobium sp,- mikoriza-Rhizobacteri mulai terbentuk pada minggu ke-6 dan nodul Rhizobium sp,-Rhizobacteri dan tanpa inokulum mulai terbentuk pada minggu ke-9. Hal ini sesuai dengan penelitian Lilik (2005), bahwa nodulasi tanaman kedelai di lahan pasir pantai terlambat. Pada minggu ke-3 dan ke-6 perlakuan Rhizobium sp,- mikoriza nyata lebih tinggi (lampiran 12.a dan 12.b), namun pada minggu ke-9 perlakuan Rhizobium sp,- mikoriza cenderung lebih tinggi walau berdasarkan sidik ragam tidak berbeda nyata (lampiran 12.c). Pada minggu ke-9, perlakuan Rhizobium sp.-mikoriza memiliki jumlah nodul tertinggi sebesar 8,67 nodul, kemudian perlakuan Rhizobium sp.-Rhizobacteri (2,78 buah),
Rhizobium sp.-mikoriza-Rhizobacteri (2,56 buah) dan yang terendah pada tanpa inokulum dengan jumlah nodul 1,78. Kedelai yang diinokulasi ganda Rhizobium
sp.-mikoriza memiliki jumlah nodul total yang berbeda (Lilik, 2005; Yudhy dan Inoriah, 2009). Sesuai dengan pendapat Ayu dkk. (2013), bahwa pembentukan nodul dan aktivitas nodul akar tanaman oleh Rhizobium sp. dipengaruhi oleh unsur P. Unsur P tersebut didapat dari aktivitas mikoriza yang dapat meningkatkan efisiensi penyerapan Fosfat serta ketersediaan Fosfat menjadi lebih terjamin (Gunawan, 2014).
menentukan pertumbuhan dan perkembangan mikroorganisme pada rhizosfer (Werner, 1992 dalam Gunawan, 2009), sehingga Rhizobium sp. memerlukan adaptasi terlebih dahulu sebelum menginfeksi varietas Detam-1. Dari minggu ke-3 hingga ke-9 varietas tidak menunjukkan perbedaan yang nyata dalam pembentukan nodul (lampiran 12.a, 12.b dan 12.c), namun minggu ke-6 dan minggu ke-9 varietas Grobogan cenderung lebih tinggi. Pada minggu ke-9, jumlah nodul pada varietas Grobogan sebesar 6,42 buah, varietas Detam-1 4,08 buah, dan terendah varietas petek 1,33 buah. Hal tersebut karena terdapat strain yang cenderung lebih kompatibel dengan varietas Grobogan, sehingga menyebabkan jumlah nodul varietas Grobogan cenderung lebih tinggi.
2. Persentase Nodul Efektif
Nodul efektif ditandai dengan berwarna merahnya nodul akar yang disebabkan oleh adanya leghaemoglobin (LHb) yang mengandung besi. LHb berfungsi dalam mengatur konsentrasi oksigen karena penambatan Nitrogen bersifat sangat peka terhadap oksigen. LHb bekerja dengan cara bergabung dengan Oksigen dan membentuk oxyhaemoglobin (OLHb) (Triwibowo, 2006). Persentase nodul efektif ini menunjukkan persentase nodul yang aktif dalam memfiksasi N.
Nike-Triwahyuningsih, 2004). Hasil analisis menunjukkan bahwa varietas berpengaruh sama, berarti strain Rhizobium sp. yang digunakan pada penelitian ini mempuyai kesesuaian dengan varietas Grobogan, Detam-1 maupun varietas petek.
Perkembangan keefektifan nodul akar selama 9 minggu ditunjukkan pada gambar 2.
(a) (b)
Gambar 2. Persentase nodul efektif (a) faktor inokulum (b) faktor varietas Keterangan:
A = Rhizobium sp.- mikoriza P = varietas Grobogan
B = Rhizobium sp.-Rhizobacteri Q = varietas Detam-1
C = Rhizobium sp.-mikoriza-Rhizobacteri R = varietas Petek
D = Tanpa inokulum
Gambar 2 (a), menunjukkan bahwa pada perlakuan inokulum Rhizobium sp-mikoriza dan Rhizobium sp.-Rhizobacteri efektifitas nodul mengalami peningkatan dari minggu ke-3 hingga minggu ke-6, kemudian terjadi penurunan persentase nodul efektif. Sedangkan perlakuan Rhizobium sp.- Rhizobacteri dan tanpa inokulum, efektifitas nodul baru mulai pada minggu ke-9. Hal ini didukung oleh penelitian Lilik (2005), bahwa nodulasi tanaman kedelai di lahan pasir pantai terlambat sehingga efektifitasnya juga lama. Dari minggu ke-3 hingga ke-6
Rhizobium sp,- mikoriza mempengaruhi keefektifan nodul secara nyata lebih tinggi
dibanding perlakuan inokulum lainnya (lampiran 12.d dan 12.e), hingga minggu ke-9 tetap cenderung lebih tinggi, walau berdasarkan sidik ragam tidak ada beda nyata (lampiran 12.f). Pada minggu ke-9, persentase nodul efektif tertinggi terdapat pada perlakuan Rhizobium sp.-mikoriza sebesar 65,42%, diikuti Rhizobium sp.-mikoriza-Rhizobacteri sebesar 49,17%, Rhizobium sp.-Rhizobacteri sebesar 37,78% dan terendah tanpa inokulasi sebesar 20,83%. Perlakuan Rhizobium sp.-mikoriza dapat meningkatkan persentase nodul efektif pada minggu ke-6, hal ini didukung oleh jumlah nodul yang tinggi dan sejalan dengan penelitian Endang (2007) yang menyatakan bahwa inokulasi Rhizobium sp.-mikoriza memberikan kondisi yang lebih baik di sekitar perakaran tanaman kedelai untuk pertumbuhan dan aktivitas Rhizobium sp. Selain itu Rhizobium sp. dan mikoriza saling menunjang dalam kehidupannya yaitu inokulum mikoriza dapat mengikat O2 dalam pori-pori tanah dan membuat kondisi aerob di sekitar perakaran, sehingga memacu nodulasi akar.
efektifitasnya meningkat selama 9 minggu, sedangkan varietas Detam-1 meningkat pada minggu ke-6 kemudian menurun pada minggu ke-9. Menurut Okti dkk. (2012), masing-masing varietas memberikan tanggapan inokulasi Rhizobium sp. berupa peningkatan fiksasi Nitrogen yang berbeda-beda.
3. Bobot Nodul
Bobot nodul merupakan parameter untuk mengetahui pertumbuhan nodul akar. Hasil analisis sidik ragam menunjukkan bahwa pada minggu ke-9 perlakuan macam inokulum dan macam varietas tidak saling mempengaruhi bobot nodul. Perlakuan varietas berpengaruh sama terhadap bobot nodul namun perlakuan macam inokulum berpengaruh nyata terhadap bobot nodul (lampiran 12.i). Bobot nodul sangat dipengaruhi oleh jumlah nodul akar total, diameter nodul dan fase pertumbuhan tanaman. Menurut Aep (2006), nodul akar efektif hanya sampai 50-60 hari (masa vegetatif tanaman berakhir), setelah itu akan luruh, sehingga mempengaruhi bobot nodul.
Perkembangan bobot nodul akar selama 9 minggu ditunjukkan pada gambar 3. Gambar 3 (a) menunjukkan bahwa bobot nodul perlakuan macam inokulum semakin meningkat dari minggu ke-3 hingga minggu ke-9. Perlakuan Rhizobium
sp,- mikoriza menunjukkan bobot nodul yang nyata lebih tinggi mulai dari minggu ke-3 hingga minggu ke-9 (lampiran 12.g, 12.h dan 12.i). Pada minggu ke-9, bobot nodul tertinggi terdapat pada perlakuan Rhizobium sp.-mikoriza sebesar 0,38 gram, kemudian tanpa inokulum sebesar 0,15 gram, Rhizobium sp-mikoriza-Rhizobacteri
lebih baik terutama ketersediaan air, sehingga mempengaruhi bobot nodul akar (Nike-Triwahyuningsih, 2004). Bobot nodul seharusnya mengalami penurunan pada minggu ke-9. Hal ini menunjukkan bahwa pembentukan nodul akar kedelai di tanah pasir pantai lebih panjang dibandingkan di tanah subur.
(a) (b)
Gambar 3. Bobot nodul (a) faktor inokulum (b) faktor varietas Keterangan:
A = Rhizobium sp.- mikoriza P = varietas Grobogan
B = Rhizobium sp.-Rhizobacteri Q = varietas Detam-1
C = Rhizobium sp.-mikoriza-Rhizobacteri R = varietas Petek
D = Tanpa inokulum
Gambar 3 (b) menunjukkan bahwa bobot nodul perlakuan macam varietas semakin meningkat dari minggu ke-3 hingga minggu ke-9 namun tidak menunjukkan perbedaan yang nyata (lampiran 12.g, 12.h dan 12.i). Pada minggu ke-9 varietas Grobogan cenderung lebih tinggi (0,31 gram) walau berdasarkan sidik ragam tidak ada beda nyata (lampiran 12.i), diikuti varietas Detam-1 sebesar 0,14 gram dan varietas Petek sebesar 0,08 gram. Penelitian ini menunjukkan bahwa nodulasi tidak dipengaruhi oleh varietas.
4. Diameter Nodul
Diameter nodul mengindikasikan bahwa terdapat kompatibilitas antara
Rhizobium sp. dengan varietas tanaman. Dengan adanya kompatibilitas maka
Rhizobium sp. berkembang dengan baik di dalam nodul akar yang menyebabkan
nodul semakin besar. Hasil analisis sidik ragam menunjukkan bahwa pada minggu ke-9 perlakuan macam inokulum dan macam varietas tidak saling mempengaruhi diameter nodul. Perlakuan varietas dan inokulum berpengaruh sama terhadap diameter nodul (lampiran 12.l). Apabila kompatibel, maka sel bakteri akan memasuki rambut akar tanaman dan akan berkembang, jaringan akar akan terdesak sehingga muncul benjolan (Lisna, 2008), artinya semakin pesat perkembangan
Rhizobium sp. dalam nodul maka semakin besar pula nodul yang terbentuk. Ukuran nodul yang kecil mengindikasikan bahwa hanya sedikit jaringan bakteroid yang berkembang, sehingga keefektifannya dalam memfiksasi N kurang baik (Ramdana dan Retno, 2015).
Perkembangan diameter nodul akar selama 9 minggu ditunjukkan pada gambar 4. Gambar 4 (a) menunjukkan bahwa diameter nodul perlakuan macam inokulum semakin meningkat dari minggu ke-3 hingga minggu ke-9, namun hanya berpengaruh secara nyata pada minggu ke-3 hingga minggu ke-6 (lampiran 12.j dan 12.k). Pada minggu ke-9, diameter pada perlakuan Rhizobium sp.-mikoriza cenderung lebih tinggi (lampiran 12.l) dengan diameter 3,74 mm, diikuti Rhizobium