EVALUASI PEMBERIAN KOMBINASI CACING SUTRA DAN PAKAN BUATAN
TERHADAP PERKEMBANGAN ORGAN DAN ENZIM PENCERNAAN UNTUK
PERTUMBUHAN LARVA IKAN LELE DUMBO (
Clarias
sp.)
NURHAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Evaluasi Pemberian Kombinasi Cacing Sutra dan Pakan Buatan terhadap Perkembangan Organ dan Enzim Pencernaan untuk Pertumbuhan Larva Ikan Lele Dumbo (Clarias sp.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 04 September 2014
RINGKASAN
NURHAYATI. Evaluasi Pemberian Kombinasi Cacing Sutra dan Pakan Buatan terhadap Perkembangan Organ dan Enzim Pencernaan untuk Pertumbuhan Larva Ikan Lele Dumbo (Clarias sp.). Dibimbing oleh NUR BAMBANG PRIYO UTOMO dan MIA SETIAWATI.
Stadia awal larva ikan lele sangat penting dan kritis karena pada stadia ini larva sangat sensitif terhadap ketersediaan pakan dan faktor lingkungan. Sistem pencernaan ikan pada stadia awal masih sederhana dan belum berdiferensiasi, baik secara morfologis maupun fisiologis sehingga perlu pemberian pakan alami. Pakan alami yang digunakan yaitu cacing sutra. Pada unit pembenihan berskala besar tentu diperlukan cacing sutra dalam jumlah banyak dan tersedia secara berkesinambungan, namun ketersediaan cacing sutra sebagai pakan alami di alam sangat terbatas, sedangkan untuk dapat dimanfaatkan secara optimal oleh ikan pakan harus diberikan tepat waktu dan jumlahnya. Berdasarkan hal tersebut maka pemberian cacing sutra perlu dikombinasikan dengan pakan buatan sehingga masalah keterbatasan dapat diatasi. Kemampuan ikan dalam mencerna makanan sangat bergantung pada kelengkapan organ pencernaan dan ketersediaan enzim pencernaan. Pemberian pakan buatan di awal pemeliharaan diharapkan dapat mempercepat aktivitas enzim pencernaan. Jenis pakan atau kandungan nutrien dari pakan yang diberikan dapat memberi pengaruh terhadap aktivitas enzim pencernaan. Penelitian ini bertujuan untuk mengevaluasi pemberian kombinasi cacing sutra dan pakan buatan terhadap perkembangan organ dan enzim pencernaan untuk pertumbuhan larva ikan lele dumbo.
Ikan uji yang digunakan adalah larva ikan lele dumbo berumur 4 hari berukuran berat 0.01± 0.008 g ekor-1 dan panjang 0.5±0.15 cm yang diperoleh dari satu pemijahan yang sama. Pemeliharaan ikan uji dilakukan selama 30 hari, dengan kepadatan 20 ekor L-1. Pengamatan aktivitas enzim pencernaan diamati secara berkesinambungan terhadap perkembangan yang terjadi secara alami selama 15 hari pada awal pemeliharaan. Wadah penelitian berupa wadah plastik berukuran 60x40x40 cm3 yang diisi air dengan volume total 30 liter. Pakan uji yang digunakan berupa kombinasi pakan cacing sutra dan pakan buatan. Pakan diberikan dengan feeding rate 5% dari berat biomassa perhari dengan frekuensi pemberian pakan 4 kali sehari yaitu pukul 08.00-09.00, 12.00-13.00, 16.00-17.00 dan 21.00-22.00 WIB. Untuk menjaga kualitas air supaya tidak mempengaruhi kualitas penelitian, maka dilakukan pergantian air sebanyak 10% dari volume air media. Rancangan percobaan yang digunakan adalah Rancangan Acak lengkap (RAL) dengan 3 kali ulangan. Perlakuan yang digunakan adalah pemberian PA (cacing sutra 100%), PA75+PB25 (cacing sutra 75% dan pakan buatan 25%), PA50+PB50 (cacing sutra 50% dan pakan buatan 50%), PA25+PB75 (cacing sutra 25% dan pakan buatan 75%) dan PB (pakan buatan 100%).
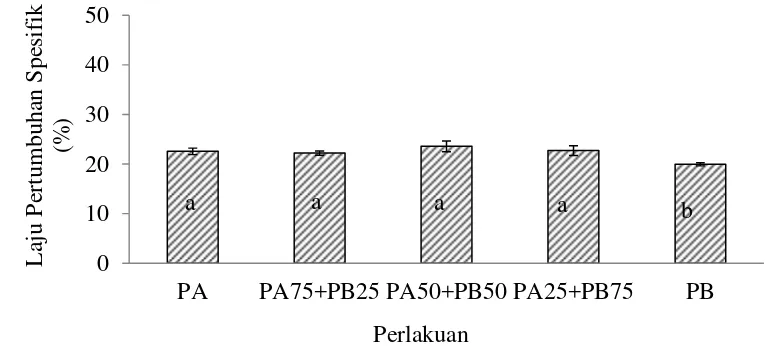
spesifik (P<0.05). Pemberian kombinasi pakan cacing sutra 50% dan pakan buatan 50% merupakan kombinasi terbaik pada pemeliharaan larva ikan lele dumbo dengan pertumbuhan panjang mutlak 8.43±0.75 cm dan laju pertumbuhan spesifik 23.56±1.08%.
SUMMARY
NURHAYATI. Evaluation of Giving Silk Worms and Artificial Diet Combination on the Development of Digestive Organs and Enzymes to the Growth of African Catfish Larvae (Clarias sp.). Supervised by NUR BAMBANG PRIYO UTOMO and MIA SETIAWATI.
Early larval stages of catfish is very important and critical because in initial stadia larvae are very sensitive to the availability of feed and environmental factors. The digestive system of larvae in initial stage was simple and undifferentiated, both morphologically and physiologically that need feeding live feed. Live feed used is silk worms. In large scale hatchery silk worms certainly needed a large quantities and provided sustainable, however availability the natural feed silk worms as very limited in the wild, while be used optimally by the fish, feed should be given appropriate time and amount. Under these conditions, then the given of silk worms needs to combined with artificial diet that the problem can be solved. The ability of fish to digest food very dependent on completeness of the digestive organs and availability digestive enzymes. Artificial feeding at the initial stadia is expected to expedite the activity of digestive enzymes. Type of feed or nutrient content of the feed can influence the activity of digestive enzymes. The aimed of this experiment was evaluate of giving silk worm and artificial diet combination on the development of organs and digestive enzymes to the growth of african catfish larvae .
The fish samples used were of african catfish larvae 4 days old, 0,01 ± 0,008 g-1 in weight and 0,5±0,15 cm long were obtained from the same spawning. The test fish raising was conducted for 30 days, with a density of 20 fish L-1. Observation of digestive enzyme activity observed sustainable on the development of naturally occurring for 15 days at the start of maintenance. The container used in this study was a plastic container measuring 60 x 40 x 40 cm3, the total water volume for each plastic containers was 30 L. The test feed used was in the form of combination of silk worms and artificial feed. The feed was given the feeding rate of 5% of the weight of biomass per day with feeding frequency is 4 times a day at 08.00-9.00, 12.00-13.00, 16.00-17.00 and 21.00-22.00 pm. To maintain the quality of water so as not to affect the quality of the research, then conducted change of water as much as 10% of the volume of water media. The experimental design used was completely randomized design (CRD) with 3 replications. The treatments used were giving of PA (live feed 100%), PA75+PB25 (live feed 75% and artificial feed 25%), PA50+PB50 (live feed 50% and artificial feed 50%), PA25+PB75 (live feed 25% and artificial feed 75%) and PB (artificial feed 100%).
of African catfish with growth of absolute length of 8.43±0.75 cm and specific growth rates of23.56±1.08%.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program StudiIlmu Akuakultur
EVALUASI PEMBERIAN KOMBINASI CACING SUTRA DAN PAKAN BUATAN
TERHADAP PERKEMBANGAN ORGAN DAN ENZIM PENCERNAAN UNTUK
PERTUMBUHAN LARVA IKAN LELE DUMBO (
Clarias
sp.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Evaluasi Pemberian Kombinasi Cacing Sutra dan Pakan Buatan terhadap Perkembangan Organ dan Enzim Pencernaan untuk Pertumbuhan Larva Ikan Lele Dumbo (Clarias sp.)
Nama : Nurhayati NIM : C151120521
Disetujui oleh Komisi Pembimbing
Dr Nur Bambang PU, MSi Ketua
Dr Mia Setiawati, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, Msi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillah puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Judul penelitian
“Evaluasi Pemberian Kombinasi Cacing Sutra dan Pakan Buatan terhadap Perkembangan Organ dan Enzim Pencernaan untuk Pertumbuhan Larva Ikan Lele Dumbo (Clarias sp.)”, yang dilaksanakan pada bulan Desember sampai Maret 2014.
Terima kasih penulis ucapkan kepada bapak Dr Nur Bambang Priyo Utomo, MSi dan ibu Dr Mia Setiawati, MSi selaku pembimbing atas segala pengarahan dan ilmu yang diberikan sehingga penelitian dan penulisan tesis ini dapat diselesaikan dengan baik. Di samping itu, penghargaan penulis sampaikan atas bantuan dana pendidikan magister yang diperoleh dari Beasiswa Unggulan DIKTI. Ungkapan terima kasih juga disampaikan kepada ayah, ibu beserta seluruh keluarga, atas segala do’a dan kasih sayangnya. Selanjutnya penulis juga menyampaikan ungkapan terima kasih dan penghargaan kepada teknisi laboratorium bapak Wasjan dari Laboratorium Nutrisi Ikan, bapak Ranta dari Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, FPIK, IPB dan teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2012.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 METODE 3
Rancangan Penelitian 3
Prosedur Penelitian 3
Kualitas Air 4
Parameter Pengamatan 5
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 12
4 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
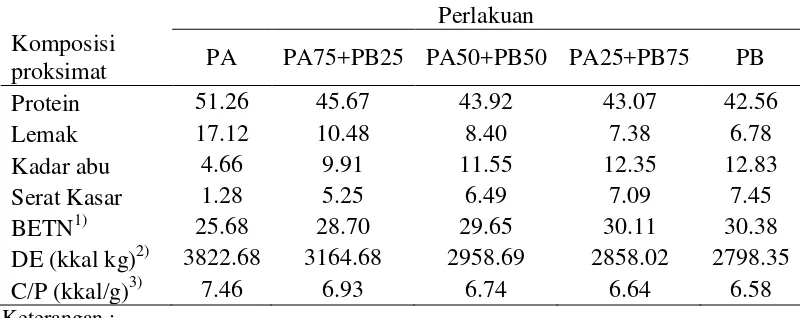
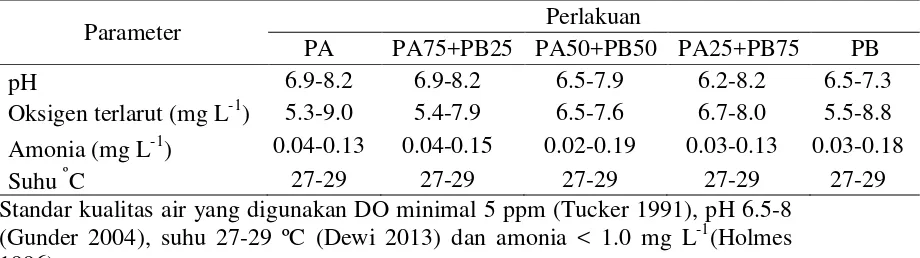
1 Komposisi proksimat (% bobot kering) dan energi pakan uji 4 2 Kualitas air selama pemeliharaan larva ikan lele dumbo, Clarias sp. 5
DAFTAR GAMBAR
1 Rancangan pengacakan wadah penelitian 3
2 Aktivitas enzim amilase larva ikan lele dumbo (Clarias sp.), pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi cacing sutra dan pakan buatan. 7 3 Aktivitas enzim lipase larva ikan lele dumbo (Clarias sp.),
pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi pakan cacing sutra dan pakan buatan. 8 4 Aktivitas enzim protease larva ikan lele dumbo (Clarias sp.),
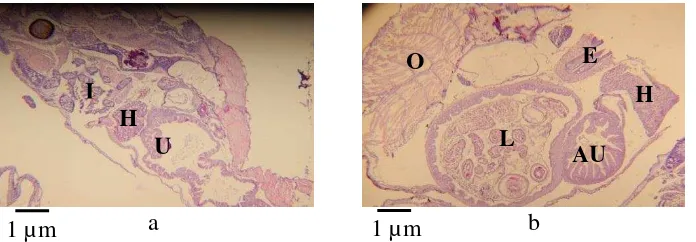
pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi cacing sutra dan pakan buatan. 8 5 Perlakuan PA histologi tubuh larva ikan lele dumbo, Clarias sp.
secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), usus (U), lambung (L), esophagus (E) dan O (otot
daging). 9
6 Perlakuan PA75+PB25 histologi tubuh larva ikan lele dumbo, Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian rongga mulut (R), insang (I), hati (H), lambung (L), faring (F), esophagus (E), anterior usus (AU), dan otot daging (O). 9 7 Perlakuan PA50+PB50 histologi tubuh larva ikan lele dumbo,
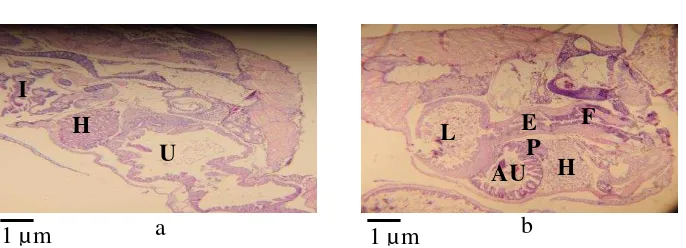
Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), usus (U), pankreas (P), anterior usus (AU), faring (F), otot daging (O) dan esophagus (E). 10 8 Perlakuan PA25+PB75 histologi tubuh larva ikan lele dumbo,
Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), faring (F), esophagus (E), pankreas (P), usus (U), anterior usus (AU) dan posterior usus (PU). 10 9 Perlakuan PB histologi tubuh larva ikan lele dumbo, Clarias sp.
secara membujur, pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), faring (F), esophagus (E), usus (U)
anterior usus (AU), dan posterior usus (PU). 10
DAFTAR LAMPIRAN
1 Analisis statistik terhadap kelangsungan hidup larva ikan lele dumbo yang diberi kombinasi pakan berbeda menggunakan Rancangan Acak
Lengkap (RAL) pada selang kepercayaan 95% 21
2 Analisis statistik terhadap pertumbuhan panjang larva ikan lele dumbo yang diberi kombinasi pakan berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95% 21 3 Analisis statistik terhadap laju pertumbuhan spesifik larva ikan lele
1 PENDAHULUAN
Latar Belakang
Stadium larva merupakan masa yang sangat penting dan kritis karena pada stadium ini larva ikan sangat sensitif terhadap ketersediaan makanan dan faktor lingkungan. Sebagaimana halnya dengan hewan lain sistem pencernaan ikan pada stadia awal masih sederhana dan belum berdiferensiasi baik secara morfologis maupun fisiologis, sehingga diperlukan pemberian pakan alami (Suryanti 2002). Jenis pakan alami yang dibutuhkan harus mengandung nutrien yang sesuai dengan kebutuhan larva ikan, salah satunya adalah cacing sutra. Cacing sutra merupakan pakan yang paling banyak digunakan sebagai pakan larva ikan, baik untuk larva ikan hias maupun larva ikan konsumsi karena memiliki kandungan protein yang tinggi (Suharyadi 2012).
Pada pembenihan ikan skala besar, tentu diperlukan cacing sutra dalam jumlah banyak dan tersedia secara berkesinambungan. Ketersediaan cacing sutra di alam terbatas, tidak kontinu dan sangat bergantung pada faktor musim. Sementara untuk dapat dimanfaatkan secara optimal oleh ikan, pakan harus selalu diberikan tepat waktu dan jumlahnya. Alternatif pemecahannya adalah penggunaan pakan cacing sutra perlu dikombinasikan dengan pakan buatan untuk menjaga supaya pakan tetap kontinu. Metode ini sebelumnya telah dilakukan oleh Fauji (2014) dan menunjukkan bahwa kombinasi pakan yang tepat memiliki nilai laju pertumbuhan bobot harian, panjang mutlak dan kelangsungan hidup lebih tinggi dibandingkan perlakuan lainnya, namun penelitian ini perlu dilakukan penelitian lanjutan berupa analisis aktivitas enzim pencernaan dan histologis larva.
Kemampuan ikan dalam mencerna makanan sangat bergantung pada kelengkapan organ pencernaan dan ketersediaan enzim pencernaan (Fitriliyani 2011). Pemberian pakan buatan di awal pemeliharaan diharapkan dapat mempercepat aktivitas enzim pencernaan. Jenis pakan atau kandungan nutrien dari pakan yang diberikan dapat memberi pengaruh terhadap aktivitas enzim pencernaan (Suzer et al. 2007). Pemberian pakan buatan pada larva ikan kerapu bebek berumur 8 hari cenderung memiliki aktivitas enzim yang lebih tinggi dibandingkan larva yang diberi pakan buatan mulai umur 13 hari. Hal ini menunjukkan bahwa perbedaan waktu pemberian pakan buatan akan berpengaruh terhadap aktivitas enzim pencernaan larva. Hal ini nampak bahwa pakan buatan merupakan substrat yang dapat mengaktifkan zymogen. Sebagaimana diketahui, ketersediaan substrat merupakan salah satu faktor yang akan berpengaruh dalam pengaturan aktivitas enzim pencernaan. Peningkatan aktivitas enzim juga dapat menunjukkan bahwa larva semakin banyak mengkonsumsi pakan buatan (Melianati et al. 2010).
2
optimal pada suhu 25-35 °C dan pH 6-9 (Junsheng et al. 2006). Aktivitas enzim pencernaan adalah suatu indikator yang baik untuk menentukan kapasitas pencernaan, ketika aktivitas enzim pencernaan tinggi, maka dapat diindikasikan secara fisiologis larva siap untuk memproses pakan dari luar (Infante dan Cahu 2007).
Pengkajian tentang perkembangan aktivitas enzim pencernaan sudah banyak dipublikasikan pada berbagai jenis ikan diantaranya adalah : ikan lidah, Solea senegalensis (Martinez et al. 1999), larva ikan patin, Pangasius hypophthalmus (Effendi et al. 2006), Pagrus pagrus (Suzer et al. 2007), ikan baung, Mystus nemurus (Srichanun et al. 2012), Diplodus puntazzo (Savona et al. 2011) dan larva ikan patin siam, Pangasionodon hypophthalmus (Rangsin et al. 2012). Hasil penelitian Olele (2011) mengenai perkembangan enzim pencernaan larva ikan lele berumur 4 minggu yang diberi kombinasi pakan alami (Maggot dan Coppens) dan buatan menunjukkan bahwa juvenil ikan yang diberi pakan kombinasi tepung maggot dan tepung ikan menghasilkan pertumbuhan tertinggi dibandingkan kombinasi pakan lainnya.
Berdasarkan uraian diatas, maka perlu dikaji tentang perkembangan enzim pencernaan dan morfologi pada larva ikan lele dumbo dengan kombinasi cacing sutra dan pakan buatan yang diberikan pada stadia awal pemeliharaan.
Perumusan Masalah
Stadia awal larva ikan lele sangat penting dan kritis karena pada stadia ini larva sangat sensitif terhadap ketersediaan pakan. Sistem pencernaan larva masih sederhana dan belum berdiferensiasi, baik secara morfologi maupun fisiologis sehingga pakan yang diberikan berupa pakan alami. Pakan alami yang sering digunakan pada tahap larva adalah cacing sutra. Pada unit pembenihan skala besar, tentu diperlukan cacing sutra dalam jumlah banyak dan tersedia secara berkesinambungan. Ketersediaan cacing sutra sebagai pakan alami sangat bergantung pada faktor alam, sedangkan untuk dapat dimanfaatkan secara optimal oleh ikan, pakan harus selalu diberikan tepat waktu dan jumlah. Alternatif pemecahan yang dilakukan adalah penggunaan cacing sutra perlu dikombinasikan dengan pakan buatan, sehingga ketersediaan pakan untuk larva ikan lele dapat diatasi. Dengan demikian untuk dapat menyediakan pakan buatan yang dapat diterima oleh larva ikan lele perlu dikaji melalui perkembangan organ dan aktivitas enzim pencernaan yang diberi kombinasi cacing sutra dan pakan buatan.
Tujuan Penelitian
3 Manfaat Penelitian
Manfaat dari penelitian ini dapat memberikan informasi mengenai kombinasi cacing sutra dan pakan buatan yang tepat dalam pemberian pakan pada larva ikan lele serta penyediaan pakan pada industri pembenihan.
Hipotesis
Hipotesis yang digunakan adalah kombinasi pakan cacing sutra dan pakan buatan dengan perbandingan yang tepat berpengaruh terhadap perkembangan organ dan enzim pencernaan untuk pertumbuhan larva ikan lele dumbo (Clarias sp.).
2 METODE
Rancangan Penelitian
Penelitian ini menggunakan metode eksperimental rancangan acak lengkap (RAL) dengan 5 perlakuan dan setiap perlakuannya mempunyai 3 ulangan sehingga terdapat 15 unit percobaan. Penempatan wadah penelitian dilakukan secara acak.
Rancangan pengacakan wadah penelitian seperti ditunjukkan pada Gambar 1. PA50+PB50 PA75+PB25 PA100 PA25+PB75 PA75+PB25
PA25+PB75 PB100 PA50+PB50 PB100 PA100
PA75+PB25 PA25+PB75 PB100 PA100 PA50+PB50
Gambar 1 Rancangan pengacakan wadah penelitian Keterangan :
PA = Pakan cacing sutra 100%
PA75+PB25 = Pakan cacing sutra 75% dan pakan buatan 25% PA50+PB50 = Pakan cacing sutra 50% dan pakan buatan 50% PA25+PB75 = Pakan cacing sutra 25% dan pakan buatan 75% PB = Pakan buatan 100%
Prosedur Penelitian
4
ruangan. Ikan uji yang digunakan adalah larva ikan lele dumbo yang berumur 4 hari yang diperoleh dari satu pemijahan yang sama dengan ukuran berat 0.01± 0.008 g ekor-1 dan panjang 0.5±0.15 cm. 1 hari sebelumnya larva ikan uji telah diberikan makanan exogenous berupa kuning telur setelah kuning telur (egg yolk) pada larva habis. Pakan yang digunakan adalah kombinasi cacing sutra dan pakan buatan seperti yang disebutkan pada rancangan penelitian dengan kandungan nutrien pakan seperti diperlihatkan pada Tabel 1.
Tabel 1 Komposisi proksimat (% bobot kering) dan energi pakan uji
Perlakuan
Komposisi
proksimat PA PA75+PB25 PA50+PB50 PA25+PB75 PB
Protein 51.26 45.67 43.92 43.07 42.56 pagi hari sebelum dilakukan penebaran ikan uji terlebih dahulu diaklimatisasi yang bertujuan untuk menyesuaikan dua kondisi lingkungan yang berbeda sehingga perubahan kondisi tersebut tidak menimbulkan stres bagi larva ikan yang dipelihara. Masa pemeliharaan ikan selama 30 hari. Ikan diberi pakan sebanyak sebanyak 5% dari bobot biomas per hari berdasarkan berat kering sesuai dengan perlakuan masing-masing seperti yang tercantum pada rancangan penelitian. Frekuensi pemberian pakan 4 kali sehari yaitu pukul 08.00-09.00, 12.00-13.00, 16.00-17.00 dan 21.00-22.00 WIB. Untuk menjaga kualitas air di dalam media pemeliharaan, dilakukan pergantian air sebanyak 10% dari volume air media dan penyiponan secara periodik, selama periode pemeliharaan larva berlangsung.
Kualitas Air
5 Tabel 2 Kualitas air selama pemeliharaan larva ikan lele dumbo, Clarias sp.
Parameter Perlakuan
Standar kualitas air yang digunakan DO minimal 5 ppm (Tucker 1991), pH 6.5-8 (Gunder 2004), suhu 27-29 ºC (Dewi 2013) dan amonia < 1.0 mg L-1(Holmes 1996).
Parameter Pengamatan
1. Analisis Kimia
Analisis kimia yang dilakukan meliputi analisis proksimat pakan uji. Analisis proksimat pakan dilakukan untuk mengetahui komposisi nutrien pada pakan tersebut. Analisis tersebut meliputi kadar protein kasar, lemak kasar, serat kasar, kadar abu dan kadar air. Analisis proksimat untuk protein kasar dilakukan dengan metode Kjeldhal, lemak kasar dengan metode ekstraksi dengan alat Soxhlet, kadar abu melalui pemanasan sampel dalam tanur pada suhu 400-600 ºC, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat serta pemanasan dan kadar air dengan metode pemanasan dalam oven pada suhu 105-110 ºC. Seluruh analisa proksimat dilakukan mengikuti prosedur Takeuchi (1988). Prosedur analisis proksimat tercantum pada Lampiran 5.
2. Histologis Larva
Pengamatan histologis bertujuan untuk melihat perkembangan organ pada larva ikan lele dumbo. Pengamatan dilakukan 2 kali yaitu pada hari ke- 0 dan hari ke- 10 pasca pemeliharaan. Sampel yang diambil berupa larva ikan lele secara utuh dan dilakukan pemotongan secara membujur. Pengambilan sampel dilakukan pada pagi hari kemudian difiksasi dalam larutan Normal Buffer Formalin (NBF) 10%. Selanjutnya pembuatan dan pengamatan preparat histologis yang meliputi dehidrasi, clearing, impregnasi, embedding, blocking, pemotongan jaringan, pewarnaan jaringan menggunakan pewarnaan Hematoksilin Eosin (HE) selanjutnya dehidrasi dan mounting dengan entellan (Angka et al. 1990).
3. Analisis Aktivitas Enzim
Aktivitas enzim yang dianalisis meliputi amilase, lipase dan protease. Sampling perkembangan enzim dilakukan sebanyak 6 kali yaitu pada pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15. Aktivitas enzim amilase diukur berdasarkan metode Worthington (1993) sebagai berikut:
6
Aktivitas enzim lipase diukur berdasarkan metode Borlongan (1990) dan aktivitas enzim protease diukur berdasarkan metode Bergmeyer et al. (1983). Prosedur analisis aktivitas enzim selengkapnya dapat dilihat pada Lampiran 4.
4. Kelangsungan Hidup
Tingkat kelangsungan hidup atau Survival rate (SR) adalah persentase dari jumlah ikan yang hidup pada setiap wadah diukur berdasarkan rumus Effendie (2002) sebagai berikut :
S =
x 100% Keterangan :
S = Kelangsungan hidup (%) No = Jumlah ikan awal penelitian Nt = Jumlah ikan akhir penelitian
5. Pertumbuhan
Pada awal penelitian, ikan uji ditimbang dan pada akhir pelaksanaan penelitian ikan uji ditimbang kembali dan dicatat.
a. Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik atau Specific Growth Rate (SGR) merupakan laju pertambahan bobot individu dalam persen dan dinyatakan berdasarkan rumus (NRC 1977):
α [
√
t t̅̅̅̅ o̅̅̅̅̅ -1]
x 100% Keterangan :α = Pertumbuhan bobot rerata harian (%)
̅̅̅̅ = Bobot rata-rata ikan akhir penelitian (g)
̅̅̅̅̅ = Bobot rata-rata ikan awal penelitian (g) t = Lama pemeliharaan (hari)
b. Pertumbuhan Panjang Mutlak
Berdasarkan data panjang ikan dilakukan penghitungan laju pertumbuhan panjang mutlak berdasarkan persamaan (Zonneveld et al. 1991) :
P = Pt-Po Keterangan :
P = Pertumbuhan panjang mutlak (cm)
7 Analisis Data
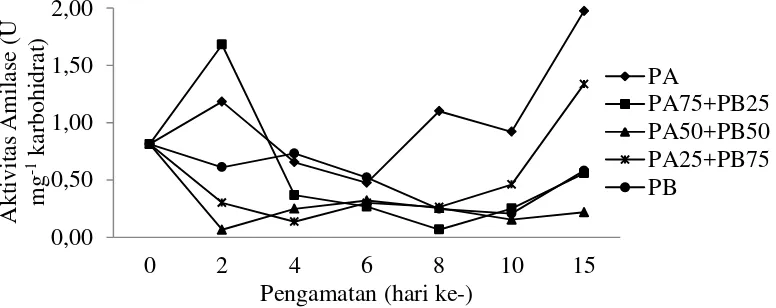
Data kelangsungan hidup, pertumbuhan panjang mutlak, laju pertumbuhan spesifik diuji secara statistik menggunakan analisis ragam (ANOVA) pada selang kepercayaan 95%, apabila hasilnya berpengaruh nyata maka dilakukan uji lanjut menggunakan uji Tukey. Data aktivitas enzim pencernaan dan histologi larva dianalisis secara deskriptif. (PA75+PB25) menunjukkan peningkatan pada pengamatan hari ke- 2. Pada pengamatan hari ke- 4 hingga 8 aktivitas enzim cenderung menurun, namun pada perlakuan pemberian pakan alami 100% (PA) aktivitas enzim meningkat lebih tinggi dibandingkan perlakuan lainnya. Pada pengamatan hari ke- 10 hingga 15 aktivitas enzim amilase pada semua perlakuan cenderung meningkat dan perlakuan pemberian PA mengalami puncak peningkatan pada pengamatan hari ke- 15. Aktivitas amilase pada perlakuan pemberian PA berkisar antara 0.81 sampai 1.97 U mg-1 karbohidrat relatif lebih tinggi dibandingkan perlakuan lain selama pemeliharaan.
Gambar 2 Aktivitas enzim amilase larva ikan lele dumbo (Clarias sp.), pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi cacing sutra dan pakan buatan.
Aktivitas enzim lipase pada pengamatan hari ke- 2 hingga 4 terjadi peningkatan pada semua perlakuan, peningkatan tertinggi diperoleh pada perlakuan PA75+PB25 dan PA25+PB75. Pada pengamatan hari ke- 6 hingga 8 aktivitas enzim cenderung menurun, namun pada pengamatan hari ke- 10 aktivitas enzim terjadi peningkatan kembali dan perlakuan pemberian PA memiliki
8
aktivitas enzim cenderung lebih tinggi. Pada pengamatan hari ke- 15 aktivitas enzim lipase pada perlakuan PA25+PB75 mengalami puncak peningkatan. Aktivitas lipase pada perlakuan PA25+PB75 memiliki kisaran 0.39 sampai 1.42 U mg-1 lemak relatif lebih tinggi dibandingkan perlakuan lain selama masa pemeliharaan.
Gambar 3 Aktivitas enzim lipase larva ikan lele dumbo(Clarias sp.), pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi pakan cacing sutra dan pakan buatan.
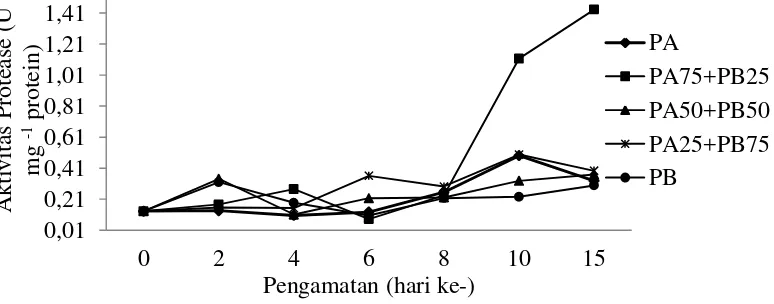
Aktivitas enzim protease pada semua perlakuan relatif sama yaitu menurun dan meningkat secara fluktuatif hingga pengamatan hari ke- 15, namun perlakuan PA75+PB25 terjadi peningkatan secara signifikan pada pengamatan hari ke- 10 hingga 15. Aktivitas protease tertinggi selama pemeliharaan dicapai oleh perlakuan pemberian PA75+PB25 dengan kisaran 0.13 sampai 1.43 U mg-1 protein.
Gambar 4 Aktivitas enzim protease larva ikan lele dumbo (Clarias sp.), pengamatan hari ke- 0, 2, 4, 6, 8, 10 dan 15 yang dipelihara dengan pemberian kombinasi cacing sutra dan pakan buatan.
Histologi Larva
Pada perlakuan PA pengamatan hari ke- 0, larva ikan lele dumbo memiliki saluran percernaan yang masih sederhana yaitu usus berbentuk tabung lurus yang berhubungan langsung ke kerongkongan (Gambar 5a). Pada pengamatan hari ke- 10 saluran pencernaan larva ikan lele dumbo sudah berdiferensiasi, lambung
9 semakin membesar dan sudah terdeteksi adanya makanan. Adanya pilorus yang merupakan segmen yang terletak antara lambung dan usus depan (Gambar 5b).
Pada perlakuan PA75+PB25 pengamatan hari ke- 0 menunjukkan saluran percernaan masih sangat sederhana seperti perlakuan PA, usus berbentuk tabung lurus yang berhubungan langsung ke faring (Gambar 6a). Pada pengamatan hari ke- 10 saluran pencernaan tersebut sudah berdiferensiasi (Gambar 6b).
Pada perlakuan PA50+PB50 pada pengamatan hari ke- 0 saluran pencernaan yang tedeteksi sama dengan perlakuan PA dan PA75+PB25 yaitu usus berbentuk tabung lurus yang langsung berhubungan ke hati dan kerongkongan (Gambar 7a). Pada pengamatan hari ke- 10 saluran pencernaan sudah berdiferensiasi, esophagus memanjang dan ukuran lambung semakin membesar kemudian diluar lambung terdapat pilorus yang merupakan segmen yang terletak antara lambung dan usus depan (Gambar 7b).
Gambar 5 Perlakuan PA histologi tubuh larva ikan lele dumbo, Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), usus (U), lambung (L), esophagus (E) dan O (otot daging).
10
Perlakuan PA25+PB75 pada pengamatan hari ke- 0 menunjukkan sudah terdeteksi adanya kerongkongan, esophagus dan lambung yang masih sempit (Gambar 8a) dan pada pengamatan hari ke- 10, saluran pencernaan sudah berdiferensiasi yaitu esophagus memanjang, lambung semakin membesar (Gambar 8b).
Pada perlakuan PB, perkembangan saluran pencernaan pengamatan hari ke- 0 sama seperti perlakuan lainnya (Gambar 9a). Pada pengamatan hari ke- 10 saluran pencernaan sudah berdiferensiasi, esophagus sudah terdeteksi dengan jelas dan ukuran lambung semakin membesar (Gambar 9b).
O O
Gambar 7 Perlakuan PA50+PB50 histologi tubuh larva ikan lele dumbo, Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), usus (U), pankreas (P), anterior usus (AU), faring (F), otot daging (O) dan esophagus (E).
Gambar 8 Perlakuan PA25+PB75 histologi tubuh larva ikan lele dumbo, Clarias sp. secara membujur. Pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), faring (F), esophagus (E), pankreas (P), usus (U), anterior usus (AU) dan posterior usus (PU).
Gambar 9 Perlakuan PB histologi tubuh larva ikan lele dumbo, Clarias sp. secara membujur, pengamatan hari ke- 0 (a) dan 10 (b). Bagian insang (I), hati (H), lambung (L), faring (F), esophagus (E), usus (U) anterior usus (AU), dan posterior usus (PU).
11 Pertumbuhan
a. Panjang Mutlak
Berdasarkan hasil uji statistik (Lampiran 2) menunjukkan bahwa perlakuan PA50+PB50 dengan perlakuan PB berbeda nyata (P<0.05) dan perlakuan PA50+PB50 dengan perlakuan PA75+PB25, PA dan PA25+PB75 tidak berbeda nyata terhadap pertumbuhan panjang mutlak larva ikan lele dumbo (P>0.05).
Keterangan:huruf yang berbeda menunjukkan perbedaan yang nyata pada taraf uji 5% (uji Tukey
Gambar 10 Pertumbuhan panjang mutlak larva ikan lele dumbo pada setiap perlakuan selama pemeliharaan
b. Laju Pertumbuhan Spesifik
Berdasarkan hasil uji statistik (Lampiran 3) menunjukkan bahwa perlakuan PA, PA75+PB25, PA50+PB50 dan PA25+PB75 dengan perlakuan PB berbeda nyata terhadap laju pertumbuhan spesifik larva ikan lele dumbo (P<0.05).
12
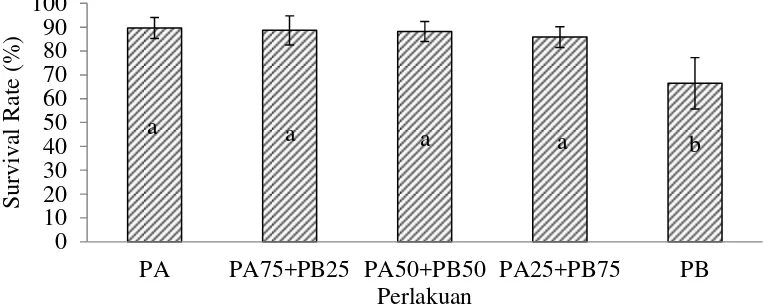
Kelangsungan Hidup
Berdasarkan hasil uji statistik (Lampiran 1) menunjukkan bahwa perlakuan PA, PA75+PB25, PA50+PB50 dan PA25+PB75 berbeda nyata dengan perlakuan PB terhadap kelangsungan hidup larva ikan lele dumbo (P<0.05).
Keterangan:huruf yang berbeda menunjukkan perbedaan yang nyata pada taraf uji 5% (uji Tukey)
Gambar 12 Kelangsungan hidup larva ikan lele dumbo pada setiap perlakuan selama pemeliharaan
Pembahasan
Hasil yang diperoleh selama penelitian menunjukkan bahwa pada larva ikan lele sudah terdeteksi aktivitas enzim amilase, lipase dan protease pada pengamatan hari ke 0. Terdeteksinya aktivitas enzim tersebut diduga berasal dari endogenous dan pemberian kuning telur, karena sebelum dilakukan penelitian larva terlebih dahulu sudah mendapatkan makanan dari luar berupa kuning telur. Kuning telur mengandung protein dan lipid yang tinggi sehingga larva tersebut memperoleh energi dari hasil katabolisme protein dan lipid. Protein dan lipid pada kuning telur akan dihidrolisis oleh enzim protease dan lipase untuk menghasilkan energi (Polat et al. 2013; Horniokova & Michalkova 2007).
Pada awal pemeliharaan, larva sudah mulai diberi pakan berdasarkan perlakuan masing-masing. Pada pengamatan hari ke- 2 aktivitas amilase cenderung meningkat, pada perlakuan PA75+PB25. Hal ini diduga, adanya kontribusi pakan buatan dan cacing sutra sebagai subtrat makanan yang merangsang saluran pencernaan untuk memproduksi endoenzim. Disamping itu, diduga larva ikan lele mampu memanfaatkan karbohidrat dalam jumlah sedikit pada tahap awal. Ini terlihat dari aktivitas amilase semakin menurun dengan bertambahnya umur larva. Hal yang sama diperoleh Yulintine et al. (2012) menjelaskan bahwa larva ikan betok memiliki kemampuan untuk mencerna karbohidrat pada tahap awal. Aktivitas amilase pada ikan herbivora lebih tinggi dibandingkan pada ikan omnivora dan karnivora. Tingginya aktivitas amilase ini tergantung pada kebiasaan makan ikan (Tameemi et al. 2010).
13 Tingginya aktivitas amilase tersebut diduga berasal dari pakan alami, karena pakan alami memiliki kemampuan autolisis sekaligus membawa enzim eksogen bagi proses pencernaan larva serta berhubungan dengan berkembangnya sistem pencernaan pencernaan berupa pankreas yang dapat mempengaruhi produksi enzim pencernaan (Farhoudi et al. 2013). Peningkatan aktivitas enzim tripsin, kemotrepsin dan amilase juga terjadi pada larva ikan baung, Mystus nemurus yang diberikan pakan hidup berupa Moina sp pada umur 3-15 hari pasca menetas (Srichanun et al. 2012). Selanjutnya Faulk et al. (2007) menjelaskan berdasarkan penelitian yang dilakukan pada larva ikan cobia, Rachycentron canadun yang diberi pakan alami Branchionus dan Artemia sp terjadi peningkatan aktivitas enzim amilase pada umur 15 hari. Disamping itu Chakrabarti et al. (2006) menyatakan bahwa aktivitas amilase larva ikan rohu, Labeo rohita pada umur 4 hari pemeliharaan lebih tinggi dibandingkan pada hari ke 6 dan ke 8. Kemudian aktivitas amilase ini meningkat kembali dan terjadi penurunan pada umur 10 hari yang diduga berhubungan dengan perkembangan sistem pencernaan.
Aktivitas enzim lipase dan protease cenderung meningkat secara fluktuatif seiring dengan bertambahnya umur larva. Beberapa studi tentang aktivitas lipase selama fase larva telah dilakukan (Suzer et al. 2007; Savona et al. 2011; Farhoudi et al. 2013; Srichanun et al. 2012). Aktivitas lipase tertinggi selama pemeliharaan diperoleh pada perlakuan pemberian PA25+PB75. Tingginya aktivitas lipase ini diduga larva mampu mencerna lemak dari pakan buatan yang terdapat dalam pakan tersebut. Hal ini sesuai dengan hasil penelitian Cara et al. (2003) menyatakan aktivitas spesifik lipase pada larva ikan kakap putih, White Sea bream yang diberi pakan buatan lebih tinggi dibandingkan pakan alami. Aktivitas enzim lipase pada larva ikan, Pagellus erythrinus yang dipelihara pada teknik green water selama 40 hari terdeteksi pada umur 4 hari dan meningkat pada umur 10 hari. Kemudian terjadi penurunan dan meningkat lagi sampai umur 25 hari (Suzer et al. 2006). Selanjutnya Rathore et al. (2005) melaporkan bahwa aktivitas enzim pencernaan pada larva ikan Catla catla berbeda-beda, dimana aktivitas spesifik amilase terdeteksi pada umur 4 hari dan mencapai maksimum pada umur 34 hari setelah menetas. Total aktivitas protease minimum terjadi pada umur 8 hari dan mencapai puncak pada umur 32 hari sedangkan aktivitas lipase terdeteksi pada umur 4 hari dan meningkat signifikan pada umur 22 hari.
14
Rendahnya aktivitas enzim amilase, lipase dan protease pada perlakuan pemberian pakan buatan, diduga bahwa pakan buatan yang diterima memiliki struktur yang berbeda dengan yang ada pada tubuh larva sehingga proses hidrolisis berjalan lambat dan mengakibatkan aktivitas enzim yang terdeteksi rendah tanpa ada kontribusi pakan alami seperti pada perlakuan lainnya. Kecenderungan peningkatan aktivitas enzim ini dapat disebabkan karena beberapa hal. Pertama, semakin besarnya tubuh larva, maka diikuti pula dengan semakin meningkatnya jumlah jaringan penyusun tubuh, termasuk didalamnya adalah jaringan penghasil enzim sehingga akan meningkatkan aktivitas enzim. Kedua, semakin besar umur larva, maka larva semakin banyak mengkonsumsi pakan buatan yang merupakan subtrat bagi enzim sehingga akan menstimulir peningkatan aktivitas enzim (Melianawati & Pratiwi 2011). Hal yang sama juga disampaikan oleh Arlia (1994) bahwa peningkatan aktivitas enzim berkaitan dengan perkembangan alat pencernaan. Dengan bertambahnya umur larva ikan, maka organ tubuh termasuk alat pencernaan akan mengalami perkembangan. Kesempurnaan alat pencernaan ini akan mempengaruhi produksi enzim pencernaan.
Peningkatan aktivitas enzim pencernaan pada larva ikan lele dumbo sejalan dengan perkembangan anatomi saluran pencernaan, terlihat bahwa semua aktivitas enzim pencernaan larva pada pengamatan hari ke 10 mempunyai aktivitas enzim yang relatif sama antar perlakuan, hal ini juga diikuti oleh perkembangan anatomi saluran pencernaan yang relatif sama pula pada setiap perlakuan. Anatomi saluran pencernaan menunjukkan adanya perkembangan dari pengamatan hari ke- 0 hingga pengamatan hari ke- 10. Pada setiap perlakuan pengamatan hari ke 0 memiliki saluran pencernaan yang masih sederhana yaitu usus masih berbentuk tabung lurus yang langsung berhubungan ke kerongkongan dan hati, sedangkan lambung masih berukuran sempit bahkan ada yang belum jelas, sehingga fungsi lambung sebagai penampung pakan yang dikonsumsi larva digantikan oleh usus depan (gambar 4a, 5a, 6a, 7a dan 8a). Morfologi saluran pencernaan yang sederhana berkorelasi dengan rendahnya produksi enzim seperti pada awal pemeliharaan. Rendahnya aktivitas enzim pada pengamatan hari ke- 0 tersebut diduga bahwa organ penghasil enzim seperti prankreas, usus dan lambung belum terbentuk secara sempurna sehingga enzim yang diproduksi juga rendah (Golchinfar et al. 2011).
15 kelenjar lambung pada ikan pertama kali berkembang umur 11 hari dan berproliferasi pada umur 15 hari pasca menetas.
Hasil penelitian Melianawati dan Pratiwi (2011) pada larva ikan kerapu macan umur 14 hari, terlihat bahwa struktur pencernaan larva sudah semakin berkembang dan menjadi lebih kompleks. Semakin meningkat umur larva diikuti pula dengan semakin besarnya liver, intestine dan rektum serta semakin tersebarnya pankreas dan semakin tingginya villi. Dengan semakin sempurnanya proses organogenesis sistem pencernaan, menunjukkan adanya peningkatan kapasitas pencernaan larva. Larva telah mampu menampung lebih banyak jumlah pakan, mensekresikan lebih banyak enzim pencernaan dan sekaligus mampu mencerna 25-75% pakan buatan.
Berkembangnya anatomi pencernaan berkorelasi dengan produksi enzim pencernaan serta berpengaruh terhadap pertumbuhan larva baik pertumbuhan panjang maupun pertumbuhan spesifik. Hasil pertumbuhan panjang dan pertumbuhan tertinggi diperoleh pada perlakuan PA50+PB50 dengan nilai masing-masing 8.43 cm dan 23.56%. Tingginya pertumbuhan panjang dan pertumbuhan spesifik pada perlakuan PA50+PB50 diduga bahwa kombinasi pakan buatan dan cacing sutra dengan perbandingan yang tepat mampu memenuhi kebutuhan nutrien larva ikan lele dumbo, karena pakan buatan mengandung nutrien yang lebih lengkap dibandingkan dengan cacing sutra yang digunakan sebagai pakan alami. Hal ini dibuktikan dengan hasil penelitian Salhi & Bessonart (2013) yang menunjukkan bahwa pemberian pakan alami atau kombinasi pakan alami dan pakan buatan pada larva ikan South American Catfish, Rhamdia quelen memiliki pertumbuhan yang lebih baik dibandingkan larva yang hanya diberi pakan buatan.
Melianawati et al. (2010) juga menyebutkan bahwa pemberian pakan buatan pada larva ikan kerapu bebek umur 8 hari mendapatkan pertumbuhan yang lebih tinggi dibandingkan umur 13 hari, hal tersebut disebabkan oleh kandungan nutrien yang terdapat pada pakan buatan lebih lengkap dibandingkan dengan pakan alami, pada larva ikan yang diberi pakan buatan lebih awal mendapatkan lebih dulu nutrien dengan komposisi yang lebih lengkap. Selanjutnya Arief et al. (2009) melaporkan bahwa pemberian kombinasi pakan pelet 50% dan cacing Tubifex sp. 50% pada benih ikan betutu, Oxyeleotris marmorata menunjukkan laju pertumbuhan spesifik dan pertumbuhan panjang mutlak yang lebih tinggi dibandingkan perlakuan lainnya. Rendahnya pertumbuhan pada perlakuan pemberian pakan buatan berkaitan dengan produksi enzim yang lebih rendah tanpa kontribusi dari pakan alami sehingga pakan yang diberikan tidak tercerna yang mengakibatkan pertumbuhan larva ikan lele juga lebih rendah.
16
4 SIMPULAN DAN SARAN
Simpulan
Pemberian kombinasi pakan cacing sutra 50% dan pakan buatan 50% berpengaruh terhadap perkembangan organ dan aktivitas enzim pencernaan (amilase, lipase dan protease) serta memberikan pertumbuhan panjang dan laju pertumbuhan spesifik yang lebih baik dibandingkan kontrol pada larva ikan lele dumbo (Clarias sp.).
Saran
Berdasarkan nilai ekonomis pemberian pakan cacing sutra 50% dan pakan buatan 50% dapat diberikan pada larva ikan lele dumbo berumur 4 hari.
DAFTAR PUSTAKA
Alarcon FJ, Diaz M, Moyano FJ. 1997. Studies on digestive enzymes in fish: Characterization and practical applications. In: Tacon AGJ (ed.), Basurco B (ed.). Feeding tomorrow's fish. Zaragoza: CIHEAM [Cahiers Options Mediterranieennes. p 113-121. Tersedia pada: http://om.cih eam.org/article.ph p?ID PD F=97605917.
Angka SL, Mokoginta I dan Hamid H. 1990. Anatomi dan histologi banding beberapa ikan air tawar yang dibudidayakan di Indonesia. Bogor (ID): Institut Pertanian Bogor. p 15-35.
Arief M, Triasih I dan Lokapirnasari WP. 2009. Pengaruh pemberian pakan alami dan pakan buatan terhadap pertumbuhan benih ikan betutu (Oxyeleostris marmorata Bleeker). Jurnal Ilmiah Perikanan dan Kelautan. 1(1):51-57. Arlia L. 1994. Pengaruh kadar protein pakan buatan terhadap pertumbuhan benih
ikan Gurami (Osphronemus gouramy Lacepede) [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Bergmeyer HU, Grossl M & Walter HE. 1983. Reagents for enzymatic analysis. In: HU Bergmeyer (ed.) methods in enzymatic analysis. 2(3):274-275.
Borlongan LG. 1990. Studies on the digestive lipases of milkfish, Chanos chanos. Aquaculture. 89:315-325.
Cara JB, Moyano FJ, Cardenas S, Diaz CF and Yuferas M. 2003. Assessment of digestive enzyme activities during larval development of white bream. Journal of Fish Biology. 63:48–58.doi:10.1046/j.1095 8649.2003.00120.x. Chakrabarti R, Rathore RM & Kumar S. 2006. Study of digestive enzyme
activities and partial characterization of digestive proteases in a freshwater teleost, Labeo rohita, during early ontogeny. Aquaculture Nutrition. 12:35-43.
17 Dewi CD, Muchlisin ZA, Sugito. 2013. Pertumbuhan dan kelangsungan hidup larva ikan lele dumbo (Clarias gariepinus) pada konsentrasi tepung daun jaloh (Salix tetrasperma Roxb) yang berbeda dalam pakan. Depik. 2(2):45-49.
Effendie MI. 2002. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara. 5 hlm.
Effendi I, Augustine D dan Widanarni. 2006. Perkembangan enzim pencernaan larva ikan patin Pangasius hypophthalmus. Jurnal Akuakultur Indonesia. 5 (1):41-49.
Eusebio SP and Coloso MR. 2002. Proteolityc enzyme activity of juvenile Asian sea bass, Lates calcarifer (Bloch), is increased with protein intake. Aquaculture. 33:569-574.
Farhoudi, AM Abedian Kenari, RM Nazari and Ch Makhdoomi. 2013. Changes of digestive enzymes activity in common carp (Cyprinus carpio) during larval ontogeny. Iranian Journal of Fisheries Sciences. 12(2):320-334. Faulk CK, Benninghoff AD and Holt GJ. Ontogeny of the gastrointestinal tract
and selected digestive enzymes in cobia Rachycentron canadum (L.). Journal of Fish Biology. 70:567–583.doi:10.1111/j.10958649.2007.01330.x. Fauji H. 2014. Pemberian kombinasi pakan buatan dan cacing sutera terhadap pertumbuhan dan kelangsungan hidup pada benih ikan lele Clarias sp. umur 4 hari[Skripsi]. Bogor (ID): Institut Pertanian Bogor. Hal 1-24.
Fitriliyani I. 2011. Aktifitas enzim saluran pencernaan ikan nila (Oreohromis niloticus) dengan pakan mengandung tepung daun lamtoro (Leucaena leucophala) terhidrolisis dan tanpa hidrolisis dengan ekstrak enzim cairan rumen domba. Bioscientiae. 8(2):16-31.
Golchinfar F, Zamani A, Hajimoradloo A and Madani R. 2011. Assessment of digestive enzymes activity during the fry development of Rainbow Trout, Oncorhynchus mykiss: from hatching to primary stages after yolk sac absorption. Iranian Journal of Fisheries Sciences. 10(3):403-414.
Gunder H. 2004. Clarias gariepinus. North African Catfish. Michigan (US): University of Michigan. 3 p; [diunduh tanggal 6 april 2014]. Tersedia pada: http://animaldiversity. ummz. umich. Edu/site/accounts/information/Claria _ gariepinus.html.
Holmes S. 1996. South African Water Quality Guidelines (second edition). Volume 6: Agricultural Water Use: Aquaculture. Department of Water Affairs and Forestry. p 27-32
Horniakova E and Michalkova. 2007. Effect of diet on amino acid profile of egg yolk. Polish Journal of Food and Nutrition Sciences. 57(4):235-238.
Infante ZJL and Cahu CL. 2007. Dietary modulation of some digestive enzymes and Metabolic processes in developing marine fish: Applications to diet formulation. Aquaculture. 268(1):98-105.
Infante ZJL, Gisbert E, Sarasquete C, Navarro I, Gutierrez J and Cahu CL. 2008. Ontogeny and physiology of the digestive system of marine fish larvae. In Feeding and Digestive Functions of Fishes. p 281-348.
18
Kuncoro MD. 2006. Perkembangan enzim pencernaan dan pertumbuhan larva ikan lele dumbo, Clarias sp yang dipelihara dalam sistem pembenihan indoor dan outdoor [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kuzmina VV. 1996. Influence of age on digestive enzyme activity in some freshwater teleosts. Aquaculture. 148: 25-37.
Martinez I, Moyano FJ, Fernandez-Diaz C and Yufera M. 1999. Digestive enzyme activity during larval development of the Senegal sole (Solea senegalensis). Fish Physiology and Biochemistry. 21:317-323.
Melianawati R, Andamari R dan Setyadi I. 2010. Identifikasi profil aktivitas enzim pencernaan untuk optimasi pemanfaatan pakan dalam usaha budidaya ikan kerapu bebek, Ciromileptes altivelis. Bali (ID): Badan Penelitian dan Pengembangan Kelautan dan Perikanan.
Melianawati R dan Pratiwi R. 2011. Pola aktivitas enzim pencernaan larva ikan kerapu macan (Epinephelus fuscoguttatus Forsskal, 1775). Jurnal Riset Akuakultur. 6:51-61.
[NRC] National Research Council. 1977. Nutrient Requirements of warm-water fishes. National Academy of sciences. Washington DC.
[NRC] National Research Council. 1993. Nutrient Requirements of Fish. National Academy of Sciences. ISBN: 0-309-59629-7. 124 p.
Olele NF. 2011. Comparative study on the use of natural and artificial based feeds for the culture of clarias gariepinus fingerlings. Journal of Agricultural and Biological Science. 6(1):9-13.
Onal U, Langdon C & Celik I. 2008. Ontogeny of the digestive tract of larval percula clownfish, Amphiprion percula (Lacepede 1802): a histological perspective. Aquaculture Research. 39:1077-1086.doi:10.1111/j.1365-2109.2008.01968.x.
Polat ES, Citil OB and Garip M. 2013. Fatty acid composition of yolk of nine poultry species kept in their natural environment. Animal Science Papers and Reports. 31(4):363-368.
Rangsin W, Areechon N and Yoonpundh R. 2012. Digestive Enzyme Activities During Larval Development of Striped Catfish, Pangasianodon hypophthalmus (Sauvage, 1878). Kasetsart Jurnal. 46 (2):217-228.
Rathore RM, Kumar S and Chakrabarti R. 2005. Digestive enzyme patterns and evaluation of protease classes in Catla catla (Family: Cyprinidae) during early developmental stages. Comparative Biochemistry and Physiology. Part B 142:98-10.
19 Srichanun M, Tantikitti C, Vatanakul V and Musikarune P. 2012. Digestive enzyme activity during ontogenetic development and effect of live feed in green catfish larvae (Mystus nemurus Cuv. & Val.). Songklanakarin Jurnal. Technol. 34(3):247-254.
Suharyadi. 2012. Studi penumbuhan dan reproduksi cacing sutra (Tubifex sp) dengan pupuk yang berbeda dalam sistem resirkulasi. [Tesis]. Jakarta (ID) Universitas Terbuka Jakarta.
Suhenda N. 2010. Penentuan awal pemberian pakan untuk mendukung sintasan dan pertumbuhan larva ikan baung (Hemibagrus nemurus). Prosiding Forum Inovasi Teknologi Akuakultur. Balai Riset Perikanan Budidaya Air Tawar, Sempur.
Suryanti S. 2002. Perkembangan aktivitas enzim pencernaan dan hubungannya dengan kemampuan pemanfaatan pakan buatan pada larva/benih ikan baung, Mystus nemurus C.V [Tesis]. Bogor (ID): Institut Pertanian Bogor. 57 hal. Suzer C, Firat K & Saka S. 2006. Ontogenic development of the digestive
enzymes in common pandora, Pagellus erythrinus, L. larvae. Aquaculture Research. 37:1565-1571.doi:10.1111/j.1365-2109.2006.01598.x.
Suzer C, Kamaci HO, Coban D, Saka S, Firat K, Ozkara B and Ozkara A. 2007. Digestive enzyme activity of the red porgy (Pagrus pagrus, L.) during larval development under culture conditions. Aquaculture Research. 38:1778-1785.doi:10.1111/j.1365-2109.2007.01841.x.
Takeuchi T. 1988. Laboratory work, chemical evaluation of dietary nutrition. p 179-229. In: Watanabe T (ed). Fish nutrition and maricultur. Tokyo (JP): Kanagawa International Fisheries Training Center.
Tameemi RA, Abdubaikul A and Salman NA. 2010. Comparative study of α -amylase activity in three Cyprinid species of different feeding habits from Southern Iraq. Turkish Journal of Fisheries and Aquatic Sciences. 10:411-414.doi:10.4194/trjfas.2010.0315.
Tucker CS. 1991. Water quantity and quality requirements for channel catfish hatcheries. [SRAC]: Southern Regional Aquaculture Center. 481.
Worthington V. 1993. Worthington Enzyme Manual. Enzymes and Related Biochemicals Worthington Chemical, New Jersey, US. 399 p.
Yulintine, E Harris, D Jusadi, R Affandi dan Alimuddin. 2012. Perkembangan aktivitas enzim pada saluran pencernaan larva ikan betok (Anabas testudineus bloch). Jurnal Ilmu-ilmu Hayati dan Fisik. 14(1):59-67.
20
21 Lampiran 1 Analisis statistik terhadap kelangsungan hidup larva ikan lele dumbo yang diberi kombinasi pakan berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 705.4 176.3 13.76 0.000
Galat 10 128.2 12.8
Total 14 833.5
Lampiran 2 Analisis statistik terhadap pertumbuhan panjang larva ikan lele dumbo yang diberi kombinasi pakan berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95% ANOVA
SK DB JK KT F Sig.
Perlakuan 4 10.95 2.73 4.30 0.028
Galat 10 6.36 0.63
Total 14 17.31
Lampiran 3 Analisis statistik terhadap laju pertumbuhan spesifik larva ikan lele dumbo yang diberi kombinasi pakan berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95% ANOVA
SK DB JK KT F Sig.
Perlakuan 4 22.03 5.50 9.38 0.002
Galat 10 5.86 0.58
Total 14 27.89
Lampiran 4 Prosedur analisis enzim amilase, lipase dan protease Preparasi sampel :
Larva ikan segar ditimbang, kemudian ditambahkan larutan buffer Tris (20 mM Tris HCl, 1 mM EDTA, 10 mM CaCl2, pH 7.5) dengan perbandingan 10%. Lalu dimasukkan kedalam tabung effendorf dan disentrifuge selama 10 menit
12.000 rpm suhu 4˚C. Diambil supernatantnya dan dilakukan berbagai analisis
enzim terhadap supernatant tersebut.
a. Enzim α amilase menggunakan metode Worthington (1993)
22
- Kemudian larutan pati dipipet sebanyak 0.5 ml, dimasukkan kedalam tabung reaksi.
- Lalu ditambahkan 0.5 mL sampel/contoh dan diinkubasi selama 3 menit pada suhu 95ºC (waterbath).
- Tambahkan larutan DNS sebanyak 0.5 ml, kemudian diinkubasikan kembali pada suhu 95ºC selama 5 menit.
- Absorbansnya dibaca pada spektrofotometer dengan panjang gelombang 540 nm.
Perhitungan :
b. Enzim lipase menggunakan metode Borlongan (1990)
- Pipet 1,5 ml substrat lipase murni (minyak zaitun murni), dan masukkan kedalam erlenmeyer ukuran 100-125 ml.
- Kemudian tambahkan 1 ml Tris-HCl 0.1 M pH 8.0 kedalam erlenmeyer tersebut, dan 1 ml contoh.
- Dihomogenkan lalu diinkubasi pada suhu 37ºC selama 6 jam.
- Tambahkan 3 ml etil alkohol 95% (untuk memberhentikan proses hidrolisis), dan dititrasi segera dengan NaOH 0.01 N (dengan menggunakan indikator Thymolphtalein 0.9%).
c. Enzim protease Bergmeyer et al. (1983)
- Siapkan tabung reaksi untuk blanko, standar dan contoh (banyaknya tabung tergantung pada jumlah contoh).
- Masukkan buffer phosphat 0.05 M pH 7 sebanyak 1 ml kedalam semua tabung reaksi.
- Lalu masukkan larutan substrat casein 20 mg/ml pH 7 sebanyak 1 ml juga kedalam semua tabung reaksi.
- Kemudian masukkan contoh sebanyak 0.2 ml, kedalam tabung reaksi contoh saja.
- Masukkan 0.2 ml larutan standar Tirosin 5 mmol/l kedalam tabung reaksi untuk standar.
- Masukkan 0.2 ml aquades kedalam tabung reaksi untuk blanko. - Kemudai diinkubasi pada suhu 37ºC selama 10 menit.
- Selanjutnya tambahkan larutan TCA 0.1 M sebanyak 2 ml kedalam semua tabung.
- Lalu tambahkan larutan CaCl2 2 mmol/l sebanyak 0.2 ml kedalam tabung
blanko dan standar, sedangkan kedalam tabung sampel/contoh ditambahkan 0.2 ml aquades.
- Diamkan pada suhu 37ºC selama 10 menit.
- Sentrifius selama 10 menit dengan kecepatan 3500 rpm.
- Filtrat dari masing-masing tabung diambil 1.5 ml, ditambahkan 5 ml Na2CO3 0.4 M kedalam setiap tabung, lalu larutan Folin Ciaucalteau
sebanyak 1 ml.
- Didiamkan selama 20 menit pada suhu 37ºC.
23 Lampiran 5 Prosedur analisis proksimat pakan uji
a. Kadar Protein
Pengujian kadar protein dilakukan melalui tiga tahap, yaitu Oksidasi, destilasi dan titrasi. Tahapan pengujian kadar protein adalah sebagai berikut : Tahap Oksidasi
- Sampel ditimbang sebanyak 0.5 g dan dimasukkan ke dalam labu kjeldahl. - Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
- 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400ᵒC selama 1-1,5 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
- Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi. Tahap Destilasi
- Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
- Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indicator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
- 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
- Campuran alkalin dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
- Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
Tahap Titrasi
- Larutan hasil destilasi dititrasi dengan larutan NaOH 0.05 N. - Volume hasil titrasi dicatat.
24
b. Kadar Lemak
Metode ekstraksi Soxhlet
- Labu ekstraksi dipanaskan dalam oven pada suhu 110o dalam waktu 1 jam. Kemudian didinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
- Sampel ditimbang sebanyak 3-5 gram (A) dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
- N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
- Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening. - Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
- Labu dan lemak yang tersisa dipanakan dalam oven 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2).
c. Kadar Air
- Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
- Bahan ditimbang 2-3 gram (A)
- Cawan dan bahan dipanaskan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2).
Penentuan kadar air menggunakan rumus: Kadar air (%) =
× 100%
d. Kadar Abu (AOAC 1995)
-Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
-Bahan ditimbang 2-3 gram (A)
-Cawan dan bahan dipanaskan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2).
Kadar abu dihitung dengan rumus: Kadar abu (%) = × 100%
e. Serat Kasar
-Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1).
-Sampel ditimbang sebanyak 0.5 gram (A) dimasukkan kedalam Erlenmeyer 250 ml.
-H2SO4 0.3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
25 -Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. -Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas
dan 25 ml acetone.
-Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110 oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
-Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau menjadi abu (± 4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
26