FRAKSI AKTIF ANTIOKSIDAN DARI EKSTRAK KULIT
KAYU SUNGKAI (
Peronema canescens
Jack.)
NURSINTA ARIFIANI ROSDIANA
DEPARTEMEN HASIL HUTAN FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Fraksi Aktif Antioksidan dari Ekstrak Kulit Kayu Sungkai (Peronema canescens Jack.)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NURSINTA ARIFIANI ROSDIANA. Fraksi Aktif Antioksidan dari Ekstrak Kulit Kayu Sungkai (Peronema canescens Jack.). Dibimbing oleh RITA KARTIKA SARI.
Ekstrak kulit sungkai (Peronema canescens Jack.) berpotensi mengandung zat ekstraktif yang bersifat antioksidan. Tujuan dari penelitian ini adalah memfraksinasi ekstrak etanol 70% kulit sungkai, menghidrolisis residu n-heksana, menentukan kadar fraksi dan aktivitas antioksidannya serta menganalisis komponen kimia tiga fraksi teraktif. Fraksinasi dilakukan dengan metode solvent-solvent extraction dengan pelarut n heksana dan etil asetat. Aktivitas antioksidan diuji dengan metode 1,1-difenil-2-pikrilhidrazil (DPPH) secara in vitro. Tiga fraksi teraktif dianalisis komponen kimianya dengan kromatografi gas spektrometer massa (GC-MS). Fraksi n-heksana memiliki nilai kadar ekstrak yang paling tinggi. Tiga fraksi yang memiliki aktivitas antioksidan terkuat adalah fraksi etil asetat non hidrolisis, fraksi n-heksana, dan fraksi etil asetat hidrolisis (IC50 43,67; 44,55; dan 53,34 µg/mL). Hasil identifikasi komponen kimia menunjukkan terdapat senyawa dominan yaitu asam kuinat, guaiakol, hidrokuinon, asam isovanilat, genkwanin, katekol, dan asam benzoat. Senyawa-senyawa tersebut merupakan golongan fenol yang memiliki aktivitas antioksidan yang kuat.
Kata kunci: antioksidan, sungkai, fenol.
ABSTRACT
NURSINTA ARIFIANI. Active Fraction of Antioxidant from Sungkai (Peronema canescens Jack) Bark Extract. Advised by RITA KARTIKA SARI
Sungkai (Peronema canescens Jack.) bark extract is potentially containing extractive materials with antioxidant properties. The objective of this research was to fractionate 70% of ethanol extract of sungkai bark, hydrolize the n-hexane residue, determine fraction content and antioxidant activity using in vitro testing, and analyze chemical compounds found in three of the most active fraction. Fractionation was conducted using solvent-solvent extraction with n-hexane and ethyl acetate. Antioxidant activity was examined using 1,1-difenil-2-pikrilhidrazil (DPPH) method. The chemical components of three most active fraction were analyzed by gas chromatography mass spectrometry (GC-MS). Extract value of n-hexane fraction was the highest levels.. The three most active fractions with antioxidant properties are non-hydrolized etil acetate, n-hexane, and hydrolized ethyl acetate (IC50 43.67, 44.55, and 53.34 µg/mL). Phenolic compound identification shows several dominant compounds: quinic acid, guaiacol, hydroquinone, isovanillic acid, genkwanin, catechol, and benzoic acid. Those compounds are categorized as phenol and own strong antioxidant activity.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Hasil Hutan
DEPARTEMEN HASIL HUTAN FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
BOGOR 2014
FRAKSI AKTIF ANTIOKSIDAN DARI EKSTRAK KULIT
KAYU SUNGKAI (
Peronema canescens
Jack.)
Judul Skripsi : Fraksi Aktif Antioksidan dari Ekstrak Kulit Kayu Sungkai (Peronema canescens Jack.)
Nama : Nursinta Arifiani Rosdiana NIM : E24100013
Disetujui oleh
Dr Ir Rita Kartika Sari, MSi Pembimbing
Diketahui oleh
Prof Dr Ir Fauzi Febrianto, MS Ketua Departemen
PRAKATA
Puji dan Syukur penulis panjatkan kepada Allah SWT. karena atas segala karunia-Nya karya ilmiah ini dapat selesai. Karya ilmiah ini berjudul “Fraksi Aktif Antioksidan dari Ekstrak kulit Sungkai (Peronema canescens Jack.)” yang dilaksanakan sejak bulan Febuari 2014 sampai dengan April 2014.
Terima kasih penulis ucapkan kepada Ibu Dr.Ir Rita Kartika Sari, M.Si selaku pembimbing yang telah memberikan arahan dan bimbingan kepada penulis. Penulis juga mengucapkan terima kasih kepada orangtua atas kasih sayang, dukungan, dan doa selama ini.
Penghargaan turut penulis sampaikan kepada Bapak Supriatin dan Gunawan selaku Laboran di Laboratorium Kimia Hasil Hutan (KHH), teknisi di Biofarmaka, dan teknisi di Laboratorium Forensik atas bantuan selama ini. Ungkapan terima kasih juga penulis ucapkan kepada Vini Alvionita Sihombing, Gisella Indira Maharani, rekan-rekan THH 47 lainnya khususnya rekan peneliti di Laboratorium KHH (Rizky Rosilia, Faitha Hanun, Dwi Erikan Rizanti, Faiza Nur Ilmi, Novi Handayani, Arif Rahmatullah, Indra Tri Putra, Fauzi Syukrillah, Catur Wulandari, Alfi Naelufar, dll) dan anggota RIMPALA khususnya RXV (Mentari Purwakasiwi, Galuh Ajeng Septaria, Fajar Alif Sampangestu, Anxious Yoga Perdana, Puspa Diva Nur Aqmarina, Nurani Hardikananda, Mentari Medinawati, Iqbal Nizar Arafat, Fitri Maharani, dan Anggi Gustiani) atas motivasi dan kebersamaan selama ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Bahan 2
Alat 2
Persiapan Bahan Baku 3
Proses Ekstraksi dan Fraksinasi 3
Uji Antioksidan 4
Analisis Komponen Kimia 5
HASIL DAN PEMBAHASAN 5
Identifikasi Jenis Pohon 5
Kadar Ekstrak dan Fraksi 5
Aktivitas Antioksidan 7
Analisis Komponen Kimia 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 Kadar zat ekstraktif dan hasil fraksinasi ekstrak etanol 70% kulit kayu
sungkai (P. canescens) (% berdasarkan BKT) 6
2 Hasil perhitungan nilai IC50 pada pengujian antioksidan ekstrak dan
fraksi kulit sungkai 8
3 Senyawa dominan dalam fraksi teraktif kulit sungkai 11
DAFTAR GAMBAR
1 Diagram alir proses ekstraksi dan fraksinasi 4 2 Grafik hubungan konsentrasi ekstrak kulit sungkai dengan persen
inhibisi 7
3 Kromatogram senyawa pada tiga fraksi teraktif 10
DAFTAR LAMPIRAN
1 Hasil identifikasi daun sungkai 15
2 Absorbansi dan inhibisi ekstrak dan fraksi kulit sungkai 16 3 Daftar nama senyawa dominan fraksi n-heksana 18 4 Daftar nama senyawa dominan fraksi etil asetat non hidrolisis 19 5 Daftar nama senyawa dominan fraksi etil asetat hidrolisis 20 6 Perhitungan kadar ekstraktif dan hasil fraksinasi ekstrak etanol 70% kulit
1
PENDAHULUAN
Latar Belakang
Peningkatan nilai tambah hasil hutan dapat dilakukan melalui pemanfaatan zat ekstraktif dari limbah industri perkayuan seperti kulit kayu sebagai bahan obat. Limbah kulit dari industri perkayuan di Indonesia sekitar 12-17% (Pari et al. 2000). Limbah kulit kayu sampai sekarang pemanfaatannya difokuskan sebagai sumber energi untuk bahan bakar boiler (Purwati 2007). Akan tetapi kulit kayu juga berpotensi dimanfaatkan sebagai sumber bahan obat. Beberapa penelitian membuktikan zat ekstraktif kulit pohon memiliki bioaktivitas alami, seperti ekstrak kulit kayu mangga (Mangifera indica) dan kayu manis (Cinnamomum zeylanicum) sebagai antiinflamasi (Garrido 2004, Vetal 2013), ekstrak kulit kayu jambu mete (Anacardium occidentale) sebagai antidiabetes (Ojewole 2003), ekstrak kulit kayu Acacia nilotica dan kenanga (Cananga odorata) sebagai antibakteri (Banso 2009; Rahman et al. 2005). Penelitian lain juga menyebutkan bahwa ekstrak metanol dari kulit kayu sungkai (Peronema canescens), mangium (Acacia mangium), dan akasia auri (Acacia auriculiformis) bersifat antioksidan (Sari et al. 2013).
Di sisi lain, Indonesia sebagai negara tropis mendapatkan paparan sinar matahari yang intensif dan salah satunya adalah sinar ultra violet yang tinggi. Selain itu, populasi penduduk Indonesia yang semakin banyak secara tidak langsung menyebabkan semakin banyaknya jumlah kendaraan bermotor dan menghasilkan polutan yang semakin tinggi. Hal tersebut menyebabkan masyarakat Indonesia rawan terkena radikal bebas yang didukung oleh perubahan gaya hidup. Radikal bebas adalah senyawa kimia yang mempunyai satu atau lebih elektron yang tidak berpasangan sehingga tidak stabil dan sangat reaktif. Radikal bebas dapat mengambil elektron dari jaringan tubuh sehingga terjadi kerusakan sel yang menimbulkan berbagai penyakit seperti jantung koroner (PJK), kanker, katarak, dan penyakit degeneratif lainnya (Kumalaningsih 2006). Senyawa radikal bebas juga dapat menimbulkan penyakit autoimun (Muchtadi 2000). Sediaan antioksidan dapat digunakan untuk menangkal radikal bebas. Namun, antioksidan yang banyak beredar di pasaran adalah antioksidan sintetis. Antioksidan sintetis memberikan efek samping yang cukup berbahaya bagi kesehatan, terutama menyebabkan penyakit kanker (Hernani 2006). Antioksidan sintetis akan bersifat radikal ketika menyumbangkan elektronnya untuk radikal bebas dan terdapat bahan sisa bersifat toksik yang tertinggal saat pembuatan antioksidan sintetis. Oleh sebab itu pengembangan antioksidan alami gencar dilakukan, karena antioksidan alami adalah senyawa yang berasal dari tumbuhan dengan struktur molekul yang dapat memberikan elektron kepada molekul radikal bebas tanpa terganggu sama sekali fungsinya dan dapat memutus rantai berantai dari radikal bebas (Kumalaningsih 2006).
2
Senyawa fenol yang dapat larut dalam metanol dan etanol adalah tanin terkondensasi, tanin terhidrolisis, polifenol, flavonoid, dan antrakuinon (Windarini 2013, Sundari 2010). Penelitian sebelumnya yang dilakukan Sari et al. (2013) menunjukkan ekstrak metanol kulit sungkai bersifat antioksidan, tetapi pada aplikasinya badan POM hanya memperbolehkan ekstraksi dengan etanol, air, atau etanol dalam berbagai konsentrasi (BPOM 2004). Etanol 70% digunakan karena polaritas yang lebih tinggi dari etanol murni dan dapat mendeteksi senyawa flavonoid dengan konsentrasi yang lebih tinggi (Tiwari et al. 2011 dalam Priyanto 2013). Fraksinasi dari ekstrak etanol diperlukan untuk memisahkan senyawa fenolik dengan kepolaran yang berbeda, sehingga dapat diketahui senyawa yang paling berpengaruh pada aktivitas senyawa antioksidan. Selain itu, fraksinasi dilakukan agar dapat diketahui pelarut yang tepat digunakan untuk mendapatkan senyawa target antioksidan untuk pemanfaatan zat ekstraktif kulit sungkai selanjutnya.
Tujuan Penelitian
Penelitian ini bertujuan memfraksinasi ekstrak etanol 70% kulit sungkai secara bertingkat dengan n-heksana dan etil asetat, menghidrolisis residu n-heksana sebelum difraksinasi dengan etil asetat, dan menentukan kadar fraksi yang dihasilkan serta aktivitas antioksidannya berdasarkan uji secara in vitro terhadap radikal bebas 1,1-difenil-2-pikrilhidrazil (DPPH). Tiga fraksi teraktif kemudian dianalisis senyawa kimianya.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Febuari 2014 hingga April 2014. Persiapan bahan baku, ekstraksi, dan fraksinasi dilakukan di Laboratorium Kimia Hasil Hutan Fakultas Kehutanan IPB, pengujian determinasi jenis pohon di Herbarium Bogoriense LIPI, pengujian aktivitas antioksidan di Pusat Studi Biofarmaka IPB Bogor, dan analisis komponen kimia di Pusat Laboratorium Forensik Mabes Polri Jakarta.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah kulit kayu sungkai dari batang pohon berdiameter 30 cm yang berasal dari kebun masyarakat di Ciampea Bogor. Pelarut yang digunakan adalah etanol 70%, n-heksana, etil asetat teknis dengan kualifikasi bahan teknis yang telah dimurnikan, HCl 2 N, air destilata, dimetil dulfoksida (DMSO), DPPH, dan vitamin C.
Alat
3 mikroliter, inkubator, oven, erlenmeyer, gelas piala, spatula, cawan petri, timbangan 4 desimal, desikator, kertas saring, botol ukuran 5 mL, dan botol ekstraksi maserasi, kromatografi gas-spektrofotometri massa (GC-MS).
Prosedur dan Analisis Data
Persiapan Bahan Baku
Kulit kayu sungkai dipotong-potong menjadi serpihan tipis dan panjang seperti ukuran korek api lalu dikeringudarakan hingga kadar air ±10%. Serpihan yang telah kering digiling dengan willey mill kemudian disaring dengan mesh screen, serbuk yang lolos saringan 40 mesh dan tertahan di saringan 60 mesh digunakan sebagai bahan penelitian. Kadar air serbuk diukur dengan mengambil sampel sebanyak 2 g lalu dioven hingga bobot kering tanur (BKT).
Proses Ekstraksi dan Fraksinasi
Serbuk kulit sungkai sebanyak ± 500 g yang telah diketahui kadar airnya diekstraki dengan metode maserasi menggunakan pelarut etanol 70% dalam toples besar yang gelap dan ditutup rapat. Pelarut etanol ditambahkan hingga perbandingan serbuk dan pelarut etanol 1:3. Serbuk yang telah terendam diaduk dengan spatula dan disimpan selama 24 jam, kemudian larutan ekstrak disaring dengan kertas saring dan ampasnya direndam kembali dengan etanol. Ekstraksi dilakukan 18 kali hingga larutan ekstrak berwarna bening. Filtrat ekstrak tersebut dipekatkan dengan penguap putar pada suhu 70 oC dengan tekanan 400 mmHg untuk memisahkan pelarut etanol dengan ekstrak kulit sungkai hingga mencapai larutan pekat sebanyak 300 mL.
Larutan ekstrak sebanyak 5 mL diambil dari larutan pekat 300 mL lalu ditaruh pada cawan petri yang telah diketahui BKT-nya, kemudian larutan ekstrak dioven pada suhu 103 oC hingga bobotnya konstan, lalu ekstrak dimasukkan dalam desikator dan ditimbang untuk mengetahui BKT ekstrak.
4
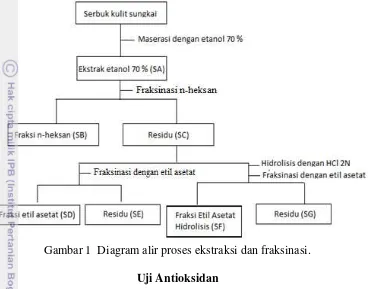
2N pada suhu 100 oC lalu ekstrak terhidrolisis difraksinasi dengan etil asetat (8 kali). Fraksi n-heksana, etil asetat, residu etil asetat dikumpulkan dan dipekatkan. Fraksinasi ekstrak etanol 70% secara singkat dijelaskan pada Gambar 1.
Gambar 1 Diagram alir proses ekstraksi dan fraksinasi. Uji Antioksidan
Uji antioksidan menggunakan metode DPPH (Leu et al. 2006). Sebanyak 1.6 mg ekstrak dilarutkan dalam 1 mL etanol dan larutan dijadikan larutan induk (konsentrasi 1600 µg/mL), lalu larutan induk diencerkan hingga konsentrasi 200 µg/mL. Larutan ekstrak dibuat dengan mengencerkan larutan induk dengan etanol dengan nisbah 1:1. Larutan ekstrak dibuat dengan konsentrasi 100, 50, 25, 12.5, 6.25, 3.125, dan 1.562 µg/mL.
5
Keterangan : A : serapan kontrol negatif (DPPH + etanol)
B : serapan ekstrak uji (DPPH +etanol+ ekstrak uji).
Korelasi antara persen inhibisi dan konsentrasi ekstrak diplotkan dan nilai IC50 dihitung melalui persamaan regresi hasil interpolasinya. IC50 adalah konsentrasi efektif ekstrak kulit sungkai yang mampu menangkap radikal bebas DPPH sebesar 50%, sehingga nilai IC50 yang semakin rendah berarti aktivitas antioksidan ekstrak semakin tinggi.
Menurut Blois (1958) dalam Priyanto (2013), suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 < 50 µg/mL, kuat untuk IC50 antara 50-100 µg/mL, sedang jika IC50 bernilai 101–150 µg/mL dan lemah jika IC50 bernilai 151 – 200 µg/mL.
Analisis Komponen Kimia
Analisis komponen kimia tiga fraksi teraktif menggunakan alat GC-MS merek Agilent Technologies 6890N series. Sampel diambil sebanyak 6 µL dan dimasukkan pada inlet. Pengolahan data menggunakan software GC-MS data analysis. Pemisahan senyawa dan analisis kuantitatif komponen dilakukan pada GC oleh kolom kapiler dengan diameter 0.25 mm dan panjang 60 m dengan suhu awal 70 oC, kenaikan suhu 15 oC/menit hingga suhu 290 oC dan waktu akhir 20 menit. Identifikasi komponen dilakukan pada MS. Identifikasi senyawa dilakukan dengan mencocokkan data pada spektrum massa dengan data yang ada dalam WILEY 9th library.
HASIL DAN PEMBAHASAN
Identifikasi Jenis Pohon
Identifikasi daun dari pohon yang digunakan dalam penelitian ini oleh Herbarium Bogoriense LIPI Cibinong menunjukkan bahwa spesies pohon tersebut adalah Peronema canescens Jack. Hasil tersebut telah memastikan kebenaran jenis pohon yang digunakan.
Kadar Ekstrak dan Fraksi
Hasil ekstraksi menunjukkan bahwa kadar ekstrak etanol 70% (8.31%) lebih tinggi dibandingkan dengan kadar ekstrak metanol kulit sungkai yang dilaporkan oleh Sari et al. (2013) yaitu 2.4%. Perbedaan kadar ekstrak ini disebabkan oleh perbedaan teknik ekstraksi dan pelarut. Teknik ekstraksi yang digunakan dalam penelitian ini adalah maserasi yang dilakukan 18 kali hingga pelarut jernih agar seluruh zat ekstraktif yang terlarut dalam etanol 70% terekstrak semua (Harborne 1987), sedangkan teknik ekstraksi dari ekstrak metanol pada penelitian Sari et al. (2013) adalah sokletasi selama 12 jam. Selain itu, etanol 70% tingkat kepolarannya lebih rendah dibandingkan dengan metanol sehingga etanol 70% dapat melarutkan
6
senyawa yang kepolarannya lebih rendah. Kulit kayu mengandung senyawa yang beragam dari nonpolar seperti lemak dan minyak (Sjostrom 1995).
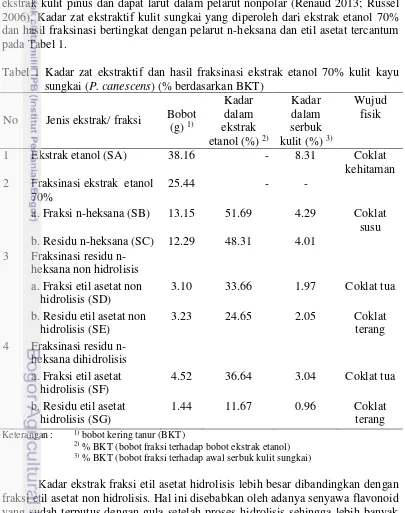
Hasil fraksinasi menunjukkan bahwa fraksinasi dengan tingkat kepolaran berbeda menghasilkan kadar fraksi yang berbeda. Fraksi nonpolar dalam ekstrak kulit sungkai lebih tinggi dibandingkan dengan residunya. Fraksi nonpolar memiliki kandungan ekstrak yang paling banyak dan menunjukkan bahwa sebagian besar ekstrak kulit sungkai mengandung senyawa nonpolar. Senyawa ekstrak kulit kayu yang dapat terlarut dalam pelarut etanol maupun n-heksana adalah lemak dan minyak (Aziz et al. 2009). Selain itu, fraksi nonpolar berpeluang mengandung karotenoid. Karotenoid merupakan senyawa antioksidan yang terlarut dalam ekstrak kulit pinus dan dapat larut dalam pelarut nonpolar (Renaud 2013; Russel 2006). Kadar zat ekstraktif kulit sungkai yang diperoleh dari ekstrak etanol 70% dan hasil fraksinasi bertingkat dengan pelarut n-heksana dan etil asetat tercantum pada Tabel 1.
Tabel 1 Kadar zat ekstraktif dan hasil fraksinasi ekstrak etanol 70% kulit kayu sungkai (P. canescens) (% berdasarkan BKT)
No Jenis ekstrak/ fraksi Bobot (g) 1) 2 Fraksinasi ekstrak etanol
70% a. Fraksi etil asetat non
hidrolisis (SD)
3.10 33.66 1.97 Coklat tua b. Residu etil asetat non
hidrolisis (SE)
2) % BKT (bobot fraksi terhadap bobot ekstrak etanol) 3) % BKT (bobot fraksi terhadap awal serbuk kulit sungkai)
7 senyawa yang terlarut dalam etil asetat. Setelah proses hidrolisis, senyawa flavonoid akan terlarut pada etil asetat sedangkan gula terlarut pada air (Andersen & Markham 2006). Kandungan air yang lebih sedikit akan menyebabkan residu etil asetat non hidrolisis paling sedikit kandungan ekstraktifnya karena sudah banyak senyawa yang terlarut dalam fraksi etil asetat hidrolisis.
Warna ekstrak dari setiap fraksi ekstrak kulit sungkai berbeda secara visual seperti pada Tabel 1. Warna yang berbeda disebabkan oleh senyawa yang terlarut dalam masing-masing pelarut menurut tingkat kepolaran yang berbeda. Menurut Rein (2005), senyawa karoten dan antosianin yang terlarut pada pelarut dengan kepolaran berbeda menghasilkan warna pelarut yang berbeda. Selain itu kadar senyawa yang berbeda juga menyebabkan warna ekstrak berbeda. Menurut Winarti (2008) kadar pH, kadar gula, dan suhu pemanasan dapat mempengaruhi warna ekstrak.
Aktivitas Antioksidan
Hasil pengujian menunjukkan bahwa terdapat korelasi antara konsentrasi ekstrak dengan persentase inhibisi (Gambar 2). Hal ini mengindikasikan bahwa ekstrak dan fraksi kulit sungkai mengandung senyawa antioksidan karena meningkatnya konsentrasi ekstrak mengakibatkan peningkatan aktivitas penangkapan radikal.
Gambar 2 Grafik hubungan konsentrasi ekstrak kulit sungkai dengan persen
inhibisi (SA= Ekstrak etanol 70%; SB= Fraksi n-heksana; SD= Fraksi etil non hidrolisis; SE= Residu etil non hidrolisis; SF= Fraksi etil hidrolisis; SG= Residu etil hidrolisis)
8
Tabel 2 Hasil perhitungan nilai IC50 pada pengujian antioksidan ekstrak dan fraksi kulit sungkai
SA: Ekstrak etanol 70% SB: Fraksi n-heksana SD: Fraksi etil non hidrolisis
SE: Residu etil non hidrolisis SF: Fraksi etil hidrolisis SG: Residu etil hidrolisis
*) Menurut Blois (1958) dalam Priyanto (2013)
Ekstrak etanol dan setiap fraksinya memiliki aktivitas antioksidan yang berbeda. Nilai IC50 yang paling rendah menunjukkan aktivitas antioksidan paling tinggi. Berdasarkan nilai IC50 (Tabel 2), aktivitas antioksidan dari yang tertinggi hingga terendah berturut-turut adalah fraksi etil asetat non hidrolisis, fraksi n-heksana, fraksi etil asetat hidrolisis, ekstrak etanol 70%, residu etil asetat non hidrolisis, dan residu etil asetat hidrolisis.
Fraksi etil asetat non hidrolisis memiliki aktivitas antioksidan yang paling tinggi dan tergolong sangat kuat (IC50 43.67 µg/mL). Menurut Jang et al. (2007), aktivitas antioksidan ekstrak tumbuhan sangat ditentukan oleh jenis pelarut yang digunakan. Aktivitas antioksidan yang tinggi diakibatkan banyak senyawa antioksidan yang terlarut dalam pelarut tersebut. Hernani (2006) menegaskan bahwa senyawa yang berfungsi sebagai antioksidan adalah polifenol, bioflavonoid, vitamin C, vitamin E, beta-karoten, dan katekin. Senyawa antioksidan yang dapat larut dalam etil asetat adalah flavonoid dan pirokatekol (Andersen & Markham 2006, Gani et al. 2013). Fraksi etil asetat non hidrolisis diduga didominasi oleh flavonoid aglikon bersifat aktivitas antioksidan tinggi walaupun tanpa hidrolisis dengan asam untuk pemutusan gula (Markham 1988).
Fraksi n-heksana memiliki aktivitas antioksidan tertinggi kedua dan tergolong sangat kuat (IC50 44.55 µg/mL). Terdapat senyawa terlarut n-heksana yang berpengaruh terhadap aktivitas antioksidan. Senyawa flavonoid berupa aglikon dapat terlarut oleh n-heksana, karena menurut Markham (1988), senyawa aglikon cenderung kurang polar. Selain itu, pelarut nonpolar dapat melarutkan senyawa antioksidan seperti karotenoid. Berdasarkan penelitian Triyem (2010) dan Masrukhan (2010), ekstrak n-heksana kulit batang manggis hutan (Garcinia bancana Miq.) memiliki aktivitas antioksidan kuat.
9 dikarenakan residu terlarut etil mengandung sisa-sisa gula yang telah diputus pada proses hidrolisis.
Vitamin C (asam askorbat) yang digunakan sebagai kontrol positif memiliki IC50 sebesar 5,37 µg/mL. Jika dibandingkan, aktivitas antioksidan vitamin C 8,13 kali lebih besar daripada fraksi etil asetat non hidrolisis sebagai senyawa yang memiliki aktivitas antioksidan tertinggi.
Analisis Komponen Kimia
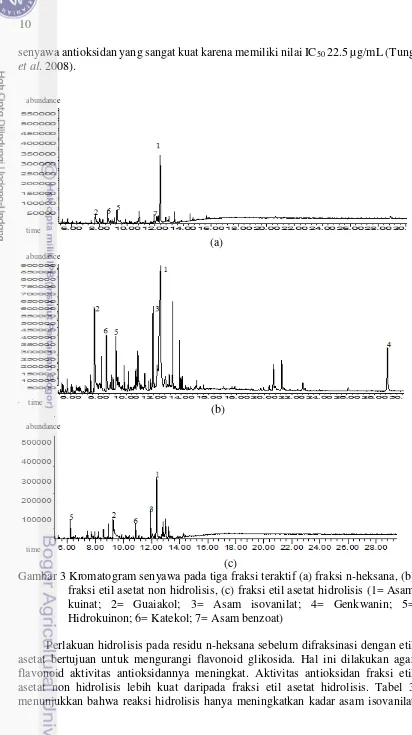
Hasil analisis kimia menunjukkan kromatograf dengan puncak area yang berbeda diantara fraksi n-heksana, fraksi etil asetat non hidrolisis, dan fraksi etil asetat hidrolisis. Berdasarkan kromatograf pada Gambar 3 teridentifikasi beberapa senyawa yang berdasarkan studi literatur memiliki aktivitas antioksidan (Tabel 3).
Analisis kimia terhadap tiga fraksi tersebut menunjukkan bahwa asam kuinat, guaiakol, hidrokuinon, dan katekol terdapat pada ketiga fraksi teraktif (Tabel 3). Hal ini menunjukkan bahwa fraksinasi yang digunakan dalam penelitian ini belum dapat memisahkan senyawa tersebut dengan baik. Menurut Harborne (1987), kandungan ekstrak yang difraksinasi dengan metode solvent-solvent extraction belum tentu mencapai pemisahan yang sempurna, dan senyawa yang sama mungkin saja terdapat dalam beberapa fraksi dalam perbandingan yang berbeda. Fraksinasi dengan n-heksana 2 kali sudah jernih tapi ternyata belum melarutkan seluruh senyawanya dan sudah dianggap telah melarutkan semua ekstrak.
Hasil analisis kimia pada fraksi n-heksana (Lampiran 3) membuktikan keberadaan lemak yang merupakan salah satu senyawa nonpolar (Sjostrom 1995). Senyawa kimia berupa lemak yang terdapat pada fraksi n-heksana adalah metil palmitat dan asam dekanoat. Metil palmitat dan asam dekanoat merupakan salah satu jenis asam lemak yang dapat larut dalam etanol maupun pelarut nonpolar seperti n-heksana (Wang et al. 2009; Sumardjo 2009; Hill 2003). Senyawa tersebut hanya terdapat pada fraksi nonpolar dengan pelarut n-heksana dan tidak terdapat pada fraksi etil asetat.
Fraksi etil asetat non hidrolisis lebih kuat aktivitas antioksidannya dibandingkan dengan fraksi n-heksana. Hal ini dapat disebabkan oleh konsentrasi relatif guaiakol dan hidrokuinon pada fraksi etil asetat non hidrolisis lebih tinggi daripada fraksi n-heksana. Hidrokuinon dan guaiakol memiliki aktivitas antioksidan yang sangat kuat karena memiliki nilai IC50 sebesar 17.16 µg/mL dan 63.24 µg/mL (Arts 2007; Murakami et al. 2007). Selain itu, asam isovanilat dan genkwanin pada fraksi etil asetat terlarut asam tidak ada pada fraksi n-heksana (Tabel 3). Asam isovanilat memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 85.1 µg/mL (Tung et al. 2008). Asam benzoat yang terdapat pada fraksi n-heksana tidak ada pada fraksi etil asetat non hidrolisis, namun aktivitas antioksidan asam benzoat lebih lemah dibandingkan dengan asam isovanilat (Tung et al. 2006). Hal tersebut menyebabkan ketidakhadiran asam benzoat pada fraksi etil asetat non hidrolisis tidak menjadikan aktivitas antioksidan pada fraksi tersebut lebih lemah.
10
senyawa antioksidan yang sangat kuat karena memiliki nilai IC50 22.5 µg/mL (Tung et al. 2008).
(a)
(b)
(c)
Gambar 3 Kromatogram senyawa pada tiga fraksi teraktif (a) fraksi n-heksana, (b) fraksi etil asetat non hidrolisis, (c) fraksi etil asetat hidrolisis (1= Asam kuinat; 2= Guaiakol; 3= Asam isovanilat; 4= Genkwanin; 5= Hidrokuinon; 6= Katekol; 7= Asam benzoat)
Perlakuan hidrolisis pada residu n-heksana sebelum difraksinasi dengan etil asetat bertujuan untuk mengurangi flavonoid glikosida. Hal ini dilakukan agar flavonoid aktivitas antioksidannya meningkat. Aktivitas antioksidan fraksi etil asetat non hidrolisis lebih kuat daripada fraksi etil asetat hidrolisis. Tabel 3 menunjukkan bahwa reaksi hidrolisis hanya meningkatkan kadar asam isovanilat
abundance
abundance
abundance
11 saja namun reaksi tersebut menurunkan asam kuinat, hidrokuinon, katekol, dan genkwanin. Beberapa senyawa fenolik bersifat tidak tahan terhadap panas (Markham 1988). Dari hasil penelitian ini menunjukkan bahwa hidrolisis yang dilakukan untuk memecah glikosida tidak tercapai.
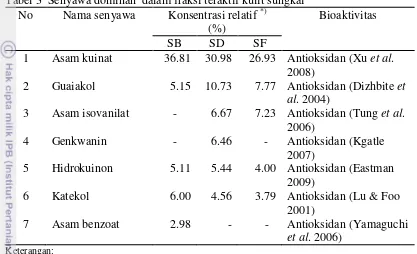
Tabel 3 Senyawa dominan dalam fraksi teraktif kulit sungkai No Nama senyawa Konsentrasi relatif *)
(%)
5 Hidrokuinon 5.11 5.44 4.00 Antioksidan (Eastman 2009)
SB: Fraksi n-heksana SD: Fraksi etil non hidrolisis SF: Fraksi etil hidrolisis
*) Konsentrasi relatif terhadap 25 senyawa terdeteksi
Fraksi etil asetat non hidrolisis merupakan fraksi yang paling kuat aktivitas antioksidannya. Asam kuinat merupakan senyawa dengan konsentrasi relatif terbesar yang terdapat pada fraksi etil asetat non hidrolisis. Fraksi etil asetat non hidrolisis memiliki enam senyawa dominan yaitu asam kuinat, guaiakol, asam isovanilat, genkwanin, hidrokuinon dan katekol, sedangkan fraksi lain hanya memiliki lima senyawa dominan. Konsentrasi relatif guaiakol, genkwanin, dan hidrokuinon pada fraksi etil asetat non hidrolisis lebih tinggi dibandingkan fraksi lainnya. Gambar 3 menunjukkan bahwa fraksi etil asetat non hidrolisis memiliki banyak senyawa dominan dengan konsentrasi relatif yang tinggi.
SIMPULAN DAN SARAN
Simpulan
12
antioksidan dengan nilai IC50 43.67 dan 44.55 µg/mL, sedangkan fraksi etil asetat hidrolisis, ekstrak etanol, residu etil asetat non hidrolisis, dan residu etil asetat hidrolisis tergolong kuat dengan nilai IC50 berturut-turut 53.34, 55.32, 58.80, dan 75.64 µg/mL. Reaksi hidrolisis menghasilkan fraksi etil asetat dengan kadar yang lebih tinggi dari fraksi etil asetat non hidrolisis. Akan tetapi, aktivitas antioksidan fraksi hasil hidrolisis lebih rendah. Hidrolisis meningkatkan konsentrasi asam isovanilat tetapi menurunkan konsentrasi asam kuinat, guaiakol, genkwanin, hidrokuinon, katekol, dan asam benzoat. Hasil fraksinasi belum memisahkan senyawa dengan sempurna karena asam kuinat, guaiakol, hidrokuinon, dan katekol masih di dalam ketiga fraksi teraktif.
Saran
Perlu dilakukan penelitian mengenai pengujian antioksidan ekstrak dari kulit dalam dan kulit luar Sungkai dan penelitian lebih lanjut mengenai fraksinasi dengan kromatografi lapis tipis preparatif (KLTP) atau kromatografi kolom dari ekstrak teraktif.
DAFTAR PUSTAKA
Andersen OM, Markham KR. 2006. Flavonoids: Chemistry, Biochemistry, and Applications. New York (US): Taylor & Francis.
Arts MJTJ. 2007. Assessing antioxidant activity [tesis]. Deurne (BE): Universitaire Pers Maastricht.
Aziz T, Cindo R, Fresca A. 2009. Pengaruh pelarut heksana dan etanol, volume pelarut, dan waktu ekstraksi terhadap hasil ekstraksi minyak kopi. J Teknik Kimia. 1(16).
Banso A. 2009. Phytochemical and antibacterial investigation of bark extracts of Acacia nilotica. Med. Plants Rech. 3:82-85.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Indonesia Vol 1. Jakarta (ID): BPOM RI.
Dizhbite T, Telysheva G, Jurkjane V, Viesturs U. 2004. Characterization of the radical scavenging activity of lignins––natural antioxidants. Biores. Technol. 95:309–317.
Eastman. 2009. Hydroquinone and Hidroquinone Derivatives. Miami (US): Eastman Chemical Comp.
Gani M, Cuaca Y, Ayucitra A, Indraswati N. 2013. Ekstraksi senyawa fenolik antioksidan dari daun dan tangkai gambir. J Teknik Kimia Indones. 11(5):250-256.
Garrido G, Gonzales D, Lemus Y, Garcia D, Lodeiro L, Quintero G, Delporte C, Nunez-Selles AJ, Delgado R. 2004. In vivo and in vitro anti-inflammatory of Mangifera indica L. Extract (VIMANG). Pharmacol Rech. 50:143-149. Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah;
13 Hernani, Rahardjo M. 2006. Tanaman Berkhasiat Antioksidan. Jakarta (ID):
Penebar Swadaya.
Hill M. 2003. Dictionary of Chemistry Second Edition. New York (US): The McGraw-Hill Companies, Inc.
Jang HD, Chang KS, Huang CL, Lee SH, Su MS. 2007. Principal phenolic phytochemicals and antioxidant activities of three chinese medicinal plants. Food Chem. 103:749-756.
Kgatle DT. 2007. Isolation and characterization of antioxidant compounds from Combretum apiculatum (Sond.) subsp apiculatum leaf extracts [disertasi]. Pretoria (tZA): University of Pretoria.
Kumalaningsih S. 2006. Antioksidan Alami. Surabaya (ID): Trubus Agrisarana. Leu SJ, Lin YP, Lin RD. 2006. Phenolic constituents of Malus doumeri var.
formosana in the field of skin care. Biol. Pharma. Bull. 29(4):740–745. Lu Y, Foo LY. 2001.Antioxidant activities of polyphenols from sage (Salvia
officinalis). Food Chem. 75:197–202.
Markham KR. 1988. Cara Mengidentifikasikan Flavonoid. Padmawinata K, penerjemah; Niksolihin s, editor. Bandung (ID): ITB. Terjemahan dari: Techniques of Flavonoid Idenctification.
Masrukhan. 2010. Isolasi dan penelitian struktur kimia serta uji aktivitas antioksidan dari ekstrak n-heksana kulit batang Garcinia bancana Miq [tesis]. Depok (ID): Universitas Indonesia.
Molyneux P. 2004. Use of DPPH to estimate antioxidant activity. Songklanakarin J Sci. Tecnol. 26:2.
Muchtadi D. 2000. Sayur-sayuran Sumber Serat dan Antioksidan: Mencegah Penyakit Degeneratif. Bogor (ID): Institut Pertanian Bogor.
Murakami Y, Hirata A, Ito S, Shoji M, Tanaka S, Yasui T, Machino M, Fujisawa S. 2007. Re-evaluation of cyclooxygenase-2-inhibiting activity of vanillin and guaiacol in macrophages stimulated with lipopolysaccharide. Anticancer Rech. 27:801-808.
Ojewole JA. 2003. Laboratory evaluation of the hypoglycemic effect of Anacardium occidentale Linn (Anacardiaceae) stem-bark extracts in rats. J.prous.com. 25(3):199.
Pari G, Tjutju N, dan Hartoyo. 2000. Kemungkinan pemanfaatan arang kulit kayu Acacia mangium Willd. untuk pemurnian minyak kelapa sawit. Bul Penelitian Hasil Hutan. 18(1):40-53.
Priyanto A. 2013. Isolasi senyawa aktif antioksidan dari fraksi etil asetat tumbuhan paku Nephrolepis falcata (cav.) [skripsi]. Jakarta (ID): Universitas Islam Negeri Syarif Hidayatullah.
Purwati S, Soetopo R, Setiawan Y. 2007. Potensi penggunaan abu boiler industri pulp dan kertas sebagai bahan pengkondisi tanah gambut. Berita Selulosa. 42 (1):8-17.
Rahman MM, Lopa SS, Sadik G, Rashid H, Islam R, Khondkar P, Alam AHMK, Rashid MA. 2005. Antibacterial and cytotoxic compounds from the bark of Cananga odorata. Fitoterapia 76:758-761.
Rein MJ. 2005. Copigmentation reactions and color stability of berry anthocyanins [disertasi]. Helsinki (FI): University of Helsinki.
14
http://communications.uwo.ca/com/media_newsroom/media_newsroom_stori es.
Russell RM. 2006. The multifuctional carotenoids: insights into their behaviour. J Nutr. 136:2690S -2692S.
Sari RK, Nawawi DS, Darmawan W. 2013. Eksplorasi Senyawa Antikanker dari Limbah Industri Kayu Rakyat. Bogor (ID): Lembaga Penelitian Dan Pengabdian Kepada Masyarakat Institut Pertanian Bogor.
Sjostrom E. 1995. Kimia Kayu: Dasar-Dasar dan Penggunaan. Sastrohamidjojo H, penerjemah; Prawirohatmodjo S, editor. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Wood Chemistry Fundamental and Application. Ed ke-2.
Sumardjo D. 2009. Pengantar Kimia Buku Panduan Kuliah Mahasiswa Kedokteran. Jakarta (ID): Penerbit Buku Kedokteran EGC.
Sundari I. 2010. Identifikasi senyawa dalam ekstrak etanol biji buah merah (Pandanus conoideus Lamk.) [skripsi]. Surakarta (ID): Universitas Sebelas Maret.
Triyem. 2010. Aktivitas antioksidan dari kulit batang manggis hutan (Garcinia cf. Bancana Miq) [tesis]. Depok (ID): Universitas Indonesia.
Tung YT, Wu JH, Kuo YH, Chang ST. 2006. Antioxidant activities of natural phenolic compounds from Acacia confusa bark. Food Chem. 111:92–97. Tung YT, Wu JH, Huang CY, Kuo YH, Chang ST. 2009. Antioxidant activities and
phytochemical characteristics of extracts from Acacia confusa bark. Biores. Technol. 100:509–514
Vetal S, Bodhankar SL, Mohan V, Tharkudesal AT. Antiinflamatory and anti arthritic activity of type A procyanidine polyphenol from bark of Cinnamomum zeylanicum in rats. Food Sci. Human Wellness. 2:59-67.
Wang YN, Wang HX, Shen ZJ, Zhao LL, Clarke SR, Sun JH, Du YY, Shi GL. 2009. Methyl palmitate, an acaridical compound occurring in green walnut husks. J of Economic Entomol. 102(1):196-202.
Winarti S, Sarofa U, Anggrahini D. 2008. Ekstraksi dan stabilitas warna uni jalar ungu (Ipomoean-heksana batatas L.) sebagai pewarna alami. J Teknik Kimia. 3(1):207-214.
Windarini LGE, Astuti KW, Wardiatiani NK. 2013. Skrining Fitokimia Ekstrak Metanol Kulit Buah Manggis (Garcinia mangostana L.). Bali (ID): Universitas Udayana.
Xu YJ, Sun SB, Sun LM, Qiu DF, Liu XJ, Jiang ZB, Yuan SC. 2008. Quinic acid esters and sesquiterpenes from Sonchus arvensis. Food Chem. 111:92–97. Yamaguchi LF, Lago JHG, Tanizaki TM, Di Mascio P, Kato MJ. 2006. Antioxidant
15
RIWAYAT HIDUP
Penulis merupakan anak kedua dari empat bersaudara yang lahir di Jakarta pada tanggal 21 Agustus 1992 dari pasangan Bapak Rasna Ibnu Andi dan Ibu Ghosriyani. Pada tahun 2007 penulis menyelesaikan studi di SMAN 6 Bogor dan diterima di Departemen Hasil Hutan Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menempuh pendidikan di Fakultas Kehutanan IPB, penulis telah mengikuti Praktek Pengenalan Ekosistem Hutan (P2EH) di Baturraden dan Cilacap pada tahun 2012, Praktek Pengolahan Hutan (P2H) di Hutan Pendidikan Gunung Walat pada tahun 2013, serta Praktek Kerja Lapang (PKL) di PT Sari Bumi Kusuma di Kumpai, Kalimantan Barat. Penulis juga pernah menjadi asisten praktikum Kimia Kayu pada tahun 2014.
Penulis juga aktif mengikuti kegiatan organisasi di kampus, antara lain panitia Forester Cup tahun 2012 dan 2013, panitia Bina Corps Rimbawan tahun 2012 dan 2013, anggota divisi TPMK Himpunan Mahasiswa Hasil Hutan tahun 2011-2012, anggota divisi Kewirausahaan Himpunan Mahasiswa Hasil Hutan tahun 2012-2013, anggota Rimbawan Pecinta Alam sejak tahun 2011, dan ketua divisi Gunung Hutan Rimbawan Pecinta Alam tahun 2011-2012.
21