APLIKASI FOSFIN FORMULASI CAIR
UNTUK PENGENDALIAN
Thrips parvispinus
Karny
(Thysanoptera: Thripidae) PADA BUNGA POTONG KRISAN
SEBAGAI PERLAKUAN KARANTINA
TAUFAN TANTO SETYAWAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul : ”Aplikasi Fosfin Formulasi Cair untuk Pengendalian Thrips parvispinus Karny (Thysanoptera: Thripidae) pada Bunga Potong Krisan sebagai Perlakuan Karantina” adalah benar merupakan hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis ini kepada Institut Pertanian Bogor
Bogor, November 2014
RINGKASAN
TAUFAN TANTO SETYAWAN. Aplikasi Fosfin Formulasi Cair untuk Pengendalian Thrips parvispinus Karny (Thysanoptera: Thripidae) pada Bunga Potong Krisan sebagai Perlakuan Karantina. Dibimbing oleh IDHAM SAKTI
HARAHAP dan DADANG.
Bunga krisan (Chrysanthemum indicum) merupakan komoditas hortikultura yang mempunyai prospek baik sebagai sumber devisa negara. Volume ekspor bunga krisan Indonesia masih relatif rendah dibandingkan dengan negara lain. Salah satu penyebabnya adalah terbawanya organisme pengganggu tumbuhan (OPT) pada bunga yang diekspor. OPT yang sering menyerang bunga krisan di antaranya adalah Thrips parvispinus Karny. Salah satu tindakan yang dilakukan untuk mengendalikan hama ini adalah perlakuan fumigasi. Alternatif fumigan yang memiliki keefektifan yang baik adalah fosfin formulasi cair. Tujuan penelitian ini adalah untuk menentukan konsentrasi dan lama waktu papar aplikasi fosfin formulasi cair yang efektif terhadap T. parvispinus pada bunga krisan dan mengevaluasi pengaruhnya terhadap kualitas bunga potong krisan.
Penelitian dilaksanakan dalam 5 tahap, yaitu: (1) Koleksi dan identifikasi serangga uji; (2) Perbanyakan (rearing) T. parvispinus; (3) Uji pendahuluan dengan 2 tahap untuk menentukan batasan kisaran waktu dan konsentrasi yang diperlukan dalam fumigasi; (4) Uji lanjut aplikasi fosfin cair dengan beberapa konsentrasi dan waktu papar tertentu terhadap T. parvispinus; dan (5) Uji validasi konsentrasi dan waktu papar yang paling efektif dan pengaruhnya terhadap kualitas bunga potong krisan.
Uji pendahuluan tahap pertama menunjukkan bahwa pada seluruh perlakuan semua serangga uji mengalami kematian sebesar 100% pada konsentrasi 200, 250, 300, dan 350 ppm dengan kombinasi waktu papar 1, 3, 6, 9, 12, 15, dan 18 jam. Uji pendahuluan tahap kedua pada lama waktu papar 1 jam dengan konsentrasi lebih rendah dari 200 ppm, mortalitas tertinggi ditunjukkan pada konsentrasi 175 ppm dengan persentase mortalitas sebesar 98.7% dan persentase mortalitas terendah pada 25 ppm dengan mortalitas sebesar 57.3%. Pada uji lanjut yang menggunakan konsentrasi antara 25 – 200 ppm, persentase mortalitas sebesar 100% terjadi pada konsentrasi 200 ppm dengan lama waktu papar 1, 3, dan 6 jam dan juga pada konsentrasi 175 ppm dengan lama waktu papar 6 jam, sementara itu nilai LC50 dan LC95 terendah ditunjukkan pada waktu papar 6 jam dengan nilai
17.323 ppm dan 120.69 ppm.
Aplikasi fosfin cair terhadap T. parvispinus pada bunga potong krisan efektif pada perlakuan 1 jam dengan konsentrasi 200 ppm yang menyebabkan mortalitas sebesar 100%. Pada konsentrasi tersebut tidak terjadi penurunan kualitas bunga potong krisan.
SUMMARY
TAUFAN TANTO SETYAWAN. Liquified Formulation of Phosphine Application to Control Thrips parvispinus Karny (Thysanoptera: Thripidae) on Cut Flower Chrysanthemum as a Quarantine Treatment. Supervised by IDHAM
SAKTI HARAHAP and DADANG.
Chrysanthemum flower (Chrysanthemum indicum) is a horticultural commodity that has good prospects as a source of country revenue. Compared to other countries, export volume of this commodity from Indonesia is relatively low. High intensity of plant pest and disease infestation on chrysanthemum in this country is one of the reason for that situation. One pest of insects that often attacks chrysanthemum cut flower is Thrips parvispinus. One of the measures taken to control this insect is fumigation treatment. Alternative fumigant that has good effectiveness is liquified formulations of phosphine. The objectives of this study were to determine the concentration level and time of liquified phosphine formulation application against T. parvispinus on the chrysanthemum cut flower and to evaluate the quality of chrysanthemum cut flowers.
The experiment was conducted in five stages: (1) Collection and identification of test insect, (2) Rearing of T. parvispinus, (3) Preliminary test in 2 stages to determine a level time and concentration for liquified phosphine application to T. parvispinus, (4) Application of liquified phosphine concentration level and time to T. parvispinus, and (5). Validation test of effective concentration and time level and evaluate their effects on quality of chrysanthemum cut flowers. The first stage of preliminary test showed in all treatments about test insect mortality of 100% at concentration 200, 250, 300, and 350 ppm with time level combination of 1, 3, 6, 9, 12, 15, and 18 hours. The second stage of a preliminary test with 1 hour time level at a concentration lower than 200 ppm, the highest mortality was shown at a concentration of 175 ppm with percentage mortality 98.7% and the lowest percentage of mortality at 25 ppm with a mortality 57.3%. In a further test that uses a concentration between 25-200 ppm, the percentage of 100% mortality occurred at a concentration of 200 ppm with time level 1, 3 and 6 hours and also at a concentration of 175 ppm with the time level of 6 hours, while the lowest of LC50 and LC95 values indicated at the time 6 hours with 17.323 ppm
and 120.69 ppm.
Applications of liquified phosphine to T. parvispinus on chrysanthemum cut flower are effective within 1 hour treatment at 200 ppm concentrations that cause mortality of 100%. Treatment at these concentration did not decrease the quality of cut chrysanthemum flowers.
© Hak Cipta milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
APLIKASI FOSFIN FORMULASI CAIR
UNTUK PENGENDALIAN
Thrips parvispinus
Karny
(Thysanoptera: Thripidae) PADA BUNGA POTONG KRISAN
SEBAGAI PERLAKUAN KARANTINA
TAUFAN TANTO SETYAWAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Aplikasi Fosfin Formulasi Cair untuk Pengendalian Thrips parvispinus Karny (Thysanoptera: Thripidae) pada Bunga Potong Krisan sebagai Perlakuan Karantina Nama Mahasiswa : Taufan Tanto Setyawan
NRP : A351120101
Disetujui oleh
Komisi Pembimbing
Dr. Ir. Idham Sakti Harahap, M.Si. Prof. Dr. Ir. Dadang, M.Sc. Ketua Anggota
Diketahui oleh
Ketua Program Studi Entomologi Dekan Sekolah Pascasarjana
Dr. Ir. Pudjianto, M.Si. Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia yang dilimpahkan-Nya sehingga penulis dapat menyelesaikan penelitian tesis yang berjudul “Aplikasi Fosfin Formulasi Cair untuk Pengendalian Thrips parvispinus Karny (Thysanoptera: Thripidae) pada Bunga Potong Krisan sebagai Perlakuan Karantina”, sebagai salah satu syarat untuk menyelesaikan pendidikan pada Program Studi Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Desember 2013 sampai dengan Juni 2014 di Laboratorium Entomologi dan gedung workshop fumigasi dan X-ray di Balai Uji Terap Teknik dan Metode Karantina Pertanian di Bekasi.
Pada kesempatan ini, perkenankanlah penulis mengucapkan terima kasih kepada Dr. Ir. Idham Sakti Harahap, M.Si. dan Prof. Dr. Ir. Dadang, M.Sc., selaku komisi pembimbing yang senantiasa membimbing, memberikan arahan dan masukan kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Dr. Ir. Pudjianto, M.Si. selaku dosen pembimbing akademik yang banyak memberikan motivasi dan bimbingan, kepada teman-teman Program Studi Entomologi Angkatan 2012, seluruh sivitas akademik Program Studi Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor yang membantu dan memberikan semangat kepada penulis dan kepada Pusat Pendidikan, Standardisasi dan Sertifikasi Profesi Pertanian, Kementerian Pertanian sebagai pemberi beasiswa program pascasarjana.
Ucapan terima kasih dan rasa hormat secara khusus penulis sampaikan kepada Mama, Papa, Istri dan anak-anak-ku serta keluarga besar penulis yang selalu mendoakan, memberikan dukungan baik moril maupun materil, sehingga penulis dapat menyelesaikan penelitian ini.
Penulis menyadari bahwa dalam penulisan ini masih terdapat banyak kekurangan. Untuk itu masukan dan saran yang bersifat membangun sangat diharapkan agar karya ini menjadi lebih sempurna. Semoga karya kecil ini bermanfaat bagi kita semua
Bogor, November 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Hipotesis 3
Manfaat 3
TINJAUAN PUSTAKA 4
Kepentingan Krisan dalam Ekspor Indonesia 4
Tanaman Krisan 5
Thrips parvispinus Karny 7
Fosfin 10
Strategi Pengendalian T. parvispinus 12
BAHAN DAN METODE 13
Tempat dan Waktu 13
Bahan dan Alat 13
Metode Penelitian 13
Analisis Data 17
HASIL DAN PEMBAHASAN 18
Hasil 18
Pembahasan 24
SIMPULAN DAN SARAN 28
Simpulan 28
Saran 28
DAFTAR PUSTAKA 29
LAMPIRAN 35
DAFTAR TABEL
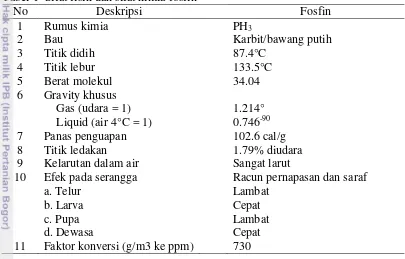
1 Sifat fisik dan sifat kimia dari fosfin 11
2 Persentase mortalitas T. parvispinus pada perlakuan beberapa
konsentrasi fosfin cair yang dipaparkan 1 jam 20
3 Penduga parameter toksisitas fosfin cair terhadap mortalitas T.
parvispinus 20
4 Persentase mortalitas T. parvispinus pada perlakuan beberapa
konsentrasi fosfin cair yang dipaparkan 1, 3, dan 6 jam 21 5 Penduga parameter toksisitas fosfin cair terhadap mortalitas T.
parvispinus dengan waktu papar 1, 3, dan 6 jam 21 6 Persentase mortalitas T. parvispinus pada perlakuan beberapa
konsentrasi fosfin cair yang dipaparkan 1, 3, dan 6 jam pada
bunga krisan 22
7 Rata-rata skor kerusakan bunga potong krisan pada pengamatan 1,
24, 48, dan 72 jam setelah perlakuan (JSP) 22
DAFTAR GAMBAR
1 Tanaman krisan pada pot 6
2 Bunga potong krisan 7
3 Siklus hidup T. parvispinus 8
4 Kotak perbanyakan T. parvispinus 14
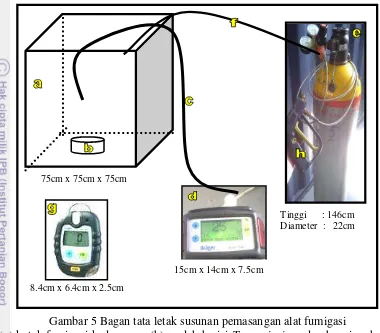
5 Bagan tata letak susunan pemasangan alat fumigasi 15
6 Tahap urutan pelaksanaan perlakuan fumigasi 16
7 Imago T. parvispinus pada perbesaran 40 kali 18
8 Antena T. parvispinus pada perbesaran 100 kali 18
9 Kepala T. parvispinus pada perbesaran 40 kali 19
10 Sayap T. parvispinus pada perbesaran 200 kali 19
11 Abdomen T. parvispinus pada perbesaran 100 kali 19
12 Penampilan bunga potong krisan setelah pemaparan 1 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d).
72 JSP (JSP : jam setelah perlakuan) 23
13 Penampilan bunga potong krisan setelah pemaparan 3 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d).
72 JSP (JSP : jam setelah perlakuan) 23
14 Penampilan bunga potong krisan setelah pemaparan 6 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d).
DAFTAR LAMPIRAN
1 Persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair dengan beberapa waktu pemaparan fumigan 35 2 ANOVA persentase mortalitas T. parvispinus pada perlakuan
beberapa konsentrasi fosfin cair yang dipaparkan 1 Jam 36
3 ANOVA persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 1 Jam 37 4 ANOVA persentase mortalitas T. parvispinus pada perlakuan
beberapa konsentrasi fosfin cair yang dipaparkan 3 jam 39 5 ANOVA persentase mortalitas T. parvispinus pada perlakuan
beberapa konsentrasi fosfin cair yang dipaparkan 6 jam 41 6 ANOVA persentase mortalitas T. parvispinus pada perlakuan
beberapa konsentrasi fosfin cair yang dipaparkan 1 jam pada bunga
krisan 43
7 ANOVA persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 3 jam pada bunga
krisan 44
8 ANOVA persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 6 jam pada bunga
PENDAHULUAN
Latar Belakang
Ekspor komoditas pertanian merupakan program pemerintah yang terus digalakkan di samping industri dan jasa untuk meningkatkan taraf hidup masyarakat. Komoditas ekspor pertanian Indonesia antara lain kopi, lada, kakao, karet, buah, sayuran segar dan tanaman hias (bunga potong) merupakan beberapa komoditi unggulan untuk ekspor yang sangat diminati oleh negara-negara lain.
Bunga merupakan komoditas hortikultura yang pertumbuhan ekspornya semakin meningkat dan mempunyai prospek baik sebagai sumber devisa negara. Salah satu jenis bunga yang sangat digemari adalah Chrysanthemum indicum, karena memiliki keragaman, baik dari segi penampilan, bentuk maupun warnanya. Kesinambungan komoditas ini baik dari segi kualitas maupun kuantitasnya perlu dijaga untuk memasuki pasar luar negeri yang lebih baik. Bunga krisan merupakan salah satu tanaman hias yang memiliki nilai ekonomis yang tinggi. Pada tahun 2012 ekspor bunga krisan ke beberapa negara tujuan ekspor mencapai 50.92 ton dengan nilai sekitar US $ 1 031 511 (BPS 2013). Tujuan ekspor bunga krisan ini meliputi Jepang, China, Taiwan, Hongkong, Korea Selatan, Malaysia, dan Singapura. Selain negara kawasan Asia, negara-negara lain yang merupakan pasar potensial bunga potong di antaranya Amerika Serikat, Canada, Columbia, Belanda, Italia, dan Jerman. Meski demikian, volume ekspor tanaman hias Indonesia khususnya bunga krisan masih relatif rendah dibandingkan dengan negara lain.
Hal ini diakibatkan beberapa kendala di antaranya adalah terbawanya organisme pengganggu tumbuhan (OPT) pada bunga yang diekspor. OPT yang sering menyerang bunga krisan di antaranya adalah thrips, Thrips parvispinus merupakan salah satu hama utama pada tanaman krisan. Hama ini selain merusak tanaman melalui aktivitas makan juga dapat menjadi vektor virus mosaik (Deligeorgidis et al. 2006). Menurut Prabaningrum dan Moekasan (2007), warna bunga krisan dapat menjadi daya tarik bagi thrips untuk hinggap dan hidup pada bunga. Thrips dikenal sebagai hama yang sulit dikendalikan karena ukurannya yang kecil dan perilakunya yang tidak terlalu mudah diketahui (Laksanawati 1996).
Fumigasi sebagai salah satu perlakuan karantina tumbuhan bertujuan untuk membebaskan media pembawa dari OPT/OPTK. Fumigasi merupakan cara yang sangat luas dilakukan dalam kegiatan karantina, baik pada produk buah, sayuran maupun tanaman hias. Keunggulan fumigasi adalah dapat dilakukan pada komoditas dalam jumlah besar secara bersamaan sehingga dapat menghemat waktu. Fumigan yang banyak digunakan adalah metil bromida (MB), fosfin padat (PH3) dan etil format. Metoda fumigasi yang diterapkan secara luas pada beberapa
komoditas seperti biji-bijian di gudang penyimpanan diketahui menyisakan residu dan tidak aman bagi kesehatan manusia. Fumigan MB yang memiliki keefektifan yang baik ternyata telah dibatasi penggunaannya karena dapat merusak lapisan ozon (Maha 1997), menurunkan kualitas pada komoditas bunga potong yang sensitif terhadap MB (Wang dan Lin 1984), dan diketahui meninggalkan residu yang bersifat karsinogenik pada komoditas yang difumigasi (Pusat Karantina Pertanian 2000). Sementara itu, fumigasi dengan menggunakan fosfin formulasi padat memerlukan waktu papar yang lama, meninggalkan residu dan tidak dapat diaplikasikan pada komoditas dengan kadar air yang tinggi karena mudah terbakar (Barantan 2013).
Penelitian untuk mendapatkan alternatif fumigan yang memiliki keefektifan yang lebih baik namun tidak berdampak negatif bagi komoditas, manusia, hewan dan lingkungan perlu dilakukan. Salah satu alternatif fumigan yang mulai banyak digunakan adalah fosfin formulasi cair (gas yang dikemas dalam silinder bertekanan tinggi). Keberadaan fumigan fosfin formulasi cair dapat memecahkan permasalahan aplikasi fosfin dalam bentuk padat, mengingat fosfin formulasi cair sudah berbentuk gas fosfin yang bertekanan ditempatkan dalam tabung. Sifat fisik serta sifat kimia fumigan formulasi cair berbeda dengan fosfin padat. Di beberapa negara seperti Amerika Serikat, Australia dan Thailand telah menggunakan fosfin formulasi cair untuk perlakuan fumigasi dalam membebaskan hama pada berbagai komoditas seperti kopi, kakao, tembakau, buah-buahan dan bunga. Selain itu, fosfin formulasi cair juga dapat dijadikan sebagai salah satu alternatif perlakuan karantina tumbuhan karena sesuai dengan ketentuan International Sanitary and Phytosanitary Measurement (ISPM) No. 28 (Barantan 2013).
Menurut Barantan (2013), penggunaan fosfin formulasi cair sebagai alternatif dapat digunakan terhadap berbagai komoditas yang bermasalah apabila difumigasi dengan fosfin formulasi padat. Fosfin formulasi cair yang diperdagangkan dalam tabung bertekanan tinggi dicampur dengan karbon dioksida (CO2). Hal ini karena fosfin formulasi cair memilki sifat-sifat 1) tidak
mudah terbakar sebab fosfin cair adalah campuran gas dari 2% fosfin dalam 98% karbon dioksida (CO2), 2) reaksi sinergis dengan CO2, 3) stabilitas gas konsentrasi
fosfin formulasi cair dapat lebih mudah dipertahankan selama fumigasi dan akan konstan selama berlangsungnya fumigasi sejak awal dilepaskan. Karbon dioksida adalah gas pembawa (carrier) yang sangat baik untuk fosfin dan tidak menyebabkan fosfin cair menjadi mudah terbakar dengan udara, beberapa penelitian telah menunjukkan efek sinergis bila CO2 digunakan dengan fosfin cair.
CO2 cenderung menyebabkan pernapasan serangga menjadi lebih cepat sehingga
3
Fosfin telah digunakan sebagai fumigan untuk mengendalikan hama gudang selama lebih dari 6 dekade (Chaudry 1997). Menurut Barantan (2013), fosfin cair efektif mengendalikan berbagai serangga pada konsentrasi 200 - 1 000 ppm tergantung pada jenis serangga dan tempat fumigasi dilakukan. Di negara Chili fosfin telah diuji dan digunakan pada berbagai varietas buah segar dan sayuran untuk penanganan pengendalian pascapanen pada temperatur rendah (Horn et al. 2005). Fosfin digunakan secara luas untuk mengendalikan berbagai hama gudang, namun diperlukan konsentrasi dan lama waktu papar yang sesuai untuk masing-masing spesies hama (Bond et al. 1969).
Menurut Karunaratne et al. (1997), beberapa serangga sangat rentan terhadap fosfin yang mana pada konsentrasi 600 ppm dan suhu 20ºC yang dipapar selama 2 jam efektif dalam mengendalikan Heliothrips haemorrhoidalis. Sementara itu perlakuan fumigasi pada konsentrasi ≥250 ppm dan waktu papar ≥18 jam pada suhu 2ºC efektif dalam mengendalikan Frankliniella occidentalis. Fumigasi pada konsentrasi 1 000 ppm dan suhu 2ºC tidak menyebabkan kerusakan pada selada dan brokoli, kemudian perlakuan fumigasi pada 500 dan 1 000 ppm tidak menyebabkan kerusakan dan aman untuk strawberry (Liu 2008). Hingga saat ini belum diketahui konsentrasi dan waktu papar yang efektif untuk pengendalian T. parvispinus pada bunga krisan pada suhu di indonesia yang berkisar antara 26-35ºC dan pengaruhnya terhadap kualitas bunga potong krisan. Untuk itu, perlu dilakukan penelitian untuk mengetahui konsentrasi dan lama waktu papar yang efektif untuk imago T. parvispinus pada bunga potong krisan dan tidak menyebabkan penurunan kualitas pada bunga potong krisan.
Tujuan
Untuk menentukan konsentrasi fosfin formulasi cair dan lama waktu papar yang efektif sebagai fumigan terhadap imago T. parvispinus pada bunga potong krisan dan pengaruhnya terhadap kualitas bunga potong krisan.
Hipotesis
Fumigan fosfin cair pada konsentrasi dan lama waktu papar tertentu efektif untuk mengendalikan imago T. parvispinus dengan tingkat mortalitas 100% dan tidak berpengaruh terhadap kualitas bunga potong krisan.
Manfaat
Kepentingan Krisan dalam Ekspor Indonesia
Tanaman Krisan merupakan tanaman yang berpotensi untuk dikembangkan dalam skala komersial terutama sebagai tanaman hias dalam pot maupun bunga potong. Terdapat lebih dari seribu varietas krisan yang dikenal yang tersebar di seluruh dunia. Awalnya krisan dibudidayakan di Jepang, bahkan menjadikan krisan sebagai simbol kekaisaran Jepang dan disebut sebagai Queen of the East, kemudian menyebar ke Eropa lalu ke seluruh Asia. Tanaman Krisan masuk ke Indonesia pada abad ke- 17 dan baru dikembangkan pada tahun 1940 di Cianjur, Lembang, Cisarua, Brastagi dan Bandungan (Rukmana dan Mulyana 1997).
Widyawan dan Prahastuti (1994) menyatakan bahwa jenis bunga potong yang mempunyai nilai komersial di Indonesia antara lain krisan, anggrek, mawar, anyelir, anthurium, gladiol, gerbera, sedap malam, aster, dan melati. Peningkatan nilai estetis dan ekonomis sangat diperlukan untuk menjaga keindahan dan kesenangan para penyuka bunga potong, sehingga akan dapat meningkatkan jumlah konsumen dan penyuka bunga potong.
Terdapat empat jenis bunga lokal yang berpotensi diproduksi di Indonesia untuk keperluan pasar dalam negeri dan ekspor ke pasar internasional, yaitu anggrek, krisan, mawar dan sedap malam. Pertumbuhan produksi selama tiga tahun terakhir masing-masing bunga adalah 1.53%, 68.44%, 13.53% dan 10.81% per tahun. Nilai ekspor anggrek, krisan dan mawar pada tahun 2011 masing-masing mencapai USD 783 785; USD 1 329 468 dan USD 781 377 (BPS 2012). Krisan menempati urutan pertama sebagai penghasil devisa pada ekspor tanaman hias, dari waktu ke waktu permintaan terhadap bunga krisan baik dalam bentuk bunga potong maupun dalam pot mengalami kenaikan.
Krisan merupakan salah satu jenis bunga potong penting di dunia yang banyak diminati di beberapa negara (Widiastuti et al. 1999). Bunga krisan kuning (Chrysanthemum indicum) sebagai bunga potong sangat disenangi konsumen di Indonesia dan negara lain karena keindahannya. Keragaman bentuk, warna, kemudahan untuk dirangkai dan memiliki kesegaran bunga yang cukup lama, bisa bertahan sampai dengan 3 minggu (Harry 1994).
Menurut Direktorat Jenderal Hortikultura (2007), pasokan bunga krisan di dunia saat ini masih dikuasai oleh pelaku usaha yang bersal dari Belanda, Colombia, dan Italia yang mencapai total ekspor lebih dari 60% dari nilai perdagangan dunia, sementara negara-negara lain hanya mampu memasok sekitar 10% dari total permintaan dunia.
Usaha produksi krisan di Indonesia dihadapkan pada beberapa kendala, antara lain ketergantungan terhadap bibit dari luar negeri dan infestasi hama pada bunga potong sehingga terdapat kesulitan untuk menembus pasar luar negeri. Salah satunya adalah hama T. parvispinus (Balithi 2000). Kerusakan yang ditimbulkan oleh thrips pada tanaman bunga krisan di lapangan berkisar 40-55 % tergantung pada kondisi lingkungan (Prabaningrum dan Moekasan 1997)
5
pengganggu tumbuhan (OPT). Salah satu contoh, ekspor bunga krisan dengan tujuan negara Jepang dinyatakan terinfestasi oleh thrips sehingga harus diberi perlakuan dengan penyemprotan insektisida dosis tinggi oleh pemerintah Jepang untuk melindungi negaranya dari penyebaran OPT, dampaknya hanya 40% bunga krisan yang dapat bertahan sehingga eksportir mengalami kerugian.
Tanaman Krisan
Klasifikasi Ilmiah
Bunga krisan adalah anggota dari famili Asteraceae yang mencakup bermacam-macam jenis Chrysanthemum. Klasifikasi Ilmiah dari tanaman bunga krisan adalah sebagai berikut :
Kingdom : Plantae
Filum : Magnoliophyta Kelas : Magnoliopsida
Sub Kelas : Asteridae Ordo : Asterales Famili : Asteraceae
Genus : Chrysanthemum Spesies Chrysanthemum sp.
Botani
Menurut Rukmana dan Mulyana (1997), tanaman krisan memiliki batang dengan bentuk yang tegak, bulat, sedikit bercabang, permukaan kasar dan berwarna hijau. Daun berbentuk tunggal, berseling, lonjong dengan ujung runcing dan pangkal yang membulat, panjang 7-13 cm dan lebar 3-6 cm pertulangan menyirip, tebal, permukaan kasar, hijau. Sementara itu bunga bersifat majemuk, berbentuk seperti cawan dengan garis tengah 3-5 cm. Buah dari tanaman krisan berbentuk lonjong, kecil, ditutupi selaput buah, yang masih muda berwarna putih sementara yang tua berwarna hitam. Biji berbentuk lonjong dengan ukuran kecil berwarna hitam dan akar tunggang berwarna putih.
Krisan pada umumnya dibudidayakan dan tumbuh baik di dataran medium sampai tinggi yaitu pada kisaran 650 – 1 200 m dpl. Di habitat aslinya, krisan merupakan tanaman yang bersifat menyemak dan dapat tumbuh hingga mencapai tinggi 30 – 200 cm. Berdasarkan siklus hidupnya, krisan dibedakan menjadi 2 tipe, yaitu krisan semusim (hardy annual) dan krisan tahunan (hardy perennial) (Harry 1994).
Gambar 1 Tanaman krisan pada pot
Krisan berasal dari daerah subtropis, sehingga suhu yang terlalu tinggi merupakan faktor pembatas dalam pertumbuhan tanaman. Krisan dapat tumbuh pada kisaran suhu harian antara 17-30ºC. Pada fase vegetatif, kisaran suhu harian 22-28ºC pada siang hari dan tidak melebihi 26ºC pada malam hari dibutuhkan untuk pertumbuhan optimal krisan. Suhu ideal pada fase generatif adalah 16-18ºC. Pada suhu di atas 25ºC, proses inisiasi bunga akan terhambat dan menyebabkan pembentukan bakal bunga juga terlambat. Suhu yang terlalu tinggi juga mengakibatkan bunga yang dihasilkan cenderung berwarna kusam, pucat dan memudar (Hashim dan Reza 1995)
Bunga
Krisan merupakan tanaman bunga hias berupa perdu dengan sebutan lain Seruni atau bunga emas (Golden Flower) berasal dari dataran Cina. Krisan kuning berasal dari dataran Cina, dikenal dengan Chrysanthenum indicum (kuning), C. Morifolium (ungu dan pink) dan C. daisy (bulat, ponpon). Krisan masuk ke Indonesia pada tahun 1800 dan tahun 1940 krisan dikembangkan secara komersial. Menurut Sanjaya (1996) jenis dan varietas tanaman krisan di Indonesia umumnya hibrida berasal dari Belanda, Amerika Serikat dan Jepang. Krisan yang ditanam di Indonesia terdiri atas:
a. Krisan lokal (krisan kuno)
Berasal dari luar negri, tetapi telah lama dan beradaptasi di Indoenesia maka dianggap sebagai krisan lokal. Ciri-cirinya antara lain sifat hidup di hari netral dan siklus hidup antara 7-12 bulan dalam satu kali penanaman. Contoh C. Maximum berbunga kuning banyak ditanam di Lembang dan berbunga putih di Cipanas (Cianjur).
b. Krisan introduksi (krisan modern atau krisan hibrida)
7
hybr. Indianapolis (berbunga kuning) Cossa, Clingo, Fleyer (berbunga putih), Alexandra Van Zaal (berbunga merah) dan Pink Pingpong (berbunga pink).
c. Krisan produk Indonesia
Balai Penelitian Tanaman Hias Cipanas telah melepas varietas krisan buatan Indonesia yaitu varietas Balithi 27.108, 13.97, 27.177, 28.7 dan 30.13A.
Dari beberapa jenis varietas, krisan berwarna kuning dan hijau adalah yang paling banyak dicari. Persentasenya bisa mencapai 90%, sementara sisanya memilih warna-warna lain.
Gambar 2 Bunga potong krisan
Thrips parvispinus Karny
Thrips ditemukan hampir di seluruh dunia dengan jumlah spesies mencapai 6 000 spesies. Dialam bebas, thrips lebih menyukai berada pada gulma sebagai inangnya, tetapi adanya gangguan pada gulma menyebabkan thrips bermigrasi ke tanaman ekonomis seperti sayuran, tanaman hias, dan buah-buahan. Beberapa dari spesies thrips dikenal sebagai penyebab kerusakan tanaman (Reynaud 2010). Di Indonesia tanaman yang menjadi inang dengan tingkat kerusakan yang cukup tinggi antara lain adalah cabai, bawang merah, bawang putih, kentang, tomat, terung, waluh dan mentimun juga beberapa tanaman hias seperti krisan, mawar, dan sedap malam. Kondisi kadar air tanaman mempengaruhi kepindahan thrips dalam memilih inang, kadar air yang tinggi akan dipilih dari pada tanaman dengan kadar air kurang (Dibyantoro 1994).
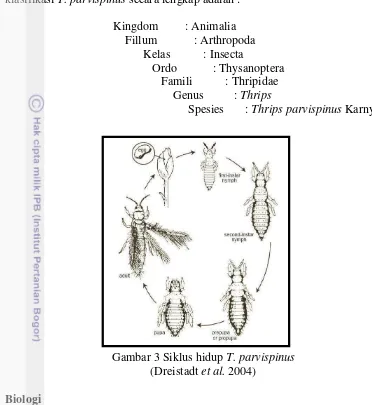
Thrips diklasifikasikan kedalam ordo Thysanoptera dan famili Thripidae, klasifikasi T. parvispinus secara lengkap adalah :
Kingdom : Animalia Fillum : Arthropoda Kelas : Insecta
Ordo : Thysanoptera Famili : Thripidae Genus : Thrips
Spesies : Thrips parvispinus Karny
Gambar 3 Siklus hidup T. parvispinus (Dreistadt et al. 2004)
Biologi
Pada umumnya thrips dewasa berbentuk langsing, berwarna kuning hingga coklat kehitaman, berukuran kecil 0.8 – 1.4 mm, ukuran paling besar hingga mencapai 3 mm (Davidson dan Lyon 1987). Thrips dewasa maupun nimfa tubuhnya bersegmen-segmen, nimfa berwarna putih atau putih kekuningan dan tidak bersayap (Lewis 1973). Thrips berkembang biak secara seksual dan aseksual, perkembangan aseksual thrips disebut dengan parthenogenesis. Imago betina yang mengalami perkembangbiakan secara aseksual akan menghasilkan keturunan betina lagi (Kendall dan Capinera 1990). Thrips betina meletakan telur secara tunggal di dalam jaringan tanaman, di permukaan bawah daun atau pada kelopak dan mahkota bunga. Jumlah telur yang dihasilkan oleh seekor betina berkisar antara 30-300 butir tergantung kualitas dan jumlah makanan yang tersedia dan suhu lingkungan (Davidson dan Lyon 1987). Pada suhu yang tinggi imago akan mengalihkan energi yang dimilikinya untuk memproduksi telur yang lebih banyak, sementara pada suhu rendah imago akan menimbun energi yang dimilikinya untuk membentuk struktur tubuh (Berger et al. 2008)
9
mengalami dua fase instar nimfa dan pupa. Instar pertama dan kedua merupakan fase aktif, setelah fase nimfa selanjutnya adalah fase prepupa dan pupa merupakan fase istirahat dan kemudian menjadi imago yang mulai aktif makan lagi. Siklus hidup thrips sekitar 15.4 hari (Dibyantoro 1994), sementara itu menurut Lu dan Lee (1987) untuk menyelesaikan satu siklus hidup thrips membutuhkan waktu 35 hari dengan fase telur 4.8 hari, nimfa 5.9 hari, prepupa 1.4 hari dan pupa 2.4 hari serta dewasa 20.2 hari.
Telur thrips berbentuk oval atau seperti ginjal dan berwarna putih bening. Telur biasanya diletakkan pada bagian permukaan bawah daun atau di dalam jaringan tanaman secara terpencar atau ditusukkan ke dalam jaringan tanaman. Nimfa berwarna putih dan sangat aktif, terdiri atas dua instar, yang diikuti dengan periode prepupa yaitu nimfa yang menyerupai sifat seperti pupa dan tidak makan, nimfa yang baru menetas berwarna putih kekuningan. Nimfa instar pertama dan kedua aktif berada di permukaan daun sedangkan instar selanjutnya tidak aktif. Nimfa T. parvispinus paling banyak dijumpai pada daun bagian atas (Sutherland 2006).
Pupa biasanya jatuh ke tanah, kemudian menjadi serangga dewasa. Perkembangan pupa menjadi imago meningkat pada kelembaban relatif rendah dan suhu relatif tinggi. Pupa terdapat di bawah daun atau permukaan tanah di sekitar tanaman. Imago yang telah memiliki sayap biasanya belum dapat terbang tetapi sudah dapat meloncat dan hidup secara berkelompok (Mound et al. 1976). Imago berukuran sangat kecil, dengan panjang tubuh + 1 mm dan berwarna kuning pucat sampai coklat kehitaman. Imago yang sudah tua berwarna agak kehitaman bergaris-garis. Serangga jantan tidak bersayap, sedangkan yang betina mempunyai dua pasang sayap yang halus dan tidak rata. Umur serangga dewasa dapat mencapai 20 hari. Imago paling banyak ditemukan pada pucuk daun dan bagian dalam bunga (Davidson dan Lyon 1987).
Gejala Serangan
Fosfin
Fosfin atau hidrogen fosfida (PH3) adalah gas yang dihasilkan oleh fumigan
yang dikenal sebagai metal fosfida yang merupakan salah satu fumigan tertua dan banyak digunakan dalam pengendalian hama. Fosfin sangat toksik terhadap serangga termasuk manusia dan hewan. Disamping toksik, fosfin juga menyebabkan korosi pada logam tertentu dan dapat terbakar secara tiba-tiba di udara pada konsentrasi yang lebih tinggi dari titik ledak yaitu 1.8% (17 900 ppm). Sifat-sifat lain dari fosfin adalah berat jenis dan berat molekulnya rendah sehingga membuat kemampuan penetrasinya dapat tembus ke bagian dalam komoditas (Wirawan 2006).
Perlakuan dengan Fosfin secara berulang-ulang relatif tidak meninggalkan residu pada komoditas, sehingga relatif aman terhadap komoditas yang difumigasi. Berdasarkan ketentuan Codex Alimentarius, batas residu untuk fosfin yang diperbolehkan pada biji-bijian belum diolah adalah 0,1mg/kg dan 0,01mg/kg pada biji-bijian yang telah diolah. Selain itu, penggunaan fosfin banyak dipersyaratkan oleh negara-negara tertentu karena ion fosfin diketahui sebagai zat yang tidak menimbulkan kerusakan pada lapisan ozon.
Fumigasi fosfin harus memperhatikan sifat fisik dan sifat kimianya, untuk itu yang perlu diperhatikan sebelum pelaksanaan fumigasi dengan fosfin adalah ketersedian waktu yang cukup untuk pelaksanaan fumigasi, kandungan air komoditas yang akan difumigasi, jenis komoditas, dan jenis organisme pengganggu tumbuhan yang menjadi sasaran fumigasi. Penggunaan fosfin dihindari apabila suhu berada di bawah 10ºC karena pada suhu tersebut serangga tidak aktif, pada konsentrasi di atas 1.8% volume di udara atau 25 g/m3 pada tekanan udara normal mudah meledak, pada temperatur di atas 100°C (212°F) mudah terbakar dengan sendirinya, komoditas memiliki kandungan air yang tinggi dan komoditas yang mengandung emas, perak dan tembaga.
Menurut Barantan (2013), fosfin adalah fumigan yang sangat beracun terhadap manusia, keracunan fosfin dapat berakibat kematian bagi manusia. Pengaruh dari paparan gas tergantung pada konsentrasi gas, lama waktu papar dan seringnya terkena paparan. Efek yang langsung membahayakan terhadap manusia terjadi apabila setelah fosfin terpapar dengan konsentrasi 2.8 g/m3 dapat mematikan manusia dalam beberapa menit. Apabila fosfin terpapar dengan konsentrasi lebih dari 0.5g/m3 selama 30-60 menit dapat mengakibatkan efek yang sama. Akan tetapi, pengaruh tidak langsung dapat berakibat fatal apabila fosfin dalam konsentrasi rendah terhisap oleh manusia secara terus menerus.
11
difumigasi. Namun, penggunaan fosfin padat membutuhkan waktu lebih lama dan tidak dapat digunakan pada semua komoditas, hal ini karena sifat fosfin yang sangat mudah terbakar (flammable). Sementara itu, fosfin formulasi cair mulai dikembangkan untuk menutupi kekurangan dari fosfin formulasi padat agar dapat digunakan untuk banyak komoditas.
Menurut Barantan (2013), fosfin memiliki sifat fisik dan sifat kimia seperti yang disajikan pada tabel 1.
Tabel 1 Sifat fisik dan sifat kimia fosfin
No Deskripsi Fosfin
9 Kelarutan dalam air Sangat larut
10 Efek pada serangga
Aplikasi fumigasi dengan menggunakan fosfin formulasi cair harus memperhatikan sifat-sifat fisik dan kimia yang dimilikinya. Faktor lain yang harus diperhatikan adalah keamanan selama berlangsungnya kegiatan fumigasi. Fosfin formulasi cair umumnya berasal dari senyawa PH3 sebanyak 2% dan CO2
Strategi Pengendalian T. parvispinus
Pengendalian T. parvispinus di lapangan dapat dilakukan dengan beberapa teknik pengendalian seperti pengendalian secara kimia dengan menggunakan insektisida, secara hayati dan pengendalian secara terpadu. Menurut Lewis (1973) thrips semula cukup rentan terhadap jenis insektisida sintetik namun akibat penggunaan insektisida yang berlebih membuat thrips menjadi lebih tahan (resisten). Pengendalian hayati yang telah dilakukan adalah dengan penggunaan mikroorganisme Beauveria bassiana dan Verticilium lecani (Hadisoeganda 1997), penggunaan tungau predator Amblyseius cucumeris (Prabaningrum dan Sastrosiwojo 1997) dan penggunaan predator kumbang Coccinella transversalis dan Menochilus sexmaculatus yang merupakan predator yang sangat baik memangsa nimfa dan imago T. parvispinus (Pracaya 2011)
Pengendalian yang dilakukan pada produk pasca panen bunga potong terhadap thrips adalah melalui karantina untuk mencegah terbawanya thrips ketika komoditas bunga potong krisan ini akan diperdagangkan antar negara. Tindakan karantina yang dilakukan adalah dengan memberikan perlakuan terhadap bunga potong krisan. Perlakuan yang biasa digunakan di antaranya adalah dengan perlakuan fumigasi. Menurut Barantan (2013) fumigasi merupakan suatu tindakan atau perlakuan terhadap media pembawa OPT menggunakan fumigan dalam ruangan kedap udara pada suhu dan waktu tertentu dapat membunuh OPT. Fumigan yang banyak digunakan saat ini adalah metil bromida (MB), fosfin padat dan etil format.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Entomologi dan Gedung Workshop Fumigasi dan X-Ray di Balai Uji Terap Teknik dan Metoda Karantina Pertanian, Bekasi dari bulan November 2013 hingga Juni 2014.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah fumigan fosfin cair (ECO2FUME® ; CYTEC Australia), bunga potong krisan, imago T. parvispinus,
buncis, polen, madu, tissue, disposable masker dan kertas label. Alat-alat yang digunakan meliputi nozzle gun, selang penyalur, selang monitor, alat ukur deteksi kebocoran gas (Dräger Pac 7000) , alat ukur konsentrasi gas (Dräger X-am 7000), SCBA (self contained breathing apparatus) (Dräger), kipas angin, timbangan digital, kotak fumigasi kedap udara, mikroskop stereo, mikroskop compound, thermometer, hand counter, dissecting set, kotak perbanyakan serangga, nampan plastik, tabung plastik dan kuas.
Metode Penelitian
Penelitian dilaksanakan dalam 5 tahap, yaitu: (1) Koleksi dan identifikasi serangga uji; (2) Perbanyakan (rearing) T. parvispinus; (3) Uji pendahuluan dengan 2 tahap untuk menentukan batasan kisaran waktu dan konsentrasi yang diperlukan dalam fumigasi fosfin cair terhadap T. parvispinus; (4) Uji lanjut aplikasi fosfin cair dengan beberapa konsentrasi dan waktu papar tertentu terhadap T. parvispinus dan (5) Uji validasi konsentrasi dan waktu papar yang paling efektif dan pengaruhnya terhadap kualitas bunga potong krisan.
Koleksi dan Identifikasi Serangga Uji
Perbanyakan dilakukan dengan cara mengumpulkan thrips yang terdapat pada tanaman krisan dan bunga potong krisan di lapangan, dengan cara mengambil daun dan bunga yang terserang thrips kemudian dikumpulkan dalam suatu wadah untuk dibawa ke laboratorium. Selanjutnya dilakukan identifikasi terhadap thrips yang didapatkan untuk memastikan bahwa serangga yang akan diuji adalah T. parvispinus. Identifikasi dilakukan berdasarkan kunci yang dibuat oleh Sartiami dan Mound (2013).
Perbanyakan T. parvispinus
perbanyakan ditempatkan polen, madu, gulungan kapas basah dan pakan berupa buncis. Selain itu ditempatkan juga kertas saring yang ditutup dengan ram kawat sebagai tempat untuk menyimpan buncis. Pada setiap kotak perbanyakan ditempatkan sebanyak 60 thrips betina dan 10 thrips jantan dan dibiarkan kawin untuk menghasilkan telur, nimfa, pupa dan imago.
Gambar 4 Kotak perbanyakan T. parvispinus a. Diagram kotak perbanyakan tampak samping b. Diagram kotak perbanyakan tampak atas c. Kotak perbanyakan tampak samping d. Kotak perbanyakan tampak atas
(Helen dan Glenys 2009)
Keterangan : c = buncis, cw = clingwrap, h = madu, m = ram kawat, p = pollen, pc = vial berisi kapas basah, pt = kertas saring, rb = perekat, s = jendela dengan lapisan kain, w = gulungan kapas basah.
Pelaksanaan fumigasi fosfin cair
Tahap awal dalam pelaksanaan fumigasi adalah proses persiapan yang meliputi penyiapan serangga uji dan pemeriksaan alat keselamatan fumigasi, alat ukur konsentrasi gas, dan alat deteksi kebocoran. Bagan tata letak susunan pemasangan alat fumigasi disajikan pada gambar 5. Setelah siap, dilakukan penghitungan dosis atau jumlah fumigan yang digunakan untuk masing-masing konsentrasi. Menurut Barantan (2013) dosis dan konsentrasi dari fosfin cair dapat dihitung dengan menggunakan rumus sebagai berikut :
Dosis (kg) =
14.000
(ppm) perlakuan i
konsentras x
) (m fumigasi kotak
15
dengan menggunakan rumus tersebut akan didapatkan dosis yang dibutuhkan untuk mendapatkan konsentrasi sesuai dengan perlakuan yang diinginkan, dimana 1 gram fosfin setara dengan 700 ppm.
Gambar 5 Bagan tata letak susunan pemasangan alat fumigasi
(a) kotak fumigasi kedap gas; (b) wadah berisi T. parvispinus dan buncis sebagai pakan; (c) selang monitor; (d) alat ukur konsentrasi; (e) tabung berisi fosfin cair; (f) selang penyalur gas; (g) alat deteksi kebocoran; dan (h) nozzle gun
Proses pelepasan gas (gassing) untuk setiap perlakuan dilakukan sesuai dengan konsentrasi yang diinginkan. Pelepasan gas dilakukan melalui selang penyalur pada tabung fosfin cair yang di bagian ujungnya dipasang nozzle gun untuk pengeluaran fosfin cair dalam jumlah yang diinginkan (gambar 6a). Selanjutnya dilakukan pengukuran konsentrasi fosfin dalam ruang fumigasi menggunakan alat ukur konsentrasi gas fosfin yang dihubungkan ke selang monitor (gambar 6b).
Fumigasi berlangsung setelah pelepasan gas dilakuan sesuai dengan waktu papar yang diinginkan, kemudian dilanjutkan dengan pengukuran konsentrasi akhir menggunakan alat ukur konsentrasi gas fosfin. Bila konsentrasi mengalami penurunan artinya terjadi kebocoran dalam proses fumigasi sehingga harus dilakukan pengulangan, namun jika konsentrasi fosfin cair yang diukur konstan maka fumigasi dinyatakan berhasil (gambar 6c).
Pada tahap akhir dilakukan proses pembebasan fumigan (aerasi) dari kotak fumigasi yang bertujuan untuk membuang sisa fumigan di dalam kotak fumigasi sampai ambang batas aman (Threshold Limit Value / TLV). Batas aman tercapai
75cm x 75cm x 75cm
15cm x 14cm x 7.5cm
Tinggi : 146cm Diameter : 22cm
bila konsentrasi di dalam kotak fumigasi dibawah 0.3 ppm. Dalam melakukan aerasi harus menggunakan alat keselamatan diri sesuai standar (gambar 6d).
Gambar 6 Tahap urutan pelaksanaan perlakuan fumigasi a. Pelepasan gas (gassing);
b. Pengamatan konsentrasi awal; c. Pengamatan konsentrasi akhir;
d. Proses pembuangan gas fosfin (aerasi)
Uji Pendahuluan
Uji pendahuluan dilakukan dalam 2 tahap untuk menentukan kisaran waktu papar minimal yang diperlukan dalam pelaksanaan perlakuan fumigasi dengan kombinasi konsentrasi fosfin cair. Pada tahap pertama konsentrasi fosfin cair yang digunakan terdiri dari 5 taraf konsentrasi yaitu 0, 200, 250, 300, dan 350 ppm dengan waktu papar 1, 3, 6, 9, 12, 15, dan 18 jam dengan 3 ulangan. Serangga uji yang digunakan sebanyak 25 ekor imago T. parvispinus pada setiap perlakuan. Pengamatan dilakukan terhadap mortalitas T. parvispinus pada 1 jam setelah waktu papar untuk tiap perlakuan.
17
Uji Lanjut Aplikasi Fosfin Cair pada T. parvispinus
Uji lanjut dilakukan terhadap imago T. parvispinus yang dilakukan pada wadah plastik dan kotak fumigasi yang sama pada uji pendahuluan. Pada uji lanjut dilakukan 3 perlakuan waktu papar (1, 3, dan 6 jam) dan 9 perlakuan konsentrasi fosfin cair (200, 175, 150, 125, 100, 75, 50, 25, dan 0 ppm). Tiap perlakuan diulang 3 kali di tiap gelas plastik yang diisi 25 ekor imago T. parvispinus.
Seluruh tahapan pengujian baik uji pendahuluan maupun uji lanjut dilakukan pada wadah plastik yang berisi buncis sebagai pakan dan ditempatkan dalam kotak fumigasi (fumigation chamber) dengan ukuran 0.75m x 0.75m x 0.75m.
Uji Validasi dan Pengaruh pada Bunga Potong Krisan
Uji validasi dilakukan pada kombinasi waktu papar dan konsentrasi dengan hasil terbaik pada uji lanjut dan ditambah 1 perlakuan konsentrasi di atasnya untuk memperkirakan kemungkinan adanya penyerapan gas fosfin cair oleh bunga potong. Pada uji validasi dan pengaruh terhadap kualitas bunga potong ini dilakukan 4 perlakuan konsentrasi (250, 200, 175, dan 0 ppm) pada 3 waktu papar (1, 3, dan 6 jam) dengan 3 ulangan. Perlakuan diujikan pada masing-masing 1 ikat bunga potong krisan (terdiri dari 10 bunga potong) dan pada setiap ikat bunga diinfestasikan 25 ekor imago T. parvispinus. Bunga potong ditempatkan pada kotak kertas yang ditutup kain kassa. Setelah aplikasi fosfin cair, dilakukan pengamatan terhadap mortalitas T. parvispinus dan kualitas bunga potong krisan. Bunga potong yang telah difumigasi ditempatkan dalam ember yang berisi air dan pengamatan dilakukan pada 1, 24, 48, dan 72 jam setelah perlakuan (JSP) untuk penurunan kualitas bunga khususnya layu dan bercak. Pengamatan dilakukan secara visual dengan teknik skoring. Skor kerusakan bunga diamati pada bagian yang layu dan terdapat bercak berdasarkan Smith (1989), sebagai berikut:
0 = tidak terjadi kerusakan ( bunga sehat) 1 = kerusakan 1- 25 % (bunga layu sebagian)
2 = kerusakan 26 - 50 % ( bunga layu sebagian hingga setengahnya) 3 = kerusakan 51 - 75 % (bunga layu hampir seluruhnya)
4 = kerusakan 76 - 100 % (bunga layu seluruhnya hingga mati)
Analisis Data
Hasil
Koleksi dan Identifikasi Serangga Uji
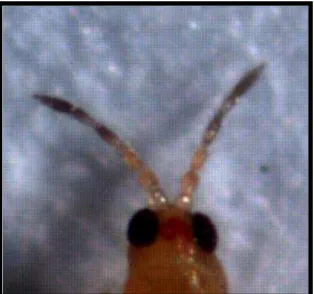
Serangga uji dari lapangan yang diidentifikasi memiliki ciri morfologi yang sama berdasarkan Sartiami dan Mound (2013). Menurut kunci identifikasi, thrips ini termasuk ordo Thysanoptera famili Thripidae yang merupakan spesies Thrips parvispinus. Serangga dewasa berukuran sangat kecil, dengan panjang tubuh lebih kurang 1 mm, bewarna kuning pucat hingga coklat kehitaman, bagian kepala dan thoraks terlihat lebih pucat dibandingkan dengan abdomen, abdomen berbentuk kerucut dan berwarna gelap (gambar 7).
Gambar 7 Imago T. parvispinus pada perbesaran 40 kali
T. parvispinus memiliki antena yang terdiri atas 7 segmen dimana pada ruas kedua dan ketiga terdapat organ sensori yang berbentuk kerucut bercabang seperti garpu (gambar 8). Pada bagian kepala terlihat mata majemuk yang berukuran besar dan oseli yang memiliki pigmen berwarna merah. Tidak memiliki seta oseli 1 dan seta oseli 2 lebih pendek daripada seta oseli 3. Seta oseli 3 terdapat di bagian pinggir bagian depan segitiga oseli (gambar 9). Alat mulut terdiri atas satu mandibel bagian kiri sementara mandibel bagian kanan tereduksi, sepasang maksila yang berkembang dengan baik, labrum di depan dan labium di belakangnya.
19
Gambar 9 Kepala T. parvispinus pada perbesaran 40 kali
Pada bagian toraks, terdapat 2 pasang seta posteroangular yang panjang dan 3 pasang seta posteromarginal. Metanotum memiliki pola retikulasi seperti kotak yang berukuran sama, tidak terdapat sensila kampaniform dan memiliki mesofurka dengan spinula. Sayap thrips berumbai dengan warna gelap agak transparan, memiliki panjang sayap lebih dari setengah panjang abdomen. Pada sayap depan venasi pertama dan kedua terdapat deretan seta yang lengkap. Sayap T. parvispinus (gambar 10).
Gambar 10 Sayap T. parvispinus pada perbesaran 200 kali
Abdomen terdiri dari 11 segmen, pada tergit 8 tidak terdapat comb (deretan mikrotrikhia). Pada bagian sisi tergit 5 sampai 8 terdapat ctenidia dan pada tergit 8 ctenidia terletak di belakang spirakel (gambar 11).
Uji Pendahuluan
Perlakuan fosfin cair pada uji pendahuluan tahap pertama menunjukkan bahwa semua serangga uji mengalami kematian sebesar 100% pada seluruh perlakuan (Lampiran 1). Untuk itu pada uji pendahuluan tahap kedua ditentukan waktu papar yang tercepat yaitu 1 jam dengan konsentrasi yang lebih rendah dari 200 ppm. Hasil pengujian pada tahap kedua disajikan pada tabel 2.
Tabel 2 Persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 1 jam
Rata-rata persentase mortalitas T. parvispinus. Rata-rata persentase mortalitas yang diikuti oleh huruf yang sama menunjukan tidak berbeda nyata berdasarkan uji tukey taraf 5%
Sementara itu nilai penduga parameter toksisitas fosfin cair disajikan pada tabel 3.
Uji Lanjut Perlakuan Fumigasi Fosfin Cair pada T. parvispinus
Hasil uji lanjut menunjukkan persentase mortalitas tertinggi aplikasi fosfin cair terjadi pada perlakuan dengan konsentrasi 200 ppm pada semua waktu papar dan pada konsentrasi 175 ppm pada waktu papar 6 jam (tabel 4). Nilai penduga parameter toksisitas LC50 dan LC95 terendah ditunjukan pada waktu papar 6 jam
21
Tabel 4 Persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 1, 3, dan 6 jam
Konsentrasi
Rata-rata persentase mortalitas T. parvispinus. Rata-rata persentase mortalitas yang diikuti oleh huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji tukey
Uji Validasi dan Pengaruh pada Bunga Potong Krisan
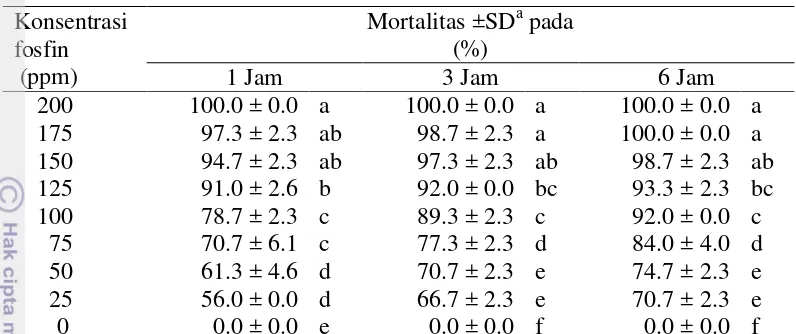
Uji validasi dilakukan untuk konfirmasi keefektifan konsentrasi perlakuan fosfin cair dan kualitas bunga potong krisan. Persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair pada bunga krisan dengan waktu papar 1, 3, dan 6 jam disajikan pada tabel 6.
Tabel 6 Persentase mortalitas T. parvispinus pada perlakuan beberapa konsentrasi fosfin cair yang dipaparkan 1, 3, dan 6 jam pada bunga krisan
Rata-rata persentase mortalitas T. parvispinus. Rata-rata persentase mortalitas yang diikuti oleh huruf yang sama pada kolom yang sama menunjukan tidak berbeda nyata berdasarkan uji tukey taraf 5%
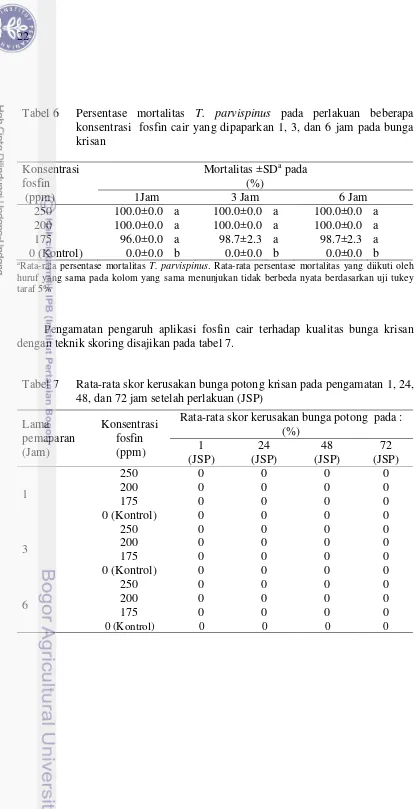
Pengamatan pengaruh aplikasi fosfin cair terhadap kualitas bunga krisan dengan teknik skoring disajikan pada tabel 7.
Tabel 7 Rata-rata skor kerusakan bunga potong krisan pada pengamatan 1, 24, 48, dan 72 jam setelah perlakuan (JSP)
23
Gambar 8 Penampilan bunga potong krisan setelah pemaparan 1 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d). 72 JSP (JSP : jam setelah perlakuan)
Gambar 9 Penampilan bunga potong krisan setelah pemaparan 3 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d). 72 JSP (JSP : jam setelah perlakuan)
1 Jam Setelah Perlakuan 24 Jam Setelah Perlakuan
48 Jam Setelah Perlakuan
48 Jam Setelah Perlakuan
72 Jam Setelah Perlakuan
72 Jam Setelah Perlakuan
1 Jam Setelah Perlakuan 24 Jam Setelah Perlakuan
48 Jam Setelah Perlakuan
48 Jam Setelah Perlakuan
72 Jam Setelah Perlakuan
Gambar 10 Penampilan bunga potong krisan setelah pemaparan 6 jam fosin cair pada pengamatan (a). 1 JSP, (b). 24 JSP, (c.) 48 JSP, dan (d). 72 JSP (JSP : jam setelah perlakuan)
Pembahasan
Perbanyakan T. parvispinus
T. parvispinus meletakan telur pada buncis yang digunakan sebagai inang alternatif. Nimfa T. parvispinus instar 1 dan instar 2 bergerak aktif kemudian nimfa instar 3 dan 4 tidak aktif dan berperilaku seperti prapupa dan pupa pada serangga yang mengalami metamorfosis holometabola. Imago memiliki sayap berumbai yang digunakan untuk terbang jarak pendek atau meloncat. Selain itu imago T. parvispinus menunjukkan perilaku selalu mendekati sumber cahaya.
Thrips menghisap cairan buncis untuk memenuhi kebutuhan makanan, jaringan yang dihisap menjadi kosong dan diisi oleh udara yang menyebabkan perubahan warna pada buncis hingga berubah warna jadi kuning kecoklatan (Adiarto 2003). Sementara pada bunga, bagian yang terserang menjadi layu, mengering, dan rontok, ini disebabkan thrips berada pada putik untuk menghisap cairan yang kaya karbohidrat dari tangkai bunga yang berperan untuk pembentukan kelopak dan polen.
Menurut Mound dan Masumoto (2005) fase telur berkisar 3-7 hari, nimfa (2-4 hari), pra pupa dan pupa (2-3 hari), dan imago (20-25 hari), sementara hasil pada pengamatan fase telur berkisar 3-5 hari, nimfa (2-4 hari), pra pupa dan pupa (3-4 hari), dan imago (16-20 hari). Hal ini menunjukkan bahwa pada saat proses pemeliharaan T. parvispinus sesuai dengan keadaan untuk perkembangan T. parvispinus bagi kelangsungan hidupnya seperti suhu, kelembaban, dan ketersediaan sumber makanan.
1 Jam Setelah Perlakuan 24 Jam Setelah Perlakuan
48 Jam Setelah Perlakuan 72 Jam Setelah Perlakuan
25
Menurut Dibyantoro (1994) Thrips tabaci berkembang biak dengan cepat pada kelembaban 70% dan kisaran suhu 27-32oC. Pada kondisi tersebut akan memicu produksi hormon seks mereka sehingga terjadi perkawinan masal. Pada penelitian ini kelembaban berkisar 70-80% dan kisaran suhu 26-32 oC, sehingga sangat mendukung dalam perbanyakan T. parvispinus. Pada musim kemarau, perkembangan telur sampai dewasa 13–15 hari dan fase imago berkisar 15–20 hari, bila suhu di sekitar tanaman meningkat maka trips akan berkembang dengan lebih cepat.
Aplikasi Fosfin Cair terhadap T. parvispinus
Uji pendahuluan menggunakan 5 konsentrasi, menunjukkan mortalitas pada semua konsentrasi sebesar 100% kecuali pada kontrol yang menunjukan mortalitas 0%. Menurut Liu (2008) perlakuan fumigasi diatas 250 ppm dengan lama waktu diatas 18 jam pada suhu 2ºC efektif dalam mengendalikan F. occidentalis. Pada penelitian ini perlakuan konsentrasi terendah dalam waktu papar 1 jam telah menyebabkan mortalitas sebesar 100%. Respon thrips terhadap fosfin sangat rentan dibandingkan dengan beberapa serangga lain seperti aphid dan larva lepidoptera pada suhu diatas 24ºC (Karunatratne et al. 1997). Hasil pengujian ini dilanjutkan dengan uji pendahuluan tahap dua untuk mencari kisaran waktu papar dan konsentrasi yang akan digunakan pada uji lanjut yang akan dilakukan pada waktu papar 1 jam dengan konsentrasi dibawah 200 ppm.
Hasil uji pendahuluan tahap 2 menunjukan, pada konsentrasi antara 25 - 175 ppm dengan waktu papar 1 jam tidak ada perlakuan yang menunjukan persentase mortalitas sebesar 100%. Hal ini kemungkinan diakibatkan kurang lamanya waktu papar fumigasi atau kurang tingginya konsentrasi yang digunakan. Persentase mortalitas pada uji pendahuluan menunjukan rentang yang lebar antar perlakuan, untuk itu rentang interval konsentrasi antar perlakuannya dapat diperkecil. Kenaikan konsentrasi ternyata secara signifikan meyebabkan peningkatan persentase mortalitas.
Pada hasil uji lanjut dengan kombinasi 3 waktu papar (1, 3, dan 6 jam) dengan 9 konsentrasi (200, 175, 150, 125, 100, 75, 50, 25, 0 ppm) pada suhu berkisar 26-32º C, terlihat bahwa dengan adanya peningkatan konsentrasi fosfin cair akan meningkatkan mortalitas thrips dan dengan bertambahnya lama waktu papar juga meningkatkan mortalitas thrips. Perlakuan pada konsentrasi terendah (25 ppm) pada lama waktu 1, 3, dan 6 jam terjadi peningkatan mortalitas jadi 56%, 3 jam sebesar 66.67% dan pada 6 jam sebesar 70.67%. Hal ini juga terjadi pada perlakuan lainnya. Mortalitas sebesar 100% ditunjukan pada konsentrasi 200 ppm pada waktu papar 1, 3, dan 6 jam dan 175 ppm pada waktu papar 6 jam. Selain faktor konsentrasi dan waktu papar, faktor lain yang berpengaruh adalah suhu, pada suhu tinggi dapat meningkatkan mortalitas, akibat semakin aktifnya pergerakan serangga yang menyebabkan pernafasan serangga menjadi lebih cepat sehingga lebih banyak menghirup fosfin cair.
Pengaruh waktu papar memiliki dampak terhadap toksisitas fosfin cair, ini diperlihatkan dari nilai LC50 dan LC95, semakin lama waktu papar nilai LC yang
ditunjukan lebih rendah dibandingkan dengan waktu papar yang lebih pendek. Nilai LC50 untuk masing-masing waktu papar 1, 3, dan 6 jam berturut-turut adalah
jam membutuhkan konsentrasi lebih tinggi yaitu 29.134 ppm, sehingga ada keterkaitan antara waktu papar dan konsentrasi. Menurut Hole et.al. (1976) fumigasi menggunakan fosfin dengan konsentrasi rendah pada waktu papar lebih lama akan lebih efektif dibandingkan dengan konsentrasi fosfin yang tinggi pada waktu papar yang singkat. Penentuan konsentrasi fosfin bergantung pada berbagai faktor antara lain kondisi lingkungan, penyimpanan, lama perlakuan serta jenis serangga utama yang dikendalikan (TDRI 1983).
Pada uji validasi, aplikasi konsentrasi 200 ppm dengan waktu papar 1 jam menunjukan kematian 100% dan tidak berdampak pada kualitas bunga potong krisan. Persentase rata-rata kerusakan yang diamati terhadap tingkat layu dan bercak pada bunga (tabel 7) baik itu 1, 24, 48, dan 72 JSP, tidak menunjukan penurunan kualitas seperti layu dan timbul bercak bila dibandingkan dengan kontrol (Gambar 8, 9, dan 10).
Fumigan fosfin cair merupakan insektisida yang tergolong kedalam racun pernapasan. Fumigan merupakan insektisida yang mudah menguap menjadi gas dan masuk kedalam tubuh serangga melalui sistem pernapasan (sistem trakea) yang kemudian diedarkan keseluruh tubuh (Untung 1993). Menurut Tarumingkeng (1992) insektisida yang mempengaruhi sistem pernapasan serangga berperan menghambat enzim pernapasan berupa penghambatan sistem transpor elektron dan fosforilasi oksidatif.
Cara kerja fosfin di dalam tubuh serangga terjadi dengan pembukaan spirakel yang mengakibatkan hilangnya air pada tubuh serangga sehingga terjadi dehidrasi yang menybabkan kematian pada T. parvispinus (Valmas et al. 2008). Selain itu menurut Wirawan (2006) fosfin akan menghambat terbentuknya adenosin trifosfat (ATP) yang merupakan sumber energi bagi serangga dan penghambatan kerja enzim suksinat dehidrogenase yang mengakibat perubahan alur reaksi metabolisme. Proses pembentukan ATP terjadi melalui proses respirasi yang salah satu fasenya adalah transport elektron, apabila fase ini terhambat pembentukan ATP menjadi terganggu, sementara fumigan akan terikat pada sitokrom yang terdapat pada mitokondria dan mengganggu proses transport elektron sehingga serangga akan mati kehabisan energi.
Menurut Barantan (2013) cara kerja dari fosfin cair yaitu adanya efek sinergis dengan CO2 ketika digunakan bersama dengan fosfin dan juga sifat
stabilitas dari konsentrasi fosfin cair lebih mudah dipertahankan selama fumigasi jika dibandingkan dengan fosfin padat. CO2 mampu meningkatkan pernapasan
serangga sehingga spirakel akan terbuka ketika bernapas yang akan mempercepat serangga dalam mengambil konsentrasi yang mematikan dari fosfin cair. Hal ini menyebabkan penggunaan fosfin cair lebih efesien untuk mencapai hasil yang diinginkan dan waktu papar aplikasi fosfin cair dapat dipersingkat.
27
Suhu saat aplikasi fosfin cair berkisar antara 26-32ºC, pada suhu tersebut menyebabkan waktu papar yang diperlukan untuk aplikasi fosfin cair menjadi lebih cepat. Pada suhu tinggi waktu papar untuk aplikasi fosfin cair lebih cepat karena menyebabkan aktivitas serangga meningkat dibandingkan pada suhu rendah. Ketika aktivitas meningkat maka proses respirasi yang terjadi menjadi lebih cepat dan gas fosfin cair yang terhirup jadi lebih banyak sehingga mempercepat mortalitas, hal ini sesuai dengan hasil penelitian Song et al. (2011) yang menyebutkan kondisi optimal untuk fumigasi fosfin cair yaitu pada suhu ≥ 26ºC.
Kualitas bunga setelah perlakuan tampak normal, karena fosfin cair yang digunakan merupakan campuran 2% fosfin dan 98% CO2 dimana CO2 dibutuhkan
oleh tanaman dalam fotosintesis atau asimilasi karbon. Konsentrasi gas CO2 yang
tinggi dapat memperpanjang masa simpan dengan cara menghambat proses respirasi (Salunkhe et al. 1990). Pada bunga potong, etilen dapat merangsang gugurnya kuncup bunga, sementara CO2 berefek antagonis terhadap etilen (Wills
et al. 1989). Sementara perlakuan pada buah, CO2 berpengaruh terhadap sintesa
etilen yang dibutuhkan dalam proses pematangan buah. Konsentrasi CO2 yang
Simpulan
Aplikasi fosfin cair terhadap imago T. parvispinus pada bunga potong krisan efektif dilakukan pada konsentrasi 200 ppm dengan waktu papar 1 jam yang menyebabkan mortalitas sebesar 100%. Pada konsentrasi dan waktu tersebut tidak memberikan pengaruh negatif terhadap kualitas bunga potong krisan.
Saran
DAFTAR PUSTAKA
Adiarto BK. 2003. Eksplorasi, Identifikasi dan Evaluasi Potensi Musuh-musuh Alami Thrips. Balai Penelitian Tanaman Sayuran Lembang.
Ananthakrisnan TN. 1993. Bionomics of thrips. Annual Review Entomology. 38:71-92.
Anderson M, Edmund P, Mellor HE, Walbak MH. 1992. The Role of The Olfactory System of Three Crop Pests : Aphids, Whitefly and Thrips in The Detection of Semichemicals. Briton Crop Protection.
[Balithi] Balai Penelitian Tanaman Hias. 2000. Deskripsi Klon-Klon Unggul Krisan Tipe Spray dan Standar. Balai Penelitian Tanaman Hias. Jakarta.
[Barantan] Badan Karantina Pertanian. 2013. Keputusan Kepala Badan Karantina Pertanian Nomor 1645 Tahun 2003 tentang Standar Teknis Fosfin Formulasi Cair. Jakarta (ID) DEPTAN.
Berger D, Walters R, Gotthard K. 2008. What limits insect fecundity, body size and temperature dependent egg maturation and oviposition in a butterfly. Funct Ecol. 22:523-529.
Bond EJ, Robinson JR, Buckland CT. 1969. The toxic action of phosphine. Journal of Stored Product 5: 289-298.
[BPS] Badan Pusat Statistik. 2013. Analisa Komoditi Ekspor 2007-2012 Sektor Pertanian, Industri dan Pembangunan. Jakarta.
Chaudry MQ. 1997. A review of the mechanism involved in the action of phosphine as an insecticide and phosphine resistance in stored-product insect. Pesticide Science. 49: 213-228.
Desmarchelier JM. 1999. Ethyl formate and formic acid : occurance and environmentalfate. Postharvest News. 10: 7-12.
Dibyantoro ALH. 1994. Management of Thrips tabaci Lind with special reference on garlic (A. sativum L.). PhD. 3 rd-Year Report. University of Newcastle. UK. P: 23-25.
Deligeogirdis PN, Ipsilandis CG, Vaiopoulou M, Petkou D, Simoupoulus E. 2006. Evaluation of the damage caused by Frankliniella occidentalis (Pergande) (Thysanoptera: Tripidae) on cucumber leaves (Cucumis sativus). Journal Entomology. 3(1):1-8.
Dethier VG. 1982. Mechanism of host plant recognition. Entomologia Experimentalis Applicata. 31:49-56.
Dreistadt SH, Clark JK and Flint ML. 2004. Pests of Landscape Trees and Shrubs: An Integrated Pest Management Guide. Oakland University of California. Agriculture National Research. Publ. 3359.
Hadisoeganda WW. 1997. Peranan pestisida biorasional dalam sistem pertanian berkelanjutan. Balai Penelitian Tanaman Sayuran.
Harein PK, Davis R. 1992. Controlled of Stored Grain Insects. American Associationof Cereal Chemists, Inc., St Paul, Minnesota.
Harry NR. 1994. Usaha Tani Bunga Potong. Badan Penelitian dan Pengembangan Pertanian. Jakarta.
Hasim I, Reza M. 1995. Krisan. Penebar Swadaya. Jakarta
Helen ED, Glenys MW. 2009. An improved method for rearing western flower thrips Frankliniella occidentalis. Florida Entomologist 92(4).
Hole BD, Bell CH, Mills KA, Goodship G. 1976. The toxicity of phosphin to all developmental stages of thirteen species of stored product beetles. Journal Stored Product Res 12: 235-244.
Horn F, Horn P, Sullivan J. 2005. Current practice in fresh fruit fumigation with phosphine in Chile. In Proceedings of 2005 Annual Research Conference on Methyl Bromide Alternatives and Emission Reductions. San Diego. CA.
Karunaratne C, Moore GA, Jones R, Ryan R. 1997. Phosphine and its effect on some common insects in cut flowers . Postharv. Biol. Technol. 10:255-262.
Kendall DM, Capinera JL. 1990. Geographic and temporal variation in the sex ration of onion thrips. Southwestern Entomol. 15:80-88.
Klose MJ, Sdoodee R, Teakle DS, Milne JR, Greber RS, Walter GH. 1996. Transmission of three strain of Tobacco streak ilarvirus by different thrips species using virus-infected pollen. J. Phytopathology 144:281-284.
31
Lewis T. 1973. Thrips: Their Biology Economic. and Economic Importance. London: Academic Press.
Liu YB. 2008. Low temperature phosphine fumigation for postharvest control of western flower thrips (Thysanopthera; Thripidae) on lettuce. broccoli. asparagus. and strawberry. Journal of Economic Entomology. Vol. 101. 6: 1786-1791.
Lu FM, Lee HS. 1987. The life history and seasonal occurance of onion Thrips. Journal Agriculture Research China. 36(1):118-124.
Maha M. 1997. Irradiasi sebagai salah satu alternatif untuk perlakuan karantina. Prosiding Seminar Teknik Pangan. Jakarta.
Mound LA, Morison GD, Pitkin BR, Palmer JM. 1976. Thysanopthera : Handbooks for Identification of British Insect. 1(11):79p.
Mound LA, Masumoto M. 2005. The genus Thrips (Thysanoptera. Thripidae) in Australia, New Caledonia and New Zealand. Zootaxa 1020: 1-64.
Park MG, Sung BK, Tumambing J. 2012. Effect of PH3 and CO2 mixture as a
quarantine fumigant in cut flowers. National Plant Quarantine Service (NPQS). Ministry for Food, Agriculture, Forestry, and Fisheries of Korea. South Korea.
Prabaningrum L, Moekasan TK. 2007. Identifikasi status hama pada budidaya paprika (Capsicum annum Var. Grossum) terhadap serangan Thrips parvispinus Karny (Thysanopthera: Tripidae) di Kabupaten Bandung, Jawa Barat. Jurnal Hortikultura 17(2); 161-167.
Prabaningrum L, Sastrosiswojo S. 1997. Kemampuan pemangsaan predator Amblyseius cucumeris terhadap Thrips parvispinus dan Polyphagotarsonemus latus pada tanaman cabai di laboratorium. Jurnal Hortikultura 7(2): 678-684.
Pracaya. 2011. Hama dan Penyakit Tanaman. Penebar Swadaya. Jakarta.
Pusat Karantina Tumbuhan. 2000. Laporan Pelatihan Fumigasi. Pusat Karantina Tumbuhan Ciawi. Bogor.
Reynaud P. 2010. Thrips (Thysanophtera) Chapter 13.1. BioRisk 4(2):767-791. France.
Salunkhe DK, Bhat NR, Desai BB. 1990. Postharvest Biotechnologhy of Flowers and Ornamental Plants. Springer-Verlag.