REKAYASA GENETIK
Nicotiana tabacum
KULTIVAR SR1
DENGAN GEN
Peroksidase (PerL)
DARI KEDELAI KULTIVAR
LUMUT
DESTIK WULANDARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Rekayasa Genetik Nicotiana tabacum Kultivar SR1 dengan Gen Peroksidase (PerL) dari Kedelai Kultivar Lumut adalah benar karya saya bersama dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
Destik Wulandari. Rekayasa Genetik Nicotiana tabacum Kultivar SR1 dengan Gen Peroksidase (PerL) dari Kedelai Kultivar Lumut. Dibimbing oleh UTUT WIDYASTUTI dan ARIS TJAHJOLEKSONO.
Peroksidase merupakan enzim golongan oksidoreduktase yang mengkatalis reaksi oksidasi reduksi. cDNA gen peroksidase (PerL) dari kedelai kultivar Lumut telah berhasil diisolasi dengan panjang 1100 pb. Kedelai kultivar Lumut menunjukkan ekspresi gen peroksidase ketika diberi cekaman pH 4+Al 1,6 mM. Peroksidase merubah H2O2, menjadi air dan oksigen ketika mengoksidasi sejumlah substrat. Tujuan dari penelitian ini adalah merakit vektor ekspresi gen PerL dan mengintroduksikannya ke dalam genom Nicotiana tabacum kultivar SR1 menggunakan Agrobacterium tumefaciens. cDNA gen PerL telah berhasil disisipkan dalam plasmid entry clone pENTRTM/D-TOPO®. cDNA gen PerL yang dibawa oleh plasmid pENTR-PerL telah berhasil disisipkan ke dalam vektor ekspresi pGWB502 dengan sistem gateway cloning. Verifikasi keberhasilan konstruksi plasmid overekspresi pGWB502-PerL dilakukan menggunakan PCR dengan primer 35S-F dan AtprxCb-R menghasilkan pita berukuran 1500 bp. Plasmid pGWB502-PerL telah berhasil diintroduksikan ke dalam A.tumefaciens LBA4404 menggunakan metode triparental mating (TPM) dengan bantuan plasmid penolong pRK2013. Keberhasilan introduksi plasmid pGWB502-PerL ke dalam A. tumefaciens dikonfirmasi menggunakan PCR dengan primer 35S-F dan AtprxCb-R menghasilkan pita berukuran 1500 bp. Transformasi genetik ke Nicotiana tabacum kultivar SR1 telah berhasil dilakukan dengan bantuan bakteri A. tumefaciens LBA4404 yang membawa plasmid rekombinan pGWB502-PerL. Transformasi genetik Nicotiana tabacum kultivar SR1 dilakukan menggunakan eksplan daun dengan teknik ko-kultivasi dan diseleksi pada media yang mengandung 30 mg/L higromisin. Integrasi gen PerL di dalam genom tumbuhan Nocotiana tabacum kultivar SR1 transgenik telah berhasil dikonfirmasi menggunakan PCR dengan primer spesifik 35SF dan AtprxCb-R menghasilkan pita berukuran 1500 bp.
SUMMARY
DESTIK WULANDARI Genetic Engineering of Nicotiana tabacum cultivar SR1 with Peroksidase (PerL) gene from soybean cultivar Lumut. Supervised by UTUT WIDIYASTUTI and ARIS TJAHJOLEKSONO.
Peroxidase is an oxidoreductase enzyme class that catalyze oxidation-reduction reactions. cDNA of Peroxsidase (PerL) gene from soybean cv Lumut has been isolated and contained 1100 bp. The aim of this research was to construct an overexpression vector of PerL gene and introduce the PerL gene into Nicotiana tabacum cultivar SR1 genome using Agrobacterium tumefaciens mediated transformation. Soybean cv Lumut showed the expression of peroxidase gene when given pH 4+Al 1,6 mM stresses. Peroxidases convert H2O2 into water and oxygen when the enzyme oxidizes a number of organic substrates PerL gene cDNA was successfully inserted in the entry clone pENTRTM /D-TOPO®. cDNA PerL gene that carried by pENTR-PerL plasmid has been successfully inserted into pGWB502 as a expression vector by using gateway cloning system. Verify the successfully of construction plasmid pGWB502-PerL as a overexpression plasmid performed by PCR using primers 35S-F and AtprxCb-R produces 1500 bp lenght nucleotides. Plasmid pGWB502-PerL overexpression plasmid has been successfully introduced into A.tumefaciens LBA4404 by triparental mating method (TPM) with using of a pRK2013 as a helper plasmid and verified with 35S-F and AtprxCb-R specific primery and produces 1500 bp lenght nucleotides. Genetic transformation of Nicotiana tabacum kultivar SR1 using A. tumefacuens LBA4404 carries pGWB502-PerL plasmid as a mediated transformation has been successfully. The genetic transformation of Nicotiana tabacum SR1 performed using leaf explants and with co-cultivation techniques then selected with medium containing 30 mg/L hygromycin. Integration of cDNA PerL genes in the genome of N.tabacum SR1 transgenic plants have been confirmed using PCR with specific primers 35SF and AtprxCb-R produces has 1500 bp lenght nucleotides.
Keywords: Agrobacterium tumefaciens-mediated transformation, Nicotiana tabacum cultivar SR1, Peroxidase (PerL) gene, pGWB502
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
REKAYASA GENETIK
Nicotiana tabacum
KULTIVAR
SR1 DENGAN GEN
Peroksidase (PerL)
DARI KEDELAI
KULTIVAR LUMUT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Rekayasa Genetik Nicotiana tabacum Kultivar SR1 dengan Gen Peroksidase (PerL) dari Kedelai Kultivar Lumut
Nama : Destik Wulandari NIM : G353120151
Disetujui oleh Komisi Pembimbing
Dr Ir Utut Widyastuti, MSi Ketua
Dr Ir Aris Tjahjoleksono, DEA Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2014-oktober 2014 ini ialah rekayasa genetik, dengan judul Rekayasa Genetik Nicotiana tabacum Kultivar SR1 dengan Gen Peroksidase (PerL) dari Kedelai Kultivar Lumut. Penelitian ini merupakan bagian dari kegiatan Hibah Penelitian Unggulan Perguruan tinggi DIKTI 2014 atas nama Dr Ir Utut Widyastuti, MSi dengan judul Perbaikan Genetik Tumbuhan Kedelai terhadap Cekaman Asam melalui Teknik DNA Rekombinan Gen Antioksidan GST (Glutathione S-Transferase) dan Per (Peroksidase), dengan nomor kontrak: 79/IT3.41.2/L1/SPK/2014 tanggal 28 Mei 2014.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Utut Widyastuti dan Bapak Dr Ir Aris Tjahjoleksono, DEA selaku pembimbing, dan Prof Dr Ir Suharsono, DEA selaku kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB yang telah mengijinkan penulis melakukan penelitian di PPSHB IPB. Terimakasih kepada Dr Diah Ratnadewi selaku dosen penguji luar komisi atas masukkan dan sarannya sehingga tulisan ini menjadi lebih baik. Terimakasih penulis ucapkan pula kepada Direktorat Jendral Pendidikan Tinggi yang telah memberikan Beasiswa Unggulan Calon Dosen. Terimakasih kepada Ibu Pepi Elvavina, Ibu Nia Dahniar dan Bapak Abdul Mulya selaku teknisi yang telah banyak membantu dalam penelitian ini. Ungkapan terimakasih penulis sampaikan untuk bapak, ibu, kakak, adik dan keluarga untuk semua doa dan semangat yang luar biasa dalam menyelesaikan tesis ini. Terimakasih juga penulis sampaikan kepada sahabat dan keluarga plant genetic and engineering 2012; Baso, Mas Rudi, Tiwi, Mbak Fajri dan Mbak Eva. Terimakasih kepada keluarga besar Laboratorium Biotechnology Research Indonesia-The Netherland (BIORIN), Laboratorium Biologi Molekuler dan Seluler Tumbuhan (BMST) PPSHB, dan keluarga besar Biologi Tumbuhan Departemen Biologi IPB 2012. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Peroksidase 2
Transformasi Genetik dengan Perantara Agrobacterium tumefaciens 3
Transformasi Genetik Nicotiana tabacum 4
METODE 5
Waktu dan Tempat Penelitian 5
Bahan Penelitian 5
Metode 6
HASIL DAN PEMBAHASAN 10
Introduksi cDNA Gen PerL ke dalam Entry Vector pENTRTM/D-TOPO® 10 Pengklonan cDNA gen PerL ke dalam Vektor Ekspresi pGWB502 11 Introduksi plasmid pGWB502-PerL ke dalam Agrobacterium tumefaciens
LBA4404 13
Transformasi Genetik Nicotiana tabacum Kultivar SR1 14
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR GAMBAR
1 Perbandingan daerah domain asam amino terkonservasi antara (1) PerL dan
(2) Per G. max l78163 dari Genebank (Amirullah 2008)
3
2 Peta plasmid pENTRTM/D-TOPO® dengan daerah overhang GTGG dan gen
penyandi ketahanan antibiotik kanamisin
7
3 Rekombinasi pada sistem gateway cloning antara situs attL1 dan attL2yang
mengapit gen PerL (plasmid pENTR-PerL) dengan situs attR1 dan attR2
yang mengapit daerah ccdB (plasmid pGWB502)
7
4 Hasil perbanyakan cDNA gen PerL menggunakan PCR dengan primer PerL
-pENTR-F dan AtprxCb-R
10
5 Hasil identifikasi koloni E. coli yang mengandung pENTR-PerL
menggunakan PCR dengan primer PerL pENTR-F dan AtprxCb-R
11
6 Peta konstruksi plasmid rekombinan pGWB502 yang membawa cDNA gen
PerL (pGWB502-PerL)
12
7 Hasil PCR koloni bakteri E.coli DHSα yang telah ditransformasi dengan
plasmid pGWB502-PerL
12 8 Hasil pemotongan plasmid pGWB502-PerL dengan enzim restriksi
Xba dan Sac1
12
9 Identifikasi DNA rekombinan menggunakan PCR koloni dengan primer
35SF dan AtprxCb-R
13
10 Pertumbuhan dan perkembangan N.tabacum kultivar SR1 hasil transforman. 14
11 Hasil amplifikasi DNA genom N. tabacum kultivar SR1 transgenik putatif
menggunakan primer spesifik 35SF dan AtprxCb-R.
15
DAFTAR LAMPIRAN
1 Alur konstruksi plasmid overekspresi pGWB502-PerL dan perakitan N.tabacum SR1 transgenik
PENDAHULUAN
Latar Belakang
Cekaman abiotik dan biotik yang dialami tumbuhan dapat meningkatkan konsentrasi reactive oxygen species (ROS) seperti radikal superoksida (O2-), hidrogen peroksida (H2O2) (Badawi et al. 2004). Radikal bebas dalam jumlah normal tidak berbahaya bagi tumbuhan karena berfungsi untuk keberlangsungan beberapa proses fisiologis pada tumbuhan. Radikal bebas yang berlebihan dapat berbahaya bagi tumbuhan karena dapat menyebabkan peroksidasi lipid dan merusak makromolekul seperti karbohidrat, protein dan DNA. Kerusakan makromolekul pada sel dapat menyebabkan kematian sel (Halliwel dan Gutteridge 1999; Apel dan Hirt 2004). Peroksidasi lipid dapat disebabkan oleh radikal superoksida, hidrogen peroksida dan radikal hidroksil. Salah satu senyawa radikal bebas adalah superoksida yang dapat dirubah menjadi hidrogen peroksida (H2O2). ROS dihasilkan dari rantai transport elektron pada kloroplas dan mitokondria. Selain itu, ROS juga dihasilkan pada proses fotorespirasi dan dari aktivitas enzim oksidase dan peroksidase pada dinding sel. Pada kloroplas, oksigen singlet dan superoksida dihasilkan pada saat fotosistem I dan II. Produk sampingan dari fotorespirasi yaitu glikolat dioksidasi oleh glikolat oksidase di dalam peroksisom menghasilkan hidrogen peroksidase. Selain dihasilkan di dalam organel sel, ROS juga dihasilkan pada membran sel, dinding sel dan apoplas.
Hidrogen peroksida berbahaya bagi organisme karena dapat menyebabkan kerusakan sel dengan cara memutus ikatan rantai protein, merusak membran lipid dan bereaksi dengan DNA sehingga menyebabkan terjadinya kerusakan pada sel (Sgherri dan Navari-Izzo 1995). Secara alamiah tumbuhan mempunyai mekanisme untuk menanggulangi pembentukan radikal bebas dan mekanisme untuk mempercepat degradasi senyawa tersebut. Salah satu mekanisme tersebut adalah dengan sistem pertahanan perventif yang bersifat enzimatis seperti enzim superoksida dismutase, katalase, dan glutation peroksidase (Fridovich 1975; Bowler et al. 1992; Apel dan Hirt 2004; Dong et al. 2008). Tumbuhan mempunyai mekanisme untuk mengontrol akumulasi senyawa ROS dengan melibatkan reaksi enzim peroksidase dan senyawa antioksidan (Niyogi 1999).
Peroksidase merupakan salah satu enzim golongan oksidoreduktase, yaitu enzim yang mengkatalis reaksi oksidasi-reduksi. Enzim peroksidase tersebar luas pada jaringan tumbuhan dan banyak terdapat pada peroksisom. Enzim ini berkaitan erat dengan sejumlah proses fisiologis yang meliputi lignifikasi, penyembuhan luka, oksidasi fenol dan patogen. Lignifikasi berperan secara alami untuk mekanisme pertahanan terhadap cekaman biotik dan abiotik (Ostergaard et al. 2000). Tingginya tingkat aktivitas peroksidase pada tumbuhan berhubungan erat dengan pertahanan tumbuhan terhadap cekaman abiotik seperti cekaman oksidatif (Hiraga et al. 2001).
2
termasuk dalam golongan secretory peroxidase kelas III pada tumbuhan diketahui mempunyai fungsi spesifik seperti menghilangkan hidrogen peroksida pada kloroplas dan sitosol, mengoksidasi senyawa toksik, berperan dalam biosintesis dinding sel, respon pertahanan akibat dari pelukaan, katabolisme indole acetic acid (IAA) dan biosintesis etilen (Welinder 1992). Pentingnya peranan peroksidase dalam mekanisme pertahanan tumbuhan terhadap cekaman abiotik menyebabkan peroksidase menjadi kandidat gen untuk merakit tumbuhan transgenik yang tahan terhadap cekaman abiotik.
Teknologi rekayasa genetika yang berkembang pesat memberikan harapan baru untuk memanipulasi tumbuhan sehingga diperoleh tumbuhan unggul yang tahan terhadap cekaman abiotik. Konstruksi plasmid dan metode transfer yang tepat merupakan salah satu faktor penentu keberhasilan perakitan tumbuhan transgenik. Metode transformasi menggunakan Agrobacterium tumefaciens sebagai perantara banyak digunakan karena mempunyai pola integrasi yang stabil di dalam tumbuhan (Zupan dan Zambryski 1995).
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk merakit vektor ekspresi gen PerL dan melakukan transformasi ke Nicotiana tabacum kultivar SR1 dengan bantuan bakteri Agrobacterium tumefaciens.
TINJAUAN PUSTAKA
Peroksidase
Peroksidase merupakan enzim yang terlibat dalam beberapa metabolisme primer dan sekunder termasuk di antaranya regulasi pemanjangan sel, cross lingking dari polisakarida dinding sel (Fry 1986), lignifikasi, penyembuhan luka (Espelie et al. 1986 ), pertahanan terhadap patogen (Hammerschmidt et al. 1982) dan oksidasi fenol (Strivastava dan van Huystee 1977). Lignifikasi berperan secara alami untuk mekanisme pertahanan terhadap cekaman biotik dan abiotik (Ostergaard et al. 2000). Tingginya tingkat aktivitas peroksidase pada tumbuhan berhubungan erat dengan pertahanan tumbuhan terhadap cekaman abiotik seperti cekaman oksidatif (Hiraga et al. 2001). Cekaman Al diketahui dapat menginduksi ekspresi gen penyandi peroksidase pada tumbuhan Arabidobsis thaliana (Richard et al, 1998) yang menunjukkan bahwa gen penyandi peroksidase mempunyai peranan yang sangat penting dalam sistem toleransi tumbuhan terhadap cekaman Al.
3 menghasilkan lipid peroksida dan selanjutnya akan terurai menjadi senyawa produk oksidasi sekunder yang bersifat toksik (Dumet dan Benson 2000).
Mekanisme yang dilakukan tumbuhan untuk membatasi jumlah molekul-molekul toksik tersebut adalah dengan mengekspresikan sejumlah enzim salah satunya adalah peroksidase. Peroksidase bekerjasama dengan enzim SOD (Superoksida dismutase) dalam mekanisme menanggulangi terjadinya Reactif Oksigen Species (ROS). Superoksida akan dipecah oleh SOD menjadi H2O2, kemudian H2O2 diuraikan oleh peroksidase menjadi air. Peroksidase memecah H2O2 menjadi air ketika mengoksidasi sejumlah substrat organik. Cekaman yang disebabkan oleh aluminium juga diketahui dapat menyebabkan terinduksinya ekspresi gen peroksidase (Richard et al. 1998). Peroksidase membutuhkan kofaktor dalam melakukan aktivitas enzimatisnya yakni kofaktor heme, sehingga peroksidase disebut juga heme dependent peroksidase. Heme adalah kompleks antara ion besi dan molekul protoporphyrin IX (Ferriprotoporphyrin IX).
Berdasarkan kemiripan sekuen dan strukturnya, peroksidase dibedakan menjadi 2 famili yakni; 1) peroksidase hewan dan 2) peroksidase tumbuhan, fungi dan bakteri. Famili peroksidase tumbuhan berdasarkan struktur dan fungsi, dibedakan menjadi 3 kelas, yakni: kelas I meliputi peroksidase intraseluler yang disebut dengan peroksidase-katalase yang menunjukkan aktivitas peroksidase dan katalase dalam spektrum yang luas dan bergantung pada kestabilan hidrogen peroksidase; kelas II meliputi ligninase dan peroksidase ekstraseluler; kelas III peroksidase ekstraseluler klasik tumbuhan seperti horseperadish peroksidase (Welinder 1992). Hasil analisis kesejajaran sekuen cDNA gen PerL menunjukkan nilai kemiripan yang tinggi terhadap sekuen cDNA dari gen Per dari Arabidobsis thaliana (X71794) yakni sebesar 98%. Penyejajaran dilakukan dengan menggunakan primer spesifik yang didesain menggunakan sekuen gen Per dari Arabidopsis thalianan (Amirullah, 2008). Penelusuran daerah domain terkonservasi urutan asam amino PerL menunjukkan bahwa urutan asam amino PerL termasuk dalam tipe secretory peroxidase kelas III (Gambar 1).
Gambar 1 Perbandingan daerah domain asam amino terkonservasi antara (1) PerL dan (2) Per G. max l78163 dari Genebank (Amirullah 2008).
Transformasi Genetik dengan Perantara Agrobacterium tumefaciens
4
menyebabkan penyakit tumor (crown gall). Agrobacterium tumefaciens dapat menyebabkan tumor pada tumbuhan karena adanya gen penginduksi tumor yang ada di dalam plasmid Ti. Plasmid Ti digunakan sebagai vektor untuk memindahkan gen asing ke dalam genom tumbuhan. Kemampuan A. tumefaciens sebagai genetic engineer alami telah banyak dimanfaatkan sebagai media transformasi genetik ke dalam tumbuhan (Ronald 2007). Agrobacterium tumefaciens mempunyai tiga komponen genetik yang digunakan ketika menginfeksi tumbuhan sehingga mampu mentransfer gen asing ke dalam genom tumbuhan. Komponen pertama adalah daerah T-DNA yang merupakan fragmen yang ditransfer ke dalam genom tumbuhan dan terletak di dalam plasmid Ti. Komponen kedua adalah virulen region (vir), gen-gen vir terletak di sebelah batas kiri T-DNA dan mensintesis protein virulensi yang berperan menginduksi terjadinya transfer dan integrasi T-DNA ke dalam tumbuhan. Gen vir akan terinduksi jika terdapat induser yang berupa senyawa monosiklik fenolik seperti asetosyringone dan monosakarida seperti glukosa dan galaktosa (Ronald 2007).
Proses transfer gen secara alami oleh A.tumefaciens ke dalam genom tumbuhan melalui empat tahap, yakni: 1) kolonisasi bakteri; 2) induksi sistem virulensi; 3) perakitan kompleks transfer T-DNA; 4) transfer dan integrasi T-DNA ke dalam genom tumbuhan (Riva et al. 1998). Transfer T-DNA ke dalam genom tumbuhan merupakan proses yang kompleks. Proses transfer T-DNA dari A. tumefaciens ke daam genom tumbuhan dimulai dari adanya luka pada sel tumbuhan. Luka yang dialami oleh sel tumbuhan ini akan memproduksi senyawa fenolik seperti asetosiringone. Senyawa asetosiringone akan menarik dan mengaktifkan gen-gen vir yang diperlukan dalam proses transfer T-DNA.
Gen chromosomal virulence (chv) yakni chvA, chvB, dan pscA merupakan gen yang terletak pada kromosom Agrobacterium. Gen-gen tersebut mempunyai fungsi untuk pelekatan bakteri pada sel tumbuhan dengan membentuk senyawa protein β-1,2-glukan. Ekspresi gen vir juga sangat dipengaruhi oleh senyawa induser dan kondisi pH dimana pH optimum untuk ekspresinya berkisar antara 5-5,8 (Hiei et al. 1997). Asetosiringone akan mengaktifkan gen vir A dan menyebabkan terjadinya fosforilasi yang kemudian mengaktifkan gen vir G. Gen vir G akan mengaktifkan gen-gen vir lainnya. Gen vir D1 berfungsi mengontrol pemotongan T-DNA sehingga diperoleh untai tunggal DNA linear, gen vir D menempel pada ujung 5’ DNA lalu membawa DNA ke sitosol sel inang dan T-DNA akan terinsersi ke dalam genom tumbuhan (Ciftci 2012).
Transformasi Genetik Nicotiana tabacum
5 2012) dan sel (An 1985; Mayo et al. 2006). Selanjutnya eksplan ditumbuhkan pada media regenerasi secara in vitro untuk menghasilkan tanaman transgenik. Media regenerasi sering berfungsi juga sebagai media seleksi dengan penambahan agen seleksi seperti antibiotik. Antibiotik yang digunakan sesuai dengan gen ketahanan terhadap antibiotik yang terdapat di daerah T-DNA (Waluyo 2013; Rahmawati 2003). Antibiotik yang digunakan bersifat racun bagi eksplan non transgenik, sehingga digunakan sebagai agen seleksi pertama kali pada perakitan tumbuhan transgenik. Tunas yang hidup pada media seleksi merupakan tunas transgenik putatif. Perolehan tumbuhan transgenik yang mengandung gen penanda seleksi menjadi faktor penting untuk mendapatkan tumbuhan transgenik yang mengandung gen sasaran (Miki dan McHugh 2004).
Mantell et al (1985) menyatakan bahwa beberapa eksplan hasil transformasi genetik dengan gen cp-SMV tumbuh menjadi kalus dan mengalami organogenesis yang ditandai dengan pertambahan tinggi dan jumlah daun yang nyata. Eksplan yang dikulturkan mengalami morfogenesis organ adventif secara tidak langsung, yaitu membentuk kalus dan selanjutnya dengan dirangsang pada media baru, kalus akan mengalami morfogenesis membentuk tunas dan daun. Kultur in vitro tembakau transgenik cp-SMV pada medium MS yang ditambah NAA 0,3 mg/L dan BAP 1 mg/L dapat menghasilkan kalus yang kemudian bertunas (Agung-Astuti et al. 2004).
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Biotechnological Research Indonesia-The Netherland (BIORIN) dan Biologi Molekuler dan Seluler Tumbuhan (BMST) PPSHB IPB. Waktu pelaksanaan penelitian dimulai bulan Maret 2014 sampai dengan Oktober 2014.
Bahan Penelitian
6
Metode
Penelitian ini dilakukan melalui 3 tahapan, yaitu: konstruksi vektor ekspresi, perakitan tumbuhan transgenik dan analisis tumbuhan transgenik (Lampiran 1). Tahapan pertama adalah konstruksi vektor ekspresi yang terdiri dari: a) amplifikasi cDNA gen PerL dari plasmid pGEM-PerL kemudian dipurifikasi dengan cara elusi, b) cDNA gen PerL yang telah dipurifikasi di introduksikan ke dalam plasmid pENTRTM/D-TOPO® (pENTR-PerL) dan c) introduksi cDNA gen PerL ke vektor ekspresi pGWB502 (pGWB502-PerL). Tahap kedua adalah perakitan tumbuhan transgenik yang terdiri dari introduksi pGWB502-PerL ke dalam A. tumefaciens LBA4044 dan perakitan N. tabacum SR1 transgenik dengan teknik ko-kultivasi. Tahap ketiga adalah analisis tumbuhan transgenik dengan uji integrasi gen PerL di dalam genom N. tabacum SR1.
Introduksi cDNA gen PerL ke dalam entryvector pENTRTM/D-TOPO®
cDNA gen PerL diperoleh dengan cara mengamplifikasinya dari plasmid pGEM-PerL dengan primer spesifik yaitu (PerL pENTR-F: 5’CAC CAT GCA TTT CTC TTC GTC 3’ dan AtprxCb-R: 5’GTT CTG AAG TAA ACG TCT TGA GAG 3’) yang ditambah situs CACC pada ujung 5’ primer forward. Komposisi reaksi PCR yang digunakan adalah 0.5 μl DNA template, 1x buffer Tag, 4 mM dNTP, 10 pmol primer forward, 10 pmol primer reverse, 2U enzim Tag polymerase dan ditambah ddH2O hingga volume akhir menjadi 10μl. PCR dilakukan pada kondisi pra PCR pada suhu 94°C selama 5 menit, denaturasi pada suhu 94°C selama 30 detik, penempelan primer pada suhu 55°C selama 30 detik, dan pemanjangan pada suhu 72°C selama 1 menit, dilakukan sebanyak 35 siklus, pasca PCR pada 72°C selama 5 menit dan pendinginan 20°C selama 20 menit. Hasil PCR (fragmen PerL) dipurifikasi dengan cara elusi dari gel agarosa mengikuti prosedur kit dari Geneid. Hasil elusi fragmen cDNA gen PerL direaksikan dengan pENTRTM/D-TOPO® mengikuti protokol dari Invitrogen, USA.
pENTRTM/D-TOPO® rekombinan diintroduksikan ke dalam sel kompeten bakteri E.coli TOP10 dengan menggunakan metode heat shock (Sambrook et al. 1989), kemudian disebar pada media Luria Agar (LA) yang mengandung 50 mg/L kanamisin. Koloni yang tumbuh diverifikasi dengan PCR menggunakan primer PerL pENTR-F (5’CAC CAT GCA TTT CTC TTC GTC 3’) dan AtprxCb-R
(5’GTT CTG AAG TAA ACG TCT TGA GAG 3’) dengan kondisi PCR sama
7
Gambar 2 Peta plasmid pENTRTM/D-TOPO® dengan daerah overhang GTGG dan gen penyandi ketahanan antibiotik kanamisin.
Pengklonan cDNA gen PerL ke dalam vektor ekspresi pGWB502
Plasmid pENTR-PerL direaksikan dengan plasmid biner pGWB502 dengan bantuan enzim LR clonase sesuai dengan protokol gateway cloning (Gambar 3). Hasil ligasi diintroduksikan ke dalam E.coli DH5α dan ditumbuhkan pada media Luria Agar (LA) yang mengandung antibiotik spektinomisin 50 mg/L. Koloni yang tumbuh diverifikasi dengan menggunakan primer spesifik 35S-F
(5’AAA CCT CCT CGG ATT CCA TT 3’) dan AtprxCb-R (5’GTT CTG AAG
8
Gambar 3 Rekombinasi pada sistem gateway cloning antara situs attL1 dan attL2 yang mengapit gen PerL (plasmid pENTR-PerL) dengan situs attR1 dan attR2 yang mengapit daerah ccdB (plasmid pGWB502)
Introduksi pGWB502-PerL ke dalam Agrobacterium tumefaciens LBA4044
Introduksi plasmid biner pGWB502 yang mengandung gen PerL ke dalam bakteri A. tumefaciens LBA4404 dilakukan dengan menggunakan metode konjugasi triparental mating (Anggraito 2012) dengan bantuan plasmid penolong pRK2013. Koloni bakteri A. tumefaciens LBA4404 hasil konjugasi ditumbuhkan pada media Luria Agar (LA) yang mengandung 50 mg/L spektinomisin dan 50 mg/L streptomisin. Bakteri E. coli DH1 yang mengandung plasmid penolong pRK2013 ditumbuhkan dalam media LB cair yang mengandung 50 mg/L kanamisin, diinkubasi pada suhu 370C selama 16-18 jam dan digoyang dengan kecepatan 220 rpm. Bakteri A. tumefaciens LBA4404 ditumbuhkan dalam media LB cair yang mengandung streptomisin 50 mg/L, diinkubasi pada suhu 280C selama 2 hari atau OD600=1 dan digoyang dengan kecepatan 220 rpm. Biakan dari masing-masing bakteri diambil sebanyak 20 µl, kemudian diteteskan pada media LB yang tidak mengandung antibiotik dan diresuspensi agar terjadi konjugasi. Selanjutnya diinkubasi pada suhu 280C selama dua hari dalam ruangan gelap. Koloni hasil konjugasi yang tumbuh selanjutnya diambil dan dilarutkan dalam 500 µl LB cair dan dihomogenkan, kemudian sebanyak 5µl kultur bakteri hasil pengenceran tersebut diencerkan kembali dalam 495 µl LB cair. Hasil pengenceran diambil sebanyak 80 µl dan disebar pada media LB padat yang mengandung spektinomisin 50 mg/L dan streptomisin 50 mg/L, selanjutnya kultur diinkubasi pada suhu 280C selama dua hari. Agrobacterium tumefaciens LBA4404 transforman kemudian di verifikasi dengan PCR menggunakan primer spesifik 35S-F dan AtprxCb-R.
Persiapan eksplan Nicotiana tabacum kultivar SR1
Biji N. tabacum kultivar SR1 disterilisasi dengan cara merendam biji pada larutan alkohol 70% dan digoyang dengan tangan selama 5 menit. Selanjutnya biji dicuci dengan air steril lalu direndam pada larutan pemutih-disinfektan Bayclin (NaClO 5,25%) 20% kemudian digoyang selama 10 menit. Biji dicuci kembali menggunakan air steril sebanyak enam kali. Biji ditumbuhkan pada media dasar Murashige dan skoog (MS0) yang mengandung garam MS, Vitamin MS, 30 g/L sukrosa, dan 0.3% agar. Biji ditumbuhkan pada suhu 26°C-27°C, setelah berumur 1 bulan tanaman yang tumbuh disubkultur untuk perbanyakan. Eksplan yang digunakan dalam transformasi adalah daun dari tanaman aseptik yang tumbuh dari biji N. tabacum kultivar SR1 yang berumur 2 bulan.
Transformasi genetik Nicotiana tabacum kultivar SR1
digoyang-9 goyang menggunakan tangan, kemudian dikeringkan dengan tissue steril. Eksplan ditanam pada media ko-kultivasi padat dengan komposisi garam MS, vitamin MS, 3% sukrosa, 40 mg/L asetosiringone, 0.3% gelrite, 0.5 mg/L IAA dan 0.5mg/L BA, selama 3 hari dalam ruangan gelap.
Eksplan hasil ko-kultivasi dicuci dengan air steril sebanyak 3 kali dan dilanjutkan dengan air steril yang ditambah dengan 200 mg/L cefotaxime, dikeringkan dengan tissue steril dan kemudian ditanam pada media pengkalusan (garam MS, vitamin MS, 3% sukrosa, 0.5 mg/L IAA, 0.5 mg/L BA, 200 mg/L cefotaxime, dan 0.3% gelrite) (lampiran 2) selama 7-10 hari. Setelah itu, eksplan dipindahkan ke media seleksi (lampiran 2) yang mengandung garam MS, vitamin MS, 3% sukrosa, 0.5 mg/L BA, 0.5 mg/L IAA, 100 mg/L cefotaxime, 30 mg/L higromisin dan 0.3% gelrite hingga muncul tunas. Tunas yang panjangnya mencapai 3-4 cm dipindahkan ke media MS0 hingga terbentuk akar. Tunas yang sudah menghasilkan akar dipindahkan ke media arang sekam dan dipelihara di ruang kultur selama satu minggu. Tumbuhan yang mempunyai pertumbuhan baik dipindahkan ke media tanah dan diletakkan di luar ruangan, kemudian dipelihara hingga dewasa untuk menghasilkan biji T0.
Identifikasi Nicotiana tabacum SR1 transgenik
10
HASIL DAN PEMBAHASAN
Introduksi cDNA Gen PerL ke dalam EntryVector pENTRTM/D-TOPO®
Fragmen cDNA PerL berhasil diamplifikasi dari plasmid pGEM-PerL dengan primer spesifik yang ditambah situs CACC pada ujung 5’ primer forward (PerL pENTR-F: 5’CAC CAT GCA TTT CTC TTC GTC’ dan AtprxCb-R:5’ -GTT CTG AAG TAA ACG TCT TGA GAG-3’). Penambahan situs spesifik CACC ini bertujuan agar fragmen cDNA PerL dapat disisipkan pada plasmid pENTRTM/D-TOPO® sebagai vektor pengklonan dengan menggunakan metode gateway cloning.
Fragmen PerL yang telah berhasil dipurifikasi berukuran 1100 bp sesuai dengan ukuran cDNA gen PerL (Gambar 4). Hasil purifikasi kemudian direaksikan dengan plasmid pENTRTM/D-TOPO® mengikuti protokol Invitrogen, USA. Proses pengklonan dibantu oleh enzim topoisomerase I yang memotong rantai utas tunggal pada situs CCCTT sehingga plasmid pENTRTM/D-TOPO® mempunyai daerah overhang GTGG (Gambar 2). Situs CACC yang terdapat pada fragmen cDNA gen PerL hasil PCR akan berkomplemen dengan situs GTGG pada pENTRTM/D-TOPO®, sehingga cDNA gen PerL dapat menyisip pada plasmid pENTRTM/D-TOPO®. Proses ligasi antara vektor dan sisipan terjadi karena adanya aktivitas enzim Topoisomerase I selama inkubasi. Hasil reaksi kemudian diintroduksikan ke dalam bakteri E. coli TOP10 dengan metode heat shock.
Gambar 4 Hasil perbanyakan cDNA gen PerL menggunakan PCR dengan primer PerL-pENTR-F dan AtprxCb-R. M= marka 1kb, 1= gen PerL.
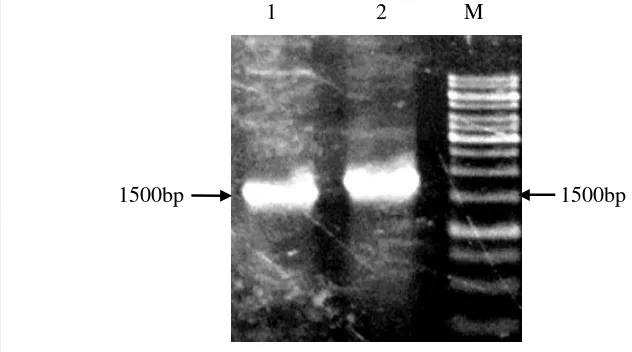
Koloni yang tumbuh pada media seleksi yang mengandung 50 mg/L kanamisin diduga membawa plasmid pENTRTM/D-TOPO® yang mengandung cDNA gen PerL. Koloni tersebut diverifikasi menggunakan PCR koloni dengan primer PerL pENTR-F dan AtprxCb-R untuk memastikan keberadaan cDNA gen PerL. Hasil PCR berupa fragmen berukuran 1100 bp (Gambar 5). Hal ini menunjukkan bahwa koloni yang diverifikasi telah mengandung plasmid pENTRTM/D-TOPO® rekombinan (plasmid pENTRTM/D-TOPO® yang mengandung cDNA gen PerL). Plasmid pENTR-D/TOPO rekombinan yang membawa gen PerL diberi nama PerL. Selanjutnya plasmid pENTR-PerL diisolasi menggunakan Geneid Plasmid Miniprep Kit. pENTRTM/D-TOPO®
M 1
11
M 1 2
yang mempunyai situs attP1 dan attP2 sebagai tempat rekombinasi gen PerL. Adanya situs rekombinasi ini menyebabkan tidak terjadinya kesalahan orientasi keberadaan cDNA gen PerL pada plasmid pENTRTM/D-TOPO®.
Gambar 5 Hasil identifikasi koloni E. coli yang mengandung pENTR-PerL menggunakan PCR dengan primer PerL pENTR-F dan AtprxCb-R. M= Marka 1kb, 1=koloni non transforman, 2= koloni transforman.
Pengklonan cDNA gen PerL ke dalam Vektor Ekspresi pGWB502
Fragmen PerL yang dibawa oleh plasmid pENTR-PerL telah berhasil disisipkan ke dalam vektor ekspresi pGWB502 dengan sistem gateway cloning. Reaksi antara plasmid pENTR-PerL dengan plasmid pGWB502 dibantu oleh enzim LR clonase (Invitrogen, USA). Enzim LR clonase berfungsi untuk memindahkan fragmen cDNA gen PerL yang terdapat pada plasmid pENTR-PerL ke dalam plasmid ekspresi pGWB502. Fragmen PerL dapat menyisip ke dalam vektor pGWB502 karena terjadinya proses rekombinasi antara situs attL1 dan attL2 pada pENTR-PerL dengan situs attR1 dan attR2 pada vektor ekspresi pGWB502. Gen PerL yang diapit situs attL1 dan attL2 akan berpindah pada daerah ccdB yang diapit oleh situs attR1 dan attR2 sehingga menghasilkan plasmid rekombinan pGWB502-PerL dengan peta konstruksi LB dan RB seperti Gambar 6.
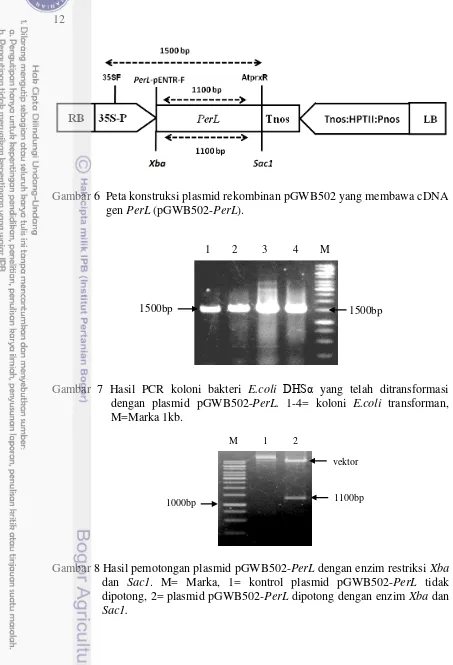
Introduksi vektor pGWB502-PerL ke dalam E.coli DH5α telah berhasil dilakukan dengan teknik heat shock. Koloni bakteri E.coli DH5α yang tumbuh pada media seleksi yang mengandung spektinomisin 50 mg/L diduga sebagai koloni bakteri yang membawa plasmid pGWB502-PerL. Koloni bakteri yang tidak membawa plasmid rekombinan pGWB502-PerL akan mati karena situs ccdB pada plasmid pGWB502 non rekombinan akan mengekspresikan protein yang bersifat racun tehadap bakteri E.coli DH5α. Koloni E.coli DH5α yang tumbuh pada media seleksi selanjutnya diverifikasi dengan PCR menggunakan primer 35SF dan AtprxCb-R. Hasil PCR berupa fragmen DNA berukuran 1500 bp (Gambar 6 dan 7). Primer 35SF digunakan untuk mengetahui keberhasilan sisipan dan membuktikan bahwa rekombinan yang terbentuk akan diekspresikan karena membawa promoter kuat 35S CaMV. Plasmid pGWB502-PerL berhasil diisolasi dan dipotong menggunakan enzim restriksi Xba dan Sac1 (Gambar 6 dan 8).
12
Gambar 6 Peta konstruksi plasmid rekombinan pGWB502 yang membawa cDNA gen PerL (pGWB502-PerL).
Gambar 7 Hasil PCR koloni bakteri E.coli DHSα yang telah ditransformasi dengan plasmid pGWB502-PerL. 1-4= koloni E.coli transforman, M=Marka 1kb.
Gambar 8 Hasil pemotongan plasmid pGWB502-PerL dengan enzim restriksi Xba dan Sac1. M= Marka, 1= kontrol plasmid pGWB502-PerL tidak dipotong, 2= plasmid pGWB502-PerL dipotong dengan enzim Xba dan Sac1.
vektor M 1 2
1000bp 1100bp
1500bp 1500bp
13
Introduksi plasmid pGWB502-PerL ke dalam Agrobacterium tumefaciens
LBA4404
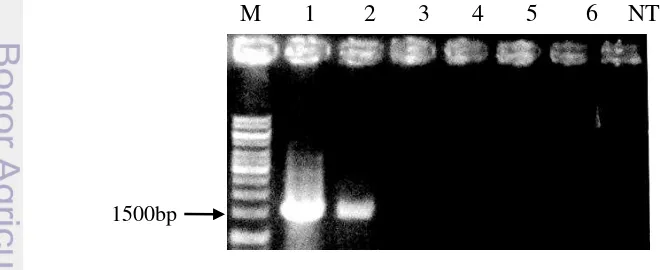
Plasmid pGWB502-PerL telah berhasil diintroduksikan ke dalam A.tumefaciens LBA4404 dengan metode triparental mating (TPM). Triparental mating menggunakanam plasmid penolong pRK2013 konjugatif yang efisien untuk mentransfer gen ke dalam plasmid nonkonjugatif (Wise et al. 2006). Plasmid pGWB502-PerL yang terdapat pada E.coli DH5α hasil transformasi (sebagai donor) dipindahkan ke dalam A.tumefaciens LBA4404 (sebagai resipien) melalui proses konjugasi dengan bantuan plasmid penolong pRK2013 yang terdapat pada bakteri E. coli DH1. Koloni A.tumefaciens LBA4404 hasil konjugasi ditumbuhkan pada media seleksi yang mengandung spektinomisin 50 mg/L dan streptomisin 50 mg/L. Antibiotik spektinomisin digunakan karena plasmid pGWB502-PerL mempunyai gen ketahanan spektinomisin di luar daerah T-DNA dan A.tumefaciens mempunyai gen ketahanan terhadap streptomisin. Koloni bakteri yang tumbuh di media seleksi spektinomisin dan streptomisin diduga A.tumefaciens transforman yang mengandung plasmid pGWB502-PerL. Agrobacterium tumefaciens LBA4404 terduga transforman kemudian diverifikasi menggunakan PCR koloni dengan primer spesifik 35SF dan AtprxCb-R. PCR koloni menghasilkan fragmen DNA berukuran 1500 bp (Gambar 9). Hal ini menunjukkan bahwa koloni yang diverifikasi adalah A. tumefaciens transforman yang membawa plasmid pGWB502-PerL. Hanum (2012) telah melaporkan keberhasilan memindahkan plasmid pGWB5-MmCUZn-SOD ke dalam bakteri A.tumefaciens LBA4404. Anggraito (2012) juga telah berhasil mengintroduksikan
plasmid rekombinan pIG6-MaMt2 ke dalam bakteri A. tumefaciens LBA4404. Ohta
(1990) berhasil mengintroduksikan plasmid pBI121 yang membawa gen reporter
ß-Glucuronidase (GUS) ke dalam A. tumefaciems LBA4404 dengan bantuan plasmid penolong pAL4404.
Gambar 9 Identifikasi DNA rekombinan menggunakan PCR koloni dengan primer 35SF dan AtprxCb-R. 1-2= A.tumefaciens LBA4404 transforman , M= Marka 1kb
1 2 M
14
Transformasi Genetik Nicotiana tabacum Kultivar SR1
Transformasi genetik Nicotiana tabacum kultivar SR1 telah berhasil dilakukan dengan bantuan bakteri A. tumefaciens LBA4044 yang membawa plasmid rekombinan pGWB502-PerL. Transformasi genetik N. tabacum kultivar SR1 dilakukan melalui eksplan daun dengan teknik ko-kultivasi. Bakteri A. tumefaciens LBA4404 transforman digunakan sebagai media transformasi gen PerL ke dalam N.tabacum kultivar SR1. Bakteri ini ditumbuhkan pada media Luria Bertani (LB) yang mengandung spektinomisin 50 mg/L dan streptomisin 50 mg/L hingga OD=0.5. Pelukaan yang dilakukan pada daun N. tabacum dan penambahan senyawa fenolik asetosiringone pada media ko-kultivasi menyebabkan A.tumefaciens terinduksi sehingga menempel pada tumbuhan. Senyawa asetosiringone juga akan mengaktifkan gen-gen vir pada A. tumefaciens. Gen vir A akan mengaktifkan gen vir G. Daerah T-DNA akan dipotong oleh protein yang dihasilkan oleh gen vir D sehingga diperoleh untai tunggal. Gen vir E bertindak melindungi T-DNA dari degradasi enzim nuklease yang ada pada tumbuhan sehingga T-DNA berhasil tersisip ke genom tumbuhan. Ko-kultivasi dilakukan selama tiga hari di ruang gelap, kemudian eksplan dipindahkan ke dalam media induksi kalus selama 1 minggu. Kalus yang telah terbentuk selanjutnya dipindahkan ke dalam media seleksi yang mengandung 30 mg/L higromisin hingga terbentuk tunas. Tunas yang tumbuh pada media seleksi tersebut diduga sebagai tunas transgenik putatif (Gambar 10). Tunas yang tumbuh dan sudah membentuk daun kemudian dipisahkan dan dipindahkan ke dalam media MS0 atau media induksi akar.
15 Integrasi gen PerL di dalam genom tumbuhan N.tabacum kultivar SR1 transgenik putatif telah berhasil dikonfirmasi menggunakan PCR dengan primer spesifik 35S-F dan AtprxCb-R. Identifikasi akan adanya insersi gen PerL dilakukan pada 6 sampel daun tumbuhan kultur N. tabacum kultivar SR1. Dari keenam sampel, dua tanaman adalah transforman (positif terinsersi gen PerL) sedangkan empat tanaman lainnya adalah non transforman (tidak terinsersi) sehingga keberhasilan transformasi genetik N. tabacum kultivar SR1 adalah 33%. Keempat tanaman non tansforman yang mampu bertahan di media seleksi kemungkinan dapat disebabkan oleh beberapa factor. Faktor pertama adalah adanya bagian kalus yang tidak menyentuh media seleksi sehingga tunas yang tumbuh tidak terseleksi oleh higromisin. Faktor kedua yaitu terjadinya variasi somaklonal yang dikarenakan oleh zat pengatur tumbuh (ZPT) atau terjadinya tumbuhan yang mempunyai sifat kimera. Dong dan McHughen (1993) menyatakan bahwa pada media seleksi, sel tumbuhan yang tidak terinsersi T-DNA dilindungi oleh sel yang berhasil diinsersi oleh T-DNA sehingga ketika mengalami organogenesis, tunas non transgenik yang dihasilkan juga mampu bertahan pada media seleksi. Amplifikasi DNA genom tumbuhan N. tabacum SR1 transgenik putatif dengan primer 35S-F dan AtprxCb-R menghasilkan fragmen DNA berukuran 1500 bp (Gambar 11). Hasil ini menunjukkan bahwa gen PerL telah berhasil disisipkan ke dalam genom tumbuhan N.tabacum SR1 dengan perantara bakteri A. tumefaciens. Metode transformasi dengan menggunakan A. tumefaciens merupakan metode yang banyak digunakan karena menghasilkan integrasi DNA atau gen yang stabil (Dai et al. 2001). Selain itu, teknik ini juga menghasilkan tumbuhan transgenik yang stabil pada generasi berikutnya (Travella et al. 2005). Agarwal et al. (2004) berhasil menyisipkan gen GUS ke dalam genom tumbuhan Morus alba L dengan perantara A. tumefaciens LBA4404. Waluyo (2013) melaporkan bahwa gen BtCspB penyandi cold shock protein berhasil disisipkan ke dalam tanaman tembakau dengan perantara A. tumefaciens LBA4404. Gen MaMt2 penyandi metallothionein tipe II dari Melastoma malabathricum L telah berhasil diintroduksikan ke dalam N. benthamiana L dengan bantuan A. tumefaciens LBA4404 (Anggraito 2012). Gen reporter ß-Glucuronidase (GUS) yang mengandung intron berhasil diintroduksikan ke dalam genom tembakau dengan bantuan A. tumefaciens LBA4404 (Ohta et al. 1990)
M 1 2 3 4 5 6 NT
16
SIMPULAN DAN SARAN
Simpulan
Vektor ekspresi pGWB502-PerL telah berhasil dikonstruksi dengan teknik gateway cloning. cDNA gen PerL berhasil disisipkan ke dalam genom tumbuhan N. tabacum SR1 dengan bantuan bakteri A. tumefaciens.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui tingkat ekspresi gen PerL melalui analisis ekspresi dan uji tantang terhadap cekaman abiotik maupun biotik.
DAFTAR PUSTAKA
Agarwal K, Kanwar K, Saini N, Jain RK. 2004. Agrobacterium tumefaciens mediated genetic transformation and regeneration of Morus alba L. Sci Hort. 100: 183-191.
Agung-Astuti, Handayani E, Rineksane IA, Fitriyah NA. 2004. Multiplikasi, induksi planlet dan seleksi tembakau hasil transformasi gen coat protein SMV secara kultur in vitro. Bioteknologi. 1(2):31-36.
Amirullah A. 2008. Pengklonan dan karakterisasi gen PerL dari kedelai peka cekaman aluminium [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
An G. 1985. High efficiency transformation of cultured tobacco cell. Plant Physiol. 79:568-570.
Anggraito YU. 2012. Transformasi genetik Nicotiana benthamiana L. dan kedelai dengan gen MaMt2 penyandi metallothionein tipe II dari Melastoma malabathricum L. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Apel K, Hirt H. 2004. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annu Rev Plant Biol. 55:373–399.
Badawi GH. Yamauchi Y, Shimada E, Sasaki R, Kawano N, Tanaka K. 2004. Enhanced tolerance to salt stress and water deficit by over expressing superoxide dismutase in tobacco (Nicotiana tabacum) chloroplasts. Plant Sci. 166: 919-928.
Bowler C, Montagu MV, Inze D. 1992. Superoxide dismutase and stress tolerance. Annu Rev Plant Physiol Plant Biol. 43:83-116.
Ciftci YO. 2012. Transgenic Plant Advances and Limitation. Rejeka (CRO): InTech.
17 Dong C, Li G, Li Z, Zhu H, Zhou M, Hu Z. 2008. Molecular cloning and expression analysis of an Mn-SOD gene from Nelumbo nucifera. Appl Biochem Biotechnol. 158(3):605-14.
Dong JZ, McHughen A. 1993. Transgenic flax plants from Agrobacterium mediated transformation incidence of chimeric regenerants and inheritance of transgenic plants. Plant Sci. 91:139-148.
Dumet D, Benson EE. 2000. The use of physical and biochemical studies to elucidate and reduce cryopreservation-induced damage in hydrated/ desiccated plant germplasm. Engelmann F and Takagi H, editor. Cryopreservation of Tropical Plant Germplasm: Current Research Progress and Application. Roma (IT): IPGRI.
Espelie KE, Franceschi VR, Kolattukudy PE. 1986. Immunocytochemical localization and time course of appearance of an anionic peroxidase associated with suberization in woundhealing potato tuber tissue. Plant Physiol. 81: 487-492.
Fridovich I. 1975. Superoxide dismutases. Annu Rev Biochem. 44:147-159.
Fry SC. 1986. Cross-linking of matrix polymers in the growing cell walls of angiosperms. Annu Rev Plant Physiol. 37:165-186.
Halliwell, Gutteridge J. 1999. Free Radicals in Biology and Medicine. New York (US): Oxford Pr.
Hammerschmidt R, Nuckles E, Kuc J. 1982. Association of enhanced peroxidase activity with induced systemic resistance of cucumber to Colletotrichlum lagenarium. Physiol Plant Patho. 20: 73-82.
Hanum S. 2012. Isolasi pengklonan dan analisis ekspresi gen penyandi copper/zinc superoxidase dismutase (CuZn-SOD) dari Melastoma malabathricum L.[Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Hiei Y, Komari T, Kubo T. 1997. Transformation of rice mediated by Agrobacterium tumefaciens. Plant Mol Biol. 35:205-218.
Hiraga S, Sasaki K, Ito H, Ohasi Y, Matsui H. 2001. A large family of class II plant peroxidases. Plant Cell Physiol. 42: 462-468.
Jones H. 1996. Plant gene transfer and expression protocols. Methods Mol Biol. 49:39-48.
Lubis RA. 2008. Ekspresi gen penyandi protein heterometrik Gα dan peroksidase pada kedelai kultivar Lumut yang mendapat cekaman aluminiun. [Tesis]. Bogor(ID): Institut Pertanian Bogor.
Mantell, S.H., J.A. Matthews, and R.A. McKee. 1985. Principle of plant biotechnology an introduction to genetic. J Biotechnol. 1(2): 31-36.
Mayo KJ, Gonzalez BJ, Mason HS. 2006. genetic transformation of tobacco NT1 cell with Agrobacterium tumefaciens. Nature Protocol. 1(3): 1105-1111. Miki B, McHugh S. 2004. Selectable marker genes in transgenic plants:
applications, alternatives and biosafety. J Biotechnol. 107:193-232.
Niyogi KK. 1999. Protoprotection revisited: genetic and molecular approaches. Annu Rev Plant Physiol Plant Mol Biol. 50:333-359.
Ohta S, Mita S, Hattori T, Nakamura KC. 1990. Construction and expression in tobacco of a ß-Glucuronidase (GUS) reporter gene containing an intron within the coding sequence. Plant Cell Physiol. 31(6): 805-813.
18
Expression and high-resolution structure of a plant peroxidase with implications for lignifications. Plant Mol Biol. 44:231-243.
Quiros-Figueroa FR, Rojas-Herrera R, Galaz-Avalos RM, Loyola-Vargas VM. 2006. Embryo production through somatic embryogenesis can be used to study cell differentiation in plants. Plant Cell Tiss Org Cult. 86: 285-301. Rahmawati S. 2003. Gen penyeleksi alternatif untuk transformasi tumbuhan.
Buletin AgroBiol. 6(1):26-33.
Richard KD, Schott EJ, Sharma YK, Davis KR, Gardner RC. 1998. Aluminum induces oxidative stress genes in Arabidobsis thaliana. Plant Physiol. 116: 409-418.
Riva GA, Gonzalez-Cabrera J, Vasquez-Padron R, Ayra-Pardo C. 1998. Agrobacterium tumefaciens: a natural tool for plant transformation. J Biotechnol. 1(1):77-83.
Ronald PC. 2007. Plant-Pathogen Interaction Method and Protocol. New Jersey (US): Humana Press.
Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular Cloning a Laboratory Manual 2nd Ed. New York (US): Cold spring Harbor Laboratory Press. Sgherii CLM, Navari-Izzo F. 1995. Sunflower seedling subjected to increasing
water deficit stress, oxidative stress and defence mechanism. Plant Physiol. 93:25-30.
Sasaki Y, Sone T, Yoshida S, Yahata K, Hotta J, Chesnut JD, Honda T, Imamoto F. 2003. Evidence for high specificity and efficiency of multiple recombination signals in mixed DNA cloning by the multisite gateway system. J Biotechnol. 107: 233–243.
Soliman MH, Omar HS, El-Awady MA, Al-Assal S, El-Din AAYG. 2009. Transformation and expression of Na+/H+ antiporter vacuolar (AtNHX1) gene in tobacco plants under salt stress. Arab J Biotechnol. 12(1):99-108. Strivastava OP, van Huystee RB. 1977. An interrelationship among peroxidase,
IAA oxidase, and polyphenoloxidase frompeanut cells. Can J Bot. 55: 2630-2635.
Su G, Park S, Lee S, Murai N. 2012. Low co-cultivation temperature at 20˚C resulted in the reproducible maximum increase in both the fresh weight yield and stable expression of gus activity after Agrobacterium tumefaciens-mediated transformation of tobacco leaf disks. Plant Sci. 3:537-545.
Travella S et al. 2005. A comparison of transgenic barley lines produced by particle bombardment and Agrobacterium-mediated techniques. Plant Cell. 23:780-789.
Waluyo S. 2013. Transformasi genetik tembakau dengan gen BtCspB penyandi cold shock protein melalui perantara Agrobacterium tumefaciens. [Tesis]. Bogor [ID]: Institut Pertanian Bogor.
Welinder KG. 1992. Superfamily of plant, fungal and bacterial peroxidase. Curr Opin Struct Biol. 2:388-393.
Wise AA, Liu Z, Binns AN. 2006. Three methods for introduction of foreign DNA into Agrobacterium. Methods Mol Biol. 343(1): 44-54.
19
LAMPIRAN
Lampiran 1 Alur kostruksi plasmid overekspresi pGWB502-PerL dan perakitan N. tabacum SR1 transgenik
Teknik ko-kultivasi A.tumefaciens
LBA4404
Nicotiana tabacum transgenik
Uji integrasi gen PerL
Rekombinasi dengan pGWB502
Introduksi ke pENTRTM/D-TOPO®
pGEM-PerL PCR cDNA gen PerL
Elusi
pENTR-PerL
Konstruksi vektor ekspresi
Perakitan tumbuhan transgenik
20
21 f. Komposisi garam MS
Garam Makro
KNO3 1900 mg/L
NH4NO 1650 mg/L
CaCl2 332.2 mg/L
MgSO4 180.7 mg/L
KH2PO4 170 mg/L
Garam Mikro
Na2EDTA.2H2O 37.26 mg/L
FeSO4.7H2O 27.8 mg/L
MnSO4.7H2O 16.9 mg/L
ZnSO4.7H2O 8.6 mg/L
H3BO3 6.2 mg/L
KI 0.83 mg/L
Na2MoO4 0.25 mg/L
CuSO4.5H2O 0.025 mg/L
CoCl2. 6H2O 0.025 mg/L
g. Komposisi Vitamin MS
Myo-Inositol 100mg/L
Glisin 2 mg/L
Nicotinic acid 0.5 mg/L
Pyridoxine-HCL 0.5 mg/L
22