REKAYASA GENETIK TEMBAKAU (Nicotiana tabacum L. cv. SR1)
DAN JARAK PAGAR (Jatropha curcas L.) DENGAN GEN
INHIBITOR OF MERISTEM ACTIVITY (IMA)
ASRI PIRADE PASERANG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa disertasi berjudul "Rekayasa Genetik Tembakau (Nicotiana tabacum L. cv. SR1) dan Jarak Pagar (Jatropha curcas L.) dengan Gen Inhibitor of Meristem Activity (IMA)" adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Asri Pirade Paserang
NIM G363100071
RINGKASAN
ASRI PIRADE PASERANG. Rekayasa Genetik Tembakau (Nicotiana tabacum L. cv. SR1) dan Jarak Pagar (Jatropha curcas L.) dengan Gen Inhibitor of Meristem Activity (IMA). Dibimbing oleh SUHARSONO, UTUT WIDYASTUTI, dan ARIS TJAHJOLEKSONO.
Tanaman jarak pagar (Jatropha curcas L.) merupakan salah satu tanaman yang pada awalnya merupakan tanaman yang digunakan sebagai tanaman pagar. Tanaman ini berpotensi sebagai penghasil bahan baku energi terbarukan. Keuntungan jarak pagar sebagai sumber bahan biodiesel antara lain, 1) minyak jarak pagar tidak termasuk dalam kategori minyak makan (non edible oil) sehingga pemanfaatan jarak pagar sebagai bahan baku biodiesel tidak akan mengganggu penyediaan kebutuhan minyak makan nasional, 2) tanaman jarak pagar ini dapat beradaptasi dengan lahan pada kondisi kering (curah hujan <500 mm per tahun), 3) dapat tumbuh pada lahan dengan kesuburan rendah (lahan marjinal dan lahan kritis, 4) biji jarak pagar mengandung minyak dengan rendemen 30–40%. Rendahnya produktivitas tanaman jarak pagar menjadi perhatian utama dalam pemulian tanaman. Rasio bunga betina yang sangat sedikit dibandingkan dengan bunga jantan merupakan salah satu factor pembatas produktivitas.
Salah satu strategi untuk meningkatkan kualitas produktivitas jarak pagar yaitu dengan teknologi rekayasa genetika. Metode transformasi merupakan metode yang diaplikasikan untuk mengintroduksikan gen IMA ke tanaman tersebut. Gen Inhibitor of Meristem Activity (IMA). Gen IMA telah diisolasi dari tanaman tomat (Solanum lycopersicum L.) dan telah berhasil dilakukan ekspresi berlebih pada tanaman tomat. Gen IMA berperanan dalam pertumbuhan dan perkembangan pada meristem pucuk, mampu menginduksi pembungaan dan perkembangan ovul. Tujuan penelitian ini adalah dapat mengetahui peranan gen
IMA pada pertumbuhan tanaman melalui konstruksi gen dalam vektor ekspresi, analisis gen pada tanaman model tembakau dan tanaman target jarak pagar.
Pada penelitian pertama dilakukan konstruksi gen IMA ke dalam vektor ekspresi A. tumefaciens LBA4404. Metode yang digunakan untuk konstruksi adalah metode gateway. Metode ini diawali dengan desain primer spesifik gateway. Konstruksi gen IMA dirancang dengan dua arah yaitu sens dan antisens. Diperoleh koloni A. tumefaciens LBA4404 yang membawa plasmid pGWB402- IMA sens dan antisens. Koloni tersebut dapat digunakan untuk transformasi pada tanaman.
Pada penelitian ketiga dilakukan introduksi gen IMA sens dan antisens ke tanaman jarak pagar. Tujuannya adalah mengintroduksi gen IMA sens dan antisens ke tanaman Jarak Pagar. Transformasi berhasil dilakukan pada tanaman jarak pagar dengan gen IMA sens berdasarkan hasil analisis PCR. Tetapi dalam kultur in vitro menghadapi kendala pada proses pengakaran dan aklimatisasi. Diharapkan pada penelitian selanjutnya dapat ditemukan metode yang baik untuk pengakaran dan aklimatisasi.
SUMMARY
ASRI PIRADE PASERANG. Genetic Engineering of Tobacco (Nicotiana tabacum L. cv. SR1) and Jatropha curcas L. using Inhibitor of Meristem Activity Gene (IMA). Under the Supervision of SUHARSONO, UTUT WIDYASTUTI, and ARIS TJAHJOLEKSONO.
Jatropha (Jatropha curcas L.) is a plant that is usually as a boundary plant and as well as a renewable energy producer plant. Jatropha have many advantages as a source of biodiesel: 1) The oil of Jatropha is not included in the category of edible oil so the use of Jatropha as a biodiesel will not disrupt the supply of oil needs to eat ,2) Jatropha can adapt to the soil in dry conditions (rainfall <500 mm per year), 3) this plant can grow well on soils with low fertility (marginal and degraded), 4) Jatropha seeds contain 30-40% oil.
The low level of Jatropa productivity is a major concern in plant breeding. One of such low level or limitation factors in productivity is the female flowers ratio is very lower as compared to its male flower. One of the strategies to improve the productivity of Jatropha is the use of genetic engineering technology. A transformation technique was used to introduce IMA genes into the plants. IMA
gene has been isolated from tomato (Solanum lycopersicum L.) plant and was successfully overexpressed in the tomato plant. The objective of this study was to determine IMA gene role in the growth of plants through the construction of expression of vector as well as analysis of the gene from tobacco model plant and Jatropa as a target plant.
The first experiment of the study was the construction of expression vector for IMA gene, and introduce it into A. tumefaciens strains LBA4404 using the gateway method and specific primers were also design using gateway method. Construction of IMA gene with designed with two-way (sense and antisense). A. tumefaciens LBA4404 colonies obtained carried the plasmid pGWB402-IMA
sense and antisense that was used for transformation into the targeted plants. The second experiment of this study was the introduction of IMA genes into tobacco plants. Genes were transformed in the orientation form: sense and
characteristic to antibiotic resulting in a 3:1 ratio according to the results of chi-square analysis. This indicates that the IMA gene was inherited on the next generation.
The third experiment of this study was the introduction of IMA gene to Jatropha. The objective was to introduce IMA gen sense and antisense into
Jatropha curcas L. Transformation was successful carried out based on the results of PCR analysis but unfortunately cultivation in vitro had barriers in root induction and acclimatization. It is expected that further research will develop and find a good method for rooting and acclimatization.
Many people in Indonesia are suffering breast and cervical cancer. Cancer cell is a cell that continuesly grow without inhibition and it can invade other
normal cells. Traditionally, Typhonium flagelliforme was used for anticancer
treatment in Indonesia. Previous study showed that the T. divaricatum (L.) Decne
from Chengdu (Cina) has anticancer activity because it has antiproliferative effect of tuber lectin on cancer cell line. However, there is no phytopharmaca
information about tuber lectin of T. flagelliforme in Indonesia. Therefore, the
(South Sumatera), and Solok (West Sumatera) were used in this research. Those accessions have been cultivated in greenhouse at Biotech Centre, Agency for The Assessment and Application of Technology, Indonesia. The tubers were harvested from 1, 3, 5, and 6 months old plant and used as plant materials. The tuber total protein content, toxicity effect, and hemagglutination activity was determined from the crude tuber protein extract. The selected of tuber protein extract from 6 months old plant (NaCl extraction) used for protein fractination. Thext stage was to identify of lectin gene from all accession. After that, the selected of tuber protein extract from 6 months old plant (water extraction) used for mammalian cell culture test (MCF-7 and fibroblast cells). Those extracts was selected by hemagglutination activity and toxicity effect on BSLT (Brine Shrimp Lethality Test) before mammalian cell culture test performed.
The results showed some accessions have fluctuations of the tuber weight like Singaraja, Merapi Farm, Indmira, and Solok accession. Bogor, Ogan Ilir, and Matesih accession showed tuber weight increasing in each month, from 1 to 6 months planting. The observation of the total protein level during growing period showed that Ogan Ilir protein increased linearly from 1 to 6 months, while other accessions showed fluctuation in total protein level during growing period. Three accessions, Singaraja, Merapi Farm, and Indmira have been produced lectin since 1 month planting. The other accessions, Bogor, Ogan Ilir, Matesih, and Solok were detected of lectin in 3 months planting. There is no accession showed linearly elevated levels of lectin from 1 month to 6 months planting, except Bogor accession. The tuber protein content has many proteins under 30 kDa. The above 30 kDa proteins in tuber were detected in 5 and 6 months old plant.
The tuber protein extract of 6 months old plant Solok accession was selected to lectin purification. It has the highest hemagglutination acitivity than the other accessions. The molecular weight of lectin from Solok accession is 12.67 kDa. 0-
The partial coding DNA sequence of each accessions were isolated with the size of 600 bp for each accessions. These sequences have high similarity with the
lectin coding DNA sequence of another plants in Araceae, such as T. divaricatum,
Pinellia ternata, and Pinellia pedatisecta.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
ASRI PIRADE PASERANG
REKAYASA GENETIK TEMBAKAU (Nicotiana tabacum L. cv. SR1)
DAN JARAK PAGAR (Jatropha curcas L.) DENGAN GEN
Penguji pada Ujian Tertutup:
Dr. Ence Darmo Jaya Supena, M.Si
(Staf pengajar pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor)
Prof. Dr. Ir. Bambang S. Purwoko, M.Sc
(Staf pengajar pada Departemen Agronomi dan Hortikultura Institut Pertanian Bogor)
Penguji pada Ujian Promosi:
Dr. Ence Darmo Jaya Supena, M.Si
(Staf pengajar pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor)
Dr. Saptowo J. Pardal, M.Si
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT Yang Maha Pengasih dan Maha Penyayang karena atas rahmat izin dan hidayah-Nya disertasi yang
berjudul “Rekayasa Genetik Tembakau (Nicotiana tabacum L. cv. SR1) dan Jarak Pagar (Jatropha curcas L.) dengan Gen Inhibitor of Meristem Activity (IMA)” dapat diselesaikan dengan baik. Disertasi ini merupakan salah satu syarat untuk memperoleh gelar Doktor pada Mayor Biologi Tumbuhan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Prof. Dr. Suharsono, DEA yang telah membiayai sebagian penelitian ini serta memberikan fasilitas penelitian. Kepada Dr. Ir. Utut Widyastuti, M.Si dan Dr. Ir. Aris Tjahjoleksono, DEA, kami mengucapkan terima kasih atas arahan dan bimbingan selama penelitian dan penulisan disertasi ini. Terima kasih penulis ucapkan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si dan Prof. Dr. Ir. Bambang S. Purwoko, M.Sc selaku penguji luar komisi pada ujian tertutup dan kepada Dr. Ir. Saptowo J. Pardal, M.Si selaku penguji luar komisi pada ujian promosi doktor yang telah memberikan saran demi kesempurnaan penulisan disertasi ini.
Terima kasih penulis ucapkan kepada Prof. Kawaichi dan Prof. Umeda,
Nara Institute of Science and Technology (NAIST) Nara-Japan, yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian tentang kloning gen. Ungkapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Mayor Biologi Tumbuhan, yang telah memberikan bekal ilmu dan bantuan sehingga penulis dapat menyelesaikan studi dengan baik. Tidak lupa ucapan terima kasih kepada rekan-rekan mahasiswa S3 BOT angkatan 2010 (Siti Ifadatin, Retno Lestari, Dr. Pieter Riupassa, Dr. Priyanti, Dr. Muh. Alfarabi, Dr. Zumaidar, dan Dr. Etty Siregar), rekan kerja Laboratorium Biotechnology Research Indonesia–the Netherland (BIORIN) PPSHB IPB (ibu Ifa, bapak Alias, ibu Dr. ST. Hidayani, Muchdar Davis, mba Ida, Seni Kurnia senjaya, Hayatul Fajri, Nurul Fitriah, Nuril Farizah, Yusdar Mustamin, Fattahillah, Andi Farhanah, Nono Gea, Muhammad Lutfi dan mba Pepy Elvavina), dan rekan kerja di Laboratorium Kultur Jaringan, PPSHB IPB (mba Nia, bapak Asep dan Sarah). Ungkapan terima kasih juga penulis ucapkan kepada istri (Muanah S.Sos) dan anak-anakku (Ahmad Fardizza Pirade, Hayyan Raffi Pirade dan Aimar Kinawa) atas kesabarannya mengiringi saya menempuh studi S3. Ungkapan terima kasih juga penulis sampaikan kepada orang tua ibunda Toban Fatimah dan ayahanda Drs. Sitangke Paserang (Alm), kakak (Idris P. Paserang) dan adik-adik (Nurhayati P. Paserang, Fajrianti P. Paserang, Jumadi P. Paserang, Muayyadah M. Amin) serta seluruh keluarga atas segala doa, dukungan, dan kasih sayangnya selama penulis menjalani program Doktor di IPB.
Akhir kata, semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat dan Kebaruan Penelitian 3
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 5
Gen Inhibitor of Meristem Activity 5
Pengklonan Metode Gateway 7
Biologi Agrobacterium 11
Agrobacterium dalam Rekayasa Genetik 14
Botani Tanaman Jarak Pagar (Jatropha curcas L.) 14
Transformasi Genetik pada Jarak Pagar 16
3 KONSTRUKSI VEKTOR EKSPRESI UNTUK GEN INHIBITOR OF
MERISTEM ACTIVITY (IMA) 18
Pendahuluan 18
Bahan dan Metode 19
Hasil dan Pembahasan 22
Simpulan 26
4 INTRODUKSI GEN INHIBITOR OF MERISTEM ACTIVITY (IMA) PADA
TANAMAN TEMBAKAU 27
Pendahuluan 27
Bahan dan Metode 28
Hasil dan Pembahasan 30
Simpulan 38
5 INTRODUKSI GEN INHIBITOR OF MERISTEM ACTIVITY (IMA) KE
TANAMAN JARAK PAGAR 39
Pendahuluan 39
Bahan dan Metode 40
Hasil dan Pembahasan 42
Simpulan 46
6 PEMBAHASAN UMUM 47
7 SIMPULAN DAN SARAN 49
DAFTAR PUSTAKA 50
LAMPIRAN 57
DAFTAR GAMBAR
1 Bagan alir penelitian rekayasa genetik tanaman tembakau dan jarak
pagar dengan mengintroduksi gen IMA 4
2 Model tentatif fungsi IMA dalam meregulasi aktifitas meristem dan determinasi bunga. (A) IMA sebagai inhibitor umum pada hormon
5 Peranan teknologi kloning gateway. Gen target dapat dipindahkan ke vektor Entri melalui PCR, restriksi endonuklease dan ligasi, atau situs spesifik rekombinasi dari pustaka cDNA yang didesain melalui vektor gateway. Sebuah gen di Entry Clone dapat ditransfer secara
bersamaan ke berbagai tujuan 10
6 Peta plasmid Ti yang terdiri dari T-DNA, daerah virulensi, opin dan
ORI 12
7 Interaksi tanaman dengan A. tumefaciens 13
8 Morfologi tanaman jarak pagar, A. Posisi buah terminal, B. Bunga situs primer spesifik Gateway IMAforward dan reverse. M= Marker
100bp, 1= pita gen IMA sens, 2= pita gen IMA antisens 23 11 Fragmen gen IMA dari plasmid pGWB402-IMA sens (A) dan
pGWB402-IMA antisens (B) 24
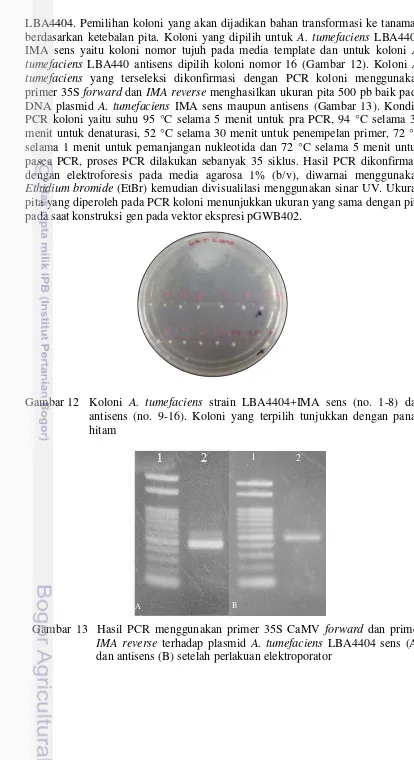
12 PCR koloni A. tumefaciens strain LBA4404+IMA sens (no. 1-8) dan antisens (no. 9-16). Koloni yang terpilih tunjukkan dengan panah
hitam 25
13 Hasil PCR menggunakan primer 35S CaMV forward dan primer
IMA reverse terhadap plasmid A. tumefaciens LBA4404 sens (A)
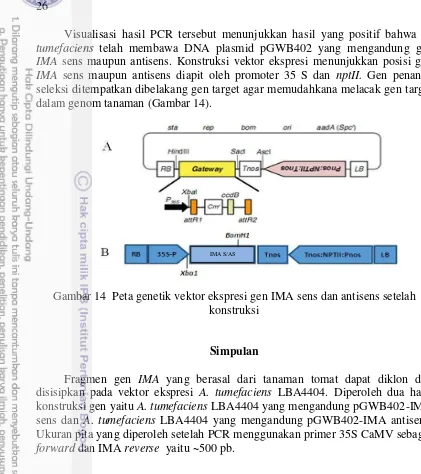
dan antisens (B) setelah perlakuan elektroporator 25 14 Peta genetik gen IMA sens dan antisens setelah konstruksi 26 15 Perkembangan kalus menjadi plantlet. A) Plantlet yang diberi
perlakuan kanamisin. B) Proses pengkalusan pada media induksi
kalus 31
16 Hasil PCR genom tembakau. M= Marker 100bp, 1-2= hasil PCR
dengan primer gen forward dan reverse 32
17 Hasil PCR genom tanaman transgenik dengan gen IMA sens menggunakan primer spesifik 35SCaMV forward dan IMA reverse, (A) semua galur menghasilkan pita 500 pb kecuali galur nomor 36
(B) kontrol internal dengan gen actin 32
18 Morfologi tembakau perlakuan transformasi dengan gen IMA sens
19 Perbandingan pembungaan tanaman transgenik menggunakan gen
IMA sens (A) dan tanaman tanpa perlakuan (B) 33
20 Seleksi biji tembakau IMA sens pada tanaman T0 menggunakan 60
μg/ml kanamisin. Tanda panah kuning menunjukan tanaman yang toleran terhadap kanamisin (transgenik), dan panah biru menunjuk
ke tanaman yang peka terhadap kanamisin (non transgenik) 34 21 Seleksi biji tembakau IMA sens pada tanaman T0 menggunakan 60
μg/ml kanamisin 36
22 Bunga transgenik gen IMA sens (A), bunga tanaman tanpa perlakuan
(B), bunga tanaman transgenik gen IMA antisens (C) 37 23 Hasil PCR genom tanaman putatif transgenik T0 IMA antisens. (A)
menggunakan primer spesifik 35S CaMV dan IMA forward. (B)
menggunakan primer actin 38
24 Proses introduksi gen IMA sens pada Jarak pagar, (A) kokultivasi, (B) pengkalusan, (C & D) pemanjangan tunas, (E) pengakaran, (F)
aklimatisasi 44
25 Hasil PCR genom tanaman transgenik dengan gen IMA sens. 1= marker 100 bp, 2= plasmid, 3= non transgenik, 4= PCR menggunakan primer spesifik gen, (5,6,7,9,14)= PCR menggunakan
primer 35S CaMV dan IMA reverse 45
26 Perkembangan in vitro tanaman jarak pagar yang ditransformasi dengan gen IMA antisens, (A) kokultivasi, (B) pertunasan, (C)
DAFTAR TABEL
1 Jumlah eksplan, kalus dan tunas N. tabacum 31
2 Nilai sebaran populasi tanaman T0 tembakau + IMA sens 34 3 Uji Chi square segregasi tanaman T0 IMA sens 35 4 Nilai sebaran populasi tanaman T1 tembakau + IMA sens 35 5 Nilai sebaran populasi tanaman T0 tanaman tembakau IMA +
antisens 36
6 Nilai sebaran populasi tanaman T1 tanaman tembakau IMA +
antisens 36
7 Hasil pengujian resistensi tembakau transgenik T1 terhadap
DAFTAR LAMPIRAN
1 Komposisi media Luria Bertani untuk 100 ml 59
2 Komposisi media untuk transformasi N. tabacum cv SR1 60
1 PENDAHULUAN
Latar Belakang
Seiring dengan kemajuan zaman dan bertambahnya jumlah penduduk, maka kebutuhan akan sumber energi juga semakin besar. Bahan bakar minyak yang selama ini menjadi sumber energi utama jumlahnya semakin menipis dan harganya pun tidak stabil. Di samping itu, energi ini pun tidak dapat diperbaharui karena berasal dari fosil yang terbentuk melalui proses yang sangat lama mencapai jutaan tahun. Oleh karena itu dibutuhkan sumber energi baru yang dapat diperbaharui untuk menjaga ketersediaan energi di masa yang akan datang. Jarak pagar merupakan salah satu solusi untuk mengatasi masalah kebutuhan dan ketersediaan energi tersebut.
Usaha mengurangi ketergantungan terhadap minyak bumi dan mengurangi emisi gas rumah kaca, diperlukan pengembangan bahan bakar alternatif ramah lingkungan. Pemerintah telah memberikan perhatian yang serius untuk pengembangan bahan bakar nabati (biofuel) dengan menerbitkan Instruksi Presiden No. 1 Tahun 2006 tanggal 25 Januari 2006. Inpres tersebut tentang Penyediaan dan Pemanfaatan Bahan Bakar Nabati sebagai Bahan Bakar Lain yang menyebutkan bahwa penyediaan biofuel pada tahun 2025 minimal 5% dari kebutuhan energi nasional.
Tanaman jarak pagar (Jatropha curcas L.) merupakan salah satu tanaman yang pada awalnya merupakan tanaman yang digunakan sebagai tanaman pagar di lahan pertanian dan perumahan karena dapat dengan mudah diperbanyak dan ditanam rapat untuk tujuan tersebut. Tanaman ini berpotensi sebagai penghasil bahan baku energi terbarukan (Achten et al. 2010). Keuntungan jarak pagar sebagai sumber bahan biodiesel antara lain, 1) minyak jarak pagar tidak termasuk dalam kategori minyak makan (non edible oil) sehingga pemanfaatan jarak pagar sebagai bahan baku biodiesel tidak akan mengganggu penyediaan kebutuhan minyak makan nasional, 2) tanaman jarak pagar ini dapat beradaptasi dengan lahan pada kondisi kering (curah hujan <500 mm per tahun), 3) dapat tumbuh pada lahan dengan kesuburan rendah (lahan marjinal dan lahan kritis), 4) biji jarak pagar mengandung minyak dengan rendemen 30 – 40% (King et al. 2009).
2
penghasil bioenergi sangat penting untuk mengantisipasi kelangkaan bahan bakar berbasis fosil di masa yang akan datang. Bahan bakar alternatif yang mulai banyak dikembangkan saat ini adalah yang berasal dari minyak nabati (biofuel) dan bersifat terbarukan (renewable fuels) seperti kelapa sawit, tebu, singkong, dan jarak pagar.
Perumusan Masalah
Produktivitas tanaman jarak pagar menjadi perhatian utama dalam pemulian tanaman. Perbandingan bunga betina yang sangat sedikit dibandingkan dengan bunga jantan merupakan salah satu faktor pembatas produktivitas (Hartati 2006). Keberhasilan pembentukan buah pada tanaman ini cukup tinggi, sebab sekitar 92% dari bunga betina mampu berkembang menjadi buah namun jumlah bunga betina yang sedikit, mengakibatkan total produksi buah rendah.
Salah satu strategi untuk meningkatkan kualitas produktivitas jarak pagar yaitu dengan teknologi rekayasa genetika. Rekayasa genetika tanaman adalah suatu teknik untuk memindahkan gen spesies asing ke dalam suatu sel tanaman, yang diikuti dengan regenerasi dari sel-sel tanaman tersebut sehingga menjadi tanaman lengkap. Metode transformasi genetik telah diaplikasikan untuk mengintroduksikan gen Inhibitor of Meristem Activity (IMA) ke tanaman model dan tanaman target. Gen IMA telah diisolasi dari tanaman tomat (Solanum lycopersicum L.) dan telah berhasil diekspresikan secara berlebih pada tanaman tomat yang menghasilkan tanaman transgenik yang menghasilkan bunga yang lebih banyak (Sicard et al. 2008a). Ekspresi gen IMA secara berlebih (over expression) di dalam tanaman jarak pagar, diharapkan menghasilkan tanaman transgenik yang berbunga lebih banyak sehingga dapat menghasilkan buah dan biji yang lebih banyak.
Gen IMA yang telah berhasil diisolasi dari tanaman tomat harus dapat disisipkan ke vektor ekspresi supaya dapat digunakan untuk melakukan transformasi genetik tanaman. Gen IMA yang tersisip di dalam vektor ekspresi A. tumefacies belum tersedia sehingga perlu dilakukan konstruksi vektor ekspresi untuk gen IMA. Peranan gen dapat dipelajari bila gen IMA diekspresikan secara berlebih dan dibungkam (silencing), sehingga konstruksi ekspresi gen IMA
dilakukan dengan dua orientasi. Konstruksi gen IMA dengan orientasi transkripsi searah dengan promoter kuat (sens) ditujukan untuk ekspresi berlebih dan konstruksi dengan arah transkripsi gen berlawanan arah dengan promoter kuat (antisens) dimaksudkan untuk membungkam ekspresi gen.
Introduksi gen ke dalam genom tanaman untuk mengekspresikan gen target merupakan suatu upaya perbaikan sifat yang terarah karena langsung mengenai karakter yang diinginkan. Introduksi gen untuk melakukan transformasi genetik tanaman dengan bantuan Agrobacterium merupakan metode yang banyak digunakan karena dianggap paling efektif serta memiliki efisiensi transformasi yang tinggi. Transformasi genetik tanaman jarak pagar dengan perantaraan
3 Pemilihan eksplan dan metode seleksi sangat berpengaruh terhadap keberhasilan perakitan jarak pagar transgenik. Trivedi et al. (2009) yang menggunakan higromisin sebagai agen seleksi, dan Mazumdar et al. (2010) yang menggunakan kanamisin sebagai agen seleksi, belum menghasilkan tanaman transgenik. Pada penelitian selanjutnya, tanaman jarak pagar transgenik dapat diperoleh dari eksplan daun muda (Zong et al. 2010) serta kotiledon (Pan et al. 2010) dengan penundaan pemberian agen seleksi kanamisin pada tahap induksi kalus. Metode seleksi yang lain dikembangkan oleh Kajikawa et al. (2012) dan berhasil mendapatkan tanaman transgenik dengan menggunakan byspiribac sebagai agen seleksi.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengetahui peranan gen IMA pada pertumbuhan tanaman. Tujuan khusus penelitian ini adalah 1) mengkonstruksi vektor ekspresi yang membawa gen IMA dengan orientasi sens dan antisens, 2) melakukan rekayasa genetika tanaman tembakau dengan gen IMA dengan orientasi ekspresi sens dan antisens, dan 3) melakukan rekayasa genetika tanaman jarak pagar dengan gen IMA dengan orientasi ekspresi sens dan antisens.
Manfaat dan Kebaruan Penelitian
Manfaat dari penelitian ini adalah menyediakan vektor ekspresi gen IMA. Gen ini dapat diaplikasikan pada berbagai spesies tanaman, baik untuk menghambat pembungaan maupun untuk menginduksi pembungaan. Induksi pembungaan biasanya diikuti dengan penurunan pertumbuhan vegetatif. Tanaman yang kecil atau kerdil tetapi berbunga sangat bermanfaat dalam perakitan tanaman hias transgenik. Di lain fihak, penghambatan pembungaan diharapkan dapat menginduksi pertumbuhan vegetatif. Pertumbuhan vegetatif yang cepat sangat berguna dalam produksi kayu, sehingga strategi penghambatan pembungaan sangat bermanfaat industri yang menggunakan kayu sebagai bahan dasar seperti untuk bangunan dan industri bubur kertas dan kertas (pulp and paper).
Penelitian ini memiliki kebaruan yaitu: (1) konstruksi vektor ekspresi untuk gen IMA dengan orientasi sens dan antisens yang terdapat di dalam A. tumefaciens, (2) tanaman tembakau transgenik yang mengekspresi gen IMA dan yang membungkam ekspresi gen IMA, dan (3) tunas jarak pagar transgenik yang mengandung gen IMA dengan arah ekspresi sens.
Ruang Lingkup Penelitian
4
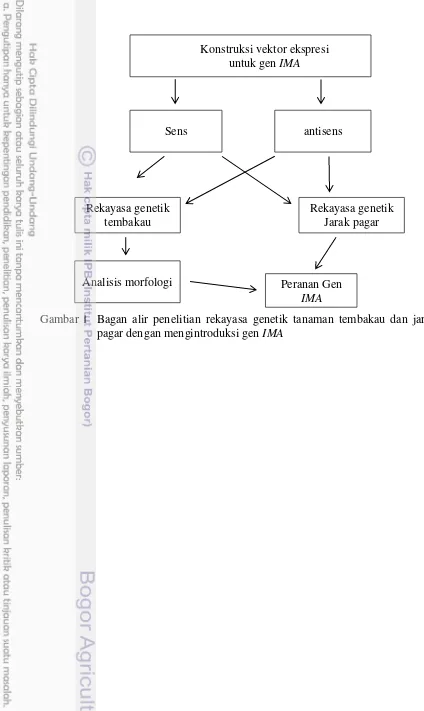
Gambar 1 Bagan alir penelitian rekayasa genetik tanaman tembakau dan jarak pagar dengan mengintroduksi gen IMA
Konstruksi vektor ekspresi untuk gen IMA
Sens antisens
Rekayasa genetik tembakau
Analisis morfologi
Rekayasa genetik Jarak pagar
Peranan Gen
5
2 TINJAUAN PUSTAKA
Gen Inhibitor of Meristem Activity
Perkembangan dan pertumbuhan tanaman berlangsung secara terus menerus selama tanaman masih hidup. Jaringan tanaman vaskular memiliki kemampuan untuk membentuk organ baru yang didukung oleh daerah sel yang selalu membelah yang disebut meristem. Shoot apical meristem (SAM) terdiri atas
central zone (CZ) yang meliputi organizing central (OC), yang mendasari pembelahan sel, dikelilingi oleh peripheral zones (PZ) (Castellano dan Sablowski 2005). Perkembangan pembelahan sel pada CZ dikendalikan oleh protein homeodomain WUSCHEL (WUS) yang diekspresikan dalam OC pada CZ (Laux
et al. 1996; Mayer et al. 1998). Selama induksi bunga, SAM diubah menjadi meristem perbungaan yang pada gilirannya menimbulkan beberapa meristem bunga atau Floral Meristem (FM) (Blazquez et al. 2006). Dua gen utama LEAFY
(LFY) dan APETALA1 (AP1) menentukan identitas FM. Berbeda dengan SAM, FM memperlihatkan pertumbuhan yang mengarah ke pembentukan sejumlah organ sebelum penghentian aktivitas meristematik. Proses ini disebut floral termination, yang merupakan respon negatif yang melibatkan pengendali perkembangan meristem yaitu gen WUSCHEL (WUS) dan gen AGAMOUS (AG) (Lenhard et al. 2001). Setelah induksi bunga, LFY dan WUS diekspresikan dan mengaktifkan AG di tengah FM yang pada gilirannya merepresi WUS untuk perkembangan bunga.
Serangkaian gen spesifik yang mengatur pembentukan organ-organ bunga diatur berdasarkan pola ABC dan memiliki fungsi yang berbeda (Jack 2004). Gen C dan E mengendalikan pembentukan carpel dan terdapat pada lingkaran ke-4 (Castillejo et al. 2005; Ferrario et al. 2006). Sedangkan ovul yang terletak di pusat carpel dikendalikan oleh gen tipe D (Colombo et al. 1995).
Perkembangan ovul terjadi setelah melewati 4 fase (Schneitz et al. 1997). Fase pertama yaitu inisiasi primordia bakal biji dari plasenta yang terdapat di dalam carpel. Fase kedua terjadi spesifikasi identitas bakal biji, kemudian diikuti oleh pembentukan bagian-bagian ovul di fase ketiga. Pada fase ke-4, primordia bakal biji berkembang menjadi nucellus yang mengandung megaspore mother cell
(MMC). MMC kemudian mengalami meiosis menghasilkan empat megaspora dan MMC yang dekat dengan mikropil dapat bertahan dan akhirnya membentuk kantung embrio. Dalam angiospermae, ovul terdiri atas nucellus tertutup yang didukung oleh integumen dan funiculus yang menghubungkan ovul ke plasenta (Bouman dan Meijer 1994). Perkembangan ovul berada di bawah kontrol genetik yang ketat (Skinner et al. 2004), dan karena ovul berasal dari plasenta sebagai daerah meristematik spesifik, maka gen pengatur seperti WUS memainkan peran kunci dalam organogenesis ovul (Gallois et al. 2002). WUS dalam primordia ovul berperan dalam koordinasi pembentukan gametofit betina selama perkembangan ovul (Groß-Hardt et al. 2002; Skinner et al. 2004).
6
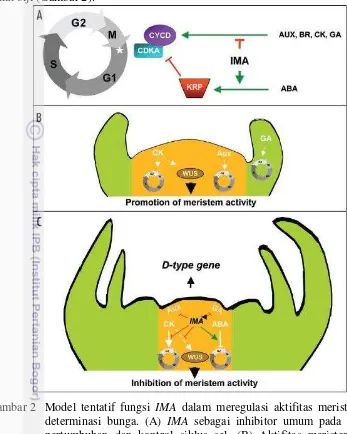
terbukti terlibat dalam inisiasi primordia bakal biji dan determinasi dari nucellus bakal biji (Gambar 2).
Gambar 2 Model tentatif fungsi IMA dalam meregulasi aktifitas meristem dan determinasi bunga. (A) IMA sebagai inhibitor umum pada hormon pertumbuhan dan kontrol siklus sel, (B) Aktifitas meristem tanpa ekspresi gen IMA, (C) Penghambatan aktifitas meristem oleh gen IMA (Sicard et al. 2008a)
Ekspresi gen ini dijumpai ketika pembelahan sel pada tahap perkembangan buah (Joubès et al. 2001). Gen IMA menyandikan 90 asam amino yang dikelompokkan dalam mini zinc finger (MIF) (Hu dan Ma 2006). Gen IMA
mengatur proses pembungaan dan perkembangan ovul, menghambat proliferasi sel selama terminasi floral, mengontrol jumlah carpel selama perkembangan bunga dan menginisiasi ovul primordial. Gen IMA dapat bertindak sebagai penghambat terhadap gen WUSCHEL yang mengontrol kelompok pusat meristem dan determinasi nucellus selama perkembangan ovul (Sicard et al. 2008a).
7 dalam mengatur lintasan signal beberapa hormon dan merupakan faktor penting dalam mengendalikan lintasan aktivitas meristem yang berkaitan dengan pembelahan sel dan diferensiasi (Sicard et al. 2008b).
Analisis ekspresi berlebih gen IMA telah dilakukan pada tanaman
Arabidopsis dan tomat akan tetapi belum pernah dilakukan analisis ekspresi gen
IMA di tanaman tembakau dan jarak pagar. Tembakau merupakan tanaman dikotil dan inang alami untuk A. tumefaciens (Mayo et al. 2006). Tanaman model yang sering digunakan dalam transformasi genetik yaitu N. tabacum (Mayo et al. 2006; Bhatti dan He 2009) dan N. benthamiana (Anggraito 2012). Pada jenis N. tabacum seperti Samsun (Stanic et al. 1999), SRI (Bhatti dan He 2009), Bright yellow (An 1985), Xanthi (Guiying et al. 2012), dan KasturI (Miswar et al. 2005) telah berhasil dilakukan transformasi melalui perantara A. tumefaciens.
Keberhasilan transformasi genetik tembakau telah digunakan untuk berbagai tujuan seperti mengungkap regulasi sistem biologi tanaman, bioremediasi untuk merkuri, tanaman model untuk pengujian cekaman biotik dan abiotik. Gen-gen yang berhubungan dengan cekaman lingkungan juga telah berhasil diintroduksikan pada tembakau seperti gen Citrate synthase (De la Fuente et al.
1997) dan gen Copper/Zinc Superoxida Dismutase (CuZnSOD) (Hannum 2012). Keunggulan tanaman tembakau sebagai tanaman model karena jumlah bijinya yang banyak, siklus hidupnya pendek, secara in vitro mudah diinduksi menjadi tanaman utuh dan efisiensi transformasi tinggi.
Pengklonan Metode Gateway
Kloning DNA adalah proses penggandaan jumlah DNA rekombinan melalui perkembangbiakan sel bakteri (biasanya E. coli). Proses kloning dilakukan dengan memasukkan DNA rekombinan ke dalam sel E. coli. Selanjutnya sel E.coli
diinkubasi pada suhu optimal sehingga sel dapat berkembang biak secara eksponensial. DNA rekombinan merupakan gabungan antara DNA vektor yang merupakan molekul DNA yang dapat mereplikasi diri dan DNA asing ynag biasanya berupa gen dari suatu makhluk hidup. Penggabungan DNA vektor dan DNA asing ini biasanya dibantu oleh enzim ligase sehingga disebut dengan proses ligasi. Molekul DNA yang masuk ke dalam sel akan mengubah fenotipe sel tersebut, sehingga proses ini disebut transformasi. Sel yang digunakan dalam proses transformasi biasanya disebut dengan sel kompeten. Konfirmasi keberhasilan terbentuknya DNA rekombinasi dan penggandaan jumlah gen yang disisipkan ke dalam plasmid sel kompeten melalui kloning DNA dilakukan dengan melihat perubahan yang terjadi pada koloni yang ditumbuhkan pada media. Koloni yang berwarna putih dapat dipastikan merupakan sel yang membawa DNA rekombinan. Langkah berikutnya yaitu isolasi DNA rekombinan dari sel E. coli , pemotongan DNA dengan enzim restriksi yang digunakan dalam pembuatan DNA rekombian, pemisahan DNA melalui gel elektroforesis dan visualisasi DNA.
8
diinginkan dari satu organisme ke dalam suatu vektor, misalnya plasmid. Fragmen DNA dan vektor yang telah bergabung disebut molekul DNA rekombinan. DNA rekombinan tersebut kemudian dapat diperbanyak dalam suatu sel inang. Tahap awal yang umum dilakukan dalam pengklonan gen adalah isolasi fragmen DNA dan vektor, misalnya dari bakteri, dan setelah diisolasi fragmen DNA dan vektor dipotong dengan enzim restriksi yang sama. Tahap selanjutnya adalah menggabungkan fragmen DNA dengan vektor yang dibantu oleh enzim ligase, sehingga disebut juga tahap ligasi, menghasilkan molekul DNA rekombinan. Molekul DNA rekombinan kemudian ditransformasikan ke dalam bakteri. Transformasi adalah proses memasukkan DNA asing (DNA rekombinan) ke dalam sel inang. Sel inang yang telah mengalami transformasi (mengandung DNA rekombinan) kemudian diseleksi berdasarkan gen penanda yang dibawa oleh plasmid. Gen penanda, atau selectable marker, biasanya berupa gen yang menyandikan ketahanan terhadap antibiotik. Sel inang yang telah diseleksi selanjutnya ditransformasi ke dalam sel target. Tahap terakhir adalah meneliti gen yang diklon, yaitu dengan mendapatkan informasi mengenai lokasi gen, cara gen ditranskripsi, hasil translasi yang dikode oleh gen, dan struktur gen.
Pengklonan metode gateway merupakan salah satu metode pengklonan dengan rekombinasi situs spesifik secara in vitro. Teknologi pengklonan DNA sangat penting dalam bidang biologi, terutama genetika dan biologi molekuler. Pengklonan DNA dibutuhkan untuk analisis fungsional gen dan ekspresi gen. Saat ini telah berkembang teknik pengklonan DNA dengan menggunakan prinsip rekombinasi situs spesifik yang lebih efisien dibandingkan dengan teknik pengklonan yang menggunakan enzim restriksi (Hartley et al. 2000; Akbari et al.
2009).
Metode pengklonan gateway, yang ditemukan dan dikembangkan oleh Invitrogen sejak akhir tahun 1990-an, adalah suatu metode biologi molekuler yang memungkinkan peneliti untuk memindahkan fragmen DNA dari suatu plasmid ke plasmid lain secara efisien dengan menggunakan suatu set sekuen rekombinasi
yang disebut situs “att gateway”, dan dua mix enzim yang disebut enzim BP clonase dan LR clonase. B merupakan singkatan dari bacterial dan P (phage), sedangkan L (left) dan R (right) (Magnani et al. 2006; Karimi et al. 2007; Nakagawa et al. 2007; Akbari et al. 2009).
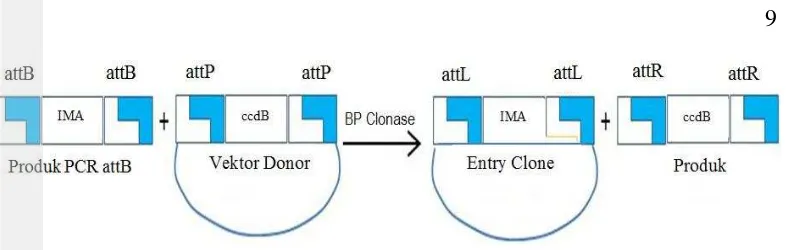
Sistem ini mengontruksi gen sisipan yang terlebih dahulu diklon ke dalam vektor entri (pENTR) dan kemudian ditransfer ke dalam vektor destinasi dengan rekombinasi situs spesifik. Metode ini dapat secara efektif menggantikan fungsi dari enzim restriksi endonuklease dan ligase pada metode pengklonan biasa. Metode pengklonan gateway sebenarnya memanfaatkan reaksi rekombinasi situs spesifik yang memungkinkan bakteriofag lambda untuk berintegrasi ke dalam kromosom bakteri atau sebaliknya. Protokol gateway sangat bergantung pada reaksi BP dan LR clonase. Reaksi BP dikatalisis oleh enzim mix BP clonase yang terdiri atas enzim integrase fage (Int) dan protein Integration Host Factor (IHF) (Dubin et al. 2008). Enzim BP clonase memindahkan suatu fragmen DNA yang diinginkan, misalnya produk PCR, yang diapit oleh dua situs bacterial attachment
9
Gambar 3 Reaksi BP clonase dalam metode Gateway (Invitrogen 2003) Rekombinasi terjadi antara situs attB dan attP yang cocok, selanjutnya fragmen DNA disisipkan ke dalam vektor donor, menghasilkan suatu klon entri (pENTR) yang diapit oleh dua situs left attachment (attL). Klon entri juga dapat dirakit oleh restriksi dan ligasi fragmen DNA dalam vektor yang mana situs pengklonan jamaknya diapit oleh situs attL (Karimi et al. 2007; Dubin et al.
2008). Klon entri merupakan substrat kunci dalam reaksi LR (Gambar 4) yang dikatalisis oleh mix enzim LR clonase yang terdiri atas enzim integrase (Int),
exsisionase fage (Xis), dan protein IHF. Enzim LR clonase memindahkan fragmen DNA yang diinginkan yang diapit oleh dua situs attL (di dalam klon entri) ke dalam vektor destinasi (pDEST) yang membawa dua situs right attachment (attR).
Gambar 4 Reaksi LR clonase dalam metode gateway (Invitrogen 2003) Rekombinasi terjadi antara situs attL dan attR yang cocok, selanjutnya fragmen DNA disisipkan ke dalam klon ekspresi (pEXPR) dan diapit lagi oleh situs attB (Karimi et al. 2007). Hasil rekombinasi dapat diseleksi dengan kombinasi seleksi positif (resisten terhadap antibiotik) dan seleksi negatif (gen sitotoksik ccdB). Gen sitotoksik Control of Cell Death B (ccdB) terdapat pada vektor donor dan vektor destinasi. Saat rekombinasi pada reaksi BP terjadi, gen ccdB akan bertukar dengan fragmen DNA yang diinginkan sehingga vektor yang tidak disisipi DNA tersebut akan mati karena gen ccdB. Begitu juga pada reaksi LR, fragmen DNA yang telah diapit oleh situs attL akan bertukar dengan gen
ccdB yang telah diapit oleh situs attR pada vektor destinasi (Bernard dan Couturier 1992).
Vektor gateway mempunyai dua daerah att yang diapit suatu pita yaitu 1) gen ccdByang berperanan sebagai kontrol negatif (pada vektor donor, destination,
dan supercoiled entry vector), 2) gen ketahanan terhadap Cloramphenicol (cmR)
counter selection (pada donor dan destination vectors). Gen ccdB akan digantikan oleh gen sisipan dan menghasilkan entry clone dan expression clone. Keberadaan gen ccdB adalah sebagai kontrol negatif pada donor dan destination. Protein ccdB terganggu dengan adanya DNA gyrase pada E.coli (Bernard dan Couturier 1992), dengan demikian menghambat pertumbuhan hampir semua strain E.coli (misalnya
DH5α™, TOP10). Pada saat rekombinasi (misalnya antara destination vector dan
10
gen sisipan. Vektor yang tidak tersisipi akan mati sehingga metode gateway
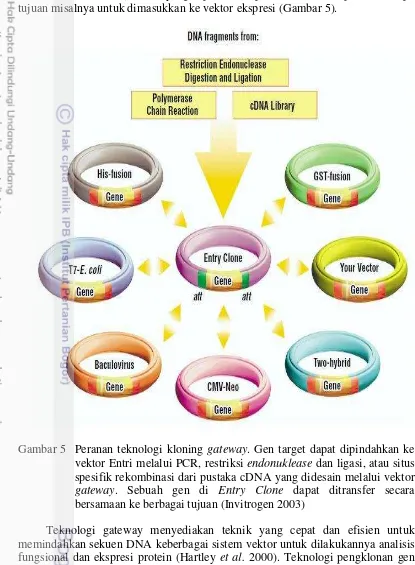
memiliki efisiensi yang tinggi untuk mendapatkan klon target (Bernard dan Couturier 1992). Entry clone yang diperoleh dapat dimanfaatkan pada beberapa tujuan misalnya untuk dimasukkan ke vektor ekspresi (Gambar 5).
Gambar 5 Peranan teknologi kloning gateway. Gen target dapat dipindahkan ke vektor Entri melalui PCR, restriksi endonuklease dan ligasi, atau situs spesifik rekombinasi dari pustaka cDNA yang didesain melalui vektor
gateway. Sebuah gen di Entry Clone dapat ditransfer secara bersamaan ke berbagai tujuan (Invitrogen 2003)
11 penggunaan dan ekspresi dari berbagai tipe sekuen DNA (misalnya dari hasil PCR,
clone cDNA, atau dari fragmen restriksi, 3) memudahkan pemindahan sejumlah besar sekuen DNA ke berbagai destination vector (Hartley et al. 2000).
Biologi Agrobacterium
Rekayasa genetik pada tanaman semakin meningkat setelah diketahui bahwa
Agrobacterium tumefaciens dapat menginfeksi tanaman dikotil dan beberapa tanaman monokotil. Agrobacterium merupakan bakteri tanah dan bersifat gram negatif (Srivasta 2002). Secara alami Agrobacterium pada tanaman dikotil dapat menyebabkan tumor yang dikenal dengan crown gall (Smith dan Hood 1995). Hal ini disebabkan oleh ekspresi DNA di dalam sel-sel tanaman yang terinfeksi. T-DNA terdiri atas gen-gen yang terlibat dalam sintesis hormon pertumbuhan dan produksi opin yang merupakan kondensasi antara asam amino dan gula (Sheng dan Citovsky 1996). Peningkatan aktivitas sitokinin dan indol acetic acid (IAA) dapat menginduksi tumor. Kedua hormon tersebut diperlukan untuk menghasilkan opin sebagai sumber makanan (McCullen dan Binns 2006). Pada proses ini, DNA dari Agrobacterium tipe liar ditransfer ke nukleus. Jenis Agrobacterium yang dapat menyebabkan crown gall yaitu A. rubi yang menginfeksi Rubus idaeus dan
A. rhizogenesis yang menginfeksi jaringan akar (Otten et al. 2008).
Komponen genetik Agrobacterium yang diperlukan untuk transformasi sel tanaman yaitu, komponen pertama adalah T-DNA yang diperlukan untuk mentransfer gen dari sel bakteri ke dalam sel tanaman. T-DNA terdapat dalam Ti plasmid Agrobacterium. Bagian ujung T-DNA dibatasi oleh pembatas atau border
di sisi sebelah kiri dan kanan. Komponen kedua adalah daerah virulensi (vir) yang berukuran 35-Kpb yang mengandung tujuh lokus mayor yaitu virA, virB, virC, virD, virE, virG dan virH. Komponen ketiga adalah gen virulen kromosomal (vk) yang terletak di kromosom bakteri (Sheng dan Citovsky 1996),
Kemampuan Agrobacterium menginfeksi sel inang berkaitan dengan plasmid yang berukuran besar sebagai penginduksi tumor atau tumor-inducing
12
Gambar 6 Peta plasmid Ti yang terdiri atas T-DNA, daerah virulensi, katabolisme opin dan daerah origin of replication (Hooykaas dan Beijersbergen 1994)
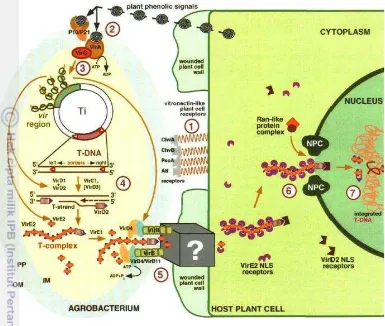
McCullen dan Binns (2006) membagi tahapan masuknya T-DNA ke dalam tanaman menjadi 7 tahap yaitu: 1) pengenalan senyawa kimia tanaman inang dan pengaktifan ekspresi gen virulensi, 2) pengenalan fisik dan interaksi antara bakteri dan inang, 3) produksi substrat yang ditransfer 4) transfer subtrat dari bakteri ke dalam sel inang, 5) pergerakan substrat ke dalam nukleus, 6) integrasi T-DNA ke dalam genom inang dan 7) ekspresi T-DNA di dalam sel inang (Gambar 7).
Proses pengenalan terjadi dalam dua tahapan yaitu aktifasi gen virulen dan pengikatan sel inang (McCullen dan Binns 2006). Sel tanaman yang mengalami luka akan mengeluarkan eksudat berupa senyawa kimia. Kompleks senyawa reseptor virA/virG mengenali senyawa kimia tersebut yang terdapat pada membran plasma Agrobacterium. Gen virA mengenali senyawa opin kemudian akan ditransduksikan melalui virG untuk mengaktifkan salinan gen yang akan ditransfer ke sel inang. Tahapan mekanisme tersebut merupakan karakteristik bakteri konjugatif. Agrobacterium akan melekat pada permukaan sel kemudian terjadi sintesis filamen selulosa untuk memperkuat pelekatan (Zupan et al. 1996). Proses fosforilasi melibatkan gen virA dan virG yang mempunyai homologi dengan gen yang menyandikan dua sensor kinase untuk menerima respon. Gen virG dalam kondisi tidak aktif menempel pada protein virA sebagai penerima signal. Jika terdapat signal berupa opin, gula, PO4 dan pH rendah opin maka virG
menjadi bentuk yang terfosforilisasi dan terlepas dari virA. Pemberian opin termasuk di dalamnya oktopin, nopalin, leucinopin, dan sucinamopin meningkatkan induksi 2-10 kali. Asetosiringon dapat mengaktifkan gen virA dan virG (Veluthambi et al. 1989). Asetosiringon dan ADP-glukosa meningkatkan efisiensi transformasi pada embrio muda tanaman gandum (Cheng et al. 1997).
Batas Kanan
Batas Kiri Auksin
Sitokinin
Opin
Katabolisme opin
Ori
Gen-gen
13 Gen virG akan mengaktifkan operon gen vir yang berperan mengatur transport T-DNA ke dalam genom tanaman (Zupan et al. 1996).
Gambar 7 Interaksi tanaman dengan A. tumefaciens (Sheng dan Citovsky 1996) Bersama dengan aktivasi gen vir, Agrobacterium melekatkan diri pada sel inang. Terdapat dua tipe pelekatan Agrobacterium pada sel inang yaitu pelekatan nonspesifik dan spesifik. Pelekatan nonspesifik dapat diketahui dengan cara pencucian menggunakan buffer garam. Jumlah bakteri yang melekat pada satu sel inang berkisar 200-1000 bakteri. Pelekatan spesifik terjadi dengan terbentuknya T-pilus yang tersusun dari ß1-2 glukan. Gen-gen pada kromosom chvA, chvB dan pscA (exoC) (McCullen dan Binns 2006), serta virB di Ti plasmid (Judd et al.
2005) terlibat dalam pembentuk sintesis dan lokalisasi pilus.
T-DNA dibatasi oleh sekuen 25 pb yang dikenal dengan batas kanan (right border) dan batas kiri (left border) (Zambryski et al. 1981). Protein kompleks VirD1/VirD2 berfungsi mengenali dan memotong bagian T-DNA pada bagian batas kanan sehingga terlepas menjadi utas tunggal dan setelah mencapai batas kiri maka utas tunggal T-DNA terpotong dari plasmid Ti. Utas tunggal T-DNA tersebut diselimuti dengan VirE2 untuk menghindari pemotongan nuklease (Citovsky et al. 1989). VirD1 kemudian dilepaskan dari potongan utas tunggal T-DNA dan virD2 tetap melekat pada utas tunggal T-T-DNA (Zupan et al. 1996).
14
daerah terminal C menyebabkan VirD mengalami kegagalan transfer (van Kregten
et al. 2009). Integrasi T-DNA ke dalam kromosom inang diilustrasikan seperti pada Gambar 7 (Tzfira et al. 2004).
Agrobacterium dalam Rekayasa Genetik
Laporan mengenai keberhasilan transformasi genetik yang dimediasi oleh
Agrobacterium pada berbagai spesies dan kultivar telah banyak dilakukan. Beberapa publikasi menunjukkan bahwa transformasi dapat terjadi ke target non tanaman seperti organisme bersel tunggal (uniseluler) mulai dari bakteri hingga khamir dan organisme bersel banyak (multiseluler) mulai dari fungi hingga manusia (Tzfira dan Citovsky 2006). Pemanfaatan Agrobacterium dalam introduksi DNA ke dalam tanaman target memiliki keunggulan dibandingkan dengan metode lain yaitu lebih ekonomis dan jumlah kopi transgen yang terintegrasi adalah rendah (Paz et al. 2004).
Beberapa faktor yang mempengaruhi infeksi Agrobacterium yaitu mulai pengenalan terhadap inang hingga integrasi gen target ke dalam genom inang (Zupan et al. 1996). Intensitas cahaya yang tinggi dapat mempengaruhi kemampuan Agrobacterium dalam menginfeksi sel inang. Dalam kondisi ada cahaya kemampuan bakteri tersebut menginfeksi tanaman berkurang disebabkan penurunan jumlah flagella. Penurunan pembentukan flagella disebabkan adanya penghambatan operon flaABC oleh cahaya sehingga kemampuan pembentuk flagellin menurun (Oberpichler et al. 2008). Agrobacterium mampu tumbuh optimum baik pada kondisi pH netral, asam dan sedikit basa. Patogenitas bakteri tersebut meningkat pada kondisi asam (Li et al. 2007).
Pada penelitian yang diarahkan untuk menguji ekspresi suatu gen, gen target harus disisipkan pada DNA di antara promoter dan terminator. Selain itu, T-DNA harus mengandung gen penyeleksi untuk membedakan sel-sel transgenik dari sel-sel non transgenik. Gen penyeleksi tersebut dapat berupa gen resistensi terhadap antibiotik (Chee et al. 1989), atau gen resistensi terhadap herbisida (Fang
et al. 2004). Sebagai gen pelapor ekspresi dapat digunakan gen ß glucuronidase
(GUS) (Batra dan Kumar 2003) atau green fluorescent protein (GFP) (Yancheva
et al. 2006).
Introduksi gen IMA menggunakan A. tumefaciens telah berhasil dilakukan pada tanaman tembakau dan jarak pagar (Paserang et al. 2015). Ezaki et al. (2000) mengintroduksikan beberapa gen glutation S-transferase, peroksidase, inhibitor disosiasion GDP dan blue copper-binding protein dengan bantuan A. tumefaciens
LBA4404.
Botani Tanaman Jarak Pagar
Tanaman jarak pagar (J. curcas L.) berasal dari Meksiko, Amerika Tengah, termasuk famili Euphorbiaceae, yang mencakup juga karet dan ubi kayu.
15 Tanaman ini dapat tumbuh pada daerah tropis dan subtropis baik pada dataran rendah hingga ketinggian 500 m di atas permukaan laut (dpl) dengan tekstur dan jenis tanah yang beragam, tidak tergenang dan pH tanah antara 5.0-6.5. Tanaman ini dapat tumbuh pada curah hujan 300-2380 mm/tahun dengan curah hujan optimum 625 mm/tahun. Temperatur tahunan rata-rata yang dibutuhkan jarak pagar adalah 20-28 °C.
Tanaman jarak pagar termasuk tanaman perdu. Tinggi tanaman dapat mencapai 1-7 m. Jarak pagar termasuk tanaman semak besar dengan cabang yang tidak teratur. Umur tanaman jarak pagar bisa mencapai 20 tahun. Cabang pohonnya mengandung getah (lateks) (Hasnam 2007).
Daun berwarna hijau muda sampai hijau tua dan tersusun berselang-seling pada batang hingga membentuk spiral. Daun jarak pagar pada umumnya berlekuk 3-5, lekukan daun bisa dangkal maupun sangat dalam. Panjang tangkai daun bervariasi 6-23 mm. Daunnya berbentuk jantung dengan lebar 6 cm dan panjang 15 cm (Gambar 8D). Tanaman ini akan menggugurkan daunnya pada musim kemarau (Hasnam 2007).
Jarak pagar adalah tanaman monosius dengan bunga berkelamin satu (uniseksual) dan jarang yang biseksual. Bunga tersusun dalam malai (inflorescence) dengan lima kelopak bunga (sepal) dan lima mahkota bunga (petal) yang berwarna hijau-kekuningan atau coklat-kekuningan. Bunga jantan mempunyai 10 tangkai sari (stamen) dengan pola tersusun dalam dua lingkaran (whorl) masing-masing terdiri atas lima tangkai sari yang menyatu membentuk tabung. Bunga betina berukuran lebih besar dari bunga jantan dan terdiri atas bakal buah (ovarium) dengan lima lokus (ruang) yang masing-masing berisi satu bakal biji (ovulum). Tangkai putik (stilus) melekat pada pangkal bunga dengan kepala putik (stigma) terpecah tiga (Gambar 8B) (Hartati 2006; Hasnam 2006).
Buah berbentuk bulat telur berwarna hijau dan hitam, panjangnya ± 2 cm. Buah jarak memiliki tiga ruang, masing-masing ruang berisi satu biji. Pada umur 5 bulan setelah tanam akan mulai berbuah dan mencapai produktivitas penuh pada umur 5 tahun. Biji jarak pagar berbentuk lonjong, berwarna coklat kehitaman dengan ukuran panjang 1-2 cm, tebal 0.5-1 cm, dan berat 0.4-0.6 gram/biji (Prihandana dan Hendroko, 2006). Biji masak yang ditandai dengan perubahan warna kapsul berubah warna dari hijau menjadi kuning kemudian menjadi hitam, saat 3 bulan setelah berbunga (Gambar 8C) (Hartati dan Sudarmo 2007).
Sistem perakaran tanaman jarak pagar mampu menahan air dan tanah sehingga mampu bertahan terhadap kekeringan dan mampu menahan erosi. Kemampuan untuk bertahan terhadap kekeringan ini juga dapat disebabkan oleh batang yang bersifat sukulen (berair). Menurut Pitono et al. (2008), keadaan lingkungan dapat mempengaruhi pertumbuhan vegetatif jarak pagar, seperti pH < 5.0 (menyebabkan tinggi tanaman, luas daun dan diameter batang hanya mencapai 30-50% dari pertumbuhan jarak pagar pada pH 6.0) sedangkan kadar garam yang tinggi dapat menghambat pertumbuhan.
16
terhadap defisit air tanah daripada kultivar IP-1P (Improved Population-1 Pakuwon). Ketiga kultivar tersebut kemudian diseleksi kembali dan tiga kultivar baru yang telah diperoleh dan diluncurkan pada tahun 2007, yaitu kultivar IP-2A. IP-2M dan IP-2P. Produktivitas kultivar IP-2 mampu mencapai 2.0 – 2.5 ton/ha per tahun pada tahun pertama dan diprediksi mampu mencapai 7.0 – 8.5 ton/ha per tahun mulai tahun ke-4 pada kondisi optimal. Kultivar IP-2M dan IP-2A lebih sesuai untuk dibudidayakan pada daerah beriklim kering sedangkan kultivar IP-2P lebih sesuai untuk daerah beriklim basah (Hasnam 2007). Sedangkan menurut Memen 2010 bahwa kultivar yang baik adalah kultivar Banten dengan bobot biji kering 193.8 g/tanaman.
Gambar 8 Morfologi tanaman jarak pagar, A. Posisi buah terminal, B. Bunga jantan dengan 10 tangkai sari dan bunga betina, C. Buah, D. Akar, daun dan buah muda
Tanaman jarak pagar dapat bertahan hidup hingga berumur 20 tahun. Produktivitas biji berkisar antara 2-4 kg biji/pohon/tahun dan akan stabil setelah umur 5 tahun. Kadar minyak dalam biji berkisar 25-35% berat kering biji sehingga produksi minyak jarak mentah (Cruide Jatropha Oil/CJO) dapat diperoleh sebesar 1.8-2.5 ton minyak/ha/tahun. Minyak jarak pagar mengandung asam linolenat dan asam oleat, sekitar 80% dari komposisi minyak. Asam palmitik dan asam stearit merupakan asam lemak yang terdapat pada minyak ini (Ferry 2006).
Transformasi Genetik pada Jarak Pagar
17 diperoleh minyaknya yang digunakan sebagai bahan bakar kapal dan pelumas senjata. Sejak saat itu jarak pagar banyak ditemukan di berbagai daerah di Indonesia namun umumnya hanya dimanfaatkan sebagai pembatas halaman rumah maupun kebun. Selain sebagai pagar pembatas, jarak pagar juga banyak dimanfaatkan sebagai obat tradisional yaitu untuk mengobati diare, penurun panas, mengobati luka dan menghentikan pendarahan (Hasnam 2007).
Jarak pagar dapat digunakan sebagai bahan biodiesel alternatif sehingga penggunaan bahan bakar minyak bumi yang semakin menipis dapat dikurangi. Penanaman jarak pagar mulai ditingkatkan di seluruh dunia. Namun yang menjadi kendala adalah minimnya luas lahan subur yang dapat digunakan sementara lahan marjinal masih banyak tersebar dan belum digunakan secara maksimal. Meskipun tanaman jarak pagar merupakan tanaman yang mampu beradaptasi pada daerah tidak subur namun penanaman jarak pagar di lahan marjinal tidak disarankan karena tidak akan diperoleh hasil panen yang maksimum. Untuk mengatasi masalah ini diperlukan adanya perbaikan genetik tanaman jarak pagar untuk meningkatkan hasil panen pada lahan marjinal (Johnson et al. 2011).
Salah satu perbaikan genetik yang saat ini banyak digunakan oleh para peneliti adalah melalui perakitan tanaman transgenik termasuk pada tanaman jarak pagar. Berbagai gen telah berhasil diintroduksikan ke dalam jarak pagar seperti gen SaDREB1 (Li et al. 2007); gen S-DREB2A (Kumar et al. 2010), gen HD3A
(Sulistyaningsih 2012), gen IMA (Paserang et al. 2015) dengan menggunakan perantara A. tumefaciens. Selain dengan perantara bakteri, penembakan partikel gen secara langsung juga dapat digunakan sebagai metode transformasi genetik ke jarak pagar (Joshi et al. 2011).
Tanaman jarak pagar termasuk dalam tanaman yang memiliki daya regenerasi yang rendah secara in vitro. Berbagai penelitian untuk memperoleh efisiensi regenerasi yang tinggi, telah dilakukan. Penggunaan berbagai zat pengatur tumbuh, seperti auksin, giberelin dan sitokinin, dengan berbagai konsentrasi telah meningkatkan efisiensi regenerasi jarak pagar yang diperbanyak secara in vitro. Efisiensi regenerasi jarak pagar telah ditingkatkan melalui organogenesis dari berbagai eksplan, yang meliputi hipokotil (Sharma et al.
2011); kotiledon (Li et al. 2007; Kumar et al. 2010; Pan et al. 2010; Sulistyaningsih 2012; Paserang et al. 2015), potongan daun (Deore dan Johnson 2008; Kumar et al. 2010; Misra et al. 2010) serta potongan batang (Singh et al.
2010).
18
3 KONSTRUKSI VEKTOR EKSPRESI UNTUK GEN
INHIBITOR OF MERISTEM ACTIVITY (IMA)
Abstrak
Teknologi rekayasa genetika telah tumbuh begitu cepat dan telah diterapkan pada berbagai organisme. Gen Inhibitor of Meristem Activity (IMA) merupakan salah satu gen yang berperanan dalam proses pertumbuhan dan perkembangan yang terdapat pada meristem pucuk tanaman. Gen IMA juga dapat mengontrol proses pembungaan pada tumbuhan. Teknik rekayasa genetika telah digunakan untuk kloning gen IMA tersebut. Gen IMA telah diisolasi dari tanaman tomat (Solanum lycopersicum L.). Tujuan dari penelitian ini adalah untuk kloning gen
IMA dengan menggunakan metode yang lebih terarah dan lebih cepat yaitu metode gateway. Gen IMA selanjutnya ditransformasi ke dalam Agrobacterium tumefaciens strain LBA4404. Kloning gen IMA ke dalam vektor donor, vektor tujuan, dan A. tumefaciens telah berhasil dilakukan yang menghasilkan ukuran pita DNA 500 pb pada elektroforesis menggunakan 1% gel agarosa. Hasil penelitian yaitu gen IMA berhasil dimasukkan ke dalam vektor ekspresi dengan menggunakan metode gateway dan terintegrasi dalam A. tumefaciens strain LBA4404.
Pendahuluan
Bioteknologi merupakan suatu bidang ilmu dalam biologi terapan yang melibatkan penggunaan organisme hidup dan bioproses untuk menciptakan suatu produk demi kepentingan manusia. Bioteknologi modern, atau sering disebut juga rekayasa genetika, telah berkembang sangat pesat dalam dua dasawarsa terakhir ini. Teknik rekayasa genetika telah banyak diaplikasikan dalam berbagai bidang, misalnya penelitian, medis, rekayasa genetika hewan, dan rekayasa genetika tanaman (Owen-Smith dan Powell 2004).
Rekayasa genetika tanaman adalah suatu teknik untuk memindahkan gen spesies asing ke dalam suatu sel tanaman, yang diikuti dengan regenerasi dari sel-sel tanaman tersebut sehingga menjadi tanaman lengkap. Teknik ini telah diterapkan pada berbagai tanaman pangan dan nonpangan. Rekayasa genetika sebenarnya merupakan kelanjutan dari pemuliaan tanaman yang telah dilakukan oleh petani secara tradisional. Rekayasa genetika memungkinkan pemindahan satu atau beberapa gen yang dikehendaki dari satu tanaman ke tanaman lainnya yang tidak mungkin terjadi dalam pemuliaan tanaman secara tradisional.
19 Gen IMA yang berasal dari tomat (Solanum lycopersicum L) merupakan gen yang dapat mengendalikan pertumbuhan dan perkembangan meristem. Upaya konstruksi vektor agar gen IMA dapat disisipkan ke dalam tanaman sebelumnya sudah pernah dilakukan dengan menggunakan metode pengklonan biasa dengan prosedur yang cukup rumit dan waktu yang cukup lama. Konstruksi gen pada penelitian ini menggunakan teknologi gateway. Teknologi gateway adalah suatu metode kloning universal yang berdasarkan rekombinasi situs spesifik pada bakteriofag lambda (Nunes-Düby et al. 1989). Teknologi gateway memungkinkan pemindahan secara cepat dan efisien sekuen DNA ke dalam beberapa vektor untuk dilakukan analisis fungsional dan ekspresi protein (Hartley et al. 2000).
Penelitian ini bertujuan mengonstruksi vektor ekspresi gen IMA dengan metode yang lebih cepat dan terarah, yaitu metode gateway. Gen IMA yang telah tersisipkan dalam vektor kloning selanjutnya ditransformasikan ke dalam A. tumefaciens. Hipotesis penelitian ini adalah gen IMA yang telah dikonstruksi pada vektor ekspresi dengan metode gateway bisa disisipkan ke dalam bakteri A. tumefaciens LBA4404 dan selanjutnya dapat diekspresikan pada tanaman. Hasil penelitian ini diharapkan dapat menghasilkan A. tumefaciens LBA4404 yang membawa gen IMA sens maupun antisens, serta memberikan informasi mengenai metode gateway sebagai teknologi rekombinasi gen yang cepat dan mudah.
Gen IMA disisipkan ke dalam vektor ekspresi dengan dua orientasi yaitu sens dan antisens. Orientasi sens searah dengan promoter sedangkan orientasi antisens berlawanan arah terhadap promoter. Manfaat dari konstruksi sens dan antisens yaitu untuk membandingkan peranan ekspresi gen apabila dalam kondisi ekspresi berlebih atau peranannya dalam genom bila terjadi pembungkaman ekspresi gen melalui konstruksi antisensnya.
Bahan dan Metode Bahan
Bahan yang digunakan dalam proses amplifikasi adalah kit dari Invitrogen, gen Inhibitor of Meristem Activity (IMA), primer spesifik gateway IMA-Forward, primer spesifik Gateway IMA-reverse, larutan buffer PCR 10x, MgCl2, dNTPs,
Taq polimerase, dan molecular water (MW).
Bahan yang digunakan dalam elektroforesis yaitu gel agarosa (Fermentas), larutan bufer Tris-Borat-EDTA (TBE) 0.5x, etidium bromida (EtBr) 5 L/100 mL, loading buffer (bromfenol biru 2.5%, sukrosa 40%), dan marker 1 Kb Plus DNA Ladder (Invitrogen). Ekstraksi dan purifikasi gel menggunakan kit dari Invitrogen (PureLinkTM Quick Gel Extraction).
Bahan yang digunakan dalam proses rekombinasi adalah kit Gateway® Technology dari Invitrogen (vektor pDONRTM, vektor destinasi, enzim BP ClonaseTM
, enzim proteinase K, enzim LR ClonaseTM). Tahap transformasi ke
dalam sel kompeten menggunakan sel kompeten Escherichia coli DH5α dan media Luria Agar (LA). Isolasi DNA plasmid menggunakan kit dari Fermentas (Gene JETTM Plasmid MiniPrep Kit).
20
Metode
Amplifikasi Fragmen Gen IMA
Gen IMA yang telah diisolasi dari tanaman tomat (Solanum lycopersicum
L.) pada penelitian sebelumnya diamplifikasi menggunakan alat PCR dan kit dari Invitrogen. Amplifikasi tersebut menggunakan sepasang primer spesifik gateway
(gateway IMA-forward dan gateway IMA-reverse)agar dapat disisipkan pada situs pengklonan pDONR. Primer Gateway IMA sens forward (5‟ -GGGGAG-CAGGCTAGATGAGAGGAGAAATGATTACTC-3‟) dan primer Gateway IMA
sens reverse adalah (5‟
-GGGGAGAAAGCTGGGTATCATTTAGTAGAAGAA-CGAAG-3‟). Primer Gateway IMA antisens forward (5‟ -GGGGAGCAGGCTA-GTCATTAGTAGAAGAAGCGGAAG-3‟) dan primer gateway IMA antisens
reverse (5‟
-GGGGAGAAAGCTGGGTAATGAAGAGCAGAAATGATTACTC-3‟). Selanjutnya produk PCR dielektroforesis pada agarosa 1% (b/v) dan dipurifikasi dengan Gel DNA fragments extraction Kit-Geneaid.
Penyisipan Fragmen Gen IMA ke Dalam Vektor pDONR
Fragmen gen IMA direaksikan dengan plasmid pDONR sesuai dengan protokol dari Invitrogen (USA) (Gambar 9). Rekombinasi gen IMA pada vektor donor dimulai dengan menyiapkan sebanyak 2 µL (150 ng/µ L) DNA hasil purifikasi, 1 µL vektor donor (150 ng/µl pDONRTM 221), dan ditambahkan larutan buffer Tris-EDTA (TE, pH 8.0) sampai volumenya menjadi 8 µL. Enzim
BP clonaseTM ditambahkan terakhir sebanyak 2 µL, kemudian diinkubasi pada suhu 25 oC selama 2 jam. Setelah inkubasi selesai ditambahkan 1 µL enzim
proteinase K (2 µg/µ L), lalu diinkubasi pada suhu 37 °C selama 15 menit. Hasil rekombinasi pada vektor donor tersebut diambil sebanyak 5 µL kemudian ditransformasikan ke E.coli dengan metode kejut panas (heat shock) untuk menggandakan plasmid yang telah membawa gen IMA. Metode kejut panas dimulai dengan melakukan proses sub kultur bakteri yaitu mengkulturkan satu koloni bakteri E. coliDH5α menggunakan tusuk gigi steril ke dalam tabung reaksi
berisi 2 ml media LB cair tanpa antibiotik (lampiran 1). Selanjutnya bakteri diinkubasi 12-16 jam pada suhu 37 °C dengan penggoyangan pada 200-250 rpm. Kemudian 100 µl biakan bakteri ditumbuhkan pada 10 ml LB pada suhu 37 °C selama 2-3 jam hingga mencapai OD600 = 0.4-0.5. Kemudian dimasukkan ke
dalam es selama 10 menit.
Selanjutnya sebanyak 1.5 ml biakan bakteri dipindahkan ke dalam tabung sentrifugasi kemudian disentrifugasi dengan kecepatan 5000 rpm, 4 °C selama 10 menit. Cairan dibuang dan endapan bakteri disuspensikan dengan perlahan dalam 495 µl Transformation Buffer (TFB) mengandung (3 g pipes 10 mM, 2.2 g CaCl2.H2O, 18.2 g KCL 250 mM, 10.9 g MnCl2.4H2O 55 mM, 950 ml H2O, pH
6.7 dengan penambahan KOH dan ditambah H2O). Suspensi bakteri disimpan
21 suhu 42 °C selama 45 detik kemudian dimasukkan kembali ke dalam es selama 5 menit. Setelah itu, ditambah 100 µl medium 2YT kemudian diinkubasi pada suhu 37 °C dengan penggoyangan. Sel bakteri tersebut kemudian disebar pada media LA yang mengandung antibiotik kanamisin dan diinkubasi semalam pada suhu 37 °C.
Koloni bakteri E. coli yang tumbuh pada media Luria Agar dikonfirmasi dengan metode PCR koloni. DNA plasmid koloni bakteri rekombinan tersebut selanjutnya diisolasi untuk direkombinasikan ke dalam vektor destinasi.
Plasmid rekombinan sebanyak 2 µL (50-150 ng) dimasukkan ke dalam tabung mikro dan ditambahkan 1 µL (150 ng/µL) vektor destinasi kemudian larutan buffer (TE pH 8.0) ditambahkan sampai volume menjadi 8 µL. Enzim LR Clonase ditambahkan terakhir sebanyak 2 µL, kemudian diinkubasi pada suhu 25
o
C selama 1 jam. Setelah inkubasi selesai, ditambahkan 1 µL enzim proteinase K
(2 µg/µ L), lalu diinkubasi pada suhu 37 oC selama 10 menit. Hasil rekombinasi diambil sebanyak 5 µL kemudian ditransformasikan ke dalam E. coli. DNA plasmid koloni bakteri yang tumbuh diisolasi lalu dikonfirmasi dengan metode PCR. Plasmid rekombinan selanjutnya ditransformasikan ke dalam E. coli.
Gambar 9 Peta genetik pDONRTM221 dengan penanda seleksi gen ketahanan terhadap kanamisin
Introduksi Vektor pDONR Rekombinan ke Dalam Bakteri E. coli
Vektor pDONR rekombinan diintroduksi ke dalam sel kompeten E. coli
strain DH5α dengan transformasi kejut panas pada suhu 42 °Cselama 45 detik (Sambrook et al. 1989). Koloni yang tumbuh pada media Luria Agar yang mengandung 50 mg/L kanamisin diambil untuk PCR koloni. PCR dilakukan dengan mengambil koloni menggunakan tusuk gigi kemudian disuspensikan ke dalam 5 µL ddH2O, kemudian suspensi dipanaskan pada 95 °C selama 10 menit
dan didinginkan pada suhu 15 °C selama 5 menit. Suspensi ini digunakan sebagai cetakan untuk reaksi PCR (Suharsono et al. 2008)