DAYA FERTILISASI SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA DENGAN ATAU TANPA SWIM UP
SEBELUM FERTILISASI
NUR
’
AISYAH AMRAH SAFITRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Daya Fertilisasi Spermatozoa Kauda Epididimis Domba dengan atau Tanpa Swim Up Sebelum Fertilisasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
NUR’AISYAH AMRAH SAFITRI. Daya Fertilisasi Spermatozoa Kauda Epididimis Domba dengan atau Tanpa Swim Up Sebelum Fertilisasi. Dibimbing oleh NI WAYAN KURNIANI KARJA, MOHAMAD AGUS SETIADI dan MOKHAMAD FAHRUDIN.
Penyelamatan materi genetik dari hewan jantan yang telah mati dapat dilakukan dengan pemanfaatan spermatozoa yang dikoleksi dari kauda epididimis. Spermatozoa pada kauda epididimis telah melewati proses pematangan di bagian kaput dan korpus epididimis, serta sudah memiliki kemampuan bergerak (motil) yang sama dengan spermatozoa dari ejakulat. Spermatozoa yang berasal dari kauda epididimis dari hewan mati berhasil dikriopreservasi dan dapat digunakan pada produksi embrio in vitro meskipun terjadi penurunan tingkat fertilisasi akibat penurunan kualitas spermatozoa. Diperlukan suatu metode pemisahan spermatozoa yang hidup untuk meningkatkan persentase spermatozoa motil. Berbagai metode seleksi spermatozoa dilakukan untuk meningkatkan kualitas spermatozoa dalam fertilisasi in vitro, salah satunya dengan penggunaan metode
swim up. Swim up merupakan metode yang menyeleksi spermatozoa dengan
motilitas tinggi yang dapat mencapai permukaan media setelah diinkubasi.
Penelitian ini dilakukan untuk mengevaluasi penggunaan metode swim up
untuk persiapan spermatozoa sebelum fertilisasi terhadap tingkat fertilisasi in vitro
spermatozoa kauda epididimis pasca penyimpanan selama 48 jam. Kauda epididimis domba disimpan pada suhu 4 oC selama 0 hari (H-0), 1 hari (H-1) dan 2 hari (H-2), kemudian semen dikoleksi dan dibekukan. Spermatozoa ejakulat beku digunakan sebagai kontrol. Oosit yang telah matang difertilisasi secara in
vitro dengan spermatozoa asal kauda epididimis pasca penyimpanan dan ejakulat
menggunakan metode persiapan sperma dengan dan tanpa swim up.
Hasil penelitian menunjukkan bahwa spermatozoa asal kauda epididimis yang dikoleksi segera setelah kematian hewan (H-0) memiliki kemampuan yang sama dengan spermatozoa ejakulat (P>0,05). Tingkat fertilisasi spermatozoa kauda epididimis pasca penyimpanan selama 2 hari mengalami penurunan seiring bertambahnya waktu simpan. Penggunaan metode swim up dan tanpa swim up
menunjukkan kemampuan fertilisasi yang sama pada spermatozoa ejakulat dan spermatozoa kauda epididimis yang disimpan. Dapat disimpulkan bahwa metode
swim up dan tanpa swim up menghasilkan pengaruh yang sama terhadap tingkat
fertilisasi in vitro spermatozoa asal kauda epididimis yang disimpan pada suhu 4 o
C selama 2 hari. Kemampuan fertilisasi spermatozoa asal kauda epididimis domba yang disimpan pada suhu 4°C mengalami penurunan sampai hari kedua, namun spermatozoa tersebut masih mampu membuahi oosit secara in vitro.
SUMMARY
NUR’AISYAH AMRAH SAFITRI. In Vitro Fertility of Post-Thawed Epididymal Ram Spermatozoa With or Without Swim Up Before Fertilization. Supervised by NI WAYAN KURNIANI KARJA, MOHAMAD AGUS SETIADI dan MOKHAMAD FAHRUDIN.
The rescue of genetic materials from dead male animals can be done by using of spermatozoa collected from cauda epididymis. Sperm deposited in the cauda epididymis has passed the maturation process in caput and corpus epididymis, and already has motility similar to ejaculates. Sperm collected from cauda epididymis of dead animals has successfully to be cryopreserved and can be used in production of embryo in vitro, despite the fertilization rate is decline caused by decreased of sperm quality. Therefore a separation is property to seperate the living sperm in order to increase the percentage of required motile sperm. Various methods of spermatozoa selection has been done to improve the quality of spermatozoa for in vitro fertilization. One of them is by using of swim up method. Swim up is a method to select sperm with high motility that can reach the surface of medium after incubation.
The aim of the study was to evaluate the using of swim up method for the preparation of sperm before in vitro fertilization of epididymidal spermatozoa after stored for 48h. Epididymides were stored at 4°C for 0 day (H-0), 1 day (H-1) and 2 days (H-2), afterward semen were collected and frozen. Ejaculated semen was used as control group. Matured oocytes were in vitro fertilized by frozen-thawed spermatozoa of each group experiments and ejaculated semen prepared using the swim up or without swim up method.
The results show of in vitro fertilization ability of cauda epididymis ram
spermatozoa collected immediately after the animal’s death (H-0) is similar to ejaculated spermatozoa (P>0,05). The fertilizing ability of cauda epididymal sperm after storage for 2 days declined gradually following the increase of storage time. There was similar ability in fertilization rate of stored cauda epididymal spermatozoa between with or without swim up method (P>0,05). It is concluded sperm preparation method with or without swim up performed similar effect to be fertilizing ability of stored cauda epididymides at 4°C for 2 days. The fertilizing ability of spermatozoa collected from cauda epididymis stored at 4°C gradually decreased as the storage period was prolonged, however it still able to be fertilized oocytes in vitro.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
DAYA FERTILISASI SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA DENGAN ATAU TANPA SWIM UP
SEBELUM FERTILISASI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Daya Fertilisasi Spermatozoa Kauda Epididimis Domba dengan atau Tanpa Swim Up Sebelum Fertilisasi
Nama : Nur’aisyah Amrah Safitri NIM : B352130131
Disetujui oleh Komisi Pembimbing
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 28 Januari 2016 Tanggal Lulus: drh Ni Wayan Kurniani Karja, MP, PhD
Ketua
drh Mokhamad Fahrudin, PhD Anggota
PRAKATA
Puji dan syukur penulis panjatkan kepada ALLAH subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini. Tema yang dipilih dalam penelitian ini adalah Daya Fertilisasi Spermatozoa Kauda Epididimis Domba dengan atau Tanpa Swim Up Sebelum Fertilisasi.
Terima kasih penulis ucapkan kepada Ibu drh Ni Wayan Kurniani Karja MP, PhD sebagai ketua komisi pembimbing, serta Bapak Prof Dr drh Mohamad Agus Setiadi, dan Bapak drh Mokhamad Fahrudin, PhD sebagai anggota komisi pembimbing yang telah banyak memberi masukan, arahan, perhatian dan nasihatnya selama penulis melakukan penelitian dan penulisan karya ilmiah. Terima kasih kepada Bapak Prof Dr drh Bambang Purwantara, MSc selaku penguji luar komisi atas saran dan kritikannya dalam penyempurnaan tesis ini. Ucapan terima kasih juga penulis sampaikan kepada pimpinan dan staf Rumah Potong Hewan Kambing/Domba yang telah banyak membantu penulis dalam memperoleh materi penelitian sehingga penulis dapat menyelesaikan penelitian ini hingga selesai.
Ucapan terima kasih juga penulis sampaikan kepada Rektor IPB, Dekan Sekolah Pascasarjana IPB, kepada Dosen-Dosen Departemen Klinik Reproduksi dan Patologi FKH IPB yang telah membagi ilmu, memberikan arahan dan bimbingan serta para staf kepegawaian yang telah membantu penulis dalam berbagai hal selama penulis menjalankan dan menyelesaikan studi. Terima kasih juga disampaikan kepada Direktorat Pendidikan Tinggi melalui Hibah Penelitian Perguruan Tinggi Institut Pertanian Bogor tahun 2014 yang telah mendanai sebagian dari penelitian ini dan Beasiswa Fresh Graduate 2013 yang telah membantu penulis selama studi.
Kepada Ayahanda dan adik-adik, penulis mengucapkan terima kasih atas perhatian, kasih sayang, serta doanya yang tiada henti, serta kepada Ibunda (Alm) atas semangatnya yang masih mengalir yang menjadi kekuatan bagi penulis selama menyelesaikan studi. Anita Hafid, SPd, MSi yang telah menjadi sahabat dan saudara dikala suka maupun duka, terima kasih untuk motivasi dan kemurahan hati dalam membantu dan mengiringi langkah penulis untuk berjalan bersama menyelesaikan tugas akhir. Thanks for the best friendship.
Semoga karya ilmiah ini berkah dan bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Spermatozoa Kauda Epididimis 3
Penyimpanan Kauda Epididimis 4
Kriopreservasi Spermatozoa Asal Kauda Epididimis 4
Metoda Swim Up untuk Persiapan Spermatozoa 6
Fertilisasi Oosit In Vitro 7
3 MATERI DAN METODE 9
Waktu dan Tempat Penelitian 9
Metode 9
Koleksi dan Kriopreservasi Spermatozoa dari Kauda Epididimis 9
Fertilisasi Oosit In Vitro 9
a. Koleksi dan Maturasi Oosit In Vitro 9
b. Fertilisasi Oosit In Vitro 10
c. Evaluasi Tingkat Fertilisasi Oosit In Vitro 10
Analisis Data 10
4 HASIL DAN PEMBAHASAN 11
5 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 21
DAFTAR GAMBAR
1 Teknik pemisahan spermatozoa swim up 6
2 Interaksi antara oosit dan spermatozoa pada proses fertilisasi sapi 8 3 Gambaran pembentukan pronukleus (PN) pada oosit domba setelah
fertilisasi in vitro 11 4 Tingkat fertilisasi oosit in vitro spermatozoa asal kauda epididimis
dan ejakulat dengan (S) atau tanpa (NS) metode swim up 11 5 Tingkat fertilisasi oosit in vitro dengan spermatozoa kauda epdidimis
pasca penyimpanan selama dua hari, dengan (S) atau tanpa (NS)
metode swim up 13
DAFTAR LAMPIRAN
1 Komposisi media Niwa and Sasaki Freezing (NSF) untuk
kriopreservasi spermatozoa 22
2 Komposisi media transportasi ovarium 23
3 Komposisi media koleksi oosit 23
4 Komposisi media TCM-199 untuk maturasi oosit 23
5 Komposisi media fertilisasi oosit in vitro 24
6 Komposisi media Tyrode Albumin Lactate Pyruvate (TALP) untuk
1
1
PENDAHULUAN
Latar Belakang
Materi genetik dari hewan yang memiliki nilai genetis unggul, hewan yang populasinya semakin menurun, satwa liar atau hewan yang dilindungi, bisa punah kapan saja akibat kematian yang tidak terduga. Penyelamatan materi genetik dari hewan jantan yang telah mati dapat dilakukan dengan pemanfaatan spermatozoa yang dikoleksi dari kauda epididimis hewan tersebut (Kaabi et al. 2003). Koleksi dan kriopreservasi spermatozoa dari kauda epididimis dapat dijadikan salah satu cara penyelamatan materi genetik dari hewan yang telah mati. Koleksi semen asal kauda epididimis dari rumah potong hewan (RPH) merupakan alternatif yang cepat dan murah serta kauda epdidimis memiliki jumlah spermatozoa hidup yang cukup tinggi (Ehling et al. 2006)
Spermatozoa pada kauda epididimis telah melewati proses pematangan di bagian kaput dan korpus epididimis, serta sudah memiliki kemampuan bergerak (motil) yang sama dengan spermatozoa dari ejakulat (Axner et al. 1998). Spermatozoa yang berasal dari kauda epididimis memiliki motilitas, integritas membran plasma dan morfologi yang tidak berbeda dengan spermatozoa dari ejakulat baik sebelum atau setelah dikriopreservasi (Tebet et al. 2006) serta masih memiliki kemampuan untuk membuahi oosit secara in vitro dan menghasilkan keturunan (Jishage et al. 1997; Songsasen et al. 1998). Seperti yang dilaporkan Kaabi et al. (2003) pada domba bahwa spermatozoa beku asal kauda epididimis yang disimpan pada suhu 5oC selama 24 jam memperlihatkan kemampuan fertilisasi yang sama dengan spermatozoa beku asal ejakulat.
Preservasi spermatozoa yang berasal dari kauda epididimis yang disimpan pada suhu 4-5oC dapat digunakan untuk teknologi reproduksi berbantuan dan fertilisasi in vitro ketika spermatozoa tersebut tidak dapat segera dikoleksi (Hishinuma et al. 2003). Penyimpanan kauda epididimis pada suhu 5oC mampu menjaga viabilitas dan kemampuan spermatozoa untuk memfertilisasi oosit secara
in vitro seperti yang dilaporkan pada rusa merah (Soler et al. 2003) dan kuda
(Vieira et al. 2012). Spermatozoa yang berasal dari kauda epididimis dari hewan mati berhasil dikriopreservasi dan dapat digunakan pada produksi embrio in vitro. Beberapa penelitian melaporkan mengenai kemampuan fertilisasi in vitro dari spermatozoa kauda epididimis pasca penyimpanan yang dikriopreservasi seperti pada sapi (Martins et al. 2009) yang memperlihatkan kemampuannya untuk menghasilkan embrio secara in vitro menggunakan spermatozoa yang dikoleksi dari kauda epididimis dan disimpan pada suhu 5oC. Pada babi (Kikuchi et al.
1998) spermatozoa asal kauda epididimis yang disimpan pada suhu 4oC sampai tiga hari menunjukkan angka pembentukan pronukleus mencapai 67-70%. Blash
et al. (2000) melaporkan pada kambing, kriopreservasi spermatozoa yang
dikoleksi dari kauda epididimis mampu memfertilisasi oosit secara in vitro
sebesar 40% dengan terjadinya cleavage dan 6% berkembang menjadi blastosis.
Di sisi lain, walaupun spermatozoa yang motil dapat dikoleksi dari epididimis 96 jam setelah kematian domba akan tetapi motilitas dan daya fertilisasinya terhadap oosit secara in vitro menurun seiring dengan lamanya periode penyimpanan epididimis (Karja et al. 2013).
2
pelusida pada oosit (Suarez dan Ho 2003). Oleh karena itu diperlukan suatu metode pemisahan spermatozoa yang hidup untuk meningkatkan persentase spermatozoa motil. Berbagai metode seleksi spermatozoa dilakukan untuk meningkatkan motilitas spermatozoa dalam fertilisasi in vitro, salah satunya dengan penggunaan metode swim up. Swim up merupakan metode yang murah dan mudah dalam pelaksanaannya (Henkel dan Schill 2003) dimana metode ini menyeleksi spermatozoa dengan motilitas tinggi yang dapat mencapai permukaan media setelah diinkubasi (Wolf et al. 2008). Metode swim up dilakukan untuk memisahkan spermatozoa motil dari spermatozoa yang tidak motil dan mati, serta menginisiasi kapasitasi (Centola et al. 1998). Jameel (2008) melaporkan terjadinya peningkatan jumlah motilitas spermatozoa dan tingkat kehamilan setelah menggunakan metoda swim up pada manusia. Pada domba (Marti et al.
2006) melaporkan metoda swim up mampu menyeleksi spermatozoa hidup dan yang tidak mengalami apoptosis. Penelitian ini dilakukan dengan menerapkan metoda swim up pada proses persiapan spermatozoa sebelum fertilisasi oleh spermatozoa asal kauda epididimis domba yang disimpan terlebih dahulu pada suhu 5oC. Penerapan metode swim up diharapkan mampu menjadi salah satu metode untuk meningkatkan kemampuan fertilisasi in vitro spermatozoa beku dari kauda epididimis pasca penyimpanan sampai hari kedua.
Kerangka Pemikiran
Pemanfaatan kauda epididimis dijadikan alternatif sebagai sumber materi genetik dari hewan jantan yang tidak dapat diperoleh semennya melalui ejakulasi. Spermatozoa asal kauda epididimis mampu membuahi oosit karena telah mengalami pematangan dan telah mampu bergerak motil. Kondisi lingkungan kauda epididimis yang tidak lagi sama seperti saat hewan tersebut masih hidup menyebabkan sel spermatozoa cepat mengalami degenerasi. Penyimpanan kauda epididimis pada suhu refrigerator merupakan upaya untuk menjaga kualitas spermatozoa selama belum dapat diolah atau langsung dibekukan. Spermatozoa asal kauda epididimis mengalami penurunan seiring bertambah lamanya waktu penyimapanan. Koleksi semen dilakukan untuk segera dikriopreservasi dan dapat disimpan untuk digunakan kapan saja. Kriopreservasi mengakibatkan terjadinya penurunan motilitas spermatozoa, merusak integritas membran plasma, dan membran akrosom. Oleh karena itu spermatozoa kriopreservasi harus diproses untuk meningkatkan jumlah sel spermatozoa dengan kualitas yang baik. Persiapan spermatozoa sebelum digunakan dalam fertilisasi in vitro dilakukan untuk menyeleksi spermatozoa motil. Metoda swim up akan menyeleksi spermatozoa dengan motilitas tinggi yang dapat mencapai permukaan media setelah diinkubasi. Penyeleksian spermatozoa ini dapat meningkatkan populasi spermatozoa yang memiliki kemampuan untuk memfertilisasi oosit.
Tujuan Penelitian
Penelitian ini dilakukan untuk mengevaluasi penggunaan metode swim up
untuk persiapan spermatozoa sebelum fertilisasi terhadap tingkat fertilisasi in vitro
3 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai pengaruh penggunaan metoda swim up untuk persiapan spermatozoa sebelum fertilisasi terhadap tingkat fertilisasi in vitro spermatozoa kauda epididimis pasca penyimpanan selama 48 jam.
2
TINJAUAN PUSTAKA
Spermatozoa Kauda Epididimis
Kauda epididimis merupakan lanjutan dari korpus epididimis dan berada di bagian bawah testis yang selanjutnya bersambung dengan vas deferens. Pada bagian kauda epididimis berfungsi sebagai tempat penyimpanan sperma. Perbedaan spermatozoa asal kauda epididimis dengan spermatozoa ejakulat secara fisik yaitu terdapatnya cytoplasmic droplet pada bagian tengah spermatozoa.
Cytoplasmic droplet adalah sisa dari sitoplasma pada saat sel spermatozoa
menjadi spermatid dan bertemu dengan cairan plasma semen. Selain itu terdapat perbedaan metabolisme dimana respirasi spermatozoa asal kauda epididimis lebih lambat dibandingkan spermatozoa ejakulat (Cooper 2005).
Spermatozoa asal kaudaepididimis telah motil dan mampu membuahi oosit yang sama baiknya dengan spermatozoa hasil ejakulasi karena spermatozoa yang ada di bagian kaudaepididimis telah melewati proses pematangan di bagian kaput dan korpus epididimis (Hafez dan Hafez 2000; Axner et al. 1998). Selain itu, spermatozoa yang berasal dari kauda epididimis memiliki motilitas, integritas membran plasma dan morfologi yang tidak berbeda dengan spermatozoa dari ejakulat baik sebelum atau setelah dikriopreservasi (Tebet et al. 2006). Dinyatakan bahwa di kaput epididimis memiliki konsentrasi spermatozoa sebesar 25-50 x 106 serta belum memiliki motilitas dan kemampuan membuahi oosit. Pada korpus epididimis, konsentrasi spermatozoa sekitar 8-25 x 109 serta sebagian spermatozoa mampu bergerak setelah diencerkan dan memiliki kemampuan membuahi oosit, walaupun kemampuan tersebut masih rendah dibandingkan dengan spermatozoa kauda epididimis dan hasil ejakulasi. Konsentrasi spermatozoa akan semakin meningkat setelah memasuki kauda epididimis, yakni sebesar 10-50 x 109 serta memiliki motilitas dan kemampuan membuahi oosit yang kurang lebih sama dengan spermatozoa hasil ejakulasi (Senger 2005)
4
menghilangkan senyawa antioksidan yang terdapat pada plasma semen (Ollero et al. 2001). Harkema et al. (1998) melaporkan bahwa keberadaan plasma semen pada spermatozoa dari ejakulat yang dihilangkan sebelum diinkubasi dalam medium IVF dapat meningkatkan persentase spermatozoa dalam mengikat protein zona pelusida pada membran plasma, sama seperti halnya pada spermatozoa dari kauda epididimis.
Penyimpanan Kauda Epididimis
Permasalahan utama dalam penyelamatan spermatozoa setelah kematian hewan adalah degenerasi sel yang terjadi dengan cepat setelah kematian (Wildt, 2000). Untuk mengatasi hal tersebut dapat dilakukan penyimpanan kauda epididimis sebelum spermatozoa dikoleksi. Penyimpanan kauda epididimis dimaksudkan untuk alternatif jika tempat hewan mati yang ditemukan berada di daerah terpencil yang tidak memungkinkan untuk dilakukan koleksi dan pengolahan semen dengan segera. Metode penyimpanan yang telah banyak dilakukan adalaha pada refrigerator dengan suhu 4-5oC.
Kauda epididimis memiliki kondisi yang memadai untuk memperpanjang kelangsungan hidup spermatozoa karena kauda epididimis menyediakan lingkungan optimal bagi kondisi fisiologis gamet yang disimpan (Fernandez-Santos et al. 2009). Spermatozoa yang dikoleksi dari kauda epididimis masih memiliki motilitas yang baik. Hal tersebut ditunjukkan dari hasil penelitian oleh beberapa peneliti bahwa spermatozoa yang dikoleksi dari kauda epididimis hewan pasca penyimpanan dan telah diolah baik dalam bentuk cair maupun beku, memenuhi syarat kualitas untuk digunakan sebagai sumber gamet jantan dalam penerapan teknologi reproduksi seperti inseminasi buatan (IB) dan fertilisasi in
vitro (IVF). Seperti yang dilaporkan Kaabi et al. (2003) bahwa penyimpanan
kauda epididimis pada suhu 5oC sampai 48 jam setelah kematian masih memiliki viabilitas spermatozoa yang baik, meskipun kemampuan fertilisasinya mengalami penurunan.
Terjadinya penurunan kualitas spermatozoa seiring dengan bertambahnya waktu penyimpanan epididimis sebelum spermatozoa dikoleksi diduga disebabkan karena kondisi lingkungan mikro epididimis mengalami perubahan dari kondisi alami seperti yang terjadi pada hewan hidup (Rizal dan Nasrullah 2004). Semakin lama penyimpanan kauda epididimis akan mengakibatkan penurunan kualitas spermatozoa. Nazlie (2004) melaporkan pada kucing, terjadi kerusakan sel-sel penyusun kauda epididimis yang disimpan pada suhu 4oC mulai dari hari kedua. Semakin lama waktu penyimpanan epididimis menyebabkan kerusakan pada sel-sel penyusun epididimis semakin meluas. Hal tersebut mengakibatkan menurunnya daya preservasi epididimis terhadap spermatozoa yang terkandung di dalamnya.
Kriopreservasi Spermatozoa Asal Kauda Epididimis
5 pengencer yang tepat, tingkat pengenceran sperma, serta pentingnya pengetahuan mengenai fisiologis sperma pada setiap spesies sehingga dapat memamksimalkan pemulihan spermatozoa setelah dithawing (Purdy 2006).
Pemanfaatan spermatozoa asal kauda epididimis dapat dilakukan dengan mengolah dalam bentuk cair maupun beku, sehingga dapat dimanfaatkan dalam keperluan berbagai aplikasi teknologi reproduksi salah satunya seperti fertilisasi in
vitro. Meskipun penggunaan spermatozoa yang dikoleksi dari kauda epididimis
dapat dijadikan sebagai alternatif, namun kriopreservasi spermatozoa dapat menjadi cara yang lebih efisien dan ekonomis karena bisa dimanfaatkan kapan saja tidak hanya setelah kematian hewan sebagai cadangan keragaman materi genetik hewan (Martins et al. 2007).
Proses kriopreservasi juga menimbulkan permasalahan karena proses ini menyebabkan kerusakan spermatozoa akibat pembekuan dan proses thawing
sehingga menurunkan kualitas spermatozoa. Penyebab utama terjadinya kerusakan sel pada proses kriopreservasi adalah akibat pembentukan es intraseluler (Anger et al. 2003). Pada proses pembekuan, suhu lingkungan yang menurun drastis menyebabkan air yang terkandung dalam spermatozoa maupun medium akan membentuk kristal es (Rodriguez-Martinez dan Wallgren 2011).
Kriopreservasi menyebabkan kerusakan permanen pada organel sperma, dan perubahan fluiditas membran dan aktifitas enzimatik, terkait dengan penurunan motilitas, viabilitas dan fertilitas spermatozoa (Sariozkan et al. 2009). Kerusakan spermatozoa selama proses kriopreservasi terkait dengan tiga komponen utama, yakni stres osmotik, pembentukan kristal es, dan komposisi lipid membran secara langsung berhubungan dengan perubahan fluiditas membran sperma dan kemampuan untuk pertukaran ion dan air melalui membran plasma (Watson 2000). Selama proses kriopreservasi cooling rate harus berjalan lambat untuk memungkinkan air dapat keluar dari dalam sel secara osmosis untuk mencegah terbentuknya kristal es intraseluler yang dapat mengakibatkan kematian sel (Watson 2000). Telah dilaporkan bahwa pembentukan kristal es intraseluler adalah faktor utama yang bertanggung jawab atas kerusakan spermatozoa yang disebabkan oleh proses pembekuan (Johnson et al. 2000).
Bahan pengencer berfungsi selain untuk menambah volume semen juga digunakan untuk menjaga kualitas selama penyimpanan hingga semen digunakan. Pengencer Niwa and Sasaki Freezing (NSF) adalah salah satu pengencer yang digunakan pada pembekuan semen domba (Karja et al. 2013). Tujuan dari pengencer pada kriopreservasi adalah melindungi sel dari kerusakan akibat perubahan suhu yang ekstrim, sebagai sumber energi dan memelihara lingkungan yang sesuai untuk keberlangsungan hidup sel spermatozoa (Purdy 2006). Menurut Kikuchi et al. (1998) penggunaan medium NSF dapat melindungi terhadap resiko
cold shock pada spermatozoa, hal ini karena kandungan sejumlah besar kuning
6
Metode Swim Up untuk Persiapan Spermatozoa
Metode persiapan spermatozoa yang ideal adalah teknik yang melibatkan penghilangan plasma semen secara efisien, cepat dan murah, tidak menyebabkan terjadinya kerusakan pada spermatozoa, mampu mengeliminasi faktor dekapasitasi atau reactive oxygen species (ROS) serta mampu meningkatkan jumlah spermatozoa yang memiliki kemampuan fertilisasi. Meskipun plasma semen melindungi spermatozoa dari kondisi stres, namun plasma semen mengandung faktor-faktor yang menghambat kemampuan fertilisasi spermatozoa dan mengurangi induksi kapasitasi. Proses kriopreservasi dapat menurunkan motilitas, merusak integritas membran, membran akrosom dan kromatin spermatozoa (Donelly et al. 2001; Celeghini et al. 2008). Oleh karena itu metode yang dikembangkan untuk menghilangkan plasma semen atau krioprotektan dan untuk memisahkan spermatozoa yang memiliki kualitas baik pada semen beku yang dithawing sehingga meningkatkan kemampuan fertilisasi spermatozoa tersebut (Henkel dan Schil 2003).
Motilitas merupakan parameter penting pada kemampuan fertilisasi spermatozoa dan meningkatkan kemampuan spermatozoa untuk menembus zona pelusida pada oosit (Suarez dan Ho 2003). Metode persiapan spermatozoa dalam fertilisasi oosit in vitro digunakan untuk menyeleksi spermatozoa yang hidup, motil dan memiliki morfologi normal (Batista et al. 2006). Swim up merupakan salah satu metode persiapan spermatozoa dalam fertilisasi in vitro yang menyeleksi spermatozoa dengan motilitas tinggi yang mencapai pemukaan media setelah diinkubasi. Metode swim up berdasarkan pada pergerakan aktif spermatozoa dari pelet pada dasar media menuju permukaan media (Henkel dan Schill 2003).
7 yang lebih bagus dan dengan kerusakan morfologis yang lebih sedikit sehingga mampu menghasilkan tingkat pembelahan lebih tinggi saat digunakan pada IVF (Gillan et al. 2008). Pada penelitian Shamsuddin et al (1993) menunjukkan hasil motilitas yang tinggi setelah dilakukannya swim up padamedia modified Tyrode’s
lactate solution (TALP) meskipun terjadi penurunan sesaat setelah di sentrifus.
Fertilisasi Oosit In Vitro
Fertilisasi adalah proses kompleks yang dimulai dengan pengenalan spesifik dan pengikatan spermatozoa terhadap oosit dan kemudian terjadi penyatuan pronukleus jantan dan betina. Fertilisasi in vitro (IVF) merupakan teknik yang dilakukan untuk memproduksi embrio dari penggabungan gamet jantan dan betina. Oosit hewan mamalia secara umum dapat difertilisasi sampai akhirnya berkembang menjadi embrio setelah mengalami pematangan inti dan pematangan sitoplasma terlebih dahulu (Beilby et al. 2009). Proses pematangan oosit merupakan transformasi oosit primer menjadi oosit sekunder matang yang ditandai dengan perubahan inti dari profase pada pembelahan meiosis pertama ke
metaphase II (MII). Pematangan sitoplasma ditandai dengan organisasi
sitoskeletal dari oosit seperti migrasi kortikal granul ke oolema, peningkatan mitokondria dan lipid droplet, mulai terbentuknya retikulum endoplasma dan peningkatan metabolisme oosit (Rahman et al. 2008). Oosit domba terlebih dahulu harus melalui proses pematangan atau maturasi di dalam inkubator selama 24 jam dengan temperatur sekitar 39°C sebelum digunakan untuk fertilisasi in
vitro. Pematangan oosit merupakan salah satu tahap penting yang membantu oosit
agar mampu menyelesaikan proses meiosis hingga mencapai tahap metaphase II sehingga dapat difertilisasi (Alomar et al. 2008).
8
Gambar 2 Interaksi antara oosit dan spermatozoa pada proses fertilisasi pada sapi (Gordon 2003)
Fertilisasi yang normal ditandai dengan terbentuknya dua pronukleus, dua badan kutub, bentuk sel telur yang teratur dengan zona pelusida utuh dan sitoplasma jelas terlihat (Elder dan Dale 2003). Pemanfaatan spermatozoa dari kauda epididimis dalam aplikasi teknologi IVF telah banyak dilaporkan dan menghasilkan keturunan. Herrick et al. (2004) melaporkan adanya penetrasi zona pelusida pada oosit setelah IVF menggunakan spermatozoa dari kauda epididimis kerbau yang diekstraksi setelah 4 jam kematian hewan dan dibekukan. Spermatozoa kauda epididimis rusa merah yang telah dibekukan, juga masih memiliki kemampuan membuahi oosit, walaupun spermatozoa tersebut dikoleksi setelah rusa mati dan dibiarkan pada suhu ruang selama 10-20 jam (Soler et al.
2003).
Kegagalan fertilisasi dapat disebabkan oleh beberapa hal, antara lain yaitu, tingkat pematangan oosit (inti maupun sitoplasma) yang kurang sempurna, kemampuan spermatozoa memfertilisasi oosit (kapasitasi dan reaksi akrosom) yang kurang memadai sehingga menyebabkan spermatozoa tidak mampu membuahi oosit serta kegagalan spermatozoa mengalami kondensasi dalam sitoplasma oosit sehingga terjadi kegagalan pembentukan pronukleus jantan (Bavers et al. 1997; Boediono et al. 2000). Selain kegagalan dalam pembentukan pronukleus jantan, kegagalan fertilisasi juga dipengaruhi oleh terbentuknya pronukleus dengan jumlah lebih dari dua (jantan dan betina) yang dikenal dengan polispermia. Polispermia terjadi akibat kurangnya kemampuan oosit dalam menghalangi penetrasi lebih dari satu spermatozoa. Berkurangnya kemampuan oosit yang matang secara in vitro untuk memblokir polispermia terjadi akibat tertundanya reaksi pada zona pelusida yang disebabkan oleh paparan pada medium FIV dengan komposisi yang tidak seperti pada fertilisasi in vivo
(Funahashi 2003). Konsentrasi spermatozoa dalam drop media fertilisasi in vitro
9
3
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Januari sampai Juni 2015 di Laboraturium Fertilisasi In Vitro, Divisi Reproduksi dan kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Metode Penelitian
Koleksi dan Kriopreservasi Spermatozoa dari Kauda Epididimis
Spermatozoa asal kauda epididimis diperoleh dari testis domba yang diperoleh dari rumah pemotongan hewan (RPH). Kauda epididimis lalu ditempatkan dalam plastik ziplock pada suhu ruang dan dibawa ke laboraturium. Kauda epididimis kemudian disimpan pada refrigerator dengan suhu 4 oC selama nol hari (H-0), satu hari (H-1) dan dua hari (H-2). Pada setiap akhir periode penyimpanan, spermatozoa dikoleksi dari kauda epididimis dengan cara penyayatan. Hanya sampel yang mempunyai motilitas lebih dari 70% yang digunakan dalam penelitian ini. Sebagai kontrol perlakukan, digunakan spermatozoa ejakulat beku yang diperoleh dari Balai Besar Inseminasi Buatan (BBIB) Lembang, Bandung.
Kriopreservasi spermatozoa dilakukan dengan metode yang dilaporkan oleh Karja et al. (2013). Segera setelah koleksi, spermatozoa diencerkan dengan media
Niwa and Sasaki Freezing (NSF) I, lalu diekulibrasi pada suhu 4°C selama 2 jam,
kemudian ditambahkan media NSF II dan diekuilibrasi kembali pada suhu yang sama selama 5 menit. Perbandingan penambahan media NSF I dengan NSF II sebesar 1:1 dengan konsentrasi akhir spermatozoa setelah penambahan media NSF sebesar 100 x 106 spermatozoa/ml dan konsentrasi akhir gliserol sebesar 3%. Spermatozoa segera dimasukkan ke dalam straw berukuran 0,25 mL (IMV, France), kemudian diletakkan pada sebuah styrofoam plate dalam uap nitrogen cair selama 20 menit (kurang lebih 4 cm dari permukaan nitrogen cair) dan kemudian segera dimasukkan dalam kontainer nitrogen cair untuk penyimpanan sebelum digunakan.
Fertilisasi oosit in vitro
a. Koleksi dan maturasi oosit in vitro
Ovarium domba diperoleh dari rumah potong hewan (RPH). Oosit dikoleksi dengan mencacah (slicing) bagian korteks ovarium menggunakan scalpel ukuran 20. Koleksi oosit dilakukan menggunakan larutan dulbecco’s Phosphate Buffer
Solution (dPBS; Gibco,Grand Island, NY, USA) disuplementasi dengan 0,3 %
Bovine Serum Albumine (BSA; Sigma-Aldrich. Inc, A-7030), 100 IU/mL
penicillin (Sigma-Aldrich. St. Louis, MO, USA) dan 0,1 mg/mL streptomycin
10
IU/mL human Chorionic Gonadotrophin (hCG; Kyoritsu Seiyaku, Japan), 1 µg/mL estradiol (Intervet international B.V Boxmeer-Holland) dan 50 µg/mL
gentamycin (Sigma-Aldrich. St. Louis, MO, USA). Pematangan oosit dilakukan
dalam media maturasi dalam bentuk drop masing-masing 100 μL untuk 10`-15 oosit dan ditutup dengan mineral oil (Sigma-Aldrich. St. Louis, MO, USA) dalam inkubator CO2 5%, 39oC selama 24 jam.
b. Fertilisasi in vitro
Persiapan spermatozoa untuk fertilisasi dilakukan dengan dan tanpa swim up. Semen beku di-thawing dalam water bath pada temperatur 35°C selama 30 detik. Persiapan spermatozoa dengan metode swim up, setelah thawing
spermatozoa diinkubasi dalam media TALP (Tyrode Albumin Lactate Pyruvate)
yang disuplementasi dengan glukosa dan BSA selama 15 menit sebelum disentrifugasi. Selanjutnya lapisan atas media dipindahkan ke tube 15 ml untuk disentrifugasi dengan kecepatan 1800 rpm, suhu 28°C selama 5 menit. Sedangkan untuk kelompok spermatozoa tanpa swim up, sampel spermatozoa langsung disentrifugasi dalam media fertilisasi. Setelah sentrifugasi baik pada kelompok
swim up atau tanpa swim up, supernatan dibuang dan pellet ditambahkan media
fertilisasi sampai konsentrasi akhir spermatozoa adalah 1×106 spermatozoa/mL, kemudian dibuat drop dan ditutup dengan mineral oil (Sigma-Aldrich. St. Louis, MO, USA). Oosit yang telah dimaturasi dimasukkan ke dalam drop spermatozoa dan diinkubasi selama 12-14 jam dalam inkubator CO2 5 % temperatur 39°C. c. Evaluasi tingkat fertilisasi in vitro
Evaluasi keberhasilan fertilisasi dilihat 12-14 jam setelah inkubasi. Sel-sel kumulus yang mengelilingi oosit dihilangkan dengan cara dipipet berulang-ulang. Oosit difiksasi dengan aceto-ethanol selama 48-72 jam. Oosit yang telah terfiksasi diwarnai dengan aceto-orcein 2 % untuk mengevaluasi pembentukan pronukleus (PN) menggunakan mikroskop fase kontras (Olympus IX 70, Japan). Oosit yang telah mengalami fertilisasi ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2PN) atau lebih (>2PN) dalam sitoplasma oosit.
Analisis Data
Data tingkat fertilisasi oosit in vitro disajikan dalam bentuk persentase dan dianalisa menggunakan Analysis of Variance (ANOVA) taraf nyata 95% dengan lima kali ulangan. Apabila terdapat perbedaan yang nyata diantara perlakuan, maka dilanjutkan dengan uji Fisher’s Protected Least Significant Difference
11
4
HASIL DAN PEMBAHASAN
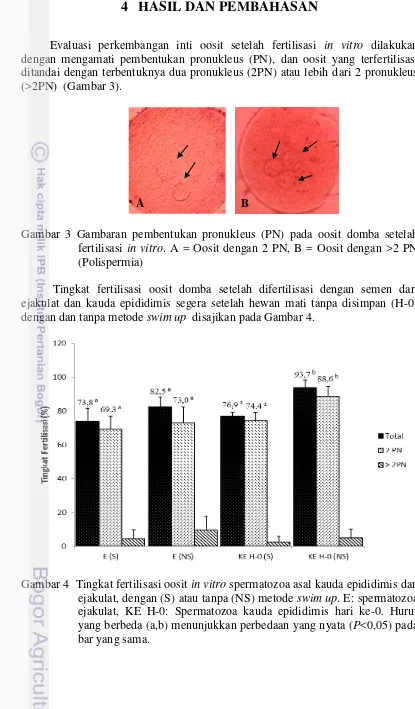
Evaluasi perkembangan inti oosit setelah fertilisasi in vitro dilakukan dengan mengamati pembentukan pronukleus (PN), dan oosit yang terfertilisasi ditandai dengan terbentuknya dua pronukleus (2PN) atau lebih dari 2 pronukleus (>2PN) (Gambar 3).
Gambar 3 Gambaran pembentukan pronukleus (PN) pada oosit domba setelah fertilisasi in vitro. A = Oosit dengan 2 PN, B = Oosit dengan >2 PN (Polispermia)
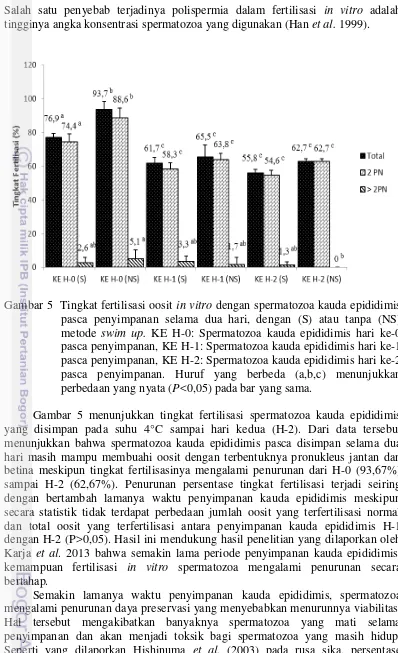
Tingkat fertilisasi oosit domba setelah difertilisasi dengan semen dari ejakulat dan kauda epididimis segera setelah hewan mati tanpa disimpan (H-0) dengan dan tanpa metode swim up disajikan pada Gambar 4.
Gambar 4 Tingkat fertilisasi oosit in vitro spermatozoa asal kauda epididimis dan ejakulat, dengan (S) atau tanpa (NS) metode swim up. E: spermatozoa ejakulat, KE H-0: Spermatozoa kauda epididimis hari ke-0. Huruf yang berbeda (a,b) menunjukkan perbedaan yang nyata (P<0,05) pada bar yang sama.
3,85 9,3
,6 2,54
3,0
6,9 4,4
,6 ,5
3,7
,06 8,6
12
Hasil penelitian pada Gambar 4 menunjukkan spermatozoa yang berasal dari kauda epididimis segera setelah kematian hewan (H-0) memiliki kemampuan yang sama untuk memfertilisasi oosit secara in vitro dengan spermatozoa ejakulat (P>0,05). Hasil serupa dilaporkan oleh Blash et al. (2000) pada kambing dan Kaabi et al. (2003) pada domba, bahwa tidak terdapat perbedaan signifikan antara spermatozoa beku asal kauda epididimis dan ejakulat yang digunakan untuk fertilisasi in vitro. Hal tersebut dikarenakan spermatozoa yang mencapai kauda epididimis umumnya motil dan telah matang sehingga memiliki kemampuan untuk memfertilisasi (Toshimori 2003). Garcia-Macias et al. (2006) menemukan pada domba bahwa spermatozoa yang berasal dari kauda epididimis, kromatinnya telah mampu terkondensasi dengan baik sama seperti spermatozoa ejakulat.
Tingkat fertilisasi yang cenderung lebih tinggi pada spermatozoa asal kauda epididimis (H-0) (93,67% vs 82,54%) kemungkinan terjadi karena kualitas spermatozoa kauda epididimis yang diperoleh lebih tinggi dibandingkan spermatozoa ejakulat. Sumber sampel semen ejakulat dan kauda epididimis yang diperoleh dari hewan yang berbeda juga dapat menyebabkan munculnya perbedaan kualitas spermatozoa. Seperti yang dilaporkan Garcia-Alvarez et al. (2009) pada domba, dimana persentase viabilitas spermatozoa dari kauda epididimis lebih tinggi dari ejakulat.. Spermatozoa asal kauda epididimis memiliki ketahanan terhadap pengaruh buruk pembekuan dan stres lingkungan lainnya dibandingkan dengan spermatozoa ejakulat. Hal tersebut dikarenakan spermatozoa domba asal kauda epididimis memiliki batas toleransi osmotik yang tinggi dibandingkan dengan spermatozoa ejakulat yang disebabkan oleh beberapa faktor termasuk gradien osmotik pada lingkungan kauda epididimis dan muatan pada membran fosfolipid (Varisli et al. 2009). Seperti yang dilaporkan Yeung et al. (2006) bahwa spermatozoa berada pada keadaan hiperosmotik selama transit pada kauda epididimis. Oleh karena itu, hal tersebut yang diduga menyebabkan spermatozoa asal kauda epididimis dapat mentoleransi tekanan hiperosmotik lebih baik daripada spermatozoa asal ejakulat.
Metode swim up merupakan salah satu teknik pemisahan spermatozoa berdasarkan pada pergerakan spermatozoa motil menuju permukaan media setelah diinkubasi. Teknik pemisahan plasma semen atau krioprotektan dan pemisahan spermatozoa motil dari yang tidak motil dapat dilakukan untuk meningkatkan kemampuan fertilisasi spermatozoa (Henkel dan Schill 2003). Kemampuan spermatozoa untuk mencapai permukaan media digunakan untuk menyeleksi spermatozoa yang motil. Pada penelitian ini penggunaan metode swim up dan tanpa swim up secara statistik tidak menunjukkan perbedaan yang nyata (P>0,05), dimana metode swim up memberikan pengaruh yang sama terhadap peningkatan kemampuan fertilisasi dengan metode tanpa swim up baik spermatozoa ejakulat maupun spermatozoa asal kauda epididimis. Banyaknya energi yang telah dihabiskan spermatozoa selama proses swim up dan sentrifuge diduga mempengaruhi penurunan motilitas spermatozoa sehingga mengakibatkan tidak berpengaruhnya metode swim up dalam peningkatan persentase tingkat fertilisasi
in vitro domba.
13 Salah satu penyebab terjadinya polispermia dalam fertilisasi in vitro adalah tingginya angka konsentrasi spermatozoa yang digunakan (Han et al. 1999).
Gambar 5 Tingkat fertilisasi oosit in vitro dengan spermatozoa kauda epididimis pasca penyimpanan selama dua hari, dengan (S) atau tanpa (NS) metode swim up. KE H-0: Spermatozoa kauda epididimis hari ke-0 pasca penyimpanan, KE H-1: Spermatozoa kauda epididimis hari ke-1 pasca penyimpanan, KE H-2: Spermatozoa kauda epididimis hari ke-2 pasca penyimpanan. Huruf yang berbeda (a,b,c) menunjukkan perbedaan yang nyata (P<0,05) pada bar yang sama.
Gambar 5 menunjukkan tingkat fertilisasi spermatozoa kauda epididimis yang disimpan pada suhu 4°C sampai hari kedua (H-2). Dari data tersebut menunjukkan bahwa spermatozoa kauda epididimis pasca disimpan selama dua hari masih mampu membuahi oosit dengan terbentuknya pronukleus jantan dan betina meskipun tingkat fertilisasinya mengalami penurunan dari H-0 (93,67%) sampai H-2 (62,67%). Penurunan persentase tingkat fertilisasi terjadi seiring dengan bertambah lamanya waktu penyimpanan kauda epididimis meskipun secara statistik tidak terdapat perbedaan jumlah oosit yang terfertilisasi normal dan total oosit yang terfertilisasi antara penyimpanan kauda epididimis H-1 dengan H-2 (P>0,05). Hasil ini mendukung hasil penelitian yang dilaporkan oleh Karja et al. 2013 bahwa semakin lama periode penyimpanan kauda epididimis, kemampuan fertilisasi in vitro spermatozoa mengalami penurunan secara bertahap.
Semakin lamanya waktu penyimpanan kauda epididimis, spermatozoa mengalami penurunan daya preservasi yang menyebabkan menurunnya viabilitas. Hal tersebut mengakibatkan banyaknya spermatozoa yang mati selama penyimpanan dan akan menjadi toksik bagi spermatozoa yang masih hidup. Seperti yang dilaporkan Hishinuma et al. (2003) pada rusa sika, persentase viabilitas spermatozoa asal kauda epididimis mengalami penurunan selama
14
penyimpanan sampai hari keempat. Garde et al. (1998) melaporkan pada rusa merah viabilitas dan kemampuan fertilisasi spermatozoa menurun akibat semakin lamanya waktu antara kematian hewan dengan waktu pengoleksian semen. Martins et al. (2009) melaporkan bahwa kauda epididimis sapi yang disimpan pada lemari es mampu memperpanjang daya hidup spermatozoa, akan tetapi terjadi penurunan motilitas setelah penyimpanan selama 72 jam.
Terjadinya penurunan motilitas selama penyimpanan juga mempengaruhi kemampuan spermatozoa dalam memfertilisasi oosit. Penurunan persentase motilitas pada spermatozoa kucing asal kauda epididimis yang disimpan pada suhu 5oC mengalami penurunan seiring bertambahnya waktu simpan (Ganan et al. 2009). Sebagai upaya untuk meningkatkan motilitas spermatozoa pada fertilisasi in vitro, dilakukan teknik pemisahan spermatozoa menggunakan metode
swim up yang diharapkan mampu meningkatkan kemampuan fertilisasi
spermatozoa asal kauda epididimis pasca penyimpanan pada suhu 4 oC. Akan tetapi metode tersebut tidak memberi pengaruh yang nyata terhadap tingkat fertilisasi spermatozoa kauda epididimis yang disimpan pada suhu 4 oC sampai hari kedua karena tingkat fertilisasi spermatozoa kauda epididimis yang di swim
up tidak berbeda dengan yang tanpa swim up (P>0,05) pada setiap kelompok
perlakuan. Hal ini kemungkinan disebabkan karena kualitas spermatozoa yang sudah menurun seiring dengan bertambahnya lama periode penyimpanan. Tanphaichitr et al. (1988) melaporkan bahwa pemisahan spermatozoa dengan
swim up akan memberikan tingkat fertilisasi yang tinggi apabila sampel semen
mempunyai kualitas yang tinggi.
Persentase polispermia pada spermatozoa kauda epididimis pasca penyimpaan tidak menunjukkan perbedaan yang signifikan (P>0,05) seiring dengan bertambahnya lama waktu penyimpanan. Namun, terjadi penurunan tingkat polispermia pada spermatozoa pasca penyimpanan dengan menggunakan metode swim up. Seperti yang dilaporkan Park et al. (2009), metode swim up
15
5
SIMPULAN DAN SARAN
Simpulan
Metode persiapan spermatozoa dengan swim up memberikan pengaruh yang sama dengan metoda tanpa swim up terhadap tingkat fertilisasi spermatozoa asal kauda epididimis yang disimpan pada suhu 4 oC selama dua hari. Kemampuan fertilisasi spermatozoa asal kauda epididimis domba yang disimpan pada suhu 4°C mengalami penurunan sampai hari kedua, namun spermatozoa tersebut masih mampu membuahi oosit secara in vitro.
Saran
16
DAFTAR PUSTAKA
Alomar M, Tasiaux H, Remacle S, George F, Paul D, Donnay I. 2008. Kinetics of fertilization and development, and sex ratio of bovine embryos produced using the semen of different bulls. Anim Reprod Sci 107: 48-61.
Anger JT, Gilbert BR, Goldstein M. 2003. Preservation of sperm: indications, methods, and results: Review Article. J Urol 170: 1079-1084.
Axner E, SormHolst B, Linde-Forsberg C. 1998. Morphology of spermatozoa in the cauda epididymis before and after electroejaculation and comparison with ejaculated spermatozoa in the domestic cat. Theriogenology 50 6 : 973-979.
Batista M, Baptista MC, Marques CC, Barbas JP, Vasques MI, Horta AEM, Silva-Pereira M, Silva-Pereira RM. 2006. Effect of Ram Sperm Capacitation by Swim-Up or Percoll on In Vitro Fertilization. Reprod Domes Anim 41: 342.
Bavers MM, Dieleman SJ, Van den Hurk R, Radyar F. 1997. Rugalation and Modulation of Oocytes Maturation in The Bovine. Theriogenology 47: 13-22.
Beilby KH, Grupen CG, Thomson PC, Maxwell WMC, Evans G. 2009. The effect of insemination time and sperm dose on pregnancy rate using sex-sorted ram sperm. Theriogenology 71:829-835.
Beydola T, Sharma RK, Lee W, Agarwal A. Sperm preparation and selection techniques. 2013. In: Rizk B, Aziz N, Agarwal A. editors. Male Infertility Practice. New Delhi: Jaypee Brothers Medical Publishers. pp. 244–251 Bilodeau-Goeseels S, Panich P. 2002. Effects of oocyte quality on development
and transcriptional activity in early bovine embryos. Anim Reprod Sci
71:143-155.
Blash S, Melican D, Gavin W. 2000. Cryopreservation of epididymal sperm obtained at necropsy from goats. Theriogenology 54:899-905.
Boediono A, Rusiyantono Y, Mohamad K, Djuwita I, Herliatien. 2000. Perkembangan oosit kambing setelah maturasi, fertilisasi dan kultur in vitro.
Media Vet 7: 11-17.
Celeghini EC, de Arruda RP, de Andrade AF, Nascimento J, Raphael CF, Rodrigues PH. 2008. Effects that bovine sperm cryopreservation using two different extenders has on sperm membranes and chromatin. Anim Reprod Sci 104: 119-131.
Centola GM, Herko R, Andolina E, Weisensel S. 1998. Comparison of sperm separation methods: effect on recovery, motility, motion parameters, and hyperactivation. Fertil Steril 70:1173-1175.
Cooper TG. 2005. Cytoplasmic droplets: The good, the bad or just confusing.
Hum Reprod 20: 9–11.
17 Elder K, Dale B. 2003. In Vitro Fertilization. Ed ke-2. Cambridge University
Press.
Fazeli A, Hage WJ, Cheng FP, Voorhout WF, Marks A, Bevers MM, Colenbrander B . 1997. Acrosome-intact boar spermatozoa initiate binding to the homologeous zona pellucida. Biol Reprod 56:430–438.
Fernandez-Santos MR, Martinez-Pastor F, Matias D, Dominguez-Rebolledo AE, Esteso MC, Montoro V, Garde JJ. 2009. Effect of long-term chilled storage of red deer epididymides on DNA integrity and motility of thawed spermatozoa. Anim Reprod Sci 111: 93-104.
Funahashi H 2003. Polyspermic penetration in porcine IVM-IVF systems. Reprod
Fertil Dev 15:167–177. Sperm characteristics and in vitro fertilization ability of thawed spermatozoa from Black Machega ram: electroejaculation and postmortem collection.
Theriogenology 72:160-168.
Garcia-Macias V, Martinez-Pastor F, Alvarez M, Garde JJ, Anel E, Anel L, de Paz P. 2006. Assessment of chromatin status (SCSA1) in epididymal and ejaculated sperm in Iberian red deer, ram and domestic dog. Theriogenology
66:1921–1930.
Garde J, Ortiz N, Garcıa A, Gallego AL, Landete CT, Lopez. 1998. Postmortem assessment of sperm characteristics of the red deer during the breeding season. Arch Androl 41:195-202.
Gillan L, Kroetsch T, Maxwell WM, Evans G. 2008. Assessment of in vitro sperm characteristics in relation to fertility in dairy bulls. Anim Reprod Sci
103:201–214.
Gordon I. 2003. Laboratory Production of Cattle Embryos 2nd edition. London (GB):CABI Publishing.
Hafez ESE, Hafez B. 2000. Anatomy of male reproduction, In : Reproduction in Farm Animals 7th Edition. USA: Lippincott Williams & Wilkins, Baltimore. pp. 3-12
Han YM, Abeydeera LR, Kim JH, Moon HB, Cabot RA, Day BN, Prather RS. 1999. Growth retardation of inner cell mass cells in polyspermic oocytes matured and fertilized in vitro. Biol Reprod 60:1110–1113.
Harkema W, Harrison RAP, Miller NGA, Topper EK, Woelders H. 1998. Enhanced binding of zona pellucida proteins to the acrosomal region of intact boar spermatozoa in response to fertilizing conditions: a flow cytometric study. Biol Reprod 58: 421 – 430.
Henkel RR, Schill WB. 2003. Sperm preparation for ART. Reprod Biol
Endocrinol 1:108.
18
Hishinuma M, Suzuki K, Sekine J. 2003. Recovery and cryopreservation of sika deer (cervus nippon) spermatozoa from epididymides stored at 4 degrees C.
Theriogenology 59:813-820.
Inaudi P, Petrilli S, Joghtapour A, Trusso P, Petraglia F. 2002. Reduction of steps in the preparation of motile sperm for intrauterine insemination does not reduce efficacy of the procedure: simplified one-step swim-up method versus classic swim-up. Hum Reprod 17: 1288-1291.
Jameel T. 2008. Sperm swim-up: a simple and effective technique of semen processing for intrauterine insemination. J Pak Med Assoc 58: 7-14.
Jishage K, Ueda O, Suzuki H. 1997. Fertility of mouse spermatozoa from cauda epididymis preserved in paraffin oil at 4°C. J Mamm Ova Res 14 : 45-48. Johnson LA, Weitze KF, Fiser P, Maxwell WMC. 2000. Storage of boar semen. J
Anim Sci 62: 143-172.
Kaabi M, Paz P, Alvarez M, Anel E, Boixo JC, Rouissi H, Herraez P, Anel L. 2003. Effect of epididymis handling conditions on the quality of ram spermatozoa recovered post-mortem. Theriogenology 60:1249–1259.
Karja NWK, Fahrudin M, Setiadi MA. 2013. In vitro Fertility of Post-thawed Epididymal Ram Spermatozoa after Storage at 5°C before Cryopreservation. Media Peternakan pp:26-31.
Kikuchi K, Nagai T, Kashiwazaki N, Ikeda H, Noguchi J, Shimmada A, Soloy E, Kaneko H. 1998. Cryopreservation and ensuing in vitro fertilization ability of boar spermatozoa from epididymides stored at 4 °C. Theriogenology
50:615–623.
Larson KL, Brannian JD, Timm BK, Jost LK, Evenson DP. 1999. Density gradient centrifugation and glass wool filtration of semen remove spermatozoa with damaged chromatin structure. Hum Reprod 14: 2015 – 2019.
Marti E, Perez-Pe R, Muino-Blanco T, Cebrian-Perez JA. 2006. Comparative study of four different sperm washing methods using apoptotic markers in ram spermatozoa. J Androl 27: 746-753.
Martins CF, Rumpf R, Pereira DC, Dode MN. 2007. Cryopreservation of epididymal bovine spermatozoa from dead animals and its uses in vitro
embryo production. Anim ReprodSci 101: 326-331.
Martins CF, Driessen K, Melo Costa P, Carvalho-Neto JO, de Sousa RV, Rumpf R, Dode MN. 2009. Recovery, cryopreservation and fertilization potential of bovine spermatozoa obtained from epididymides stored at 5 °C by different periods of time. Anim ReprodSci 116: 50-57.
Nazlie CS. 2004. Kajian Kualitas Spermatozoa Kucing Asal Epididimis dan Ductus Deferens Setelah Proses Preservasi Selama 7 Hari pada Suhu 4oC. Tesis. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor.
Ollero M, Gill GE, Lopez MC, Sharma RK, Aqarwal A, Larson K, Evenson D, Thomas AJ, Alvarez JG. 2001. Characterization of subsets of human spermatozoa at different stages of maturation: Implications in the diagnosis and treatment of male infertility. Hum Reprod 16: 1912 – 1921.
Park CH, Lee SG, Choi DH, Lee CK. 2009. A modified swim-up method reduces polyspermy during in vitro fertilization of porcine oocytes. Anim ReprodSci
19 Poiani A. 2006. Complexity of seminal fluid: A review. Behav Ecol Sociobiol 60:
289 – 310.
Purdy PH. 2006. A review on goat sperm cryopreservation. Small Rum Res 63: 215–225.
Rahman ANMA, Abdullah RB, Wan Khadijah WE. 2008. In vitro maturation of oocytes with special reference to goat [Review]. Biotechnology 7: 599-611. Rizal M, Nasrullah. 2004. Pemanfaatan spermatozoa epididimis dalm teknologi
reproduksi. Wartazoa 14: 14-20.
Rodriguez-Martinez H, Wallgren M. 2011. Advances in boar semen cryopreservation. Vet Med Int 1-5.
Sariozkan S, Tuncer PB, Bucak MN, Ulutas PA. 2009. Influence of various antioxidants on microscopicoxidative stress indicators and fertilizing ability of frozen-thawed bull semen. ACTA Vet 78:463-469.
Senger PL. 2005. The organization and function of the male reproductive system. In : Pathways to Pregnancy and Parturition 2nd Revised Edition. Current Conceptions, Inc., Washington. pp .69-71.
Shamsuddin M, Rodriguez-Martinez H, Larsson B. 1993. Fertilizing capacity of bovine spermatozoa selected after swim-up in hyaluronic acid-containing medium. Reprod Fertil Dev 5: 307-315.
Soler AJ, Perez-Guzman MD, Garde JJ. 2003. Storage of red deer epididymides for four days at 5°C: effects on sperm motility, viability, and morphology integrity. J Exp Zool 295A: 188-199.
Songsasen N, Tong J, Leibo SP. 1998. Birth of live mice derived by in vitro
fertilization with spermatozoa retrieved up to twenty-four hours after death.
J Exp Zool 280: 189-196.
Suarez SS, Ho HC. 2003. Hyperactivated motility in sperm. Reprod Domes Anim
38: 119-124.
Suzuki K, Eriksson B, Shimizu H, Nagai T, Rodriguez-Martinez H. 2000. Effect of hyaluron on monospermic penetration of porcine oocytes fertilized in vitro. Int J Androl 23:13-21.
Tanphaichitr N, Agulnick A, Seibel M, Taymor M. 1988. Comparison of in vitro
fertilization rate by human sperm capacutated by multiple-tube swim-up and percoll gradient centrifugarion. J In Vit Fert Emb Trans 5: 119-122.
Tebet JM, Martins MIM, Chirinea VH, Souza FF, Campagnol D, Lopes MD. 2006. Cryopreservation effects on domestic cat epididymal versus electroejaculated spermatozoa. Theriogenology 66: 1629 – 1632.
Toshimori K. 2003. Biology of spermatozoa maturation: An overview with an introduction to this issue. Mic Res Tech 61: 1-6.
Varisli O, Uguz C, Agca C, Agca Y. 2009. Motility and acrosomal integrity comparisons between electro-ejaculated and epididymal ram sperm after exposure to a range of anisosmotic solutions, cryoprotective agents and low temperatures. Anim Reprod Sci 110: 256–268.
Vieira LA, Gadea J, García-Vázquez FA, Avilés-López K, Matás C. 2012. Equine spermatozoa stored in the epididymis for up to 96h at 4°C can be successfully cryopreserved and maintain their fertilization capacity. Anim
Reprod Sci 136: 280-288.
Watson PF. 2000. The causes of reduced fertility with cryopreserved semen. Anim
20
Wang WH, Day BN, Wu GM. 2003. How does polyspermy happen in mammalian oocytes? Mic Res Tech 61: 335–341.
White IG. 1993. Lipids and calcium uptake of sperm in relation to cold shock and preservation: A review. Reprod Fertil Dev 6: 639 – 658.
Wildt DE. 2000. Genome resource banking for wildlife research, management, and conservation. ILAR J. 41: 228–234.
Wolf CA, Brass KE, Rubin MIB, Pazzobon SE, Mozzaquatro FD, De La Corte FD. 2008. The effect of sperm selection by Percoll or swim-up on the sex ratio of in vitro produced bovine embryos. Anim Reprod 5: 110-115.
21 Lampiran 1 Komposisi media Niwa and Sasaki Freezing (NSF) untuk kriopreservasi
spermatozoa
1 Medium Freezing NSF 1
Komponen Jumlah
Laktosa 8,8%
Kuning Telur 20%
Ampicillin 20 mg/ml
Mili-Q Water 80%
2 Medium Freezing NSF II
Lampiran 2 Komposisi media transportasi ovarium
● Stok penicillin-streptomycin
Dosis penicillin-G: 0,06 g/l = 100 IU/ml Dosis streptomycin sulfate : 0,1 g/ml
Untuk membuat stok penicillin-G 0,0006 g (Sigma-Aldrich. Inc, P-4687)
dan streptomycin sulfate (Sigma-Aldrich. Inc, S-9137) 0,001 g dilarutkan
dalam 10 ml milli-Q water.
Komponen Jumlah
Medium freezing NSF I 92,52%
Orvus ES Paste 1,48%
Gliserol 6%
Komponen Jumlah
Sodium chloride (Sigma Aldrich, USA) 9,0 g
Penicillin-streptomycin 1000 µl
22
Lampiran 3 Komposisi media koleksi oosit
● Stok PBS : 9,6 g (Dulbecco’s Nissui, Japan) / 1000 ml milli - Q water
● Stok penicillin-streptomycin
Dosis penicillin-G: 0,06 g/l = 100 IU/ml Dosis streptomycinsulfate: 0,1 g/ml
Untuk membuat stok Penicillin-G0,0006 g (Sigma-Aldrich. Inc, P-4687)
dan streptomycinsulfate (Sigma-Aldrich. Inc, S-9137) 0,001 g dilarutkan
dalam 10 ml milli-Q water
● BSA 0,3% : 0,3 g/100 ml
Lampiran 4 Komposisi media TCM-199 untuk maturasi oosit
● Stok FSH (Teikokuzoki, Tokyo, Japan) Dosis: 10 µg/mL
Untuk membuat stok, 10 IU FSH dilarutkan dalam 1 mL TCM-199 (0,01 IU/mL)
● Stok hCG (Kyoritsu Seiyaku, Japan) Dosis: 10 IU/mL
Untuk membuat stok, 1500 IU hCG dilarutkan dalam 1,5 mL TCM-199 (1 IU/µl)
● Stok gentamycin (Sigma-Aldrich, USA) Dosis: 50 µg/µ L
FSH (Follicle Stimulating Hormone)
23 Lampiran 5 Komposisi media fertilisasi oosit in vitro
Komponen mg/100ml Suzuki et al. (2000). Effect of hyaluron on monospermic penetration of porcine oocytes fertilized in vitro. Int J Androl 23:13-21.
Larutan stok dapat dibuat terlebih dahulu secara terpisah (A: NaCl, KCl, NaH2PO4 anhydrous, MgSO4 7H2O, Sodium Laktat, HEPES, CaCl2 2H2O; B: NaHCO3). Setelah larutan stok A dan B dicampurkan, baru kemudian bisa ditambahkan dengan Sodium piruvat, kafein anhydrous, dan BSA (fatty acid free) pada saat akan digunakan.
Setelah larutan stok media TALP dibuat, penambahan glukosadan BSA
24
Lampiran 7 Prosedur fiksasi dan pewarnaan untuk evaluasi oosit
● Media fiksasi : Aceto-ethanol
1. Campurkan satu bagian asam asetat dengan tiga bagian etanol (asam asetat 1 : 3 etanol)
2. Letakkan campuran media pada wadah tertutup rapat
● Pewarna : Aceto-orcein (2%)
1. Panaskan asam asetat dalam baker glass selama 20 menit 2. Tambahakan orcein sambil diaduk hingga merata
3. Tunggu sampai dingin, tambahkan 55 mL DW lalu di filtrasi sebelum disimpan
Komponen Jumlah
Orcein 2 gr
Acetic acid 45 mL
25
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi pada tanggal 23 April 1992 dari pasangan Drs H Ali Amran, M.H dan (Alm) Dra Hj Rachmawaty, M.Si. Penulis merupakan anak pertama dari empat bersaudara, yaitu Syarifah Rachmedi Amran S.Psi, Humaida Amrah Tri Putri, Rahmat Hidayat Amrah. Pendidikan sarjana ditempuh penulis pada Fakultas Peternakan, Universitas Andalas, Padang pada bulan Agustus tahun 2009 dan dinyatakan lulus pada bulan Mei tahun 2013. Pada bulan Agustus tahun 2013 penulis diterima di Program Pascasarjana, Institut Pertanian Bogor pada Program Studi Biologi Reproduksi, Fakultas Kedokteran Hewan dengan memperoleh beasiswa Fresh Graduate dari Dikti tahun 2013.
Karya ilmiah penulis dengan judul “Daya Fertilisasi Spermatozoa Kauda
Epididimis Domba dengan atau Tanpa Swim Up Sebelum Fertilisasi” telah
diajukan pada Jurnal Kedokteran Hewan, Fakultas Kedokteran Hewan, Universitas Syiah Kuala, Banda Aceh. Karya ilmiah merupakan bagian dari program magister yang semoga dapat bermanfaat bagi sesama.