SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIOKSIDAN EKSTRAK ETANOL DAUN GAHARU
(
Aquilaria malaccensis
Lamk)
SKRIPSI
Oleh :
Samuel Fransiskus Silaban 091201101
Teknologi Hasil Hutan
PROGRAM STUDI KEHUTANAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
ABSTRAK
SAMUEL FRANSISKUS SILABAN : Skrining Fitokimia dan Uji Aktivitas Antioksidan Ekstrak Etanol Daun Gaharu (Aquilaria malaccensis Lamk.). Dibawah Bimbingan RIDWANTI BATUBARA danHERAWATY GINTING.
Daun gaharu (Aquilaria malaccensis Lamk.) saat ini sudah mulai populer dimanfaatkan petani gaharu sebagai minuman kesehatan, tetapi penelitian tentang golongan senyawa kimia yang terkandung dalam daun gaharu dan kemampuan aktivitas antioksidannya belum dilakukan. Untuk itu suatu penelitian telah dilakukan di laboratorium farmakognosi dan laboratorium penelitian, Fakultas Farmasi USU pada Juli-Oktober 2013 dengan mengekstrak daun gaharu segar dan simplisia secara maserasi dengan menggunakan pelarut etanol 96%. Skirining fitokimia meliputi pemeriksaan senyawa golongan alkaloida, glikosida, steroid/triterpenoid, flavonoid, tannin dan saponin. Pengujian aktivitas antioksidan dilakukan dengan metode DPPH dengan parameter yang diamati adalah persen peredaman radikal bebas pada menit ke-60 dengan konsentrasi yang berbeda (40 ppm, 60 ppm, 80 ppm dan 100 ppm) dan nilai IC50 (inhibitory concentration)
dianalisis menggunakan persamaan regresi.
Peredaman radikal bebas oleh ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia menunjukkan bahwa konsentrasi yang tinggi akan meningkatkan aktivitas peredaman radikal bebas. Hasil pengujian aktivitas antioksidan menunjukkan bahwa ekstrak etanol daun gaharu dan simplisia memiliki aktivitas antioksidan. Nilai IC50 ekstrak etanol simplisia paling aktif
yaitu 31,12 ppm dan ekstrak etanol daun gaharu segar 38,16 ppm. Hasil penelitian menunjukkan bahwa ekstrak etanol daun gaharu segar dan simplisia mengandung golongan senyawa flavanoid, glikosida, steroid/triterpenoid dan tanin.
ABSTRACT
SAMUEL FRANSISKUS SILABAN : Phytochemical Screening and Antioxidant Activity Test of Ethanol Extract of Gaharu Leaf (Aquilaria malaccensis Lamk.). Under the supervision of RIDWANTI BATUBARA andHERAWATY GINTING.
Gaharu leaf (Aquilaria malaccensis lamk.) today has been popular used by gaharu farmers as a health beverage, but the research of chemical compound that contained in gaharu leaf and the ability of antioxidant activity haven’t yet done. Therefore, a research had been conducted at laboratory farmakognosi, and research lab the faculty of pharmacologists USU in July-October 2013 with extracting the fresh gaharu leaves and simplex by maceration method using a solvent ethanol 96%. Phytochemical screening covering checkings alkaloid contain, glycoside, steroid/triterpenoid, flavonoid, tannin and saponin. The ability testing of activity antioxidant was done with by using DPPH method with the concern parameter is free radicals at the 60th minute with different concentration (40 ppm, 60 ppm, 80 ppm and 100 ppm) and IC50 value (inhibitory concentration)
that analyzed by using regression.
Inhibitor free radical by extract of fresh gaharu and ethanol simplex showed that high concentration increased the activity of inhibitor free radicals. Test results showed that all of extract and simplex have antioxidant activity. The most active ethanol extract simplex with IC50 value 31,12 ppm and ethanol extract
of fresh gaharu leaf 38,16 ppm. The result showed that ethanol extraction of fresh gaharu leaf and simplex contain flavanoid, glycoside, steroid/triterpenoid and tannin as the chemical compounds.
RIWAYAT HIDUP
Penulis dilahirkan di Doloksanggul pada tanggal 15 Mei 1991 dari ayah Tua S. Silaban dan ibu Jenita Simamora. Penulis merupakan putra kedua dari tujuh bersaudara.
Penulis menyelesaikan pendidikan Sekolah Dasar Swasta St. Maria Doloksanggul pada tahun 2003, pendidikan tingkat Sekolah Menengah Pertama dari SMP Swasta St. Lusia Doloksanggul pada tahun 2006, pendidikan tingkat Sekolah Menengah Atas dari SMA Negeri 18 Medan tahun 2009 dan pada tahun yang sama masuk ke Fakultas Pertanian USU melalui jalur Ujian Masuk Bersama Perguruan Tinggi Negeri. Penulis memilih Program Studi Kehutanan, Fakultas Pertanian dan pada semester VII memilih minat studi Teknologi Hasil Hutan.
Selama mengikuti perkuliahan, penulis aktif dalam organisasi Himpunan Mahasiswa Sylva (HIMAS) USU dan menjabat sebagai sekretaris periode tahun 2012-2013. Selain itu penulis juga aktif dalam organisasi Ikatan Mahasiswa HUMBAHAS USU (IMHU). Penulis juga pernah menjadi asisten praktikum Sifat Kimia Kayu. Penulis mengikuti Praktik Pengenalan Ekosistem Hutan (P2EH) di
Taman Hutan Raya Bukit Barisan, Gunung Barus dan Hutan Pendidikan USU Kabupaten Karo selama 10 hari.
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang atas berkat dan rahmat serta karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini berjudul “Skrining Fitokimia dan Uji Aktivitas Antioksidan Ekstrak Etanol Daun Gaharu (Aquilaria malaccensis Lamk.)”.
Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia dan
kekuatan aktivitas antioksidan dari ekstrak etanol daun gaharu (Aquilaria malaccensis Lamk.).
Pada kesempatan ini penulis menghaturkan pernyataan terima kasih kepada:
1. Orang tua tercinta (T. S. Silaban dan J. Simamora) yang telah membesarkan dan mendidik penulis selama ini serta selalu memberi dukungan, doa dan motivasi untuk tetap semangat dalam penyelesaian skripsi ini.
2. Ibu Ridwanti Batubara, S.Hut., M.P dan Ibu Dra. Herawaty Ginting, M.Si., Apt. selaku ketua dan anggota komisi pembimbing yang telah memberi masukan dan saran berharga dalam penyelesaian skripsi ini.
3. Kakanda Baringin Silaban dan Adinda Sahala R. Silaban, Okta F. Silaban, Verawaty N. Silaban, Tri Lestari Silaban dan Seven S. Silaban atas cinta kasih dan doanya kepada penulis.
4. Bapak Petro Sembiring atas kesediaannya dalam memberikan izin untuk mengambil sampel di lahan pertanaman miliknya.
6. Asisten laboratorium dan teman-teman penelitian di Laboratorium Farmakognosi, Fakultas Farmasi, Universitas Sumatera Utara yang bersedia membantu dan memberi masukan selama melakukan penelitian.
7. Teman-teman Kehutanan angkatan 2009 lainnya yang telah memberi semangat, dukungan dan motivasi.
8. Semua rekan penghuni kontrakan pasar VII Padang Bulan, Medan atas doa dan dukungan yang diberikan.
9. Semua staf pengajar dan pegawai di Program Studi Kehutanan yang telah membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karenanya penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Penulis berharap agar skripsi ini dapat berguna sebagai sumber informasi bagi segala pihak yang membutuhkan.
DAFTAR ISI
Hal
ABSTRAK ... i
ABSTRACT ... ii
DAFTAR RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv Gaharu (Aquilaria malaccensis Lamk.) ... 14
Syarat Tumbuh dan Penyebaran Gaharu di Indonesia ... 15
Ekstraksi ... 17
Skrining Fitokimia ... 19
Pelarut Etanol ... 22
Radikal Bebas ... 23
Antioksidan ... 24
Antioksidan Alami ... 26
Pengujian Aktivitas Antioksidan ... 29
Pengukuran Absorbansi-Panjang Gelombang ... 31
METODE PENELITIAN Waktu dan Tempat Penelitian ... 32
Bahan dan Alat Penelitian ... 32
Prosedur Penelitian ... 33
Pengambilan Sampel Tanaman ... 33
Determinasi Tanaman ... 33
Persiapan Bahan Baku ... 33
Pembuatan Pereaksi ... 34
Penetapan Kadar Air ... 35
Skrining Fitokimia ... 36
Pengujian Kemampuan Antioksidan dengan Spektrofotometer
UV-visible ... 39
Penentuan Persen Peredaman ... 40
Penentuan Nilai IC50 ... 41
HASIL DAN PEMBAHASAN Determinasi Tumbuhan ... 42
Ekstrak Etanol Daun Gaharu secara Maserasi ... 42
Penetapan Kadar Air Simplisia ... 43
Hasil Skrining Fitokimia ... 44
Hasil Penentuan Panjang Gelombang Serapan Maksimum ... 46
Hasil Uji Aktivitas Antioksidan ... 47
Hasi Rendaman Radikal Bebas DPPH oleh Sampel Uji ... 49
Nilai IC50 (Inhibitory Concentration) Sampel Uji... 51
KESIMPULAN DAN SARAN Kesimpulan ... 54
Saran ... 54
DAFTAR TABEL
No. Hal 1. Hasil Uji Fitokimia Daun Gaharu (Gyrinops versteegii) ... 24
2. Hasil Skrining Fitokimia Simplisia, Ekstrak Etanol Daun Gaharu Segar dan Ekstrak Etanol Daun Gaharu Simplisia ... 43 3. Hasil Analisis Perendaman Radikal Bebas oleh Ekstrak Etanol Daun Gaharu Segar dan Ekstrak Etanol Simplisia ... 49 4. Kategori Kekuatan Aktivitas Antioksidan ... 51 5. Hasil Persamaan Regresi Linier Ekstrak Etanol Daun Gaharu
dan Ekstrak Etanol Simplisia ... 51 6. Nilai IC50 Ekstrak Etanol Daun Gaharu Segar dan Ekstrak
DAFTAR GAMBAR
No. Hal 1. Ekstrak Etanol Daun Gaharu ... 42
(a) Daun Gaharu Segar ... 42 (b) Simplisia Daun Gaharu ... 42 2. Kurva Serapan Maksimum Larutan DPPH 40 ppm dalam Metanol
secara Spektrofotometri Visibel ... 46 3. Hasil Uji Aktivitas Antioksidan Ekstrak Etanol Daun Gaharu Segar ... 47 4. Hasil Uji Aktivitas Antioksidan Ekstrak Etanol Simplisia ... 47 5. Hubungan Konsentrasi Ekstrak Etanol Daun Gaharu Terhadap Persen
ABSTRAK
SAMUEL FRANSISKUS SILABAN : Skrining Fitokimia dan Uji Aktivitas Antioksidan Ekstrak Etanol Daun Gaharu (Aquilaria malaccensis Lamk.). Dibawah Bimbingan RIDWANTI BATUBARA danHERAWATY GINTING.
Daun gaharu (Aquilaria malaccensis Lamk.) saat ini sudah mulai populer dimanfaatkan petani gaharu sebagai minuman kesehatan, tetapi penelitian tentang golongan senyawa kimia yang terkandung dalam daun gaharu dan kemampuan aktivitas antioksidannya belum dilakukan. Untuk itu suatu penelitian telah dilakukan di laboratorium farmakognosi dan laboratorium penelitian, Fakultas Farmasi USU pada Juli-Oktober 2013 dengan mengekstrak daun gaharu segar dan simplisia secara maserasi dengan menggunakan pelarut etanol 96%. Skirining fitokimia meliputi pemeriksaan senyawa golongan alkaloida, glikosida, steroid/triterpenoid, flavonoid, tannin dan saponin. Pengujian aktivitas antioksidan dilakukan dengan metode DPPH dengan parameter yang diamati adalah persen peredaman radikal bebas pada menit ke-60 dengan konsentrasi yang berbeda (40 ppm, 60 ppm, 80 ppm dan 100 ppm) dan nilai IC50 (inhibitory concentration)
dianalisis menggunakan persamaan regresi.
Peredaman radikal bebas oleh ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia menunjukkan bahwa konsentrasi yang tinggi akan meningkatkan aktivitas peredaman radikal bebas. Hasil pengujian aktivitas antioksidan menunjukkan bahwa ekstrak etanol daun gaharu dan simplisia memiliki aktivitas antioksidan. Nilai IC50 ekstrak etanol simplisia paling aktif
yaitu 31,12 ppm dan ekstrak etanol daun gaharu segar 38,16 ppm. Hasil penelitian menunjukkan bahwa ekstrak etanol daun gaharu segar dan simplisia mengandung golongan senyawa flavanoid, glikosida, steroid/triterpenoid dan tanin.
ABSTRACT
SAMUEL FRANSISKUS SILABAN : Phytochemical Screening and Antioxidant Activity Test of Ethanol Extract of Gaharu Leaf (Aquilaria malaccensis Lamk.). Under the supervision of RIDWANTI BATUBARA andHERAWATY GINTING.
Gaharu leaf (Aquilaria malaccensis lamk.) today has been popular used by gaharu farmers as a health beverage, but the research of chemical compound that contained in gaharu leaf and the ability of antioxidant activity haven’t yet done. Therefore, a research had been conducted at laboratory farmakognosi, and research lab the faculty of pharmacologists USU in July-October 2013 with extracting the fresh gaharu leaves and simplex by maceration method using a solvent ethanol 96%. Phytochemical screening covering checkings alkaloid contain, glycoside, steroid/triterpenoid, flavonoid, tannin and saponin. The ability testing of activity antioxidant was done with by using DPPH method with the concern parameter is free radicals at the 60th minute with different concentration (40 ppm, 60 ppm, 80 ppm and 100 ppm) and IC50 value (inhibitory concentration)
that analyzed by using regression.
Inhibitor free radical by extract of fresh gaharu and ethanol simplex showed that high concentration increased the activity of inhibitor free radicals. Test results showed that all of extract and simplex have antioxidant activity. The most active ethanol extract simplex with IC50 value 31,12 ppm and ethanol extract
of fresh gaharu leaf 38,16 ppm. The result showed that ethanol extraction of fresh gaharu leaf and simplex contain flavanoid, glycoside, steroid/triterpenoid and tannin as the chemical compounds.
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara kepulauan yang sangat luas, mempunyai kurang lebih 35.000 pulau yang besar dan kecil dengan keanekaragaman jenis flora dan fauna yang sangat tinggi. Di Indonesia diperkirakan terdapat 100 sampai dengan 150 suku tumbuh-tumbuhan dan dari jumlah tersebut sebagian besar mempunyai potensi untuk dimanfaatkan sebagai tanaman industri, tanaman buah-buahan, tanaman rempah-rempah dan tanaman obat-obatan (Nasution, 1992).
Penelitian dan pengembangan tentang tumbuhan obat baik di dalam maupun di luar negeri berkembang dengan pesat saat ini, terutama dalam bidang khasiat obat maupun analisis zat kimia berdasarkan indikasi tumbuhan obat yang telah digunakan oleh sebagian masyarakat dengan khasiat yang teruji secara empiris. Hasil penelitian tersebut, tentunya lebih memantapkan para pengguna tumbuhan obat akan khasiat maupun kegunaanya (Dalimartha, 2000).
Berubahnya pola hidup masyarakat serta pola makan yang tidak benar dan pertambahan usia mengakibatkan pembentukan radikal bebas dalam tubuh. Padatnya aktivitas kerja cenderung menyebabkan masyarakat mengkonsumsi makanan yang serba instan dan menerapkan pola makan yang tidak sehat. Makanan yang tidak sehat akan menyebabkan akumulasi jangka panjang terhadap radikal bebas di dalam tubuh. Lingkungan tercemar, kesalahan pola makan dan gaya hidup, mampu merangsang tumbuhnya radikal bebas (free radical) yang dapat merusak tubuh (Mega dan Swastini, 2010).
yang mengandung antioksidan. Antioksidan dapat menetralkan radikal bebas dengan cara mendonorkan satu atom protonnya sehingga membuat radikal bebas menjadi stabil dan tidak reaktif (Lusiana, 2010)
Penelitian Mega dan Swastini (2010) menjelaskan bahwa senyawa metabolit sekunder flavanoid, terpenoid dan senyawa fenol diperkirakan mempunyai aktivitas sebagai antiradikal bebas (antioksidan). Antioksidan banyak ditemukan dalam sayuran dan buah-buahan segar. Sayuran dan buah-buahan diketahui mengandung berbagai zat antioksidan termasuk vitamin dan mineral. Antioksidan yang cukup potensial adalah vitamin E, vitamin C, senyawa-senyawa polifenol dan karotenoid (Kosasih, dkk., 2004). Antioksidan alami tersebar di beberapa bagian tanaman, seperti pada kayu, kulit kayu, akar, buah, bunga, biji, dan daun (Trilaksani, 2003).
Tujuan Penelitian
1. Mengetahui golongan senyawa kimia yang terkandung dalam daun gaharu (A. malaccensis Lamk.) yang berfungsi sebagai antioksidan.
2. Mengetahui kekuatan aktivitas antioksidan dari ekstrak etanol daun gaharu
(A. malaccensis Lamk.).
Manfaat Penelitian
1. Mendapatkan informasi mengenai golongan senyawa-senyawa kimia yang terkandung dalam daun gaharu (A. malaccensis Lamk.) dan golongan senyawa kimia yang berfungsi sebagai antioksidan.
2. Dapat digunakan sebagai acuan mengenai aktivitas antioksidan dari ekstrak etanol daun gaharu (A. malaccensis Lamk.) dalam memanfaatkan antioksidan alami yang berasal dari tumbuhan.
Hipotesis
TINJAUAN PUSTAKA
Gaharu (Aquilaria malaccensis Lamk.)
Pohon gaharu (Aquilaria malaccensis Lamk.) merupakan salah satu jenis tanaman kehutanan yang telah dikembangkan dengan teknik kultur jaringan. Jenis
A. malaccensis Lamk merupakan jenis pohon gaharu yang paling banyak ditemukan di Sumatera Utara (Yusnita, 2003).
Taksonomi tumbuhan gaharu (A. malaccensis Lamk.) menurut Tarigan (2004) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dikotil
Sub Kelas : Dialypetale Ordo : Myrtales Famili : Thymeleaceae Genus : Aquilaria
Species : A. malaccensis Lamk.
Bunga terdapat diujung ranting, ketiak daun, kadang-kadang di bawah ketiak daun. Berbentuk lancip, panjang sampai 5 mm. Buahnya berbentuk bulat telur, tertutup rapat oleh rambut-rambut yang berwarna merah. Biasanya memiliki panjang hingga 4 cm lebar 2,5 cm. Buah gaharu (A. malaccensis Lamk.) berbentuk kapsul, dengan panjang 3.5 cm hingga 5 cm, ovoid dan berwarna coklat. Kulitnya agak keras dan berbaldu. Mengandung 3 hingga 4 biji benih bagi setiap buah.
Syarat Tumbuh dan Penyebaran Gaharu di Indonesia
Syarat untuk tumbuh dengan baik, gaharu tidak memilih lokasi khusus. Umumnya gaharu masih dapat tumbuh dengan baik pada kondisi tanah dengan struktur dan tekstur yang subur, sedang, maupun ekstrem. Gaharu pun dapat dijumpai pada kawasan hutan rawa, hutan gambut, hutan dataran rendah, ataupun hutan pegunungan dengan tekstur tanah berpasir. Gaharu (A. malaccensis Lamk.) sesuai ditanam di antara kawasan dataran rendah hingga ke pegunungan pada ketinggian 0 – 750 meter dari permukaan laut dengan curah hujan kurang dari 2000 mm/thn. Suhu yang sesuai adalah antara 27°C hingga 32°C dengan kadar cahaya matahari sebanyak 70%. Kesesuaian tanah adalah jenis lembut dan liat berpasir dengan pH tanah antara 4.0 hingga 6.0 (Sumarna, 2009).
kondisi lahan yang struktur tanahnya lempung, dan liat berpasir, serta solum yang dalam (Sumarna, 2007).
Marga Aquilaria terdiri dari 15 spesies, tersebar di daerah tropis Asia mulai dari India, Pakistan, Myanmar, Lao PDR, Thailand, Kamboja, China Selatan, Malaysia, Philipina dan Indonesia. Enam diantaranya ditemukan di Indonesia (A. malaccensis, A. microcarpa, A. hirta, A. beccariana, A. cumingiana dan A. filarial). Keenam jenis tersebut terdapat hampir di seluruh kepulauan Indonesia, kecuali Jawa, Bali dan Nusa Tenggara. Pohon gaharu di Indonesia dikenal dengan nama yang berbeda-beda seperti calabac, karas, kekaras, mengkaras (Dayak), galoop (Melayu), kareh (Minang), age (Sorong), bokuin (Morotai), lason (Seram), Ketimunan (Lombok), ruhuwama (Sumba), seke (Flores), halim (Lampung) dan alim (Batak) (Sumarna, 2002).
Semakin tingginya tingkat permintaan akan gaharu menyebabkan terjadinya eksploitasi A. malaccensis Lamk secara besar-besaran di hutan alam. Saat ini tanaman gaharu berada diambang kepunahan hal ini sesuai dengan hasil penelitian dari CITES (Convention On International Trade Endangered Species Of Wuild Flora And Fauna) yang memasukkan tanaman A. malaccensis ke dalam jenis tanaman terancam punah (Apendix II) (Sumarna, 2009). Pohon gaharu dapat dimanfaatkan bukan hanya gubalnya saja akan tetapi bagian batang, kulit batang, akar dan daun juga sudah dimanfaatkan sebagai bahan untuk merawat wajah dan menghaluskan kulit (Tarigan, 2004).
obat. Kurangnya pengetahuan masyarakat akan manfaat daun gaharu menyebabkan pemanfaatan bagian-bagian gaharu seperti daun belum populer di kalangan masyarakat khususnya petani gaharu itu sendiri.
Ekstraksi
Ekstraksi adalah proses penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan pelarut cair. Diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain (Ditjen POM, 2000).
Beberapa metode ekstraksi yang sering digunakan dalam berbagai penelitian menurut Departemen Kesehatan Republik Indonesia (Ditjen POM) (2000) antara lain yaitu:
A. Cara dingin 1. Maserasi
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada suhu kamar. Proses perkolasi terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan perkolat) yang terus-menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan. Hasil akhir perkolasi dapat dilakukan dengan pemeriksaan zat aktif secara kualitatif pada perkolat terakhir.
B. Cara panas 1. Sokletasi
Sokletasi adalah proses penyarian simplisia dengan menggunakan pelarut yang selalu baru, yang umumnya dilakukan dengan alat khusus (menggunakan alat Sokhlet) sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
2. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
3. Digesti
4. Dekoktasi
Dekoktasi adalah proses penyarian simplisia dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
5. Infundasi
Infundasi adalah proses penyarian simplisia dengan menggunakan pelarut air pada temperatur 90°C selama waktu 15 menit.
Skrining Fitokimia
Skrining fitokimia adalah pemeriksaan kimia secara kualitatif terhadap senyawa-senyawa aktif biologis yang terdapat dalam simplisia tumbuhan. Senyawa-senyawa tersebut adalah senyawa organik. Oleh karena itu skrining terutama ditujukan terhadap golongan senyawa organik seperti alkaloid, glikosida, flavanoid, terpenoid, tanin dan lain-lain. Pada penelitian tumbuhan, untuk aktivitas biologi atau senyawa yang bermanfaat dalam pengobatan perlu diisolasi. Oleh Karena itu pemeriksaan fitokimia, teknik skrining dapat membantu langkah-langkah fitofarmakologi yaitu seleksi awal dari pemeriksaan tumbuhan tersebut untuk membuktikan adanya senyawa kimia tertentu dalam tumbuhan tersebut dan dapat dikaitkan dengan aktivitas biologinya (Farnsworth, 1996).
Golongan senyawa-senyawa organik yang perlu diskrining pada penelitian ini adalah:
1. Alkaloida
luas dalam bidang pengobatan (Harbone, 1987). Pada umumnya alkaloid merupakan senyawa padat berbentuk kristal atau amorf, tidak berwarna dan mempunyai rasa pahit. Dalam bentuk bebas alkaloid merupakan basa lemah yang sukar larut dalam air tetapi mudah larut dalam pelarut organik (Rusdi, 1998).
2. Glikosida
Glikosida adalah komponen yang menghasilkan satu atau lebih gula jika dihidrolisis. Komponen gula disebut glikon dan bukan gula disebut aglikon. Berdasarkan atom penghubung bagian gula (glikon) dan bukan gula (aglikon), maka glikosida dapat dibedakan menjadi:
a. C-glikosida, jika atom C menghubungkan bagian glikon dan aglikon. b. N-glikosida, jika atom N menghubungkan bagian glikon dan aglikon. c. O-glikosida, jika atom O menghubungkan bagian glikon dan aglikon. d. S-glikosida, jika atom S menghubungkan bagian glikon dan aglikon.
Gula yang paling sering dijumpai dalam glikosida adalah glukosa (Tyler et al., 1976; Robinson, 1995)
3. Flavanoid
4. Steroida/triterpenoida
Inti steroida sama dengan inti triterpenoida tetrasiklik. Steroida alkohol biasanya dinamakan dengan “sterol”, tetapi karena praktis semua steroida tumbuhan berupa alkohol seringkali disebut “sterol”. Sterol adalah triterpen yang kerangka dasarnya cincin siklopentana perhidrofenantrena. Dahulu sterol dianggap sebagai senyawa hormone kelamin, tetapi pada tahun-tahun terakhir ini makin banyak senyawa tersebut ditemukan dalam jaringan tumbuhan (Harbone, 1987; Robinson, 1995).
5. Saponin
Saponin berasal dari bahasa Latin yaitu “Sapo” yang berarti sabun dan sifatnya menyerupai sabun. Saponin merupakan senyawa aktif permukaan yang kuat dan menimbulkan busa, jika dikocok dengan air. Beberapa saponin bekerja sebagai antimikroba. Dikenal dua jenis saponin, yaitu glikosida triterpenoida dan glikosida struktur tertentu yang mempunyai rantai samping spiroketal. Kedua jenis saponin ini larut dalam air dan etanol tetapi tidak larut dalam eter (Robinson, 1995).
6. Tanin
Pelarut Etanol
Etanol adalah cairan tak berwarna yang mudah menguap dengan aroma yang khas. Ia terbakar tanpa asap dengan lidah api berwarna biru yang kadang-kadang tidak dapat terlihat pada cahaya biasa. Sifat-sifat fisika etanol utamanya dipengaruhi oleh keberadaan gugus hidroksil dan pendeknya rantai karbon etanol. Gugus hidroksil dapat berpartisipasi ke dalam ikatan hidrogen, sehingga membuatnya cair dan lebih sulit menguap dari pada senyawa organik lainnya dengan massa molekul yang sama. Etanol merupakan pelarut yang serbaguna, larut dalam air dan pelarut organik lainnya, meliputi asam asetat, aseton, benzena, karbon tetraklorida, kloroform, dietil eter, etilena glikol, gliserol, nitrometana, piridina, dan toluena. Ia juga larut dalam hidrokarbon alifatik yang ringan, seperti pentana dan heksana, dan juga larut dalam senyawa klorida alifatik seperti trikloroetana dan tetrakloroetilena. Pada ekstraksi bahan pangan tidak boleh ada residu etanol pada bahan pangan yang diekstraksi (Federal Food, Drug and Cosmetic Regulation). Dalam pemilihan jenis pelarut faktor yang perlu diperhatikan antara lain adalah daya melarutkan bahan (berdasarkan kepolaritasan), titik didih, sifat racun, mudah tidaknya terbakar dan pengaruh terhadap peralatan ekstraksi (Gamse, 2002).
dalam air, dan juga melarutkan komponen lain seperti karbohidrat, resin dan gum. Larutnya komponen ini mengakibatkan berkurangnya tingkat kemurniannya. Keuntungan menggunakan pelarut etanol dibandingkan dengan aseton yaitu etanol mempunyai kepolaran lebih tinggi sehingga mudah untuk melarutkan senyawa resin, lemak, minyak, asam lemak, karbohidrat, dan senyawa organik lainnya. penggolongan mutu etanol dibagi menjadi 4 golonganyaitu: (1) etanol industri, (2) spiritus, (3) etanol murni, dan (4) etanol absolute (Paturau, 1982).
Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang dengan DNA, protein, lipida, atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul. Perubahan ini akan menyebabkan proses penuaan. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni kanker, aterosklerosis, jantung koroner, katarak dan penyakit degeneratif lainnya (Silalahi, 2006). Radikal bebas dapat terbentuk dalam tubuh atau masuk melalui pernafasan, kondisi lingkungan yang tidak sehat dan makanan berlemak (Kumalaningsih, 2006).
hidup akan menimbulkan kerusakan di berbagai bagian sel (Muhilal, 1991; Auroma, 1994).
Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya dalam makhluk hidup antara lain adalah golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), peroksidal (RO-2), peroksinitrit (ONOO-),
asam hipoklorit (HOCl) dan hidrogen peroksida (H2O2) (Silalahi, 2006).
Antioksidan
Antioksidan adalah zat yang dalam kadar rendah mampu menghambat laju oksidasi molekul target atau senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutuskan reaksi berantai dari radikal bebas (Kumalaningsih, 2006). Antioksidan juga dapat didefenisikan sebagai senyawa yang dapat mencegah terjadinya reaksi oksidasi makromolekul, seperti lipid, protein, karbohidrat atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron (Silalahi, 2006). Antioksidan merupakan senyawa yang dapat menetralkan radikal bebas dengan cara mendonorkan satu atom protonnya sehingga membuat radikal bebas stabil dan tidak reaktif (Lusiana, 2010).
Berdasarkan sumbernya, secara umum antioksidan digolongkan dalam dua jenis, yaitu antioksidan sintetik dan antioksidan alami. Contoh antioksidan sintetik yang sering digunakan masyarakat antara lain butylated hydroxyanisole (BHA),
adalah aktivitas anti radikalnya yang sangat kuat, namun antioksidan sintetik BHA dan BHT berpotensi karsinogenik. Untuk itu pencarian sumber antioksidan alami sangat dibutuhkan untuk menggantikan peran antioksidan sintetik. Antioksidan alami adalah antioksidan yang merupakan hasil ekstraksi dari bahan alami. Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia (Silalahi, 2006).
Irianti (2008) juga menyatakan bahwa antioksidan alami sebenarnya sudah sejak dahulu digunakan secara turun temurun, namun belum banyak diteliti aktivitas dan kandungan bioaktifnya. Misalnya saja daun gaharu (A. malaccensis
Lamk.) yang sudah dimanfaatkan tetapi belum begitu populer karena kurangnya informasi tentang kandungan senyawa-senyawa kimia dan kandungan biokaktifnya.
Berdasarkan penelitian Mega dan Swastini (2010), ekstrak daun gaharu dari jenis Gyrinops versteegii mengandung senyawa metabolit sekunder flavonoid, terpenoid dan senyawa fenol. Hasil uji fitokimia daun gaharu (Gyrinops versteegii) dapat dilihat pada Tabel 1:
Tabel 1. Hasil Uji Fitokimia daun Gaharu (Gyrinops versteegii)
No Pereaksi Hasil Pengamatan Keterangan
Perubahan warna larutan setelah + pereaksi
1 Willstater Coklat muda menjadi kuning muda (+) Mengandung
Flavonoid
2 NaOH 10% Coklat muda menjadi kuning (+) Mengandung
Flavonoid
3 Meyer Tak terjadi perubahan/tak timbul endapan (-) Mengandung Alkaloid
4
Leiberman-Burchard Coklat muda menjadi merah muda
(+) Mengandung Terpenoid
5 + Air lalu
dikocok Tidak Timbul Buih yang stabil selama 5 menit (+) Mengandung Saponin
6 +FeCl3 Coklat muda menjadi coklat keunguan
Hasil uji fitokimia yang dilakukan Mega dan Swastini (2010), diketahui bahwa senyawa-senyawa metabolit sekunder tersebut yang diperkirakan mempunyai aktivitas sebagai antiradikal bebas.
Antioksidan Alami
Antioksidan alami adalah antioksidan yang merupakan hasil ekstraksi dari bahan alami. Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat bioaktif ini bekerja secara sinergistik, meliputi mekanisme enzim detoksifikasi, peningkatan sistem kekebalan, pengurangan agregasi platelet, pengaturan sintesis kolesterol dan metabolisme hormon, penurunan tekanan darah, antioksidan, antibakteri serta efek antivirus (Prabantini, 2010; Silalahi, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin dan tokoferol. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavanon dan kalkon. Senyawa antioksidan alami polifenolik dapat bereaksi sebagai pereduksi, penangkap radikal bebas, pengkelat logam dan peredam terbentuknya singlet oksigen (Kumalaningsih, 2006). Antioksidan atau reduktor berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron (Silalahi, 2006).
1. Kelompok tanaman sayuran
Brokoli, kubis, lobak, wortel, tomat, bayam, cabai, buncis, pare dan mentimun. 2. Kelompok tanaman buah
Anggur, alpukat, jeruk, semangka, markisa, apel, belimbing, pepaya dan kelapa.
3. Kelompok tanaman rempah
Jahe, temulawak, kunyit, lengkuas, temu putih, kencur, kapulaga, temu ireng, lada, cengkeh, pala dan asam jawa.
4. Kelompok tanaman lain
Teh, ubi jalar, kedelai, kentang, labu kuning dan petai cina.
Dari segi kimia, komponen yang dikandung oleh sumber-sumber antibiotik tersebut di atas adalah:
a. Sejenis polifenol
Polifenol merupakan senyawa turunan fenol yang mempunyai aktivitas sebagai antioksidan. Antioksidan fenolik biasanya digunakan untuk mencegah kerusakan akibat reaksi oksidasi pada makanan, kosmetik, farmasi, dan plastik. Fungsi polifenol sebagai penangkap dan pengikat radikal bebas dari rusaknya ion-ion logam. Senyawa polifenol banyak ditemukan pada buah, sayuran, kacang-kacangan, teh dan anggur (Hernani dan Rahardjo, 2002).
terlepas dari gugus gulanya. Di samping itu senyawa ini mempunyai sifat antibakteri dan antiviral (Hernani dan Rahardjo, 2002).
c. Vitamin C
Vitamin C mempunyai efek multifungsi, tergantung pada kondisinya. Vitamin C ini dapat berfungsi sebagai antioksidan, proantioksidan, pengikat logam, pereduksi dan penangkap oksigen. Vitamin C sangat efektif sebagai antioksidan pada konsentrasi tinggi. Tubuh sangat memerlukan vitamin C, karena kekurangan vitamin C dalam darah dapat menyebabkan beberapa penyakit seperti: asma, kanker, diabetes, dan penyakit hati. Selain daripada itu vitamin C dapat
memperkecil terbentuknya penyakit katarak dan penyakit mata (Hernani dan Rahardjo, 2002).
d. Vitamin E
Vitamin E merupakan antioksidan yang cukup kuat dan memproteksi sel-sel membran serta LDL (Low Density Lipoprotein) kolesterol dari kerusakan radikal bebas. Vitamin E dapat juga membantu memperlambat proses penuaan pada arteri dan melindungi tubuh dari kerusakan sel-sel yang akan menyebabkan penyakit kanker, penyakit hati dan katarak. Vitamin E dapat bekerja sama dengan antioksidan lain seperti vitamin C untuk mencegah penyakit-penyakit kronik lainnya, namun dalam mengkonsumsi vitamin ini dianjurkan jangan terlalu berlebihan karena akan menekan vitamin A yang masuk ke dalam tubuh (Hernani dan Rahardjo, 2002).
e. Karotenoid
Kekurangan beta-karotein dapat menyebabkan tubuh terserang kanker servik. Kanker ini banyak menyerang kaum wanita yang mempunyai kadar beta-karotein, vitamin E dan vitamin C rendah dalam darah. Untuk kaum laki-laki vitamin E sangat efektif mencegah penyakit kanker prostat. Golongan senyawa karotenoid antara lain: alfa-karotein, lutin dan likopen (Hernani dan Rahardjo, 2002).
f. Katekin
Katekin termasuk dalam senyawa golongan polifenol dari gugusan flavanoid yang banyak terdapat pada teh hijau. Dalam ekstrak teh terkandung 30-40% katekin. Epigallokatekin merupakan katekin yang sangat penting dari teh hijau karena mempunyai daya antioksidan yang cukup tinggi, serta berperan dalam pencegahan penyakit jantung dan kanker. Dalam daun kering, teh hijau terdapat sekitar 30-50 mg flavanoid (Hernani dan Rahardjo, 2002).
Menurut keterangan di atas maka dapat dinyatakan bahwa kelompok antioksidan dari bioflavanoid (flavon, flavonol, flavanon, katekin, antosianidan, isoflavon) merupakan senyawa dengan aktivitas antioksidan yang cukup tinggi. Senyawa flavanoid diduga dimiliki daun gaharu (A. malaccensis Lamk.) sehingga dapat dimanfaatkan sebagai obat karena diduga memiliki antioksidan yang berperan dalam menekan radikal bebas dalam tubuh manusia.
Pengujian Aktivitas Antioksidan
Goldschmidt dan Renn pada tahun 1922 menemukan senyawa berwarna ungu radikal bebas stabil DPPH, yang sekarang digunakan sebagai reagen kolorimetri untuk proses redoks. Metode DPPH merupakan suatu metode yang cepat, sederhana, dan murah yang dapat digunakan untuk mengukur kemampuan antioksidan yang terkandung dalam makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan juga dalam bentuk larutan dan berlaku untuk keseluruhan kapasitas antioksidan sampel (Ionita, 2005).
DPPH merupakan singkatan untuk senyawa kimia 1,1- diphenyl-2-picrylhydrazil. DPPH berupa serbuk berwarna ungu gelap yang terdiri dari molekul radikal bebas yang stabil. DPPH mempunyai berat molekul 394.32 dengan rumus bangun C18H12N5O6. Penyimpanannya dalam wadah tertutup baik
pada suhu -20°C (Molyneux, 2004). Prinsipnya adalah elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang tertentu, berwarna ungu. Warna akan berubah dari ungu menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa antioksidan. Perubahan warna ini berdasarkan reaksi kesetimbangan kimia (Prakash, 2001).
atom hidrogen yang ditangkap oleh molekul DPPH akibat adanya zat reduktor (Molyneux, 2004).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah harga Inhibition Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang
dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan % penghambatan sebesar 50%. Zat yang mempunyai sifat antioksidan bila nilai IC50 kurang dari 200 ppm. Bila nilai IC50
yang diperoleh berkisar antara 200-1000 ppm, maka zat tersebut kurang aktif namun masih berpotensi sebagai zat antioksidan. Dikatakan mempunyai aktivitas antioksidan tinggi, akan mempunyai harga IC50 yang rendah (Molyneux, 2004).
Pengukuran Absorbansi – Panjang Gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran
sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang maksimum untuk DPPH antara lain 515 nm, 516 nm, 517 nm, 518 nm, 519 nm dan 520 nm. Pada praktiknya hasil pengukuran yang memberikan peak
METODE PENELITIAN
Waktu dan Tempat Penelitian
Pelaksanaan penelitian ini dilaksanakan mulai bulan Juni hingga Agustus 2013. Tempat pengambilan sampel dilakukan di pertanaman pohon gaharu milik bapak Petro Sembiring di Kecamatan Medan Tuntungan, Kota Medan, Provinsi Sumatera Utara. Uji fitokimia, ekstraksi dan pengamatan aktivitas antioksidan dilakukan di Laboratorium Farmakognosi dan Laboratorium Penelitian, Fakultas Farmasi Universitas Sumatera Utara.
Bahan dan Alat Penelitian
Bahan yang digunakan pada penelitian ini adalah daun gaharu (A. malaccensis Lamk.) yang segar dan kering. Bahan kimia yang digunakan
adalah bahan-bahan kimia lainnya yang berkualitas pro analisis adalah DPPH (Sigma), produksi E-Merck: metanol, toluen, kloroform, isoprospanol, benzen, n -heksana, asam nitrat pekat, asam klorida pekat, asam sulfat pekat, raksa (II) klorida, bismut (III) nitrat, besi (III) klorida, timbal (II) asetat, kalium iodida, kloralhidrat, asam asetat anhidrida, natrium hidroksida, amil alkohol, natrium sulfat anhidrat, serbuk magnesium. Bahan kimia berkualitas teknis adalah etanol 96% dan air suling.
Alat-alat yang digunakan pada penelitian ini meliputi alat-alat gelas laboratorium (erlenmeyer, gelas beaker, gelas corong, gelas ukur, labu alas bulat, labu tentukur, tabung reaksi), aluminium foil, blender (National), lemari pengering, oven listrik, neraca kasar (O’haus), neraca digital (Vibra), desikator,
rotary evaporator (Heidolph VV-300), freeze dryer (Edwards), spektofotometer UV/Vis (Shimadzu UV-1800) dan kamera digital.
Prosedur Penelitian
Pengambilan Sampel Tanaman
Pengambilan sampel dilakukan secara purposif tanpa membandingkan dengan tanaman yang sama dari daerah yang lain. Sampel yang digunakan dalam penelitian ini adalah daun gaharu (A. malaccensis Lamk.) yang diambil dari pertanaman pohon gaharu milik bapak Petro Sembiring di Kecamatan Medan Tuntungan, Kota Medan, Provinsi Sumatera Utara.
Determinasi Tanaman
Identifikasi tanaman gaharu dilakukan di Herbarium Medanense, Laboratorium Taksonomi Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Persiapan Bahan Baku
Pembuatan Pereaksi 1. Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
2. Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3. Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM, 1995).
4. Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Ditjen POM, 1979).
5. Pereaksi Asam Klorida 2 N
6. Pereaksi Natrium Hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Ditjen POM, 1979).
7. Pereaksi Asam Sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Ditjen POM, 1995).
8. Pereaksi Timbal (II) Asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
9. Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
10. Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampur dengan 1 bagian asam sulfat pekat. Larutan pereaksi ini harus dibuat baru (Harborne, 1984).
11. Larutan DPPH 0,5 mM
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol
hingga diperoleh volume larutan 100 ml (konsentrasi 200 ppm) (Molyneux, 2004).
Penetapan Kadar Air
Cara kerja : Ke dalam labu alas bulat dimasukkan 100 ml toluen dan 1 ml air suling, didestilasi selama 2 jam, toluen didinginkan selama 30 menit dan volume air didalam tabung penerima dibaca, kemudian ke dalam labu dimasukkan 2,5 g sampel yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian bagian dalam pendingin dibilas dengan toluen, destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, dibaca volume air dengan ketelitian 0,05 ml. Kadar air dihitung dalam persen (WHO, 1998).
Skrining Fitokimia
Skirining fitokimia meliputi pemeriksaan senyawa golongan alkaloida, glikosida, steroid/triterpenoid, flavonoid, tannin dan saponin.
1. Pemeriksaan Alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring, filtrat dipakai untuk uji alkaloida. Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat.
a. Pada tabung I, ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning.
c. Pada tabung III, ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga dari percobaan di atas (Ditjen POM, 1995).
2. Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia ditimbang, disari dengan 30 ml campuran dari tujuh bagian etanol 95% dengan tiga bagian air suling (7:3) dan 10 ml asam klorida 2N. Kemudiaan direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan kemudiaan diuapkan pada temperatur tidak lebih dari 500C, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut, 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes larutan perekasi Molish, lalu ditambahkan dengan perlahan-lahan 2 ml asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Ditjen POM, 1995).
3. Pemeriksaan Steroid/Triterpenoid
menunjukkan adanya steroida, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
4. Pemeriksaan Flavonoid
Sebanyak 10 g serbuk simplisia ditimbang, dilarutkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1996). 5. Pemeriksaaan Tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Ditjen POM, 1995).
6. Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan ke dalam tabung reaksi, ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2N buih tidak hilang (Ditjen POM, 1995).
Pembuatan Ekstrak Etanol Daun Gaharu (A. malaccensis Lamk.)
dengan 1500 ml etanol 96%, ditutup, dibiarkan selama 5 hari terlindung dari cahaya dan sesekali diaduk. Setelah 5 hari campuran tersebut diserkai (saring). Ampas dicuci dengan etanol 96% secukupnya hingga diperoleh 2000 ml, lalu dipindahkan dalam bejana tertutup dan dibiarkan di tempat sejuk terlindung dari cahaya selama 2 hari, kemudian dienaptuangkan lalu disaring. Maserat dipekatkan menggunakan alat rotary evaporator pada suhu 40°C sampai diperoleh maserat pekat kemudian dikeringkan menggunakan freeze dryer sehingga diperoleh ekstrak kering (Ditjen POM, 1979).
Pengujian Kemampuan Antioksidan dengan Spektrofotometer UV- visible
1. Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas DPPH dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang memerangkap
radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan sampel uji tersebut.
2. Pembuatan Larutan Blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis tanda (konsentrasi 40 ppm).
3. Penentuan panjang gelombang serapan maksimum
4. Pembuatan Larutan Induk
Sebanyak 25 mg ekstrak daun gaharu (A. Malaccensis Lamk.) ditimbang kemudian dilarutkan dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 ppm).
5. Pembuatan Larutan Uji
Larutan induk dipipet sebanyak 1 ml; 1,5 ml; 2 ml; 2,5 ml kemudian masing-masing dimasukkan ke dalam labu tentukur 25 ml (untuk mendapatkan konsentrasi 40 ppm, 60 ppm, 80 ppm, 100 ppm), kemudian dalam masing-masing labu tentukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volume dicukupkan dengan metanol sampai garis tanda, didiamkan di tempat gelap, lalu diukur serapannya dengan spektrofotometer sinar tampak pada panjang gelombang 516 nm, pada waktu selang 5 menit mulai dari 0 menit hingga 30 menit.
Penentuan Persen Peredaman
Penentuan persen pemerangkapan radikal bebas oleh sampel uji ekstrak etanol daun gaharu (A. Malaccensis Lamk.), menggunakan metode pemerangkapan radikal bebas 1,1-diphenyl-2-picrylhydrazil (DPPH), yaitu dihitung dengan menggunakan rumus:
Keterangan: Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi sampel
Penentuan Nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji (μg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu meredam
proses oksidasi DPPH sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi ekstrak (ppm) sebagai absis (sumbu X) dan nilai % peredaman (antioksidan) sebagai ordinatnya (sumbu Y).
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 ppm, kuat untuk IC50 bernilai 50-100 ppm, sedang
jika IC50 bernilai 100-150 ppm, dan lemah jika IC50 bernilai 151-200 ppm
HASIL DAN PEMBAHASAN
Determinasi Tumbuhan
Determinasi tumbuhan yang dilakukan di Herbarium Medanense, Laboratorium Taksonomi Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan menunjukkan bahwa sampel daun gaharu termasuk suku Thymeleaceae dan jenis
Aquilaria malaccensis Lamk..
Ekstrak Etanol Daun Gaharu secara Maserasi
Pembuatan ekstrak etanol daun gaharu diperoleh dengan proses ekstraksi. Ekstraksi merupakan suatu proses penarikan komponen yang diinginkan dari suatu bahan. Cara ekstraksi yang paling sederhana yaitu maserasi, karena bahan yang akan diekstrak cukup dilarutkan di dalam pelarut pada perbandingan tertentu dan menggunakan alat-alat sederhana. Maserasi yang dilakukan memiliki waktu yang berbeda-beda tergantung pada sifat bahan dan pelarut. Perbandingan pelarut yang digunakan pada penelitian ini yaitu 1 : 3, sedangkan lama maserasi adalah lima hari dengan perendaman ulang terhadap residu selama dua hari.
organik yang lain. Pelarut yang digunakan juga tidak mempengaruhi hasil warna dari ekstrak, dapat dikatakan bahwa pelarut yang digunakan menguap sempurna pada saat dilakukan proses rotary. Hasil ekstraksi daun gaharu segar sebanyak 200 g menghasilkan ekstrak kental sebanyak 13,09 g dengan rendemen yang dihasilkan adalah 6,55 %. Ekstraksi daun gaharu yang sudah dikeringkan (simplisia) sebanyak 200 g menghasilkan ekstrak kental 38,19 g dengan rendemen yang dihasilkan sebesar 19,08 %. Ekstrak yang dihasilkan memiliki warna coklat pekat berupa ekstrak kasar berbentuk pasta. Hasil ekstrak etanol daun gaharu dapat dilihat pada Gambar 1.
(a) daun gaharu segar (b) simplisia daun gaharu Gambar 1. Ekstrak Etanol Daun Gaharu (A. malaccensis Lamk.)
Penetapan Kadar Air Simplisia
Kandungan air yang tinggi dapat menyebabkan ketidakstabilan pada simplisia maupun ekstrak, bakteri dan jamur akan cepat tumbuh dan bahan aktif yang terkandung di dalamnya dapat terurai. Kadar air yang melebihi persyaratan dapat menjadi media yang baik untuk pertumbuhan mikroorganisme seperti jamur. Batas kadar air minimal yang dikandung simplisia akan berpengaruh terhadap lama penyimpanan sebelum simplisia tersebut digunakan.
Hasil Skrining Fitokimia
Skrining fitokimia bertujuan untuk mengetahui senyawa-senyawa aktif biologis yang terdapat dalam tumbuhan. Skrining fitokimia terhadap serbuk simplisia, ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang dikandung. Hasil skrining fitokimia terhadap serbuk simplisia, ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia dapat dilihat pada Tabel 2.
Tabel 2. Hasil Skrining Fitokimia Simplisia, Ekstrak Etanol Daun Gaharu Segar dan Ekstrak Etanol Gaharu Simplisia
No. Pemeriksaan Simplisia Ekstrak Etanol Ekstrak Etanol daun gaharu daun gaharu Simplisia
1. Alkaloid - - -
Keterangan: ( + ) positif : mengandung golongan senyawa ( - ) negatif : tidak mengandung golongan senyawa
kandungan golongan senyawa kimia. Pada penelitian ini, sampel dalam bentuk serbuk yang diuji memiliki kandungan golongan senyawa kimia yang sama dan tidak kehilangan senyawa kimia walaupun sudah menjadi ekstrak. Kesamaan kandungan golongan senyawa kimia tersebut diakibatkan karena sampel yang diuji adalah jenis yang sama yaitu Aquilaria malaccensis, akan tetapi pengujian dalam bentuk yang berbeda yaitu simplisia dan ekstrak etanol.
Senyawa flavonoid dimiliki daun gaharu ditandai dengan adanya warna merah atau kuning pada lapisan amil alkohol setelah menambahkan serbuk Mg dan serbuk Zn dengan asam klorida pekat (Farnsworth, 1996). Pada pengujian alkaloid, menunjukkan hasil yang negatif pada semua pereaksi. Pada uji Mayer tidak terbentuk endapan putih. Begitu juga dengan penambahan pereaksi Bouchardat dan Dragendorf tidak terbentuk endapan, hanya menghasilkan larutan jernih pada penambahan pereaksi Mayer, warna kuning pada penambahan pereaksi Bouchardat dan warna coklat pada pereaksi Dragendorf. Pengujian glikosida positif, ditunjukkan dengan penambahan pereaksi Molisch dan asam sulfat pekat, kemudian membentuk cincin ungu. Skrining saponin menghasilkan busa yang tidak stabil dengan tinggi busa 1 cm, setelah dilakukan penambahan HCl 2 N, busa yang ada hilang. Dalam penelitian ini skrining saponin memberikan hasil yang negatif. Larutan yang ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1% menghasilkan warna biru atau kehitaman dan menunjukkan adanya tanin (Ditjen POM, 1995).
steroida/triterpenoida (Harborne, 1987). Daun gaharu (A. malaccensis Lamk.) memiliki potensi sebagai antioksidan, mengandung golongan senyawa-senyawa yang mempunyai potensi sebagai antioksidan umumnya merupakan senyawa flavonoida (Kumalaningsih, 2006). Senyawa flavonoid tersebut bertindak sebagai penangkap radikal bebas karena gugus hidroksil yang dikandungnya mendonorkan hidrogen kepada radikal bebas. Senyawa tersebut mampu menetralisir radikal bebas dengan memberikan elektron kepadanya sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi, 2006).
Hasil skrining fitokimia yang telah diperoleh dapat memberi informasi
penting tentang senyawa kimia yang dikandung oleh daun gaharu (A. malaccensis Lamk.). Setelah mengetahui senyawa-senyawa kimia yang
terkandung, maka akan mempermudah dalam penentuan pemakaian terutama dalam bidang pengobatan. Hal ini sesuai dengan pernyataan Farnsworth (1996), yang menyatakan bahwa teknik skrining dapat membantu langkah-langkah fitofarmakologi yaitu seleksi awal dari pemeriksaan tumbuhan tersebut untuk membuktikan adanya senyawa kimia tertentu dalam tumbuhan tersebut yang dapat dikaitkan dengan aktivitas biologinya dalam bidang pengobatan maupun farmasi.
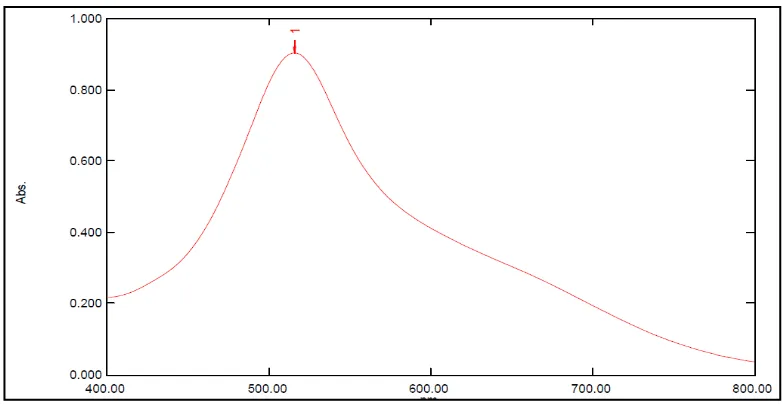
Hasil Penentuan Panjang Gelombang Serapan Maksimum (λmaks)
40 ppm dalam metanol dilakukan dengan menggunakan spektrofotometer UV-Visibel. Hasil pengukuran serapan maksimum dapat dilihat pada Gambar 2.
Gambar 2. Kurva serapan maksimum larutan DPPH 40 ppm dalam metanol secara spektrofotometri visibel.
.Hasil pengukuran yang dilakukan menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan maksimum pada panjang gelombang 516 nm. Panjang gelombang maksimum (λmaks) yang dipergunakan adalah
pengukuran yang memberi serapan maksimum (Molyneux, 2003). Karena pada panjang gelombang tersebut perubahan serapan untuk setiap satuan konsentrasi adalah paling besar.
Hasil Uji Aktivitas Antioksidan
80 ppm dan 100 ppm yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Dapat dilihat kurva hubungan antara absorbansi DPPH terhadap penambahan konsentrasi larutan uji dalam menganalisis aktivitas antioksidan pada Gambar 3 dan 4.
Gambar 3. Hasil uji aktivitas antioksidan ekstrak etanol daun gaharu segar
0.0
Gambar 4.Hasil uji aktivitas antioksidan ekstrak etanol simplisia
Hasil analisis aktivitas antioksidan ekstrak etanol daun gaharu segar dan dan ekstrak etanol simplisia dapat dilihat adanya penurunan nilai absorbansi DPPH yang diberi larutan uji dibandingkan terhadap kontrol pada setiap kenaikan
konsentrasi. Penurunan absorbansi yang semakin besar menunjukkan aktivitas antioksidan yang semakin besar pula. Ekstrak etanol simplisia memiliki penurunan absorbansi yang besar dan ekstrak etanol daun gaharu segar pada konsentrasi larutan 40 ppm, tidak memiliki perbedaan yang cukup jauh. Kondisi kedua ekstrak tersebut masih menunjukkan penurunan absorbansi yang hampir sama. Penurunan nilai absorbansi di atas menunjukkan bahwa terjadi penangkapan/peredaman radikal bebas DPPH oleh larutan uji sehingga menunjukkan adanya aktivitas antioksidan dari sampel. Pemilihan metode DPPH pada penelitian ini berdasarkan pernyataan Prakash (2001) yang menyatakan bahwa metode DPPH mudah digunakan, cepat, cukup teliti dan baik digunakan dalam pelarut organik, khususnya alkohol.
Mekanisme reaksi DPPH ini berlangsung melalui transfer elektron. Larutan DPPH akan mengoksidasi senyawa dalam ekstrak etanol daun gaharu. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen kepada DPPH, akan menetralkan radikal bebas DPPH. Semua elektron pada radikal bebas DPPH menjadi berpasangan, akan ditandai dengan warna larutan yang berubah dari ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang maksimumnya akan hilang (Molyneux, 2004).
Hasil Peredaman Radikal Bebas DPPH Oleh Sampel Uji
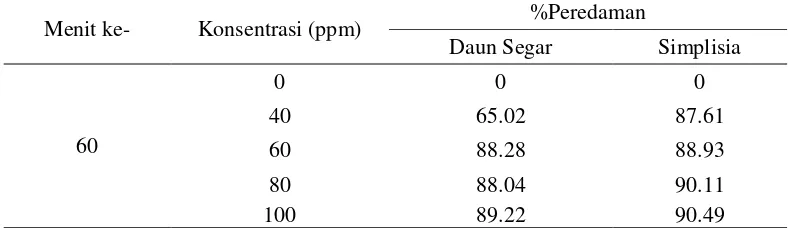
adanya penambahan larutan uji. Nilai serapan larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut dihitung sebagai persen peredaman. Hasil analisis yang telah dilakukan, diperoleh nilai persen peredaman pada setiap kenaikan konsentrasi sampel uji, dapat dilihat pada Tabel 3.
Tabel 3. Hasil Analisis Peredaman Radikal Bebas oleh Ekstrak Etanol Daun Gaharu Segar dan Ekstrak Etanol Simplisia
Menit ke- Konsentrasi (ppm) %Peredaman
Daun Segar Simplisia
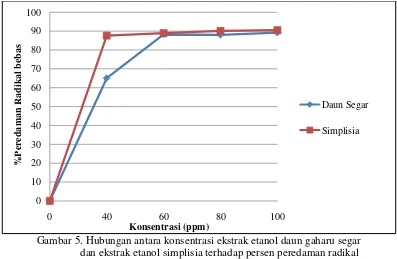
Pada Tabel 3 menunjukkan bahwa semakin meningkat konsentrasi sampel uji, maka akan semakin meningkat nilai aktivitas peredamannya. Semakin banyak DPPH yang berpasangan dengan atom hidrogen dari ekstrak yang diuji sehingga serapan DPPH menurun. Aktivitas peredaman radikal bebas DPPH (1,1-
Gambar 5. Hubungan antara konsentrasi ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia terhadap persen peredaman radikal bebas DPPH.
Nilai IC50 (Inhibitory Concentration) Sampel Uji
Penetuan potensi aktivitas peredaman radikal bebas DPPH ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia dinyatakan dengan parameter IC50
yaitu konsentrasi konsentrasi senyawa uji yang menyebabkan peredaman radikal bebas sebesar 50%. Nilai IC50 diperoleh berdasarkan perhitungan persamaan
regresi linier yang didapatkan dengan cara memplot konsentrasi larutan uji dan persen peredaman DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi larutan uji (ppm) sebagai absis (sumbu X) dan nilai persen peredaman sebagai ordinat (sumbu Y). Kategori penentuan kekuatan aktivitas antioksidan dapat dilihat pada Tabel 4.
Tabel 4. Kategori Kekuatan Aktivitas Antioksidan
No. Kategori Konsentrasi (µg/ml)
1 Sangat kuat <50
2 Kuat 50-100
3 Sedang 101-150
4 Lemah 151-200
Dikutip dari Mardawati et al., 2008.
Kemampuan sampel uji dalam memerangkap 1,1-diphenyl-2 -picrylhidrazyl (DPPH) sebagai radikal bebas dalam larutan metanol dengan nilai IC50 (konsentrasi sampel uji yang mampu memerangkap radikal bebas
sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji tersebut (Prakash, 2001). Hasil persamaan regresi linier (Y= AX + B) diperoleh setelah menghitung nilai persen peredaman untuk ekstrak etanol daun gaharu dan ekstrak etanol simplisia dapat dilihat pada Tabel 5.
Tabel 5. Hasil Persamaan Regresi Linier ekstrak etanol daun gaharu dan ekstrak etanol simplisia
Larutan Uji Persamaan regresi
Ekstrak etanol daun segar Y = 0,9039 X + 15,4936
Ekstrak etanol simplisia Y = 0,8612 X + 23,2008
Nilai IC50 didapatkan dari nilai X setelah mengganti Y = 50 pada
persamaan regresinya. Nilai IC50 dihitung berdasarkan persentase inhibisi
terhadap radikal bebas DPPH dari masing-masing konsentrasi larutan sampel. Hasil analisis nilai IC50 dapat diperoleh berdasarkan perhitungan persamaan
regresi pada Tabel 5 dan hasilnya dapat dilihat pada Tabel 6.
Tabel 6. Nilai IC50 Ekstrak Etanol Daun Gaharu Segar dan Ekstrak Etanol Simplisia
Sampel IC50 (ppm)
Ekstrak Etanol Daun Segar 38.16
Pada Tabel 6 menunjukkan bahwa ekstrak etanol daun gaharu segar memiliki nilai IC50 sebesar 38,16 ppm dan diikuti ekstrak etanol simplisia sebesar
31,12 ppm. Hal ini dapat terjadi karena pada ekstrak tersebut diperkirakan mengandung senyawa aktif sebagai antioksidan. Aktivitas yang paling tinggi diperoleh pada ekstrak etanol simplisia dan diikuti ekstrak etanol daun gaharu segar. Ditinjau dari kategori kekuatan aktivitas antioksidan, ekstrak etanol daun gaharu segar maupun simplisia termasuk dalam kategori sangat kuat dengan nilai lebih kecil dari 50 ppm.
Dapat disimpulkan bahwa nilai IC50 berbanding terbalik dengan dengan
potensi peredaman radikal bebas. Semakin besar nilai IC50 yang diperoleh maka
KESIMPULAN DAN SARAN
Kesimpulan
1. Hasil uji skrining fitokimia pada serbuk simplisia, ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia diperoleh adanya senyawa flavonoid, glikosida, tanin dan steroid/triterpenoid yang merupakan senyawa aktif antioksidan.
2. Hasil pemeriksaan aktivitas antioksidan dengan menggunakan spektrofotometer sinar tampak pada panjang gelombang 516 nm pada menit ke-60 diperoleh hasil ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia memiliki IC50 sebesar 38,16 ppm dan 31,12 ppm. Hasil pengujian ini
diketahui ekstrak etanol daun gaharu segar dan ekstrak etanol simplisia memiliki aktivitas antioksidan yang sangat kuat.
Saran
DAFTAR PUSTAKA
Andayani, R., Y. Lisawati dan Maimunah. 2008. Penentuan Aktivitas Antioksidan, Kadar Fenolat Total dan Likopen Pada Buah Tomat (Solanum lycopersicum L). Jurnal Sains dan Teknologi Farmasi 13(1). Aruoma, O.I. 1994. Free radicals and antioxidant strategies in sports. J Nutr
Biochem 5: 370-381.
Dalimartha, S. 2000. Atlas Tumbuhan Obat Indonesia. Jilid I. Cetakan Pertama. Trubus Agriwidya. Jakarta. Hal. 6-8.
Ditjen POM. 1978. Materia Medika Indonesia. Jilid II, Jakarta: Departemen Kesehatan RI. Hal. 150-156.
Ditjen POM. 1979. Farmakope Indonesia. Edisi Ketiga. Departemen Kesehatan RI. Jakarta. Hal. 29-31.
Ditjen POM. 1995. Materia Medika Indonesia, Jilid VI. Departemen Kesehatan RI. Jakarta. Hal. 321-326, 333-337.
Ditjen POM. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Departemen Kesehatan RI. Jakarta. Hal. 9-11.
Farnsworth, N.R. 1966. Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences 55(3):263.
Gamse, T., (2002), Liquid-Liquid Extraction and Solid-Liquid Extraction, Institute of Thermal Process and Environmental Engineering. Graz University of Technology. Hal. 2-24.
Harborne, J.B. 1984. Metode Fitokimia Penuntun Cara Modern Menganalisa Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Terbitan Kedua. Penerbit ITB. Bandung. Hal. 35-37, 147-148.
Harbone, J.B. 1987. Metode Fitokimia. Terjemahan dari Phytochemical Methods
oleh Kosasih Padmawinata dan Iwang Soediro. Penerbit ITB. Bandung. Hal 47-245.
Hernani dan Rahardjo, M. 2006. Tanaman Berkhasiat Antioksidan: Berbagai Jenis Tanaman Penangkal Racun. Penebar Swadaya. Jakarta.
Ionita, P. 2005. Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active Species?. Bucharest. Chemical Paper. 59(1):11-16.
Kosasih, E.N., T. Setiabudhi, dan H. Heryanto. 2004. Peranan Antioksidan pada Lanjut Usia. Jakarta: Pusat Kajian Nasional Masalah Lanjut Usia. Hal. 48-49, 56-59.
Kumalaningsih, S. 2006. Antioksidan Alami, Penangkal Radikal Bebas: Sumber, manfaat, cara penyediaan dan pengolahan. Trubus Agrisana. Surabaya. Hal. 4-5, 24, 43.
Lusiana. 2010. Kemampuan Antioksidan Asal Tanaman Obat dalam Modulasi Apoptosis sel khamir (saccharomyces cerevisiae). Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor.
Mardawati, E., F. Filianty dan H. Harta. 2008. Kajian Aktivitas Antioksidan Ekstrak Kulit Manggis (Garcinia mangostana L) dalam Rangka Pemanfaatan Limbah Kulit Manggis di Kecamatan Puspahiang Kabupaten Tasikmalaya. Hal. 4.
Mega, IM dan Swastini, DA. 2010. Skrining fitokimia dan aktivitas antiradikal bebas ekstrak metanol daun gaharu (Gyrinops versteegii). Jurnal Kimia 4(2): 187-192.
Molyneux, P. 2004. The Use of the Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci. Technol 26(2): 214-215.
Muhilal. 1991. Teori radikal bebas dalam gizi dan kedokteran Cermin Dunia Kedokteran. 73: 9-11.
Nasution, R.E. 1992. Prosiding Seminar dan Loka Karya Nasional Etnobotani. Departement Pendidikan dan Kebudayaan RI-LIPI. Perpustakaan Nasional RI. Jakarta.
Prakash, A. 2001. Antioxidant Activity. Analytical Progress. 19(2): 1-4.
Paturau, J.M. 1982. By Product of Cane Sugar Industry. Elsevier Scientific Publishing Co. Amsterdam Windholz.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tingkat Tinggi. Penerbit ITB Bandung. Bandung. Hal. 152-154.
Rusdi. 1998. Tumbuhan sebagai Sumber Bahan Obat. Pusat Penelitian Universitas Andalas. Padang. Hal. 6-7.
Silalahi, J. 2006. Makanan Fungsional. Penerbit Kanisius. Yogyakarta. Hal 40, 47-48.
Sumarna, Y. 2007. Budidaya dan Reka-yasa Produksi Gaharu. Temu Pakar Pengembangan Gaharu. Direktorat Jenderal RLPS, Jakarta.
Sumarna, Y. 2009. Gaharu; Budidaya dan Rekayasa Produksi. Penebar Swadaya, Jakarta.
Tarigan, K. 2004. Profil Pengusahaan (Budidaya) Gaharu. Pusat Bina Penyuluhan Kehutanan. Departemen Kehutanan. Jakarta.
Trilaksani, W. 2003. Antioksidan: jenis, sumber, mekanisme kerja dan peran terhadap kesehatan. Makalah. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Tyler, V. E., L. R Brady and J. E Robbers. 1976. Pharmacognosy. Seventh Edition. Philadelphia: Lea and Febiger. Hal. 76-77.
World Health Organization. 1998. Quality Control Methods For Medicinal Plant Materials. Geneva: WHO. Halaman 26-27.