IMPREGNASI KARBON AKTIF DENGAN SULFIDA UNTUK
MENGIKAT ION TEMBAGA (II) DAN KADMIUM (II)
DI DALAM AIR
T E S I S
Oleh
ALBERT NAPITUPULU
077006002/KM
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
2009
S
E
K O L A
H
P A
S C
A S A R JA N
IMPREGNASI KARBON AKTIF DENGAN SULFIDA UNTUK
MENGIKAT ION TEMBAGA (II) DAN KADMIUM (II)
DI DALAM AIR
T E S I S
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Magister Sains dalam Program Studi Kimia pada Sekolah Pascasarjana
Universitas Sumatera Utara
Oleh
ALBERT NAPITUPULU
077006002/KM
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Judul Tesis : IMPREGNASI KARBON AKTIF DENGAN NATRIUM SULFIDA UNTUK MENGIKAT ION TEMBAGA ( II ) DAN KADMIUM ( II ) DI DALAM AIR
Nama Mahasiswa : Albert Napitupulu
Nomor Pokok : 077006002
Program Studi : Kimia
Menyetujui Komisi Pembimbing
(Prof. Dr. Harlem Marpaung) Ketua
(Jamahir Gultom, Ph.D) Anggota
Ketua Program Studi, Direktur,
(Prof. Basuki Wirjosentono, MS, Ph.D) (Prof. Dr. Ir. T. Chairun Nisa. B, MSc)
Telah diuji pada
Tanggal 27 Agustus 2009
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Harlem Marpaung
Anggota : 1. Jamahir Gultom, Ph.D
2. Prof. Basuki Wirjosentono, M.S, Ph.D
3. Prof. Dr. Harry Agusnar, M.Sc, M.Phil
PERNYATAAN
IMPREGNASI KARBON AKTIF DENGAN SULFIDA UNTUK
MENGIKAT ION TEMBAGA (II) DAN KADMIUM (II)
DI DALAM AIR
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang pengetahuan juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Medan, Agustus 2009
ABSTRAK
Telah dilakukan penelitian impregnasi karbon aktif dengan Na2S dan digunakan sebagai adsorben terhadap larutan Cu2+dan Cd2+.
Impregnasi Karbon aktif dilakukan dengan larutan Na2S 0,5%, 1,0%, dan 1,5%, dengan waktu impregnasi 4, 8, dan 12 jam, kemudian diteruskan dengan penentuan daya serap karbon aktif terhadap ion Cu2+dan Cd2+ dengan variasi waktu kontak 15, 30, 45 dan 60 menit dan dibandingkan dengan tanpa impregnasi.
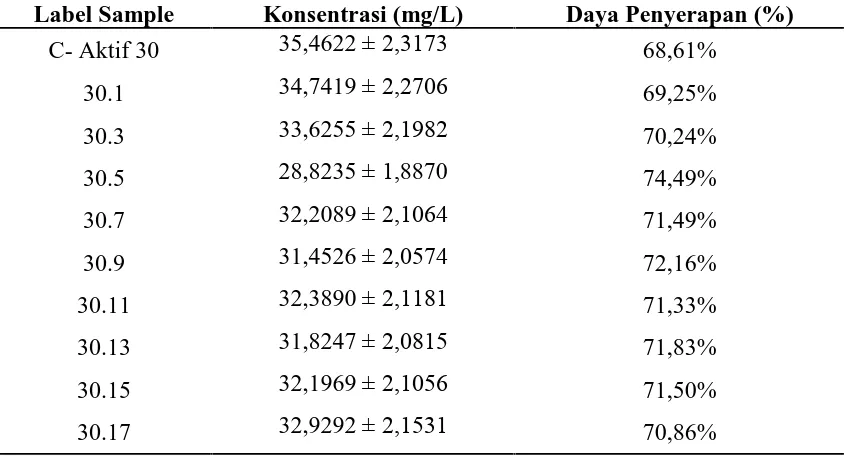
Hasil penelitian menunjukkan bahwa daya serap karbon aktif yang telah diimpregnasi lebih tinggi dibandingkan dengan karbon aktif tanpa impregnasi. Daya serap maksimum pada ion Cu2+ adalah 86,21 % dengan menggunakan karbon aktif yang diimpregnasi selama 12 jam dengan 1 % Na2S dengan waktu kontak 45 menit. Sedangkan menggunakan karbon aktif tanpa impregnasi daya serap optimum adalah 64,19% pada waktu kontak 45 menit. Daya serap maksimum pada ion Cd2+ adalah 74,49% dengan menggunakan karbon aktif yang diimpregnasi selama 4 jam dengan 1,5% Na2S pada waktu kontak 30 menit sedangkan dengan menggunakan karbon aktif tanpa impregnasi adalah 68,61% pada waktu kontak 30 menit.
ABSTRACT
The impregnation of carbon with sodium sulfide which used as an adsorbent for cupric ion and cadmium ion was carried out.
The solution of natrium sulfide of 0.5%, 1.0% and 1.5% respectively has been used to impregnate, with impregnation time 4, 8, and 12 hours and the determination of the absorption capacity of the active carbon to ion Cu2+ and Cd2+ with variations contact time 15, 30, 45 and 60 minutes respectively.
The result of research indicated that the absorption capacity of impregnated carbon was higher compared with the active carbon without impregnation. Maximum absorption of the ions Cu2+ was of 86.21% with 12 hours impregnation and 1% Na2S at the contact time of 45 minutes, while contacts with the active carbon without impregnation is 64.19% obtained in 45 minutes contact time. Whereas the maximum absorption of ions Cd2+ was 74.49% with 4 hours impregnation and 1.5% Na2S on the contact time of 30 minutes and using active carbon without impregnation is 68.61% in the contact time of 30 minutes.
UCAPAN TERIMA KASIH
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa sehingga
penyusunan tesis ini dapat diselesaikan.
Adapun maksud dari penyusunan tesis ini adalah untuk menyelesaikan tugas
akhir dalam Program Studi Kimia, Sekolah Pascasarjana, Universitas Sumatera Utara.
Dengan selesainya penyusunan tesis ini, perkenankanlah penulis
mengucapkan terima kasih kepada:
Bapak Prof. Dr. Harlem Marpaung dan Bapak Jamahir Gultom, Ph.D selaku
Dosen Pembimbing yang telah memberikan waktu dan tenaga untuk memberikan
pengetahuan dan bimbingannya yang sangat bermanfaat bagi penyusunan tesis ini.
Bapak/Ibu staf pengajar pada Program Studi Kimia yang telah memberikan
pengetahuannya kepada penulis selama di bangku perkuliahan.
Rektor Universitas Sumatera Utara, Prof. Chairuddin P. Lubis, DTM&H,
Sp.A(K), Direktur Sekolah Pascasarjana USU, Prof. Dr. Ir. T. Chairun Nisa B.,
M.Sc., dan Ketua Program Studi Kimia SPs USU, Prof. Basuki Wirjosentono, M.S.,
Ph.D. atas kesempatan dan fasilitas yang diberikan kepada penulis untuk mengikuti
pendidikan program magister.
Kepada isteri tercinta Julianna Hutabarat dan ketiga anak penulis: Meta,
Thomson dan Jordy Napitupulu atas doa dan dukungannya.
Kepada semua teman, sahabat, dan semua pihak yang membantu terlaksana
dan selesainya penyusunan tesis ini.
Semoga Tuhan Allah yang Maha baik dan pemurah melimpahkan rahmat dan
karunia-Nya atas kebaikan Bapak/Ibu dan Saudara-saudara sekalian.
Dengan menyadari keterbatasan pengalaman kemampuan yang dimiliki
penulis, sudah tentu terdapat banyak kekurangan dalam tulisan ini. Untuk itu penulis
mengharapkan saran serta kritik dari berbagai pihak yang sifatnya membangun dan
Akhir kata semoga tesis ini dapat memberikan manfaat bagi semua pihak yang
bersangkutan khususnya bagi penulis dan umumnya bagi para pembaca.
Medan, Agustus 2009
RIWAYAT HIDUP
Nama lengkap : Albert Napitupulu
Tempat/tanggal lahir : Sei Rampah/27 Desember 1964
Riwayat pendidikan : SD Negeri 02 Sei Rampah (Lulus Tahun 1976)
SMP Negeri Sei Rampah (Lulus Tahun 1980)
SMA YP. HKBP Pematang Siantar (Lulus Tahun 1983)
D-III Pendidikan Kimia IKIP Medan (Lulus Tahun 1986)
S-1 Pendidikan Kimia IKIP Medan (Lulus Tahun 1997)
Pekerjaan : PNS (Guru)
Status : Menikah dengan Julianna Hutabarat dan telah mempunyai
1 orang puteri dan 2 orang putera
Nama orang tua
Ayah : St. J Napitupulu (Alm)
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT... ii
UCAPAN TERIMA KASIH ... iii
RIWAYAT HIDUP... v
DAFTAR ISI ... vi
DAFTAR TABEL... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN... xi
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 6
1.3. Pembatasan Masalah ... 6
1.4. Tujuan Penelitian ... 7
1.5. Manfaat Penelitian ... 7
1.6. Metodologi Penelitian ... 7
1.7. Lokasi Penelitian ... 8
BAB II. TINJAUAN PUSTAKA... 9
2.1. Arang Aktif ... 9
2.2.1. Tembaga (Cu)... 19
2.2.2. Kadmium (Cd) ... 20
2.3. Adsorpsi ... 23
2.4. Impregnasi Karbon Aktif ... 25
2.5. Uji Kualitas Air ... 26
BAB III. BAHAN DAN METODE PENELITIAN... 28
3.1. Bahan ... 28
3.2. Alat... 28
3.3. Prosedur ... 29
3.3.1. Impregnasi Arang Aktif ... 29
3.3.2. Penyediaan Larutan Cu2+/ Cd2+(100 ppm) ... 30
3.3.3. Pengujian Adsorpsi ... 31
3.4. Skema Penelitian ... 32
3.4.1. Impregnasi Arang Aktif ... 32
3.4.2. Adsorpsi Logam ... 33
... BAB IV. HASIL DAN PEMBAHASAN ... 34
4.1. Hasil Penelitian dan Pengolahan Data ... 34
4.1.1. Hasil Penelitian Penetapan Kadar Logam Cu ... 34
4.1.1.1. Penentuan persamaan garis regresi dengan metode kurva kalibrasi ... 34
4.1.2. Data Hasil Pengukuran Daya Serap Logam Cu ... 37
4.1.2.1. Perhitungan persen penurunan konsentrasi logam Cu dan Cd dalam Sampel... 41
4.1.3. Penetapan Kadar Cd... 41
4.1.3.1. Penentuan persamaan garis regresi dengan metode kurva kalibrasi ... 41
4.1.3.2. Perhitungan koefisien korelasi ... 43
4.1.3.3. Penentuan kadar Cd dalam larutan sampel ... 44
4.2. Pembahasan... 48
4.2.1. Uji Kualitatif terhadap Karbon Aktif Terimpregnasi... 49
4.2.2. Daya Serap Karbon Aktif (C-aktif) Tanpa Impregnasi terhadap Logam Cu ... 49
4.2.3. Daya Serap Logam Cu dengan Karbon Aktif (C-Aktif) Terimpregnasi Natrium Sulfida (Na2S)... 50
4.2.4. Daya Serap Karbon Aktif (C-aktif) Tanpa Impregnasi terhadap Logam Cd ... 51
4.2.5. Daya Serap Logam Cd dengan Karbon Aktif (C-aktif) Terimpregnasi Natrium Sulfida (Na2S) ... 51
BAB V. KESIMPULAN DAN SARAN... 54
5.1. Kesimpulan ... 54
5.2. Saran... 54
DAFTAR TABEL
Nomor Judul Halaman
2.1. Penggunaan Arang Aktif... 11
2.2. Daftar Unsur Utama dari Logam Berat dan Sumbernya di Alam ... 16
4.1. Metode Least Square untuk Menentukan Nilai Slope, Intersep dan
Koefisien Korelasi pada Penetapan Kadar Cu. ... 35
4.2. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 15 38
4.3. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 30 39
4.4. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 45 40
4.5. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 60 40
4.6. Metode Least Square untuk Menentukan Nilai Slope, Intersep dan
Koefisien Korelasi pada Penetapan Kadar Cd. ... 42
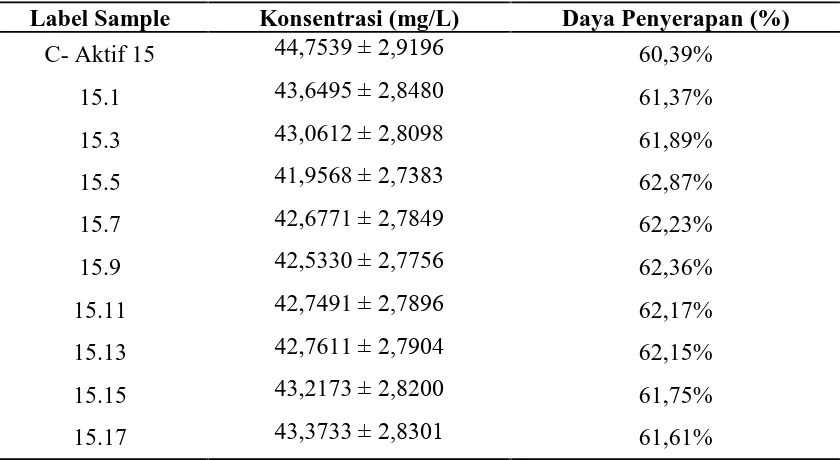
4.7. Data Pengukuran Daya Serap Cd Setelah Perlakuan dengan C-Aktif 15 45
4.8. Data Pengukuran Daya Serap Cd Setelah Perlakuan dengan C-Aktif 30 46
4.9. Data Pengukuran Daya Serap Cd Setelah Perlakuan dengan C-Aktif 45 47
DAFTAR GAMBAR
Nomor Judul Halaman
3.1. Peralatan untuk Impregnasi Karbon Aktif ... 29
3.2. Rangkaian Alat Shaker Bath pada Percobaan ... 31
4.1. Kurva Daya Serap Karbon Aktif Tanpa Impregnasi... 49
4.2. Kurva Daya Serap Karbon Aktif Terimpregnasi terhadap
Logam Cu dengan Waktu Kontak 45 Menit ... 50
4.3. Kurva Daya Serap Karbon Aktif Tanpa Impregnasi... 51
4.4. Kurva Daya Serap Karbon Aktif Terimpregnasi terhadap
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Tabel Data Absorbansi dan Konsentrasi Cu ... 58
2. Gambar Kurva Kalibrasi ... 63
ABSTRAK
Telah dilakukan penelitian impregnasi karbon aktif dengan Na2S dan digunakan sebagai adsorben terhadap larutan Cu2+dan Cd2+.
Impregnasi Karbon aktif dilakukan dengan larutan Na2S 0,5%, 1,0%, dan 1,5%, dengan waktu impregnasi 4, 8, dan 12 jam, kemudian diteruskan dengan penentuan daya serap karbon aktif terhadap ion Cu2+dan Cd2+ dengan variasi waktu kontak 15, 30, 45 dan 60 menit dan dibandingkan dengan tanpa impregnasi.
Hasil penelitian menunjukkan bahwa daya serap karbon aktif yang telah diimpregnasi lebih tinggi dibandingkan dengan karbon aktif tanpa impregnasi. Daya serap maksimum pada ion Cu2+ adalah 86,21 % dengan menggunakan karbon aktif yang diimpregnasi selama 12 jam dengan 1 % Na2S dengan waktu kontak 45 menit. Sedangkan menggunakan karbon aktif tanpa impregnasi daya serap optimum adalah 64,19% pada waktu kontak 45 menit. Daya serap maksimum pada ion Cd2+ adalah 74,49% dengan menggunakan karbon aktif yang diimpregnasi selama 4 jam dengan 1,5% Na2S pada waktu kontak 30 menit sedangkan dengan menggunakan karbon aktif tanpa impregnasi adalah 68,61% pada waktu kontak 30 menit.
ABSTRACT
The impregnation of carbon with sodium sulfide which used as an adsorbent for cupric ion and cadmium ion was carried out.
The solution of natrium sulfide of 0.5%, 1.0% and 1.5% respectively has been used to impregnate, with impregnation time 4, 8, and 12 hours and the determination of the absorption capacity of the active carbon to ion Cu2+ and Cd2+ with variations contact time 15, 30, 45 and 60 minutes respectively.
The result of research indicated that the absorption capacity of impregnated carbon was higher compared with the active carbon without impregnation. Maximum absorption of the ions Cu2+ was of 86.21% with 12 hours impregnation and 1% Na2S at the contact time of 45 minutes, while contacts with the active carbon without impregnation is 64.19% obtained in 45 minutes contact time. Whereas the maximum absorption of ions Cd2+ was 74.49% with 4 hours impregnation and 1.5% Na2S on the contact time of 30 minutes and using active carbon without impregnation is 68.61% in the contact time of 30 minutes.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Air merupakan kebutuhan pokok makhluk hidup. Bila manusia, hewan, dan
tumbuhan kekurangan air, maka akan mati. Permasalahan saat ini adalah kualitas air
terutama untuk kebutuhan (mandi, mencuci, minum, dan sebagainya) di kota-kota
besar di Indonesia masih memprihatinkan. Kepadatan penduduk, limbah industri, tata
ruang yang salah dan tingginya eksploitasi sumber daya air sangat berpengaruh pada
kualitas air. Selain itu, banyak orang yang membuang sampah, kotoran maupun
limbah ke sungai. Bahkan, ada cara lain membuang limbah berbahaya dengan cara
menanam di kedalaman beberapa meter. Hal inilah yang menyebabkan semakin
memburuknya kualitas air.
Logam berat secara umum digunakan oleh indusri modern termasuk tekstil,
penyamakan kulit, penyepuhan dan penyempurnaan logam. Logam berat ini
dilepaskan ke lingkungan baik dalam limbah air yang mencemari permukaan air
ataupun dalam bentuk endapan yang mencemari tanah. Kromium hexavalen dikenal
sebagai pengoksidasi kuat, yang dapat mengakibatkan mutasi dan penyebab kanker.
Karena tingkat racunnya yang tinggi, maka sangatlah penting untuk menurunkan
tingkat efeknya dengan mempergunakan daur ulang atau dengan penggunaan
kembali. Saat ini pengendapan kimia adalah teknik yang sangat banyak digunakan
penggunaan teknik ini adalah produksi endapan yang mengakibatkan pencemaran
tanah, dan yang lebih penting lagi efek yang berkepanjangan dalam lingkungan.
Logam tembaga (Cu) yang digunakan di pabrik biasanya berbentuk organik
dan anorganik. Logam tersebut digunakan di pabrik yang memproduksi alat-alat
listrik, gelas, dan zat warna yang biasanya bercampur dengan logam lain seperti alloi
dengan Ag, Cd, Sn, dan Zn. Garam Cu banyak digunakan dalam bidang pertanian,
misalnya sebagai larutan “Bordeaux” yang mengandung 1-3% CuSO4 untuk
membasmi jamur pada sayur dan tumbuhan buah. Senyawa CuSO4 juga sering
digunakan untuk membasmi siput sebagai inang dari parasit, cacing, dan juga
mengobati penyakit kuku pada domba.
Kadmium (Cd) merupakan salah satu jenis logam berat yang berbahaya
karena elemen ini beresiko tinggi terhadap pembuluh darah. Kadmium berpengaruh
terhadap manusia dalam jangka waktu panjang dan dapat terakumulasi pada tubuh
khususnya hati dan ginjal. Secara prinsipil pada konsentrasi rendah berefek terhadap
gangguan pada paru-paru, emphysema dan renal turbular disease yang kronis.
Jumlah normal kadmium di tanah berada di bawah 1 ppm, tetapi angka tertinggi
(1700 ppm) dijumpai pada permukaan sampel tanah yang diambil didekat
pertambangan biji seng (Zn). Kadmium lebih mudah diakumulasi oleh tanaman
dibandingkan dengan ion logam berat lainnya seperti timbal. Logam berat ini
bergabung bersama timbal dan merkuri sebagai the big three heavy metal yang
FAO/ WHO, konsumsi per minggu yang ditoleransikan bagi manusia adalah 400-500
µg per orang atau 7 µg per kg berat badan.
Karbon berpori atau yang lebih dikenal dengan nama karbon aktif digunakan
secara luas sebagai adsorben dalam proses industri untuk menghilangkan sejumlah
pengotor, terutama yang berhubungan dengan zat warna, pengolahan limbah,
pemurnian air, obat-obatan dan lain-lain. Arang aktif merupakan suatu padatan
berpori, yang sebagian besar terdiri dari unsur karbon bebas dan masing-masing
berikatan secara kovalen. Dengan demikian, permukaan arang aktif bersifat non
polar. Struktur pori berhubungan dengan luas permukaan juga menentukan
kemampuannya dalam menyerap bahan organik, logam berat, dan gas (Sembiring,
2003).
Arang umumnya mempunyai daya adsorpsi yang rendah dan daya adsorpsi itu
dapat diperbesar dengan cara mengaktifkan arang menggunakan uap atau bahan
kimia. Aktivasi karbon bertujuan untuk memperbesar luas permukaan arang dengan
membuka pori-pori yang tertutup tar, hidrokarbon, dan zat-zat organik lainnya,
sehingga memperbesar kapasitas adsorpsi. Beberapa bahan kimia yang dapat
digunakan sebagai zat pengaktif seperti: HNO3, H3PO4, CN-, Ca(OH)2, CaCl2,
Ca(PO4)2, NaOH, KOH, Na2SO4, SO2, ZnCl2, Na2CO3, dan uap air pada suhu tinggi
(Kateren, 1987). Berdasarkan penelitian yang telah dilakukan sebelumnya oleh Teng
dan Hsu (1999), KOH dapat dipergunakan sebagai bahan pengaktif karbon yang
Kebutuhan kayu yang terus meningkat dan potensi hutan yang terus berkurang
menuntut penggunaan kayu secara efisien dan bijaksana, antara lain dengan
memanfaatkan limbah berupa serbuk kayu menjadi produk yang bermanfaat. Limbah
tersebut, dalam hal ini serbuk gergaji, bila tidak dimanfaatkan lama-kelamaan akan
mengganggu misalnya dapat mengurangi produktivitas industri penggergajian dan
juga dapat mengganggu lingkungan. Di samping itu limbah ini belum banyak
dimanfaatkan padahal merupakan bahan baku yang dapat dikembangkan dalam
agroindustri, karena tersedia dalam jumlah banyak serta murah. Serbuk kayu yang
dihasilkan dari limbah penggergajian kayu dapat dimanfaatkan menjadi briket arang,
arang aktif, komposit kayu plastik (Setyawati, 2003), pot organik sebagai pengganti
polybag (Cahyono, 2000), sebagai media tanam jamur (Sariyono, 2000) dan
bentuk-bentuk lainnya.
Penggunaan karbon aktif sebagai adsorben untuk adsorpsi limbah logam
dalam air sudah banyak dilakukan, karena di samping memenuhi syarat sebagai
adsorben yang baik juga harganya murah dan mudah didapat. Namun pada beberapa
kasus, untuk suatu tujuan praktis tertentu yaitu ingin digunakan dalam sistem
campuran limbah, terkadang penggunaan karbon aktif kurang efektif. Salah satu
metode yang sedang berkembang untuk meningkatkan efektifitas karbon aktif adalah
memodifikasi permukaannya dengan cara impregnasi dengan bahan kimia tertentu.
Beberapa penelitian yang berhubungan telah cukup lama dirintis. Secara umum
disimpulkan bahwa bahan-bahan adsorben hasil modifikasi dengan teknik impregnasi
khusus yang tergantung pada jenis adsorbat logam dan gugus fungsional pada zat
organik (Amri et al, 2004). Dengan demikian, karbon aktif berpeluang untuk
memiliki manfaat tambahan dalam kegunaannya sebagai hasil modifikasi.
Korpiel (1997) telah meneliti adanya peningkatan kemampuan karbon aktif
yang diimpregnasi dengan sulfur dalam menyerap gas merkuri. Khalkhali (2004)
telah meneliti adanya peningkatan kemampuan arang aktif yang telah diimpregnasi
dengan senyawa megandung sulfur dalam menyerap ion merkuri dalam pelarut air.
Banyak tipe karbon aktif terimpregnasi sulfur. HGR, suatu karbon terimpregnasi
sulfur yang tersedia secara komersil, diproduksi secara pabrikan (Calgon Carbon
Corporation, Pittsburg, PA). Karbon seri BPL-S yang diproduksi dengan
mengimpregnasi karbon aktif batubara, BPL (Calgon Carbon Corporation, Pittsburg,
PA), dengan sulfur dalam atmosfer nitrogen murni pada berbagai temperatur. Vidic
(1997) telah mengevaluasi disain dan parameter operasional yang akan sukses dalam
mengaplikasikan adsorpsi karbon aktif yang terimpregnasi sulfur untuk menurunkan
emisi merkuri dari pembangkit tenaga batubara. Hsing-Cheng Hsi, et al, dalam
penelitiannya menyatakan bahwa impregnasi sulfur meningkatkan kandungan sulfur
dan menurunkan total luas permukaan mikropori pada semua adsorben yang
digunakan. Mereka menggunakan unsur sulfur, sulfur organik, dan sulfat dalam
mengimpregnasi adsorben.
Chung Hsuang Hung (2004) telah melakukan penelitian penurunan kadar Cu
dan Cd menggunakan karbon aktif yang terimpregnasi sulfur, di mana sulfur yang
pada karbon aktif akan meningkatkan porositas atau pori-pori karbon aktif dalam
bentuk mesoporus atau makroporus sementara itu molekul Na2S lebih efektif dalam
bentuk mesoporus dan makroporus.
Berdasarkan uraian di atas, maka penulis berkeinginan meneliti tentang
modifikasi karbon aktif yakni mengimpregnasinya dengan sulfida. Arang aktif yang
dihasilkan akan digunakan untuk mengadsorpsi logam berat yaitu Cu dan Cd.
1.2. Perumusan Masalah
Bagaimana kapasitas karbon aktif terimpregnasi sulfida dalam menyerap ion
Tembaga (II) dan Kadmium (II) dibandingkan dengan tanpa impregnasi?
1.3. Pembatasan Masalah
1. Uji penyerapan logam berat dilakukan terhadap ion Cu2+ dalam larutan
Cu(CH3COO)2 100 ppm.
2. Uji penyerapan logam berat dilakukan terhadap ion Cd2+ dalam larutan
Cd(CH3COO)2 100 ppm.
3. Impregnasi karbon aktif dengan metode vakum menggunakan larutan Na2S.
1.4. Tujuan Penelitian
Menggunakan karbon aktif yang diimpregnasi dengan sulfida untuk menyerap
ion Tembaga (II) dan Kadmium (II) dan mambandingkannya dengan karbon aktif
tanpa impregnasi.
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang kemajuan ilmu
pengetahuan khususnya penggunaan karbon aktif dalam rangka pembebasan air dari
pencemaran logam berat.
1.6. Metodologi Penelitian
Karbon aktif merupakan padatan dengan struktur berpori internal yang tinggi.
Kemampuan karbon aktif ditingkatkan dengan cara diimpregnasi (dengan variasi
konsentrasi impregnan dan waktu impregnasi) dengan sulfur. Sedangkan jenis dan
ukuran karbon aktif serta volume dan temperatur larutan impregnan dijadikan
variabel tetap. Untuk setiap variabel bebas tersebut diamati perubahan kapasitas
adsorpsi (dengan variasi waktu kontak) terhadap ion Cu2+ dan Cd2+ serta
dibandingkan kemampuannya dengan karbon aktif tanpa impregnasi.
Variasi konsentrasi impregnan, waktu impregnasi, dan waktu kontak
ditetapkan berdasarkan penelitian terdahulu, yaitu 0,5 g/100 ml, 1,0 g/100 ml, dan 1,5
g/100 ml untuk konsentrasi impregnan; 4, 8, dan 12 jam untuk waktu impregnasi;
untuk setiap perlakuan dari masing-masing sampel. Untuk mengumpulkan data, maka
dilakukan penurunan konsentrasi sampel ion Cu2+ dan Cd2+ dari larutan, yang
dipreparasi pada konsentrasi tertentu oleh karbon aktif yang telah dihasilkan.
Untuk mendapatkan nilai adsorbansi, maka dilakukan pengukuran konsentrasi
logam berat yang tertinggal dalam larutan sampel dengan alat Spektrofotometer
Serapan Atom. Hasil yang diperoleh diolah dan dianalisa secara grafik.
1.7. Lokasi Penelitian
Penelitian dilaksanakan di Laboratorium Pascasarjana dan Laboratorium
Penelitian – USU, Laboratorium Kimia Analitik, Laboratorium Biokimia FMIPA –
BAB II
TINJAUAN PUSTAKA
2.1. Arang Aktif
Arang merupakan suatu padatan berpori yang mengandung 85-95% karbon,
dihasilkan dari bahan-bahan yang mengandung karbon dengan pemanasan pada suhu
tinggi. Ketika pemanasan berlangsung, diusahakan agar tidak terjadi kebocoran udara
di dalam ruangan pemanasan sehingga bahan yang mengandung karbon tersebut
hanya terkarbonisasi dan tidak teroksidasi. Arang selain digunakan sebagai bahan
bakar, juga dapat digunakan sebagai adsorben (penyerap). Daya serap ditentukan oleh
luas permukaan partikel dan kemampuan ini dapat menjadi lebih tinggi jika terhadap
arang tersebut dilakukan aktivasi dengan aktif faktor bahan-bahan kimia ataupun
dengan pemanasan pada temperatur tinggi. Dengan demikian, arang akan mengalami
perubahan sifat-sifat fisika dan kimia. Arang yang demikian disebut sebagai arang
aktif.
Luas permukaan arang aktif berkisar antara 300-3500 m2/g dan ini
berhubungan dengan struktur pori internal yang menyebabkan arang aktif mempunyai
sifat sebagai adsorben. Arang aktif dapat mengadsorpsi gas dan senyawa-senyawa
kimia tertentu atau sifat adsorpsinya selektif, tergantung pada besar atau volume
pori-pori dan luas permukaan. Daya serap arang aktif sangat besar, yaitu 25-100%
Arang aktif dibagi atas 2 tipe, yaitu arang aktif sebagai pemucat dan sebagai
penyerap uap. Arang aktif sebagai pemucat, biasanya berbentuk powder yang sangat
halus, diameter pori mencapai 1000 Å, digunakan dalam fase cair, berfungsi untuk
memindahkan zat-zat pengganggu yang menyebabkan warna dan bau yang tidak
diharapkan, membebaskan pelarut dari zat-zat pengganggu dan kegunaan lain yaitu
pada industri kimia dan industri baju. Diperoleh dari serbuk-serbuk gergaji, ampas
pembuatan kertas atau dari bahan baku yang mempunyai densitas kecil dan
mempunyai struktur yang lemah. Arang aktif sebagai penyerap uap, biasanya
berbentuk granular atau pellet yang sangat keras diameter pori berkisar antara 10-200
Å, tipe pori lebih halus, digunakan dalam fase gas, berfungsi untuk memperoleh
kembali pelarut, katalis, pemisahan dan pemurnian gas. Diperoleh dari tempurung
kelapa, tulang, batu bata atau bahan baku yang mempunyai struktur keras.
Sehubungan dengan bahan baku yang digunakan dalam pembuatan arang aktif
untuk masing-masing tipe, pernyataan di atas bukan merupakan suatu keharusan.
Karena ada arang aktif sebagai pemucat diperoleh dari bahan yang mempunyai
densitas besar, seperti tulang. Arang tulang tersebut, dibuat dalam bentuk granular
dan digunakan sebagai pemucat larutan gula. Demikian juga dengan arang aktif yang
digunakan sebagai penyerap uap dapat diperoleh dari bahan yang mempunyai
Tabel 2.1. Penggunaan Arang Aktif
3. Kimia perminyakan Penyulingan bahan mentah 4x8, 4x12, 8x30
4. Pembersih air Penghilangan warna, bau,
penghilangan resin
5. Budi daya udang Permurnian, penghilangan
ammonia, netrite phenol dan
logam berat
4x8, 4x12
6. Industri gula Penghilangan zat-zat warna,
menyerap proses penyaringan
menjadi lebih sempurna
4x8, 4x12
7. Pelarut yang digunakan
kembali
Penarikan kembali berbagai
pelarut
4x8, 4x12, 8x30
8. Pemurnian gas Menghilangkan sulfur, gas
beracun, bau busuk asap
4x8, 4x12
9. Katalisator Reaksi katalisator pengangkut vinil
chloride, vinil acetat
4x8, 4x30
10. Pengolahan pupuk Pemurnian, penghilangan bau 8x30
Sumber: Meilita.T. Sembiring, ST dan Tuti. S. Sinaga, ST (2003)
Arang juga dapat dihasilkan dengan cara destilasi kering. Dengan cara ini,
bahan baku dipanaskan dalam suatu ruangan vakum. Hasil yang diperoleh berupa
residu yaitu arang dan destilat yang terdiri dari campuran metanol dan asam asetat.
abu dan ter. Hasil yang diperoleh seperti metanol, asam asetat dan arang tergantung
pada bahan baku yang digunakan dan metoda destilasi.
Proses aktivasi merupakan hal yang penting diperhatikan di samping bahan
baku yang digunakan. Yang dimaksud dengan aktivasi adalah suatu perlakuan
terhadap arang yang bertujuan untuk memperbesar pori yaitu dengan cara
memecahkan ikatan hidrokarbon atau mengoksidasi molekul-molekul permukaan
sehingga arang mengalami perubahan sifat, baik fisika maupun kimia, yaitu luas
permukaannya bertambah besar dan berpengaruh terhadap daya adsorpsi. Metoda
aktivasi yang umum digunakan dalam pembuatan arang aktif adalah:
a. Aktivasi Kimia: proses pemutusan rantai karbon dari senyawa organik dengan
pemakaian bahan-bahan kimia.
b. Aktivasi Fisika: proses pemutusan rantai karbon dari senyawa organik dengan
bantuan panas, uap dan CO2.
Untuk aktivasi kimia, aktivator yang digunakan adalah bahan-bahan kimia
seperti: hidroksida logam alkali garam-garam karbonat, klorida, sulfat, fosfat dari
logam alkali tanah dan khususnya ZnCl2 asam-asam anorganik seperti H2SO4 dan
H3PO4. Arang aktif sebagai pemucat, dapat dibuat dengan aktivasi kimia. Bahan baku
dicampur dengan bahan-bahan kimia, kemudian campuran tersebut dipanaskan pada
temperatur 500-900°C. Selanjutnya didinginkan, dicuci untuk menghilangkan dan
memperoleh kembali sisa-sisa zat kimia yang digunakan. Akhirnya, disaring dan
Cheremisinoff dan A. C. Moressi (1978), mengemukakan bahwa proses
pembuatan arang aktif terdiri dari tiga tahap yaitu:
a. Dehidrasi: proses penghilangan air.
Bahan baku dipanaskan sampai temperatur 170 °C.
b. Karbonisasi: pemecahan bahan-bahan organik menjadi karbon.
Temperatur di atas 170°C akan menghasilkan CO, CO2 dan asam asetat. Pada
temperatur 275°C, dekomposisi menghasilkan tar, metanol dan hasil sampingan
lainnya. Pembentukan karbon terjadi pada temperatur 400 – 600°C.
c. Aktivasi: dekomposisi tar dan perluasan pori-pori.
Dapat dilakukan dengan uap atau CO2 sebagai aktivator.
Sifat arang aktif yang paling penting adalah daya serap. Dalam hal ini, ada
beberapa faktor yang mempengaruhi daya serap adsorpsi, yaitu:
1. Sifat Adsorben
Arang aktif yang merupakan adsorben adalah suatu padatan berpori, yang
sebagian besar terdiri dari unsur karbon bebas dan masing-masing berikatan
secara kovalen. Dengan demikian, permukaan arang aktif bersifat non polar.
Selain komposisi dan polaritas, struktur pori juga merupakan faktor yang penting
diperhatikan. Struktur pori berhubungan dengan luas permukaan, semakin kecil
pori-pori arang aktif, mengakibatkan luas permukaan semakin besar. Dengan
demikian kecepatan adsorpsi bertambah. Untuk meningkatkan kecepatan
adsorpsi, dianjurkan agar menggunakan arang aktif yang telah dihaluskan. Jumlah
2. Sifat Serapan
Banyak senyawa yang dapat diadsorpsi oleh arang aktif, tetapi kemampuannya
untuk mengadsorpsi berbeda untuk masing-masing senyawa. Adsorpsi akan
bertambah besar sesuai dengan bertambahnya ukuran molekul serapan dari
sturktur yang sama, seperti dalam deret homolog. Adsorsi juga dipengaruhi oleh
gugus fungsi, posisi gugus fungsi, ikatan rangkap, struktur rantai dari senyawa
serapan.
3. Temperatur
Dalam pemakaian arang aktif dianjurkan untuk menyelidiki temperatur pada saat
berlangsungnya proses. Karena tidak ada peraturan umum yang bisa diberikan
mengenai temperatur yang digunakan dalam adsorpsi. Faktor yang mempengaruhi
temperatur proses adsoprsi adalah viskositas dan stabilitas termal senyawa
serapan. Jika pemanasan tidak mempengaruhi sifat-sifat senyawa serapan, seperti
terjadi perubahan warna maupun dekomposisi, maka perlakuan dilakukan pada
titik didihnya. Untuk senyawa volatil, adsorpsi dilakukan pada temperatur kamar
atau bila memungkinkan pada temperatur yang lebih kecil.
4. pH (Derajat Keasaman)
Untuk asam-asam organik adsorpsi akan meningkat bila pH diturunkan, yaitu
dengan penambahan asam-asam minreal. Ini disebabkan karena kemampuan asam
mineral untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila pH
asam organik dinaikkan yaitu dengan menambahkan alkali, adsorpsi akan
5. Waktu Kontak
Bila arang aktif ditambahkan dalam suatu cairan, dibutuhkan waktu untuk
mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan
jumlah arang yang digunakan. Selain ditentukan oleh dosis arang aktif,
pengadukan juga mempengaruhi waktu singgung. Pengadukan dimaksudkan
untuk memberi kesempatan pada partikel arang aktif untuk bersinggungan dengan
senyawa serapan. Untuk larutan yang mempunyai viskositas tinggi, dibutuhkan
waktu singgung yang lebih lama (Sembiring, 2003).
2.2. Kontaminasi Logam Berat
Secara umum diketahui bahwa logam berat merupakan unsur yang berbahaya
di permukaan bumi, sehingga kontaminasi logam berat di lingkungan merupakan
masalah besar dunia saat ini. Persoalan spesifik di lingkungan terutama akumulasinya
sampai pada rantai makanan dan keberadaannya di alam, serta meningkatnya
sejumlah logam berat yang menyebabkan keracunan terhadap tanah, udara, dan air
meningkat. Proses industri dan urbanisasi memegang peranan penting terhadap
peningkatan kontaminan tersebut (Onrizal, 2005).
Logam berat di suatu lahan secara umum bisa berasal dari proses alam atau
akibat kegiatan manusia. Proses alam seperti perubahan siklus alamiah
mengakibatkan batuan-batuan dan gunung berapi memberikan kontribusi yang sangat
besar ke lingkungan. Namun apabila proses alam tersebut tidak mengalami perubahan
yang dapat menyebabkan masuknya logam berat ke lingkungan antara lain adalah
pertambangan (minyak, emas, batubara, dll), pembangkit tenaga listrik, peleburan
logam, pabrik-pabrik pupuk, kegiatan-kegiatan industri lainnya, dan penggunaan
produk sintetik (misalnya pestisida, cat, baterai, limbah industri, dll). Kontaminasi ini
akan terus meningkat sejalan dengan meningkatnya usaha eksploitasi berbagai
sumber alam di mana logam berat terkandung di dalamnya (USDA NRCS, 2000,
Suhendrayatna, 2001). Unsur pencemar utama dari logam berat dan sumbernya
di alam secara lengkap disajikan pada Tabel 2.2.
Tabel 2.2. Daftar Unsur Utama dari Logam Berat dan Sumbernya di Alam
No. Unsur Sumber Logam di Alam
1. Antimony Stibnite (Sb2S3), geothermal springs, mine drainage
2. Arsenic Metal arsenides and arsenates, sulfide ores (arsenopyrite), arsenite (HasO2), vulcanic gases, geothermal springs
3. Beryllium Beryl (Be3Al2Si6O16), Phenacite (Be2Si)4)
4. Cadmium Zinc carbonate and sulfide ores, copper carbonate and sulfide ores 5. Chromium Chromite (FeCr2O), chromic oxide (Cr2O3)
6. Copper Free metal (Cu0), copper sulfide (CuS2), Chalcopyrite (CuFeS2), mine drainage
7. Lead Galena (PbS)
8. Mercury Free mercury (Hg0), Cinnabar (HgS)
9. Nickel Ferromagnesian minerals, ferrous sulfide ores, nickel oxide (NiO2), Pentladite [(Ni,Fe) 9S8], nickel hydroxide [Ni(OH)3]
10. Selenium Free metal (Ag0), Ferroselite (FeSe2), uranium deposits, black shales, Chalcopyrite-Pantladite-Pyrrhotite deposits
11. Silver Free metal (Ag0), silver chlorite (AgCl2), Argentide (AgS2), copper, lead, zinc ores
12. Thallium Copper, lead, silver residues
13. Zinc Zinc blende (ZnS), Willemite (ZnSiO4), Calamite (ZnCO3), mine drainage
Sumber: Novotny (1995) yang dimodifikasi oleh Suhendrayatna (2001)
Salah satu indikator yang digunakan untuk mendeteksi pencemaran air adalah
memiliki rapat massa tinggi (5 g/cm3) dan sejumlah konsentrasi kecil dapat bersifat
racun dan berbahaya. Di antara semua unsur logam berat, Hg menduduki urutan
pertama dalam hal sifat racunnya kemudian diikuti oleh logam berat antara lain Cd,
Ag, Ni, Cu, Pb, As, Cr, Sn, dan Zn.
Berdasarkan sudut pandang toksikologi, logam berat terbagi ke dalam dua
jenis yaitu: pertama logam berat esensial di mana keberadaannya dalam jumlah
tertentu sangat dibutuhkan oleh setiap organisme hidup, seperti antara lain Zn, Cu,
Fe, Co, Mn, dan lain-lain. Kedua logam berat tidak esensial atau beracun, di mana
keberadaan dalam tubuh organisme hidup hingga saat ini masih belum diketahui
manfaatnya bahkan justru dapat bersifat racun, seperti misalnya; Hg, Cd, Pb, Cr, dan
lain-lain.
Logam berat adalah unsur-unsur kimia dengan bobot jenis lebih besar dari 5
gr/cm3, terletak di sudut kanan bawah sistem periodik, mempunyai afinitas yang
tinggi terhadap unsur S dan biasanya bernomor atom 22 sampai 92 dari perioda 4
sampai 7 (Miettinen, 1977). Sebagian logam berat seperti timbal (Pb), kadmium (Cd),
dan merkuri (Hg) merupakan zat pencemar yang berbahaya. Afinitas yang tinggi
terhadap unsur S menyebabkan logam ini menyerang ikatan belerang dalam enzim,
sehingga enzim bersangkutan menjadi tak aktif. Gugus karboksilat (-COOH) dan
amina (-NH2) juga bereaksi dengan logam berat. Kadmium, timbal, dan tembaga
terikat pada sel-sel membran yang menghambat proses transpormasi melalui dinding
sel. Logam berat juga mengendapkan senyawa fosfat biologis atau mengkatalis
Berdasarkan sifat kimia dan fisikanya, maka tingkat atau daya racun logam
berat terhadap hewan air dapat diurutkan (dari tinggi ke rendah) sebagai berikut
merkuri (Hg), kadmium (Cd), seng (Zn), timah hitam (Pb), krom (Cr), nikel (Ni), dan
kobalt (Co) (Sutamihardja dkk, 1982). Menurut Darmono (1995) daftar urutan
toksisitas logam paling tinggi ke paling rendah terhadap manusia yang
mengkomsumsi ikan adalah sebagai berikut Hg2+> Cd2+ > Ag2+ > Ni2+ > Pb2+ >As2+
>Cr2+ > Sn2+ > Zn2+. Sedangkan menurut Kementrian Negara Kependudukan dan
Lingkungan Hidup (1990) sifat toksisitas logam berat dapat dikelompokan ke dalam 3
kelompok, yaitu bersifat toksik tinggi yang terdiri dari atas unsur-unsur Hg, Cd, Pb,
Cu, dan Zn. Bersifat toksik sedang terdiri dari unsur-unsur Cr, Ni, dan Co, sedangkan
bersifat tosik rendah terdiri atas unsur Mn dan Fe.
Adanya logam berat di perairan, berbahaya baik secara langsung terhadap
kehidupan organisme, maupun efeknya secara tidak langsung terhadap kesehatan
manusia. Hal ini berkaitan dengan sifat-sifat logam berat (PPLH-IPB, 1997;
Sutamihardja dkk, 1982) yaitu:
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan
keberadaannya secara alami sulit terurai (dihilangkan).
2. Dapat terakumulasi dalam organisme termasuk kerang dan ikan, dan akan
membahayakan kesehatan manusia yang mengkomsumsi organisme tersebut.
3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi dari
konsentrasi logam dalam air. Di samping itu sedimen mudah tersuspensi karena
dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala
waktu tertentu
2.2.1. Tembaga (Cu)
Tembaga bersifat racun terhadap semua tumbuhan pada konsentrasi larutan
di atas 0,1 ppm. Konsentrasi yang aman bagi air minum manusia tidak lebih dari 1
ppm. Bersifat racun bagi domba pada konsentrasi di atas 20 ppm. Konsentrasi normal
komponen ini di tanah berkisar 20 ppm dengan tingkat mobilitas sangat lambat
karena ikatan yang sangat kuat dengan material organik dan mineral tanah liat.
Kehadiran tembaga pada limbah industri biasanya dalam bentuk ion bivalen Cu(II)
sebagai hydrolytic product. Beberapa industri seperti pewarnaan, kertas, minyak,
industri pelapisan melepaskan sejumlah tembaga yang tidak diharapkan. Tembaga
dalam konsentrasi tinggi (22-750 mg/kg tanah kering) dijumpai pada sedimen di laut
Hongkong dan jumlah yang sama juga ditemui pada sejumlah pelabuhan-pelabuhan
di Inggris (Nora, 1998).
Tembaga merupakan logam yang ditemukan di alam dalam bentuk senyawa
dengan sulfida (CuS). Tembaga sering digunakan pada pabrik-pabrik yang
memproduksi peralatan listrik, gelas, dan alloy. Tembaga masuk keperairan
merupakan faktor alamiah seperti terjadinya pengikisan dari batuan mineral sehingga
terdapat debu, partikel-partikel tembaga yang terdapat dalam lapisan udara akan
terbawa oleh hujan. Tembaga juga berasal dari buangan bahan yang mengandung
tembaga seperti dari industri galangan kapal, industri pengolahan kayu, dan limbah
Pada konsentrasi 2,3 – 2,5 mg/l dapat mematikan ikan dan akan menimbulkan
efek keracunan, yaitu kerusakan pada selaput lendir (Saeni, 1997). Tembaga dalam
tubuh berfungsi sebagai sintesa hemoglobin dan tidak mudah dieksresikan dalam
urine karena sebagian terikat dengan protein, sebagian dieksresikan melalui empedu
ke dalam usus dan dibuang ke feses, sebagian lagi menumpuk dalam hati dan ginjal,
sehingga menyebabkan penyakit anemia dan tuberkulosis.
2.2.2. Kadmium (Cd)
Penggunaan kadmium yang paling besar (75%) adalah dalam industri batu
baterai (terutama baterai Ni-Cd). Selain itu, logam ini juga dapat digunakan campuran
pigmen, electroplating, pembuatan alloys dengan titik lebur yang rendah, pengontrol
pembelahan reaksi nuklir, dalam pigmen cat dengan membentuk beberapa garamnya
seperti kadmium oksida (yang lebih dikenal sebagai kadmium merah),
semikonduktor, stabilisator PVC, obat-obatan seperti sipilis dan malaria, dan
penambangan timah hitam dan bijih seng, dan sebagainya.
Logam kadmium mempunyai penyebaran sangat luas di alam, hanya ada satu
jenis mineral kadmium di alam yaitu greennockite (CdS) yang selalu ditemukan
bersamaan dengan mineral spalerite (ZnS). Berdasar pada sifat-sifat kimianya, logam
Cd didalam persenyawaan yang dibentuknya pada umumnya mempunyai bilangan
valensi 2+, sangat sedikit yang mempunyai bilangan valensi 1+. Waktu paruh dari
kadmium dalam tubuh 7-30 tahun dan menembus ginjal terutama setelah terjadi
Kadmium (Cd) merupakan salah satu jenis logam berat yang berbahaya
karena unsur ini berisiko tinggi terhadap pembuluh darah. Logam ini memiliki
tendensi untuk bioakumulasi. Keracunan yang disebabkan oleh kadmium dapat
bersifat akut dan keracunan kronis. Logam Cd merupakan logam asing dalam tubuh
dan tidak dibutuhkan dalam proses metabolisme. Logam ini teradsorbsi oleh tubuh
manusia yang akan menggumpal di dalam ginjal, hati dan sebagian dibuang keluar
melalui saluran pencernaan. Keracunan Cd dapat mempengaruhi otot polos pembuluh
darah. Akibatnya tekanan darah menjadi tinggi yang kemudian bisa menyebabkan
terjadinya gagal jantung dan kerusakan ginjal.
Penelitian terkini menyebutkan bahwa logam beracun kadmium dapat dibawa
ke dalam tubuh oleh seng yang terikat dalam protein (dalam hal ini adalah struktur
protein yang mengandung rantai seng). Ikatan kadmium dalam zat organik
mempunyai kekuatan 10 kali lebih besar dibandingkan dengan seng jika terikat dalam
zat organik. Sebagai tambahan, kadmium juga dapat menggantikan magnesium dan
kalsium dalam ikatannya dengan struktur zat organik. Secara prinsip, pada
konsentrasi rendah berefek terhadap gangguan pada paru-paru, emphysemia dan renal
turbular disease yang kronis. Kadmium lebih mudah terakumulasi oleh tanaman jika
dibandingkan dengan timbal (Pb). Logam berat ini tergabung bersama timbal dan
merkuri sebagai “the big three heavy metals” yang memiliki tingkat bahaya tertinggi
pada kesehatan manusia (Saeni, 1997).
Dari evaluasi beberapa teknik pengolahan logam berat dengan
melimpah, maka diperoleh suatu metode yang lebih representatif dalam mengolah
logam berat timbal dan kadmium. Metode tersebut adalah adsorpsi dengan media
karbon aktif. Karbon aktif memiliki ruang pori sangat banyak dengan ukuran
tertentu. Pori-pori ini dapat menangkap partikel-partikel sangat halus (molekul)
terutama logam berat dan menjebaknya di sana. Penyerapan menggunakan karbon
aktif adalah efektif untuk menghilangkan logam berat. Ion logam berat ditarik oleh
karbon aktif dan melekat pada permukaannya dengan kombinasi dari daya fisik
kompleks dan reaksi kimia. Karbon aktif memiliki jaringan porous (berlubang) yang
sangat luas yang berubah-ubah bentuknya untuk menerima molekul pengotor baik
besar maupun kecil. Efektivitas adsorpsi karbon aktif terhadap logam timbal Pb2+
telah ditunjukkan pada sertifikat NSF (National Sanitation Foundation) yang
merefleksikan isotherm Langmuir di mana adsorbsi logam berat Pb akan berlangsung
sampai mencapai titik keseimbangan di mana proses adsorbsi tidak akan berjalan lagi
atau berhenti meskipun dosis karbon aktif diperbesar. Kecepatan penyerapan ini
tergantung dari sifat adsorbsi, temperatur, pH, dan waktu singgung karbon aktif
dengan Pb. Sedangkan penyerapan Cd relatif merefleksikan isotherm Freundlich.
Proses eliminasi logam berat Pb dan Cd dengan karbon aktif akan semakin
efektif di mana selain sebagai adsorben karbon aktif secara simultan juga bertindak
sebagai pemberat (weighing agent) demikian pula jika berbagai metode pengolahan
digabung misalnya metode adsorbsi karbon aktif dengan metode konvensional
(koagulasi, flokulasi, sedimentasi, filtrasi dan klorinasi). Penyerapan karbon aktif
pembubuhan. Pembubuhan karbon aktif dapat dilakukan dengan sistem kering
maupun basah. Titik pembubuhan ini tentunya mempunyai kelebihan dan kekurangan
masing-masing. Untuk meningkatkan kecepatan adsorpsi, dianjurkan agar
menggunakan arang aktif yang telah dihaluskan.
2.3. Adsorpsi
Adsorpsi adalah proses pengumpulan subtansi terlarut (soluble) yang ada
dalam larutan oleh permukaan benda penyerap di mana terjadi suatu ikatan kimia
fisika antara subtansi dan penyerapnya. Proses adsorpsi digambarkan sebagai proses
molekul meninggalkan larutan dan menempel pada permukaan zat penyerap akibat
ikatan fisika dan kimia. Adsorpsi dalam air limbah sering mengikuti proses biologis
untuk menyisihkan bahan-bahan yang tidak tersisihkan oleh proses biologis, misalnya
bahan organik non-biodegradabel. Oleh karena itu adsorpsi sering dikelompokkan
sebagai pengolahan tersier (Sawyer et. al., 1994 dalam Masduqi dan Slamet, 2000).
Permukaan padatan yang kontak dengan suatu larutan cenderung untuk
menghimpun lapisan dari molekul-molekul zat terlarut pada permukaannya akibat
ketidakseimbangan gaya-gaya pada permukaan. Adsorpsi kimia menghasilkan
pembentukan lapisan monomolekular adsorbat pada permukaan melalui gaya-gaya
dari valensi sisa dari molekul-molekul pada permukaan. Adsorpsi fisika diakibatkan
kondensasi molekular dalam kapiler-kapiler dari padatan. Secara umum, unsur-unsur
Terjadi pembentukan yang cepat sebuah kesetimbangan konsentrasi
antar-muka, diikuti dengan difusi lambat ke dalam partikel-partikel karbon. Laju adsorpsi
keseluruhan dikendalikan oleh kecepatan difusi dari molekul-molekul zat terlarut
dalam pori-pori kapiler dari partikel karbon. Kecepatan itu berbanding terbalik
dengan kuadrat diameter partikel, bertambah dengan kenaikan konsentrasi zat
terlarut, bertambah dengan kenaikan temperatur, dan berbanding terbalik dengan
kenaikan berat molekul zat terlarut (Freeman, 1989).
Pada proses adsorpsi dibatasi proses difusi film dan difusi pori yang
tergantung pada lamanya kontak antara partikel adsorben dan fluida dalam sistem.
Bila lamanya kontak relatif sedikit maka lapisan film yang disekeliling partikel akan
tebal sehingga proses adsorpsi berlangsung lambat. Dengan pengadukan yang cukup
maka kecepatan difusi film meningkat.
Morris dan Weber menemukan bahwa laju adsorpsi bervariasi seiring dengan
akar pangkat dua dari waktu kontak dengan adsorben. Kecepatan ini juga meningkat
dengan menurunnya pH sebab perubahan muatan pada permukaan karbon. Kapasitas
adsorpsi dari karbon terhadap suatu zat terlarut tergantung pada dua-duanya, karbon
dan zat terlarutnya. Kebanyakan limbah cair adalah kompleks dan bervariasi dalam
hal kemampuan adsorpsi dari campuran-campuran yang ada. Struktur molekul,
2.4. Impregnasi Karbon Aktif
Polusi air menjadi masalah serius dengan perkembangan industri dari tahun ke
tahun. Dilihat dari pencegahan bau busuk atau pemeliharaan lingkungan,
pengembangan metode pengolahan kontaminasi atmosfer menjadi sangat dibutuhkan.
Pestisida dan logam berat yang dilepas ke badan air merupakan substansi utama
penyebab penurunan kualitas air bersih.
Upaya penanganan pencemaran logam berat sebenarnya dapat dilakukan
dengan menggunakan proses kimiawi. Seperti penambahan senyawa kimia tertentu
untuk proses pemisahan ion logam berat atau dengan resin penukar ion (exchange
resins), serta beberapa metode lainnya seperti penyerapan menggunakan karbon aktif,
electrodialysis dan reverse osmosis. Namun proses ini relatif mahal dan cenderung
menimbulkan permasalahan baru, yaitu akumulasi senyawa tersebut dalam sedimen
dan organisme akuatik (perairan) (Wijaya, 2006).
Karbon aktif telah banyak digunakan untuk menghilangkan berbagai spesies
bahan kimia dari fase gas ataupun cair. Ukuran porinya terdistribusi luas dan dikenal
sebagai adsorben universal. Namun, untuk meningkatkan kelemahannya diperlukan
perlakuan kimia pada permukaannya. Karena karbon aktif memiliki makropori, maka
dapat dimanfaatkan untuk impregnasi (Yoshida, 2004), salah satu tujuannya untuk
membentuk komposit karbon aktif dan garam logam yang bersifat antibakteri.
Impregnasi karbon aktif dengan berbagai mineral dan senyawa organik telah
dipaparkan oleh penelitian-penelitian terdahulu. Karbon aktif diimpregnasi dengan
yang lebih efektif dan mengurangi logam berat dari limbah. Tingkat adsorpsi dan
kesempurnaan penghilangan bergantung pada pH larutan, temperatur, konsentrasi,
ukuran molekul, dan berat molekul, kompleksitas struktur molekul adsorben, tipe dan
bentuk fisik karbon aktif yang digunakan. Faktor penting lain yang menentukan sifat
adsorpsi karbon aktif adalah distribusi ukuran pori dan gugus fungsi permukaan.
Karbon aktif tidak hanya memiliki karbon, tapi juga sejumlah kecil ikatan kimia atom
O dan H dalam bentuk berbagai gugus fungsi yang biasanya memberikan sifat asam
pada padatan karbon, ditambah kandungan mineral yang biasanya ditandai dengan
abu atau residu setelah pengarangan (Khalkhali, 2004).
2.5. Uji Kualitas Air
Menurut Soetarto (2008), semua organisme selalu membutuhkan air untuk
kelangsungan hidupnya. Hal ini disebabkan semua reaksi biologis yang berlangsung
di dalam tubuh makhluk hidup berlangsung dalam medium air. Oleh karena itu dapat
dikatakan bahwa tidak mungkin ada kehidupan tanpa adanya air. Tetapi sering sekali
terjadi pengotoran dan pencemaran air dengan kotoran-kotoran dan sampah. Oleh
karena itu air dapat menjadi sumber atau perantara berbagai penyakit.
Logam berat biasanya didefinisikan berdasarkan sifat-sifat fisiknya dalam
keadaan padat dengan menggunakan metode teknologi yang telah maju. Sifat-sifat
fisik tersebut antara lain memiliki:
1. Daya pantul cahaya yang tinggi,
3. Daya hantar panas, dan
4. Kekuatan dan ketahanan.
Logam berat dalam keadaan padat juga dapat dibedakan berdasarkan: struktur
kristalnya, sifat pengikat kimianya, serta sifat-sifat magnitnya. Kelarutan logam berat
dalam air dan lemak merupakan suatu proses toksikologi yang amat penting, karena
proses ini adalah salah satu faktor utama yang mempengaruhi adanya proses biologi
dan penyerapan logam berat itu sendiri.
Metode analisis untuk penentuan konsentrasi logam berat yang hingga kini
paling populer digunakan adalah Spektrofotometer Serapan Atom (SSA). Adapun
prinsip kerja SSA ini pada dasarnya adalah suatu proses eksitasi, di mana dalam
proses pengatoman ini setiap logam berat memiliki penyinaran dengan panjang
gelombang yang spesifik. Kneip dan Friberg (1986) berpendapat bahwa dalam
penentuan kandungan logam berat, ada tiga hal utama yang harus diperhatikan yaitu
ketepatan, ketelitian, dan batas deteksi. Jenis pelarut kimia yang digunakan dalam
analisis logam dapat mempengaruhi hasil analisis tersebut. Rivai (2000), melaporkan
bahwa ekstraksi sampel dengan menggunakan pelarut HNO3 menghasilkan
BAB III
BAHAN DAN METODE PENELITIAN
3.1. Bahan
a. Karbon aktif
b. Na2S (aq)
c. Cu(CH3COO)2 (s)
d. Cd(CH3COO)2 (s)
e. Kertas lakmus
f. HNO3 0,1 N
3.2. Alat
a. Neraca analitik
b. Oven
c. Termometer
d. Alat-alat gelas
e. Ayakan
f. Shaker bath
3.3. Prosedur
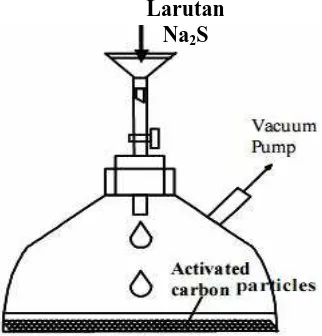
3.3.1. Impregnasi Karbon Aktif
a. Sebanyak 0,5 –1,5 g Na2S ditimbang dan kemudian dilarutkan dalam air bebas
ion hingga volume 100 ml.
b. Larutan di atas diimpregnasikan pada 10 g karbon aktif lolos ayakan 250
mesh yang telah disiapkan di dalam labu (Gambar 3.1) dan direfluks pada
temperatur 70°C dan diteruskan dengan pengadukan menggunakan pengaduk
magnetik dengan variasi waktu 4, 8, dan 12 jam.
c. Setelah itu dilakukan pemisahan dengan sentrifugasi dan endapan yang
diperoleh dicuci dengan air bebas ion hingga bersih.
d. Residu yang diperoleh dikeringkan di dalam oven pada temperatur 110°C
selama 24 jam. Bahan ini dinamakan S-karbon aktif.
Gambar 3.1. Peralatan untuk Impregnasi Karbon Aktif
3.3.2. Penyediaan Larutan Cu2+/ Cd2+(100 ppm)
A. Penyediaan larutan induk. Cu2+ (1000 ppm)
a. Ditimbang kristal Cu(CH3COO)2.H2O sebanyak 3,1665 g.
b. Dimasukkan ke dalam gelas beker berisi 50 ml akuades kemudian
diaduk hingga larut.
c. Ditambahkan HNO3(p) sebanyak 5 ml.
d. Dipindahkan ke labu takar 1 L.
e. Ditambahkan akuades hingga garis tanda.
f. Dihomogenkan.
B. Penyediaan larutan induk. Cd2+ (1000 ppm)
a. Ditimbang kristal Cd(CH3COO)2.2H2O sebanyak 2,371 g.
b. Dimasukkan ke dalam gelas beker berisi 50 ml akuades kemudian
diaduk hingga larut.
c. Ditambahkan HNO3(p) sebanyak 5 ml.
d. Dipindahkan ke labu takar 1 L.
e. Ditambahkan akuades hingga garis tanda.
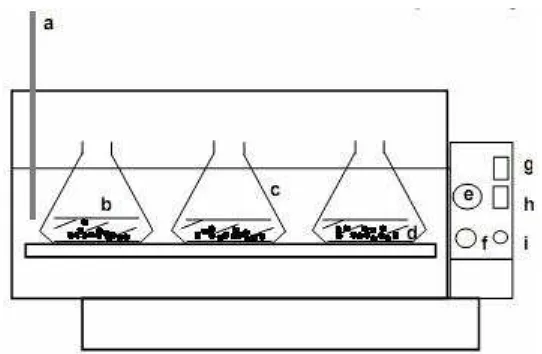
3.3.3. Pengujian Adsorpsi
a. Larutan Cu2+ konsentrasi 100 ppm sebanyak 60 ml ditempatkan dalam labu
Erlenmeyer 250 ml (Gambar 3.2).
b. Tingkat pH dijaga antara 3,5–4,0 di bawah tingkat pH di mana logam
terhidrolisa, dengan cara menambahkan setetes demi tetes HNO3 0,1 N.
c. Ke dalam labu dimasukkan pula 1 g S-karbon aktif.
d. Labu ditempatkan di dalam shaker bath pada suhu kamar dan dilakukan
penggoyangan dengan kecepatan 100 goyangan per menit dengan variasi
waktu kontak 15, 30, 45, dan 60 menit.
e. Setelah tercapai homogen, campuran didekantasi. Filtratnya dianalisis
kandungan logamnya dengan SSA.
f. Perlakuan yang sama diulang untuk pengujian adsorpsi ion Cd2+.
3.4. Skema Penelitian
3.4.1. Impregnasi Karbon Aktif
ditimbang sebanyak 10 g
disiapkan di dalam labu dengan vakum
diimpregnasi dengan larutan Na2Sdengan variasi konsentrasi 0,5 – 1,5 g/ 100 ml
direfluks pada temperatur 70°C sambil diaduk dengan variasi waktu 4, 8, dan 12 jam
disentrifugasi
endapan dicuci dengan air bebas ion
dikeringkan di dalam oven pada temperatur 110°C selama 24 jam
Karbon Aktif
Canpuran Larutan Na2S
dan Karbon Aktif
Residu
3.4.2. Adsorpsi Logam
dimasukkan dalam labu Erlenmeyer 250 ml
ditambahkan setetes asam nitrat 0,1 N
dimasukkan 0,1 g S-karbon aktif
ditempatkan di dalam shaker bath pada suhu kamar
digoyang dengan kecepatan 100 goyangan per menit dengan variasi waktu kontak 15, 30, 45, dan 60 menit
didekantasi larutan sebanyak 10 ml
dimasukkan ke dalam labu takar 100 ml, diencerkan dengan akuades
dihomogenkan
dianalisis kandungan logamnya dengan SSA
Catatan: * Perlakuan yang sama diulangi dengan mengganti larutan Cu(CH3COO)2 dengan larutan Cd(CH3COO)2 dalam pelarut air.
60 ml Cu(CH3COO)2 100 ppm*
Campuran Sampel dan S-karbon aktif
Residu Filtrat
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian dan Pengolahan Data
4.1.1. Hasil Penelitian Penetapan Kadar Logam Cu
Data hasil pengukuran dengan menggunakan spektrofotometri serapan atom
(SSA) diperoleh signal berupa absorbansi. Untuk mengetahui konsentrasi dari logam
Tembaga (II) dan Kadmium (II) yang terdapat dalam sampel maka dibuat seri larutan
standar terhadap logam Tembaga dan Kadmium yang akan ditentukan. Data
absorbansi sampel pada penetapan kadar logam Tembaga dan Cadmium sebelum
mendapat perlakuan dapat dilihat pada Tabel 4.13 dan Tabel 4.18, setelah perlakuan
dengan karbon aktif dengan waktu kontak 15, 30, 45 dan 60 menit dapat dilihat dalam
lampiran pada Tabel 4.14 s/d Tabel 4.17 dan Tabel 4.19 s/d Tabel 4.22.
4.1.1.1. Penentuan persamaan garis regresi dengan metode kurva kalibrasi
Data pengukuran absorbansi dari suatu larutan seri standar Cu (II) dapat
dilihat pada Tabel 4.11. Absorbansi dari larutan seri standar diplotkan terhadap
konsentrasi larutan standar sehingga diperoleh kurva kalibrasi berupa garis linear
seperti Gambar 4.5 pada lampiran. Persamaan garis regresi untuk kurva dapat
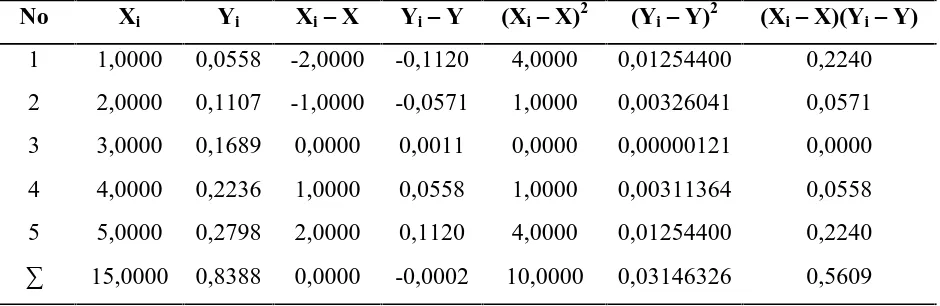
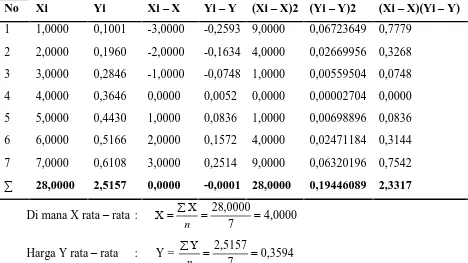
Tabel 4.1. Metode Least Square untuk Menentukan Nilai Slope, Intersep dan Koefisien Korelasi pada Penetapan Kadar Cu
No Xi Yi Xi– X Yi– Y (Xi– X)2 (Yi– Y)2 (Xi– X)(Yi– Y)
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis:
Y = aX + b
Harga intersep (b) diperoleh melalui substitusi harga (a) ke persamaan berikut
Sehingga diperoleh harga intersep (b) = -0,0005
Maka persamaan garis regresi yang diperoleh adalah:
Y = 0,0561X - 0,0005
4.1.1.2. Perhitungan koefisien korelasi
Koefisien korelasi (r) dapat ditentukan sebagai berikut:
Jadi koefisien korelasi pada penetapan kadar Cu dengan Spektrofotometri Serapan
4.1.2. Data Hasil Pengukuran Daya Serap Logam Cu
Karbon aktif yang telah diimpregnasi dengan Na2S mampu menyerap logam
Cu. Persentase daya serap dapat ditentukan dengan membandingkan konsentrasi Cu
sebelum dan sesudah penambahan karbon aktif terimpregnasi. Untuk memperoleh
kadar Cu dalam sampel maka kadar Cu yang didapat dari kurva hubungan antara
konsentrasi deret standar dengan absorbansi.harus dikoversikan terhadap faktor
pengenceran. Faktor pengenceran untuk sampel sebelum penambahan karbon aktif
adalah 20 kali sehingga konsentrasi Cu sebelum penambahan karbon aktif adalah
108,164 mg/L dan faktor pengenceran setelah penambahan karbon aktif adalah 10
kali.
Kadar Cu dapat ditentukan dengan menggunakan metode kurva kalibrasi
dengan cara mensubstitusikan nilai Y (absorbansi) yang diperoleh dari hasil
pengukuran terhadap persamaan garis regresi dari kurva kalibrasi Y = 0,0561X -
0,0005 sehingga diperoleh konsentrasi Cu.
Hasil pengukuran antara daya penyerapan oleh karbon aktif tanpa impregnasi
dan karbon aktif terimpregnasi natrium sulfida 0,5%, 1%, dan 1,5% pada waktu
kontak 15 menit terhadap konsentrasi logam Cu dalam sampel diperoleh penyerapan
optimum sebesar 75,48 % dengan impregnasi selama 8 jam oleh Na2S 1,5% dapat
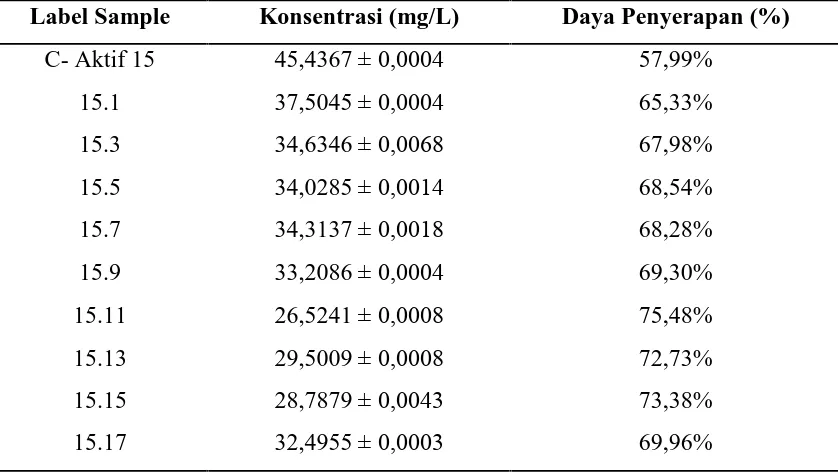
Tabel 4.2. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 15
Label Sample Konsentrasi (mg/L) Daya Penyerapan (%)
C- Aktif 15 45,4367 ± 0,0004 57,99%
15.1 37,5045 ± 0,0004 65,33%
15.3 34,6346 ± 0,0068 67,98%
15.5 34,0285 ± 0,0014 68,54%
15.7 34,3137 ± 0,0018 68,28%
15.9 33,2086 ± 0,0004 69,30%
15.11 26,5241 ± 0,0008 75,48%
15.13 29,5009 ± 0,0008 72,73%
15.15 28,7879 ± 0,0043 73,38%
15.17 32,4955 ± 0,0003 69,96%
Hasil pengukuran antara daya penyerapan oleh karbon aktif tanpa impregnasi dan
karbon aktif terimpregnasi natrium sulfida 0,5%, 1%, dan 1,5% pada waktu kontak 30
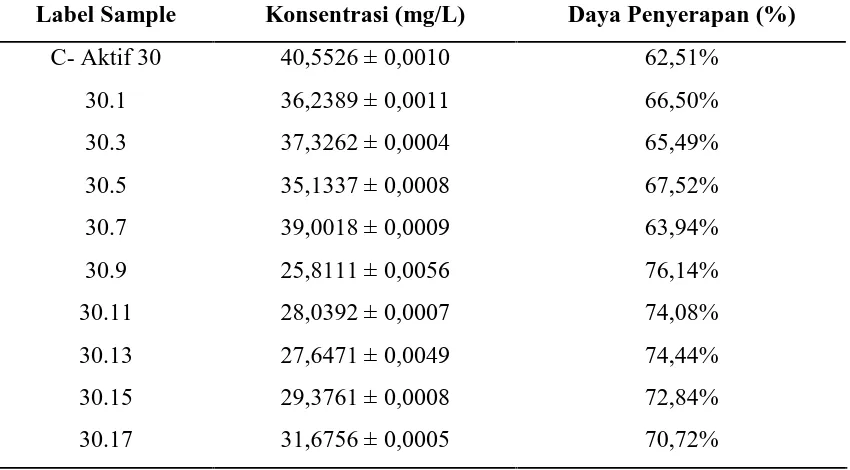
Tabel 4.3. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 30
Label Sample Konsentrasi (mg/L) Daya Penyerapan (%)
C- Aktif 30 40,5526 ± 0,0010 62,51%
30.1 36,2389 ± 0,0011 66,50%
30.3 37,3262 ± 0,0004 65,49%
30.5 35,1337 ± 0,0008 67,52%
30.7 39,0018 ± 0,0009 63,94%
30.9 25,8111 ± 0,0056 76,14%
30.11 28,0392 ± 0,0007 74,08%
30.13 27,6471 ± 0,0049 74,44%
30.15 29,3761 ± 0,0008 72,84%
30.17 31,6756 ± 0,0005 70,72%
Hasil pengukuran antara daya penyerapan logam Cu oleh karbon aktif tanpa
impregnasi dan karbon aktif terimpregnasi natrium sulfida 0,5%, 1%, dan 1,5% pada
Tabel 4.4. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 45
Label Sample Konsentrasi (mg/L) Daya Penyerapan (%)
C- Aktif 45 38,7344 ± 0,0089 64,19%
45.1 35,7754 ± 0,0004 66,92%
45.3 34,9376 ± 0,0047 67,70%
30.5 29,8039 ± 0,0041 72,45%
45.7 31,5330 ± 0,0001 70,85%
45.9 29,1979 ± 0,0008 73,01%
45.11 21,0695 ± 0,0000 80,52%
45.13 27,5223 ± 0,0042 74,56%
45.15 14,9198 ± 0,0067 86,21%
45.17 31,4795 ± 0,0006 70,90%
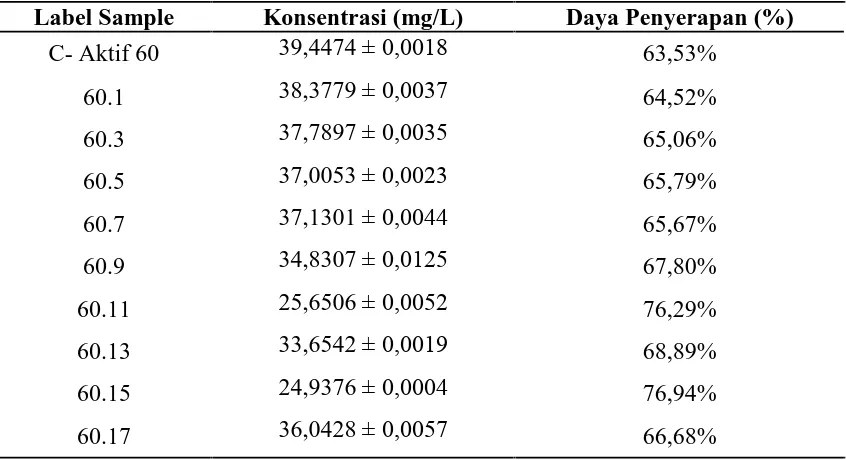
Tabel 4.5. Data Pengukuran Daya Serap Cu Setelah Perlakuan dengan C-Aktif 60
Label Sample Konsentrasi (mg/L) Daya Penyerapan (%)
C- Aktif 60 39,4474 ± 0,0018 63,53%
60.1 38,3779 ± 0,0037 64,52%
60.3 37,7897 ± 0,0035 65,06%
60.5 37,0053 ± 0,0023 65,79%
60.7 37,1301 ± 0,0044 65,67%
60.9 34,8307 ± 0,0125 67,80%
60.11 25,6506 ± 0,0052 76,29%
60.13 33,6542 ± 0,0019 68,89%
60.15 24,9376 ± 0,0004 76,94%
4.1.2.1. Perhitungan persen penurunan konsentrasi logam Cu dan Cd dalam sampel
Penurunan kadar logam Cu dalam sampel dinyatakan dalam (%) dengan
membandingkan konsentrasi logam Cu yang teradsorpsi terhadap konsentrasi awal
seperti pada persamaan berikut ini:
%
Kadar Cu yang tersisa setelah penambahan karbon aktif tanpa impregnasi serta besar
daya penyerapan karbon aktif yang telah diimpregnasi dengan Natrium sulfida dapat
dilihat pada Tabel 4.13 s/d 4.17.
Hal yang sama juga dilakukan untuk kadar logam Cd yang tersisa setelah
penambahan karbon aktif serta besar daya penyerapan karbon aktif yang telah
diimpregnasi dengan Natrium sulfida dapat dilihat pada Tabel 4.19 s/d 4.22.
4.1.3. Penetapan Kadar Cd
4.1.3.1. Penentuan persamaan garis regresi dengan metode kurva kalibrasi
Data pengukuran absorbansi dari suatu larutan seri standar Cd dapat dilihat
pada Tabel 4.12 pada lampiran. Absorbansi dari larutan seri standar diplotkan
terhadap konsentrasi larutan standar sehingga diperoleh kurva kalibrasi berupa garis
linear seperti Gambar 4.6 pada lampiran. Persamaan garis regresi untuk kurva dapat
Tabel 4.6. Metode Least Square untuk Menentukan Nilai Slope, Intersep dan Koefisien Korelasi pada Penetapan Kadar Cd
No Xi Yi Xi – X Yi – Y (Xi – X)2 (Yi – Y)2 (Xi – X)(Yi – Y)
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis:
Y = aX + b
Sehingga diperoleh harga slope (a) = 0,0833
0,0263
Sehingga diperoleh harga intersep (b) = 0,0263
Maka persamaan garis regresi yang diperoleh adalah:
Y = 0,0833X + 0,0263
4.1.3.2. Perhitungan koefisien korelasi
Koefisien korelasi (r) dapat ditentukan sebagai berikut:
Jadi koefisien korelasi pada penetapan kadar Cd dengan Spektrofotometri Serapan
Atom adalah (r) = 0,9993.
Absorbansi dari larutan seri standar diplotkan terhadap konsentrasi larutan
standar sehingga diperoleh kurva kalibrasi berupa garis linear.