PENGARUH PENCUCIAN BERULANG BERAS RAMOS IR-64 TERHADAP KADAR KARBOHIDRAT, SERAT DAN
PROTEIN DARI NATA DE ORIZA
SKRIPSI
NESTI HERAWATY. S 050812015
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH PENCUCIAN BERULANG
BERAS RAMOS IR-64 TERHADAP KADAR KARBOHIDRAT, SERAT DAN PROTEIN DARI NATA DE ORIZA
Kategori : SKRIPSI
Nama : NESTI HERAWATY. S
Nomor Induk Mahasiswa : 050812015
Program Studi : SARJANA (S1) KIMIA EKSTENSI
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU
PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA Disetujui di
Medan, November 2007 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Rumondang Bulan Nasution, MS Dra. Emma Zaidar Nasution, Msi NIP . 131 459 466 NIP . 131 653 985
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH PENCUCIAN BERULANG BERAS RAMOS IR-64 TERHADAP KADAR KARBOHIDRAT, SERAT DAN
PROTEIN DARI NATA DE ORIZA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, November 2007
PENGHARGAAN
Syukur Alhamdulillah penulis haturkan atas kehadirat ALLAH SWT yang telah banyak melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul :
1. Ibu Dra. Emma Zaidar. Nst. MSi selaku dosen pembimbing I dan Ibu DR. Rumondang Bulan. Nst. MS selaku dosen pembimbing II yang telah memberikan pengarahan kepada penulis hingga selesainya skripsi ini. “Pengaruh Pencucian Berulang Beras Ramos IR-64 Terhadap Kadar Karbohidrat,
Serat dan Protein Dari Nata de Oriza”
Selanjutnya penulis menyampaikan penghargaan dan rasa cinta yang Tulus dan Ikhlas atas doa restu dari Ayahanda H. Ir. Seman Soedigdo dan Ibunda Hj. Ratini Zamani yang telah memberikan dukungan moril, materil dan doanya yang Tulus dan Ikhlas kepada penulis. Terima kasih juga penulis kepada mbak Imai, mbak Tutut, dan adikku tersayang Fadly serta seluruh keluargaku yang selama ini memberikan dukungan dan doanya kepada penulis.
Dan selama penulis menyelesaikan penelitian dan skripsi ini, penulis juga mendapatkan bantuan dari banyak pihak. Maka dari itu penulis ingin menyampaikan rasa terima kasih kepada :
2. Ibu DR. Rumondang Bulan. Nst. MS dan Bapak Drs. Firman Sebayang. MS selaku Ketua dan Sekertaris Departemen Kimia FMIPA USU yang telah mensyakan skripsi ini.
3. Ibu Dra. Emma Zaidar. Nst. MSi selaku Kepala Laboratorium Biokimia FMIPA USU yang telah memberikan fasilitas selama penulis melakukan penelitian.
4. Bapak Zul Alkaf. Bsc selaku Kepala Laboratorium PT. Palmcoco (PCL) yang telah memberikan ilmu dan doanya selama ini.
5. Bapak Drs. Saut Nainggolan selaku dosen pembimbing penulis terdahulu, yang telah memberikan semangat kepada penulis.
7. Kawan-kawan seperjuangan dengan penulis K’vivin, K’yani, K’dian, K’ina, K’ayu, K’halimah, K’ipeh, K’sri, K’ela, K’lia, Mino, Awen, Ipol Paka’04, Intan Kimia S-1’03 serta semua anak PAKA’02 dan Ekstensi Kimia’05 yang tidak dapat penulis ucapkan satu-persatu. Terima kasih 8. Abangku yang jauh Syaiful Ramadhan, terima kasih atas doanya dan
terima kasih karena telah kembali.
9. Seluruh keluarga besar Laboratorium Palmcoco (PCL).
10.Kak Via, Kak Vika, Kak Purnama, Bang Edi selaku staf FMIPA jurusan Kimia serta Uma, Jelita, Nurhidayah, Wiwi, Budi, Mona, Ika, Ina, dan Arsyad selaku asisten Lab. Biokim. Terima kasih.
Untuk itu semua semoga ALLAH SWT memberikan balasan kebaikan yang berlipat ganda. Amin.
Akhirnya penulis menyadari atas kekurangan materi yang disajikan dalam skripsi ini, disebabkan keterbatasan literatur dan juga pengetahuan yang minim yang dimiliki penulis.
Dengan kerendahan hati, penulis mempersembahkan skripsi ini kepada para pembaca, semoga ada manfaatnya.
Medan, September 2007 Penulis,
ABSTRAK
Penentuan kadar karbohidrat, serat dan protein dari nata de oriza pada pencucian beras ramos IR-64 secara berulang telah dilakukan.
THE INFLUENCE OF RAMOS IR-64 RICE WASHED CONTINUELY AT THE CARBOHYDRATE CONTENT FIBER AND PROTEIN FROM THE
NATA DE ORIZA
ABSTRACT
DAFTAR ISI
Halaman
PERSETUJUAN ii
PERNYATAAN iii
PENGHARGAAN iv
ABSTRAK vi
ABSTRACK vii
DAFTAR ISI viii
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR SINGKATAN xiii
BAB I PENDAHULUAN 1
1.1.Latar Belakang 1
1.2.Permasalahan 2
1.3.Pembatasan Masalah 2
1.4.Tujuan Penelitian 2
1.5.Manfaat Penelitian 2
1.6.Lokasi Penelitian 3
1.7.Metodologi Penelitian 3
BAB II TINJAUAN PUSTAKA 5
2.1. Padi (Oryza Sativa. L) 5
2.1.1. Beras 5
2.1.2. Amilum 7
2.2. Nata 9
2.2.1. Jenis Bakteri Pembentuk Nata (Acetobacter xylinum) 9
2.2.2. Aktivitas Pembentuk Nata 11
2.3. Karbohidrat 11
2.3.1. Analisis Karbohidrat 12
2.4. Protein 12
2.4.1. Analisis Protein 12
2.4.1.1. Tahap Destruksi 12
2.4.1.2. Tahap Destilasi 13
2.4.1.3. Tahap Titrasi 13
2.5. Lemak 14
2.5.1. Analisis Lemak 14
2.6. Air 15
2.6.1. Analisis Air 15
2.7. Abu 15
2.7.1. Analisis Abu 16
2.8. Serat 16
BAB III BAHAN DAN METODE PENELITIAN 18
3.1. Pengambilan Sampel 18
3.2. Bahan dan Alat yang digunakan 18
3.2.1. Bahan-bahan 18
3.2.2. Alat-alat 19
3.3. Prosedur Penelitian 20
3.3.1. Pembuatan Buffer Asetat 0,2 M pH 4 20
3.3.2. Pembuatan Reagen 21
3.3.3. Pembuatan Starter 23
3.3.4. Pembuatan Nata de Oriza 23
3.3.5. Penentuan Kadar Protein 24
3.3.6. Penentuan Kadar Lemak 24
3.3.7. Penentuan Kadar Air 25
3.3.8. Penentuan Kadar Abu 25
3.3.9. Penentuan Kadar Karbohidrat 25
3.3.10. Penentuan Kadar Serat 25
3.4. Bagan Penelitian 27
3.4.1. Pembuatan Starter Air Kelapa 27
3.4.2. Pembuatan Nata de Oriza 28
3.4.3. Penetapan Kadar Protein 29
3.4.4. Penetapan Kadar Lemak 30
3.4.5. Penetapan Kadar Serat 31
3.4.6. Penetapan Kadar Air 32
3.4.7. Penetapan Kadar Abu 33
3.4.8. Penetapan Kadar Karbohidrat 33
BAB IV HASIL DAN PEMBAHASAN 34
4.1. Hasil Penelitian 34
4.2. Pengolahan Data 40
4.2.1. Perhitungan Kadar Protein 40
4.2.2. Perhitungan Kadar Lemak 40
4.2.3. Perhitungan Kadar Air 41
4.2.4. Perhitungan Kadar Abu 41
4.2.5. Perhitungan Kadar Karbohidrat 42
4.2.6. Perhitungan Kadar Serat 42
4.3. Uji statistik anova dengan metode rancangan
acak lengkap 43
4.4. Pembahasan 46
4.4.6. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Karbohidrat 48
BAB V KESIMPULAN DAN SARAN 49
5.1. Kesimpulan 49
5.2. Saran 49
DAFTAR PUSTAKA 50
LAMPIRAN 51
DAFTAR TABEL
Halaman Tabel 4.1.1. Data Hasil Pengukuran Volume Titran (HCl 0,01N) 34 Tabel 4.1.2. Data Hasil Pengukuran Kadar Protein Nata de Oriza 35 Tabel 4.1.3. Data Hasil Pengukuran Kadar Serat Nata de Oriza 36 Tabel 4.1.4. Data Hasil Pengukuran Kadar Lemak Nata de Oriza 37 Tabel 4.1.5. Data Hasil Pengukuran Kadar Air Nata de Oriza 38 Tabel 4.1.6. Data Hasil Pengukuran Kadar Abu Nata de Oriza 39 Tabel 1. Data Hasil Pengukuran Kadar Protein (%) Pada
Nata de Oriza 52
Tabel 2. Data Hasil Pengukuran Kadar Lemak (%) Pada
Nata de Oriza 52
Tabel 3. Data Hasil Pengukuran Kadar Serat (%) Pada
Nata de Oriza 52
Tabel 4. Data Hasil Pengukuran Kadar Air (%) Pada
Nata de Oriza 53
Tabel 5. Data Hasil Pengukuran Kadar Abu (%) Pada
Nata de Oriza 53
Tabel 6. Data Hasil Pengukuran Kadar Karbohidrat (%) Pada
Nata de Oriza 53
Tabel 7. Data Hasil Pengukuran Kadar Protein, Lemak, Serat, Air, Abu Dan Karbohidrat Pada Pembuatan Nata de Oriza 53 Tabel. 8 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian
Beras Pertama Kedua dan Ketiga Terhadap Kadar Protein
Nata de Oriza 54
Tabel. 9 Daftar Anova Untuk Kadar Protein 54
Tabel. 10 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Lemak
Nata de Oriza 54
Tabel. 11 Daftar Anova Untuk Kadar Lemak 55
Tabel. 12. Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Serat
Nata de Oriza 55
Tabel 13. Daftar Anova Untuk Kadar Serat 55
Tabel. 14 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Abu
Nata de Oriza 56
Tabel. 15 Daftar Anova Untuk Kadar Abu 56
Tabel. 16 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Air
Nata de Oriza 56
Tabel. 17 Daftar Anova Untuk Kadar Air 57
Tabel. 18 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Karbohidrat
Nata de Oriza 57
Tabel. 19 Daftar Anova Untuk Kadar Karbohidrat 57
DAFTAR GAMBAR
DAFTAR SINGKATAN
- FK : Faktor Koreksi
- JK : Jumlah Kuadrat
- DB : Derajat Bebas
- KT : Kuadrat Tengah
- Tij : Total Seluruh Data
- T (Yi)2 : Data Hasil Pengamatan
- TA : Total Perlakuan
- r : Banyak Ulangan
- t : Banyak Perlakuan
ABSTRAK
Penentuan kadar karbohidrat, serat dan protein dari nata de oriza pada pencucian beras ramos IR-64 secara berulang telah dilakukan.
THE INFLUENCE OF RAMOS IR-64 RICE WASHED CONTINUELY AT THE CARBOHYDRATE CONTENT FIBER AND PROTEIN FROM THE
NATA DE ORIZA
ABSTRACT
BAB I
PENDAHULUAN
1.1.Latar Belakang
Beras merupakan bahan makanan pokok yang dihasilkan dari padi (Oryza sativa.L) yang sangat penting dalam menu makanan Indonesia. Sebagai bahan makanan pokok, beras menghasilkan beberapa keuntungan. Selain dengan rasanya yang netral, beras setelah dimasak memberikan kandungan kalori yang cukup tinggi ; serta dapat memberikan zat gizi lain yang penting bagi tubuh, seperti halnya protein dan beberapa jenis mineral (Moehyi. S, 1992).
Selain itu, beras juga merupakan makanan sumber karbohidrat yang utama dikebanyakan negara-negara Asia. Negara-negara lain seperti di Eropa, Australia, dan Amerika mengkonsumsi beras dalam jumlah yang jauh lebih sedikit dari pada negara Asia. Selain dari pada beras yang bermanfaat untuk bahan makanan, jerami padi juga dapat digunakan sebagai penutup tanah pada suatu usaha tani (http://72.14.235.104/search?q=cache:warintek.ristek.go.id/pertanian/padi.htm).
Namun pada umumnya saat memasak beras, air cuciannya sering sekali dibuang begitu saja oleh masyarakat. Sedangkan, seperti yang kita ketahui bahwasanya pada air cucian beras tersebut masih ada terkandung karbohidrat yang tersuspensi ketika pencucian, begitu juga dengan dedak (abu) yang tadinya masih menyelimuti beras ikut terbuang. Karbohidrat yang terbuang itu oleh mikroorganisme akan dirombak menjadi produk yang lebih sederhana. Tetapi, jika mikroorganisme tersebut sudah tidak mampu merombaknya maka akan menimbulkan aroma yang kurang sedap (Rahman. A, 1992).
menghasilkan produk nata de oriza yang berkualitas dan bernilai ekonomis dengan tetap mempertahankan nilai gizinya.
1.2.Permasalahan
Di Indonesia, umumnya masyarakat saat memasak beras air cuciannya sering dibuang begitu saja, sebenarnya masih ada karbohidrat yang tersuspensi dari air cucian beras yang terbuang tersebut. Berdasarkan hal itu, timbul permasalahan. Apakah air cucian beras tersebut dapat diolah menjadi suatu makanan berupa nata de oriza. Penulis juga ingin memvariasikan air cucian beras tersebut, hingga diperoleh nata de oriza yang terbaik dari air cucian beras yang dilakukan secara berulang dan mengetahui berapa kadar karbohidrat, serat kasar dan protein dari nata de oriza yang dihasilkan.
1.3.Pembatasan Masalah
Karena luasnya permasalahan dalam pemanfaatan air cucian beras, maka dalam penelitian ini objek masalah dibatasi sebagai berikut :
1. Residu air cucian beras diperoleh dari pencucian berulang beras Ramos IR 64.
2. Beras Ramos IR 64 diperoleh dari satu lokasi yang sama, yaitu pasar pagi padang bulan dan memvariasikan pada perlakuan pencuciannya.
3. Parameter yang dianalisa adalah : Karbohidrat, Serat kasar dan Protein dari pembuatan nata de oriza.
1.4.Tujuan Penelitian
Tujuan penelitian ini adalah : untuk mengetahui berapakah kadar karbohidrat, serat kasar dan kadar protein pada pembuatan nata de oriza.
1.5.Manfaat Penelitian
pangan atau Standart Nasional Indonesia (SNI) tentang nata de oriza, bukan hanya untuk nata de coco.
1.6.Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia/KBM dan Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Teknologi Hasil Pertanian (THP) Fakultas Pertanian Universitas Sumatera Utara.
1.7.Metodologi Penelitian
Penelitian ini adalah eksperimen laboratorium, menggunakan metode statistik secara ANOVA. Sampel berupa air cucian beras yang diambil dari beras dengan pencucian berulang dari beras ramos IR-64, yang diambil secara acak di pasar pagi padang bulan.
Dimana langkah-langkah yang dilakukan untuk proses analisanya adalah sebagai berikut :
1. Air cucian beras yang diambil sebanyak 3 x pencucian (dengan pencucian berulang) pada satu jenis beras, dengan varietas beras IR-64. Yang diperoleh dari Pasar Pagi Padang Bulan-Medan.
2. Analisa kadar protein ditentukan dengan metode Kjeldahl.
3. Analisa kadar lemak ditentukan dengan cara ekstraksi dengan alat sokhlet. 4. Analisa kadar karbohidrat ditentukan dengan menghitung selisih antara
100% dengan kadar protein, lemak, abu, serat dan air.
5. Penetuan kadar air dilakukan dengan metode pengeringan didalam oven pada suhu antara 100 – 105°C.
6. Penentuan kadar abu dilakukan dengan metode pengabuan didalam tanur pada suhu 500°C.
7. Penentuan kadar serat metode pendelignifikasian.
8. Dalam penelitian ini ada beberapa variable yang digunakan :
a). Variabel bebas adalah variabel yang mempunyai pengaruh terhadap ketebalannya, yaitu :
b). Variabel tetap adalah variabel yang dibuat tetap agar tidak menyebabkan terjadinya perubahan pada variabel terikat. Yang menjadi variable tetap dalam penelitian ini adalah :
- pH fermentasi yaitu pH 4
c). Variabel terikat, yaitu variabel yang terukur terhadap perubahan perlakuan.
Dalam penelitian ini yang menjadi variabel terikat, yaitu : - Kadar protein
- Kadar lemak - Kadar air - Kadar abu
BAB 2
TINJAUAN PUSTAKA
2.1. Padi (Oryza sativa. L)
Golongan kelas padi seperti beras, jagung atau gandum merupakan bagian terbesar (± 60% - 80%) dari susunan pangan penduduk yang tinggal dinegara-negara Asia Tenggara. Bahkan makanan tersebut adalah sumber karbohidrat yang baik dan karena itu juga merupakan sumber kalori (tenaga). Bahan makanan tersebut juga merupakan sumber protein yang berguna, sebab 6 – 12% dari semua padi-padian biasanya terdiri dari protein. Sebagian dari jenis padi juga mengandung beberapa mineral dan beberapa vitamin yang dikenal sebagai vitamin B kompleks. Khususnya butir padi-padian yang utuh merupakan sumber besi, thiamin, riboflavin dan niasin (Suhardjo. et al, 1985).
Berikut ini merupakan taksonomi dari padi, yaitu : Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Monocotyledone Subkelas : Commelinidae Order : Glumiflorae
Family : Gramineae/Poaceae Subfamily : Oryzoideae
Tribus : Oryzeae
Species : Oryza sativa. L (Burns. G. W, 1974).
2.1.1. Beras
dan beberapa mineral. Berikut ini ditampilkan bentuk dari beras dengan varietas IR 64 :
Sumber : http://id .wikipedia.org/wiki/Beras
Berikut ini merupakan Standart beras berdasarkan panjang dan bentuk bijinya :
Sumber : Webb, 1980 dalam Darmardjati dan Endang Y. Purwarni, 1991. Beras secara biologi adalah bagian biji padi yang terdiri dari :
• aleuron, lapis terluar yang sering kali ikut terbuang dalam proses pemisahan kulit.
• endospermia, tempat sebagian besar pati dan protein beras berada, dan
• embrio, yang merupakan calon tanaman baru (dalam beras tidak dapat tumbuh lagi, kecuali dengan bantuan teknik kultur jaringan). Dalam bahasa sehari-hari embrio disebut dengan mata beras.
Ukuran Skala USDA
Beras pecah kulit Beras giling Panjang (mm)
Sangat panjang Panjang
Sedang Pendek
Bentuk (panjang : lebar)
Lonjong Sedang Agak bulat Bulat
7,5 6,61-7,5 5,51-6,60
5,51
3,0 2,1-3,0
2,1 -
7,00 6,00-6,99 5,50-5,99
5,00
3,0 - 2,0-3,0
Sebagaimana bulir serealia lain, bagian terbesar beras didominasi oleh pati (sekitar 80 – 85%). Beras juga mengandung protein, vitamin (terutama pada bagian aleuron), mineral, dan air.
Pati beras dapat digolongkan menjadi dua kelompok :
• amilosa, pati dengan sturuktur tidak bercabang
• amilopektin, pati dengan sturuktur bercabang (http://www.wikipedia.org/wiki/Beras.htm).
2.1.2. Amilum
Amilum atau dalam bahasa sehari-hari disebut pati. Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak terlarut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan α -(1,4)-D-glukosa, sedang amilopektin mempunyai cabang dengan ikatan α -(1,4)-D-glukosa sebanyak 4 – 5 % dari berat total. Berikut tampak bentuk dari pada pati beras, yaitu :
(Winarno. F. G, 1997)
Pada umumnya butir-butir padi tidak larut dalam air dingin, tetapi apabila suspensi dalam air dipanaskan akan terjadi suatu larutan koloid yang kental. Larutan koloid ini apabila diberi larutan iodium akan berwarna biru. Warna biru tersebut disebabkan oleh molekul amilosa yang membentuk senyawa. Sedangkan amilopektin dengan iodium akan memberikan warna ungu atau merah lembayung.
n C
Glukosa
Glukosa merupakan suatu aldoheksosa dan sering disebut dekstrosa karena mempunyai sifat dapat memutar cahaya terpolararisasi kearah kanan. Pada dasarnya amilum terbentuk dari glukosa yang membentuk rantai lurus maupun bercabang dengan melepaskan molekul air.
6H12O6 (C6H10O5) + n H2O
glukosa amilum
Didalam dunia perdagangan glukosa dikenal dengan nama sirup glukosa, dimana sirup glukosa ini diperoleh dari amilum melalui proses hidrolisis dengan asam. Berikut ditampilkan siklus perubahan glukosa menjadi selulosa :
Glukosa – 6P
(Fosfoglukomutase) Glukosa
ATP ADP
Glukosa – 1p UTP P UDP – Glukosa
Glikolipid
Lipid
( β 1,4 D – Glukosa )n Sellulosa
Gambar Mekanisme pembentukan sellulosa oleh Acetobacter Xylinum (Hassid, 19970, dalam Wahyudi Alamsyah, 2002)
2.2. Nata
Nata pada umumnya merupakan produk hasil fermentasi yang menggunakan bakteri Acetobacter Xylinum dan memiliki bentuk padat, berwarna putih seperti kolang-kaling dengan kandungan air yang cukup tinggi (Suryani. A. et al, 2005).
Dibawah mikroskop nata tampak sebagai massa benang melilit yang sangat banyak seperti benang-benang kapas. Kekenyalan nata biasanya tergantung dari kondisi yang ada selama nata itu dibuat. Nata memiliki serat yang tinggi, baik untuk sistem pencernaan, rendah kalori dan tidak mengandung kolesterol (Hidayat. N. et al, 2006).
Selain merupakan biomassa yang dapat membuat nata tampak berbentuk agar dan berwarna putih, massa ini juga berasal dari pertumbuhan Acetobacter xylinum pada permukaan media cair yang asam dan mengandung gula. Sebagai bahan makanan berserat, nata memiliki kandungan selulosa ± 2,5% dan lebih dari 95 kandungan air (Palungkun. R, 1992).
Menurut suatu badan penelitian dari Balai Mikrobiologi dan Puslitbang Biologi LIPI menyatakan bahwa “ didalam 100 gram nata ada terkandung nutrisi-nutrisi antara lain : Kalori 146 kal, Lemak 0,2 %, Karbohidrat 36,1 mg, Ca 12 mg, Fosfor 2 mg, dan Fe 0,5 mg. Nata juga mengandung air yang cukup banyak yakni sekitar 80 %, disamping itu juga nata dapat disimpan dalam waktu yang cukup lama
(http://jatim.litbang.deptan.go.id/index.php?option=comcontent&task=view&id=1 62&itemid=72).
2.2.1. Jenis Bakteri Pembentuk Nata (Acetobacter xylinum)
Bakteri pembentuk nata termasuk kedalam golongan Acetobacter, yang mempunyai ciri-ciri antara lain :
“ Sel bulat panjang sampai batang (seperti kapsul), tidak mempunyai endospora, sel-selnya bersifat gram negatif, bernafas secara aerob, dapat mengoksidasi etanol menjadi asam asetat, dan lain sebagainya” (Pelczar dan Chan, 1988).
khas mempunyai bentuk sigmoid dan dapat dibedakan dalam beberapa tahap pertumbuhan, yang muncul secara teratur, sangat atau kurang menonjol: tahap ancang – ancang (lag-phase), tahap eksponensial (logaritmik), tahap stasioner dan tahap menuju kematian.
Untuk lebih jelasnya dapat diperhatikan bentuk kurva pertumbuhan mikroorganisme tersebut :
(Hans. G, 1994).
Bakteri Acetobacter xylinum yang berbentuk kapsul biasanya dapat berkembang dengan adanya medium yang mengandung karbohidrat, dan merupakan jenis yang sederhana yakni homopolysakarida yang berisi 1 monomer. Acetobacter xylinum merupakan contoh untuk sebuah kapsul selulosa, yang hanya mempunyai 1 jenis ikatan ( β 1 – 4 rantai glukosa ). Untuk lebih jelasnya dapat diperhatikan susunan unit selulosa yang ditemukan sebagai kapsul Acetobacter xylinum :
2.2.2. Aktivitas Pembentuk Nata
Aktivitas pembentukan nata berada pada kisaran pH antara 3,5 – 7,5. Asam asetat glasial ditambahkan kedalam medium untuk menurunkan pH medium yang optimum yaitu 4. Sedangkan, suhu yang sangat memungkinkan terjadinya pembentukan nata dengan baik adalah pada suhu kamar antara 28–32°C Fermentasi nata dilakukan melalui tahap-tahap berikut :
1). Pemeliharaan biakan murni Acetobacter xylinum
Fermentasi nata memerlukan biakan murni Acetobacter xylinum.
Biakan murni ini harus dipelihara sehingga dapat digunakan setiap saat diperlukan.
2). Pembuatan Starter
Starter merupakan populasi mikroba dalam jumlah dan kondisi fisiologis yang siap diinokulasikan pada media fermentasi. Mikroba pada starter tumbuh dengan cepat dan fermentasi segera terjadi. Starter baru dapat digunakan 6 hari setelah diinokulasikan dengan biakan murni.
3). Fermentasi
Dilakukan pada media cair yang telah dinokulasikan dengan starter. Fermentasi ini berlangsung pada kondisi aerob, lalu fermentasi akan diteruskan sampai nata yang diperoleh hasilnya cukup tebal, dengan ketebalan natanya sekitar 1,0 – 1,5 cm. (http://www.ristek.go.id.Tek+Tepat+Guna+Agroindustri+Kecil/Sumbar.htm).
2.3. Karbohidrat
Karbohidrat banyak terdapat dalam bahan nabati, baik berupa gula sederhana, heksosa, pentosa, maupun karbohidrat dengan berat molekul yang tinggi seperti pati, pectin, selulosa dan lignin. Sumber karbohidrat utama bagi bahan makanan kita adalah umbi-umbian. Misalnya kandungan pati dalam beras = 78,3%, jagung = 72,4%, singkong = 34,6%, dan talas = 40%.
2.3.1. Analisis Karbohidrat
Ada beberapa cara analisis yang dapat digunakan untuk memperkirakan kandungan karbohidrat dalam bahan makanan. Yang paling mudah adalah dengan cara perhitungan kasar (proximate analysis) atau juga disebut Carbohydrate by Difference. Yang dimaksud dengan proximate analysis adalah suatu analisis dimana kandungan karbohidrat termasuk serat kasar diketahui bukan melalui analisis tetapi melalui perhitungan, sebagai berikut :
% Karbohidrat = 100% - % ( Protein + Lemak + Air + Abu + Serat ) Perhitungan Carbohydrate by Difference adalah penentuan karbohidrat dalam bahan makanan secara kasar, dan hasilnya ini biasnya dicantumkan dalam daftar komposisi bahan makanan (Winarno. F. G, 1997).
2.4. Protein
Didalam tubuh protein berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pembangun dan pengatur. Protein adalah sumber asam amino yang mengandung unsur-unsur C, H, O, dan N yang tidak dimiliki oleh lemak atau karbohidrat. Protein dapat juga mengganti jaringan tubuh yang rusak dan yang perlu dirombak. Fungsi utama protein bagi tubuh adalah untuk membentuk jaringan baru dan mempertahankan jaringan yang telah ada.
2.4.1. Analisis Protein
Penentuan protein berdasarkan jumlah N menunjukkan protein kasar karena selain protein juga terikut senyawaan N bukan protein misalnya : urea, ammonia, nitrat, nitrit, asam amino, amida, purin dan pirimidin. Penentuan cara ini yang paling terkenal adalah cara Kjeldahl yang dalam perkembangannya terjadi berbagai modifikasi misalnya oleh Gunning dan sebagainya. Analisa protein cara Kjeldahl pada dasarnya dapat dibagi menjadi tiga tahapan yaitu proses destruksi, proses destilasi dan tahap titrasi.
2.4.1.1. Tahap Destruksi
CO, CO2, dan H2O. Sedangkan nitrogennya (N) akan berubah menjadi (NH4)2SO4. Asam sulfat yang dipergunakan untuk destruksi diperhitungkan adanya bahan protein, lemak dan karbohidrat.
Untuk mempercepat proses destruksi sering ditambahkan katalisatr berupa Selenium (Se). Selenium dapat mempercepat proses oksidasi karean zat tersebut selain menaikkan titik didih juga mudah mengadakan perubahan dari valensi tinggi ke valensi rendah atau sebaliknya. Dengan adanya penambahan katalisator Se tersebuttitik didih asam sulfat akan dipertinggi sehingga destruksi berjalan lebih cepat. Suhu destruksi berkisar antara 37- - 410°C. Proses destruksi akan selesai, apabila larutan sudah tidak berwarna lagi (jernih).
2.4.1.2. Tahap Destilasi
Pada tahap destilasi, ammonium sulfat dipecah menjadi ammonia (NH3
% 100 008 , 14 .
1000 ) (
) (
% xNHClx x
x g l beratsampe
blanko sampel
mlHCl
N = −
) dengan penambahan NaOH sampai alkalis dan dipanaskan. Ammonia yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar. Asam standar yang dipakai adalah asam khlorida atau asam borat 3% dalam jumlah yang berlebihan. Untuk mengetahui asam dalam keadaan berlebih maka diberi indikator misalnya BCG + MR (Tashiro) atau PP. Destilasi diakhiri bila sudah semua ammonia terdestilasi sempurna dengan ditandai destilat tidak bereaksi basis.
2.4.1.3. Tahap Titrasi
Pada tahap titrasi ini, penampung destilat yang digunakan adalahasam borat maka banyaknya asam borat yang bereaksi dengan ammonia dapat diketahui dengan titrasi menggunakan asam khlorida 0,1 N dengan indikator (BCG + MR). Akhir titrasi ditandai dengan perubahan warna larutan dari biru menjadi merah muda. Selisih jumlah titrasi sampel dan blanko merupakan jumlah ekuivalen nitrogen.
% P = % N x Faktor konversi (Sudarmadji. S. et al, 1989).
Reaksi penentuan kadar protein metode Kjeldahl : - Tahap Destruksi
Se
(C, H, O, N)n + H2SO4(p) (NH4)2SO4 + SO2 (g) CO2 (g) + H2
(NH
O Larutan kuning bening
- Tahap Destilasi
dipanaskan
4)2SO4 + 2 NaOH Na2SO4 + 2 NH4 NH
OH dipanaskan
4OH NH3(g) + H2 NH
O dipanaskan
3(g) NH
2 NH
3(l) Tashiro
3(l) + 4 H3BO3 (NH4)2B4O7 + 5 H2
(NH
O Larutan hijau muda
- Tahap Titrasi
4)2B4O7 + 2 HCl 2 NH4Cl + H2B4O7 + 5 H2
Yang dipergunakan disini adalah cara terputus-putus dengan alat Soxhlet. Pelarut yang digunakan sebanyak 1½ - 2 kali isi tabung ekstraksi. Pada akhir ekstraksi yaitu kira-kira 4 – 6 jam ekstrak dituang kedalam botol timbang atau cawan porselen yang telah diketahui beratnya, kemudian pelarut diuapkan diatas
O Larutan merah jambu
2.5. Lemak
Untuk penentuan kadar lemak ini, sampel yang masih dalam keadaan basah harus dikeringkan terlebih dahulu. Dengan cara, bahan dibungkus atau ditempatkan dalam thimble, kemudian dikeringkan dalam oven untuk menghilangkan airnya. Dengan oven vakum pada suhu 70°C. Dimana ekstraksi lemak dapat dikerjakan dengan dua cara, yakni secara terputus-putus dan bersinambungan.
penangas air sampai pekat. Selanjutnya dikeringkan dalam oven sampai diperoleh berat konstan pada suhu 100°C. Berat residu dalam botol timbang dinyatakan sebagai berat lemak. Selisih berat sebelum dengan sesudah ekstraksi merupakan berat lemak yang ada dalam bahan tersebut.
2.6. Air
Meskipun sering diabaikan, air merupakan salah satu unsur penting dalam bahan makanan. Air sendiri meskipun bukan merupakan sumber nutrient bahan makanan lain, namun sangat esensial dalam kelangsungan proses biokimiawi organisme hidup (Sudarmadji. S. et al. 1989).
Air juga berfungsi sebagai bahan yang dapat mendisperrsi berbagai senyawa yang ada dalam bahan makanan. Untuk beberapa bahan malah berfungsi sebagai pelarut. Air juga dapat melarutkan berbagai bahan seperti garam, vitamin yang larut dalam air, mineral dan senyawa-senyawa cita rasa seperti yang terkandung dalam teh dan kopi (Winarno. F. G. 1997).
2.6.1. Analisa Air
Salah satu cara yang dipakai untuk menentukan banyaknya kadar air dalam bahan makanan dapat ditentukan dengan metode pengeringan (Thermogravimetri). Dimana prinsipnya adalah menguapkan air yang ada dalam bahan makanan dengan jalan pemanasan. Lalu menimbang bahan hingga diperoleh berat yang konstan yang berarti semua air sudah diuapkan. Cara ini merupakan salah satu cara yang relative mudah dalam pengerjaanya dan murah biayanya.
2.7. Abu
2.7.1. Analisa Abu
Penentuan kadar abu adalah dengan mengoksidasi semua zat organic pada suhu yang tinggi, yakni sekitar 500 - 600° dan kemudian melakukan penimbangan zat yang tertinggal setelah proses pembakaran tersebut. Bahan dengan kadar air yang tinggi sebelum pengabuan harus dikeringkan lebih dahulu. Lamanya pengabuan tiap bahan berbeda-beda dan berkisar antara 2 – 8 jam. Dimana pengabuan akan dianggap selesai apabila diperoleh sisa pengabuan yang umumnya berwarna putih abu-abu dan beratnya konstan dengan selang waktu pengabuan 30 menit.
2.8. Serat
Serat kasar mengandung senyawa selulosa, lignin dan zat lain yang belum dapat diidentifikasi dengan pasti. Yang disebut serat kasar disini adalah senyawaan yang tidak dapat dicerna dalam organ pencernaan manusia ataupun binatang.
Didalam analisa penentuan serat kasar diperhitungkan banyaknya zat-zat yang tak larut dalam asam encer ataupun basa encer dengan kondisi tertentu.
Langkah- langkah yang dilakukan dalam analisa adalah :
1. defatting, yaitu menghilangkan lemak yang terkandung dalam sampel menggunakan pelarut lemak.
2. digestion, terdiri dari dua tahapan yaitu pelarutan dengan asam dan basa. Kedua macam proses digesti ini dilakukan dalam keadaan tertutup pada suhu terkontrol (mendidih) dan sedapat mungkin dihilangkan dari pengaruh luar.
2.9. Syarat Mutu
Syarat mutu merupakan hal yang sangat penting dalam menentukan kualitas nata pada umumnya di perdagangan Internasional.
No Jenis Uji Satuan Persyaratan
1 Keadaan :
1.1 Bau - Normal
1.2 Rasa - Normal
1.3 Warna - Normal
1.4 Tekstur - Normal
2 Bahan asing - Tidak boleh ada
3 Bobot tuntas % Min 50
4 Jumlah gula (dihitung sebagai sakarosa)
% Min 15
5 Serat makanan % Maks 4,5
6 Bahan tambahan makanan : 6.1 Pemanis buatan
- Sakarin - Siklamat
Tidak boleh ada Tidak boleh ada 6.2 Pewarna tambahan Sesuai SNI 01-0222-1995 6.3 Pengawet (Na-Benzoat) Sesuai SNI 01-0222-1995 7 Campuran logam :
7.1 Timbal (Pb) mg/kg Maks 0,2
7.2 Tembaga (Cu) mg/kg Maks 2
7.3 Seng (Zn) mg/kg Maks 5,0
7.4 Timah (Sn) mg/kg Maks 40,0/250,0*
8 Cemaran Arsen (As) Maks 0,1
9 Cemaran mikroba :
9.1 Angka lempeng total Koloni/g Maks 2,0 x 102
9.2 Coliform APM/g <3
9.3 Kapang Koloni/g Maks 50
9.4 Khamir Koloni/g Maks 50
BAB 3
BAHAN DAN METODE PENELITIAN
3.1. Pengambilan Sampel
Beras ramos IR-64 diperoleh dari Pasar Pagi Padang Bulan-Medan. Beras ramos IR-64 diperoleh dari satu pembeli dari pasar pagi padang bulan dan diperkirakan sudah dapat mewakili dari beberapa pedagang yang ada. Beras ramos IR-64 yang digunakan sebanyak 4 muk (± 1 kg). Beras ramos IR-64 dicuci sebanyak 3x pencucian dan masing-masing air pencucian beras tersebut ditempatkan kedalam wadah yang berbeda.
3.2. Bahan dan Alat yang digunakan
3.2.1. Bahan-bahan − Air kelapa
− Air cucian beras
− Buffer asetat pH 4
− Starter
− Alkohol 70% p.a (E. Merck)
− Urea [Co(NH2)2
− Gula pasir Gulaku
] p.a (E. Merck)
− Aquades
− H2SO4(p) p.a (E. Merck)
− Indikator Fenolftalein p.a (E. Merck)
− NaOH (s)
− HCl 37 % p.a (E. Merck)
p.a (E. Merck)
− H2SO4 (P)
− H
p.a (E. Merck) 3BO3
− H
3% p.a (E. Merck)
2C2O4.2H2
− n-heksan p.a (E. Merck)
− Alkohol 96% p.a (E. Merck)
− Selenium p.a (E. Merck)
− Indikator metil merah p.a (E. Merck)
− Indikator metil biru p.a (E. Merck)
− CH3
− CH
COOH p. a (E. Merck)
3
− Kertas saring ash less Whattman 40
COONa p. a (E. Merck)
3.2.2. Alat-alat
− Termometer Fisher
− Gelas ukur 100 mL Pyrex
− Gelas Erlenmeyer 250 mL Pyrex
− Gelas Beaker 250 mL Pyrex
− Oven Memmert
− Neraca Analisis Meller
− Labu takar 100 mL Pyrex
− Labu takar 1000 mL
− Tripot
− Batang pengaduk
− Aluminum foil
− Statif dan klemp
− Buret Pyrex
− Desikator
− Botol aquades
− Alat sokhlet
− Kjeldahl term Gerhardt
− Tanur Gallen Kamp
− Hot plate Fisions
− Ayakan 80 mesh Fisher
− Alat destilasi Gerhard Born
− Cawan porselen
− Ayakan 100 Mesh
3.3. Prosedur Penelitian
3.3.1. Pembuatan Buffer Asetat 0,2 M pH 4
pH = pKa + log
] [ ] [ asam garam
untuk pH 4 dan pKa 4,76 Log ] [ ] [ asam garam
= pH – pKa = 4 – 4,76 = - 0,76
Jadi, ] [ ] [ asam garam
= 0,1737
% garam =
] [ ] [ 1 ] [ ] [ asam garam asam garam +
x 100 %
= 1737 , 0 1 1737 , 0
+ x 100 % = 14,893 %
% asam =
] [ ] [ 1 1 asam garam +
x 100 %
= 1737 , 0 1 1
+ x 100 % = 85,201 %
Untuk buffer asetat 0,2 M denagn pH 4 dapat ditentukan massa asam dan massa garamnya sebagai berikut :
Gram garam (CH3COONa) = % garam x [garam] x massa molekul garam = 14,893 % x 0,2 M x 82,4 g/mol
Gram asam (CH3
a) Pembuatan indikator Fenolftalein 1% (b/v)
COOH) = % asam x [asam] x massa molekul asam = 85,201 % x 0,2 M x 60,05 g/mol
= 500 mL / 1023,26 g / L = 0,4886 g / L
3.3.2. Pembuatan Reagen
Ditimbang 1 g indikator fenolftalein dan dilarutkan dengan alkohol 96% dalam labu takar 100 mL sampai garis tanda
b) Pembuatan larutan NaOH 40%
Ditimbang 40 g kristal NaOH dan dilarutkan dengan aquades dalam labu takar 100 mL hingga garis tanda
c) Pembuatan larutan H3BO3
− Ditimbang 3 g H
3% (b/v) 3BO3
− Ditambahkan 900 mL aquades, lalu dipanaskan sehingga volumenya bertambah menjadi 1000 mL
, lalu dilarutkan dengan aquades dalam labu takar 100 mL hinggga garis tanda
d) Pembuatan indikator Tashiro
Dicampurkan 2 bagian indikator metal biru 0,2% (b/v) dan 1 bagian indikator metal merah 0,2% (b/v) dalam alkohol 96%
e) Pembuatan larutan NaOH
Ditimbang 0,4 g kristal NaOH dan dilarutkan dengan aquades dalam labu takar 1000 mL hingga garis tanda
Standarisasi larutan
− Dipipet 10 mL larutan NaOH lalu dimasukkan kedalam gelas Erlenmeyer
− Ditambahkan dengan indiktor fenolftalein
− Dititrasi dengan asam oksalat 0,01 N hingga larutan berwarna bening
− Dicatat volume asam oksalat
2. Volume H2C2O4 = 10,35 mL 3. Volume H2C2O4 = 10,35 mL Volume rata-rata :
V1.N1 = V2.N2
10 . N1 = 10,35 X 0,01 N N1 = 0,0103
f). Pembuatan larutan H2C2O4 0,01 N (b/v) Ditimbang 0,63 g kristal H2C2O4.H2
- Dipipet 10 mL HCl lalu dimasukkan kedalam gelas Erlenmeyer O dan dilarutkan dengan aquades sampai dalam labu takar 100 mL sampai garis tanda
g). Pembuatan larutan HCl
Sebanyak 0,83 g mL HCl 37% diencerkan dengan aquades dalam labu takar 1000 mL sampai garis tanda.
Standarisasi larutan HCl 0,01 N
- Ditambah dengan 3 tetes indicator fenolftalein
- Dititrasi dengan NaOH 0,0103 N hingga berwarna merah lembayung
- Hal yang sama dilakukan sebanyak 3 kali 1. Volume NaOH = 9,65 mL
2. Volume NaOH = 9,65 mL 3. Volume NaOH = 9,60 mL Volume rata-rata = 9,63 mL V1.N1 = V2.N2
10 . N1 = 9,63 x 0,0103 N N1 = 0,00991 N
h). Pembuatan Buffer Asetat 0,2 M pH 4
Ditimbang 2,0548 g Na-asetat p.a dan 0,4886 g asam asetat glasial dimasukkan kedalam labu takar 500 mL lalu ditambahkan dengan aquades hingga garis tanda
i). Pembuatan larutan NaOH 1%
3.3.3. Pembuatan Starter
− Air kelapa 1000 mL didiamkan hingga terpisah dari endapannya
− Ditambahkan urea 5 g
− Ditambahkan gula 250 g
− Ditambahkan asam aetat 25% (± 5 mL) setetes demi setetes hingga diperoleh pH antara 3 – 4
− Lalu campuran semua bahan diatas dipanaskan hinga mendidih (temperaturnya 104°C), setelah itu langsung diinginkan
− Kemudian campuran diatas dimasukkan sebanyak 200 mL kedalam gelas Erlenmeyer yang telah disterilkan terlebih dahulu didalam oven pada temperatur 210°C
− Dan yang terakhir ditambahkan dengan starter awal sebanyak 20% kedalam campuran bahan tadi.
3.3.4. Pembuatan Nata de Oriza
− Disediakan 1000 mL air cucian beras
− Ditambahkan 80 g gula pasir
− Ditambahkan 5 g urea
− Setelah itu semua bahan diatas dicampurakn dan dipanaskan sambil diaduk-aduk hingga rata (dipanaskan hingga suhu 108°C)
− Kemudian ditambahkan dengan buffer asetat setetes demi setetes hingga pH mencapai pH 4 (± 45 mL)
− Lalu diaduk kembali hingga rata, setelah itu didinginkan
− Dimasukkan kedalam wadah fermentasi yang telah disterilkan terlebih dahulu
− Ditambahkan starter 10% kedalam larutan nata tadi
− Lalu ditutup dengan kertas koran yang bersih
3.3.5. Penentuan Kadar Protein
− Sampel ditimbang sebanyak 0,4 gram lalu dimasukkan kedalam tabung reaksi
− Kemudian ditambahkan dengan 0,3 g selenium dan 2,5 mL H2SO
− Didestruksi sampel dalam tabung reaksi dengan menggunakan Kjeldahl term pada suhu 400 °C sehingga larutan yang ada didalam tabung reaksi menjadi jernih
4 (p)
− Ditambahkan dengan 50 mL aquades
− Dipindahkan sampel tersebut kedalam tabung destilasi lalu ditambahkan dengan 3 tetes indikator fenolftalein dan juga 5 mL NaOH 40%
− Disediakan penampung hasil destilat berupa gelas Erlenmeyer yang telah berisi 5 mL H3BO3
− Dipasang tabung destilat pada alat destilasi, kemudian diletakkan destilasi sampai diperoleh destilat berwarna hijau muda
3% dan 3 tetes indikator tashiro dan 30 mL aquades
− Destilat dititrasi dengan HCL 0,1 N sampai terbentuk warna merah muda (merah lembayung)
− Dicatat volume titran yang diperoleh dan ditentukan %N
3.3.6. Kadar Lemak
− Ditimbang 10 gram nata, dikeringkan dan dihaluskan kemudian dibungkus dengan kertas saring dan dimasukkan kedalam alat sokhlet
− Kedalam labu destilasi dimasukkan n-heksan sebanyak 2/3 bagian labu, kemudian nata diekstraksi selama ± 6 jam
− Ekstrak yang diperoleh dipindahkan kedalam cawan porselen yang telah diketahui beratnya
− Dikeringkan dalam oven pada suhu 100 - 110 °C
− Didinginkan dalam desikator dan ditimbang
3.3.7. Kadar Air
− Ditimbang 2 gram nata dalam kruskrusibel yang telah diketahui beratnya
− Kemudian dikeringkan dalam oven pada suhu 100 – 105 °C selama sekitar 6 jam
− Didinginkan kruskrusibel kedalam desikator selama 20 menit. Setelah dingin kruskrusibel ditimbang
− Penimbangan dilakukan berulang hingga diperoleh berat yang konstan
− Dihitung kadar kadar airnya
3.3.8. Kadar Abu
− Ditimbang 2 gram nata dalam kruskrusibel yang telah diketahui beratnya
− Diletakkan dalam tanur pengabuan, kemudian dibakaar pada suhu 500°C hingga diperoleh abu yang berwarna putih abu-abu
− Didinginkan dalam desikator dan ditimbang
− Penimbangan dilakukan berulang hingga diperoleh berat yang konstan
− Dihitung kadar abunya
3.3.9. Penentuan Kadar Karbohidrat
− Dihitung jumlah persentase dari kadar protein, lemak, air dan abu
− Kadar karbohidrat diketahui dengan menghitung selisih antara 100 % dengan jumlah dari persentase tersebut
− Kadar karbohidrat (%) = 100 % - % (Protein + Lemak + Air + Abu + Serat)
3.3.10. Kadar Serat
− Pemisahan lemak dengan metode sokletasi
Nata de Oriza yang telah dikeringkan pada suhu 110°C dilarutkan dalam 50 mL alkohol 96% dan diuapkan, selanjutnya ditambahkan 50 mL n-heksan, kemudian direfluks dan disaring.
− Ditambahkan 150 mL aquades dan 100 mL H2SO4
− Residu dicuci dengan air panas hingga pH netral
− Delignifikasi serat kasar dengan menggunakan NaOH 1 %
− Residu yang telah dicuci dididihkan dengan 200 mL NaOH 1% dan direfluks selama ± 60 menit, lalu disaring dan residu dicuci sampai keadaan netral dengan menggunakan pH universal. Kemudian dikeringkan pada suhu 105-110°C selama ± 1 jam
3.4. Bagan Penelitian 3.4.1. Pembuatan Starter
Didiamkan
Disaring
Ditambah urea 5 g Ditambah gula 250 g
Ditambah asam asetat 25 % 5 mL hingga pH 3-4 Dipanaskan hingga mendidih
Didinginkan
Dimasukkan kedalam gelas Erlenmeyer 250 mL Ditambah starter induk 20%
1 L air kelapa
Air kelapa Kotoran
Larutan asam bergula
3.4.2. Pembuatan Nata de Oriza
Ditambah 80 g gula
Ditambah 5 g urea
Dicampur
Dipanaskan sambil diaduk hingga rata
Ditambah buffer asetat 0,2 M hingga pH 4 (± 45 mL)
Diaduk kembali hingga rata Didinginkan
Dimasukkan ke dalam wadah fermentasi
Ditambah starter 10 %
Ditutup dengan kertas koran bersih Diikat hingga rapat
Diletakkan dalam ruang fermentasi selama 10 – 14 hari lamanya
1 L air cucian beras
Larutan asam bergula
3.4.3. Penetapan Kadar Protein
Dimasukkan kedalam tabung reaksi
Ditambah 0,3 g Selenium (Se) Ditambah 2,5 mL H2SO4 (P)
Didestruksi dengan Kjeldahl term hingga larutan jernih
Ditambah 50 mL aquades Dipindahkan kedalam tabung reaksi
Ditambah 3 tetes indikator Fenolftalein
Didestilasi
Ditampung dalam gelas Erlenmeyer yang berisi 5 mL H3BO3
Ditambah 30 mL aquades
3% dan indikator tashiro 3 tetes
Dipasang alat destilasi, lalu destilat didestilasi
Dititrasi dengan HCl 0,01 N
Dicatat volume titran HCl 0,01 N Dihitung % N-nya
0,4 g Nata de oriza
Larutan sampel
Larutan putih kekuningan
Destilat
Larutan hijau muda
Larutan merah lembayung
3.4.4. Penetapan Kadar Lemak
Dihaluskan
Dibungkus dengan kertas saring Dimasukkan kedalam alat soklet
Ditambahkan pelarut n-heksan kedalam labu destilasi sebanyak 2/3 bagian
Diekstraksi selama ± 6 jam atau hingga tidak berwarna lagi
Dipindahkan kedalam cawan porselen yang telah diketahui beratnya
Dikeringkan dalam oven pada suhu 100°C
Didinginkan didalam desikator
Dihitung kadar lemak-nya 10 g nata de oriza kering
Ekstrak
Lemak
3.4.5. Penetapan Kadar Serat
Dikeringkan pada suhu 100-110°C Dihaluskan
Diayak dengan ayakan 80 mesh
Ditimbang sebanyak 5 gram
Ditambahkan 50 mL alkohol 96% dan diuapkan 15 menit
Ditambah 50 mL n-heksan, direfluks selama 30 menit
Disaring
Ditambahkan akuades 150 mL & 100 mL H2SO4
Disaring
1,25%, direfluks selama 30 menit
Dicuci dengan air panas sampai pH netral
Didihkan dengan 200 mL NaOH 1 % Direfluks selama 60 menit
Disaring derngan kertas saring telah diketahui beratnya
Dicuci sampai pH netral dengan akuades
Diovenkan pada suhu 100-110°C selama 60 menit Didinginkan, ditimbang sampai berat konstan
Nata de oriza
Nata (bubuk)
Nata halus
Filtrat Residu
Filtrat Residu
Residu Filtrat
3.4.6. Penetapan Kadar Air
Dihaluskan
Dimasukkan kedalam cawan porselen yang telah diketahui beratnya
Dimasukkan kedalam oven pada suhu 100 - 105°C selama ± 6 jam
Didinginkan dalam desikator selama ± 20 menit
Ditimbang
Dihitung kadar airnya 2 g nata de oriza
3.4.7. Penetapan Kadar Abu
Dikeringkan Dihaluskan
Dimasukkan kedalam cawan porselen yang telah diketahui beratnya
Dibakar dalam tanur pada suhu 500°C selama ± 6 jam
Didinginkan dalam desikator selama ± 20 menit
Ditimbang
Dihitung kadar abunya
3.4.8. Penetapan Kadar Karbohidrat
Dikurangkan dengan kadar protein (%) Dikurangkan dengan kadar lemak (%) Dikurangkan dengan kadar air (%) Dikurangkan dengan kadar abu (%) Dikurangkan kadar serat kasar (%)
2 g nata de oriza
Hasil
Berat Aliquot (100%)
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Data yang diperoleh dari penelitian ini diolah dan diuji secara statistik dengan menggunakan :
- Metode statistik dengan ANOVA
Pengolahan data meliputi :
[image:49.595.113.513.478.587.2]- Perhitungan kadar protein, lemak, abu, air, karbohidrat, dan serat kasar.
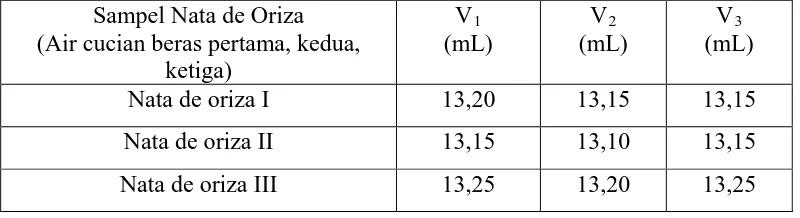
Tabel 4.1.1. Data Hasil Pengukuran Volume Titran (HCL 0,01 N)
Variasi perbandingan antara air cucian beras pertama, kedua dan ketiga terhadap kadar protein pada nata de oriza dilakukan dengan metode Kjeldahl. Jumlah volume HCL 0,01 N yang terpakai pada tahap titrasi dapat dilihat pada table berikut ini :
Sampel Nata de Oriza (Air cucian beras pertama, kedua,
ketiga)
V1 (mL)
V2 (mL)
V3 (mL)
Nata de oriza I 13,20 13,15 13,15
Nata de oriza II 13,15 13,10 13,15
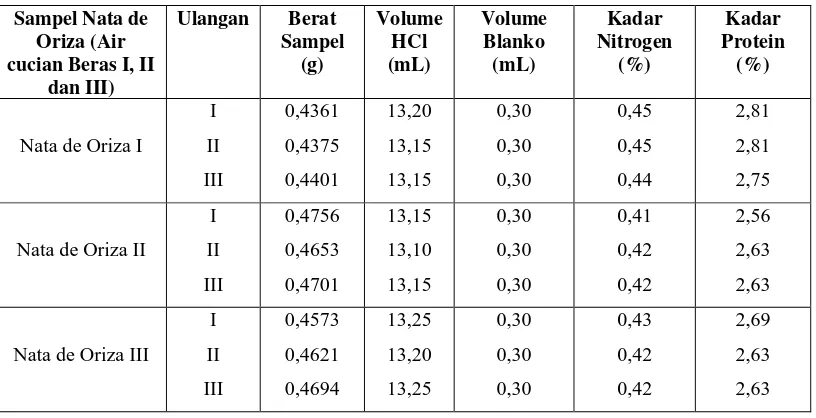
Tabel 4.1.2. Data Hasil Pengukuran Kadar Protein Pada Nata de Oriza
Variasi perbandingan air cucian beras pertama, kedua dan ketiga terhadap kadar protein pada pembuatan nata de oriza dengan menggunakan metode Kjeldahl term.
Persen (%) kadar protein yang diperoleh utnuk nata de oriza terdapat pada tabel berikut ini :
Sampel Nata de Oriza (Air cucian Beras I, II
dan III)
Ulangan Berat Sampel (g) Volume HCl (mL) Volume Blanko (mL) Kadar Nitrogen (%) Kadar Protein (%)
Nata de Oriza I
I II III 0,4361 0,4375 0,4401 13,20 13,15 13,15 0,30 0,30 0,30 0,45 0,45 0,44 2,81 2,81 2,75
Nata de Oriza II
I II III 0,4756 0,4653 0,4701 13,15 13,10 13,15 0,30 0,30 0,30 0,41 0,42 0,42 2,56 2,63 2,63
Nata de Oriza III
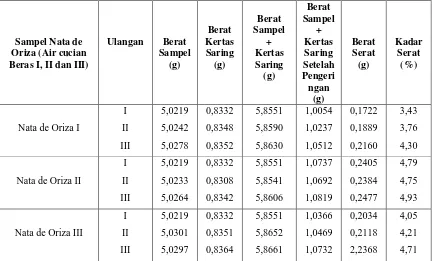
Tabel 4.1.3. Data Hasil Pengukuran Kadar Serat Pada Nata de Oriza
Variasi perbandingan air cucian beras pertama, kedua dan ketiga terhadap kadar serat pada pembuatan nata de oriza yang dilakukan dengan metode pendelignifikasian.
Persen (%) kadar serat yang diperoleh untuk nata de oriza terdapat pada tabel berikut ini :
Sampel Nata de Oriza (Air cucian Beras I, II dan III)
Ulangan Berat Sampel (g) Berat Kertas Saring (g) Berat Sampel + Kertas Saring (g) Berat Sampel + Kertas Saring Setelah Pengeri ngan (g) Berat Serat (g) Kadar Serat (%)
Nata de Oriza I
I II III 5,0219 5,0242 5,0278 0,8332 0,8348 0,8352 5,8551 5,8590 5,8630 1,0054 1,0237 1,0512 0,1722 0,1889 0,2160 3,43 3,76 4,30
Nata de Oriza II
I II III 5,0219 5,0233 5,0264 0,8332 0,8308 0,8342 5,8551 5,8541 5,8606 1,0737 1,0692 1,0819 0,2405 0,2384 0,2477 4,79 4,75 4,93
Nata de Oriza III
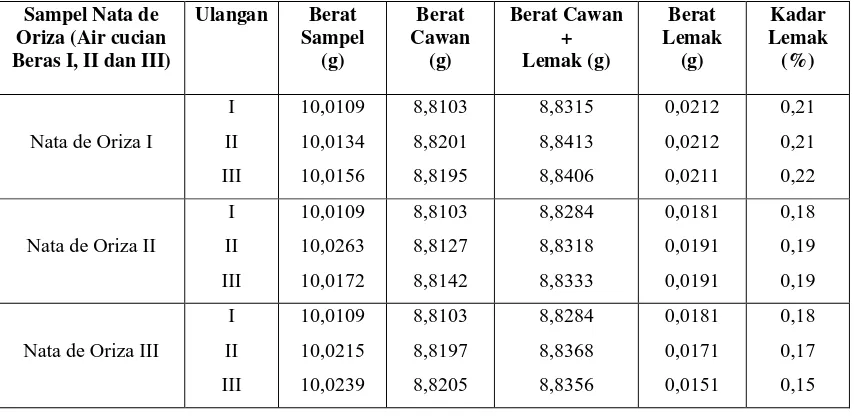
Tabel 4.1.4. Data Hasil Pengukuran Kadar Lemak Pada Nata de Oriza
Variasi perbandingan air cucian beras pertama, kedua dan ketiga terhadap kadar lemak pada pembuatan nata de oriza yang dilakukan dengan metode ekstraksi sokletasi dengan alat soklet.
Persen (%) kadar lemak yang diperoleh untuk nata de oriza terdapat pada tabel berikut ini :
Sampel Nata de Oriza (Air cucian Beras I, II dan III)
Ulangan Berat Sampel (g) Berat Cawan (g) Berat Cawan + Lemak (g) Berat Lemak (g) Kadar Lemak (%)
Nata de Oriza I
I II III 10,0109 10,0134 10,0156 8,8103 8,8201 8,8195 8,8315 8,8413 8,8406 0,0212 0,0212 0,0211 0,21 0,21 0,22
Nata de Oriza II
I II III 10,0109 10,0263 10,0172 8,8103 8,8127 8,8142 8,8284 8,8318 8,8333 0,0181 0,0191 0,0191 0,18 0,19 0,19
Nata de Oriza III
Tabel 4.1.5. Data Hasil Pengukuran Kadar Air Pada Nata de Oriza
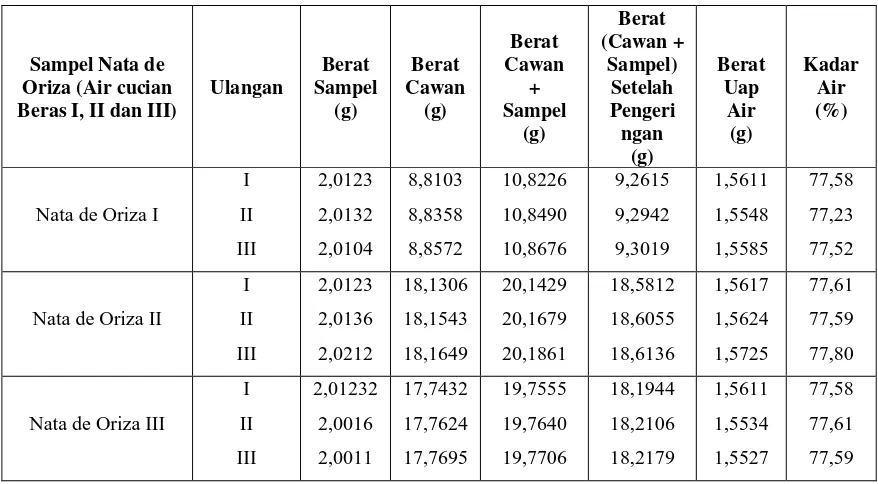
Variasi perbandingan air cucian beras pertama, kedua dan ketiga terhadap kadar air pada pembuatan nata de oriza yang dilakukan dengan metode penguapan air. Persen (%) kadar air yang diperoleh untuk nata de oriza terdapat pada tabel berikut :
Sampel Nata de Oriza (Air cucian Beras I, II dan III)
Ulangan Berat Sampel (g) Berat Cawan (g) Berat Cawan + Sampel (g) Berat (Cawan + Sampel) Setelah Pengeri ngan (g) Berat Uap Air (g) Kadar Air (%)
Nata de Oriza I
I II III 2,0123 2,0132 2,0104 8,8103 8,8358 8,8572 10,8226 10,8490 10,8676 9,2615 9,2942 9,3019 1,5611 1,5548 1,5585 77,58 77,23 77,52
Nata de Oriza II
I II III 2,0123 2,0136 2,0212 18,1306 18,1543 18,1649 20,1429 20,1679 20,1861 18,5812 18,6055 18,6136 1,5617 1,5624 1,5725 77,61 77,59 77,80
Nata de Oriza III
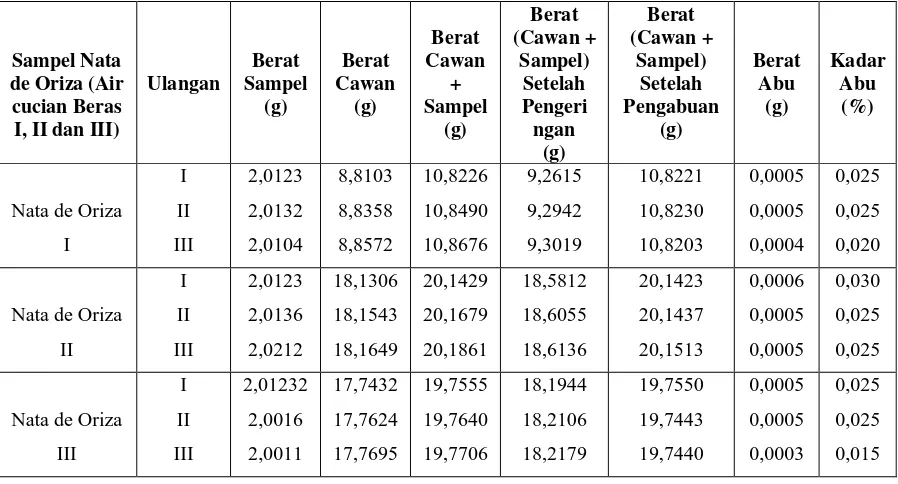
Tabel 4.1.6. Data Hasil Pengukuran Kadar Abu Pada Nata de Oriza
Variasi perbandingan air cucian beras pertama, kedua dan ketiga terhadap kadar abu pada pembuatan nata de oriza yang dilaukan dengan metode pembakaran dalam tanur.
Persen (%) kadar abu yang diperoleh untuk nata de oriza terdapat pada tabel berikut ini :
Sampel Nata de Oriza (Air cucian Beras I, II dan III)
Ulangan Berat Sampel (g) Berat Cawan (g) Berat Cawan + Sampel (g) Berat (Cawan + Sampel) Setelah Pengeri ngan (g) Berat (Cawan + Sampel) Setelah Pengabuan (g) Berat Abu (g) Kadar Abu (%)
Nata de Oriza
I I II III 2,0123 2,0132 2,0104 8,8103 8,8358 8,8572 10,8226 10,8490 10,8676 9,2615 9,2942 9,3019 10,8221 10,8230 10,8203 0,0005 0,0005 0,0004 0,025 0,025 0,020
Nata de Oriza
II I II III 2,0123 2,0136 2,0212 18,1306 18,1543 18,1649 20,1429 20,1679 20,1861 18,5812 18,6055 18,6136 20,1423 20,1437 20,1513 0,0006 0,0005 0,0005 0,030 0,025 0,025
Nata de Oriza
4.2 Pengolahan Data
4.2.1. Perhitungan Kadar Protein
Besarnya kadar protein pada nata oriza dapat dihitung dengan rumus sebagai berikut : % 100 008 , 14 1000 ) ( ) (
% xNHClx x
x g l beratsampe blanko sampel mlHCl
N = −
% P = % N x Faktor Konversi
Maka dapat dicontohkan kadar protein pada nata oriza yakni :
N HCl = 0,01087 N
Faktor Konversi = 6,25
mL HCl = 1,60 mL
mL blanko = 0,30 mL Berat sampel = 0,0436 g
% 100 008 , 14 01087 , 0 1000 4361 , 0 ) 30 , 0 20 , 13 (
% x x x
x
N = −
% N = 0,03 x 0,01087 x 14,008 x 100 % = 0,45 %
% P = % N x 6,25 = 2,81%
4.2.2. Perhitungan kadar lemak
Penentuan kadar lemak pada nata oriza dapat hitung dengan cara sebagai berikut : Berat cawan = 8,8103 g
% 100 x l Beratsampe Beratlemak Kadarlemak = 100% 0109 , 10 0212 , 0 x =
= 0,21 %
4.2.3. Perhitungan Kadar Air
Penentuan kadar air pada nata oriza dapat dihitung dengan cara sebagai berikut :
Berat cawan = 8,8103 g
Berat sampel = 2,0123 g
Berat cawan + sampel basah = 10,8226 g Berat cawan + sampel setelah pengeringan = 9,2615 g
Berat Uap air = 1,5611 g
% 100 x l Beratsampe r Beratuapai Kadarair = 100% 0123 , 2 5611 , 1 x =
= 77,58 %
4.2.4. Perhitungan Kadar Abu
Penentuan kadar abu pada nata oriza dapat dihitung dengan cara sebagai berikut :
Berat cawan = 8,8103 g
Berat sampel = 2,0123 g
Berat cawan + sampel basah = 10,8226 g Berat cawan + sampel setelah pengeringan = 8,8881 g Berat cawan + sampel setelah pengabuan = 10,8221 g
Berat Abu = 0,0005 g
= 0,025 %
4.2.5. Perhitungan Kadar Karbohidrat
Penentuan kadar Karbohidrat pada nata dapat ditentukan dengan cara sebagai berikut :
% Karbohidrat = 100 % - % ( Protein + Lemak + Abu + Air + Serat)
= 100 % - % (2,81 + 0,21 + 0,025 + 77,58 + 3,43) = 100 % - 84,055 %
= 15,95 %
4.2.6. Perhitungan kadar serat kasar
Penentuan kadar serat kasar pada nata oriza dapat dihitung dengan cara sebagai berikut :
Berat sampel = 5,0219 g
Berat kertas saring = 0,8332 g
Berat sampel + kertas saring = 5,8551 g Berat sampel + kertas saring setelah pengeringan = 1,0054 g
Berat Serat = 0,1722 g
% 100
% x
l Beratsampe
Beratserat Serat =
% 100 0219 , 5
1722 , 0
x
=
4.3. Uji statistik anova dengan metode rancangan acak lengkap
Dalam hal ini rancangan acak lengkap merupakan suatu metode untuk pelengkap penentuan anova. Karena data anova yang akan diperoleh dilakukan dengan menghitung melalui langkah – langkah rancangan caka lengkap.
Hipotesa :
Ho = Apabila tidak ada pengaruh variasi air cucian beras pertama, kedua dan ketiga terhadap kadar karbohidrat, protein, lemak,
abu dan air pada pembuatan nata de oriza.
Ha = Apabila ada pengaruh variasi air cucian beras pertama, kedua, ketiga terhadap kadar karbohidrat, protein, lemak, abu dan air pada pembuatan nata de oriza
Kriteria keputusan :
Jika F hitung ≤ F tabel : maka Ho diterima dan Ha ditolak Jika F hitung ≥ F tabel : maka Ho ditolak dan Ha diterima
Berikut ini dipaparkan salah satu contoh dari perhitungan rancangan acak lengkap yang merupakan metode untuk menentukan harga anova – nya. Yang diambil sebagai contoh perhitungan rancangan acak lengakp untuk memperoleh data anova adalah pada kadar serat nata pertama.
4.3.1. Rancangan Acak Lengkap Untuk Kadar Serat Pada Nata de Oriza
V1 = t – 1
= 3 – 1 = 2 V2
rxt Tij2
= (r.t – 1) – (t – 1)
= (3.3 – 1) – (3 – 1) = 6
1. FK =
=
3 3
93 , 39 2
x = 177,1561
2. JK Total = T(Yi)2 – FK
3. JK Perlakuan = FK r
TA
− 2
= 177,1561
3 97 , 12 47 , 14 49 , 11
( 2 2 2
− +
+
= 8643,7203
4. JK Galat = JK Total – JK Perlakuan = 26034,454 – 8643,7203 = 1740,734
5. KT Perlakuan =
1 V n JKPerlakua = 2 7203 , 8643
= 4321,9015
6. KT Galat =
2 V JKGalat = 6 734 , 1740
= 290,1223
7. F hitung =
KTGalat n KTPerlakua = 1223 , 290 9015 , 4321
= 14,9763 Harga F pada tabel adalah :
F0,05 = 5,14 F0,01 = 10,92
4.4. Pembahasan
4.4.1. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Protein
Pada gambar II. Menunjukkan bahwasanya terjadi peningkatan kadar protein pada nata de oriza dengan adanya variasi air cucian beras pertama, kedua dan ketiga. Hal ini disebabkan karena kandungan protein pada air cucian beras kedua jauh lebih sedikit dari pada kadar protein pada air cucian beras yang pertama dan ketiga. Namun dengan adanya proses pemanasan didalam oven dalam pengolahan nata juga dapat mempengaruhi kadar proteinnya, sehingga menyebabkan kadar protein juga dapat berkurang. Akibat adanya suhu, tambahan bahan-bahan kimia, pH dan sebagainya juga dapat menyebabkan protein mengalami denaturasi. Dikatakan terjadi denaturasi, apabila ada sebagian rantai polipeptida suatu molekul proteinnya berubah. Proses denaturasi ini dapat mengubah bentuk molekul proteinnya tetapi tidak merusak ikatan peptidanya.
4.4.2. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Lemak
4.4.3. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Serat
Pada gambar I. Menunjukkan bahwasanya terjadi peningkatan kadar serat pada proses pengolahan nata de orizanya. Hal ini disebabkan karena nata de oriza yang kedua memiliki kandungan serat yang jauh lebih tinggi dari nata de oriza yang pertama dan ketiga. Menurut badan penelitian pusat di LIPI Bogor dan Badan POM (BPOM) menyatakan bahwa pada umumnya kandungan serat yang paling maksimum dalam 100 gram nata adalah 4,5 %. Namun dalam penelitian ini jumlah kadar serat yang tinggi terdapat pada nata yang kedua yakni 4,82% dari jumlah yang seharusnya yakni 4,5 %. Hal ini dapat saja terjadi akibat adanya pengaruh pemanasan, penambahan bahan kimia ataupun suhu dan lainnya. Sehingga terjadi perbedaan yang nyata pada masing-masing nata yang dihasilkan terhadap kadar seratnya. Namun ada opini yang menyatakan bahwa nata sangat baik untuk kebutuhan diet, karena kandungan seratnya yang cukup tinggi selain dari kandungan airnya ynag juga besar.
4.4.4. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Abu
Pada gambar IV. Menunjukkan bahwasanya terjadi penurunan kadar abu pada masing-masing nata yang dihasilkan. Hal ini dikarenakan, pada saat pencucin beras yang pertama sekali yang larut adalah kotoran (abu) yang biasanya disebut dengan dedak. Sehingga dihasilkan jumlah kadar abu yang cukup besar pada nata yang pertama dan semakin berkurang selanjutnya untuk nata kedua dan ketiga. Tetapi kadar abu yang dihasilkan juga berpengaruh terhadap kadar air yang sebelumnya diperiksa terlebih dahulu. Namun dalam penelitian ini, jumlah kadar abu yang diperoleh tidak begitu penting.
4.4.5. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Air
yang seharusnya. Menurut Warisno (2005) menyatakan bahwa kandungan air di dalam 100 gram nata pada umumnya adalah 80 %. Namun pada saat pengolahan air cucian beras yang kedua untuk diubah menjadi nata de oriza yang kedua diperoleh kadar air yang cukup besar yakni 77,66 %. Oleh karena itulah nata dengan kandungan air yang besar ini sering sekali dipakai oleh para konsumen sebagai pelepas dahaga, terutama disaat mereka sedang dalam keadaan lelah.
4.4.6. Pengaruh Perbandingan Air Cucian Beras Pertama, Kedua dan Ketiga Terhadap Kadar Karbohidrat
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian diperoleh kadar karbohidrat yang terbaik pada nata de oriza III yaitu 19,56% dari pada nata de oriza II yaitu 19,51%. Kadar serat terbaik pada nata de oriza II yaitu 4,82% dari pada nata de oriza I yaitu 3,83%. Kadar protein terbaik pada nata de oriza I yaitu 2,79% dari pada nata de oriza II yaitu 2,60%
5.2. Saran
DAFTAR PUSTAKA
Burns. G. W. 1974. The Plant Kingdom. Second edition. Publhising by Mac – Milan. London
Hans. G. 1994. Mikrobiologi Umum. Edisi Keenam. Cetakan Pertama. Yogyakarta : UGM-Press
Hidayat. N. et al. 2006. Mikrobiologi Industri. Edisi Pertama. Yogyakarta : ANDI (http://jatim.litbang.deptan.go.id/index.php?option=comcontent&id=162&itemid= 72)
Kegunaan Beras. 18 Desember 2006 (http://www.wikipedia.org/wiki/Beras.htm)
Lilian H. E. and Linton. H. A. 1976. Micro-organism : Function, Form and Environtment. Second edition. Edward Arnold Publhiser. London
Moehyi. S. 1992. Makanan Institusi dan Jasa Boga. Cetakan pertama. Jakarta : Bhratara
Manfaat Padi. 20 Desember 2006
(http://72.14.235.104/search?q=cache:warintek.ristek.go.id/pertanian/padi.htm) Palungkun. R. 1992. Aneka Produk Olahan Kelapa. Cetakan ke-VII. Jakarta :
Penebar Swadaya
Pelczar dan Chan. 1988. Dasar-Dasar Mikrobiologi. Jilid 2. Cetakan pertama. Penerbit UI-Press. Jakarta
Poedjadi. A. 1994. Dasar-Dasar Biokimia. Cetakan pertama. Jakarta : UI-Press Rahman. A. 1992. Teknologi Fermentasi. Penerbit Arcan. Jakarta
Suhardjo. Et al. 1985. Pangan, Gizi dan Pertanian. Cetakan pertama. Jakarta : UI-Press
Suryani. A. et al. 2005. Membuat Aneka Nata. Cetakan pertama. Jakarta : Penebar Swadaya
Teknologi Tepat Guna Agro Industri Kecil. 18 Desember 2006
(http://www.ristek.go.id.Tek+Tepat+Guna+Agro+Industri+Kecil/Sumbar.htm) Winarno. F. G. 1997. Kimia Pangan dan Gizi. Cetakan kedelapan. Penerbit PT.
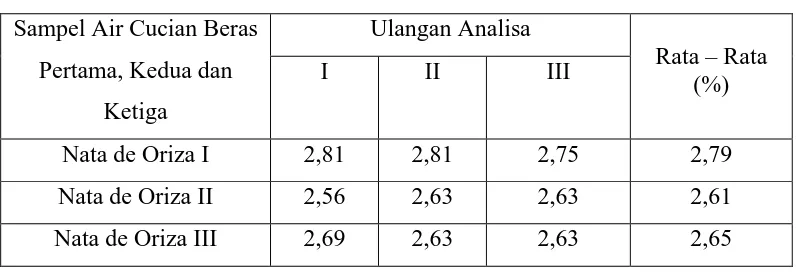
Tabel 1. Data Hasil Pengukuran Kadar Protein (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan
Ketiga
Ulangan Analisa
Rata – Rata (%)
I II III
Nata de Oriza I 2,81 2,81 2,75 2,79
Nata de Oriza II 2,56 2,63 2,63 2,61
Nata de Oriza III 2,69 2,63 2,63 2,65
Tabel 2. Data Hasil Pengukuran Kadar Lemak (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan Ketiga
Ulangan Analisa
Rata – Rata (%)
I II III
Nata de Oriza I 0,21 0,21 0,22 0,21
Nata de Oriza II 0,18 0,19 0,19 0,19
Nata de Oriza III 0,18 0,17 0,15 0,17
[image:67.595.114.512.293.404.2]
Tabel. 3 Data Hasil Pengukuran Kadar Serat (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan Ketiga
Ulangan Analisa
Rata – Rata (%)
I II III
Nata de Oriza I 3,43 3,76 4,30 3,83
Nata de Oriza II 4,79 4,75 4,93 4,82
Nata de Oriza III 4,05 4,21 4,71 4,32
Tabel. 4 Data Hasil Pengukuran Kadar Air (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan Ketiga
Ulangan Analisa
Rata – Rata (%)
I II III
[image:67.595.113.513.628.741.2]Tabel. 5 Data Hasil Pengukuran Kadar Abu (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan Ketiga
Ulangan Analisa
Rata –Rata (%)
I II III
[image:68.595.112.513.273.383.2]Nata de Oriza I 0,025 0,025 0,020 0,023 Nata de Oriza II 0,030 0,025 0,025 0,027 Nata de Oriza III 0,025 0,025 0,015 0,022
Tabel. 6 Data Hasil Pengukuran Kadar Karbohidrat (%) Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua dan Ketiga
Ulangan Analisa Rata –Rata (%)
I II III
Nata de Oriza I 15,95 15,97 15,20 15,71 Nata de Oriza II 14,83 14,82 14,43 14,69 Nata de Oriza III 15,48 15,36 14,91 15,25
Tabel. 7 Data Hasil Pengukuran Kadar Protein, Lemak, Serat, Air, Abu dan Karbohidrat Pada Nata de Oriza
Sampel Air Cucian Beras Pertama, Kedua
dan ketiga
Protein (%)
Lemak (%)
Serat (%)
Air (%)
Abu (%)
Karbohidrat (%)
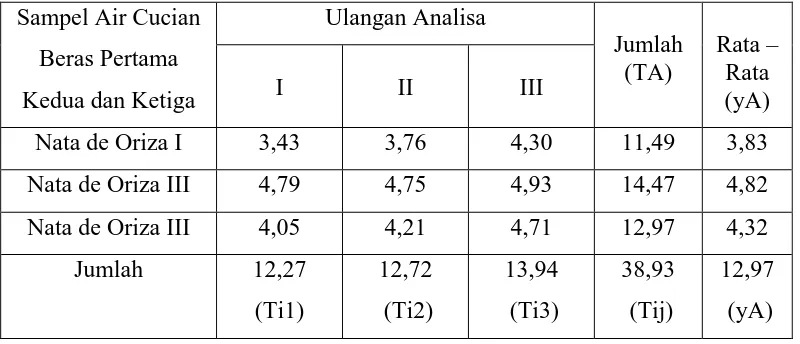
[image:68.595.114.512.484.632.2]Tabel. 8 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Protein Nata de Oriza
Sampel Air Cucian Beras Pertama Kedua dan Ketiga
Ulangan Analisa Jumlah (TA) Rata – Rata (yA)
I II III
Nata de Oriza I 2,81 2,81 2,75 8,37 2,79
Nata de Oriza II 2,56 2,63 2,63 7,82 2,61
Nata de Oriza III 2,69 2,63 2,63 7,95 2,65
Jumlah 8,06
[image:69.595.111.514.116.304.2](Ti1) 8,07 (Ti2) 8,01 (Ti3) 24,14 (Tij) 8,04 (yA)
Tabel. 9 Daftar Anova Untuk Kadar Protein
Sumber Keragaman Derajat bebas Derajat kuadrat Kuadrat tengah
F. Hitung F. Tabel 0,05 0,01 Perlakuan 2 0,05 0,025 3,63.10-05** 5,14 10,92
Galat 6 4129,05 688,18 Total 8 4129,1 688,105 Keterangan ** : sangat nyata
Harga F hitung ≤ F tabel : maka Ho diterima dan Ha ditolak
Tabel. 10 Rancangan Acak Lengkap Pengaruh Variasi Air Cucian Beras Pertama Kedua dan Ketiga Terhadap Kadar Lemak Nata de Oriza
Sampel Air Cucian Beras Pertama Kedua dan Ketiga
Ulangan Analisa Jumlah (TA) Rata – Rata (yA)
I II III
Nata de Oriza I 0,21 0,21 0,22 0,64 0,21
Nata de Oriza II 0,18 0,19 0,19 0,56 0,19 Nata de Oriza III 0,18 0,17 0,15 0,5 0,17
[image:69.595.110.512.550.726.2]Tabel. 11 Daftar Anova Untuk Kadar Lemak Sumber Keragaman Derajat bebas Derajat kuadrat Kuadrat tengah
F. Hitung F. Tabel 0,05 0,01 Perlakuan 2 -0,019 -9,5.10-03 0,23** 5,14 10,92
Galat 6 -0,223 -0,041
Jumlah 8 -0,242 -0,0505 Keterangan ** : sangat nyata
[image:70.595.113.513.316.488.2]Harga F hitung ≤ F tabel : maka Ho diterima dan Ha ditolak