KAJIAN PERKEMBANGAN LARVA DAN
PERTUMBUHAN SPAT TIRAM MUTIARA
Pinctada maxima
(JAMESON) PADA KONDISI
LINGKUNGAN PEMELIHARAAN BERBEDA
TJAHJO WINANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
KAJIAN PERKEMBANGAN LARVA DAN
PERTUMBUHAN SPAT TIRAM MUTIARA
Pinctada maxima
(JAMESON) PADA KONDISI
LINGKUNGAN PEMELIHARAAN BERBEDA
TJAHJO WINANTO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
TJAHJO WINANTO. The study of growth and development of larvae and spat pearl oyster
Pinctada maxima
(Jameson) in different rearing environment conditions. Under the
supervisions of DEDI SOEDHARMA, RIDWAN AFFANDI and HARPASIS S. SANUSI.
Major constrain in the pearl oyster breeding that are lowest of growth and
development of larvae to spat and also low survival rate. One of the affected factors its
unknown the optimum of rearing environment conditions, such as temperature, salinity,
dissolved oxygen and light intensity. The objective of this research was to determine
feeding activity, levels of food consumption, types and correct density of feed for
optimizing of larvae growth and development of spat so that obtained high survival rate.
This research consisted of four levels experiments, which are the study of larvae
rearing in laboratory, spat rearing in laboratory, rearing of larvae and spat under optimum
environment condition and study of spat rearing in the sea. Factorial completely
randomized design was applied to know that effect of types and feed density, physiology
response of larvae and spat to the levels of temperature and salinity. Completely
randomized design was applied to the study of response of larvae and spat to the levels of
light intensity. Randomized block design was applied to the study of spat in natural sea
waters.
Result of the research showed that environment factors such as temperature,
salinity, oxygen consumption and light intensity were significant affected (P
≤
0.05) to the
survival rate, growth of larvae and spat. Optimum temperature and salinity for larvae and
spat were 20
oC and 32, 34 ‰ (P
≥
0.05). Energetic cost for routine metabolism of larvae
was average 5.65; 5.98 Calorie g wet weigh
-1hour
-1(21.62; 24.70 J/g wet weigh
-1hour
-1)
and for spat was 2.18; 2.28 Calorie g wet weigh
-1hour
-1(9.54; 10.02 J/g wet weigh
-1hour
-1). The optimum light intensity for larvae was
≤
200 lux and for spat was
≤
500 lux.
Larvae were eat in the fist time after hatching at 22–24 hour age (first critical
period) and suitable food is
I. galbana
. Life food type and density were significantly
affected (P
≤
0.05) to the survival rate, development of larvae and growth of spat.
Feeding schedule for larvae and spat: stage I larvae was fed
I. galbana
(2600
−
4200 cells
ml
-1hour
-1). Stage II:
I. galbana
(3700
−
7800 cells ml
-1hour
-1) or P
. lutheri
(2300
−
7800
cells ml
-1hour
-1). Stage III:
I. galbana
(50 %) +
P. lutheri
(50 %) by fed density was
7700
−
9300 cells ml
-1hour
-1. Spat D25–D28: mixture food of
I. galbana
(50 %) +
T.
tetrathele
(50 %), by density 8900
−
10000 cells ml
-1hour
-1. D28
−
D35: mixture fed of
I.
galbana
(25 %) +
P. lutheri
(25 %) +
T. tetrathele
(50 %). Food density at D28
−
D31:
9100
−
15800 cells ml
-1hour
-1. D31
−
D33: 14600
−
18200 cells ml
-1hour
-1. D33
−
D35:
17200–18925 cells ml
-1hour
-1.
RINGKASAN
TJAHJO WINANTO. Kajian perkembangan larva dan pertumbuhan spat tiram mutiara
Pinctada maxima
(Jameson) pada kondisi lingkungan pemeliharaan berbeda. Dibimbing
oleh DEDI SOEDHARMA, RIDWAN AFFANDI dan HARPASIS S. SANUSI.
Kendala utama pada pembenihan tiram mutiara adalah perkembangan serta
pertumbuhan larva dan spat yang lambat dan sintasan rendah. Diduga, salah satu faktor
penyebabnya adalah kondisi lingkungan pemeliharaan optimum (seperti suhu, salinitas,
konsumsi oksigen dan intensitas cahaya) yang belum diketahui.
Tujuan dari penelitian ini adalah mendapatkan informasi tentang aktivitas makan,
tingkat konsumsi pakan, jenis dan densitas pakan yang tepat untuk mengoptimumkan
perkembangan larva dan pertumbuhan spat. Mendapatkan informasi tentang kondisi
lingkungan pemeliharaan yang optimum (suhu, salinitas, konsumsi oksigen, intensitas
cahaya) sehingga diperoleh pertumbuhan dan sintasan larva serta spat yang tinggi.
Penelitian ini dibagi menjadi empat tahap, yaitu kajian pemeliharaan larva di
laboratorium, pemeliharaan spat di laboratorium, pemeliharaan larva dan spat pada
kondisi lingkungan optimum dan kajian pemeliharaan spat di laut. Metode observasi
digunakan pada percobaan perkembangan larva, aktivitas makan dan tingkat konsumsi
pakan. Disain rancangan acak kelompok faktorial digunakan untuk mengatahui pengaruh
jenis dan densitas pakan, suhu dan salinitas, konsumsi oksigen, metabolisme rutin larva
dan spat terhadap pertumbuhan dan sintasan. Percobaan tentang toleransi larva dan spat
terhadap intensitas cahaya menggunakan rancangan acak lengkap dan kajian spat di laut
menggunakan rancangan acak kelompok.
Hasil percobaan menunjukkan bahwa suhu, salinitas, laju konsumsi oksigen, laju
metabolisme dan intensitas cahaya berpengaruh nyata (P
≤
0,05) terhadap perkembangan,
pertumbuhan, sintasan larva dan spat. Suhu dan salinitas optimum untuk larva dan spat
adalah 28
oC dan 32, 34 ‰ (P
≥
0,05). Belanja energi untuk metabolisme rutin larva pada
kondisi tersebut rata-rata 5,65; 5,98 Kalori/g berat basah/jam (21,62; 24,70 J/g berat
basah/jam dan pada spat rata-rata 2,18; 2,28 Kalori/g berat basah/jam (9,54; 10,02 J/g
berat basah/jam. Intensitas cahaya optimum untuk larva adalah
≤
200 lux dan untuk spat
≤
500 lux.
Larva pertama kali makan pada umur 22–24 jam setelah menetas (masa kritis
pertama) dan pakan yang sesuai
I. galbana
. Jenis dan densitas pakan hidup berpengaruh
nyata (P
≤
0,05) terhadap sintasan, perkembangan larva dan pertumbuhan spat. Jadwal
pemberian pakan untuk larva dan spat: larva stadia I diberi pakan
I. galbana
(2600
−
4200
sel/ml/hari. Stadia II:
I. galbana
(3700
−
7800 sel/ml/hari) atau
P. lutheri
(2300
−
7800
sel/ml/hari). Stadia III:
I. galbana
(50 %) +
P. lutheri
(50 %) densitas pakan 7700
−
9300
sel/ml/hari. Spat D25–D28: campuran pakan:
I. galbana
(50 %)+
T. tetrathele
(50 %),
densitas 8900
−
10000 sel/ml/hari. D28
−
D35 diberi pakan campuran
I. galbana
(25 %) +
P. lutheri
(25 %) +
T. tetrathele
(50 %). Densitas pakan D28
−
D31: 9100
−
15800
sel/ml/hari. D31
−
D33: 14600
−
18200 sel/ml/hari. D33
−
D35: 17200–18925 sel/ml/hari.
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Kajian Perkembangan Larva dan
Pertumbuhan Spat Tiram Mutiara Pinctada maxima (Jameson) Pada Kondisi
Lingkungan Pemeliharaan Berbeda adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, April 2009
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu
masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Kelautan
Dr. Ir. Neviati P. Zamani, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWAT yang telah berkenan memberikan rahmat dan hidayahNya, sehingga paripurna penelitian dan dapat terselesaikan disertasi dengan judul “Kajian Perkembangan Larva dan Pertumbuhan Spat Tiram Mutiara Pinctada maxima (Jameson) Pada Kondisi Lingkungan
Pemeliharaan Berbeda”.
Pada kesempatan ini penulis mengucapkan banyak terima kasih kepada yang terhormat Prof. Dr. Ir. Dedi Soedharma, DEA selaku Ketua Komisi Pembimbing, Dr. Ir. Ridwan Affandi, DEA dan Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc, yang telah berkenan memberikan saran, bimbingan serta pengarahan selama penyusunan proposal, pelaksanaan penelitian, penyusunan disertasi hingga publikasi. Kepada Dr. Ir. Odang Carman, M.Sc, Dr. Ir. Fredinan Yulianda, M.Sc, Dr. Ir. Edward Danakusumah, M.Sc., PU dan Prof. Dr. Ir. Enang Harris, MS terima kasih atas kesediaannya menjadi penguji luar komisi pada sidang tertutup dan terbuka.
Ungkapan terima kasih dari hati yang terdalam juga penulis sampaikan kepada Rektor, Dekan Fakultas Sain dan Teknik, Ketua Jurusan Perikanan dan Ilmu Kelautan dan teman-teman dosen Unsoed Purwokerto, Drs. M. Jimo dan teman-teman dosen Stiper Surya Dharma Bandar Lampung, Pimpinan dan staf C.V. Mina Mitra Usaha di Manado, P.T. Mariat Utama di Sorong, teman-teman di Balai Besar Pengembangan Budidaya Laut Lampung, teman-teman Program Doktoral (S3) IPB, Program Studi IKL khususnya Ir. Suparno, M.Si, Dr. Ir. M. Hatta, M.Si, Dr. Yulianus Paonganan, S.Si, M.Si. Utamanya untuk istri tercinta Ir. Esty Juliaty, ananda tersayang Muthiary Nitzschia Nur Iswari dan Bintang Ramanditya terima kasih atas dukungan, pengorbanan serta ketulusan doa dan kasih sayangnya. Rasa hormat dan terima kasih penulis sampaikan kepada Ayah dan Ibu, keluarga besar Bapak H. Slamet Atmowirono (Almarhum) dan Ibu Sumariyati, kakanda Nanik Widiastuti sekeluarga, Irawan Wijaya sekeluarga serta adiku Kusumo Wibowo sekeluarga.
Sangat disadari bahwa disertasi ini masih belum sempurna, namun demikian semoga bermanfaat dan dapat menjadi sumber informasi untuk pengembangan penelitian-penelitian selanjutnya, khususnya aplikasi produksi missal spat tiram mutiara dan pengembangan hatchery skala rumah tangga.
RIWAYAT HIDUP
Penulis dilahirkan di Semarang tanggal 5 Agustus 1961, sebagai anak ketiga dari empat bersaudara, pasangan R. Soegiono Kartosaputro (Almarhum) dan Rr. S. Yuniati. Pendidikan sarjana ditempuh di Stiper Surya Dharma Lampung, lulus pada tahun 1994. Pada tahun 1998 penulis diterima sebagai mahasiswa Program Magister Sain pada Program Studi Ilmu Kelautan, Program Pasca Sarjana IPB dan lulus tahun 2000. Kesempatan untuk melanjutkan studi ke program doktor pada perguruan tinggi dan program studi yang sama diperoleh tahun 2004.
DAFTAR ISI
Halaman
DAFTAR TABEL ………. xiii
DAFTAR GAMBAR……….. xiv
DAFTAR LAMPIRAN……….. xvi
PENDAHULUAN ………. 1
Latar Belakang ………... 1
Perumusan Masalah ………... 3
Tujuan Penelitian ………... 5
Manfaat Penelitian ………... 5
Hipotesis ………... 5
TINJAUAN PUSTAKA... 8
KAJIAN PEMELIHARAAN LARVA DAN SPAT DI LABORATORIUM …… 18
Pengaruh Jenis dan Densitas Pakan Hidup Terhadap Sintasan Serta Pertumbuhan Larva dan Spat Tiram Mutiara Pinctada maxima (Jameson)... 19
Abstract ... 19
Pendahuluan ... 19
Bahan dan Metode ………... 21
Hasil dan Pembahasan... ……… 27
Simpulan ... 50
Daftar Pustaka ... 50
Pengaruh Suhu dan Salinitas Terhadap Sintasan Serta Pertumbuhan Larva dan Spat Tiram Mutiara Pinctada maxima (Jameson) ... 56
Abstract ... 56
Pendahuluan ... 56
Bahan dan Metode ………... 58
Hasil dan Pembahasan ………... 62
Simpulan ... 81
Daftar Pustaka ... 82
Pengaruh Berbagai Tingkat Intensitas Cahaya Terhadap Sintasan Serta Pertumbuhan Larvadan SpatTiram Mutiara Pinctada maxima (Jameson)…...………. 87
Abstract ... 87
Pendahuluan ... 87
Bahan dan Metode ………... 88
Hasil dan Pembahasan ……….... 91
Simpulan ... 101
Halaman
APLIKASI PEMELIHARAAN LARVA DAN SPAT PADA
MEDIA OPTIMUM………... 104
Pengaruh Kondisi Lingkungan Pemeliharaan Berbeda Terhadap Sintasan Serta Laju Pertumbuhan Larva dan Spat Tiram Mutiara Pinctada maxima (Jameson)... 105
Abstract ... 105
Pendahuluan ... 105
Bahan dan Metode ………... 106
Hasil dan Pembahasan ………... 108
Simpulan ... 113
Daftar Pustaka ... 113
KAJIAN PEMELIHARAAN SPAT DI LAUT ... 116
Pengaruh Umur Pemindahan Terhadap Sintasan dan Laju Pertumbuhan Spat Tiram Mutiara Pinctada maxima (Jameson)………. 117
Abstract ... 117
Pendahuluan ... 117
Bahan dan Metode ………... 118
Hasil dan Pembahasan ………... 121
Simpulan ... 125
Daftar Pustaka ... 126
Pengaruh Tingkat Kepadatan Spat Tiram Mutiara Pinctada maxima (Jameson) Terhadap Sintasan dan Laju Pertumbuhan ……… 128
Abstract ... 128
Pendahuluan ... 128
Bahan dan Metode ………... 129
Hasil dan Pembahasan ………... 131
Simpulan ... 136
Daftar Pustaka ... 136
PEMBAHASAN UMUM ………... 138
SIMPULAN DAN SARAN ………... 149
DAFTAR TABEL
Halaman
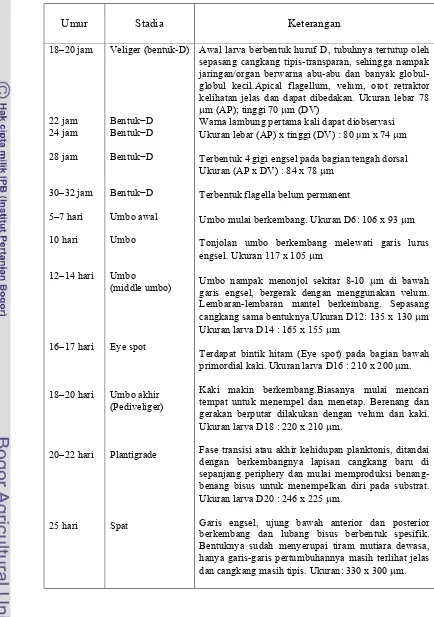
1. Spesies microalga yang digunakan sebagai pakan larva Pteria sterna………... 17 2. Diskripsi tahapan perkembangan larva sampai spat P. maxima... 28 3. Sintasan (%) larva P. maxima stadia veliger sampai stadia plantigrade
(rata-rata ± SD; n = 30) pada berbagai jenis dan densitas pakan
hidup……….. 39 4. Sintasan (%) spat P. maxima (rata-rata ± SD) pada berbagai jenis
dan densitas pakan hidup ... 44 5. Tingkat konsumsi oksigen (mgO2/g berat basah/jam) larva P. maxima
(rata-rata ± SD) pada berbagai suhu dan salinitas ... 62 6. Tingkat konsumsi oksigen (mgO2/g berat basah/jam) spat P. maxima (rata-
rata ± SD; n = 20) pada berbagai suhu dan salinitas... 64 7. Pembelanjaan energi untuk metabolisme rutin (C-J/g berat basah/jam) larva
P. maxima (rata-rata ± SD) pada berbagai suhu dan salinitas... 67
8. Pembelanjaan energi untuk metabolisme rutin (K-J/g berat basah/jam) spat P. maxima pada berbagai suhu dan salinitas... 70
9. Sintasan (%) larva P. maxima (rata-rata ± SD) pada berbagai
tingkat suhu dan salinitas... 74 10. Sintasan (%) spat P. maxima (rata-rata ± SD) pada berbagai suhu dan salinitas... 76 11. Sintasan larva P. maxima (rata-rata + SD) pada berbagai tingkat intensitas
cahaya... 94 12. Uji nilai tengah Tukey terhadap sintasan dan pertumbuhan panjang relatif
pada larva dan spat tiram mutiara P. maxima... 109 13. Sintasan spat P. maxima (rata-rata ± SD) terhadap lama waktu pemindahan
DAFTAR GAMBAR
Halaman
1. Kerangka konseptual pendekatan masalah dan tahapan penelitian larva dan spat tiram mutiara P. Maxima di lab... 6
2. Kerangka konseptual pendekatan masalah dan tahapan penelitian spat tiram mutiara P. Maxima di lab... 7 3. Siklus hidup tiram mutiara Pinctada maxima... 12 4. Pengukuran panjang antero-posterior (AP) dan dorso-ventral (DV) larva
tiram mutiara P. maxima …... 24 5. Larva P. maxima stadia bentuk-D diantara telur-telur, ditemukan
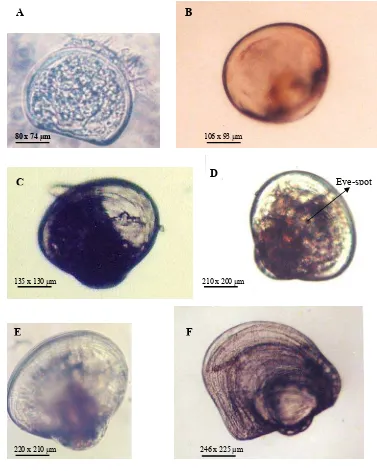
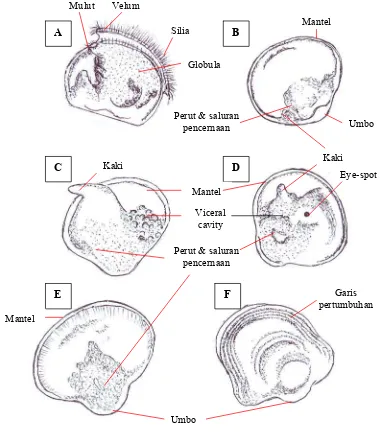
pertama kali 18 – 20 jam setelah menetas... 27 6a. Tahapan perkembangan larva P. maxima.
(A) bentuk-D; (B) Umbo awal; (C) Umbo tengah; (D) Eye-spot;
(E)Umbo akhir (pediveliger); (F) Plantigrade ……….. 29 6b. Sketsa tahapan perkembangan larva P. maxima. (A) bentuk-D;
(B) Umbo awal; (C) Umbo tengah; (D) Eye-spot; (E)Umbo
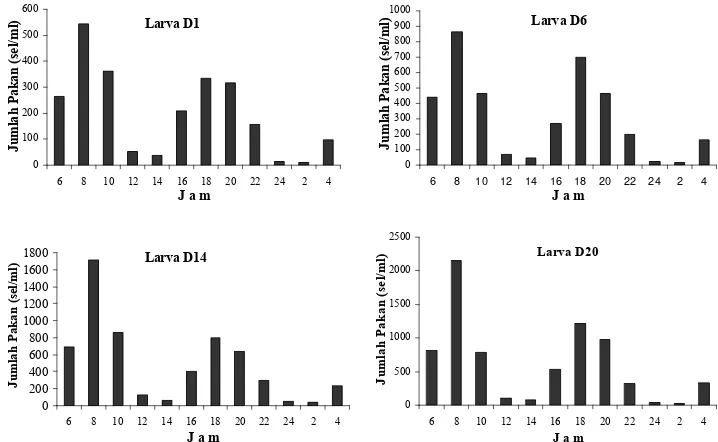
akhir (pediveliger); (F) Plantigrade ………... 30 7. Jumlah pakan yang dikonsumsi (sel/ml) larva P. maxima pada berbagai
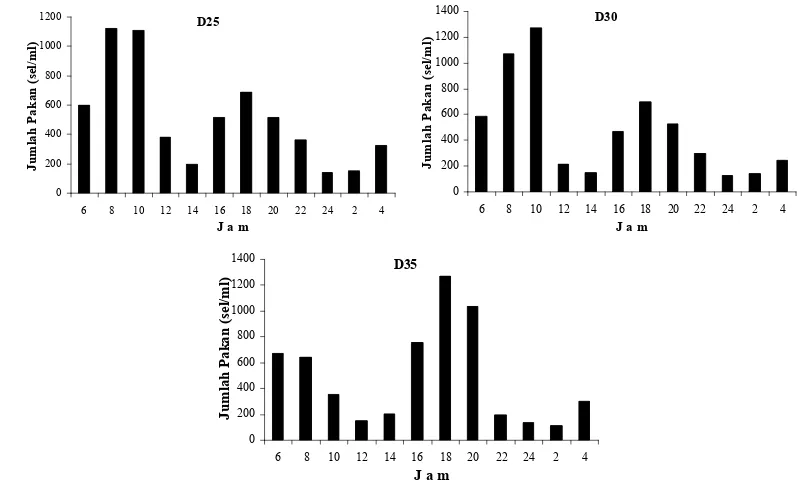
tingkatan stadia... 32 8. Jumlah pakan yang dikonsumsi (sel/ml) spat tiram mutiara P. maxima
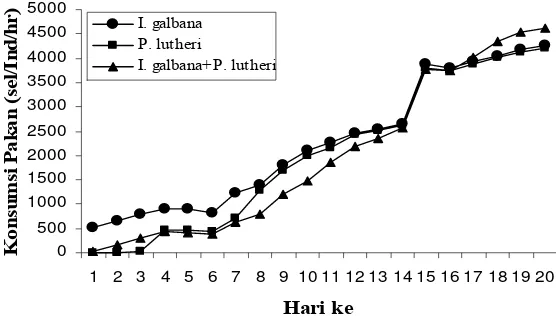
pada berbagai tingkat umur... 33 9. Tingkat konsumsi pakan harian larva P. maxima dari stadia veliger (D1)
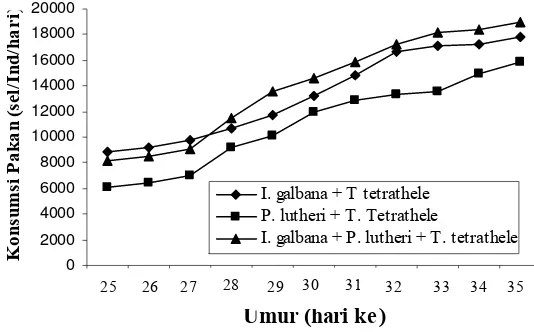
sampai stadia plantigrade (D20)... 34 10. Tingkat konsumsi pakan harian spat P. maxima dari umur 25 – 35 hari... 38 11. Laju pertumbuhan spesifik (%) larva P. maxima (rata-rata ± SD) pada
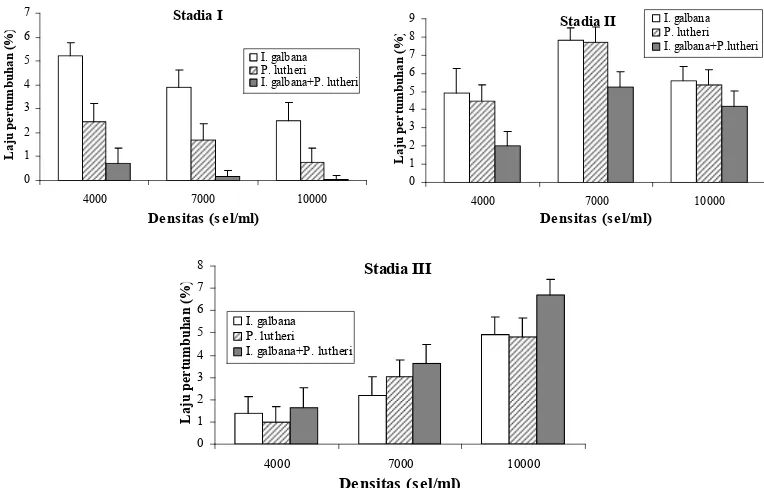
berbagai jenis dan densitas pakan hidup... 40 12. Jadwal pemberian pakan larva tiram mutiara P. maxima dari umur 1–20 hari... 40 13. Laju pertumbuhan spesifik (%) spat P. maxima (rata-rata ± SD) pada
berbagai jenis dan densitas pakan hidup... 45 14. Jadwal pemberian pakan spat tiram mutiara P. maxima dari umur 25–35 hari... 45 15. Lama waktu (hari) pencapaian stadia plantigrade (D20) pada berbagai
jenis dan densitas pakan hidup...…………... 48 16. Disain percobaan untuk pengukuran laju konsumsi oksigen larva
tiram mutiara P. maxima... 60 17. Laju pertumbuhan spesifik (%) larva stadia I, II dan III pada berbagai
Halaman
18. Laju pertumbuhan spesifik (%) spat P. maxima (rata-rata ± SD) pada berbagai suhu dan salinitas………... 77 19. Lama waktu (hari) pencapaian stadia plantigrade larva P. maxima pada
berbagai tingkat suhu dan salinitas………... 79 20. Posisi pengambilan sampel untuk mengetahui behavior larva secara
kuantitatif …... 90 21. Distribusi larva P.maxima stadia veliger sampai platigrade pada berbagai
tingkat intensitas cahaya. (A) 0 lux; (B) 200 lux; (C) 500 lux; (D) 800 lux….... 92 22. Laju pertumbuhan spesifik (%) larva P. maxima (rata-rata ± SD) pada
berbagai tingkat intensitas cahaya... 95 23. Warna spat tiram mutiara P. maxima, (I) Perlakuan A dan B;
(II) Perlakuan C, D dan E... 97 24. Sintasan spat (rata-rata ± SD) pada berbagai tingkat intensitas cahaya... 99 25. Laju pertumbuhan spesifik (%) spat P. maxima pada berbagai tingkat
intensitas cahaya sampai spat... 99 26. Sintasan spat P. maxima (rata-rata ± SD) dari stadia I sampai spat (D25)... 108 27. Laju pertumbuhan spesifik (%) spat P. maxima (rata-rata ± SD) dari stadia I
sampai spat (D25)... 109 28. Pertumbuhan panjang spat P. maxima (rata-rata) pada berbagai waktu
pemindahan selama masa pemeliharaan 90 hari... 123 29. Laju pertumbuhan spesifik (%) spat P. maxima (rata-rata) pada berbagai
waktu pemindahan selama masa pemeliharaan 90 hari... 123 30. Pertumbuhan spat P. maxima (rata-rata ± SD) pada berbagai tingkat
kepadatan selama percobaan ... 130 31. Laju pertumbuhan spesifik (%) spat P. maxima pada berbagai tingkat
kepadatan selama percobaan ... 134 32. Pertumbuhan cangkang spat P. maxima yang tidak normal, (A) Memanjang
DAFTAR LAMPIRAN
Halaman 1a. Lokasi Penelitian kajian pemeliharaan larva dan spat tiram mutiara
P. maxima di laboratorium, Desa Mangkit, Kec. Belang, Kab. Minahasa
Tenggara, Prop. Sulawesi Utara... 165 1b. Lokasi penelitian kajian pemeliharaan spat P.maxima di P. Kabra Kecil
dan Selat Kabra, Kabupaten Raja Empat, Prop. Irian Jaya Barat ... 165 2. Komposisi Pupuk Walne dan Hirata ... 166 3. Jumlah pakan yang dikonsumsi larva P. Maxima (sel/ml/hari) pada
berbagai tingkat stadia... 167 4. Tingkat konsumsi pakan harian larva P. maxima... 168 5. Tingkat konsumsi pakan spat tiram mutiara P. maxima... 168 6. Analisis varian dan uji Tukey terhadap sintasan larva P. maxima pada
berbagai jenis dan densitas pakan hidup …..………... 169
7a. Laju pertumbuhan spesifik (%) larva P. maxima (rata-rata ± SD) pada berbagai jenis dan densitas pakan hidup ... 170 7b. Analisis varian dan uji Tukey terhadap laju pertumbuhan spesifik AP
larva P. maxima pada berbagai jenis dan densitas pakan hidup... 171 7c. Analisis varian dan uji Tukey terhadap laju pertumbuhan spesifik DV
larva P. maxima pada berbagai jenis dan densitas pakan hidup... 172 8a. Sintasan spat P. maxima pada berbagai jenis dan densitas pakan hidup... 173 8b. Analisis kovarian dan uji nilai tengah Tukey terhadap sintasan
spat P. maxima pada berbagai jenis dan densitas pakan hidup... 173 9a. Laju pertumbuhan spesifik (%) spat P. maxima pada berbagai jenis dan
densitas pakan hidup... 174 9b. Analisis varian dan uji Tukey terhadap laju pertumbuhan spesifik spat
P. maxima pada berbagai jenis dan densitas pakan hidup... 174
10a. Lama waktu (hari) pencapaian stadia plantigrade larva P.maxima pada berbagai jenis dan densitas fitoplankton... 176 10b. Analisis varian dan uji Tukey terhadap lama waktu (hari) pencapaian stadia
plantigrade larva P.maxima pada berbagai jenis dan densitas fitoplankton... 176
11. Hasil pengamatan parameter kualitas air pada percobaan pemeliharaan larva
dan spat ……… 177 12. Analisis varian dan uji nilai tengah Tukey terhadap konsumsi oksigen
(mg O2/g berat basah/jam) larva P. maxima stadia veliger sampai
plantigrade pada berbagai suhu dan salinitas... 178 13. Analisis varian dan uji nilai tengah Tukey terhadap laju konsumsi oksigen
spat P. maxima pada berbagai suhu dan salinitas... 179
Halaman
15. Analisis varian dan uji nilai tengah Tukey terhadap laju metabolisme basal spat P. maxima pada berbagai suhu dan salinitas... 181
16. Analisis varian dan uji nilai tengah Tukey terhadap sintasan larva P. maxima pada berbagai tingkat suhu dan salinitas... 182
17a. Laju pertumbuhan spesifik (%) larva P. maxima pada berbagai tingkat suhu dan salinitas………... 183 17b. Analisis varian dan uji nelai tengah Tukey terhadap laju pertumbuhan
spesifik AP x DV larva P. maxima pada berbagai tingkat suhu
dan salinitas………... 184 18a. Sintasan spat P. maxima pada berbagai suhu dan salinitas... 186 18b. Analisis varian dan uji nelai tengah Tukey terhadap sintasan spat
P. maxima pada berbagai suhu dan salinitas... 186
19a. Laju pertumbuhan spesifik (%) spat P. maxima pada berbagai suhu dan
salinitas... 187 19b. Analisis varian dan uji nelai tengah Tukey terhadap laju pertumbuhan
spesifik (%) AP spat P. maxima pada berbagai suhu dan salinitas... 187 19c. Analisis varian dan uji nelai tengah Tukey terhadap laju pertumbuhan
spesifik (%) DV spat P. maxima pada berbagai suhu dan salinitas... 188
20a. Lama waktu (hari) pencapaian stadia plantigrade pada suhu dan salinitas
berbeda………..…. 189 20b. Analisis kovarian dan uji nilai tengah Tukey terhadap lama waktu (hari)
pencapaian stadia plantigrade pada suhu dan salinitas berbeda…….………... 189
21. Distribusi larva P. maxima pada berbagai intensitas cahaya……… 190 22. Analisis varian dan uji nilai tengah Tukey terhadap sintasan larva P. maxima
pada berbagai intensitas cahaya………... 191 23a. Laju pertumbuhan spesifik (%) larva P. maxima pada berbagai tingkat
intensitas cahaya……….……... 192 23b. Analisis varian dan uji Tukey terhadap laja pertumbuhan spesifik (AP) larva
P. maxima pada berbagai intensitas cahaya……….. 192 23c. Analisis varian dan uji Tukey terhadap laja pertumbuhan spesifik (DV) larva
P. maxima pada berbagai intensitas cahaya……….. 193
24a. Sintasan, laja pertumbuhan spesifik (rata-rata ± SD) spat pada berbagai tingkat intensitas cahaya... 194 24b. Analisis varian dan uji Tukey terhadap sintasan, laja pertumbuhan spesifik
spat pada berbagai tingkat intensitas cahaya... 195 25a. Sintasan dan laja pertumbuhan spesifik spat pada kondisi
lingkungan optimum... 197 25b. Analisis varian dan uji Tukey terhadap sintasan dan laju pertumbuhan
Halaman
26. Analisis varian dan uji Tukey terhadap sintasan spat P. maxima pada lama waktu pemindahan dari lab ke tempat pemeliharaan di laut... 200
27a. Pertumbuhan Panjang spat P. maxima terhadap lama waktu pemindahan dari laboratorium ke tempat pemeliharaan di laut... 201 27b. Analisis varian dan uji nilai tengah Tukey terhadap pertumbuhan panjang
spat P. maxima terhadap lama waktu pemindahan dari laboratorium ke tempat pemeliharaan di laut... 203
28a. Hasil pengamatan beberpa parameter fisika dan kimia air pada lokasi
pemeliharaan spat tiram mutiara P. maxima di Selat Kabra... 204 28b. Jenis dan kelimpahan fitoplankton di lokasi penelitian perairan Selat Kabra... 204 29a. Sintasan spat P. maxima pada berbagai tingkat kepadatan... 205 29b. Analisis varian dan uji nilai tengah Tukey terhadap sintasan spat P. maxima
pada berbagai tingkat kepadatan... 206
30a. Pertumbuhan spat P. maxima pada berbagai tingkat kepadatan ... 207 30b. Analisis varian dan uji Tukey terhadap pertumbuhan spat P. maxima pada
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara penghasil mutiara “South Sea Pearl” dari tiram mutiara Pinctada maxima yang sangat digemari di pasaran dunia. Sebagian besar produksi South Sea Pearl yang dipasarkan berasal dari hasil budidaya (Anna 2006). Perkembangan usaha budidaya mutiara saat ini sudah mengarah pada kegiatan industri yang terintegrasi (Fassler 1995). Berdasarkan nilai ekspor hasil perikanan pada tahun 2006, mutiara dapat dijadikan sebagai salah satu andalan penyumbang devisa negara. Ekspor mutiara sekitar 1,94 % dari total ekspor hasil perikanan, dengan jumlah ekspor mencapai 18.000 kg, atau senilai US $ 13.793.000 (DKP 2006).
Diperkirakan, saat ini di Indonesia terdapat sekitar 65 perusahaan budidaya mutiara, dari jumlah tersebut hanya 10 % yang mempunyai unit pembenihan sendiri, sisanya masih tergantung pada hasil tangkapan dari alam. Kecenderungan yang berkembang saat ini, khususnya perusahaan-perusahaan di daerah Indonesia Bagian Tengah dan Timur ternyata lebih memilih spat yang berasal dari hatchery untuk kemudian dibesarkan, karena ukurannya seragam, lebih mudah beradaptasi dan dalam waktu relatif singkat dapat diperoleh jumlah yang banyak. Menurut Gricourth et al. (2006) pada kondisi permintaan spat dari alam menjadi isu utama, maka permintaan akan produksi spat dari hatchery juga akan terus meningkat secara efisien.
Pada umumnya, dalam satu siklus implantasi atau operasi pemasangan inti bulat dibutuhkan tiram antara 10.000–40.000 ekor. Perusahan bermodal besar, dalam satu siklus biasanya mengimplan 20.000–50.000 ekor, sedangkan perusahaan kecil antara 5.000–10.000 ekor (Daryatmo 2003). Dari sekitar 58 perusahaan yang tidak memiliki unit pembenihan, setiap siklus operasi (1 tahun dua siklus) membutuhkan tiram mutiara rata-rata 25.000 ekor. Diperkirakan setiap tahun ada permintaan tiram mutiara ukuran implantasi sebesar 2.900.000 ekor.
Berkembangnya budidaya mutiara ternyata juga menjadi pemicu meningkatnya permintaan spat dan tiram siap operasi. Sedangkan spat dan calon induk yang berasal dari alam jumlahnya terbatas, sangat fluktuatif dan dipengaruhi musim. Penyediaan spat secara terkendali melalui hatchery merupakan alternatif yang tepat untuk menanggulangi terbatasnya spat alam. Hatchery mampu menyediakan spat secara massal, tepat waktu dan jumlah, disamping ukurannya seragam serta berkualitas tinggi. Menurut Jeffrey et al. (1990) tujuan utama dari kegiatan pembenihan adalah memproduksi jutaan juvenil (spat) dengan cara memelihara larva pada tingkat kepadatan yang lebih tinggi dari kondisi di alam. Produksi spat melalui hatchery merupakan pendekatan yang paling memungkinkan untuk menyediakan spat dalam skala besar dan berkesinambungan (Rupp et al. 2005).
Kendala utama pada pembenihan tiram mutiara saat ini adalah pertumbuhan yang lambat dan sintasan rendah dalam pemeliharaan larva dan spat. Sintasan dari larva (D1) sampai menjadi spat berukuran 2–3 cm sekitar 0,05 % dan untuk mencapai ukuran 2–3 cm diperlukan waktu pemeliharaan selama 3–4 bulan (BBL 2001). Menurut Taufiq (2009) sintasan spat P. maxima umur 30 hari pemeliharaan di laboratorium antara 6–7 %. Diduga, salah satu faktor yang menyebabkan sintasan rendah dan pertumbuhan lambat adalah kondisi lingkungan pemeliharaan seperti suhu, salinitas, pH, DO dan pakan optimum yang belum diketahui. Menurut Odum (1976); Asha and Muthiah (2005) kondisi lingkungan mempunyai peranan yang vital pada saat perkembangan larva, lebih spesifik lagi kondisi kualitas air secara menyeluruh berpengaruh terhadap komunitas perairan. Apabila salah satu faktor lingkungan melewati batas toleransi spesies atau jika salah satu unsur tersebut jumlahnya menurun sampai di bawah batas kebutuhan minimum spesies sehingga menjadi faktor pembatas, maka spesies tersebut akan mengalami perubahan pola dispersi, aktivitas fisiologis terganggu, bahkan dapat mengakibatkan kematian.
menyampaikan status budidaya tiram mutiara P. maxima pada PT. Autore Pearl Culture di Sumbawa. Taufiq et al. (2009) dan Mangidi et al. (1009) melakukan studi pertumbuhan tiram mutiara P. maxima di perairan Sumbawa dan Sekotong, Lombok (NTB). Di India, Alagarswami et al. (1983; 1987), CFMRI (1991), Dharmaraj et al. (1991) melakukan studi pembenihan tiram mutiara P. fucata. Studi aspek lingkungan dan budidaya P. margaritifera di laut telah dilakukan oleh Friedman and Bell (1996; 1999), Friedman and Southgate (1999), Southgate et al. (1998). Taylor et al. (1997; 1998) di Australia lebih banyak melakukan penelitian pada P. maxima di alam. Studi tentang larva Pteria sterna dilakukan oleh Martinez-Fernandez et al. (2004) dan Wayne et al. (2004) melakukan pengkajian pada embrio dan juvenil P. imbricata.
Sampai saat ini, sebagian besar kegiatan pembenihan tiram mutiara di Indonesia masih dilakukan oleh perusahaan-perusahaan besar milik swasta, dengan menggunakan tenaga ahli asing, sehingga penyebaran informasi teknologinya sangat terbatas (Winanto 2004). Sedangkan, tuntutan akan penyediaan spat dalam jumlah yang cukup, tepat waktu dan berkesinambungan, serta kebutuhan informasi teknologi pembenihan tiram mutiara sangat dibutuhkan. Berkaitan dengan hal tersebut, maka perlu dilakukan penelitian tentang kebutuhan lingkungan optimum, untuk mengoptimalkan sintasan dan laju pertumbuhan larva serta spat tiram mutiara P. maxima, sehingga dapat dibuat standar operasional prosedure (SOP) untuk produksi
spat secara massal dan terkendali. SOP tersebut dapat dilakukan oleh praktisi atau pembudidaya perikanan, pengusaha dan masyarakat perikanan pada umumnya.
Perumusan Masalah
Rasionalisasi dari perkembangan usaha budidaya mutiara menjadi industri budidaya adalah kemampuan menyediakan tiram implan dalam jumlah yang cukup dan berkesinambungan. Konsekuensinya adalah eksploitasi tiram dari alam dengan intensitas tinggi, akibatnya populasi di alam menurun drastis. Sampai saat ini, sebagian besar perusahaan budidaya mutiara di Indonesia masih sangat tergantung pada spat alam dan kegiatan penyelaman tiram mutiara sangat tergantung pada musim.
2005). Upaya penyediaan spat melalui hatchery, merupakan langkah yang paling bijaksana untuk mengurangi perburuan tiram mutiara di alam.
Pada pemeliharaan larva sampai spat diperlukan kondisi lingkungan yang optimum dan terkendali, karena pada stadia tersebut kondisinya masih sangat rentan, jika terjadi perubahan lingkungan dalam pemeliharaan dapat mengakibatkan kematian, sehingga berbagai kajian yang berkaitan dengan pemeliharaan larva dan spat baik yang dilakukan di laboratorium maupun di lapangan (laut) sangat diperlukan. Menurut Gricourth et al. (2006) untuk memproduksi larva dan spat baik secara kualitas maupun kuantitas diperlukan kondisi lingkungan pemeliharaan yang optimal, seperti untuk perkembangan, pertumbuhan dan proses-proses fisiologis yang mengatur serta mengontrol kondisi biota laut.
Perkembangan, pertumbuhan dan sintasan tiram mutiara sangat dipengaruhi oleh faktor lingkungan seperti suhu, salinitas, oksigen terlarut (DO), pH dan intensitas cahaya. Menurut Alfaro (2005); Asha dan Muthiah (2005); Martinez-Fernandez et al. (2004) dalam memproduksi spat skala besar di hatchery, sangat diperlukan informasi tentang pengaruh suhu, salinitas, DO dan pakan terhadap pertumbuhan dan sintasan larva serta spat.
Beberapa pendekatan yang dapat dilakukan untuk mengatasi permasalahan yang terjadi (Gambar 1, 2), yaitu melakukan pengkajian perkembangan larva dan pertumbuhan spat. Kajian ini dibagi menjadi tiga tahap penelitian, yaitu Penelitian Tahap Pertama: Kajian pemeliharaan larva dan spat di laboratorium, terdiri dari tiga seri percobaan yaitu studi pendahuluan pengaruh jenis dan densitas pakan hidup terhadap sintasan dan pertumbuhan, mengkaji pengaruh suhu dan salinitas terhadap sintasan dan pertumbuhan, serta mengkaji pengaruh berbagai tingkat intensitas cahaya terhadap sintasan dan pertumbuhan. Penelitian Tahap Kedua: Aplikasi pemeliharaan larva dan spat pada kondisi lingkungan optimum. Penelitian Tahap Ketiga: Kajian pertumbuhan spat di laut, terdiri dari dua seri percobaan yaitu mengkaji umur pemindahan dan tingkat kepadatan spat.
Tujuan Penelitian
Penelitian dilakukan dengan tujuan sebagai berikut:
1. Mengetahui parameter kualitas air optimum (suhu, salinitas, tingkat konsumsi oksigen dan intensitas cahaya), untuk mendapatkan sintasan, perkembangan dan pertumbuhan larva dan spat yang tinggi.
2. Mengetahui umur pemindahan yang tepat dan tingkat kepadatan optimum, untuk mendapatkan sintasan dan pertumbuhan spat yang tinggi.
3. Membuat standar operasional prosedure (SOP) pemeliharaan larva dan spat untuk mengoptimalkan sintasan dan laju pertumbuhan.
Manfaat Penelitian
Manfaat yang diharapkan dari hasil penelitian adalah meningkatkan sintasan serta laju pertumbuhan larva dan spat, sehingga dapat menjadi informasi dasar bagi pengembangan hatchery skala rumah tangga tiram mutiara P. maxima. Hasil studi juga diharapkan berguna untuk pengembangan produksi massal spat di masa datang dan atau penebaran benih kembali (restocking) di alam. Lebih lanjut, produksi hatchery tersebut dapat mencukupi kebutuhan spat secara nasional, sehingga dapat mengurangi perburuan tiram mutiara di alam dan menjaga kelestarian sumberdayanya. Perkembangan teknologi hatchery skala rumah tangga yang dikelola oleh anak-anak bangsa, diharapkan bisa mengurangi dominansi tenaga ahli asing, membuka lapangan kerja dan memberi peluang berkembangnya swasta nasional dan usaha kecil budidaya mutiara.
Hipotesis
1. Terdapat perbedaan sintasan, perkembangan, pertumbuhan larva dan spat pada suhu, salinitas, tingkat konsumsi oksigen dan intensitas cahaya optimum yang berbeda.
MASALAH PENDEKATAN MASALAH
ASPEK KAJIAN PARAMETER YANG
DIAMATI
LUARAN APLIKASI
Gambar 1. Kerangka konseptual pendekatan masalah dan tahapan penelitian larva dan spat tiram mutiara P. maxima di laboratorium Spat
Pakan Hidup
Lingkungan
Tingkah laku Morfologi
Suhu
Salinitas
Intensitas Cahaya
Oksigen (DO) Larva
Metabolisme Respon Larva & Spat
Konsumsi Oksigen
Jadwal Pemberian Pakan
Lingkungan Optimum Sintasan
Pertumbuhan
Biometri Morfogenesis Jenis & Densitas
Aktivitas Makan
Tingkat Konsumsi Pakan
Umur Mulai Makan
Stadia Mulai Makan
Waktu Pencapaian Stadia
Produksi Masal Spat, Berkualitas &
Kontinyu
MASALAH PENDEKATAN MASALAH
ASPEK KAJIAN PARAMETER YANG DIAMATI
LUARAN APLIKASI
Gambar 2. Kerangka konseptual pendekatan masalah dan tahapan penelitian spat tiram mutiara P. maxima di laut Spat
Sintasan
Pertumbuhan
Ketepatan Umur Pemindahan dan
Padat Tebar Optimum Waktu Pemindahan
Tingkat Kepadatan
Kualitas Air
Produksi Massal Spat, Berkualitas dan Kontinyu Biometri
Morfogenesis Suhu
Salinitas
pH
DO
Nitrat
Fosfat
Silikat
Kelimpahan Plankton
TINJAUAN PUSTAKA
Tiram Mutiara Pinctada maxima (Jameson)
Tiram mutiara spesies P. maxima termasuk moluska laut, dengan tubuh
dilindungi atau ditutupi oleh sepasang cangkang, termasuk kelas Bivalvia dan famili
Pteriidae (Cahn 1949).
P. maxima merupakan salah satu jenis tiram penghasil mutiara yang
mempunyai nilai ekonomis paling tinggi dan ukuran paling besar. Di pasaran
internasional, mutiara yang diproduksi sering kali disebut dengan nama “South Sea
Pearl” (Shirai 1981). Spesies ini mempunyai diameter dorso-ventral dan
anterior-posterior hampir sama sehingga bentuknya agak bundar. Bagian dorsal berbentuk
datar dan panjang serta dihubungkan oleh semacam engsel berwarna hitam
(Takemura and Kafuku 1957).
Tiram muda atau spat mempunyai warna cangkang bervariasi dengan warna
dasar kuning pucat, kuning tua atau kuning kecoklatan, coklat kemerahan, merah
anggur dan kehijauan. Pada cangkang bagian luar terdapat garis-garis radier yang
menonjol seperti sisik, berwarna lebih terang dari warna dasar cangkang, berjumlah
10 – 12 buah dan ukurannya lebih besar dibandingkan pada spesies lain.
Umumnya setelah dewasa warna cangkang menjadi kuning tua sampai kuning
kecoklatan, warna garis radier biasanya sudah memudar. Cangkang bagian dalam
(nacre) berkilau dengan warna putih-keperakan, bagian tepi nacre (nacreous-lip) ada
yang berwarna keemasan sehingga sering disebut “Gold-lip Pearl Oyster” dan yang
berwarna perak disebut juga “Silver-lip Pearl Oyster”. Pada bagian luar nacre
(non-nacreous border) berwarna coklat kehitaman.
Habitat dan Daerah Penyebaran
P. maxima disebut juga Shirocho-gai merupakan spesies tiram mutiara yang
ukurannya paling besar (Shirai 1981; Takemura and Kafuku 1957). Tempat hidupnya
mulai dari perairan dangkal dengan dasar perairan berpasir, atau pasir berkarang yang
pada karang hingga kedalaman 10–75 m. Ditemukan juga di perairan laut dalam
dengan substrat bersedimen di daerah yang berdekatan dengan landas kontinen dan
paparan pulau, dimana airnya agak keruh. Biasanya dapat ditemukan banyak individu
tergeletak di atas substrat tanpa bisus (Gervis and Sims 1992; Tun and Winanto
1987; Yukihira et al. 1999, 2006). Di lokasi sekitar budidaya mutiara sering kali
ditemukan hidup menempel pada karang di kedalaman 50–100 cm (Winanto et al.
1992).
Daerah penyebaran P. maxima mulai dari laut Arafuru, Australia bagian
Utara, Philipine, Myanmar, Thailand, Papua New Guiniea dan Indonesia. Di perairan
Indonesia Pinctada maxima dapat ditemukan mulai dari Kep Aru, Papua, Laut
Banda, Kep. Maluku, Kep. Bacaan, Laut Seram, Nusa Tenggara Barat, Nusa
Tenggara Timur, Sulawesi Tenggara, pantai Utara Jawa Barat dan Banten,
Kalimantan Barat dan Bangka-Belitung. Namun demikian polulasi terbesar berada di
daerah Indonesia bagian Tengah dan Timur (Tun and Winanto 1987; Winanto et al.
1992).
Siklus Hidup dan Reproduksi
Tiram mutiara mempunyai jenis kelamin terpisah, kecuali pada beberapa
kasus tertentu ditemukan sejumlah individu yang hermaprodit. Perubahan kelamin
(sex reversal) biasanya terjadi pada sejumlah individu setelah memijah atau pada
stadia awal perkembangan gonad. Fenomena sex reversal juga diamati Wada and
Wada (1939) dalam Cahn (1949) terhadap tiram P. maxima, hasilnya menunjukkan
bahwa jenis kelamin tiram ternyata tidak tetap, sejumlah jantan berubah menjadi
betina dan sebaliknya betina bisa menjadi jantan.
Bentuk gonad tebal-menggembung, pada kondisi matang penuh gonad
menutupi seluruh organ dalam (perut, hati dan yang lain) kecuali bagian kaki. Secara
eksternal sulit untuk membedakan antara gonad jantan dan betina, utamanya pada
stadia awal, keduanya berwarna krem kekuningan. Tetapi setelah stadia matang
penuh, gonad tiram P. maxima jantan berwarna putih krem, sedang yang betina
berwarna kuning tua. Sedangkan menurut Chellam (1987); CMFRI (1991) gonad
jantan P. fucata berwarna krem pucat keputihan dan betina berwarna krem
Tingkat kematangan gonad tiram mutiara dikelompokkan menjadi lima stadia
(deskripsi perkembangan gonad ini hanya didasarkan pada tiram betina) yaitu :
Stadia I : Tahap tidak aktif/salin/ istirahat (inactive/spent/resting); Stadia II:
Perkembangan/ pematangan (developing/maturing); Stadia III: Matang (mature);
Stadia IV: Matang penuh/memijah sebagian (fully maturation/partially spawned);
Stadia V : Salin (spent). Pada stadia awal perkembangan gonad, tiram jantan dan
betina menunjukkan perkembangan reproduksi yang sama, oleh karena itu pada
stadia II dan III warna gonad krem pucat. Pada stadia gametogonesis yang lain,
gonad jantan dan betina nampak sama jika diamati secara ekternal (Chellam 1987;
CMFRI 1991; Winanto 2004).
Pada berbagai kasus di lapangan, para praktisi (breeder) sering kali
menggunakan induk stadia III dan IV untuk pemijahan. Spesifikasi induk betina
stadia III adalah gonad tersebar merata hampir di seluruh jaringan organ, biasanya
berwarna krem kekuningan. Sebagian besar oocyt berbentuk buah peer, dengan
ukuran 68 x 50 .μm, ukuran inti 25 μm. Sedangkan induk Stadia IV mempunyai
ciri-ciri gonad menggembung, tersebar merata dan secara konsisten akan keluar dengan
sendirinya atau jika ada sedikit trigger. Oocyt bebas dan terdapat di seluruh dinding
kantong gonad. Hampir semua oocyt berbentuk bulat dan berinti, dengan ukuran
rata-rata 51,7 .μm.
Menurut Wada et al. (1995) pengetahuan tentang biologi reproduksi tiram
mutiara sangat dibutuhkan untuk pengembangan industri budidaya mutiara,
khususnya memahami perkembangan gonad dan dinamika populasinya di alam.
Pengetahuan ini dapat digunakan untuk mengembangkan teknik pembenihan dan
perbaikan teknik penempatan inti bulat di dalam gonad pada budidaya mutiara.
Hasil pengamatan Winanto et al. (2002) terhadap stadia kematangan gonad
dan musim pemijahan P. maxima di Teluk Hurun, Lampung dari tahun 1996–2002
menunjukkan, bahwa kematangan gonad terjadi setiap bulan, namun stadia
kematangan gonad penuh (TKG IV) hanya terjadi pada bulan Maret, Mei dan
Agustus sampai Nopember. Gonad dalam masa istirahat (resting phase) terjadi pada
bulan Desember, stadia I dan II terjadi hampir sepanjang tahun. Selama tujuh tahun
pengamatan, dicatat stadia perkembangan gonad tertinggi hanya sampai TKG II
terutama pada bulan April dan Juni. Sedangkan TKG III terjadi pada bulan Januari–
Chellam (1987); CMFRI (1991) menyatakan bahwa beberapa jenis tiram
mutiara dapat dijumpai matang gonad sepanjang tahun. Sedangkan Chacko (1970)
dan Rao (1970) melaporkan bahwa musim pemijahan Pinctada spp terjadi setiap
bulan sepanjang tahun. Musim puncak kematangan gonad identik dengan musim
puncak pemijahan. Pada musim tertentu, induk tiram di alam yang telah dewasa
akan bertelur. Telur-telur tersebut kemudian akan dibuahi oleh sel kelamin jantan
(sperma) dan pembuahan terjadi secara eksternal di dalam air.
Telur yang telah dibuahi akan mengalami perubahan bentuk, mula-mula
terjadi penonjolan polar, lalu membentuk polar lobe II yang merupakan awal proses
pembelahan sel dan akhirnya menjadi multisel. Tahap berikutnya adalah fase
trocofor, dengan bantuan bulu-bulu getar trocofor dapat berenang-renang dan
bergerak berputar-putar. Beberapa jam kemudian trocofor akan berkembang menjadi
veliger atau larva bentuk D (Gambar 3), dengan ditandai tumbuhnya organ mulut
dan pencernaan. Larva mulai makan dan tubuhnya telah ditutupi cangkang tipis.
Perkembangan selanjutnya adalah tumbuh velum, pada fase ini biasanya sangat
sensitif terhadap cahaya dan sering berenang-renang di permukaan air. Selama stadia
planktonis, larva biasanya berenang-renang dengan menggunakan bulu-bulu getar
atau menghanyut dalam arus air.
Pada saat mencapai stadia umbo (Gambar 3) secara bertahap cangkang juga
ikut berkembang. Bentuk sepasang cangkangnya sama dan mantel sudah berfungsi
secara permanen. Pada akhir stadia umbo, larva bergerak dengan menggunakan
velum.
Stadia pediveliger (Gambar 3) ditandai dengan berkembangnya kaki,
gerakan-gerakan sederhana dari berenang sampai berputar-putar dilakukan dengan
velum dan kaki. Setelah kaki berfungsi dengan baik velum akan menghilang,
lembaran-lembaran insang mulai nampak jelas.
Proses pencarian tempat atau substrat untuk menempel dan menetap dimulai
sejak larva mencapai stadia pediveliger. Pertumbuhan awal cangkang terlihat pada
bagian tepi cangkang, bentuknya sangat tipis, transparan, tersusun oleh selaput tipis
conchiolin. Pada waktu yang sama kelenjar bisus akan mensekresikan
benang-benang bisus untuk menempel. Organ lain yang berkembang yaitu labial palp dan
insang. Stadia pertumbuhan setelah pediveliger ini biasanya disebut Plantigrade
Perkembangan akhir larva yaitu perubahan stadia plantigrade menjadi spat
(Gambar 3). Bentuk spat menyerupai tiram dewasa, mempunyai engsel, auricula
depan dan belakang serta terdapat takik bisus pada bagian anterior. Cangkang
sebelah kiri lebih cembung dari pada yang kanan. Spat-spat bisa menempel pada
substrat dengan bantuan benang-benang bisus. Laju pertumbuhan dari stadia larva
sampai spat pada satu tempat dan tempat yang lain berbeda-beda, tergantung dari
faktor lingkungan.
Gambar 3. Siklus hidup tiram mutiara Pinctada maxima (modifikasi dari Tun and Winanto 1987; Winanto 1988; Ikenoue and Kafuku 1992). (1) Telur dan sperma. (2) Telur dibuahi. (3) Pembelahan sel. (4) Gastrula. (5) Larva bentuk-D. (6) Stadia umbo. (7) Spat. (8) Dewasa.
Sistem Pencernaan
Seperti halnya pada jenis kekerangan yang lain, tiram mutiara mampu
memanfaatkan phytoplankton yang terdapat secara alamiah di sekitarnya. Tiram
mutiara bersifat filter feeder atau mengambil makanan dengan jalan menyaring
pakan yang ada di dalam air laut. Getaran silia pada insang menimbulkan arus air
yang masuk ke dalam rongga mantel. Gerakan silia akan memindahkan
phytoplankton yang berada di sekeliling insang dan dengan bantuan labial palp atau
melalui simpul bibir yang bergerak-gerak akan membawa masuk makanan ke dalam
mulut (Gosling 2004; Velayudhan and Gandhi 1987).
Mulut terletak pada bagian ujung depan saluran pencernaan atau di sebelah
yang pendek langsung masuk perut, atau saluran kantong tipis pada perut dengan
kulit luar (cuticle) kasar yang berfungsi untuk memisah-misahkan makanan. Dari
perut sisa makanan (kotoran) akan dibuang melalui saluran usus yang relatif pendek
dan bentuknya seperti huruf S kemudian keluar lewat anus (Velayudhan and Gandhi
1987).
Sistem Pernafasan
Insang merupakan organ yang mempunyai peran fungsional baik dalam
pernafasan maupun osmoregulasi. Sel-sel yang berperan pada proses osmoregulasi
adalah sel-sel chlorida yang terletak pada bagian dasar lembaran-lembaran insang.
Insang berjumlah empat buah, berbentuk sabit, dua insang berada di sisi kanan dan
kiri, menggantung pada pangkal mantel seperti lipatan buku (Velayudhan and
Gandhi 1987).
Air yang masuk melalui saluran inhalen akan terhenti pada bagian mantel,
lalu secara cepat dan kompak bekerjasama dengan insang sehingga dapat
memanfaatkan udara yang terangkut dan air dikeluarkan kembali melaui saluran
ekshalen. Air serta darah yang tidak berwarna masuk melalui beberapa filamen
tunggal lalu mengalir ke luar menuju pinggir insang, kemudian melintas ke atas
berputar kembali melalui filamen dan masuk ke branchial atau ctenidial. Dengan
bantuan silia-silia pada branchial dapat menimbulkan arus yang masuk ke bilik palial
dan melintas keatas, melalui lamela branchial. Jadi selain menjalankan fungsi
pernafasan, filamen pada insang dan mantel dapat memperlancar peredaran darah
(Gosling 2004; Velayudhan and Gandhi 1987).
.
Kualitas Air
Perkembangan, pertumbuhan dan sintasan tiram mutiara sangat dipengaruhi
oleh kualitas air di lingkungan tempat hidupnya. Beberapa parameter kualitas air
tersebut antara lain suhu, kecerahan, salinitas, Oksigen terlarut (DO), pH. dan pakan
hidup (CMFRI 1991; Gricourth et al. 2006; O’Connor and Lawler 2004; Soria et al.
Suhu
Perubahan suhu memegang peranan penting dalam aktivitas biofisiologi tiram
mutiara di dalam air. Menurut Cahn (1949) suhu yang baik untuk kelangsungan
hidup tiram mutiara berkisar antara 25−30 oC. Sedangkan menurut Suharyanto et al. (1993), suhu air pada kisaran 27−31 oC dianggap cukup layak untuk kehidupan tiram mutiara P. margaritifera (japing-japing).
Menurut Nayar dan Mahadevan (1987); Alagarswami et al. (1983 a), selama
pemeliharaan di dalam laboratorium, suhu yang bervariasi dapat mempengaruhi
waktu penempelan larva tiram mutiara. Pada suhu 28,2−29,8 oC, larva akan menempatkan diri untuk menetap-melekat pada substrat setelah umur 24 hari.
Selanjutnya pada rentang suhu 24,3−27,2 oC larva baru akan melekat setelah 32 hari. Pada suhu yang rendah, sebagian besar waktu tiram mutiara akan dihabiskan untuk
melakukan metamorfose secara lengkap dan melekatkan diri untuk menetap.
Suhu air sangat berperan dalam mengendalikan proses metabolisme.
Perubahan suhu walaupun kecil selama pemeliharaan larva dapat mengakibatkan
kematian. Pada suhu antara 24−30 oC, tiram mutiara P. margaritifera sangat aktif melakukan kegiatan metabolisme, sedangkan pada suhu 18−20 oC tidak aktif lagi. Suhu air yang baik untuk pemeliharaan larva berkisar antara 25−27 oC (Hisada dan Komatsu, 1985; Holliday et al. 1993; Shokita et al. 1991). Di Balai Budidaya Laut
Lampung, Larva dan spat P maxima menunjukkan pertumbuhan dan kelangsungan
hidup yang baik pada kisaran suhu 26 – 28 oC (BBL 2001).
Kecerahan
Kecerahan air berpengaruh terhadap fungsi dan struktur invertebrata dalam
air. Lama penyinaran akan berpengaruh terhadap proses pembukaan dan penutupan
cangkang. Cangkang tiram akan terbuka sedikit bila ada cahaya, dan terbuka lebar
bila suasananya gelap. Oleh sebab itu ruang pemeliharaan larva dan spat biasanya
dibuat agak gelap, dengan tujuan agar organisme yang dipelihara merasa nyaman dan
cangkang bisa bebas terbuka, sehingga proses filtrasi pakan dapat berlangsung
Kecerahan yang tidak terlalu tinggi dapat melindungi tubuh larva stadia
veliger dari radiasi sinar ultra violet. Karena larva masih bersifat fototaksis positif
dan umumnya di dalam proses metamorfose menghendaki sinar yang sesuai (CMFRI
1991).
Lokasi pemeliharaan induk sebaiknya mempunyai kecerahan antara 4,5–6,5
m. Apabila kecerahan lebih dari kisaran tersebut akan menyulitkan pemeliharaan,
karena demi kenyamanan induk harus dipelihara di kedalaman melebihi tingkat
kecerahan yang ada (Tun and Winanto 1987).
Salinitas
Dilihat dari habitatnya tiram mutiara lebih menyukai hidup pada salinitas
yang tinggi. Tiram mutiara toleran terhadap kisaran salinitas 24 dan 50 %o, namun
hanya untuk jangka waktu yang pendek yaitu sekitar 2–3 hari.
Lokasi pembenihan sebaiknya dipilih di lokasi perairan yang memiliki
salinitas antara 32–35 %o, karena baik untuk pertumbuhan dan kelangsungan hidup
larva dan spat. Pada salinitas 14 %o dan 50 %o, dapat mengakibatkan kematian tiram
mutiara sampai 100 % (BBL 2001; Tun and Winanto 1987).
Oksigen terlarut (DO)
Bagi organisme akuatik yang dibudidayakan, oksigen terlarut dapat menjadi
faktor pembatas kelangsungan hidup, perkembangan dan pertumbuhan. Menurut
Imai (1982), tiram dapat hidup dengan baik pada perairan dengan kandungan oksigen
terlarut berkisar antara 5,20−6,60. Pengamatan Darmaraj (1983) di daerah populasi alami tiram P. sugilata menunjukkan bahwa kadungan rata-rata oksigen terlarut di
bagian permukaan air 4,22 ml/l dan dasar perairan 4,37 ml/l. Sadangkan
pengamatannya di daerah budidaya mencatat kandungan oksigen terlarut di bagian
permukaan 5,05 ml/l dan di dasar perairan 4,77 ml/l.
Pendapat yang berbeda disampaikan oleh Nayar dan Mahadevan (1987),
bahwa tiram mutiara tidak akan mengalami banyak stres pada kisaran konsentrasi
kebanyakan moluska tergantung pada batas tekanan oksigen terlarut, sampai
mencapai batas tekanan terendah hingga oksigen terlarut akan naik kembali.
Hasil penelitian Dharmaraj (1983) tentang kebutuhan oksigen terlarut tiram
mutiara P. fucata, menunjukkan bahwa tiram berukuran 40−50 mm mengkonsumsi oksigen 1,339 μl/l; ukuran 50−60 mm mengkonsumsi 1,650 μl/l dan ukuran 60−70 mm mengkonsumsi 1,810 μl/l.
Di tempat pemeliharaan yang terkendali seperti hatchery, sebenarnya
kebutuhan oksigen terlarut tidak menjadi masalah, karena ketersediaannya dapat
diatasi dengan memberikan pengudaraan buatan menggungkan alat blower (CMFRI
1991).
pH
pH air yang layak untuk kehidupan tiram mutiara P. maxima berkisar antara
7,8–8,6 (Matsui 1960). Sedangkan pada pH 7,9–8,2 tiram mutiara dapat berkembang
biak dan tumbuh dengan baik.
Menurut Mahadevan and Nayar (1974); Nayar and Mahadevan (1987), pada
prinsipnya habitat tiram mutiara berada pada perairan dengan pH lebih tinggi dari
6,75. Tiram tidak akan bereproduksi kembali bila pH lebih tinggi dari 9,00. Aktivitas
tiram akan meningkat pada pH 6,75–7,00 dan menurun pada pH 4–6,5., pada kisaran
pH tersebut jumlah tiram yang normal hanya sekitar 10 %.
Pakan Hidup
Pakan merupakan salah satu faktor penentu di dalam keberhasilan kegiatan
pembenihan tiram mutiara. Ketersediaan pakan yang tepat waktu, jumlah dan jenis
akan sangat mendukung sukses produksi massal spat. Pakan utama yang biasa
diberikan pada larva tiram mutiara yaitu jenis flagelata, berukuran kurang dari 10
mikron. Beberapa jenis alga yang umum diberikan untuk pakan antara lain Isochrysis
galbana, Pavlova lutheri/Monochrysis lutheri, Chromulina sp., Chaetoceros sp.,
Nannochloropsis sp., dan Dicrateria sp. Untuk fase pertumbuhan sampai menjelang
spat dapat diberi variasi berbagai jenis alga tersebut. Namun untuk stadia awal larva,
Haptophyceae) dengan ukuran sekitar 7 μm. Adakalanya digunakan jenis Tetraselmis
tetrathele dan Chlorella sp., terutama untuk stadia spat atau sebagai pakan campuran
induk (Alagarswami et al. 1987; Dharmaraj et al. 1991; Winanto el al. 2001;
Winanto 2004). Menurut Martinez-Fernandez (2004) beberapa jenis mikroalga yang
digunakan sebagai pakan larva Pteria sterna antara lain Nannochloris sp, Pavlova
lutheri, Isochrysis galbana, Phaeodactilum tricornutum, Chaetoceros meulleri,
Chaetoceros calcitran, Thalassiosira weisflogii, Dunaliella salina, Tetraselmis
tetrathele, Tetraselmis suecica (Tabel 1). Namun mikroalga yang dapat dicerna oleh
[image:34.612.112.542.293.545.2]larva hanya Nannochloris sp., Pavlova lutheri dan Isochrysis galbana.
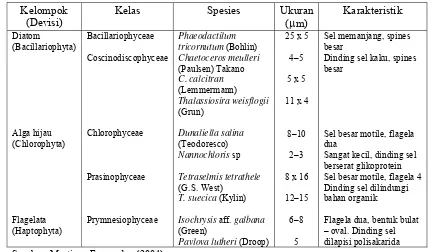
Tabel 1. Spesies mikroalga yang digunakan sebagai pakan larva Pteria sterna
Kelompok (Devisi)
Kelas Spesies Ukuran
(μm)
Karakteristik Diatom (Bacillariophyta) Alga hijau (Chlorophyta) Flagelata (Haptophyta) Bacillariophyceae Coscinodiscophyceae Chlorophyceae Prasinophyceae Prymnesiophyceae Phaeodactilum tricornutum (Bohlin) Chaetoceros meulleri (Paulsen) Takano C. calcitran (Lemmermann) Thalassiosira weisflogii (Grun) Dunaliella salina (Teodoresco) Nannochloris sp Tetraselmis tetrathele (G.S. West)
T. suecica (Kylin)
Isochrysis aff. galbana (Green)
Pavlova lutheri (Droop)
25 x 5
4–5
5 x 5
11 x 4
8–10
2–3
8 x 16
12–15
6–8
5
Sel memanjang, spines besar
Dinding sel kaku, spines besar
Sel besar motile, flagela dua
Sangat kecil, dinding sel berserat glikoprotein Sel besar motile, flagela 4 Dinding sel dilindungi bahan organik
Flagela dua, bentuk bulat – oval. Dinding sel dilapisi polisakarida
Sumber: Martinez-Fernandez (2004)
Preferensi larva terhadap pakan sangat tergantung pada ukuran dan spesies,
masing–masing jenis tiram mempunyai kemampuan yang berbeda-beda dalam
memilah dan mengambil makanan yang disukai. Pada prinsipnya, mikro alga yang
digunakan sebagai pakan larva tiram atau organisme laut lainnya adalah mempunyai
ukuran yang tepat untuk dimakan atau sesuai dengan bukaan mulut larva/spat, mudah
dibudidayakan, cepat tumbuh dengan kepadatan tinggi dan tidak menghasilkan
KAJIAN PEMELIHARAAN LARVA DAN SPAT DI LABORATORIUM
Tujuan Penelitian
Untuk mengetahui kondisi lingkungan yang optimum (suhu, salinitas, tingkat
konsumsi oksigen, intensitas cahaya) pada pemeliharaan larva dan spat P. maxima.
Penelitian Tahap I, kajian pemeliharaan larva dan spat di laboratorium terdiri dari
tiga seri percobaan yaitu :
¾ Pengaruh jenis dan densitas pakan hidup terhadap sintasan serta pertumbuhan
larva dan spat (merupakan studi pendahuluan).
¾ Pengaruh suhu dan salinitas terhadap sintasan serta pertumbuhan larva dan
spat.
¾ Pengaruh berbagai tingkat intensitas cahaya terhadap sintasan serta
pertumbuhan larva dan spat.
Waktu dan Tempat
Penelitian dilakukan mulai dari bulan Pebruari sampai Mei 2007. Aktivitas
penelitian dilakukan di laboratorium C.V. Mina Mitra Usaha, Desa Mangkit,
Kecamatan Belang, Kabupaten Minahasa Tenggara, Propinsi Sulawesi Utara
Pengaruh Jenis dan Densitas Pakan Hidup Terhadap Sintasan Serta Pertumbuhan Larva dan Spat Tiram Mutiara Pinctada maxima (Jameson)
Abstract
Microalgae are the major food source for bivalve. The objective of this research is to obtain information of required food types and densities, to determined of feeding schedule for larva and spat. An experiment was conducted using observations method, factorial randomized block and completely design. The result showed that firstly D-shape larvae was found during 18–20 hours after fertilization and was firstly fed of fitoplankton at 22–24 hours (first critical period). Larvae and spat was consuming food all the day. The larvae was have highest food consumption in the morning at 8 am and the evening at 6 pm, while spat was have tendency consumed a lot of food at about 8–10 am in the morning and evening from 4 to 6 pm. Feeding schedule of larvae could be divided into three groups: (1) D1–D8: larvae fed I. galbana at 2,600–4,200 cells ml-1 day-1. (2) D8–D16: larvae fed I. galbana at 3,700–7,800 cells ml-1 day-1 or P. lutheri at 2,300–7,800 cells ml-1 day-1. (3) D14–D20: larvae fed mixed algae of I. galbana (50 %) and P. lutheri (50 %) at 7,700–9,300 cells ml-1 day-1. Feeding schedule of D25–D28 spat are mixtures food of I. galbana (50 %) + T. tetrathele (50 %) at density 8,900–10,700 cells ml-1 day-1. Food type for D28–D35 spat: mixtures food of I. galbana (25 %) + P. lutheri (25 %) + T. tetrathele (50 %). Food density of D28–D31 spat, 11,000–15,800 cells ml-1 day-1. D31–D33: 15,800–18,200 cells ml-1 day-1 and D33–D35: 18,200–18,900 cells ml-1 day-1 density. Highest survival rate of larvae stage I, was recorded for treatment AD (90.47 %); Stage II at treatment AE (82.28 %) and stage III at treatment CF (62.50 %). The highest survival rate of spat was showed by treatment CE (86.53 %) or combination of I. galbana (25 %) + P. lutheri (25 %) + T. tetrathele (50 %) at density 15,000 cells ml-1. The best of relative growth length of larvae stage I, was showed by treatment AD (AP x DV = 32.50 x 25.63 µm); at stage II, by treatment AE (66.95 x 55.44 µm) and at stage III, by treatment CF (60.37 x 56.71 µm).The quickest of attainment time of plantigrade stage was found on treatment CF (days 19,2) and at longest on treatment BD (days 28,28). The highest of relative growth was found at treatment CE (681.44 x 566.34 µm) and 15,000 cells ml-1 density.
Keywords: Pinctada maxima; larvae; spat; life foods; survival rate; growth.
Pendahuluan
Mikroalga merupakan sumber pakan utama bagi bivalvia (Knauer and
Southgate 1999). Flagelata berukuran kurang dari 10 mikron merupakan jenis pakan
hidup yang paling disukai larva tiram mutiara. Beberapa jenis mikroalga yang umum
diberikan untuk pakan antara lain Isochrysis galbana, Pavlova lutheri/Monochrysis
lutheri, Chromulina sp., Chaetoceros sp., Nannochloropsis sp., dan Dicrateria sp.
Untuk fase pertumbuhan sampai menjelang spat dapat diberi variasi berbagai jenis
alga tersebut. Namun jenis flagelata yang paling penting untuk pakan stadia awal
larva adalah I. galbana (Klas: Haptophyceae) dengan ukuran sekitar 3–5 μm.
(Alagarswami et al. 1987; Dharmaraj et al. 1991). Larva Pteria sterna dapat diberi
pakan Nannochloris sp, Pavlova lutheri, Isochrysis galbana, Phaeodactilum
Dunaliella salina, Tetraselmis tetrahele, Tetraselmis suecica. Namun mikroalga yang
dapat dicerna oleh larva hanya Nannochloris sp., Pavlova lutheri dan Isochrysis
galbana (Martinez-Fernandez et al. 2004).
Preferensi larva terhadap pakan sangat tergantung pada ukuran dan spesies.
Masing-masing jenis tiram mempunyai kemampuan yang berbeda-beda, dalam
memilah dan mengambil makanan yang disukai. Pada prinsipnya, mikro alga yang
digunakan sebagai pakan larva tiram atau organisme laut lainnya, hendaknya
mempunyai ukuran yang sesuai dengan bukaan mulut larva, cepat dicerna,
mengandung nilai nutrisi tinggi, potensial dikultur skala masal, cepat tumbuh dengan
kepadatan tinggi dan tidak menghasilkan substansi racun (Coutteau 1996; Ponis et al.
2006).
Berdasarkan pada nilai nutrisinya, berbeda spesies mikroalga mempunyai
daya dukung terhadap pertumbuhan yang berbeda pula, utamanya pada tingkat atau
stadia yang bervariasi. I. galbana mengandung PUFAs 20: 5
w
3 (7,2 mg) dan 22: 6w
3 (4,3 mg), kandungan PUFAs sangat penting bagi perkembangan danpertumbuhan organisme laut dan ini hanya dapat diperoleh dari alga. Khususnya
PUFAs, merupakan komponen esensial dari membran sel semua stadia kehidupan
bivalvia moluska (Jeffrey et al. 1990). P. lutheri juga merupakan sumber asam lemak
yang baik, asam lemak yang terkandung seperti SAFA 27 mg, MUFA 8,0 mg, PUFA
72,1 mg, EPA + DHA 43,9 mg (Martinez-Fernandez et al. 2006). T. tetrathele
mempunyai kandungan asam lemak penting dari seri w6, seperti linoleic, gamma
-linolenic, dihomo-gamma-linolenic dan kandungan asam arachidonic (AA) yang
relatif tinggi. Pada spesies lain AA merupakan komponen sangat minor, sehingga
jarang dilaporkan. Kandungan asam lemak w6 seri (persen total asam lemak) yang
terdiri dari 18:2w6 sebanyak 6,5 %, 18:3w6 = 0,1 %, 20:3w6 = 0,2 % dan 20:4w6 =
2,4 % (Napolitano et al. 1990).
Melalui pemberian pakan dengan jenis yang sesuai dan dalam jumlah tepat,
diharapkan dapat meningkatkan sintasan dan laju pertumbuhan spat. Namun
sayangnya informasi dan publikasi yang berkaitan langsung dengan jadwal pemberian
pakan larva dan spat tiram mutiara P. maxima khususnya masih sangat terbatas,
pakan hidup merupakan studi pendahuluan dan akan menjadi dasar percobaan
selanjutnya.
Tujuan
Tujuan dari studi pendahuluan ini adalah untuk mendapatkan informasi
tentang jenis dan jumlah pakan yang sesuai, serta menentukan jadwal pemberian
pakan larva dan spat. Informasi hasil yang diperoleh akan menjadi dasar percobaan
pemeliharaan larva dan spat di laboratorium.
Bahan dan Metode
Kultur Pakan Hidup
Pakan hidup yang digunakan sebagai pakan adalah fitoplankton jenis
Isochrysisgalbana, Pavlova lutheri dan Tetraselmis tetrathele. Pakan disiapkan satu
bulan sebelum percobaan dimulai, dengan kepadatan 8–10 juta sel/ml. Media pupuk
kultur fitoplankton adalah formula Walne dan Hirata (Alagarswami et al. 1987;
CMFRI 1991) (Lampiran 2)
Pemeliharaan Larva
Percobaan dibagi menjadi dua tahap, yaitu tahap I, melakukan pengkajian
terhadap perkembangan larva, aktivitas makan dan tingkat konsumsi pakan. Tahap II,
mengkaji pengaruh jenis dan densitas pakan terhadap sintasan, pertumbuhan dan
waktu pencapaian stadia larva.
Lama waktu percobaan 20 hari. Padat penebaran larva disesuaikan dengan
stadia perkembangannya, yaitu Stadia I: stadia bentuk-D sampai umbo awal (D6)
dengan kepadatan 5 ekor/ml; Stadia II: stadia umbo awal (D7) sampai umbo akhir
(D14), kepadatan 3 ekor/ml dan Stadia III: stadia umbo akhir (D15) sampai stadia
plantigrade (D20), kepadatan 2 ekor/ml (BBL 2001).
Media air laut yang digunakan untuk pemeliharaan telah melalui beberapa
tahapan proses penyaringan seperti sand filter, catrage (15, 10, 5 µm), cotton filter
dan sterilisasi ultra violet. Setiap 2–3 hari dilakukan penggantian air sebanyak 50–
Percobaan Tahap I
Percobaan tahap I merupakan dasar dari percobaan tahap II. Percobaan
dilakukan dengan menggunakan metode observasi, dilaksanakan di dalam
laboratorium dan mengkondisikan ruangan dengan pencahayaan rendah atau ruangan
tertutup.
Prosedur percobaan
Percobaan dilakukan dengan menggunakan hewan uji berupa larva P. maxima
stadia bentuk-D (D1). Larva diperoleh dari hasil pemijahan Induk P. maxima dengan
menggunakan kombinasi metode kejut suhu dan ekspose (CMFRI 1991; Winanto
2004). Wadah percobaan bak fiberglass ukuran 500 liter. Padat penebaran larva dan
densitas pakan (N2) dihitung berdasarkan metode volumetrik, yang merupakan hasil
perkalian volume air stok (ml)(V1) dan kepadaan stok (sel/ml)(N1), dibandingkan
dengan volume air percobaan (ml)(V2).
2 2 1
1
N
V
N
V
=
Pengamatan terhadap perkembangan larva dan aktivitas makan dilakukan
dalam satu wadah percobaan, sedangkan pengamatan terhadap tingkat konsumsi
pakan dilakukan pada wadah yang berbeda dengan volume sama. Pengamatan
dilakukan dengan menggunakan mikroskop (perbesaran 40−60 kali), jumlah sampel 10 ml.
Untuk mengetahui tahap awal perkembangan stadia larva dilakukan
pengamatan setiap jam, dimulai dari saat pembelahan sel hingga trokofor.
Selanjutnya pengamatan dilakukan setiap 6 jam, mulai dari stadia awal larva (D1)
sampai stadia plantigrade (D20). Aktivitas makan diketahui melalui pengamatan
densitas pakan dalam media yang dilakukan setiap 2 jam selama 24 jam pada stadia
D1, D6, D14 dan D20.
Pengamatan terhadap tingkat konsumsi pakan harian dilakukan dengan
menempatkan hewan uji di dalam tiga wadah yang masing-masing diberi pakan
berbeda yaitu I. galbana (A), P. lutheri (B) dan I. galbana (50 %) + P. lutheri (50 %)
(C). Densitas pakan pada stadia D1–D3: 4000 sel/ml, D4–D6: 5000 sel/ml, D7–D9:
6000 sel/ml. D10–D11:7000 sel/ml. D12–D14: 8000 sel/ml. D15–D17:9000 sel/ml
dan D18–D20: 10.000 sel/ml. Pengambilan sampel dilakukan setiap hari antara 5–6
Percobaan Tahap II
Rancangan percobaan
Disain percobaan menggunakan rancangan acak kelompok faktorial
(RAK-Faktorial 3 x 3). Pengelompokan berdasarkan pada stadia perkembangan larva.
Perlakuan terdiri dari 2 faktor dan masing-masing diberi ulangan 3 kali. Faktor (I)
Jenis Pakan Hidup dan (II) Densitas Pakan. Faktor I terdiri dari 3 taraf faktor, yaitu
Isochrysis galbana (A), Pavlova lutheri (B) dan Kombinasi I. galbana (50 %)+ P.
lutheri (50 %)(C). Faktor II terdiri dari 3 taraf faktor: 4000 sel/ml (D); 7000 sel/ml
(E) dan 10.000 sel/ml (F). Model linear dari rancangan yang digunakan adalah:
Y
ijkl=
µ
+
τ
i+
δ
j+ (
τ
δ
)
ijk+
β
k+
ε
ijklKeterangan:
Yijkl = Respon pada jenis pakan ke-i, densitas pakan ke-j, kelompok stadia ke-k
dan ulangan ke-l.
µ = Rataan umum.
τi = Pengaruh jenis pakan ke-i.
δj = Pengaruh densitas pakan ke-j. βk = Pengaruh kelompok stadia ke-k.
(τδ)ijk = Pengaruh interaksi jenis pakan ke-i, densitas pakan ke-j & stadia ke-k. εijkl = Pengaruh galad pada jenis pakan ke-i, densitas pakan ke-j, stadia ke-k
dan ulangan ke-l.
Prosedur percobaan
Hewan uji berupa larva P. maxima stadia bentuk-D (D1), ditempatkan di
dalam ember berukuran 20 liter. Pakan hidup diberikan sesuai dengan perlakuan,
jumlah plankton dihitung dengan haemocytometer.
Pengambilan sampel sebanyak 10 ml dilakukan pada hari ke 6 (D6), D14 dan
D20, selanjutnya diamati di bawah mikroskop dengan perbesaran 40–60 kali. Jumlah
larva dihitung dengan menggunakan sadgewick rafter cell. Pengukuran panjang
antero-posterior (AP) dan dorso-ventral (DV) (Gambar 4) dilakukan dengan
Gambar 4. Pengukuran panjang antero-posterior (AP) dan dorso-ventral (DV) larva tiram mutiara P. maxima
Pemeliharaan Spat
Percobaan dilakukan selama 10 hari. Hewan uji yang digunakan adalah spat
P. maxima