PENGARUH TDZ TERHADAP INISIASI DAN
MULTIPLIKASI KULTUR
IN VITRO
PISANG RAJA BULU
(
Musa paradisiaca
L. AAB Group)
Oleh
Nurul Isnaeni
A34303015
PROGRAM STUDI AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
NURUL ISNAENI.
Pengaruh TDZ terhadap Inisiasi dan Multiplikasi Kultur In Vitro Pisang Rajabulu (Musa paradisiaca L. AAB Group). Dibimbing oleh Sri Setyati Harjadi dan Darda Efendi.Penelitian ini bertujuan untuk menentukan kombinasi zat pengatur tumbuh Thiadiazuron dan IAA yang lebih baik dalam mempercepat multiplikasi tunas in vitro pisang Rajabulu. Di samping itu penelitian ini juga bertujuan untuk mempelajari pengaruh beberapa konsentrasi zat pengatur tumbuh, yaitu BAP 1 ppm (4.4 μM), BAP 2 ppm (8.9μM), TDZ 0.04 ppm (0.2μM) dan TDZ 0.08 ppm (0.4μM) terhadap kemampuan inisiasi tunas pisang Rajabulu.
Penelitian dilakukan di laboratorium kultur jaringan Pusat Kajian Buah-buahan Tropika, Institut Pertanian Bogor (IPB) Baranangsiang Bogor pada bulan Februari sampai bulan Juli 2007. Bahan tanaman atau eksplan yang digunakan dalam penelitian ini adalah anakan atau rebung pisang Rajabulu Polytani; biakan in vitro pisang Rajabulu Juara (subkultur ke-5 dari media MS0) dan biakan in vitro pisang Rajabulu Cianjur (subkultur ke-2 dari media BA 2 ppm). Beragamnya jenis pisang yang digunakan di sini karena kegagalan inisiasi dan keterbatasan bahan. Diasumsikan pisang dengan genom yang sama memiliki respon yang sama pada perlakuan yang sama.
Penelitian ini terdiri dari dua set percobaan. Percobaan pertama untuk inisiasi terdapat 4 perlakuan dan masing-masing perlakuan dengan 7 ulangan sehingga terdapat 28 satuan percobaan satu faktor yaitu jenis sitokinin yang terdiri dari konsentrasi BAP 1 ppm (4.4 μM), BAP 2 ppm (8.9μM), TDZ 0.04 ppm (0.2μM) dan TDZ 0.08 ppm (0.4μM). Data tidak memiliki kontrol dan merupakan jumlah pertotal 7 eksplan yang ditanam sehingga tidak diolah secara statistik. Data percobaan disajikan secara deskriptif. Kondisi tersebut berakibat kesimpulan yang diambil dalam percobaan ini kurang kuat. Media inisiasi yang digunakan adalah media MS padat masing-masing ditambah sitokinin (TDZ atau BAP) sesuai perlakuan.
Pada percobaan kedua (multiplikasi) perlakuan merupakan kombinasi dari dua faktor. Faktor pertama adalah konsentrasi Thiadiazuron yang terdiri dari tiga taraf yaitu 0 ppm, 0.01 ppm, dan 0.1 ppm. Faktor kedua adalah konsentrasi IAA dengan dua taraf yaitu 0 ppm dan 3 ppm. Semuanya 6 kombinasi perlakuan, masing-masing perlakuan dengan 6 ulangan (untuk pisang Rajabulu Juara) total terdapat 36 satuan percobaan dan untuk pisang Rajabulu Cianjur masing-masing perlakuan dengan 7 ulangan sehingga total 42 satuan percobaan. Setiap satuan percobaan terdiri dari 1 botol kultur, masing-masing botol berisi 1 eksplan. Percobaan ini menggunakan rancangan acak lengkap.
Persen kematian pada percobaan inisiasi mencapai 35.7%. Nilai kematian eksplan terendah didapat pada perlakuan TDZ 0.04 ppm. Pada perlakuan lainnya (TDZ 0.08 ppm, BAP 1 ppm, dan BAP 2 ppm) jumlah eksplan yang mati nilainya sama yaitu 3 eksplan dari keseluruhan 7 eksplan yang ditanam. Penggunaan TDZ dengan konsentrasi 0.04 ppm diduga memicu inisiasi lebih cepat dibandingkan penyebaran senyawa fenolik yang terjadi pada eksplan, sehingga sel-sel yang ada dapat berfungsi normal. Penggunaan TDZ 0.04 ppm terbukti lebih baik bila dibandingkan dengan BAP.
Pada percobaan multiplikasi hasil analisis statistik menunjukkan bahwa media perlakuan tidak berpengaruh nyata pada jumlah tunas dan jumlah daun pisang Rajabulu Juara, tetapi berpengaruh nyata terhadap jumlah akar pada 2 MST dan berpengaruh sangat nyata menurunkan jumlah akar 3-7 MST. Pada pengamatan yang dilakukan sebelum aklimatisasi (10 MST) didapati bahwa media perlakukan berpengaruh nyata pada panjang akar. Perlakuan TDZ dengan konsentrasi 0.1 dan 0.01 ppm terlihat menurunkan panjang akar. Akar terpanjang didapatkan pada kontrol, atau media tanpa penambahan ZPT. Peubah tinggi tunas in vitro pisang berbeda sangat nyata antara kontrol dan perlakuan TDZ. Konsentrasi TDZ 0.1 dan 0.01 ppm yang diberikan dapat mengurangi tinggi tanaman. Respon terbaik terhadap jumlah daun, jumlah tunas, jumlah akar, panjang akar dan tinggi tanaman diberikan oleh media kontrol.
PENGARUH TDZ TERHADAP INISIASI DAN
MULTIPLIKASI KULTUR
IN VITRO
PISANG RAJA BULU
(
Musa paradisiaca
L. AAB Group)
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Nurul Isnaeni
A34303015
PROGRAM STUDI AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul :
PENGARUH TDZ TERHADAP INISIASI DAN
MULTIPLIKASI KULTUR
IN VITRO
PISANG RAJA
BULU (
Musa paradisiaca
L. AAB Group)
Nama : Nurul Isnaeni
NRP : A34303015
Menyetujui, Dosen Pembimbing
Pembimbing 1 Pembimbing 2
Prof. Dr Ir Sri Setyati Harjadi, MSc Dr Ir Darda Efendi, MSi NIP.130203587 NIP. 131841755
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr Ir Didy Sopandie, MAgr
NIP. 131124 019
RIWAYAT HIDUP
Penulis dilahirkan di Kudus, Propinsi JawaTengah pada tanggal 04 Juni
1985. Penulis adalah anak pertama dari tiga bersaudara dari Bapak Nur Ali dan
Ibu Parisih. Tahun 1992 penulis lulus dari TK Pertiwi Ngembal Rejo, kemudian
pada tahun 1997 penulis menyelesaikan studi di SDN 2 Ngembal Rejo Kudus.
Selanjutnya penulis lulus dari SLTP N 2 Kudus pada tahun 2000 dan SMU N 1
Bae Kudus pada tahun 2003.
Tahun 2003 penulis diterima di IPB melalui jalur USMI sebagai
mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian. Dari
tahun 2003 hingga 2007 penulis aktif di berbagai organisasi kemahasiswaan.
Tahun 2003 /2004 penulis menjadi Sekretaris Komisi Minat dan Bakat DPM
(Dewan Perwakilan Mahasiswa) TPB-40 IPB. Tahun 2004 sampai 2005 sebagai
Ketua OMDA (Organisasi Mahasiswa Daerah) Keluarga Kudus Bogor “Menara
Kota” dan Staff Biro Eksternal Himagron (Himpunan Mahasiswa Agronomi)
Faperta IPB. Selanjutnya tahun 2005/2006 sebagai Ketua Divisi Pengembangan
Kerjasama Himagron Faperta IPB dan tim Dewan Pembina OMDA KKB “MK”.
Tahun 2006/2007 penulis menjadi Ketua Divisi Komunikasi dan
Hubungan Alumni Organisasi Mahasiswa Daerah Keluarga Kudus Bogor
“Menara Kota” (OMDA KKB “MK”). Penulis saat ini juga aktif dalam kegiatan
pemberantasan buta aksara sebagai salah satu tutor di daerah Leuwiliang. Selama
masa perkuliahan penulis juga mengikuti kegiatan-kegiatan kepanitiaan, seminar
dan pelatihan (magang). Salah satu kegiatan pelatihan dan magang yang penulis
ikuti adalah “Program Belajar Bekerja Terpadu” selama 4 bulan di Pusat Kajian
Buah-buahan Tropika Bogor, kerjasama Kantor Jasa Ketenagakerjaan IPB dengan
Direktorat Jendral Perguruan Tinggi Depdiknas. Selama kuliah penulis
mendapatkan beasiswa “Student Equity” dari Direktorat Jendral Perguruan Tinggi
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas berkat, rahmat
dan karunia-Nya penulis dapat menyelesaikan penelitian yang berjudul “Pengaruh
TDZ terhadap Inisiasi dan Multiplikasi Kultur In Vitro Pisang Rajabulu (Musa
paradisiaca L. AAB Group)” ini dengan baik.
Penelitian ini dilaksanakan karena melihat prospek pengembangan pisang
untuk mencukupi kebutuhan pangan masyarakat Indonesia yang semakin
mendesak. Penelitian ini dilaksanakan bekerjasama dengan Pusat Kajian
Buah-buahan Tropika, LPPM-IPB.
Penulis menyampaikan terima kasih kepada Prof Dr Ir Sri Setyati Harjadi,
MSc dan Dr Ir Darda Efendi, MSi selaku dosen pembimbing atas bimbingan,
kesabaran, motivasi dan waktu untuk memberikan pengarahan dan penjelasan
berkaitan dengan penelitian ini. Ucapan terima kasih juga disampaikan kepada
staf PKBT yang telah memberikan bantuan selama pelaksanaan penelitian.
Kepada keluarga dan teman–teman seperjuangan yang telah memberikan
dorongan yang tulus baik moril maupun materiil, penulis mengucapkan
terimakasih yang sedalam-dalamnya.
Akhir kata penulis berharap semoga hasil penelitian ini berguna bagi
penulis dan pembaca pada umumnya.
Bogor, Maret 2008
DAFTAR ISI
Halaman
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesis... 3
TINJAUAN PUSTAKA ... 4
Taksonomi Pisang ... 4
Pisang Raja Bulu ... 4
Teknik Kultur Jaringan ... 5
Pertumbuhan dan Perkembangan in Vitro... 9
Zat Pengatur Tumbuh... 10
Sitokinin ... 10
Auksin ... 11
BAHAN DAN METODE ... 13
Waktu dan Tempat ... 13
Bahan dan Alat... 13
Metode Percobaan... 13
Pelaksanaan Penelitian ... 14
Pengamatan ... 16
HASIL DAN PEMBAHASAN ... 18
Keadaan Umum Kultur ... 18
Inisiasi Kultur Pisang Rajabulu ... 19
Multiplikasi Tunas in vitro Pisang Rajabulu ... 21
KESIMPULAN DAN SARAN ... 30
Kesimpulan ... 30
DAFTAR PUSTAKA... 31
DAFTAR TABEL
No. Teks Halaman
1. Pengaruh IAA dan TDZ terhadap Rata-rata Jumlah Tunas Pisang
Raja bulu Juara yang Baru Terbentuk pada Tanaman awal ... 21
2. Pengaruh IAA dan TDZ terhadap Rata-rata Jumlah Daun Pisang
Rajabulu Juara yang Baru Terbentuk pada Tanaman awal ... 22
3. Pengaruh IAA dan TDZ terhadap Rata-rata Jumlah Akar Pisang
Rajabulu Juara yang Baru Terbentuk pada Tanaman awal ... 23
4. Pengaruh IAA dan TDZ terhadap Rata-rata Panjang Akar dan
Tinggi Tanaman awal Pisang Rajabulu Juara pada 10 MST ... 24
5. Pengaruh IAA dan TDZ terhadap Rata-Rata Jumlah Tunas Pisang
Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal ... 25
6. Pengaruh IAA dan TDZ terhadap Rata-Rata Jumlah Daun Pisang
Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal ... 26
7. Pengaruh IAA dan TDZ terhadap Rata-Rata Jumlah Akar Pisang
Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal ... 27
8. Pengaruh IAA dan TDZ terhadap Rata-Rata Panjang Akar dan
Tinggi Tanaman Awal Pisang Rajabulu Cianjur pada 10 MST... 28
No. Lampiran Halaman
1. Komposisi Media Murashige-Skoog ... 35
2. Jumlah Eksplan Hidup dan Mati selama Periode Pengamatan ... 36
3. Rekapitulasi hasil Analisis Ragam pada Tahap Multiplikasi Tunas
in vitro pisang Rajabulu Juara ... 37
4. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Jumlah Tunas Pisang Rajabulu Juara ... 38
5. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Jumlah Akar Pisang Rajabulu Juara ... 39
7. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Tinggi Pisang Rajabulu Juara ... 41
8. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Panjang Akar Pisang Rajabulu Juara ... 42
9. Rekapitulasi hasil Analisis Ragam pada Tahap Multiplikasi Tunas
in vitro pisang Rajabulu Juara ... 43
10. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Jumlah Tunas Pisang Rajabulu Cianjur ... 44
11. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Jumlah Akar Pisang Rajabulu Cianjur ... 45
12. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Jumlah Daun Pisang Rajabulu Cianjur ... 46
13. Analisis Sidik Ragam Pengaruh TDZ dan IAA terhadap Panjang Akar Pisang Rajabulu Cianjur ... 47
DAFTAR GAMBAR
No. Teks Halaman
1. Histogram Jumlah Eksplan Hidup dan Mati Pisang Rajabulu Polytani pada 8 MST ... 20
2. Kultur tunas Pisang Rajabulu Polytani pada media (A) BAP 1 ppm, (B) BAP 2 ppm, (C) TDZ 0.04 ppm, dan (D) TDZ 0.08 ppm
pada 8 MST ... 20
3.Penampakan Planlet Pisang Rajabulu Juara (A) Kontrol atau MS0 tanpa Zat Pengatur Tumbuh, (B) Perlakuan TDZ 0.1 ppm
pada 8 MST ... 24
4. Penampakan Planlet Pisang Rajabulu Cianjur (A) Kontrol atau MS0 tanpa Zat Pengatur Tumbuh, (B) Perlakuan TDZ 0.1 ppm
PENDAHULUAN
Latar Belakang
Meningkatnya kesadaran akan pentingnya hidup sehat mendorong
kenaikan kebutuhan produk hortikultura, khususnya buah-buahan. Pisang adalah
salah satu komoditi buah-buahan dari kawasan tropis yang cukup digemari.
Pisang sangat populer dan banyak dikonsumsi karena rasanya enak dan harganya
murah. Buah pisang merupakan sumber makanan yang bergizi tinggi, sumber
vitamin A dan karbohidrat. Apabila dikonsumsi setelah makan, kandungan
Kalium dalam pisang dapat membantu menetralisir efek negatif konsumsi garam
dan MSG berlebih. Selain itu kandungan Kalium dalam pisang dapat berfungsi
menjaga keseimbangan air tubuh, kenormalan tekanan darah, fungsi jantung dan
kerja otot.
Kebutuhan konsumen terhadap komoditi pisang yang terus meningkat
tersebut harus diikuti oleh suatu upaya peningkatan produksi dengan tetap
mempertahankan kualitas. Masalah utama dalam peningkatan produksi pisang
adalah penyediaan bibit tanaman dalam jumlah yang besar, kontinu dan bermutu
tinggi.
Salah satu teknologi alternatif yang dapat digunakan untuk mengatasi
permasalahan pengadaan bibit yang berkualitas adalah melalui teknik kultur
jaringan. Melalui metode ini satu tunas pisang Rajabulu dapat menghasilkan
sekitar 200.000 bibit dalam waktu satu tahun, dengan asumsi satu tunas dalam
waktu 13 MST menghasilkan 21.4 tunas dan tidak terjadi penurunan daya
multiplikasi tunas (Pasaribu, 1996), sedangkan teknik perbanyakan secara
konvensional menggunakan bonggol hanya menghasilkan 6-10 bibit dari satu
tanaman (Rismunandar, 1981).
Dalam kultur jaringan peran zat pengatur tumbuh (ZPT) sangat penting.
Penambahan zat pengatur tumbuh ke dalam media merupakan salah satu faktor
yang sangat mempengaruhi keberhasilan kultur jaringan. Zat pengatur tumbuh
digolongkan menjadi 6 kelompok yaitu: Auksin, giberelin, sitokinin, asam absisik
(ABA), etilen dan retardan (PAU, 1991). Auksin dan sitokinin adalah dua zat
tumbuh ini mempengaruhi pertumbuhan dan morfogenesis kultur sel, organ, dan
jaringan.
Efek penggunaan sitokinin dan auksin ini ditentukan oleh perimbangan
auksin dan sitokinin. Perimbangan konsentrasi yang lebih efisien dari auksin dan
sitokinin tidak dapat ditentukan dengan pasti, karena sumber ZPT yang sama
pada tanaman yang berbeda dapat memberikan efek yang berbeda. Perbandingan
konsentrasi tersebut dipengaruhi oleh tingkatan taxa dan spesifik kultivar pisang
(Sukma, 1994). Konsentrasi yang efisien dari zat pengatur tumbuh harus
diperhatikan, karena akan mempengaruhi kecepatan inisiasi, sehingga diperlukan
studi untuk mengetahui nilai yang paling efisien dari ZPT ini.
Salah satu jenis zat pengatur tumbuh yang banyak digunakan dalam
penelitian adalah IAA, BAP, dan Thiadiazuron (TDZ). Fungsi dari IAA terkait
dengan proses pertumbuhan untuk meningkatkan kualitas tunas dan pembentukan
akar. BAP dan TDZ lebih berfungsi untuk pembentukan tunas dan morfogenesis.
Pemanfaatan TDZ di Indonesia belum banyak dilaporkan, karena peneliti lebih
sering menggunakan sitokinin jenis BAP.
TDZ merupakan sitokinin sintesis turunan dari phenylurea. Meskipun
tidak banyak penggunaan TDZ sebagai salah satu jenis sitokinin telah dilaporkan
oleh beberapa peneliti. Onamu (2003) menyatakan bahwa TDZ dalam konsentrasi
rendah mampu meningkatkan jumlah, panjang dan kualitas tunas anyelir. Fatimah
Nursandi (2006) sebagai salah satu peneliti PKBT menyatakan bahwa TDZ juga
memiliki kemampuan yang tinggi dalam menginduksi tunas secara langsung pada
nenas.
Tujuan
Tujuan dari percobaan inisiasi adalah untuk mempelajari pengaruh jenis
sitokinin BAP dan TDZ terhadap inisiasi tunas pisang Rajabulu. Tahap
multiplikasi bertujuan untuk menentukan kombinasi zat pengatur tumbuh
Thiadiazuron (TDZ) dan auksin IAA dalam multiplikasi biakan in vitro pisang
Rajabulu.
Hipotesis
1. Konsentrasi zat pengatur tumbuh BAP dan TDZ berpengaruh terhadap
inisiasi tunas pisang Rajabulu.
2. Konsentrasi zat pengatur tumbuh TDZ, IAA dan interaksinya berpengaruh
terhadap multiplikasi tunas pisang Rajabulu dan kemampuan plantlet
TINJAUAN PUSTAKA
Taksonomi Pisang
Tanaman pisang (Musa sp.) termasuk dalam famili Musaceae, ordo
Scitaminae. Famili Musaceae terdiri dari dua genus yaitu Ensente dan Musa.
Genus Musa dibagi menjadi empat golongan yaitu Australimusa, Eumusa,
Callimusa, Rodochlamys. Australimusa dan Eumusa adalah golongan yang
banyak dimanfaatkan sebagai buah konsumsi. Golongan Eumusa adalah golongan
yang saat ini paling banyak dibudidayakan. Kultivar pisang yang dapat dimakan
dan terkenal sekarang merupakan hasil persilangan dari dua spesies liar anggota
Eumusa yaitu Musa acuminata (AA) dan Musa balbisiana (BB) (Simmonds,
1959). Hasil persilangan pisang budidaya diploid tersebut menghasilkan turunan
hibrid steril baik diploid, triploid maupun tetrapolid dengan genom AB, AAA,
AAB, ABB dan seterusnya.
Pisang Raja Bulu
Buah pisang dikelompokkan menjadi dua, yaitu pisang meja yang dimakan
setelah matang (banana) dan pisang yang diolah terlebih dulu baru dimakan
(plantain). Menurut Direktorat Bina Produksi Hortikultura (1985) jenis pisang
yang disenangi (populer) di Indonesia untuk pisang meja adalah pisang Rajabulu,
Ambon, Raja Sereh, Mas, dan Barangan, sedangkan untuk plantain adalah pisang
Tanduk, Oli, Kepok, dan Nangka.
Menurut Pusat Kajian Buah-buahan Tropika (2005) pisang Rajabulu
merupakan jenis pisang dengan genom AAB. Bentuk buahnya lurus sedikit
melengkung dengan ujung buah sedikit tumpul. Kulitnya memiliki ketebalan
0.3-0.4 cm dan berwarna kuning cerah bila sudah matang. Daging buahnya sangat
manis, berwarna kuning kemerahan, bertekstur lunak, dan tidak berbiji. Panjang
buah antara 10-17 cm dengan bobot rata-rata 160-170 gram. Setiap pohon
biasanya dapat menghasilkan rata-rata sekitar 100 buah.
Berdasarkan analisis gizi diketahui bahwa pisang Rajabulu memiliki
keunggulan dari segi rasa (lebih manis dan lebih legit), penampilan buah menarik,
kandungan karoten sangat tinggi serta memiliki total gula rendah. Nilai indeks
Pisang Raja Bulu adalah tanaman monokotil yang berasal dari kawasan Asia
Tenggara sehingga pisang dapat tumbuh dengan baik pada berbagai kondisi iklim
tropik. Pisang merupakan tanaman herba tahunan sehingga salah satu syarat yang
harus dipenuhi dalam budidaya pisang adalah drainase tanah yang baik untuk
mencegah terjadinya busuk akar.
Pisang secara keseluruhan adalah tanaman yang unik. Pisang memiliki
sistem perakaran bonggol yang berasal dari batang yang terletak di bawah tanah.
Batang semu yang terletak di atas permukaan tanah sebenarnya merupakan
kumpulan pangkal pelepah daun. Bunga pisang terdiri dari daun-daun pelindung
yang saling menutupi, sedangkan bunganya sendiri terletak diantara daun
pelindung tersebut. Setiap kumpulan bunga-bunga pisang (atau calon sisir) ini
tersusun spiral pada tangkainya.
Cara konvensional dalam perbanyakan pisang adalah dengan cara vegetatif
menggunakan anakan (sucker). Sedangkan cara generatif dengan biji tidak dapat
dilakukan karena tanaman pisang umumnya tidak berbiji. Walaupun ada sebagian
yang berbiji namun bijinya bersifat steril.
Terdapat beberapa kelemahan perbanyakan tanaman secara konvensional
antara lain: (1) waktu yang diperlukan untuk memperbanyak anakan atau mata
tunas sangat lama, (2) jumlah bibit yang dihasilkan sedikit, (3) propagula vegetatif
memungkinkan bagi meluasnya patogen, yang akan sangat nyata menurunkan
produksi.
Teknik Kultur Jaringan
Kultur jaringan adalah salah satu metode perbanyakan tanaman yang
dilakukan untuk menjawab berbagai masalah yang terjadi dalam perbanyakan
tanaman secara konvensional. Kultur jaringan dilakukan dengan mengisolasi
berbagai bagian dari tanaman serta menumbuhkannya dalam kondisi aseptik,
sehingga bagian tanaman tersebut dapat beregenerasi dan berkembang menjadi
tanaman utuh.
Dasar kultur jaringan adalah teori totipotensi sel yang menyatakan bahwa
setiap sel merupakan suatu satuan otonomi dan mempunyai kemampuan untuk
beregenerasi menjadi tanaman lengkap kembali (Gunawan, 1988). Secara umum
jaringan adalah seleksi eksplan dan persiapan, inisiasi dan kultur pada media
prekondisi, media multiplikasi,media pengakaran dan media aklimatisasi
(Acquaah, 2004).
1. Seleksi eksplan dan persiapan
Bagian tanaman yang digunakan sebagai bahan inisiasi dalam kultur
jaringan disebut eksplan. Eksplan yang digunakan dalam kultur jaringan harus
memiliki kondisi fisiologi yang bagus dan bebas penyakit. Jenis tanaman, bagian
tanaman yang digunakan, morfologi permukaan, lingkungan tumbuhnya, umur,
kondisi tanaman, dan ukuran eksplan serta musim waktu mengambil merupakan
beberapa faktor yang menentukan keberhasilan proses selanjutnya (Gunawan,
1988).
Jaringan sumber eksplan dapat berupa sel meristematik, kambium dan
embrio yang belum mengalami perubahan bentuk dan kekhususan fungsi. Selain
itu dapat pula digunakan tunas, bunga, daun muda, cabang, akar, umbi bagian–
bagian embrio, benangsari dan sebagainya. Walaupun eksplan dapat
dikembangkan dari berbagai bagian tanaman, tetapi bagian yang lebih muda
seringkali merupakan sumber eksplan yang lebih baik pada banyak spesies
(Conger, 1981).
Ukuran eksplan yang digunakan tergantung dari tujuan pembiakannya.
Ukuran eksplan yang besar cenderung mudah terkontaminasi, namun ukuran
eksplan yang telalu kecil mempunyai persentase kematian jaringan yang lebih
tinggi (Conger, 1981). Tingkat kontaminasi juga dipengaruhi oleh musim waktu
mengambil eksplan. Pengambilan bahan tanaman yang dilakukan pada musim
hujan biasanya memiliki tingkat kontaminasi yang lebih tinggi dibandingkan pada
musim kemarau. Pada musim penghujan terjadi peningkatan kelembaban tanah
dan kelebihan air yang mendukung pertumbuhan jamur maupun bakteri secara
cepat pada lingkungan tumbuh tempat mengambil bahan tanaman (Semangun,
1989).
2. Inisiasi dan kultur pada media prekondisi
Inisiasi kultur yang bebas dari kontaminan merupakan langkah yang sangat
penting dalam kultur jaringan karena bila tidak dihilangkan kontaminan ini akan
tahap ini dilakukan proses sterilisasi eksplan untuk mendapatkan kultur aseptik.
Eksplan yang telah disterilisasi kemudian ditanam pada media kultur prekondisi
untuk memastikan apakah eksplan telah bebas dari kontaminasi mikroba dan
jaringan berinisiasi untuk tumbuh. Tahap ini merupakan tahapan paling mahal
dalam proses produksi.
Halperin dalam Tripepi (1997) menyatakan bahwa terdapat tiga
kemungkinan yang dapat menyebabkan eksplan gagal berinisiasi. Pertama, sel-sel
pada eksplan kekurangan totipotensi. Kedua, sel-sel pada eksplan tidak mampu
berdiferensiasi. Ketiga, eksplan mempunyai batasan fisiologi untuk dapat
berdiferensiasi dan berdediferensiasi karena kurangnya rangsangan induksi
esensial seperti jenis atau konsentrasi zat pengatur tumbuh yang tidak tepat.
Faktor lain yang mempengaruhi ketidakberhasilan inisiasi adalah
munculnya pencoklatan (browning) pada eksplan beberapa hari setelah ditanam
di media kultur. Browning tersebut diakibatkan oleh oksidasi senyawa fenolik.
Tingkat Browning pada pisang Raja bulu dengan genom AAB ini cukup tinggi.
Browning yang terjadi masih bisa muncul setelah beberapa kali subkultur
Ernawati et al. (1994). Senyawa fenolik yang terakumulasi tersebut dapat
menghambat penyerapan bahan pangan dalam media, akibatnya eksplan
kekurangan energi untuk pertumbuhan dan perkembangan. Kondisi ini lama
kelamaan akan mengakibatkan kematian pada eksplan (Trigiano, 2003).
3. Media multiplikasi
Multiplikasi merupakan kegiatan memperbanyak calon tanaman yang
dilakukan dengan penanaman eksplan pada media dengan kandungan sitokinin
yang tinggi. Pada tahap ini diupayakan eksplan menghasilkan tunas sebanyak
mungkin (bermultiplikasi). Tunas yang terbentuk dipisahkan melalui kegiatan
subkultur berulang.
Tingkat multiplikasi pisang Rajabulu ini antara lain dipengaruhi oleh
perbedaan genom. Pisang Raja bulu dengan genom AAB tergolong sebagai
kultivar pisang dengan laju multiplikasi yang rendah (Kasutjianingati, 2004).
Permasalahan yang sering terjadi dalam tahap multiplikasi antara lain
munculnya senesen, yaitu salah satu proses fisiologi dalam kultur in vitro yang
dan akumulasi racun pada media kultur jaringan. Senesen pada kultur in vitro
dapat terjadi melalui wujud yang berbeda seperti daun menguning dan perubahan
warna kalus menjadi abu-abu lalu coklat. Senesen yang terjadi pada daun diawali
oleh degradasi kloroplas, diikuti membran sitoplasma. Mitokondria dan nukleus
merupakan bagian akhir yang terpisah dan masih terus berfungsi hingga akhir
tahap senesen (Cachiţă and Crăciun dalam Prihatmanti dan Mattjik, 2004).
4. Media pengakaran
Fase dimana eksplan menunjukkan adanya pertumbuhan akar sebagai syarat
bahwa tanaman siap dipindah ke lapang. Pengakaran dapat dirangsang dengan
penggunaan media dengan tambahan ZPT jenis auksin. Wattimena (1988)
menyatakan bahwa pemberian auksin diketahui sebagai pemicu pertumbuhan
tunas dan akar.
5. Media aklimatisasi
Gunawan (1988) menyatakan bahwa aklimatisasi merupakan tahap
pemindahan plantlet dari kondisi aseptik (in vitro) ke kondisi lapang (ex vitro)
atau dari keadaan heterotrop ke keadaan autotrop. Tahap aklimatisasi adalah
tahap yang sangat penting, karena keberhasilan teknik kultur jaringan dilihat dari
berhasil atau tidaknya proses aklimatisasi.
Proses aklimatisasi seringkali gagal karena adanya cekaman lingkungan
yang tinggi. Perubahan kondisi heterotrop ke autotrop mengharuskan tanaman
dapat melakukan fotosintesis dan melakukan penyerapan hara menggunakan akar.
Akar yang berasal dari tanaman in vitro masih lemah dan belum berfungsi dengan
baik, sehingga akar menjadi cepat mati dan mungkin akan digantikan dengan akar
baru yang tumbuh ketika plantlet ditanam pada media aklimatisasi. Oleh karena
itu lingkungan tumbuhnya harus mendekati lingkungan asalnya pada biakan,
terutama kelembaban dan suhu. Hal ini disebabkan tanaman hasil in vitro peka
terhadap evapotranspirasi, serangan cendawan dan bakteri serta intensitas cahaya
yang tinggi. Pemberian hara tanaman yang cukup juga sangat penting dilakukan,
Pertumbuhan dan Perkembangan In Vitro
Totipotensi sel sebagai dasar teori kultur jaringan terkait dengan proses
pertumbuhan dan perkembangan tanaman. Pertumbuhan berarti pertambahan
ukuran volume, bobot, jumlah sel, banyaknya protoplasma dan tingkat kerumitan
(Salisbury dan Ross, 1992).
Pertumbuhan pada tumbuhan berlangsung terbatas pada beberapa bagian
tertentu yang terdiri dari sejumlah sel yang baru saja dihasilkan melalui proses
pembelahan sel di meristem. Daerah-daerah meristematik antara lain terdapat
pada ujung akar, ujung tajuk, kambium pembuluh, dan tepat di atas nodus
pertumbuhan monokotil, atau di pangkal daun rumputan. Pembelahan sel tidak
menyebabkan pertumbuhan (pertambahan ukuran), namun produk dari
pembelahan sel itulah yang tumbuh dan menyebabkan pertumbuhan (Salisbury
dan Ross, 1992).
Perkembangan adalah keseluruhan proses pertumbuhan dan diferensiasi sel
menjadi jaringan, organ dan organisme. Nama lain proses tersebut adalah
morfogenesis (dari bahasa Yunani morphos: bentuk, dan genesis: asal).
Pembelahn sel menghasilkan sel baru yang tidak hanya menjadi lebih besar, tetapi
juga lebih kompleks. Sel mengalami perubahan dengan cara yang berbeda-beda,
menghasilkan tumbuhan dewasa yang tersusun dari berbagai jenis sel (Salisbury
dan Ross, 1992).
Beragam bentuk sel yang dihasilkan dalam pertumbuhan dan perkembangan
merupakan hasil dari tiga proses yang sederhana. Proses tersebut terdiri dari
pembelahan, pembesaran dan diferensiasi sel. Satu sel dewasa membelah menjadi
dua sel yang terpisah, yang tidak selalu serupa satu sama lain. Salah satu atau
kedua sel anak tersebut membesar volumenya. Sel yang sudah mencapai volume
akhirnya, menjadi terspesialisasi dengan cara tertentu menghasilkan berbagai jenis
jaringan, organ tumbuhan, dan banyak jenis tumbuhan (Salisbury dan Ross,
1992).
Zat Pengatur Tumbuh
Kelompok dari zat-zat yang mempengaruhi pertumbuhan dan
perkembangan, dapat secara memuaskan disebut zat pengatur tumbuh. Zat
dibandingkan dengan konsentrasinya. Keaktifan tersebut menyangkut
proses-proses fisiologi tanaman seperti pertumbuhan, diferensiasi, dan perkembangan
tanaman. Proses-proses lain yaitu pembukaan stomata, serapan hara, dan
translokasi. Kerja zat pengatur tumbuh ini masih dapat diwujudkan dalam tempat
yang jauh dari tempat asalnya (Harjadi, 1996).
Dua golongan zat pengatur tumbuh yang sangat penting dan mempengaruhi
pertumbuhan serta morfogenesis adalah sitokinin dan auksin. Interaksi dan
perimbangan zat pengatur tumbuh yang diberikan media dan yang diproduksi
oleh sel akan mempengaruhi arah perkembangan suatu kultur.
Sitokinin
Sitokinin adalah kelompok senyawa organik yang menyebabkan
pembelahan sel yang dikenal dengan proses sitokinesis (Wattimena, 1988).
Pengaruh sitokinin di dalam kultur jaringan tanaman antara lain berhubungan
dengan proses pembelahan sel, proliferasi tunas ketiak, penghambatan
pertumbuhan akar dan induksi umbi mikro terutama pada kentang. Pembelahan
mitosis tidak akan terjadi tanpa sitokinin. Jenis sitokinin yang saat ini sering
digunakan adalah BAP (6-benzyl amino purine) dan TDZ (Thiadiazuron).
Peran khusus BAP adalah untuk induksi kalus, pertumbuhan kalus dan
suspensi sel serta induksi morfogenesis. Pada konsentrasi yang lebih tinggi dapat
digunakan untuk meningkatkan multiplikasi tunas, pucuk atau meristem. BAP
banyak digunakan dalam perbanyakan tanaman melalui kultur jaringan karena
sifatnya stabil, tidak mahal dan mudah tersedia. Ernawati, Purwito dan Suketi
(1994) menyatakan bahwa kombinasi IAA dan BAP pada perbanyakan mikro
pisang Ambon, Barangan dan Rajabulu dapat menginduksi penggandaan tunas
tertinggi. Berdasarkan penelitian tersebut juga diketahui bahwa BAP 0.5-1 ppm
mampu menginduksi pembentukan embrio somatik. Menurut Sukma (1994)
perlakuan yang terbaik untuk multiplikasi tunas pada pisang Rajabulu dengan
eksplan tunas in vitro dari anakan adalah pada 10.5 ppm BAP + 3.0 ppm IAA.
Penelitian tersebut juga melaporkan pengaruh BAP terhadap pertumbuhan
daun. BAP sebagai salah satu jenis sitokinin lebih berfungsi untuk mendorong
pembentukan tunas, menghambat pertambahan tinggi, sehingga menekan jumlah
konsentrasi BAP yang tinggi (7 dan 10 ppm) cenderung kurang normal, dimana
daun sebagian menggulung dan sempit (Sukma, 1994).
TDZ merupakan sitokinin yang juga bersifat merangsang multiplikasi pucuk
dalam konsentrasi rendah dan dapat menghasilkan tunas kerdil dengan kualitas
rendah pada konsentrasi yang tinggi. Devilana (2005) menyatakan bahwa pada
kultur jaringan nenas, TDZ dengan konsentrasi 1x10-1 ppm menghasilkan jumlah
tunas aksilar dan tunas adventif tertinggi yaitu sekitar 35 buah pada lima minggu
setelah tanam.
BAP dan TDZ adalah dua jenis sitokinin dengan tipe urea yang berbeda.
Menurut Huetteman dan Preece dalam Anwar (2007) sitokinin tipe urea seperti
TDZ, memiliki aktivitas lebih kuat dibanding tipe adenin atau purin seperti BAP.
Penggunaan TDZ dan BAP sebagai salah satu zat pengatur tumbuh pada
komoditas pisang dilaporkan oleh Sukmadjaja et al. (2007) yang menyatakan
bahwa pemberian 0.1 ppm TDZ tanpa penambahan BAP serta pemberian BAP
pada konsentrasi rendah (0.5 ppm) yang dikombinasikan dengan TDZ 1.5 ppm
merupakan konsentrasi zat pengatur tumbuh yang memberikan hasil penambahan
jumlah tunas yang lebih tinggi dibandingkan dengan kontrol dan perlakuan
lainnya.
Auksin
Auksin didefinisikan sebagai zat tumbuh yang mendorong elongasi jaringan
koleoptil hasil pembelahan sel. Pengaruh auksin lainnya adalah penghambatan
mata tunas samping, merangsang akivitas kambium dan merangsang
pertumbuhan akar (Wattimena, 1988). Jenis auksin yang sering digunakan adalah
Indole Acetic Acid (IAA), 1-Napthalena Acetic Acid (NAA), Indole 3-Butyric
Acid (IBA), dan 2,4-Dichlorophenoxy Acetic Acid (2,4-D). IAA merupakan
satu-satunya jenis auksin alami yang terdapat dalam tumbuhan. Kasutjianingati (2004)
menyatakan bahwa taraf IAA 3 ppm meningkatkan tunas layak pada kultur in
vitro pisang 10% bila dibandingkan media tanpa IAA. Beberapa pustaka juga
menunjukkan bahwa penggunaan IAA 3 ppm untuk mengimbangi rangsangan
BAP lebih efektif dalam menambah jumlah tunas (Sukma, 1994; Ernawati et al,
Penggunaan auksin dalam kultur jaringan pada umumnya dilakukan melalui
kombinasi dengan sitokinin. Nisbah sitokinin dan auksin akan menentukan apakah
suatu tunas akan membentuk tunas adventif, akar, atau tunas adventif dan akar.
Sampai saat ini belum diketahui secara pasti perimbangan auksin dan sitokinin
yang paling efektif. Konsentrasi yang diperlukan dari masing-masing ZPT ini
tergantung pada jenis eksplan, genom, kondisi kultur serta jenis sitokinin dan
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Pusat Kajian
Buah-buahan Tropika, Institut Pertanian Bogor (IPB) Baranangsiang Bogor pada
bulan Februari sampai bulan Juli 2007.
Bahan dan Alat
Bahan tanaman yang digunakan dalam percobaan tahap inisiasi adalah
anakan pisang Raja bulu (Musa paradisiaca L.) asal Polytani. Tahap multiplikasi
adalah tunas in vitro pisang Raja bulu dari LIPI yang diinisiasi dari anakan
(subkultur ke-5 dari media MS0) dan tunas in vitro pisang Raja bulu dari Cianjur
yang diinisiasi di Laboratorium Kultur Jaringan PKBT dari anakan (subkultur
ke-2 dari media BA ke-2 ppm). Beragamnya jenis pisang yang digunakan disini terkait
dengan ketersediaan bahan dan kegagalan dalam inisiasi. Diasumsikan pisang
dengan genom yang sama memiliki respon yang sama pada perlakuan yang sama.
Bahan kimia yang digunakan berupa penyusun media dasar Murashige dan
Skoog, IAA, BAP dan TDZ. Bahan lain yang digunakan yaitu HCl 1.0 N, NaOH
1.0 N, alkohol, spiritus, asam askorbat (untuk mengurangi pencoklatan), aquades
steril, tissue, bahan pemadat berupa agar, kertas saring, plastik, deterjen, formalin
dan clorox.
Peralatan yang digunakan untuk persiapan media meliputi timbangan
analitik, gelas ukur, pipet, erlenmeyer, labu takar, pengaduk, gelas piala, botol
kultur dan autoklaf. Peralatan untuk menanam antara lain laminar air flow
cabinet, handsprayer, lampu bunsen, pinset, pisau, dan petridish.
Metode Percobaan
Penelitian ini terdiri dari dua tahap percobaan :
1. Tahap Inisiasi Tunas
Pada tahap inisiasi tunas perlakuan yang digunakan adalah BAP 1 ppm (4.4
μM), BAP 2 ppm (8.9μM), TDZ 0.04 ppm (0.2μM), dan TDZ 0.08 ppm (0.4μM) yang ditambahkan pada media MS0 padat. Percobaan ini terdiri dari 4 perlakuan
percobaan. Pada tahap inisiasi tunas digunakan rancangan acak lengkap dengan
satu faktor yaitu jenis sitokinin. Setiap satu satuan percobaan terdiri dari satu
botol yang berisi satu eksplan. Data selanjutnya disajikan secara deskriptif.
2. Tahap Multiplikasi
Pada tahap multiplikasi tunas perlakuan merupakan kombinasi dari dua
faktor. Faktor pertama adalah konsentrasi Thiadiazuron yang terdiri dari tiga taraf
yaitu 0 ppm, 0.01 ppm, dan 0.1 ppm. Faktor kedua adalah konsentrasi IAA
dengan dua taraf yaitu 0 ppm dan 3 ppm. Semuanya 6 kombinasi perlakuan,
masing-masing perlakuan dengan 6 ulangan (untuk pisang Rajabulu Juara) total
terdapat 36 satuan percobaan dan untuk pisang Rajabulu Cianjur masing-masing
perlakuan dengan 7 ulangan sehingga total 42 satuan percobaan. Setiap satuan
percobaan terdiri dari 1 botol kultur, masing-masing botol berisi 1 eksplan.
Percobaan ini menggunakan rancangan acak lengkap.
Kombinasi dari perlakuan diatas adalah sebagai berikut :
a.T1A1 = TDZ 0,01 ppm + IAA 3 ppm
b.T2A0 = TDZ 0,1 ppm + IAA 0 ppm
c.T2A1 = TDZ 0,1 ppm + IAA 3 ppm
d.T0A0 = TDZ 0 ppm + IAA 0 ppm
e.T0A1 = TDZ 0 ppm + IAA 3 ppm
f. T1A0 = TDZ 0,01 ppm + IAA 0 ppm
Data dianalisa dengan uji F, bila terjadi beda nyata, diuji lanjut dengan uji
DMRT pada taraf 5 % .
Pelaksanaan Penelitian
Sterilisasi Botol dan Alat Tanam
Pinset, pisau, gelas ukur, erlenmeyer, labu takar, petridish, pipet,
pengaduk, gelas piala, dan botol kultur yang akan dipakai dicuci bersih dengan
deterjen, kemudian di sterilisasi selama 60 menit pada suhu 1700 C dengan oven.
Pembuatan Media
Untuk memudahkan pembuatan media dibuat larutan stok MS0 terlebih
dahulu. Selanjutnya pembuatan media dilakukan dengan cara memipet larutan
Sejumlah larutan stok berupa stok A, B, C, D, E, F, Myo inositol dan
vitamin (Tabel Lampiran 1) dipipet kemudian dimasukkan ke dalam labu takar 1
liter yang berisi aquades 1/3 volume. Kemudian ZPT ditambahkan sesuai dengan
jenis dan konsentrasi perlakuan. Aquades ditambahkan hingga volume mencapai
tera 1 l. Derajat keasaman diatur hingga mencapai 5.8 dengan menambahkan
NaOH atau HCl 1 N. Jika pH kurang dari normal dilakukan penambahan NaOH,
sedangkan jika pH lebih dari 5.8 dilakukan penambahan HCL menggunakan
pipet. Media yang telah diatur pH-nya ditambah agar-agar 6,5 gram/liter sebagai
pemadat (khusus untuk media padat), dimasak di atas kompor sampai mendidih
kemudian media dimasukkan ke dalam botol kultur yang telah disterilisasi dan
diusahakan setiap botol isinya sama. Botol kemudian ditutup menggunakan
plastik dan diikat dengan karet.
Proses selanjutnya adalah sterilisasi media dalam botol menggunakan
autoclave dengan suhu 1210 C dan tekanan 17.5 psi selama 20 menit.
Sterilisasi Bahan Tanaman
Anakan pisang Rajabulu Polytani yang diambil dari Kebun Koleksi
PKBT–IPB Tajur dikupas, dibuka seludangnya hingga berukuran kurang lebih
1.5 cm, dibersihkan dengan cara dicuci bersih dengan air mengalir, direndam
dalam larutan deterjen selama 30 menit kemudian dalam larutan formalin 0,4%
selama 30 menit. Bahan tanaman dicuci dengan air mengalir selama 30 menit.
Selanjutnya direndam dalam campuran Benlate 2 gr/liter dan Agrept 2 gr/liter
selama dua jam sambil dikocok dengan shaker.
Sterilisasi tahap selanjutnya dilakukan dalam laminar air flow cabinet.
Bahan tanaman yang telah dikocok kemudian dicuci dengan air steril sebanyak
tiga kali atau sampai bersih. Bahan tanaman yang sudah bersih dikupas
seludangnya lalu direndam dalam larutan clorox 30% selama 10 menit, setelah itu
anakan dibilas dengan air steril, dibuka seludangnya, direndam dalam larutan
clorox 20% selama 20 menit dan dibilas. Tahap terakhir bahan tanaman direndam
Penanaman Eksplan
Pada percobaan inisiasi, eksplan yang telah disterilkan dari anakan
ditanam pada media MS0 padat, setelah 4 minggu dipilih eksplan yang terbebas
dari kontaminan dan seragam untuk dikulturkan dalam media sesuai perlakuan.
Pada percobaan multiplikasi digunakan eksplan berupa tunas in vitro
pisang Rajabulu Juara dari laboratorium LIPI hasil inisiasi anakan (subkultur
ke-5 dari media MS0) dan tunas in vitro pisang Rajabulu Cianjur yang diinisiasi dari
anakan di Laboratorium Kultur Jaringan PKBT (subkultur ke-2dari media BA 2
ppm). Eksplan hasil inisiasi dikulturkan ke dalam botol kultur yang berisi media
MS0 cair dan ditutup dengan plastik. Botol kultur yang telah berisi eksplan
diletakkan dalam ruang kultur dan diinkubasi selama kurang lebih 4 minggu.
Eksplan yang terbebas dari kontaminan dan seragam disubkultur ke dalam media
perlakuan.
Aklimatisasi
Plantlet hasil multiplikasi selanjutnya diaklimatisasi di screen house untuk
mengetahui pengaruh media perlakuan terhadap kondisi tanaman di lapang.
Pelaksaan aklimatisasi diawali dengan penyiapan media tanam berupa sekam
steril yang dimasukkan dalam gelas plastik sampai kira-kira 1 cm dari permukaan
gelas. Plantlet dikeluarkan dari botol dengan pinset secara hati-hati, dibersihkan
dari sisa-sisa media dengan cara dicuci menggunakan air mengalir, lalu dikering
anginkan. Bahan tanaman hasil in vitro ditanam dalam media tumbuh dan
keseluruhnnya disungkup dengan kantong plastik selama kurang lebih satu
minggu. Setelah satu minggu tanaman dikeluarkan dari sungkup, dipindah dalam
media pembibitan berupa arang sekam yang disterilkan dengan autoclave selama
30 menit pada tekanan 17.5 psi. Perawatan dilakukan dengan penyiraman.
Pengamatan
Pengamatan keadaan visual kultur tahap inisisi berupa:
Jumlah tunas hidup: jumlah eksplan yang berwarna kehijauan.
Jumlah tunas mati: jumlah eksplan yang berwarna merah atau kecoklatan
Jumlah tunas yang mengalami kontaminasi: ditandai dengan keberadaan
cendawan dan bakteri.
Pada tahap multiplikasi pengamatan respon tumbuh yang dilakukan setiap
minggu di botol kultur meliputi:
Jumlah tunas: Jumlah tunas yang baru terbentuk, yang merupakan
parameter yang paling menentukan keberhasilan tahap multiplikasi.
Jumlah daun: Jumlah daun baru yang terbentuk dan telah membuka
sempurna pada eksplan awal (induk pisang).
Jumlah akar: Jumlah akar yang terbentuk pada eksplan awal (induk
pisang).
Sebagai data pendukung diamati keadaan visual kultur pada media MS0
dan media multiplikasi seperti tingkat kontaminasi, tingkat browning, dan warna
daun. Pengamatan ini dilakukan selama 8 MST.
Pada tahap multiplikasi pengamatan pertumbuhan kultur yang dilakukan
setelah plantlet dikeluarkan dari botol kultur dan dicuci bersih dari sisa-sisa media
yang menempel sebelum aklimatisasi (10 MST) meliputi:
Panjang akar pada eksplan awal (induk pisang): diukur dari pangkal akar
hingga ujung akar yang terpanjang.
Tinggi tanaman pada eksplan awal (induk pisang): diukur dari pangkal
HASIL DAN PEMBAHASAN
Keadaan Umum Kultur
Temperatur ruangan selama penelitian berkisar antara 19-240 C.
Penyinaran menggunakan lampu 15 dan 20 watt selama 16 jam/hari dan Intensitas
cahaya rata-rata 100 ft-c. Pada percobaan pertama pertumbuhan eksplan mulai
terlihat sekitar 1 MST, ditandai dengan perubahan warna eksplan dari putih
menjadi kehijauan dan eksplan yang mati ditandai dari perubahan warna putih
menjadi kemerahan dan lama-kelamaan menjadi coklat kemudian mati. Tingkat
kontaminasi yang terjadi ketika inisiasi mencapai 25%.
Pada percobaan kedua pengaruh interaksi dari 2 faktor perlakuan IAA dan
TDZ setelah dianalisis ragam memberikan hasil yang tidak berbeda nyata pada
semua variabel pengamatan. Koefisien keragaman menunkjukkan nilai antara
45-600%. Pembahasan selanjutnya diarahkan pada hasil analisis ragam faktor tunggal
yang menunjukkan beda nyata.
Hasil analisis statistik faktor tunggal TDZ dan IAA menunjukkan bahwa
media perlakuan tidak berpengaruh nyata pada jumlah tunas dan jumlah daun
Pisang Rajabulu Juara. Perlakuan yang diberikan berpengaruh sangat nyata pada
jumlah akar sejak 3 MST. Pada pengamatan yang dilakukan sebelum aklimatisasi
(10 MST) didapatkan bahwa media perlakukan tidak berpengaruh nyata pada
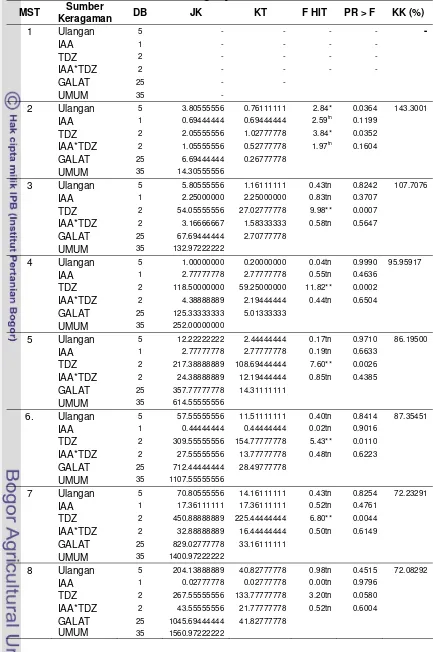
panjang akar tetapi berpengaruh nyata pada tinggi eksplan (Tabel Lampiran 3).
Hasil analisis statistik menunjukkan bahwa media perlakuan tidak
berpengaruh nyata pada jumlah tunas Pisang Rajabulu Cianjur. Perlakuan TDZ
berpengaruh nyata pada jumlah akar (3, 4, dan 5 MST), sedangkan perlakuan IAA
berpengaruh nyata pada 5-8 MST. Pada pengamatan jumlah daun nilai yang
berbeda nyata hanya diperoleh pada minggu ke-enam. Pada pengamatan yang
dilakukan sebelum aklimatisasi yaitu pada 10 MST didapatkan pengaruh sangat
nyata pada panjang akar dan tinggi eksplan (Tabel Lampiran 9).
Pertumbuhan pisang mulai terlihat sejak 1 MST. Pertumbuhan ini ditandai
dengan pemanjangan daun-daun yang terpotong dan terbentuknya daun-daun
baru. Daun baru yang terbentuk berwarna hijau muda pada hampir semua
bagian ujung, gejala ini ditandai dengan perubahan warna daun menjadi
kekuningan. Perubahan warna daun ini mungkin terjadi akibat degradasi
kloroplas.
Inisiasi Kultur Pisang Rajabulu
Pada percobaan ini tidak digunakan kontrol karena awalnya percobaan ini
bertujuan untuk menyiapkan bahan tanaman untuk percobaan multiplikasi, tetapi
inisiasi yang dilakukan mengalami kegagalan (membutuhkan waktu yang lama
dan hasilnya tidak mencukupi) sehingga akhirnya dibuat sebagai percobaan
tersendiri. Kondisi tersebut berakibat kesimpulan yang diambil dalam percobaan
ini kurang kuat. Data tidak memiliki kontrol dan merupakan jumlah pertotal 7
eksplan yang ditanam sehingga tidak diolah secara statistik. Data hanya
ditampilkan secara deskriptif.
Gambar 1 menunjukkan jumlah eksplan hidup pada masing-masing
perlakukan BAP atau TDZ pada 8 MST: terlihat bahwa jumlah eksplan yang
hidup pada hampir sama untuk semua perlakuan. Nilai tertinggi didapatkan pada
perlakuan TDZ 0.04 ppm sebanyak 5 eksplan dari keseluruhan 7 eksplan yang
ditanam (71%). Selanjutnya penambahan TDZ 0.08 ppm didapatkan 4 eksplan
hidup (57%). Nilai ini terkait dengan fungsi sitokinin dalam meningkatkan
pembelahan sel, memacu inisiasi dan pertumbuhan tunas in vitro.
Pada perlakuan BAP 1 ppm didapatkan jumlah eksplan hidup yang rendah
(2 eksplan). Sedangkan pada media dengan penambahan BAP 2 ppm tidak
diperoleh eksplan hidup hal ini mungkin diakibatkan oleh bahan tanaman yang
gagal berinisiasi. Eksplan tidak memperlihatkan adanya pertumbuhan dan
mengalami dormansi (Gambar 2 B).
Persen kematian pada percobaan inisiasi ini mencapai 35.7%. Nilai kematian
eksplan terendah didapat pada perlakuan TDZ 0.04 ppm (1 eksplan). Pada
perlakuan lainnya (TDZ 0.08 ppm, BAP 1 ppm, dan BAP 2 ppm) jumlah eksplan
yang mati menunjukkan nilai yang sama yaitu 3 eksplan (43%) dari keseluruhan
eksplan yang ditanam (7 eksplan). Penggunaan TDZ dengan konsentrasi 0.04 ppm
fenolik yang terjadi pada eksplan, sehingga sel-sel yang ada dapat berfungsi
Jumlah Eksplan Hidup Jumlah Eksplan Mati
Gambar 1. Histogram Jumlah Eksplan Hidup dan Mati Pisang Rajabulu Polytani pada 8 MST
(A) (B)
(C) (D)
MST (Eksplan pada gambar B tidak menunjukkan adanya pertumbuhan dan mengalami dormansi)
Penggunaan TDZ 0.04 ppm terbukti lebih baik bila dibandingkan dengan
BAP. Penggunaan sitokinin tipe urea seperti TDZ, memiliki aktivitas lebih kuat
dibanding tipe adenin atau purin seperti BAP. Hasil ini sama dengan hasil
penelitian Sukmadjaja et al. (2007).
Multiplikasi Tunas in vitro Pisang Rajabulu
Pisang Rajabulu Juara
Respon Pertumbuhan
Respon pertumbuhan yang diamati meliputi jumlah tunas, jumlah daun
dan jumlah akar setiap minggu selama kultur (8 MST). Semua data disajikan
dalam 6 ulangan.
Pengaruh interaksi TDZ dan IAA tidak berpengaruh nyata pada jumlah
tunas hingga minggu terakhir pengamatan (Tabel Lampiran 3). Analisis pada
faktor tunggal juga tidak berpengaruh nyata hingga 8 MST (Tabel 1). Perlakuan
TDZ dan IAA pada berbagai taraf dapat menginduksi tunas, tetapi nilainya masih
sangat rendah. Nilai ini masih cukup baik mengingat konsentrasi TDZ yang
digunakan di sini sangat rendah (0.01 dan 0.1 ppm) bila dibandingkan dengan
konsentrasi yang telah digunakan dalam penelitian sejenis.
Hasil penelitian Sukmadjaja et al. (2007) menunjukkan bahwa pemberian
BAP pada konsentrasi rendah (0.5 ppm) yang dikombinasikan dengan
Thiadiazuron 1.5 ppm merupakan konsentrasi zat pengatur tumbuh yang
memberikan hasil penambahan jumlah tunas yang lebih tinggi dibanding dengan
kontrol maupun perlakuan lainnya.
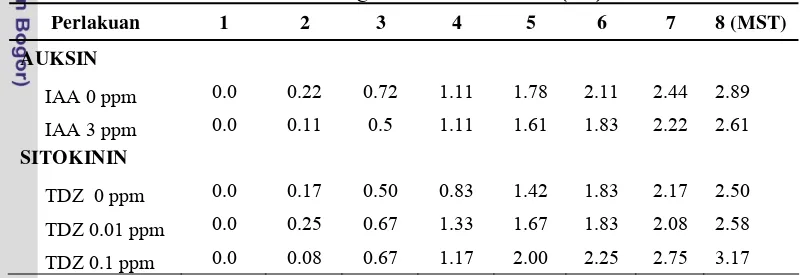
Tabel 1. Rata-rata Jumlah Tunas Pisang Rajabulu Juara yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
AUKSIN
IAA 0 ppm 0.06 0.06 0.22 0.22 0.22 0.22 0.22 0.22
IAA 3 ppm 0.06 0.06 0.11 0.17 0.17 0.17 0.17 0.17
TDZ 0 ppm 0.08 0.08 0.08 0.08 0.08 0.08 0.08 0.08
TDZ 0.01 ppm 0.08 0.08 0.17 0.25 0.25 0.25 0.25 0.25
TDZ 0.1 ppm 0.00 0.00 0.25 0.25 0.25 0.25 0.25 0.25 Rendahnya jumlah tunas yang dihasilkan oleh semua perlakuan diduga karena
sumber eksplan yang digunakan kurang bersifat meristematis (telah tua, hasil dari
sub kultur ketiga) untuk berdiferensiasi dan menginduksi tunas baru.
Jumlah daun pada percobaan ini dihitung dari daun yang telah mekar
sempurna pada tanaman awal (induk biakan). Interaksi TDZ dan IAA tidak
berpengaruh nyata hingga minggu terakhir pengamatan (Tabel Lampiran 3).
Penambahan IAA dan TDZ sebagai faktor tunggal juga tidak berpengaruh nyata
terhadap jumlah daun mulai minggu pertama sampai minggu kedelapan setelah
tanam seperti yang terlihat pada Tabel 2. Tunas yang ditanam pada media dengan
penambahan TDZ dan IAA memiliki jumlah daun yang sama dengan media tanpa
penambahan Zat Pengatur Tumbuh.
Tabel 2. Rata-rata Jumlah Daun Pisang Rajabulu Juara yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
Hal ini diduga disebabkan tanaman pisang pada kultur in vitro memiliki
pertumbuhan tinggi yang cepat sehingga pada 4 MST tanaman sudah mencapai
tutup botol. Kondisi ini mengakibatkan daun yang terbentuk melengkung dan
tetap menggulung. Media kontrol lebih baik digunakan karena secara ekonomi
lebih murah dan memberikan hasil yang sama bila dibandingkan dengan media
perlakuan.
Interaksi TDZ dan IAA tidak berpengaruh nyata terhadap jumlah akar
hingga minggu terakhir pengamatan (Tabel Lampiran 3). Penambahan IAA
hingga 8 MST. Analisis ragam menunjukkan bahwa pemberian TDZ pada media
untuk multiplikasi berpengaruh sangat nyata menurunkan jumlah akar bila
dibandingkan dengan kontrol. Respon mulai terlihat sejak dua minggu setelah
tanam, dengan kecenderungan adanya penurunan jumlah akar dengan
penambahan sitokinin TDZ (Tabel 2). Konsentrasi TDZ yang lebih tinggi yakni
0.1 ppm memberikan jumlah akar paling sedikit. Penambahan TDZ 0.1 mg/l ke
dalam media mengakibatkan penurunan jumlah akar pisang Rajabulu Juara hingga
seperempatnya dibandingkan dengan kontrol pada 8 MST. Peningkatan
konsentrasi TDZ diduga meningkatkan konsentrasi etilen yang dapat menghambat
pembentukan akar. Hasil ini searah dengan penelitian Devilana (2005) pada
komoditi nenas yang menyatakan bahwa konsentrasi TDZ 0.01 dan 0.1 ppm dapat
menghambat pembentukan akar yang menyebabkan tidak terbentuknya akar.
Tabel 3. Rata-rata Jumlah Akar Pisang Rajabulu Juara yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
AUKSIN
IAA 0 ppm 0.0 0.50 1.78 2.61 4.67 6.22 8.67 9.00
IAA 3 ppm 0.0 0.22 1.28 2.06 4.11 6.00 7.28 8.94
SITOKININ
TDZ 0 ppm 0.0 a 0.67 a 3.25 a 4.83 a 7.67 a 9.83 a 12.25 a 12.42 a
TDZ 0.01ppm 0.0 a 0.08 b 0.83 b 1.58 b 3.75 b 5.83 ab 8.08 ab 8.75 ab
TDZ 0.1 ppm 0.0 a 0.33 ab 0.50 b 0.58 b 1.75 b 2.67 b 3.58 b 5.75 b
Keterangan : Nilai yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%.
Ukutan Plantlet
Ukuran plantlet dalam hal ini ditekankan pada panjang akar dan tinggi
plantlet pada 10 MST. Semua data disajikan dalam 6 ulangan.
Pemberian IAA tidak berpengaruh nyata pada panjang akar, tanaman yang
ditanam pada media dengan penambahan IAA memiliki panjang akar yang sama
dibandingkan dengan tanaman yang ditanam pada media kontrol. Perlakuan TDZ
(A) (B)
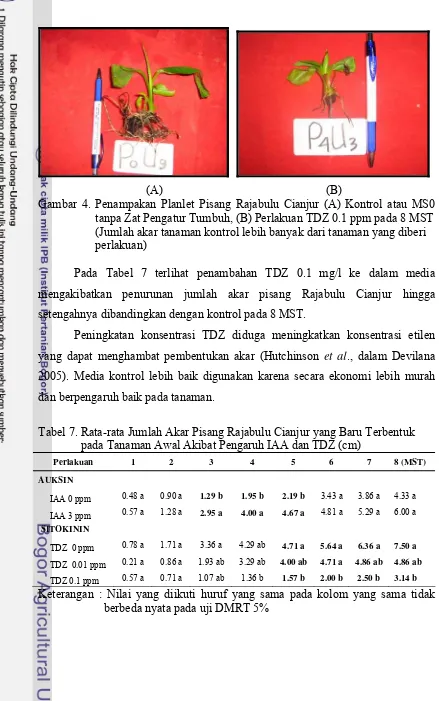
Gambar 3. Penampakan Planlet Pisang Rajabulu Juara (A) Kontrol atau MS0 tanpa Zat Pengatur Tumbuh, (B) Perlakuan TDZ 0.1 ppm pada 8 MST (Tanaman kontrol lebih tinggi dari tanaman yang diberi perlakuan)
Penggunaan TDZ pada media multiplikasi tunas in vitro pisang berpengaruh
sangat nyata pada tinggi. Semakin tinggi konsentrasi TDZ yang diberikan dapat
mengurangi tinggi tanaman (Gambar 3). Penambahan TDZ 0.1 mg/l ke dalam
media mengakibatkan penurunan tinggi pisang Rajabulu Juara hingga
sepertiganya dibandingkan dengan kontrol pada 10 MST (Tabel 4). Al-Wasel
(2000) menyatakan bahwa TDZ mampu menginduksi tunas tetapi menghambat
pertumbuhan tanaman. Oleh karena itu, tanaman harus disubkultur terlebih dahulu
ke media MS0 sebelum diaklimatisasi.
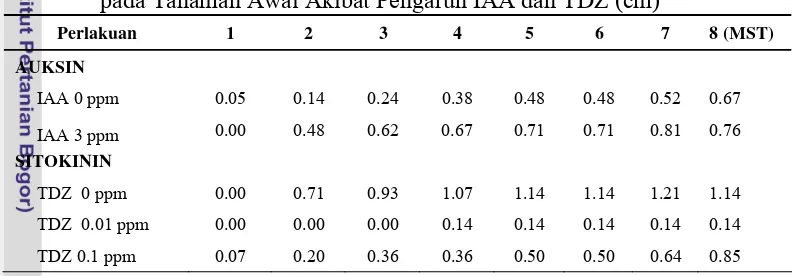
Tabel 4. Rata-rata Panjang Akar dan Tinggi Tanaman Awal Pisang Rajabulu Juara pada 10 MST Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan Panjang Akar Tinggi Tanaman AUKSIN
IAA 0 ppm 15.06 14.06 IAA 3 ppm 14.22 10.41 SITOKININ
TDZ 0 ppm 21.00 a 19.11 a TDZ 0.01 ppm 12.62 ab 11.46 b TDZ 0.1 ppm 10.29 b 6.12 b
Keterangan : Nilai yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Pada Tabel 4 terlihat penambahan TDZ 0.1 mg/l ke dalam media
setengahnya dibandingkan dengan kontrol pada 10 MST. Akar terpanjang
didapatkan pada media tanpa penambahan ZPT. Hasil ini searah dengan penelitian
Anwar (2007) pada komoditi nenas yang menyatakan bahwa penggunaan TDZ
0.1-0.5 µM yang disertai dengan penambahan konsentrasi auksin yang semakin
tinggi cenderung menurunkan panjang akar.
Pisang Rajabulu Cianjur
Respon Pertumbuhan
Respon pertumbuhan yang diamati meliputi jumlah tunas, jumlah daun
dan jumlah akar setiap minggu selama kultur (8 MST). Semua data disajikan
dalam 7 ulangan.
Tabel 5. Rata-rata Jumlah Tunas Pisang Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
Pada Tabel Lampiran 9 dapat dilihat bahwa interaksi TDZ dan IAA tidak
berpengaruh nyata pada jumlah tunas hingga minggu terakhir pengamatan.
Analisis pada faktor tunggal juga memberikan hasil yang sama. Namun, hampir
semua perlakuan TDZ dan IAA pada berbagai taraf perlakuan dapat menginduksi
tunas, walaupun nilainya masih rendah (Tabel 5). Rendahnya jumlah tunas yang
dihasilkan oleh semua perlakuan diduga karena sumber eksplan yang digunakan
kurang bersifat meristematis (telah tua, hasil dari sub kultur ketiga) untuk
berdiferensiasi dan menginduksi tunas baru.
Tunas rata-rata mulai terbentuk pada minggu pertama setelah tanam
kecuali pada perlakuan IAA 3 ppm, tunas baru terbentuk pada minggu kedua
setelah tanam dan pada penambahan TDZ 0.01 ppm tunas baru terbentuk pada
Jumlah daun pada percobaan ini dihitung dari daun yang telah mekar
sempurna. Pada Tabel Lampiran 9 dapat dilihat bahwa interaksi TDZ dan IAA
tidak berpengaruh nyata hingga minggu terakhir pengamatan. Penambahan IAA
juga tidak berpengaruh nyata hingga minggu terakhir pengamatan. Tunas yang
ditanam pada media dengan konsentrasi IAA 3 ppm memiliki jumlah daun yang
hampir sama dengan media tanpa penambahan Zat Pengatur Tumbuh.
Pemberian TDZ pada beberapa taraf perlakuan juga memberikan hasil
yang tidak berbeda nyata, kecuali pada 6 MST (Tabel 6). Pada minggu keenam
pertambahan jumlah daun pada media tanpa ZPT lebih tinggi dibandingkan
dengan perlakukan lainnya. Pada 7 - 8 MST sidik ragam kembali memberikan
hasil yang tidak berbeda nyata. Hal ini kemungkinan disebabkan oleh terjadinya
stagnasi kembali akibat ruang tumbuh yang terbatas sehingga daun yang terbentuk
melengkung dan tetap menggulung.
Tabel 6. Rata-rata Jumlah Daun Pisang Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
Keterangan : Nilai yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%.
Pengaruh penambahan IAA pada jumlah akar berbeda nyata pada 3-5
MST. Pada 6-8 MST penggunaan IAA tidak memberikan hasil yang berbeda
nyata. Analisis ragam menunjukkan bahwa pemberian TDZ pada media untuk
multiplikasi memberikan pengaruh yang nyata bila dibandingkan dengan kontrol.
Konsentrasi TDZ yang lebih tinggi yakni 0.1 ppm memberikan jumlah akar paling
sedikit (Gambar 4). Respon mulai terlihat sejak 5 MST, dengan kecenderungan
adanya penurunan jumlah akar dengan penambahan zat pengatur tumbuh pada
(A) (B)
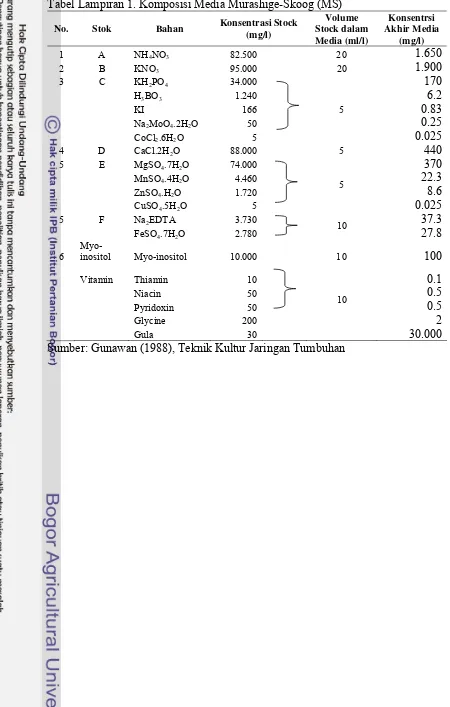
Gambar 4. Penampakan Planlet Pisang Rajabulu Cianjur (A) Kontrol atau MS0 tanpa Zat Pengatur Tumbuh, (B) Perlakuan TDZ 0.1 ppm pada 8 MST (Jumlah akar tanaman kontrol lebih banyak dari tanaman yang diberi perlakuan)
Pada Tabel 7 terlihat penambahan TDZ 0.1 mg/l ke dalam media
mengakibatkan penurunan jumlah akar pisang Rajabulu Cianjur hingga
setengahnya dibandingkan dengan kontrol pada 8 MST.
Peningkatan konsentrasi TDZ diduga meningkatkan konsentrasi etilen
yang dapat menghambat pembentukan akar (Hutchinson et al., dalam Devilana
2005). Media kontrol lebih baik digunakan karena secara ekonomi lebih murah
dan berpengaruh baik pada tanaman.
Tabel 7. Rata-rata Jumlah Akar Pisang Rajabulu Cianjur yang Baru Terbentuk pada Tanaman Awal Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan 1 2 3 4 5 6 7 8 (MST)
AUKSIN
IAA 0 ppm 0.48 a 0.90 a 1.29 b 1.95 b 2.19 b 3.43 a 3.86 a 4.33 a
IAA 3 ppm 0.57 a 1.28 a 2.95 a 4.00 a 4.67 a 4.81 a 5.29 a 6.00 a
SITOKININ
TDZ 0 ppm 0.78 a 1.71 a 3.36 a 4.29 ab 4.71 a 5.64 a 6.36 a 7.50 a
TDZ 0.01 ppm 0.21 a 0.86 a 1.93 ab 3.29 ab 4.00 ab 4.71 a 4.86 ab 4.86 ab
TDZ 0.1 ppm 0.57 a 0.71 a 1.07 ab 1.36 b 1.57 b 2.00 b 2.50 b 3.14 b
Ukuran Plantlet
Ukuran plantlet dalam hal ini ditekankan pada panjang akar dan tinggi
plantlet selama kultur pada 10 MST. Semua data disajikan dalam 7 ulangan.
Pemberian IAA tidak berpengaruh nyata pada panjang akar, media dengan
penambahan IAA memiliki panjang akar yang sama dibandingkan dengan media
tanpa penambahan IAA. Perlakuan konsentrasi TDZ 0.01 dan 0.1 ppm
berpengaruh sangat nyata menurunkan panjang akar. Akar terpanjang didapatkan
pada media tanpa penambahan TDZ. Pemberian TDZ 0.1 ppm memberikan akar
terpendek dengan rata-rata 6.89 cm (Gambar 4). Pada Tabel 8 terlihat
penambahan TDZ 0.1 mg/l ke dalam media mengakibatkan penurunan panjang
akar pisang Rajabulu Cianjur hingga sepertiganya dibandingkan dengan kontrol
pada 10 MST. Hambatan pertumbuhan akar disebabkan adanya etilen sebagai
penghambat pertumbuhan akar yang sintesisnya diinduksi oleh media dengan
penambahan TDZ.
Pengamatan pada peubah tinggi tunas in vitro pisang berpengaruh sangat
nyata antara kontrol dan perlakuan dengan TDZ. Pada Tabel 8 terlihat
penambahan TDZ 0.1 mg/l ke dalam media mengakibatkan penurunan tinggi
pisang Rajabulu Cianjur hingga setengahnya dibandingkan dengan kontrol pada
10 MST. Semakin tinggi konsentrasi TDZ yang diberikan mengurangi tinggi
tanaman. Hal ini disebabkan karena TDZ lebih berfungsi dalam proses
pembelahan sel dan memacu inisiasi.
Tabel 8. Rata-rata Panjang Akar dan Tinggi Tanaman Awal Pisang Rajabulu Cianjur pada 10 MST Akibat Pengaruh IAA dan TDZ (cm)
Perlakuan Panjang Akar Tinggi Tanaman
AUKSIN
Aklimatisasi
Proses aklimatisasi dilaksanakan pada 10 MST. Proses ini diawali dengan
penanaman dalam media tumbuh berupa sekam dalam gelas plastik dan
keseluruhnnya disungkup dengan kantong plastik selama kurang lebih satu
minggu. Setelah satu minggu tanaman dikeluarkan dari sungkup, dipindah dalam
media pembibitan. Perawatan dilakukan dengan penyiraman.
Pertumbuhan planlet mulai terlihat sejak awal penyungkupan dengan
terjadinya pembukaan daun yang menggulung. Pada masa awal aklimatisasi
warna daun terlihat pucat dan keriting. Hal ini merupakan reaksi yang wajar
terjadi pada masa awal aklimatisasi. Pada masa awal ini biasanya planlet belum
mampu beradaptasi dengan kondisi lingkungan yang baru.
Tunas yang berasal dari media multiplikasi dengan berbagai taraf
konsentrasi TDZ dan IAA menghasilkan persentase tunas hidup yang cukup tinggi
di atas 90% pada masa penyungkupan. Persentase tunas hidup kemudian terus
mengalami penurunan pada minggu pengamatan selanjutnya hingga akhirnya
keseluruhan tunas mengalami kematian.
Kegagalan ini mengakibatkan tidak diperolehnya data mengenai dampak
media multiplikasi terhadap kondisi tanaman di lapang. Kegagalan aklimatisasi ini
diduga akibat kondisi lingkungan yang kurang mendukung. Suhu di dalam screen
house yang tinggi sekitar 30-330 C, kelembaban yang terlalu rendah yaitu sekitar
50-55% dan paranet yang dipergunakan kurang dari 75%. Alasan utama
kegagalan aklimatisasi diduga karena planlet yang digunakan belum melalui tahap
pengakaran, tetapi dari tahap multiplikasi langsung aklimatisasi sehingga akar
KESIMPULAN DAN SARAN
KESIMPULAN
Pada tahap inisiasi penggunaan zat pengatur tumbuh Thiadiazuron
memberikan hasil yang lebih baik bila dibandingkan dengan BAP. Jumlah tunas
hidup tertinggi diberikan oleh media dengan penambahan TDZ 0.04 mg/l .
Pada tahap multiplikasi tidak terdapat interaksi antara IAA dan TDZ dalam
mempengaruhi multiplikasi pisang Rajabulu Juara. Penggunaan kedua konsentrasi
TDZ belum mampu meningkatkan jumlah tunas dan secara statistik tidak
berpengaruh nyata dibandingkan dengan kontrol. Penambahan TDZ 0.1 mg/l ke
dalam media mengakibatkan penurunan jumlah akar pisang Rajabulu Juara hingga
seperempatnya dibandingkan dengan kontrol pada 8 MST. Penggunaan Media
TDZ berpengaruh lebih buruk pada multiplikasi pisang Rajabulu Juara
dibandingkan dengan media MS0.
Tidak terdapat interaksi antara IAA dan TDZ dalam mempengaruhi
multiplikasi pisang Rajabulu Cianjur. Penggunaan TDZ dengan konsentrasi 0.01
ppm atau 0.1 ppm belum mampu meningkatkan multiplikasi tunas dan tidak
berbeda nyata secara statistik dengan kontrol. Penambahan TDZ 0.1 mg/l ke
dalam media mengakibatkan penurunan jumlah akar pisang Rajabulu Cianjur
hingga setengahnya dibandingkan dengan kontrol pada 8 MST. Penggunaan TDZ
pada media berpengaruh lebih buruk pada multiplikasi pisang Rajabulu Cianjur
dibandingkan media MS0.
SARAN
Perlu dilakukan pengkajian ulang mengenai pengaruh TDZ dalam inisiasi
dan multiplikasi tunas in vitro pisang Rajabulu menggunakan bahan tanaman yang
lebih banyak dalam level konsentrasi yang lebih beragam agar dapat dilakukan
regresi (disarankan menggunakan TDZ pada level konsentrasi lebih rendah dari
0.1 dan 0.01 ppm). Pada kultur in vitro pisang sebaiknya digunakan botol ukuran
besar (panjang).
Perlu diteliti kembali metode aklimatisasi yang tepat bagi pisang Rajabulu,
DAFTAR PUSTAKA
Acquaah, G. 2004. Understanding Biotechnology. Pearson Prentice Hall. New Jersey. 402p.
Al-Wasel, A. S. 2000. Micropagation of Acacia seyal Del. In vitro. Journal of Arid Environtment 46: 425-431.
Andriana, D. 2005. Pengaruh Konsentrasi BAP Terhadap Multiplikasi Tunas dan Giberelin terhadap Kualitas Tunas Pisang FHIA-17 In vitro. Jurusan Budidaya Pertanian. Institut Pertanian Bogor.
Anwar, N. 2007. Pengaruh Media multiplikasi Terhadap Pembentukan Akar pada Tunas In vitro Nenas (Ananas Comosos (L.) Merr.) cv. Smooth Cayenne di Media Pengakaran. Skripsi. Jurusan Budidaya Pertanian. Institut Pertanian Bogor.
Arinaitwe, G., P. R. Rubaihayo, and M.J.S. Magambo. 1999. Effect of Auxin/Cytokinin Combination on Shoot Proliveration on Banana Cultivar. African Crop Science Journal. 7(4) : 605-611.
Azria, D. and P. L. Bhalla. 2000. Plant Regeneration From Mature Embryo-Derived Callus (Oryza sativa L.) Varieties. Aust. J. Agric. Res. 51:305-312.
Conger, B. S. 1981. Cloning Agriculture Plant via In vitro Techniques. CRC Press-Boca Raton. Florida. 280p.
Direktorat Bina Produksi hortikultura. 1985. Vademekum Buah-buahan. Dirjen. Pertanian Tanaman Pangan. Jakarta.
Devilana, M. R. 2005. Pengaruh Sitokinin (TDZ) dan Auksin (IAA dan NAA) Terhadap Multiplikasi Nenas (Ananas comosus (L) Merr.) cv. Queen dalam Perbanyakan Kultur Jaringan. Skripsi. Departemen Budidaya Pertanian. Fakultas Petanian. IPB.
Dodds, J. H. dan L. W. Roberts.1999. Experiments in Plant Tissue Culture. Ed.3. Cambridge University press. British. 256 p.
Ernawati, A., A. Purwito dan K. Suketi. 1994. Studi Perbanyakan Cepat Pisang Raja bulu, Pisang Ambon Kuning dan Pisang Barangan dengan teknik kultur jaringan (laporan penelitian ). Fakultas Pertanian . IPB. Bogor
Gamborg, O. L. Dan J. P. Shylux. 1981. Nutrition media, and characteristic of plant cell and tissue culture, p.21-24. In:Trevor A. Thorpe, (ed.).Plant Tissue Culture and Aplication in Agriculture. Academic Press Inc. New York.
Gunawan, L. W. 1988. Teknik Kultur Jaringan Tumbuhan. PAU (Pusat Antar Universitas). IPB. Bogor. 304 hal.
Harjadi, S. S. 1996. Pengantar agronomi. Jakarta : PT. Gramedia Pustaka Utama. 197 hal.
Hutami, S. dan R. Purnamaningsih. 2003.Perbanyakan Klonal Temu Mangga (Curcuma mangga) melalui Kultur In vitro. Bul. Plasma Nutfah. 9(1):39-44.
Kasutjianingati. 2004. Pembiakan Mikro berbagai Genotipe Pisang (Musa spp) dan Potensi Bakteri Endofitik Terhadap Layu Fusarium (Fusarium oxysporum f. sp. cubense). Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor.
Khalafalla, M. M.and K. Hattori.2000.Ethylene inhibitors enhance in vitro root formation on faba bean shoots regenerated on medium containing thiadiazuron. Plant growth regulation 32 : 59-63
Mattjik, A. A. dan I. M. Sumertajaya. 2002. Perancangan Percobaan. IPB Press.
Mattjik, N. A. 2005. Peran kultur Jaringan dalam Perbaikan Tanaman. Fakultas Pertanian. Institut Pertanian Bogor.102 hal.
Pasaribu, J. M. 1996. Perbanyakan Tunas In vitro Pisang Raja Bulu (Musa AAB Group) dengan Eksplan yang Berasal dari Sucker (Anakan) dan Jantung. Skripsi. Jurusan Budidaya Pertanian. Institut Pertanian Bogor.
Nursandi, F. 2006. Studi Perbanyakan In vitro Tanaman Nenas (Ananas comosus (L.) Merr.) dan Analisa Kestabilan Genetik Berdasarkan Karakter Morfologi, Isoenzim dan RAPD. Disertasi. Sekolah Pasca Sarjana. InstitutPertanian Bogor. Bogor. 148 hal.
Onamu, R., S. D. Obukosia, N. Musembi and M.J. Hutchinson. 2003. Efficacy of Thiadiazuron In vitro Propagation of Carnation Shoot Tips : Influence of dose and duration of explosure. African Crop Science Journal 11(2) : 125-132.
PAU, Tim Kultur Jaringan Tanaman. 1991. Bioteknologi Tanaman. IPB Press. 455 hal.