AKTIVITAS AMILOLITIK BEBERAPA KAPANG DAN
KEMAMPUAN PRODUKSI ALKOHOLNYA DARI PATI
SINGKONG
TAHIRA TUNNISA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TAHIRA TUNNISA. Aktivitas Amilolitik Beberapa Kapang dan Kemampuan Produksi Alkoholnya dari Pati Singkong.Dibimbing oleh GAYUH RAHAYU dan NISA RACHAMANIA MUBARIK.
Penggunaan bioetanol telah menjadi salah satu alternatif dalam usaha penyediaan energi terbarukan. Produksi bioetanol memerlukan sumber enzim. Oleh sebab itu penelitian ini bertujuan untuk menyeleksi kapang yang berpotensi menghasilkan glukoamilase untuk mengubah glukosa menjadi etanol secara berkesinambungan. Empat dari 32 isolat kapang koleksi Institut Pertanian Bogor Culture Collection (IPBCC) yaitu Aspergillus niger IPBCC 88.145, Trichoderma longibrachiatum IPBCC 07.556, Penicillium sp. IPBCC 07.537, dan P. herquei IPBCC 07.557 memiliki aktivitas amilolitik. Aspergillus niger IPBCC 88.145 memiliki indeks amilolitik tertinggi (2,7) dengan aktivitas glukoamilase optimumnya (1,95 Unit/mL) terjadi pada jam ke-96 inkubasi. Hasil uji produksi etanol melalui konversi kehilangan CO2 oleh isolat Aspergillus niger IPBCC
88.145 menunjukkan bahwa produksi etanol meningkat terus sampai 192 jam inkubasi sebesar 4,13 mL, sedangkan produksi alkohol dari bubur singkong (50%) yang disterilisasi menunjukkan bahwa efisiensi produksi alkohol sebesar 52,11% (v/v) dengan volume alkohol sebesar 7,25% (v/v), dan kadar alkohol 90,5%. Produksi alkohol dari bubur singkong yang dipasteurisasi memiliki efisiensi produksi sebesar 55,71% (v/v) dengan volume alkohol sebesar 7,75% (v/v), dan kadar alkohol 93,5%.
ABSTRACT
TAHIRA TUNNISA. Amilolytic Activity of Some Molds and Alcohol Production from Starch of Cassava. Supervised by GAYUH RAHAYU and NISA RACHMANIA MUBARIK.
Bioethanol is a renewable energy, that is produced from starch by enzymatic process. The aim of this research was to select potential fungi which were able to produce glucoamylase and subsequently convert glucose to ethanol. Four out of 32 isolate molds of Institut Pertanian Bogor Culture Collection (IPBCC), that were Aspergillus niger IPBCC 88.145, Trichoderma longibrachiatum IPBCC 07.556, Penicillium sp. IPBCC 07.537, and P. herquei IPBCC 07.557 had amylolytic activity. Aspergillus niger IPBCC 88.145 had the highest amylolytic index 2.7 with optimum activity of glucoamylase (1.95 Unit/mL) at 96 hours of incubation. Based on the CO2
AKTIVITAS AMILOLITIK BEBERAPA KAPANG DAN
KEMAMPUAN PRODUKSI ALKOHOLNYA DARI PATI
SINGKONG
TAHIRA TUNNISA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Amilolitik Beberapa Kapang dan Kemampuan Produksi
Alkoholnya dari Pati Singkong
Nama
: Tahira Tunnisa
NIM
: G34104040
Disetujui:
Pembimbing I,
Pembimbing II,
Dr.Ir. Gayuh Rahayu
Dr. Nisa Rachmania Mubarik, M.Si.
NIP. 131289335
NIP. 132045531
Diketahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP. 131578806
Tanggal Lulus :
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang berjudul Aktivitas Amilolitik beberapa Kapang dan Kemampuan Produksi Alkoholnya dari Pati Singkong ini dilaksanakan sejak bulan Desember 2007 hingga Juli 2008 di Laboratorium Mikologi dan Laboratorium Fisiologi Tumbuhan, Departemen Biologi, FMIPA, Institut Pertanian Bogor (IPB).
Penulis mengucapkan terima kasih kepada Ibu Dr. Ir. Gayuh Rahayu dan Ibu Dr. Nisa Rachmania Mubarik, M.Si selaku dosen pembimbing yang telah memberikan saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih kepada Ibu Dr. Triadiati, M.Si. selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini. Terima kasih penulis sampaikan kepada almarhum Ayah, Ibu serta kedua kakakku Kak Syarif, Kak Maryam, Kak Yuni, dan Aisyah atas segala doa, dukungan, pengorbanan, dan kasih sayangnya. Terima kasih kepada Pak Joni yang telah setia menemani menjadi tempat berbagi cerita dan berkeluh kesah, kepada Kak Irni, Yuyun, Dika, dan Mbak Asti atas segala saran dan masukkan selama penelitian ini, kepada Mbak Wiwi dan Pak Kus atas bantuannya di laboratorium, kepada Lia, Ririn, Esti atas persahabatan dan kebersamaannya dan kepada teman-teman Biologi 41 atas kebersamaannya.
Semoga karya tulis ini dapat bermanfaat di kemudian hari.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 2 Desember 1985 sebagai anak ketiga dari tiga bersaudara pasangan Almarhum Hamid Machmud dan Rohma Tunisa. Tahun 2004, penulis lulus dari SMUN 29 Jakarta dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB.
Penulis aktif sebagai anggota Himpunan Mahasiswa Biologi pada tahun 2006/2007 dan menjadi anggota Organisasi Kewirausahaan Mahasiswa Biologi BIOWORLD Divisi Nata pada tahun 2004-2005. Penulis menjadi asisten mata kuliah Biologi Dasar Tingkat Persiapan Bersama pada tahun 2006-2008 dan Biologi Cendawan tahun 2007-2008. Pada tahun 2007, penulis melakukan praktik lapangan dengan judul Manajemen Perusahaan dan Proses Pengolahan Limbah Cair di bagian Instalasi Pengolahan Air Limbah di PT Capsugel Indonesia, Cibinong.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat ... 1
Bahan ... 1
Peremajaan Isolat Kapang ... 1
Pengukuran Indeks Amilolitik ... 1
Produksi Enzim dan Penetapan Periode Inkubasi Optimum ... 2
Penetapan Aktivitas Glukoamilase ... 2
Uji Produksi Etanol pada Erlenmeyer Berkatup Muller ... 2
Produksi Etanol Menggunakan Media Singkong ... 2
HASIL Seleksi Kapang Amilolitik ... 3
Produksi Enzim dan Penetapan Periode Inkubasi Optimum ... 3
Produksi Etanol pada Erlenmeyer Berkatup Muller... 3
Produksi Alkohol Menggunakan Media Singkong ... 3
PEMBAHASAN ... 4
SIMPULAN ... 5
SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR GAMBAR
Halaman 1 Zona bening yang terbentuk di sekitar koloni A. niger (IPBCC 88.145) setelah 3 hari
inkubasi pada media ADK+1% (b/v) pati tapioka ... 3
2 Kurva pertumbuhan dan aktivitas glukoamilase A. niger (IPBC 88.145) yang diinkubasi pada suhu 30 0C ... 3
3 Produksi etanol dan kadar gula selama fermentasi pati dengan erlenmeyer berkatup Muller ... 3
DAFTAR LAMPIRAN
Halaman 1 Isolat kapang yang digunakan dalam penelitian ini ... 82 Komposisi berbagai media yang digunakan dalam penelitian ini ... 9
3Diagram alir metode Somogyi-Nelson (Breuil & Saddler 1985) ... 10
PENDAHULUAN
Latar Belakang
Permintaan dan kebutuhan sumber energi dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk dan semakin berkurangnya minyak dunia. Dalam rangka mengantisipasi hal tersebut, sumber energi alternatif perlu dicari. Penggunaan bioetanol telah menjadi salah satu alternatif dalam usaha memenuhi kebutuhan sumber energi terbarukan. Bioetanol sebagai substitusi bahan bakar minyak memberikan berbagai manfaat antara lain sebagai octan booster, pelarut fosfat, dan bahan campuran produk gasolin (Prihandana & Hendroko 2008). Penggunaan bioetanol juga dapat meningkatkan efisiensi pembakaran dan mengurangi emisi bahan bakar (Chandel et al. 2007; Prihandana & Hendroko 2008).
Bioetanol dapat diproduksi melalui proses fermentasi. Proses fermentasinya dipengaruhi oleh beberapa faktor di antaranya substrat dan jenis mikrob. Substrat yang digunakan dalam produksi bioetanol merupakan sumber glukosa seperti pati singkong, pati sorgum, pati sagu, nira kelapa, tetes tebu, dan nira sorgum. Menurut Benda (1982) fermentasi substrat untuk produksi etanol membutuhkan waktu 3 sampai 7 hari.
Salah satu mikrob yang dapat digunakan dalam produksi bioetanol ialah kapang. Kapang mampu merombak pati menjadi monomernya melalui produksi amilase. Glukoamilase ialah jenis enzim amilase yang mampu merombak pati menjadi glukosa (Sigurskjold et al. 1994), sedangkan amilase lainnya seperti λ-amilase dan β-amilase menghasilkan produk akhir berupa maltosa dan maltotriosa. Enzim glukoamilase atau amiloglukosidase (EC 3.2.1.3) memecah polisakarida (pati dan glikogen) pada ikatan α-1,4 dan α-1,6 dari bagian ujung molekul pati secara berurutan menjadi glukosa (Cornett et al. 2003). Enzim ini dihasilkan oleh genus Aspergillus, Rhizopus (Benda 1982; Oliveira et al. 2007),
Mucor, Endomyces (Benda 1982) dan
Thermomyces lanuginosus (Li et al. 1998). Enzim λ-amilase dihasilkan oleh A. oryzae dan A. niger (Ponte & Reed 1982). Enzim β-amilase dihasilkan oleh
Syncephalastrum racemosum (Ray & Chakraverty 1998).
Glukoamilase dapat diproduksi dalam skala industri melalui fermentasi kultur cair
maupun fermentasi padat (Moreira et al.
2001). Kondisi lingkungan seperti pH, aerasi, dan kehomogenan media pada fermentasi dengan media cair, dapat dikendalikan untuk menunjang pertumbuhan mikrob (Moreira et al. 2001). Sampai saat ini, produksi bioetanol dari pati singkong di Indonesia masih bergantung pada enzim amilase impor, oleh karena itu perlu dilakukan inventarisasi isolat-isolat kapang yang memiliki potensi menghasilkan enzim glukoamilase ekstraseluler sebagai langkah awal.
Tujuan
Penelitian ini bertujuan menyeleksi kapang yang berpotensi menghasilkan glukoamilase dan secara berkesinambungan dapat mengubah glukosa menjadi alkohol.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2007 sampai Juli 2008 di Laboratorium Mikologi dan Laboratorium Fisiologi Tumbuhan, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan-bahan yang digunakan ialah 32 isolat kapang (Lampiran 1) koleksi dari Institut Pertanian Bogor Culture Collection
(IPBCC), media agar-agar dekstrosa kentang (ADK) yang ditambahkan pati tapioka 1% (b/v) merek Pak Tani (Lampiran 2A). Media produksi enzim (Lampiran 2B), media produksi alkohol (Lampiran 2C), larutan bufer fosfat 0,2 M pH 7,0 (Lampiran 2D), larutan Lugol (Lampiran 2E), larutan Somogyi-Nelson (Lampiran 3), dan larutan total gula dengan metode fenol (Lampiran 4).
Peremajaan Isolat Kapang
Tiga puluh dua isolat kapang koleksi IPBCC diremajakan masing-masing pada media agar-agar ADK dan diinkubasi pada suhu ruang (27 0C) selama 5 hari, kemudian isolat ini digunakan sebagai kultur kerja untuk produksi alkohol.
Pengukuran Indeks Amilolitik
Biakan diinkubasi selama 3 hari pada suhu ruang, pada akhir masa inkubasi biakan disiram larutan Lugol di sekitar tepi koloni lalu diamati zona bening yang terbentuk di sekeliling koloni. Isolat kapang lalu dipilih berdasarkan indeks amilolitiknya (IA), yaitu rasio diameter zona bening di luar koloni terhadap diameter koloni.
Produksi Enzim dan Penetapan Periode Inkubasi Optimum
Isolat-isolat dengan aktivitas amilolitik yang relatif tinggi diproduksi enzim glukoamilasenya. Tiga potong koloni kapang (diameter 0,5 cm) diinokulasikan pada 25 mL media produksi enzim dalam erlenmeyer 100 mL, lalu diinkubasi pada suhu ruang (± 30 0C) dengan menggunakan penggoyang rotari pada kecepatan 120 rpm selama 6 hari. Aktivitas glukoamilase dan pertumbuhan kapang diamati setiap hari selama 6 hari inkubasi. Pengukuran pertumbuhan kapang dilakukan melalui pengukuran bobot kering massa kapang. Bobot kering massa kapang adalah bobot massa kapang setelah dikering-ovenkan pada suhu 105 0C selama 2 hari.
Penetapan Aktivitas Glukoamilase Aktivitas enzim glukoamilase diukur dengan metode Somogyi-Nelson (Breuil & Saddler 1985). Sebanyak 0,5 mL larutan pati terlarut 0,5% (b/v), 0,4 mL bufer fosfat 0,2 M pH 7,0 dan 0,1 mL larutan enzim dicampurkan dan diinkubasi selama 30 menit pada suhu 35 0C, pada akhir inkubasi ditambahkan 1 mL larutan A.
Sebanyak 1 mL larutan tersebut diambil dan dicampurkan dengan 1 mL larutan D lalu dididihkan selama 20 menit. Campuran lalu didinginkan pada air mengalir selama 5 menit, kemudian ditambahkan dengan 1 mL larutan C dan dikocok kuat sampai tidak ada gelembung. Campuran diencerkan dengan akuades hingga volume akhir 25 mL. Absorbansi diukur pada panjang gelombang 520 nm. Satu unit (U) aktivitas glukoamilase setara dengan 1 µ mol glukosa yang dihasilkan per menit pada kondisi pengukuran. Sebagai standar digunakan glukosa pada konsentrasi 0-600 ppm dengan selang konsentrasi 100 ppm. Pengujian aktivitas glukoamilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Uji Produksi Etanol pada Erlenmeyer Berkatup Muller
Sebanyak 3 potong inokulum (diameter 0,5 cm) dari isolat terpilih (umur 3 hari) dimasukkan ke dalam 200 mL media produksi enzim dan dilakukan sebanyak 4 ulangan. Biakan diinkubasi pada suhu ruang dengan penggoyang rotari pada kecepatan 120 rpm selama 48 jam setelah itu biakan tidak diagitasi hingga jam ke-192. Setelah media berubah menjadi lebih jernih, Erlenmeyer ditutup dengan katup Muller
berisi asam sulfat 96%, kemudian diinkubasi selama 5 hari. Kandungan total gulanya diukur setiap hari dengan metode Fenol. Berat CO2 yang hilang adalah selisih berat
awal dan berat akhir media produksi enzim. Produksi etanol ditetapkan berdasarkan berat CO2 yang hilang kemudian dikalikan dengan
konstanta 1,25 (Martini & Martini 1998). Masa inkubasi optimum produksi etanol adalah masa inkubasi optimum yang diperlukan mikrob untuk memproduksi etanol dalam jumlah maksimum.
Produksi Etanol Menggunakan Media Singkong
Sebanyak 1 600 g singkong segar dikupas bagian kulitnya, dibersihkan, dan diparut. Singkong yang telah diparut dimasukkan ke dalam panci dan ditambahkan 1 600 mL air yang sudah diberi 3 584 g urea, 68,8 g CO(NH2)2, 68,8 g KCl,
dan 68,8 g P2O5. Campuran diaduk sampai
terbentuk bubur singkong kemudian dipanaskan pada suhu 60 0C selama 20 menit sambil diaduk. Bubur singkong yang telah dingin dibagi ke dalam lima Erlenmeyer untuk perlakuan dan tiga Erlenmeyer lainnya digunakan sebagai kontrol. Bubur singkong tersebut kemudian disterilisasi dengan dua cara yaitu pada suhu 121 0C, tekanan 1 atm selama 15 menit dan dipasteurisasi pada suhu 62,5 0C selama 30 menit.
optimum yang dihasilkan dalam periode fermentasi diukur dengan labu ukur sedangkan kadar alkohol diukur dengan alkoholmeter.
HASIL
Seleksi Kapang Amilolitik
Hasil pengukuran indeks amilolitik diperoleh empat isolat (Tabel 1, Gambar 1) yang mampu membentuk zona bening di sekitar koloni. Zona bening menunjukkan hidrolisis pati oleh enzim amilase ekstraseluler yang dihasilkan kapang. Pati yang tidak terhidrolisis tampak berwarna biru setelah bereaksi dengan larutan Lugol.
Gambar 1 Zona bening yang terbentuk di sekitar koloni A. niger (IPBCC 88.145) setelah 3 hari inkubasi pada media ADK + 1% (b/v) pati tapioka.
A. niger (IPBCC 88.145) memiliki IA lebih tinggi (2,7) dibandingkan isolat pembanding yaitu Aspergillus sydowii K-10 (1,4). A. niger (IPBCC 88.145) selanjutnya diuji secara kuantitatif aktivitas amilolitiknya dan kemampuannya dalam produksi alkohol.
Tabel 1 Indeks amilolitik beberapa isolat kapang
No Nama Isolat IA
1 A. niger (IPBCC 88.145) 2,7 2 Trichoderma
longibrachiatum (IPBCC 07.556)
1,2
3 Penicilllium sp. (IPBCC 07.537) 1,2 4 P. herquei (IPBCC 07.557) 1,2 5 A. sydowii K-10* 1,4 *Damayanti (2000).
Produksi Enzim dan Penetapan Periode Inkubasi Optimum
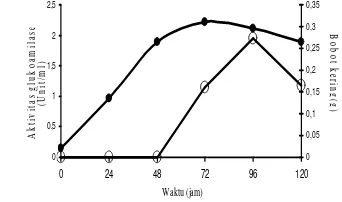
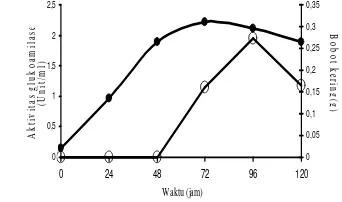
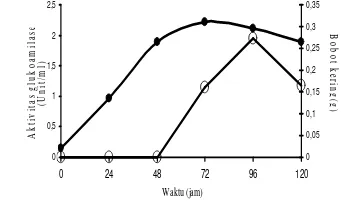
Inokulum A. niger (IPBCC 88.145) dimasukkan ke dalam media produksi enzim sebesar 0,02 g. Inokulum ini aktif tumbuh dan mencapai biomasa maksimalnya pada 72 jam inkubasi (Gambar 2) sebesar 0,31 g. Pertumbuhan kapang sudah dapat diukur
pada 24 jam inkubasi, aktivitas glukoamilasenya baru terdeteksi pada 72 jam inkubasi yaitu sebesar 1,15 Unit/mL. Aktivitas glukoamilase mencapai puncaknya pada jam ke-96 inkubasi sebesar 1,95 Unit/mL pada kondisi uji. Masa produksi glukoamilase optimum ini terjadi 24 jam setelah masa pertumbuhan optimumnya atau pada fase stasioner.
0 0,5 1 1,5 2 2,5
0 24 48 72 96 120
Waktu (jam) A k ti v it a s g lu k o a m il as e (U n it /m l) 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 B o b o t k e ri n g (g )
Gambar 2 Kurva pertumbuhan dan aktivitas glukoamilase A. niger (IPBCC 88.145) yang diinkubasi pada suhu 30 0 C; (●) bobot kering dan (о) aktivitas glukoamilase.
Produksi Etanol pada Erlenmeyer Berkatup Muller
Larutan pati menjadi jernih setelah 48 jam inkubasi, sehingga semua pati diasumsikan sudah berubah menjadi gula. Kadar gula pada awal inkubasi sebesar 4,95% (b/v) (Gambar 3). Kadar gula pada 72 jam inkubasi terus menurun menjadi 4,47% (b/v) dan mendekati kadar minimal pada 144 jam inkubasi sebesar 0,82% (b/v) dan tidak terdeteksi lagi pada 192 jam inkubasi.
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
0 24 48 72 96 120 144 168 192
Waktu (jam) P ro d u k si E ta n o l (m L )) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 T o ta l g u la % (b /v )
Gambar 3 Produksi etanol dan kadar gula selama fermentasi pati dengan erlenmeyer berkatup Muller; (о) produksi etanol (ml) dan (●) total gula % (b/v).
Melalui perhitungan kehilangan CO2,
dengan jumlah produksi etanol sebesar 4,13 mL.
Produksi Alkohol Menggunakan Media Singkong
Sebelum proses fermentasi, tingkat likuifikasi bubur singkong yang disterilisasi lebih rendah dibandingkan bubur singkong yang dipasteurisasi. Likuifikasi bertambah terus selama masa sakarifikasi. Kadar gula pada awal sakarifikasi sebesar 20,39% (b/v). Jika pati diubah seluruhnya menjadi gula maka kadar gula pada bubur singkong sekitar 27,4% (b/b). Efisiensi sakarifikasi pada penelitian ini sebesar 74,3% (b/b). Selama masa fermentasi kadar gula menurun terus sekitar 1,21%–6,3% (b/v) setiap 24 jam.
Alkohol yang terbentuk pada media singkong yang disterilisasi sebanyak 29 mL dan untuk media singkong yang dipasteurisasi sebanyak 31 mL pada 5 hari inkubasi. Volume alkohol pada akhir fermentasi mencapai 7,25% (v/v) untuk bubur yang disterilisasi dan 7,75% (v/v) untuk bubur yang dipasteurisasi. Efisiensi produksinya sekitar 52,11% (v/v) dan efisiensi fermentasinya sekitar 70,2% (v/v) untuk bubur yang disterilisasi. Bubur yang dipasteurisasi menunjukkan efisiensi produksi sekitar 55,71% (v/v) dan efisiensi fermentasi sekitar 75,1% (v/v) dari perhitungan produksi alkohol teoritis sebesar 43,9 mL. Kadar alkohol yang dihasilkan dari bubur singkong yang dipasteurisasi sebesar 93,5% juga lebih tinggi daripada kadar alkohol dari bubur singkong yang disterilisasi sebesar 90,5%.
PEMBAHASAN
Zona bening yang terbentuk di sekitar koloni kapang pada media agar-agar ADK yang mengandung pati setelah disiram larutan Lugol menunjukkan bahwa kapang tersebut mampu menghasilkan amilase ekstraseluler. Isolat-isolat kapang yang diuji memiliki IA yang bervariasi karena setiap kapang memiliki kemampuan berbeda-beda dalam menguraikan pati menjadi gula sederhana. Hasil penelitian ini menunjukkan bahwa isolat A. niger (IPBCC 88.145) memiliki IA yang relatif lebih tinggi dibandingkan dengan IA A. sydowii K-10 (Damayanti 2000). Menurut Madi et al. (1987) dan Oliveira et al. (2007), kemampuan produksi amilase bergantung pada sumber karbon yang dipergunakan.
Sebagai contoh, produksi α-amilase dari
Clostridium sp.lebih baik pada maltotriosa sebagai sumber karbon dibandingkan gula lainnya (Madi et al. 1987), sedangkan amilase dari rhizobia diproduksi maksimal pada maltosa dan pati jagung sebagai sumber karbon (Oliveira et al. 2007). Maltosa merupakan senyawa penginduksi bagi amilase (Busch et al. 1997; Oliveira et al. 2007).
Pertumbuhan A. niger (IPBCC 88.145) terbagi dalam beberapa tahap, yaitu fase lag, fase log, fase stasioner, dan fase kematian. Fase lag A. niger (IPBCC 88.145) dapat dilihat pada jam ke-0, isolat ini mulai beradaptasi dengan nutrisi dan lingkungan yang tersedia. Isolat tersebut sudah menggunakan nutrisi dalam media fermentasinya pada fase log sehingga pertumbuhan bobot kering massa sel mulai meningkat dengan cepat, dapat dilihat dari jam ke-24 dan mencapai maksimum yaitu jam ke-72, setelah itu kapang relatif tidak tumbuh lagi atau memasuki fase stasioner. Pola pertumbuhan ini mengikuti pola pertumbuhan kapang pada medium cair pada umumnya.
Aktivitas glukoamilase baru terdeteksi pada jam ke-72 inkubasi dan mencapai maksimum pada jam ke-96 inkubasi sebesar 1,95 Unit/mL. Aktivitas glukoamilase A. niger (IPBCC 88.145) tertinggi terjadi ketika pertumbuhan kapang berada dalam fase stasioner. Aktivitas enzim ini lebih rendah dibandingkan aktivitas ekstrak kasar glukoamilase komersial yang dipergunakan dalam produksi bioetanol di Cicurug, Sukabumi yaitu 2,2 Unit/mL (data tidak dipublikasikan). Aktivitas enzim dipengaruhi oleh sumber karbonnya. Menurut Madi et al. (1987), aktivitas amilase Clostridium sp. yang ditumbuhkan pada pati meningkat pada fase stasioner, sedangkan jika menggunakan sumber karbon berupa pullulan, aktivitas amilase diproduksi selama pertumbuhan eksponensial.
dengan perbandingan 1:1, pada rasio tersebut sudah membentuk suspensi yang cukup baik. Tingkat likuifikasi yang optimum untuk produksi etanol bergantung pada jenis kapang yang digunakan. Menurut Fujio et al. (1984), kadar singkong optimum untuk fermentasi singkong oleh Rhizopus
spp. sebesar 40% tanpa pemanasan. Menurut Han & Steinberg (1986), A. niger dapat ditumbuhkan pada jagung (whole corn) untuk produksi etanol. Bubur singkong setelah dipanaskan tingkat likuifikasinya berubah. Tingkat likuifikasi bubur singkong yang dipasteurisasi lebih tinggi daripada bubur singkong yang disterilisasi. Menurut Balagopalan et al. (1988) pati singkong akan mengalami proses gelatinisasi pada suhu 58,5-70,0 0C. Tingkat likuifikasi menurun selama proses fermentasi seperti dikemukakan oleh Fujio et al. (1984).
Larutan pati dalam Erlenmeyer berkatup
Muller berubah menjadi lebih jernih setelah 48 jam inkubasi. Kadar gula awal inkubasi pada suspensi pati sebesar 4,95% (b/v) sedangkan pada bubur singkong, kadar gula awal inkubasi sebesar 20,39% (b/v) atau sekitar 40,78 g gula. Hal ini menunjukkan bahwa proses sakarifikasi terjadi akibat aktivitas A. niger (IPBCC 88.145) selama 24-48 jam inkubasi. Aktivitas glukoamilase baru terdeteksi pada 72 jam inkubasi, sedangkan pada awal inkubasi telah terjadi perombakan pati menjadi gula. Hal ini dapat terjadi melalui bantuan enzim-enzim amilase lainnya karena pada penelitian sebelumnya mengindikasikan adanya aktivitas amilase selain glukoamilase.
Glukoamilase dapat mengubah seluruh pati menjadi glukosa. Menurut Balagopalan
et al. (1988) glukoamilase berbeda dengan enzim amilase lainnya yang hanya mampu mengubah 85% (b/v) pati menjadi glukosa. Glukoamilase tidak toleran terhadap suhu lebih dari 55 0C dan A. niger (IPBCC 88.145) yang digunakan termasuk kapang mesofil, oleh sebab itu inokulan ditambahkan setelah larutan pati atau bubur singkong agak dingin. Kadar gula pada 72 jam inkubasi dalam Erlenmeyer berkatup
Muller menurun sebesar 0,49% (b/v). Gula hasil hidrolisis pati selama 72 jam inkubasi digunakan oleh kapang untuk produksi biomassa. Fermentasi baru terjadi setelah 72 jam inkubasi.
Konsentrasi gula, optimum pada proses fermentasi etanol berkisar 12%-18% (Balagopalan 1988). Kadar gula pada pati tapioka tidak pernah mencapai konsentrasi
optimum pembentukan etanol. Kadar glukosa awal 4,95% (b/v), setelah 72 jam inkubasi kadar gula terus menurun dan mendekati kadar minimal pada 144 jam inkubasi sebesar 0,82% (b/v), dan tidak terdeteksi lagi pada 192 jam inkubasi. Oleh sebab itu proses fermentasi berjalan lambat dan proses fermentasi baru terdeteksi pada jam ke-96 inkubasi ketika etanol sudah diproduksi sekitar 0,47 mL. Awal inkubasi, produksi etanol pada katup Muller sangat rendah karena diduga kondisi dalam Erlenmeyer cenderung aerobik daripada anaerobik. Gula awalnya dipergunakan oleh kapang untuk proses asimilasi sehingga ketika produksi etanol melampaui 0,47 mL, kondisi berubah menjadi anaerobik. Kondisi ini mendorong laju pembentukan etanol menjadi lebih cepat. Produksi etanol meningkat terus sampai 192 jam inkubasi dengan jumlah produksi etanol sebesar 4,13 mL. Hasil ini lebih besar dari perhitungan teoritis (1,98 mL), sedangkan periode inkubasinya mendekati perkiraan semula bahwa periode inkubasi untuk produksi etanol sekitar 120 jam.
Produksi etanol pada media singkong mencapai 7,25%-7,75% (v/v) dari volume substrat. Produksi ini lebih tinggi dari hasil penelitian Cronk et al. (1977), tetapi lebih rendah dari hasil penelitian Fujio et al. (1984). Cronk et al. (1977) menemukan bahwa produksi etanol pada pembuatan tape ketan oleh Amylomyces rouxii pada 96 jam inkubasi mencapai 5,6% (v/v). Produksi etanol dapat meningkat dengan menggunakkan inokulan kombinasi. Kombinasi A. rouxii dan Candida lactosa
menghasilkan 7,4% (v/v) etanol sedangkan Fujio et al. (1984) melaporkan bahwa dengan Rhizopus spp. produksi alkohol dari bubur singkong mencapai 13,7% (v/v).
Produksi etanol dari bubur singkong pada penelitian ini, sekitar 7% (v/v) mungkin sudah menjadi represor aktif bagi pembentukan etanol oleh A. niger (IPBCC 88.145). Etanol menjadi represor bagi produksi etanol dengan cara mengubah permeabilitas membran dan mengganggu fungsi membran dalam transpor ion hidrogen (Dombek & Ingram 1987). Menurut Dombek & Ingram (1987) pada
SIMPULAN
Empat isolat kapang yaitu A. niger
IPBCC 88.145, T. longibrachiatum IPBCC 07.556, Penicilllium sp. IPBCC 07.537, dan
P. herquei IPBCC 07.557 memiliki aktivitas amilolitik. Aspergillus niger (IPBCC 88.145) memiliki IA tertinggi sebesar 2,7 dan menghasilkan glukoamilase. Aktivitas glukoamilase optimum (1,95 Unit/mL) terjadi pada 96 jam inkubasi. Kapang ini juga mampu mengubah pati singkong menjadi alkohol. Produksi alkohol sebesar 29 mL-31 mL dengan kadar alkoholnya 90,5%-93,5%, sedangkan efisiensi produksi alkohol berkisar antara 52,11%-55,71% (v/v) dan efisiensi fermentasinya berkisar 70,2%-75,1% (v/v) bergantung dari tingkat likuifikasi bubur singkongnya.
SARAN
Kapasitas hidrolisis pati dan fermentasi optimum oleh kapang A. niger IPBCC 88.145 perlu dikaji lebih lanjut.
DAFTAR PUSTAKA
Balagopalan C, Padmaja G, Nanda SK, Moothy SN. 1988. Cassava in Food, Feed, and Industry. Florida: CRC Pr. Benda I. 1982. Wine and brandy. Di dalam:
Reed G, editor. Prescott & Dunn’s Industrial Microbiology. Ed ke-4. New York: AVI Publishing. hlm 293-402. Breuil C, Saddler JN. 1985. Comparison of
the 3.5-dinitrosalicylic acid and Nelson Somogyi methods of assaying for reducing sugars and determining cellulose activity. Enzyme Microbiol Technol 7: 331.
Busch JE, Porter EG, Stutzenberger FJ.
1997. Induction of α-amylase by malto-oligosaccharides in Thermomonospora curvata. J Appl Microbiol 82:669-676. Chandel et al. 2007. Economics and
environmental impact of bioethanol production technologies an appraisal.
Biotechnol Molec Biol 2:14-32. Cornett CAG, Fang TY, Reilly PJ, Ford C.
2003. Starch-binding domain shuffling in Aspergillus niger glucoamylase. Prot Eng16:521-529.
Cronk TC, Steinkraus KH, Hackler LR, Mattick LR. 1977. Indonesian tape ketan fermentation. Appl Environ Microbiol 33: 1067-1073.
Damayanti E. 2000. Isolasi dan karakterisasi amilase dari kapang alkalotoleran asal limbah cair tapioka [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dombek KM, Ingram LO. 1987. Ethanol production during batch fermentation with Saccharomyces cerevisiae: changes in glycolytic enzymes and internal pH. Appl Environ Microbiol
53:1286-1291.
Fujio Y, Suyanadona P, Attasampunna P, Ueda S. 1984. Alcoholic fermentation of raw cassava starch by Rhizopus koji
without cooking. Biotechnol Bioeng
26:315-319.
Han IY, Steinberg MP. 1986. Amylosis of raw corn by Aspergillus niger for simultaneous ethanol fermentation.
Biotechnol Bioeng 30:225-234. Li DC, Yang YS, Peng YL, Shen CY. 1998.
Purification and characterization of extracellular glucoamylase from the thermophilic Thermomyces lanuginosus.
J Mycol Res 102:568-572.
Martini AV, Martini A. 1998. Determination of ethanol production. Di dalam: Kurtzman CP, Fell JW, editor. The Yeast, A Taxonomic Study. Ed ke-4. Amsterdam: Elsevier. hlm 107.
Madi E, Antranikian G, Ohmiya K, Gottschalk. 1987. Thermostable amylolytic enzymes from a new
Clostridium isolate. Appl Environ Microbiol 53:1661-1667.
Moreira et al. 2001. The use of α -methyl-D-glucoside, a synthetic analogue of maltose, as inducer of amylase by
Aspergillus sp. in solid state and submerged fermentations. Braz J Microbiol 32:81-86.
Oliveira AN de, Olivieira LA de, Andrade JS, Junior AFC. 2007. Rhizobia amylase production using various starchy substances as carbon substrates.
Braz J Microbiol 38:208-216.
Prihandana R, Hendroko R. 2008. Energi Hijau Pilihan Bijak menuju Negeri Mandiri Energi. Jakarta: Penebar Swadaya.
Ray RR, Chakraverty R. 1998. Extacellular β-amylase from Syncephalastrum racemosum. J Mycol Res 102:1563-1567.
Sigurskjold BW, Berland CR, Svensson B. 1994. Thermodynamics of inhibitor binding to the catalytic site of glucoamylase from Aspergillus niger
Lampiran 1 Isolat kapang yang digunakan dalam penelitian ini
Nama Isolat No aksesi Asal Lokasi
Acremonium sp. IPBCC 07.548 Serasah meranti Katingan-Kalteng
A. niger IPBCC 88.099 Tanah Pasar Bogor
IPBCC 88.100 Tanah Cibodas
IPBCC 88.102 Anggur Pasar Bogor
IPBCC 88.138 Tanah Taiwan
IPBCC 88.140 Tanah perkebunan kelapa
sawit, kacang tanah, kedelai, dan jagung
IPBCC 88.141 Tanah perkebunan kelapa
sawit, kacang tanah, kedelai, dan jagung IPBCC 88.143 Tanah limbah Tasikmalaya
IPBCC 88.145 Anggur Pasar Bogor
IPBCC 90.243 Kontaminan
IPBCC 93.265 CBS (Centraalbureau Voor Schimmelcultures)
A. ornatus IPBCC 07.554 Serasah meranti Katingan-Kalteng
Fusarium oxysporum IPBCC 07.540 Serasah meranti Katingan-Kalteng
Gliocladium sp. IPBCC 07.543 Serasah meranti Katingan-Kalteng
Gongronella sp. IPBCC 07.553 Serasah meranti Katingan-Kalteng
Paecylomyces sp. IPBCC 07.549 Serasah meranti Katingan-Kalteng IPBCC 07.550 Serasah meranti Katingan-Kalteng
Penicillium sp. IPBCC 07.537 Serasah meranti Katingan-Kalteng IPBCC 07.538 Serasah meranti Katingan-Kalteng IPBCC 07.539 Serasah meranti Katingan-Kalteng 80/31/9 07.536 Serasah meranti Katingan-Kalteng
P. herquei IPBCC 07.557 Serasah meranti Katingan-Kalteng
P. notatum IPBCC 07.555 Serasah meranti Katingan-Kalteng
P. miczynskii IPBCC 07.541 Serasah meranti Katingan-Kalteng
P. velutinum IPBCC 07.535 Serasah meranti Katingan-Kalteng
P. janthinellum IPBCC 07.542 Serasah meranti Katingan-Kalteng
Trichoderma harzianum
IPBCC 07.545 Serasah meranti Katingan-Kalteng
IPBCC 07.546 Serasah meranti Katingan-Kalteng IPBCC 07.547 Serasah meranti Katingan-Kalteng
T. longibrachiatum IPBCC 07.556 Serasah meranti Pulau Obi
T. koningii IPBCC 07.552 Serasah meranti Katingan-Kalteng
Lampiran 2 Komposisi berbagai media yang digunakan dalam penelitian ini
A. Komposisi media agar-agar dekstrosa kentang (ADK) + pati tapioka 1% (b/v) Kentang 200 g
Agar-agar 15 g Gula 20 g Pati tapioka 10 g Kloramfenikol 2 tablet Akuades 1 000 mL
B. Komposisi media produksi enzim Ekstrak khamir 10 g
Pati tapioka 10 g MgSO4
.
7H2O 0,5 g
KH2PO4 1,3 g
Akuades 1 000 mL
C. Komposisi media produksi alkohol Singkong 1 600 g (kadar pati 28%) Urea 3 584 g
CO(NH2)2 68,8 g
KCl 68,8 g P2O5 68,8 g
Akuades 1 600 mL
D. Komposisi pembuatan bufer fosfat 0,2 M pH 7,0 Na2HPO4
.
H2O 0,2M 39 mL
NaH2PO4 .
H2O 0,2M 61 mL
E. Komposisi larutan Lugol KI 2 g I2 2 g
Lampiran 3 Diagram alir metode Somogyi-Nelson (Breuil & Saddler 1985)
0,1 mL enzim + 0,5 mL larutan pati terlarut + 0,4 mL bufer fosfat
Diinkubasi (suhu optimum, 30 menit)
Ditambahkan 1 mL Larutan A*
Diambil 1 mL kemudian ditambahkan 1 mL Larutan D*
Dididihkan 20 menit
Didinginkan 5 menit
Ditambahkan 1 mL Larutan C*, dikocok hingga tidak ada gelembung
Diencerkan hingga 25 mL
Absorbansi diukur pada λ 520 nm
Blanko : enzim diganti dengan akuades steril.
Kontrol: penambahan enzim dilakukan setelah ditambah larutan A, sebelum dididihkan. Standar: larutan standar glukosa 0-600 ppm, dengan selang konsentrasi 100 ppm.
y = 0,00024x + 0,04789 R² = 0,98597
0 0,05 0,1 0,15 0,2 0,25
0 100 200 300 400 500 600
Konsentrasi glukosa (ppm)
A
b
s
o
rb
a
n
s
i (
5
2
0
n
m
)
Persamaan aktivitas glukoamilase (Unit/ml): [glukosa] x Fp BM glukosa x V x t
Keterangan:
[glukosa]: konsentrasi glukosa (ppm) Fp: faktor pengenceran
BM: bobot molekul glukosa (180,16 g/mol) V: volume enzim yang digunakan (0,1 mL) t: waktu inkubasi (20 menit)
*) Cara membuat: • Larutan A:
Na2CO3 2,5 g
NaKtartrat 2,5 g NaHCO3 2 g
Na2SO4 20 g
Akuades 100 mL
• Larutan B: CuSO4 .
5H2O
30 g H2SO4 pekat 4 tetes
Akuades 200 mL
• Larutan C:
Larutan 1: 5 g NH4MoO4 dalam 50 mL akuades yang mengandung 4,2 mLH2SO4.
Larutan 2: 0,6 g Na2HAsO4 .
7H2O dalam 5 mL akuades.
Kedua larutan kemudian dicampur dan diencerkan hingga 100 mL. Campuran diinkubasi semalam pada suhu 37-40 0C, dimasukkan ke dalam botol gelap, dan disimpan pada suhu 30 0C.
Lampiran 4 Diagram alir pengukuran total gula dengan metode Fenol
2 mL substrat yang telah diencerkan 10 000 + 1 mL larutan fenol 5%
Dikocok sampai homogen
Ditambahkan 5 mL H2SO4 pekat
Diamkan selama 10 menit
Direndam dalam air sampai dingin
Absorbansi diukur pada λ 490 nm
Blanko: singkong diganti dengan akuades.
Standar: larutan standar glukosa 0-15 ppm, dengan selang konsentrasi 5 ppm.
y = 0,0412x + 0,216 R2 = 0,9519
0 0,2 0,4 0,6 0,8 1
0 5 10 15
Konsentrasi glukosa (ppm)
A
b
s
o
rb
a
n
s
i (
4
9
0
n
m
)
ABSTRAK
TAHIRA TUNNISA. Aktivitas Amilolitik Beberapa Kapang dan Kemampuan Produksi Alkoholnya dari Pati Singkong.Dibimbing oleh GAYUH RAHAYU dan NISA RACHAMANIA MUBARIK.
Penggunaan bioetanol telah menjadi salah satu alternatif dalam usaha penyediaan energi terbarukan. Produksi bioetanol memerlukan sumber enzim. Oleh sebab itu penelitian ini bertujuan untuk menyeleksi kapang yang berpotensi menghasilkan glukoamilase untuk mengubah glukosa menjadi etanol secara berkesinambungan. Empat dari 32 isolat kapang koleksi Institut Pertanian Bogor Culture Collection (IPBCC) yaitu Aspergillus niger IPBCC 88.145, Trichoderma longibrachiatum IPBCC 07.556, Penicillium sp. IPBCC 07.537, dan P. herquei IPBCC 07.557 memiliki aktivitas amilolitik. Aspergillus niger IPBCC 88.145 memiliki indeks amilolitik tertinggi (2,7) dengan aktivitas glukoamilase optimumnya (1,95 Unit/mL) terjadi pada jam ke-96 inkubasi. Hasil uji produksi etanol melalui konversi kehilangan CO2 oleh isolat Aspergillus niger IPBCC
88.145 menunjukkan bahwa produksi etanol meningkat terus sampai 192 jam inkubasi sebesar 4,13 mL, sedangkan produksi alkohol dari bubur singkong (50%) yang disterilisasi menunjukkan bahwa efisiensi produksi alkohol sebesar 52,11% (v/v) dengan volume alkohol sebesar 7,25% (v/v), dan kadar alkohol 90,5%. Produksi alkohol dari bubur singkong yang dipasteurisasi memiliki efisiensi produksi sebesar 55,71% (v/v) dengan volume alkohol sebesar 7,75% (v/v), dan kadar alkohol 93,5%.
ABSTRACT
TAHIRA TUNNISA. Amilolytic Activity of Some Molds and Alcohol Production from Starch of Cassava. Supervised by GAYUH RAHAYU and NISA RACHMANIA MUBARIK.
Bioethanol is a renewable energy, that is produced from starch by enzymatic process. The aim of this research was to select potential fungi which were able to produce glucoamylase and subsequently convert glucose to ethanol. Four out of 32 isolate molds of Institut Pertanian Bogor Culture Collection (IPBCC), that were Aspergillus niger IPBCC 88.145, Trichoderma longibrachiatum IPBCC 07.556, Penicillium sp. IPBCC 07.537, and P. herquei IPBCC 07.557 had amylolytic activity. Aspergillus niger IPBCC 88.145 had the highest amylolytic index 2.7 with optimum activity of glucoamylase (1.95 Unit/mL) at 96 hours of incubation. Based on the CO2
PENDAHULUAN
Latar Belakang
Permintaan dan kebutuhan sumber energi dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk dan semakin berkurangnya minyak dunia. Dalam rangka mengantisipasi hal tersebut, sumber energi alternatif perlu dicari. Penggunaan bioetanol telah menjadi salah satu alternatif dalam usaha memenuhi kebutuhan sumber energi terbarukan. Bioetanol sebagai substitusi bahan bakar minyak memberikan berbagai manfaat antara lain sebagai octan booster, pelarut fosfat, dan bahan campuran produk gasolin (Prihandana & Hendroko 2008). Penggunaan bioetanol juga dapat meningkatkan efisiensi pembakaran dan mengurangi emisi bahan bakar (Chandel et al. 2007; Prihandana & Hendroko 2008).
Bioetanol dapat diproduksi melalui proses fermentasi. Proses fermentasinya dipengaruhi oleh beberapa faktor di antaranya substrat dan jenis mikrob. Substrat yang digunakan dalam produksi bioetanol merupakan sumber glukosa seperti pati singkong, pati sorgum, pati sagu, nira kelapa, tetes tebu, dan nira sorgum. Menurut Benda (1982) fermentasi substrat untuk produksi etanol membutuhkan waktu 3 sampai 7 hari.
Salah satu mikrob yang dapat digunakan dalam produksi bioetanol ialah kapang. Kapang mampu merombak pati menjadi monomernya melalui produksi amilase. Glukoamilase ialah jenis enzim amilase yang mampu merombak pati menjadi glukosa (Sigurskjold et al. 1994), sedangkan amilase lainnya seperti λ-amilase dan β-amilase menghasilkan produk akhir berupa maltosa dan maltotriosa. Enzim glukoamilase atau amiloglukosidase (EC 3.2.1.3) memecah polisakarida (pati dan glikogen) pada ikatan α-1,4 dan α-1,6 dari bagian ujung molekul pati secara berurutan menjadi glukosa (Cornett et al. 2003). Enzim ini dihasilkan oleh genus Aspergillus, Rhizopus (Benda 1982; Oliveira et al. 2007),
Mucor, Endomyces (Benda 1982) dan
Thermomyces lanuginosus (Li et al. 1998). Enzim λ-amilase dihasilkan oleh A. oryzae dan A. niger (Ponte & Reed 1982). Enzim β-amilase dihasilkan oleh
Syncephalastrum racemosum (Ray & Chakraverty 1998).
Glukoamilase dapat diproduksi dalam skala industri melalui fermentasi kultur cair
maupun fermentasi padat (Moreira et al.
2001). Kondisi lingkungan seperti pH, aerasi, dan kehomogenan media pada fermentasi dengan media cair, dapat dikendalikan untuk menunjang pertumbuhan mikrob (Moreira et al. 2001). Sampai saat ini, produksi bioetanol dari pati singkong di Indonesia masih bergantung pada enzim amilase impor, oleh karena itu perlu dilakukan inventarisasi isolat-isolat kapang yang memiliki potensi menghasilkan enzim glukoamilase ekstraseluler sebagai langkah awal.
Tujuan
Penelitian ini bertujuan menyeleksi kapang yang berpotensi menghasilkan glukoamilase dan secara berkesinambungan dapat mengubah glukosa menjadi alkohol.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2007 sampai Juli 2008 di Laboratorium Mikologi dan Laboratorium Fisiologi Tumbuhan, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan-bahan yang digunakan ialah 32 isolat kapang (Lampiran 1) koleksi dari Institut Pertanian Bogor Culture Collection
(IPBCC), media agar-agar dekstrosa kentang (ADK) yang ditambahkan pati tapioka 1% (b/v) merek Pak Tani (Lampiran 2A). Media produksi enzim (Lampiran 2B), media produksi alkohol (Lampiran 2C), larutan bufer fosfat 0,2 M pH 7,0 (Lampiran 2D), larutan Lugol (Lampiran 2E), larutan Somogyi-Nelson (Lampiran 3), dan larutan total gula dengan metode fenol (Lampiran 4).
Peremajaan Isolat Kapang
Tiga puluh dua isolat kapang koleksi IPBCC diremajakan masing-masing pada media agar-agar ADK dan diinkubasi pada suhu ruang (27 0C) selama 5 hari, kemudian isolat ini digunakan sebagai kultur kerja untuk produksi alkohol.
Pengukuran Indeks Amilolitik
PENDAHULUAN
Latar Belakang
Permintaan dan kebutuhan sumber energi dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk dan semakin berkurangnya minyak dunia. Dalam rangka mengantisipasi hal tersebut, sumber energi alternatif perlu dicari. Penggunaan bioetanol telah menjadi salah satu alternatif dalam usaha memenuhi kebutuhan sumber energi terbarukan. Bioetanol sebagai substitusi bahan bakar minyak memberikan berbagai manfaat antara lain sebagai octan booster, pelarut fosfat, dan bahan campuran produk gasolin (Prihandana & Hendroko 2008). Penggunaan bioetanol juga dapat meningkatkan efisiensi pembakaran dan mengurangi emisi bahan bakar (Chandel et al. 2007; Prihandana & Hendroko 2008).
Bioetanol dapat diproduksi melalui proses fermentasi. Proses fermentasinya dipengaruhi oleh beberapa faktor di antaranya substrat dan jenis mikrob. Substrat yang digunakan dalam produksi bioetanol merupakan sumber glukosa seperti pati singkong, pati sorgum, pati sagu, nira kelapa, tetes tebu, dan nira sorgum. Menurut Benda (1982) fermentasi substrat untuk produksi etanol membutuhkan waktu 3 sampai 7 hari.
Salah satu mikrob yang dapat digunakan dalam produksi bioetanol ialah kapang. Kapang mampu merombak pati menjadi monomernya melalui produksi amilase. Glukoamilase ialah jenis enzim amilase yang mampu merombak pati menjadi glukosa (Sigurskjold et al. 1994), sedangkan amilase lainnya seperti λ-amilase dan β-amilase menghasilkan produk akhir berupa maltosa dan maltotriosa. Enzim glukoamilase atau amiloglukosidase (EC 3.2.1.3) memecah polisakarida (pati dan glikogen) pada ikatan α-1,4 dan α-1,6 dari bagian ujung molekul pati secara berurutan menjadi glukosa (Cornett et al. 2003). Enzim ini dihasilkan oleh genus Aspergillus, Rhizopus (Benda 1982; Oliveira et al. 2007),
Mucor, Endomyces (Benda 1982) dan
Thermomyces lanuginosus (Li et al. 1998). Enzim λ-amilase dihasilkan oleh A. oryzae dan A. niger (Ponte & Reed 1982). Enzim β-amilase dihasilkan oleh
Syncephalastrum racemosum (Ray & Chakraverty 1998).
Glukoamilase dapat diproduksi dalam skala industri melalui fermentasi kultur cair
maupun fermentasi padat (Moreira et al.
2001). Kondisi lingkungan seperti pH, aerasi, dan kehomogenan media pada fermentasi dengan media cair, dapat dikendalikan untuk menunjang pertumbuhan mikrob (Moreira et al. 2001). Sampai saat ini, produksi bioetanol dari pati singkong di Indonesia masih bergantung pada enzim amilase impor, oleh karena itu perlu dilakukan inventarisasi isolat-isolat kapang yang memiliki potensi menghasilkan enzim glukoamilase ekstraseluler sebagai langkah awal.
Tujuan
Penelitian ini bertujuan menyeleksi kapang yang berpotensi menghasilkan glukoamilase dan secara berkesinambungan dapat mengubah glukosa menjadi alkohol.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2007 sampai Juli 2008 di Laboratorium Mikologi dan Laboratorium Fisiologi Tumbuhan, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan-bahan yang digunakan ialah 32 isolat kapang (Lampiran 1) koleksi dari Institut Pertanian Bogor Culture Collection
(IPBCC), media agar-agar dekstrosa kentang (ADK) yang ditambahkan pati tapioka 1% (b/v) merek Pak Tani (Lampiran 2A). Media produksi enzim (Lampiran 2B), media produksi alkohol (Lampiran 2C), larutan bufer fosfat 0,2 M pH 7,0 (Lampiran 2D), larutan Lugol (Lampiran 2E), larutan Somogyi-Nelson (Lampiran 3), dan larutan total gula dengan metode fenol (Lampiran 4).
Peremajaan Isolat Kapang
Tiga puluh dua isolat kapang koleksi IPBCC diremajakan masing-masing pada media agar-agar ADK dan diinkubasi pada suhu ruang (27 0C) selama 5 hari, kemudian isolat ini digunakan sebagai kultur kerja untuk produksi alkohol.
Pengukuran Indeks Amilolitik
Biakan diinkubasi selama 3 hari pada suhu ruang, pada akhir masa inkubasi biakan disiram larutan Lugol di sekitar tepi koloni lalu diamati zona bening yang terbentuk di sekeliling koloni. Isolat kapang lalu dipilih berdasarkan indeks amilolitiknya (IA), yaitu rasio diameter zona bening di luar koloni terhadap diameter koloni.
Produksi Enzim dan Penetapan Periode Inkubasi Optimum
Isolat-isolat dengan aktivitas amilolitik yang relatif tinggi diproduksi enzim glukoamilasenya. Tiga potong koloni kapang (diameter 0,5 cm) diinokulasikan pada 25 mL media produksi enzim dalam erlenmeyer 100 mL, lalu diinkubasi pada suhu ruang (± 30 0C) dengan menggunakan penggoyang rotari pada kecepatan 120 rpm selama 6 hari. Aktivitas glukoamilase dan pertumbuhan kapang diamati setiap hari selama 6 hari inkubasi. Pengukuran pertumbuhan kapang dilakukan melalui pengukuran bobot kering massa kapang. Bobot kering massa kapang adalah bobot massa kapang setelah dikering-ovenkan pada suhu 105 0C selama 2 hari.
Penetapan Aktivitas Glukoamilase Aktivitas enzim glukoamilase diukur dengan metode Somogyi-Nelson (Breuil & Saddler 1985). Sebanyak 0,5 mL larutan pati terlarut 0,5% (b/v), 0,4 mL bufer fosfat 0,2 M pH 7,0 dan 0,1 mL larutan enzim dicampurkan dan diinkubasi selama 30 menit pada suhu 35 0C, pada akhir inkubasi ditambahkan 1 mL larutan A.
Sebanyak 1 mL larutan tersebut diambil dan dicampurkan dengan 1 mL larutan D lalu dididihkan selama 20 menit. Campuran lalu didinginkan pada air mengalir selama 5 menit, kemudian ditambahkan dengan 1 mL larutan C dan dikocok kuat sampai tidak ada gelembung. Campuran diencerkan dengan akuades hingga volume akhir 25 mL. Absorbansi diukur pada panjang gelombang 520 nm. Satu unit (U) aktivitas glukoamilase setara dengan 1 µ mol glukosa yang dihasilkan per menit pada kondisi pengukuran. Sebagai standar digunakan glukosa pada konsentrasi 0-600 ppm dengan selang konsentrasi 100 ppm. Pengujian aktivitas glukoamilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Uji Produksi Etanol pada Erlenmeyer Berkatup Muller
Sebanyak 3 potong inokulum (diameter 0,5 cm) dari isolat terpilih (umur 3 hari) dimasukkan ke dalam 200 mL media produksi enzim dan dilakukan sebanyak 4 ulangan. Biakan diinkubasi pada suhu ruang dengan penggoyang rotari pada kecepatan 120 rpm selama 48 jam setelah itu biakan tidak diagitasi hingga jam ke-192. Setelah media berubah menjadi lebih jernih, Erlenmeyer ditutup dengan katup Muller
berisi asam sulfat 96%, kemudian diinkubasi selama 5 hari. Kandungan total gulanya diukur setiap hari dengan metode Fenol. Berat CO2 yang hilang adalah selisih berat
awal dan berat akhir media produksi enzim. Produksi etanol ditetapkan berdasarkan berat CO2 yang hilang kemudian dikalikan dengan
konstanta 1,25 (Martini & Martini 1998). Masa inkubasi optimum produksi etanol adalah masa inkubasi optimum yang diperlukan mikrob untuk memproduksi etanol dalam jumlah maksimum.
Produksi Etanol Menggunakan Media Singkong
Sebanyak 1 600 g singkong segar dikupas bagian kulitnya, dibersihkan, dan diparut. Singkong yang telah diparut dimasukkan ke dalam panci dan ditambahkan 1 600 mL air yang sudah diberi 3 584 g urea, 68,8 g CO(NH2)2, 68,8 g KCl,
dan 68,8 g P2O5. Campuran diaduk sampai
terbentuk bubur singkong kemudian dipanaskan pada suhu 60 0C selama 20 menit sambil diaduk. Bubur singkong yang telah dingin dibagi ke dalam lima Erlenmeyer untuk perlakuan dan tiga Erlenmeyer lainnya digunakan sebagai kontrol. Bubur singkong tersebut kemudian disterilisasi dengan dua cara yaitu pada suhu 121 0C, tekanan 1 atm selama 15 menit dan dipasteurisasi pada suhu 62,5 0C selama 30 menit.
optimum yang dihasilkan dalam periode fermentasi diukur dengan labu ukur sedangkan kadar alkohol diukur dengan alkoholmeter.
HASIL
Seleksi Kapang Amilolitik
Hasil pengukuran indeks amilolitik diperoleh empat isolat (Tabel 1, Gambar 1) yang mampu membentuk zona bening di sekitar koloni. Zona bening menunjukkan hidrolisis pati oleh enzim amilase ekstraseluler yang dihasilkan kapang. Pati yang tidak terhidrolisis tampak berwarna biru setelah bereaksi dengan larutan Lugol.
Gambar 1 Zona bening yang terbentuk di sekitar koloni A. niger (IPBCC 88.145) setelah 3 hari inkubasi pada media ADK + 1% (b/v) pati tapioka.
A. niger (IPBCC 88.145) memiliki IA lebih tinggi (2,7) dibandingkan isolat pembanding yaitu Aspergillus sydowii K-10 (1,4). A. niger (IPBCC 88.145) selanjutnya diuji secara kuantitatif aktivitas amilolitiknya dan kemampuannya dalam produksi alkohol.
Tabel 1 Indeks amilolitik beberapa isolat kapang
No Nama Isolat IA
1 A. niger (IPBCC 88.145) 2,7 2 Trichoderma
longibrachiatum (IPBCC 07.556)
1,2
3 Penicilllium sp. (IPBCC 07.537) 1,2 4 P. herquei (IPBCC 07.557) 1,2 5 A. sydowii K-10* 1,4 *Damayanti (2000).
Produksi Enzim dan Penetapan Periode Inkubasi Optimum
Inokulum A. niger (IPBCC 88.145) dimasukkan ke dalam media produksi enzim sebesar 0,02 g. Inokulum ini aktif tumbuh dan mencapai biomasa maksimalnya pada 72 jam inkubasi (Gambar 2) sebesar 0,31 g. Pertumbuhan kapang sudah dapat diukur
pada 24 jam inkubasi, aktivitas glukoamilasenya baru terdeteksi pada 72 jam inkubasi yaitu sebesar 1,15 Unit/mL. Aktivitas glukoamilase mencapai puncaknya pada jam ke-96 inkubasi sebesar 1,95 Unit/mL pada kondisi uji. Masa produksi glukoamilase optimum ini terjadi 24 jam setelah masa pertumbuhan optimumnya atau pada fase stasioner.
0 0,5 1 1,5 2 2,5
0 24 48 72 96 120
Waktu (jam) A k ti v it a s g lu k o a m il as e (U n it /m l) 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 B o b o t k e ri n g (g )
Gambar 2 Kurva pertumbuhan dan aktivitas glukoamilase A. niger (IPBCC 88.145) yang diinkubasi pada suhu 30 0 C; (●) bobot kering dan (о) aktivitas glukoamilase.
Produksi Etanol pada Erlenmeyer Berkatup Muller
Larutan pati menjadi jernih setelah 48 jam inkubasi, sehingga semua pati diasumsikan sudah berubah menjadi gula. Kadar gula pada awal inkubasi sebesar 4,95% (b/v) (Gambar 3). Kadar gula pada 72 jam inkubasi terus menurun menjadi 4,47% (b/v) dan mendekati kadar minimal pada 144 jam inkubasi sebesar 0,82% (b/v) dan tidak terdeteksi lagi pada 192 jam inkubasi.
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
0 24 48 72 96 120 144 168 192
Waktu (jam) P ro d u k si E ta n o l (m L )) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 T o ta l g u la % (b /v )
Gambar 3 Produksi etanol dan kadar gula selama fermentasi pati dengan erlenmeyer berkatup Muller; (о) produksi etanol (ml) dan (●) total gula % (b/v).
Melalui perhitungan kehilangan CO2,
optimum yang dihasilkan dalam periode fermentasi diukur dengan labu ukur sedangkan kadar alkohol diukur dengan alkoholmeter.
HASIL
Seleksi Kapang Amilolitik
Hasil pengukuran indeks amilolitik diperoleh empat isolat (Tabel 1, Gambar 1) yang mampu membentuk zona bening di sekitar koloni. Zona bening menunjukkan hidrolisis pati oleh enzim amilase ekstraseluler yang dihasilkan kapang. Pati yang tidak terhidrolisis tampak berwarna biru setelah bereaksi dengan larutan Lugol.
Gambar 1 Zona bening yang terbentuk di sekitar koloni A. niger (IPBCC 88.145) setelah 3 hari inkubasi pada media ADK + 1% (b/v) pati tapioka.
A. niger (IPBCC 88.145) memiliki IA lebih tinggi (2,7) dibandingkan isolat pembanding yaitu Aspergillus sydowii K-10 (1,4). A. niger (IPBCC 88.145) selanjutnya diuji secara kuantitatif aktivitas amilolitiknya dan kemampuannya dalam produksi alkohol.
Tabel 1 Indeks amilolitik beberapa isolat kapang
No Nama Isolat IA
1 A. niger (IPBCC 88.145) 2,7 2 Trichoderma
longibrachiatum (IPBCC 07.556)
1,2
3 Penicilllium sp. (IPBCC 07.537) 1,2 4 P. herquei (IPBCC 07.557) 1,2 5 A. sydowii K-10* 1,4 *Damayanti (2000).
Produksi Enzim dan Penetapan Periode Inkubasi Optimum
Inokulum A. niger (IPBCC 88.145) dimasukkan ke dalam media produksi enzim sebesar 0,02 g. Inokulum ini aktif tumbuh dan mencapai biomasa maksimalnya pada 72 jam inkubasi (Gambar 2) sebesar 0,31 g. Pertumbuhan kapang sudah dapat diukur
pada 24 jam inkubasi, aktivitas glukoamilasenya baru terdeteksi pada 72 jam inkubasi yaitu sebesar 1,15 Unit/mL. Aktivitas glukoamilase mencapai puncaknya pada jam ke-96 inkubasi sebesar 1,95 Unit/mL pada kondisi uji. Masa produksi glukoamilase optimum ini terjadi 24 jam setelah masa pertumbuhan optimumnya atau pada fase stasioner.
0 0,5 1 1,5 2 2,5
0 24 48 72 96 120
Waktu (jam) A k ti v it a s g lu k o a m il as e (U n it /m l) 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 B o b o t k e ri n g (g )
Gambar 2 Kurva pertumbuhan dan aktivitas glukoamilase A. niger (IPBCC 88.145) yang diinkubasi pada suhu 30 0 C; (●) bobot kering dan (о) aktivitas glukoamilase.
Produksi Etanol pada Erlenmeyer Berkatup Muller
Larutan pati menjadi jernih setelah 48 jam inkubasi, sehingga semua pati diasumsikan sudah berubah menjadi gula. Kadar gula pada awal inkubasi sebesar 4,95% (b/v) (Gambar 3). Kadar gula pada 72 jam inkubasi terus menurun menjadi 4,47% (b/v) dan mendekati kadar minimal pada 144 jam inkubasi sebesar 0,82% (b/v) dan tidak terdeteksi lagi pada 192 jam inkubasi.
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
0 24 48 72 96 120 144 168 192
Waktu (jam) P ro d u k si E ta n o l (m L )) 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 T o ta l g u la % (b /v )
Gambar 3 Produksi etanol dan kadar gula selama fermentasi pati dengan erlenmeyer berkatup Muller; (о) produksi etanol (ml) dan (●) total gula % (b/v).
Melalui perhitungan kehilangan CO2,
dengan jumlah produksi etanol sebesar 4,13 mL.
Produksi Alkohol Menggunakan Media Singkong
Sebelum proses fermentasi, tingkat likuifikasi bubur singkong yang disterilisasi lebih rendah dibandingkan bubur singkong yang dipasteurisasi. Likuifikasi bertambah terus selama masa sakarifikasi. Kadar gula pada awal sakarifikasi sebesar 20,39% (b/v). Jika pati diubah seluruhnya menjadi gula maka kadar gula pada bubur singkong sekitar 27,4% (b/b). Efisiensi sakarifikasi pada penelitian ini sebesar 74,3% (b/b). Selama masa fermentasi kadar gula menurun terus sekitar 1,21%–6,3% (b/v) setiap 24 jam.
Alkohol yang terbentuk pada media singkong yang disterilisasi sebanyak 29 mL dan untuk media singkong yang dipasteurisasi sebanyak 31 mL pada 5 hari inkubasi. Volume alkohol pada akhir fermentasi mencapai 7,25% (v/v) untuk bubur yang disterilisasi dan 7,75% (v/v) untuk bubur yang dipasteurisasi. Efisiensi produksinya sekitar 52,11% (v/v) dan efisiensi fermentasinya sekitar 70,2% (v/v) untuk bubur yang disterilisasi. Bubur yang dipasteurisasi menunjukkan efisiensi produksi sekitar 55,71% (v/v) dan efisiensi fermentasi sekitar 75,1% (v/v) dari perhitungan produksi alkohol teoritis sebesar 43,9 mL. Kadar alkohol yang dihasilkan dari bubur singkong yang dipasteurisasi sebesar 93,5% juga lebih tinggi daripada kadar alkohol dari bubur singkong yang disterilisasi sebesar 90,5%.
PEMBAHASAN
Zona bening yang terbentuk di sekitar koloni kapang pada media agar-agar ADK yang mengandung pati setelah disiram larutan Lugol menunjukkan bahwa kapang tersebut mampu menghasilkan amilase ekstraseluler. Isolat-isolat kapang yang diuji memiliki IA yang bervariasi karena setiap kapang memiliki kemampuan berbeda-beda dalam menguraikan pati menjadi gula sederhana. Hasil penelitian ini menunjukkan bahwa isolat A. niger (IPBCC 88.145) memiliki IA yang relatif lebih tinggi dibandingkan dengan IA A. sydowii K-10 (Damayanti 2000). Menurut Madi et al. (1987) dan Oliveira et al. (2007), kemampuan produksi amilase bergantung pada sumber karbon yang dipergunakan.
Sebagai contoh, produksi α-amilase dari
Clostridium sp.lebih baik pada maltotriosa sebagai sumber karbon dibandingkan gula lainnya (Madi et al. 1987), sedangkan amilase dari rhizobia diproduksi maksimal pada maltosa dan pati jagung sebagai sumber karbon (Oliveira et al. 2007). Maltosa merupakan senyawa penginduksi bagi amilase (Busch et al. 1997; Oliveira et al. 2007).
Pertumbuhan A. niger (IPBCC 88.145) terbagi dalam beberapa tahap, yaitu fase lag, fase log, fase stasioner, dan fase kematian. Fase lag A. niger (IPBCC 88.145) dapat dilihat pada jam ke-0, isolat ini mulai beradaptasi dengan nutrisi dan lingkungan yang tersedia. Isolat tersebut sudah menggunakan nutrisi dalam media fermentasinya pada fase log sehingga pertumbuhan bobot kering massa sel mulai meningkat dengan cepat, dapat dilihat dari jam ke-24 dan mencapai maksimum yaitu jam ke-72, setelah itu kapang relatif tidak tumbuh lagi atau memasuki fase stasioner. Pola pertumbuhan ini mengikuti pola pertumbuhan kapang pada medium cair pada umumnya.
Aktivitas glukoamilase baru terdeteksi pada jam ke-72 inkubasi dan mencapai maksimum pada jam ke-96 inkubasi sebesar 1,95 Unit/mL. Aktivitas glukoamilase A. niger (IPBCC 88.145) tertinggi terjadi ketika pertumbuhan kapang berada dalam fase stasioner. Aktivitas enzim ini lebih rendah dibandingkan aktivitas ekstrak kasar glukoamilase komersial yang dipergunakan dalam produksi bioetanol di Cicurug, Sukabumi yaitu 2,2 Unit/mL (data tidak dipublikasikan). Aktivitas enzim dipengaruhi oleh sumber karbonnya. Menurut Madi et al. (1987), aktivitas amilase Clostridium sp. yang ditumbuhkan pada pati meningkat pada fase stasioner, sedangkan jika menggunakan sumber karbon berupa pullulan, aktivitas amilase diproduksi selama pertumbuhan eksponensial.
dengan perbandingan 1:1, pada rasio tersebut sudah membentuk suspensi yang cukup baik. Tingkat likuifikasi yang optimum untuk produksi etanol bergantung pada jenis kapang yang digunakan. Menurut Fujio et al. (1984), kadar singkong optimum untuk fermentasi singkong oleh Rhizopus
spp. sebesar 40% tanpa pemanasan. Menurut Han & Steinberg (1986), A. niger dapat ditumbuhkan pada jagung (whole corn) untuk produksi etanol. Bubur singkong setelah dipanaskan tingkat likuifikasinya berubah. Tingkat likuifikasi bubur singkong yang dipasteurisasi lebih tinggi daripada bubur singkong yang disterilisasi. Menurut Balagopalan et al. (1988) pati singkong akan mengalami proses gelatinisasi pada suhu 58,5-70,0 0C. Tingkat likuifikasi menurun selama proses fermentasi seperti dikemukakan oleh Fujio et al. (1984).
Larutan pati dalam Erlenmeyer berkatup
Muller berubah menjadi lebih jernih setelah 48 jam inkubasi. Kadar gula awal inkubasi pada suspensi pati sebesar 4,95% (b/v) sedangkan pada bubur singkong, kadar gula awal inkubasi sebesar 20,39% (b/v) atau sekitar 40,78 g gula. Hal ini menunjukkan bahwa proses sakarifikasi terjadi akibat aktivitas A. niger (IPBCC 88.145) selama 24-48 jam inkubasi. Aktivitas glukoamilase baru terdeteksi pada 72 jam inkubasi, sedangkan pada awal inkubasi telah terjadi perombakan pati menjadi gula. Hal ini dapat terjadi melalui bantuan enzim-enzim amilase lainnya karena pada penelitian sebelumnya mengindikasikan adanya aktivitas amilase selain glukoamilase.
Glukoamilase dapat mengubah seluruh pati menjadi glukosa. Menurut Balagopalan
et al. (1988) glukoamilase berbeda dengan enzim amilase lainnya yang hanya mampu mengubah 85% (b/v) pati menjadi glukosa. Glukoamilase tidak toleran terhadap suhu lebih dari 55 0C dan A. niger (IPBCC 88.145) yang digunakan termasuk kapang mesofil, oleh sebab itu inokulan ditambahkan setelah larutan pati atau bubur singkong agak dingin. Kadar gula pada 72 jam inkubasi dalam Erlenmeyer berkatup
Muller menurun sebesar 0,49% (b/v). Gula hasil hidrolisis pati selama 72 jam inkubasi digunakan oleh kapang untuk produksi biomassa. Fermentasi baru terjadi setelah 72 jam inkubasi.
Konsentrasi gula, optimum pada proses fermentasi etanol berkisar 12%-18% (Balagopalan 1988). Kadar gula pada pati tapioka tidak pernah mencapai konsentrasi
optimum pembentukan etanol. Kadar glukosa awal 4,95% (b/v), setelah 72 jam inkubasi kadar gula terus menurun dan mendekati kadar minimal pada 144 jam inkubasi sebesar 0,82% (b/v), dan tidak terdeteksi lagi pada 192 jam inkubasi. Oleh sebab itu proses fermentasi berjalan lambat dan proses fermentasi baru terdeteksi pada jam ke-96 inkubasi ketika etanol sudah diproduksi sekitar 0,47 mL. Awal inkubasi, produksi etanol pada katup Muller sangat rendah karena diduga kondisi dalam Erlenmeyer cenderung aerobik daripada anaerobik. Gula awalnya dipergunakan oleh kapang untuk proses asimilasi sehingga ketika produksi etanol melampaui 0,47 mL, kondisi berubah menjadi anaerobik. Kondisi ini mendorong laju pembentukan etanol menjadi lebih cepat. Produksi etanol meningkat terus sampai 192 jam inkubasi dengan jumlah produksi etanol sebesar 4,13 mL. Hasil ini lebih besar dari perhitungan teoritis (1,98 mL), sedangkan periode inkubasinya mendekati perkiraan semula bahwa periode inkubasi untuk produksi etanol sekitar 120 jam.
Produksi etanol pada media singkong mencapai 7,25%-7,75% (v/v) dari volume substrat. Produksi ini lebih tinggi dari hasil penelitian Cronk et al. (1977), tetapi lebih rendah dari hasil penelitian Fujio et al. (1984). Cronk et al. (1977) menemukan bahwa produksi etanol pada pembuatan tape ketan oleh Amylomyces rouxii pada 96 jam inkubasi mencapai 5,6% (v/v). Produksi etanol dapat meningkat dengan menggunakkan inokulan kombinasi. Kombinasi A. rouxii dan Candida lactosa
menghasilkan 7,4% (v/v) etanol sedangkan Fujio et al. (1984) melaporkan bahwa dengan Rhizopus spp. produksi alkohol dari bubur singkong mencapai 13,7% (v/v).
Produksi etanol dari bubur singkong pada penelitian ini, sekitar 7% (v/v) mungkin sudah menjadi represor aktif bagi pembentukan etanol oleh A. niger (IPBCC 88.145). Etanol menjadi represor bagi produksi etanol dengan cara mengubah permeabilitas membran dan mengganggu fungsi membran dalam transpor ion hidrogen (Dombek & Ingram 1987). Menurut Dombek & Ingram (1987) pada
SIMPULAN
Empat isolat kapang yaitu A. niger
IPBCC 88.145, T. longibrachiatum IPBCC 07.556, Penicilllium sp. IPBCC 07.537, dan
P. herquei IPBCC 07.557 memiliki aktivitas amilolitik. Aspergillus niger (IPBCC 88.145) memiliki IA tertinggi sebesar 2,7 dan menghasilkan glukoamilase. Aktivitas glukoamilase optimum (1,95 Unit/mL) terjadi pada 96 jam inkubasi. Kapang ini juga mampu mengubah pati singkong menjadi alkohol. Produksi alkohol sebesar 29 mL-31 mL dengan kadar alkoholnya 90,5%-93,5%, sedangkan efisiensi produksi alkohol berkisar antara 52,11%-55,71% (v/v) dan efisiensi fermentasinya berkisar 70,2%-75,1% (v/v) bergantung dari tingkat likuifikasi bubur singkongnya.
SARAN
Kapasitas hidrolisis pati dan fermentasi optimum oleh kapang A. niger IPBCC 88.145 perlu dikaji lebih lanjut.
DAFTAR PUSTAKA
Balagopalan C, Padmaja G, Nanda SK, Moothy SN. 1988. Cassava in Food, Feed, and Industry. Florida: CRC Pr. Benda I. 1982. Wine and brandy. Di dalam:
Reed G, editor. Prescott & Dunn’s Industrial Microbiology. Ed ke-4. New York: AVI Publishing. hlm 293-402. Breuil C, Saddler JN. 1985. Comparison of
the 3.5-dinitrosalicylic acid and Nelson Somogyi methods of assaying for reducing sugars and determining cellulose activity. Enzyme Microbiol Technol 7: 331.
Busch JE, Porter EG, Stutzenberger FJ.
1997. Induction of α-amylase by malto-oligosaccharides in Thermomonospora curvata. J Appl Microbiol 82:669-676. Chandel et al. 2007. Economics and
environmental impact of bioethanol production technologies an appraisal.
Biotechnol Molec Biol 2:14-32. Cornett CAG, Fang TY, Reilly PJ, Ford C.
2003. Starch-binding domain shuffling in Aspergillus niger glucoamylase. Prot Eng16:521-529.
Cronk TC, Steinkraus KH, Hackler LR, Mattick LR. 1977. Indonesian tape ketan fermentation. Appl Environ Microbiol 33: 1067-1073.
Damayanti E. 2000. Isolasi dan karakterisasi amilase dari kapang alkalotoleran asal limbah cair tapioka [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Dombek KM, Ingra