ABSTRAK
MAGDA MARGARETH. Isolasi dan Seleksi Bakteri Metanotrof Pemfiksasi Nitrogen dari Sawah di Sragen, Jawa Tengah. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Metan adalah salah satu gas yang menyebabkan pemanasan global. Penurunan emisi metan 20,60 kali lebih efektif dalam penurunan potensi pemanasan global dibandingkan dengan penurunan emisi karbon dioksida. Penelitian ini bertujuan untuk mengisolasi bakteri metanotrof dari lahan sawah di daerah Sragen, Jawa Tengah, dan menyeleksinya berdasarkan pada aktivitas oksidasi metan dan efektifitas fiksasi nitrogen (N2). Aplikasi bakteri metanotrof dapat mengurangi emisi metan dari sawah. Ekplorasi bakteri metanotrof dari contoh sedimen asal sawah di Sragen yang ditumbuhkan pada media (NMS) menghasilkan 52 isolat bakteri metanotrof. Sebanyak 31 isolat bakteri metanotrof diperoleh dari hasil isolasi menggunakan media NMS lengkap, dan 21 isolat bakteri metanotrof diperoleh dari hasil isolasi menggunakan media NMS bebas nitrogen. Aktivitas oksidasi metan diukur dengan menggunakan kromatografi gas, sedangkan aktivitas fiksasi nitrogen diukur berdasarkan kadar akumulasi amonium dalam kultur. Lima isolat bakteri metanotrof dengan aktivitas oksidasi metan tertinggi di media NMS lengkap adalah isolat 1AN1, 2DN1, 2AN1, 3DN1, dan 3CN1. Lima isolat bakteri metanotrof dengan oksidasi metan tertinggi di media NMS bebas nitrogen adalah isolat 2C1, 4C2, 3D1, 3C2, dan 3A1. Lima isolat bakteri metanotrof dengan fiksasi nitrogen tertinggi adalah isolat bakteri metanotrof 2C2, 1C2, 4C1, 1B1, dan 4D1.
Kata kunci: Metan, bakteri metanotrof, oksidasi metan, fiksasi nitrogen
ABSTRACT
MAGDA MARGARETH. Isolation and Selection Nitrogen Fixing Methanotrophic Bacteria from Ricefields in Sragen, Jawa Tengah. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Methane is one of green house gasses that can cause global warming. Decreasing of methane emission from ricefields will be more effective 20,60 times than that of carbon dioxide in reduces global warming potency. This research was conducted to isolate and select methanotrophic bacteria that can oxidize methane and fix nitrogen from ricefields in Sragen, Jawa Tengah. Application of methanotrophic bacteria can reduce methane emission from ricefields. Exploration of methanotrophic bacteria from sediment of ricefields in Sragen using Nitrat Medium Salts (NMS) medium resulted fifty two isolates of methanotrophic bacteria. A total of 31 methanotrophic bacterial isolates obtained from isolation using complete NMS medium and 21 methanotrophic bacterial isolates obtained from isolation using NMS medium without nitrogen. Methane oxidation activity of the isolates was determined using a gas chromatograph, while determination of nitrogen fixation activity was performed by measuring ammonium accumulation. Five methanotrophic bacterial isolates having the highest methane oxidation activity in complete NMS medium were 1AN1, 2DN1, 2AN1, 3DN1, and 3CN1 isolates. Five methanotrophic bacterial isolates having the highest methane oxidation activity in NMS medium without nitrogen were 2C1, 4C2, 3D1, 3C2, and 3A1 isolates. Five methanotrophic bacterial isolates having the highest nitrogen fixation activity were 2C2, 1C2, 4C1, 1B1, and 4D1 isolates.
PENDAHULUAN
Latar Belakang
Pemanasan global ( ) pada dasarnya merupakan fenomena peningkatan temperatur global dari tahun ke tahun karena meningkatnya emisi gas rumah kaca di atmosfir. Selama 100 tahun terakhir ini, konsentrasi gas rumah kaca CO2, CH4, dan N2O di atmosfir terus meningkat sebagai hasil dari aktivitas manusia (Griffin 2003). Konsentrasi metan di atmosfer pada tahun 1990 adalah 1.72 ppm dengan laju peningkatan 1% per tahun, sedangkan untuk karbondioksida masing,masing 354 ppm dan 0.5% per tahun (Lelieveld 1993). Data Pada tahun 1992 metan (CH4) menempati urutan ketiga dalam hal pemanasan global setelah CO2 dan CFC (IPCC 1992).
Laju peningkatan konsentrasi metan di atmosfer dua kali lipat lebih tinggi dibandingkan dengan CO2. Penyerapan metan terhadap sinar infra merah dengan panjang gelombang 4,100 nm lebih besar daripada CO2 (Lelieveld 1993; Hanson & Hanson 1996). Pengurangan emisi metan akan 20,60 kali lebih efektif dalam menurunkan potensi pemanasan atmosfer bumi daripada pengurangan emisi CO2 (Hogan . 1991). Selain itu, metan juga menyebabkan pengikisan dan melubangi lapisan ozon di stratosfer (Wild 1995).
Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah dan sawah (Wild 1995). Dari jumlah tersebut, diperkirakan masing,masing 20% berasal dari sawah dan rawa (Bouwman & Sombroek 1990). Metan yang diproduksi pada bagian anaerob sebagian akan mengalami oksidasi di bagian permukaan sedimen sawah. Proses oksidasi metan tersebut dilakukan oleh kelompok bakteri metanotrof pada kondisi aerobik. Oksidasi metan oleh bakteri metanotrof di lahan sawah mencapai 80% dari metan yang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Bakteri metanotrof memanfaatkan metan sebagai donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya.
Aplikasi bakteri metanotrof sebagai agen pengoksidasi metan dapat menjadi salah satu solusi untuk mengurangi emisi metan dari sawah. Oleh karena itu perlu dilakukan eksplorasi dan seleksi isolat,isolat bakteri metanotrof yang potensial untuk diaplikasikan di sawah.
Tujuan
Penelitian ini bertujuan untuk mengisolasi bakteri metanotrof dari lahan sawah di daerah Sragen, Jawa Tengah, dan menyeleksinya berdasarkan pada aktivitas oksidasi metan dan efektifitas fiksasi nitrogen (N2).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Oktober 2010 sampai dengan Mei 2011 di lahan sawah di wilayah Sragen, Jawa Tengah, Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah, Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan adalah media komposisi lengkap (MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L; KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4 4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L; FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L; CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L; MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0 mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0 mg/L), media NMS bebas nitrogen, Bacto agar 20 g/L, larutan NH4Cl 100 ppm, Milli,Q water, larutan fenol alkohol (C6H5OH) 10%, larutan Natrium Dihidro Nitroprusid 0,5%, dan larutan oksidan yang terdiri atas Natrium Sitrat 20% dan Natrium Hipoklorit 5,25%.
Metode
Pengambilan contoh tanah sedimen. Sampel sedimen diperoleh dari sawah di wilayah Sragen, Jawa Tengah. Pengambilan sampel dilakukan dengan menancapkan 10 ml yang telah dipotong ujungnya di atas sedimen sawah yang tergenang. Setelah terisi dengan sedimen (kedalaman ± 3 cm), segera ditutup dengan sumbat karet dan dimasukkan kedalam plastik untuk dibawa ke laboratorium.
Isolasi, Pemurnian, dan
PENDAHULUAN
Latar Belakang
Pemanasan global ( ) pada dasarnya merupakan fenomena peningkatan temperatur global dari tahun ke tahun karena meningkatnya emisi gas rumah kaca di atmosfir. Selama 100 tahun terakhir ini, konsentrasi gas rumah kaca CO2, CH4, dan N2O di atmosfir terus meningkat sebagai hasil dari aktivitas manusia (Griffin 2003). Konsentrasi metan di atmosfer pada tahun 1990 adalah 1.72 ppm dengan laju peningkatan 1% per tahun, sedangkan untuk karbondioksida masing,masing 354 ppm dan 0.5% per tahun (Lelieveld 1993). Data Pada tahun 1992 metan (CH4) menempati urutan ketiga dalam hal pemanasan global setelah CO2 dan CFC (IPCC 1992).
Laju peningkatan konsentrasi metan di atmosfer dua kali lipat lebih tinggi dibandingkan dengan CO2. Penyerapan metan terhadap sinar infra merah dengan panjang gelombang 4,100 nm lebih besar daripada CO2 (Lelieveld 1993; Hanson & Hanson 1996). Pengurangan emisi metan akan 20,60 kali lebih efektif dalam menurunkan potensi pemanasan atmosfer bumi daripada pengurangan emisi CO2 (Hogan . 1991). Selain itu, metan juga menyebabkan pengikisan dan melubangi lapisan ozon di stratosfer (Wild 1995).
Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah dan sawah (Wild 1995). Dari jumlah tersebut, diperkirakan masing,masing 20% berasal dari sawah dan rawa (Bouwman & Sombroek 1990). Metan yang diproduksi pada bagian anaerob sebagian akan mengalami oksidasi di bagian permukaan sedimen sawah. Proses oksidasi metan tersebut dilakukan oleh kelompok bakteri metanotrof pada kondisi aerobik. Oksidasi metan oleh bakteri metanotrof di lahan sawah mencapai 80% dari metan yang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Bakteri metanotrof memanfaatkan metan sebagai donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya.
Aplikasi bakteri metanotrof sebagai agen pengoksidasi metan dapat menjadi salah satu solusi untuk mengurangi emisi metan dari sawah. Oleh karena itu perlu dilakukan eksplorasi dan seleksi isolat,isolat bakteri metanotrof yang potensial untuk diaplikasikan di sawah.
Tujuan
Penelitian ini bertujuan untuk mengisolasi bakteri metanotrof dari lahan sawah di daerah Sragen, Jawa Tengah, dan menyeleksinya berdasarkan pada aktivitas oksidasi metan dan efektifitas fiksasi nitrogen (N2).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Oktober 2010 sampai dengan Mei 2011 di lahan sawah di wilayah Sragen, Jawa Tengah, Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah, Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan adalah media komposisi lengkap (MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L; KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4 4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L; FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L; CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L; MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0 mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0 mg/L), media NMS bebas nitrogen, Bacto agar 20 g/L, larutan NH4Cl 100 ppm, Milli,Q water, larutan fenol alkohol (C6H5OH) 10%, larutan Natrium Dihidro Nitroprusid 0,5%, dan larutan oksidan yang terdiri atas Natrium Sitrat 20% dan Natrium Hipoklorit 5,25%.
Metode
Pengambilan contoh tanah sedimen. Sampel sedimen diperoleh dari sawah di wilayah Sragen, Jawa Tengah. Pengambilan sampel dilakukan dengan menancapkan 10 ml yang telah dipotong ujungnya di atas sedimen sawah yang tergenang. Setelah terisi dengan sedimen (kedalaman ± 3 cm), segera ditutup dengan sumbat karet dan dimasukkan kedalam plastik untuk dibawa ke laboratorium.
Isolasi, Pemurnian, dan
NMS dengan komposisi lengkap dan media NMS bebas nitrogen. Sebanyak 1 gr contoh sedimen diinokulasikan ke dalam 50 ml medium NMS dalam botol serum 125 ml lalu ditutup sumbat karet. Komposisi gas pada bagian dibuat dengan perbandingan 1:1 untuk udara dan metan. Inkubasi dilakukan di atas (100 rpm) pada suhu ruang pada kondisi gelap selama14 hari. Selanjutnya bakteri,bakteri metanotrof tersebut diberikan kode,kode tertentu. Karakter pertama dan kedua dari kode tersebut menunjukkan titik pengambilan sampel tanah sawah. Karakter terakhir merupakan identitas masing,masing bakteri tersebut. Sedangkan kode N yang berada di tengah,tengah dari beberapa bakteri metanotrof menunjukkan tanda untuk bakteri yang menggunakan media NMS dengan komposisi lengkap. Bila tidak terdapat kode N, berarti bakteri tersebut menggunakan media NMS bebas nitrogen.
Uji Aktivitas Oksidasi Metan. Aktivitas oksidasi CH4 isolat diuji dengan mengukur konsentrasi gas metan tersisa pada bagian menggunakan teknik kromatografi gas seperti yang dipaparkan dalam Kumaraswamy 2001. Sebanyak 1 ml isolat cair bakteri metanotrof diinokulasikan ke 9 ml medium NMS dalam tabung bervolume 17 ml lalu ditutup sumbat karet. Gas di bagian dibuat komposisinya mendekati 50% metan dan 50% udara. Sebagai kontrol, digunakan tabung berisi 10 ml media NMS dengan komposisi yang sama. Inkubasi dilakukan selama 14 hari di atas pada suhu ruang (27,30°C) dalam kondisi gelap. Pengukuran konsentrasi metan tersisa
dilakukan pada akhir masa inkubasi. Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah.
Pengukuran Rapat Optis Kultur.
Pada akhir masa inkubasi, masing,masing kultur diukur rapat optisnya menggunakan spektrofotometer (Spektronic Genesys 20). Pengukuran dilakukan pada panjang gelombang 620nm.
Uji Fiksasi N2. Kemampuan fiksasi
nitrogen bakteri metanotrof diukur berdasarkan kadar amonium yang diakumulasikan dalam kultur. Kadar amonium ditentukan dengan metode spektrofotometri. Sebanyak 5 ml sampel yang telah disaring berturut,turut ditambah dengan 0.2 ml fenol alkohol 10%, 0.2 ml nitroprusid 0.5%, dan 0.5 ml campuran Na, sitrat : NA,hipoklorit (1:4), kemudian didiamkan selama 1 jam. Warna biru yang terbentuk sebagai hasil reaksi dibaca serapannya pada panjang gelombang 640 nm (Greenberg ., 1992). Sebagai standar pada penentuan kadar amonium digunakan serial larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50, dan 100 µM yang diberi pereaksi yang sama. Kurva standar amonium dapat dilihat pada Lampiran 1.
HASIL
Isolat Bakteri Metanotrof yang Diperoleh
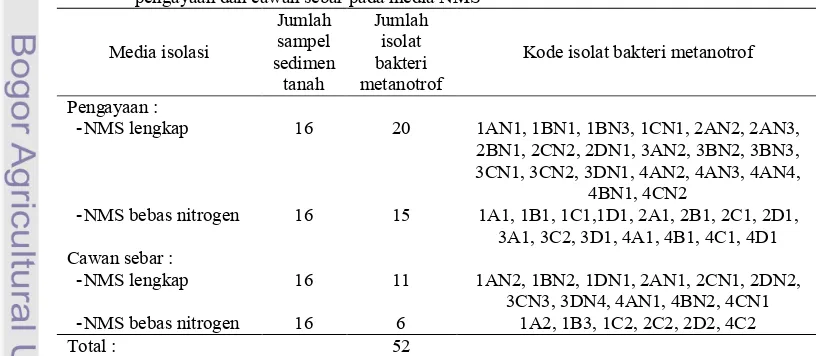
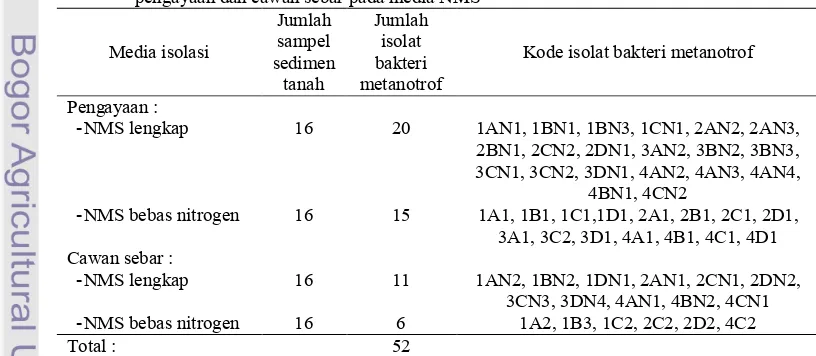
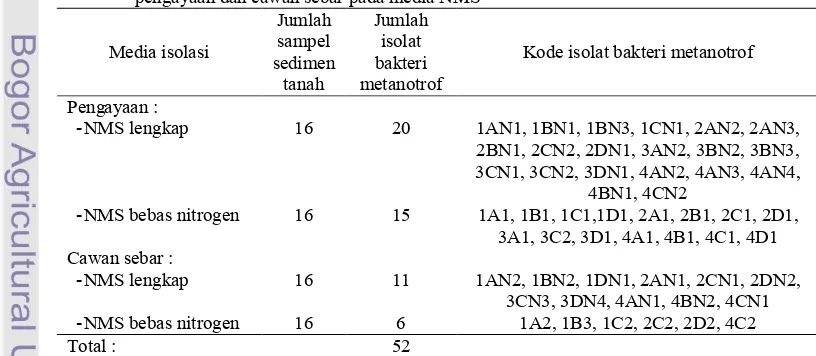
Dari 16 sampel sedimen sawah yang diisolasi dengan metode pengayaan dan isolasi langsung dengan cawan sebar diperoleh 52 isolat bakteri metanotrof (Tabel 1).
Tabel 1 Hasil isolasi bakeri metanotrof dari sedimen sawah di daerah Sragen dengan metode pengayaan dan cawan sebar pada media NMS
Media isolasi Jumlah sampel sedimen tanah Jumlah isolat bakteri metanotrof
Kode isolat bakteri metanotrof
Pengayaan :
, NMS lengkap 16 20 1AN1, 1BN1, 1BN3, 1CN1, 2AN2, 2AN3, 2BN1, 2CN2, 2DN1, 3AN2, 3BN2, 3BN3, 3CN1, 3CN2, 3DN1, 4AN2, 4AN3, 4AN4,
4BN1, 4CN2
, NMS bebas nitrogen 16 15 1A1, 1B1, 1C1,1D1, 2A1, 2B1, 2C1, 2D1, 3A1, 3C2, 3D1, 4A1, 4B1, 4C1, 4D1 Cawan sebar :
, NMS lengkap 16 11 1AN2, 1BN2, 1DN1, 2AN1, 2CN1, 2DN2, 3CN3, 3DN4, 4AN1, 4BN2, 4CN1 , NMS bebas nitrogen 16 6 1A2, 1B3, 1C2, 2C2, 2D2, 4C2
2
NMS dengan komposisi lengkap dan media NMS bebas nitrogen. Sebanyak 1 gr contoh sedimen diinokulasikan ke dalam 50 ml medium NMS dalam botol serum 125 ml lalu ditutup sumbat karet. Komposisi gas pada bagian dibuat dengan perbandingan 1:1 untuk udara dan metan. Inkubasi dilakukan di atas (100 rpm) pada suhu ruang pada kondisi gelap selama14 hari. Selanjutnya bakteri,bakteri metanotrof tersebut diberikan kode,kode tertentu. Karakter pertama dan kedua dari kode tersebut menunjukkan titik pengambilan sampel tanah sawah. Karakter terakhir merupakan identitas masing,masing bakteri tersebut. Sedangkan kode N yang berada di tengah,tengah dari beberapa bakteri metanotrof menunjukkan tanda untuk bakteri yang menggunakan media NMS dengan komposisi lengkap. Bila tidak terdapat kode N, berarti bakteri tersebut menggunakan media NMS bebas nitrogen.
Uji Aktivitas Oksidasi Metan. Aktivitas oksidasi CH4 isolat diuji dengan mengukur konsentrasi gas metan tersisa pada bagian menggunakan teknik kromatografi gas seperti yang dipaparkan dalam Kumaraswamy 2001. Sebanyak 1 ml isolat cair bakteri metanotrof diinokulasikan ke 9 ml medium NMS dalam tabung bervolume 17 ml lalu ditutup sumbat karet. Gas di bagian dibuat komposisinya mendekati 50% metan dan 50% udara. Sebagai kontrol, digunakan tabung berisi 10 ml media NMS dengan komposisi yang sama. Inkubasi dilakukan selama 14 hari di atas pada suhu ruang (27,30°C) dalam kondisi gelap. Pengukuran konsentrasi metan tersisa
dilakukan pada akhir masa inkubasi. Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah.
Pengukuran Rapat Optis Kultur.
Pada akhir masa inkubasi, masing,masing kultur diukur rapat optisnya menggunakan spektrofotometer (Spektronic Genesys 20). Pengukuran dilakukan pada panjang gelombang 620nm.
Uji Fiksasi N2. Kemampuan fiksasi
nitrogen bakteri metanotrof diukur berdasarkan kadar amonium yang diakumulasikan dalam kultur. Kadar amonium ditentukan dengan metode spektrofotometri. Sebanyak 5 ml sampel yang telah disaring berturut,turut ditambah dengan 0.2 ml fenol alkohol 10%, 0.2 ml nitroprusid 0.5%, dan 0.5 ml campuran Na, sitrat : NA,hipoklorit (1:4), kemudian didiamkan selama 1 jam. Warna biru yang terbentuk sebagai hasil reaksi dibaca serapannya pada panjang gelombang 640 nm (Greenberg ., 1992). Sebagai standar pada penentuan kadar amonium digunakan serial larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50, dan 100 µM yang diberi pereaksi yang sama. Kurva standar amonium dapat dilihat pada Lampiran 1.
HASIL
Isolat Bakteri Metanotrof yang Diperoleh
Dari 16 sampel sedimen sawah yang diisolasi dengan metode pengayaan dan isolasi langsung dengan cawan sebar diperoleh 52 isolat bakteri metanotrof (Tabel 1).
Tabel 1 Hasil isolasi bakeri metanotrof dari sedimen sawah di daerah Sragen dengan metode pengayaan dan cawan sebar pada media NMS
Media isolasi Jumlah sampel sedimen tanah Jumlah isolat bakteri metanotrof
Kode isolat bakteri metanotrof
Pengayaan :
, NMS lengkap 16 20 1AN1, 1BN1, 1BN3, 1CN1, 2AN2, 2AN3, 2BN1, 2CN2, 2DN1, 3AN2, 3BN2, 3BN3, 3CN1, 3CN2, 3DN1, 4AN2, 4AN3, 4AN4,
4BN1, 4CN2
, NMS bebas nitrogen 16 15 1A1, 1B1, 1C1,1D1, 2A1, 2B1, 2C1, 2D1, 3A1, 3C2, 3D1, 4A1, 4B1, 4C1, 4D1 Cawan sebar :
, NMS lengkap 16 11 1AN2, 1BN2, 1DN1, 2AN1, 2CN1, 2DN2, 3CN3, 3DN4, 4AN1, 4BN2, 4CN1 , NMS bebas nitrogen 16 6 1A2, 1B3, 1C2, 2C2, 2D2, 4C2
Keterangan : , tidak terdeteksi
Sebanyak 31 isolat bakteri metanotrof diperoleh dari isolasi yang dilakukan menggunakan media NMS lengkap dan 21 isolat bakteri metanotrof dari isolasi menggunakan media NMS bebas Nitrogen.
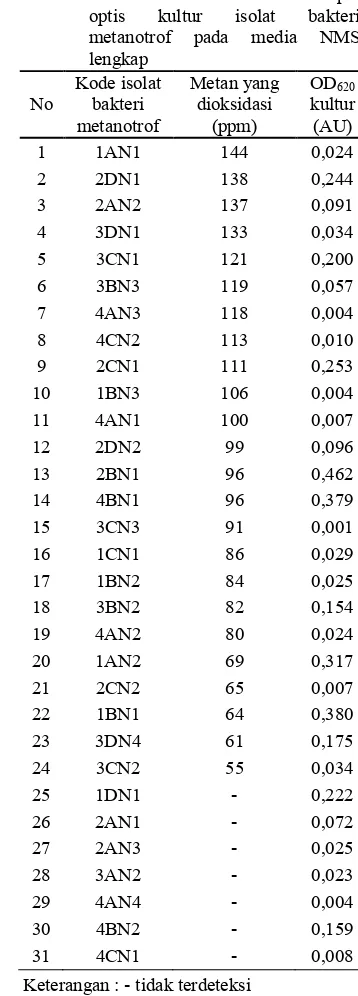
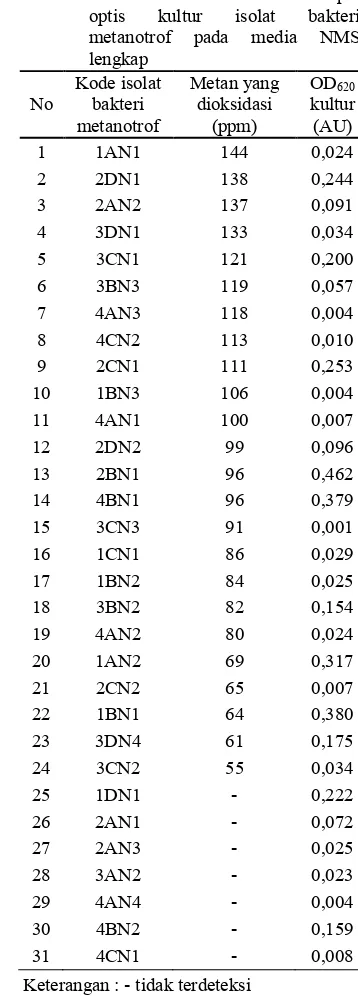
Tabel 2 Aktivitas oksidasi metan dan rapat optis kultur isolat bakteri metanotrof pada media NMS lengkap No Kode isolat bakteri metanotrof Metan yang dioksidasi (ppm) OD620 kultur (AU)
1 1AN1 144 0,024
2 2DN1 138 0,244
3 2AN2 137 0,091
4 3DN1 133 0,034
5 3CN1 121 0,200
6 3BN3 119 0,057
7 4AN3 118 0,004
8 4CN2 113 0,010
9 2CN1 111 0,253
10 1BN3 106 0,004
11 4AN1 100 0,007
12 2DN2 99 0,096
13 2BN1 96 0,462
14 4BN1 96 0,379
15 3CN3 91 0,001
16 1CN1 86 0,029
17 1BN2 84 0,025
18 3BN2 82 0,154
19 4AN2 80 0,024
20 1AN2 69 0,317
21 2CN2 65 0,007
22 1BN1 64 0,380
23 3DN4 61 0,175
24 3CN2 55 0,034
25 1DN1 , 0,222
26 2AN1 , 0,072
27 2AN3 , 0,025
28 3AN2 , 0,023
29 4AN4 , 0,004
30 4BN2 , 0,159
31 4CN1 , 0,008
Aktivitas Oksidasi Metan dan Fiksasi N2
isolat metanotrof
Dari 31 isolat bakteri metanotrof yang didapatkan dari media NMS lengkap,
didapatkan 24 isolat bakteri metanotrof yang dapat dideteksi aktivitas oksidasi metannya. Di antara 24 isolat bakteri metanotrof tersebut terdapat 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi, antara lain isolat 1AN1, 2DN1, 2AN2, 3DN1 dan 3CN1 (Tabel 2).
Kemampuan masing,masing kultur dalam mengfiksasi Nitrogen bervariasi yang ditunjukkan oleh konsentrasi amonium yang terakumulasi dalam media pertumbuhannya. Akumulasi amonium tertinggi terdapat pada kultur isolat 2C2 sebesar 0,223 µM (Tabel 3). Masing,masing kultur isolat juga menunjukkan aktivitas oksidasi metan yang berbeda. Isolat 2C1 menghasilkan aktivitas oksidasi CH4 tertinggi yaitu sebesar 202 ppm (Tabel 3).
Tabel 3 Kadar amonium terakumulasi, aktivitas oksidasi metan dan rapat optis kultur isolat bakteri metanotrof pada media NMS bebas Nitrogen No Kode isolat bakteri metanotrof Akumulasi amonium (µM) Metan yang dioksidasi (ppm) OD620 kultur (AU)
1 2C2 0.223 99 0,220
2 1C2 0.209 105 0,009
3 4C1 0.195 113 0,278
4 1B1 0.191 107 0,213
5 4D1 0.184 115 0,445
6 2D2 0.180 99 0,340
7 1A2 0.173 121 0,018
8 4B1 0.173 32 0,248
9 1B3 0.169 94 0,081
10 3D1 0.097 176 0,013
11 3A1 0.083 131 0,350
12 3C2 0.076 148 0,058
13 1C1 0.068 103 0,010
14 2C1 0.065 202 0,115
15 4A1 0.065 , 0,003
16 4C2 0.061 179 0,326
17 2B1 0.047 127 0,195
18 2D1 0.047 119 0,066
19 1D1 0.032 96 0,074
20 2A1 0.029 98 0,001
21 1A1 0.025 104 0,111
4
PEMBAHASAN
Pada penelitian ini sebanyak lima puluh dua isolat bakteri pengoksidasi metan telah berhasil diisolasi dari bagian atas sedimen sawah asal Sragen. Bakteri metanogen yang hidup pada bagian bawah sedimen tanah mengubah karbon dioksida (CO2), metil (seperti CH3OH), dan asetat (CH3COO,) menjadi metan melalui proses yang disebut metanogenesis. Metan yang dihasilkan berdifusi ke bagian atas sedimen yang aerob dan menciptakan kondisi yang sangat cocok bagi pertumbuhan bakteri metanotrof (Frenzel 1992).
Oksidasi metan merupakan tahap awal penggunaan metan sebagai sumber karbon dan energi untuk pertumbuhan bakteri metanotrof. Semakin tinggi aktivitas oksidasi metan maka semakin rendah kadar gas metan tersisa pada bagian
kultur. Isolat bakteri metanotrof 1AN1, 2DN1, 2AN2, 3DN1 dan 3CN1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS lengkap berturut,turut dengan nilai aktivitas oksidasi metan 144, 138, 137, 133 dan 121 ppm (Tabel 2). Sedangkan isolat bakteri metanotrof 2C1, 4C2, 3D1, 3C2 dan 3A1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS bebas nitrogen berturut,turut dengan nilai aktivitas oksidasi metan 202, 179, 176, 148 dan 131 ppm (Tabel 3).
Selain sumber karbon, bakteri juga memerlukan sumber nitrogen untuk pertumbuhannya. Sebagian bakteri metanotrof diketahui memiliki gen dan mampu melakukan fiksasi nitrogen (Toukdarian & Lindstrom 1984). Kemampuan fiksasi nitrogen tersebut bisa diukur diantaranya dengan mengukur kadar amonium yang terakumulasi dalam kulturnya. Kadar amonium yang tinggi dalam kultur mengindikasikan tingginya kemampuan bakteri dalam menambat nitrogen. Isolat bakteri metanotrof 2C2, 1C2, 4C1, 1B1 dan 4D1 adalah lima isolat bakteri metanotrof yang memiliki kadar amonium dalam kultur tertinggi berturut, turut dengan kadar amonium terakumulasi 0,223, 0,209, 0,195, 0,191 dan 0,184 µM (Tabel 3).
Pengamatan yang dilakukan terhadap kerapatan optis ( /OD) kultur cair isolat metanotrof menunjukkan nilai yang relatif kecil. Kecilnya nilai OD tersebut
mengindikasikan pertumbuhan sel yang sangat lambat. Bakteri metanotrof merupakan bakteri yang tumbuh lambat (Begonja & Hrsak 1998), bahkan pada media agar NMS koloni bakteri ini baru tumbuh optimal pada umur 14 hari inkubasi.
Isolat,isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan yang tinggi potensial untuk dikembangkan sebagai agen pereduksi emisi metan di lahan sawah. Sedangkan, isolat,isolat bakteri metanotrof yang memiliki kemampuan fiksasi nitrogen yang tinggi potensial untuk dikembangkan sebagai agen pupuk hayati pada lahan sawah. Kombinasi kedua jenis bakteri metanotrof tersebut dapat dikembangkan sebagai agen pereduksi emisi metan sekaligus pupuk hayati untuk lahan sawah.
SIMPULAN
Sebanyak 52 isolat bakteri metanotrof berhasil diisolasi dari contoh sedimen sawah asal Sragen. Dari 52 isolat bakteri metanotrof tersebut, sebanyak 44 isolat bakteri metanotrof (24 isolat bakteri metanotrof berasal dari media NMS lengkap dan 20 isolat bakteri metanotrof berasal dari media NMS bebas nitrogen) menunjukkan aktivitas oksidasi metan dan 21 isolat bakteri metanotrof menunjukkan aktivitas fiksasi nitrogen.
DAFTAR PUSTAKA
Begonja A, Hrsak D. 1998. Growth characteristics and metabolic activities of the methanotrophic,heterotrophic groundwater community.
85: 448,456.
Bouwman AF, Sombroek WG. 1990. Inputs to climate change by soil and agriculture related activities. Di dalam: Scharpenseel HW, Scomacker M, Ayoup A. (eds)
. . Amsterdam: hlm. 15,30. Conrad R, Rothfus F. 1991. Methane
oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. ! " 12:28,32. Frenzel P, Rothfus BF, Conrad R. 1992.
Oxygen profiles and methane tumover in flooded rice microcosm. ! "
PEMBAHASAN
Pada penelitian ini sebanyak lima puluh dua isolat bakteri pengoksidasi metan telah berhasil diisolasi dari bagian atas sedimen sawah asal Sragen. Bakteri metanogen yang hidup pada bagian bawah sedimen tanah mengubah karbon dioksida (CO2), metil (seperti CH3OH), dan asetat (CH3COO,) menjadi metan melalui proses yang disebut metanogenesis. Metan yang dihasilkan berdifusi ke bagian atas sedimen yang aerob dan menciptakan kondisi yang sangat cocok bagi pertumbuhan bakteri metanotrof (Frenzel 1992).
Oksidasi metan merupakan tahap awal penggunaan metan sebagai sumber karbon dan energi untuk pertumbuhan bakteri metanotrof. Semakin tinggi aktivitas oksidasi metan maka semakin rendah kadar gas metan tersisa pada bagian
kultur. Isolat bakteri metanotrof 1AN1, 2DN1, 2AN2, 3DN1 dan 3CN1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS lengkap berturut,turut dengan nilai aktivitas oksidasi metan 144, 138, 137, 133 dan 121 ppm (Tabel 2). Sedangkan isolat bakteri metanotrof 2C1, 4C2, 3D1, 3C2 dan 3A1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS bebas nitrogen berturut,turut dengan nilai aktivitas oksidasi metan 202, 179, 176, 148 dan 131 ppm (Tabel 3).
Selain sumber karbon, bakteri juga memerlukan sumber nitrogen untuk pertumbuhannya. Sebagian bakteri metanotrof diketahui memiliki gen dan mampu melakukan fiksasi nitrogen (Toukdarian & Lindstrom 1984). Kemampuan fiksasi nitrogen tersebut bisa diukur diantaranya dengan mengukur kadar amonium yang terakumulasi dalam kulturnya. Kadar amonium yang tinggi dalam kultur mengindikasikan tingginya kemampuan bakteri dalam menambat nitrogen. Isolat bakteri metanotrof 2C2, 1C2, 4C1, 1B1 dan 4D1 adalah lima isolat bakteri metanotrof yang memiliki kadar amonium dalam kultur tertinggi berturut, turut dengan kadar amonium terakumulasi 0,223, 0,209, 0,195, 0,191 dan 0,184 µM (Tabel 3).
Pengamatan yang dilakukan terhadap kerapatan optis ( /OD) kultur cair isolat metanotrof menunjukkan nilai yang relatif kecil. Kecilnya nilai OD tersebut
mengindikasikan pertumbuhan sel yang sangat lambat. Bakteri metanotrof merupakan bakteri yang tumbuh lambat (Begonja & Hrsak 1998), bahkan pada media agar NMS koloni bakteri ini baru tumbuh optimal pada umur 14 hari inkubasi.
Isolat,isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan yang tinggi potensial untuk dikembangkan sebagai agen pereduksi emisi metan di lahan sawah. Sedangkan, isolat,isolat bakteri metanotrof yang memiliki kemampuan fiksasi nitrogen yang tinggi potensial untuk dikembangkan sebagai agen pupuk hayati pada lahan sawah. Kombinasi kedua jenis bakteri metanotrof tersebut dapat dikembangkan sebagai agen pereduksi emisi metan sekaligus pupuk hayati untuk lahan sawah.
SIMPULAN
Sebanyak 52 isolat bakteri metanotrof berhasil diisolasi dari contoh sedimen sawah asal Sragen. Dari 52 isolat bakteri metanotrof tersebut, sebanyak 44 isolat bakteri metanotrof (24 isolat bakteri metanotrof berasal dari media NMS lengkap dan 20 isolat bakteri metanotrof berasal dari media NMS bebas nitrogen) menunjukkan aktivitas oksidasi metan dan 21 isolat bakteri metanotrof menunjukkan aktivitas fiksasi nitrogen.
DAFTAR PUSTAKA
Begonja A, Hrsak D. 1998. Growth characteristics and metabolic activities of the methanotrophic,heterotrophic groundwater community.
85: 448,456.
Bouwman AF, Sombroek WG. 1990. Inputs to climate change by soil and agriculture related activities. Di dalam: Scharpenseel HW, Scomacker M, Ayoup A. (eds)
. . Amsterdam: hlm. 15,30. Conrad R, Rothfus F. 1991. Methane
oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. ! " 12:28,32. Frenzel P, Rothfus BF, Conrad R. 1992.
Oxygen profiles and methane tumover in flooded rice microcosm. ! "
ISOLASI DAN
PEMFIKSASI N
FAKULTAS MATE
IN
DAN SELEKSI BAKTERI METANOTRO
SASI NITROGEN DARI SAWAH DI SRAGE
JAWA TENGAH
MAGDA MARGARETH
DEPARTEMEN BIOLOGI
ATEMATIKA DAN ILMU PENGETAHUAN AL
INSTITUT PERTANIAN BOGOR
BOGOR
2011
TROF
RAGEN,
Greenberg AE, Clesceri LS, Eaton AD. 1992.
# .
18th Edition. Washington DC: Publication Office American Public Health Association.
Griffin JM. 2003. $ % % &
' ( ( ) .
Massachusetts: Edward Elgar Publishing Inc.
Hanson R, Hanson TE. 1996. Metanotrophic bacteria. * 60 : 439, 471.
Hanson RS. 1998. Ecology of methylotrophic bacteria. Di dalam: Bularge RS, Atlas R, Sthal, Geesey G, Dayler G, editor. ' +,
. Oxford: Oxford University Press. Hlm 137,162
Hogan KB, Hoffman JS, Thompson AM. 1991. Methane on the greenhouse agenda. , 354:181,182.
[IPCC] Intergovernmental Panel on Climate Change. 1992. The Suplementary Report to The IPCC Scientific. Hougton Jt, Callendar BA, Varney SK, editor. Cambridge: Cambridge Univ Press. Kumaraswamy S, Ramakrishnan B,
Sethunathan N. 2001. Methane production and oxidation in annoxic rice soil as influenced by inorganic redox species. -, 30: 2195,2201.
Lelieveld J, Crutzen PJ, Bruhl C. 1993. Climate Effects of Atmospheric Methane. % 26: 739,768. Madigan MT, Martinko JM, Parker J. 2000.
Brock ! . 9th
Edition. New Jersey: Prentice Hall. Toukdarian, A.E., M.E. Lindstrom. 1984.
DNA hybridization analysis of the nif region of two methylotrophs and molecular cloning of nif specific DNA.
! 157:925,930.
Wild A. 1995. ' &
ISOLASI DAN
PEMFIKSASI N
FAKULTAS MATE
IN
DAN SELEKSI BAKTERI METANOTRO
SASI NITROGEN DARI SAWAH DI SRAGE
JAWA TENGAH
MAGDA MARGARETH
DEPARTEMEN BIOLOGI
ATEMATIKA DAN ILMU PENGETAHUAN AL
INSTITUT PERTANIAN BOGOR
BOGOR
2011
TROF
RAGEN,
ABSTRAK
MAGDA MARGARETH. Isolasi dan Seleksi Bakteri Metanotrof Pemfiksasi Nitrogen dari Sawah di Sragen, Jawa Tengah. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Metan adalah salah satu gas yang menyebabkan pemanasan global. Penurunan emisi metan 20,60 kali lebih efektif dalam penurunan potensi pemanasan global dibandingkan dengan penurunan emisi karbon dioksida. Penelitian ini bertujuan untuk mengisolasi bakteri metanotrof dari lahan sawah di daerah Sragen, Jawa Tengah, dan menyeleksinya berdasarkan pada aktivitas oksidasi metan dan efektifitas fiksasi nitrogen (N2). Aplikasi bakteri metanotrof dapat mengurangi emisi metan dari sawah. Ekplorasi bakteri metanotrof dari contoh sedimen asal sawah di Sragen yang ditumbuhkan pada media (NMS) menghasilkan 52 isolat bakteri metanotrof. Sebanyak 31 isolat bakteri metanotrof diperoleh dari hasil isolasi menggunakan media NMS lengkap, dan 21 isolat bakteri metanotrof diperoleh dari hasil isolasi menggunakan media NMS bebas nitrogen. Aktivitas oksidasi metan diukur dengan menggunakan kromatografi gas, sedangkan aktivitas fiksasi nitrogen diukur berdasarkan kadar akumulasi amonium dalam kultur. Lima isolat bakteri metanotrof dengan aktivitas oksidasi metan tertinggi di media NMS lengkap adalah isolat 1AN1, 2DN1, 2AN1, 3DN1, dan 3CN1. Lima isolat bakteri metanotrof dengan oksidasi metan tertinggi di media NMS bebas nitrogen adalah isolat 2C1, 4C2, 3D1, 3C2, dan 3A1. Lima isolat bakteri metanotrof dengan fiksasi nitrogen tertinggi adalah isolat bakteri metanotrof 2C2, 1C2, 4C1, 1B1, dan 4D1.
Kata kunci: Metan, bakteri metanotrof, oksidasi metan, fiksasi nitrogen
ABSTRACT
MAGDA MARGARETH. Isolation and Selection Nitrogen Fixing Methanotrophic Bacteria from Ricefields in Sragen, Jawa Tengah. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Methane is one of green house gasses that can cause global warming. Decreasing of methane emission from ricefields will be more effective 20,60 times than that of carbon dioxide in reduces global warming potency. This research was conducted to isolate and select methanotrophic bacteria that can oxidize methane and fix nitrogen from ricefields in Sragen, Jawa Tengah. Application of methanotrophic bacteria can reduce methane emission from ricefields. Exploration of methanotrophic bacteria from sediment of ricefields in Sragen using Nitrat Medium Salts (NMS) medium resulted fifty two isolates of methanotrophic bacteria. A total of 31 methanotrophic bacterial isolates obtained from isolation using complete NMS medium and 21 methanotrophic bacterial isolates obtained from isolation using NMS medium without nitrogen. Methane oxidation activity of the isolates was determined using a gas chromatograph, while determination of nitrogen fixation activity was performed by measuring ammonium accumulation. Five methanotrophic bacterial isolates having the highest methane oxidation activity in complete NMS medium were 1AN1, 2DN1, 2AN1, 3DN1, and 3CN1 isolates. Five methanotrophic bacterial isolates having the highest methane oxidation activity in NMS medium without nitrogen were 2C1, 4C2, 3D1, 3C2, and 3A1 isolates. Five methanotrophic bacterial isolates having the highest nitrogen fixation activity were 2C2, 1C2, 4C1, 1B1, and 4D1 isolates.
ISOLASI DAN SELEKSI BAKTERI METANOTROF
PEMFIKSASI NITROGEN DARI SAWAH DI SRAGEN,
JAWA TENGAH
MAGDA MARGARETH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Isolasi dan Seleksi Bakteri Metanotrof Pemfiksasi Nitrogen dari
Sawah di Sragen, Jawa Tengah.
Nama
: Magda Margareth
NIM
: G34062214
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Iman Rusmana, M.Si)
(Alina Akhdiya, M.Si)
NIP 196507201991031002 NIP 196812082001122001
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ir. Ence Darmo Jaya Supena, M.S.)
NIP 196410021989031002
PRAKATA
Puji dan syukur penulis haturkan pada Tuhan Yang Maha Esa atas terselenggaranya penelitian dan pembuatan karya ilmiah dengan judul Isolasi dan Seleksi Bakteri Metanotrof Pemfiksasi Nitrogen dari Sawah di Sragen, Jawa Tengah. Penelitian dilaksanakan selama delapan bulan dari Oktober 2010 sampai dengan Mei 2011 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si dan Ibu Alina Akhdiya, M.Si atas bimbingan, masukan, dan arahan yang diberikan sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Terima kasih juga kepada kedua orang tua dan keluarga yang telah memberikan bantuan moril berupa nasehat, doa, dorongan semangat dan kasih sayang. Terima kasih kepada keluarga, seluruh staf Laboratorium Mikrobiologi, dan rekan,rekan yang melaksanakan penelitian di Laboratorium Mikrobiologi atas dukungan yang diberikan. Selain itu, terima kasih kepada Rani, Melania, Sira, Dini, Iin, Molly, dan teman,teman Biologi 43 yang telah memberikan dukungan dan semangat kepada penulis. Terima kasih pula penulis ucapkan kepada semua pihak yang telah membantu dalam pengumpulan data karya ilmiah ini.
Semoga karya ilmiah ini dapat bermanfaat bagi yang memerlukannya.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 Maret 1988 dari ayahanda Harijanto Suparta dan ibunda Lidia Limartin. Penulis merupakan anak ketiga dari tiga bersaudara. Pada tahun 2000 penulis lulus dari SD Budi Mulia Bogor. Pada tahun 2000 penulis melanjutkan pendidikan di SMP Negeri 1 Bogor dan pada tahun 2006 penulis lulus dari SMA Negeri 3 Bogor. Pada tahun yang sama, penulis diterima sebagai mahasiswi program studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru IPB (SPMB).
Selama masa perkuliahan, penulis aktif menjadi anggota Komisi Pelayanan Siswa, Perkumpulan Mahasiswa Kristen IPB (KPS PMK). Penulis juga aktif menjadi anggota beberapa kepanitian yang diadakan oleh IPB seperti menjadi anggota tim khusus pada acara LCTB (Lomba Cepat Tepat Biologi) tahun 2008, anggota tim khusus pusat pada acara PESTA SAINS tahun 2009, Penanggung Jawab Keluarga (PJK) dalam kepanitiaan Masa Perkenalan Departemen (MPD) tahun 2008 yang diselengarakan oleh BEM Biologi. Penulis juga aktif sebagai asisten praktikum Mikrobiologi Dasar dan Biologi Dasar pada tahun ajaran 2010/2011.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan... 1
BAHAN DAN METODE ... 1
Waktu dan Tempat ... 1
Bahan ... 1
Metode ... 1
Pengambilan contoh tanah sedimen ... 1
Isolasi, Pemurnian, dan Pengkulturan Bakteri Metanotrof ... 1
Uji Aktivitas Oksidasi Metan ... 2
Pengukuran Rapat Optis Kultur ... 2
Uji Fiksasi N2 ... 2
HASIL ... 2
Isolat Bakteri Metanotrof yang Diperoleh ... 2
Aktivitas Oksidasi Metan dan Fiksasi N2 isolat metanotrof ... 3
PEMBAHASAN ... 4
SIMPULAN ... 4
DAFTAR PUSTAKA ... 4
DAFTAR TABEL
Halaman
1 Hasil isolasi bakeri metanotrof dari sedimen sawah di daerah Sragen dengan metode pengayaan dan cawan sebar.pada media NMS ... 2 2 Aktivitas oksidasi metan dan rapat optis kultur isolat bakteri metanotrof pada media NMS
lengkap ... .3 3 Kadar amonium terakumulasi, aktivitas oksidasi metan dan rapat optis kultur isolat bakteri
metanotrof pada media NMS bebas Nitrogen ... 3
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Pemanasan global ( ) pada dasarnya merupakan fenomena peningkatan temperatur global dari tahun ke tahun karena meningkatnya emisi gas rumah kaca di atmosfir. Selama 100 tahun terakhir ini, konsentrasi gas rumah kaca CO2, CH4, dan N2O di atmosfir terus meningkat sebagai hasil dari aktivitas manusia (Griffin 2003). Konsentrasi metan di atmosfer pada tahun 1990 adalah 1.72 ppm dengan laju peningkatan 1% per tahun, sedangkan untuk karbondioksida masing,masing 354 ppm dan 0.5% per tahun (Lelieveld 1993). Data Pada tahun 1992 metan (CH4) menempati urutan ketiga dalam hal pemanasan global setelah CO2 dan CFC (IPCC 1992).
Laju peningkatan konsentrasi metan di atmosfer dua kali lipat lebih tinggi dibandingkan dengan CO2. Penyerapan metan terhadap sinar infra merah dengan panjang gelombang 4,100 nm lebih besar daripada CO2 (Lelieveld 1993; Hanson & Hanson 1996). Pengurangan emisi metan akan 20,60 kali lebih efektif dalam menurunkan potensi pemanasan atmosfer bumi daripada pengurangan emisi CO2 (Hogan . 1991). Selain itu, metan juga menyebabkan pengikisan dan melubangi lapisan ozon di stratosfer (Wild 1995).
Sebesar 43% dari emisi metan ke atmosfer berasal dari lahan basah dan sawah (Wild 1995). Dari jumlah tersebut, diperkirakan masing,masing 20% berasal dari sawah dan rawa (Bouwman & Sombroek 1990). Metan yang diproduksi pada bagian anaerob sebagian akan mengalami oksidasi di bagian permukaan sedimen sawah. Proses oksidasi metan tersebut dilakukan oleh kelompok bakteri metanotrof pada kondisi aerobik. Oksidasi metan oleh bakteri metanotrof di lahan sawah mencapai 80% dari metan yang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Bakteri metanotrof memanfaatkan metan sebagai donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya.
Aplikasi bakteri metanotrof sebagai agen pengoksidasi metan dapat menjadi salah satu solusi untuk mengurangi emisi metan dari sawah. Oleh karena itu perlu dilakukan eksplorasi dan seleksi isolat,isolat bakteri metanotrof yang potensial untuk diaplikasikan di sawah.
Tujuan
Penelitian ini bertujuan untuk mengisolasi bakteri metanotrof dari lahan sawah di daerah Sragen, Jawa Tengah, dan menyeleksinya berdasarkan pada aktivitas oksidasi metan dan efektifitas fiksasi nitrogen (N2).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Oktober 2010 sampai dengan Mei 2011 di lahan sawah di wilayah Sragen, Jawa Tengah, Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah, Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan adalah media komposisi lengkap (MgSO4.7H2O 1,0 g/L; CaCl2.6H2O 0,2 g/L; KNO3 1,0 g/L; KH2PO4 0,272 g/L; Na2HPO4 4,0 g/L; NH4Cl 4,0 mg/L; Na2EDTA 0,5 g/L; FeSO4.7H2O 0,2 g/L; H3BO4 0,03 g/L; CoCl2.6H2O 0,02 g/L; ZnSO4.7H2O 0,01 g/L; MnCl2.4H2O 3,0 mg/L; Na2MoO4. 2H2O 3,0 mg/L; NiCl2.6H2O 2,0 mg/L; CaCl2.2H2O 1,0 mg/L), media NMS bebas nitrogen, Bacto agar 20 g/L, larutan NH4Cl 100 ppm, Milli,Q water, larutan fenol alkohol (C6H5OH) 10%, larutan Natrium Dihidro Nitroprusid 0,5%, dan larutan oksidan yang terdiri atas Natrium Sitrat 20% dan Natrium Hipoklorit 5,25%.
Metode
Pengambilan contoh tanah sedimen. Sampel sedimen diperoleh dari sawah di wilayah Sragen, Jawa Tengah. Pengambilan sampel dilakukan dengan menancapkan 10 ml yang telah dipotong ujungnya di atas sedimen sawah yang tergenang. Setelah terisi dengan sedimen (kedalaman ± 3 cm), segera ditutup dengan sumbat karet dan dimasukkan kedalam plastik untuk dibawa ke laboratorium.
Isolasi, Pemurnian, dan
NMS dengan komposisi lengkap dan media NMS bebas nitrogen. Sebanyak 1 gr contoh sedimen diinokulasikan ke dalam 50 ml medium NMS dalam botol serum 125 ml lalu ditutup sumbat karet. Komposisi gas pada bagian dibuat dengan perbandingan 1:1 untuk udara dan metan. Inkubasi dilakukan di atas (100 rpm) pada suhu ruang pada kondisi gelap selama14 hari. Selanjutnya bakteri,bakteri metanotrof tersebut diberikan kode,kode tertentu. Karakter pertama dan kedua dari kode tersebut menunjukkan titik pengambilan sampel tanah sawah. Karakter terakhir merupakan identitas masing,masing bakteri tersebut. Sedangkan kode N yang berada di tengah,tengah dari beberapa bakteri metanotrof menunjukkan tanda untuk bakteri yang menggunakan media NMS dengan komposisi lengkap. Bila tidak terdapat kode N, berarti bakteri tersebut menggunakan media NMS bebas nitrogen.
Uji Aktivitas Oksidasi Metan. Aktivitas oksidasi CH4 isolat diuji dengan mengukur konsentrasi gas metan tersisa pada bagian menggunakan teknik kromatografi gas seperti yang dipaparkan dalam Kumaraswamy 2001. Sebanyak 1 ml isolat cair bakteri metanotrof diinokulasikan ke 9 ml medium NMS dalam tabung bervolume 17 ml lalu ditutup sumbat karet. Gas di bagian dibuat komposisinya mendekati 50% metan dan 50% udara. Sebagai kontrol, digunakan tabung berisi 10 ml media NMS dengan komposisi yang sama. Inkubasi dilakukan selama 14 hari di atas pada suhu ruang (27,30°C) dalam kondisi gelap. Pengukuran konsentrasi metan tersisa
dilakukan pada akhir masa inkubasi. Pengukuran gas ini dilakukan di Balai Penelitian Lingkungan Pertanian Jakenan Pati, Jawa Tengah.
Pengukuran Rapat Optis Kultur.
Pada akhir masa inkubasi, masing,masing kultur diukur rapat optisnya menggunakan spektrofotometer (Spektronic Genesys 20). Pengukuran dilakukan pada panjang gelombang 620nm.
Uji Fiksasi N2. Kemampuan fiksasi
nitrogen bakteri metanotrof diukur berdasarkan kadar amonium yang diakumulasikan dalam kultur. Kadar amonium ditentukan dengan metode spektrofotometri. Sebanyak 5 ml sampel yang telah disaring berturut,turut ditambah dengan 0.2 ml fenol alkohol 10%, 0.2 ml nitroprusid 0.5%, dan 0.5 ml campuran Na, sitrat : NA,hipoklorit (1:4), kemudian didiamkan selama 1 jam. Warna biru yang terbentuk sebagai hasil reaksi dibaca serapannya pada panjang gelombang 640 nm (Greenberg ., 1992). Sebagai standar pada penentuan kadar amonium digunakan serial larutan NH4Cl dengan konsentrasi 0, 5, 10, 20, 50, dan 100 µM yang diberi pereaksi yang sama. Kurva standar amonium dapat dilihat pada Lampiran 1.
HASIL
Isolat Bakteri Metanotrof yang Diperoleh
Dari 16 sampel sedimen sawah yang diisolasi dengan metode pengayaan dan isolasi langsung dengan cawan sebar diperoleh 52 isolat bakteri metanotrof (Tabel 1).
Tabel 1 Hasil isolasi bakeri metanotrof dari sedimen sawah di daerah Sragen dengan metode pengayaan dan cawan sebar pada media NMS
Media isolasi Jumlah sampel sedimen tanah Jumlah isolat bakteri metanotrof
Kode isolat bakteri metanotrof
Pengayaan :
, NMS lengkap 16 20 1AN1, 1BN1, 1BN3, 1CN1, 2AN2, 2AN3, 2BN1, 2CN2, 2DN1, 3AN2, 3BN2, 3BN3, 3CN1, 3CN2, 3DN1, 4AN2, 4AN3, 4AN4,
4BN1, 4CN2
, NMS bebas nitrogen 16 15 1A1, 1B1, 1C1,1D1, 2A1, 2B1, 2C1, 2D1, 3A1, 3C2, 3D1, 4A1, 4B1, 4C1, 4D1 Cawan sebar :
, NMS lengkap 16 11 1AN2, 1BN2, 1DN1, 2AN1, 2CN1, 2DN2, 3CN3, 3DN4, 4AN1, 4BN2, 4CN1 , NMS bebas nitrogen 16 6 1A2, 1B3, 1C2, 2C2, 2D2, 4C2
3
Keterangan : , tidak terdeteksi
Sebanyak 31 isolat bakteri metanotrof diperoleh dari isolasi yang dilakukan menggunakan media NMS lengkap dan 21 isolat bakteri metanotrof dari isolasi menggunakan media NMS bebas Nitrogen.
Tabel 2 Aktivitas oksidasi metan dan rapat optis kultur isolat bakteri metanotrof pada media NMS lengkap No Kode isolat bakteri metanotrof Metan yang dioksidasi (ppm) OD620 kultur (AU)
1 1AN1 144 0,024
2 2DN1 138 0,244
3 2AN2 137 0,091
4 3DN1 133 0,034
5 3CN1 121 0,200
6 3BN3 119 0,057
7 4AN3 118 0,004
8 4CN2 113 0,010
9 2CN1 111 0,253
10 1BN3 106 0,004
11 4AN1 100 0,007
12 2DN2 99 0,096
13 2BN1 96 0,462
14 4BN1 96 0,379
15 3CN3 91 0,001
16 1CN1 86 0,029
17 1BN2 84 0,025
18 3BN2 82 0,154
19 4AN2 80 0,024
20 1AN2 69 0,317
21 2CN2 65 0,007
22 1BN1 64 0,380
23 3DN4 61 0,175
24 3CN2 55 0,034
25 1DN1 , 0,222
26 2AN1 , 0,072
27 2AN3 , 0,025
28 3AN2 , 0,023
29 4AN4 , 0,004
30 4BN2 , 0,159
31 4CN1 , 0,008
Aktivitas Oksidasi Metan dan Fiksasi N2
isolat metanotrof
Dari 31 isolat bakteri metanotrof yang didapatkan dari media NMS lengkap,
didapatkan 24 isolat bakteri metanotrof yang dapat dideteksi aktivitas oksidasi metannya. Di antara 24 isolat bakteri metanotrof tersebut terdapat 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi, antara lain isolat 1AN1, 2DN1, 2AN2, 3DN1 dan 3CN1 (Tabel 2).
Kemampuan masing,masing kultur dalam mengfiksasi Nitrogen bervariasi yang ditunjukkan oleh konsentrasi amonium yang terakumulasi dalam media pertumbuhannya. Akumulasi amonium tertinggi terdapat pada kultur isolat 2C2 sebesar 0,223 µM (Tabel 3). Masing,masing kultur isolat juga menunjukkan aktivitas oksidasi metan yang berbeda. Isolat 2C1 menghasilkan aktivitas oksidasi CH4 tertinggi yaitu sebesar 202 ppm (Tabel 3).
Tabel 3 Kadar amonium terakumulasi, aktivitas oksidasi metan dan rapat optis kultur isolat bakteri metanotrof pada media NMS bebas Nitrogen No Kode isolat bakteri metanotrof Akumulasi amonium (µM) Metan yang dioksidasi (ppm) OD620 kultur (AU)
1 2C2 0.223 99 0,220
2 1C2 0.209 105 0,009
3 4C1 0.195 113 0,278
4 1B1 0.191 107 0,213
5 4D1 0.184 115 0,445
6 2D2 0.180 99 0,340
7 1A2 0.173 121 0,018
8 4B1 0.173 32 0,248
9 1B3 0.169 94 0,081
10 3D1 0.097 176 0,013
11 3A1 0.083 131 0,350
12 3C2 0.076 148 0,058
13 1C1 0.068 103 0,010
14 2C1 0.065 202 0,115
15 4A1 0.065 , 0,003
16 4C2 0.061 179 0,326
17 2B1 0.047 127 0,195
18 2D1 0.047 119 0,066
19 1D1 0.032 96 0,074
20 2A1 0.029 98 0,001
21 1A1 0.025 104 0,111
PEMBAHASAN
Pada penelitian ini sebanyak lima puluh dua isolat bakteri pengoksidasi metan telah berhasil diisolasi dari bagian atas sedimen sawah asal Sragen. Bakteri metanogen yang hidup pada bagian bawah sedimen tanah mengubah karbon dioksida (CO2), metil (seperti CH3OH), dan asetat (CH3COO,) menjadi metan melalui proses yang disebut metanogenesis. Metan yang dihasilkan berdifusi ke bagian atas sedimen yang aerob dan menciptakan kondisi yang sangat cocok bagi pertumbuhan bakteri metanotrof (Frenzel 1992).
Oksidasi metan merupakan tahap awal penggunaan metan sebagai sumber karbon dan energi untuk pertumbuhan bakteri metanotrof. Semakin tinggi aktivitas oksidasi metan maka semakin rendah kadar gas metan tersisa pada bagian
kultur. Isolat bakteri metanotrof 1AN1, 2DN1, 2AN2, 3DN1 dan 3CN1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS lengkap berturut,turut dengan nilai aktivitas oksidasi metan 144, 138, 137, 133 dan 121 ppm (Tabel 2). Sedangkan isolat bakteri metanotrof 2C1, 4C2, 3D1, 3C2 dan 3A1 adalah 5 isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan tertinggi pada media NMS bebas nitrogen berturut,turut dengan nilai aktivitas oksidasi metan 202, 179, 176, 148 dan 131 ppm (Tabel 3).
Selain sumber karbon, bakteri juga memerlukan sumber nitrogen untuk pertumbuhannya. Sebagian bakteri metanotrof diketahui memiliki gen dan mampu melakukan fiksasi nitrogen (Toukdarian & Lindstrom 1984). Kemampuan fiksasi nitrogen tersebut bisa diukur diantaranya dengan mengukur kadar amonium yang terakumulasi dalam kulturnya. Kadar amonium yang tinggi dalam kultur mengindikasikan tingginya kemampuan bakteri dalam menambat nitrogen. Isolat bakteri metanotrof 2C2, 1C2, 4C1, 1B1 dan 4D1 adalah lima isolat bakteri metanotrof yang memiliki kadar amonium dalam kultur tertinggi berturut, turut dengan kadar amonium terakumulasi 0,223, 0,209, 0,195, 0,191 dan 0,184 µM (Tabel 3).
Pengamatan yang dilakukan terhadap kerapatan optis ( /OD) kultur cair isolat metanotrof menunjukkan nilai yang relatif kecil. Kecilnya nilai OD tersebut
mengindikasikan pertumbuhan sel yang sangat lambat. Bakteri metanotrof merupakan bakteri yang tumbuh lambat (Begonja & Hrsak 1998), bahkan pada media agar NMS koloni bakteri ini baru tumbuh optimal pada umur 14 hari inkubasi.
Isolat,isolat bakteri metanotrof yang memiliki aktivitas oksidasi metan yang tinggi potensial untuk dikembangkan sebagai agen pereduksi emisi metan di lahan sawah. Sedangkan, isolat,isolat bakteri metanotrof yang memiliki kemampuan fiksasi nitrogen yang tinggi potensial untuk dikembangkan sebagai agen pupuk hayati pada lahan sawah. Kombinasi kedua jenis bakteri metanotrof tersebut dapat dikembangkan sebagai agen pereduksi emisi metan sekaligus pupuk hayati untuk lahan sawah.
SIMPULAN
Sebanyak 52 isolat bakteri metanotrof berhasil diisolasi dari contoh sedimen sawah asal Sragen. Dari 52 isolat bakteri metanotrof tersebut, sebanyak 44 isolat bakteri metanotrof (24 isolat bakteri metanotrof berasal dari media NMS lengkap dan 20 isolat bakteri metanotrof berasal dari media NMS bebas nitrogen) menunjukkan aktivitas oksidasi metan dan 21 isolat bakteri metanotrof menunjukkan aktivitas fiksasi nitrogen.
DAFTAR PUSTAKA
Begonja A, Hrsak D. 1998. Growth characteristics and metabolic activities of the methanotrophic,heterotrophic groundwater community.
85: 448,456.
Bouwman AF, Sombroek WG. 1990. Inputs to climate change by soil and agriculture related activities. Di dalam: Scharpenseel HW, Scomacker M, Ayoup A. (eds)
. . Amsterdam: hlm. 15,30. Conrad R, Rothfus F. 1991. Methane
oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. ! " 12:28,32. Frenzel P, Rothfus BF, Conrad R. 1992.
Oxygen profiles and methane tumover in flooded rice microcosm. ! "
5
Greenberg AE, Clesceri LS, Eaton AD. 1992.
# .
18th Edition. Washington DC: Publication Office American Public Health Association.
Griffin JM. 2003. $ % % &
' ( ( ) .
Massachusetts: Edward Elgar Publishing Inc.
Hanson R, Hanson TE. 1996. Metanotrophic bacteria. * 60 : 439, 471.
Hanson RS. 1998. Ecology of methylotrophic bacteria. Di dalam: Bularge RS, Atlas R, Sthal, Geesey G, Dayler G, editor. ' +,
. Oxford: Oxford University Press. Hlm 137,162
Hogan KB, Hoffman JS, Thompson AM. 1991. Methane on the greenhouse agenda. , 354:181,182.
[IPCC] Intergovernmental Panel on Climate Change. 1992. The Suplementary Report to The IPCC Scientific. Hougton Jt, Callendar BA, Varney SK, editor. Cambridge: Cambridge Univ Press. Kumaraswamy S, Ramakrishnan B,
Sethunathan N. 2001. Methane production and oxidation in annoxic rice soil as influenced by inorganic redox species. -, 30: 2195,2201.
Lelieveld J, Crutzen PJ, Bruhl C. 1993. Climate Effects of Atmospheric Methane. % 26: 739,768. Madigan MT, Martinko JM, Parker J. 2000.
Brock ! . 9th
Edition. New Jersey: Prentice Hall. Toukdarian, A.E., M.E. Lindstrom. 1984.
DNA hybridization analysis of the nif region of two methylotrophs and molecular cloning of nif specific DNA.
! 157:925,930.
Wild A. 1995. ' &
7
Lampiran 1 Kurva standar amonium
y = 0.0011x + 0.0204 R² = 0.9961
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14
0 20 40 60 80 100 120
A
b
sor
b
a
n
si
Konsentrasi NH4Cl (µM)
Series1
7
Lampiran 1 Kurva standar amonium
y = 0.0011x + 0.0204 R² = 0.9961
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14
0 20 40 60 80 100 120
A
b
sor
b
a
n
si
Konsentrasi NH4Cl (µM)
Series1