1. PENDAHULUAN
1.1. Latar Belakang
Selat merupakan suatu wilayah perairan yang menghubungkan dua bagian perairan yang lebih luas dan biasanya terletak diantara dua daratan. Selat Bali merupakan perairan yang menghubungkan Laut Flores dan Selat Madura di utara dan Samudera Hindia di bagian selatan. Selat Bali merupakan daerah perairan yang relatif sempit (sekitar 960 mil). Mulut bagian utara sekitar satu mil dan merupakan perairan yang dangkal (kedalaman sekitar 50 meter), sedangkan di bagian selatan memiliki wilayah yang lebih luas yaitu sekitar 28 mil dan merupakan perairan yang dalam (Nikyuluw 2005). Kondisi ini menyebabkan perairan Selat Bali lebih dipengaruhi oleh massa air Samudera Hindia di bagian selatan dibanding massa air Laut Flores atau Selat Madura di bagian utara.
Selat Bali merupakan salah satu selat yang memiliki fungsi dan peranan penting di Indonesia. Selain sebagai penghubung antara Pulau Jawa dan Pulau Bali, Selat Bali yang merupakan bagian dari WPP 573 memiliki potensi yang cukup tinggi di bidang perikanan tangkap khususnya perikanan lemuru (Sardinella
lemuru). Menurut data statistik Direktorat Jenderal Perikanan Tangkap,
Kementerian Kelautan & Perikanan Indonesia tahun 2011 perikanan tangkap lemuru sampai akhir tahun 2010 menunjukkan produksi tertinggi perikanan pelagis yang menjadi komoditi utama dengan jumlah sebesar 71,3 ribu ton atau sekitar 25% dari total produksi perikanan dominan di WPP 573 (perairan Samudera Hindia sebelah selatan Jawa hingga sebelah selatan Nusa Tenggara, Laut Sawu dan Laut Timor bagian barat). Produksi lemuru di Selat Bali dari tahun 2005 sampai tahun 2007 menunjukkan trend yang meningkat hingga mencapai 38.617,008 ton. Namun pada tahun 2010 nilai produksi lemuru di Selat Bali menurun hingga 17.854,857 ton. Hal ini diakibatkan sering terjadinya cuaca ekstrim yang mengakibatkan nelayan tidak dapat melaut selama hampir empat bulan terakhir (Wiyono 2011).
dengan peristiwa upwelling. Proses upwelling merupakan fenomena yang berkaitan dengan gerakan naiknya massa air laut. Gerakan vertikal ini adalah bagian integrasi dari sirkulasi air laut. Dampak dari upwelling sangat berpengaruh secara ekonomi yaitu berkaitan dengan daerah penangkapan ikan (Surinati 2009).
Pengetahuan berbagai macam parameter perairan pada lapisan permukaan, kolom, dan dasar perairan menjadi sangat penting untuk diketahui agar dapat memahami karakteristik massa air di suatu wilayah perairan. Keadaan topografi Selat Bali yang memiliki kedalaman yang sangat berbeda antara di bagian utara dan selatan menjadikan aliran massa air yang semula tampak sederhana menjadi tidak sederhana lagi. Hal ini juga berpengaruh terhadap proses upwelling di perairan. Surinati (2009) menyatakan bahwa pengaruh dari upwelling ini dapat memberikan dampak positif terhadap kesuburan suatu perairan terutama konsentrasi senyawa hara pada lapisan permukaan yang terbawa oleh penaikan massa air dari kedalaman tertentu.
Berbagai macam parameter fisika-kimia perairan seperti suhu, salinitas, oksigen, dan lainnya merupakan hal yang penting untuk dianalisis untuk mempelajari karakteristik dan menentukan status mutu suatu perairan. Di bidang perikanan, parameter-parameter tersebut dapat membantu memberikan informasi mengenai daerah penangkapan, pola penyebaran serta memberikan ciri khas suatu perairan. Oleh karena itu di dalam hal pengelolaan sumberdaya perikanan sangatlah membutuhkan informasi tentang data yang menjelaskan tentang kualitas perairan yang dapat menunjang dalam rencana pengelolaan sumberdaya perikanan secara optimum dan lestari.
1.2. Rumusan Masalah
diakibatkan oleh pergerakan angin dan sirkulasi air, kondisi suatu peraian juga dapat dipengaruhi oleh kegiatan manusia seperti pelayaran dan aktivitas manusia lainnya khususnya yang berada di wilayah pesisir. Hal ini berdampak pada kualitas perairan baik pada lapisan permukaan maupun pada kolom perairan dibawahnya.
Gambar 1. Skema perumusan masalah analisis spasial kualitas perairan bagian selatan Selat Bali
1.3. Tujuan
Tujuan dari penelitian mengenai analisis kualitas perairan di Selat Bali ini adalah:
1. Mengetahui dan membandingkan parameter fisika-kimia perairan di bagian selatan Selat Bali secara horizontal maupun vertikal.
2. Menentukan status mutu perairan.
1.4. Manfaat
Penelitian ini diharapkan dapat memberikan informasi mengenai karakteristik parameter fisika kimia perairan Selat Bali yang dapat dijadikan sebagai dasar dalam pengelolaan perikanan secara optimum dan lestari.
Upwelling
Aktivitas manusia
Lingkungan perairan
Parameter fisika, kimia:
suhu, kekeruhan, TSS, salinitas, pH, DO, BOD, amonia, nitrat, fosfat, raksa (Hg), kadmium (Cd), tembaga (Cu), timbal (Pb).
2. TINJAUAN PUSTAKA
2.1. Kondisi Umum Perairan Selat Bali
Perairan Selat Bali terletak diantara Pulau Jawa di sebelah barat dan Pulau Bali di sebelah timur dengan posisi antara 114° 20’-115° 10’ BT dan 8° 10’-8° 50’ LS. Perairan ini menghubungkan Laut Flores dan Selat Madura di utara dan Samudera Hindia di selatan. Perairan Selat Bali merupakan suatu bentuk perairan yang relatif sempit, berbentuk corong dengan luas kira-kira 2.500 km2. Perairan Selat Bali bagian utara lebih sempit dibanding dengan mulut selat yang menghadap ke perairan Samudera Hindia. Di bagian mulut selat bagian utara sangat sempit yaitu hanya mencapai 1 mil dan melebar ke bagian selatan hingga mencapai 28 mil. Karakteristik perairan tersebut menyebabkan Selat Bali cenderung lebih dipengaruhi oleh masa air Samudera Hindia di bagian selatan dibanding oleh masa air Laut Flores atau Selat Madura di bagian uatara. Kedalaman perairan di sebelah utara mencapai 50 meter dan semakin ke selatan kedalaman perairan menjadi sangat dalam hingga mencapai 1.300 meter (Burhanudin & Praseno 1982).
bawahnya terdapat lapisan termoklin yang dicirikan perubahan suhu menurun dengan cepat seiring bertambahnya kedalaman. Pada lapisan permukaan, upwelling
ditandai dengan rendahnya suhu permukaan berkisar antara 25,5-26,9 °C dan salinitas yang tinggi antara 33,6-34,2 ‰ (Illahude 1974).
Menurut data statistik Direktorat Jenderal Perikanan Tangkap, Kementerian Kelautan & Perikanan Indonesia, perikanan tangkap lemuru sampai akhir tahun 2010 menunjukkan produksi tertinggi perikanan pelagis yang menjadi komoditi utama dengan jumlah sebesar 71,3 ribu ton atau sekitar 25 % dari total produksi perikanan dominan di WPP 573 (Gambar 2). Di Selat Bali, produksi lemuru dari tahun 2005 sampai 2007 terus naik hingga mencapai 38.617,008 ton, namum menurun sampai tahun 2010 produksinya sebesar 17.854,857 ton (Tabel 1). Menurunnya produksi lemuru pada tahun 2010 diakibatkan sering terjadinya cuaca ekstrim yang mengakibatkan nelayan tidak dapat melaut selama hampir empat bulan (Juni dan September-Desember) di Kabupaten Banyuwangi, namun di Kabupaten Jembrana masih bisa berproduksi. Produksi pada armada ukuran 5-10 GT dan 10-30 GT memiliki pola trend yang sama, yaitu menunjukkan trend naik walaupun trend
armada 5-10 GT lebih tinggi dibandingkan armada 10-30 GT (Wiyono 2011).
Tabel 1. Hasil produksi tahunan lemuru di Selat Bali tahun 2005-2010
Tahun Produksi lemuru (ton)
10-30 GT 5-10 GT Total
2005 8.674,112 3.126,746 11.800,858 2006 13.695,591 4.936,050 18.631,641 2007 6.757,780 11.859,228 18.617,008 2008 20.287,721 11.518,945 31.806,666 2009 20.840,529 14.760,997 35.601,526 2010 10.128,554 7.726,303 17.854,857
2.2. Parameter Fisika Perairan 2.2.1. Suhu
Suhu merupakan suatu besaran fisika yang mendefinisikan banyaknya bahang yang terkandung atau diterima oleh suatu benda. Suhu di perairan laut adalah salah satu faktor yang sangat penting bagi kehidupan organisme di laut. Suhu dapat mempengaruhi baik aktivitas metabolisme maupun perkembangan dari organisme. Secara tidak langsung suhu berpengaruh terhadap daya larut oksigen (O2) yang
digunakan dalam proses respirasi biota laut. Daya larut oksigen akan berkurang jika suhu naik sehingga kandungan karbondioksida (CO2) bertambah dan oksigen terlarut
yang dibutuhkan untuk respirasi menjadi semakin berkurang (Sverdrup et al. 1946). Intensitas penyinaran cahaya matahari menjadi faktor utama yang mempengaruhi suhu di perairan laut. Energi dari pancaran cahaya matahari tersebut akan diserap oleh massa air yang dikenal dengan proses absorpsi sinar matahari. Lapisan permukaan yang pertama kali terkena sinar matahari adalah lapisan yang hangat dan mengalami penurunan suhu yang sangat cepat pada selang kedalaman antara 50 sampai 300 meter. Selain itu, suhu air laut juga dapat naik karena aliran bahang dari bumi melalui dasar laut, kondensasi dan perubahan energi kinetik menjadi energi bahang (Sverdrup et al. 1946). Menurut Wyrtki (1961) sebaran suhu di laut tropis secara vertikal dapat dibedakan menjadi tiga lapisan utama, yaitu: 1. Lapisan homogen (homogeneous layer/mixed layer) di lapisan atas
2. Lapisan termoklin (thermoclined/discontinuity layer) di lapisan tengah 3. Lapisan dalam (homogeneous/deep layer) di bagian dalam.
fenomena-fenomena yang terjadi di laut seperti front, arus, upwelling dan sebaran suhu permukaan laut secara horizontal. Dalam proses upwelling, terjadi penurunan suhu permukaan laut dan tingginya kandungan zat hara dibandingkan daerah sekitarnya. Menurut Nontji (1987), suhu permukaan laut di perairan Indonesia
Lapisan termoklin merupakan lapisan yang mengalami perubahan nilai suhu yang cepat terhadap kedalaman. Kedalaman lapisan termoklin yang besar dapat menjadi pemisah antara lapisan di bagian atas dan bagian bawahnya yang terdapat perbedaan baik dari sifat fisik, kimia maupun biologi. Kedalaman lapisan termoklin dan homogen berbeda-beda tergantung pada musim. Selain penurunan suhu, lapisan termoklin juga ditandai dengan penurunan oksigen terlarut dan penaikan yang cepat dari kadar zat hara. Pada saat terjadinya penaikan massa air, lapisan termoklin bergerak ke atas dan gradiennya menjadi tidak terlalu tajam sehingga massa air yang kaya akan zat hara dari lapisan dalam naik ke lapisan atas. Fluktuasi jangka pendek dari kedalaman termoklin dipengaruhi oleh pergerakan permukaan, pasang surut, dan arus. Di bawah lapisan termoklin, suhu menurun secara perlahan dengan bertambahnya kedalaman. Kedalaman dari lapisan termoklin di Samudera Hindia mencapai 120 meter dan semakin ke arah selatan di daerah ekuator kedalaman mencapai 140 meter (Wyrtki 1961).
2.2.2. Kekeruhan
maupun bahan anorganik dan organik berupa plankton dan mikroorganisme air (Eaton 2005).
Faktor yang mempengaruhi nilai kekeruhan suatu perairan diantaranya adalah material organik maupun anorganik, run off dari daratan, pengadukan perairan yang disebabkan oleh badai, aktivitas gelombang, musim dan buangan akibat aktivitas manusia seperti pertanian, industri dan lain sebagainya. Kekeruhan tinggi dapat mengakibatkan terhambatnya penetrasi cahaya ke dalam air yang berdampak pada menurunnya produktivitas primer seperti fitoplankton (Sverdrup et al. 1946).
Dari hasil penelitian yang dilakukan oleh Anwar (2008), diketahui bahwa nilai kekeruhan suatu perairan dipengaruhi pula oleh kedalaman suatu perairan. Pada perairan laut nilai dari kekeruhan akan semakin berkurang dengan seiring bertambahnya kedalaman, sebaliknya semakin meningkat seiring berkurangnya kedalaman. Secara spasial nilai kekeruhan akan semakin meningkat ke arah estuari atau ke arah daratan. Hal ini diakibatkan masih besarnya pengaruh dari aliran sungai dan air limpasan dari darat (run off). Di wilayah laut lepas nilai kekeruhan suatu perairan relatif rendah dan konstan. Kekeruhan di perairan Selat Bali relatif rendah karena masukan dari daratan sedikit yang ditandai dengan sedikitnya jumlah sungai yang bermuara ke Selat Bali (Priyono et al. 1992).
2.2.3. Total padatan tersuspensi (TSS)
melalui aliran sungai, ataupun dari udara dan perpindahan karena suspensi endapan akibat pengikisan (Permana et al. 1994 in Tarigan & Edwar 2003).
Menurut Sanusi (2006) sumber utama padatan tersuspensi di perairan laut adalah dari proses pelapukan batuan/rock weathering (aloton) yang ditransport melalui sungai dan udara serta berasal dari dalam laut itu sendiri (autoton). Dari hasil penelitian yang dilakukan oleh Tarigan & Edwar (2003) diketahui bahwa nilai kandungan TSS di wilayah Raha, Sulawesi Tenggara berkisar antara 74,9-78,9 ppm. Nilai ini tergolong tinggi akibat masih adanya pengaruh aliran sungai dan run off dari daratan.
2.3. Parameter Kimia Perairan 2.3.1. Salinitas
Salinitas didefinisikan sebagai jumlah total garam yang dinyatakan dalam gram yang terdapat dalam satu kilogram air laut (‰). Sebaran salinitas di permukaan air laut dipengaruhi oleh berbagai macam faktor seperti penguapan (evaporasi), curah hujan dan pembentukan atau pencairan es. Daerah yang mengalami penguapan cukup tinggi akan mengakibatkan salinitas perairan menjadi sangat tingggi pula. Salinitas air laut juga akan semakin tinggi dengan bertambahnya kedalaman. Nilai kisaran salinitas di perairan laut terbuka umumnya bervariasi antara 33-37 PSU (Ross 1970).
Nilai salinitas rata-rata tahunan di perairan Indonesia yang terendah sering di dijumpai pada perairan Indonesia bagian barat dan semakin ke timur nilai rata-rata tahunannya semakin meningkat. Hal ini disebabkan karena pengaruh massa air dengan salinitas tinggi dari Samudera Pasifik sepanjang tahun dan lebih sedikitnya pengaruh massa air daratan. Hal ini juga disebabkan karena sedikitnya jumlah sungai-sungai besar di Indonesia bagian timur dibandingkan dengan bagian barat (Wyrtki 1961).
sedangkan di bagian utara, adanya massa air yang datang dari mulut utara Selat Bali bersama-sama dengan massa air yang relatif tawar di pantai Bali yang berasal dari mulut sungai dari pulau Bali. Di bagian utara, salinitas permukaan berkisar antara 32,753-32,770 PSU, sedangkan di bagian selatan nilainya berkisar antara 32,888-33,068 PSU.
Selain suhu, salinitas pun dapat dijadikan sebagai indikator fenomena
upwelling di perairan. Saragih (2002) mengemukakan bahwa pada bulan Agustus
2000, di perairan Selat Bali bagian selatan terjadi upwelling. Hal ini ditunjukkan dengan adanya massa air dengan salinitas tinggi pada lapisan permukaan dibandingkan dengan lapisan dibawahnya yang diduga disebabkan adanya penaikan massa air di perairan sebelah selatan Selat Bali.
2.3.2. pH
Nilai pH digunakan untuk mengukur sifat asam dan basa suatu larutan
(solution). Semakin rendah nilai pH, maka akan semakin besar sifat asamnya, dan
sebaliknya semakin tinggi pH maka akan semakin besar nilai basanya. Suatu zat dikatakan asam apabila zat tersebut mengeluarkan (releasing) satu atau lebih proton, sementara dikatakan basa apabila zat tersebut mengikat (combining) satu atau lebih proton (Compton 1976 in Sanusi 2006). Menurut Langmuir (1997) menganalisis kandungan pH dalam suatu perairan sangatlah penting, hal ini diakibatkan karena: 1. Derajat keasaman suatu perairan menyebabkan peningkatan kapasitas untuk
merusak segala hal yang berhubungan dengan material geologi perairan.
2. Peningkatan konsentrasi pH suatu perairan meningkatkan daya larut dari zat-zat yang berbahaya seperti logam, korosif dan toksisitas yang dapat berdampak negatif terhadap biota perairan didalamnya.
Pada dasarnya, air laut memiliki kemampuan penyangga yang sangat besar untuk mencegah perubahan pH. Perubahan pH sedikit saja dari pH alami akan memberikan petunjuk terganggunya sistem penyangga. Hal ini dapat menimbulkan perubahan dan ketidakseimbangan kadar CO2 yang dapat membahayakan kehidupan
biota laut. Derajat keasaman (pH) air laut permukaan di Indonesia umumnya bervariasi dari lokasi ke lokasi dengan kisaran nilai sebesar 6,0-8,5. Perubahan pH dapat mempunyai akibat buruk terhadap kehidupan biota laut, baik secara langsung maupun tidak langsung (Romimohtarto 1991 in Anwar 2008).
2.3.3. Oksigen terlarut (DO)
Oksigen atau O2 merupakan salah satu gas yang terlarut di perairan. Kadar
kelarutan oksigen ini bervariasi tergantung pada suhu, salinitas, turbulensi air, dan tekanan atmosfer. Semakin besar suhu dan ketinggian serta semakin kecil tekanan atmosfer maka kadar oksigen terlarut akan semakin kecil (Jeffris et al. in Effendi 2003). Sverdrup et al. (1946) menyatakan bahwa konsentrasi oksigen terlarut relatif lebih tinggi di lapisan permukaan karena adanya penambahan oksigen melalui proses fotosintesis dan difusi udara.
berkaitan dengan penetrasi cahaya yang masuk ke badan perairan yang menjadi sumber utama bagi fitoplankton untuk melakukan fotosintesis dalam hubungannya dengan produktivitas primer di perairan.
Dalam keadaan normal dan tidak tercemar oleh senyawa beracun (toksik) kandungan oksigen terlarut minimum adalah sebesar 2 ppm. Kandungan oksigen terlarut ini sudah cukup untuk mendukung kehidupan organisme akuatik di dalamnya, sedangkan idealnya kandungan oksigen terlarut tidak kurang dari 1,7 ppm selama waktu 8 jam dengan sedikitnya pada tingkat kejenuhan sebesar 70 % (Swingle 1968 in Salmin 2005). Kadar oksigen terlarut dapat dijadikan ukuran untuk menentukan mutu air. Kehidupan organisme akuatik dapat bertahan jika ada kandungan oksigen terlarut minimum sebanyak 5 mg/L selebihnya tergantung kepada ketahanan organisme, derajat aktivitas, kehadiran pencemar, suhu air, dan sebagainya (Anwar 2008).
Oksigen memegang peranan penting sebagai indikator kualitas perairan karena oksigen terlarut berperan dalam proses oksidasi dan reduksi bahan organik maupun anorganik. Pada kondisi aerobik, peranan oksigen adalah untuk mengoksidasi bahan organik dan anorganik, sedangkan pada kondisi anaerobik, oksigen yang dihasilkan akan mereduksi senyawa-senyawa kimia menjadi lebih sederhana dalam bentuk nutrien dan gas. Kramer (1987) menjelaskan bahwa konsentrasi oksigen terlarut di dalam air merupakan salah satu faktor pembatas bagi organisme akuatik khususnya ikan.
dari udara dan sebagian lagi yang tak kurang pentingnya ialah besarnya sumbangan oksigen sebagai hasil fotosintesis dari fitoplankton.
2.3.4. Biocemical Oxygen Demand (BOD)
Kebutuhan oksigen biologi (BOD) didefinisikan sebagai banyaknya oksigen terlarut yang dibutuhkan oleh organisme pada saat pemecahan bahan organik pada kondisi aerobik. Pemecahan bahan organik diartikan bahwa bahan organik ini digunakan oleh organisme sebagai bahan makanan dan energinya diperoleh dari proses oksidasi. Secara umum parameter BOD banyak digunakan untuk menentukan tingkat pencamaran air buangan. Penentuan BOD sangat penting untuk menelusuri aliran pencemar dari tingkat hulu ke muara (Salmin 2005).
Penguraian bahan organik secara biologis di alam, banyak melibatkan bermacam-macam organisme dan menyangkut reaksi oksidasi dengan hasil akhir karbondioksida (CO2) dan air (H2O). Penentuan kandungan BOD dapat dianggap
sebagai suatu prosedur oksidasi. Organisme hidup bertindak sebagai medium untuk menguraikan bahan organik bahan organik menjadi CO2 dan H2O. Reaksi oksidasi
selama proses analisis merupakan hasil aktivitas biologis dengan kecepatan reaksi yang berlangsung sangat dipengaruhi oleh jumlah populasi dan suhu. Oleh karena itu pada analisis kandungan BOD, suhu diusahakan konstan pada suhu 20 °C. Menurut Salmin (2005), suatu perairan yang tingkat pencemarannya rendah dan bisa dikategorikan sebagai perairan yang baik kadar BOD berada pada kisaran 0-10 ppm.
pergerakan molekul dan tubrukan semakin banyak, maka beberapa ikatan kimia semakin lama akan semakin labil terhadap serangan oksigen sehingga terjadi proses oksidasi.
2.3.5. Amonia
Parameter kimia perairan yang bersifat toxic diantaranya adalah amonia. Sumber amonia di perairan adalah hasil pemecahan nitrogen anorganik yang terdapat di dalam tanah dan air yang berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah lama mati) oleh mikroba dan jamur yang dikenal istilah amonifikasi. Kadar amonia bebas lebih dari 0,2 mg/L bersifat toksik bagi beberapa jenis ikan. Selain itu, kadar amonia yang tinggi merupakan salah satu indikasi adanya pencemaran bahan organik yang berasal dari limbah domestik, industri, dan run off pupuk pertanian (Effendi 2003).
Amonia dapat bersifat toksik bagi biota perairan karena mengganggu proses pengikatan oksigen oleh darah. Handy & Poxton (1993) menyatakan bahwa amonia yang tidak terionisasi bersifat akut pada organisme perairan dan tingkat keracunannya sangat tergantung pada salinitas, suhu, pH, sementara nitrat dan nitrit secara signifikan tidak bersifat toksik bagi ikan, akan tetapi sebagai penyebab terjadinya blooming alga perairan. Begitu kadar amonia meningkat dalam air, eksresi amonia oleh ikan akan menurun dan kadar amonia dalam darah dan jaringan meningkat. Hal ini akan berdampak pada semakin tingginya nilai pH darah dan berpengaruh buruk terhadap reaksi katalis enzim dan stabilitas membran. Amonia juga meningkatkan konsumsi oksigen oleh jaringan, merusak insang, dan mengurangi kemampuan darah untuk mengikat oksigen. Perubahan histologi yang terjadi dalam ginjal, empedu, kelenjar tiroid dan darah ikan yang terkena konsentrasi
sublethal amonia.
2.3.6. Nitrat
yang selanjutnya disebut sebagai nutrien atau zat hara. Nitrat adalah senyawa nutrien yang merupakan hasil akhir dari oksidasi nitrogen. Nitrat merupakan senyawa nitrogen yang paling stabil dengan adanya oksigen bebas yang cukup dalam laut. Di beberapa perairan laut, nitrat digambarkan sebagai senyawa mikroprotein pengontrol produktivitas primer di lapisan permukaan daerah eufotik. Kadar nitrat di daerah eufotik sangat dipengaruhi oleh transportasi nitrat ke daerah tersebut dan mengambil nitrat untuk produktivitas primer. Bila intensitas cahaya yang masuk ke dalam kolom air cukup, maka kecepatan pengambilan nitrat lebih cepat dari proses transportasi nitrat ke lapisan permukaan (Grasshoff 1976).
Nitrat adalah bentuk nitrogen utama di perairan alami. Nitrat merupakan salah satu nutrien senyawa yang penting dalam sintesa protein hewan dan tmbuhan. Konsentrasi nitrat yang tinggi diperairan dapat menstimulasi pertumbuhan dan perkembangan organisme perairan apabila didukung oleh ketersediaan nutrien. Menurut Anwar (2008), kisaran nilai nitrat dapat diakibatkan oleh letaknya secara geografis. Kandungan nitrat akan akan semakin tinggi dari laut lepas ke arah dekat dengan pantai yang memiliki kedalaman perairan yang lebih rendah dibanding di tengah laut. Aktivitas di dermaga maupun pemukiman warga dapat mengakibatkan nilai yang diamati di dekat dengan daratan akan semakin tinggi, hal ini berkaitan dengan penguraian dan nitrifikasi akibat input dari sungai. Nitrat merupakan faktor pembatas bagi produktivitas di laut. Jika kandungan nitrat lebih dari 0,1 mg/L masih dapat digunakan untuk pertumbuhan fitoplankton (Mackenthum 1969 in Anwar 2008)
2.3.7. Fosfat
Selain nitrat dan amonia, fosfat merupakan senyawa nutrien yang penting untuk menggambarkan karakteristik suatu perairan. Senyawa ini diabsorpsi oleh fitoplankton dan selanjutnya masuk ke dalam rantai makanan. Fosfat anorganik di laut biasanya dalam bentuk asam orthofosfat (H3PO4) dan polifosfat trifosfat dan
pirofosfat), sedangkan yang berada dalam bentuk senyawa organik terdiri dari gula fosfat dan hasil oksidasi (nukleoprotein dan fosfoprotein). Secara umum konsentrasi fosfat akan meningkat dengan bertambahnya kedalaman. Hal ini sebagai mana dinyatakan oleh Saragih (2002) yang melakukan penelitian di wilayah perairan Selat Bali pada bulan Agustus 2000 yang menjelaskan bahwa kadar fosfat pada lapisan permukaan berkisar antara 0,076-0,564 µg/L yang selanjutnya meningkat hingga kedalaman 150 meter menjadi berkisar antara 0,224-0,715 µg/L.
Secara spasial kandungan dari fosfat akan semakin meningkat dari laut lepas ke arah pantai. Koreleff (1976) in Saragih (2002) menjelaskan bahwa tingginya kadar fosfat di daerah dekat dengan pantai atau muara disebabkan karena masuknya limbah domestik dari daratan yang mencemari perairan.
2.3.8. Raksa (Hg)
Logam berat seperti raksa, timah, tembaga, kadmium, dan lain sebagainya merupakan bahan yang beracun pada sel atau organisme tertentu walaupun berada dalam konsentrasi yang relatif rendah. Logam berat adalah unsur yang mempunyai densitas lebih besar dari 5 gram/cm3. Beberapa macam logam berat sangat beracun terhadap tumbuhan hewan termasuk ikan dan manusia, serta keracunannya sangat tahan dalam jangka waktu yang lama. Unsur logam berat ada yang bersifat esensial dan nonesensial, dalam jumlah yang berlebihan logam nonesensial akan bersifat racun bagi organisme hidup. Daya racun logam berat tergantung pada jenis, kadar, efek sinergis-antagonis, dan bentuk fisika kimianya (Bahri 2003).
Menurut Razak (1980) dalam perairan, logam berat dapat ditemukan dalam bentuk terlarut dan tidak terlarut. Logam berat terlarut adalah logam yang membentuk komplek dengan senyawa organik dan anorganik, sedangkan logam berat yang tidak terlarut merupakan partikel-partikel yang berbentuk koloid dan senyawa kelompok metal yang teradsorbsi pada partikel-partikel yang tersuspensi. Unsur-unsur logam berat biasanya erat kaitannya dengan masalah pencemaran dan toksisitas. Pencemaran yang dapat menghancurkan lingkungan hidup biasanya berasal dari limbah-limbah yang sangat berbahaya (memiliki tingkat toksisitas tinggi). Limbah industri merupakan salah satu sumber pencemar logam berat yang potensial bagi perairan. Pembuangan limbah industri secara terus menerus tidak hanya mencemari lingkungan perairan tetapi menyebabkan terkumpulnya logam berat dalam sedimen maupun biota perairan.
0,00015 ppm, sedangkan pengamatan organisme laut kadar maksimum Hg untuk batas aman bagi biota perairan adalah sebesar 0,002 ppm. Pada umumnya kandungan Hg pada air laut berkisar antara (0,03-5,00 ppb).
2.3.9. Kadmium (Cd)
Kadmium (Cd) adalah salah satu logam berat dengan penyebaran yang sangat luas di alam. Kadmium bernomor atom 48, berat atom 112,40 dengan titik cair 321 °C dan titik didih 765 °C. Menurut Clark & Hill (1986) sumber kadmium yang masuk ke perairan berasal dari :
1. Uap, debu, dan limbah dari pertambangan timah dan seng 2. Air bilasan elektroplating
3. Besi, tembaga dan industri logam
4. Seng yang digunakan untuk melapisi logam (0,2 % Cd) 5. Pupuk fosfat dan endapan sampah
Kadar kadmium (Cd) pada perairan tawar alami berkisar antara 0,0001-0,01 mg/L, sedangkan pada perairan laut sebesar 0,0001 mg/L. Untuk melindungi kehidupan organisme akuatik, kandungan kadmium dalam perairan tidak lebih dari 0,0002 mg/L. Kadmium tergolong logam berat dan memiliki afinitas yang tinggi terhadap grup sulfhidrid daripada enzim dan meningkat kelarutannya dalam lemak. Perairan alami yang bersifat basa, kadmium mengalami hidrolisis, teradbsorpsi oleh padatan tersuspensi dan membentuk ikatan kompleks dengan bahan organik. Kadmium pada perairan alami membentuk ikatan kompleks dengan ligan baik organik maupun inorganik yang memiliki tingkat kelarutan yang berbeda (Sanusi 2006). Dalam biota perairan jumlah logam yang terakumulasi akan terus mengalami peningkatan (biomagnifikasi) dan dalam rantai makanan biota yang tertinggi akan mengalami akumulasi Cd yang lebih banyak (Palar 2004).
2.3.10. Tembaga (Cu)
2003). Mukhtasor (2007) menyatakan bahwa kandungan Cu di wilayah samudera sekitar 1 mg/L, akan tetapi di perairan yang tercemar dapat mencapai 11 mg/L. Kandungan tembaga di perairan dapat berasal dari buangan limbah industri dan dari atmosfer yang tercemar oleh asap pabrik tembaga, pelapisan logam, tekstil, serta dari pengecatananti foulling pada kapal.
Di perairan alami, tembaga (Cu) terdapat dalam bentuk partikulat, koloid dan terlarut. Fase terlarut merupakan Cu2+ bebas dan ikatan kompleks, baik dengan ligan inorganik (CuOH+, Cu2(OH)22+) maupun organik. Selain dengan ligan OH-,
Cu membentuk ikatan kompleks dengan ligan inorganik lainnya yaitu dengan: karbonat (CO32-), nitrat (NO3-), fosfat (HPO42-), sulfat (SO42-), sulfida (SH-),
klorida(Cl-) dan amonia (NH3) yang bersifat basa dengan stabilitas berbeda-beda.
Ikatan Cu kompleks dengan amonia dan sulfida tergolong stabil (Sanusi 2006).
2.3.11. Timbal (Pb)
Konsentrasi Timbal atau Pb di perairan dapat bersumber baik dari aktivitas manusia maupun akibat fenomena alami. Logam ini masuk ke perairan melalui pengkristalan Pb di udara dengan bantuan air hujan. Selain itu, proses korosifikasi dari batuan mineral akibat hempasan gelombang dan angin juga merupakan salah satu jalur sumber Pb yang dapat masuk ke perairan (Palar 2004). Menurut Darmono (1995) logam berat Pb banyak dihasilkan dari pabrik pembuatan baterai, industri percetakan, alat listrik, pelapis logam (anti karat), industri kimia dan pabrik cat.
Kandungan normal Pb di laut adalah sebesar 0,00003 ppm, sedangkan pengamatan terhadap organisme laut konsentrasi Pb pada air laut tidak melebihi dari 0,01 ppm. Konsentrasi Pb sebesar 0,05 ppm dapat menimbulkan bahaya pada lingkungan laut (Waldichuk 1974 in Bahri 2003). Selain Hg, Pb merupakan salah satu logam yang sifatnya mengendap di perairan. Pengendapan logam berat di suatu perairan dapat terjadi karena adanya senyawa H2S pada perairan yang tercemar
3. METODE PENELITIAN
3.1. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan selama 9 hari, dimulai pada tanggal 19 Maret hingga 27 Maret 2011. Seluruh kegiatan pengambilan sampel air dilakukan dengan menggunakan kapal riset Baruna Jaya VIII milik PUSLIT Oseanografi LIPI. Titik pengambilan sampel air dilakukan pada posisi lintang antara 8,39-9,08 °LS dan posisi bujur antara 114,14-115,39 °BT.
Stasiun pengamatan dalam pengambilan sampel air dalam pendugaan kualitas perairan Selat Bali terdiri 9 titik pengamatan yang melintang dari wilayah Grajagan, Jawa Timur sampai Jimbaran, Bali yang disesuaikan dengan rute pelayaran kapal Baruna Jaya VIII. Letak koordinat, waktu pengambilan sampel dan kedalaman perairan tiap stasiun dapat dilihat pada Lampiran 4. Peta lokasi penelitian di perairan Selat Bali dapat dilihat pada Gambar 2. Pengambilan sampel air dilakukan pada kedalaman yang berbeda, hal ini bertujuan untuk mengetahui perbedaan karakteristik perairan pada beberapa kolom perairan (permukaan, termoklin, dan dekat dasar perairan).
3.2. Alat dan Bahan
Alat dan bahan yang digunakan selama penelitian meliputi alat dan bahan yang digunakan dalam proses pengambilan air sampel dan analisis parameter kualitas perairan (fisika kimia). Alat dan metode yang digunakan dalam analisis kualitas perairan parameter fisika kimia perairan dapat dilihat pada Tabel 2.
Tabel 2. Alat/metode yang digunakan dalam analisis parameter kualitas air
Parameter Satuan Alat/metode Keterangan
a. Fisika
1. Suhu °C CTD In-situ
2. Kekeruhan NTU Spektrofotometer Ex-situ
3. TSS mg/L Gravimetri Ex-situ
b. Kimia
1. pH - pH meter In-situ
2. Salinitas PSU Salinometer In-situ
3. DO mg/L DO meter In-situ
4. BOD mg/L Titrasi Winkler In-situ
5. Amonia mg/L Spektrofotometer Ex-situ
6. Nitrat mg/L Spektrofotometer Ex-situ
7. Fosfat mg/L Spektrofotometer Ex-situ
8. Raksa mg/L AAS Ex-situ
9. Kadmium mg/L AAS Ex-situ
10. Tembaga mg/L AAS Ex-situ
11. Timbal mg/L AAS Ex-situ
Mengacu pada: Eaton et al. 2005
Alat yang digunakan dalam proses pengambilan air sampel adalah Rossete
Water Sampler yang terdiri dari 10 tabung niskin dan tiap tabung memiliki kapasitas
sebesar 10 liter. Bersamaan dengan Rossete Water Sampler, CTD (Conductivity
Temperature Depth) beserta alat yang digunakan untuk keperluan pengambilan data
in-situ seperti pHmeter, salinometer dan DOmeter dirangkai dalam satu unit
(lampiran 1).
3.3. Pengumpulan Data
nutrien dan logam terlarut dilakukan analisis di Laboratorium Fisika-Kimia Perairan, bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Pengukuran parameter seperti kedalaman dan suhu dilakukan dengan menggunakan CTD (Conductivity Temperature Depth). Kedalaman selama penelitian sangat bervariasi, kedalaman yang paling dangkal yaitu 29,4 m dan yang paling dalam mencapai 2.549 m. CTD memiliki tiga sensor utama yaitu sensor konduktivitas listrik, sensor suhu, dan sensor tekanan. Prinsip pengoperasian CTD ini adalah dengan menurunkannya ke perairan dan secara kontinu CTD akan mengambil data numerik tiap satu meter kedalaman yang dihubungkan langsung ke ruang kontrol atau ruang operasi CTD. Dalam ruangan ini, CTD dikontrol dan dikendalikan dengan perangkat komputer. Pada pengukuran pH, pHmeter yang digunakan hanya mampu mengukur hingga kedalaman kurang dari 1.000 meter, maka ketika pengambilan sampel air pada stasiun yang memiliki kedalaman lebih dari 1.000 meter, pHmeter tidak dipasang.
Pengambilan sampel air untuk kebutuhan analisis lab dilakukan dengan mengggunakan tabung Niskin. Contoh air laut yang diambil berdasarkan 3 kolom perairan, yaitu lapisan permukaan, lapisan termoklin, dan lapisan dekat dasar perairan.
Pengambilan sampel air pada lapisan permukaan dilakukan pada kedalaman 5-10 m. Secara otomatis Rossete Water Sampler dapat dikontrol untuk dibuka dan ditutup dari ruang kontrol untuk keperluan pengambilan air sampel. Penentuan lapisan termoklin perairan dapat terlihat dari adanya perubahan suhu yang drastis. Ketika CTD diturunkan ke perairan, data parameter seperti kedalaman, temperatur, salinitas, pH, dan DO dapat langsung terbaca dalam bentuk grafik pada layar monitor dari ruang kontrol yang menghubungkan perangkat komputer dengan CTD yang diturunkan ke perairan. Ketika monitor pengamatan terlihat perbedaan suhu yang signifikan, maka satu unit tabung niskin diberhentikan untuk proses pengambilan sampel air. Setelah itu, tabung Niskin ditutup dan Rossette Water
Sampler diturunkan kembali ke dasar perairan untuk mengambil contoh air pada
berbeda ini bertujuan untuk mengetahui karakteristik kualitas air pada masing-masing kolom perairan.
Pengambilan sampel air untuk keperluan analisis ex-situ, dengan memindahkan air sampel dari tabung Niskin ke dalam botol sampel polyethylene
beserta pengawetnya yang disesuaikan untuk keperluan analisis tertentu (Lampiran 2). Botol yang diberi label biru yang memiliki kapasitas satu liter digunakan untuk keperluan analisis parameter fisika seperti kekeruhan dan TSS. Botol biru ini tidak menggunakan pengawet apapun untuk keperluan analisis. Botol polyethylene yang diberi label warna merah muda memiliki kapasitas sebesar 500 ml digunakan untuk keperluan analisis parameter logam terlarut, seperti Hg, Pb, Cd, dan Cu diberi pengawet berupa HNO3, sedangkan untuk keperluan analisis parameter seperti total
P, NH3, dan NO2 digunakan botol polyethylene 500 ml yang diberi label warna
jingga dengan bahan pengawet H2SO4. Botol BOD yang terbuat dari gelas bening
yang memiliki kapasitas sebesar 125 ml digunakan untuk inkubasi. Beberapa sampel untuk analisis parameter seperti BOD, nitrat, amonia dan fosfat disimpan pada suhu 4 °C. Pengawetan atau penanganan sampel mengacu pada APHA (2005). Parameter fisika-kimia yang diamati dan alat/metode analisisnya selengkapnya disajikan pada Tabel 2.
3.4. Analisis Data
Data yang diperoleh terlebih dahulu dikelompokkan ke dalam parameter dan stasiunnya masing-masing. Kemudian dalam menganalisis data, hasil pengolahan lebih lanjut ditampikan dalam bentuk grafik sehingga perbedaan mengenai karakteristik fisika dan kimia perairan dapat terlihat.
3.4.1. Sebaran menegak
Profil ini dapat digunakan untuk melihat kedalaman, sebaran maksimum dan minimum nilai parameter fisika kimia pada kedalaman tiap stasiun serta pola distribusi secara vertikal parameter-parameter tersebut.
3.4.2. Sebaran melintang
Sebaran melintang dibuat untuk mengetahui perbedaan secara spasial karakteristik fisika-kimia perairan berdasarkan tiga lapisan perairan, yaitu lapisan permukaan, termoklin, dan dekat dasar perairan (Lampiran 5). Lapisan termoklin tiap stasiun berada pada kedalaman yang berbeda. Penentuan lapisan termoklin dilihat dari perbedaan suhu yang signifikan yang dapat terlihat pada saat CTD diturunkan yang dikendalikan dengan komputer yang mengukur kedalaman, suhu, salinitas, DO secara kontinu tiap satu meter. Nilai dari parameter fisika-kimia perairan yang ditampilkan pada sebaran melintang dapat melihat kisaran maksimum dan minimum pada titik stasiun yang telah ditentukan serta melihat perbedaan antara stasiun yang relatif dekat dengan daratan sampai ke laut lepas. Sebaran melintang diolah dan disajikan dengan menggunakan software ODV (Ocean Data View) versi 3.0.1-2005. Pola sebaran warna yang ditampilkan dalam ODV didasarkan atas data parameter fisika-kimia perairan di setiap stasiun yang dianalisis dan pendekatan interpolasi pada wilayah diluar stasiun pengamatan.
3.4.3. Penentuan status mutu air dengan Metode Storet
Metode Storet merupakan metode yang umum digunakan untuk menentukan status mutu perairan. Secara prinsip, Metode Storet membandingkan data kualitas perairan dengan baku mutu air yang disesuaikan dengan peruntukannya. Penelitian analisis kualitas perairan ini disesuaikan dengan Kepmen-LH nomor 51 tahun 2004 tentang baku mutu air laut untuk biota perairan (Lampiran 3).
Cara menentukan status mutu air adalah dengan menggunakan sistem nilai dari US-EPA (United States Enviromental Protection Agency) dengan mengklasifikasikan air ke dalam 4 kelas, yaitu:
1. Kelas A : baik sekali, skor = 0 memenuhi baku mutu
3. Kelas C : sedang, skor = -11 s/d -30 tercemar sedang 4. Kelas D : buruk, skor ≥ -31 tercemar berat
Prosedur penggunaan: data pengamatan mengenai kualitas air dibandingkan dengan baku mutu yang sesuai dengan kelas air. Jika hasil pengukuran memenuhi
baku mutu air (hasil pengukuran ≤ baku mutu) maka diberi skor 0. Jika hasil pengukuran tidak memenuhi baku mutu air (hasil pengukuran > baku mutu) maka diberi skor seperti pada Tabel 3. Jumlah negatif dari seluruh parameter dihitung dan ditentukan status mutunya dari jumlah skor yang di dapat dengan menggunakan sistem nilai (lampiran 6).
Tabel 3. Penentuan sistem nilai untuk menentukan status mutu air pada Indeks Storet berdasarkan Kepmen-LH No.115 tahun 2003
Untuk penentuan indeks storet ini, data dikelompokkan menjadi tiga kelompok data, yakni:
1. Kelompok I yang terdiri dari stasiun 1 dan 2 2. Kelompok II yang terdiri dari stasiun 3, 4, dan 5 3. Kelompok III yang terdiri dari stasiun 6,7, dan 8
Pengelompokkan stasiun ini bertujuan untuk membandingkan status mutu perairan dari stasiun yang relatif dekat pantai dan stasiun yang berada jauh dari pantai.
3.4.4. Penentuan status mutu air dengan Indeks Pencemaran
Indeks Pencemaran (IP) dapat memberi masukan pada pengambilan keputusan agar dapat menilai kualitas perairan untuk suatu peruntukan serta melakukan tindakan untuk memperbaiki kualitas jika terjadi penurunan kualitas akibat kehadiran senyawa pencemar.
Jika Lij menyatakan konsentrasi parameter kualitas air yang dicantumkan
dalam baku mutu peruntukan air (j) (Lampiran 3) dan Ci menyatakan konsentrasi
parameter kualitas air (i) yang diperoleh dari hasil analisis, maka Pij adalah Indeks
Pencemaran bagi peruntukan (j) yang merupakan fungsi dari Ci/Lij. Pij ditentukan
dengan cara:
1. Memilih parameter yang terdapat dalam baku mutu
2. Menghitung nilai dari Ci/Lij untuk tiap parameter pada setiap stasiun.
3. a). Jika nilai konsentrasi yang menurun menyatakan tingkat pencemaran meningkat (misalkan DO), maka penentuan nilai maksimum Cim (misalkan
untuk DO, maka Cim merupakan nilai DO jenuh). Dalam kasus ini nilai Ci/Lij
hasil pengukuran digantikan oleh nilai Ci/Lij hasil perhitungan,yaitu:
b). Jika nilai baku mutu Lij memiliki rentang,
- untuk Ci≤ Lij rata-rata
- untuk Ci > Lij rata-rata
c). Jika dua nilai (Ci/Lij) berdekatan dengan nilai acuan 1,0. Misalkan
(C1/L1j)= 0,9 dan (C2/L2j) = 1,1 atau perbedaan yang sangat besar, misalkan
(C3/L3j) = 5,0 dan (C4/L4j) = 10,0. Dalam contoh ini tingkat kerusakan badan
air sulit untuk ditentukan. Cara untuk mengatasinya adalah:
- Penggunaan nilai (Ci/Lij) hasil pengukuran jika nilai ini < 1,0 maka nilai
- Jika hasil (Ci/Lij) hasil pengukuran > 1,0 maka nilai (Ci/Lij) baru dapat diperoleh
dari:
P adalah konstanta dan nilainya ditentukan dengan bebas dan disesuaikan dengan hasil pengamatan lingkungan dan atau persyaratan yang dikehendaki untuk suatu peruntukan (biasanya digunakan nilai 5).
4. Menentukan nilai rata-rata dan nilai maksimum dari keseluruhan Ci/Lij ((Ci/Lij)R
dan (Ci/Lij)M).
5. Sehingga nilai dari Indeks Pencemaran dapat diketahui dari persamaan:
√
Dari hasil perhitungan nilai Indeks Pencemaran, besarnya nilai atau skor menggambarkan kondisi kualitas perairan sesuai dengan kriteria pada Tabel 4. berikut.
Tabel 4. Penentuan status mutu air berdasarkan Indeks Pencemaran
Skor Kriteria
0,0 ≤ PIj≤ 1,0 Kondisi baik
1,0 < PIj≤ 5,0 Tercemar ringan
5,0 < PIj≤ 10 Tercemar sedang
4. HASIL DAN PEMBAHASAN
4.1. Parameter Fisika Perairan 4.1.1. Suhu
Sebaran menegak suhu di perairan bagian selatan Selat Bali pada bulan Maret 2011 pada masing-masing stasiun pengamatan dapat dilihat pada Gambar 4. Setiap stasiun pengamatan memiliki kedalaman yang bervariasi mulai dari kedalaman 29,4 m hingga 2.549 m. Pengelompokkan stasiun pada Gambar 4 berdasarkan kedalaman maksimum tiap staiun. Grafik pertama, pengelompokkan berdasarkan kedalaman stasiun yang kurang dari 100 meter. Grafik kedua adalah stasiun yang memiliki kedalaman antara 100-1.000 m. Sedangkan grafik ketiga adalah pengelompokan stasiun yang memiliki kedalaman lebih dari 1.000 m. Pada Gambar 4 terlihat bahwa secara umum nilai suhu pada semua stasiun pengamatan akan semakin menurun seiring bertambahnya kedalaman perairan.
Pada lapisan permukaan, terlihat bahwa kisaran nilai suhu pada semua stasiun relatif sama yaitu berkisar antara 28-30 °C. Di bawah lapisan permukaan, terdapat lapisan termoklin yang dapat terlihat dari adanya perubahan suhu yang drastis pada kolom perairan. Kedalaman lapisan termoklin pada tiap stasiun berbeda antara satu stasiun dengan stasiun lainnya. Pada stasiun 1, lapisan termoklin terbentuk pada kedalaman 10 m, sedangkan pada stasiun 2 sampai stasiun 9 secara berturut-turut kedalaman lapisan termoklin adalah 80 m, 70 m, 80 m, 80 m, 100 m, 110 m, 120 m dan 14 m.
120 meter (Wyrtki 1961). Hal ini sesuai dengan data pengamatan pada stasiun 6,7, dan 8 yang memiliki kedalaman lebih dari 1.000 meter pada wilayah selatan Selat Bali yang berbatasan dengan Samudera Hindia, lapisan termoklin teramati berada pada kolom perairan dengan kedalaman antara 100-120 meter.
Gambar 4. Sebaran menegak suhu tiap stasiun di perairan Selat Bali pada bulan Maret 2011
tenggara berhembus sepanjang bulan Mei sampai November. Angin musim tenggara ini mencapai puncaknya pada bulan Juni sampai Agustus dan disebut sebagai musim timur karena angin bertiup dari arah timur ke barat. Pada bulan Desember sampai April dipengaruhi oleh angin musim dari Barat Laut dan mencapai puncaknya pada bulan Desember sampai Februari yang dikenal sebagai musim barat karena angin berhembus dari barat ke timur. Bulan Maret-Mei dan September-November disebut sebagai musim pancaroba atau musim peralihan karena angin yang berhembus pada bulan tersebut tidak beraturan. Pada setiap awal periode masa peralihan ini, pengaruh angin musim sebelumnya masih sangat kuat (Nontji 1987).
Penelitian dilakukan pada bulan Maret 2011 yang merupakan musim peralihan I dimana proses penaikan air pada musim ini tidak terjadi, hal ini ditunjukkan dengan tidak ditemukannya suhu permukaan yang lebih rendah dibanding suhu yang berada di kolom perairan di bawahnya. Hal ini mengindikasikan tidak terjadinya proses upwelling pada saat proses pengambilan data. Pada saat musim timur, perairan Selat Bali dikatakan cukup subur, hal ini diakibatkan proses upwelling atau kenaikan massa air yang lebih rendah ke atas permukaan air laut (Illahude 1974). Naiknya massa air yang cenderung relatif lebih rendah ini diikuti oleh tingginya kandungan unsur hara seperti nitrat dan fosfat yang memicu tingginya perkembangan fitoplankton dan produktivitas perairan.
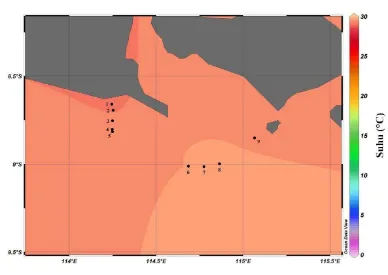
Gambar 5. Sebaran melintang suhu lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
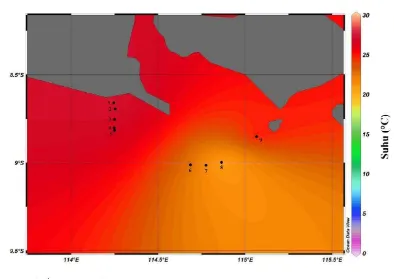
Gambar 6. Sebaran melintang suhu lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
stasiun 9 dengan kedalaman termoklin sebesar 14 meter, suhu perairan pada lapisan ini relatif menjadi lebih hangat yaitu sebesar 29 °C.
Gambar 7. Sebaran melintang suhu lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
4.1.2. Kekeruhan
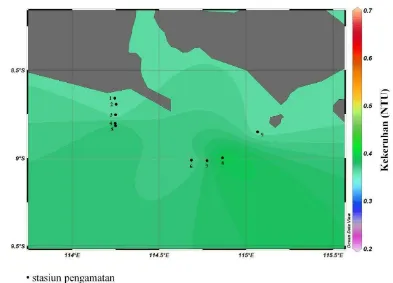
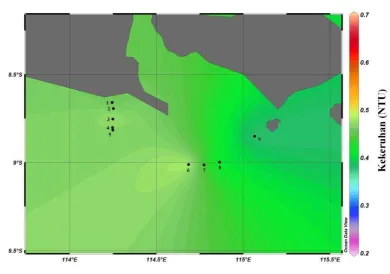
Hasil analisis yang dilakukan terhadap parameter kekeruhan, sebaran melintang pada tiap stasiun pada lapisan permukaan, lapisan termoklin, dan lapisan dekat dasar perairan dapat dilihat pada Gambar 8, 9 dan 10. Secara keseluruhan nilai kekeruhan yang teramati baik pada lapisan permukaan, termoklin maupun dekat dasar perairan nilainya berkisar antara 0,2-0,7 NTU. Pada lapisan permukaan, nilai kekeruhan cenderung lebih tinggi pada wilayah sebelah barat dan semakin tinggi ke arah timur. Hal ini ditunjukkan dengan perbedaan gradien warna pada gambar 8. Pada lapisan termoklin, nilai kekeruhan yang teramati berkisar antara 0,4-0,5 NTU. Pada dasar perairan kisaran nilai dari parameter kekeruhan yang teramati lebih besar dibanding lapisan permukaan dan termoklin (0,4-0,6 NTU).
Gambar 8. Sebaran melintang kekeruhan lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
yang relatif dekat dengan daratan dibanding dengan stasiun 6-8 yang berada di laut lepas menyebabkan pengaruh dari daratan lebih besar. Hal ini sesuai dengan pernyataan Anwar (2008) yang menyatakan bahwa secara spasial nilai kekeruhan akan semakin meningkat ke arah estuari atau daratan yang diakibatkan masih adanya pengaruh air limpasan dari darat (run off).
Gambar 9. Sebaran melintang kekeruhan lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
Gambar 10. Sebaran melintang kekeruhan pada lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
Secara keseluruhan baik pada lapisan permukaan, termoklin maupun dekat dasar, nilai kekeruhan di perairan selatan Selat Bali sangat kecil terutama pada stasiun 6,7 dan 8 yang berbatasan dengan Samudera Hindia di bagian selatan. Di wilayah laut lepas, nilai kekeruhan suatu perairan relatif rendah dan konstan. Menurut Priyono et al. (1992) rendahnya nilai kekeruhan di perairan Selat Bali disebabkan rendahnya masukan dari daratan yang ditandai dengan sedikitnya jumlah sungai yang bermuara ke Selat Bali.
4.1.3 Total padatan tersuspensi (TSS)
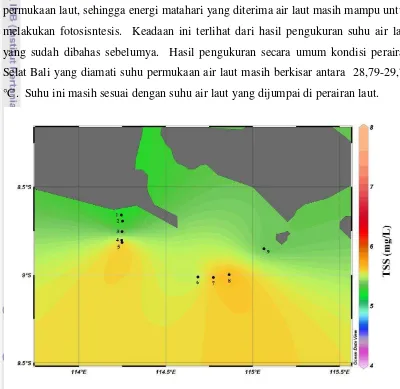
Hasil pengukuran kandungan zat padat tersuspensi di perairan Selat Bali pada lapisan permukaan, termoklin, dan dekat dasar perairan disajikan pada Gambar 11, 12 dan 13. Secara keseluruhan nilai TSS yang diamati baik pada lapisan permukaan, termoklin, maupun dekat dasar perairan nilai rata-ratanya sebesar 6,07 mg/L.
Pada lapisan permukaan nilai TSS berada pada kisaran 5-7 mg/L. Pada stasiun 1-5 yang terletak pada 114-114,5 °BT nilai TSS berada pada rentan 5-6 mg/L. Nilai yang lebih tinggi terlihat pada gambar dengan perubahan warna hijau ke jingga tua pada stasiun 6-8 yang berada pada 114,5-115 °BT dengan nilai 6-7 mg/L. Menurut Tarigan & Edward (2003), pengaruh padatan tersuspensi sangat beragam tergantung pada sifat kimia alamiah bahan tersuspensi tersebut, khususnya bahan toksik. Kandungan zat padat tersuspensi yang tinggi banyak mengurangi penetrasi cahaya matahari ke dalam laut sehingga panas yang diterima air laut permukaan tidak cukup efektif untuk proses fotosintesis. Namun tampaknya kandungan zat padat tersuspensi belum menyebabkan terhalangnya transfer energi dari matahari ke permukaan laut, sehingga energi matahari yang diterima air laut masih mampu untuk melakukan fotosisntesis. Keadaan ini terlihat dari hasil pengukuran suhu air laut yang sudah dibahas sebelumya. Hasil pengukuran secara umum kondisi perairan Selat Bali yang diamati suhu permukaan air laut masih berkisar antara 28,79-29,73 °C. Suhu ini masih sesuai dengan suhu air laut yang dijumpai di perairan laut.
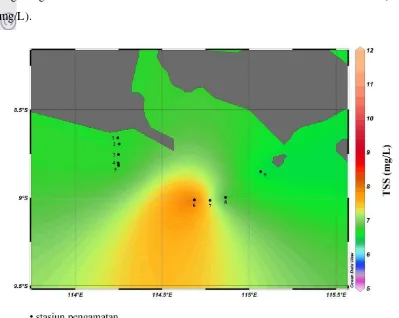
Gradasi warna dari hijau ke jingga tua pada Gambar 12 memperlihatkan bahwa kandungan TSS pada lapisan termoklin di Selat Bali berkisar antara 4-7 mg/L. Pada stasiun 6-8 yang yang memiliki kedalaman termoklin lebih dari 100 meter kandungan TSS berada pada kisaran nilai 5-6 mg/L. Kisaran nilai ini masih tergolong kecil dan masih berada di bawah baku mutu untuk biota air laut (<20 mg/L).
Gambar 13. Sebaran melintang TSS lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
pengaruh dan kontribusi aliran sungai yang membawa zat padat tersuspensi relatif tinggi.
4.2. Parameter Kimia Perairan 4.2.1. Salinitas
Sebaran menegak salinitas di perairan selatan Selat Bali pada bulan Maret 2011 dapat dilihat pada Gambar 14, sementara sebaran melintang disajikan pada Gambar 15, 16 dan 17. Bentuk sebaran menegak salinitas setiap stasiun relatif sama, semakin tinggi seiring bertambahnya kedalaman dan semakin stagnan pada kedalaman yang lebih dalam.
Pada lapisan permukaan, kisaran salinitas untuk seluruh stasiun berkisar antara 32,71-33,77 PSU. Pada lapisan termoklin secara umum kisaran salinitas relatif lebih tinggi dibanding dengan lapisan permukaan yaitu sebesar 33,39-34,25 PSU. Semakin dalam atau ke dekat dasar perairan nilai salinitas pun lebih tinggi dan penurunan salinitas relatif lebih lambat atau relatif stagnan. Dari hasil pengamatan, kandungan salinitas pada lapisan dekat dasar perairan berkisar antara 33,48-34,74 PSU. Hasil pengamatan ini sesuai dengan pernyataan Sverdrup et al. (1946) yang menyatakan bahwa permukaan air laut memiliki salinitas dan kandungan zat hara yang rendah. Sebaliknya pada lapisan yang lebih dalam air laut mempunyai kandungan salinitas dan kandungan zat hara yang lebih tinggi. Pada proses terjadinya upwelling nilai kandungan salinitas di permukaan biasanya lebih tinggi dibandingkan dengan bagian bawah lapisan di bawahnya.
Gambar 15. Sebaran melintang salinitas lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
daratan menunjukkan nilai dari salinitas yang relatif lebih rendah jika dibandingkan pada stasiun yang jauh dari daratan atau berbatasan dengan Samudera Hindia di bagian selatan. Menurut Ross (1970), kisaran salinitas di perairan terbuka berkisar antara 33-37 PSU dengan rata-rata sebesar 35 PSU. Dari Gambar 15 dapat diketahui bahwa kisaran salinitas yang termasuk ke dalam lapisan permukaan memiliki nilai yang berkisar antara 33-34 PSU. Jika dibandingkan dengan baku mutu biota perairan menurut dengan Kepmen-LH No. 51 tahun 2004 kisaran salinitas hasil pengukuran pada semua stasiun masih termasuk ke dalam rentan yang masih diperbolehkan dalam suatu perairan.
Lapisan kedua dibawah lapisan homogen permukaan adalah lapisan termoklin. Sebaran melintang salinitas pada lapisan termoklin (Gambar 16) memperlihatkan adanya perbedaan nilai salinitas tiap stasiun, hal ini terlihat dari gradien warna pada gambar. Warna ungu menunjukkan nilai salinitas pada kisaran 33 sampai 33,5 PSU.
Pada Stasiun 1-5 yang berada pada wilayah 114-114,5 °BT, sebaran salinitas termoklin cenderung lebih rendah jika dibanding dengan stasiun 6-8 yang terletak pada 114,5-115 °BT. Pada stasiun 1-5 kisaran salinitas pada lapisan termoklin dengan kedalaman 10-80 m adalah sebesar 33-34 PSU, sedangkan kisaran salinitas pada stasiun 6-8 yang memiliki kedalaman antara 100-120 meter memiliki kisaran salinitas sebesar 34-35 PSU. Intrusi massa air dari Samudera Hindia dan kedalaman lapisan termoklin yang lebih dalam pada stasiun 6,7 dan 8 diindikasikan menjadi penyebab salinitas pada lapisan termoklin di wilayah ini lebih tinggi dibanding dengan stasiun yang lainnya. Pada stasiun 9 dengan kedalaman termoklin sebesar 14 meter, salinitas perairan pada lapisan ini relatif menjadi lebih rendah dan hampir sama dengan stasiun 1-5 yaitu sebesar 33 PSU.
Gambar 17. Sebaran melintang salinitas lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
lepas yang memiliki kedalaman lebih dari 1.000 meter, yaitu pada stasiun 6,7 dan 8 dibanding lapisan permukaan dan termoklin. Seperti halnya suhu, jika dilihat dari keseluruhan titik pengamatan, stasiun 8 yang memiliki kedalaman 2.549 meter memiliki nilai salinitas paling tinggi di wilayah dasar perairan yaitu sebesar 35 PSU. Menurut Saragih (2002), salinitas pada bagian utara Selat Bali pada bulan Agustus tahun 2000 kandungannya lebih rendah jika dibandingkan dengan kandungan salinitas di wilayah selatan Selat Bali. Kandungan salinitas di wilayah selatan akan meningkat dari arah barat ke timur. Mengacu pada hasil penelitian Saragih (2002), data hasil pengamatan sesuai dengan pernyataan tersebut, bahwa pada lapisan dekat dasar perairan terlihat bahwa nilai salinitas akan semakin tinggi ke arah selatan. Faktor utama yang menyebabkannya adalah kedalaman perairan di wilayah selatan Selat Bali lebih tinggi jika dibandingkan dengan kedalaman perairan di wilayah utara.
4.2.2 pH
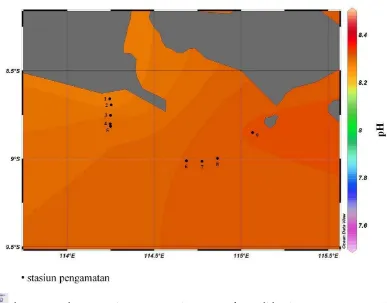
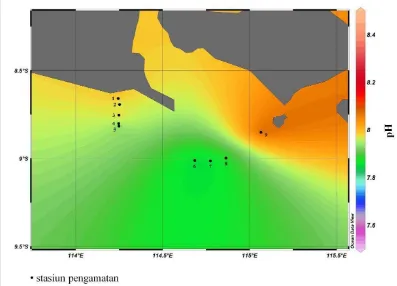
Sebaran menegak pH di perairan Selat Bali pada bulan Maret 2011 disajikan pada Gambar 18, sedangkan sebaran melintang pH pada tiap stasiun pada lapisan permukaan, termoklin dan dekat dasar perairan dapat dilihat pada Gambar 19, 20 dan 21. Secara keseluruhan, kisaran nilai pH dari seluruh stasiun yang diamati baik pada lapisan permukaan, lapisan termoklin maupun dekat dasar perairan nilainya berada pada rentan 7,66-8,33. Nilai ini masih sesuai dengan nilai ambang batas menurut Kepmen-LH No. 51 tahun 2004 untuk biota laut (7-8,5). Pada lapisan permukaan, rata-rata kandungan pH dari seluruh stasiun adalah sebesar 8,30, sedangkan nilai yang lebih rendah ditunjukkan pada hasil pengukuran pH pada kedalaman termoklin dan dekat dasar perairan dengan nilai rata-rata sebesar 8,21 dan 7,95.
ketidakseimbangan kadar CO2 yang dapat membahayakan kehidupan biota laut.
Berdasarkan hasil pengamatan, diketahui nilai pH pada seluruh stasiun pengamatan menunjukkan nilai yang berada pada kisaran normal di laut.
Gambar 18. Sebaran menegak pH tiap stasiun di bagian selatan Selat Bali pada bulan Maret 2011
Gambar 19. Sebaran melintang pH lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
Pada lapisan permukaan, terlihat bahwa sebaran pH secara horizontal pada tiap stasiun relatif seragam. Hal ini ditunjukkan dengan tidak terlalu mencoloknya perbedaan warna di tiap stasiun pada Gambar 19, namun pada wilayah selatan Selat Bali terlihat bahwa kisaran nilai pH permukaan akan semakin tinggi ke arah timur, walaupun perbedaannya tidak terlalu tinggi (<0,1). Stasiun 1-5 yang terletak pada posisi 114-114,5 °BT nilai rata-rata pH sebesar 8,29; pada stasiun 6,7 dan 8 yang berbatasan dengan Samudera Hindia di bagian selatan/terletak pada koordinat 114,5-115 °BT, nilai rata-rata pH yang teramati adalah sebesar 8,31; sedangkan pada stasiun 9 yang terletak antara 115-115,5 °BT nilai pH yang teramati adalah sebesar 8,33. Data hasil pengukuran pH ini sesuai dengan pernyataan Romimuhtarto (1991)
Gambar 20. Sebaran melintang pH lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
Derajat keasaman merupakan salah satu parameter penentu produktivitas suatu perairan. Menurut Nontji (2001) in Anwar (2008) pada umumnya kisaran pH air laut tidak terlalu bervariasi, hal ini disebabkan adanya sistem karbondioksida dalam laut yang menyebabkan air laut memiliki kapasitas penyangga atau buffer yang kuat.
Gambar 21. Sebaran melintang pH lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
4.2.3. Oksigen terlarut (DO)
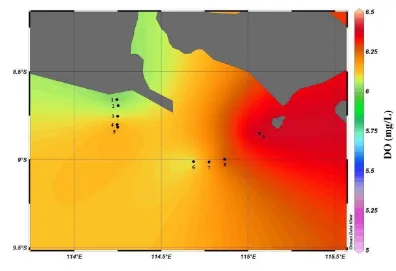
Sebaran menegak kandungan oksigen terlarut atau Dissolved Oxygen (DO) di perairan Selat Bali pada bulan Maret 2011 dapat dilihat pada Gambar 22, sedangkan sebaran horizontal pada tiap stasiun pada lapisan permukaan, termoklin, dan dekat dasar perairan disajikan pada Gambar 23, 24 dan 25. Seperti halnya suhu dan salinitas, penyajian grafik nilai DO secara vertikal dikelompokkan berdasarkan kedalaman maksimum tiap stasiun. Grafik pertama, pengelompokkan berdasarkan kedalaman stasiun yang kurang dari 100 meter. Grafik kedua adalah stasiun yang memiliki kedalaman antara 100-1.000 m. Sedangkan grafik ketiga adalah pengelompokan stasiun yang memiliki kedalaman lebih dari 1.000 m.
Konsentrasi DO di laut sangat bervariasi terutama di lapisan termoklin. Pada lapisan permukaan kandungan oksigen terlarut cenderung lebih tinggi, hal ini berkaitan dengan penetrasi cahaya yang masuk ke badan perairan yang menjadi sumber energi utama bagi fitoplankton untuk melakukan fotosintesis dalam hubungannya dengan produktivitas primer di perairan. (Schmittner et al. 2007).
Kadar oksigen terlarut dapat dijadikan ukuran umtuk menentukan mutu air. Kehidupan organisme akuatik dapat bertahan jika ada kandungan oksigen terlarut minimum sebanyak 5mg/L selebihnya tergantung kepada ketahanan organisme, derajat aktivitas, kehadiran pencemar, suhu air, dan sebagainya (Anwar 2008).
Hasil analisis diketahui bahwa sebaran rata-rata konsentrasi oksigen terlarut di lapisan permukaan adalah sebesar 6,15 mg/L sedangkan pada lapisan termoklin dan dekat dasar perairan nilainya secara berurutan adalah sebesar 5,83 mg/L dan 4,36 mg/L. Menurut Swingle (1968) in Salmin (2005) kandungan oksigen terlarut minimum yang dibutuhkan untuk organisme akuatik dalam menjaga kelangsungan hidupnya adalah sebesar 2 ppm dalam keadaan normal dan tidak tercemar oleh senyawa beracun (toksik).
Gambar 22 memperlihatkan bahwa kandungan oksigen terlarut tiap kedalaman perairan cenderung berfluktuatif. Secara umum, pada lapisan permukaan, kisaran kandungan oksigen terlarut cenderung lebih tinggi dibanding dengan lapisan dibawahnya. Hal ini disebabkan karena adanya proses difusi anatara air dengan udara bebas serta adanya proses fotosintesis. Semakin bertambahnya kedalaman akan terjadi penurunan kadar oksigen terlarut karena proses fotosintesis semakin berkurang dan oksigen yang ada banyak digunakan untuk proses respirasi dan oksidasi organik maupun anorganik. Salmin (2005) menyebutkan bahwa kecepatan difusi oksigen dari udara tergantung dari beberapa faktor seperti kekeruhan air, suhu, salinitas, pergerakan massa air, arus, gelombang dan pasang surut.
kedalaman yang lebih dalam yang memiliki kandungan suhu rendah terlihat bahwa kandungan oksigen akan semakin tinggi.
Gambar 23. Sebaran melintang DO lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
Gambar 24. Sebaran melintang DO lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
Kedalaman lapisan termoklin yang berbeda-beda pada tiap stasiun menyebabkan konsentrasi oksigen terlarut terlihat bervariatif. Pada Stasiun 1-5 yang berada pada wilayah 114-114,5° BT, sebaran konsentrasi DO termoklin cenderung lebih tinggi (5,64-6,13 mg/L) dibanding konsentrasi DO pada stasiun 6-8 yang berada pada wilayah 114,5-115 °BT (5,20-5,89 mg/L). Konsentrasi oksigen ini semakin meningkat ke arah timur yaitu teramati pada stasiun 9 yang memiliki nilai konsentrasi oksigen sebesar 6,37 mg/L.
Gambar 25. Sebaran melintang DO lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
Secara keseluruhan konsentrasi oksigen terlarut pada lapisan dekat dasar perairan memiliki nilai rata-rata sebesar 4,3 mg/L. Warna ungu pada gambar menunjukkan nilai kandungan oksigen terlarut berkisar antara 2-4 mg/L. Pada stasiun 1-5 nilai kandungan DO memiliki nilai rata-rata sebesar 3,99 sedangkan pada stasiun 6-8 yang memiliki kedalaman lebih dari 1.000 meter, nilai konsentrasi oksigen lebih tinggi yaitu sebesar 4,30 mg/L. Tingginya konsentrasi DO pada stasiuun 6-8 mengindikasikan bahwa semakin bertambahnya kedalaman nilai dari konsentrasi oksigen terlarut akan semakin meningkat. Pada stasiun 9 terlihat kandungan oksigen lebih tinggi dibanding stasiun yang lainnya yaitu sebesar 6,37 mg/L.
dihasilkan akan mereduksi senyawa-senyawa kimia menjadi lebih sederhana dalam bentuk nutrien dan gas (Salmin 2005).
4.2.4. Biocemical Oxygen Demand (BOD)
Sebaran melintang nilai BOD di perairan bagian selatan Selat Bali pada tiap stasiun di lapisan permukaan, termoklin, dan dekat dasar perairan disajikan pada Gambar 26, 27 dan 28. Secara keseluruhan nilai rata-rata dari nilai BOD baik pada lapisan permukaan, termoklin maupun lapisan dekat dasar perairan adalah sebesar 2,02 mg/L. Secara umum penentuan nilai BOD banyak digunakan untuk menentukan tingkat pencemaran pada suatu badan perairan. Menurut Salmin (2005) suatu perairan yang tingkat pencemarannya rendah dan bisa dikategorikan sebagai perairan yang baik kadar BOD berada pada kisaran 0-10 ppm.
Gambar 26. Sebaran melintang BOD lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
114-114,5 °BT adalah sebesar 1 mg/L, stasiun 6-8 yang terletak pada 114,5-115 °BT adalah sebesar 1,3 mg/L dan pada stasiun 9 yang terletak antara 115-115,5 °BT nilainya sebesar 1,32 mg/L. Nilai BOD tertinggi teramati pada stasiun 6 dengan nilai sebesar 2,75 mg/L.
Gambar 27. Sebaran melintang BOD lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
Gambar 28. Sebaran melintang BOD lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
4.2.5. Amonia
Sebaran melintang amonia pada seluruh stasiun pada lapisan permukaan, lapisan termoklin, dan lapisan dekat dasar perairan disajikan pada Gambar 29, 30 dan 31. Secara keseluruhan nilai konsentrasi amonia di perairan bagian selatan Selat Bali pada bulan Maret 2011 baik pada lapisan permukaan, termoklin, maupun lapisan dekat dasar perairan berkisar antara 0,05-0,23 mg/L. Nilai ini terlihat sangat kecil jika dibandingkan dengan baku mutu menurut Kepmen-LH No. 51 tahun 2004 untuk peruntukan biota laut yaitu sebesar 3 mg/L.
Gambar 29. Sebaran melintang amonia lapisan permukaan di bagian selatan Selat Bali pada bulan Maret 2011
menurun ketika terjadi peningkatan konsentrasi CO2 sehingga amonia jarang
dijumpai pada perairan dengan kelarutan oksigen yang cukup. Pada pengukuran konsentrasi oksigen terlarut yang sudah dibahas sebelumnya terlihat bahwa konsentrasi oksigen terlarut pada lapisan permukaan cenderung tinggi. Hal ini yang mengindikasikan konsentrasi amonia yang teramati pada perairan selatan Selat Bali pada bulan Maret 2011 relatif kecil.
Gambar 30. Sebaran melintang amonia lapisan termoklin di bagian selatan Selat Bali pada bulan Maret 2011
Pada lapisan termoklin, secara keseluruhan konsentrasi amonia berkisar antara 0,05 mg/L sampai 0,1 mg/L. Pada stasiun 1-5 yang terletak antara 114-114,5 °BT konsentrasi amonia rata-rata dari kelima stasiun tersebut adalah sebesar 0,07 mg/L, sedangkan pada stasiun 6 sampai 8 yang berada pada wilayah 114,5-115 °BT dan berbatasan dengan Samudera Hindia di bagian selatan, konsentrasi amonia cenderung lebih tinggi yaitu berkisar antara 0,01 mg/L sampai 0,13 mg/L, sedangkan pada stasiun 9, konsentrasi amonia sebesar 0,06 mg/L.
dijadikan sebagai adanya indikasi adanya pencemaran bahan organik yang berasal dari limbah domestki, industri dan limpasan. Adapun sumber amonia di perairan adalah dari hasil pemecahan nitrogen organik (protein dan urea), serta nitrogen anorganik yang terdapat di dalam tanah dan air yang berasal dari dekomposisi bahan organik oleh mikroba.
Gambar 31. Sebaran melintang amonia lapisan dekat dasar di bagian selatan Selat Bali pada bulan Maret 2011
mengalami ionisasi dalam air tawar akan lebih besar jika dibandingkan dengan air laut.
Secara keseluruhan, amonia hasil pengukuran yang dilakukan pada seluruh titik sampling di perairan selatan Selat Bali pada bulan Maret 2011 berkisar antara 0,05 sampai 0,2 mg/L. Konsentrasi amonia yang bersifat toksik bagi sebagian besar biota perairan berkisar antara 0,60 mg/L sampai 2,00 mg/L. Handy & poxton (1993) menyatakan bahwa amonia yang tidak terionisasi bersifat akut pada organisme perairan dan tingkat keracunannya sangat tergantung pada salinitas, suhu dan pH sementara nitrat dan nitrit secara signifikan tidak bersifat toksik bagi ikan. Berdasarkan literatur sebelumnya, maka dapat dikatakan bahwa kandungan amonia pada perairan Selat Bali tidak bersifat toksik bagi organisme.
4.2.6. Nitrat
Grafik konsentrasi nitrat pada tiap stasiun di lapisan permukaan, termoklin, dan dekat dasar perairan dapat dilihat pada Gambar 32. Sebaran nitrat yang teramati pada tiap stasiun relatif sangat kecil, bahkan pada lapisan permukaan nilai nitrat hanya terdeteksi pada stasiun 9 dengan nilai sebesar 0,024 mg/L sedangkan sisanya nilai konsentrasi nitrat berada di bawah batas deteksi alat/metode yang digunakan untuk melakukan analisis kandungan nitrat yaitu sebesar 0,001 mg/L.