MEKANISME ADAPTASI AKSESI TERUNG-TERUNGAN
(
Solanum
spp.) TERHADAP CEKAMAN KEKERINGAN :
FISIOLOGI DAN MOLEKULER
SITI KURNIAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Mekanisme Adaptasi Aksesi Terung-terungan (Solanum spp.) terhadap Cekaman Kekeringan : Fisiologi dan Molekuler adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Siti Kurniawati
RINGKASAN
SITI KURNIAWATI. Mekanisme Adaptasi Aksesi Terung-terungan (Solanum
spp.) terhadap Cekaman Kekeringan : Fisiologi dan Molekuler. Dibimbing oleh
NURUL KHUMAIDA, ENNY SUDARMONOWATI dan SINTHO
WAHYUNING ARDIE.
Terung (Solanum melongena L.) termasuk salah satu komoditi sayuran yang umum dan populer tumbuh di daerah tropis dan subtropis terutama di wilayah Asia dan Afrika serta memiliki toleransi cukup baik terhadap cekaman biotik dan abiotik. Terung adalah spesies dengan variabilitas karakter morfologi dan fisiologi luas, sehingga sangat diperlukan untuk mendapatkan sumber-sumber ketahanan yang lebih tinggi dari spesies liarnya.
Ketersediaan air yang cukup pada fase awal petumbuhan sangat penting bagi tanaman. Jika ketersediaan air rendah maka dapat mengakibatkan cekaman kekeringan (drought stress). Cekaman kekeringan dengan periode yang panjang pada tanaman menyebabkan gangguan proses metabolisme dan kerusakan jaringan yang bersifat tidak dapat balik (permanen) sehingga tanaman tidak dapat melakukan pemulihan atau recovery. Dampak cekaman kekeringan sangat nyata menurunkan pertumbuhan dan produktivitas tanaman.
Penelitian ini mempelajari mekanisme adaptasi melalui pendekatan fisiologi dan molekuler terhadap 6 aksesi terung yang berasal dari beberapa daerah kering di Indonesia (aksesi 098, aksesi 155, aksesi 414, aksesi 754, aksesi 772, aksesi 827) dan varietas Panjalu F1 sebagai genotipe pembanding. Benih terung ditumbuhkan pada media tanam yang terdiri atas campuran tanah, pasir dan kompos dengan perbandingan 1:1:1 (v/v/v) di dalam rumah kaca. Perlakuan cekaman kekeringan dilakukan selama 21 hari setelah tanaman memiliki 6 lembar daun penuh. Parameter yang diukur selama cekaman kekeringan meliputi :kadar air media (KAM), kadar air relatif (KAR) daun, pertumbuhan dan bobot kering tanaman, kandungan prolin, klorofil daun dan poliamin. Pada 21 HSP cekaman kekeringan, dilakukan isolasi RNA total dari daun terung kemudian kloning fragmen cDNA penyandi gen arginine decarboxylase (ADC) dari S. melongena. Gen ADC merupakan salah satu gen yang terlibat dalam biosintesis poliamin dan berperan dalam mekanisme toleransi tanaman terhadap cekaman kekeringan.
Hasil penelitian menunjukkan bahwa cekaman kekeringan secara nyata menurunkan pertumbuhan tinggi tajuk, luas daun, kerapatan stomata dan persentase stomata terbuka pada tanaman terung. Namun, cekaman kekeringan secara nyata tidak mempengaruhi kandungan klorofil daun terung pada 21 HSP. Akumulasi senyawa prolin dan/atau poliamin berperan penting dalam mekanisme adaptasi tanaman terung terhadap cekaman kekeringan, sehingga peningkatan kandungan prolin maupun poliamin dapat dijadikan sebagai indikator bahwa tanaman terung dalam kondisi tercekam kekeringan terutama setelah periode cekaman mencapai 14 sampai 21 hari.Tingkat akumulasi prolin pada jaringan daun terung dapat mencapai10 kali kondisi normal dan kandungan poliamin terutama putresin mencapai 10 kali dari kondisi normal.
tiga fragmen berasal dari cDNA aksesi 098 dan 772 sebagai cetakan serta satu fragmen berasal dari genom aksesi 098. Primer ADC berdasarkan conserved region pada sekuen gen ADC tanaman Solanum lycopersicum (nomor aksesi HM629957.1). Analisis urutan nukleotida menunjukkan bahwa empat fragmen
SmADC yang diperoleh berukuran 1 442 pb, 1 422 pb, 1 407 pb dan 636 pb menyandi 151, 357, 466, 182 asam amino. Analisis alignment berdasarkan urutan nukleotida menunjukkan bahwa keempat fragmen SmADC memiliki homologi yang tinggi (86-93%) dengan aksesi gen ADC pada beberapa tanaman lain yaitu
Solanum lycopersicum (NM_001247720.1), Datura stramonium (AJ251898.1),
Capsicum annuum (AY156514.1) dan Nicotiana tabacum (AF321137.1). Berdasarkan pengelompokkan pohon filogenetik deduksi urutan asam amino,
SmADC berada pada kelompok yang sama dengan Solanum lycopersicum, Datura stramonium,Capsicum annuum dan Nicotiana tabacum. Analisis conserved domain menunjukkan bahwa fragmen SmADC diprediksi mempunyai fungsi
Pyridoxal 5-phosphate (PLP)-Dependent Enzyme Arginine Decarboxylase tipe III yaitu suatu protein yang berperan dalam biosintesis ADC, dimana PLP-DE ADC tipe III mempunyai urutan asam amino yang spesifik pada daerah conserved binding site yaitu Pro-Lys-Glu-Asn-Arg-His-Ser-Gly-Gly-Glu-Ser-Gly-Arg-Cys-Tyr.
Kata kunci: terung, prolin, poliamin, gen arginine decarboxylase (ADC),
SUMMARY
SITI KURNIAWATI. Drought Stress Tolerance Mechanisms of Eggplant
(Solanum spp.): Physiology and Molecular. Supervised by NURUL
KHUMAIDA, ENNY SUDARMONOWATI and SINTHO WAHYUNING ARDIE.
Eggplant (Solanum melongena L.) is a popular and economically important vegetable crop grown in the tropics and subtropics, especially in Asia and Africa. Most of these crops grown in Asia and Africa are tolerant to biotic and abiotic stresses. Eggplant has a wide variation in morphological and physiological characteristics, therefore, it is necessary to explore the germplasm to gain more genotypes tolerant to biotic and abiotic stresses.
Sufficient water availability at the first stage of plant growth is very important. Limited water supply may lead to drought stress. The long period of drought stress may disturb the metabolic process and lead the irreversible damage of the plant tissues, so the plant can not recover. This abiotic stress has been significantly proved to be one of factors decreasing the plant growth and productivity.
The objective of this research was to reveal physiological and molecular response of six eggplant accessions (i.e. 098, 155, 414, 754, 772, and 827 accessions, and Panjalu-F1 as the control genotype) to drought stress. Plants were grown in medium containing soil, sand and compost (1:1:1, v/v/v) in the greenhouse. Plants were exposed to the drought treatment at 21 days after the plants have 6 fully leaves. Some parameters were examined during the drought treatment, which were media water content (MWC), relative water content (RWC), plant growth and dry weight, proline concentration, chlorophyll content and polyamine concentration. Total RNA was extracted from leaves on day 21st of the treatment. The arginine decarboxylaseS. melongena (SmADC)fragment gene was amplified from the cDNA. ADC gene is one of genes involved in polyamine biosynthesis and plays important role in the plant tolerance mechanism to drought stress.
The results showed that drought stress significantly reduced plant height, leaf area, stomatal density and aperture in all plants. Levels of chlorophylls were similar during the drought treatment in all plants. Proline and/or polyamines were accumulated and reached the maximum levels after 14 to 21 days after the treatment. High levels of these amines can be used to indicate that the plant is stressed by drought. Levels of proline and polyamines, especially putrescine, increased 10 times higher in the stressed-plants compared to those grown in the optimum condition.
Nucleotide alignment analysis showed that four SmADC fragments were 86-93 % homologue to Solanum lycopersicum (Acc: NM_001247720.1), Datura stramonium (Acc: AJ251898.1), Capsicum annuum (Acc: AY156514.1) and
Nicotiana tabacum (Acc: AF321137.1). Based on the phylogenetic tree developed from the deduced amino acid sequence of ADC, SmADCs were grouped with
Solanum lycopersicum, Datura stramonium, Capsicum annuum and Nicotiana tabacum. Analysis of conserved domains revealed that the SmADC fragments were predicted to have Pyridoxal 5-phosphate-Dependent Enzyme Arginine Decarboxylase (PLP-DE ADC) type III function, a protein that is important for the biosynthesis of ADC, of which this enzyme has a conserved region on its binding site, i.e. Pro-Lys-Glu-Asn-Arg-His-Ser-Gly-Gly-Glu-Ser-Gly-Arg-Cys-Tyr. These results will enhance further steps for improving eggplant and other plants genetically.
Key Words: eggplant, proline, polyamine, arginine decarboxylase (ADC),
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
MEKANISME ADAPTASI AKSESI TERUNG-TERUNGAN
(
Solanum
spp.) TERHADAP CEKAMAN KEKERINGAN :
FISIOLOGI DAN MOLEKULER
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Mekanisme Adaptasi Aksesi Terung-Terungan (Solanum spp.) terhadap Cekaman Kekeringan : Fisiologi dan Molekuler Nama : Siti Kurniawati
NIM : A253100181
Disetujui oleh Komisi Pembimbing
Dr Ir Nurul Khumaida, MSi Ketua
Prof (R) Dr Ir Enny Sudarmonowati Anggota
Dr Sintho Wahyuning Ardie, SP, MSi Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti WE Kusumo, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc.Agr
PRAKATA
Bismillaahirrahmaanirrahiim
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah (tesis) ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2010 di rumah kaca dan Laboratorium Genetika Molekuler Tanaman dan Modifikasi Jalur Biosintesa, Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong-Bogor ini ialah adaptasi tanaman terhadap cekaman kekeringan, dengan judul Mekanisme Adaptasi Aksesi Terung-terungan (Solanum spp.) terhadap Cekaman Kekeringan: Fisiologi dan Molekuler. Terima kasih dan penghargaan yang tinggi penulis haturkan kepada semua pihak yang telah membantu dalam pelaksanaan penelitian dan penyelesaian penulisan tesis ini, yaitu :
1. Ibu Dr. Ir. Nurul Khumaida, M. Si., Ibu Prof (R). Dr. Ir. Enny Sudarmonowati dan Ibu Dr. Sintho Wahyuning Ardie, SP., M.Si selaku komisi pembimbing atas waktu, ilmu, kesabaran dan kemudahan yang diberikan selama bimbingan mulai dari tahap awal persiapan penelitian sampai akhir penyelesaian tesis ini. 2. Ibu Dr N. Sri Hartati yang telah banyak memberi saran dan dukungan moral
serta material selama penelitian berlangsung hingga akhir penyelesaian tesis. 3. Bapak Prof. Dr. Bambang Sapta Purwoko selaku penguji luar komisi atas ilmu
dan saran yang telah diberikan untuk kesempurnaan tesis ini.
4. Ketua Mayor, seluruh dosen, karyawan, dan pengelola Laboratorium pada Departemen Agronomi dan Hortikultura atas bantuan dan fasilitas yang diberikan selama penelitian dilakukan sampai penyelesaian tesis ini.
5. Kementerian Negara Riset dan Teknologi yang telah memberikan kesempatan bagi penulis untuk memperoleh dana beasiswa karyasiswa pada Program Magister Sains.
6. Kepala Pusat Penelitian Bioteknologi LIPI yang telah memberikan izin kepada penulis untuk melanjutkan studi dengan tugas belajar pada Program Pascasarjana IPB.
7. Bapak Djoemani dan mamah Siti Aminah (Almh) tercinta, serta seluruh keluarga teh Nung danmas Teguh atas segala do’a, nasehat, perhatian, semangat, kepercayaan, pengertian dan kasih sayang yang telah diberikan sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini
8. Rekan-rekan Pascasarjana terutama Mayor PBT tahun 2010 atas kebersamaan dan kerjasamanya selama menyelesaikan studi.
9. Rekan-rekan Puslit Biotek LIPI terutama kelompok penelitian Genetika Molekuler dan Modifikasi Jalur Biosintesa atas kerjasama, kebersamaan dan dukungannya selama penulis melakukan penelitian dan menyelesaikan studi. Semoga Allah senantiasa membalas kebaikan semuanya dengan pahala yang berlipat ganda, aamiin. Penulis berharap semoga karya ilmiah ini bermanfaat bagi pihak yang terkait.
Bogor, Januari 2014
DAFTAR ISI
Halaman
DAFTAR ISI vii
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 4
Ruang Lingkup Penelitian 4
Hipotesis Penelitian 5
2 TINJAUAN PUSTAKA 7
Gambaran Umum Tanaman Terung-terungan 7
Fungsi Air dalam Pertumbuhan Tanaman 8
Akumulasi Prolin dan Poliamin sebagai Respon terhadap Cekaman
Kekeringan 9
3 POLA AKUMULASI SENYAWA OSMOTIKUM PROLIN DAN POLIAMIN SEBAGAI MEKANISME ADAPTASI BEBERAPA AKSESI TERUNG
TERHADAP CEKAMAN KEKERINGAN 14
Abstract 14
Pendahuluan 14
Bahan dan Metode 15
Hasil dan Pembahasan 19
Kesimpulan 29
4 ISOLASI DAN ANALISIS GEN ARGININE DECARBOXYLASE (ADC) ASAL TERUNG (Solanum melongena) RESPONSIF TERHADAP
CEKAMAN KEKERINGAN 30
Abstract 30
Pendahuluan 30
Bahan dan Metode 32
Hasil dan Pembahasan 35
Kesimpulan 44
5 PEMBAHASAN UMUM 45
DAFTAR PUSTAKA 52
DAFTAR TABEL
Halaman
1 Lokasi asal aksesi terung koleksi 16
2 Rata-rata luas daun, panjang akar, bobot kering tajuk dan bobot kering
akar aksesi terung pada 21 HSP cekaman kekeringan 23 3 Rata-rata kerapatan stomata dan persentase stomata terbuka aksesi
terung pada 21 HSP cekaman kekeringan 24
4 Akumulasi poliamin ketujuh aksesi terung pada 21 HSP cekaman
kekeringan 28
DAFTAR GAMBAR
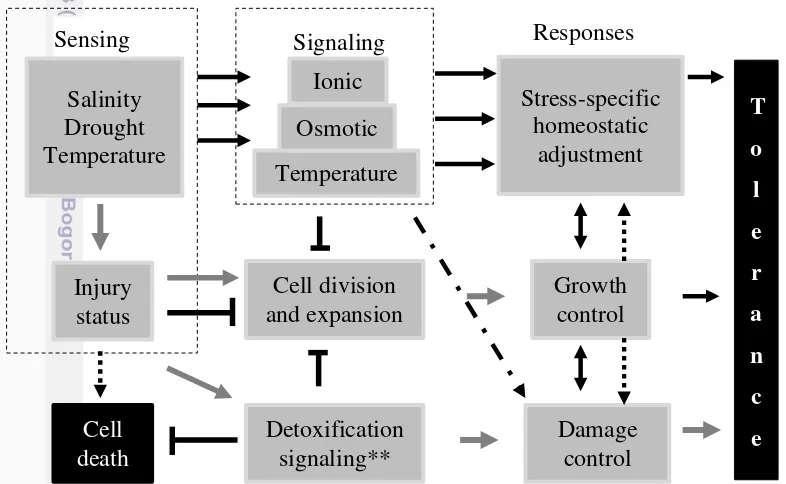
Halaman 1 Proses dan mekanisme yang menghubungkan antara sinyal cekaman
abiotik, kerusakan dan toleransi 2
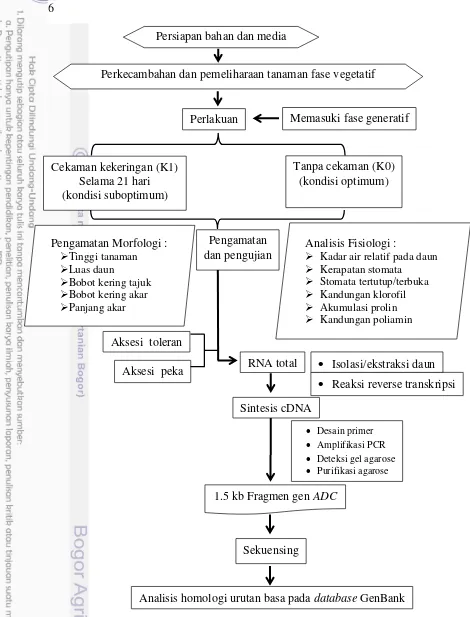
2 Bagan alur penelitian 6
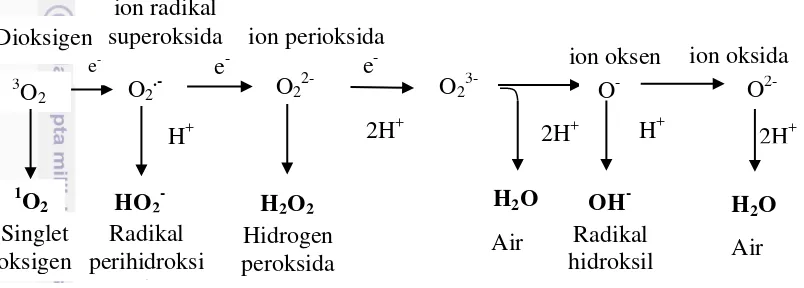
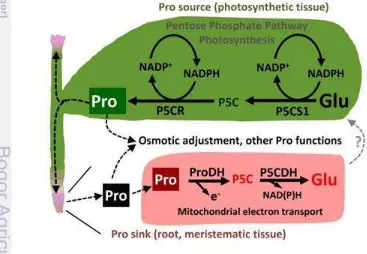
3 Mekanisme pembentukan senyawa reactive oxygen species (ROS) 10 4 Model sintesis dan katabolisme prolin pada jaringan spesifik dalam
kondisi potensial air rendah (ѱw) 11
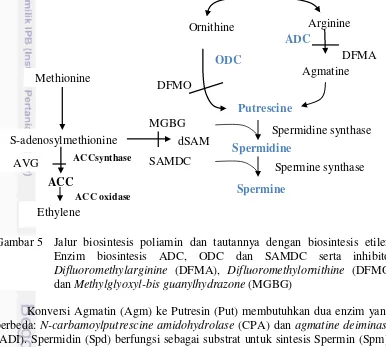
5 Jalur biosintesis poliamin dan tautannya dengan biosintesis etilen. Enzim biosintesis ADC, ODC dan SAMDC serta inhibitor
Difluoromethylarginine (DFMA), Difluoromethylornithine (DFMO) dan
Methylglyoxyl-bis guanylhydrazone (MGBG) 12
6 Keragaan buah beberapa aksesi terung (Solanum spp.) yang digunakan dalam penelitian; Panjalu F1(A), 098 (B), 155 (C), 414 (D), 754 (E), 772
(F), dan 827 (G) 16
7 Status kadar air media antara kontrol dan perlakuan cekaman kekeringan
selama 21 hari pada beberapa aksesi terung 19
8 Status kadar air media tujuh aksesi terung antara tanaman kontrol dan
perlakuan cekaman kekeringan pada 21 hari HSP 20
9 Kadar air relatif daun antara kontrol dan perlakuan cekaman kekeringan
selama 21 HSP pada aksesi terung 21
10 Rata-rata kadar air relatif daun antara kontrol dan perlakuan cekaman
kekeringan pada 21 HSP tujuh aksesi terung 21
11 Profil daun terung kondisi optimum (K0) dan 21 HSP cekaman
kekeringan (K1) aksesi 155 (A), aksesi 754 (B) dan aksesi 827 (C) 21 12 Rata-rata pertambahan tinggi tajuk tujuh aksesi terung pada 21 HSP
cekaman kekeringan dan kontrol 22
13 Morfologi akar tanaman terung aksesi 098 dan aksesi 827 antara kondisi optimum (kontrol) dan 21 HSP cekaman kekeringan 23 14 Kandungan klorofil daun aksesi terung antara kontrol dan perlakuan
cekaman kekeringan selama 21 HSP 25
15 Kandungan prolin pada daun terung selama perlakuan cekaman
kekeringan dan kontrol 26
16 Akumulasi prolin ke-7 aksesi pada 0-21 Hari Setelah Perlakuan (HSP)
cekaman kekeringan dan kontrol 27
18 Daun terung 21 HSP cekaman kekeringan aksesi 098 (A) dan aksesi 772
(B) 32
19 Tahapan isolasi dan analisis fragmen cDNA ADC dari S.melongena 33 20 Integritas pita RNA total daun terung aksesi Panjalu F1 (1), 098 (2), 155
(3), 414 (4), 754 (5), 772 (6), dan 827 (7) 35
21 Pita hasil PCR cDNA aktin menggunakan cDNA total aksesi 098 dan
772 sebagai cetakan; M= Marker/penanda ukuran 1 kb 36 22 Pita hasil PCR cDNA SmADC menggunakan cDNA aksesi 098 (1),
cDNA aksesi 772 (2) dan genom aksesi 098 (3) sebagai cetakan 37 23 Urutan basa dan prediksi urutan asam amino dari fragmen SmADC
terung 39
24 Pohon filogenetik berdasarkan runutan asam amino dari fragmen ADC 41 25 Hasil penyejajaran tiga fragmen asam amino putatif gen SmADC 43 26 Skema pengaturan transkripsional biosintesis poliamin oleh ABA 48 27 Jalur sinyal transduksi pada tanaman saat cekaman kekeringan dan
salinitas 48
28 Jalur metabolisme prolin pada tanaman 50
DAFTAR LAMPIRAN
Halaman
1 Prosedur Analisis Prolin 60
2 Prosedur Analisis Poliamin 61
3 Prosedur Analisis Klorofil daun 62
4 Hasil analisis penyejajaran fragmen SmADC menggunakan program
ClustalW2 63
5 Hasil analisis penyejajaran fragmen gSmADC, SmADC1.1
danSmADC2.1asal aksesi 098 menggunakan program ClustalW2 65
6 Hasil analisis peyejajaran fragmen gSmADC dengan gen atau DNA yang telah terdeposit pada GenBank menggunakan program BLAST 67 7 Hasil analisis peyejajaran fragmen SmADC1.2 dengan gen atau DNA
yang telah terdeposit pada GenBank menggunakan program BLAST 68 8 Hasil analisis peyejajaran fragmen SmADC2.1 dengan gen atau DNA
yang telah terdeposit pada GenBank menggunakan program BLAST 69 9 Motif conserved domain dari residu PLP binding-site pada fragmen
gSmADC 70
10 Motif conserved domain dari residu PLP binding-site pada fragmen
SmADC1.1 71
11 Motif conserved domain dari residu PLP binding-site pada fragmen
SmADC1.2 72
12 Motif conserved domain dari residu PLP binding-site pada fragmen
SmADC2.1 73
13 Motif conserved domain dari residu PLP binding-site pada fragmen
ADC Solanum lycopersicum 74
1
1
PENDAHULUAN
Latar Belakang
Tanaman terung termasuk jenis sayuran, salah satu anggota dari keluarga Solanaceae yang memiliki manfaat luas, umum dan populer tumbuh di daerah tropis dan subtropis (Weese dan Bohs 2010). Terung dapat menjadi sumber vitamin dan mineral, mengandung cukup banyak kalori (24.0 Kal/100g), sedikit protein (1.4 g/100g) dan lemak (0.3 g/100g) (Chen dan Li 1996). Terung juga merupakan salah satu komoditas yang diekspor oleh Indonesia ke Jepang dan disenangi oleh konsumen di negara tersebut (Risseli 2006). Berdasarkan data Biro Pusat Statistik, produksi terung tahun 2012 (518 827 ton) jauh lebih rendah dari produksi tomat (893 504 ton) dan kentang (1 094 240 ton) (BPS 2013). Produksi terung pada tahun 2011 di seluruh dunia lebih dari 46.106 ton namun masih jauh lebih rendah jika dibandingkan dengan produksi tomat dan kentang pada tahun yang sama yaitu lebih dari 159.106 ton dan 373.106 ton (FAO 2013). Negara dengan produksi terung terbesar yaitu Cina (27.106 ton) dan negara dengan produktivitas terung terbesar per hektar yaitu Belanda (4 ton/Ha). Oleh karena itu perbaikan tanaman terung di Indonesia perlu ditingkatkan.
Peningkatan produktivitas tanaman budidaya, pada umumnya terkendala oleh cekaman abiotik. Perubahan iklim dunia dengan curah hujan yang tidak menentu, musim kemarau yang semakin panjang dan temperatur bumi yang semakin tinggi sebagai dampak dari pemanasan global menyebabkan stabilitas produksi bahan pangan terganggu. Musim kemarau yang panjang mengakibatkan cekaman kekeringan ekstrim pada berbagai lahan pertanian. Kekeringan merupakan faktor pembatas dan salah satu kendala utama dalam produksi tanaman. Dengan demikian, perhatian terhadap pengembangan plasma nutfah yang tahan terhadap cekaman kekeringan menjadi prioritas dan sangat diperlukan. Menurut Behboudian (1977), tanaman terung memiliki sifat ketahanan terhadap kekeringan yang relatif lebih tinggi daripada tanaman sayuran lainnya. Tanaman terung lebih tahan terhadap kekeringan dan curah hujan yang tinggi jika dibandingkan dengan tomat, tetapi pertumbuhannya akan terhambat pada kondisi suhu tinggi dan dapat menyebabkan kekerdilan pada tanaman (Chen dan Li 1996). Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI) memiliki sejumlah aksesi terung hasil koleksi dari Jawa, Sumatera, Nusa Tenggara, Kalimantan dan Sulawesi yang diperoleh dari kerjasama dengan Belanda dalam program INDOSOL pada tahun 2009. Beberapa aksesi tersebut berasal dari daerah kering sehingga berpotensi sebagai sumber genetik sifat toleran kekeringan.
2
oleh Fu et al. (2013). Kerapatan dan jumlah trikom bagian atas daun terung lebih tinggi serta meningkat sekitar 20% pada kondisi tercekam sedangkan jumlah kloroplas per sel lebih rendah dan bentuknya menjadi bulat dengan struktrur membran yang rusak, jumlah granul osmiophilic meningkat dan jumlah butir pati menurun.
Reaksi terhadap berbagai cekaman abiotik merupakan suatu sistem terpadu antara sensing, sinyal dan respon jalur biosintesis pada jaringan tanaman (Gambar 1).Respon yang ditimbulkan tergantung faktor cekaman tertentu. Respon umum berawal dari ketidakseimbangan metabolik dan/atau kerusakan seluler.Hal tersebut menyebabkan perubahan regulasi gen yang saling tumpang tindih pada beberapa kondisi cekaman lingkungan.
Toleransi terhadap cekaman kekeringan dapat dikelompokkan menjadi 3 kategori, yaitu (1) melepaskan diri dari cekaman kekeringan (drought escape), (2) bertahan terhadap kekeringan dengan tetap menjaga potensial air yang tinggi dalam jaringan (drought avoidance), dan (3) bertahan terhadap kekeringan dengan potensial air jaringan yang rendah (drought tolerance) (Jiban 2001).
.
Beberapa mekanisme toleransi tanaman terhadap kekeringan menyebabkan berkurangnya pembukaan stomata untuk meminimalisir kehilangan air di bawah kondisi cahaya berlebihan (Tanaka et al. 2005), peningkatan senyawa antioksidan seperti asam askorbat yang berfungsi sebagai agen reduksi dalam menetralisir radikal oksigen serta pada beberapa tanaman juga mengakumulasi senyawa osmotikum seperti prolin yang berfungsi untuk pengaturan derajat osmotik sel (osmotic adjustment) (Szabados dan Savouré 2009).
Akumulasi prolin dapat meningkatkan potensial osmotik sehingga menurunkan potensial air dalam sel tanpa membatasi fungsi enzim dan menjaga turgor sel (Tuasamu 2009). Senyawa terlarut lain yang terakumulasi dan berperan
Signaling
3 dalam proses pengaturan tekanan osmotik adalah fruktan, trehalosa, manitol, ononitol, myo-inositol, glisin betain dan poliamin. Senyawa tersebut terakumulasi dalam jumlah signifikan yang dapat membantu dalam mempertahankan potensial osmotik, keseimbangan ionik, integritas membran, radikal bebas dan perlindungan kromatin dalam kondisi cekaman (Prabhavathi et al. 2002).
Karakter toleran cekaman kekeringan pada tanaman juga memiliki korelasi positif dengan peningkatan kandungan poliamin (Gill dan Tuteja 2010). Poliamin merupakan senyawa polycation sederhana yang terdapat pada semua organisme (Rajam 1997). Poliamin (putresin, spermidin dan spermin) mempunyai peran yang sangat penting sebagai respon pertahanan tanaman terhadap cekaman abiotik. Selain berperan dalam kondisi cekaman, poliamin juga berperan dalam pengaturan berbagai sel dan proses molekuler, antara lain pada masa pertumbuhan dan perkembangan, integritas membran, serta sintesis dan fungsi makromolekul. Menurut Zhao dan Yang (2008), poliamin juga dikenal sebagai anti-senesen dan anti-cekaman yang dapat menetralkan asam organik dan berfungsi sebagai antioksidan, serta memiliki kemampuan untuk menstabilkan membran dan dinding sel.
Transformasi tanaman menggunakan gen yang berperan dalam biosintesis poliamin dapat menjelaskan tentang pentingnya peranan poliamin, terutama dalam akuisisi toleransi cekaman dan mekanismenya. Menurut Gill dan Tuteja (2010), transformasi genetik gen responsif arginine decarboxylase (ADC), ornithine decarboxylase (ODC), S-adenosylmethionine decarboxylase (SAMDC) atau
spermidine synthase (SPDS) yang berperan dalam biosintesispoliamin dapat meningkatkan toleransi terhadap cekaman abiotik pada beberapa spesies tanaman. Roy dan Wu (2001) adalah yang pertama mengintroduksi gen ADC oat (Avena sativa L.) ke dalam genom tanaman padi untuk menghasilkan tanaman transgenik yang menunjukkan peningkatan toleransi terhadap cekaman salinitas tinggi. Menurut Capell et al. (2004), padi transgenik yang mengekspresikan gen ADC
dari Datura stramonium juga menunjukkan peningkatan produksi putresin jauh lebih tinggi dari tipe liarnya pada kondisi cekaman kekeringan. Peningkatan tersebut dapat memicu konversi putresin menjadi spermidin dan sintesis spermin sehingga dapat melindungi tanaman dari cekaman kekeringan. Manipulasi biosintesis poliamin pada tanaman dapat menghasilkan tanaman toleran kekeringan dan dapat dijadikan model dengan peran poliamin dalam perlindungan tanaman terhadap cekaman abiotik terutama kekeringan.
Tujuan Penelitian
Tujuan Umum
4
Tujuan Khusus
1. Mengetahui respon pertumbuhan serta adaptasi secara morfologi dan fisiologi tanaman terung terhadap cekaman kekeringan.
2. Mengetahui perubahan akumulasi kandungan prolin dan poliamin sebagai senyawa osmotikum pada tanaman terung selama 21 hari periode cekaman kekeringan pada tujuh aksesi terung.
3. Mengetahui tingkat homologi aksesi gen arginine decarboxylase dari tanaman terung dengan aksesi gen ADC tanaman lain terutama keluarga
Solanaceae yang telah tersedia pada database GenBank.
4. Mengetahui dugaan fungsi gen ADC hasil isolasi dari tanaman
S. melongena.
Manfaat Penelitian
Penelitian ini diharapkan memberikan informasi mengenai respon adaptasi dan mekanisme yang terjadi pada tanaman terung ketika tercekam kekeringan. Informasi mengenai pengaruh cekaman kekeringan terhadap tanaman terung masih sangat terbatas terutama pada aksesi yang berasal dari daerah di Indonesia, sehingga aksesi yang digunakan diharapkan dapat menjadi informasi awal dan dijadikan sebagai aksesi pembanding untuk memperoleh aksesi terung dengan tingkat toleransi yang berbeda terhadap cekaman kekeringan.
Fragmen gen arginine decarboxylase (ADC) yang diperoleh diharapkan dapat menjadi dasar untuk mendesain primer spesifik dalam mengisolasi gen secara utuh. Dengan berhasil diperolehnya fragmen gen SmADC responsif terhadap cekaman kekeringan yang berperan dalam biosintesis poliamin dari terung lokal, maka diharapkan dapat berkontribusi dalam peningkatan potensi plasma nutfah lokal terhadap toleransi cekaman abiotik tanaman.
Ruang Lingkup Penelitian
Sehubungan dengan tujuan penelitian untuk mengetahui mekanisme adaptasi tanaman terung terhadap cekaman kekeringan baik tinjauan secara fisiologi ataupun molekuler, maka disusun penelitian yang terdiri atas dua aspek kajian. Aspek pertama mencakup kajian respon dan mekanisme adaptasi tanaman terung ketika tercekam kekeringan sedangkan aspek kedua adalah kajian mengenai keterlibatan salah satu gen responsif cekaman kekeringan dan dugaan fungsi atau perannya dalam mekanisme adaptasi terhadap cekaman kekeringan.
Kedua aspek kajian tersebut kemudian dirumuskan dalam dua judul penelitian, sebagai berikut :
1. Pola akumulasi senyawa osmotikum prolin dan poliamin sebagai mekanisme adaptasi beberapa aksesi terung terhadap cekaman kekeringan
2. Isolasi dan analisis gen arginine decarboxylase (ADC) asal terung (Solanum melogena) responsif terhadap cekaman kekeringan
5 cekaman) di dalam rumah kaca. Untuk mengetahui respon dan mekanisme adaptasi terhadap cekaman kekeringan maka diperlukan beberapa peubah penting yang diamati dan dianalisis terkait pertumbuhan dan fisiologi tanaman.Bagan alir penelitian disajikan pada Gambar 2.
Hipotesis Penelitian
Berdasarkan ruang lingkup penelitian maka disusun hipotesis sebagai berikut:
1. Perbedaan aksesi terung akan menunjukkan perbedaan respon terhadap cekaman kekeringan.
2. Terdapat perbedaan peningkatan kandungan poliamin (putresin, spermidin dan spermin) pada setiap aksesi terung.
6
Persiapan bahan dan media tanam
Desain primer
Amplifikasi PCR
Deteksi gel agarose
Purifikasi agarose
Sintesis cDNA RNA total Aksesi toleran
Aksesi peka
Analisis Fisiologi :
Kadar air relatif pada daun
Kerapatan stomata
Stomata tertutup/terbuka
Kandungan klorofil
Akumulasi prolin
Kandungan poliamin Pengamatan
dan pengujian Pengamatan Morfologi :
Tinggi tanaman
Luas daun
Bobot kering tajuk
Bobot kering akar
Panjang akar
Tanpa cekaman (K0) (kondisi optimum) Cekaman kekeringan (K1)
Selama 21 hari (kondisi suboptimum)
Memasuki fase generatif Perlakuan
Perkecambahan dan pemeliharaan tanaman fase vegetatif
Reaksi reverse transkripsi
1.5 kb Fragmen gen ADC
Analisis homologi urutan basa pada database GenBank Sekuensing
Isolasi/ekstraksi daun
7
2
TINJAUAN PUSTAKA
Gambaran Umum Tanaman Terung-terungan
Terung-terungan (Solanum spp.) termasuk salah satu tanaman jenis sayuran yang penting. Terung berasal dari India dan Cina yang kemudian diperkenalkan ke Eropa oleh para pedagang Arab lalu dibawa ke Amerika Utara oleh para imigran Eropa (Magioli dan Mansur 2005). Tipe liar terung dengan ukuran buah kecil sering disebut sebagai S. melongena var. insanum, ditemukan di dataran Bengal,India. Variasi warna dan bentuk buah terung ditemukan di seluruh Asia Tenggara, hal ini menunjukkan bahwa daerah ini merupakan daerah pusat keragaman dan memungkinkan sebagai daerah asal tanaman terung. Solanum adalah salah satu genera tanaman vaskular terbesar yang memiliki lebih dari 1 500 spesies (Chen dan Li 1996).
Chen dan Li (1996) juga melaporkan manfaat buah terung berwarna putih bagi penderita diabetes dan sangat diajurkan bagi penderita gangguan hati. Selain itu kultivar terung berbuah oblong kaya akan gula total terlarut, sedangkan kultivar berbuah panjang memiliki kandungan gula reduksi, antosianin, fenol, glycol alkaloids (seperti solasodine), bahan kering, dan amide protein yang tinggi. Menurut Khan (1979), meskipun kandungan nutrisi terung masih lebih rendah dari tomat tetapi lebih baik jika dibandingkan dengan sayuran umum lainnya, yaitu 92.7% air, 1.4% protein, 1.3% serat, 0.3% lemak, 0.3% mineral, dan 4% sisanya terdiri atas karbohidrat dan vitamin (A dan C).
Menurut Collonnier et al. (2001), terung (Solanum melongena L.) yang banyak terdapat di Asia dan Afrika memiliki toleransi cukup baik terhadap cekaman biotik dan abiotik. Upaya penyilangan terung dengan kerabat liarnya untuk mendapatkan tanaman dengan keunggulan tertentu seperti produktivitas tinggi, rasa yang lebih enak, kandungan gizi yang lebih baik, warna yang lebih menarik serta ketahanan terhadap cekaman abiotik dan cekaman biotik mengalami keterbatasan akibat inkompatibilitas seksual. Menurut Magioli dan Mansur (2005), terung mudah diregenerasikan menggunakan teknik kultur jaringan, sehingga memungkinkan penerapan bioteknologi, khususnya eksploitasi variasi somaklonal, haploidisasi, hibridisasi somatik dan transformasi genetik dalam kegiatan pemuliaannya. Studi tentang hubungan interspesifik dan hibridisasi telah dilakukan pada tanaman terung karena hibridisasi interspesifik diperlukan untuk memasukkan gen pada tanaman budidaya.
8
suhu tinggi dan menyebabkan kekerdilan tanaman. Ketika suhu dan kelembaban relatif tinggi maka pertumbuhan terung lebih mengarah ke pertumbuhan vegetatif (Chen dan Li 1996).
Ketahanan terhadap hama atau patogen terung sebagian telah ditemukan tetapi masih pada taraf yang rendah, oleh karena itu untuk mendapatkan ketahanan yang lebih tinggi dari spesies liar masih sangat diperlukan. Di antara spesies liar, S. sisymbriifolium dan S. torvumare memiliki resistensi terhadap tiga penyakit yang paling serius pada tanaman terung yaitu layu bakteri, layu Verticillium dan nematoda. Jika kedua spesies disilangkan dengan S. melongena
tidak memberikan progeny fertil (Chen dan Li 1996). Resistensi terhadap layu bakteri dan cendawan telah berhasil diintroduksi ke dalam terung budidaya melalui hibridisasi somatik. Sebagian hibrida somatik yang dihasilkan menjadi steril jika menggunakan galur tetua yang mempunyai hubungan jauh, namun sebaliknya penggunaan kerabat dekat untuk fusi atau fusi asimetris menghasilkan hibrida subur/fertil yang memiliki sifat resistensi serta memiliki morfologi serupa dengan terung budidaya sehingga dapat mengurangi serangkaian silang balik/backcross untuk menghasilkan sifat-sifat yang diinginkan ke dalam terung. Variasi somaklonal juga telah digunakan untuk memperoleh galur dengan peningkatan toleransi terhadap salinitas dan penyakit daun kecil (little leaf disease) (Collonnier et al. 2001).
Studi hubungan genetik antara terung dan kerabatnya telah dilakukan menggunakan analisis AFLP dan ctDNA. Hingga saat ini hanya resistensi terhadap serangga dan perkembangan buah partenokarpi yang telah berhasil dikembangkan pada terung melalui transformasi yang dimediasi oleh
Agrobacterium tumefasciens (Collonnier et al. 2001). Namun demikian, rekayasa genetika terung untuk cekaman biotik dan abiotik lainnya baru mulai menjadi perhatian.
Fungsi Air dalam Pertumbuhan Tanaman
Air penting bagi pertumbuhan dan perkembangan tanaman. Air merupakan komponen utama tanaman, yaitu membentuk 80-90% bobot segar jaringan yang sedang tumbuh aktif. Air sebagai komponen utama tanaman memiliki peranan antara lain: (a) sebagai pelarut, di dalamnya terdapat gas, garam, dan zat terlarut lainnya, yang bergerak keluar masuk sel, (b) sebagai pereaksi dalam fotosintesis dan pada berbagai proses hidrolisis, (c) air esensial untuk menjaga tekanan turgor, terutama pada pembesaran sel, pembukaan stomata dan menyangga bentuk daun-daun muda atau struktur lainnya (Levitt 1980). Menurut Gardner et al. (1991), kandungan air pada tanaman bervariasi antara 70-90%, tergantung pada umur, spesies, jaringan dan lingkungan.
9 Kekurangan air akan mempengaruhi pertumbuhan dan hasil tanaman karena terjadinya perubahan pada anatomi, morfologi, fisiologi, biokimia dan pada akhirnya menurunkan produktivitas tanaman (Gardner et al. 1991).
Cekaman kekeringan, permanen atau sementara, membatasi pertumbuhan dan distribusi vegetasi alami serta produktivitas tanaman budidaya lebih dari faktor lingkungan lainnya (Zhang 1997). Ketika tanaman mengalami cekaman kekeringan atau tidak mendapatkan pasokan air yang cukup, tanaman akan mempertahankan rantai metabolismenya dengan mengatur pembukaan stomata yaitu melalui penutupan stomata untuk menghambat kehilangan air yang berlebihan lewat proses transpirasi (Mansfield et al. 1990). Namun, penutupan stomata akan menghentikan proses metabolisme penting dalam tanaman, oleh karena itu tanaman akan menjaga agar stomata tetap terbuka sebanyak mungkin (Takana et al. 2005). Selama air cukup tersedia pada siang hari, stomata terbuka agar CO2 dapat masuk melalui daun dan terjadi proses fotosintesis. CO2 merupakan bahan baku penting untuk fotosintesis. Fotosintesis akan terhenti jika tidak terdapat CO2. Terganggunya fotosintesis dapat menyebabkan gangguan pertumbuhan tanaman. Hal ini merupakan salah satu penyebab utama tanaman yang tumbuh di lahan kering akan lebih kecil dari tanaman yang tumbuh di lahan dengan pasokan air yang cukup tersedia (Casper et al. 2006; Kondoh et al. 2006).
Akumulasi Prolin dan Poliamin sebagai Respon terhadap Cekaman Kekeringan
Menurut Al-Ghamdi (2009), cekaman biotik dan abiotik dapat menimbulkan konsentrasi reactive oxygen species (ROS) berlebih yang mengakibatkan kerusakan oksidatif pada tingkat seluler. ROS merupakan hasil dari metabolism aerobik dan produksinya meningkat selama kondisi kekeringan melalui gangguan sistem transpor elektron. Oleh karena itu, konsekuensi dari kekeringan adalah keterbatasan fotosintesis dan biasanya disertai dengan pembentukan ROS di kloroplas seperti radikal superoksida (O2-), hidrogen peroksida (H2O2) dan radikal hidroksil (OH-) (Al-Ghamdi 2009). Tanaman memproduksi protein untuk menekan dampak cekaman biotik dan abiotik yang diinduksi oleh beberapa senyawa seperti asam salisilat (SA) atau asam askorbat (ASA) (Davies 2005). ASA dan SA adalah dua senyawa yang mampu secara efektif menurunkan dampak negatif cekaman kekeringan. ASA merupakan salah satu senyawa non-enzimatik yang terbaik sebagai antioksidan untuk melindungi tanaman dari cekaman oksidatif (Smironoff 1996). Reaksi pembentukan ROS dapat dilihat pada Gambar 3.
10
oksigen lainnya. Radikal oksigen merupakan molekul yang sangat reaktif, karena memiliki elektron yang tidak berpasangan dan dapat mengakibatkan kerusakan organel seperti kloroplas, mitokondria, dan membran plasma (Asada 2006). ASA bereaksi secara non-enzimatik dengan superoksida, hidrogen peroksida, dan oksigen singlet. Selain itu, ASA terlibat dalam fungsi-fungsi lainnya seperti pertumbuhan tanaman, regulasi gen, modulasi dari beberapa enzim dan regulasi redoks senyawa antioksidan yang terikat membran (Al-Ghamdi 2009).
Selain ASA, beberapa tanaman juga mengakumulasi prolin untuk menjaga keseimbangan osmotik sel saat mengalami cekaman kekeringan. Prolin merupakan asam amino proteinogenic yang sangat berperan dalam penyesuaian tekanan osmotik dan inisiasi metabolisme (Szabados dan Savouré 2009). Akumulasi prolin diduga berhubungan dengan kemampuan prolin bertindak sebagai osmoregulator, agen pelindung bagi enzim sitoplasma dan enzim-enzim membran (Sopandie 2006). Prolin juga ditanspor ke bagian ujung akar terutama pada zona pemanjangan akar untuk merangsang pertumbuhan akar sebagai respon awal ketika terjadi defisit air (Voetberg dan Sharp 1991).
Meskipun telah diketahui tentang sintesis dan katabolisme prolin terutama ketika dalam kondisi potensial air rendah, namun beberapa aspek fungsi biologinya masih belum jelas. Fungsi dan regulasi dari akumulasi prolin juga belum dipahami secara menyeluruh, dengan demikian rekayasa dari metabolisme prolin masih menarik dipelajari untuk membuktikan peranannya pada toleransi tanaman saat mengalami cekaman abiotik. Menurut Szabados dan Savouré (2009), prolin dapat berperan sebagai molekul sinyal untuk memodulasi fungsi mitokondria, berpengaruh pada proliferasi sel atau kematian sel, dan memicu ekspresi gen tertentu yang berperan pada pemulihan tanaman setelah mengalami cekaman.
Menurut Sharma et al. (2011), model sintesis dan katabolisme prolin pada jaringan spesifik ketika tanaman dalam kondisi potensial air rendah yaitu ketika potensial air rendah, sintesis prolin meningkat terutama pada jaringan fotosintesis dari tajuk (Pro-source), ditunjukkan dengan meningkatnya ekspresi dari ∆1 -pyrroline-5-carboxylate synthetase1 (P5CS1) dan ∆1 -pyrroline-5-carboxylatereductase (P5CR). Sintesis ini menghasilkan NADP untuk mempertahankan rasio NADP/NADPH teroksidasi. Kemudian sebagian prolin
3
11 didistribusikan ke bagian lain (Pro-sink) yaitu daerah untuk pertumbuhan akar dan tunas. Proses katabolisme prolin pada jaringan Pro-sink terjadi dalam mitokondria untuk menunjang pertumbuhan, namun hasil dari katabolisme prolin ini kemudian kembali ke tajuk untuk siklus selanjutnya masih belum diketahui dengan jelas (Gambar 4). Dari hasil sintesis prolin pada Pro-source dan katabolisme prolin pada Pro-sink, akumulasi prolin diperlukan sebagai fungsi lain seperti osmotic adjustment.
Senyawa terlarut lain yang terakumulasi dan berperan dalam proses pengaturan tekanan osmotik atau sering dikenal sebagai osmotic adjustment dalam menghadapi cekaman abiotik kekeringan adalah fruktan, trehalosa, manitol, ononitol, myo-inositol, glisin betain, dan poliamin. Peningkatan aktivitas biosintesis poliamin telah dipelajari pada berbagai proses pertumbuhan, perkembangan tanaman maupun kondisi cekaman pada tanaman (Evans dan Malmberg 1989; Walden et al. 1997). Poliamin (PA) yang terdiri atas putresin, spermidin dan spermin merupakan polikation sederhana yang ditemukan pada semua organisme hidup (Cohen 1998; Rajam 1997). Hubungan antara poliamin dan cekaman abiotik pertama kali diketahui dari akumulasi putresin sebagai respon terhadap kadar kalium suboptimal pada barley (Richards dan Coleman 1952). Kandungan poliamin tanaman dimodulasi oleh pengaturan arginine decarboxylase (ADC), ornithine decarboxylase (ODC), dan S-adenosyl methionine decarboxylase (SAMDC) (Capell et al. 2004). Jalur biosintesis PA pada tanaman secara menyeluruh telah dipelajari dengan rinci (Evans dan Malmberg 1989) dan relatif sudah diketahui dengan baik bersama inhibitornya pada biosintesis enzim (Gambar 5).
Gambar 4 Model sintesis dan katabolisme prolin pada jaringan spesifik dalam kondisi potensial air rendah (ѱw) (Sharma et al. 2011).
12
aktivitas sebagai pembatas, karena dengan aktivitas SAMDC akan tersedia aminopropil dari S-adenosyl methionine (SAM) yang digunakan oleh spermidine synthase dan spermine synthase untuk mengkonversi putresin menjadi spermidin dan spermin. SAM juga merupakan prekursor dalam biosintesis etilen. Peningkatan biosintesis poliamin, terutama melalui aktivitas SAMDC, cenderung mempengaruhi tingkat sintesis etilen. Perubahan poliamin lebih cenderung mempengaruhi ACC (1-aminocyclopropane-1-carboxylic acid) dan biosintesis etilen daripada sebaliknya, karena konsentrasi poliamin jauh lebih tinggi dibandingkan ACC dan etilen (Galston dan Kaur-Sawhney 1995; Kaur-Sawhney
et al. 2002). Hildebrand dan Grayburn (1991) melaporkan bahwa peningkatan etilen pada kondisi cekaman oksidatif terkait dengan peroksidasi lipid karena adanya aktivasi dari radikal oksigen.
Konversi Agmatin (Agm) ke Putresin (Put) membutuhkan dua enzim yang berbeda: N-carbamoylputrescine amidohydrolase (CPA) dan agmatine deiminase
(ADI). Spermidin (Spd) berfungsi sebagai substrat untuk sintesis Spermin (Spm), poliamin lebih tinggi. Putresin dikatabolisasi oleh diamin oksidase (DAOs), yang
mengkonversi Put menjadi Δ1-pyrroline dan menghasilkan amonia dan H2O2 sebagai produk sampingan (Kusano et al. 2008).
Poliamin berada dalam bentuk larutan bebas (free soluble) yang kemudian disebut free-polyaminesatau poliamin bebas. Poliamin juga dapat berkonjugasi dengan fenolik dan asam hydroxycinnamic atau terikat dengan makromolekul seperti protein dan asam nukleat (Quinet et al. 2010; Groppa dan Benavides 2008; Kaur-Sawhney et al. 2002). Fungsi bentuk terkonjugasi dari poliamin belum diketahui dengan baik. Bentuk terkonjugasi dari agmatin pada barley dapat
Ornithine Arginine
Gambar 5 Jalur biosintesis poliamin dan tautannya dengan biosintesis etilen. Enzim biosintesis ADC, ODC dan SAMDC serta inhibitor
13 meningkatkan karakter anti-cendawan dan pada tembakau bentuk poliamin terkonjugasi berupa alkaloid beracun seperti nikotin lebih banyak daripada poliamin bebas, tergantung pada jaringan (Burtin dan Michael 1997).
14
3
POLA AKUMULASI SENYAWA OSMOTIKUM PROLIN
DAN POLIAMIN SEBAGAI MEKANISME ADAPTASI
BEBERAPA AKSESI TERUNG TERHADAP CEKAMAN
KEKERINGAN
ABSTRACT
Proline and Polyamines Accumulation Patterns of Eggplant in Response to Drought Stress. Drought is one of most important environmental factors decreasing growth and productivity of plants. Proline and polyamines (PA) are essential compounds for cell survival and have key roles in plant stress protection. However, the role of proline and PA in drought stress responses of eggplant are not well understood. Seven eggplant accessions were drought stressed for 21-days and rewatered for the following next 7-days. The objective of this study was to reveal the drought tolerance mechanism of eggplant especially proline and polyamine pattern. The results showed that drought stress caused decrease of MWC and RWC which generally influenced leaf area, plant height, root length and dry weight. Eggplant reacts to water deficit with a closure of stomata to avoid further loss of water through transpiration. The chlorophyll content of the plants subjected to drought stress was relatively stable and equal to that of plant control. Drought stress also induced proline and PA accumulation in the leaf tissues of eggplant. These accumulations started at 14-days after drought stress period indicated by soil water content less than 20% and reached their peaks at 21-days after drought stress. The highest level of proline (134.70 μmol g-1) and that of putrescine (20.836 ng g-1) could be used as indicators in eggplant drought stress condition. Osmotic adjustment is one trait, which plays an important role in sustaining growth under water deficit conditions.
Keywords : eggplant, drought stress, physiological responses, proline, polyamine (PA), arginine decarboxylase (ADC)
PENDAHULUAN
15 tanah. Cekaman kekeringan dapat disebabkan oleh dua faktor, yaitu kekurangan suplai air di daerah perakaran atau laju kehilangan air (evapotranspirasi) lebih besar dari absorbsi air meskipun kadar air tanahnya cukup.
Respon tanaman terhadap kondisi defisit air berbeda-beda dan sangat tergantung pada spesies, waktu dan tingkat keparahan defisit air (Fu et al. 2013). Menurut Zlatev dan Lidon (2012), organisme tingkat tinggi termasuk tanaman memiliki interaksi yang komplek dengan lingkungan. Pengaruh lingkungan terhadap tanaman tergantung oleh faktor genetik dan interaksi antara genetik dengan lingkungannya. Menurut Behboudian (1977), tanaman terung memiliki sifat ketahanan terhadap kekeringan yang lebih baik jika dibandingkan dengan jenis tanaman sayuran lainnya. Menurut Chen dan Li (1996), terung lebih tahan terhadap kekeringan pada kondisi suhu tinggi jika dibandingkan dengan tomat, dan tahan pada kondisi curah hujan yang tinggi namun pertumbuhannya terhambat sehingga menyebabkan kekerdilan. Kemampuan tanaman untuk menyesuaikan diri terhadap lingkungan, salah satunya adalah ketersediaan air tanah dapat mempengaruhi perubahan morfologi dan karakteristik anatomi daun terung (Fu et al. 2013).
Mekanisme adaptasi yang kompleks juga terjadi ketika tanaman merespon kondisi cekaman kekeringan, diawali dengan cara tanaman menanggapi dan memberi sinyal cekaman yang kemudian menyebabkan perubahan biosintesis beberapa senyawa utama seperti asam absisat. Asam absisat diketahui sebagainya salah satu pemberi sinyal adanya cekaman kekeringan sehingga tanaman merespon dengan cara penutupan stomata daun untuk menghindari penguapan berlebih (Raghavendra et al. 2010). Akumulasi senyawa osmotik juga terjadi ketika cekaman terutama cekaman salinitas (kadar garam tinggi) ataupun defisit air. Menurut Achard et al. (2006), ketika tanaman mengalami cekaman maka terjadi pengalihan penggunaan senyawa penting yang semula digunakan untuk pertumbuhan kemudian digunakan untuk memproduksi senyawa yang dapat mengatur tekanan osmotik sel (osmotic adjustment) sehingga retensi air dan turgor sel meningkat. Prolin dan poliamin merupakan senyawa yang berperan dalam pengaturan tekanan osmotik dan terakumulasi pada beberapa tanaman ketika kondisi defisit air. Akumulasi prolin dan poliamin dapat digunakan sebagai indikator tingkat cekaman yang dihadapi tanaman (Aziz dan Larher 1995).
Prolin terakumulasi selama tanaman mengalami kekeringan disebabkan oleh aktivasi biosintesis prolin dan inaktivasi degradasi prolin (Prihastanti 2012), sedangkan poliamin terakumulasi saat tercekam terkait dengan perannya dalam jalur metabolisme hormon dan sinyal reactive oxygen species (ROS) (Alcázar et al. 2012). Oleh karena itu, mekanisme adaptasi beberapa aksesi terung (Solanum
spp.) terhadap cekaman kekeringan yang menyebabkan perubahan morfologi dan fisiologi terutama pola akumulasi senyawa prolin dan perubahan kandungan poliamin perlu dipelajari.
BAHAN DAN METODE
16
Modifikasi Jalur Biosintesa, Pusat Penelitian Bioteknologi-Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong-Bogor. Bahan tanaman yang digunakan adalah enam (6) aksesi terung yang berasal dari daerah kering di Indonesia dan satu varietas komersial (Panjalu F1) sebagai genotipe pembanding (Gambar 6; Tabel 1). Media persemaian terdiri atas campuran tanah dan pasir dengan perbandingan 1:1 (v/v), dan media tanam terdiri atas campuran tanah, pasir dan kompos dengan perbandingan 1:1:1(v/v/v). Media dimasukkan ke dalam ember plastik berdiameter 30 cm dan tinggi 20 cm yang dilubangi pada kedua sisi berlawanan sebanyak 3 titik dengan jarak 5 cm. Setiap ember berisi 8 kg campuran media.
Tabel 1 Genotipe terung dan lokasi asalnya
No. Nomor Genotipe Lokasi Asal Koleksi 1
2 3 4 5 6 7
Panjalu F1 098 155 414 754 772 827
Varietas komersial Wilayah Bogor dan sekitarnya Gunung Kidul, Yogyakarta
Cilacap, Jawa Tengah Bengkulu
NTT NTT
Minahasa, Sulawesi Utara
Pelaksanaan Penelitian
Penanaman dan pemeliharaan
Perkecambahan biji tujuh genotipe terung dilakukan dengan merendam biji-biji yang terpilih dalam air hangat selama 15 menit dan kemudian direndam larutan KNO3 5% selama 24 jam untuk menghilangkan sifat dormansinya. Benih ditanam pada media persemaian sampai 14 hari setelah semai (HTS), kecambah yang tumbuh baik dan sehat dengan tinggi relatif seragam dipindahtanam pada Gambar 6 Keragaan buah beberapa aksesi terung (Solanum spp.) yang digunakan
dalam penelitian; Panjalu F1(A), 098 (B), 155 (C), 414 (D), 754 (E), 772 (F), dan 827 (G)
D C
B A
17 media campuran tanah, pasir dan kompos. Pemeliharaan tanaman dilakukan hingga benih tumbuh dengan baik. Pemberian pupuk NPK majemuk (16:16:16) dilakukan pada minggu ke 3 dan ke 5 setelah transplanting dengan cara dilarutkan dalam air dengan konsentrasi 20 gL-1, dengan dosis 150mL/tanaman (Koswara 2006). Penyemprotan insektisida dilakukan sesuai tingkat dan jenis serangan hama. Penyiangan terhadap tanaman pengganggu dilakukan secara berkala.
Perlakuan cekaman kekeringan
Penelitian disusun berdasarkan rancangan kelompok lengkap teracak dengan 2 faktor dan 3 ulangan. Faktor pertama adalah perlakuan yang terdiri atas dua taraf, yaitu perlakuan disiram sesuai dengan kadar air pada media awal sebelum perlakuan dimulai (K0) dan tanpa disiram selama 21 hari (K1). Perlakuan cekaman kekeringan merujuk metode Yue et al. (2006) yang dimodifikasi serta metode Easlon dan Richards (2009) yaitu penghentian penyiraman dilakukan ketika tanaman memiliki 6 lembar daun dengan luas daun penuh dan seragam.
Skema perlakuan cekaman kekeringan sebagai berikut : 1. Tanaman disiram sesuai volume kadar air media awal (K0).
2. Tanaman tanpa disiram dan dibiarkan mendapat cekaman kekeringan selama 21 hari (K1).
Faktor yang kedua adalah genotipe yang terdiri atas tujuh taraf. Terdapat 42 unit percobaan dari 14 kombinasi perlakuan dengan 3 ulangan. Total tanaman yang disiapkan adalah 420 tanaman. Data yang diperoleh dianalisis menggunakan sidik ragam dan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf kepercayaan
λ5% (α = 0.05) dengan SAS 9.1.3.
Pengamatan
Pengamatan dilakukan terhadap kadar air media (KAM), kadar air relatif (KAR) daun, pengukuran kandungan klorofil dan akumulasi prolin pada 0, 7, 14, 21 HSP cekaman kekeringan dan 7 hari setelah pengairan kembali (rewatering). Pengukuran akumulasi poliamin, pengamatan kerapatan stomata serta rasio stomata dilakukan pada 21 HSP. Peubah pertumbuhan meliputi; luas daun dan
Penyiraman sesuai kadar air media awal 7-14 hari
Fase generatif Fase vegetatif
Fase perkecambahan
7 hari pengairan kembali 21 hari cekaman kekeringan
6 lembar daun sudah tumbuh
penuh 7-14 hari
Fase generatif Fase vegetatif
18
tinggi tajuk pada 0 dan 21 HSP; panjang akar, bobot kering tajuk dan akar pada 21 HSP cekaman kekeringan.
Pengukuran KAM dilakukan secara gravimetri dengan mengambil sampel tanah ± 10 g (di bagian atas, tengah dan bawah). Sampel tanah ditimbang untuk memperoleh bobot basah (BB), kemudian dioven pada suhu 80ºC selama 48 jam untuk mendapatkan bobot kering (BK). KAM diperoleh dengan persamaan sebagai berikut : kemudian dilakukan hidrasi selama 24 jam di dalam botol vial untuk memperoleh bobot jenuh (BJ) yang sebelum pengukuran ditiriskan terlebih dahulu menggunakan kertas tissue. Sampel daun selanjutnya dioven pada suhu 80ºC selama 48 jam untuk mendapatkan bobot kering (BK), yang sebelum penimbangan telah didinginkan di dalam desikator. KAR daun diperoleh dengan persamaan sebagai berikut : dengan mengukur panjang daun (P) mulai dari bagian pangkal daun sampai ujung daun terpanjang dan mengukur lebar daun (L) mulai pada bagian helai daun terlebar. LD dihitung menggunakan persamaan sebagai berikut :
LD (cm2) = P x L x k
k adalah konstanta kalibrasi (0.74).
Tinggi tajuk diukur mulai dari permukaan tanah sampai pada titik tumbuh. Panjang akar diukur mulai dari pangkal akar sampai ujung akar terpanjang. Bobot kering akar dan bobot kering tajuk diukur secara terpisah dengan cara dioven pada suhu 80ºC selama 48 jam. Pengukuran prolin dilakukan berdasarkan metode Bates
19
HASIL DAN PEMBAHASAN
Perubahan Kadar Air Media (KAM) dan Kadar Air Relatif (KAR) Daun selama Perlakuan Cekaman Kekeringan
Penentuan periode perlakuan cekaman kekeringan pada ke-7 aksesi tanaman terung dilakukan berdasarkan percobaan pendahuluan, dimana penundaan penyiraman selama 21 hari merupakan waktu yang tepat ketika kadar air media diperkirakan berada diantara kapasitas lapang dan titik layu permanen. Hal ini ditandai dengan mampu pulihnya (recover) tanaman yang diberi perlakuan cekaman kekeringan seperti tanaman kontrol setelah dilakukan penyiraman (rewatering) mencapai 80%. Keadaan tersebut menunjukkan bahwa ke-7 genotipe hanya mengalami layu sementara selama 21 HSP dan belum mencapai titik layu permanen meskipun KAM rata-rata perlakuan cekaman kekeringan hampir mencapai 10% (Gambar 7).
Gambar 7 Status kadar air media antara kontrol ( ) dan perlakuan cekaman kekeringan ( ) selama 21 hari pada beberapa aksesi terung ** = berbeda sangat nyata pada = 0.05; Rew = rewatering
20
Penurunan KAM (cekaman kekeringan) menyebabkan kehilangan air pada jaringan tanaman sehingga turgor sel menurun, mempengaruhi membran sel dan potensi aktivitas kimia air dalam tanaman (Mubiyanto 1997). Kadar air media menggambarkan besarnya air tersedia yang diserap oleh tanaman untuk melakukan pertumbuhan hingga batas air tidak tersedia, yang kemudian akan menyebabkan tanaman mengalami kelayuan. Besarnya air yang diperlukan tanaman meningkat seiring dengan besarnya pertumbuhan tanaman. Kebutuhan air setiap tanaman sangat dipengaruhi oleh faktor genetik tanaman (Ashri 2006).
Aksesi 827 mengalami penurunan KAM terbesar, sedangkan aksesi 098 mengalami penurunan KAM terkecil (Gambar 8). Kondisi ini berlangsung sampai akhir periode cekaman yaitu pada 21 HSP. Penurunan KAM aksesi 827 pada 21 HSP mencapai 73% dibandingkan kontrol. Penurunan KAM yang tajam pada aksesi 827 diduga terkait dengan keragaandan pertumbuhan tanaman.
Gambar 8 Status kadar air media tujuh aksesi terung antara tanaman kontrol ( ) dan perlakuan cekaman kekeringan ( ) pada 21 hari HSP
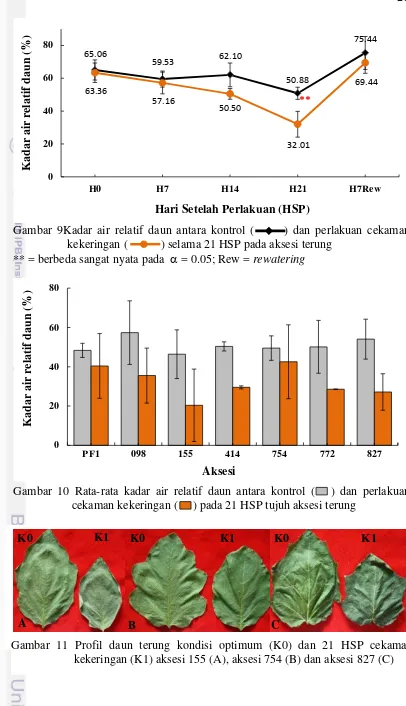
Penurunan KAM diikuti juga dengan terjadinya penurunan KAR daun. KAR merupakan indikator utama kekeringan. Penurunan KAR daun menunjukkan perbedaan yang nyata terjadi pada hari ke 21 setelah perlakuan (Gambar 9). Terdapat interaksi penurunan KAR daun antara aksesi dengan perlakuan cekaman kekeringan pada 21 HSP. Penurunan KAR daun terbesar terjadi pada aksesi 155 dan aksesi 827 yaitu sebesar 56% dan 50%, sedangkan kelima aksesi yang lainnya terjadi penurunan rata-rata sebesar 30% (Gambar 10).
Penurunan KAR daun yang besar pada aksesi 155 dan aksesi 827 berdampak pada keragaan daun aksesi 155 dan aksesi 827 yang lebih layu dari aksesi lainnya (Gambar 11). Penurunan KAR daun merupakan salah satu mekanisme pertahanan hidup terhadap cekaman kekeringan. Sodikin (2009) melaporkan bahwa pada tanaman kedelai toleran terjadi penurunan KAR daun yang jauh lebih kecil jika dibandingkan dengan varietas peka. Menurut Sarker et al. (2004), tanaman terung memiliki kemampuan efisiensi pemanfaatan air yang lebih baik jika dibandingkan dengan tanaman tomat terutama pada kemampuannya pulih kembali setelah penyiraman (rewatering).
0 10 20 30 40
PF1 098 155 044 754 772 827
Kad
ar
air
m
ed
ia
(%
)
21 kekeringan (K1) aksesi 155 (A), aksesi 754 (B) dan aksesi 827 (C)
22
Respon Pertumbuhan Tanaman Terung terhadap Cekaman Kekeringan
Tinggi tajuk tujuh aksesi terung yang digunakan pada penelitian ini memiliki perbedaan yang sangat nyata, sehingga untuk melihat pengaruh cekaman kekeringan pada pertumbuhan tanaman terung diukur pertambahan (∆) tinggi tanaman sejak 0 hingga 21 HSP. Aksesi 827 memiliki tinggi tanaman tertinggi dibandingkan dengan aksesi lainnya (Gambar 12). Tinggi tajuk berkorelasi positif dengan KAM yang menunjukkan bahwa keragaan tanaman yang besar diduga berimplikasi pada kebutuhan air yang lebih tinggi. Selain aksesi 827, aksesi yang memiliki tajuk yang tinggi adalah PanjaluF1 yang merupakan aksesi pembanding. Cekaman kekeringan yang secara nyata menurunkan pertambahan tinggi tajuk menunjukkan bahwa cekaman kekeringan menghambat pertumbuhan tanaman pada fase vegetatif. Kekurangan air pada tanaman akan mempengaruhi semua proses metaboliknya sehingga dapat menurunkan pertumbuhan tanaman (Ashri 2006).
Gambar 12 Rata-rata pertambahan tinggi tajuk tujuh aksesi terung pada 21 HSP cekaman kekeringan ( ) dan kontrol ( )
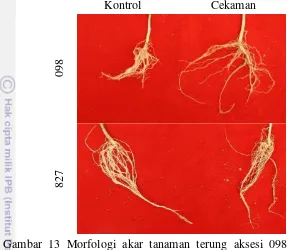
Cekaman kekeringan selama 21 HSP juga menghambat pertumbuhan akar namun menurunkan panjang akar tidak berbeda nyata dengan kondisi optimum (Gambar 13; Tabel 2). Umumnya tanaman dengan pengairan yang baik mempunyai sistem perakaran yang lebih panjang daripada tanaman yang tumbuh pada tempat kering. Rendahnya kadar air tanah akan menurunkan perpanjangan akar, kedalaman penetrasi dan diameter akar. Peningkatan pertumbuhan akar pada kondisi cekaman air ringan sampai sedang terkait dengan respon tanaman dalam mencari sumber air.
Hasil penelitian Nour dan Weibel (1978) menunjukkan bahwa kultivar-kultivar sorgum yang lebih tahan terhadap kekeringan mempunyai perakaran yang lebih banyak, volume lebih besar dan nisbah akar tajuk lebih tinggi daripada yang rentan kekeringan. Penelitian Martin et al. (1994) menunjukkan bahwa perakaran tanaman ercis yang mengalami cekaman kekeringan pada pertengahan siklus hidupnya tidak dapat mencapai lapisan tanah pada kedalaman 45-75 cm, sehingga cekaman kekeringan menurunkan hasil tanaman dan bahkan tanaman gagal
23 membentuk hasil. Jika intensitas cekaman kekeringan semakin tinggi dan periodenya semakin lama maka dapat mengakibatkan kematian.
Kontrol Cekaman
098
827
Gambar 13 Morfologi akar tanaman terung aksesi 098 dan aksesi 827 pada kondisi optimum (kontrol) dan 21 HSP cekaman kekeringan
Selama 21 HSP cekaman kekeringan, respon adaptasi terung adalah dengan menggugurkan daun tua yang mempunyai luas daun besar dan penurunan pertumbuhan ukuran luas daun. Hal tersebut diduga untuk mengurangi kehilangan air yang berlebihan, sehingga luas daun tanaman terung yang tercekam kekeringan berbeda nyata dengan luas daun pada kondisi optimum. Walaupun cekaman kekeringan menyebabkan hambatan pertumbuhan pada tanaman terung, cekaman kekeringan tidak menyebabkan penurunan bobot kering tajuk dan akar aksesi terung yang diuji (Tabel 2).
Tabel 2 Rata-rata luas daun, panjang akar, bobot kering tajuk dan bobot kering akar aksesi terung pada 21 HSP cekaman kekeringan
Perlakuan Luas daun (cm2)
Panjang akar (cm)
Bobot kering tajuk (g)
Bobot kering akar (g)
Kontrol 158.58 21.36 1.16 1.03
Cekaman 98.85 18.97 1.10 1.02
Uji-t ** tn tn tn
Keterangan : ** = berbeda nyata; tn= tidak berbeda nyata pada = 0.05
Penelitian Khan et al. (2012) terhadap tanaman cabai (Capsicum annuum
L.) menunjukkan bahwa cekaman kekeringan menyebabkan penurunan bobot kering tajuk dan bobot kering total tanaman berbeda nyata dibandingkan kontrol. Penelitian Rezaei et al. (2012) menunjukkan bahwa penambahan glycinebetain
24
tersebut mengindikasikan peran penting senyawa osmotikum dalam toleransi tanaman terhadap cekaman kekeringan.
Tanaman terung yang digunakan dalam penelitian ini dapat mempertahankan bobot kering akar dan bobot kering tajuk pada kondisi cekaman kekeringan. Hal tersebut mengindikasikan bahwa tanaman terung relatif toleran terhadap cekaman kekeringan dibandingkan anggota famili Solanaceae lainnya. Penelitian Sarker dan Hara (2009) terhadap tanaman terung (Solanum melongena
L.) yang diberi kombinasi perlakuan cekaman kekeringan dan peningkatan konsentrasi CO2, menunjukkan hasil bahwa terjadi perubahan struktur pada sel akar tanaman terung. Hal tersebut diduga karena cekaman kekeringan berkontribusi terhadap akumulasi lemak suberin pada bagian lapisan endodermis dan eksodermis yang menyebabkan penurunan konduktansi hidrolik. Konduktansi hidrolik yang rendah sangat diharapkan ketika defisit air karena dapat meminimalkan terjadinya transpirasi atau penguapan yang berlebihan. Menurut Hsiao dan Acevedo (1974) sit Khan et al. (2012), jika cekaman tidak parah kemungkinan akan berdampak kecil terhadap penurunan bobot kering tetapi akan cukup berpengaruh terhadap penurunan hasil. Aksesi dengan bobot kering yang rendah dapat dikategorikan sebagai aksesi peka dan aksesi dengan bobot kering tinggi merupakan aksesi toleran.
Mekanisme Adaptasi Tanaman Terung terhadap Cekaman Kekeringan
Perlakuan cekaman kekeringan pada terung sangat nyata menurunkan kerapatan dan persentase stomata terbuka pada 21 HSP (Tabel 3). Penurunan kerapatan stomata dan persentase stomata terbuka merupakan respon adaptasi tanaman terung untuk mengurangi kehilangan air melalui transpirasi. Stomata memainkan peran penting dalam regulasi status air daun. Menurut Fu et al. (2013), stomata daun terung sebagian besar terletak di sisi abaxial pada lapisan bawah trikoma, memiliki ukuran stomata serta daun lebih kecil saat tercekam kekeringan jika dibandingkan dengan kondisi status air normal. Penelitian Benesova et al. (2012) pada tanaman jagung menunjukkan bahwa genotipe toleran mempunyai kemampuan untuk mempertahankan stomata tetap dalam kondisi terbuka dan aktif berfotosintesis meskipun berada dalam kondisi dehidrasi.
Tabel 3 Rata-rata kerapatan stomata dan persentase stomata terbuka aksesi terung pada 21 HSP cekaman kekeringan
Perlakuan Kerapatan stomata (mm2) Stomata terbuka (%)
Kontrol 631.36 46.67
Cekaman 506.24 22.94
Uji-t ** **
Keterangan : ** = berbeda nyata pada = 0.05
25 dilaporkan bahwa tanaman terung memiliki kemampuan efisiensi pemanfaatan air yang lebih baik jika dibandingkan tanaman tomat terutama pada kemampuannya pulih kembali setelah penyiraman (rewatering).
Kandungan klorofil daun pada tanaman terung merupakan salah satu faktor penting yang menentukan kemampuan fotosintesisnya. Cekaman kekeringan selama 21 hari tidak mempengaruhi kandungan klorofil daun. Kandungan klorofil daun pada tanaman perlakuan relatif sama dan tidak berbeda nyata dengan kontrol hingga akhir periode cekaman (Gambar 14). Perubahan kandungan klorofil selama cekaman kekeringan telah diteliti pada tanaman Festuca arundinasea L. dan Poa protensis L. dengan kombinasi perlakuan kekeringan dan suhu tinggi. Kandungan klorofil daun meningkat sementara selama periode cekaman (6-12 HSP), selanjutnya menurun perlahan-lahan dengan lamanya periode cekaman (Huang dan Jiang 2000).
Gambar 14 Kandungan klorofil daun aksesi terung antara kontrol ( ) dan perlakuan cekaman kekeringan ( ) selama 21 HSP
Kandungan Senyawa Prolin dan Poliamin
Hasil analisis ragam menunjukkan bahwa cekaman kekeringan berpengaruh sangat nyata terhadap kandungan senyawa prolin pada 14 HSP (28.97 µmol g-1) dan 21 HSP (89.77 µmol g-1). Konsentrasi prolin meningkat tajam pada 21 HSP (Gambar 15). Meskipun tidak ada interaksi antara ketujuh aksesi dengan perlakuan cekaman kekeringan selama 21 HSP, namun terlihat kecenderungan bahwa aksesi 827 sudah mengalami peningkatan kandungan prolin secara tajam pada 14 HSP dan kemudian terjadi penurunan pada 21 HSP (Gambar 16).
Aksesi 827 merespon lebih cepat kondisi kekeringan dengan peningkatan senyawa prolin sebagai osmoprotektan untuk mempertahankan potensial osmotik dalam tanaman. Peningkatan prolin tertinggi terjadi pada aksesi pembanding yaitu Panjalu F1 dan aksesi 155 masing-masing sebesar 134.70 mol g-1 dan 101.18
mol g-1 yaitu 10–13 kali lebih tinggi dibanding kontrol dan yang terendah pada
aksesi 754 sebesar 40.07 mol g-1
atau 3 kali lebih tinggi dari kontrol.
Peningkatan prolin secara tajam pada akhir periode kekeringan menunjukkan bahwa tanaman dalam keadaan tercekam sangat berat. Hal ini