POTENSI FRAKSI AKTIF DAUN KACANG BABI (
Tephrosia
vogelii
) SEBAGAI ANTIKANKER
RIDHO PUTROTOMO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RIDHO PUTROTOMO. Potensi Fraksi Aktif Daun Kacang Babi (
Tephrosia
vogelii
) sebagai Antikanker. Dibimbing oleh GUSTINI SYAHBIRIN dan DJOKO
PRIJONO.
Kacang babi (
Tephrosia vogelii
) telah dimanfaatkan sebagai insektisida
nabati. Berhubung sifat toksiknya tersebut, daun tumbuhan ini diuji potensinya
sebagai antikanker. Ekstrak metanol kasar difraksionasi menggunakan ekstraksi
cair-cair menghasilkan 4 fraksi, yaitu fraksi
n-
heksana, fraksi kloroform, fraksi
n
-butanol, dan fraksi air. Uji letalitas larva udang menunjukkan bahwa semua fraksi
aktif memiliki toksisitas tinggi, dengan fraksi
n
-butanol menunjukkan aktivitas
tertinggi, yaitu 28.29 ppm. Uji fitokimia keempat fraksi positif menunjukkan
golongan senyawa alkaloid dan flavonoid. Fraksi teraktif menghasilkan 2 noda
pada pemisahan dengan kromatografi lapis tipis menggunakan eluen
n
-heksana-kloroform (3:7). Spektrum inframerah noda dengan
R
f~
0.82 menunjukkan
beberapa kemiripan dengan standar rotenon dan diduga merupakan rotenon. Noda
dengan
R
f~
0.75 menghasilkan serapan yang berbeda dengan standar rotenon
sehingga diduga sebagai golongan rotenoid lain dengan gugus OH.
Kata kunci: antikanker, kacang babi, rotenoid
ABSTRACT
RIDHO PUTROTOMO. Potency of Active Fraction of Fish-poison Bean
(
Tephrosia vogelii
) as Leaves an Anticancer
.
Supervised by GUSTINI
SYAHBIRIN and DJOKO PRIJONO.
Fish-poison bean (
Tephrosia vogelii
) has been used as a botanical
insecticide. Due to its toxic property, the leave of this plant was studied for its
anticancer potency. Crude methanol extract was fractionated by using
liquid-liquid extraction yielding 4 fractions, namely
n
-hexane, chloroform,
n
-butanol,
and water fractions. Brine shrimp lethality test showed that all active fractions
had
high toxicity with
n
-butanol fraction showed the highest activity, that was 28.29
ppm. Phytochemical test of the 4 fractions were positively showed alkaloids and
flavonoids. The most active fraction produced 2 spots in separation with thin layer
chromatography by using
n
-hexane-chloroform (3:7) as the eluent. The infrared
spectrum of the spot with
R
f~
0.82
showed several similarities with rotenone
standard and was expected to be rotenone. The spot with
R
f~
0.75 gave different
absorption from the standard so that it was predicted to be other rotenoid having
-OH group.
Disetujui
Pembimbing I
Dr Gustini Syahbirin, MS
NIP 19600819 198903 2 001
Pembimbing II
Ir Djoko Prijono, MAgrSc
NIP 1959827 198303 1 005
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Tanggal Lulus:
Judul Skripsi : Potensi Fraksi Aktif Daun Kacang Babi (
Tephrosia vogelii
)
sebagai Antikanker
Nama : Ridho Putrotomo
POTENSI FRAKSI AKTIF DAUN KACANG BABI (
Tephrosia
vogelii
) SEBAGAI ANTIKANKER
RIDHO PUTROTOMO
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas berkat limpahan
rahmat dan hidayah-Nya penulis dapat menyelesaikan karya ilmiah yang berjudul
Potensi Fraksi Aktif Daun Kacang Babi (
Tephrosia vogelii
) sebagai Antikanker.
Shalawat serta salam semoga selalu tercurahkan kepada junjungan Nabi
Muhammad SAW yang telah membimbing umatnya hingga akhir zaman.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr Gustini Syahbirin
MS dan Bapak Ir Djoko Prijono MAgrSc, selaku pembimbing yang senantiasa
memberikan arahan, dorongan semangat, dan doa kepada penulis selama
melaksanakan penelitian. Penulis juga mengucapkan terima kasih kepada
Ibu,
Papa, Mbak Rina, dan yang terkasih
Livia Elsa atas motivasi, doa, dan waktu
luangnya.
Penghargaan penulis sampaikan kepada seluruh Staf Laboratorium Kimia
Organik, Bapak Budi Arifin, Bapak Sabur, Wahyu, Lia, Ugi, Catur, Astri, Mbak
Herma, Mbak Nella, Syifa, Rina, Dumas atas bantuan serta masukan selama
penelitian berlangsung. Terima kasih takterhingga penulis ucapkan kepada Kak
Bekti serta seluruh keluarga Cemara, Adi, Indra, Fijar, Feli, Risal, Fery, Irvan,
Dono, Farid dan keluarga besar Kimia 43 atas doa, kasih sayang, motivasi, serta
segala dukungan yang telah kalian berikan.
Atas segala khilaf dan kekurangan, semoga dapat dibukakan pintu maaf
yang sebesar-besarnya. Penulis berharap karya ilmiah ini dapat bermanfaat bagi
semua pihak dan juga bagi perkembangan ilmu pengetahuan.
Bogor, Januari 2013
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 1
Lingkup Kerja ... 1
Fraksionasi Ekstrak Metanol Daun Kacang Babi ... 1
Uji Fitokimia ... 1
Uji Toksisitas Fraksi terhadap
A. salina
... 2
Pencirian Senyawa Fraksi Teraktif ... 2
HASIL DAN PEMBAHASAN
Fraksi Ekstrak Metanol Daun Kacang Babi ... 2
Kandungan Fitokimia ... 3
Toksisitas terhadap Larva Udang ... 3
Ciri-ciri Senyawa Fraksi Teraktif ... 3
SIMPULAN DAN SARAN
Simpulan ... 4
Saran ... 4
DAFTAR PUSTAKA ... 4
DAFTAR GAMBAR
1 Kacang babi (
T. vogelii
) ... 1
2
Struktur kimia rotenon dan deguelin ... 1
3 Fraksi
n
-heksana, kloroform, metanol-air, dan
n
-butanol dari ekstrak metanol
daun kacang babi. ... 3
4 Nilai LC
50keempat fraksi ekstrak daun kacang babi terhadap
A. salina
... 3
5 Kromatogram fraksi
n
-butanol daun kacang babi
dengan penampak lampu
UV 254 dan 366 nm Eluen kloroform:
n
-heksana (7:3) ... 4
DAFTAR LAMPIRAN
1 Diagram alir penelitian ... 7
2 Rendemen fraksi daun kacang babi... 8
3 Kandungan metabolit sekunder daun kacang babi ... 8
4 Penduga parameter hubungan konsentrasi-mortalitas ekstrak daun
T. vogelii
terhadap larva
A. salina
dengan metode BSLT ... 8
5 Hasil uji toksisitas BSLT fraksi terhadap larva
A. salina
(larva awal 10) ... 9
6 Spektrum FTIR standar rotenon, noda 1 dan noda 2 fraksi
n
-butanol ... 10
7 Serapan inframerah fraksi
n
-butanol daun kacang babi ... 11
PENDAHULUAN
Kacang babi (Tephrosia vogelii) (Gambar 1) merupakan salah satu jenis tumbuhan yang memiliki potensi untuk dikembangkan sebagai insektisida nabati. Bagian tumbuhan tersebut, terutama daunnya memiliki aktivitas insektisida yang kuat (Delfel et al. 1970; Gaskins et al. 1972). Tumbuhan kacang babi yang termasuk famili Fabaceae ini dikenal kaya akan isoflavonoid. Isoflavonoid merupa-kan metabolit sekunder golongan flavonoid yang memiliki distribusi terbatas. Flavonoid banyak ditemukan pada berbagai jenis tumbuhan, sedangkan isoflavonoid umumnya hanya terdapat pada kacang-kacangan seperti kedelai, yang memiliki kandungan isoflavonoid genistein dan daidzein, keduanya bersifat antioksidatif dan dapat berkhasiat sebagai obat (Anderson 2002).
Gambar 1 Kacang babi (T. vogelii). Senyawa isoflavonoid dalam tumbuhan kacang babi adalah kelompok rotenoid seperti rotenon, deguelin, dan tefrosin (Delfel et al. 1970; Lambert et al. 1993; Koona & Dorn 2005). Kosmeder (1998) melaporkan bahwa senyawa rotenon dan deguelin (Gambar 2) dapat menurunkan pertumbuhan sel tumor kelenjar susu sehingga berpotensi antikanker. Fang dan Casida (1998), Li et al. (2012) telah melaporkan efek senyawa rotenon dan deguelin sebagai kemopreventif kanker. Selain itu, Prijono dan Pujianto (2008) juga melaporkan toksisitas ekstrak n-heksana daun kacang babi terhadap ulat krop kubis
Crocidolomia pavonana dengan konsentrasi mematikan 50% (LC50) 0.14% (b/v).
(a) (b) Gambar 2 Struktur kimia (a) rotenon dan (b)
deguelin
Potensi antikanker lazim diujikan dengan menggunakan metode uji letalitas larva udang (BSLT). Metode BSLT merupakan uji penapisan awal potensi antikanker dari ekstrak tanaman (Meyer et al. 1982) dengan hasil uji berupa nilai LC50.
Penelitian ini bertujuan mencari fraksi teraktif ekstrak metanol daun kacang babi menggunakan metode BSLT sebagai indikasi potensi antikanker (Colegate & Molyneux 2008). Senyawa fraksi teraktif dicirikan dengan spektroskopi inframerah transformasi Fourier (FTIR).
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan ialah ekstrak metanol daun kacang babi yang berasal dari Cianjur, etil asetat, metanol, kloroform, n -butanol, n-heksana, Tween 80, dan larva A. salina Leach. Alat-alat yang digunakan ialah spektrofotometer FTIR Perkin Elmer Spectrum One di Laboratorium Bidang Pangan, Gedung Pusat Laboratorium Terpadu, Universitas Islam Negeri Syarif Hidayatullah, Jakarta.
Lingkup Kerja
Metode penelitian dilakukan mengikuti diagram alir pada Lampiran 1. Tahapannya meliputi fraksionasi ekstrak metanol daun kacang babi, pengujian toksisitas fraksi dengan metode BSLT, dan pencirian gugus fungsi senyawa fraksi teraktif dengan FTIR.
Fraksionasi Ekstrak Metanol Daun Kacang Babi
Sebanyak 10 g ekstrak metanol daun kacang babi diencerkan dengan metanol-air deionisasi (1:1) sebanyak 100 mL lalu dimasukkan ke dalam corong pisah, dan difraksionasi dengan n-heksana dengan nisbah 1:5. Penambahan n-heksana dilakukan secara bertahap sampai fase organik tidak berwarna. Fase organik dipisahkan dari fase air, lalu dipekatkan dengan penguap putar dan dikeringbekukan. Berikutnya fase air difraksionasi kembali berturut-turut menggunakan kloroform dan n-butanol dengan prosedur yang sama.
Uji Fitokimia (Harborne 1987)
dalam 10 mL kloroform lalu ditambahkan 4 tetes NH4OH dan disaring. Filtrat yang
diperoleh ditambahkan 10 tetes H2SO4 2 M
kemudian dikocok hingga terbentuk 2 lapisan. Lapisan asam diteteskan pada lempeng tetes dan ditambahkan pereaksi Dragendorf, Mayer, dan Wagner. Uji positif jika berturut-turut didapatkan endapan berwarna jingga, putih, dan cokelat.
Saponin. Sebanyak 0.1 g dari setiap fraksi daun kacang babi dilarutkan dalam 10 mL akuades panas dan dididihkan selama 5 menit. Campuran disaring dan dikocok kuat selama 10 menit hingga timbul busa. Apabila busa stabil selama 10 menit, maka filtrat positif mengandung saponin.
Steroid dan Triterpenoid. Sebanyak 0.1 g dari fraksi daun kacang babi dilarutkan masing-masing dalam 25 mL etanol panas (50
°C) kemudian disaring ke kaca arloji dan diuapkan sampai kering. Residu dilarutkan dalam eter dan ditambahkan 3 tetes pereaksi Lieberman-Burchard. Uji positif triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan uji positif steroid ditandai dengan terbentuknya warna hijau atau biru.
Tanin. Sebanyak 0.1 g dari setiap fraksi daun kacang babi masing-masing dilarutkan dalam 10 mL akuades panas kemudian disaring. Filtrat ditambahkan FeCl3 1%.
Warna hijau, biru, atau hitam menunjukkan filtrat positif mengandung tanin.
Flavonoid. Sebanyak 0.1 g dari setiap fraksi daun kacang babi dilarutkan masing-masing dalam 10 mL akuades panas kemudian disaring. Sebanyak 5 mL filtrat ditambahkan 0.05 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol kemudian dikocok kuat. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah, jingga, atau kuning pada lapisan amil alkohol.
Uji Toksisitas Fraksi terhadap A. salina
(Krishnaraju et al. 2005)
Penetasan Telur A. salina. Telur A. salina yang sudah siap ditetaskan ditimbang sebanyak 0.5 g, kemudian dimasukkan ke dalam wadah yang berisi air laut yang sudah disaring dan diaerasi. Telur dibiarkan selama 48 jam di bawah pencahayaan lampu agar menetas sempurna. Telur yang telah menetas menjadi larva digunakan untuk uji toksisitas.
Larutan stok fraksi n-heksana, kloroform,
n-butanol, dan air dibuat dengan konsentrasi 1000 ppm dalam pelarut air laut. Apabila ada fraksi yang tidak larut, ditambahkan 1 mL
Tween 80. Selanjutnya setiap fraksi dimasukkan ke dalam sumur uji dengan konsentrasi berturut-turut 200, 150, 100, 50, dan 10 ppm, lalu masing-masing dimasukkan 10 ekor larva udang. Uji dilakukan sebanyak 3 kali ulangan. Selanjutnya sumur uji ditutup dengan aluminium foil dan diinkubasi selama 24 jam. Nilai LC50 ditentukan dengan
menggunakan analisis probit.
Pencirian Senyawa Fraksi Teraktif (Houghton dan Raman 1998)
Fraksi teraktif dipantau nodanya dengan menggunakan pelat kromatografi lapis tipis (KLT) dengan eluen n-heksana-kloroform (3:7) (Panggraito 2011). Noda yang dihasilkan dari proses elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm. Setiap noda yang diperoleh dicirikan menggunakan FTIR.
HASIL DAN PEMBAHASAN
Fraksi Ekstrak Metanol Daun Kacang Babi
Sampel yang digunakan sudah berbentuk ekstrak kasar dalam pelarut metanol, berwarna hijau pekat dengan rendemen 7.10% (b/v). Bobot ekstrak kasar 14.4681 g (Wulan 2008). Ekstrak metanol ini kemudian difraksionasi cair-cair untuk memisahkan senyawa metabolit sekunder berdasarkan tingkat kepolarannya. Fraksionasi diawali dengan pelarut nonpolar, yaitu n-heksana. Fraksi
n-heksana berwarna hijau (Gambar 3a).
Fraksi metanol sisa difraksionasi kembali dengan kloroform. Tidak terjadi pemisahan antara kloroform dan metanol, karena kepolaran kedua pelarut ini hampir sebanding. Untuk itu, ditambahkan air dengan nisbah 1:1 untuk menambah kepolaran metanol sehingga kedua fraksi terpisahkan. Fraksi kloroform berwarna cokelat (Gambar 3b).
3
(a) (b) (c) (d)
Gambar 3 Fraksi n-heksana (a), kloroform (b), metanol-air (c), dan n- butanol (d), dari ekstrak metanol daun kacang babi.
Berdasarkan Tabel 1, rendemen terbesar diperoleh pada fraksi n-heksana. Hal ini menunjukkan bahwa senyawa nonpolar lebih dominan pada sampel. Perhitungan rendemen dirangkum dalam Lampiran 2.
Tabel 1 Rendemen fraksi daun kacang babi Fraksi Rendemen (% b/b)
n-Heksana 3.43 Kloroform 0.77
n-Butanol 0.59 Metanol-air 0.79
Kandungan Fitokimia
Uji fitokimia bertujuan menentukan kandungan metabolit sekunder pada suatu tumbuhan. Uji fitokimia dilakukan pada fraksi
n-heksana, kloroform, dan n-butanol. Uji yang dilakukan meliputi uji alkaloid, saponin, triterpenoid, steroid, tanin, dan flavonoid.
Hasil uji fitokimia (Lampiran 3) menunjukkan bahwa ketiga fraksi mengandung alkaloid. Hanya fraksi n-butanol yang positif mengandung flavonoid. Hasil uji negatif ditunjukkan pada uji saponin, triterpenoid, dan steroid. Hasil uji negatif mengindikasikan bahwa fraksi-fraksi daun kacang babi tidak mengandung golongan senyawa tersebut atau kandungannya dalam contoh sangat kecil.
Hasil uji fitokimia menunjukkan bahwa kemungkinan golongan senyawa yang aktif sebagai antikanker pada daun kacang babi adalah alkaloid dan flavonoid. Hasil uji fitokimia alkaloid menghasilkan endapan yang cukup banyak. Uji fitokimia flavonoid pada fraksi n-butanol menghasilkan intensitas warna kuning yang pekat. Alkaloid dan flavonoid telah dilaporkan memiliki potensi sebagai antikanker (Yi et al. 2005).
Toksisitas terhadap Larva Udang
Uji toksisitas dengan metode BSLT menggunakan larva udang A. salina
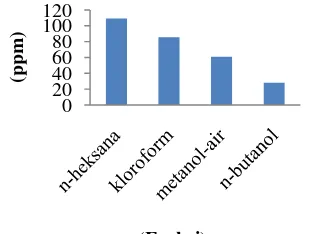
digunakan untuk menentukan fraksi teraktif. Parameter sitotoksisitas yang didapatkan adalah nilai LC50 (Gambar 4) yang diperoleh
dari hasil dengan perangkat lunak analisis probit (Lampiran 4). Data yang dianalisis diberikan pada Lampiran 5.
(Fraksi)
Gambar 4 Nilai LC50 keempat fraksi ekstrak
daun kacang babi terhadap A. salina.
Fraksi n-butanol daun kacang babi memiliki nilai LC50 paling rendah (28.29 ppm)
dibandingkan dengan ketiga fraksi lainnya. Fraksi ini dapat dikatakan sebagai fraksi teraktif karena semakin rendah nilai LC50,
semakin tinggi toksisitasnya. Toksisitas fraksi ini lebih tinggi dibandingkan dengan ekstrak
n-heksana daun keji beling yang memiliki nilai LC50 sebesar 30.49 ppm (Rahmah et al.
2011). Suatu senyawa dikatakan berpotensi untuk dikembangkan lebih lanjut sebagai antikanker apabila mempunyai LC50 ≤ 30
μg/mL (Meyer et al. 1982).
Senyawa flavonoid diperkirakan berperan dalam efek toksik dari ekstrak n-butanol. Menurut Ren et al. (2003), flavonoid mempunyai efek penting pada pencegahan kanker dan kemoterapi kanker. Sementara Vrana dan Grant (2001) melaporkan peranan senyawa golongan alkaloid dan terpenoid pada pencegahan kanker.
Ciri-ciri Senyawa Fraksi Teraktif
Fraksi n-butanol diuji dengan KLT menggunakan fase diam silika gel GF254 pelat
Uji KLT ekstrak n-butanol menghasilkan 2 noda di bawah lampu UV 254 nm, yaitu noda 1 dengan nilai Rf ~ 0.82dan noda 2 dengan
nilai Rf ~ 0.75 (Gambar 5a). Dengan
menggunakan lampu UV 366 nm, fraksi n -butanol juga menampakkan keberadaan noda 2 (Gambar 5b). Kedua noda yang diperoleh ini dicirikan lebih lanjut dengan membanding-kan spektrum FTIR-nya dengan spektrum FTIR standar rotenon (Lampiran 6)
(a) (b)
Gambar 5 Kromatogram fraksi n-butanol daun kacang babi dengan penampak lampu UV 254 nm (a) dan 366 nm (b). Eluen n -heksana-kloroform (3:7). Rotenon merupakan kelompok kecil senyawa isoflavonoid golongan rotenoid yang banyak terkandung dalam kacang babi. Spektrum FTIR standar rotenon (Lampiran 6a) memiliki puncak serapan 3080.04 cm-1 yang menunjukkan ulur CH aromatik; 2941.65 cm-1 (ulur CH2 asimetrik); 1672.40
cm-1 (ulur CO2 asimetrik) yang mewakili
struktur isoflavonoid; 1304.50, 1265.15, dan 1212.64 cm-1 (gugus oksiaril); 1092.43 dan 1006.43 cm-1 (H-aromatik sebidang); serta 911.50 dan 812.93 cm-1 (H-aromatik di luar bidang).
Spektrum FTIR noda 1 (Lampiran 6b) memiliki puncak serapan pada bilangan gelombang 3431.10 cm-1 yang menunjukkan ulur OH dan tidak dijumpai pada spektrum FTIR standar rotenon. Serapan 2959.72 cm-1 berasal dari vibrasi ulur –CH2 asimetrik,
1727.96 cm-1 (ulur aromatik C=O), dan 1273.48 cm-1 (gugus oksiaril). Serapan di daerah sidik jari (742.78 dan 705.51 cm-1) menunjukkan gugus aromatik monosubstitusi. Adanya gugus aromatik pada noda 1 dan beberapa puncak serapan yang mirip dengan standar, diduga bahwa noda 1 merupakan golongan isoflavonoid. Namun, terdapat serapan gugus OH, maka noda 1 bukan senyawa rotenon. Senyawa pada noda 1 diduga golongan rotenoid lain dengan gugus OH, yaitu rotenolon atau tefrosin.
Spektrum FTIR noda 2 (Lampiran 6c) memberikan puncak serapan di 2941.52 cm-1 yang menunjukkan ulur CH2 asimetrik.
Serapan di 1731.66 cm-1 menunjukkan ulur C=O aromatik; 1672.07 dan 1611.10 cm-1 (ulur CO2 asimetrik); 1233.01 dan 1211.71
cm-1 (gugus oksiaril) yang merupakan ciri senyawa flavonoid; serta 1092.45 dan 1005.55 cm-1 (H aromatik sebidang). Serapan di 911.21, 812.14, dan 809.96 cm-1 menunjukkan lentur aromatik H di luar bidang; serapan di 782.70, 754.04, dan 728.68 cm-1 menunjukkan gugus benzena monosubstitusi dan lekuk CH dalam bidang. Serapan keseluruhan FTIR standar rotenon, noda 1, dan noda 2 dirangkum dalam Lampiran 7 dan struktur kelompok rotenoid dirangkum dalam lampiran 8. Noda 2 memiliki beberapa puncak serapan yang sama dengan standar rotenon khususnya gugus aromatik. Meskipun ada puncak serapan yang berbeda, perbedaan tersebut dapat disebabkan oleh fraksi n-butanol yang bercampur. Dengan demikian, noda 2 diduga merupakan senyawa rotenoid dari golongan isoflavonoid, yaitu rotenon.
SIMPULAN DAN SARAN
Simpulan
Fraksi daun kacang babi diduga berpotensi sebagai antikanker. Fraksi n-butanol paling aktif dengan nilai LC50 28.29 ppm. Fraksi ini
menghasilkan 2 noda dengan eluen n -heksana-kloroform dengan nisbah 3:7 (v/v) KLT, yaitu Rf ~ 0.75 dan Rf ~ 0.82.
Berdasarkan spektrum FTIR, noda dengan Rf
~ 0.82 diduga merupakan senyawa rotenon, sedangkan noda dengan Rf ~ 0.75 diduga
merupakan golongan rotenoid lain dengan gugus –OH.
Saran
Kedua senyawa dari dari fraksi n-butanol perlu ditentukan strukturnya dengan spektrofotoneter resonans magnet inti serta diuji aktivitas antikanker lebih lanjut.
DAFTAR PUSTAKA
Anderson JW. 2002. Meta-analysis of the effect of soy proteins intake of serum lipid.
J Med 333:276-282.
Colegate SM, Molyneux RJ. 2008. Bioactive
Natural Products: Detection, Isolation
Noda 2 Noda 1
5
and Structural Determination. California: CRC Pr.
Delfel NE, Tallent WH, Carlson DG, Wolff IA. 1970. Distribution of rotenone and deguelin in Tephrosia vogelii and separation of rotenoid-rich fractions. J Agric Food Chem 18:385-390.
Fang N, Casida JE. 1998. Anticancer action of cube insectiside: correlation for rotenoid constituents between inhibition of NADH:ubiquinone oxidoreductase and induced ornithine decarboxylase activities.
Proc Natl Acad Sci 95:3380-3384.
Gaskins MH et al. 1972. Tephrosia vogelii: A Source of Rotenoids for Insecticidal and Piscicidal Use. Technical Bulletin 1445.
Washington DC: US Government Printing Office.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Phytochemical Methods.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extract. London: Chapman & Hall.
Koona P, Dorn S. 2005. Extracts from
Tephrosia vogelii for the protection of stored legume seeds against damage by three bruchid species. Ann Appl Biol
147:43-48.
Kosmeder JW. 1998. Synthesis and evaluation of rotenoids, flavonoids, and dithiocarbamates as cancer chemopreventive agents [tesis]. Chicago: University of Illinois.
Krishnaraju AV et al. 2005. Assessment of bioactivity of Indian medicinal plants using brine shrimp (A. salina) lethality assay. Int J Appl Sci Eng 3:125-134. Lambert N, Trouslot MF, Nef-Campa C,
Crestin H. 1993. Production of rotenoids by heterotrophic and photomixotrophic cell cultures of Tephrosia vogelii.
Phytochemistry 34:1515-1520.
Li Z, Wu J, Wu C, Jiang J, Zheng, Xu B, Li M. 2012. Deguelin, a natural rotenoid, inhibits mouse myeloma cell growth in vitro via induction of apoptosis. Oncol Lett
4:677-681.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, Mc Laughlin JL. 1982.
Brine shrimp: a convenient general bioassay for active lant constituents. Plant Medica 45:31-34.
Mukhtar MH, Adnan AZ, Pitra MW. 2007. Uji sitotoksisitas minyak atsiri daun kamanggi (Ocimum basilicum L) dengan metode Brine Shrimp Lethality Test Bioassay. J Sains Tek Far 12:1-4.
Panggraito A. 2011. Perbandingan kandungan senyawa rotenoid dan aktivitas insektisida ekstrak Tephrosia vogelii terhadap hama kubis Crocidolomia pavonana [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Prijono D, Pudjianto. 2008. Pengembangan formulasi insektisida botani yang dibakukan berbasis daun kacang babi (Tephrosia vogelii Hook.f., Leguminosae) dan buah kemukus (Piper cubeba L.f., Piperaceae) [laporan Research Grant Program B]. Bogor: Departemen Proteksi Tumbuhan, Institut Pertanian Bogor. Ren W, Qiao Z, Wang H, Zhu L, Zhang L.
2003. Flavonoid: promising anticancer agents. Med Res Rev 2:519-534.
Rahmah M, Hardianti S, Susanti E. 2011. Aktivitas sitotoksik ekstrak heksana, diklorometana dan metanol daun keji beling (Sericocalyx crispus. L) terhadap
Artemia salina Leach. Sekolah Tinggi Ilmu Farmasi Riau.
Supratman U. 2009. Elusidasi Struktur
Senyawa Organik. Ed ke-5. Bandung:
FMIPA Unpad.
Vrana JA, Grant S. 2001. Synergistic induction of apoptosis in human leukemia cells (U937) exposed to bryostatin 1 and the proteosome inhibitor lactacystin involves dysregulation of the PKC/MAP cascade. Blood 97:2015-2114.
Wulan RDR. 2008. Aktivitas insektisida ekstrak daun Tephrosia vogelii Hook. f. (Leguminosae) terhadap larva
Crocidolomia pavonana (F.)
(Lepidoptera: Pyralidae) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Yi WG, Fischer J, Akoh CC. 2005. Study of anticancer activities of muscadine grape phenolics in vitro. J Agric Food Chem
7
Lampiran 1 Diagram alir penelitian
Uji toksisitas larva udang (pencarian fraksi teraktif)
Ekstrak metanol daun kacang babi
+ metanol-air (1:1)
+
n
-heksana
Fraksi
n
-heksana
Fraksi metanol-air
Fraksi kloroform
Fraksi metanol-air
Fraksi
n
-butanol
Fraksi metanol-air
Uji fitokimia
Pemantauan fraksi teraktif dengan KLT
Pencirian dengan FTIR
+ kloroform
8
Lampiran 2 Rendemen fraksi daun kacang babi
Fraksi
b
(g)
a
(g)
Rendemen
(%b/b)
n
-Heksana
12.0071
0.4192
3.43
Kloroform
12.0082
0.0931
0.77
n
-Butanol
11.8319
0.0751
0.59
Air
12.0075
0.0951
0.79
Contoh perhitungan rendemen fraksi daun kacang babi
= 3.43%
Lampiran 3 Kandungan metabolit sekunder daun kacang babi
Komponen
fitokimia
Bahan
Keterangan
FH
FK
FB
FMA
Alkaloid
++
++
+++
+
Terdapat endapan
Saponin
-
-
-
-
Tidak berbusa
Triterpenoid
-
-
-
-
Tidak berwarna merah/ungu
Steroid
-
-
-
-
Tidak berwarna hijau/biru
Tanin
-
-
-
-
Hijau
Flavonoid
-
-
++
-
Kuning
Lampiran 4
Penduga parameter hubungan konsentrasi-mortalitas ekstrak daun
T.
vogelii
terhadap larva
A. salina
dengan metode BSLT
9
Lampiran 5 Hasil uji toksisitas BSLT fraksi terhadap larva
A. salina
(larva awal
10)
Keterangan: Rerata kematian =
FH = fraksi
n
-heksana, FK = fraksi kloroform FB = fraksi
n
-butanol
,
FMA =
fraksi methanol-air
Konsentrasi
Jumlah larva mati
Rerata Kematian (%)
(ppm)
FH
FK
FB
FMA
FH
FK
FB
FMA
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
10
1
1
3
2
13.3
20
30
23.3
1
3
4
3
2
2
2
2
50
2
3
5
3
23.3
23.3
53.3
33.3
3
1
5
3
2
3
6
4
100
4
5
7
6
46.7
53.3
76.7
56.7
5
5
7
6
5
6
9
5
150
7
7
9
7
56.7
66.7
86.7
73.3
5
6
9
8
5
7
8
7
200
7
8
10
7
70
70
100
76.7
7
7
10
9
10
Lampiran 6 Spektrum FTIR standar rotenon (a), noda 1 (b), dan noda 2 (c) fraksi
n
-butanol
(a)
(b)
1
Lampiran 7 Serapan inframerah fraksi
n
-butanol daun kacang babi
Standar rotenon Fraksi 1 Fraksi 2
Bilangan gelombang (cm-1) Gugus fungsi Bilangan gelombang (cm-1) Gugus fungsi Bilangan gelombang (cm-1) Gugus fungsi 3084.04 C-H aromatik 3431.10 ulur OH 2941.52 ulur -CH2-asimetri
2941;2916 ulur -CH2
-asimetrik 2959.72
ulur -CH2
-asimetrik 1731.66 ulur C=O aromatik 1672.40 ulur CO2
asimetrik 1727.96
ulur C=O
aromatik 1672.07;1611.10 ulur CO2 asimetrik
1610.03;1514.95 benzena
monosubstitusi 1272.48 Oksiaril 1233.01;1211.71 Oksiaril 1456.81 lekuk C-H
alifatik 1124.14;1072.59 CH sebidang 1092.45;1005.55 H-aromatik sebidang 1351.15 vinilik 742.78;705.51 aromatik mono
substitusi 911.21;812.14;809.96
H-aromatik di luar bidang
1304.50;1265.15;1212.64 oksiaril 782.70;754.04;728.68 lekuk C-H sebidang benzena monosubstitusi 1092.43;1006.43 H-aromatik sebidang 673.99;634.28 lekuk CH di luar bidang 911.50;812.93 H-aromatik di luar bidang 551.26;501.03;475.23 CH2
(Supratman 2009)