KEEFEKTIFAN LIMBAH
Brassica
SEBAGAI BIOFUMIGAN
DALAM PENGENDALIAN NEMATODA PURU AKAR
(
Meloidogyne
sp.) PADA TANAMAN TOMAT
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Limbah Brassica sebagai Biofumigan dalam Pengendalian Nematoda Puru Akar (Meloidogyne sp.) pada Tanaman Tomat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AMALLIA ROSYA. Keefektifan Limbah Brassica sebagai Biofumigan dalam Pengendalian Nematoda Puru Akar (Meloidogyne sp.) pada Tanaman Tomat Dibimbing oleh SUPRAMANA dan ABDUL MUNIF.
Nematoda puru akar (NPA), Meloidogyne sp., merupakan nematoda parasit tanaman utama yang menyebabkan kehilangan hasil 5-20%. Di Indonesia beberapa penelitian telah dilakukan hanya sebagai penelitian di rumah kaca. Kekurangan data menyebabkan kehilangan hasil oleh nematoda parasit tanaman di lapangan belum dapat diprediksi. Salah satu metode pengendalian yang potensial terhadap NPA adalah penggunaan biofumigan. Biofumigan adalah senyawa yang bersifat volatil dan dapat digunakan untuk pengendalian Meloidogyne sp. Glukosinolat (GSL) dilaporkan telah banyak digunakan sebagai biofumigan. Senyawa ini banyak ditemukan dari tanaman famili kubis-kubisan (Brassicaceae). Beberapa penelitian melaporkan bahwa senyawa isotiosianat (ITS) sangat beracun bagi patogen tular tanah, antara lain cendawan Gaeumanomyces graminis var. tritici, Fusarium oxysporum, Rhizoctonia solani dan Pythium, bakteri Ralstonia solanacearum. Senyawa ITS dilaporkan dapat mematikan nematoda Pratylenchus dan Meloidogyne.
Penelitian ini bertujuan untuk mengetahui keefektifan berbagai limbah Brassicaceae, yaitu kubis (Brassica oleracea var. capitata), kembang kol (B. oleracea var. botrytis), brokoli (B. italica var. oleracea), kubis Cina (B. chinensis) dan pakcoy (B. rapa var. parachinensis) dalam mengendalikan NPA (Meloidogyne sp.) pada tanaman tomat. Tanah yang terinfestasi nematoda dan limbah Brassica diambil dari Pasir Sarongge, Cianjur, Jawa Barat yang digunakan sebagai bahan penelitian. Penelitian dilakukan di rumah kaca dan rancangan percobaan yang digunakan adalah split-spit plot rancangan acak lengkap (RAL). Limbah Brassicaceae, dosis limbah dan waktu inkubasi berturut-turut ditetapkan sebagai petak utama, anak petak dan anak-anak petak. Pot yang diaplikasi Carbofuran (Furadan 3G, 60kg/ha) sebagai kontrol positif, tanpa limbah Brassica sebagai kontrol negatif dan tanaman tomat sebagai tanaman indikator. Percobaan diulang 5 kali.
SUMMARY
AMALLIA ROSYA. The Effectiveness of Brassica Remnant as Biofumigant to Control Root Knot Nematodes (Meloidogyne sp.) on Tomatoes. Supervised by SUPRAMANA and ABDUL MUNIF.
Root knot nematode (RKN), Meloidogyne sp., is a major plant parasitic nematode causing 5-20% yield loss. In Indonesia, previous researches have been conducted only as study of green house. Lack of data causes the yield losses of plant-parasitic nematodes on farm cannot be predicted yet. One of potential control methods against RKN is utilization of biofumigant. Biofumigants are volatile compound that can be utilized to control Meloidogyne sp. Glucosinolates (GSL) had been studied and used widely as biofumigants. This compound was widely studied and found mostly in crucifereous plant (Brassicaceae). The previous studies reported the isothiocyanate compound (ITS) was highly toxic to soil-borne pathogens, such as fungi Gaeumanomyces graminis var. tritici, Fusarium oxysporum, Rhizoctonia solani and Pythium, bacterium Ralstonia solanacearum. ITS compounds were reported lethal nematode Pratylenchus and Meloidogyne.
This research aimed to determine the effectiveness of various Brassicaceae remnants, that were: cabbage (Brassica oleracea var.capitata), cauliflower (B. oleracea var. botrytis), broccoli (B. oleracea var. italica), Chinese cabbage (B. chinensis) and pakcoy (B. rapa var. parachinensis) to control root knot nematode Meloidogyne sp. on tomato. Nematode infested soil and remnant of Brassica taken from Pasir Sarongge Cianjur West Java had been used as research materials. The experiment was conducted in the green house and arranged in a split-split plot completely randomized design (CRD). Brassicaceae remnants, remnant dosage and incubation periode were set as the mainplot, sub-plot and subsub-plot, respectively. Carbofuran (Furadan 3G, 60 kg/ha) was used as positive control, without Brassica remnant pot as negative control, and tomato as indicator plants. The experiment was replicated 5 times.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
KEEFEKTIFAN LIMBAH
Brassica
SEBAGAI BIOFUMIGAN
DALAM PENGENDALIAN NEMATODA PURU AKAR
(
Meloidogyne
sp.) PADA TANAMAN TOMAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih pada tesis ini adalah Keefektifan Limbah Brassica Sebagai Biofumigan Dalam Pengendalian Nematoda Puru Akar (Meloidogyne sp.) pada Tanaman Tomat.
Penulis menyampaikan rasa hormat dan ucapan terima kasih kepada Bapak Dr Ir Supramana, MSi dan Dr Ir Abdul Munif, MSc Agr selaku dosen pembimbing dengan kesabaran dan keikhlasan dalam membimbing sehingga membuka wawasan penulis dalam menyelesaikan tesis ini.
Penulis menyampaikan rasa hormat dan ucapan terima kasih serta penghargaan sebesar-besarnya kepada kedua orang tua Ayahanda Syahrum dan Ibunda Rosna Alam yang telah memberi dukungan moril dan materil serta sebagai motivator terbesar dalam kehidupan penulis, semoga ketulusan hati beliau dalam mendidik penulis mendapat balasan pahala dan limpahan rahmat dari Allah SWT. Kepada saudara/i saya Fajri Syah, Anggi Ansyah dan Aulia Putri Rosya yang senantiasa memberikan motivasi kepada penulis. Rekan-rekan seperjuangan Fitopatologi 2012 yang sangat kompak dalam kebersamaannya, terima kasih atas arahan serta nasehat yang bersifat membangun bagi penulis baik dalam hal perkuliahan maupun dalam kehidupan sehari-hari. Rekan-rekan Laboratorium Nematologi Tumbuhan, khususnya Bapak Gatut Heru Bromo yang banyak membantu penulis selama penelitian berlangsung. Terimakasih kepada Daniel Ferryansyah yang selalu setia menemani dan memotivasi penulis selama menyelesaikan tesis ini. Serta semua pihak yang namanya tidak tercantum yang telah memberikan andil secara ikhlas membantu penulis dalam berbagai hal.
Akhirnya dengan segala kerendahan hati, penulis menyadari bahwa hasil dari karya ini masih sangat jauh dari kesempurnaan. Oleh karena itu, penulis sangat mengharapkan kritikan dan saran positif yang bersifat membangun dalam mengembangkan karya ini, sehingga dapat berguna bagi kita semua, insya Allah, Amin.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1. PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2. TINJAUAN PUSTAKA 3
Nematoda Puru Akar 3
Fumigasi 7
Biofumigan 8
3. METODE 11
Waktu dan Tempat Penelitian 11
Metode 11
Penyiapan tanah 11
Penyiapan limbah Brassica dan tanaman indikator 11
Rancangan percobaan 11
Penghitungan populasi awal nematoda puru akar 11
Perlakuan biofumigasi 12
Pengamatan efek uji biofumigasi terhadap nematoda puru akar 12
Pengamatan mikroba tanah 12
Identifikasi spesies NPA dengan pola perinial (Perineal Pattern) 13
Analisis data 13
4. HASIL DAN PEMBAHASAN 13
Hasil 13
Pembahasan 19
5. KESIMPULAN 22
DAFTAR PUSTAKA 22
DAFTAR TABEL
1. Jenis isotiosianat yang berperan sebagai biofumigan yang dihasilkan
famili Brassicaceae 10
2. Rata-rata jumlah puru dan keefektifan pengendalian Meloidogyne sp.
pada tanaman tomat di rumah kaca pada perlakuan limbah Brassica 13 3. Rata-rata keefektifan pengendalian perlakuan jenis, dosis dan waktu
inkubasi limbah Brassica terhadap penurunan jumlah puru
Meloidogyne sp. pada tanaman tomat 14
4. Rata-rata keefektifan pengendalian perlakuan jenis dan dosis limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp. pada
Tanaman Tomat 15
5. Rata-rata keefektifan pengendalian perlakuan jenis dan waktu inkubasi limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp.
pada tanaman tomat 15
6. Rata-rata keefektifan pengendalian perlakuan dosis dan waktu inkubasi limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp.
pada tanaman tomat 15
7. Pengaruh perlakuan limbah Brassica terhadap rata-rata tinggi dan
jumlah daun tanaman tomat di rumah kaca 17
DAFTAR GAMBAR
1. Siklus hidup nematoda puru akar 4
2. Puru yang terbentuk dengan perlakuan tanpa limbah Brassica (P0), carbofuran dan perlakuan masing-masing limbah Brassica (J1, J2, J3,
J4 dan J5) pada tanaman tomat. 16
3. Pengamatan pertumbuhan tanaman tomat minggu pertama sampai
minggu keempat di rumah kaca 17
4. Pola perinial nematoda betina Meloidogyne incognita 18
DAFTAR LAMPIRAN
1. Rata-rata populasi nematoda pada tanah yang diberi perlakuan
limbah Brassica 27
2. Morfologi Melodogyne sp. dan nematoda non parasit pada tanaman
tomat 28
3. Populasi bakteri pada tanah yang diberi perlakuan limbah Brassica 29 4. Koloni bakteri pada tanah yang diberi perlakuan limbah Brassica
DAFTAR LAMPIRAN (lanjutan)
5. Rata-rata populasi cendawan pada tanah yang diberi perlakuan
limbah Brassica 31
6. Hasil isolasi cendawan tanah yang diberi perlakuan limbah Brassica
pada media PDA 32
7. Pengamatan suhu masing-masing sampel perlakuan limbah Brassica 34 8. Annova keefektifan perlakuan limbah Brassica dalam menurunkan
1
PENDAHULUAN
Latar Belakang
Nematoda merupakan salah satu jenis organisme pengganggu tanaman (OPT) penting yang menyerang berbagai jenis tanaman pertanian utama di seluruh Dunia. Kehilangan hasil pertanian akibat infestasi nematoda di seluruh Dunia mencapai US$80 miliar/tahun (Price 2000). Di Indonesia, nematoda parasit dilaporkan menginfeksi berbagai jenis tanaman, baik pangan, hortikultura maupun perkebunan (Puskara 2000). Kerugian ekonomi akibat nematoda pada tanaman pertanian di Indonesia belum dapat diperkirakan, mengingat data kerusakan yang ada masih bersifat parsial, hanya berdasarkan hasil penelitian di rumah kaca dan lapangan dalam luasan yang sangat terbatas. Gejala khas nematoda puru akar (NPA) pada akar yaitu bintil-bintil yang sering disebut puru. Gejala lain yaitu terjadinya nekrosis dan membentuk sel transfer makanan dalam bentuk giant cell (sel raksasa) pada tempat infeksi. Bila terinfeksi berat, tanaman tumbuh kerdil dengan daun yang mengalami klorosis atau pucat (Luc et al. 2005). Teknik pengendalian nematoda pada beberapa tanaman penting antaranya adalah pemanfaatan varietas tahan atau toleran, teknik pergiliran tanaman, pengendalian hayati dengan menggunakan agen hayati dan pestisida nabati, pencegahan penyebaran, pengendalian kimiawi, dan berbagai teknik budidaya lainnya. Strategi pengendalian nematoda dilaksanakan dengan menerapkan sistem PHT, yaitu dengan memadukan satu atau lebih teknik pengendalian yang kompatibel (Mustika 2010). Pengendalian nematoda pada umumnya dilakukan secara kimiawi dengan menggunakan nematisida sintetik. Nematisida yang sering digunakan untuk mengendalikan NPA biasanya berupa fumigan dan non-fumigan (Luc et al. 2005).
Fumigasi adalah cara perlakuan pengendalian organisme penggangu tanaman termasuk patogen dengan menggunakan gas beracun, salah satunya adalah metil bromida (CH3Br). Senyawa ini memiliki tingkat penetrasi yang
tinggi, keuntungan lain fumigasi adalah membunuh semua siklus hidup serangga dan patogen tanpa mengotori bahan yang difumigasi (Hendrawan 2007). Metil bromida banyak digunakan untuk fumigasi merupakan salah satu senyawa yang dapat merusak ozon. Bahan perusak lapisan ozon tergolong senyawa kimia yang berpotensi dapat bereaksi dengan molekul ozon di lapisan stratosfir (Kementerian Perdagangan Republik Indonesia 2006)
bahan aktif metil bromida harus memenuhi syarat dari Badan Karantina Tumbuhan. Petugas Karantina Tumbuhan adalah pejabat fungsional pengendali organisme pengganggu tumbuhan yang bekerja pada Instansi Karantina Pertanian. Perusahan fumigasi yang telah diregistrasi Badan Karantina Pertanian yang dapat melakukan perlakuan fumigasi dengan fumigan metil bromida.
Biofumigan adalah senyawa yang mudah menguap (volatil) yang berasal dari tanaman dan bersifat biosida terhadap serangga dan patogen. Banyak ragam jenis senyawa biofumigan. Senyawa yang telah banyak diteliti dan dimanfaatkan sebagai biofumigan adalah glukosinolat (GSL). Senyawa glukosinolat banyak berasal dari famili kubis-kubisan (Brassicaceae) antara lain Raphanus sativus, Brassica juncae, B. oleraceae dan B. oleraceae var. italica. Glukosinolat merupakan senyawa yang mengandung nitrogen (N) dan belerang (S) hasil metabolisme sekunder tanaman. Glukosinolat terdapat pada seluruh bagian tanaman. Hasil proses hidrolisis glukosinolat berperan dalam berbagai fungsi fisiologis patogen. Proses hidrolisis glukosinolat terjadi jika senyawa ini kontak dengan enzim mirosinase dan tersedia air yang cukup. Kontak antara glukosinolat dengan mirosinase terjadi jika jaringan tanaman robek. Hidrolisis glukosinolat menghasilkan senyawa isothiosianat (ITS) yang merupakan senyawa toksik sehingga dapat digunakan sebagai biofumigan (Litbang Departemen Pertanian 2009).
Faktor-faktor yang berperan penting dalam proses hidrolisis GSL berlangsung optimum yaitu dosis limbah, ketersediaan air dan kecepatan rusaknya jaringan tanaman (Kirkegaard et al. 2001). Brown dan Morra (2005) menyatakan bahwa tingkat kelarutan ITS dalam air berpengaruh terhadap tingkat toksisitasnya meskipun tidak mutlak. Penelitian Matthiessen (2002) sisa tanaman brokoli segar 3.4-4.0 kg/m2 kemudian dicacah dan ditutup dengan terpal plastik dapat menurunkan viabilitas cendawan Rhizoctonia solani, Verticilium dahliae dan Fusarium oxysporum secara drastis pada tanah
Beberapa penelitian melaporkan bahwa senyawa isotiosianat (ITS) sangat beracun bagi patogen tular tanah, antara lain cendawan Gaeumanomyces graminis var. tritici, Fusarium oxysporum (Sarwar et al. 1998), Rhizoctonia solani (Manici et al. 2000) dan Pythium (Charron and Sams 1999), bakteri Ralstonia solanacearum (Kirkegaard 2007). ITS dilaporkan dapat mematikan nematoda Pratylenchus (Mazzola et al. 2007) dan Meloidogyne (Kirkegaard 2007).
Rumusan Masalah
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keefektifan beberapa limbah tanaman kubis-kubisan, yaitu kubis (B. oleracea var. capitata), bunga kol (B. oleracea var. botrytis), brokoli (B. oleracea var. italica), sawi putih (B. chinensis) dan pakcoy (B. rapa var. parachinensis) dalam mengendalikan nematoda puru akar (Meloidogyne sp.) pada tanaman tomat.
Manfaat Penelitian
Aplikasi limbah tanaman dari famili Brassicaceae dapat dikembangkan lebih lanjut sebagai teknologi pengendalian nematoda yang efektif, murah, ramah lingkungan dan aplikatif bagi petani. Pengendalian menggunakan limbah Brassica dapat mengurangi kerugian secara ekonomi pada petani yang diakibatkan penurunan produksi hasil pertanian yang disebabkan nematoda puru akar (Meloidogyne sp.).
2
TINJAUAN PUSTAKA
Nematoda Puru Akar
Nematoda puru akar (NPA) Meloidogyne sp. merupakan salah satu patogen yang dapat menurunkan produksi tanaman. Nematoda bersifat kosmopolit dan memiliki kisaran inang yang sangat luas, yaitu hampir semua jenis tanaman dan berbagai spesies gulma. Nematoda puru akar bersifat endoparasit menetap (sedentary endoparasite), sehingga hubungan antara nematoda dengan tanaman inangnya sangat spesifik dan kompleks (Mulyadi 2009).
Taksonomi
Nematoda puru akar (Meloidogyne spp.) tergolong ke dalam kingdom Animalia, filum Nematoda, ordo Tylenchida, super famili Heteroderoidea, famili Meloidogynidae dan genus Meloidogyne (Dropkin 1996).
Morfologi
Juvenil 2 (J2) berbentuk silindris dengan panjang ± 450 μm. Stilet dan kerangka kepala juvenil 2 mengalami sklerotinasi yang tipis dengan ekor berbentuk kerucut hialin dimulai dekat ujung ekor (Luc et al. 2005). Tubuh nematoda betina berbentuk seperti buah pir dengan leher yang pendek dan posterior membulat. Betina dewasa memiliki ukuran panjang 430-921 μm yang diukur dari leher hingga posterior (Eisenback et al. 2003). Stilet berukuran pendek dan mengalami sklerotinasi sedang. Nematoda betina memiliki kerangka kepala lembek dengan lubang ekskresi terletak agak anterior sampai pada lempeng klep median bulbus dan sering terlihat pada dekat basal stilet. Vulva terletak subterminal dekat anus, kutikula berwarna agak keputihan, tipis dan beranulasi jelas (Luc et al. 2005).
lebih kuat, dengan ekor pendek setengah melingkar. Jantan memiliki spikula yang kuat dan tidak mempunyai bursa (Eisenback et al. 2003).
Biologi
Siklus hidup nematoda terdiri dari 3 stadia, dimulai dari telur, juvenil, dan dewasa. Stadia juvenil dibagi menjadi 4 tahap, yaitu Juvenil 1 (J1), Juvenil 2 (J2), Juvenil 3 (J3), dan Juvenil 4 (J4) (Dropkin 1996). Setiap stadia dalam siklus hidup nematoda berada di tempat yang berbeda-beda. Siklus hidup nematoda dapat dilihat pada Gambar 1.
Gambar 1 Siklus hidup nematoda puru akar (NPA) (Mitkowski dan Abawi 2003)
kali berturut-turut menjadi juvenil 3 (J3), juvenil 4 (J4), dan dewasa di dalam jaringan inang (Dropkin 1996).
Nematoda jantan meninggalkan akar sedangkan nematoda betina hidup menetap pada jaringan tanaman inang (Roberts dan Mullens 2002). Sistem reproduksi betina terbentuk setelah fase dewasa dan pola parineal akan tampak (Eisenback et al. 2003). Betina mengalami beberapa pergantian bentuk selama masa perkembangannya, setelah ganti kulit terakhir betina tumbuh dengan cepat dan bentuknya menjadi seperti buah pir (Franklin 1995).
Siklus hidup nematoda dari telur hingga menjadi juvenil 2 berlangsung selama 7-10 hari. Di Filipina pada suhu 25-29 ºC Meloidogyne incognita memerlukan waktu 15 hari untuk bertelur setelah inokulasi dari juvenil 2 pada tanaman tomat. Umumnya M. incognita memproduksi massa telur setelah inokulasi dalam waktu 18-20 hari. Pada temperatur antara 22-26 ºC sejumlah besar juvenil Meloidogyne spp. memasuki perakaran dalam waktu 24 jam dan menetap di dalam posisi memakan antara 2 atau 3 hari. Tubuh berkembang sekitar 6 hari setelah masuk dan perbedaan jenis kelamin tampak setelah 12 hari. Pergantian kulit ke-2 dalam waktu 18 hari diikuti dengan pergantian kulit ke-3 dan ke-4 antara 18 sampai 24 hari. Nematoda betina tumbuh dengan cepat antara hari ke 24 sampai hari ke 30. Massa telur tampak setelah hari ke-27 hingga hari ke-30. Telur-telur ini mulai tersimpan pada hari ke-30 sampai pada hari ke-40 (Roberts dan Mullens 2002)
Temperatur optimum untuk pertumbuhan M. hapla, M. fallax dan M. chitwoodi antara 15–25 ºC, sedangkan M. arenaria, M. incognita, dan M. javanica antara 25–30 ºC. Sangat sedikit aktivitas nematoda pada suhu di atas 38 ºC dan di bawah 5 ºC (Roberts dan Mullens 2002).
Mekanisme infeksi NPA
Juvenil 2 (J2) merupakan tahap nematoda untuk mengifeksi tanaman. Juvenil 2 bergerak aktif di dalam tanah menuju akar yang sedang tumbuh. Juvenil 2 menginfeksi dengan melakukan penetrasi pada epidermis di sekitar tudung akar dan melakukan pergerakan di antra sel-sel dekat slinder pusat. Selanjutnya merusak sel-sel akar dengan menginjeksikan hasil sekresi kelenjar esofagus (elisitor) menggunakan stilet ke dalam jaringan inang. Sekresi nematoda ini menyebabkan perubahan fisiologis dalam sel-sel inang yang mengubah sel inang menjadi sel raksasa (giant cells). Giant cells merupakan bentuk respon inang terhadap infeksi nematoda, yang selanjutnya digunakan sebagai sumber nutrisi bagi nematoda.
Gejala penyakit
Gejala penyakit NPA pada tajuk tanaman dicirikan dengan tanaman yang mengerdil dan daun menguning (klorosis) yang menyebabkan berkurangnya vigor tanaman. Infeksi nematoda juga menyebabkan kerusakan pada akar tanaman karena nematoda mengisap sel-sel pada akar, jaringan pembuluh terganggu sehingga translokasi air dan hara terhambat. Kerusakan akar tanaman juga akan menyebabkan pasokan air ke daun menjadi berkurang sehingga stomata menutup dan laju fotosintesis menurun. Akibatnya, pertumbuhan tanaman terhambat dan produktivitas tanaman menurun (Mustika 2010).
Puru merupakan gejala khas dari infeksi NPA. Puru muncul sebagai tanda awal terjadinya asosiasi antara tanaman dan betina NPA. Puru terjadi akibat pembesaran dan pembelahan sel yang berlebihan pada perisikel, serta perubahan bentuk jaringan pengangkut. Tanaman yang mengalami infeksi berat oleh NPA sistem perakarannya mengalami pengurangan jumlah akar. Pembentukan akar baru hampir tidak terjadi, sehingga fungsi perakaran dalam menyerap dan menyalurkan air dan unsur hara ke seluruh bagian tanaman terhambat (Kurniawan 2010).
Bentuk puru akibat infeksi NPA berbeda-beda tergantung dari spesies nematoda, misalnya M. hapla menyebabkan timbulnya puru seperti manik-manik dan cenderung lebih kecil dibandingkan dengan puru yang diakibatkan oleh spesies NPA lain, yang cenderung lebih besar dan menyatu (Roberts dan Mullens 2002). Puru yang disebabkan NPA terlihat bergabung dan berjajar di sepanjang perakaran. Akar yang terinfeksi biasanya pendek dan mempunyai sedikit akar lateral dan akar rambut (hairy root) (Agrios 2005). Malformasi merupakan salah satu gejala infeksi NPA selain adanya puru. Infeksi NPA mengakibatkan tanaman semakin rentan terhadap infeksi OPT lain. Infeksi cendawan patogen meningkat apabila kandungan eksudat puru akar diubah dan jumlahnya lebih banyak, sehingga cendawan pada stadium istirahat yang terjangkau oleh akar menjadi aktif (Agrios 2005).
Pengendalian nematoda
kecil dengan kandungan protein tinggi (kelompok amina) sangat efektif untuk meningkatkan pengendalian. Beberapa jenis tanaman dapat berfungsi sebagai tanaman perangkap (trap crop) yang diusahakan dalam bentuk pola tanam seperti pergiliran tanaman atau tumpang sari, di antaranya adalah tagetes (Tagetes patula), jarak (Ricinus communis) dan wijen (Sesamum indicum). Jarak dan wijen digunakan sebagai tanaman perangkap dalam pola pergiliran tanaman kacang tanah, kedele dan kapas untuk mengendalikan nematoda puru akar (Meloidogyne sp.). Tanaman jarak dan wijen tersebut sangat efektif dalam menekan populasi Meloidogyne sp. karena mengeluarkan eksudat akar yang toksik terhadap nematoda (Kabana 1992).
Biofumigan terbukti dapat memperbaiki sifat kimia dan fisik tanah, serta mampu mereduksi infeksi OPT tular tanah seperti M. incognita dan R. solanacearum (Johnson dan Shafer 2003). Penggunaan nematisida sintetis merupakan alternatif terakhir apabila teknik pengendalian yang lain dinilai tidak berhasil dan dilakukan secara bijaksana. Penggunaan nematisida secara bijaksana adalah (1) nematisida yang digunakan adalah jenis yang terdaftar dan atau diizinkan oleh Menteri Pertanian, (2) memenuhi kriteria tepat, yaitu tepat jenis, mutu, waktu, sasaran (nematoda dan tanamannya), dosis dan konsentrasinya, serta cara dan alat aplikasinya (3) tidak membahayakan manusia dan lingkungan (Mustika 2010).
Fumigasi
Fumigasi merupakan salah satu metode kimia untuk pengendalian hama dan penyakit. Senyawa fosfin dan metil bromida merupaka produk yang paling
banyak digunakan (Emekci 2010). Fumigasi merupakan tindakan perlakuan terhadap media pembawa organisme pengganggu tumbuhan dengan menggunakan fumigan ke dalam ruang yang kedap udara pada suhu dan tekanan tertentu
(Priyono 2005). Fumigan yang digunakan dalam fumigasi merupakan pestisida yang dalam suhu dengan tekanan tertentu berbentuk uap dan dalam konsentrasi serta waktu tertentu dapat membunuh Organisme Pengganggu Tanaman (Arinana et al 2008).
penggunaannya di negara-negara maju, dijadwalkan akan dihapus di seluruh Dunia pada tahun 2015 (Graver 2004).
Metil bromida tidak berwarna, tidak mudah terbakar dan tidak berbau kecuali pada konsentrasi tinggi. Metil bromida adalah fumigan yang berspektrum luas yang dapat mengendalikan nematoda, jamur, bakteri, gulma dan serangga tanah. Metil bromida sangat beracun pada semua stadia siklus hidup serangga dan patogen. Diperkenalkan sebagai pestisida pada tahun 1932, metil bromida pertama kali terdaftar di Amerika Negara pada tahun 1961. Environmental Protection Agency (EPA) Amerika Serikat telah mengklasifikasikan metil bromida sebagai "Pestisida yang dibatasi penggunaannya" yaitu pestisida yang dapat dibeli dan digunakan hanya dengan orang yang bersertifikat. Klasifikasi ini disebabkan toksisitas akut metil bromida. Metil bromida saat ini penggunaannya dilarang karena dapat merusak lapisan ozon. Mulai 1 Januari 2005, produksi dan penggunaan metil bromida akan berhenti di Amerika Serikat, kecuali darurat dan kritis (Sarma dan Bankobeza 2000).
Sifat metil bromida sangat larut dalam air, tekanan uap tinggi, dan sulit menyerap ke dalam tanah menyebabkan senyawa ini cepat menguap. Metil bromida dapat mengendap di atmosfer pada suhu 8-25 oC dalam jangka waktu yang lama, selama 4-18 bulan. Rendahnya fotolisis di troposfer mengakibatkan bahan kimia ini pada akhirnya akan menyebar ke stratosfer. Fotolisis di stratosfer dapat menghasilkan bromin aktif yang berhubungan dengan penipisan ozon. Protokol Montreal menyatakan bahwa metil bromida dianggap sebagai perusak ozon kelas 1 (Kells et al. 2000)
Biofumigan
Biofumigan adalah senyawa yang mudah menguap (volatil) yang berasal dari tumbuhan, bersifat biosida terhadap serangga dan patogen tanaman (Kirkegaard 2004). Mathiessen (2001), menyaktakan banyak ragam jenis senyawa biofumigan, satu di antaranya adalah minyak atsiri (essential oils) yang dapat diekstraksi dari daun, bunga, biji, atau kulit berbagai jenis tanaman di daerah tropis maupun subtropis. Potensi minyak atsiri masih belum banyak digali untuk digunakan sebagai biofumigan. Senyawa biofumigan lain yang telah banyak diteliti berasal dari famili kubis-kubisan (Brassicaceae) yang mengandung senyawa glukosinolat (GSL).
Sekitar 350 genera dan 2.500 spesies famili Brassicaceae yang diketahui mengandung senyawa GSL. Kelompok tanaman lain yang juga mengandung senyawa GSL adalah Capparaceae, Moringaceae, Resedaceae, dan Tovariaceae. Kandungan GSL pada Brassicaceae paling tinggi dibandingkan pada tanaman lainnya (Rosa dan Rodriguez 1999).
Biosintesis senyawa Glukosinolat
alifatik, misalnya alkil, alkenil, hidroksialkenil dan w-metiltioalkil berasal dari metionin, rantai heterosiklik seperti indolil berasal dari fenilalanin dan rantai aromatik misalnya bensil berasal dari triptofan.
Sampai saat ini, lebih dari 120 macam GSL, baik dari kelompok alifatik aromatik maupun indolil, telah berhasil diisolasi dan diidentifikasi (Fahey et al. 2001), sebanyak 30-40 jenis GSL dari famili Brassicaceae. GSL terdapat pada seluruh bagian tanaman, mulai dari akar, batang, daun, bunga sampai biji. Satu tanaman biasanya mengandung lebih dari satu macam GSL. Kandungan GSL dalam tanaman bergantung pada jenis jaringan, umur, kesehatan dan tingkat nutrisi tanaman. Produksi GSL pada suatu tanaman dipengaruhi oleh teknik budi daya, iklim, tanah tempat tumbuh dan umur tanaman. Pupuk yang mengandung belerang akan meningkatkan kandungan GSL, tetapi pupuk nitrat akan menurunkannya. Hasil penelitian Kirkegaard et al. (2003) menunjukkan bahwa jaringan tanaman yang diberikan pada saat masih berbunga, daya hambatnya terhadap pertumbuhan cendawan Gaeumannomyces graminis, Rhizoctonia solani, Fusarium graminearum, Pythium irregulare, dan Bipolaris sorokiniana lebih tinggi dibandingkan dengan jaringan yang berasal dari tanaman yang sudah tua.
GSL bukanlah senyawa yang toksik terhadap mikroorganisme. Setelah melalui proses hidrolisis, GSL akan membentuk senyawa-senyawa yang berperan dalam berbagai fungsi fisiologis. Misalnya bau yang menyengat pada mustard, bau spesifik sayuran golongan kubis/sawi, atau sebagai sistem pertahanan tanaman terhadap serangan hama dan patogen (Bones dan Rossiter 1996).
Proses hirolisis senyawa biofumigan
Proses hidrolisis GSL terjadi jika senyawa tersebut kontak dengan enzim
mirosinase dan tersedia air. Enzim mirosinase (β-tioglukoside glukohidrolase) tidak hanya dihasilkan oleh tanaman yang menghasilkan GSL. Pertanaman penghasil GSL, enzim mirosinase dihasilkan oleh sel-sel mirosin yang letaknya terpisah dari vakuola yang mengandung GSL. Hidrolisis GSL akan dimulai apabila terjadi kontak antara GSL dengan mirosinase, biasanya melalui pelukaan jaringan tanaman. Hasil hidrolisis senyawa GSL adalah senyawa-senyawa yang bersifat volatil maupun tidak, misalnya isotiosianat (ITS), ion tiosianat (SCN+), nitril, epitionitril, indolil alkohol, amin, sianid organik, dan oksazo-lidinetion. Hidrolisis GSL pada tanah masam (pH rendah) cenderung menghasilkan nitril. Smolinska (2000) melaporkan bahwa bungkil canola yang diperlakukan berbeda akan menghasilkan senyawa yang berbeda pula. Hidrolisis GSL dari bungkil yang dipanaskan dengan autoklaf menghasilkan nitril, sementara yang tidak diautoklaf menghasilkan lebih banyak ITS. Di antara semua senyawa yang dihasilkan, ITS merupakan senyawa yang paling toksik sehingga dapat digunakan sebagai biofumigan.
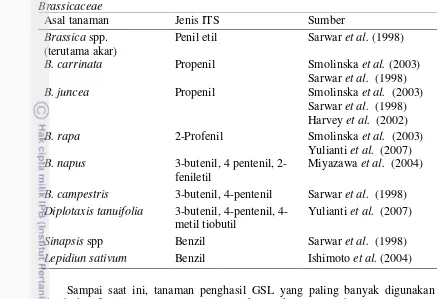
Tabel 1 Jenis isotiosianat yang berperan sebagai biofumigan yang dihasilkan famili Brassicaceae
Asal tanaman Jenis ITS Sumber
Brassica spp. (terutama akar)
Penil etil Sarwar et al. (1998) B. carrinata Propenil Smolinska et al. (2003)
Sarwar et al. (1998) B. campestris 3-butenil, 4-pentenil Sarwar et al. (1998) Diplotaxis tanuifolia 3-butenil, pentenil,
4-metil tiobutil
Yulianti et al. (2007) Sinapsis spp Benzil Sarwar et al. (1998) Lepidiun sativum Benzil Ishimoto et al. (2004)
Sampai saat ini, tanaman penghasil GSL yang paling banyak digunakan adalah dari famili Brassicaceae. Di Amerika Serikat, Eropa, dan Australia, para pemulia tanaman sengaja menciptakan varietas baru yang mengandung GSL tinggi dan dikomersialkan sebagai tanaman penutup tanah atau pupuk hijau. BQ
mulch™ merupakan campuran dari spesies B. napus dan B. rapa produksi Australia dan produksi Amerika Serikat (McGuire 2003).
Selain tanaman tersebut, beberapa spesies sayuran banyak digunakan sebagai sumber biofumigan karena produk ITS yang dihasilkan. Di beberapa negara maju, tanaman-tanaman tersebut digunakan sebagai tanaman rotasi dan sisa tanamannya digunakan sebagai pupuk hijau. Dengan demikian, selain berperan sebagai sumber biofumigan bagi hama, patogen tanah dan gulma, tanaman ini juga digunakan untuk menambah kandungan bahan organik di dalam tanah. Ketika sisa-sisa tanaman dihancurkan kemudian dibenamkan, terjadilah proses hidrolisis GSL dan terbentuk senyawa-senyawa yang beracun. Senyawa inilah yang diharapkan berfungsi sebagai biofumigan untuk mengendalikan populasi patogen tanah.
3
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Rumah Kaca dan Laboratorium Nematologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Agustus 2013 sampai April 2014.
Metode Penyiapan tanah
Tanah diambil dari lahan pertanaman sayuran yang sudah terinfestasi nematoda puru akar di Kebun Percobaan IPB Pasir Sarongge, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat.
Penyiapan limbah Brassica dan tanaman indikator
Limbah Brassica diperoleh dari sisa panen pada lahan petani di kebun percobaan Pasir Sarongge Kecamatan Pacet Kabupaten Cianjur Jawa Barat. Limbah Brassica dicacah dengan ukuran ± 1 cm dan siap untuk diaplikasikan ke tanah yang telah terinfestasi nematoda. Tanaman tomat varietas Permata digunakan sebagai tanaman indikator untuk menghitung jumlah nematoda di dalam tanah.
Rancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah split split plot, rancangan acak lengkap (RAL). Petak utama adalah 5 jenis limbah Brassica, yaitu kubis, bunga kol atau kembang kol, brokoli, sawi putih dan pakcoy. Anak petak adalah dosis limbah Brassica per pot ukuran 5 kg/pot dengan dosis 0.5, 1, 1.5 dan 0 kg. Anak-anak petak adalah lama inkubasi limbah Brassica: 1, 2 dan 3 minggu. Penggunaan nematisida sintetik dengan bahan aktif carbofuran (Furadan 3G 60 kg/ha) dan pot tanpa limbah Brassica digunakan sebagai pembanding. Percobaan dibuat dalam 5 ulangan.
Penghitungan populasi awal nematoda puru akar (NPA)
Penghitungan awal jumlah nematoda puru akar dilakukan pada 20 tanaman indikator. Bibit tomat berumur 2 minggu dipindahkan ke pot berisi tanah terinfestasi sebanyak 5 kg/pot dan dipelihara selama 30 hari. Tanaman tomat dicabut selanjutnya jumlah puru dihitung menggunakan hand counter.
Perlakuan biofumigasi
dengan dosis 0.5, 1 dan 1.5 kg per pot. Masing-masing pot perlakuan limbah ditutup dan diikat rapat. Perlakuan carbofuran (Furadan 3G dan perlakuan yang tanpa limbah Brassica (0 kg) sebagai pembanding. Tanah yang telah diberi perlakuan ditanami bibit tomat varitas Permata berumur 2 minggu untuk menghitung jumlah nematoda puru akar yang masih hidup. Percobaan dibuat dalam 5 ulangan.
Pengamatan efek uji biofumigasi terhadap nematoda puru akan (NPA) Tanah yang telah diinkubasi, dibiarkan terbuka selama 3 hari. Tanaman tomat dipelihara selama 30 hari. Pengamatan efek biofumigan dilakukan dengan cara penghitungan jumlah puru pada akar tomat. Selain pengamatan efek biofumigan dilakukan juga pengamatan pertumbuhan tanaman. Pengamatan pewarnaan jaringan juga dilakukan untuk membuktikan kebenaran bahwa puru yang terbentuk pada akar disebabkan oleh nematoda. Metode yang digunakan pada pewarnaan akar nematoda adalah metode Shurtleff dan Averre (2000). Keefektifan pengendalian puru akar menggunakan Abbot (1925):
Keterangan: P0 : jumlah puru sebelum perlakuan Pt : jumlah puru setelah perlakuan Pengamatan mikroba tanah
Nematoda parasit tumbuhan dan non-parasit diekstraksi dari sampel tanah dengan metode corong Bearmann yang dimodifikasi. Tanah sebelum dan setelah aplikasi limbah Brassica diambil sebanyak 30 g. Selanjutnya tanah dimasukkan ke dalam saringan yang sudah dilapisi tissu. Wadah diisi dengan air sehingga menyentuh bagian bawah saringan, diinkubasi selama 2x24 jam dan disaring menggunakan saringan 500 mesh. Suspensi hasil saringan diamati di bawah mikroskop stereo dan dihitung populasinya.
Tanah sebelum dan setelah aplikasi limbah Brassica diambil sebagai sampel dan dilakukan isolasi dan pembiakan mikroba. Mikroba pada tanah sebelum dan setelah aplikasi dalam penelitian ini ditumbuhkan dengan metode pencawanan dalam media biakan PDA untuk cendawan dan NA untuk bakteri. Suspensi tanah dibuat pengenceran berseri 10-4 dan 10-5 untuk isolasi bakteri dan 10-3 dan 10-5 untuk isolasi cendawan. Selanjutnya masing-masing suspensi dituang pada media sebanyak 0.01 mL. Protokol isolasi bakteri dan cendawan dengan seri pengenceran mengikuti metode yang disusun Schaad et al. (2001). Masing-masing sampel diulang sebanyak 3 ulangan. Tujuan pengenceran ini adalah untuk memperoleh mikroorganisme utama dengan menyisihkan mikroorganisme lain. Identifikasi spesies NPA dengan pola perinial (Perineal Pattern)
Analisis data
Data hasil pengamatan dianalisis secara statistika dengan menggunakan prosedur General Linear Model (GLM) dilanjutkan dengan uji Duncan’s pada program SAS 9.1.3 for Window dengan p-value 0.05.
4
HASIL DAN PEMBAHASAN
Hasil
Lima jenis limbah Brassica pada dosis dan waktu inkubasi yang diuji sangat efektif menurunkan populasi nematoda puru akar. Jumlah puru akar pada pot perlakuan lebih rendah dibandingkan pot yang tidak diberi limbah Brassica dan pot perlakuan carbofuran (Furadan 3G 60 kg/ha). Percobaan tanpa limbah Brassica rata-rata persentase keefektifannya 48.21% sedangkan perlakuan limbah Brassica persentase keefektifannya dari 93-100%.
Tabel 2 Rata-rata jumlah puru dan keefektifan pengendalian Meloidogyne sp. pada tanaman tomat di rumah kaca pada perlakuan limbah Brassica
Perlakuan Jumlah puru Keefektifan pengendalian(%) Jenis limbah Brassica
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
dosis dan waktu inkubasi dapat meningkatkan persentase keefektifannya dari 85.00-100% (Tabel 3).
Tabel 3 Rata-rata keefektifan pengendalian perlakuan jenis, dosis dan waktu inkubasi limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp. pada tanaman tomat
Jenis limbah Brassica Dosis (kg/5kg tanah)*
0.5 1 1.5
Waktu inkubasi 1 minggu
Kubis 89.89a 85.00b 99.09a
Bunga kol 94.66a 99.31a 100.00a
Brokoli 97.27a 98.86a 100.00a
Sawi putih 100.00a 100.00a 100.00a
Pakcoy 100.00a 100.00a 100.00a
Waktu inkubasi 2 minggu
Kubis 85.21b 86.48b 100.00a
Bunga kol 94.66a 100.00a 100.00a
Brokoli 94.88a 94.32a 100.00a
Sawi putih 100.00a 100.00a 100.00a
Pakcoy 100.00a 100.00a 100.00a
Waktu inkubasi 3 minggu
Kubis 86.48b 99.54a 100.00a
Bunga kol 100.0a 97.72a 100.00a
Brokoli 98.29a 100.00a 100.00a
Sawi putih 100.00a 100.00a 100.00a
Pakcoy 100.00a 100.00a 100.00a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Limbah kubis dengan dosis 0.5 kg/5 kg tanah keefektifannya 91.29% ketika dosis ditingkatkan menjadi 1.5 kg/5 kg keefektifan meningkat menjadi 99.69% (Tabel 4). Waktu inkubasi 1 minggu pada semua jenis limbah yang diuji efektif menurunkan jumlah puru NPA 90-100%. Jika waktu inkubasi diperpanjang sampai 3 minggu keefektifan limbah kubis meningkat 99.77% (Tabel 5). Pada semua tingkatan dosis dan waktu inkubasi, aplikasi limbah Brassica lebih efektif dalam menurunkan jumlah puru NPA yang disebabkan Meloidogyne sp. (Tabel 6).
Tabel 4 Rata-rata keefektifan pengendalian perlakuan jenis dan dosis limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp. pada tanaman tomat
Jenis limbah Dosis (kg/5kg tanah)*
0.5 1 1.5
Kubis 91.29b 90.34b 99.69a
Bunga kol 96.41a 99.01a 100.00a
Brokoli 96.82a 97.72a 100.00a
Sawi putih 100.00a 100.00a 100.00a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Tabel 5 Rata-rata keefektifan pengendalian perlakuan jenis dan waktu inkubasi limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp. pada tanaman tomat
Jenis limbah
Brassica Waktu Inkubasi *
1 minggu 2 minggu 3 minggu
Kubis 91.33b 90.23b 99.77a
Bunga kol 97.99a 98.22a 99.24a
Brokoli 98.71a 96.40a 99.43a
Sawi putih 100.00a 100.00a 100.00a
Pakcoy 100.00a 100.00a 100.00a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Tabel 6 Rata-rata keefektifan pengendalian perlakuan dosis dan waktu inkubasi limbah Brassica terhadap penurunan jumlah puru Meloidogyne sp. pada tanaman tomat
Dosis (kg/5kg) Waktu inkubasi*
1 2 3
0.5 96.36a 94.75a 99.61a
1 96.63a 96.16a 99.45a
1.5 99.81a 100.00a 100.00a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Gambar 2 Puru yang terbentuk dengan perlakuan tanpa limbah Brassica (P0), carbofuran dan perlakuan masing-masing limbah Brassica (J1, J2, J3, J4 dan J5) pada tanaman tomat.
Keterangan: J1= kubis; J2= Bunga kol; J3= Brokoli; J4= sawi putih; J5= pakcoy; carbofuran (Furadan 3G)= nematisida sintetik; P0= perlakuan tanpa limbah Brassica.
Peningkatan pertumbuhan tanaman tomat dapat dilihat pada gambar 3. Tanaman tomat yang diberi perlakuan limbah sawi putih memperlihatkan pertumbuhan yang sangat baik. Perlakuan tanpa limbah Brassica yang ditutup saja pertumbuhannya lebih lambat dibanding yang diberi perlakuan limbah Brassica.
Gambar 3 Pengamatan pertumbuhan tanaman tomat minggu pertama sampai minggu keempat di rumah kaca
Keterangan: J= jenis limbah Brassica (J1= kubis; J2= Bunga kol; J3= Brokoli; J4= sawi putih; J5= pakcoy); D= dosis (1= 0.5kg; 2= 1kg; 3= 1.5 kg); M= waktu (1= satu minggu; 2= dua minggu; 3= tiga minggu);J= jenis limbah Brassica; D= dosis; M= waktu; carbofuran (Furadan 3G)= nematisida sintetik; P0= perlakuan tanpa limbah Brassica dan ditutup.
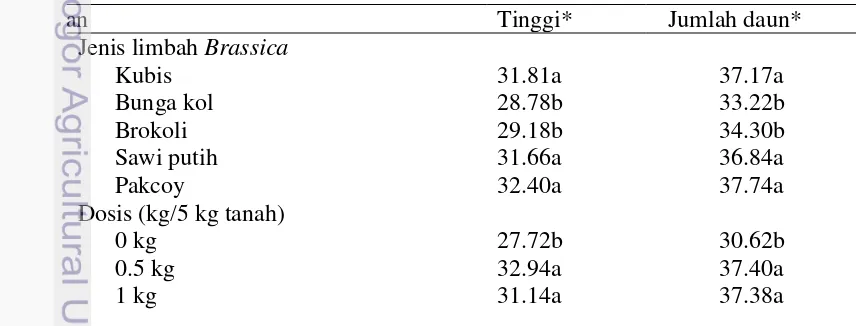
1.5 kg 31.22a 36.78a Waktu inkubasi (minggu)
1 minggu 28.90b 34.71b
2 minggu 31.55a 36.42a
3 minggu 31.23a 35.85a
Carbofuran (Furadan 3G) 28.85b 28.85c
P0 (tanpa Brassica) 26.60c 26.60c
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Pertumbuhan tanaman tomat setelah perlakuan dengan mengukur tinggi tanaman dan jumlah daun dapat dilihat pada Tabel 7. Pertumbuhan tanaman yang paling baik adalah yang diberi perlakuan limbah pakcoy, sawi putih dan kubis. Dosis limbah tidak berpengaruh nyata terhadap pertumbuhan tanaman, sedangkan waktu inkubasi 2 dan 3 minggu memperlihatkan pertumbuhan tanaman tomat lebih baik.
Hasil ekstraksi nematoda pada tanah sebelum perlakuan dan setelah diberi perlakuan mendapatkan nematoda parasit tanaman juga didapatkan nematoda non parasit (Lampiran 1). Hasil pewarnaan nematoda dalam jaringan akar memperlihatkan adanya nematoda Meloidogyne pada akar tanaman tomat yang mengakibatkan gejala puru. Hasil identifikasi NPA pada akar tanaman tomat ditemukan M. incognita. Ciri khasnya terdapat garis lengkungan dorsal yang tinggi ditandai dengan tanda panah dan menyempit berbentuk persegi, bagian paling luarnya sedikit melebar dan datar, tidak memiliki garis lateral terlihat jelas (Gambar 4).
Gambar 4 Pola perinial nematoda betina Meloidogyne incognita Perlakuan lima jenis limbah Brassica lebih efektif menurunkan populasi bakteri dibanding tanpa limbah Brassica dan aplikasi carbofuran (Furadan 3G) (Lampiran 3). Tiga tingkatan dosis yaitu 0.5, 1 dan 1.5 kg tidak berpengaruh nyata terhadap populasi bakteri. Waktu inkubasi 3 minggu yang dapat menurunkan populasi bakteri. Populasi koloni bakteri yang ditumbuhkan pada media dapat dilihat pada Lampiran 4.
aplikasi carbofuran (Furadan 3G) menyebabkan penurunan populasi yang beragam. Populasi cendawan yang diberi kode C6 diduga Trichoderma. Hal ini didasari pada bentuk koloni, warna koloni dan miroskopik cendawan tersebut. Trichoderma yang dikenal sebagai agen antagonis berhasil ditemukan dan populasinya meningkat pada perlakuan menggunakan limbah Brassica. Hal ini dapat diartikan bahwa perlakuan limbah tidak menurunkan agen antagonis dan selektif terhadap patogen tular tanah (Lampiran 5). Koloni cendawan secara makroskopis dan mikroskopis dapat dilihat pada Lampiran 6. Tingkatan dosis berpengaruh terhadap penurunan jumlah populasi cendawan. Aplikasi limbah dengan dosis 0.5, 1 dan 1.5 efektif menurunkan jumlah populasi cendawan dibanding aplikasi carbofuran (Furadan 3G) dan tanpa perlakuan limbah Brassica (0 kg).
Masa inkubasi 3 minggu sangat efektif dalam menurunkan jumlah puru NPA. Hal ini menunjukkan ada korelasi antara waktu inkubasi dan peningkatan suhu. Keefektifan biofumigasi pada waktu inkubasi 3 minggu memperlihatkan adanya peningkatan suhu pada pot mencapai rata-rata 36.92 oC. Pada Lampiran 7 terlihat adanya peningkatan suhu pada tanah yang diberi perlakuan limbah Brassica dapat meningkatkan suhu 4-6 oC jika dibandingkan sebelum perlakuan, yang ditutup saja dan nematisida sintetik. Secara keseluruhan terjadinya peningkatan suhu pada limbah yang diuji berpengaruh terhadap efek biofumigasi dalam menurunkan jumah puru NPA dan aktifitas mikroba pada tanah.
Pembahasan
Nematoda puru akar (Meloidogyne sp.) di dalam puru yang terbentuk/berkembang pada tanaman tomat berhasil dideteksi dengan metode pewarnaan. Puru akar berfungsi sebagai sumber makanan bagi nematoda. Menurut Perry et al. (2009), nematoda yang terdapat pada puru akar merupakan nematoda betina dewasa yang hidup menetap, sedangkan nematoda jantan dewasa hidup di luar tanaman. Puru akar terbentuk akibat adanya pengalihan fungsi jaringan pengangkut tanaman yang disebabkan terbentuknya sinsitium oleh nematoda untuk tempat hidup.
Penurunan jumlah puru akar menunjukkan adanya efek biofumigasi pada perlakuan limbah Brassica. Menurut Buena et al. (2007) tanaman Brassica menghasilkan metabolit skunder berupa senyawa glukosinolat. Hidrolisis senyawa glukosinolat oleh enzim mirosinase menghasilkan senyawa isotiosianat yang berperan sebagai biofumigan. Hidrolisis glukosinolat terjadi ketika senyawa tersebut kontak dengan enzim mirosinase akibat rusaknya dinding sel tanaman selama maserasi. Isotiosianat memiliki efek toksik pada patogen tular tanah. Menurut Matthiessen (2002), salah satu faktor yang mempengaruhi proses hidrolisis glukosinolat agar berlangsung optimum adalah ketersediaan air. Ketersediaan air dapat menjaga senyawa isotiosianat tidak cepat menguap sehingga bertahan lama di tanah. Oleh karna itu, perlakuan penyiraman sangat penting pada proses uji biofumigasi menggunakan limbah Brassica. Berdasarkan uji biofumigasi, senyawa isotiosianat dapat mematikan nematoda dalam tanah. Hal ini yang menyebabkan terjadinya penurunan jumlah puru akar pada perlakuan limbah Brassica.
pori-pori tanah. Senyawa isotiosianat dapat sampai ke lapisan air dan mengganggu sistem pernafasan nematoda. Nematoda bernafas secara difusi, pada proses ini senyawa isotiosianat masuk ke dalam tubuh nematoda sehingga mematikan nematoda tersebut. Menurut Gimsing dan Kirkegaard (2006) bahwa senyawa isotiosianat menghasilkan senyawa alelokimia bersifat toksik. Senyawa isotiosianat dapat mematikan nematoda dengan menghambat pernafasan. Pada proses difusi, senyawa isotiosianat yang bersifat racun masuk ke dalam tubuh nematoda dan menyebabkan kematian sehingga, populasi nematoda menurun. Penurunan populasi juvenil Meloidogyne sp. di tanah setelah aplikasi limbah Brassica menyebabkan jumlah puru NPA menurun. Penelitian Monfort et al. (2007) membuktikan tanaman dari famili Brassicaeceae menunjukkan aktivitas nematisidal pada juvenil M. incognita dan M. javanica.
Pemberian dosis dan waktu inkubasi yang berbeda pada perlakuan limbah Brassica berpengaruh terhadap efek biofumigan yang dihasilkan. Yulianti (2009) menyatakan bahwa untuk mencapai tahap nematisidal, bakterisidal dan fungisidal, dosis limbah mempengaruhi konsentrasi isotiosianat. Pada penelitian ini aplikasi limbah dengan tingkat dosis yang berbeda akan mempengaruhi konsentrasi isotiosianat dalam menurunkan jumlah puru Meloidogyne sp. Menurut Kirkegaard
et al. (2001) waktu inkubasi limbah Brassicaceae berpengaruh terhadap kecepatan rusaknya jaringan tanaman. Dosis yang digunakan harus disesuaikan dengan waktu inkubasi yang tepat, sehingga menghasilkan konsentrasi isotiosianat yang tinggi.
Perlakuan limbah Brassica pada dosis 1.5 kg/5 kg tanah memperlihatkan gejala fitotoksik pada tanaman tomat. Perlakuan limbah dengan dosis 1.5 kg/5 kg tanah setelah dibiarkan terbuka selama 1 minggu dan disulam dengan bibit baru dapat menurunkan jumlah puru NPA. Rata-rata persentase keefektifan penurunan jumlah puru sebesar 99.93%. Dosis 1.5 kg/5 kg tanah membutuhkan waktu yang lebih lama untuk menyelesaikan proses hidrolisis, sehingga tidak terjadi fitotoksis. Peningkatan dosis pada perlakuan harus diikuti dengan penambahan waktu inkubasi sehingga, proses hidrolisis berlangsung dengan baik. Memperpanjang waktu dibiaran pot terbuka akan menurunkan suhu tanah akibatnya tanaman tidak mengalami fitotoksik. Perpanjangan waktu dibiarkan terbuka ini tidak mempengaruhi senyawa biofumigan yang dihasilkan limbah Brassica. Roubtsova et al. (2007) menyatakan bahwa penambahan Brassica dan dibiarkan selama 10 hari sebelum tanam lebih efektif dalam menurunkan populasi M. incognita. Pot yang dibiarkan terbuka selama batas waktu tertentu tidak menghilangkan efek biofumigan. Litbang Departemen Pertanian (2009) menyatakan bahwa pelepasan senyawa glukosinolat yang kemudian diikuti dengan hidrolisis dapat berada di dalam tanah 5-10 hari. Hal ini sesuai dengan penelitian Gimsing dan Kirkegaard (2006) menyatakan isotiosianat masih bisa dideteksi 8-12 hari setelah perlakuan dengan efisiensi pelepasan 26-56%.
dibutuhkan untuk mencapai pengendalian yang optimum. Peningkatan suhu setelah perlakuan juga akan mempengaruhi aktivitas mikroba tanah salah satunya nematoda. Menurut Roberts and Mullens (2002) suhu optimum Meloidogyne sp. antara 25-30 oC, sangat sedikit aktivitas nematoda di atas 38 oC. Peningkatan suhu setelah perlakuan, selain menstabilkan senyawa isotiosianat juga dapat menganggu aktivitas nematoda di dalam tanah. Nematoda yang berada di dalam tanah akan cepat dikendalikan, karena pengaruh isotiosinat yang stabil dan suhu yang tinggi.
Perbedaan keefektifan limbah kubis dengan empat limbah lainnya dipengaruhi oleh kandungan GSL yang berbeda-beda pada Brassica. Das et al. (2000) menyatakan bahwa konsentrasi glukosinolat dalam tanaman tergantung pada berbagai faktor seperti variasi, kondisi lahan, iklim, dan praktek agronomis. Konsentrasinya pada tanaman tertentu juga bervariasi antara berbagai bagian. Perbedaan keefektifan lima limbah Brassica yang digunakan juga dipengaruhi
oleh gugus kimia isotiosianat. Isotiosianat mengandung gugus ‘R yang bebas dan dapat berikatan dengan molekul atom lainnya. Menurut Wang et al. (2011), Isotiosianat mempunyai molekul dengan struktur R-N=C=S, terdapat sebagai glukosida kompleks pada beberapa jenis Brassica. Gugus isotiosianat dapat berikatan dengan gugus karbon alkil lainnya sehingga, menghasilkan isotiosianat dengan konsentrasi tinggi. Hasil penelitian Harvey et al. (2002), Brassica spp. mengahasilkan isotiosianat jenis penil etil, dan Brassica campestris menghasilkan 3-butenil, 4-pentenil. Hasil penelitian lain Ishimoto et al. (2004), menyatakan bahwa famili Brassicaceae dapat mengasilkan isotiosianat jenis benzil yang sangat toksik terhadap patogen tular tanah. Jenis isotiosianat yang dihasilkan limbah Brassica pada uji biofumigasi berbeda sehingga, kekefektifan dalam menurunkan jumlah puru NPA juga berbeda.
Perlakuan limbah Brassica pada penelitian ini berpengaruh terhadap aktifitas mikroba tanah. Fahey (2005) menyatakan bahwa famili Brassicaceae mengahasilkan senyawa seperti isotiosianat dan benzil isotiosianat yang merupakan senyawa antimikroba. Pada pengamatan mikroba tanah, populasi bakteri menurun setelah diberi perlakuan limbah Brassica. Hal ini menunjukkan adanya senyawa isotiosianat yang dapat mempengaruhi bakteri di dalam tanah. Lin et al. (2000), menyatakan bahwa ketika isotiosianat kontak dengan bakteri mengakibatkan membran sel bakteri rusak. Terjadinya kerusakan membran sel bakteri akan mengganggu aktivitas bakteri sehingga, menyebabkan kematian. Perlakuan tingkatan dosis yang berbeda pada semua limbah uji berpengaruh terhadap menurunkan populasi bakteri dibandingkan aplikasi nematisida dan perlakuan ditutup. Peningkatan dosis dapat meningkatkan keefektifan biofumigan yang dihasilkan limbah Brassica. Yulianti (2009) mengungkapkan bahwa diperlukan konsentrasi isotiosianat yang tinggi untuk menghasilkan biofumigan yang bersifat bakterisidal ataupun fungisidal.
limbah Brassica dapat meningkatkan populasi Trichoderma spp. cendawan ini berperan sebagai agen antagonis. Menurut Brown dan Morra (2005) Trichoderma paling toleran terhadap senyawa isotiosianat dibandingkan Phytophthora, Sclerotium, Pythium, R. solani, Aphanomyces, Geumanomyces, dan Thielaviopsis. Perlakuan limbah Brassica meningkatkan populasi cendawan antagonis yang dapat menekan populasi cendawan patogen tular tanah.
Keefektifan limbah kubis lebih rendah dibanding empat limbah Brassica lainnya, tetapi limbah kubis mampu meningkatkan pertumbuhan tanaman tomat lebih baik. Aktivitas biofumigasi oleh senyawa glukosinolat yang dihasilkan Brassica selain mengendalikan nematoda puru akar juga dapat meningkatkan pertumbuhan tanaman. Hal ini sesuai dengan penelitian Anita (2012) biofumigasi dengan sulfur yang mengandung limbah sayuran 1 kg/5 kg tanah dapat mengurangi Meloidogyne hapla yang menginfeksi seledri secara signifikan sebesar 60.6% dan meningkatkan pertumbuhan tanaman serta meningkatkan hasil produksi sebanyak 41.9% jika dibandingkan tanpa perlakuan. Selain aktivitas biofumigasi pemberian limbah Brassica juga terjadi proses dekomposisi bahan organik. Penambahan bahan organik ke dalam tanah dapat memperbaiki struktur fisik dan kimia tanah. Selain itu kondisi tanah yang baik akan menstimulasi mikroba tanah dan mikoorganisme antagonis. Keberadaan mikroorganisme antagonis mempengaruhi pertumbuhan tanaman tomat dan pengendalian penyakit.
5
KESIMPULAN
Lima limbah Brassica yang diuji, yaitu kubis, bunga kol, brokoli, sawi putih dan pakcoy efektif dalam menurunkan populasi NPA dalam tanah dengan tingkat keefektifan berturut-turut 93.77, 98.48, 98.18, 100 dan 100 %. Jenis limbah brokoli, bunga kol, sawi putih dan pakcoy dengan dosis 0.5 kg/5 kg tanah efektif menurunkan jumlah puru NPA 96-100%. Waktu inkubasi 1 minggu pada semua jenis limbah yang diuji efektif menurunkan jumlah puru NPA 90-100%. Aplikasi limbah Brassica tidak menimbulkan fitotoksis terhadap tanaman uji sampai dosis 1 kg/ 5 kg tanah, bahkan aplikasi limbah kubis dapat meningkatkan pertumbuhan tanaman. Perlakuan limbah Brassica dapat bersifat selektif terhadap nematoda, bakteri dan cendawan tanah.
DAFTAR PUSTAKA
Abbott WS. 1925. A method of computing the effectiveness of insecticide. J Econ Entomtol. 18: 265-267.
Agrios GN. 2005. Plant Pathology. 5th ed. New York (US): Academic Press. Anita B. 2012. Crucifer vegetable leaf wastes as biofumigants for the
Arinana, Rismayadi Y, Mustika D. 2008. Efikasi Fumigan Aluminium Phosphida Terhadap Kumbang Bubuk Kayu Kering Heterobostricus aequalis Wat. Prosiding Seminar Nasional MAPEKI XI; Palangka Raya, 8-10 Agustus 2008. Bogor: Masyarakat Peneliti Kayu Indonesia. Bogor (ID). hlm 585-592.
Brown J, Morra MJ. 2005. Glucosinolate Containing Seed Meal as a Soil Amendment to Control Plant Pest. National Renewable Energy Laboratory, University of Idaho. Moscow. Idaho (RU).
Buena P, Garcia A, Rojo D, Ros C, Fernadez P, Lacasa, Bello A. 2007. Use of pepper crop residues for the control of root-knot nematodes. J Bioresource Technol. 9(8):2846-2851. penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Plant Nematology Ed ke-2.
Eisenback JD, Hirschmann H, Sasser JN, Triantaphyllou AC. 1981. A Guide to the Four Most Common Species of Root-knot Nematodes (Meloidogyne spp.) with a pictorial key. Raleigh (US): IMP.
Emekci M. 2010. Quo Vadis the fumigants In: Carvalho OM, Fields PG, Adler CS, Arthur FH, Athanassiou CG, Campbell JF, Fleurat-Lessard F, Flinn PW, Hodges RJ, Isikber AA, Navarro S, Noyes RT, Riudavets J, Sinha KK, Thorpe GR, Timlick BH, Trematerra P, White NDG (Eds), Proceedings of The 10th International Working Conference on Stored Product Protection. 303-313. Portugal (PT).
Fahey JW, Zalcmann AT, Talalay P. 2001. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56: 5-51.
Franklin MT. 1995. A root-knot nematoda, Meloidogyne naasi on field crops in England and Wales. Nematologica. 11:79-86.
Giler J. 2006. Fumigation. Washington DC (US): United States Departement of Agriculture.
Gimsing AL, Kirkeegard JA. 2006. Glucosinolate and isothiocyanate concentration in soil following incorporation of Brassica biofumigants. Soil Biol & Biochem. 38: 2255-2264.
Graver JE. 2004. Guide to Fumigation under Gas-Proof Sheets. Rome (IT): Food and Agricultural Organization of the United Nations.
Ishimoto H, Y Fukushi, S Tahara. 2004. Non-pathogenic Fusarium strains protect the seedlings of Lepidium sativum from Pythium ultimum. Soil Biol &. Biochem. 36: 409-414.
Istiyanto ES. 2009. Biofumigasi menekan layu bakteri kentang dan akar gada kubis. Lembaga Pengembangan Teknologi Perdesaan (LPTP) Surakarta (ID).
Johnson H, Shafer B. 2003. Prevention of soil borne pests in organic edible ginger. Sustainable Agriculture Research and Education. Hawaii.
Kementerian Perdagangan Republik Indonesia. 2006. Peraturan Menteri Perdagangan Republik Indonesia Nomor 24 Tahun 2006 tentang Ketentuan Impor Bahan Perusak Lapisan Ozon. Jakarta (ID).
Kirkegaard JA, Wong PT, Desmarchelier JM. 2001. In vitro supression of fungal root pathogens of cereals by Brassica tissues. Plant Pathol. 45: 593-603. Kirkegaard JA. 2004. Biofumigation potential of brassicas. I. Variation in
glucosinolate profiles of diverse field-grown brassicas. Plant Soil. 201 (1): 71–89.
Kirkegaard JA. 2007. Evaluating biofumigation for soil-borne disease management in tropical vegetable production. Camberra (AU): ACIAR Final Report.
Kristensen K, Jensen LS, Magid J. 2003. Catch crops and green manures as biological tools in nitrogen management in temperate zones. Adv. Agron. 79: 227-300.
Kurniawan W. 2010. Identifikasi penyakit umbi bercabang pada wortel, Daucus carota (L.), di Indonesia [tesis]. Bogor (ID): Fakultas Pasca Sarjana, Institut Pertanian Bogor.
Levelle P, Spain AV. 2001. Soil Ecology. Dordrecht (AN). Kluwer Academic Press Inc.
Litbang Departemen Pertanian. 2009. Alternatif baru dalam mengendalikan penyakit tanaman. 31(6): 4. Indonesia (ID): Litbang Departemen Pertanian. Luc M, Sikora RA, Bridge J. 2005. Plant Parasitic Nematodes in Subtropical and
Tropical Agriculture. Wallingford (GB): CABI Publishing
Magdoff F, Weil RR. 2004. Soil Organic Matter in Sustainable Agriculture. Manici LM, Lazzeri L, Baruzzi G, Leoni O, Galletti S, Palmieri S. 2000.
Suppressive activity of some glucosinolates and their enzyme-deried product toward plant pathogenic fungi. J Agric. Food Chem. 45: 2768-2773. Matthiessen J. 2002. Plant maceration and moisture hold the key to biofumigation
success. CSIRO Bulletin: Biofumigation update: Horticulture 15: 1-2. Mazzola M, Brown J, Izzo AD, Cohen MF. 2007. Mechanism of action and
McGuire AM. 2003. Mustard green manures replace fumigant and improve infiltration in potato cropping system. Crop Management doi:10.1094/CM- 2003-0822-01-RS.
Mitkowski NA, Abawi GS. 2003. Root-knot nematodes [Internet] [diunduh 2013
April 25]. Tersedia pada:
http://www.apsnet.org/Nematodes/Pages/Rootknot/Nematode/aspx.
Miyazawa M, T Nishiguchi, T Yamafuji. 2004. Volatile components of the leaves of Brassica rapa L. var. perviridis Bailey. Flavour Fragrance J. Tokyo (JP) 20: 158-160.
Monfort WS, Csinos AS, Desaeger J, Seebold K, Webster TM, Perez JC. 2007. Evaluating brassica species as an alternative control measure for root-knot nematode (M. incognita) in Georgia vegetable plastic culture. Crop Prot. 26:1359-1368.
Mulyadi. 2009. Nematologi Pertanian. Yogyakarta (ID): Gajah Mada University Press.
Mustika I. 2010. Konsepsi dan strategi pengendalian nematoda parasit tanaman di Indonesia. Pengembangan Inovasi Pertanian. 3(2): 81-101.
Pal KK, McSpadden GB. 2006. Biological control of plant pathogens. The Plant Health Instructor. [internet]. Tersedia pada: http://www. apsnet.org/edcenter/advanced/topics/HI-BiologicalControl.pdf. DOI: 10.1094/PHI-A-2006-1117-02.
Perez J, Roubtsova T, Ploeg A. 2005. Effect of three plant residues and chickenmanure used as biofumigants at three temperatures on Meloidogyne incognita infestation of tomato in greenhouse experiments. Journal Nematol 37 (4): 489–494.
Perry RN, Moens M. 2009. Root-knot Nematodes. Starr JL, editor.Wallingford (GB): CABI.
Ploeg AT. 2007. Biofumigation to manage plant-parasitic nematodes. Di dalam:. Ciancio A and Mukerji KG editor. Integrated management and biocontrol of vegetable and grain crops nematodes. Berlin (DE). Springer-Verlag. hlm 239–248.
Price TV. 2000. Plant-parasitic nematodes. Integrated Pest Management for Smallholder Estate Crops Project. Plant Quarantine Component-Nematology. pp:27-34.
Priyono JA. 2005. Meningkatkan Mutu Kemasan Kayu Melalui Aplikasi Fumigasi. Laporan Seminar Nasional Peningkatan dan Pengawasan Mutu Kemasan Kayu Indonesia dalam Rangka Penerapan ISPM#15. Jakarta 23 Juni 2005.
Rask L, Andreasson E, Ekbom. 2000. Myrosinase gene family evolution and herbivore defense in Brassicaceae. J Plant Mol. 4(2): 93-113.
Rosa EAS, Rodriguez PMF. 1999. Towards more sustainable agriculture system: The effect of glucosinolates on the control of soilborne diseases. J Hort. Sci. Biotechnol. 74: 667 674.
Roubtsova T, Perez J, Edwards S, Ploeg A. 2007. Effect of Broccoli (Brassica oleracea) tissue, incorporated at different depths in a soil column on Meloidogyne incognita. Journal Nematol 39 (2): 111–117.
Sarma KM, Bankobeza. 2000. Montreal Protocol that Deplete the Ozon Layer. United Nations Environment Programme. UNON Press. Nairobi, Kenya (KE). 47 pp.
Sarwar M, Kirkegaard JA, Wong PTW, Desmarchelier JM. 1998. Biofumigation potential of brassicas. III. In vitro toxicity of isothiocyanates to soil-borne fungal pathogens. Plant Soil.20(1): 103-112.
Shurtleff MC, Averre CW. 2000. Diagnosing Plant Disease Caused by Nematodes. Minnesota (US): APS Press.
Smolinska U, MJ Morr, GR Knudsen, RL James. 2003. Isothiocyanates produced by Brassicaceae species as inhibitors of Fusarium oxysporum. Plant Dis. 87: 407-412.
Smolinska U. 2000. Survival of Sclerotium cepivorum sclerotia and Fusarium oxysporum chlamydospores in soil amended with cruciferous residues. J.Phytopathol 148: 343-349.
Tsao R, Q Yu, Potter J, Chiba M. 2000. Factors affecting the dissolution and degradation of oriental mustardderied sinigrin and allyl isothiocyanate in aqueous media. J. Agric Food Chem. 48: 1898-1902.
Wang X, Dipasqua AJ, Govind S, MmcCracken, Hong C, Mi L, Mao Y, Wu JY, Tomita Y, Woodrick JC, Fine RL, Chung FL. 2011. Selective deplotion of mutant p53 by cancer chemopreventive isothiocyanates and their structure activity relationships. Journal Medical Chemistry. 21: 10-12.
Lampiran 1. Rata-rata populasi nematoda pada tanah yang diberi perlakuan limbah Brassica
Perlakuan
Nematoda*
Meloidogyne sp. Non parasit
Jenis limbah Brassica
Kubis 1.22c 0.33d
Bunga kol 0.55c 2.00c
Brokoli 0.11c 1.66c
Sawi putih 0.22c 12.33a
Pakcoy 0 c 12.44a
Dosis (kg/5 kg tanah)
0 kg 19.66 a 6.61a
0.5kg 0.66 b 5.86b
1kg 0.33 b 5.73b
1.5kg 0.26 b 5.66b
Waktu inkubasi(minggu)
1 minggu 6.76a 6.09 a
2 minggu 6.09a 5.95 a
3 minggu 4.90a 5.65 a
Carbofuran (Furadan 3G) 14.00b 4.44b
P0 (ditutup) 25.33a 2.77c
X0 30.55a 13.20a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Lampiran 2. Morfologi Meloidogyne sp. dan nematoda non parasit pada tanaman tomat
(A) Bentuk tubuh Meloidogyne sp. perbesaran 40x10 (B) Bagian anterior perbesaran 60x10 (C)Bagian posterior perbesaran 60x10
Lampiran 3. Populasi bakteri pada tanah yang diberi perlakuan limbah Brassica
Perlakuan Bakteri (cfu/ml)*
Jenis limbah Brassica
Kubis 3.45 x 105b
Bunga kol 4.15 x 105b
Brokoli 3.68 x 105b
Sawi putih 3.30 x 105b
Pakcoy 2.44 x 105b
Dosis (kg/5 kg tanah)
0 kg 1.64 x 106a
0.5 kg 3.55 x 105b
1 kg 3.97 x 105b
1.5 kg 2.68 x 105b
Waktu inkubasi (minggu)
1 minggu 7.47 x 105a
2 minggu 7.17 x 105a
3 minggu 5.53 x 105
b
Carbofuran (Furadan 3G) 1.73 x 106a
P0 (tanpa Brassica) 1.55 x 106a
X0 (sebelum perlakuan) 2.02 x 106a
*) Angka-angka pada kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
Lampiran 4. Koloni bakteri pada tanah yang diberi perlakuan limbah Brassica yang ditumbuhkan pada media NA
Keterangan: Carbofuran (Furadan 3G)=nematisida sintetik; P0=tanpa limbah Brassica; X0=sebelum perlakuan; D1= dosis 1 kg/5kg tanah; W1=waktu inkubasi 1 minggu