NATALINA PANJAITAN. Case Study of Fasciolosis in Purwodadi Slaughterhouse, Grobogan District-Central Java: Diagnosis, Degree of Infection and Liver Damage in Cattle. Under direction of YUSUF RIDWAN and EKOWATI HANDHARYANI.
The research aims were to determine the degree of fasciolosis infection, the sensitivity of filtration-sedimentation method, and correlation between number of eggs in the feces with the number of flukes found in the liver and liver damage. A total of 18 liver and fecal samples were collected from cattle slaughtered at the abattoir of Purwodadi, Grobogan District-Central Java Province. Fecal examination was conducted using filtration-sedimentation method whereas the liver examination was observed to identify the F.gigantica infection, score of hepatic pathology. Results of the study showed 6 cattle (33.33%) had both flukes in the liver and fluke eggs in fecal samples. Filtration-sedimentation method had a sensitivity as high as 100%. Correlation test showed no correlation between the number of eggs in the feces with the number flukes found in the liver. Pathological examinations showed varying degrees of liver damage between mild, moderate, and severe. Number F.gigantica also has no correlation with the degree of liver damage both gross pathology and histopathology of livers.
NATALINA PANJAITAN. Studi Kasus Fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah: Diagnosis, Derajat Infeksi Fasciola gigantica, dan Tingkat Kerusakan Hati pada Sapi. Dibimbing oleh YUSUF RIDWAN dan EKOWATI HANDHARYANI.
Penelitian ini bertujuan untuk menentukan tingkat infeksi fasciolosis, sensitifitas metode filtrasi-sedimentasi, korelasi jumlah telur Fasciola sp. dalam tinja dengan jumlah cacing Fasciola sp. yang ditemukan dalam hati, dan kerusakan hati. Sebanyak 18 sampel organ hati dan sampel tinja dikumpulkan dari sapi yang dipotong di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah. Pemeriksaan tinja dilakukan dengan menggunakan metode filtrasi-sedimentasi sedangkan pemeriksaan sampel hati dilakukan dengan identifikasi infeksi F.gigantica, skor derajat kerusakan patologi anatomi dan histopatologi. Hasil pemeriksaan tinja dan identifikasi cacing F.gigantica di dalam organ hati diperoleh 6 sapi (33.33 %) terinfeksi F. gigantica. Metode filtrasi-sedimentasi memiliki sensitivitas yang tinggi yaitu 100%. Uji korelasi menunjukkan tidak ada korelasi antara jumlah telur dalam feses dengan jumlah cacing yang ditemukan pada hati. Pemeriksaan patologi anatomi hati menunjukkan berbagai tingkat kerusakan antara lain ringan, sedang, dan berat. JumlahF.giganticadi dalam hati juga tidak memiliki korelasi dengan derajat kerusakan patologi anatomi dan histopatologi hati.
KERUSAKAN HATI PADA SAPI
NATALINA PANJAITAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi Studi Kasus Fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah: Diagnosis, Derajat Infeksi Fasciola gigantica, dan Tingkat Kerusakan Hati pada Sapi adalah karya sendiri dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2012
NATALINA PANJAITAN. Studi Kasus Fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah: Diagnosis, Derajat Infeksi Fasciola gigantica, dan Tingkat Kerusakan Hati pada Sapi. Dibimbing oleh YUSUF RIDWAN dan EKOWATI HANDHARYANI.
Penelitian ini bertujuan untuk menentukan tingkat infeksi fasciolosis, sensitifitas metode filtrasi-sedimentasi, korelasi jumlah telur Fasciola sp. dalam tinja dengan jumlah cacing Fasciola sp. yang ditemukan dalam hati, dan kerusakan hati. Sebanyak 18 sampel organ hati dan sampel tinja dikumpulkan dari sapi yang dipotong di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah. Pemeriksaan tinja dilakukan dengan menggunakan metode filtrasi-sedimentasi sedangkan pemeriksaan sampel hati dilakukan dengan identifikasi infeksi F.gigantica, skor derajat kerusakan patologi anatomi dan histopatologi. Hasil pemeriksaan tinja dan identifikasi cacing F.gigantica di dalam organ hati diperoleh 6 sapi (33.33 %) terinfeksi F. gigantica. Metode filtrasi-sedimentasi memiliki sensitivitas yang tinggi yaitu 100%. Uji korelasi menunjukkan tidak ada korelasi antara jumlah telur dalam feses dengan jumlah cacing yang ditemukan pada hati. Pemeriksaan patologi anatomi hati menunjukkan berbagai tingkat kerusakan antara lain ringan, sedang, dan berat. JumlahF.giganticadi dalam hati juga tidak memiliki korelasi dengan derajat kerusakan patologi anatomi dan histopatologi hati.
NATALINA PANJAITAN. Case Study of Fasciolosis in Purwodadi Slaughterhouse, Grobogan District-Central Java: Diagnosis, Degree of Infection and Liver Damage in Cattle. Under direction of YUSUF RIDWAN and EKOWATI HANDHARYANI.
The research aims were to determine the degree of fasciolosis infection, the sensitivity of filtration-sedimentation method, and correlation between number of eggs in the feces with the number of flukes found in the liver and liver damage. A total of 18 liver and fecal samples were collected from cattle slaughtered at the abattoir of Purwodadi, Grobogan District-Central Java Province. Fecal examination was conducted using filtration-sedimentation method whereas the liver examination was observed to identify the F.gigantica infection, score of hepatic pathology. Results of the study showed 6 cattle (33.33%) had both flukes in the liver and fluke eggs in fecal samples. Filtration-sedimentation method had a sensitivity as high as 100%. Correlation test showed no correlation between the number of eggs in the feces with the number flukes found in the liver. Pathological examinations showed varying degrees of liver damage between mild, moderate, and severe. Number F.gigantica also has no correlation with the degree of liver damage both gross pathology and histopathology of livers.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KERUSAKAN HATI PADA SAPI
NATALINA PANJAITAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Natalina Panjaitan
NIM : B04070035
Disetujui,
Dr. Drh. Yusuf Ridwan, MSi Drh. Ekowati Handharyani, MSi, Ph.D Pembimbing I Pembimbing II
Diketahui,
Drh. Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
berkat dan kuasa-Nya sehingga skripsi ini dapat diselesaikan dengan baik. Penelitian ini dilaksanakan sejak tahun 2010 sampai 2011 dengan judul skripsi Studi Kasus Fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah: Diagnosis, Derajat InfeksiFasciola gigantica, dan Tingkat Kerusakan Hati pada Sapi. Skripsi ini disusun untuk memenuhi salah satu syarat guna menyelesaikan studi di Program Sarjana Fakultas Kedokteran Hewan, Institut Pertanian Bogor agar dapat mencapai gelar Sarjana Kedokteran Hewan.
Dalam kesempatan ini penulis menyampaikan ucapan terima kasih kepada semua pihak yang telah membantu dan membimbing dalam penyelesaian skripsi ini. Ucapan terima kasih ini disampaikan kepada:
1. Keluarga tercinta (Bapak, Mama, Ricardo, Novalia, Rivaldo, Rinaldo, Ryan) atas cinta kasih, kesabaran, perhatian, dukungan dan doanya kepada penulis.
2. Bapak Dr. Drh. Yusuf Ridwan, MSi dan Ibu Drh. Ekowati Handharyani, MSi, Ph.D selaku dosen pembimbing skripsi yang telah banyak meluangkan waktu dan pikiran dalam memberikan bimbingan dan arahan kepada penulis untuk menyelesaikan skripsi ini.
3. Ibu Dr. Drh. Dwi Jayanti Gunandini, MSi selaku dosen moderator dan Bapak Drh. Fadjar Satrija, MSc, Ph.D selaku dosen penilai seminar atas saran dan masukan yang diberikan terhadap makalah dan skripsi penulis. 4. Bapak Dr. Drh. Razak Achmad Hamzah, MS selaku dosen penguji sidang,
yang telah memberikan saran yang membangun sehingga skripsi penulis menjadi lebih baik.
5. Ibu Dr. Drh. Elok Budi Retnani, MSi selaku Pembimbing Akademik. 6. Teman-teman PFKH IPB dan PA atas doa dan kerjasamanya kepada
penulis selama ini.
7. Teman-teman Gianuzzi FKH 44 dan Novia`ers (Marisa, Regina, Tantri, Tika, Hera, Nova, Patris, Nita Dian, Desma, Septi) yang telah memberikan sejuta kenangan suka duka kepada penulis.
Akhir kata, penulis menyadari bahwa skripsi ini jauh dari kata sempurna sehingga penulis terbuka terhadap saran dan kritik yang diberikan. Semoga skripsi ini bermanfaat.
Bogor, Januari 2012
Penulis dilahirkan di Nagatimbul Kab.Tobasa-SUMUT pada tanggal 19 Desember 1989 dari pasangan Bapak Gr. Jatnen Panjaitan dan Ibu Lastry Maria Pasaribu. Penulis merupakan anak pertama dari lima bersaudara.
Penulis menyelesaikan jenjang pendidikan sekolah dasar pada tahun 2001 di SD Negeri I Pematang Bandar dan pada tahun yang sama penulis melanjutkan pendidikan ke SMP Negeri I Siborongborong hingga lulus pada tahun 2004. Pendidikan sekolah menengah umum diselesaikan pada tahun 2007 di SMA Negeri I Siborongborong. Pada tahun yang sama penulis berkesempatan untuk melanjutkan pendidikan di Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Semasa menjadi mahasiswa FKH IPB penulis pernah aktif dalam kegiatan eksternal dan internal kampus, yaitu di UKM Persekutuan Mahasiswa Kristen (PMK) Komisi Pelayanan Anak, anggota Himpunan Minat dan Profesi Ruminansia FKH IPB serta mengikuti berbagai kepanitiaan di dalam dan di luar kampus.
DAFTAR TABEL ………….………. xi Pengambilan Sampel Tinja dan Hati ………..… 15
Pemeriksaan Patologi Anatomi Organ Hati ……… 16
Koleksi dan Penghitungan JumlahF.gigantica……….. 16
Pemeriksaan Sampel Tinja ………. 17
Pembuatan Preparat Histopatologi ………. 17
Pengamatan Histopatologi ……….. 18
HASIL DAN PEMBAHASAN Pemeriksaan Organ Hati dan Tinja ………..… 20
Sensitifitas Metode Modifikasi Filtrasi dan Sedimentasi………… 23
DAFTAR TABEL
Halaman 1 Skoring derajat kerusakan patologi anatomi organ hati……… 16 2 Skoring derajat kerusakan histopatologi organ hati …..………..……… 19 3 Jumlah cacing dalam hati dan jumlah telur cacingF. gigantica
dalam tinja ………..….. 20
DAFTAR GAMBAR
Halaman
1 Fasciola gigantica………..….………. 3
2 MorfologiFasciolasp………... 5
3 TelurFasciolasp………... 6
4 Siklus hidupFasciolasp……… 7
5 Perubahan anatomi hati sapi yang mengalami fasciolosis ……… 9
6 Anatomi hati ………. 13
7 Sebaran jumlah telurF.giganticadengan jumlah cacing F.giganticadi dalam hati pada sapi yang terinfeksi ………. 22
8 Hati sapi yang mengalami fasciolosis tampak bengkak, mengeras, warna menjadi lebih pucat dan fibrosis. Terdapat terowongan jalur migrasi cacing ……… 25
DAFTAR LAMPIRAN
Halaman 1 Korelasi antara jumlah telurF.giganticadengan jumlahF.gigantica…. 34 2 Korelasi antara jumlahF.giganticadengan derajat kerusakan patologi
anatomi ………... 34 3 Korelasi antara jumlahF.giganticadengan derajat kerusakan
PENDAHULUAN
Latar Belakang
Sapi merupakan salah satu ternak sumber protein hewani bagi masyarakat Indonesia. Tingkat konsumsi daging sapi masyarakat Indonesia saat ini masih rendah yaitu sekitar 7 kg per kapita per tahun (Ditjennak 2011). Data statistika peternakan menunjukkan bahwa Indonesia belum dapat memenuhi kebutuhan masyarakat akan daging (BPS 2011). Oleh karena itu pemerintah melakukan impor sapi potong dan daging beku rata-rata 30 % dari kebutuhan daging nasional. Impor yang dilakukan secara terus menerus dapat mengurangi devisa negara. Untuk itu pemerintah Indonesia mencanangkan swasembada daging sapi pada tahun 2014 (Ditjennak 2011).
Pencapaian swasembada daging tahun 2014 dilakukan melalui usaha peningkatan jumlah produksi ternak sapi serta status kesehatan ternak yang optimal. Salah satu usaha untuk menjamin kesehatan hewan dilakukan melalui surveilans dan pengendalian berbagai penyakit yang dapat mempengaruhi reproduktif dan produktivitas sapi (Ditjennak 2011). Salah satu penyakit yang dapat mempengaruhi reproduksi dan produktivitas sapi adalah infeksi cacing hati (fasciolosis).
Fasciolosis merupakan penyakit endemik ternak di daerah tropis termasuk Indonesia (Ronohardjoet al1986). Penyakit ini disebabkan oleh cacing trematoda yaitu F.hepatica dan F.gigantica. Fasciolosis yang terjadi di berbagai daerah Indonesia disebabkan oleh infeksiF.gigantica dengan prevalensi sekitar 25 % - 90 % (Spithill et al 1998). Fasciolosis menyebabkan penurunan berat badan, penurunan produksi susu, penurunan daya tahan terhadap infeksi bakteri maupun virus, peningkatan biaya produksi berupa biaya pakan, tenaga kerja, pengobatan, pengafkiran organ hati yang rusak serta kematian (Soulsby 1986). Indonesia mengalami kerugian sekitar 439-525 juta dolar Australia pada tahun 2004 akibat fasciolosis (Copemanet al 2008).
tingkat sensitivitas yang rendah dan dapat menunjukan hasil negatif palsu. Dalam penelitiannya Anderson et al (1999) melaporkan dari 72 ekor sapi yang mengandung cacing Fasciola sp. di dalam hati menunjukkan hasil negatif palsu pada pemeriksaan tinja sebesar 34.72 %. Oleh karena itu diperlukan metode pemeriksaan tinja yang lebih sensitif.
Saat ini telah dikembangkan metode baru dalam pemeriksaan tinja yaitu metode filtrasi-sedimentasi. Metode ini dikembangkan oleh Danish Bilharziasis Laboratory (DBL) dengan mengkombinasikan antara penyaringan bertingkat, sedimen, dan sentrifugasi (Anh et al 2008). Penelitian ini dilakukan untuk mengetahui sensitivitas dan keakuratan metode filtrasi-sedimentasi yang telah dimodifikasi untuk pemeriksaan telur Fasciola sp. dengan membandingkan hasil pemeriksaan tinja dan jumlah cacingFasciolasp. di dalam organ hati.
Tujuan
Penelitian ini dilakukan untuk :
1. Mengetahui derajat infeksi dan kerusakan organ hati akibat fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah.
2. Mengetahui tingkat sensitifitas metode modifikasi filtrasi-sedimentasi dan korelasi antara jumlah telur F.gigantica di dalam tinja dengan jumlah F.giganticayang ditemukan di dalam organ hati.
TINJAUAN PUSTAKA
Fasciola gigantica
Klasifikasi dan MorfologiFasciola gigantica
Fasciola gigantica dikenal dengan cacing hati merupakan parasit dari kelas trematoda yang hidup di dalam buluh empedu sapi, domba, kambing dan mamalia lainnya. KlasifikasiF.giganticamenurut Soulsby (1986) adalah
kingdom : Animalia filum : Platyhelminthes kelas : Trematoda sub kelas : Digenea ordo : Echinostomida famili : Fasciolidae genus :Fasciola
spesies :Fasciola gigantica
Gambar 1 Fasciola gigantica Sumber: Anonim 2011
Fasciola sp. memiliki alat penghisap oral (sucker oral)dan alat penghisap ventral (sucker ventral). Alat penghisap oral terletak di ujung anterior dan mengelilingi mulut, sedangkan alat penghisap ventral terletak di sepertiga anterior permukaan ventral tubuh atau sejajar dengan bahu. Sistem pencernaan Fasciola sp. terdiri dari mulut, faring, esofagus dan percabangan sekum yang membentang sampai ujung posterior tubuh. Makanan diperoleh dari sekresi empedu dan menghisap darah induk semang. Metabolisme cacing dewasa berjalan secara anaerob. Sisa metabolisme diekskresikan melalui saluran ekskresi berupa gelembung ekskresi, tabung koleksi, sel-sel api (sel ekskresi) dan lubang ekskresi.
Fasciola sp. dilengkapi dengan sistem syaraf yang sederhana. Sistem syaraf cacing dewasa terdiri atas sistem syaraf pusat, otak, serabut syaraf, dan sistem syaraf perifer. Otak cacing dewasa dilengkapi dengan ganglia yang terletak di samping faring. Syaraf yang keluar dari ganglia menginervasi sekitar penghisap oral (sucker oral) dan faring, sedangkan sistem syaraf perifer mengelilingi esofagus kemudian berjalan bilateral pada setiap sisi tubuh menginervasi dinding tubuh, jaringan adhesi, faring dan sistem reproduksi (Fairweatheret al1998).
Gambar 2 Morfologi Fasciola sp.. (A) sistim reproduksi dan (B) sistem pencernaan (Andrews 1998).
Keterangan: 1. penghisap oral (sucker oral); 2. faring; 3. esofagus; 4. penghisap ventral (sucker ventral); 5. sekum; 6. lubang genital; 7. kantung sirus; 8. vas deferens; 9. ovarium; 10. uterus; 11. ootipe; 12. duktus vitelaria; 13. testis; 14. kelenjar vitelaria
Siklus HidupFasciola gigantica
F.giganticamemiliki siklus hidup secara tidak langsung yaitu memerlukan siput sebagai inang antara. Inang antara F.gigantica adalah siput Lymnaea rubiginosa (Asia Tenggara), Lymnaea auricularia (Amerika, Asia, Pasifik) dan Lymnaea natalensis (Afrika) sedangkan inang antara F.hepatica adalah siput Lymnaea truncatula (Eropa), Lymnaea tomentosa (Australia) dan Lymnaea humilis (Amerika Utara). Perbedaan inang antara ini menyebabkan kasus fasciolosis yang terjadi di Indonesia pada umumnya disebabkan oleh F.gigantica (Levine 1990).
Gambar 3 TelurFasciolasp.
Sumber: Andrews (1998).
Telur F.gigantica menetas dalam waktu 14-17 hari pada suhu lingkungan 280 C. Telur menetas mengeluarkan mirasidium. Mirasidium memiliki bentuk mirip segitiga sama sisi, bagian ujung posterior lancip, memiliki sebuah papila di pertengahan ujung anterior, epitel bersilia, dan sepasang bintik mata. Mirasidium bergerak aktif dalam air dan melakukan penetrasi masuk ke dalam siput. Di dalam tubuh siput, mirasidium melepaskan epitelnya kemudian masuk ke hepatopankreas dan berubah menjadi sporokista. Di dalam sporokista terdapat 1-6 bola-bola benih yang akan berkembang menjadi redia. Redia memiliki mulut, faring yang berotot, dan sepasang tonjolan tumpul ke lateral di pertengahan posterior tubuh. Di dalam redia terdapat bola-bola benih yang selanjutnya menetas mengeluarkan larva berupa serkaria.
Serkaria memiliki bentuk tubuh agak bulat dengan lekukan pada ujung posterior. Larva ini dilengkapi dengan sebuah alat penghisap anterior di sekeliling mulut, faring berotot, sepasang sekum sederhana, sebuah alat penghisap ventral atau asetabulum, ekor serta terdapat sejumlah kelenjar kistogenosa berwarna gelap dan bergranula terletak di bagian lateral tubuh. Serkaria keluar dari dalam siput (Lymnaea sp) sekitar 3-7 minggu setelah infeksi dan dipengaruhi oleh suhu lingkungan. Serkaria aktif berenang dalam air dan menempel pada benda-benda di sekitar permukaan air. Serkaria kemudian melepaskan ekornya dan memproduksi bahan pembungkus kista membentuk metaserkaria (Levine 1990).
Sebagian cacing muda sudah menembus kapsula dan bermigrasi dalam parenkim hati sekitar 4-8 hari setelah infeksi. Cacing tinggal di dalam parenkim hati selama 7 minggu kemudian bermigrasi masuk ke dalam buluh empedu untuk berkembang menjadi cacing dewasa. Cacing F.gigantica dewasa mulai memproduksi telur sekitar 8-10 minggu setelah infeksi (Levine 1990).
Gambar 4 Siklus hidupFasciolasp. Sumber: Bennett 1999
Patogenesis dan Gejala Klinis Fasciolosis
Fasciolosis subakut terjadi pada akhir musim gugur sampai musim semi (Mitchell 2007). Pada kasus ini ditemukan cacing dewasa sebanyak 500-1500 ekor di dalam buluh empedu dan telur cacing di dalam tinja kurang dari 100 (Matthews 1999). Kejadian subakut ditandai dengan adanya gejala klinis berupa ikterus, anemia, penurunan berat badan, edema submandibular (bottle jaw), serta perdarahan akibat dari cacing yang memakan jaringan hati (Soulsby 1986).
Fasciolosis kronis terjadi akibat dari migrasi dan keberadaan cacing dewasa di dalam buluh empedu sehingga menyebabkan kerusakan parenkim hati. Kejadian ini muncul pada musim dingin dan musim semi (Mitchell 2007) dengan jumlah cacing yang ditemukan sekitar 250 ekor dan telur cacing di dalam tinja mencapai 100 (Matthews 1999). Fasciolosis kronis ditandai dengan penurunan nafsu makan, anemia, anoreksia, diare kronis, penurunan berat badan, bottle jaw, cholangitis, dan fibrosis organ hati akibat dari cacing hati dewasa yang hidup dalam buluh empedu (Soulsby 1986).
Pada daerah tropis seperti Indonesia kejadian fasciolosis banyak terjadi di awal musim hujan dan di awal musim kemarau. Hal ini terjadi karena pertumbuhan optimal telur menjadi mirasidium terjadi pada awal musim hujan dan perkembangan di dalam tubuh siput mencapai tahap yang lengkap pada akhir musim hujan. Kemudian pelepasan serkaria terjadi pada awal musim kering saat curah hujan masih cukup tinggi dan menurun seiring dengan penurunan curah hujan.
tampak adanya perdarahan, degenerasi sel hati, peradangan, proliferasi buluh empedu, infiltrasi sel radang, serta adanya globula leukosit pada mukosa buluh empedu. Pada stadium kronis tampak fokus-fokus radang granuloma, mineralisasi, dan fibrosis (Winarsihet al1996).
Gambar 5 Perubahan anatomi hati sapi yang mengalami fasciolosis. Tanda panah menunjukkan terowongan jalur migrasi F.gigantica.
Sumber: Copemanet al2008
Diagnosa Fasciolosis
Diagnosa fasciolosis didasarkan pada gejala klinis, pemeriksaan laboratorium dan pemeriksaan post-mortem organ hati untuk melihat adanya F.gigantica di dalam buluh empedu. Pemeriksaan laboratorium yang umum dilakukan adalah pemeriksaan tinja untuk mendeteksi telur F.gigantica, pemeriksaan enzim hati, pemeriksaan hematologi, uji serologi, dan coproantigen atau pemeriksaan antigen dalam tinja (Mitchell 2003).
Pemeriksaan enzim hati dilakukan untuk mengukur level enzimaspartate aminotransfarase (AST), glutamate dehydrogenase (GLDH), dan L-gamma glutamyl transferase (GGT) pada sampel darah. Metode ini dapat mendeteksi adanya infeksi akut pada 2-3 minggu setelah infeksi. Jika level enzim AST lebih dari 60 iu/l, level enzim GLD lebih dari 13 iu/l (sapi) dan 10 iu/l (domba), serta level enzim GGT lebih dari 31 iu/l (domba) maka mengindikasikan adanya cacing dewasa di dalam buluh empedu. Pemeriksaan hematologi berupa deferensial leukosit dilakukan untuk menghitung jumlah sel radang eosinofil. Pemeriksaan ini merupakan indikator awal kemungkinan adanya infeksi cacing Fasciola sp. (Mitchell 2003).
Pendekatan alternatif untuk diagnosis fasciolosis adalah dengan uji serologi dan coproantigen. Uji serologi dilakukan untuk mendeteksi adanya antibodi dalam serum menggunakan ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 2 sampai minggu ke 4 setelah infeksi dengan sensitifitas 91 % dan spesifisitas 88 % (Estuningsih et al 2004). Sedangkan coproantigen dilakukan untuk mendeteksi antigen dalam tinja menggunakan Sandwich-ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 5 sampai minggu ke 9 setelah infeksi dengan sensitifitas 95 % dan spesifisitas 91 % (Estuningsihet al2004
Epidemiologi dan Pengendalian Fasciolosis
Populasi siput meningkat pada musim penghujan sehingga populasi harus dikendalikan. Menurut Martindah et al (2005) pengendalian populasi siput dapat dilakukan secara biologis, kimia dan mekanis. Pengendalian secara biologis yaitu dengan memelihara itik/bebek sebagai predator dan itik yang terinfeksi cacing Echinostoma sp. Cacing Echinostoma sp yang menginfeksi itik akan memproduksi telur yang akan keluar bersama tinja itik. Telur Echinostoma sp berkembang di lingkungan, menetas mengeluarkan larva mirasidium sebagai kompetitor mirasidum Fasciola sp. untuk memasuki tubuh siput. Secara alami terjadi juga persaingan antara mirasidium Fasciolasp. dengan mirasidium cacing Haplometra cylindricea (cacing paru-paru pada katak) untuk memasuki tubuh siput (Torgersonet al1998).
Pengendalian secara kimia dilakukan dengan pemberian molusida pada musim panas seiring dengan awal musim merumput bagi ternak. Molusida yang dipakai diantaranya adalah sodium pentachlorophenenate/ NaPCP, triklosamide, dan copper sulfat. Pengendalian secara mekanik dilakukan dengan pengeringan saluran irigasi dan habitat siput.
Kejadian fasciolosis dapat dikurangi dengan penerapan manajemen pemeliharaan ternak yang baik. Beberapa hal yang dapat dilakukan adalah manajeman pemberian pakan, pengembalaan ternak, serta manajemen penggunaan tinja sebagai pupuk. Menurut Martindah et al (2005), sebaiknya ternak diberikan pakan segar yang tidak terendam dalam air. Pengambilan jerami dari sawah sebagai pakan ternak dilakukan dengan pemotongon sekitar 10 cm dari atas permukaan air. Manajemen pengembalaan ternak sebaiknya dilakukan secara rotasi untuk menghindari daerah yang tercemar oleh metaserkaria. Ternak digembalakan di daerah yang tidak berair dan lembab. Menurut Mitchell (2003), penggunaan tinja sebagai pupuk sebaiknya setelah dilakukan dekomposisi supaya telurFasciolasp. sudah mati.
Hati Anatomi Hati
Hati merupakan kelenjar terbesar dalam tubuh yang berada di dalam rongga perut. Pada ruminansia, hati terletak di bawah diafragma pada bagian atas cavum abdominis dan cenderung terletak di sisi sebelah kanan akibat adanya dorongan dari perut besar (Fradson 1992). Hati difiksasi secara erat oleh beberapa ligamentum yaitu ligamentum coronarium hepatis, ligamentum triangulare dextrum dan sinistrum, ligamentum falciniformis hepatis dan ligamentum hepatorenale yang menghubungkan hati dengan ginjal kanan dan caecum. Pada hati terdapat ligamentum teres hepatis berupa jaringan ikat sisa vena umbilicalis yang berjalan dari pusar ke hati (Ressang 1984).
Gambar 6 Anatomi hati
1.Lobus dexter; 2. Lobus sinister; 3. Lobus caudatus; 4. Lobus quadratus; 5. Vena porta hepatica; 6. Ductus cysticus; 7. Vesica fellea. Sumber: Atlas of Anatomy Veterinary Horse, Ruminant and
Carnivorous.
Histologi Hati
Hati dikelilingi oleh mesotelium berupa kapsula jaringan ikat yang diperluas menjadi glandula dan terbagi menjadi lobus dan lobulus. Lobulus berbentuk silindris dengan panjang beberapa millimeter dan berdiameter 0.8 sampai 2 mm. Setiap lobulus terdiri dari berbagai komponen yaitu sel-sel hati (hepatosit), vena sentralis, sinusoid, cabang-cabang vena porta, cabang-cabang arteri hepatika, sel Kupffer dan kanalikuli biliaris (Ganong 1995).
Sel hati (hepatosit) berbentuk polihedral dengan inti bulat yang terletak di tengah. Sel- sel ini tersusun secara radial ke arah luar vena sentralis. Diantara baris-baris sel hati yang berdekatan terdapat kanalikuli empedu yang dibentuk oleh dua atau lebih membran plasma hepatosit yang berbatasan. Empedu disekresikan ke dalam kanalikuli empedu dibawa ke daerah portal (segitiga Kiernan) dan akhirnya meninggalkan hati melalui duktus hepatikus (Dellmann dan Brown 1992).
Sinusoid diselaputi oleh sel-sel makrofag yang dikenal dengan nama sel Kupffer. Sel-sel ini merupakan bagian terbesar dari sistem makrofag (retikulo endotelial) yang memiliki fungsi fagositik terhadap benda asing serta merontokkan jaringan, termasuk sel-sel merah yang aus atau rusak di dalam hati.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Oktober 2010 sampai Maret 2011 bertempat di Laboratorium Helmintologi bagian Parasitologi dan Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner dan Laboratorium Histopatologi Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat Penelitian
Sebanyak 18 ekor sapi potong di RPH Purwodadi Kabupaten Grobogan-Jawa Tengah pada tanggal 15 dan 16 Oktober 2010 diambil sampel tinjanya. Selanjutnya, setelah sapi disembelih diambil organ hatinya untuk dilakukan pemeriksaan.
Bahan yang diperlukan untuk pemeriksaan tinja adalah air dan methylen blue. Alat yang digunakan adalah kantung plastik, kertas label, lemari es, timbangan, gelas plastik, sendok, saringan teh dengan ukuran lubang 750-900 x 600-675 µm, saringan bertingkat berukuran 45 µm, 100 µm, dan 400 µm, pipet, gelas Baerman, cawan petri, mikroskop cahaya, dan lembar pencatatan.
Bahan dan alat yang digunakan dalam pemeriksaan patologi anatomi organ hati adalah NaCl fisiologis, pisau, gunting bedah, pinset anatomis, cawan petri, kertas label, dan kantung plastik. Sementara bahan yang digunakan dalam pembuatan preparat histopatologi hati adalah xylene, alkohol 70%, 96%, dan absolut, lithium carbonate, parafin, Mayer Haematoxyline serta Eosin. Alat yang digunakan adalah tissue cassette, automatic tissue processor, cetakan parafin, inkubator, mikrotom, mikroskop cahaya, dan alat tulis.
Metode Penelitian
Pengambilan Sampel Tinja dan Hati
dibawa ke laboratorium untuk dilakukan pemeriksaan terhadap adanya telur cacing.
Sampel organ hati dikoleksi dari 18 ekor sapi yang sudah disembelih. Masing-masing organ hati diambil kira-kira setebal 5 cm dari lobulus hati. Sampel dimasukkan ke dalam kantung plastik yang berisi Buffered Neutral Formalin (BNF) 10 % dan diberi label. Selanjutnya sampel dibawa ke laboratorium untuk dilakukan pemeriksaan histopatologi.
Pemeriksaan Patologi Anatomi Organ Hati
Organ hati sapi dipisahkan dari bagian jeroan lainnya, kemudian dilakukan pemeriksaan patologi anatomi (PA). Pemeriksaan PA dilakukan dengan melakukan inspeksi, palpasi dan insisi pada setiap organ hati yang dikoleksi. Derajat kerusakan yang terjadi diberi skor berdasarkan Jubb et al (1993), dalam Dumayanti (2003). Kriteria penilaian atau skoring disajikan pada Tabel 1.
Tabel 1 Skoring derajat kerusakan patologi anatomi organ hati
Skor derajat kerusakan Perubahan patalogi anatomi organ hati 0 (normal) Organ hati utuh dengan susunan normal.
+1 (ringan) Pembendungan, pembengkakan, buluh empedu sedikit melebar disertai fibrosis ringan.
+2 (sedang) Warna hati pucat, konsistensi keras, pelebaran buluh empedu, disertai fibrosis yang merata.
+3 (parah) Warna hati lebih pucat, konsistensi sangat keras, buluh empedu menebal, fibrosis yang cukup parah disertai pengapuran dan kalsifikasi.
Koleksi dan Penghitungan JumlahF.gigantica
dilakukan dengan menghitung bagian anterior cacing. Hal ini dilakukan untuk menghindari adanya penghitungan ganda bagian cacing yang terpotong.
Pemeriksaan Sampel Tinja
Pemeriksaan sampel tinja dilakukan dengan metode modifikasi filtrasi-sedimentasi. Tinja ditimbang sebanyak 4 gram kemudian dimasukkan ke dalam gelas dan dihomogenkan menggunakan air sebanyak 50 ml, diaduk lalu disaring dengan saringan teh. Penyaringan dilanjutkan dengan menggunakan saringan bertingkat berukuran 400 µm, 100 µm, dan 45 µm. Filtrat yang tersaring pada saringan ukuran 45 µm dimasukkan ke dalam gelas Baerman. Selanjutnya ditambahkan air sampai penuh lalu didiamkan selama 10 sampai 15 menit. Kemudian supernatan dibuang sedangkan sedimennya dibiarkan mengendap. Perlakuan ini diulang sampai diperoleh supernatan yang jernih. Sedimen yang terdapat pada dasar gelas Baerman dimasukkan ke dalam cawan petri bergaris dan ditambah methylen blue. Kemudian diperiksa di bawah mikroskop dengan perbesaran 10 kali dan 40 kali lalu dihitung jumlah telur cacing F.gigantica yang ditemukan (Willinghamet al1998, dalam Chrisnawaty 2008).
Pembuatan Preparat Histopatologi
Sampel organ hati difiksasi dalam larutan Buffered Neutral Formalin (BNF) 10%. Setiap sampel dipotong dengan ketebalan kurang lebih 3 mm. Hasil pemotongan dimasukkan ke dalam tissue cassettedan dilakukan dehidrasi. Proses dehidrasi menggunakan mesin automatic tissue processor dengan merendam sediaan tersebut secara berturut-turut ke dalam alkohol 70%, 80%, 90%, alkohol absolut I, II, dan III; clearing dengan xylol I, II, dan III; serta infiltrasi oleh parafin. Semua proses dehidrasi berjalan secara otomatis. Setelah didehidrasi, sampel dimasukkan ke dalam alat embedding blok pencetak yang telah berisi parafin cair dan cetakan dibiarkan hingga parafin mengeras.
diangkat dari permukaan air hangat menggunakan gelas objek dan dikeringkan dalam inkubator 600C selama 24 jam.
Proses deparafinisasi dilakukan dengan cara memasukkan sediaan ke dalam larutan xylene I, II, dan III masing-masing selama 1 menit. Kemudian sediaan didehidrasi dengan alkohol bertingkat dimulai dari alkohol absolut, 96%,dan 70% masing-masing selama 1 menit. Setelah itu, sediaan dicuci dengan air mengalir dan dikeringkan.
Pewarnaan sediaan menggunakan Hematoksilin-Eosin. Pewarnaan dilakukan dengan merendam sediaan ke dalam Mayer Hematoksilin selama 1 menit, kemudian sediaan dicuci dengan air mengalir dan dicuci dengan lithium carbonate sebanyak 3 kali celupan. Sediaan dibilas kembali dengan air mengalir dan selanjutnya diwarnai dengan eosin selama 2 menit 30 detik. Kemudian sediaan dicuci dengan air mengalir selama 30 detik lalu dilakukan dehidrasi dalam alkohol bertingkat mulai dari alkohol 70%, 80%, dan 96% masing-masing sebanyak 10 kali celupan. Kemudian dicelupkan ke dalamxylene I, II, III, dan IV masing-masing selama 1 menit. Setelah itu, sediaan dikeringkan dan ditetesi dengan perekat permount dan segera ditutup menggunakan cover glass dan dibiarkan sampai mengering (Augheyet al2001).
Pengamatan Histopatologi
Tabel 2 Skoring derajat kerusakan histopatologi organ hati
Skor derajat kerusakan Perubahan histopatologi organ hati
0 (normal) Sel hati utuh, susunan normal dan buluh empedu normal.
+1 (ringan) Degenerasi parenkim, perdarahan, infiltrasi sel radang makrofag eosinofil, limfosit, adanya proliferasi buluh empedu dan sedikit fibrosis.
+2 (sedang) Degenerasi parenkim, infiltrasi sel radang makrofag, eosinofil, limfosit, adanya proliferasi buluh empedu dan fibrosis.
+3 (parah) Degenerasi parenkim, degenerasi lemak, infiltrasi sel radang eosinofil, neutrofil, limfosit dan makrofag, fibrosis yang cukup parah serta mineralisasi.
Analisis
HASIL DAN PEMBAHASAN
Pemeriksaan Organ Hati dan Tinja
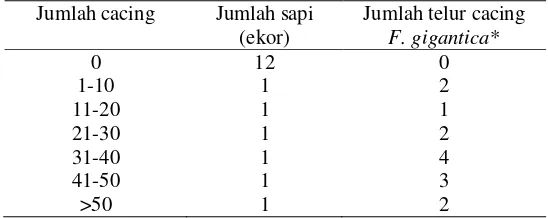
Hasil pemeriksaan organ hati dan tinja terhadap keberadaan cacing F.gigantica dan telurnya dapat dilihat pada Tabel 3. Jumlah cacing F.gigantica yang ditemukan dalam hati sapi sangat bervariasi dari 5 ekor sampai dengan 52 ekor cacing, sedangkan jumlah telur yang ditemukan dalam 4 gram tinja dari setiap sampel adalah sangat sedikit yaitu berkisar antara 1 sampai 4 telur cacing.
Tabel 3 Jumlah cacing dalam hati dan jumlah telur cacing F. gigantica dalam tinja
Jumlah sapi yang terinfeksi F.gigantica baik berdasarkan pemeriksaan organ hati dan tinja adalah 6 ekor (33,3 %). Menurut Sudardjat (1992) infeksi fasciolosis pada sapi dipengaruhi oleh umur. Penelitian yang dilakukan Anderson et al (1999), menunjukkan bahwa prevalensi infeksi Fasciola pada sapi dengan umur lebih dari 2 tahun lebih tinggi dibanding sapi berumur kurang dari 2 tahun. Hasil penelitian lainnya juga menunjukkan bahwa tingkat prevalensi infeksi F.gigantica pada sapi Bali berumur lebih dari 12 bulan lebih tinggi dibanding umur kurang dari 6 bulan dan antara 6 sampai 12 bulan (Sayuti 2007). Dalam penelitian ini tidak difokuskan pengamatan pada umur sapi karena sapi yang disembelih umumnya sudah dewasa dan berumur lebih dari 2 tahun.
dari peternakan rakyat yang dipelihara secara ekstensif, tradisional, dan dimanfaatkan untuk keperluan pertanian sehingga kemungkinan terinfeksi F.gigantica masih tinggi. Hal ini sesuai dengan hasil penelitian Sadarman et al (2007) yang menyatakan bahwa sapi Bali yang dipelihara secara ekstensif cenderung terinfeksi Fasciola sp. lebih tinggi dibandingkan sapi yang dipelihara secara intensif. Sapi yang dipelihara secara ekstensif dilepas di padang pengembalaan sehingga memiliki peluang lebih tinggi terpapar oleh metaserkaria.
Hasil pemeriksaan organ hati menunjukkan bahwa jumlah F.gigantica yang ditemukan sangat bervariasi. Menurut Martindahet al (2005) jumlah cacing di dalam organ hati dipengaruhi oleh jumlah metaserkaria yang termakan oleh inang definitif. Jumlah metaserkaria yang masuk ke dalam tubuh akan mempengaruhi derajat infeksi yang terjadi pada hewan tersebut. Semakin banyak metaserkaria yang tertelan maka semakin banyak cacing yang ditemukan di dalam organ hati. Selain itu, Fairweather et al (1998) menyatakan bahwa kemampuan cacing muda terhindar dari sistem pertahanan induk semang ketika melakukan migrasi juga akan mempengaruhi jumlah cacing di dalam organ hati.
Cacing F.gigantica mulai produksi telur ketika sudah mencapai stadium dewasa yaitu 8 hingga 10 minggu setelah infeksi (Hutchinsonet al 2007). Cacing F.gigantica dapat memproduksi sekitar 20.000 telur per hari. Telur yang diproduksi akan dikeluarkan melalui duktus bilirubin menuju duodenum dan akhirnya keluar bersama dengan tinja (Andrews 1998).
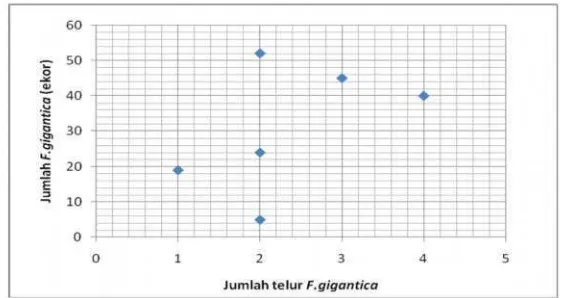
Gambar 7 Sebaran jumlah telurF. giganticadengan jumlah cacing F. gigantica di dalam hati pada sapi yang terinfeksi.
Tidak adanya korelasi antara jumlah telurF.gigantica di dalam tinja dengan jumlah F.gigantica di dalam organ hati dapat disebabkan oleh beberapa faktor. Faktor yang sangat berpengaruh adalah proses pemeriksaan sampel. Menurut Anderson et al (1999) hasil penghitungan telur di dalam tinja dipengaruhi oleh jumlah atau ukuran sampel yang digunakan dan konsentrasi telur di dalam tinja. Konsentrasi telur dalam tinja tergantung pada volume harian tinja ternak, laju ingesta di dalam usus dan distribusi telur dalam massa tinja. Tinja sapi dengan massa yang banyak dan konsistensi yang lembek menyebabkan distribusi telur tidak beraturan sehingga mempengaruhi hasil pemeriksaan (Kusumamihardja 1992).
Konsentrasi telur di dalam tinja juga dipengaruhi oleh perbedaan interval waktu pengeluaran telur pada setiap ternak. Molina (2005) dalam penelitiannya menyatakan bahwa telur dapat ditemukan di dalam tinja sekitar 8 minggu setelah infeksi. Konsentrasi telur di dalam tinja akan terus meningkat selama 4 sampai 12 minggu sejak telur pertama kali muncul dalam tinja selanjutnya mengalami penurunan seiring dengan perjalanan infeksi. Diduga infeksi yang terjadi pada sapi dalam penelitian ini sudah berlangsung lama atau kronis sehingga konsentrasi telur di dalam tinja sudah mulai menurun.
obstruksi pada duktus bilirubin akibat migrasi cacing di dalam hati sehingga telur tidak dapat keluar. Menurut Jones et al (2006) sebagian besar telur akan terakumulasi di dalam vesica fellea (kandung empedu). Hal ini tentu mempengaruhi konsentrasi telur di dalam tinja dan hasil pemeriksaan yang dilakukan.
Sensitifitas Metode Modifikasi Filtrasi-Sedimentasi
Sensitifitas merupakan proporsi dari individu terinfeksi dalam sampel yang memberikan hasil positif uji. Sensitifitas metode modifikasi filtrasi-sedimentasi dapat dihitung berdasarkan Tabel 4. Dengan membandingkan proporsi hasil positif pemeriksaan tinja dengan proporsi organ hati yang positif mengandung cacing F.gigantica dewasa maka diperoleh sensitifitas metode modifikasi filtrasi-sedimentasi sebesar 100 %.
Tabel 4 Hasil pemeriksaan tinja dan cacing dalam hati sapi Pemeriksaan tinja F.giganticadi dalam hati
Cacing (+) Cacing (-) Jumlah
Telur (+) 6 0 6
Telur (-) 0 12 12
Jumlah 6 12 18
Metode modifikasi filtrasi-sedimentasi yang digunakan pada penelitian ini memiliki sensitivitas yang lebih tinggi dibandingkan metode sedimentasi yang digunakan pada penelitian lain. Hal ini dilihat dari penelitian Adedokun et al (2008) yang menyatakan bahwa metode sedimentasi yang dipakai untuk pemeriksaan 1000 sampel tinja memiliki sensitifitas 66.5 % (proporsi dibandingkan dengan uji AGPT).
Pengamatan Patologi Anatomi Organ Hati
positif mengalami fasciolosis ditandai dengan ditemukannya F.giganticadi dalam buluh empedu. Hubungan jumlah cacing F. giganticadi dalam organ hati dengan derajat kerusakan patologi anatomi organ hati dapat dilihat pada tabel berikut.
Tabel 5 Derajat kerusakan patologi anatomi hati yang terinfeksiF.gigantica
Jumlah cacingF.gigantica Derajat kerusakan patologi
Hasil uji korelasi spearman`s rho menunjukkan tidak ada korelasi (p>0.05) antara jumlah F.gigantica yang ditemukan dengan derajat kerusakan patologi anatomi yang terjadi. Hasil ini berbeda dengan laporan yang disampaikan Martindah et al (2005) yang menyatakan bahwa luas kerusakan organ hati dipengaruhi oleh jumlah cacingF.giganticadan lamanya infeksi yang terjadi.
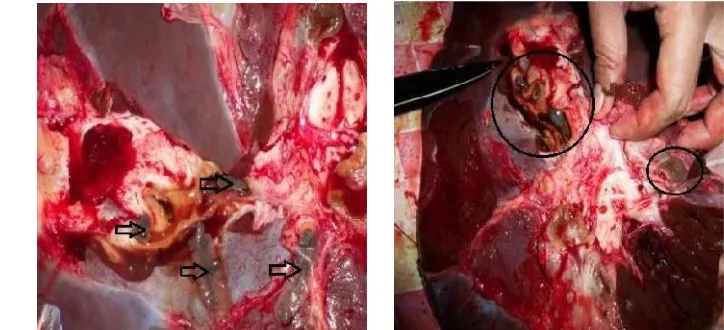
Menurut Joneset al(2006) lesio kerusakan pada organ hati disebabkan oleh dua faktor yaitu adanya migrasi cacing muda dan induksi cacing dewasa yang terjadi secara berkesinambungan. Cacing melakukan migrasi menuju organ hati melalui beberapa cara yaitu lewat aliran darah menuju vena porta, aliran empedu atau duktus choledochus dan perforasi usus melalui peritoneum menembus kapsula dan parenkim hati lalu bermigrasi menuju buluh empedu. Migrasi cacing di dalam organ hati menyebabkan kerusakan pada parenkim. Semakin banyak cacing yang melakukan migrasi maka kerusakan parenkim hati akan semakin parah. Parenkim hati yang rusak akibat migrasi cacing akan digantikan oleh jaringan ikat atau fibrosis sehingga akan mengubah struktur hati. Akibatnya hati yang mengalami fasciolosis memiliki konsistensi yang lebih keras daripada hati normal. Pengerasan yang terjadi lama kelamaan akan menyebabkan sirosis hati.
konsistensi yang kenyal pada beberapa bagian, sedangkan bagian yang lain terasa lebih keras. Hati mengalami kongesti ditandai dengan keluarnya cairan darah pada saat dilakukan insisi.
Gambar 8 1. Hati sapi yang mengalami fasciolosis tampak bengkak, mengeras, warna menjadi lebih pucat dan fibrosis 2. Terdapat terowongan jalur migrasi cacing.
Insisi pada bagian yang pucat dan putih ditemukan adanya jaringan fibrosa serta terdapat terowongan jalur migrasi cacing. Buluh empedu mengalami dilatasi dan penebalan serta ditemukan adanya F.gigantica disertai gumpalan kotor berlendir berwarna merah kecoklatan. Hal ini menunjukkan adanya proses infeksi yang sudah berjalan kronis.
Pengamatan Histopatologi
Hasil pengamatan histopatologi terhadap 18 sampel hati diperoleh 15 sampel hati mengalami perubahan histologi dengan derajat kerusakan yang bervariasi. Sebanyak 8 sampel mengalami kerusakan derajat ringan (+1), 4 sampel mengalami kerusakan derajat sedang (+2), dan 3 sampel mengalami kerusakan derajat parah (+3). Sebanyak 6 sampel diantaranya berasal dari hati yang positif mengalami fasciolosis. Hubungan jumlah cacingF. giganticadi dalam organ hati dengan derajat kerusakan histopatologi organ hati dapat dilihat pada Tabel 6.
Tabel 6 Derajat kerusakan histopatologi hati yang terinfeksiF.gigantica
Jumlah cacingF.gigantica Derajat kerusakan
Hasil uji korelasi Spearman`s rho menunjukkan bahwa tidak ada korelasi yang nyata (p>0.05) antara jumlah F.gigantica yang ditemukan di dalam organ hati dengan derajat kerusakan histopatologi. Hati yang tidak mengandung F.gigantica juga mengalami kerusakan histopatologi yang mengarah pada fasciolosis. Hal ini diduga terjadi akibat adanya kemungkinan ternak pernah terinfeksi namun sudah mendapat pengobatan sehingga pada saat dilakukan pemeriksaan post mortem tidak ditemukan lagi adanya F.gigantica, sementara kerusakan histopatologi yang terjadi bersifat permanen dan masih teramati.
Fasciolosis menyebabkan perubahan histopatologi organ hati yang terjadi secara konstan seiring dengan perjalanan infeksi. Lesio disebabkan oleh adanya migrasi cacing muda dan induksi cacing dewasa di dalam hati. Menurut McGavin et al (2007) migrasi cacing muda menyebabkan perdarahan dan kerusakan parenkim serta sel-sel hepatosit. Jalur migrasi cacing akan terisi darah, benang-benang fibrin dan runtuhan sel. Kerusakan parenkim hati akan digantikan oleh jaringan fibrosis.
Setelah melakukan migrasi, cacing akan mencapai buluh empedu dan hidup sebagai cacing dewasa. Cacing F.giganticadewasa di dalam buluh empedu merangsang terjadinya peradangan sehingga terjadi infiltrasi neutrofil, eosinofil, dan limfosit sementara makrofag, sel epiteloid dan sel raksasa multinukleal meningkat seiring dengan kerusakan yang semakin parah terutama disekitar larva cacing yang mati (Joneset al2006).
Cacing dewasa menginduksi proliferasi buluh empedu. Proliferasi disertai dengan hiperplasia dinding buluh empedu dan infiltrasi leukosit. Cacing dewasa mengakibatkan terbentuknya jaringan fibrosa sehingga dinding buluh empedu menjadi tebal. Penebalan buluh empedu akan menghambat aliran empedu, sehingga terjadi endapan kalsium pada saluran empedu (Joneset al2006).
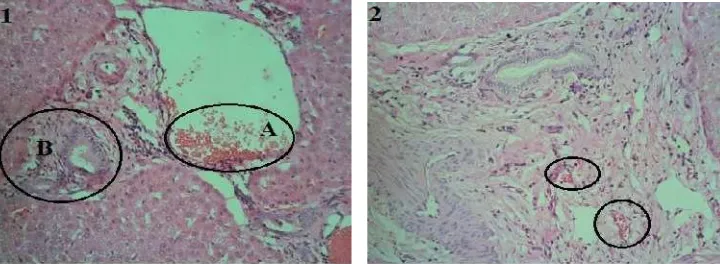
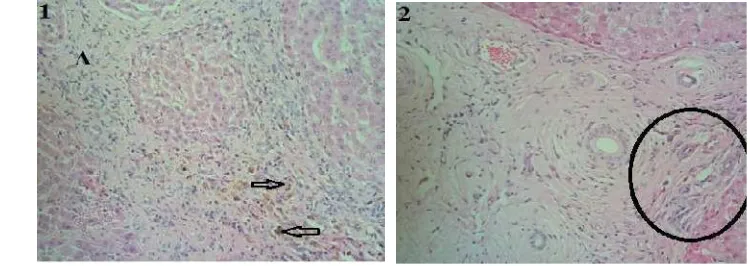
Sampel organ hati yang mengalami kerusakan derajat ringan (+1) ditandai lesio berupa degenerasi parenkim, perdarahan, infiltrasi sel radang makrofag, eosinofil, dan limfosit, proliferasi buluh empedu dan sedikit fibrosis. Perdarahan yang terjadi dapat dilihat dari adanya sel-sel eritrosit di parenkim hati.
Sampel organ hati yang mengalami kerusakan derajat sedang (+2) ditandai lesio berupa degenerasi parenkim, infiltrasi sel radang makrofag, eosinofil, limfosit, proliferasi buluh empedu serta fibrosis.
Gambar 11 Histopatologi hati sapi yang mengalami kerusakan derajat sedang (+2). 1.Terdapat proliferasi buluh empedu dan infiltrasi sel radang. 2.Tanda panah menunjukkan adanya fibrosis. Pewarnaan HE, objektif 20X.
Sampel organ hati yang mengalami kerusakan derajat parah (+3) ditandai lesio berupa degenerasi parenkim, degenerasi lemak, infiltrasi sel radang makrofag, eosinofil, neutrofil, dan limfosit, proliferasi buluh empedu, fibrosis yang cukup parah disertai mineralisasi.
SIMPULAN DAN SARAN
Simpulan
1. Hasil pemeriksaan tinja dan pemeriksaan keberadaan cacing F.gigantica pada hati menunjukkan sebanyak 6 sampel (33,33 %) positif terinfeksi F.gigantica.
2. Pemeriksaan tinja menggunakan metode modifikasi filtrasi-sedimentasi memiliki sensitifitas yang tinggi yaitu 100 %. Tidak ada korelasi antara jumlah telur F.gigantica di dalam tinja dengan jumlah F.gigantica yang ditemukan di dalam organ hati.
3. Evaluasi terhadap 18 sampel organ hati diperoleh 7 sampel mengalami perubahan patologi anatomi, sebanyak 6 sampel diantaranya positif fasciolosis. Hasil pengamatan histopatologi menunjukkan bahwa 15 sampel hati mengalami perubahan histopatologi dengan derajat yang bervariasi antara ringan, sedang, dan parah.
4. Tidak ada korelasi antara jumlahF.gigantica di dalam organ hati dengan perubahan patologi anatomi dan histopatologi hati.
Saran
DAFTAR PUSTAKA
Adedokun OA, Ayinmode AB, Fagbemi BO. 2008. A comparative study of three methods for detecting Fasciola infections in Nigerian cattle. Veterinarski Arhiv78 (5): 411-416.
Anderson N, Luong TT, Vo NG, Bui KL, Smooker PM, Spithill TW. 1999. The sensitivity and specificity of two methods for detectingFasciolainfections in cattle.Vet. Parasitology83: 15-24.
Andrews SJ. 1998. The life cycle of Fasciola hepatica. Di dalam: Dalton JP, editor.Fasciolosis. UK: CABI Publishing. hlm 1-29.
Anh NTL, Phuong NT, Ha GH, Thu LT, Johansen MV, Murrell DK, Thamsborg SM. 2008. Evaluation of techniques for detection of small trematode eggs in faeces of domestic animals [abstrak]. Di dalam: Vet. Parasitology156: 346-349.
Anonim. 2011. Fasciola gigantica. [terhubung berkala]. http://abouthealt-h.com/fasciola-gigantica/fasciola-gigantica.html. [20 Desember 2011]. Aughey E, Frye FL. 2001. Comparative Veterinary Histology. UK: Iowa State
University Press.
Banks WJ. 1986. Applied Veterinary Histology. Ed ke-2. USA: Williams & Wilkins.
Bennett C. 1999. The life cycle of Fasciola hepatica. [terhubung berkala]. http://www.soton.ac.uk/~ceb/Insideafluke/lifecycle.htm. [14 Desember 2011].
[BPS] Badan Pusat Statistik. 2011. Data Konsumsi. [terhubung berkala]. http://www.bps.go.id/. [14 Januari 2012].
Chrisnawaty D. 2008. Infeksi cacing saluran pencernaan pada Monyet ekor panjang (Macaca fascicularis) di Pulau Tinjil [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Copeman DB, Copland RS. 2008. Importance and potential impact of liver fluke in cattle and buffalo. Di dalam: Gray GD, Copland RS, Copeman DB, editor. Overcoming Liver Fluke in South-East Asia. Australia: Australian Centre for International Agricultural Research. hlm 22-36.
[Ditjennak] Direktorat Jenderal Peternakan. 2011. Blue Print Program Swasembada Daging Sapi 2014. Jakarta: Ditjennak.
Dumayanti J. 2003. Kajian patologis hati sapi terhadap kemungkinan fasciolosis di rumah potong hewan Depok [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Estuningsih SE, Widjajanti S, Adiwinata G. 2004. Perbandingan antara uji elisa-antibodi dan pemeriksaan telur cacing untuk mendeteksi infeksi Fasciola giganticapada sapi.Jurnal Ilmu Ternak dan Veteriner9(1): 55-60.
Fairweather I, Threadgold LT, Hanna REB. 1998. Development of Fasciola hepaticain the mammalian host. Di dalam: Dalton JP, editor.Fasciolosis. UK: CABI Publishing. hlm 47-111.
Fradson RD. 1992. Anatomi dan Fisiologi Ternak. Yogyakarta: Gadjah Mada University Press.
Ganong WF. 1995. Buku Ajar Fisiologi Kedokteran. Andrianto P, penerjemah; Oswari J, editor. Jakarta: EGC. Terjemahan dari: Review of Medical Physiology.
Hutchinson GW, Love S. 2007. Liver fluke disease in sheep and cattle. Primefact 446: 1-10.
Jones TC, Hunt RD, King NW. 2006. Veterinary Pathology. Ed ke-6. USA: Blackwell Publishing.
Kusumamihardja S. 1992. Parasit dan Parasitosis pada Hewan Ternak dan Hewan Piaraan di Indonesia. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Levine ND. 1990. Parasitologi Veteriner. Ashadi G, penerjemah; Wardiarto, editor. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: Textbook of Veterinary Parasitology.
Martindah E, Widjajanti S, Estuningsih SE, Suhardono. 2005. Meningkatkan kesadaran dan kepedulian masyarakat terhadap fasiolosis sebagai penyakit zoonosis.Wartazoa15: 143-154.
Matthews JG. 1999.Disease of the Goat. Ed ke-2. London: Blackwell Publishing. McGavin MD, Zachary JF. 2007.Pathologic Basis of Veterinary Diseases. Ed
ke-4. USA: Mosby Elseiver.
Mitchell GBB. 2003. Treatment and control of liver fluke in sheep and cattle. [terhubung berkala]. http//www.sac.ac.uk/vet/external/monthly report/curent.asp. [27 April 2011]
Molina EC. 2005. Comparison of host parasite relationships of Fasciola gigantica infection in cattle (Bos indicus) and swamp buffaloes (Bubalus bubalis) [thesis]. Australia: School of Tropical Veterinary and Biomedical Sciences, James Cook University.
Ressang AA. 1984. Patologi Khusus Veteriner. Bali: NV Percetakan Bali.
Ronohardjo P, Wilson AJ. 1986. Disease problems of small ruminants in Indonesia. Di dalam: Devendra C, editor. Small Ruminant Production Systems in South and Southeast Asia. Proceedings of a Workshop Held In Bogor; Indonesia, 6-10 October 1986. Ottawa: The International Development Research Centre. hlm 280-288.
Sadarman, Handoko J, Febrina D. 2007. Infestasi Fasciola sp. pada sapi Bali dengan sistem pemeliharaan yang berbeda di Desa Tanjung Rambutan Kecamatan Kampar.Jurnal Peternakan4: 37-45.
Sayuti L. 2007. Kejadian infeksi cacing hati (Fasciola sp.) pada sapi Bali di Kabupaten Karang Asem Bali [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Soulsby EJL. 1986. Helminth, Arthropods and Protozoa of Domecticated Animals. Ed ke-7. London: Bailliere Tidall.
Spithill TW, Smooker PM, Copeman DB. 1998. Fasciola gigantica: epidemiology, control, immunology and molecular biology. Di dalam: Dalton JP, editor.Fasciolosis. UK: CABI Publishing. hlm 465-525. Sudardjat S. 1992.Epidemiologi Veteriner Terapan. Jakarta: Deptan.
Taylor MA, Coop RL, Wall RL. 2007. Veterinary Parasitology. Ed ke-3. UK: Blackwell Publishing.
Torgerson P, Claxton J. 1998. Epidemiology and control. Di dalam: Dalton JP, editor.Fasciolosis. UK: CABI Publishing. hlm 113-149.
Analisa Statistik Menggunakan SPSS
Lampiran 1 Korelasi antara jumlah telurF.giganticadengan jumlahF.gigantica
Karena p-value(0,333) > alpha(0,05) maka tidak terdapat korelasi antara jumlah telur F.giganticadengan jumlahF.gigantica.
Lampiran 2 Korelasi antara jumlah F.giganticadengan derajat kerusakan patologi anatomi
Lampiran 3 Korelasi antara jumlah F.giganticadengan derajat kerusakan histopatologi
PENDAHULUAN
Latar Belakang
Sapi merupakan salah satu ternak sumber protein hewani bagi masyarakat Indonesia. Tingkat konsumsi daging sapi masyarakat Indonesia saat ini masih rendah yaitu sekitar 7 kg per kapita per tahun (Ditjennak 2011). Data statistika peternakan menunjukkan bahwa Indonesia belum dapat memenuhi kebutuhan masyarakat akan daging (BPS 2011). Oleh karena itu pemerintah melakukan impor sapi potong dan daging beku rata-rata 30 % dari kebutuhan daging nasional. Impor yang dilakukan secara terus menerus dapat mengurangi devisa negara. Untuk itu pemerintah Indonesia mencanangkan swasembada daging sapi pada tahun 2014 (Ditjennak 2011).
Pencapaian swasembada daging tahun 2014 dilakukan melalui usaha peningkatan jumlah produksi ternak sapi serta status kesehatan ternak yang optimal. Salah satu usaha untuk menjamin kesehatan hewan dilakukan melalui surveilans dan pengendalian berbagai penyakit yang dapat mempengaruhi reproduktif dan produktivitas sapi (Ditjennak 2011). Salah satu penyakit yang dapat mempengaruhi reproduksi dan produktivitas sapi adalah infeksi cacing hati (fasciolosis).
Fasciolosis merupakan penyakit endemik ternak di daerah tropis termasuk Indonesia (Ronohardjoet al1986). Penyakit ini disebabkan oleh cacing trematoda yaitu F.hepatica dan F.gigantica. Fasciolosis yang terjadi di berbagai daerah Indonesia disebabkan oleh infeksiF.gigantica dengan prevalensi sekitar 25 % - 90 % (Spithill et al 1998). Fasciolosis menyebabkan penurunan berat badan, penurunan produksi susu, penurunan daya tahan terhadap infeksi bakteri maupun virus, peningkatan biaya produksi berupa biaya pakan, tenaga kerja, pengobatan, pengafkiran organ hati yang rusak serta kematian (Soulsby 1986). Indonesia mengalami kerugian sekitar 439-525 juta dolar Australia pada tahun 2004 akibat fasciolosis (Copemanet al 2008).
tingkat sensitivitas yang rendah dan dapat menunjukan hasil negatif palsu. Dalam penelitiannya Anderson et al (1999) melaporkan dari 72 ekor sapi yang mengandung cacing Fasciola sp. di dalam hati menunjukkan hasil negatif palsu pada pemeriksaan tinja sebesar 34.72 %. Oleh karena itu diperlukan metode pemeriksaan tinja yang lebih sensitif.
Saat ini telah dikembangkan metode baru dalam pemeriksaan tinja yaitu metode filtrasi-sedimentasi. Metode ini dikembangkan oleh Danish Bilharziasis Laboratory (DBL) dengan mengkombinasikan antara penyaringan bertingkat, sedimen, dan sentrifugasi (Anh et al 2008). Penelitian ini dilakukan untuk mengetahui sensitivitas dan keakuratan metode filtrasi-sedimentasi yang telah dimodifikasi untuk pemeriksaan telur Fasciola sp. dengan membandingkan hasil pemeriksaan tinja dan jumlah cacingFasciolasp. di dalam organ hati.
Tujuan
Penelitian ini dilakukan untuk :
1. Mengetahui derajat infeksi dan kerusakan organ hati akibat fasciolosis di RPH Purwodadi Kabupaten Grobogan- Jawa Tengah.
2. Mengetahui tingkat sensitifitas metode modifikasi filtrasi-sedimentasi dan korelasi antara jumlah telur F.gigantica di dalam tinja dengan jumlah F.giganticayang ditemukan di dalam organ hati.
TINJAUAN PUSTAKA
Fasciola gigantica
Klasifikasi dan MorfologiFasciola gigantica
Fasciola gigantica dikenal dengan cacing hati merupakan parasit dari kelas trematoda yang hidup di dalam buluh empedu sapi, domba, kambing dan mamalia lainnya. KlasifikasiF.giganticamenurut Soulsby (1986) adalah
kingdom : Animalia filum : Platyhelminthes kelas : Trematoda sub kelas : Digenea ordo : Echinostomida famili : Fasciolidae genus :Fasciola
spesies :Fasciola gigantica
Gambar 1 Fasciola gigantica Sumber: Anonim 2011
Fasciola sp. memiliki alat penghisap oral (sucker oral)dan alat penghisap ventral (sucker ventral). Alat penghisap oral terletak di ujung anterior dan mengelilingi mulut, sedangkan alat penghisap ventral terletak di sepertiga anterior permukaan ventral tubuh atau sejajar dengan bahu. Sistem pencernaan Fasciola sp. terdiri dari mulut, faring, esofagus dan percabangan sekum yang membentang sampai ujung posterior tubuh. Makanan diperoleh dari sekresi empedu dan menghisap darah induk semang. Metabolisme cacing dewasa berjalan secara anaerob. Sisa metabolisme diekskresikan melalui saluran ekskresi berupa gelembung ekskresi, tabung koleksi, sel-sel api (sel ekskresi) dan lubang ekskresi.
Fasciola sp. dilengkapi dengan sistem syaraf yang sederhana. Sistem syaraf cacing dewasa terdiri atas sistem syaraf pusat, otak, serabut syaraf, dan sistem syaraf perifer. Otak cacing dewasa dilengkapi dengan ganglia yang terletak di samping faring. Syaraf yang keluar dari ganglia menginervasi sekitar penghisap oral (sucker oral) dan faring, sedangkan sistem syaraf perifer mengelilingi esofagus kemudian berjalan bilateral pada setiap sisi tubuh menginervasi dinding tubuh, jaringan adhesi, faring dan sistem reproduksi (Fairweatheret al1998).
Gambar 2 Morfologi Fasciola sp.. (A) sistim reproduksi dan (B) sistem pencernaan (Andrews 1998).
Keterangan: 1. penghisap oral (sucker oral); 2. faring; 3. esofagus; 4. penghisap ventral (sucker ventral); 5. sekum; 6. lubang genital; 7. kantung sirus; 8. vas deferens; 9. ovarium; 10. uterus; 11. ootipe; 12. duktus vitelaria; 13. testis; 14. kelenjar vitelaria
Siklus HidupFasciola gigantica
F.giganticamemiliki siklus hidup secara tidak langsung yaitu memerlukan siput sebagai inang antara. Inang antara F.gigantica adalah siput Lymnaea rubiginosa (Asia Tenggara), Lymnaea auricularia (Amerika, Asia, Pasifik) dan Lymnaea natalensis (Afrika) sedangkan inang antara F.hepatica adalah siput Lymnaea truncatula (Eropa), Lymnaea tomentosa (Australia) dan Lymnaea humilis (Amerika Utara). Perbedaan inang antara ini menyebabkan kasus fasciolosis yang terjadi di Indonesia pada umumnya disebabkan oleh F.gigantica (Levine 1990).
Gambar 3 TelurFasciolasp.
Sumber: Andrews (1998).
Telur F.gigantica menetas dalam waktu 14-17 hari pada suhu lingkungan 280 C. Telur menetas mengeluarkan mirasidium. Mirasidium memiliki bentuk mirip segitiga sama sisi, bagian ujung posterior lancip, memiliki sebuah papila di pertengahan ujung anterior, epitel bersilia, dan sepasang bintik mata. Mirasidium bergerak aktif dalam air dan melakukan penetrasi masuk ke dalam siput. Di dalam tubuh siput, mirasidium melepaskan epitelnya kemudian masuk ke hepatopankreas dan berubah menjadi sporokista. Di dalam sporokista terdapat 1-6 bola-bola benih yang akan berkembang menjadi redia. Redia memiliki mulut, faring yang berotot, dan sepasang tonjolan tumpul ke lateral di pertengahan posterior tubuh. Di dalam redia terdapat bola-bola benih yang selanjutnya menetas mengeluarkan larva berupa serkaria.
Serkaria memiliki bentuk tubuh agak bulat dengan lekukan pada ujung posterior. Larva ini dilengkapi dengan sebuah alat penghisap anterior di sekeliling mulut, faring berotot, sepasang sekum sederhana, sebuah alat penghisap ventral atau asetabulum, ekor serta terdapat sejumlah kelenjar kistogenosa berwarna gelap dan bergranula terletak di bagian lateral tubuh. Serkaria keluar dari dalam siput (Lymnaea sp) sekitar 3-7 minggu setelah infeksi dan dipengaruhi oleh suhu lingkungan. Serkaria aktif berenang dalam air dan menempel pada benda-benda di sekitar permukaan air. Serkaria kemudian melepaskan ekornya dan memproduksi bahan pembungkus kista membentuk metaserkaria (Levine 1990).
Sebagian cacing muda sudah menembus kapsula dan bermigrasi dalam parenkim hati sekitar 4-8 hari setelah infeksi. Cacing tinggal di dalam parenkim hati selama 7 minggu kemudian bermigrasi masuk ke dalam buluh empedu untuk berkembang menjadi cacing dewasa. Cacing F.gigantica dewasa mulai memproduksi telur sekitar 8-10 minggu setelah infeksi (Levine 1990).
Gambar 4 Siklus hidupFasciolasp. Sumber: Bennett 1999
Patogenesis dan Gejala Klinis Fasciolosis
Fasciolosis subakut terjadi pada akhir musim gugur sampai musim semi (Mitchell 2007). Pada kasus ini ditemukan cacing dewasa sebanyak 500-1500 ekor di dalam buluh empedu dan telur cacing di dalam tinja kurang dari 100 (Matthews 1999). Kejadian subakut ditandai dengan adanya gejala klinis berupa ikterus, anemia, penurunan berat badan, edema submandibular (bottle jaw), serta perdarahan akibat dari cacing yang memakan jaringan hati (Soulsby 1986).
Fasciolosis kronis terjadi akibat dari migrasi dan keberadaan cacing dewasa di dalam buluh empedu sehingga menyebabkan kerusakan parenkim hati. Kejadian ini muncul pada musim dingin dan musim semi (Mitchell 2007) dengan jumlah cacing yang ditemukan sekitar 250 ekor dan telur cacing di dalam tinja mencapai 100 (Matthews 1999). Fasciolosis kronis ditandai dengan penurunan nafsu makan, anemia, anoreksia, diare kronis, penurunan berat badan, bottle jaw, cholangitis, dan fibrosis organ hati akibat dari cacing hati dewasa yang hidup dalam buluh empedu (Soulsby 1986).
Pada daerah tropis seperti Indonesia kejadian fasciolosis banyak terjadi di awal musim hujan dan di awal musim kemarau. Hal ini terjadi karena pertumbuhan optimal telur menjadi mirasidium terjadi pada awal musim hujan dan perkembangan di dalam tubuh siput mencapai tahap yang lengkap pada akhir musim hujan. Kemudian pelepasan serkaria terjadi pada awal musim kering saat curah hujan masih cukup tinggi dan menurun seiring dengan penurunan curah hujan.
tampak adanya perdarahan, degenerasi sel hati, peradangan, proliferasi buluh empedu, infiltrasi sel radang, serta adanya globula leukosit pada mukosa buluh empedu. Pada stadium kronis tampak fokus-fokus radang granuloma, mineralisasi, dan fibrosis (Winarsihet al1996).
Gambar 5 Perubahan anatomi hati sapi yang mengalami fasciolosis. Tanda panah menunjukkan terowongan jalur migrasi F.gigantica.
Sumber: Copemanet al2008
Diagnosa Fasciolosis
Diagnosa fasciolosis didasarkan pada gejala klinis, pemeriksaan laboratorium dan pemeriksaan post-mortem organ hati untuk melihat adanya F.gigantica di dalam buluh empedu. Pemeriksaan laboratorium yang umum dilakukan adalah pemeriksaan tinja untuk mendeteksi telur F.gigantica, pemeriksaan enzim hati, pemeriksaan hematologi, uji serologi, dan coproantigen atau pemeriksaan antigen dalam tinja (Mitchell 2003).
Pemeriksaan enzim hati dilakukan untuk mengukur level enzimaspartate aminotransfarase (AST), glutamate dehydrogenase (GLDH), dan L-gamma glutamyl transferase (GGT) pada sampel darah. Metode ini dapat mendeteksi adanya infeksi akut pada 2-3 minggu setelah infeksi. Jika level enzim AST lebih dari 60 iu/l, level enzim GLD lebih dari 13 iu/l (sapi) dan 10 iu/l (domba), serta level enzim GGT lebih dari 31 iu/l (domba) maka mengindikasikan adanya cacing dewasa di dalam buluh empedu. Pemeriksaan hematologi berupa deferensial leukosit dilakukan untuk menghitung jumlah sel radang eosinofil. Pemeriksaan ini merupakan indikator awal kemungkinan adanya infeksi cacing Fasciola sp. (Mitchell 2003).
Pendekatan alternatif untuk diagnosis fasciolosis adalah dengan uji serologi dan coproantigen. Uji serologi dilakukan untuk mendeteksi adanya antibodi dalam serum menggunakan ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 2 sampai minggu ke 4 setelah infeksi dengan sensitifitas 91 % dan spesifisitas 88 % (Estuningsih et al 2004). Sedangkan coproantigen dilakukan untuk mendeteksi antigen dalam tinja menggunakan Sandwich-ELISA. Uji ini dapat mendeteksi adanya infeksi awal pada minggu ke 5 sampai minggu ke 9 setelah infeksi dengan sensitifitas 95 % dan spesifisitas 91 % (Estuningsihet al2004
Epidemiologi dan Pengendalian Fasciolosis
Populasi siput meningkat pada musim penghujan sehingga populasi harus dikendalikan. Menurut Martindah et al (2005) pengendalian populasi siput dapat dilakukan secara biologis, kimia dan mekanis. Pengendalian secara biologis yaitu dengan memelihara itik/bebek sebagai predator dan itik yang terinfeksi cacing Echinostoma sp. Cacing Echinostoma sp yang menginfeksi itik akan memproduksi telur yang akan keluar bersama tinja itik. Telur Echinostoma sp berkembang di lingkungan, menetas mengeluarkan larva mirasidium sebagai kompetitor mirasidum Fasciola sp. untuk memasuki tubuh siput. Secara alami terjadi juga persaingan antara mirasidium Fasciolasp. dengan mirasidium cacing Haplometra cylindricea (cacing paru-paru pada katak) untuk memasuki tubuh siput (Torgersonet al1998).
Pengendalian secara kimia dilakukan dengan pemberian molusida pada musim panas seiring dengan awal musim merumput bagi ternak. Molusida yang dipakai diantaranya adalah sodium pentachlorophenenate/ NaPCP, triklosamide, dan copper sulfat. Pengendalian secara mekanik dilakukan dengan pengeringan saluran irigasi dan habitat siput.