TUGAS KIMIA
1. UNSUR-UNSUR HALOGEN
Berdasarkan konfigurasi elektronnya, halogen menempati golongan VIIA dalam tabel periodik. Atom-atom unsur halogen memiliki afinitas elektron tinggi sehingga mudah menerima elektron membentuk konfigurasi elektron gas mulia. Oleh sebab itu, unsur-unsur halogen tidak pernah ditemukan dalam keadaan unsur bebas di alam.
A. Kelimpahan Unsur Halogen
Halogen umumnya terdapat dalam bentuk garamnya. Oleh sebab itu, unsur-unsur golongan VIIA dinamakan halogen, artinya pembentuk garam (halos dan genes, halos = garam; genes = pembentuk atau pencipta).
Fluorin dan klorin merupakan unsur halogen yang melimpah di alam. Fluorin terdapat dalam mineral fluorapatit,
B. Sifat-Sifat Unsur Halogen
Semua unsur halogen terdapat sebagai molekul diatom, yaitu F2, Cl2, Br2, dan I2. Fluorin dan klorin berwujud gas, fluorin berwarna kuning pucat dan klorin berwarna kuning kehijauan. Bromin mudah menguap, cairan dan uapnya berwarna cokelat-kemerahan. Iodin berupa zat padat berwarna hitam mengkilap yang dapat menyublim menghasilkan uap berwarna ungu.Unsur-unsur halogen mudah dikenali dari bau dan warnanya. Halogen umumnya berbau menyengat, terutama klorin dan bromin (bromos, artinya pesing). Kedua gas ini bersifat racun sehingga harus
ditangani secara hati-hati.
Kenaikan titik leleh dan titik didih dari atas ke bawah dalam tabel periodik disebabkan gaya London di antara molekul halogen yang makin meningkat dengan bertambahnya panjang ikatan. Gaya berbanding lurus dengan jarak atau panjang ikatan.
Kereaktifan halogen dapat dipelajari dari jari-jari atomnya. Dari atas ke bawah, jari-ja ri atom meningkat sehingga gaya tarik inti terhadap penerimaan (afinitas) elektron makin lemah.
Akibatnya, kereaktifan unsur-unsur halogen dari atas ke bawah berkurang.
Kereaktifan halogen dapat juga dipelajari dari afinitas elektron. Makin besar afinitas elektron, makin reaktif unsur tersebut. Dari atas ke bawah dalam tabel periodik, afinitas elektron unsur-unsur halogen makin kecil sehingga kereaktifannya: F Cl Br I. Oleh karena unsur-unsur halogen mudah menerima elektron maka semua unsur halogen merupakan oksidator kuat. Kekuatan oksidator halogen menurun dari atas ke bawah dalam tabel periodik. Hal ini dapat dilihat dari potensial reduksi standar:
Berdasarkan data potensial reduksi standar dapat
disimpulkan bahwa F2 merupakan oksidator paling kuat. Oleh karena itu, unsur halogen dapat mengoksidasi halogen lain yang terletak di bawahnya dalam tabel periodik, tetapi reaksi kembalinya tidak terjadi.
Kekuatan oksidator F2, Cl2, Br2, dan I2 dapat dilihat dari reaksi antarhalogen. Gas fluorin dapat mengoksidasi unsur-unsur halogen yang berada di bawahnya:
Demikian pula jika gas klorin ditambahkan ke dalam larutan yang mengandung ion Br– atau ion I–, akan terbentuk bromin dan iodin.
Cl2(aq) + 2Br–(aq) →2Cl–(aq) + Br2(aq) Cl2(aq) + 2I–(aq) →2Cl–(aq) + I2(aq)
Reaksi Cl2 dengan Br– atau I– dapat digunakan untuk identifikasi bromin dan klorin dalam suatu senyawa ion.
Halogen dapat bereaksi dengan hampir semua unsur, baik unsur logam maupun nonlogam. Demikian pula dengan sesama halogen dapat membentuk senyawa antarhalogen, seperti ClF, BrF, IBr, ClF3, ClF5, dan IF7. Pada senyawa antarhalogen, biloks positif dimiliki oleh halogen dengan keelektronegatifan lebih kecil. Misalnya, dalam molekul ClF3, biloks Cl = +3 dan biloks F = –1. Halogen bereaksi dengan logam membentuk senyawa ionik. Dengan unsur bukan logam, halogen membentuk senyawa kovalen. Baik dalam senyawa ionik maupun kovalen, pada
umumnya halogen memiliki +3, +5, dan +7. Contohnya dapat dilihat pada tabel berikut.
C. Pembuatan dan Kegunaan Unsur Halogen
Gas F2 merupakan oksidator kuat sehingga hanya dapat dibuat melalui elektrolisis garamnya, yaitu larutan KF dalam HF cair. Dalam elektrolisis dihasilkan gas H2 di katode dan gas F2 di anode. Perhatikan gambar disamping. Gas F2 diproduksi secara komersial untuk bahan bakar nuklir uranium. Logam uranium direaksikan dengan gas fluorin berlebih menghasilkan uranium heksafluorida, UF6 (padatan berwarna putih dan mudah menguap).
Gas Cl2 dibuat melalui elektrolisis lelehan NaCl, reaksinya: Anode: Cl–(l) → Cl2(g)
Katode: Na+(l) →Na(s)
Gas Cl2 digunakan sebagai bahan dasar industri plastik, seperti vinil klorida, CH2=CHCl (untuk PVC), CCl4 (untuk fluorokarbon), dan CH3Cl (untuk silikon dan TEL). Dalam jumlah besar, klorin digunakan untuk desinfektan, pemutih, pulp kertas, dan tekstil. Gas Br2 dibuat dari air laut melalui oksidasi dengan gas Cl2. Secara komersial, pembuatan gas Br2 sebagai berikut.
Air laut dipanaskan kemudian dialirkan ke tanki yang berada di puncak menara.
Selanjutnya bromin dimurnikan melalui distilasi. Bromin digunakan dalam industri untuk membuat senyawa metil bromida, CH3Br (sebagai pestisida), perak bromida (untuk film fotografi), dan alkali bromida (untuk sedatif).
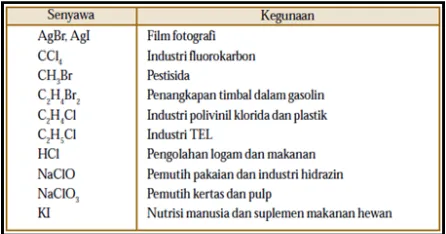
Gas I2 diproduksi dari air laut melalui oksidasi ion iodida dengan oksidator gas Cl2. Iodin juga dapat diproduksi dari natrium iodat (suatu pengotor dalam garam , NaNO3) melalui reduksi ion iodat oleh NaHSO3. Iodin digunakan untuk membuat senyawa AgI sebagai film fotografi dan KI sebagai nutrisi dan makanan ternak. Beberapa kegunaan senyawa halogen dijabarkan pada tabel disamping.
Senyawa halogen yang penting adalah asam hidrogen halida (HX), asam okso-halida (HXOn), dan garamnya (MX). Setiap unsur halogen dapat membentuk senyawa biner dengan hidrogen: HF, HCl, HBr, dan HI. Semuanya merupakan gas tak berwarna dengan bau sangat tajam.
Titik didih asam halida meningkat dari atas ke bawah dalam sistem periodik (HCl = – 85°C; HBr = –67°C; HI = –35°C), kecuali HF memiliki titik didih paling tinggi, yaitu 20°C. Penyimpangan ini sebagai akibat adanya ikatan hidrogen antarmolekul HF yang sangat kuat dibandingkan asam-asam halida yang lain.
Kekuatan asam halida di dalam pelarut air meningkat dari atas ke bawah dalam tabel periodik. Hal ini disebabkan oleh jari-jari atom halogen yang makin besar sehingga kemampuan menarik atom H makin lemah, akibatnya atom H mudah lepas.Asam-asam halida di dalam air terionisasi sempurna, kecuali asam fluorida tergolong asam lemah dengan derajat ionisasi 2,9%. Asam-asam halida dapat disintesis langsung dari unsur-unsurnya. Gas F2 dan H2 bereaksi sangat
dahsyat membentuk senyawa HF, tetapi reaksinya tidak memiliki nilai komersial, sebab gas F2 sendiri dibuat dari penguraian HF. H2(g) + F2(g) →2HF(g)
Senyawa HCl dibuat melalui reaksi gas Cl2 dan H2 berlebih. H2(g) + Cl2(g) →2HCl(g)
HBr dan HI dibuat dengan cara serupa, tetapi menggunakan katalis platina sebab reaksi tanpa katalis sangat lambat.Umumnya, asam-asam halida disintesis melalui pemanasan garam halida dengan asam yang tidak mudah menguap.
NaHSO4(l) →Na2SO4(s) + HCl(g). HBr dan HI, tidak dapat dibuat dengan H2SO4, sebab dapat mengoksidasi Br– dan I– menjadi unsur-unsurnya. Dalam hal ini digunakan asam fosfat.
Reaksinya: NaBr(s) + H3PO4(l) →HBr(g) + NaH2PO4(s)
Kegunaan utama HF adalah sebagai bahan baku pembuatan CCl3F, freon, dan teflon. Senyawa CCl3F digunakan sebagai pendingin dan bahan bakar aerosol, yang disintesis dari CCl4 dan HF dengan antimon pentafluorida sebagai katalis. Reaksinya: CCl4(l) + HF(g) →CCl3F(aq) + HCl(g). Kegunaan utama HF yang lain adalah sebagai cairan elektrolit dalam pengolahan mineral aluminium dan untuk melukis/mengetsa gelas. Dalam mengeetsa gelas, HF bereaksi dengan silika (SiO2), kemudian bereaksi dengan gelas. Reaksinya:
Senyawa HCl adalah asam keempat yang penting bagi industri asam setelah asam sulfat, fosfat, dan nitrat. Asam ini digunakan untuk membersihkan permukaan logam dari oksida (disebut pickling) dan untuk mengekstrak bijih logam tertentu, seperti tungsten.
Dalam elektrolisis larutan NaCl, gas Cl2 yang dihasilkan pada anode dapat bereaksi dengan larutan NaOH yang dihasilkan di katode membentuk natrium hipoklorit. Reaksinya: Cl2(g) + 2NaOH(aq) → NaClO(aq) + NaCl(aq) + H2O(l)
Larutan NaClO digunakan sebagai pemutih pada industri tekstil. Ion hipoklorit tidak stabil, dan terdisproporsionasi membentuk ion klorat, ClO3– dan ion klorida, Cl–. Reaksinya: 3ClO–(aq) → ClO3–(aq) + 2Cl–(aq).
1. UNSUR-UNSUR ALKALI
Unsur-unsur golongan IA disebut juga logam alkali. Unsur-unsur alkali merupakan logam yang sangat reaktif. Kereaktifan unsur alkali disebabkan kemudahan melepaskan elektron valensi pada kulit ns1 membentuk senyawa dengan bilangan oksidasi +1. Oleh sebab itu, unsur-unsur logam alkali tidak ditemukan sebagai logam bebas di alam, melainkan berada dalam bentuk senyawa.
A. Kelimpahan Unsur Logam Alkali di Alam
Sumber utama logam alkali adalah air laut. Air laut merupakan larutan garam-garam alkali dan alkali tanah dengan NaCl sebagai zat terlarut utamanya. Jika air laut diuapkan, garam-garam yang terlarut akan membentuk kristal. Selain air laut, sumber utama logam natrium dan kalium adalah deposit mineral yang ditambang dari dalam tanah, seperti halit (NaCl), silvit
(KCl), dan karnalit (KCl.MgCl.H2O). Mineral-mineral ini banyak ditemukan di berbagai belahan bumi.
dari pantai. Logam alkali lain diperoleh dari mineral aluminosilikat. Litium terdapat dalam bentuk spodumen, LiAl(SiO3)2. Rubidium terdapat dalam mineral lepidolit. Cesium diperoleh dari pollusit yang sangat jarang, CsAl(SiO3)2.H2O. Fransium bersifat radioaktif.
B. Sifat-Sifat Unsur
Logam Alkali
Unsur-unsur alkali semuanya logam yang sangat reaktif dengan sifat-sifat fisika ditunjukkan pada Tabel berikut.
Logam alkali sangat reaktif dalam air. Oleh karena tangan kita mengandung air, logam alkali tidak boleh disentuh langsung oleh tangan.
Semua unsur golongan IA berwarna putih keperakan berupa logam padat, kecuali cesium berwujud cair pada suhu kamar. Natrium merupakan logam lunak dan dapat dipotong dengan pisau. Kalium lebih lunak dari natrium.
Pada tabel disamping tampak bahwa logam litium, natrium, dan kalium mempunyai massa jenis kurang dari 1,0 g cm–3. Akibatnya, logam tersebut terapung dalam air. Akan tetapi, ketiga logam ini sangat reaktif terhadap air dan reaksinya bersifat eksplosif disertai nyala.
Sifat-sifat fisika logam seperti lunak dengan titik leleh rendah menjadi petunjuk bahwa ikatan logam antaratom dalam alkali sangat lemah. Ini akibat jari-jari atom logam alkali relatif besar dibandingkan unsur-unsur lain dalam satu periode. Penurunan titik leleh dari litium ke
cesium disebabkan oleh jari-jari atom yang makin besar sehingga mengurangi kekuatan ikatan antaratom logam. Logam-logam alkali merupakan reduktor paling kuat, seperti ditunjukkan oleh potensial reduksi standar yang negatif pada tabel disamping.
Keelektronegatifan logam alkali pada umumnya rendah (cesium
paling rendah), yang berarti logam tersebut cenderung membentuk kation. Sifat ini juga didukung oleh energi ionisasi pertama yang rendah, sedangkan energi ionisasi kedua sangat tinggi sehingga hanya ion dengan biloks +1 yang dapat dibentuk oleh logam alkali.
Semua logam alkali dapat bereaksi dengan air. Reaksinya melibatkan pergantian hidrogen dari air oleh logam membentuk suatu basa kuat disertai pelepasan gas hidrogen. 2Na(s) +
2H2O(l) → 2NaOH(aq) + H2(g)
Kereaktifan logam alkali terhadap air menjadi sangat kuat dari atas ke bawah dalam tabel periodik. Sepotong logam litium jika dimasukkan ke dalam air akan bergerak di sekitar
membentuk oksida. Litium membentuk Li2O, natrium membentuk Na2O, tetapi produk yang dominan adalah natrium peroksida (Na2O2).
Jika kalium dibakar dengan oksigen, produk dominan adalah kalium superoksida (KO2), suatu senyawa berwarna kuning-jingga. Oksida ini merupakan senyawa ion dari ion K+ dan ion O2–. Logam alkali bereaksi dengan halogen membentuk garam halida. Pada suhu tinggi, logam alkali bereaksi dengan hidrogen membentuk senyawa hidrida, seperti LiH dan NaH. Di udara terbuka, litium dapat bereaksi dengan gas nitrogen, sedangkan logam lainnya tidak dapat bereaksi.
Jika logam alkali atau senyawanya dibakar dalam nyala bunsen, akan tampak warna yang khas untuk setiap logam alkali. Warna-warna tersebut menjadi petunjuk adanya logam alkali di dalam suatu sampel.
2. Unsur-unsur Aluminium
Aluminium ialah unsur kimia. Lambang aluminium ialah Al, dan nomor atomnya 13. Aluminium ialah logam paling berlimpah. Aluminium bukan merupakan jenis logam berat, namun merupakan elemen yang berjumlah sekitar 8% dari permukaan bumi dan paling berlimpah ketiga. Aluminium terdapat dalam penggunaan aditif makanan, antasida, buffered aspirin, astringents, semprotan hidung, antiperspirant, air minum, knalpotmobil, asap tembakau, penggunaan aluminium foil, peralatan masak, kaleng, keramik , dan kembang api.
Aluminium merupakan konduktor listrik yang baik. Terang dan kuat. Merupakan konduktor yang baik juga buat panas. Dapat ditempa menjadi lembaran, ditarik menjadi kawat dan
diekstrusi menjadi batangan dengan bermacam-macam penampang. Tahan korosi.
Aluminium digunakan dalam banyak hal. Kebanyakan darinya digunakan dalam kabel bertegangan tinggi. Juga secara luas digunakan dalam bingkai jendela dan badan pesawat terbang. Ditemukan di rumah sebagai panci, botol minuman ringan, tutup botol susu dsb. Aluminium juga digunakan untuk melapisi lampu mobil dan compact disks.
Aluminium juga bersifat amfoter. Ini dapat ditunjukkan pada reaksi sebagai berikut: a. Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O
Aluminium merupakan unsur yang sangat reaktif sehingga mudah teroksidasi. Karena sifat kereaktifannya maka Aluminium tidak ditemukan di alam dalam bentuk unsur melainkan dalam bentuk senyawa baik dalam bentuk oksida Alumina maupun Silikon.
Sifat-sifat Aluminium yang lebih unggul bila dibandingkan dengan logam lain adalah sebagai berikut:
1. Ringan
Massa jenis Aluminium pada suhu kamar (29oC) sekitar 2,7 gr/cm3. 2. Kuat
Aluminium memiliki daya renggang 8 kg/mm3, tetapi daya ini dapat berubah menjadi lebih kuat dua kali lipat apabila Aluminium tersebut dikenakan proses pencairan atau roling. Aluminium juga menjadi lebih kuat dengan ditambahkan unsur-unsur lain seperti Mg, Zn, Mn, Si.
3. Ketahanan Terhadap Korosi
Aluminium mengalami korosi dengan membentuk lapisan oksida yang tipis dimana sangat keras dan pada lapisan ini dapat mencegah karat pada Aluminium yang berada di bawahnya. Dengan demikian logam Aluminium adalah logam yang mempunyai daya tahan korosi yang lebih baik dibandingkan dengan besi dan baja lainnya.
4. Daya Hantar Listrik Yang Baik
Aluminium adalah logam yang paling ekonomis sebagai penghantar listrik karena massa jenisnya dari massa jenis tembaga, dimana kapasitas arus dari Aluminium kira-kira dua kali lipat dari kapasitas arus pada tembaga.
3.
Unsur-unsur Besi
Besi adalah logam yang berasal dari bijih besi (tambang) yang banyak digunakan untuk kehidupan manusia sehari-hari. Dalam tabel periodik, besi mempunyai simbol Fe dan nomor atom 26. Besi juga mempunyai nilai ekonomis yang tinggi.
Besi adalah logam yang paling banyak dan paling beragam penggunaannya. Hal itu karena beberapa hal, diantaranya:
Kelimpahan besi di kulit bumi cukup besar
Pengolahannya relatif mudah dan murah, dan
Besi mempunyai sifat-sifat yang menguntungkan dan mudah dimodifikasi.
Korosi besi memerlukan oksigen dan air. Berbagai jenis logam contohnya Zink dan Magnesium dapat melindungi besi dari korosi. Cara-cara pencegahan korosi besi yang akan dibahas berikut ini didasarkan pada dua sifat tersebut.
1. Pengecatan. Jembatan, pagar, dan railing biasanya dicat. Cat menghindarkan kontak dengan udara dan air. Cat yang mengandung timbel dan zink (seng) akan lebih baik, karena keduanya melindungi besi terhadap korosi.
2. Pelumuran dengan Oli atau Gemuk. Cara ini diterapkan untuk berbagai perkakas dan mesin. Oli dan gemuk mencegah kontak dengan air.
3. Pembalutan dengan Plastik. Berbagai macam barang, misalnya rak piring dan
keranjang sepeda dibalut dengan plastik. Plastik mencegah kontak dengan udara dan air.
4. Tin Plating (pelapisan dengan timah). Kaleng-kaleng kemasan terbuat dari besi yang dilapisi dengan timah. Pelapisan dilakukan secara elektrolisis, yang disebut tin plating. Timah tergolong logam yang tahan karat. Akan tetapi, lapisan timah hanya melindungi besi selama lapisan itu utuh (tanpa cacat). Apabila lapisan timah ada yang rusak,
misalnya tergores, maka timah justru mendorong/mempercepat korosi besi. Hal itu terjadi karena potensial reduksi besi lebih negatif daripada timah. Oleh karena itu, besi yang dilapisi dengan timah akan membentuk suatu sel elektrokimia dengan besi sebagai anode. Dengan demikian, timah mendorong korosi besi. Akan tetapi hal ini justru yang
diharapkan, sehingga kaleng-kaleng bekas cepat hancur.
5. Galvanisasi (pelapisan dengan Zink). Pipa besi, tiang telepon dan berbagai barang lain dilapisi dengan zink. Berbeda dengan timah, zink dapat melindungi besi dari korosi sekalipun lapisannya tidak utuh. Hal ini terjadi karena suatu mekanisme yang disebut
perlindungan katode. Oleh karena potensial reduksi besi lebih positif daripada zink, maka besi yang kontak dengan zink akan membentuk sel elektrokimia dengan besi sebagai katode. Dengan demikian besi terlindungi dan zink yang mengalami oksidasi (berkarat). Badan mobil-mobil baru pada umumnya telah digalvanisasi, sehingga tahan karat.
6. Cromium Plating (pelapisan dengan kromium). Besi atau baja juga dapat dilapisi dengan kromium untuk memberi lapisan pelindung yang mengkilap, misalnya untuk bumper mobil. Cromium plating juga dilakukan dengan elektrolisis. Sama seperti zink, kromium dapat memberi perlindungan sekalipun lapisan kromium itu ada yang rusak.
7. Sacrificial Protection (pengorbanan anode). Magnesium adalah logam yang jauh lebih aktif (berarti lebih mudah berkarat) daripada besi. Jika logam magnesium dikontakkan dengan besi, maka magnesium itu akan berkarat tetapi besi tidak. Cara ini digunakan untuk melindungi pipa baja yang ditanam dalam tanah atau badan kapal laut. Secara periodik, batang magnesium harus diganti.
teknik/proses pembuatan serta. Komposisi kimia unsur-unsur pemadu dalam besi kasar ini terdiri dari 3-4 %C. Dibuat dari kayu, cetakan yang komposisi kimia suatu paduan, tetapi juga
tergantung pada struktur. Satu- satunya cara pembuatan yang dapat dikerjakan adalah dengan silikon merupakan unsur yang sangat penting dalam pembuatan besi tuang. la menaikan fluiditas. Ada sekitar 20 unsur non logam yang biasanya dengan cara pengendapan ion logam, pembuatan senyawa yang mengandung lamelar dengan besi berkoordinasi secara tetrahedral dengan enam ligan khlorin.
Secara bergantian lokasi ion ditempati oleh ion lurus NO2 bersifat oksidator kuat dan digunakan dalam pembuatan bahan-bahan kimia, dan PbO2 terbentuk.
Alam dan kehidupan kita pun semua tertulis dengan lambang-lambang kimia membuat daftar periodik tempat unsur-unsur yang bersifat mirip masuk. Hemoglobin mengandung besi, berfungsi membawa oksigen. Nama Geologi : Vickers, Annealing, fase, Baja chrom.
4. Unsur-unsur Silikon
Silikon (Latin: silicium) merupakan unsur kimia yang mempunyai simbol Si dan nomor atom 14. Ia merupakan unsur kedua paling berlimpah setelah oksigen di dalam kerak Bumi, mencapai hampir 25.7% . Unsur kimia ini ditemukan oleh Jons Jakob Berzelius. Terdapat dialam dalam bentuk tanah liat, granit, kuartza dan pasir, kebanyakan dalam bentuk silikon dioksida (dikenal sebagai silika) dan dalam bentuk silikat.
tak rusak akibat bahan kimia dan proses oksidasi, tahan dalam suhu tinggi, serta tidak dapat menghantarkan listrik.
Silikon murni berwujud padat seperti logam dengan titik lebur 14100C. silikon dikulit bumi terdapat dalam berbagai bentuk silikat, yaitu senyawa silikon dengan oksigen. Unsur ini dapat dibuat dari silikon dioksida (SiO2) yang terdapat dalam pasir, melalui reaksi:
SiO2(s) + 2C(s) → Si(s) + 2CO(g)
Silikon murni berstruktur seperti Intan ( tetrahedral) sehingga sangat keras dan tidak menghantarkan listrik, jika dicampur dengan sedikit unsur lain, seperti alumunium (Al) atau boron (B). silikon bersifat semikonduktor (sedikit menghantarkan listrik), yang diperlukan dalam berbagai peralatan, elektronik, seperti kalkulator dan Komputer. Itulah sebabnya silikon
merupakan zat yang sangat penting dalam dunia modern. Untuk itu dibutuhkan silikon yang kemurniannya sangat tinggi dan dapat dihasilkan dengan reaksi:
SiCl4(g) + 2H2(g) → Si(s) + 4HCl(g)
Jari-jari silikon lebih besar dari karbon, sehingga tidak dapat membentuk ikatan π (rangkap dua atau tiga) sesamanya, hanya ikatan tunggal (σ). Karena itu silikon tidak reaktif pada suhu kamar dan tidak bereaksi dengan asam, tetapi dapat bereaksi dengan basa kuat seperti NaOH.
Si(s) + 4OH-(aq) → SiO4(aq) + 2H2(g)
Pada suhu tinggi, silikon dapat bereaksi dengan hidrogen membentuk hidrida, dan dengan halogen membentuk halide, seperti:
Si(s) + 2H2 → SiH4
Si(s) + 2Cl2 → SiCl4
terdiri dari atom-atom yang terikat erat. Sebuah contoh dari zat padat demikian, adalah silikon dioksida, yang terdapat dialam dalam bentuk kuarsa, aqata (akik), pasir, dan seterusnya.
ikatan silikon dioksida
a. Reaksi dengan Halogen
Silikon bereaksi dengan halogen secara umum, bahkan sampai terbakar dalam gas flour (menggunakan suatu atom halogen).
Si + 2X2 → SiX4
b. Asam-oksi yang umum
Bila dipanaskan dalam udara, unsur ini bereaksi dengan oksigen dalam reaksi
pembakaran yang sangat eksotermik untuk membentuk oksida SiO2, pada hakikatnya tidak reaktif dengan air pada suhu-suhu biasa. Namun, dua asam silikat sederhana adalah asam ortosilikat, H4SiO4, dan asam metasilikat, H2SiO3. Kedua senyawa ini praktis dan larut dalam air, tetapi mereka memang bereaksi dengan basa.
H4SiO4(s) + 4 NaOH(aq) → Na4SiO4(aq) + H2O(aq)
(nartium ortosilikat)
Bila kering seBagian (parsial) asam silikat disebut gel silika (suatu asam yang agak mirip dengan garam buatan, NaCl). Dalam bentuk ini ia mempunyai kapasitas menyerap yang besar terhadap uap air, belerang dioksida, asam sitrat, benzena dan zat-zat lain, ia digunakan secara luas sebagai bahan untuk menghilangkan kelembaban dalam wadah-wadah kecil yang tertutup.
Garam-garam asam oksi dari kedua asam silikat tadi meliputi;
Na2SiO3 natrium metasilikat
Na4SiO4 natrium ortosilikat
Mg2SiO4 magnesium ortosilikat
LiAl(SiO3)2 litium alumunium metasilikat
Semua silikat ini kecuali silikat dari Na+, K+, Rb+, Cs+, dan NH4+, praktis tidak larut dalam air.
Semua silikat yang larut, membentuk larutan yang berasifat basa bila dilarutkan dalam air. Ion SiO32-, bertindak sebagai basa dengan menghilangkan proton dari air.
SiO32-(aq) + H2O(aq) → HSiO3-(aq) + OH -(aq)
Suatu sifat kimia yang penting dari silikon adalah kecenderungan yang membentuk molekul yang signifikan besar. Silikon cenderung membentuk ikatan tunggal (masing-masing membentuk 4 dan 3 ikatan tunggal). Silikon membentuk molekul-molekul dan ion-ion raksasa, atom oksigen membentuk kedudukan yang berselang-seling.
B. Karakteristik silikon
seperti intan, silikon bersifat semi konduktor. Dalam siloka SiO2, setiap atom Si terikat pada empat atom O dan tiap atom O terikat pada dua atom Si. Susunan struktur tersebut membentuk jaringan yang sangat besar, yaitu struktur kristal kovalen raksasa (seperti intan). Kuarsa
mempunyai titik leleh tinggi dan bersifat insulator. Kuarsa merupakan bentuk umum untuk silika namun, sesungguhnya bentuk-bentuk silika lain banyak, sehingga umumnya disebut mineral silika. Sebagian besar silika tidak larut dalam air. Hanya silikat dari logam alkali yang dapat diperoleh sebagai senyawa yang larut dalam air. Sifat umum dari mineral silikat adalah
kekomplekan anion silikatnya, namun struktur dasarnya merupakan tetrahedral sederhana dari empat atom O disekitar atom pusat Si, tetrahedral ini dapat berupa:
· Unit terpisah
· Bergabung menjadi rantai atau cincin dari 2,3,4 atau 6 gugus
· Bergabung membentuk rantai tunggal yang panjang atau rantai ganda
· Tersusun dalam lembaran
· Terikat menjadi kerangka tiga dimensi
SiO44-(aq) + 4H+(aq) → Si(OH)4(aq)
C. Reaktifitas silikon dan senyawanya
reaksi pembakaran yang sangat eksotermik untuk membentuk oksida B2O3, CO2 dan SiO2,Ketiga oksida ini bersifat asam.
SiO2 pada hakikatnya tidak reaktif dengan air pada suhu-suhu biasa. Namun dua asam silikat sederhana adalah asam ortosilikat, H4SiO4 dan asam metasilikat, H2SiO3- Kedua senyawa ini praktis tak larut dalam air, tetapi mereka bereaksi dengan basa, contohnya
H4SiO4(s) + 4NaOH(aq) → Na4SiO4(aq) + 4H2O(aq)
Bila kering sebagian (parsial), asam silikat disebut gel silika (suatu bahan yang agak mirip dengan garam batuan, NaCl). Dalam bentuk ini, ia mempunyai kapasitas menyerap yang besar terhadap uap air, belerang dioksida, asam nitrat, benzena dan zat-zat lain. Ia digunakan secara luas sebagai bahan untuk menghilangkan kelembaban dalam wadah-wadah kecil.
D. Kegunaan silikon dan senyawa silikon 1. Penggunaan penting silikon
Penggunaan penting dari silikon adalah dalam pembuatan transistor, chips, komputer dan sel surya. Untuk tujuan itu diperlukan silikon ultra murni. Silikon juga digunakan dalam berbagai jenis alise dengan besi (baja). Sedangkan senyawa silikon digunakan dalam industri. Silica dan silikat digunakan untuk membuat gelas, keramik, porselin dan semen.
Larutan pekat natrium silikat (Na2SiO3), suatu zat padat amorf yang tidak berwarna, yang disebut water glass, digunakan untuk pengawetan telur dan sebagai perekat, juga sebagai bahan pengisi (fillir) dalam detergent.
Silikon karbida (SiC), merupakan zat padat yang sangat keras digunakan untuk ampelas (abrasive) dan pelindung untuk pesawat ulang alik terhadap suhu yang tinggi
sewaktu kembali kebumi. Silica gel, suatu zat padat amorf yang sangat berfori, dibuat dengan melepas sebagian air dari asam silikat (H2SiO3) atau (SiO2H2O). silica gel bersifat
Bahan-bahan yang mengandung silikon yang dikenal baik :
a. Keramik. b. Semen c. Kaca d. Silikon e. Zeolit
5. Unsur-unsur Krom
Kromium adalah sebuah unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Kromium trivalen (Cr(III), atau Cr3+) diperlukan dalam jumlah kecil dalam metabolisme gula pada manusia. Kekurangan kromium trivalen dapat menyebabkan penyakit yang disebut penyakit kekurangan kromium (chromium deficiency).
pelapis perhiasan seperti emas, emas yang dilapisi oleh kromium ini lebih dikenal dengan sebutan emas putih. Perpaduan Kromium dengan besi dan nikel menghasilkan baja tahan karat.
a. Sifat – sifat kromium
Merupakan logam pasif berwarna putih perak dan lembek jika dalam keadaan murninya. Tahan terhadap korosi karena reaksi dengan udara menghasilkan Cr2O3 yang bersifat
nonpori
Warna oksidanya berbeda – beda tergantung jenis dan jumlah atom yang diikatnya.
Titik leleh : 1900 C Titik didih : 2690 C
Mempunyai tingkat oksidasi +3, +2, +6
CrO2 bersifat konduktor dan magnetic Tahan terhadap panas
b. Kegunaan kromium 1. Pelapis baja atau logam
2. Sebagai fungsi dekoratif
3. Merupakan bahan paduan yang menjadikan baja bersifat keras dan kuat
4. Cr(OH)SO4 bereaksi dengan kolagen menjadikan kulit bersifat liat, lentur dan tahan terhadap kerusakan biologis
5. Bahan paduan steinless steel ( yang biasa berisi kromium dan sedikit nikel ) digunakan pada industry alat – alat dapur
6. Logam paduan tanpa besi ( Ni dan Cr ), digunakan untuk berbagai peralatan tahan panas karena bersifat bukan konduktor
7. CrO3 yang berwarna coklat gelap, bersifat konduktor listrik yang tinggi dan bersifat magnetic, digunakan pada pita rekaman
8. CrO3,PbCr4, digunakan sebagai pewarna cat dan gelas 9. Na2CrO7 sebagai oksidan dalam industry kimia Sumber dan Ekstraksi
Sumber kromium diantaranya dari biji kromit ( FeCrO4 ), krokoit ( PbCrO4 ), dan oker kroma ( Cr2O3 )
Berdasarkan penggunaannya, ekstraksi kromium dibagi menjadi 2 yaitu : 1. Sebagai paduan ferokrom
Tembaga atau cuprum dalam tabel periodik yang memiliki lambang Cu dan nomor atom 29. Tembaga di alam tidak begitu melimpah dan ditemukan dalam bentuk bebas maupun dalam bentuk senyawaan. Bijih tembaga yang terpenting yaitu pirit atau chalcopyrite (CuFeS2), copper glance atau chalcolite (Cu2S), cuprite (Cu2O), malaconite (CuO) dan malachite (Cu2(OH)2CO3) sedangkan dalam unsur bebas ditemukan di Northern Michigan Amerika Serikat.
a. Sifat Kimia Tembaga
1) Tembaga merupakan unsur yang relatif tidak reaktif sehingga tahan terhadap korosi. Pada udara yang lembab permukaan tembaga ditutupi oleh suatu lapisan yang berwarna hijau yang menarik dari tembaga karbonat basa, Cu(OH)2CO3.
2) Pada kondisi yang istimewa yakni pada suhu sekitar 300 °C tembaga dapat bereaksi dengan oksigen membentuk CuO yang berwarna hitam. Sedangkan pada suhu yang lebih tinggi, sekitar 1000 ºC, akan terbentuk tembaga(I) oksida (Cu2O) yang berwarna merah. 3) Tembaga tidak diserang oleh air atau uap air dan asam-asam nooksidator encer seperti HCl encer dan H2SO4 encer. Tetapi asam klorida pekat dan mendidih menyerang logam tembaga dan membebaskan gas hidrogen. Hal ini disebabkan oleh terbentuknya ion kompleks CuCl2¯(aq) yang mendorong reaksi kesetimbangan bergeser ke arah produk.
b. 2Cu (s) + 2H+ (aq) a Cu+ (aq) + H2 c. 2Cu+ (aq) + 4Cl- (aq) 2 CuCl2- (aq)
d.
Asam sulfat pekatpun dapat menyerang tembaga, seperti reaksi berikut e. Cu (s) + H2SO4 (l) CuSO4 (aq) + 2H2O (l) + SO2 (g) 4) Asam nitrat encer dan pekat dapat menyerang tembaga, sesuai reaksi
f. Cu (s) + HNO3 (encer) 3Cu(NO3)2 (aq) + 4H2O (l) + 2NO (g) g. Cu (s) +4HNO3 (pekat) Cu(NO3)2 (aq) + 2H2O (l) + 2NO2 (g)
5) Tembaga tidak bereaksi dengan alkali, tetapi larut dalam amonia oleh adanya udara membentuk larutan yang berwarna biru dari kompleks Cu(NH3)4+.
b. Cara Pembuatan
Bijih tembaga yang terpenting adalah kalkopirit(CuFeS2). Sebenarnya tembaga mudah direduksi. Akan tetapi, adanya besi dalam bijih tembaga membuat proses pengolahan tembaga menjadi relatif sulit. Pengolahan tembaga melalui beberapa tahap, yaitu flotasi, pemanggangan, peleburan, pengubahan, dan elektrolisis.
Pada umumnya, bijih tembaga hanya mengandung 0,5% Cu. Melalui pengapungan dapat diperoleh bijih pekat yang mengandung 20-40% Cu. Bijih pekat itu kemudian dipanggang untuk mengubah besi sulfide menjadi besi oksida, sedangkan tembaga tetap berupa sulfida.
4CuFeS2 + 9O2 → 2Cu2S + 2Fe2O3 + 6SO2
Bijih yang sudah melalui pemanggangan kemudian dilebur sehingga bahan tersebut mencair dan terpisah menjadi dua lapisan. Lapisan bawah disebut “copper matte” yang
mengandung Cu2S dan besi cair, sedangkan lapisan atas merupakan terak silikat yang antara lain mengandung FeSiO3. Selanjutnya, “copper matte”dipindahkan ke dalam tungku lain dan
ditiupkan udara sehingga terjadi reaksi redoks yang menghasilkan tembaga lepuh (blister copper).
2Cu2S + 3O2 → 2Cu2O + 2SO2 Cu2S + Cu2O → 2Cu + SO2
Tembaga lepuh adalah tembaga yang mengandung gelembung gas SO2 beku. Tembaga lepuh mengandung 98-99% Cu dengan berbagai jenis pengotor seperti besi, zink, perak, emas, dan platina.
Pemurnian tembaga dilakukan dengan elektrolisis. Tembaga lepuh digunakan sebagai anode, sedangkan tembaga murni digunakan sebagai katodenya. Elektrolit yang digunakan adalah larutan CuSO4. Selama elektrolisis, Cu dipindahkan dari anode ke katode. Dengan menggunakan potensial tertentu, bahan pengotor dapat terpisah.
c. Manfaat
7. Unsur-unsur Belerang
Belerang atau sulfur adalah unsur kimia dalam tabel periodik yang memiliki
lambang S dan nomor atom 16. Belerang merupakan unsur non-logam yang tidak
berasa. Belerang, dalam bentuk aslinya, adalah sebuah zat padat kristalin kuning. Di alam, belerang dapat ditemukan sebagai unsur murni atau sebagai mineral-mineral
sulfida dan sulfat. Belerang adalah unsur penting untuk kehidupan dan ditemukan
dalam 2 asam amino. Salah satu contoh penggunaan umum belerang adalah dalam
pupuk. Selain itu, belerang juga digunakan dalam bubuk mesiu, korek api, insektisida, dan fungisida.
a.
Sifat Belerang :
Belerang (sulfur) adalah unsur non-logam multivalen, berlimpah, tidak berasa dan tidak berbau.
Dalam bentuk alami, belerang berbentuk kristal padat berwarna kuning.
Meskipun belerang terkenal karena baunya yang mirip telur busuk, bau ini sebenarnya berasal dari gas hidrogen sulfida (H2S), bukan dari belerang murni. Belerang memiliki kristalografi kompleks. Tergantung pada kondisinya, alotrop
belerang membentuk beberapa struktur kristal yang berbeda.
Kehidupan di bumi mungkin terjadi karena kehadiran belerang yang berkontribusi pada pembentukan berbagai asam amino yang merupakan pembangun dasar kehidupan.
b.
Kegunaan Belerang :
Turunan utama belerang adalah asam sulfat (H2SO4), yang merupakan salah satu elemen penting dalam berbagai industri.
Belerang juga digunakan dalam baterai, deterjen, fungisida, pupuk, bubuk mesiu, korek api, dan kembang api.
8. Unsur-unsur Oksigen
Oksigen atau zat asam adalah unsur kimia dalam sistem tabel periodik yang
mempunyai lambang O dan nomor atom 8. Ia merupakan unsur golongan kalkogen dan
dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi
oksida). Pada Temperatur dan tekanan standar, dua atom unsur ini berikatan menjadi
dioksigen, yaitu senyawa gas diatomik dengan rumus O2 yang tidak berwarna, tidak
berasa, dan tidak berbau. Oksigen merupakan unsur paling melimpah ketiga di alam
semesta berdasarkan massa[1] dan unsur paling melimpah di kerak Bumi.[2] Gas oksigen
diatomik mengisi 20,9% volume atmosfer bumi..[3]
Semua kelompok molekul struktural yang terdapat pada organisme hidup, seperti
protein, karbohidrat, dan lemak, mengandung oksigen. Demikian pula senyawa anorganik
yang terdapat pada cangkang, gigi, dan tulang hewan. Oksigen dalam bentuk O2
dihasilkan dari air oleh sianobakteri, ganggang, dan tumbuhan selama fotosintesis, dan
digunakan pada respirasi sel oleh hampir semua makhluk hidup. Oksigen beracun bagi
organisme anaerob, yang merupakan bentuk kehidupan paling dominan pada masa-masa
awal evolusi kehidupan. O2 kemudian mulai berakumulasi pada atomsfer sekitar
2,5 miliar tahun yang lalu.[4] Terdapat pula alotrop oksigen lainnya, yaitu ozon (O 3). Lapisan ozon pada atomsfer membantu melindungi biosfer dari radiasi ultraviolet, namun
pada permukaan bumi ia adalah polutan yang merupakan produk samping dari asbut.
a. Sifat Oksigen :
Oksigen mendidih pada 90,20 K (−182,95 °C, −297,31 °F), dan membeku pada 54.36 K (−218,79 °C, −361,82 °F). Baik oksigen cair dan oksigen padat berwarna biru langit. Hal ini dikarenakan oleh penyerapan panjang gelombang warna merah. Oksigen cair dengan kadar kemurnian yang tinggi biasanya didapatkan dengan distilasi bertingkat udara cair. Oksigen cair juga dapat dihasilkan dari pengembunan udara, menggunakan nitrogen cair dengan pendingin. Oksigen merupakan zat yang sangat reaktif dan harus dipisahkan dari bahan-bahan yang mudah terbakar. Pada suhu dan tekanan biasa, oksigen didapati sebagai dua atom oksigen dengan formula kimia O2.
Oksigen merupakan gas yang dibebaskan oleh tumbuhan ketika proses fotosintesis, dan diperlukan oleh hewan untuk pernafasan. Perkataan oksigen terdiri daripada dua perkataan Greek, oxus (asid) dan gennan (menghasilkan). Oksigen cair dan pepejal mempunyai warna biru lembut dan mempunyai sifat paramagnet (mudah menjadi magnet). Oksigen cair biasanya dihasilkan dengan proses perbedaan suhu dari udara cair (disejukkan sehingga menjadi cair). Berikut ini perbandingan sifat fisik oksigen dengan unsur-unsur segolongannya, yaitu Sulfur, Selenium, Tellurium dan Polonium.
c. Kegunaan Oksigen :
1. pengolahan besi menjadi baja di tanur terbuka (tanur oksigen).
Besi bekas sebanyak ± 30% dimasukkan ke dalam bejana yang dilapisi batu tahan api basa. Logam panas dituangkan kedalam bejana tersebut. Suatu pipa aliran oksigen yang didinginkan dengan air dimasukkan kedalam bejana 1 sampai 3 m diatas permukaan logam cair. Unsur-unsur karbon, mangan dan silicon akan teroksidasi. Batu kapur dan kalsium fluor ditambahkan untuk mengikat kotoran-kotoran seperti fosfor dan belerang dan membentuk terak. Jenis Baja yang dihasilkan oleh proses ini adalah Baja karbon & Baja paduan 0,1 % < c < 2,0 %.
2. Pembakaran logam
Reaksi pembakaran logam besi 4 Fe + 3 O2 → 2 Fe2O3
CH16 + 11 O2 → 7 CO2 + 8 H2O
Reaksi diatas juga mengindikasikan adanya gas oksigen. Reaksi pembakaran sering juga disebut dengan reaksi oksidasi.
9.
Unsur-Unsur Gas Mulia
Gas mulia adalah unsur-unsur golongan VIIIA (18) dalam tabel periodik. Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi). Tidak ditemukan satupun senyawa
alami dari gas mulia. Menurut Lewis, kestabilan gas mulia tersebut disebabkan konfigurasi
elektronnya yang terisi penuh, yaitu konfigurasi oktet (duplet untuk Helium). Kestabilan gas
mulia dicerminkan oleh energi ionisasinya yang sangat besar, dan afinitas elektronnya yang
sangat rendah (bertanda positif). Para ahli zaman dahulu yakin bahwa unsur-unsur gas mulia
benar-benar inert. Pendapat ini dipatahkan, setelah pada tahun 1962, Neil Bartlett, seorang ahli
kimia dari Kanada berhasil membuat senyawa xenon, yaitu XePtF6. Sejak itu, berbagai senyawa
gas mulia berhasil dibuat.
Gas mulia adalah gas yang mempunyai sifat lengai, tidak reaktif, dan susah bereaksi dengan
bahan kimia lain. Gas mulia banyak digunakan dalam sektor perindustrian. Berikut adalah gas-gas mulia:
1. Kereaktifan Gas Mulia Sangat Rendah
Telah dsebutkan bahwa gas mulia bersifat inert (lembam). Tidak ditemukan satupun senyawa alami dari gas mulia. Gas-gas mulia terdapat sebagai molekul monoatomik (atom-atomnya berdiri sendiri). Untuk jangka waktu yang cukup lama, usaha-usaha untuk mensintesis senyawa gas mulia tidak membawa hasil. Oleh karena itu para ahli yakin bahwa gas mulia benar-benar inert. Menurut para ahli,
energy pengionan yang besar menunjukkan sukarnya unsur-unsur itu untuk melepas electron, sedangkan harga afinitas electron yang rendah menunjukkan kecilnya kecenderungan untuk menyerap electron. Jadi, unsure gas mulia tidak
berkecenderungan untuk melepas maupun menyerap electron. Oleh karena itu unsur-unsur gas mulia tidak mudah terlibat dalam reaksi kimia.
2. Makin Besar Jari-jari Atom Makin Reaktif
Dunia kimia seperti terguncang ketika pada tahun 1962, Neil Bartlett, seorang ahli kimia dari Kanada, berhasil membuat suatu senyawa stabil dari xenon, yaitu XePtF6. Penemuan itu telah mendobrak kegaiban gas mulia. Tidak lama emudian, ahli riset lainnya dapat membuat berbagai senyawa dari xenon, radon dan krypton. Radon ternyata dapat bereaksi spontan dengan fluorin, sedangkan xenon memerlukan pemanasan atau penyinaran untuk memulai reaksi. Krypton lebih sukar, hanya bereaksi dengan fluorin jika disinari atau jika diberi loncatan muatan listrik. Sementara itu helium, neon dan argon ternyata lebih sukar bereaksi dan belum berhasil dibuat suatu senyawa dari ketiga unsure itu.
Fakta diatas menunjukkan bahwa kereaktifan gas mulia bertambah besar sesuai dengan pertambahan jari-jari atomnya, yaitu dari atas kebawah. Pertambahan jari-jari atom mengakibatkan daya tarik inti terhadap electron kulit luar berkurang, sehingga elektronnya makin mudah ditarik oleh atom lain. Walaupun senyawa gas mulia telah berhasil dibuat, namun harus tetap diakuai bahwa unsure gas mulia lebih stabil dari semua golongan lainnya. Unsur gas mulia hanya dapat berikatan dengan unsur yang sangat elektronegatif, seperti fluorin dan oksigen. Setelah senyawa gas mulia berhasil dibuat, istilah gas inert (lembam) tidak sesuai lagi. Para ahli lebih cenderung
menggunakan istilah gas mulia, yang berarti stabil atau sukar bereaksi, serupa dengan istilah lagam mulia yang digunakan untuk emas dan platina.
b. Kegunaan Gas Mulia :
1. Helium
Helium merupakan zat yang ringan dan tidak muadah terbakar, Helium biasa digunakan untuk mengisi balon udara, dan helium yang tidak reaktif digunakan untuk mengganti nitrogen untuk membuat udara buatan yang dipakai dalam penyelaman dasar laut. Helium yang berwujud cair juga dapat digunakan sebagai zat pendingin karena memiliki titik uap yang sangat rendah.
2. Neon
Neon biasanya digunakan untuk mengisi lampu neon. Selain itu juga neon dapat digunakan untuk berbagi macam hal seperti indicator tegangan tinggi, zat pendingin, penangkal petir, dan mengisi tabung televisi.
Argon dapat digunakan dalam las titanium dan stainless steel. Argon juga digunakan dalam las dan sebagai pengisi bola lampu pijar.
4. Kripton
Kripton bersama argon digunakan sebagai pengisi lampu fluoresen bertekanan rendah. Krypton juga digunakan dalam lampu kilat untuk fotografi kecepatan tinggi 5. Xenon