PERTUMBUHAN CENDAWAN ENTOMOPATOGEN
Lecanicillium lecanii PADA BERBAGAI MEDIA SERTA
INFEKTIVITASNYA TERHADAP KUTUDAUN KEDELAI
Aphis glycines Matsumura (HEMIPTERA: APHIDIDAE)
LUTFI AFIFAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
LUTFI AFIFAH. Pertumbuhan Cendawan Entomopatogen Lecanicillium lecanii pada Berbagai Media serta Infektivitasnya terhadap Kutudaun Kedelai Aphis
glycines Matsumura (Hemiptera: Aphididae). Dibimbing oleh TEGUH
SANTOSO.
Kedelai (Glycine max) merupakan tanaman pangan penting sebagai sumber gizi protein nabati utama. Salah satu hama penting yang menyerang kedelai adalah kutudaun Aphis glycines Matsumura (Hemiptera: Aphididae). Mikoinsektisida L. lecanii telah ditunjukkan efektif terhadap beberapa hama kedelai, tetapi belum diteliti pengaruhnya terhadap kutudaun A. glycines. Penelitian ini bertujuan untuk mempelajari infektivitas cendawan entomopatogen
L. lecanii untuk menekan perkembangan hama kutudaun kedelai A. glycines dan
mempelajari produksi konidia cendawan L. lecanii yang ditumbuhkan pada media PDA, jagung, dan beras. Media PDA merupakan media yang paling baik untuk pertumbuhan dan perkembangan cendawan L. lecanii karena menghasilkan kerapatan konidia tertinggi dan daya kecambah yang tinggi jika dibandingkan dengan media jagung dan beras. Cendawan L. lecanii dengan kerapatan konidia 109 ,108, 107, 106, 105 konidia/ml yang disemprotkan pada tubuh serangga mampu menginfeksi kutudaun kedelai A. glycines dan menyebabkan mortalitas pada kutudaun. Perbedaan kerapatan konidia L. lecanii yang digunakan berpengaruh terhadap tingkat mortalitas A. glycines. Semakin banyak atau rapat konidia yang digunakan, maka semakin cepat cendawan tersebut menginfeksi dan mematikan
A. glycines. Selain itu, penyemprotan L. lecanii pada kutudaun kedelai A. glycines
menyebabkan menurunnya jumlah anakan kutudaun yang dihasilkan. Dengan demikian, L. lecanii sebagai agens hayati A. glycines layak untuk dikembangkan lebih lanjut.
Kata kunci: Lecanicillium lecanii, Aphis glycines, mortalitas, daya kecambah, anakan.
iii
PERTUMBUHAN CENDAWAN ENTOMOPATOGEN
Lecanicillium lecanii PADA BERBAGAI MEDIA SERTA
INFEKTIVITASNYA TERHADAP KUTUDAUN KEDELAI
Aphis glycines Matsumura (HEMIPTERA: APHIDIDAE)
LUTFI AFIFAH A34070039
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Pertanian pada Fakultas Pertanian
Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul : Pertumbuhan Cendawan Entomopatogen Lecanicillium
lecanii pada Berbagai Media serta Infektivitasnya terhadap
Kutudaun Kedelai Aphis glycines Matsumura (Hemiptera: Aphididae)
Nama Mahasiswa : Lutfi Afifah
NRP : A34070039
Disetujui, Dosen Pembimbing
Dr. Ir. Teguh Santoso, DEA NIP. 19570907 198003 1 006
Diketahui,
Ketua Departemen Proteksi Tanaman
Prof. Dr. Ir. Dadang, M.Sc NIP. 19640204 199002 1 002
v
RIWAYAT HIDUP
Penulis dilahirkan di Ponorogo pada tanggal 6 Agustus 1989 sebagai anak pertama dari dua bersaudara dari pasangan Drs. H. Ahmad Mujiono dan Susilowati. Tahun 2007 penulis menamatkan pendidikan Sekolah Menengah Atas di SMAN 02 Ponorogo. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Mayor Proteksi Tanaman dan Minor Komunikasi dari Departemen Sains Komunikasi dan Pengembangan Masyarakat, Fakultas Ekologi Manusia, IPB.
Selama kuliah penulis memiliki pengalaman organisasi sebagai pengurus Badan Eksekutif Mahasiswa Fakultas Pertanian (BEM-A) pada tahun 2008, Pengurus Himpunan Profesi Mahasiswa Proteksi Tanaman (HIMASITA) pada tahun 2010, dan pengurus Entomology Club pada tahun 2010. Pengalaman kerja penulis yaitu menjadi Asisten praktikum di beberapa mata kuliah di Departemen Proteksi Tanaman antara lain: Mata kuliah Biologi Patogen Tumbuhan, Ilmu Hama Tumbuhan Dasar, Entomologi Umum, Hama & Penyakit Tanaman Tahunan, dan Klinik Tanaman. Selain itu penulis pernah menjadi Asisten dosen pada mata kuliah Dasar-dasar Komunikasi, Departemen Sains Komunikasi dan Pengembangan Masyarakat, Fakultas Ekologi Manusia selama tiga periode semester pada tahun 2010-2011.
Penulis juga pernah magang di Balai Penelitian Kacang-kacangan dan Umbi-umbian (BALITKABI) Malang, Jawa Timur pada tahun 2009 dan pengalaman magang di Laboratorium Nematologi Departemen Proteksi Tanaman IPB pada tahun 2010. Selain itu, penulis juga berkesempatan mengikuti Program
Syngenta Connection 2 yang merupakan program pendidikan masyarakat
pedesaan yang disupport oleh PT. Syngenta Indonesia dan PT. Syngenta Singapore bersama Mahasiswa Indonesia dan Mahasiswa Australia di Malang, Jawa Timur pada tahun 2011. Berbagai beasiswa yang pernah diterima oleh penulis yaitu Beasiswa Peningkatan Prestasi Akademik dan Beasiswa Yayasan
Goodwill International. Selain itu, penulis pernah lolos dalam Program
Kreativitas Mahasiswa bidang penelitian yang berjudul “Prospek Buah Pinang (Areca catechu L.) sebagai Nematisida Botani pada Tanaman Kedelai (Glycine
max (L) Merril)”. Penulis juga meraih peringkat kedua sebagai Mahasiswa
PRAKATA
Puji dan syukur penulis panjatkan kepada kehadirat Allah SWT yang telah melimpahkan segala rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pertumbuhan Cendawan Entomopatogen
Lecanicillium lecanii pada Berbagai Media serta Infektivitasnya terhadap
Kutudaun Kedelai Aphis glycines Matsumura (Hemiptera: Aphididae)”, sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Banyak pihak yang terlibat dalam penyelesaian penulisan skripsi ini. Ucapan terima kasih penulis kepada:
1. Ayah, ibu, dan Adik Zulfa Permata Suri yang selalu memberi semangat dan dukungannya.
2. Dr. Ir. Teguh Santoso, DEA selaku dosen pembimbing skripsi yang banyak memberi masukan dan saran dalam pembuatan skripsi ini. Dr. Ir. Abdjad Asih Nawangsih, M.Si yang telah menjadi penguji tamu dan Ir. Djoko Prijono, MAgrSc yang telah menjadi moderator dalam seminar tugas akhir penulis. Selain itu penulis juga ucapkan terima kasih kepada Dr. Ir. Abdul Muin Adnan, MS yang selaku pembimbing akademik yang senantiasa memberi semangat dan dukungannya terhadap penulis.
3. Teman-teman seperjuangan di Departemen Proteksi Tanaman khususnya Dolpina Antonia Ratissa SP., Nelly Nailufar SP., Mohamad Eldiary Akbar SP., Ellyta Sariani Tarigan SP., Agus Setiawan SP., Ahmad Faishol SP., Reka Pradana SP., Rita Kurnia Apindiati SP., Irma Utami Siagian SP., Gamatriani Markhamah SP., dan Ida Parida SP. yang telah banyak membantu penelitian penulis dan juga telah memberi persahabatan dan dukungan. Penulis ucapkan terima kasih kepada saudari Tuti Purwaningsih S. Stat dan Retno Kusuma Dewi S. Stat yang telah membantu penulis dalam mengolah data penelitian. Selain itu ucapan terima kasih kepada Fauziah crew yaitu Resa Pratika Sari S.Si dan Turasih S.Kpm yang telah membantu penulis mencari kutudaun di lapangan.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun demi peningkatan yang lebih baik. Semoga skripsi ini bisa bermanfaat dan menjadi acuan untuk penelitian berikutnya. Atas perhatiannya, penulis mengucapkan terima kasih.
Bogor, 14 Oktober 2011
vii
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2 TINJAUAN PUSTAKA ... 3
Permasalahan Hama Kedelai ... 3
Kutudaun Kedelai Aphis glycines ... 3
Cendawan Entomopatogen Lecanicillium lecanii ... 5
Pengendalian Hama Kedelai ... 8
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Bahan ... 10
Serangga Uji Aphis glycines ... 10
Cendawan Lecanicillium lecanii ... 10
Metode ... 11
Penyiapan Suspensi Konidia L. lecanii ... 11
Perlakuan Serangga Uji ... 11
Pembuatan Media PDA, Jagung, dan Beras ... 12
Penghitungan Kerapatan Konidia dan Daya kecambah ... 13
Rancangan Percobaan ... 13
HASIL DAN PEMBAHASAN ... 14
Pengaruh Jenis Media dan Umur Biakan L. lecanii terhadap Kerapatan Konidia ... 14
Pengaruh Jenis Media dan Umur Biakan L. lecanii terhadap Daya Kecambah ... 17
Mortalitas A. glicines oleh L. lecanii ... 20
Pengaruh L. lecanii terhadap Jumlah Anakan yang Dihasilkan ... 25
KESIMPULAN DAN SARAN ... 28
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Halaman 1 Kerapatan konidia L. lecanii umur biakan 21 dan 42 hari setelah
Inkubasi ... 14 2 Pengaruh jenis media dan umur biakan terhadap kerapatan konidia
L. lecanii ... 16 3 Daya kecambah L. lecanii umur biakan 21 dan 42 HSI ... 17 4 Pengaruh jenis media dan umur biakan terhadap daya kecambah
konidia L. lecanii. ... 18 5 Persentase mortalitas A. glycines akibat perlakuan L. lecanii selama
empat hari pengamatan. ... 20 6 Persentase mortalitas A. glycines terhadap L. lecanii pada empat hari
pengamatan ... 22 7 Kumulatif jumlah anakan yang dihasilkan A. glycines selama sebelas
ix
DAFTAR GAMBAR
Halaman 1 Aphis glycines yang sedang menghisap cairan tanaman... 5 2 Koloni Lecanicillium lecanii di media PDA (a) dan konidia L. lecanii
yang diproduksi oleh setiap tangkai konidiofor, perbesaran 400x (b) ... 6 3 Tempat pemeliharaan serangga uji A. glycines ... 10 4 Cawan petri dengan alas kertas tisu yang berisi serangga perlakuan ... 12 5 Koloni L. lecanii yang ditumbuhkan di tiga media berbeda PDA (a),
jagung (b), dan beras (c) pada umur 42 HSI ... 15 6 Tabung kecambah isolat L. lecanii pada 10 jam setelah inkubasi
(JSI) ... 19 7 Mortalitas kumulatif A. glycines yang terinfeksi cendawan L. lecanii
selama empat hari ... 21 8 Hubungan antara kerapatan konidia dengan mortalitas A.glycines
akibat perlakuan cendawan L. lecamii selama empat hari setelah
perlakuan... 23 9 A. glycines bewarna kehitaman mulai menunjukkan gejala terinfeksi (a)
dan A. glycines sudah terkolonisasi oleh cendawan L. lecanii
(warna putih) (b). ... 24 10 Koloni L. lecanii yang tumbuh pada bangkai kutudaun pada perlakuan
selain kontrol. ... 25 11 Nimfa instar satu yang dihasilkan oleh kutudaun dan kutudaun bersayap (alate) ... 27
DAFTAR LAMPIRAN
Halaman 1. Hasil analisis RAL Faktorial (2 Faktor) in time/repeated measurement
terhadap mortalitas A. glycines ... 34 2. Hasil analisis RAL Faktorial (2 Faktor) in time/repeated measurement
terhadap jumlah anak yang dihasilkan A. glycines... 34 3 Hasil RAL Faktorial (2 Faktor) terhadap kerapatan konidia
L. lecanii ... 34
PENDAHULUAN
Latar Belakang
Di Indonesia, selain dikonsumsi sebagai sumber gizi protein nabati utama, kedelai juga dibutuhkan sebagai komponen pakan ternak. Kebutuhan kedelai di dalam negeri terus meningkat seiring pesatnya perkembangan industri pangan dan pakan olahan berbahan baku kedelai. Menurut BPS (2010) produksi kedelai tahun 2010 mencapai 908,11 ribu ton biji kering, angka tersebut menurun 66,40 ribu ton (6,81%) dibanding tahun 2009. Padahal kebutuhan kedelai di Indonesia mencapai 2,1 juta ton.
Salah satu faktor pembatas utama dalam budidaya kedelai adalah gangguan hama dan penyakit atau organisme pengganggu tanaman (OPT) (Tengkano & Soehardjan 1993; Shepard et al. 1997; Baliadi et al. 2008). Kutudaun Aphis glycines Matsumura merupakan salah satu hama yang berkembang dalam koloni besar pada tanaman kedelai. Populasi kutudaun yang tinggi dapat mengurangi produksi kedelai secara langsung melalui beberapa kerusakan seperti kerdil, distorsi daun, dan mengurangi kualitas polong yang dihasilkan (Sun et al. 1990). Selain itu, kutudaun pada tanaman kedelai mampu mentransmisikan potyvirus Soybean mosaic virus (SMV) dan alfamovirus Alfalfa
mosaic virus (AMV) (Wang 2006). Kehilangan hasil oleh SMV yang ditularkan
oleh A. glycines sekitar 94% sedangkan kehilangan hasil akibat AMV sekitar 32-48% (Slack 2011).
Dalam penanggulangan hama tersebut sampai kini petani masih mengandalkan insektisida kimiawi. Padahal penggunaan insektisida kimia secara terus menerus akan menimbulkan resistensi dan resurgensi pada hama (Rauf et al. 1994). Dengan demikian, pengendalian menggunakan insektisida kimia perlu ditekan. Salah satu cara untuk menekan penggunaan insektisida kimia adalah menggunakan bioinsektisida berbahan aktif mikroorganisme. Pemanfaatan bioinsektisida sebagai agens hayati pada pengendalian hama merupakan salah satu komponen pengendalian hama terpadu (PHT).
Akhir-akhir ini mulai dikembangkan bioinsektisida cendawan entomopatogen Lecanicillium lecanii. L. lecanii (=Verticillium lecanii) (Zimm.) (Viegas) Zare & Gams merupakan salah satu jenis agens hayati yang sudah diketahui potensinya untuk mengendalikan berbagai jenis hama (Ahmadi et al. 2004). Menurut Prayogo (2004) L. lecanii diketahui efektif untuk mengendalikan
Riptortus linearis L. (Hemiptera: Alydidae) stadia telur, nimfa, maupun imago.
Keberhasilan pengendalian hama menggunakan cendawan entomopatogen dipengaruhi oleh berbagai faktor yaitu virulensi isolat, kerapatan konidia, kerentanan stadia inang, dan faktor lingkungan (Wenzel et al. 2007). Aplikasi cendawan L. lecanii di pertanaman kedelai berpotensi menyerang hama-hama lain seperti kutudaun A. glycines. Dengan demikian, perlu dilakukan suatu penelitian mengenai potensi penggunaan cendawan L. lecanii terhadap hama-hama lain yang menyerang pertanaman kedelai seperti kutudaun A. glycines.
Untuk keperluan praktis aplikasi di lapangan, umumnya cendawan Hypomycetes entomopatogen termasuk L. lecanii diproduksi secara massal dengan media alternatif seperti beras dan jagung. Penelitian ini juga bertujuan untuk mempelajari produksi konidia cendawan apabila ditumbuhkan pada media tersebut.
Tujuan Penelitian
Mempelajari infektivitas cendawan entomopatogen L. lecanii untuk menekan perkembangan hama kutudaun kedelai A. glycines dan mempelajari produksi konidia cendawan L. lecanii yang ditumbuhkan pada media PDA, jagung, dan beras.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai produksi massal L. lecanii. Selain itu mengetahui infeksi cendawan entomopatogen L.
lecanii terhadap kutudaun kedelai A. glycines sebagai upaya pengendalian hama
3
TINJAUAN PUSTAKA
Permasalahan Hama kedelai
Tanaman kedelai secara alami dapat terinfestasi oleh serangga hama selama pertumbuhan dan penyimpanan (Tengkano & Soehardjan 1993; Jackai et
al. 1990). Secara umum diketahui bahwa serangga arthropoda yang berasosiasi
dengan tanaman kedelai di Indonesia tercatat 266 jenis, 111 di antaranya sebagai hama, 53 serangga bukan hama seperti polinator dan detritivora, 61 predator, 41 serangga parasitoid (Okada et al. 1988). Tengkano & Soehardjan (1993) menginformasikan ada sekitar 28 spesies serangga hama yang menggunakan tanaman kedelai sebagai inang utama. Sedangkan Jackai et al. (1990) melaporkan ada 56 spesies hama tanaman kedelai. Namun hanya sekitar 12-14 spesies yang memiliki nilai ekonomis tinggi, yaitu lalat kacang Ophiomyia phaseoli Tryon., kumbang daun kedelai Phaedonia inclusa Stal., ulat grayak Spodoptera litura Fabricius, ulat jengkal semu Chrysodeixis chalcites Esper, Lamprosema indicata Fabricius, pemakan polong Helicoverpa armigera Hubner, penggerek polong
Etiella zinckenella Treitschke dan Etiella hobsoni Butler, pengisap polong Nezara viridula Linnaeus, Piezodorus hybneri Gmelin, Riptortus linearis L., dan dua jenis
vektor virus, yaitu kutucabuk Aphis glycines Matsumura, dan kutukebul Bemicia
tabaci Gennadius (Nakasuji et al. 1985; Okada et al.1988 a; Tengkano et al. 1988
b; Ditlintan 1997). Selain itu, serangga vektor virus, A. glycines dan B. tabaci, perlu mendapat perhatian lebih karena fungsinya sebagai vektor virus-virus utama kedelai. A. glycines menularkan soybean mosaic virus (SMV), alfalfa mosaic
virus (AMV), soybean stunt virus (SSV), peanut stripe virus (PStV), peanut mottle virus (PMoV), bean yellow mosaic virus (BYMV), indonesian soybean dwaef virus (ISDV), blakeye cowpea mosaic virus (BICMV) (Wang 2006).
Sebagian besar virus tersebut ditularkan secara non-persisten atau tular stilet.
Kutudaun Kedelai Aphis glycines
A. glycines telah banyak ditemukan menyerang tanaman kedelai di
Indonesia. Kehadiran kutudaun tersebut pada tanaman kedelai sudah mulai sejak tanaman berumur tujuh hari setelah tanam (Tengkano 1993). Kehilangan produksi
akibat serangan kutudaun pada tanaman kedelai dipengaruhi saat terjadinya infeksi. Semakin awal terjadi infeksi maka pengurangan produksi semakin tinggi (Soegiarto et al. 1988).
A. glycines tergolong dalam ordo Hemiptera, superfamili Aphidoidea,
famili Aphididae, subfamili Aphidinae (Blackman & Eastop 2000). Kutudaun tersebut tergolong serangga yang berukuran kecil. Tubuh betina yang tidak bersayap bewarna kuning pucat atau kuning kehijauan, panjang tubuh 1.0-1.6 mm, kornikel hitam dan seringkali dengan dasar kauda yang pucat. Marginal tubercles kecil, terdapat pada ruas abdomen kesatu dan ketujuh. Antenal tubercles tidak berkembang. Antena beruas enam dan panjangnya kurang lebih 2/3 panjang tubuh. Pada kauda terdapat 7-10 seta. Di daerah tropik seperti Indonesia, kutudaun berkembang biak secara partenogenetik yaitu sel telur dapat menjadi embrio tanpa mengalami pembuahan dan secara vivipar yaitu serangga dewasa melahirkan nimfa. Kemampuan kutudaun berkembangbiak secara partenogenetik tersebut menyebabkan populasi kutudaun dapat meningkat dengan cepat jika dalam kondisi yang baik.
Menurut Rohajati (1976) siklus hidup A. glycines di Bogor satu minggu dengan rincian: stadium nimfa instar satu selama satu hari, instar dua, tiga, dan empat masing-masing dua hari. Nimfa dengan cepat (lebih kurang seminggu) menjadi dewasa dan siap melahirkan generasi baru. Pada kedelai varietas Orba rata-rata lama hidup dan keperidian berturut-turut adalah 15 hari dan 21 nimfa.
A. glycines merusak tanaman kedelai dengan cara menghisap cairan
tanaman pada daun, tangkai daun muda, pucuk, dan polong (Gambar 1). Pada tanaman kedelai yang terserang berat kutudaun mempunyai kenampakan daun yang menghitam. Hal ini disebabkan oleh ekskret kutudaun yang berupa embunmadu. Embunmadu tersebut menjadi media pertumbuhan cendawan embun jelaga atau biasa disebut sooty mold, sehingga permukaan bagian tanaman terserang mengalami perubahan warna yaitu menghitam.
5
Gambar 1 Aphis glycines yang sedang menghisap cairan tanaman.
Cendawan Entomopatogen Lecanicillium lecanii
Cendawan Lecanicillium lecanii (Zimm.) (Viegas) Zare & Gams digolongkan divisi Deuteromycotina kelas Hyphomycetes yang tergolong
imperfect fungi atau cendawan yang memiliki siklus tidak sempurna. L. lecanii
merupakan cendawan entomopatogen yang pertama kali ditemukan oleh Zimmermann pada tahun 1898 dengan nama Chephalosporium lecanii. Pada tahun 1939, Viegas mengubah nama menjadi Verticillium lecanii berdasarkan studi kisaran inang (Kouvelis et al. 1999). Pengamatan lebih lanjut terhadap sifat morfologi dan analisis molekuler, cendawan tersebut berubah nama menjadi L.
lecanii sampai sekarang (Zare & Gams 2001). Cendawan L. lecanii dapat
digunakan untuk mengendalikan serangga hama terutama Hemiptera dengan tingkat mortalitas yang sangat bervariasi (Prayogo 2004).
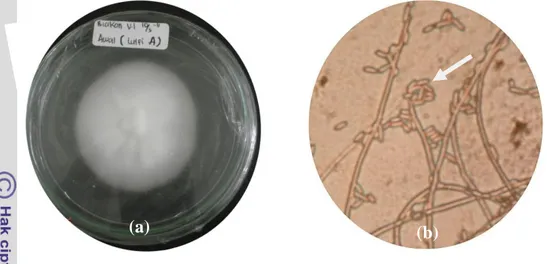
Karakteristik L. lecanii adalah koloni cendawan bewarna putih pucat dengan diameter berkisar 4,0-7,3 cm setelah 20 hari inokulasi pada media PDA (potato dextrose agar). Konidiofor berbentuk fialid (whorls) seperti huruf V, setiap konidiofor memproduksi 5-10 konidia yang terbungkus dalam kantong lendir. Konidia berbentuk silinder hingga elips, terdiri dari satu sel, tidak bewarna (hialin), dan berukuran 1,9-2,2 x 5,0-6,1 µm (Gambar 2).
Gambar 2 Koloni Lecanicillium lecanii di media PDA (a) dan konidia L. lecanii yang diproduksi oleh setiap tangkai konidiofor, perbesaran 400x (b). Cendawan entomopatogen memerlukan kelembaban yang tinggi untuk tumbuh dan berkembang, hal tersebut diperlukan selama proses pembentukan tabung kecambah (germ tube), sebelum terjadi penetrasi ke integumen serangga. Cendawan L. lecanii tumbuh baik pada suhu 18-30ºC dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% cendawan tumbuh sangat baik (Cloyd 2003). Cendawan L. lecanii mampu hidup pada bahan organik yang mati dalam rentang waktu yang sangat panjang (Tanada & Kaya 1993).
Keefektifan cendawan emtomopatogen terhadap serangga dipengaruhi oleh antara lain asal isolat, kerapatan konidia, umur dan stadia perkembangan inang, dan juga waktu aplikasi (Prayogo 2009). Salah satu faktor lain yang mempengaruhi keefektifan cendawan entomopatogen dalam mengendalikan hama adalah tingkat virulensi isolat. Virulensi antar isolat cendawan entomopatogen disebabkan karena adanya keragaman intraspesies. Hal ini disebabkan isolat yang diperoleh dari lokasi yang sama tetapi dari jenis serangga yang berbeda atau sebaliknya, yaitu isolat dari lokasi yang berbeda tetapi dari jenis serangga yang sama dimungkinkan memiliki karakter yang berbeda baik secara fisiologis maupun genetis.
Cendawan entomopatogen sebagai agens biokontrol akan dapat mengurangi populasi hama dan kerusakan yang ditimbulkan di agrosistem yang berbeda (Inglis et al. 2001). Kesuksesan agens hayati seperti cendawan entomopatogen harus mempunyai kemampuan untuk memproduksi inokulum
7 dalam jumlah yang besar (Gothel & Robbert 1992). Perbedaan media pertumbuhan yang digunakan untuk produksi massal tergantung pada kebutuhan nutrisi cendawan entomopatogen yang digunakan. Metarhizium anisopliae (Metschnikoff) dapat ditumbuhkan pada media beras (Kaay & Hassan 2000), bulir padi atau jagung (Shashi et al. 1999). Media yang digunakan akan mempengaruhi produksi konidia dari cendawan entomopatogen.
Menurut Moore dan Prior (1993) karakteristik yang digunakan untuk produksi massal harus mempunyai sporulasi yang tinggi pada media buatan, virulensi yang tinggi dalam melawan organisme target, dan kemampuan untuk bertahan pada lingkungan tempat hama tersebut berada. Indikator virulensi cendawan entomopatogen yang baik antara lain perkecambahan yang tinggi, pertumbuhan dan sporulasi yang tinggi pula (Chandler 1993). Telah dilaporkan bahwa sumber nutrisi (media) berperan sebagai faktor yang menentukan bagi pertumbuhan dan virulensi cendawan entomopatogen (Shah et al. 2005). Nutrisi merupakan substansi yang digunakan sebagai biosintesis dan energi pembebasan yang menyajikan faktor utama dalam viabilitas, kelangsungan hidup, dan keberlanjutan organisme. Selain itu, pertumbuhan miselia dan spora pada media buatan tergantung pada isolat cendawan yang digunakan dan komponen yang digunakan dalam media.
Pada umumnya, untuk menyelesaikan secara lengkap siklus hidup cendawan entomopatogen, maka kebanyakan patogen harus kontak dengan inangnya, masuk ke dalam tubuh inang, reproduksi di dalam satu atau lebih jaringan inang dan mempunyai propagul untuk kontak dan menginfeksi inang baru. Dalam biologi patogen terdapat proses yang meliputi kontak dengan inang, penetrasi inang, reproduksi, keluarnya propagul patogen dari inang dan penyebaran dan persistensi propagul patogen di lingkungan (Anonim 2007).
Kontak dengan inang dilakukan secara pasif pada berbagai stadia dari patogen seperti spora cendawan oleh angin, hujan, atau oleh serangga. Setelah terjadi kontak dengan inang maka cendawan masuk tubuh inang dan melakukan penetrasi langsung ke kutikula. Penetrasi dilakukan oleh hifa yang memproduksi enzim yang mampu menghancurkan kutikula serangga. Jaringan inang yang terserang akan mempengaruhi jumlah propagul patogen yang diproduksi per berat
inang. Proses setelah reproduksi adalah spora patogen harus melakukan kontak dengan inang lainnya untuk melanjutkan siklus hidupnya. Keberlanjutan populasi patogen di alam tergantung sekali pada kontaknya dengan inang baru (Anonim 2007).
Pengendalian Hama Kedelai
Dalam penanggulangan hama kedelai sampai kini petani Indonesia masih mengandalkan insektisida kimia sebagai upaya pengamanan produksi usaha tani kedelai dari serangan hama (Shepard et al. 1987). Faktor yang mempengaruhinya antara lain insektisida tersebut mudah diperoleh, aplikasinya mudah, keuntungan hasil akibat aplikasi insektisida lebih cepat tampak. Oleh karena itu, dalam pertanian modern, penggunaan insektisida kimia tetap sulit untuk dihindarkan (Norris et al. 2003). Peningkatan penggunaan insektisida kimia akan berdampak langsung pada penambahan biaya oleh petani. Selain itu, aplikasi insektisida kimia sejenis mempunyai daya racun insektisida yang luas sehingga penggunaan dalam kurun waktu tertentu insektisida tersebut akan kehilangan keefektifannya (Hardy 1996).
Dalam konsep PHT, pemanfaatan musuh alami sebagai agens hayati dalam mengendalikan hama dan penyakit perlu dikedepankan dalam menekan penggunaan pestisida kimia yang berlebihan (Rauf et al. 1994). Agens hayati merupakan bagian dari suatu ekosistem yang sangat penting peranannya dalam mengatur keseimbangan ekosistem tersebut. Secara alamiah, agens hayati merupakan komponen utama dalam pengendalian alami yang dapat mempertahankan semua organisme pada ekosistem tersebut berada dalam keadaan seimbang.
Menurut Marwoto & Suharsono (1999) terdapat beberapa kelebihan pemakaian agens hayati antara lain: (1) menurunkan resiko resistensi hama dan penyakit tanaman dan ketahanannya terhadap perlakuan, (2) tidak mematikan musuh-musuh alami lainnya, (3) menurunkan resiko ledakan hama sekunder, (4) tidak berdampak negatif terhadap kesehatan manusia dan ternak, (5) tidak merusak lingkungan dan sumber air, (6) menurunkan biaya produksi. Beberapa jenis agens hayati yang sudah dapat dikembangkan antara lain parasitoid,
9 predator, dan patogen serangga terdiri dari virus, bakteri, dan cendawan. Contoh yang telah dilakukan yaitu pengendalian hama Riptortus linearis dengan menggunakan cendawan L. lecanii (Prayogo & Suharsono 2005).
Menurut Prayogo (2009) cendawan entomopatogen L. lecanii efektif untuk pengendalian hama penghisap polong kedelai R. linearis. Laporan lain menyebutkan bahwa L. lecanii juga mampu menginfeksi telur Bemisia tabaci, B.
argentifolii, dan Trialeurodes vaporariorum (Hemiptera Aleyrodidae) (Gindin et al. 2000). Menurut Marwoto (2003) pemanfaatan parasitoid telur menggunakan T. bactrae-bactrae sebagai agen hayati hama penggerek polong kedelai E. zinckenella mempunyai prospek yang baik dalam pengendalian hama kedelai.
Dalam aplikasinya, parasitoid telur T. bactrae-bactrae dilepas ke lapangan dengan perantaraan telur hama gudang Corcyra cephalonica (Stt.) (Lepidoptera: Pyralidae). Penelitian Kurniawan (2010) menunjukkan bahwa ternyata cendawan
L. lecanii dapat menyerang telur C. cephalonica. Karena L. lecanii mempunyai
kemampuan yang tinggi untuk menginfeksi berbagai jenis serangga, potensi cendawan ini untuk menginfeksi serangga kedelai lain, misalnya A. gossypii perlu diteliti.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai bulan September 2011.
Bahan Serangga uji Aphis glycines
Hama kutu daun kedelai didapat dari eksplorasi pada pertanaman kedelai di Kelurahan Situ gede, Bogor Barat. Kutu daun kemudian diidentifikasi menggunakan buku identifikasi oleh Blackman (2000). Pembiakan kutu daun kedelai A. glycines dilakukan pada sangkar pemeliharaan. Tanaman kedelai varietas Wilis yang berumur 3 minggu setelah tanam ditutup dengan sangkar yang terbuat dari kain kasa (Gambar 3). Kutu daun dikembangbiakkan dalam sangkar tersebut.
Gambar 3 Tempat pemeliharaan serangga uji A. glycines.
Cendawan Lecanicillium lecanii
Isolat murni cendawan L. lecanii diperoleh dari Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Institut Pertanian Bogor. Isolat murni cendawan kemudian ditumbuhkan dalam media potato dextrose agar (PDA). Komposisi media PDA adalah kentang, agar, dextrose, ditambah chloramphenicol 1 gram/liter aquades. Cendawan ditumbuhkan dalam incubator pada suhu 25ºC
11 selama 21 hari setelah inokulasi sehingga siap digunakan untuk penelitian lebih lanjut.
Metode
Penyiapan suspensi konidia L. lecanii
Inokulum cendawan L. lecanii ditumbuhkan pada media PDA di dalam cawan petri diameter 9 cm. Setelah berumur 21 hari konidia cendawan yang terbentuk dikerok dengan spatula steril yang dibasahi dengan air kemudian ditumbuk dengan mortar hingga halus. Kemudian gerusan dimasukkan ke dalam tabung reaksi yang berisi air steril yang telah dicampur Tween 20 (0,05%) sebanyak 0,025 ml per 50 ml air. Selanjutnya, suspensi konidia dikocok dengan menggunakan vortex selama 60 detik dan kerapatan konidianya dihitung menggunakan haemocytometer Neubauer-improved hingga diperoleh kerapatan konidia 10⁹/ml. Pengamatan kerapatan konidia dilakukan di bawah mikroskop
compound dengan perbesaran 40x10. Setelah didapatkan kerapatan konidia 10⁹/ml maka untuk mendapatkan kerapatan konidia 10⁸/ml, 10⁷/ml, 10⁶/ml, 10⁵/ml dilakukan pengenceran bertingkat.
Perlakuan serangga uji
Aplikasi cendawan L. lecanii terhadap A. glycines dilakukan pada lima kerapatan konidia berbeda yaitu 10⁵/ml, 106/ml, 107/ml, 108/ml, 109/ml , dan kontrol (hanya menggunakan air steril). Masing-masing perlakuan diulang sebanyak empat kali. Dalam satu cawan petri berukuran diameter 150 mm x tinggi 25 mm diaplikasikan 20 ekor kutu daun instar 2, sehingga dalam satu perlakuan diperlukan 80 ekor kutu daun (Gambar 4). Penentuan instar perkembangan serangga didasarkan pada ukuran tubuh. Suspensi konidia L. lecanii yang sudah dihitung kerapatan konidianya disemprotkan ke nimfa A. glycines. Aplikasi penyemprotan menggunakan sprayer tangan dengan volume semprot ± 1 ml. Aplikasi diulang sebanyak dua kali.
Gambar 4 Cawan petri dengan alas kertas tisu yang berisi serangga perlakuan.
Pengamatan dilakukan pada dua hari setelah aplikasi. Variabel yang diamati yaitu jumlah kematian/mortalitas kutu daun yang terinfeksi cendawan L. lecanii dan jumlah anak yang dihasilkan. Kutu daun yang terkolonisasi oleh cendawan dicek ulang kebenaran patogennya dengan cara mengisolasi cendawan dari bangkai serangga mati (cadaver). Cadaver direndam di dalam larutan hipoklorit 1-5% selama 3 menit untuk mematikan mikrob kontaminan. Masing-masing
cadaver kemudian direndam di dalam air steril selama 1 menit. Perendaman
dalam air steril diulang tiga kali kemudian dikeringkan menggunakan kertas saring sebelum ditumbuhkan pada media PDA.
Pembuatan media PDA, jagung, dan beras
Jagung digiling sehingga ukurannya menyerupai ukuran butiran beras. Beras dan jagung kemudian dicuci sampai bersih. Setelah dicuci bersih, maka beras dan jagung dikukus selama ±15 menit sampai agak lunak. Kemudian masing-masing media sebanyak 100 gram dimasukkan ke dalam plastik tahan panas, dan disterilkan dalam autoklaf pada suhu 121ºC selama 15 menit. Setelah media beras dan jagung steril kemudian media tersebut dipindahkan ke dalam cawan petri 150 mm x 25 mm. Media PDA steril dibuat dari media PDA murni (DifcoTM) sebanyak 39 gram yang dilarutkan dalam satu liter aquades dan ditambahkan chloramfenikol 1gram/liter. Setelah media dingin, maka ditambahkan suspensi L. lecanii dengan kerapatan konidia 4,69 x 10⁷/ml,
13 sebanyak 3 ml (jagung dan beras). Pada media PDA ditambahkan suspensi konidia sebanyak 0,3 ml dan kemudian diratakan menggunakan spreader. Semua media yang telah ditulari suspensi cendawan ditaruh dalam inkubator pada suhu 25ºC selama 21 dan 42 HSI.
Dalam percobaan ini terdapat 3 perlakuan yaitu media PDA, jagung, dan beras. Masing-masing perlakuan diulang sebanyak lima kali. Pengamatan dilakukan pada dua waktu berbeda yaitu pada 21 dan 42 hari setelah inokulasi (HSI). Dua ulangan diamati pada 21 HSI dan tiga ulangan berikutnya diamati pada 42 HSI.
Penghitungan kerapatan konidia dan daya kecambah
Setelah cendawan berumur 21 dan 42 HSI, media diambil dan dihancurkan dalam aquades 250 ml dengan menggunakan blender tanpa ditambahkan perata Tween 20. Penghitungan kerapatan konidia dan daya kecambah dilakukan secara langsung menggunakan haemocytometer Neubauer-improved. Sebanyak 5 ml suspensi L. lecanii dari masing-masing media dipindahkan ke dalam tabung reaksi. Untuk masing-masing media, perhitungan dilakukan dari dua tabung reaksi dan dari tiap tabung reaksi dilakukan dua kali penghitungan.
Pengamatan daya kecambah dilakukan setelah suspensi L. lecanii diinkubasi di dalam aquades steril selama 10 jam pada suhu kamar. Pengamatan kerapatan konidia dan pengamatan daya kecambah dilakukan di bawah mikroskop
compound dengan perbesaran 40x10. Pengambilan contoh daya kecambah sama
dengan pengambilan contoh pada penghitungan kerapatan konidia.
Rancangan percobaan
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL). Keragaman data diolah dengan menggunakan Microsoft excel 2007 dan dianalisis dengan program SAS dengan uji lanjut Pengujian Jarak Berganda Duncan (DMRT) atau uji t dengan taraf nyata 5%.
HASIL DAN PEMBAHASAN
Pengaruh Jenis Media dan Umur Biakan L. lecanii terhadap Kerapatan Konidia
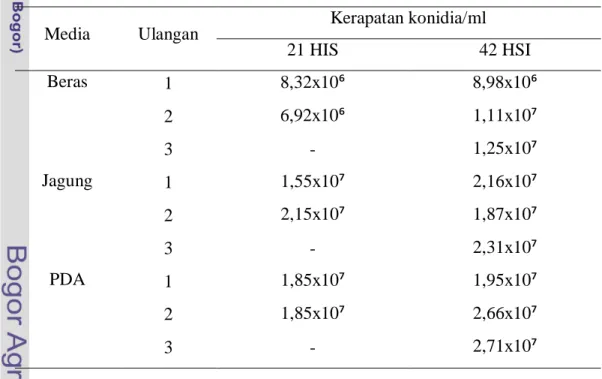
Secara umum media PDA menghasilan kerapatan konidia tertinggi jika dibandingkan dengan media jagung dan beras (Tabel 1). Hal ini mungkin disebabkan oleh adanya faktor-faktor perbedaan nutrisi dan kadar oksigen dalam ruang tumbuh. Cendawan ini bersifat aerob sehingga dalam pertumbuhan dan perkembangannya membutuhkan oksigen. Pertumbuhan hifa pada media juga menentukan kecepatan pertumbuhan dan perkembangan cendawan dalam media tumbuh. Semakin cepat pertumbuhan hifa dalam media maka akan semakin cepat pertumbuhan dan perkembangan cendawan. Kondisi ini menyebabkan timbulnya perbedaan pertumbuhan pada media PDA, jagung, dan beras. Hifa pada media PDA lebih cepat tumbuh daripada media jagung dan beras (Gambar 5).
Tabel 1 Kerapatan konidia L. lecanii umur biakan 21 dan 42 hari setelah inkubasi
Media Ulangan Kerapatan konidia/ml
21 HIS 42 HSI Beras 1 8,32x10⁶ 8,98x10⁶ 2 6,92x10⁶ 1,11x10⁷ 3 - 1,25x10⁷ Jagung 1 1,55x10⁷ 2,16x10⁷ 2 2,15x10⁷ 1,87x10⁷ 3 - 2,31x10⁷ PDA 1 1,85x10⁷ 1,95x10⁷ 2 1,85x10⁷ 2,66x10⁷ 3 - 2,71x10⁷
15
Gambar 5 Koloni L. lecanii yang ditumbuhkan di tiga media berbeda PDA (a), jagung (b), dan beras (c) pada umur 42 HSI
Jenis media berpengaruh signifikan terhadap kerapatan konidia pada taraf nyata 5%. Uji lanjut Duncan menunjukkan bahwa rata-rata kerapatan konidia L.
lecanii yang dihasilkan oleh media PDA tidak berbeda nyata dengan kerapatan
konidia L. lecanii yang dihasilkan oleh media jagung. Kerapatan konidia L.
lecanii yang dihasilkan oleh media beras berbeda nyata dengan kerapatan konidia
yang dihasilkan oleh media PDA dan jagung (Tabel 2).
(a) (b)
Tabel 2 Pengaruh jenis media dan umur biakan terhadap kerapatan konidia L.
lecanii
Media
Kerapatan konidia/ml ± SD (x10⁶)¹ Jumlah konidia total²
t hitung t tabel
21 HSI 42 HSI 21 HSI 42 HSI
Beras 7,62x10⁶ ± 1,82b 1,08x10⁷ ± 1,84b 1,91x10⁹ 2,70x10⁹ -3,90
2,44 Jagung 1,85x10⁷ ± 3,50a 2,11x10⁷ ± 3,98a 4,62x10⁹ 5,27x10⁹ -1,53
PDA 1,85x10⁷ ± 2,21a 2,44x10⁷ ± 4,08a 4,62x10⁹ 6,10x10⁹ -3,73 1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan =0,05.
² Analisis umur biakan terhadap kerapatan konidia L. lecanii menggunakan uji t dengan =0,05.
Pada 42 HSI dapat dihasilkan 2,70x10⁹ konidia pada 100 gram media beras, 5,27x10⁹ konidia pada 100 gram media jagung, dan 6,10x10⁹ konidia dalam 100 gram media PDA. Perbedaan kandungan nutrisi sangat mempengaruhi produksi konidia, oleh karena itu, pemilihan bahan media substrat untuk perbanyakan cendawan entomopatogen harus dilakukan secara tepat, terutama memilih bahan yang memiliki kemampuan memproduksi konidia secara konsisten. Kardin dan Priyatno (1996 dalam Prayogo 2005) menyatakan bahwa cendawan entomopatogen membutuhkan media dengan kandungan gula yang tinggi di samping protein. Media dengan kadar gula yang tinggi akan meningkatkan virulensi cendawan entomopatogen.
Selain pengaruh jenis media terhadap kerapatan konidia L. lecanii, juga bisa dilihat pengaruh umur biakan terhadap kerapatan konidia yang dihasilkan. Dari hasil t hitung yang didapat pada media beras dan PDA < |t tabel| yaitu 2,44 (Tabel 2) yang berarti rata-rata kerapatan konidia media pada 21 HSI berbeda nyata dengan rata-rata kerapatan konidia pada 42 HSI pada taraf nyata 5%. Kerapatan konidia pada media jagung > |t tabel| yaitu 2,44 yang berarti kerapatan konidia media jagung pada 21 HSI tidak berbeda nyata dengan kerapatan konidia pada 42 HSI. Rata-rata konidia pada 42 HSI lebih tinggi daripada 21 HSI. Berdasarkan hasil tersebut, terlihat bahwa umur cendawan mempengaruhi jumlah konidia yang dihasilkan. Menurut Wahyunendo (2002) pertumbuhan dan perkembangan cendawan menunjukkan peningkatan jumlah konidia sebanding dengan lamanya waktu inkubasi, sampai menunjukkan titik stasioner pertumbuhan.
17
Pengaruh Jenis Media dan Umur Biakan L. lecanii terhadap Daya Kecambah
Daya kecambah cendawan entomopatogen merupakan awal dari stadia pertumbuhan cendawan sebelum melakukan penetrasi ke integumen serangga. Pada umumnya, semakin tinggi daya kecambah suatu cendawan entomopatogen maka tingkat virulensinya juga tinggi dalam pengendalian hama. Menurut Altre et
al. (1999) virulensi cendawan entomopatogen berkaitan dengan ukuran konidia,
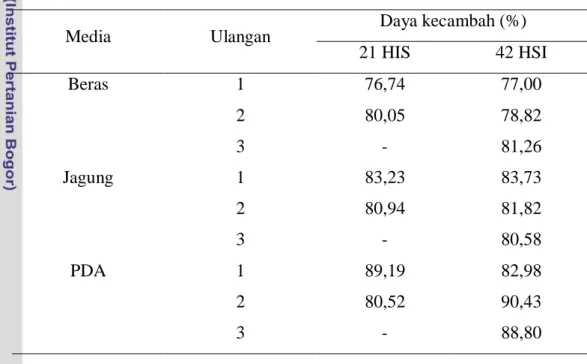
kecepatan perkecambahan konidia, dan produksi enzim yang berfungsi sebagai pendegradasi kutikula inang. Data yang diperoleh menunjukkan persentase perkecambahan pada tiga media antara 76%-90% (Tabel 3).
Tabel 3 Daya kecambah L. lecanii umur biakan 21 dan 42 HSI
Media Ulangan Daya kecambah (%)
21 HIS 42 HSI Beras 1 76,74 77,00 2 80,05 78,82 3 - 81,26 Jagung 1 83,23 83,73 2 80,94 81,82 3 - 80,58 PDA 1 89,19 82,98 2 80,52 90,43 3 - 88,80
Jenis media berpengaruh signifikan terhadap daya kecambah pada taraf nyata 5%. Uji lanjut Duncan menunjukkan bahwa daya kecambah L. lecanii yang dihasilkan oleh media PDA tidak berbeda nyata dengan daya kecambah pada media jagung. Daya kecambah pada media jagung juga menunjukkan tidak berbeda nyata dengan daya kecambah pada media beras. Akan tetapi, daya kecambah pada media PDA berbeda nyata dengan daya kecambah pada media beras (Tabel 4). Perbedaan tersebut berlaku baik untuk umur 21 HSI maupun 42 HSI.
Tabel 4 Pengaruh jenis media dan umur biakan terhadap daya kecambah konidia
L. lecanii
Media
Rata-rata daya kecambah (% ± SD)¹
t hitung² t tabel
21 HSI 42 HSI
Beras 78,39 ± 5,10b 79,02 ± 4,98b -0,28
2,44
Jagung 82,08 ± 2,33ab 82,04 ± 2,66ab 0,04
PDA 84,85 ± 5,28a 87,40 ± 4,65a -1,14
1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan = 0,05.
² Analisis umur biakan terhadap kerapatan konidia L. lecanii menggunakan uji t dengan =0,05.
Daya kecambah konidia L. lecanii umur 42 HSI pada tiga media dinilai masih cukup tinggi yaitu PDA (87,40%), jagung (82,04%), dan beras (79,02%). Daya kecambah mengekspresikan kemampuan konidia yang dapat tumbuh dan berkembang apabila faktor lingkungan mendukung. Daya kecambah konidia mempunyai peran yang cukup besar bagi keberhasilan konidia dalam proses penetrasi dan infeksi ke serangga inang (Sitch & Jackson 1997; Alovo et al. 2002). Semakin tinggi daya kecambah konidia maka semakin besar pula peluang agens hayati tersebut dapat menginfeksi serangga inang sehingga kolonisasi dan proses epizooti di lapangan cepat terjadi (Wagner & Lewis 2000). Menurut Kassa (2003), daya kecambah konidia cendawan entomopatogen yang digunakan sebagai agens hayati minimal harus 80%. Liu et al. (2003) menyarankan bahwa daya kecambah konidia cendawan yang akan digunakan sebagai agens hayati harus diatas 90%. Samuels dan Coracini (2004) menegaskan bahwa proses infeksi akan mencapai optimal apabila daya kecambah konidia isolat yang digunakan mencapai 99%.
Selain pengaruh jenis media terhadap daya kecambah L. lecanii, juga bisa dilihat pengaruh umur biakan terhadap daya kecambah yang dihasilkan. Dari hasil
t hitung yang didapat pada ketiga media > |t tabel| yaitu 2,44 (Tabel 4) yang
berarti daya kecambah pada semua media pada umur 21 HSI tidak berbeda nyata dengan umur 42 HSI (taraf nyata 5%).
Media jagung memiliki kandungan lemak, hal ini diduga merupakan faktor meningkatnya jumlah konidia dan perkecambahan jika dibandingkan media beras. Berdasarkan penelitian Prayogo (2009) konsentrasi dan jenis minyak nabati selain
19 berpengaruh terhadap pertumbuhan juga berpengaruh pada perkembangan L.
lecanii. Jumlah konidia yang terbentuk lebih banyak pada minyak nabati jika
dibandingkan kontrol (tanpa minyak). Penambahan minyak nabati ke dalam media tumbuh meningkatkan daya kecambah konidia L. lecanii.
Gambar 6 Tabung kecambah L. lecanii pada 10 jam setelah inkubasi (JSI). Tabung kecambah yang terbentuk pada 10 JSI berbentuk memanjang dari ukuran konidia sebelumnya (Gambar 6). Konidia dapat dianggap hidup (viable) apabila tabung kecambah telah mencapai dua kali diameter konidia (Goettel & Inglis 1997). Tabung kecambah yang terbentuk akan berkembang membentuk apresorium yang berfungsi untuk menempelkan organ infektif pada permukaan inang. Semakin cepat tabung kecambah terbentuk dan semakin besar ukurannya diduga akan semakin besar pula peluang inang dapat dipenetrasi oleh cendawan karena permukaan inang lebih cepat dihidrolisis oleh cendawan (Prayogo 2009).
Mortalitas A. glycines oleh L. lecanii
Secara umum data yang diperoleh menunjukan bahwa semakin banyak atau rapat konidia yang digunakan, maka semakin cepat cendawan tersebut menginfeksi dan mematikan A. glycines. Perbedaan kerapatan konidia L. lecanii berpengaruh terhadap tingkat mortalitas A.glycines. Pada hari keempat setelah perlakuan didapatkan mortalitas tinggi pada kerapatan konidia 10⁹/ml yaitu mencapai 100%. Persentase mortalitas berturut-turut pada kerapatan konidia 10⁸/ml, 10⁷/ml, 10⁶/ml, dan 10⁵/ml yaitu 97,5%; 92,5%; 81,25%; dan 82,5%. Persentase mortalitas kontrol mencapai 77,5% (Tabel 5). Menurut Feng (1990) pada perlakuan L. lecanii terhadap enam spesies kutudaun pada serealia termasuk
A. glycines, nilai LC50 adalah 4,1x105 konidia/ml.
Tabel 5 Persentase mortalitas A. glycines akibat perlakuan L. lecanii selama empat hari pengamatan
Kerapatan konidia/ml
Mortalitas (%) Hari Setelah Perlakuan
1 2 3 4 10⁵ 58,75 68,75 77,50 82,50 10⁶ 52,50 65,00 76,25 81,25 10⁷ 67,50 76,25 87,50 92,50 10⁸ 56,25 77,50 95,00 97,50 10⁹ 70,00 91,25 98,75 100 Kontrol 16,25 42,50 62,50 77,50
21
mcn
Gambar 7 Mortalitas kumulatif A. glycines yang terinfeksi cendawan L. lecanii selama empat hari.
Kematian nimfa menunjukkan peningkatan seiring dengan berjalannya waktu (Gambar 7). Persentase kematian pada kontrol sampai hari keempat menunjukkan angka yang cukup tinggi yaitu 77,50%. Diduga perlakuan dengan penyemprotan air secara mekanik akan mempengaruhi pergerakan kutudaun. Di samping itu butiran air yang berasal dari penyemprotan diduga menutupi spirakel serangga, sehingga mengalami kesulitan dalam mengambil oksigen untuk proses
0 20 40 60 80 100 0 1 2 3 4 % k e m ati an waktu (hari) Kerapatan 10⁵ konidia/ml 0 20 40 60 80 100 0 1 2 3 4 % k e m ati an waktu (hari) Kerapatan 10⁶ konidia/ml 0 20 40 60 80 100 0 1 2 3 4 % k e m ati an waktu (hari) Kerapatan 10⁷ konidia/ml 0 20 40 60 80 100 0 1 2 3 4 % k e m at ia n waktu (hari) Kerapatan 10⁸ konidia/ml 0 20 40 60 80 100 0 1 2 3 4 % k e m at ia n waktu (hari) Kerapatan 10⁹ konidia/ml 0 20 40 60 80 100 0 1 2 3 4 % k em at ia n waktu (hari) Mortalitas Kontrol
metabolisme. Terganggunya proses metabolisme menyebabkan serangga mengalami kematian.
Pada umumnya, kutudaun dinilai cukup tahan terhadap infeksi L. lecanii, ketahanan ini disebabkan oleh proses ganti kulit sesudah perlakuan cendawan. Menurut Alavo et al. (2002) meskipun stadia inang cukup rentan terhadap infeksi
L. lecanii akan tetapi jika serangga inang tersebut mengalami ganti kulit maka
infektifitas cendawan juga sangat rendah. Hal ini disebabkan konidia akan terlepas bersama kutikula sebelum menginfeksi inang. Menurut Wiyono (2007) penelitian di lapang membuktikan bahwa curah hujan yang sangat tinggi dapat mengurangi bahkan menghilangkan populasi kutudaun dari tumbuhan inang. Kutudaun dapat terhempas dari tanaman dan hanyut oleh aliran air hujan.
Tabel 6 Persentase mortalitas kumulatif A. glycines terhadap L. lecanii pada empat hari pengamatan
Kerapatan Konidia Mortalitas (% ± SD)¹
10⁵ 82,50 ± 2,98b 10⁶ 81,25 ± 3,37b 10⁷ 92,00 ± 2,56ab 10⁸ 97,50 ± 3,92ab 10⁹ 100,0 ± 2,68a Kontrol 77,50 ± 4,82c 1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan = 0,05.
Penyemprotan berbagai konsentrasi suspensi konidia cendawan L. lecanii memberikan pengaruh signifikan terhadap mortalitas kutudaun, dengan
probability= 0.0003 < Alpha (5%=0.05). Pada uji lanjut Duncan dapat dilihat
bahwa perlakuan dengan kerapatan konidia 10⁹/ml tidak berbeda nyata dengan perlakuan 10⁸/ml dan 10⁷/ml, akan tetapi berbeda nyata dengan perlakuan dengan kerapatan konidia 10⁶/ml, 10⁵/ml, dan kontrol (Tabel 6).
Analisis regresi dilakukan berdasarkan data mortalitas sampai dengan hari keempat, karena pada pengamatan hari keempat, 100% mortalitas serangga sudah diperoleh pada kerapatan konidia 109/ml (Gambar 8). Analisis probit tidak dilakukan karena angka mortalitas pada kontrol cukup tinggi
23
Gambar 8 Hubungan antara kerapatan konidia dengan mortalitas A.glycines akibat perlakuan cendawan L. lecamii selama empat hari setelah perlakuan
Persamaan garis regresi menunjukkan hasil yang didapat yaitu y= 5,125x + 54,875. Apabila kerapatan konidia L. lecanii meningkat sebesar 101 (satu-satuan) maka mortalitas akan meningkat sebesar 5,125% (Gambar 8).
A. glycines yang terinfeksi cendawan dan mati, pada awalnya berwarna
kehitaman. Infeksi cendawan pada kutudaun mulai terjadi pada waktu dua hari setelah perlakuan (HSP). Pada 3 HSP bangkai serangga mulai menunjukkan tanda terinfeksi yaitu ditumbuhi oleh miselia cendawan bewarna putih. Mula-mula miselia cendawan hanya pada bagian tertentu saja, tetapi lama-kelamaan miselia cendawan tersebut menyebar ke seluruh bagian kutudaun, sehingga seluruh bagian kutudaun terkolonisasi oleh miselia cendawan tersebut (Gambar 9).
y = 5,125x + 54,875 R²= 0,898 0 20 40 60 80 100 5 6 7 8 9 P er se n ta se m o rt al it as
Gambar 9 A. glycines bewarna kehitaman mulai menunjukkan gejala terinfeksi (a) dan A. glycines sudah terkolonisasi oleh cendawan L. lecanii (warna putih) (b).
Pada kontrol, kutudaun yang mati juga menunjukkan gejala berwarna kehitaman tetapi tidak ditumbuhi oleh miselia cendawan. Untuk lebih meyakinkan sebab kematian pada perlakuan kontrol digunakan metode surface sterilization. Pada metode ini telah didapatkan hasil bahwa bangkai pada perlakuan kontrol tidak terinfeksi oleh cendawan L. lecanii. Hal ini berbeda dengan perlakuan selain kontrol. Pada perlakuan selain kontrol bangkai yang diinkubasi di media PDA ditumbuhi oleh cendawan L. lecanii (Gambar 10).
Pada penelitian ini telah dibuktikan bahwa L. lecanii patogenik terhadap kutudaun. Penggunaan cendawan L. lecanii di pertanaman kedelai untuk pengendalian R. linearis diduga juga akan berpengaruh terhadap kutudaun A.
glycines. Perlu dilakukan penelitian lanjutan untuk mengkaji dampak perlakuan
cendawan entomopatogen L. lecanii terhadap serangga lain bila diaplikasikan di lapang.
(b)
25
Gambar 10 Koloni L. lecanii yang tumbuh pada bangkai kutudaun pada perlakuan selain kontrol
Pengaruh L. lecanii terhadap Jumlah Anakan yang Dihasilkan
Kutudaun berkembangbiak secara partenogenetik sehingga populasinya dapat meningkat cepat dalam kondisi baik. Rata-rata jumlah individu baru tertinggi yang dihasilkan kutudaun A. glycines didapatkan pada kontrol yaitu 64,8 ekor kutudaun dari total jumlah awal yaitu 20 ekor kutudaun dari tiap cawan (Tabel 7). Dalam kurungan lebih luas, satu ekor kutudaun A. glycines dapat menghasilkan anakan kurang lebih 21 nimfa selama hidupnya (Rohajati 1976). Banyak faktor yang dapat mempengaruhi jumlah anakan yang dihasilkan kutudaun pada waktu penelitian, di antaranya: kondisi kelembaban dalam cawan petri tempat kutudaun diperlakukan yang tinggi, sress karena terbatasnya ruang gerak maupun sirkulasi yang kurang baik di dalam cawan petri sehingga kurang memungkinkan bagi kutudaun untuk memproduksi anakan dalam jumlah yang normal. Selain itu, kutudaun pada perlakuan selain kontrol juga menghasilkan anakan namun dalam kuantitas yang lebih rendah dibandingkan kontrol. Hal ini dapat disebabkan oleh terganggunya fisiologi kutudaun tersebut. Cendawan L.
lecanii yang disemprotkan pada kutudaun mampu melakukan penetrasi kedalam
tubuh kutudaun dan mengganggu reproduksi anakan baru sebelum akhirnya kutudaun tersebut mati.
Tabel 7 Kumulatif jumlah anakan yang dihasilkan A. glycines selama sebelas hari pengamatan
Perlakuan
Ulangan Individu baru
1 2 3 4 Rata-rata/cawan Rata-rata/betina± SD1 Kontrol 77 65 52 65 64,8 3,2 ± 6,34a 10⁵ 14 8 22 74 29,5 1,5 ± 5,69bc 10⁶ 30 32 73 12 36,8 1,8 ± 5,16b 10⁷ 33 14 16 20 20,8 1,0 ± 3,16bc 10⁸ 28 30 23 5 21,5 1,1 ± 3,95bc 10⁹ 3 3 9 5 5,0 0,3 ± 1,08c 1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan = 0,05.
Pengamatan terhadap jumlah anakan yang dihasilkan oleh imago A.
glycines dilakukan selama sebelas hari. Penyemprotan berbagai konsentrasi
suspensi konidia cendawan L. lecanii memberikan pengaruh signifikan terhadap jumlah anak yang dihasilkan. Pada perlakuan kontrol, rata-rata jumlah individu baru/betina yang dihasilkan adalah 3,2 anakan. Jumlah anakan pada kontrol berbeda nyata dengan jumlah anak yang dihasilkan pada konsentrasi yang lain. Rata-rata jumlah anakan yang dihasilkan/betina pada kerapatan konidia 10⁵/ml, 10⁶/ml, 10⁷/ml, 10⁸/ml, dan 10⁹/ml berturut-turut adalah: 1,5; 1,8; 1,0; 1,1; dan 0,3 (Tabel 7). Jumlah anak yang dihasilkan pada kerapatan konidia 105/ml tidak berbeda nyata dengan jumlah anak yang dihasilkan pada konsentrasi 10⁶/ml, 10⁷/ml, 10⁸/ml, dan 10⁹/ml. Akan tetapi pada kerapatan konidia 10⁶/ml jumlah anak yang dihasilkan berbeda nyata dengan jumlah anak yang dihasilkan pada kerapatan konidia 10⁹/ml.
Kutudaun mulai menurunkan anakan pada fase imago setelah tiga kali ganti kulit. Hal ini terlihat dari data pengamatan harian yang menunjukkan anakan kutudaun sudah bisa dijumpai pada dua HSP. Dalam pengamatan harian juga dijumpai banyak kutudaun yang memproduksi sayap/alate (Gambar 11). Pada umumnya kutudaun bersayap akan diproduksi ketika kutu dalam kondisi stres. Kutudaun bersayap akan terbang ke lahan lain sehingga akan menyebabkan populasi kutudaun menurun secara drastis. Perpindahan populasi A. glycines dari
27 tanaman kedelai disebabkan oleh pertumbuhan tanaman kedelai dan adanya perubahan nutrisi (Rutledge 2006).
Gambar 11 Nimfa instar satu yang dihasilkan oleh kutudaun (a) dan kutudaun bersayap (alate) (b).
(a)
KESIMPULAN DAN SARAN
Kesimpulan
1. Media PDA merupakan media yang paling baik untuk pertumbuhan dan perkembangan cendawan L. lecanii jika dibandingkan dengan media jagung dan beras.
2. Cendawan L. lecanii mampu menginfeksi kutudaun kedelai A. glycines dan menyebabkan mortalitas pada kutudaun.
3. Perbedaan kerapatan konidia L. lecanii berpengaruh terhadap tingkat mortalitas A.glycines. Semakin banyak atau rapat konidia yang digunakan, maka semakin cepat cendawan tersebut menginfeksi dan mematikan A. glycines.
4. Penyemprotan L. lecanii pada kutudaun kedelai A. glycines menyebabkan menurunnya jumlah anakan kutudaun yang dihasilkan.
Saran
Perlu dilakukan penelitian lanjutan untuk mengkaji media lain yang tepat untuk produksi massal cendawan L. lecanii yang memiliki kemampuan memproduksi konidia secara konsisten. Selain itu perlu dilakukan penelitian lanjutan untuk mengkaji dampak cendawan entomopatogen L. lecanii terhadap serangga lain bila diaplikasikan di lapang.
29
DAFTAR PUSTAKA
Ahmadi LB, Askary H, Ashouri A. 2004. Preeliminary evaluation of the effectiveness of a Verticillium lecanii isolates in the control of Thrips,
Bemisia tabaci (Thysanoptera: Thripidae). Common Agric Appl Biol
6;3:201-204.
Alavo TBC, Sermann H, Bochow H. 2002. Biocontrol of aphid using Verticillium
lecanii in greenhouse: Factor reducing the effectiveness of the
entomopathogenic fungus. Arch Phytopathol and Plant Protect 34;6:407-424.
Altre JA, Vandenberg JD, Cantone FA (1999). Pathogenicity of Paecilomyces
fumosoroseus isolates to Diamondback Moth, Plutella xylostella:
Correlation with Spore Size, Germination Speed, and Attachment to Cuticle. J. Invertebr. Pathol. 73(3): 332-338.
[Anonim] 2007. Pathogen Serangga. Universitas Negeri Jember.
http://www.clearning.unej.ac.id/courses/PNH1653/document/PATOGEN_ SERANGGA.pdf?. 14 hal. [15 Maret 2011]
Baehaki SE, Noviyanti. 1993. Pengaruh umur biakan Metarhizium anisopliae strain lokal Sukamandi terhadap perkembangan wereng coklat. Prosiding.
Makalah Simposium Patologi Serangga. Yogyakarta, 12-13 Oktober 1993.
Pp. 113-124.
Baliadi, Y. 2007. Musuh alami, tanaman inang, dan pengendalian Aphis glycines dengan pestisida nabati di lahan kering masam Propinsi Lampung, p:461-472. Dalam Harnowo, D. et al. (eds) Peningkatan produksi Kacang-kacangan dan Umbi-umbian Mendukung Kemandirian Pangan. Puslitbangtan.
Blackman, R. L., and V. F. Easttop. 2000.Aphids on the Worlds Crops: An
Identification and Information Guide. Wiley, New York.
[BPS] Badan Pusat Statistik. 2010. (http://www.bps.go.id/tnmn_pgn.php?eng=0) [15 Maret 2011]
Chandler D, Heale JB, Gillespie AT (1993). Germination of the entomopathogenic fungus Verticillium lecanii on scales of the glasshouse whitefly Trialeurodes vaporariorum. Biocontrol Sci. Technol. 3: 161–164. Cloyd. 2003. The entomopathogen Verticillium lecanii. Midwest Biological
control News. University of Illionis.
http://www.extension.umn.Edu/distribution/horticulture/DG7373.html Ditlintan. 1997. Pedoman Rekomendasi Pengendalian Hama Terpadu Tanaman
Padi dan Palawija. Direktorat Bina Perlindungan Tanaman. 159 hlm. Feng, M.G., Johnson, J.B., Kish, and L.P. 1990. Virulence of Verticillium lecanii
and an Aphid-Derived Isolate of Beauveria bassiana (Fungi: Hyphomycetes) for Six Species of Cereal-Infesting Aphids (Homoptera:Aphididae) [abstrak]. Environ Entomol 19: 815-820(6)
Goettel MS and DW Robbet. 1992. Mass Production, Formulation and Field Application of Entomopathogenic Fungi In: Lomer, CJ and C Prior (Eds.). Biological Control of Locust and Grasshoppers. Wallingford, Oxon, UK, CAB, International, pp: 230-238.
Hardy, R. W. F. 1996. Ecologically Based Pest Management: New Solutions for a New Century. National Academy Press. Constitution Avenue, N. W. Wahington, D. C. 144 p.
Inglis DG, Goettel MS, Butt TM, Strasser H (2001). Use of hyphomycetous fungi for managing insect pests. In: T.M. Butt, N. Magan and C. Jacson, Editors, Fungi as Biocontrol Agents: Progress, Problems and Potential, CAB International, Wallingford, Oxon pp.23–69
Inglish, G.D., G.M. Duke, L.M. Kawchuk, and M.S. Goetetel. 1999. Influence of Oscillating Temperatures on The Infection and Colonization of The Migratory Grasshopper by Beauveria bassiana and Metarhizium
flavoviride. Biol. Control. 14:111-120.
Jackai, L.E.N., A.R. Panizzi, G.G. Kundu, and K. Srivastava. 1990. Insect pests of soybean in the tropics, p:91-156. In. S.R. Singh (ed). Insect Pests of Tropical Food Legumes. John Wiley & Sons, Chichester New York Brisbane Toronto Singapore.
Kaay GP and S Hassan. 2000. Entomogenous fungi as promising biopesticides for tick control. Exp. Applied Acarol 24: 913-926.
Kassa A. 2003. Development and testing of mycoinsecticides based on submerged apores and aerial conidia of the entomopathogenic fungi Beauveria
bassiana and Metarhizium anisopliae (Deuteromycotina: Hyponycetes)
for control of locust, Grasshoppers, and storage pest. [disertation]. Gottingen: http://wcdoc.sub.gwdg.de/diss/2003/kassa.pdf. [5 Juli 2011] Kauvelis VN, Zare R, Bridge PD, Typas MA. 1999. Differentation of
mitochondrial subgroups in the Verticillium lecanii species complex.
Letter in Appl Microbial 28:263-268.
Kurniawan T. 2010. Infektivitas cendawan entomopatogen Lecanicillium lecanii terhadap parasitoid telur Trichogrammatidae bactrae-bactrae Nagaraja (Hymenoptera: Trichogrammatidae) [skripsi]. Bogor: Institut Pertanian Bogor.
Liu H, Skinner M, Brownbridge M, Parker BL. 2003. Characterization of
Beauveria bassiana and Metarhizium anisopliae isolates for management
of tarnished plant bug Lygus lineolaris (Hemiptera: Miridae). J Invertebr
Pathol 82;3:139-147.
Marwoto, Suharsono, dan Supriyatin. 1999. Hama Kedelai dan Komponen Pengendalian Hama Terpadu. Monograf Balitkabi No.4-1999. 50 hlm. Moore, D. and C. Prior, 1993. The potential of mycoinsecticides. Biocontr. News
Inform.,14: 31-40.
Nakasuji, F., T. Ichikiwa, and F.X. Susilo. 1985. Insect pest and insect borne disease of soybean in Lampung. P:17-36. In: I Yamamoto and S.
31 Sosromarsono (eds.). Ecological impact pest management in indonesia. crop protection studies in the frame work of the agroecosystem. Tokyo Univ.Agric.
Norris, R.F., E.P. Caswell-Chen, and M. Kogan. 2003. Concept in Integrated Pest Management. Prentice Hall. Upper Saddle River, New Jersey. 586 p. Okada, T., W. Tengkano, and T. Djuwarso. 1988. An outline on soybean pest in
Indonesia in faunistict aspects. Seminar Balittan Bogor, 6 Desember, 1988. 37p.
Prayogo Y, Tengkano W, Marwoto. 2005. Prospek cendawan entomopatogen
Metarhizium anisopliae untuk mengendalikan ulat grayak Spodoptera litura pada kedelai. Jurnal Litbang Penelitian 24(1) [jurnal on-line].
http://pustaka.litbang.deptan.go.id/publikasi/p3241053.pdf [7 Nov 2011].
Prayogo, Y, Suharsono. 2005. Optimalisasi pengendalian hama penghisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium
lecanii. J. Litbang Pertanian: 24(4), Malang: Balitkabi.
Prayogo, Y. 2004. Keefektifan lima jenis cendawan entomopatogen terhadap hama penghisap polong kedelai Riptortus linearis (L.) (Hemiptera: Alydidae) dan dampaknya terhadap predator Oxyopes javanus Thorell (Araneida: Oxyopidae). [tesis]. Bogor: Sekolah Pascasarjana. Institut Pertanian Bogor.
Prayogo, Y. 2009. Kajian cendawan entomopatogen Lecanicillium lecanii (Zimm.) (Viegas) Zare & Gams untuk menekan perkembangan telur hama penghisap polong kedelai Riptortus linearis (F.) (Hemiptera: Alydidae). [disertasi]. Bogor. Sekolah Pascasarjana. Institut Pertanian Bogor.
Rauf A, Triwidodo H, Widodo. 1994. Penggunaan pestisida oleh petani kedelai di tingkat kabupaten di Jawa Barat. Seminar Nasional Peningkatan Produktivitas dan Kualitas Kedelai melalui Penerapan PHT Kedelai. Bappenas dan Fakultas Pertanian Universitas Brawijaya. 13 hlm.
Rohajati A. 1976. Biologi Aphis craccivora dan Aphis glycines Matsamura (Homoptera: Aphididae) pada Tiga Varietas Kedelai. Laporan masalah khusus, Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian-IPB. 73 hal.
Rutledge EC, O’neil RJ. 2006. Soybean Plant Stage and Population Growth of Soybean Aphid. J. Econ Entomol. 99(1): 60-66
Samuels RI, Coracini DLA. 2004. Selection of Beauveria bassiana and
Metarhizium anisopliae isolates for the control of Blissus antillus
(Hemiptera: Lygaenidae). Sci Agric 61;3:271-275.
Shah FA, Cheng SW, Tariq MB (2005). Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiol.
Shashi S, RBL, Gupta and CPR Yadava. 1999. Mass multiplication and formulation of entomopathogenic fungi and efficacy against whitegrubs. J.
Mycol. Plant Pathol 29: 299-305.
Shepard, M., E..F. Shepard, G.R. Carner, M.D. Hamming, A. Rauf, S.G. Turnipseed, and Samsudin. 1997. Prospects for IPM in secondary food crops. Presentation Made at the Kongres V dan Simposium Entomologi, PEI. Bandung, June 24-26, 1997. 31 p.
Sitch JC, Jackson CW. 1997. Pre-penetration events affecting host specificity of
Verticillium lecanii. Mycol Res 101:535-541.
Slack. 2011. NCERA200: Management strategies to control major soybean virus
disease in the north central region. NCERA200.
http://nimss.umd.edu/homepages/home.cfm?trackID=13296 [18 November 2011].
Soegiarto B, Okada, J. Soejitno. 1988. Studi Populasi Aphis glycines Matsamura (Homoptera: Aphididae) Pada Tanaman Kedelai. Seminar Hasil Penelitian Hama Kedelai. Balittan Bogor. 11 hal.
Sun, Z., P.Z. Tian, and J. Wang. 1990. Atudy on the uses of aphid-resistant character in wild soybean. I. Aphid resistance performance of F2 generation from crosses between-cultivated and wild soybean. Soybean
Genet. Newsl. 17:43-48.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego: Academic Press, INC. Harcourt Brace Jovanovich, Publisher.
Tengkano, W. dan M. Soehardjan. 1993. Jenis hama utama pada berbagai fase pertumbuhan tanaman kedelai, hlm 295-318. Dalam Somaatmadja, S., M. Ismunadji, Sumarno, M. Syam, S.O. Manurung, dan Yuswadi (Eds). Kedelai. Pusat penelitian dan Pengembangan Tanaman Pangan Bogor. Wagner BL, Lewis LC. 2000. Colonization of corn. Zea maize L. by
ENDOPHYTIC FUNGUS Beauveria bassiana (Balsamo) Vuillemin.
Environ Microbiol 66:3468-3473.
Wahyunendo, YD. 2002. Sporulasi cendawan entomopatogen beauveria bassiana (bals.) Vuill. Pada berbagai media alami dan viabilitasnya di bawah pengaruh suhu dan sinar matahari. [skripsi], Bogor. Institut Pertanian Bogor
Wang L. Huang J, You M, Liu B. 2004. Time-dose-mortality modeling and virulence indices for six strains of Verticillium lecanii against sweet potato whitefly Bemisia tabaci (Genadius). J Appl Entomol 128;7;494-500. Wang YR, Kritzman A, Hershman DE, Ghabrial SA. 2006. Aphis glycines as a
vector of persistently and nonpersistently transmitted viruses and potential risks for soybean and other crops. 90:7 [jurnal on-line]. http://www.blackwell-synergy.com/doi/abs/10.1111/j.1439-0418 [26 April 2010]
Wenzel et al. 2007. Performance of Lecanicillium lecanii on culture media containing vitamins and yeast extract concentrations. 66:3 [jurnal on-line].
33
http://www.blackwell-synergy.com/doi/abs/10.1111/j.1744-7348.2000.tb00075X [26 April 2010]
Willson, H.R. 1990. Soybean Pest Management. The OHIO STATE University Extension. 5 p. http://ohioline.osu.edu/icm-fact/fc-21.html
Wiyono Suryo. 2007. Perubahan iklim dan hama dan penyakit Tumbuhan.
Direktorat Perlindungan Tanaman Pangan.
http://www.agriculturesnetwork.org/magazines/indonesia/26-bertahan- menghadapi-perubahan-iklim/perubahan-iklim-pemicu-ledakan-hama-dan-penyakit/at_download/article_pdf [23 Juni 2011].
Zare R, Gams W. 2001. A revision of Verticillium sect. Prostrata. IV The genera