Lecanicillium lecanii TERHADAP PARASITOID TELUR
Trichogrammatoidea bactrae bactrae Nagaraja
(HYMENOPTERA: TRICHOGRAMMATIDAE)
TEGUH KURNIAWAN
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRACT
TEGUH KURNIAWAN. Infectivity of Entomopathogenic Fungus Lecanicillium lecanii to Egg Parasitoid Trichogrammatoidea bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae). Under direction of TEGUH SANTOSO and MARWOTO
Soybean is a high value agriculture’s comodity which can give many benefits. Soybean podborer Etiella zinckenella is one of important soybean pest in Indonesia that can decrease harvest until 80%. The control method using chemical insecticides are difficult to apply because the larva bore into soybean pod. The egg parasitoid Trichogrammatoidea bactrae bactrae can be used as alternative method to control the soybean podborer. On the other hand, on soybean plantation, the entomopathogenic fungus Lecanicillium lecanii is also used to control other soybean pests, especially against soybean pod sucker. The impact of this fungi toward the egg parasitoid T. bactrae bactrae is important to investigate. At conidial density 109/ml, L. lecanii could infect the egg of host Corcyra cephalonica that have been previously infested by parasitoid aged 1 to 6 days of infestation. At age 1 to 3 days post-infestation by parasitoid, there was no parasitoid exit from the egg, where as at age 4 to 8 days post-infestation T. bactrae bactrae adult emerged from the egg of C. Cephalonica. When directed against T. bactrae bactrae adult, spraying of 109conidia/ml killed 100% of tested parasitoid. With conidial density 109/ml, the lethal time 50 (LT50) L. lecanii
against T. bactrae bactrae was calculated 4 days.
ABSTRAK
TEGUH KURNIAWAN. Infektivitas Cendawan Entomopatogen Lecanicillium lecanii Terhadap Parasitoid Telur Trichogrammatoidea bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae). Dibimbing oleh TEGUH SANTOSO dan MARWOTO
Kedelai merupakan komoditas yang bernilai ekonomi tinggi dan banyak memberi manfaat. Penggerek polong Etiella zinckenella merupakan salah satu hama utama pada pertanaman kedelai di Indonesia yang dapat menurunkan hasil sampai 80%. Pengendalian menggunakan insektisida kimiawi sulit diaplikasikan karena perilaku hama yang menggerek ke dalam polong kedelai. Untuk itu, digunakan parasitoid telur Trichogrammatoidea bactrae bactrae sebagai agens hayati. Di sisi lain, telah dikembangkan agens hayati cendawan entomopatogen Lecanicillium lecanii untuk mengendalikan hama kedelai lain, terutama hama penghisap polong. Dengan demikian, perlu dilakukan suatu penelitian mengenai dampak cendawan L. lecanii terhadap T. bactrae bactrae. Cendawan L. lecanii dengan kerapatan konidia 109/ml mampu menginfeksi telur inang C. cephalonica yang telah terparasit T. bactrae bactrae pada umur infestasi telur 1-6 hari. Telur T. bactrae bactrae yang berhasil menetas dan imagonya keluar dari telur inang terjadi pada umur infestasi telur 4-8 hari, sedangkan pada umur infestasi telur 1-3 hari parasitoid tidak keluar. Penyemprotan suspensi konidia cendawan L. lecanii dengan kerapatan 109/ml memberikan pengaruh mortalitas terhadap imago T. bactrae bactrae sampai 100%. Berdasarkan hasil penelitian diketahui pada kerapatan konidia 109/ml cendawan L. lecanii mampu menginfeksi telur uji dan imago T. bactrae bactrae. Waktu LT50 cendawan L. lecanii pada kerapatan
konidia 109/ml dicapai ± 4 hari.
INFEKTIVITAS CENDAWAN ENTOMOPATOGEN
Lecanicillium lecanii TERHADAP PARASITOID TELUR
Trichogrammatoidea bactrae bactrae Nagaraja
(HYMENOPTERA: TRICHOGRAMMATIDAE)
TEGUH KURNIAWAN
Skripsi
sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Infektivitas Cendawan Entomopatogen Lecanicillium lecanii Terhadap Parasitoid Telur Trichogrammatoidea bactrae bactrae Nagaraja (Hymenoptera : Trichogrammatidae)
Nama Mahasiswa : Teguh Kurniawan
NRP : A34061294
Disetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. Teguh Santoso, DEA Prof (Riset). Dr. Marwoto NIP. 19570907 198003 1 006 NIP. 19520102 198101 1 001
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc NIP. 19640204 199002 1 002
PRAKATA
Puji syukur penulis panjatkan ke-hadirat Allah SWT, karena berkat rahmat dan karuniaNya sehingga penulis mampu menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada Dr. Ir. Teguh Santoso, DEA sebagai pembimbing dalam pembuatan skripsi ini, kemudian kepada Prof (Riset). Dr. Marwoto dan Dr. Ir. Yusmani Prayogo, MSi dari Balai Penelitian Tanaman Kacang-kacangan dan umbi-umbian (Balitkabi) Malang yang telah banyak memberikan bantuan sehingga skripsi ini dapat diselesaikan. Serta teman-teman yang telah banyak membantu dan memberikan dukungannya.
Penulis menyadari bahwa dalam skripsi ini masih banyak kekurangan baik dari segi isi dan penulisan. Untuk itu, diharapkan kritik dan sarannya demi peningkatan yang lebih baik. Semoga skripsi ini bisa bermanfaat dan menjadi acuan untuk penelitian berikutnya. Atas perhatiannya, penulis mengucapkan terima kasih.
Bogor, Juli 2010
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... . vii
DAFTAR GAMBAR ... . viii
DAFTAR LAMPIRAN ... . ix
PENDAHULUAN ... . 1
Latar Belakang ... 1
Tujuan Penelitian ... . 2
Manfaat Penelitian ... . 2
TINJAUAN PUSTAKA ... . 3
Permasalahan Hama Kedelai ... 3
Cara Pengendalian ... 3
Bioekologi Trichogramma spp ... . 5
Cendawan Entomopatogen Lecanicillium lecanii ... . 6
BAHAN DAN METODE ... . 8
Tempat dan Waktu Penelitian ... 8
Bahan ... . 8
Serangga Uji Trichogrammatoidea bactrae bactrae ... . 8
Cendawan Lecanicillium lecanii ... . 8
Metode ... . 9
Penyiapan Suspensi Konidia ... . 9
Perlakuan Serangga Uji ... 9
HASIL DAN PEMBAHASAN ... . 10
Pengaruh L. lecanii Terhadap Telur Inang yang Terparasit ... . 10
Pengaruh L. lecanii Terhadap Mortalitas Imago T. bactrae bactrae ... 13
KESIMPULAN DAN SARAN ... . 16
DAFTAR PUSTAKA ... . 17
PENDAHULUAN
Latar Belakang
Kedelai merupakan komoditas yang bernilai ekonomi tinggi dan banyak memberi manfaat. Selain digunakan sebagai bahan pangan, dapat juga dijadikan sebagai bahan baku industri dan pakan ternak. Salah satu kendala dalam peningkatan dan stabilisasi produksi kedelai di Indonesia adalah serangan hama (Tengkano dan Soehardjan 1985). Penggerek polong Etiella zinckenella Treitschke (Lepidoptera : Pyralidae) merupakan salah satu hama utama pada pertanaman kedelai di Indonesia, terutama pada sentra-sentra produksi (Tengkano et al 2007). Kehilangan hasil akibat serangan hama tersebut mencapai 80%, bahkan bisa mengakibatkan puso apabila tidak dikendalikan (Marwoto et al. 1999; Sumarno 1999).
Saat ini, petani masih banyak yang menggunakan insektisida kimiawi untuk mengendalikan hama tersebut. Namun kenyataannya pengendalian dengan cara tersebut sulit diaplikasikan karena perilaku hama yang menggerek ke dalam polong kedelai. Menurut Rauf et al (1994) pengendalian dengan insektisida kimiawi hasilnya kurang efektif dalam menekan serangan, bahkan berpotensi menimbulkan resurjensi terhadap hama. Untuk itu, perlu dicari alternatif pengendalian lain yang lebih efektif. Cara pengendalian yang berpeluang untuk dikembangkan adalah dengan menggunakan parasitoid. Hasil penelitian Mangundojo (1958, dalam Marwoto & Saleh 2003) menunjukkan bahwa pada telur Etiella spp. ditemukan parasitoid Trichogramma persunatum Relly (Hymenoptera: Trichogrammatidae). Selanjutnya Naito dan Djuwarso (1993) mengidentifikasi parasitoid tersebut sebagai Trichogrammatoidea bactrae bactrae Nagaraja. Pemanfaatan parasitoid telur sebagai agens hayati dalam pengendalian hama tersebut mempunyai prospek yang baik.
2
kedelai. Beberapa hama kedelai telah berhasil dikendalikan dengan bioinsektisida ini, salah satunya adalah penghisap polong kedelai Riptortus linearis L. (Hemiptera : Alydidae). Menurut Prayogo 2004, cendawan L. lecanii mampu menginfeksi semua stadia R. linearis yaitu stadia telur, nimfa, maupun imago. Aplikasi cendawan L. lecanii tersebut juga harus dikaji lebih jauh mengingat di areal yang sama juga dilepas parasitoid T. bactrae bactrae untuk mengendalikan hama penggerek polong. Dengan demikian, perlu dilakukan suatu penelitian mengenai dampak cendawan L. lecanii terhadap musuh alami dan serangga berguna lain yang ada di sekitar areal pertanaman. Hal ini dilakukan untuk menjaga kelestarian musuh alami tersebut, agar dapat bekerja secara optimal dalam membantu mengendalikan hama kedelai.
Tujuan Penelitian
Mempelajari infektivitas cendawan entomopatogen Lecanicillium lecanii terhadap parasitoid T. bactrae bactrae sebagai agens hayati.
Manfaat Penelitian
TINJAUAN PUSTAKA
Permasalahan Hama Kedelai
Seiring dengan berkembangnya industri makanan dan pakan ternak,
permintaan terhadap komoditas kedelai meningkat pesat. Untuk memenuhi
kebutuhan akan kedelai tersebut perlu ditingkatkan sasaran luas tanaman serta
produktivitasnya. Salah satu kendala utama dalam usaha meningkatkan produksi
kedelai adalah adanya serangan hama. Jenis hama yang menyerang tanaman
kedelai di Indonesia sangat banyak. Ada sekelompok hama yang hanya merusak
bagian tanaman tertentu, ada pula yang merusak hampir seluruh bagian tanaman.
Sementara itu ada yang kehadirannya hanya membahayakan pada fase tertentu
dan ada pula yang dapat merusak sepanjang pertumbuhan tanaman. Selain itu,
terdapat pula serangga yang imago dan larva atau nimfanya merusak tanaman.
Besar kecilnya pengaruh kerusakan tanaman dan kehilangan hasil akibat serangan
hama ditentukan beberapa faktor yaitu tinggi rendahnya populasi hama yang hadir
di pertanaman, bagian tanaman yang dirusak, tanggap tanaman terhadap serangan
hama, dan fase pertumbuhan tanaman/umur tanaman. Adapun hama-hama utama
pada tanaman kedelai yaitu lalat kacang (Ophiomyiia phaseoli), penggerek pucuk kedelai (Melanagromyza dolichostigma), penggerek batang kedelai
(Melanagromyza sojae), ulat grayak (Spodoptera litura), ulat jengkal
(Chrysodexis chalcites), penggulung daun (Lamprosema indicata), penggerek
polong (Etiella zinknella), penghisap polong (Riptortus linearis), kepik hijau
(Nezara viridula), penghisap polong (Piezodorus hubneri) (Marwoto et. al, 1999)
Cara Pengendalian
Pemantauan di sentra produksi kedelai menunjukkan bahwa pengendalian
hama kedelai masih tertumpu pada penggunaan insektisida. Pada daerah yang
petaninya mempunyai modal yang cukup hampir 90% petani menggunakan
4
daerah yang petaninya kurang modal hanya 50% petani menggunakan insektisida.
Namun demikian cara aplikasi insektisida masih belum sesuai dengan ketentuan.
Di beberapa daerah ada yang sangat intensif memakai insektisida dengan dosis
dan frekuensi yang tinggi tetapi ada pula yang menggunakan insektisida dengan
dosis di bawah yang dianjurkan. Kedua cara tersebut berdampak negatif, hama
tidak dapat terkendali dengan baik akibatnya timbul masalah resistensi dan
resurgensi pada hama sasaran (Marwoto 2007).
Dengan memahami konsepsi Pengendalian Hama Terpadu (PHT), maka
pendekatan dalam memilih strategi pengendalian hama akan bertumpu pada
pemanfaatan kombinasi yang kompatibel dari komponen pengendalian yang
dipilih. PHT pada kedelai membatasi penggunaan insektisida kimiawi serta
menghindari terjadinya ketahanan dan resurjensi hama terhadap insektisida dan
dampak buruk penggunaan insektisida terhadap serangga berguna serta kesehatan
manusia dan lingkungan. Adapun cara pengendaliannya didasarkan pada
komponen-komponen PHT yang tersedia. Untuk mengatasi hama perusak bibit
dapat dilakukan dengan cara melakukan penanaman secara serentak, sanitasi
tanaman terserang, pergiliran tanaman dengan tanaman lain, menutup
lubang-lubang dengan jerami (mulsa), dan pemanfaatan agens hayati. Pengendalian
terhadap hama perusak daun adalah dengan mengupayakan agar periode vegetatif
dapat dilakukan serempak dalam areal luas, pada derah kronis dapat dilakukan
pengolahan tanah untuk mematikan hama yang berada dalam tanah, serta
pemanfaatan serangga berguna yang ada di pertanaman. Pengendalian hama
perusak polong dilakukan dengan cara pergiliran tanaman, melakukan penanaman
secara serentak, penggunaan tanaman perangkap, dan pemanfaatan musuh alami
yang ada di sekitar areal pertanaman. Contoh pengendalian yang telah dilakukan
Bioekologi Trichogramma spp.
Trichogrammatidae berasal dari bahasa Yunani kuno thriks atau trihos yang artinya rambut, dan grammata yang artinya gambar atau huruf. Disebut demikian
karena adanya keteraturan (susunan) rambut pada sayap. (Pracaya, 2005)
Parasit ini kecil, panjangnya 0,3-1,0 mm; warnanya hitam, hitam pucat,
cokelat pucat atau kuning. Antenanya terdiri dari 3-8 ruas termasuk satu ruas
cincin. Sayapnya berumbai-rumbai rambut (bulu-bulu) teratur dalam garis-garis
atau pita-pita rambut, yang terpanjang terdapat pada tepi sayap. Ovipositornya
pendek, kadang-kadang matanya berwarna merah.
Populasi parasitoid Trichogramma spp. dipengaruhi oleh keberadaan inang
dan lingkungan pertanaman (suhu, cuaca, udara). Populasi inang yang rendah
menyebabkan parasitoid tidak dapat berkembang. Demikian pula jika lingkungan
kurang mendukung, parasitoid tidak dapat berperan secara efektif. Naito dan
Djuwarso (1993) menyatakan bahwa daya tahan hidup T. bactrae-bactrae
mencapai 90% pada kisaran suhu 25−400C. Seekor parasitoid Trichogramma spp.
mampu memarasit lebih dari satu spesies telur inang, dan sebutir telur inang dapat
diparasit oleh lebih dari satu spesies Trichogramma spp. Hal ini menunjukkan
bahwa satu spesies Trichogramma spp. mampu memarasit beberapa spesies hama.
Parasitoid telur Trichogramma spp. bersifat polifag. Jenis inang parasitoid ini
meliputi telur Chilo suppressalis (WLK), Chrysodeixis chalcites (Esper), dan Heliothis assulta GN. T. bactrae-bactrae dapat memarasit telur penggerek polong Etiella spp., telur ulat buah kedelai Helicoverpa armigera, dan telur ulat jengkal Chrysodeixis chalsites. Pelepasan parasitoid Trichogramma spp. di lapang untuk mengendalikan hama terutama hama dari kelompok Lepidoptera. Pada tanaman
kedelai, sebagian besar hama penting didominasi oleh kelompok Lepidoptera.
(Pracaya, 2005)
Sumber : www.insectimages.org
6
Cendawan Entomopatogen Lecanicillium lecanii
Cendawan dari divisi Deuteromycotina merupakan cendawan yang memiliki
siklus tidak sempurna atau biasa disebut imperfect fungi. Cendawan
entomopatogen dari divisi Deuteromycotina dibagi menjadi dua kelas, yaitu kelas
Hyphomycetes dan Coelomycetes. Banyak cendawan dari kelas tersebut yang
memiliki daya virulen yang tinggi dan telah banyak diaplikasikan untuk
mengendalikan serangga hama.
Cendawan Lecanicillium lecanii termasuk dalam divisi Deuteromycotina
kelas Hyphomycetes. Cendawan L. lecanii dapat digunakan untuk mengendalikan
serangga hama terutama dari ordo Homoptera (Cloyd 2003) dan Hemiptera
(Prayogo 2004). Cendawan L. lecanii mudah tumbuh pada berbagai media,
terutama pada medium potato dextrose agar (PDA) dan beras. Di dalam cawan
petri, diameter koloni dapat mencapai 4–5,5 cm pada 3 hari setelah inokulasi.
Koloni cendawan berwarna putih pucat. Dua hari setelah inokulasi, cendawan
sudah mampu memproduksi konidia. Kumpulan konidia ditopang oleh tangkai
konidiofor yang membentuk pialid (whorls) seperti huruf V. Setiap konidia
menopang 5-10 konidia yang terbungkus dalam kantong lendir. Konidia
berbentuk silinder hingga elip, terdiri dari satu sel, tidak berwarna dan berukuran
2,30-10×1-2,60 µm.
Cendawan entomopatogen memerlukan kelembaban yang tinggi untuk
tumbuh dan berkembang, hal tersebut diperlukan selama proses pembentukan
tabung kecambah (germ tube), sebelum terjadi penetrasi ke integumen serangga.
Cendawan L. lecanii tumbuh baik pada suhu 18-30oC dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% cendawan tumbuh sangat baik (Cloyd
2003). Cendawan V. lecanii mampu hidup pada bahan organik yang mati dalam
rentang waktu yang sangat panjang (Tanada dan Kaya 1993).
Keefektifan cendawan entomopatogen dipengaruhi oleh waktu aplikasi.
Waktu aplikasi perlu diperhatikan karena cendawan entomopatogen sangat rentan
terhadap sinar matahari khususnya sinar ultra violet (Cloyd 2003). Bila terkena
sinar matahari dalam waktu 4 jam, cendawan L. lecanii akan kehilangan viabilitas
atas 50%. Oleh karena itu, bila cendawan diaplikasikan pada musim kemarau
perlu dihindarkan dari sinar matahari langsung dan sebaiknya aplikasi dilakukan
pada saat kelembaban udara tinggi yaitu sore hari (Suharsono dan Prayogo 2005).
Aplikasi L. lecanii pada sore hari (setelah pukul 16.00) mampu menyebabkan kematian hama pengisap polong kedelai R. linearis hingga 80%. Makin tinggi
mortalitas serangga, jumlah biji yang rusak pun makin menurun (Prayogo 2004).
Keberhasilan pengendalian hama dengan cendawan entomopatogen juga
ditentukan oleh konsentrasi cendawan yang diaplikasikan, yaitu kerapatan konidia
dalam setiap ml air. Jumlah konidia berkaitan dengan banyaknya biakan
cendawan yang dibutuhkan setiap hektar. Kerapatan konidia yang dibutuhkan
untuk mengendalikan hama bergantung pada jenis dan populasi hama yang akan
dikendalikan (Wikardi 1993). Pada tanaman pangan, kerapatan konidia yang
dibutuhkan lebih tinggi dibandingkan dengan pada tanaman perkebunan.
Miselium cendawan L. lecanii menghasilkan racun cyclodepsipeptide,
bassianolide, yang juga dihasilkan oleh Beauveria bassiana. Selain itu,
menghasilkan pula racun insektisida, seperti asam dipicolinic dan C25
coumpounds (Suharsono dan Prayogo 2005).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Patologi Serangga dan
Laboratorium Bioekologi Parasitoid dan Predator Departemen Proteksi Tanaman,
Fakultas Pertanian, Institut Pertanian Bogor dari bulan Februari sampai Juli 2010.
Bahan
Serangga uji Trichogrammatoidea bactrae bactrae
Parasitoid T. bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae)
diperbanyak pada telur inang alternatif Corcyra cephalonica (Stt.) (Lepidoptera :
Pyralidae). Imago parasitoid dimasukkan dalam tabung reaksi berisi kertas pias
berukuran 2 cm x 1 cm yang telah ditempeli telur inang C. cephalonica. Telur
inang ditempelkan ke kertas pias menggunakan gom arab. Telur akan terparasit
setelah empat hari. Ciri telur yang terparasit berwarna hitam, lalu dalam kurun
waktu ± 7-8 hari imago parasitoid keluar dari telur.
Cendawan Lecanicillium lecanii
Cendawan diperbanyak dengan cara inokulasi biakan cendawan L. lecanii
koleksi Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian (Balitkabi)
pada media PDA di dalam cawan petri. Kemudian disimpan di dalam incubator
Metode
Penyiapan suspensi konidia
Konidia cendawan L. lecanii dipanen pada umur 21 HSI (Hari Setelah
Inokulasi) dengan cara memotong media PDA yang berisi konidia cendawan, lalu
menumbuknya dengan mortar hingga halus. Kemudian dimasukkan ke dalam
erlenmeyer yang berisi air steril yang telah dicampur Tween 20 (0,05%),
selanjutnya dikocok menggunakan vortex selama 30 detik. Setelah itu, hancuran
media diendapkan dengan menggunakan sentrifuse sampai didapatkan supernatan.
Supernatan dikocok kembali dengan vortex dan diamati kerapatan konidianya
menggunakan haemocytometer Neubauer-improved hingga diperoleh kerapatan konidia 109/ml.
Perlakuan serangga uji
Suspensi konidia cendawan L. lecanii (kerapatan 109/ml) disemprotkanke
telur C. cephalonica pada kertas pias yang telah terparasit dalam berbagai stadia infestasi parasitoid. Dalam satu tabung reaksi diletakkan sepotong kertas pias
yang mengandung telur inang yang telah terparasit. Pada satu kertas pias terdapat
kurang lebih 20 butir telur inang C. cephalonica. Stadia infestasi parasitoid pada
telur yang digunakan yaitu umur infestasi telur 1 hari, 2 hari, 3 hari, 4 hari, 5 hari,
6 hari, 7 hari, dan 8 hari (telur akan menetas). Aplikasi dilakukan juga pada imago
T. bactrae bactrae. Aplikasi penyemprotan menggunakan sprayer tangan dengan volume semprot ± 5 ml. Aplikasi diulang sebanyak tiga kali.
Pengamatan dilakukan pada dua hari setelah aplikasi. Variabel yang diamati
yaitu jumlah telur inang C. cephalonica yang terinfeksi cendawan L. lecanii,
presentase imago parasitoid yang keluar setelah telur terinfeksi cendawan L.
lecanii, dan persentase imago parasitoid mati yang terinfeksi cendawan L. lecanii.
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL), data diolah
menggunakan program SAS (Statistic Analysis System) versi 6.12, dilanjutkan
HASIL DAN PEMBAHASAN
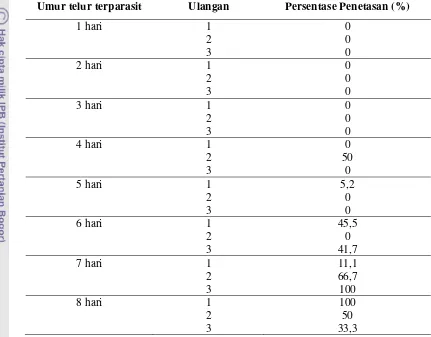
Pengaruh L. lecanii Terhadap Telur Inang yang Terparasit
Cendawan L. lecanii dengan kerapatan konidia 109/ml mampu menginfeksi telur inang C. cephalonica yang telah terparasit T. bactrae bactrae pada umur infestasi telur 1-6
hari. Pada tujuh dan delapan hari setelah telur inang terparasit, tidak terjadi infeksi oleh
cendawan. Infeksi cendawan pada telur inang mulai terjadi pada waktu dua hari setelah
perlakuan (HSP). Pada umur infestasi telur tujuh dan delapan hari, tampak infeksi
cendawan pada telur tersebut tetapi imago T. bactrae bactrae berhasil keluar dari telur
inang yang terparasit tersebut. Perkembangan cendawan L. lecanii yang diaplikasikan
mulai terjadi dua hari setelah perlakuan. Infeksi cendawan antara umur infestasi telur enam
hari dengan umur infestasi telur 1-5 hari terlihat berbeda nyata. Perkembangan cendawan
mulai tinggi pada umur infestasi telur 1-5 hari (Tabel 1).
Ciri-ciri telur inang yang terinfeksi cendawan L. lecanii adalah telur tersebut
terkoloni oleh miselium cendawan berwarna putih. Mula-mula miselium cendawan hanya
pada bagian permukaan telur saja, tetapi lama-kelamaan miselium cendawan tersebut
menyebar ke seluruh bagian telur, sehingga seluruh bagian telur tertutupi oleh hifa
cendawan tersebut. Miselia cendawan yang dihasilkan pun telah banyak dan menembus
sampai ke dalam telur (Gambar 4).
Tabel 1 Persentase telur inang C. cephalonica yang terinfeksi cendawan L. lecanii pada dua hari setelah aplikasi
Ulangan Telur inang yang terinfeksi cendawan (%) Umur infestasi telur oleh parasitoid (hari)
1 2 3 4 5 6 7 8
1 100 100 100 100 85 60 0 0
2 3 100 100 100 100 100 100 90 100 100 100 100 30 0 0 0 0
Rata-rata1 100 a 100 a 100 a 96,67 a 95 a 63,33 b 0 c 0 c
Kontrol 0 0 0 0 0 0 0 0
1
Gambar 4 Telur C. cephalonica yang terparasit T. bactrae bactrae (warna hitam) dan
terinfeksi cendawan L. lecanii (warna putih)
Telur T. bactrae bactrae yang berhasil menetas dan imagonya keluar dari telur inang
terjadi pada infestasi umur telur 4-8 hari, sedangkan pada umur infestasi telur 1-3 hari
parasitoid tidak keluar. Persentase parasitoid keluar tertinggi pada umur infestasi telur
delapan hari, ini menunjukkan umur infestasi telur yang telah terparasit delapan hari belum
sempat terinfeksi cendawan, sama halnya dengan umur infestasi telur tujuh hari.
Umumnya cendawan menginfeksi telur inang dua hari setelah perlakuan. Setelah dua hari
perlakuan penetasan telur inang yang terparasit mengalami penurunan yang signifikan. Ini
disebabkan cendawan telah banyak mengkoloni telur, sehingga menurunkan daya
penetasan telur bahkan membuat telur tidak menetas (Tabel 2). Hasil penelitian Prayogo
(2004) menunjukkan bahwa cendawan L. lecanii mampu menginfeksi telur R. linearis,
sehingga telur yang tidak menetas mencapai 59%. Walaupun telur mampu menetas
membentuk nimfa instar I, kelangsungan hidup nimfa hanya 21%.
Diduga selain menginfeksi telur inang C. cephalonica, cendawan L. lecanii juga
menginfeksi telur parasitoid T. bactrae bactrae sehingga parasitoid tidak berkembang.
Kemungkinan lain adalah meskipun telur parasitoid T. bactrae bactrae berhasil menetas,
larva parasitoid tersebut ikut terinfeksi cendawan. Seandainya tidak terinfeksi cendawan,
larva parasitoid tidak mendapatkan makanan yang memadai karena telur inang telah
terinfeksi cendawan. Diperlukan penelitian lanjutan untuk mengkaji permasalahan infeksi
pada parasitoid ini. Masa rentan telur terhadap infeksi cendawan L. lecanii terjadi pada
umur infestasi telur 1-3 hari, diduga ini disebabkan T. bactrae bactrae belum berkembang
di dalam telur inang (belum terlihat telur terparasit). Biasanya telur inang mulai terparasit
12
berwarna hitam pucat, namun lama kelamaan akan makin hitam pekat. Tampaknya
cendawan L. lecanii memiliki pengaruh infeksi yang cukup signifikan pada umur infestasi
telur 1-6 hari, sedangkan umur infestasi telur 7-8 hari tidak terlalu terpengaruh infeksi
(Gambar 5).
Tabel 2 Persentase imago parasitoid telur T. bactrae bactrae yang keluar dari telur inang yang telah diaplikasi cendawan L. lecanii
Ulangan Persentase kemunculan imago parasitoid (%)
Umur infestasi telur oleh parasitoid (hari)
1 2 3 4 5 6 7 8
1 0 0 0 0 5,2 45,5 11,7 100
2 3 0 0 0 0 0 0 50 0 0 0 0 41,7 66,7 100 50 33,3 Rata-rata1 0 c 0 c 0 c 16,67 c 1,73 c 29,07 bc 59,27 b 61,10 b
Kontrol 100 100 100 100 100 100 100 100
1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan α = 0,05
Pengaruh L. lecanii Terhadap Mortalitas Imago T. bactrae bactrae
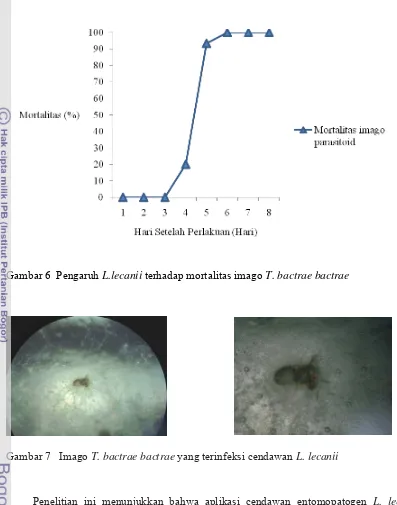
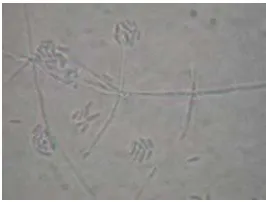
Pengamatan terhadap mortalitas imago T. bactrae bactrae yang terinfeksi cendawan
L. lecanii dilakukan selama delapan hari. Penyemprotan suspensi konidia cendawan L. lecanii dengan kerapatan 109/ml memberikan pengaruh mortalitas terhadap imago T. bactrae bactrae sampai 100% (seluruh imago T. bactrae bactrae mati terinfeksi cendawan L. lecanii). Mortalitas imago T. bactrae bactrae akibat terinfeksi cendawan L. lecanii mulai terjadi pada empat HSP (Hari Setelah Perlakuan) dengan tingkat mortalitas sebesar
20%. Waktu mortalitas terhadap infeksi cendawan didapat dengan mencari nilai LT50nya.
Adapun nilai LT50 yang didapat yaitu sebesar 3,99 (Tabel 3). Hal ini menunjukkan bahwa
waktu kematian 50% serangga uji dengan menggunakan kerapatan konidia cendawan L.
lecanii 109/ml yaitu sekitar empat hari setelah perlakuan. Tingkat mortalitas kemudian
meningkat tajam pada 5-8 HSP (Gambar 6)
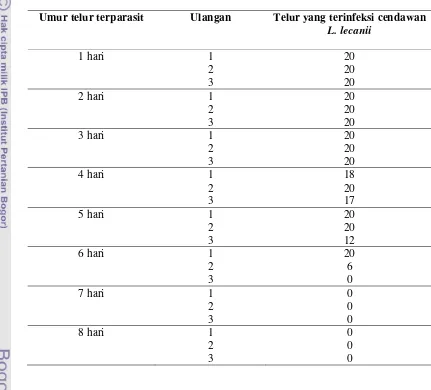
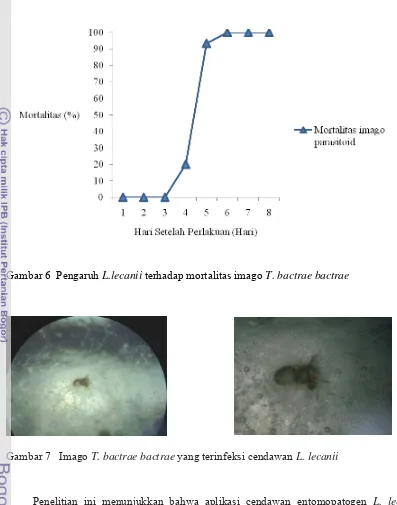
Adapun ciri-ciri dari imago dari T. bactrae bactrae yang terinfeksi cendawan L.
lecanii yaitu spora cendawan menyebar 4-6 hari setelah infeksi. Sporulasi terjadi pada
tungkai, antena, tetapi jarang terjadi pada thorax dan abdomen. Hal ini bisa dilihat dari
hifa-hifa cendawan berwarna putih yang terus berkembang sampai menutupi seluruh
bagian tubuh parasitoid tersebut (Gambar 7).
Tabel 3 Persentase mortalitas imago T. bactrae bactrae yang terinfeksi cendawan L. lecanii
Ulangan Persentase Mortalitas imago T. bactrae bactrae (%)
Hari Setelah Perlakuan (HSP)
1 2 3 4 5 6 7 8
1 0 0 0 10 80 100 100 100
2 0 0 0 30 100 100 100 100
3 0 0 0 20 100 100 100 100
Rata-rata1 0 c 0 c 0 c 20 b 93,33 a 100 a 100 a 100 a
Kontrol 0 0 0 0 0 0 0 0
LT50 3,99
1
14
Gambar 6 Pengaruh L.lecanii terhadap mortalitas imago T. bactrae bactrae
Gambar 7 Imago T. bactrae bactrae yang terinfeksi cendawan L. lecanii
Penelitian ini menunjukkan bahwa aplikasi cendawan entomopatogen L. lecanii
dapat berdampak negatif terhadap imago parasitoid T. bactrae bactrae yang juga
dilepaskan di habitat yang sama. Namun demikian, percobaan ini perlu dilanjutkan di
lapangan mengingat cendawan L. lecanii bekerja secara kontak, sedangkan imago T.
bactrae bactrae adalah parasitoid yang ukurannya sangat kecil. Peluang kontak antara
Kesimpulan
1. Cendawan Lecanicillium lecanii mampu menginfeksi telur Corcyra cephalonica yang telah diparasit oleh Trichogramma bactrae bactrae pada umur infestasi telur 1-6 hari.
2. Pada kerapatan konidia 109/ml, cendawan L. lecanii mampu menginfeksi imago parasitoid T. bactrae bactrae setelah empat HSP (Hari Setelah Perlakuan).
3. Waktu LT50 cendawan L. lecanii pada kerapatan konidia 109/ml dicapai
kurang lebih empat hari.
Saran
DAFTAR PUSTAKA
Cloyd. 2003. The entomopathogen Verticillium lecanii. Midwest Biological Control News. University of Illinois. http://www.extension.umn. Edu/distribution/horticulture/DG7373.html [27 Juli 2010].
Marwoto. 2007. Dukungan pengendalian hama terpadu dalam program bangkit kedelai. Iptek Tanaman Pangan. Vol. 2. Malang: Balitkabi
Marwoto, Saleh N. 2003. Peningkatan peran parasitoid telur Trichogrammatoidea bactrae bactrae dalam pengendalian penggerek polong kedelai Etiella spp. Jurnal Litbang Pertanian: 22(4), Malang: Balitkabi
Marwoto, Suharsono, dan Supriyatin. 1999. Hama kedelai dan komponen pengendalian hama terpadu. Monograf Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Malang (4): 1−50.
Naito A., Djuwarso T. 1993. Biological control of Etiella pod borer. Makalah Simposium Penelitian Tanaman Pangan III. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. 8 pp.
Pracaya. 2005. Hama dan Penyakit Tanaman. Jakarta: Penebar Swadaya
Prayogo Y. 2004. Keefektifan lima jenis cendawan entomopatogen terhadap hama pengisap polong kedelai Riptortus linearis L. (Hemiptera: Alydidae) dan dampaknya terhadap predator Oxyopes javanus Thorell (Araneida: Oxyopidae). [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. 51 hlm.
Prayogo Y, Suharsono. 2005. Optimalisasi pengendalian hama penghisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium lecanii. Jurnal Litbang Pertanian: 24(4), Malang: Balitkabi
Rauf A, Triwidodo H, Widodo. 1994. Penggunaan pestisida oleh petani kedelai di tingkat kabupaten di Jawa Barat. Seminar Nasional Peningkatan Produktivitas dan Kualitas Kedelai melalui Penerapan PHT Kedelai. Bappenas dan Fakultas Pertanian Universitas Brawidjaja. 13 hlm.
Sumarno. 1999. Strategi pengembangan produksi kedelai nasional mendukung Gema Palagung 2001. Prosiding Lokakarya Pengembangan Produksi Kedelai Nasional, Bogor 16 Maret 1999. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. hlm. 7−22.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego: Academic Press, INC. Harcourt Brace Jovanovich, Publisher
Tengkano W, Supriyatin, Suharsono, Bedjo, Prayogo Y., dan Purwantoro. 2007. Status hama kedelai dan musuh alami di lahan kering masam Lampung. Iptek Tanaman Pangan 2(1): 93−109.
Wikardi W, Rayati DJ. 1993. Pengaruh Frekuensi Penyemprotan Jamur Entomopatogenik terhadap Ulat Jengkal (Ectropis bhurmitra) di Perkebunan Teh. hlm 91−103. Di dalam: Yusmani P, editor. Optimalisasi pengendalian hama penghisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium lecanii. Jurnal litbang pertanian: 24(4). Malang: Balitkabi
LAMPIRAN
Tabel 1. Jumlah Telur Inang Terparasit yang Terinfeksi Cendawan Lecanicillium lecanii
Umur telur terparasit Ulangan Telur yang terinfeksi cendawan L. lecanii
1 hari 1 20
2 20
3 20
2 hari 1 20
2 20
3 20
3 hari 1 20
2 20
3 20
4 hari 1 18
2 20
3 17
5 hari 1 20
2 20
3 12
6 hari 1 20
2 6
3 0
7 hari 1 0
2 0
3 0
8 hari 1 0
2 0
Tabel 2. Presentase Trichogrammatoidea bactrae bactrae yang Menetas Pada Telur Inang Terparasit dan Terinfeksi Cendawan Lecanicillium lecanii
Umur telur terparasit Ulangan Persentase Penetasan (%)
1 hari 1 0
2 0
3 0
2 hari 1 0
2 0
3 0
3 hari 1 0
2 0
3 0
4 hari 1 0
2 50
3 0
5 hari 1 5,2
2 0
3 0
6 hari 1 45,5
2 0
3 41,7
7 hari 1 11,1
2 66,7
3 100
8 hari 1 100
2 50
21
Tabel 3. Jumlah Imago Trichogrammatoidea bactrae bactrae yang Terinfeksi
Cendawan Lecanicillium lecanii
Pengamatan (hari) Ulangan Imago yang terinfeksi cendawan L. lecanii
1 hari 1 0
2 0
3 0
2 hari 1 0
2 0
3 0
3 hari 1 1
2 3
3 2
4 hari 1 8
2 10
3 10
5 hari 1 10
2 10
3 10
6 hari 1 10
2 10
3 10
7 hari 1 10
2 10
3 10
8 hari 1 10
2 10
3 10
Lecanicillium lecanii TERHADAP PARASITOID TELUR
Trichogrammatoidea bactrae bactrae Nagaraja
(HYMENOPTERA: TRICHOGRAMMATIDAE)
TEGUH KURNIAWAN
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRACT
TEGUH KURNIAWAN. Infectivity of Entomopathogenic Fungus Lecanicillium lecanii to Egg Parasitoid Trichogrammatoidea bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae). Under direction of TEGUH SANTOSO and MARWOTO
Soybean is a high value agriculture’s comodity which can give many benefits. Soybean podborer Etiella zinckenella is one of important soybean pest in Indonesia that can decrease harvest until 80%. The control method using chemical insecticides are difficult to apply because the larva bore into soybean pod. The egg parasitoid Trichogrammatoidea bactrae bactrae can be used as alternative method to control the soybean podborer. On the other hand, on soybean plantation, the entomopathogenic fungus Lecanicillium lecanii is also used to control other soybean pests, especially against soybean pod sucker. The impact of this fungi toward the egg parasitoid T. bactrae bactrae is important to investigate. At conidial density 109/ml, L. lecanii could infect the egg of host Corcyra cephalonica that have been previously infested by parasitoid aged 1 to 6 days of infestation. At age 1 to 3 days post-infestation by parasitoid, there was no parasitoid exit from the egg, where as at age 4 to 8 days post-infestation T. bactrae bactrae adult emerged from the egg of C. Cephalonica. When directed against T. bactrae bactrae adult, spraying of 109conidia/ml killed 100% of tested parasitoid. With conidial density 109/ml, the lethal time 50 (LT50) L. lecanii
against T. bactrae bactrae was calculated 4 days.
ABSTRAK
TEGUH KURNIAWAN. Infektivitas Cendawan Entomopatogen Lecanicillium lecanii Terhadap Parasitoid Telur Trichogrammatoidea bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae). Dibimbing oleh TEGUH SANTOSO dan MARWOTO
Kedelai merupakan komoditas yang bernilai ekonomi tinggi dan banyak memberi manfaat. Penggerek polong Etiella zinckenella merupakan salah satu hama utama pada pertanaman kedelai di Indonesia yang dapat menurunkan hasil sampai 80%. Pengendalian menggunakan insektisida kimiawi sulit diaplikasikan karena perilaku hama yang menggerek ke dalam polong kedelai. Untuk itu, digunakan parasitoid telur Trichogrammatoidea bactrae bactrae sebagai agens hayati. Di sisi lain, telah dikembangkan agens hayati cendawan entomopatogen Lecanicillium lecanii untuk mengendalikan hama kedelai lain, terutama hama penghisap polong. Dengan demikian, perlu dilakukan suatu penelitian mengenai dampak cendawan L. lecanii terhadap T. bactrae bactrae. Cendawan L. lecanii dengan kerapatan konidia 109/ml mampu menginfeksi telur inang C. cephalonica yang telah terparasit T. bactrae bactrae pada umur infestasi telur 1-6 hari. Telur T. bactrae bactrae yang berhasil menetas dan imagonya keluar dari telur inang terjadi pada umur infestasi telur 4-8 hari, sedangkan pada umur infestasi telur 1-3 hari parasitoid tidak keluar. Penyemprotan suspensi konidia cendawan L. lecanii dengan kerapatan 109/ml memberikan pengaruh mortalitas terhadap imago T. bactrae bactrae sampai 100%. Berdasarkan hasil penelitian diketahui pada kerapatan konidia 109/ml cendawan L. lecanii mampu menginfeksi telur uji dan imago T. bactrae bactrae. Waktu LT50 cendawan L. lecanii pada kerapatan
konidia 109/ml dicapai ± 4 hari.
PENDAHULUAN
Latar Belakang
Kedelai merupakan komoditas yang bernilai ekonomi tinggi dan banyak memberi manfaat. Selain digunakan sebagai bahan pangan, dapat juga dijadikan sebagai bahan baku industri dan pakan ternak. Salah satu kendala dalam peningkatan dan stabilisasi produksi kedelai di Indonesia adalah serangan hama (Tengkano dan Soehardjan 1985). Penggerek polong Etiella zinckenella Treitschke (Lepidoptera : Pyralidae) merupakan salah satu hama utama pada pertanaman kedelai di Indonesia, terutama pada sentra-sentra produksi (Tengkano et al 2007). Kehilangan hasil akibat serangan hama tersebut mencapai 80%, bahkan bisa mengakibatkan puso apabila tidak dikendalikan (Marwoto et al. 1999; Sumarno 1999).
Saat ini, petani masih banyak yang menggunakan insektisida kimiawi untuk mengendalikan hama tersebut. Namun kenyataannya pengendalian dengan cara tersebut sulit diaplikasikan karena perilaku hama yang menggerek ke dalam polong kedelai. Menurut Rauf et al (1994) pengendalian dengan insektisida kimiawi hasilnya kurang efektif dalam menekan serangan, bahkan berpotensi menimbulkan resurjensi terhadap hama. Untuk itu, perlu dicari alternatif pengendalian lain yang lebih efektif. Cara pengendalian yang berpeluang untuk dikembangkan adalah dengan menggunakan parasitoid. Hasil penelitian Mangundojo (1958, dalam Marwoto & Saleh 2003) menunjukkan bahwa pada telur Etiella spp. ditemukan parasitoid Trichogramma persunatum Relly (Hymenoptera: Trichogrammatidae). Selanjutnya Naito dan Djuwarso (1993) mengidentifikasi parasitoid tersebut sebagai Trichogrammatoidea bactrae bactrae Nagaraja. Pemanfaatan parasitoid telur sebagai agens hayati dalam pengendalian hama tersebut mempunyai prospek yang baik.
kedelai. Beberapa hama kedelai telah berhasil dikendalikan dengan bioinsektisida ini, salah satunya adalah penghisap polong kedelai Riptortus linearis L. (Hemiptera : Alydidae). Menurut Prayogo 2004, cendawan L. lecanii mampu menginfeksi semua stadia R. linearis yaitu stadia telur, nimfa, maupun imago. Aplikasi cendawan L. lecanii tersebut juga harus dikaji lebih jauh mengingat di areal yang sama juga dilepas parasitoid T. bactrae bactrae untuk mengendalikan hama penggerek polong. Dengan demikian, perlu dilakukan suatu penelitian mengenai dampak cendawan L. lecanii terhadap musuh alami dan serangga berguna lain yang ada di sekitar areal pertanaman. Hal ini dilakukan untuk menjaga kelestarian musuh alami tersebut, agar dapat bekerja secara optimal dalam membantu mengendalikan hama kedelai.
Tujuan Penelitian
Mempelajari infektivitas cendawan entomopatogen Lecanicillium lecanii terhadap parasitoid T. bactrae bactrae sebagai agens hayati.
Manfaat Penelitian
TINJAUAN PUSTAKA
Permasalahan Hama Kedelai
Seiring dengan berkembangnya industri makanan dan pakan ternak,
permintaan terhadap komoditas kedelai meningkat pesat. Untuk memenuhi
kebutuhan akan kedelai tersebut perlu ditingkatkan sasaran luas tanaman serta
produktivitasnya. Salah satu kendala utama dalam usaha meningkatkan produksi
kedelai adalah adanya serangan hama. Jenis hama yang menyerang tanaman
kedelai di Indonesia sangat banyak. Ada sekelompok hama yang hanya merusak
bagian tanaman tertentu, ada pula yang merusak hampir seluruh bagian tanaman.
Sementara itu ada yang kehadirannya hanya membahayakan pada fase tertentu
dan ada pula yang dapat merusak sepanjang pertumbuhan tanaman. Selain itu,
terdapat pula serangga yang imago dan larva atau nimfanya merusak tanaman.
Besar kecilnya pengaruh kerusakan tanaman dan kehilangan hasil akibat serangan
hama ditentukan beberapa faktor yaitu tinggi rendahnya populasi hama yang hadir
di pertanaman, bagian tanaman yang dirusak, tanggap tanaman terhadap serangan
hama, dan fase pertumbuhan tanaman/umur tanaman. Adapun hama-hama utama
pada tanaman kedelai yaitu lalat kacang (Ophiomyiia phaseoli), penggerek pucuk kedelai (Melanagromyza dolichostigma), penggerek batang kedelai
(Melanagromyza sojae), ulat grayak (Spodoptera litura), ulat jengkal
(Chrysodexis chalcites), penggulung daun (Lamprosema indicata), penggerek
polong (Etiella zinknella), penghisap polong (Riptortus linearis), kepik hijau
(Nezara viridula), penghisap polong (Piezodorus hubneri) (Marwoto et. al, 1999)
Cara Pengendalian
Pemantauan di sentra produksi kedelai menunjukkan bahwa pengendalian
hama kedelai masih tertumpu pada penggunaan insektisida. Pada daerah yang
petaninya mempunyai modal yang cukup hampir 90% petani menggunakan
daerah yang petaninya kurang modal hanya 50% petani menggunakan insektisida.
Namun demikian cara aplikasi insektisida masih belum sesuai dengan ketentuan.
Di beberapa daerah ada yang sangat intensif memakai insektisida dengan dosis
dan frekuensi yang tinggi tetapi ada pula yang menggunakan insektisida dengan
dosis di bawah yang dianjurkan. Kedua cara tersebut berdampak negatif, hama
tidak dapat terkendali dengan baik akibatnya timbul masalah resistensi dan
resurgensi pada hama sasaran (Marwoto 2007).
Dengan memahami konsepsi Pengendalian Hama Terpadu (PHT), maka
pendekatan dalam memilih strategi pengendalian hama akan bertumpu pada
pemanfaatan kombinasi yang kompatibel dari komponen pengendalian yang
dipilih. PHT pada kedelai membatasi penggunaan insektisida kimiawi serta
menghindari terjadinya ketahanan dan resurjensi hama terhadap insektisida dan
dampak buruk penggunaan insektisida terhadap serangga berguna serta kesehatan
manusia dan lingkungan. Adapun cara pengendaliannya didasarkan pada
komponen-komponen PHT yang tersedia. Untuk mengatasi hama perusak bibit
dapat dilakukan dengan cara melakukan penanaman secara serentak, sanitasi
tanaman terserang, pergiliran tanaman dengan tanaman lain, menutup
lubang-lubang dengan jerami (mulsa), dan pemanfaatan agens hayati. Pengendalian
terhadap hama perusak daun adalah dengan mengupayakan agar periode vegetatif
dapat dilakukan serempak dalam areal luas, pada derah kronis dapat dilakukan
pengolahan tanah untuk mematikan hama yang berada dalam tanah, serta
pemanfaatan serangga berguna yang ada di pertanaman. Pengendalian hama
perusak polong dilakukan dengan cara pergiliran tanaman, melakukan penanaman
secara serentak, penggunaan tanaman perangkap, dan pemanfaatan musuh alami
yang ada di sekitar areal pertanaman. Contoh pengendalian yang telah dilakukan
5
Bioekologi Trichogramma spp.
Trichogrammatidae berasal dari bahasa Yunani kuno thriks atau trihos yang artinya rambut, dan grammata yang artinya gambar atau huruf. Disebut demikian
karena adanya keteraturan (susunan) rambut pada sayap. (Pracaya, 2005)
Parasit ini kecil, panjangnya 0,3-1,0 mm; warnanya hitam, hitam pucat,
cokelat pucat atau kuning. Antenanya terdiri dari 3-8 ruas termasuk satu ruas
cincin. Sayapnya berumbai-rumbai rambut (bulu-bulu) teratur dalam garis-garis
atau pita-pita rambut, yang terpanjang terdapat pada tepi sayap. Ovipositornya
pendek, kadang-kadang matanya berwarna merah.
Populasi parasitoid Trichogramma spp. dipengaruhi oleh keberadaan inang
dan lingkungan pertanaman (suhu, cuaca, udara). Populasi inang yang rendah
menyebabkan parasitoid tidak dapat berkembang. Demikian pula jika lingkungan
kurang mendukung, parasitoid tidak dapat berperan secara efektif. Naito dan
Djuwarso (1993) menyatakan bahwa daya tahan hidup T. bactrae-bactrae
mencapai 90% pada kisaran suhu 25−400C. Seekor parasitoid Trichogramma spp.
mampu memarasit lebih dari satu spesies telur inang, dan sebutir telur inang dapat
diparasit oleh lebih dari satu spesies Trichogramma spp. Hal ini menunjukkan
bahwa satu spesies Trichogramma spp. mampu memarasit beberapa spesies hama.
Parasitoid telur Trichogramma spp. bersifat polifag. Jenis inang parasitoid ini
meliputi telur Chilo suppressalis (WLK), Chrysodeixis chalcites (Esper), dan Heliothis assulta GN. T. bactrae-bactrae dapat memarasit telur penggerek polong Etiella spp., telur ulat buah kedelai Helicoverpa armigera, dan telur ulat jengkal Chrysodeixis chalsites. Pelepasan parasitoid Trichogramma spp. di lapang untuk mengendalikan hama terutama hama dari kelompok Lepidoptera. Pada tanaman
kedelai, sebagian besar hama penting didominasi oleh kelompok Lepidoptera.
(Pracaya, 2005)
Sumber : www.insectimages.org
Cendawan Entomopatogen Lecanicillium lecanii
Cendawan dari divisi Deuteromycotina merupakan cendawan yang memiliki
siklus tidak sempurna atau biasa disebut imperfect fungi. Cendawan
entomopatogen dari divisi Deuteromycotina dibagi menjadi dua kelas, yaitu kelas
Hyphomycetes dan Coelomycetes. Banyak cendawan dari kelas tersebut yang
memiliki daya virulen yang tinggi dan telah banyak diaplikasikan untuk
mengendalikan serangga hama.
Cendawan Lecanicillium lecanii termasuk dalam divisi Deuteromycotina
kelas Hyphomycetes. Cendawan L. lecanii dapat digunakan untuk mengendalikan
serangga hama terutama dari ordo Homoptera (Cloyd 2003) dan Hemiptera
(Prayogo 2004). Cendawan L. lecanii mudah tumbuh pada berbagai media,
terutama pada medium potato dextrose agar (PDA) dan beras. Di dalam cawan
petri, diameter koloni dapat mencapai 4–5,5 cm pada 3 hari setelah inokulasi.
Koloni cendawan berwarna putih pucat. Dua hari setelah inokulasi, cendawan
sudah mampu memproduksi konidia. Kumpulan konidia ditopang oleh tangkai
konidiofor yang membentuk pialid (whorls) seperti huruf V. Setiap konidia
menopang 5-10 konidia yang terbungkus dalam kantong lendir. Konidia
berbentuk silinder hingga elip, terdiri dari satu sel, tidak berwarna dan berukuran
2,30-10×1-2,60 µm.
Cendawan entomopatogen memerlukan kelembaban yang tinggi untuk
tumbuh dan berkembang, hal tersebut diperlukan selama proses pembentukan
tabung kecambah (germ tube), sebelum terjadi penetrasi ke integumen serangga.
Cendawan L. lecanii tumbuh baik pada suhu 18-30oC dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% cendawan tumbuh sangat baik (Cloyd
2003). Cendawan V. lecanii mampu hidup pada bahan organik yang mati dalam
rentang waktu yang sangat panjang (Tanada dan Kaya 1993).
Keefektifan cendawan entomopatogen dipengaruhi oleh waktu aplikasi.
Waktu aplikasi perlu diperhatikan karena cendawan entomopatogen sangat rentan
terhadap sinar matahari khususnya sinar ultra violet (Cloyd 2003). Bila terkena
sinar matahari dalam waktu 4 jam, cendawan L. lecanii akan kehilangan viabilitas
7
atas 50%. Oleh karena itu, bila cendawan diaplikasikan pada musim kemarau
perlu dihindarkan dari sinar matahari langsung dan sebaiknya aplikasi dilakukan
pada saat kelembaban udara tinggi yaitu sore hari (Suharsono dan Prayogo 2005).
Aplikasi L. lecanii pada sore hari (setelah pukul 16.00) mampu menyebabkan kematian hama pengisap polong kedelai R. linearis hingga 80%. Makin tinggi
mortalitas serangga, jumlah biji yang rusak pun makin menurun (Prayogo 2004).
Keberhasilan pengendalian hama dengan cendawan entomopatogen juga
ditentukan oleh konsentrasi cendawan yang diaplikasikan, yaitu kerapatan konidia
dalam setiap ml air. Jumlah konidia berkaitan dengan banyaknya biakan
cendawan yang dibutuhkan setiap hektar. Kerapatan konidia yang dibutuhkan
untuk mengendalikan hama bergantung pada jenis dan populasi hama yang akan
dikendalikan (Wikardi 1993). Pada tanaman pangan, kerapatan konidia yang
dibutuhkan lebih tinggi dibandingkan dengan pada tanaman perkebunan.
Miselium cendawan L. lecanii menghasilkan racun cyclodepsipeptide,
bassianolide, yang juga dihasilkan oleh Beauveria bassiana. Selain itu,
menghasilkan pula racun insektisida, seperti asam dipicolinic dan C25
[image:38.612.352.485.446.547.2]coumpounds (Suharsono dan Prayogo 2005).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Patologi Serangga dan
Laboratorium Bioekologi Parasitoid dan Predator Departemen Proteksi Tanaman,
Fakultas Pertanian, Institut Pertanian Bogor dari bulan Februari sampai Juli 2010.
Bahan
Serangga uji Trichogrammatoidea bactrae bactrae
Parasitoid T. bactrae bactrae Nagaraja (Hymenoptera: Trichogrammatidae)
diperbanyak pada telur inang alternatif Corcyra cephalonica (Stt.) (Lepidoptera :
Pyralidae). Imago parasitoid dimasukkan dalam tabung reaksi berisi kertas pias
berukuran 2 cm x 1 cm yang telah ditempeli telur inang C. cephalonica. Telur
inang ditempelkan ke kertas pias menggunakan gom arab. Telur akan terparasit
setelah empat hari. Ciri telur yang terparasit berwarna hitam, lalu dalam kurun
waktu ± 7-8 hari imago parasitoid keluar dari telur.
Cendawan Lecanicillium lecanii
Cendawan diperbanyak dengan cara inokulasi biakan cendawan L. lecanii
koleksi Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian (Balitkabi)
pada media PDA di dalam cawan petri. Kemudian disimpan di dalam incubator
9
Metode
Penyiapan suspensi konidia
Konidia cendawan L. lecanii dipanen pada umur 21 HSI (Hari Setelah
Inokulasi) dengan cara memotong media PDA yang berisi konidia cendawan, lalu
menumbuknya dengan mortar hingga halus. Kemudian dimasukkan ke dalam
erlenmeyer yang berisi air steril yang telah dicampur Tween 20 (0,05%),
selanjutnya dikocok menggunakan vortex selama 30 detik. Setelah itu, hancuran
media diendapkan dengan menggunakan sentrifuse sampai didapatkan supernatan.
Supernatan dikocok kembali dengan vortex dan diamati kerapatan konidianya
menggunakan haemocytometer Neubauer-improved hingga diperoleh kerapatan konidia 109/ml.
Perlakuan serangga uji
Suspensi konidia cendawan L. lecanii (kerapatan 109/ml) disemprotkanke
telur C. cephalonica pada kertas pias yang telah terparasit dalam berbagai stadia infestasi parasitoid. Dalam satu tabung reaksi diletakkan sepotong kertas pias
yang mengandung telur inang yang telah terparasit. Pada satu kertas pias terdapat
kurang lebih 20 butir telur inang C. cephalonica. Stadia infestasi parasitoid pada
telur yang digunakan yaitu umur infestasi telur 1 hari, 2 hari, 3 hari, 4 hari, 5 hari,
6 hari, 7 hari, dan 8 hari (telur akan menetas). Aplikasi dilakukan juga pada imago
T. bactrae bactrae. Aplikasi penyemprotan menggunakan sprayer tangan dengan volume semprot ± 5 ml. Aplikasi diulang sebanyak tiga kali.
Pengamatan dilakukan pada dua hari setelah aplikasi. Variabel yang diamati
yaitu jumlah telur inang C. cephalonica yang terinfeksi cendawan L. lecanii,
presentase imago parasitoid yang keluar setelah telur terinfeksi cendawan L.
lecanii, dan persentase imago parasitoid mati yang terinfeksi cendawan L. lecanii.
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL), data diolah
menggunakan program SAS (Statistic Analysis System) versi 6.12, dilanjutkan
HASIL DAN PEMBAHASAN
Pengaruh L. lecanii Terhadap Telur Inang yang Terparasit
Cendawan L. lecanii dengan kerapatan konidia 109/ml mampu menginfeksi telur inang C. cephalonica yang telah terparasit T. bactrae bactrae pada umur infestasi telur 1-6
hari. Pada tujuh dan delapan hari setelah telur inang terparasit, tidak terjadi infeksi oleh
cendawan. Infeksi cendawan pada telur inang mulai terjadi pada waktu dua hari setelah
perlakuan (HSP). Pada umur infestasi telur tujuh dan delapan hari, tampak infeksi
cendawan pada telur tersebut tetapi imago T. bactrae bactrae berhasil keluar dari telur
inang yang terparasit tersebut. Perkembangan cendawan L. lecanii yang diaplikasikan
mulai terjadi dua hari setelah perlakuan. Infeksi cendawan antara umur infestasi telur enam
hari dengan umur infestasi telur 1-5 hari terlihat berbeda nyata. Perkembangan cendawan
mulai tinggi pada umur infestasi telur 1-5 hari (Tabel 1).
Ciri-ciri telur inang yang terinfeksi cendawan L. lecanii adalah telur tersebut
terkoloni oleh miselium cendawan berwarna putih. Mula-mula miselium cendawan hanya
pada bagian permukaan telur saja, tetapi lama-kelamaan miselium cendawan tersebut
menyebar ke seluruh bagian telur, sehingga seluruh bagian telur tertutupi oleh hifa
cendawan tersebut. Miselia cendawan yang dihasilkan pun telah banyak dan menembus
sampai ke dalam telur (Gambar 4).
Tabel 1 Persentase telur inang C. cephalonica yang terinfeksi cendawan L. lecanii pada dua hari setelah aplikasi
Ulangan Telur inang yang terinfeksi cendawan (%) Umur infestasi telur oleh parasitoid (hari)
1 2 3 4 5 6 7 8
1 100 100 100 100 85 60 0 0
2 3 100 100 100 100 100 100 90 100 100 100 100 30 0 0 0 0
Rata-rata1 100 a 100 a 100 a 96,67 a 95 a 63,33 b 0 c 0 c
Kontrol 0 0 0 0 0 0 0 0
1
11
[image:42.612.356.494.92.202.2]Gambar 4 Telur C. cephalonica yang terparasit T. bactrae bactrae (warna hitam) dan
terinfeksi cendawan L. lecanii (warna putih)
Telur T. bactrae bactrae yang berhasil menetas dan imagonya keluar dari telur inang
terjadi pada infestasi umur telur 4-8 hari, sedangkan pada umur infestasi telur 1-3 hari
parasitoid tidak keluar. Persentase parasitoid keluar tertinggi pada umur infestasi telur
delapan hari, ini menunjukkan umur infestasi telur yang telah terparasit delapan hari belum
sempat terinfeksi cendawan, sama halnya dengan umur infestasi telur tujuh hari.
Umumnya cendawan menginfeksi telur inang dua hari setelah perlakuan. Setelah dua hari
perlakuan penetasan telur inang yang terparasit mengalami penurunan yang signifikan. Ini
disebabkan cendawan telah banyak mengkoloni telur, sehingga menurunkan daya
penetasan telur bahkan membuat telur tidak menetas (Tabel 2). Hasil penelitian Prayogo
(2004) menunjukkan bahwa cendawan L. lecanii mampu menginfeksi telur R. linearis,
sehingga telur yang tidak menetas mencapai 59%. Walaupun telur mampu menetas
membentuk nimfa instar I, kelangsungan hidup nimfa hanya 21%.
Diduga selain menginfeksi telur inang C. cephalonica, cendawan L. lecanii juga
menginfeksi telur parasitoid T. bactrae bactrae sehingga parasitoid tidak berkembang.
Kemungkinan lain adalah meskipun telur parasitoid T. bactrae bactrae berhasil menetas,
larva parasitoid tersebut ikut terinfeksi cendawan. Seandainya tidak terinfeksi cendawan,
larva parasitoid tidak mendapatkan makanan yang memadai karena telur inang telah
terinfeksi cendawan. Diperlukan penelitian lanjutan untuk mengkaji permasalahan infeksi
pada parasitoid ini. Masa rentan telur terhadap infeksi cendawan L. lecanii terjadi pada
umur infestasi telur 1-3 hari, diduga ini disebabkan T. bactrae bactrae belum berkembang
di dalam telur inang (belum terlihat telur terparasit). Biasanya telur inang mulai terparasit
berwarna hitam pucat, namun lama kelamaan akan makin hitam pekat. Tampaknya
cendawan L. lecanii memiliki pengaruh infeksi yang cukup signifikan pada umur infestasi
telur 1-6 hari, sedangkan umur infestasi telur 7-8 hari tidak terlalu terpengaruh infeksi
(Gambar 5).
Tabel 2 Persentase imago parasitoid telur T. bactrae bactrae yang keluar dari telur inang yang telah diaplikasi cendawan L. lecanii
Ulangan Persentase kemunculan imago parasitoid (%)
Umur infestasi telur oleh parasitoid (hari)
1 2 3 4 5 6 7 8
1 0 0 0 0 5,2 45,5 11,7 100
2 3 0 0 0 0 0 0 50 0 0 0 0 41,7 66,7 100 50 33,3 Rata-rata1 0 c 0 c 0 c 16,67 c 1,73 c 29,07 bc 59,27 b 61,10 b
Kontrol 100 100 100 100 100 100 100 100
1
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji Duncan α = 0,05
13
Pengaruh L. lecanii Terhadap Mortalitas Imago T. bactrae bactrae
Pengamatan terhadap mortalitas imago T. bactrae bactrae yang terinfeksi cendawan
L. lecanii dilakukan selama delapan hari. Penyemprotan suspensi konidia cendawan L. lecanii dengan kerapatan 109/ml memberikan pengaruh mortalitas terhadap imago T. bactrae bactrae sampai 100% (seluruh imago T. bactrae bactrae mati terinfeksi cendawan L. lecanii). Mortalitas imago T. bactrae bactrae akibat terinfeksi cendawan L. lecanii mulai terjadi pada empat HSP (Hari Setelah Perlakuan) dengan tingkat mortalitas sebesar
20%. Waktu mortalitas terhadap infeksi cendawan didapat dengan mencari nilai LT50nya.
Adapun nilai LT50 yang didapat yaitu sebesar 3,99 (Tabel 3). Hal ini menunjukkan bahwa
waktu kematian 50% serangga uji dengan menggunakan kerapatan konidia cendawan L.
lecanii 109/ml yaitu sekitar empat hari setelah perlakuan. Tingkat mortalitas kemudian
meningkat tajam pada 5-8 HSP (Gambar 6)
Adapun ciri-ciri dari imago dari T. bactrae bactrae yang terinfeksi cendawan L.
lecanii yaitu spora cendawan menyebar 4-6 hari setelah infeksi. Sporulasi terjadi pada
tungkai, antena, tetapi jarang terjadi pada thorax dan abdomen. Hal ini bisa dilihat dari
hifa-hifa cendawan berwarna putih yang terus berkembang sampai menutupi seluruh
bagian tubuh parasitoid tersebut (Gambar 7).
Tabel 3 Persentase mortalitas imago T. bactrae bactrae yang terinfeksi cendawan L. lecanii
Ulangan Persentase Mortalitas imago T. bactrae bactrae (%)
Hari Setelah Perlakuan (HSP)
1 2 3 4 5 6 7 8
1 0 0 0 10 80 100 100 100
2 0 0 0 30 100 100 100 100
3 0 0 0 20 100 100 100 100
Rata-rata1 0 c 0 c 0 c 20 b 93,33 a 100 a 100 a 100 a
Kontrol 0 0 0 0 0 0 0 0
LT50 3,99
1
[image:45.612.100.497.84.589.2] [image:45.612.329.491.400.521.2]
Gambar 6 Pengaruh L.lecanii terhadap mortalitas imago T. bactrae bactrae
Gambar 7 Imago T. bactrae bactrae yang terinfeksi cendawan L. lecanii
Penelitian ini menunjukkan bahwa aplikasi cendawan entomopatogen L. lecanii
dapat berdampak negatif terhadap imago parasitoid T. bactrae bactrae yang juga
dilepaskan di habitat yang sama. Namun demikian, percobaan ini perlu dilanjutkan di
lapangan mengingat cendawan L. lecanii bekerja secara kontak, sedangkan imago T.
bactrae bactrae adalah parasitoid yang ukurannya sangat kecil. Peluang kontak antara
KESIMPULAN DAN SARAN
Kesimpulan
1. Cendawan Lecanicillium lecanii mampu menginfeksi telur Corcyra cephalonica yang telah diparasit oleh Trichogramma bactrae bactrae pada umur infestasi telur 1-6 hari.
2. Pada kerapatan konidia 109/ml, cendawan L. lecanii mampu menginfeksi imago parasitoid T. bactrae bactrae setelah empat HSP (Hari Setelah Perlakuan).
3. Waktu LT50 cendawan L. lecanii pada kerapatan konidia 109/ml dicapai
kurang lebih empat hari.
Saran
DAFTAR PUSTAKA
Cloyd. 2003. The entomopathogen Verticillium lecanii. Midwest Biological Control News. University of Illinois. http://www.extension.umn. Edu/distribution/horticulture/DG7373.html [27 Juli 2010].
Marwoto. 2007. Dukungan pengendalian hama terpadu dalam program bangkit kedelai. Iptek Tanaman Pangan. Vol. 2. Malang: Balitkabi
Marwoto, Saleh N. 2003. Peningkatan peran parasitoid telur Trichogrammatoidea bactrae bactrae dalam pengendalian penggerek polong kedelai Etiella spp. Jurnal Litbang Pertanian: 22(4), Malang: Balitkabi
Marwoto, Suharsono, dan Supriyatin. 1999. Hama kedelai dan komponen pengendalian hama terpadu. Monograf Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Malang (4): 1−50.
Naito A., Djuwarso T. 1993. Biological control of Etiella pod borer. Makalah Simposium Penelitian Tanaman Pangan III. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. 8 pp.
Pracaya. 2005. Hama dan Penyakit Tanaman. Jakarta: Penebar Swadaya
Prayogo Y. 2004. Keefektifan lima jenis cendawan entomopatogen terhadap hama pengisap polong kedelai Riptortus linearis L. (Hemiptera: Alydidae) dan dampaknya terhadap predator Oxyopes javanus Thorell (Araneida: Oxyopidae). [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. 51 hlm.
Prayogo Y, Suharsono. 2005. Optimalisasi pengendalian hama penghisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium lecanii. Jurnal Litbang Pertanian: 24(4), Malang: Balitkabi
Rauf A, Triwidodo H, Widodo. 1994. Penggunaan pestisida oleh petani kedelai di tingkat kabupaten di Jawa Barat. Seminar Nasional Peningkatan Produktivitas dan Kualitas Kedelai melalui Penerapan PHT Kedelai. Bappenas dan Fakultas Pertanian Universitas Brawidjaja. 13 hlm.
Sumarno. 1999. Strategi pengembangan produksi kedelai nasional mendukung Gema Palagung 2001. Prosiding Lokakarya Pengembangan Produksi Kedelai Nasional, Bogor 16 Maret 1999. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. hlm. 7−22.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego: Academic Press, INC. Harcourt Brace Jovanovich, Publisher
18
Tengkano W, Supriyatin, Suharsono, Bedjo, Prayogo Y., dan Purwantoro. 2007. Status hama kedelai dan musuh alami di lahan kering masam Lampung. Iptek Tanaman Pangan 2(1): 93−109.
Wikardi W, Rayati DJ. 1993. Pengaruh Frekuensi Penyemprotan Jamur Entomopatogenik terhadap Ulat Jengkal (Ectropis bhurmitra) di Perkebunan Teh. hlm 91−103. Di dalam: Yusmani P, editor. Optimalisasi pengendalian hama penghisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium lecanii. Jurnal litbang pertanian: 24(4). Malang: Balitkabi
LAMPIRAN
Tabel 1. Jumlah Telur Inang Terparasit yang Terinfeksi Cendawan Lecanicillium lecanii
Umur telur terparasit Ulangan Telur yang terinfeksi cendawan L. lecanii
1 hari 1 20
2 20
3 20
2 hari 1 20
2 20
3 20
3 hari 1 20
2 20
3 20
4 hari 1 18
2 20
3 17
5 hari 1 20
2 20
3 12
6 hari 1 20
2 6
3 0
7 hari 1 0
2 0
3 0
8 hari 1 0
2 0
[image:49.612.100.531.198.588.2]20
Tabel 2. Presentase Trichogrammatoidea bactrae bactrae yang Menetas Pada Telur Inang Terparasit dan Terinfeksi Cendawan Lecanicillium lecanii
Umur telur terparasit Ulangan Persentase Penetasan (%)
1 hari 1 0
2 0
3 0
2 hari 1 0
2 0
3 0
3 hari 1 0
2 0
3 0
4 hari 1 0
2 50
3 0
5 hari 1 5,2
2 0
3 0
6 hari 1 45,5
2 0
3 41,7
7 hari 1 11,1
2 66,7
3 100
8 hari 1 100
2 50
[image:50.612.102.533.184.521.2]
Tabel 3. Jumlah Imago Trichogrammatoidea bactrae bactrae yang Terinfeksi
Cendawan Lecanicillium lecanii
Pengamatan (hari) Ulangan Imago yang terinfeksi cendawan L. lecanii
1 hari 1 0
2 0
3 0
2 hari 1 0
2 0
3 0
3 hari 1 1
2 3
3 2
4 hari 1 8
2 10
3 10
5 hari 1 10
2 10
3 10
6 hari 1 10
2 10
3 10
7 hari 1 10
2 10
3 10
8 hari 1 10
2 10
3 10
[image:51.612.98.534.160.555.2]