KEEFEKTIFAN CENDAWAN ENTOMOPATOGEN Beauveria
bassiana (Balsamo) Vuillemin dan Lecanicillium lecanii (Zimm.)
Zare & Gams TERHADAP PENGGEREK
BATANG JAGUNG ASIA Ostrinia furnacalis Guenée
(LEPIDOPTERA: CRAMBIDAE)
DIANA AGUSTIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Cendawan Entomopatogen Beauveria bassiana (Balsamo) Vuillemin dan Lecanicilliumlecanii (Zimm.) (Viegas) Zare & Gams terhadap Penggerek Batang Jagung Asia Ostrinia furnacalisGuenée (Lepidoptera: Crambidae) adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DIANA AGUSTIN. Keefektifan Cendawan Entomopatogen Beauveria bassiana (Balsamo) Vuillemin dan Lecanicillium lecanii (Zimm.) (Viegas) Zare& Gams terhadap Penggerek Batang Jagung Asia Ostrinia furnacalis Guenée(Lepidoptera: Crambidae). Dibimbing oleh TEGUH SANTOSO dan RULY ANWAR.
Penelitian ini bertujuan untuk menguji keefektifan cendawan entomopatogen Beauveria bassiana dan Lecanicillium lecanii terhadap larva dan telur penggerek batang jagung Asia Ostrinia furnacalis. Penelitian ini dilaksanakan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman IPB sejak bulan Maret sampai dengan bulan September 2013.
Serangga uji O. furnacalis dikoleksi dari pertanaman jagung milik petani di daerah Dramaga, Bogor dan diperbanyak di Laboratorium Patologi Serangga IPB. Isolat yang digunakan dalam penelitian ini merupakan koleksi dari Laboratorium Patologi Serangga IPB, yang ditularkan lagi pada serangga Tenebrio molitor untuk meningkatkan virulensinya. Isolat cendawan ini selanjutnya diperbanyak pada media beras untuk digunakan pada pengujian.
Perlakuan di laboratorium menggunakan larva dan telur O.furnacalis untuk melihat keefektifan B. bassiana dan L. lecanii. Sebanyak 20 ekor larva O. furnacalis disemprot dengan ± 3 mLsuspensi konidia cendawanB. bassiana dengan kerapatan 105, 106, 107, 108, dan 109 konidia/mL. Pada perlakuan telur digunakan satu kelompok telur dengan jumlah telur yang berbeda-beda untuk tiap-tiap ulangan. Masing-masing perlakuan dibuat ulangan sebanyak empat kali. Perlakuan yang sama juga dilakukan denganmenggunakan konidia L. lecanii. Pengamatan dilakukan setiap hari selama tujuh hari untuk mendapatkan data mortalitas larva dan telur O. furnacalis.
Hasil penelitian menunjukkan keefektifan yang tertinggi untuk perlakuan pada larva yaitu 78.75% dengan aplikasi menggunakan B. bassiana dan 71.25% dengan aplikasi menggunakan L. lecanii pada kerapatan 109 konidia/mL. Pada hari ketujuh diperoleh nilai LC50B. bassiana pada perlakuan larva adalah 1.39 x 106 dan L. lecanii 1.62 x 106 konidia/mL.
Pada perlakuan telur O. furnacalis, kerapatanB. bassiana 109 konidia/mL mampu menyebabkan mortalitas hingga 100% demikian juga kerapatanL. lecanii 108 dan 109 konidia/mL mampu menyebabkan mortalitas hingga 100%. Nilai LC50pada hari ketigauntuk B. bassiana adalah 9.6 x 105 konidia/mL dan untuk L. lecanii 6.1 x 105 konidia/mL.
SUMMARY
DIANA AGUSTIN. The Effectiveness of Entomopathogenic Fungi, Beauveria bassiana (Balsamo) Vuillemin and Lecanicillium lecanii (Zimm.) (Viegas) Zare & Gams Against The Asiatic Corn Borer, Ostrinia furnacalis Guenée (Lepidoptera: Crambidae). Supervised by TEGUH SANTOSO and RULY ANWAR.
This study was conducted at the Insect Pathology Laboratory, Plant Protection Department, Bogor Agricultural University, from March to September 2013. Tested insects,Ostrinia furnacalis, were collected from farmers cornfield in Dramaga, Bogor andthen reared in the laboratory.
Isolates of Beauveria bassiana and Lecanicillium lecanii in this study were obtained from the collection of Insect Pathology Laboratory. Fungal suspension was innoculated to Tenebrio molitor adultsin order to increase the virulence after a long storage in the laboratory.
Mycelia of the fungi from T. molitor cadavers were isolated and cultured on PDA (Potato Dextrose Agar) media, then colonies from PDA were subsequently transfered and maintained on rice media until± 21 days old. Fungi from this culture were used in this study. Bioassay were conducted with five levels of density, i.e. 105, 106, 107, 108 and 109 conidia/mL with ± 3 mL application volume for each treatment. Each treatment were made of four replicates. The number of larvae that were used for each replicate were 20 larvae, while the eggs treatment consistedof one egg mass per replicate. Probit analysis was used to analyze the mortality data and to estimate the value of LC.
Result of this study indicated that B. bassiana with 109 conidia/mL caused 78.75% mortality of 2rd instar larvae, whereasthe same conidial density of L. lecanii caused 71.25% mortality. The value of LC50 were 1.39 x 106 conidia/mL for B. bassiana and 1.62 x 106 for L. lecanii; both LC values were calculated at 7 days observation. While 100% egg mortality was achieved by application of B. bassiana at 109 conidia/mL, the same degree of mortality could be achieved by L. lecanii at lower density,i.e. 108konidia/mL. Value of LC for both fungi against eggs at 3 days post treatment are 9.6 x 105 and 6.1 x 105 conidia/mL, respectively.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
KEEFEKTIFAN CENDAWAN ENTOMOPATOGEN Beauveria
bassiana (Balsamo) Vuillemin dan Lecanicillium lecanii (Zimm.)
(Viegas) Zare & Gams TERHADAP PENGGEREK
BATANG JAGUNG ASIA Ostrinia furnacalis Guenée
(LEPIDOPTERA: CRAMBIDAE)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Keefektifan Cendawan Entomopatogen Beauveria bassiana (Balsamo) Vuillemin dan Lecanicillium lecanii (Zimm.) (Viegas) Zare & Gams terhadap Penggerek Batang Jagung Asia Ostrinia furnacalis Guenée (Lepidoptera: Crambidae)
Nama : Diana agustin
NIM : A351110031
Disetujui oleh Komisi Pembimbing
Dr Ir Teguh Santoso, DEA Ketua
Dr Ir Ruly Anwar, MSi Anggota
Diketahui oleh
Ketua Program Studi Entomologi
Dr Ir Pudjianto, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret hingga September 2013 ini ialah cendawan entomopatogen, dengan judul Keefektifan Cendawan Entomopatogen Beauveria bassiana (balsamo) Vuillemin dan Lecanicillium lecanii (Zimm.) (Viegas) Zare& Gams terhadap Penggerek Batang Jagung Asia Ostrinia furnacalis Guenee (Lepidoptera: Crambidae).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Teguh Santoso dan Bapak Dr Ir Ruly Anwar selaku pembimbing. Penulis juga menyampaikan ucapan terima kasih kepada Bapak Saefudin yang telah membantu selama koleksi serangga dari lapang. Di samping itu, terima kasih juga disampaikan kepada orangtua, suamiku tercinta Bambang Suhendro SH, dan anak-anakku tersayang M. Ikbaar al Islami, Aqila Fayyaza dan M. Azam al Fayyadh atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Penggerek Batang Jagung Asia (Ostrinia furnacalis) 3
Cendawan Entomopatogen 3
Beauveria bassiana 5
Lecanicillium lecanii 6
3 METODE 9
Tempat dan Waktu Penelitian 9
Persiapan Serangga Uji dan Cendawan Uji 9
Pemeliharaan Serangga Uji 9
Preparasi B. bassiana dan L. lecanii pada media beras 11 Penyiapan Suspensi B. bassiana dan L. lecanii untuk Pengujian 12 Uji Mortalitas B. bassiana dan L. lecanii terhadap Larva O. furnacalis 12 Uji Mortalitas B. bassiana dan L. lecanii terhadap Telur O. furnacalis 12
Rancangan Percobaan 13
4 HASIL DAN PEMBAHASAN 15
Hasil 15 Infektifitas B. bassiana dan L. lecanii terhadap Larva O. furnacalis 15
Infektifitas B. bassiana dan L. lecanii terhadap Telur O. furnacalis 19
Pembahasan Umum 23
5 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 29
DAFTAR PUSTAKA 31
DAFTAR TABEL
1 Mortalitas larva O. furnacalis setelah aplikasi B. bassiana selama tujuh hari pengamatan
15 2 Mortalitas larva O. furnacalis setelah aplikasi L. lecanii selama tujuh hari
pengamatan
16 3 Mortalitas kumulatif larva O. furnacalis setelah aplikasiB.
bassianaselama tujuh hari pengamatan
16 4 Mortalitas kumulatif larva O. furnacalis setelah aplikasi B.
bassianaselama tujuh hari pengamatan
17 5 Mortalitas telur O. furnacalis selama lima hari pengamatan setelah
aplikasiB. bassiana
20 6 Mortalitas telur O. furnacalis selama lima hari pengamatan setelah
aplikasi L. lecanii
20 7 Persentase kumulatif larva instar I yang mampu hidup setelah aplikasi B.
bassiana pada telur O. furnacalis
21 8
9
Persentase kumulatif larva instar I yang mampu hidup setelah aplikasi L. lecanii pada telur O. furnacalis
Jumlah imago O. furnacalis yang berasal dari koleksi potongan batang dan rasio jantan dan betina
DAFTAR GAMBAR
1 Gejala serangan O. furnacalis pada batang jagung berupa liang bekas gerekan
9 2 Kurungan untuk pemeliharaan imago O. furnacalis 10
3 Telur O. furnacalis yang hampir menetas 10
4 Bangkai T. molitor yang ditumbuhi miselia cendawan entomopatogen 11 5 Cendawan entomopatogen yang diperbanyak di media beras 12 6 Hubungan antara kerapatan konidia dengan mortalitas larva O.
furnacalis akibat perlakuan cendawan B. bassiana (A) dan L. lecanii (B) pada tujuh hari setelah aplikasi
18
7 Bangkai O. furnacalis yang ditumbuhi miselia B. bassiana dan L. lecanii
19 8 Konidiofor B. bassiana berbentuk zigzag dan L. lecani seperti huruf V 19 9 Hubungan antara kerapatan konidia dengan mortalitas telur O.
furnacalis akibat perlakuan cendawan B. bassiana (A) dan L. lecanii (B) pada lima hari setelah aplikasi
22
10 Pertanaman jagung yang banyak menunjukkan tanda terserang O. furnacalis
23 11 Tahapan perkembangan O. furnacalis: telur, larva, pupa dan imago 24 12 Koloni L. lecanii dan B. bassiana pada media PDA 25 13 Konidia B. bassiana yang diambil dari bangkai larva dan telur O.
furnacalis
25 14 Konidia L. lecanii yang diambil dari bangkai larva dan telur O.
furnacalis
26 15 Larva O. furnacalis dengan infeksi awal, mulai ditumbuhi miselia dan
sudah ditutupi miselia cendawan entomopatogen
1
PENDAHULUAN
Latar Belakang
Jagung merupakan tanaman pangan sumber makanan pokok serta merupakan produk pertanian yang mempunyai peranan strategis dan ekonomis di Indonesia. Peranan jagung selain sebagai bahan pangan (food) dan pakan (feed), juga banyak digunakan sebagai bahan baku energi (fuel) serta bahan baku industri lainnya yang kebutuhannya setiap tahun terus mengalami peningkatan. Pada tahun 2020, permintaan jagung di negara sedang berkembang akan melebihi permintaan beras dan gandum. Permintaan jagung dunia diperkirakan akan meningkat 50%, yakni dari 558 juta ton pada tahun 1995 menjadi 837 juta ton pada tahun 2020 (Dirjen Tanaman Pangan 2011).
Pada tahun 2013 produksi jagung di Indonesia ditargetkan mencapai 19.83 juta ton. Meskipun secara nasional produktivitas jagung meningkat, namun di tingkat petani produktivitas jagung masih rendah yaitu antara 1.0-7.0 ton/ha, sedangkan hasil penelitian menunjukkan bahwa potensi produktivitas jagung bisa mencapai 10 ton/ha (Dirjen Tanaman Pangan 2011; BPS 2013).
Salah satu faktor yang mempengaruhi produktivitas jagung adalah adanya serangan organisme pengganggu tanaman (OPT). Beberapa hama penting pada tanaman jagung yang sering menimbulkan kerusakan berat di Indonesia adalah lalat bibit, Antherigona exigua (Diptera: Anthomyiidae), penggerek batang, Ostrinia furnacalis (Lepidoptera: Crambidae) dan kumbang bubuk, Sitophilus zeamais (Coleoptera: Curculionidae) (Dirjen Tanaman Pangan 2011).
Hama O. furnacalis merupakan hama utama pada tanaman jagung yang dapat merusak batang, tongkol, dan bunga jantan. Hama penggerek ini menyerang seluruh fase perkembangan tanaman dan seluruh bagian tanaman jagung. Kehilangan hasil yang disebabkan oleh hama ini dapat mencapai 80% (Bato et al. 1983). Kehilangan hasil terbesar terjadi ketika kerusakan terjadi pada fase reproduktif. Gejala serangan berupa lubang kecil pada daun, gerekan pada batang, kerusakan pada tassel dan kerusakan sebagian pada janggel (Kalshoven 1981).
Di Indonesia belum tersedia jagung berproduksi tinggi yang tahan terhadap penggerek batang. Jika terjadi serangan hama ini, umumnya petani menggunakan insektisida. Namun, penggunaan insektisida yang tidak bijaksana dapat menimbulkan berbagai dampak negatif seperti timbulnya resistensi, resurjensi serta dampak terhadap lingkungan lainnya serta harganya yang relatif
mahal (Mas’ud 2010).
2
Saat ini sudah banyak diteliti keefektifan mikroorganisme musuh alami serangga seperti virus, cendawan, nematoda dan bakteri sebagai teknologi
alternatif untuk mengendalikan serangan hama (Mas’ud 2010). Beberapa
cendawan entomopatogen yang banyak diteliti keefektifannya dalam mengendalikan hama antara lain dari genusBeauveria, Metarhizium dan Lecanicillium. Cendawan entomopatogen Beauveria bassiana dan Lecanicillium lecanii merupakan jenis agen hayati yang sudah diketahui potensinya untuk mengendalikan berbagai jenis hama. Menurut Soehardjan dan Sudarmaji (1993) B. bassiana efektif menyerang serangga perusak tanaman. Cendawan ini menginfeksi serangga target melalui kontak kutikula, mulut, sistem pencernaan dan pernafasan serangga. Cendawan ini mudah dikembangbiakkan, diproduksi secara sederhana tanpa bantuan alat yang canggih. Cendawan entomopatogen B. bassiana dilaporkan efektif untuk mengendalikan larva instar III Ostrinia furnacalis (Surtikanti et al.1997).Pada komoditas tanaman pangan lain, B. bassiana juga dilaporkan efektif terhadap serangga hama Spodoptera litura (Yasin et al. 1997), Cylas formicarius (Bari 2006;Ratissa 2011).
Penelitian Miller et al. (2003) juga menunjukkan keefektifan cendawan ini dalam mengendalikan Sphaerotheca macularis dan S.fuliginea yang menyerang tanaman strawberi. Hasil penelitian Prayogo (2004) menunjukkan bahwa L. lecanii efektif untuk mengendalikan hama Riptortuslinearis. Selain itu, Prayogo (2012) menyatakan bahwa L. lecanii juga efektif untuk mengendalikan Bemisia tabaci vektor penyakit SMV pada tanaman kedelai. Selain untuk mengendalikan serangga hama, L. lecanii juga dilaporkan efektif mengendalikan nematoda Heteroderaglycines yang menyerang tanaman kedelai (Meyer et al. 1998; Shinya et al.2008). Mengingat potensi L. lecanii sebagai agens pengendali hama pada fase telur, penelitian ini mencoba mempelajari potensi tersebut terhadap hama O.furnacalis di laboratorium.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji keefektifan cendawan entomopatogen B. bassiana dan L. lecanii terhadap telur dan larva penggerek batang jagung Asia O. furnacalis.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Penggerek Batang Jagung Asia (Ostriniafurnacalis) Guenée (Lepidoptera: Crambidae)
Penggerek batang jagung Asia, O. furnacalis Guenee merupakan salah satu hama utama pada pertanaman jagung. Wilayah penyebaran O. furnacalis meliputi seluruh Asia Tenggara, Asia Tengah, Asia Timur dan Australia. Di Indonesia, serangga ini menyerang pertanaman jagung di Jawa, Sumatra, Sulawesi, Nusa Tenggara dan Papua (Kalshoven 1981).
Larva penggerek batang jagung dapat merusak daun, batang, serta bunga jantan dan betina. Larva instar I-III merusak daun dan bunga jantan, sedangkan larva instar IV-V merusak batang dan tongkol. Serangan pada tanaman jagung umur 2 dan 4 minggu menyebabkan kerusakan pada daun, pucuk dan batang; pada tanaman umur 6 minggu menyebabkan kerusakan pada daun, batang, bunga jantan dan bunga betina; dan pada tanaman umur 8 minggu menyebabkan kerusakan pada daun dan batang (Nonci 2004).
Nonci dan Baco (1991) mengemukakan bahwa stadia telur berlangsung 3-4 hari. Telur diletakkan berkelompok. Jumlah telur yang diletakkan dalam satu kelompok telur bervariasi antara 5 hingga lebih dari 100 butir. Di laboratorium, jumlah telur setiap kelompok beragam dari 2 hingga 200 butir (Kalshoven 1981).
Stadia larva bervariasi, tergantung pada bagian tanaman jagung yang dimakan. Hasil penelitian menunjukkan bahwa tanaman jagung umur 6 minggu paling disenangi oleh larva O. furnacalis. Perkembangan larva terdiri atas lima instar dengan ukuran yang berbeda-beda. Pupa terbentuk di dalam batang dengan stadia bervariasi antara 7-9 hari atau rata-rata 8.50 hari (Nonci 2004).
Ngengat biasanya muncul serta aktif pada malam hari dan segera berkopulasi. Lama hidup ngengat antara 2-7 hari. Ukuran ngengat betina lebih besar daripada ngengat jantan dan warna sayap ngengat jantan lebih terang daripada betina (Nonci dan Baco 1991).
Kehilangan hasil akibat serangan O. furnacalis berkisar antara 20%-80% (Nonci dan Baco 1987). Kehilangan hasil terbesar ketika kerusakan terjadi pada fase reproduktif (Kalshoven 1981). Kehilangan hasil di lapangan, selain dipengaruhi oleh kepadatan populasi larva O. furnacalis juga ditentukan oleh umur tanaman jagung saat terserang. O. furnacalis meletakkan telur pada pertanaman jagung di lapangan pada 15 HST (hari setelah tanam) dan serangan berakhir pada 75 HST (Nonci dan Baco 1991). Belum tersedia varietas jagung berproduksi tinggi yang tahan terhadap hama penggerek batang. Pengendalian
hama ini di lapangan masih mengandalkan insektisida (Mas’ud 2010).
4
C02melalui stomata menurun yang berakibat terhadap penurunan tingkat fotosintesis (Godfrey et al. 1991).
Cendawan Entomopatogen
Cendawan entomopatogen tergolong salah satu dari organisme yang dapat menyebabkan sakit pada serangga. Penularan cendawan entomopatogen lebih sering terjadi melalui kontak dengan integumen serangga. Keefektifan cendawan entomopatogen untuk mengendalikan hama sasaran sangat tergantung pada keragaman jenis isolat, kerapatan spora, kualitas media tumbuh, jenis hama yang dikendalikan, stadia hama, waktu aplikasi, frekuensi aplikasi, dan faktor lingkungan.
Pengendalian hayati serangga hama menggunakan cendawan entomopatogen memiliki beberapa kelebihan dibanding pestisida kimia sintetik antara lain, mempunyai kapasitas reproduksi yang tinggi, siklus hidupnya pendek, membentuk spora yang dapat bertahan lama di alam dalam kondisi lingkungan yang tidak menguntungkan, sifatnya lebih spesifik, biaya relatif lebih murah, relatif mudah diproduksi, relatif lebih aman bagi ekosistem dan kemungkinan sangat kecil akan terjadi resistensi (Hall 1973; Castillo et al. 2000). Cendawan entomopatogen mempunyai peran yang nyata dalam mengendalikan berbagai hama pertanian. Tidak seperti bakteri ataupun virus, cendawan mampu menginfeksi inangnya langsung melalui kutikula. Meskipun dilaporkan ada sekitar 700-750 spesies cendawan entomopatogen tetapi hanya sekitar 12 spesies yang banyak digunakan untuk mengendalikan serangga hama (Stark dan Banks 2003). Beauveria, Metarhizium, Paecilomyces, Nomuraea, Verticillium, Hirsutella, Aspergillus, Sorosporella, Tolypocladium, dan Culinomyces merupakan genus yang dapat menyebabkan kematian pada serangga (Tanada dan Kaya 1993).
Menurut Ferron (1985) terdapat empat tahap etiologi penyakit serangga yang disebabkan oleh cendawan: (1) inokulasi, yaitu kontak antara propagul cendawan (misalnya konidia) dengan tubuh serangga inang; (2) proses penempelan dan perkecambahan propagul cendawan dengan integumen serangga. (3) penetrasi dan invasi pada tubuh serangga. dan (4) destruksi pada titik penetrasi dan terbentuknya blastospora yang kemudian beredar ke dalam hemolimfa dan membentuk hifa sekunder untuk menyerang jaringan lainnya.Tahap penempelan dan perkecambahan propagul sangat membutuhkan kelembaban yang tinggi. Pada waktu melakukan penetrasi dan menembus integumen, cendawan membentuk tabung kecambah (apresorium). Penembusan dilakukan secara mekanis atau kimiawi dengan mengeluarkan enzim dan toksin.Santoso (1993) mengatakan bahwa apabila keadaan kurang mendukung, perkembangan saprofit hanya berlangsung dalam tubuh serangga tanpa keluar menembus integumen.
5 kemudian akan berkecambah dan tumbuh di bagian belakang saluran pencernaan. Selanjutnya hifa berkecambah dan melakukan penetrasi ke dalam tubuh dan hemosel serangga. Pada mekanisme ini biasanya cendawan menyerang inang dengan dua cara yaitu perusakan jaringan oleh miselia dan atau produksi toksin. Biasanya sebelum cendawan membentuk hifa (proliferasi) dalam hemosel, serangga sendiri mengembangkan sistem pertahanan diri, misalnya dengan fagositosis yang biasanya dilakukan oleh plasmatosit atau enkapsulasi dengan membentuk granuloma.
Beauveria bassiana
Beauveria bassiana (Balsamo) Vuillemin (Deuteromycota: Hypomycetes) adalah cendawan entomopatogen yang ditemukan pada tahun 1835 oleh Agostino Bassi yang menyebabkan muscardine disease pada ulat sutera (Tanada dan Kaya 1993; Alexopoulos dan Mims 1996). B. bassiana memiliki kisaran inang yang luas. Dengan kemampuan menginfeksi inang yang luas, menyebabkan cendawan ini memiliki strain dan isolat yang beragam. Indonesia, dengan iklim tropik yang dimilikinya memungkinkan B. bassiana hidup dengan keragaman strain. Keragaman strain ini akan berpengaruh terhadap kemampuannya menginfeksi inang (Trizelia 2005). Cendawan ini dapat menyerang serangga dari berbagai ordo serta mampu menyerang seluruh stadia perkembangan serangga. Cendawan B.bassiana di luar negeri seperti di Jepang dan Eropa telah dikenal luas penggunaannya. Di antara perusahaan yang mengembangkan formula B. bassiana adalah Mycotech Corp. dan Troy BioSciences.(Hassanloui et al. 2007).
B. bassiana mempunyai konidiofor tunggal dan bercabang dengan pola zigzag jika telah menghasilkan konidia. Konidia keras, bersel satu, berbentuk bulat atau oval, hialin, berukuran 2-3 µm dan terbentuk pada tiap ujung percabangan konidiofor. Hifanya hialin, bersekat dan bercabang. Miselia berbentuk seperti benang, berwarna kuning pucat atau putih, tampak seperti tepung atau kapas. B. bassiana termasuk ke dalam fungi imperfect (tidak sempurna) karena tidak ditemukan fase seksualnya sehingga bereproduksi secara aseksual dengan menggunakan konidia (Steinhaus 1963; Tanada dan Kaya 1993).
B. bassiana memiliki kemampuan adaptasi yang baik untuk mampu bertahan di dalam tanah dalam bentuk konidia atau hifa saprofit. Cendawan bertahan dalam bentuk dorman selama kondisi lingkungan tidak mendukung pertumbuhan atau bila inang tidak tersedia, ketika inang telah tersedia maka proses infeksi akan terjadi. Infeksi B. bassiana pada inangnya terjadi melalui tiga tahap, yaitu adhesi, perkecambahan dan penetrasi. Cendawan ini dapat hidup pada pH antara 3.3-8.5 dengan pH optimum 6.7 (Boucias et al. 1998). Cendawan ini menghasilkan beberapa toksin antara lain beauvericin, cyclosporin A, oosporein dan bassianolidae. Daya kerja toksin tersebut adalah merusak jaringan atau organ hemosel secara mekanis seperti saluran pencernaan, otot, sistem syaraf, dan sistem pernafasan yang akhirnya menyebabkan kematian. Ketika inang sudah mati, miselia menyebar dengan cepat memenuhi rongga tubuh dan menyebabkan tubuh inang mengeras. Pada kondisi yang optimal (25-30ºC), dapat menembus keluar integumen dan menghasilkan konidia (Vey et al. 2001).
6
protease untuk melunakkan kutikula. Penetrasi berlangsung dalam waktu 12-24 jam dan kematian terjadi antara 48-72 jam kemudian (Purnama et al. 2003).
B. bassiana adalah parasit fakultatif. Cendawan ini potensial untuk mengendalikan lebih dari 70 jenis serangga hama dari ordo yang berbeda terutama dari ordo Lepidoptera (Kaur et al. 2011).
Mazra’awi (2007) menyatakan bahwa B. bassiana efektif diaplikasikan baik melalui oral maupun topical terhadap Apis mellifera dalam kondisi laboratorium. Hassanloui (2008) melaporkan bahwa B. bassiana efektif terhadap Tetranychusurticae dan Myzuspersicae dengan rataan mortalitas mencapai 83%.
Hasil penelitian Castillo et al. (2000) juga menunjukkan bahwa B. bassiana efektif terhadap Ceratitis capitata. Selain itu Howard et al. (2010) melaporkan bahwa cendawan entomopatogen ini juga bisa digunakan untuk mengendalikan nyamuk Culex quinquefasciatus. B. bassiana juga dilaporkan efektif untuk mengendalikan kumbang saguRhynchoporus ferrugineus serta bubuk buah kopi Hypothenemushampei di lapangan (Posada et al. 2007; Agullo et al. 2011).
Lecanicillium lecanii
Menurut Howard et al. (2010) karakteristik koloni L. lecanii adalah berwarna putih pucat dengan diameter antara 4.0-7.3 cm setelah inokulasi pada media potato dextrose agar (PDA). Koloni biasanya mulai tumbuh setelah 20 hari diinokulasi pada media PDA. Prayogo (2005) menyatakan koloni cendawan L. lecanii pada media PDA dalam cawan petri bisa mencapai ukuran 4.0-5.5 cm pada hari ketiga setelah inokulasi. Konidiofor berupa fialid berbentuk seperti huruf V, setiap konidiofor memproduksi 5-10 konidia yang terbungkus dalam kantung lendir (Aiuchi et al. 2007). Konidia berbentuk silinder sampai elips, terdiri dari satu sel, tidak berwarna (hialin), berukuran 1.9-2.2 x 5.0-6.1 µm (Feng et al. 2002). Cendawan ini tumbuh baik pada suhu 15-30 ºC, namun pertumbuhannya akan terhambat pada suhu 35 ºC (Cuthbertson et al. 2005). Pertumbuhan yang optimum cendawan ini pada suhu 25 ºC dan kelembaban 90%. Kelembaban yang tinggi berperan dalam proses perkecambahan dan infeksi terhadap serangga inang. Konidia akan berkecambah cepat pada suhu 20-25ºC (Fatiha et al. 2007). Beberapa toksin yang dihasilkan cendawan ini antara lain cyclosporin A, dipcolonicacid, dan hydroxycarboxylicacid (Vey et al. 2001).
9
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor sejak bulan Maret hingga September 2013.
Persiapan Serangga Uji dan Cendawan Uji
Pemeliharaan Serangga Uji
Serangga yang digunakan dalam penelitian ini diambil dari pertanaman jagung milik petani di daerah Dramaga, Bogor. Tanaman jagung yang menunjukkan gejala terserang O. furnacalis berupa liang bekas gerekan di batang, dipotong-potong ± 15 cm (gambar 1).
Selanjutnya potongan batang bergejala ini dibawa ke laboratorium untuk dipelihara lebih lanjut. Potongan batang jagung tersebut diletakkan dalam wadah plastik berukuran 33 cm x 16 cm x 8 cm yang bagian atas dan bawahnya telah dialasi tisu lalu dibiarkan hingga imagonya keluar dari lubang gerekan. Tutup wadah dilubangi dan diberi kain kasa untuk sirkulasi udara dalam wadah. Satu wadah plastik biasanya bisa menampung 15-20 potongan batang jagung. Imago biasanya mulai muncul sejak seminggu hingga sebulan setelah koleksi dari lapangan. Imago yang muncul kemudian dipindahkan dalam kotak pemeliharaan yang berukuran 20cm x 15cm x 15cm yang bagian atasnya telah dilapisi kertas untuk tempat meletakkan telur serta lembaran busa yang telah dilembabkan untuk menjaga kelembaban dalam kotak pemeliharaan (Gambar 2).
10
Imago diberi pakan larutan madu 10% yang diserapkan pada potongan busa berdiameter ± 8 cm yang diletakkan dalam cawan petri berdiameter 9 cm. Imago dipelihara sampai meletakkan telur. Banyaknya cawan petri berisi larutan madu yang diletakkan dalam kotak pemeliharaan masing-masing 4 cawan. Dalam satu kotak pemeliharaan bisa menampung hingga 20 imago jantan dan betina. Telur-telur yang diletakkan dipindahkan dan disimpan dalam inkubator pada suhu 12ºC untuk menunda penetasannya. Setelah telur yang terkumpul jumlahnya cukup untuk digunakan dalam pengujian, telur dikeluarkan dari inkubator dan dipindahkan ke cawan petri yang telah dialasi kertas saring yang sudah dilembabkan hingga menetas menjadi larva. Larva-larva tersebut kemudian dipindahkan dalam wadah plastik berukuran 33cm x 16cm x 8cm yang telah dialasi tisu yang sudah dilembabkan pada bagian bawah dan atasnya serta diberi pakan jagung muda untuk selanjutnya digunakan dalam pengujian sesuai dengan instar yang dibutuhkan. Pakan madu diganti tiap 2 hari, sedangkan jagung muda diganti tiap 3 hari. Sementara untuk pengujian menggunakan telur, telur dibiarkan 2-3 hari di inkubator hingga siap untuk dilakukan pengujian. Kelompok telur yang digunakan dalam pengujian adalah yang sudah hampir menetas dan memperlihatkan bakal kepala larva yang berwarna hitam (Gambar 3).
Gambar 2 Kurungan untuk pemeliharaan imago O. furnacalis
11 Preparasi B. bassiana dan L.lecanii
Isolat cendawan yang digunakan dalam penelitian ini berasal dari koleksi Laboratorium Patologi Serangga, Departemen Proteksi Tanaman IPB. Untuk meningkatkan virulensinya, cendawan tersebut diinokulasikan lagi ke tubuh serangga untuk melengkapi fase infektifnya. Serangga inang yang digunakan adalah kumbang Tenebrio molitor. Larva T.molitor didapat dari pasar burung di daerah Empang, Bogor. Larva-larva ini diberi pakan pellet dan dipelihara dalam wadah plastik (seperti yang digunakan untuk meyimpan potongan batang jagung dari lapangan) hingga menjadi imago. Imago inilah yang kemudian digunakan untuk menaikkan virulensi cendawan B. bassiana dan L. lecanii yang sudah lama disimpan di laboratorium.
Suspensi dari masing-masing isolat dibuat, lalu disemprotkan pada T. molitor dan dibiarkan hingga tumbuh miseliumnya (Gambar 4). Miselia tersebut kemudian diisolasi pada PDA. Isolat yang berasal dari T. molitor yang sudah dimurnikan pada media PDA inilah yang akan diperbanyak pada media beras untuk digunakan dalam penelitian ini.
Perbanyakan B. bassiana dan L. lecanii pada Media Beras
Biakan murni isolat B. bassiana dan L. lecanii dari media PDA umur 14 hari selanjutnya diperbanyak pada media beras. Hal ini bertujuan untuk mendapatkan kerapatan konidia yang diperlukan dalam penelitian ini. Beras yang sudah dicuci hingga bersih, dikukus setengah matang lalu didinginkan dalam nampan-nampan plastik. Media sebanyak ± 50 g dimasukkan dalam kantong-katong plastik bening tahan panas. Media beras tersebut disterilisasi dengan autoklaf. Setelah dingin, mediadiinokulasi denganB. bassiana dan L. lecanii. Media beras diusahakan agar bercampur dengan konidia cendawan. Semua tahapan dilakukan pada kondisi steril dalam laminarflow. Biakan cendawan ini diinkubasi selama 21 hari, umur optimum untuk pengujian (Gambar 5).
12
Penyiapan Suspensi B bassiana dan L.lecanii untuk Pengujian
BiakanB. bassiana dan L. lecanii pada media beras dibuat suspensi. Media diambil sebanyak 2 kantong (50 g/kantong) dan digerus dengan mortar sampai halus. Akuades yang telah disterilkan ditambahkan pada media sebanyak 100 mLdan larutan Tween 20 sebanyak 0.025 mL tiap 50 mL air (0.05%), lalu dikocok dengan vortex selama 30 detik hingga homogen. Campuran disaring dengan kain kasa halus dan dimasukkan ke dalam labu Erlenmeyer berukuran 100 mL. Kerapatan konidia dari suspensi dihitung dengan menggunakan haemocytometer Neubauer-improved hingga didapatkan kerapatan konidia yang tertinggi yaitu 109 konidia/mL. Kerapatan konidia lainnya diperoleh dengan membuat pengenceran bertingkat dengan campuran akuades steril.
Uji MortalitasB. bassiana dan L. lecanii terhadap Telur O. furnacalis
Sebelum perlakuan, kelompok-kelompok telur O. furnacalis diseragamkan perkembangannya dengan cara disimpan dalam inkubator pada suhu ± 10ºC. Telur yang digunakan dalam pengujian adalah yang sudah hampir menetas, yang ditandai mulai terlihat bintik-bintik berwarna hitam yang merupakan bakal kepala larva. Jumlah telur dalam masing-masing kelompok dihitung terlebih dahulu di bawah mikroskop sebelum perlakuan. Kerapatan konidia yang digunakan pada perlakuan telurO. furnacalis, yaitu 105, 106, 107, 108 dan 109 konidia/mL dan volume semprot ± 3 mL untuk masing-masing perlakuan. Setiap perlakuan dilakukan 4 ulangan. Perlakuan dilakukan dengan cara menyemprot kelompok telur yang diletakkan dalam cawan petri berdiameter 8 cm yang sudah dialasi kertas saring yang telah dilembabkan terlebih dulu. Perlakuan kontrol dilakukan dengan menyemprotkan air steril pada permukaan kelompok telur. Pengamatan dilakukan setiap hari selama lima hari. Telur yang tidak menetas dari tiap-tiap kelompok telur diamati. Selain itu juga diamati miselia cendawan entomopatogen yang tumbuh pada cangkang telur
13 Uji Mortalitas B. bassiana dan L. lecanii terhadap Larva O. furnacalis
Pada cawan petri berdiameter 9 cm dimasukkan 20 ekor larva instar II O. furnacalis.Larva-larva tersebut disemprot dengan konidia B. bassiana dengan kerapatan 105,106,107,108 dan 109 konidia/mL. Tiap-tiap perlakuan dibuat ulangan sebanyak 4 ulangan. Volume suspensi yang disemprotkan ± 3mL untuk masing-masing perlakuan. Perlakuan kontrol dilakukan dengan menyemprotkan air steril. Larva-larva dipindahkan ke dalam cawan petri berdiameter 15 cm yang telah dialasi tisu dan diberi jagung muda untuk pakannya. Wadah-wadah tersebut diletakkan di atas meja laboratorium dengan suhu ruang untuk diamati lebih lanjut. Untuk menjaga kelembaban, air steril disemprotkan ke kertas tisu bersamaan dengan penggantian pakan. Mortalitas larvadan LC50diamati setiap hari selama tujuh hari.dari masing-masing perlakuan. Selain itu miseliayang tumbuh pada larva yang mati diamati. Seluruh data yang diperoleh dicatat untuk dianalisis lebih lanjut. Pengujian yang sama juga dilakukan dengan menggunakan cendawan uji L. lecanii.
Rancangan Percobaan
15
4
HASIL DAN PEMBAHASAN
Hasil
Infektifitas B. bassiana dan L. lecanii terhadap Larva O. furnacalis
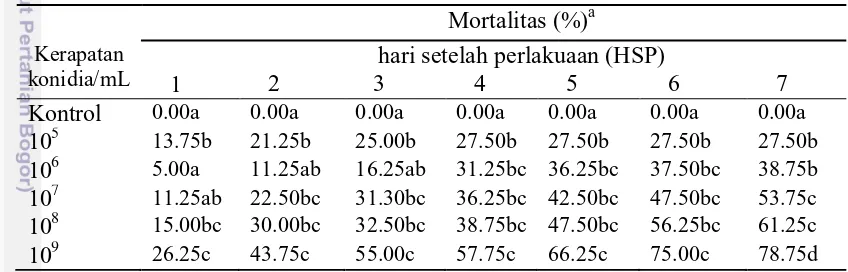
Hasil pengamatan pada perlakuan larva O. furnacalis dengan cendawan B. bassiana dari hari pertama hingga hari ketujuh terlihat terjadi peningkatan mortalitas larva pada semua perlakuan, kecuali perlakuan dengan kerapatan 105 konidia/mL terlihat mortalitas larva hanya terjadi hingga hari keempat pengamatan. Hal ini mungkin disebabkan oleh kerapatan konidia yang rendah.Soehardjan dan Sudarmaji (1993) melaporkan bahwa konsentrasi cendawan patogen yang menimbulkan daya bunuh yang optimal terhadap serangga berada pada tingkat 107 konidia/mL suspensi. Persentase mortalitas tertinggi terlihat pada kerapatan 109 konidia/mL yaitu 78.75% (Tabel 1).
Tabel 1 Mortalitas larva O. furnacalis setelah aplikasi B. bassiana selama tujuh hari pengamatan
Kontrol 0.00a 0.00a 0.00a 0.00a 0.00a 0.00a 0.00a
105 13.75b 21.25b 25.00b 27.50b 27.50b 27.50b 27.50b
106 5.00a 11.25ab 16.25ab 31.25bc 36.25bc 37.50bc 38.75b
107 11.25ab 22.50bc 31.30bc 36.25bc 42.50bc 47.50bc 53.75c
108 15.00bc 30.00bc 32.50bc 38.75bc 47.50bc 56.25bc 61.25c
109 26.25c 43.75c 55.00c 57.75c 66.25c 75.00c 78.75d
a
Nilai rataan yang diikuti huruf kecil yang sama pada setiap lajur menunjukkan tidak berbeda
nyata pada uji Duncan, α = 0.05
Menurut Melina (2008) kematian serangga akibat cendawan entomopatogen biasanya terjadi 2 harisampai 14 hari setelah terinfeksi, namun kematian bisa pula terjadi kurang dari 24 jam. Cepat atau lambat terjadinya mortalitas pada serangga uji bergantung pada kerentanan dari masing-masing individu serangga. Semakin muda instar larva yang digunakan, biasanya kerentanannya terhadap patogen juga semakin tinggi. Selain itu, isolat yang berbeda juga akan menyebabkan mortalitas yang berbeda terhadap serangga uji (Trizelia 2005). Kematian serangga biasanya terjadi karena rusaknya jaringan-jaringan tubuh serangga yang dipenuhi miselia yang menyebar dengan cepat dan memenuhi hemosel serangga inang, semua cairan tubuh inang digunakan untuk multiplikasi cendawan sehingga menyebabkan serangga mati dengan tubuh mengeras. Kematian serangga inang berhubungan erat dengan total konidia yang tertelan dan yang kontak dengan serangga.
16
pengamatan hari pertama hingga hari ketujuh terjadi peningkatan mortalitas larva (Tabel 2).
Mortalitas yang tertinggi terjadi pada perlakuan dengan kerapatan 109 konidia/mL yaitu sebesar 71.25%. Selain itu mortalitas larva juga masih bertambah hingga hari ketujuh pengamatan. Berdasarkan Tabel 2 dan 3 dapat dilihat bahwa aplikasi cendawan patogen B. bassianamengakibatkan mortalitas yang lebih tinggi terhadap larva O. furnacalis dibandingkan L. lecanii. Hasil tersebut sesuai dengan yang dilaporkan Prayogo (2002) yang mengemukakan bahwa B. bassiana menyebabkan mortalitas yang lebih tinggi dibandingkan L. lecanii terhadap Spodoptera litura.
Tabel 2 Mortalitas larva O. furnacalis setelah aplikasi L. lecanii selama tujuh hari pengamatan
Kontrol 0.00a 0.00a 0.00a 0.00a 0.00a 0.00a 0.00a
105 5.00a 7.50a 7.50a 8.75a 11.25b 18.75b 20.00b
106 6.25a 13.75ab 20.00b 21.25b 26.25c 31.25c 35.00c
107 11.25ab 16.25b 21.25b 26.25b 35.00c 46.25cd 51.25c
108 12.50ab 23.75bc 31.25b 41.25c 51.25cd 58.75cd 67.50d
109 26.25b 37.50c 50.00c 57.50d 61.25d 65.00d 71.25e
a
Nilai rataan yang diikuti huruf kecil yang sama pada setiap lajur menunjukkan tidak berbeda nyata pada uji Duncan, α = 0.05
Tabel 3 Mortalitas kumulatif larva O. furnacalis yang yang mati selama tujuh hari pengamatan setelah aplikasi B. bassiana
17
Secara kumulatif baik aplikasi menggunakan cendawan patogen B. bassiana maupun L. lecanii menunjukkan bahwa dengan semakin tingginya kerapatan konidia/mL suspensi, maka mortalitas larva O. furnacalis juga akan semakin tinggi. Hasil ini sesuai dengan pernyataan James dan Lighthart (1994) bahwa adanya korelasi positif antara kerapatan konidia cendawan entomopatogen dengan mortalitas serangga uji, yaitu semakin tinggi kerapatan konidia cendawan entomopatogen maka mortalitas serangga uji juga semakin tinggi. Persentase mortalitas tertinggi untuk aplikasi menggunakan B. bassiana yaitu 78.75% dan L. lecanii 71.25%. Sedangkan yang terendah 27.50% untuk aplikasi menggunakan B. bassiana dan 20 % untuk L. lecanii. Berdasarkandata ini terlihat bahwaB. bassiana memiliki persentase mortalitas yang lebih tinggi terhadap larva O. furnacalis dibandingkan L. lecanii (Tabel 3 dan 4).
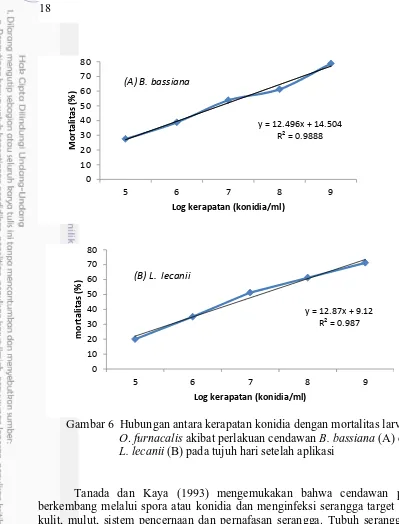
Analisis regresi dibuat berdasarkan data mortalitas larva hingga hari ketujuh pengamatan.Persamaan garis regresi yang didapat dari hasil perlakuanB. bassiana terhadap larva O. furnacalis yaitu y=12.49x+14.50, yang artinya jika kerapatan konidia B. bassiana naik sebesar 101 (satu unit) maka mortalitas akan ikut naik sebesar 12.49% (Gambar 6). Analisis probit dilakukan untuk mengetahui pengaruh infeksiB. bassiana terhadap larva O. furnacalis yang ditunjukkan dengan nilai LC50 sebesar 1.39x106konidia/mL pada hari ketujuh pengamatan. Ini artinyaB. bassiana dengan kerapatan sebesar 1.39x106 sudah mampu membunuh 50% dari populasi serangga uji O. furnacalis.
18
Gambar 6 Hubungan antara kerapatan konidia dengan mortalitas larva O. furnacalis akibat perlakuan cendawan B. bassiana (A) dan L. lecanii (B) pada tujuh hari setelah aplikasi
19
Berdasarkan hasil penelitian juga diketahui bahwa tidak semua bangkai larva yang terinfeksi cendawan B. bassiana dan L. lecanii dari tubuhnya tumbuh miselia cendawan patogen tersebut. Menurut Trizelia (2005) dan Santoso (1993) hal ini bisa terjadi karena kondisi lingkungan yang kurang sesuai untuk perkembangan miselia cendawan di luar tubuh inangnya.
Pemeriksaan mikroskop menunjukkan bahwa konidia cendawan B. bassiana berbentuk bulat atau oval dan terbentuk pada tiap ujung percabangan konidiofor yang membentuk pola zigzag (rachis). Sementara cendawan L. lecanii konidianya berbentuk silinder sampai elips yang biasanya terbungkus dalam kantung lender dengan konidiofor seperti huruf V (Gambar 8). Ini berarti bahwa cendawan yang tumbuh adalah cendawan yang berasal dari aplikasi percobaan.
Infektifitas B. bassiana dan L. lecanii Terhadap Telur O. furnacalis
Kelompok telur O. furnacalis yang telah diaplikasi dengan cendawan patogen B.bassiana dan L. lecanii tampak tertutupi oleh miselia masing-masing cendawan yang mulai muncul pada hari ketiga setelah aplikasi.
Hasil pengamatan pada perlakuan telur yang diaplikasi denganB. bassiana dan L. lecanii secara umum menunjukkan bahwa dengan semakin meningkatnya kerapatan konidia maka persentase telur yang tidak menetas akan semakin meningkat juga. Pada perlakuan ini keseluruhan telur hanya menetas pada hari ketiga setelah perlakuan dan tidak ada lagi telur yang menetas hingga hari kelima
Gambar 7 Bangkai O. furnacalis yang ditumbuhi miselia B. bassiana (a) dan L. lecanii (b)
a b
Gambar 8 Konidiofor B. bassiana berbentuk zigzag (a) dan L. lecanii seperti huruf V (b) (perbesaran 400x)
20
pengamatan. Persentase mortalitas tertinggi dimana telur tidak menetas sebesar 100% terlihat pada perlakuan dengan kerapatan konidia 109 konidia/mL untuk B. bassiana serta kerapatan 109 dan 108 konidia/mL untuk L. lecanii (Tabel 5 dan 6).
Tabel 5 Mortalitas telur O. furnacalis setelah aplikasi B. bassiana selama lima hari pengamatan
Tabel 6 Mortalitas telur O. furnacalis setelah aplikasi L. lecanii selama lima hari pengamatan apabila kerapatan konidianya ditingkatkan menjadi 108 konidia/mL mampu menyebabkan mortalitas T. pavorariorum hingga mencapai 100 % dalam kurun waktu lima hari setelah aplikasi.
Mortalitas telur O. furnacalis yang tinggi juga dimungkinkan karena kondisi telur yang digunakan dalam pengujian sudah hampir menetas. Gindin et al.(2000) dan del Prado et al. (2008) menyatakan bahwa telur yang efektif untuk dikendalikan dengan cendawan entomopatogen adalah telur yang baru diletakkan oleh imago atau telur yang sudah hampir menetas. Hal ini dikarenakan pada telur yang baru diletakkan struktur bagian telur terluar, yaitu korion masih lentur karena belum mengalami pengerasan (melanisasi), sehingga tabung kecambah (germ tube) yang baru terbentuk pada konidia selanjutnya lebih mudah untuk penetrasi masuk ke dalam jaringan telur. Sementara pada telur yang yang hampir menetas, dimana struktur korion mulai pecah sehingga konidia yang berkecambah langsung penetrasi ke dalam telur.
21 semua stadia perkembangan serangga. Menurut Soesanto dan Darsam (1993) cendawan B. bassiana juga mampu menyerang semua stadia perkembangan serangga, sehingga bisa juga diaplikasikan pada telur. Selain itu aplikasi cendawan entomopatogen pada telur lebih mudah karena telur tidak bergerak, sehingga suspensi cendawan yang diaplikasikan mudah mengenai sasaran. Ini nampak dari data yang memperlihatkan persentase mortalitas hasil pengujian kedua cendawan entomopatogen lebih tinggi pada aplikasi telur dibandingkanpada larva O. furnacalis.
Tabel 7 Persentase kumulatif larva instar I yang mampu hidup setelah aplikasi B. bassiana pada telur O. furnacalis
Kerapatan konidia/mL Larva instar I yang hidup (%)
Kontrol 100
Kerapatan konidia/mL Larva instar I yang hidup (%)
22
keluar masih bisa mati. Tabel 7 dan 8 memperlihatkan persentase kumulatif larva instar I yang mampu hidup setelah empat hari telur menetas.
Gambar 9 menunjukkan hasil analisis regresi perlakuan cendawan B. bassiana dan L. lecanii pada telur O. furnacalis. Persamaan garis regresi yang didapat untuk aplikasi dengan cendawan B. bassiana adalah y=18.66x+11.10. Sementara itu persamaan garis regresi yang didapat untuk perlakuan telur dengan cendawan L. lecanii yaitu y=21.83x+1.42. Nilai LC50 yang didapat dari analisis probit untuk perlakuan telur dengan cendawan B. bassiana adalah 9.6x105 konidia/mL dan untuk cendawan L. lecanii adalah 6.1x105 konidia/mL. Iniartinya B. bassiana dengan kenaikan kerapatan konidia satu unit kerapatan kemampuannya untuk menyebabkan mortalitas pada telur O. furnacalis lebih rendah dibanding cendawan L. lecanii pada kerapatan konidia yang sama. Selain itu, cendawanB. bassiana juga membutuhkan kerapatan konidia yang lebih tinggi dibandingkan cendawan L. lecanii untuk menyebabkan mortalitas sebesar 50% dari populasi telur O. furnacalis yang diuji. Sedangkan nilai R2 (koefisien regresi) yang diperoleh dari kedua persamaan regresi baik untuk perlakuan dengan B. bassiana maupun L. lecanii nilainya lebih besar dari 0.9, ini artinya infeksi kedua cendawan entomopatogen yang digunakan mempengaruhi mortalitas telur O. furnacalis.
23 Pembahasan Umum
Pengamatan di laboratorium menunjukkan bahwa imago mulai keluar dari potongan batang jagung pada seminggu hingga sebulan setelah koleksi dari lapangan. Jika dilihat dari data lama hidup tiap stadia, maka O. furnacalistersebut berada pada stadia yang bervariasi. Selain itu pertanaman jagung yang banyak menunjukkan gejala serangan adalah di areal pertanaman yang banyak ditumbuhi gulma dan daun-daun terbawahnya tidak dibuang/dirompes (Gambar 10).
Serangga O.furnacalis umum ditemukan pada pertanaman jagung manis (sweetcorn). Kehadiran hormon/enzim dimboa pada tanaman jagung merupakan faktor yang menarik datangnya O. furnacalis pada tanaman jagung (Melinaet al. 2008). Hasil koleksi dari lapangan juga menunjukkan bahwa dalam satu batang tanaman jagung bisa ditemukan lebih dari satu bekas lubang gerekan. Tabel 9 memperlihatkan persentase imago total dan rasio jantan betina yang berasal dari koleksi O. furnacalis dari lapangan. Dari batang jagung terserang yang dikumpulkan, tidak selalu keluar imago. Ini menandakan bahwa sebagian individu larav atau pupa mati di dalam liang gerek, atau liang gerek tersebut tidak dihuni lagi karena larva telah berpindah ke bagian batang lain. Kematian tersebut mungkin disebabkan karena serangan agens hayati seperti parasitoid, predator, virus, bakteri, cendawan atau nematoda yang menyerang O. furnacalis selama di lapangan. Rahmawati (2012) mendapatkan nematoda yang dapat menyerang larva O. furnacalis di Bogor; parasitoid dari Ordo Diptera juga diketahui menyerang larva (Santoso T 8 Oktober 2013, komunikasi pribadi).
Jumlah telur yang diletakkan imago betina di laboratorium berkisar antara 8-86 butir dengan rata-rata 33.06 butir. Hasil ini sesuai dengan yang disampaikan Kalshoven (1981) yang menyatakan jumlah telur O. furnacalis berkisar antara 2 hingga lebih dari 100 butir. Berdasarkan data di atas terlihat besarnya potensi reproduksi O. furnacalis sebagai hama.
24
Serangga O. furnacalis mengalami metamorfosis sempurna. Tahap perkembangan O. furnacalis secara umum yaitu telur, larva, pupa dan imago (Gambar 11). Menurut Nonci (2004), telur diletakkan dalam bentuk kelompok telur. Pada waktu baru diletakkan telur berwarna putih kekuningan dan apabila telur sudah akan menetas maka akan terlihat titik-titik kehitaman yang merupakan bakal kepala larva. Perkembangan larva terdiri atas lima instar, dengan stadia dan ukuran tubuh yang berbeda-beda antar instar. Larva berbentuk eruciform. Instar I-II biasanya menyerang daun, pucuk dan bunga jantan; instar I-III-V menyerang daun, bunga jantan dan batang. Pengendalian terhadap hama ini relatif mudah dilakukan pada larva instar awal (instar I-III) karena masih berada di sekitar daun dan kondisinya relatif masih rentan. Pupa O. furnacalisbertipe obtekta. Stadia pupa antara 7-9 hari, sedangkan Heryana (2012) mendapatkan stadia pupa berlangsung 6-8 hari. Nisbah kelamin (sex ratio) yang diperoleh adalah 1 : 1, meskipun di dalam laboratorium dengan menggunakan pakan buatan.Populasi serangga jantan cenderung sedikit lebih tinggi dibandingkan serangga betina (Santoso T 8 Oktober 2013, komunikasi pribadi). Imago aktif pada malam hari. Ukuran tubuh imago jantan lebih kecil daripada imago betina, tetapi warnanya lebih cerah.
(a) (b) (c)
(d)
Gambar 11 Tahapan perkembangan O. furnacalis: telur (a), larva (b), pupa (c, kiri jantan, kanan betina) dan imago (d, kiri jantan,
25 KoloniL. lecanii dan B. bassianadi media PDA menunjukkan karakteristik yang berbeda (Gambar 12). Warna koloni B. bassiana lebih putih bersih serta membentuk koloni-koloni kecil yang menyebar.sedangkan koloni L. lecaniberwarnaputih kotor mengelompok seperti kumpulan benang wol.
B. bassiana dan L. lecanii tergolong fungi imperfect atau tidak sempurna karena tidak ditemukan fase seksualnya, memperbanyak diri dengan spora aseksual yang disebut konidia. Kedua cendawan ini masuk ke dalam filum Deuteromycota kelas Hyphomycetes. Cendawan dari kelompok ini umumnya banyak digunakan dalam pengendalian hayati karena relatif mudah diperbanyak pada media buatan dan konidianya relatif stabil sehingga mudah dalam penanganannya. Kebanyakan Deuteromycetes adalah patogen fakultatif yang bisa hidup sebagai saprofit di tanah (Bidachka et al. 2000). Miselia mulai tampakpada permukaan tubuh serangga umumnya pada hari ketiga setelah kematian. Hal inijugaterjadi pada cangkang telur O. furnacalis yang diperlakukan dengan kedua cendawan tersebut. Hasil pengamatan di bawah mikroskopmenunjukkan bahwa cendawan yang menyebabkan mortalitas larva dan telur O. furnacalis adalah L. lecanii dan B. bassiana (Gambar13dan14).
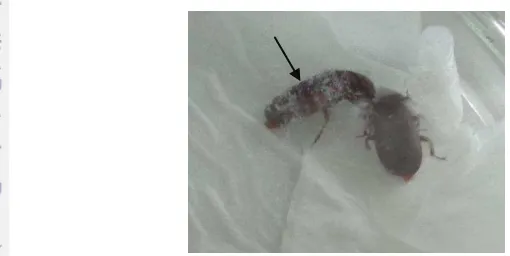
Gejala awal larva yang terinfeksi adalalah gerakan kurang aktif dan nafsu
a b
Gambar 12 Koloni L. lecanii (a) dan B. bassiana (b) pada media PDA
Gambar 13 Konidia B. bassiana yang diambil dari bangkai larva (a) dan telur (b) O. furnacalis(perbesaran 400x)
a a
26
Gambar 14 Konidia L. lecanii yang diambil dari bangkai larva (a) dan telur (b)
O. furnacalis (perbesaran 400x)
Gejala awal larva yang terinfeksi adalah gerakan kurang aktif dan nafsu makan berkurang, kemudian larva mengalami kematian.miselium cendawan tumbuh yang semakin lama semakin tebal (Gambar 15).Hasil tersebut sesuai dengan pernyataan Boucias dan Pendland (1998) bahwa serangga yang terinfeksi cendawan entomopatogen menjadi kurang aktif, nafsu makan berkurang, lemah, kurang koordinasi dan akhirnya mati. Biasanya, cendawan patogen masuk ke dalam tubuh serangga inang melalui membran intersegmental, menyebar ke seluruh lapisan dinding tubuh dengan bantuan enzim proteinase, lipase dan kitinase (Ferron 1985). Tidak semua serangga yang mati ditumbuhi oleh miselium. Hal ini menurut Santoso (1993) biasanya disebabkan karena keadaaan yang kurang mendukung, sehingga pertumbuhan cendawan hanya berlangsung dalam tubuh inangnya tidak sampai keluar menembus integumen.
Cendawan entomopatogen memegang peranan penting dalam mengendalikan populasi serangga di alam. Cara kerja cendawan entomopatogen membutuhkan waktu yang lebih lama untuk mematikan serangga targetnya. Selama proses infeksi, cendawan entomopatogen menghasilkan sejumLah enzim selama masa perkecambahan dalam tubuh inang seperti protease, kitinase, dan lipase yang berfungsi untuk mendegradasi kutikula inang dan memfasilitasi penempelan konidia cendawan entomopatogen pada kutikula serangga inang Cendawan entomopatogen juga menghasilkan beberapa jenis toksin yang dalam
a
Gambar 15 Larva O. furnacalis dengan infeksi awal (a) mulai ditumbuhi miselia (b) dan sudah ditutupi miselia (c) cendawan entomopatogen
b c
27 cara kerjanya akan menyebabkan kenaikan pH hemolimfa, penggumpalan dan terhentinya peredaran hemolimfa serangga inang. Beberapa toksin yang dihasilkan oleh cendawan B. bassiana adalah bassianin, beauvericin, bassianolide, beaverolides dan tenellin, sedangkan yang dihasilkan oleh L. lecanii adalah dipcolonic acid, hydroxy carboxylic acid dan cyclosporin. Toksin ini dapat menimbulkan gangguan pada fungsi hemolimfa dan nukleus serangga, sehingga mengakibatkan pembengkakan dan pengerasan pada serangga yang terinfeksi (Vey et al. 2001).
Data penelitian menunjukkan bahwa dalam pengendalian larva O.furnacalis, cendawan B. bassiana dan L. lecanii mempunyai patogenisitas seimbang. Demikian juga patogenisitas kedua cendawan terhadap telur O.furnacalis cenderung seimbang dengan kemiringan regresi yang juga kurang lebih seimbang.
29
5
SIMPULAN DAN SARAN
Cendawan patogen B. bassiana mampu menyebabkan mortalitas larva O. furnacalis 78.75% pada kerapatan 109 konidia/mL, sedangkan cendawan L. lecanii pada kerapatan yang sama menunjukkan keefektifan 71.25%. Nilai LC50 untuk perlakuan larva dengan cendawan B. bassiana sebesar 1.39x106 konidia/mL dan LC50 untuk L. lecanii adalah sebesar 1.62x106 konidia/mL.
Pada perlakuan telur O. furnacalis, kerapatan 109 konidia/mL mampu menyebabkan mortalitas hingga 100% dan kerapatan 108 dan 109 konidia/mL juga mampu menyebabkan mortalitas hingga 100% pada penelitian ini. Nilai LC50 untuk B. bassiana adalah 9.6x105 konidia/mL dan untuk L. lecanii sebesar 6.1x109 konidia/mL.
31
DAFTAR PUSTAKA
Agullo BG, Lopez RF, Asensio L, Barronco P, Lopez-liorca LV. 2011. Use of a solid formulation of Beauveria bassiana for biocontrol of the red palm weevil (Rhynchophorus ferrugineus) (Coleoptera: Dryophthoridae) under field condition in the Spain. Florida Entomol Soc. 94(4): 737-747.
Aiuchi D, Horie S, Koike M. 2007. Screening of Verticillium lecanii (=Lecanicillium lecanii) hybrid strains based on evaluation of pathogenicity against cotton aphid and greenhouse whitefly and viability on leaf surface. J Appl Entomol and Zool.51: 205-212.
Alavo TBC, Sermann H, Bochow H. 2002. Biocontrol of Bemisia tabaci using Verticillium lecanii in greenhouse: Factor reducing the effectiveness of the entomopathogenic fungus. J Arch Phytopathol and Plant Protect. 34(6): 407-424.
Alexopoulos CJ, Mims CW. 1996. Introductory Mycology. 4th ed. New York: John Wiley and Sons. 177p.
Bari D. 2006. Keefektifan beberapa isolat cendawan entomopatogen Beauveriabassiana (Balsamo) Vuillemin terhadap hama boleng Cylas formicarius (Fabr.) (Coleoptera: Curculionidae) di laboratorium. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Bato SM, Everett TR, Malijan OO. 1983. Integrated pest management for Asian Corn Borer control. National Crop Protection Centre Series. (PH). 9:4. Bidochka MJ, Kamp AM, de Cross JNA. 2000. Insect pathogenic fungi: from
genes to populations. Di dalam: JW Kronstad, editor. Fungal Pathology. Nederlands: Springer. hlm 171-173.
Boucias DG, Pendland JC. 1998. Principles of Insect Pathology. Boston: Kluwer Academic Publisher.
Bouhous M, Larbi L. 2012. Efficiency of the entomopathogenic fungus Verticillium lecanii in the biological control of Trialeurodes vaporariorum (Homoptera: Aleyrodidae), a greenhouse culture pest. African J of Microb Res.6(10): 2435-2442.
[BPS] Badan Pusat Statistik. 2013. ARAM I Jagung Nasional. 2013. Jakarta (ID): Badan Pusat Statistik.
Castillo MA, Moya P, Hernandez E, Primo YE. 2000. Susceptibility of Ceratitiscapitata Wiedemann (Diptera: Tephritidae) to entomopathogenic fungi and their extracts. Biol Control. 19: 274-282.
Chadler D. 2005. Evolution of fungal virulence. Warwick (UK): University of Warwick.
Cuthbertson AGS, North JP, Walters KFA. 2005. Effect of temperature and host plant leaf morphology on the efficacy of two entomopathogen biocontrol agents of Thrips palmi (Thysanoptera: Thripidae). Bull Entomol Res. 95: 321-327.
32
Fatiha L, Ali S, Ren S, Afzal M. 2007. Biological characterictics and pathogenicity of Verticillium lecanii against Bemisia tabaci (Homoptera: Aleyrodidae) on eggplant. J Pak Entomol. 29(2): 63-72.
Feng KC, Liu BL, Tzeng YM. 2002. Morphological characterization and germination of aerial and submerged spores of the entomopathogenic fungus Verticillium lecanii. World J Microbiol and Biotechnol. 18(3): 217-224. Ferron P. 1985. Fungal Control. Di dalam: Kerkut GA, Gilbert LI, editor.
Comprehensive Insect Physiology Biochemistry and Pharmacology. Oxford (GB): Pergamon Press Ltd. Hlm 313-341.
Gindin G, Geschtort NU, Raccah B, Barash I. 2000. Pathogenicity of Verticilliumlecanii to different developmental stages of the silverleaf whitefly Bemisia argentifolii. Phytopar. 28(3): 231-242.
Godfrey LD, Haltzer YO, Norman JM. 1991. Effects of European corn borer (Lepidoptera: Pyralidae) tunneling and drought stress of field corn gas exchange parameters. J of Econ Entomol. 84(4): 1370-1380.
Hall TM. 1973. Use of microorganism in biological control. Di dalam: Debac, editor. Biological control of insects pest and weeds. London (GB): Chapman and Hall Ltd. hlm 610-628.
Hassanloui TR, Kharezi PA, Goettel MS, Little S, Mozaffari J. 2007. Germination polarity of Beauveria bassiana conidia and its possible correlation with virulence. J. Invert Pathol. 94: 102-107.
Heryana RTS. 2012. Penggerek batang jagung Ostrinia furnacalis Guenee (Lepidoptera: Crambidae): Tingkat serangan di wilayah Bogor dan siklus hidupnya di laboratorium. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Howard AFV, N’Guessan R, Koenraadt CJN, Asidi A, Farenhorst M, Akogbeto
M, Thomas MB, Knok BGJ, Takken W. 2010. The entomopathogenic fungus Beauveria bassiana reduces instantaneous blood feeding in wild multi-insecticide-resistant Culex quinquefasciatus mosquitoes in Benin, West Africa. J. Parasites and Vector. 3: 87.
James RR, Lighthart B. 1994. Suscepibility of the convergent lady beetle (Coleoptera: Coccinellidae) to four entomogenous fungi. Environ Entomol. 23: 190-192.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. Laan PA van der, penerjemah. Jakarta(ID): Ichtiar Baru-van Hoeve. Terjemahan dari: De Plagen van deCultuurgewassen in Indonesie.
Kaur S, Preet KH, Kaur K, Kaur A. 2011. Effect of different concentrations of Beauveria bassiana on development and reproductive potential of Spodoptera litura (Fabricius). J of Biopesticides. 4(2): 161-168.
Lee MH, Yoon YS, Yun T, Kim HS, Yoo JK,. 2002. Selection of a highly virulent Verticillium lecanii strain againts Trialeurodes pavorariorum at various temperature. J Microbiol and Biotechnol. 12(1): 145-148.
Mas’ud S. 2010. Efektivitas pellet alginat Beauveria bassiana dalam beberapa kisaran dosis untuk menekan serangan penggerek jagung. Maros (ID): Pusat Penelitian Tanaman Serealia.
33 Melina, Bassa, Madika DP, Yumarto. 2008. Pengujian cendawan entomopatogen Fusarium spp. terhadap penggerek batang jagung Ostrinia furnacalis Guenee (Lepidoptera: Pyralidae). Agrikam (ID). 2(4): 211-218.
Meyer SLF, Robert DP, Wergin WP. 1998. Association of the plant-beneficial fungus Verticillium lecanii with soybean root and rhizosphere. J of Nemat.30(4): 451-460.
Miller TC, Gubler WD, LaemmLen FF, Geng S, Rizzo DM. 2003. Potential for using Lecanicillium lecanii for suppression of strawberry powdery mildew. Bioc Sci and Tech.. 14(2): 215-220.
Monteiro AC, Barbosa CC, Correira ACB. 2004. Growth and sporulation of Verticillium lecanii isolates under different environmental conditions. PestAgropec Bras. 39(6): 561-565.
Nafus OM, Schreiner IH. 1987. Location of Ostrinia furnacalis (Lepidoptera: Pyralidae) egg and larva on sweet corn in relation to plant growth stage. JEcon. Entomol. 80(2): 411-416.
Nonci N, Baco D. 1987. Pengaruh waktu infestasi dan jumLah larva Ostrinia furnacalis Guenee terhadap kerusakan pada tanaman jagung. Agrikam (ID). 2(2): 49-59.
Nonci N, Baco D. 1991. Pertumbuhan penggerek jagung (Ostrinia furnacalis) Guenee pada berbagai tingkat umur tanaman jagung (Zea mays L.). Agrikam (ID). 6(3): 95-101.
Nonci N. 2004. Biologi dan musuh alami penggerek batang Ostrinia furnacalis Guenee (Lepidoptera: Pyralidae) pada tanaman jagung. Jurnal Litbangtan(ID). 23(1): 8-14.
Park HY, Keun K. 2010. Selection of Lecanicillium strains with high virulence against developmental stages of Bemisia tabaci. Mycobiol. 38(3): 210-214. Posada F, M Catherine Aime, Stephen WP, Stephen AR, Fernando EV. 2007.
Inoculation of coffee plants with the fungal entomopathogen Beauveriabassiana (Ascomycota: Hypocreales). British Mycological Society. III: 748-757.
Prado EN, Jose I, Hilda G. 2008. Effect of two entomopathogenic fungi in controlling A. cocois (Curtis, 1846) (Hemiptera: Aleyrodidae). Chilean Journal of Agric Res.68(1): 21-30.
Prayogo Y, Tengkano W, Suharsono. 2002. Jamur entomopatogen pada Spodoptera litura dan Helicoverpa armigera. Malang (ID): Balai Penelitan Tanaman Kacang-kacangan dan Umbi-umbian.
Prayogo Y. 2004. Penambahan minyak nabati untuk meningkatkan efikasi cendawan entomopatogen Lecanicillium lecanii dalam mengendalikan telur kepik coklat (Riptortus linearis) (Hemiptera: Alydidae) pada tanaman kedelai. Suara Lintan. 1(2): 28-40.
Prayogo Y. 2005. Optimalisasi pengendalian hama pengisap polong kedelai (Riptortus linearis) dengan cendawan entomopatogen Verticillium lecanii. J Litbangtan. 24(4): 123-130.
Prayogo Y. 2006. Upaya mempertahankan keefektifan cendawan entomopatogen untuk mengendalikan hama tanaman pangan. J Litbangtan. 25(2): 47-54. Prayogo Y. 2009. Kajian cendawan entomopatogen Lecanicillium lecanii (Zimm.)
34
polong kedelai Riptortus linearis (F.). [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Prayogo Y. 2012. Keefektifan cendawan entomopatogen Lecanicillium lecanii (Zare& Gams) terhadap Bemisia tabaci gen sebagai vektor Soybean MosaicVirus (SMV) pada tanaman kedelai. Suara Lintan. 2(1): 11-21. Purnama PC, Nastiti SJ, Situmorang J. 2003. Uji patogenisitas jamur
Beauveriabassiana pada Aphis craccivora. BioSMART. 5(2): 81-88.
Rahmawati LT. 2012. Distribusi nematoda entomopatogen pada pertanaman jagung (Zea mays) di wilayah Bogor. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ratissa DA. 2011. Keefektifan cendawan entomopatogen Beauveria bassiana (Bals.) Vuill terhadap Cylas formicarius (F.) (Coleoptera: Brentidae) dan pengaruhnya pada keperidian. [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Santoso T. 1993. Dasar-dasar patologi serangga. Di dalam: Martono E, Mahrub E, Putra NS, dan Trisetyawati Y, editor. Simposium Patologi Serangga I; Yogyakarta; 1993 Okt 12-13;Yogyakarta, Indonesia. Yogyakarta (ID): Universitas Gadjah Mada Press. Hlm 1-15.
Shinya R, Watanabe A, Aiuchi D, Tani M, Kuramochi K, Kushida A, Koike M. 2008. Potential of Verticillium lecanii (Lecanicillium spp.) hybrid strains as biological control agents for soybean cyst nematode: is protoplast fusion an effective tool for develpment of plant-parasitic nematode control agents? Japanese J of Nemat. 38(1): 9-18.
Soesanto, Darsam. 1993. Mikroba entomopatogenik:Patogenisitasnya terhadap Nezara viridula LDi dalam: Martono E, Mahrub E, Putra NS, dan Trisetyawati Y, editor. Simposium Patologi Serangga I; Yogyakarta, Indonesia;1993 Okt 12-13; Yogyakarta (ID): Universitas Gadjah Mada Press. Hlm 22-29.
Soehardjan, Sudarmadji. 1993. Pemanfaatan organisme mikro sebagai bioinsektisida di negara sedang berkembang. Jurnal Litbangtan(ID) XII(1): 7-10.
Stark JD, Banks JE. 2003. Population level effects of pesticides and other toxicant on arthropods. Annual Rev. of Entomol. (48): 505-519.
Steinhaus EA. 1963. Microbiolgy. New York (US): Comstock Publishing Company, Inc.
Surtikanti, Soenartiningsih, Yasin M, Baco D. 1997. Efektifitas cendawan Beauveria bassiana terhadap Ostrinia furnacalis Guenee di lapangan. Maros (ID): Balai Penelitian Tanaman Serealia.
Surtikanti, Yasin M. 2009. Keefektifan entomopatogenik Beauveria bassiana Vuill. dari berbagai media tumbuh terhadap Spodoptera litura F. (Lepidoptera: Noctuidae) di laboratorium. Maros (ID) : Balai Penelitian Tanaman Serealia.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego (US): Academic Press. INC. Harcourt Brace Javanovich, Publisher.