RIDHO PRATAMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penambatan Molekuler Senyawa Aktif Temulawak (Curcuma Xanthoriza) dengan Enzim COX-2
SebagaiKandidat Obat Anti Kanker Payudara adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Ridho Pratama
Xanthoriza) Dengan Enzim Cox-2 SebagaiKandidat Obat Anti Kanker Payudara.
Dibimbing oleh Laksmi Ambarsari dan Tony Ibnu Sumaryada.
Kasus kanker payudara adalah satu dari lima jenis penyakit kanker terbesar di dunia. Kasus kanker payudara di Indonesia mencapai 347.792 jiwa pada tahun 2013 (Kemenkes RI 2015). Kanker payudara diketahui memiliki kaitan erat dengan inflamasi kronis yang dikontrol oleh Siklooksigenase 2 (COX-2). Penghambatan pada enzim ini memiliki potensi untuk pengembangan obat antikanker payudara. Beberapa obat sintetis telah digunakan secara komersial untuk menghambat pertumbuhan sel kanker. Namun demikian obat ini memiliki beberapa efek samping yang berbahaya bagi tubuh seperti kerontokan rambut, diare, muntah, dan gangguan tidur. Untuk menghadapi tantangan ini, saat ini banyak dikembangkan obat yang berasal dari tanaman herbal.
Temulawak (Curcuma xanthoriza) adalah tanaman rimpang biasa
digunakan sebagai tanaman obat terhadap beberapa penyakit antara lain sebagai senyawa obat anti kanker, anti inflamasi dan menurunkan kadar kolesterol pada manusia. Komponen temulawak terdiri dari kurkuminoid dan santorizol. Kurkumin banyak diteliti karena memiliki berbagai khasiat obat yaitu dalam penurunan plak β-amiloid, menunda degradasi saraf, pengkelat logam, anti inflamasi, antioksidan, penurunan pembentukan mikroglia pada penyakit alzaimer, hepatoprotektif ,dan menghambat angiogenesis. Santorizol merupakan senyawa yang berperan sebagai zat antiproliferasi dengan cara menginduksi proses apoptosis pada sel MDA-MB-231.
Potensi senyawa aktif dari temulawak sebagai inhibitor dari enzim COX-2telah diuji dengan metode penambatan molekuler menggunakan perangkat lunak Autodock Vina. Hasil uji senyawa ligan dengan aturan Lipinski didapatkan hasil bahwa senyawa kurkuminoid dan santorizol memenuhikriteria sebagai senyawa obat. Seluruh senyawa aktif berhasil tertambat pada sisi aktif enzim COX-2. Kurkumin memiliki energi ikatan terbesar yaitu (ΔG) = -9,3 kkal/mol mendekati afinitas ikatan obat komersial selekoksib. Terdapat 3 ikatan hidrogen pada asam amino Arg106, Tyr341, dan His75,ketiga asam amino ini merupakan bagian sisi aktif dari COX-2. Terdapat 16 asam amino yang memiliki ikatan yang sama dengan obat komersial selekoksib. Senyawa kurkuminoid dan santorizol diprediksi memiliki potensi sebagai agen anti kanker payudara.
SUMMARY
Ridho Pratama. Molecular docking of Temulawak (Curcuma xanthoriza) active
compound with COX-2 enzyme as anti breast cancer drug.
Breast cancer is one of the biggest 5 types of cancer in the world. In Indonesia alone breast cancer cases are347.792 people (Kemenkes RI 2015). Breast cancer is known to be closely related with chronic inflammation which is controlled by cyclooxigenase 2 (COX-2). This enzyme synthesizes prostaglandins and are known to be associated with the development of breast cancer. Inhibition of these enzymes has potential for the development of anticancer drugs. Some of the synthetic drugs have been used commercially to inhibit the growth of cancer cells. However this drug has some side effects that are harmful to body like hair loss, diarrhea, vomiting, and sleep disorders. Facing this challenge, currently many developed drugs are derived from plants and herbs. Therefore this research developed a candidate of herbal medicine that play a role in inhibiting COX-2 with minimal side effects.
Temulawak (Curcuma xanthoriza) is a rhizome plant that traditionally has
been used as medicinal plant against several diseases among other compounds as anti-cancer drugs, anti-inflammatory and lowering cholesterol levels in humans. The components of temulawak consists of curcuminoid and xanthorizol. Curcumin was examined because it has many medicinal properties such us decline in β-amyloid plaques, delaying the degradation of nerve, stuck the metals, antioxidant, anti-inflammatory, decreased formation of microglia on alzaimer diseases, hepatoprotective, and inhibits angiogenesis. Furthermore curcumin also has cancer effects. Xanthorizol is a compound that acts as an anti-proliferation substance by inducing cell apoptosis process in MDA-MB-231.
Active compounds of temulawak test have done by molecular docking withAutodock Vina. The principle of this methodis to simulate the interaction of ligand as an inhibitor of COX-2 enzyme. The results of the test show that curcuminoid and xanthorizol meets the criteria as medicinal compounds. The entire active compounds successfully docked on the active site of the enzymes COX-2. Curcumin has the largest binding free energy (∆ G) =-9.3 kcal/mol. This energy is approached the affinity bonds of commercial drug celecoxib. There are three hydrogen bonds in amino acid Arg106, Tyr341, and His75, these three amino acid is part of the active side of COX-2. There are 16 another similar amino acids bonding with commercial drug celecoxib. Curcuminoid and xantorizol compounds predicted have potential as anti-breast cancer agents.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
RIDHO PRATAMA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PENAMBATAN MOLEKULER SENYAWA AKTIF TEMULAWAK
(Curcuma xanthoriza) DENGAN ENZIMCOX-2 SEBAGAI
Judul Tesis : Penambatan Molekuler Senyawa Aktif Temulawak (Curcuma Xanthoriza) Dengan Enzim COX-2 Sebagai Kandidat Obat Anti
Kanker Payudara Nama : Ridho Pratama NIM : G851130411
Disetujui Oleh Komisi Pembimbing
Dr Laksmi Ambarsari, MS Dr Tony Ibnu Sumaryada, MSi Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Biokimia
Prof Dr drh Maria Bintang, MS Dr Ir Dahrul Syah, MScAgr
Bismillahirrahmanirrahim
Alhamdulillah, puji dan syukur atas segala rahmat dan karunia Allah SWT, sehingga penulis dapat menyelesaikan penelitian dan penulisan thesis ini. Sholawat dan salam atas Nabi junjungan alam, Muhammad SAW. Penulis bersyukur dapat menyelesaikan penelitian dan penulisan ilmiah berjudul “Penambatan Molekuler Senyawa Aktif Temulawak (Curcuma xanthoriza)
Dengan Enzim COX-2 SebagaiKandidat Obat Anti Kanker Payudara”. Penelitian ini berlangsung selama 6 bulan, yaitu pada bulan Oktober tahun 2014 hingga bulan Maret tahun 2015 di Laboratorium Biofisika Institut Pertanian Bogor.
Penulis menyadari bahwa penelitian dan karya ilmiah ini dapat diselesaikan atas izin yang Maha kuasa dengan perantara bantuan dan dorongan semangat dari berbagai pihak. Untuk itu penulis ucapkan terima kasih sebesar-besarnya kepada bapak dan ibu tercinta atas kesabaran dan kasih sayang yang telah diberikan selama ini. Penulis mengucapkan terima kasih kepada ibu Dr Laksmi Ambarsari, MS dan bapak Dr Tony Ibnu Sumaryada, MSi sebagai dosen pembimbing penelitian yang telah banyak memberikan bimbingan, bantuan, kritik dan saran selama penelitian dan penyusunan thesis ini. Selanjutnya kepada Komisi pendidikan departmen Biokimia dan rekan sejawat yang telah membantu selama penelitian ini. Semoga hasil penelitian ini dapat bermanfaat bagi semua pihak yang memerlukan khususnya untuk kemajuan pengetahuan ilmu biokimia.
Bogor, Agustus 2015
DAFTAR ISI
Tempat dan Waktu Penelitian 3
Bahan 3
Alat 3
Prosedur Penelitian 3
3 HASIL 6
Preparasi Ligan 6
Ligan Yang Memenuhi Aturan Lipinski 7
Uji Toksisitas ADMET 7
Karakterisasi Enzim Siklooksigenase-2 8
Stabilitas enzim COX-2 10
Validasi Metode Penambatan 10
Afinitas Ikatan Dengan Menggunakan Autodock Vina 11 Visualisasi Interaksi Hidrogen yang Terdapat Pada Ligan dan COX-2 12 Analisis Kesamaan Ikatan dan Interaksi Hidrofobik 14
Analisis Ikatan Elektrostatik Pi dan Sigma 16
Visualisasi 3D Dengan Pymol 18
4 PEMBAHASAN 20
Preparasi Ligan 19
Ligan Yang Memenuhi Atruan Lipinski 19
Uji toksisitas Senyawa Aktif Menggunakan ADMET 20
Karakterisasi Enzim Siklooksigenase 21
Preparasi Enzim 22
Kestabilian Struktur COX-2 23
Validasi Metode Penambatan 23
Afinitas Ikatan Dengan Menggunakan Autodock Vina 23 Analisis Interaksi Hidrogen yang Terdapat Pada Ligan dan COX-2 24 Analisis Kesamaan Ikatan dan Interaksi Hidrofobik 25
Analisis Ikatan Elektrostatik Pi dan Sigma 26
5 SIMPULAN DAN SARAN 28
DAFTAR PUSTAKA 29
2. Ligan yang memenuhi aturan Lipinski 7
3. Uji Toksisitas ADMET 8
4. Asam amino penyusun struktur enzim COX-2 8
5. Interaksi hidrogen senyawa aktif dan substart alami 14
6. Data kemiripan interaksi 15
DAFTAR GAMBAR
Halaman
1. Struktur 3D enzim COX-2 5
2. Struktur sekunder COX-2 menggunakan klasifikasi DSSP 9
3. Plot Ramachandran COX-2 dengan PDB ID:3LN1 10
4. Validasi metode dengan self docking pada senyawa aktif Celecoxib 11
5. Data energi interaksi pada enzim COX-2 12
6. Kemiripan interaksi ikatan hidrogen dan interaksi hidrofobik 13 7 Kemiripan interaksi ikatan hidrogen dan interaksi hidrofobik 14 8. Interaksi sigma dan pi pada senyawa aktif selekoksib dan kurkumin 16
9. Interaksi sigma dan pi pada senyawa bis dan demetoksi kurkumin 16
10. Interaksi sigma dan pi pada santorizol dan asam arakidonat 17
11. Situs pengikatan senyawa aktif kurkuminoid dan santorizol 17 12. Superimpose struktur 3D interaksi kurkumin dan demetoksikurkumin 18
13. Superimpose struktur 3D interaksi bisedemetoksi dan santorizol 18
14. Mekanisme induksi COX-2 terhadap perkembangan kanker payudara 21 15. Resolusi ligan dalam metode penambatan molekuler 22
DAFTAR LAMPIRAN
Halaman
1. Tahapan penelitian 32
1 PENDAHULUAN
Latar Belakang
Kanker payudara merupakan kanker terbanyak yang menyerang wanita, baik dinegara maju maupun negara berkembang. Berdasarkan data pada tahun 2011 oleh World Health Organization (WHO) (2013), jumlah kematian wanita
akibat kanker payudara diseluruh dunia mencapai 508.000 jiwa. Berdasarkan data tersebut diketahui bahwa jumlah penderita kanker dinegara berkembang lebih banyak daripada negara maju yaitu 58%. Kasus kanker payudara diIndonesia menempati urutan tertinggi untuk kategori kanker yang diderita wanita, yaitu mencapai 26 kasus untuk setiap 100.000 jiwa (Ibrahim 2008).
Beberapa obat komersial sebagai anti kanker payudara memiliki efek samping yang berbahaya bagi tubuh seperti resiko stroke dan pengumpalan darah (Connor et al. 2006). Oleh karena itu perlu dikembangkan senyawa obat yang
bersifat aman dan efektif dalam menghambat pertumbuhan sel kanker payudara. Penanganan menggunakan senyawa obat yang berasal dari bahan alam banyak dilakukan saat ini karena diharapkan bisa mendapatkan senyawa obat yang aman dan efektif bagi pengobatan kanker payudara. Salah satunya adalah temulawak (Curcuma xanthoriza).
Temulawak adalah tanaman yang mengandung senyawa aktif dengan komponen utama kurkuminoid dan minyak atsiri (Wahyuni 2004). Selain itu temulawak juga kaya akan santorizol. Kurkuminoid terdiri atas kurkumin, demetoksikurkumin, dan bisdemetoksikurkumin. Kurkumin (1E, 6E)-1, 7-bis (4-hydroxy-3-methoxyphenyl)-1, 6-heptadiene-3, 5 dione) (Zhou 2011) adalah
senyawa yang banyak diteliti karena memiliki berbagai khasiat obat yaitu dalam penurunan plak β-amiloid, menunda degradasi saraf, pengkelat logam, anti inflamasi, antioksidan, penurunan pembentukan mikroglia pada penyakit alzaimer (Mishra 2008), hepatoprotektif (Sing 2011), dan menghambat angiogenesis (Binion 2008). Selain itu kurkumin juga memiliki efek anti kanker. Senyawa santorizol merupakan senyawa sesquiterpenoid yang diisolasi dari temulawak.
Senyawa ini juga telah dilaporkan memiliki kemampuan untuk menghambat siklooksigenase 2 (COX-2) dan nitrit oksida sintase (Lee 2002).
Kanker payudara diketahui memiliki kaitan erat dengan inflamasi yang bersifat kronis. Inflamasi dalam sel dikontrol oleh enzim siklooksigenase 2 (COX-2). Enzim yang berperan mensintesis prostaglandin ini diketahui memiliki kaitan dengan perkembangan kanker payudara. Sintesis berlebihan pada COX-2 ditemukan pada kanker payudara (Soslow et al. 2000). Penghambatan pada enzim
ini memiliki potensi untuk pengembangan obat antikanker payudara. Obat komersial yang telah diuji aktivitasnya adalah selekoksib yang merupakan obat yang telah diterima oleh Food and Drug Administration (FDA) dan memiliki efek
anti kanker. Namun demikian, konsumsi selekoksib memiliki efek negatif terhadap kesehatan seperti peningkatan penyakit kardiovaskular sebesar 37% (Bhala et al. 2013). Pengembangan senyawa aktif herbal khususnya temulawak
(kurkuminoid dan santorizol) yang berperan dalam menghambat COX-2 dengan harapan memiliki efek samping yang minimal pada terapi kanker perlu dilakukan.
Pendekatan in vitro dan in vivo umum dilakukan untuk memperoleh
2
namun metode ini membutuhkan waktu dan biaya yang mahal. Selain itu metode ini tidak bisa memberikan detail interaksi molekuler yang terjadi. Pengembangan senyawa obat baru perlu diketahui mekanisme interaksi yang terlibat antara target dan senyawa aktif. Informasi interaksi ini bisa menjadi patokan untuk merancang senyawa obat baru yang memiliki selektifitas dan efektifitas yang tinggi terhadap target. Suatu obat bisa berinteraksi secara langsung dengan protein maupun secara tidak langsung sehingga menyebabkan perubahan sifat fisik dari protein (Spratto 2010). Metode penambatan molekuler dilakukan untuk mengetahui mekanisme interaksi antara senyawa temulawak dan COX-2. Metode ini adalah metode in silico yang merupakan metode gabungan ilmu structural molekuler biologi dan
komputasi obat. Tujuan penelitian ini adalah untuk memperoleh informasi interaksi dan orientasi tiga dimensi dari protein dan ligan (senyawa uji) dengan menggunakan indikator energi bebas interaksi (∆G). Informasi jenis ikatan dan kekuatan interaksi memberikan data yang dapat memperlihatkan mekanisme inhibisi suatu senyawa aktif terhadap reseptor spesifik yang berperan dalam pengembangan penyakit (Morris et al. 2008). Pada penelitian Pendekatan in silico
yang digunakan adalah metode penambatan molekuler dengan Autodock Vina. Metode ini memiliki keakuratan yang tinggi dan waktu simulasi yang cepat.
Rumusan Masalah
Temulawak memiliki kemampuan dalam mengatasi penyakit kanker payudara yang diakibatkan oleh proses inflamasi, namun mekanisme interaksi antara senyawa aktif dengan protein yang terlibat dalam inflamasi belum diketahui dengan pasti. Senyawa kurkuminoid dan santorizol memiliki potensi sebagai senyawa anti kanker yang tidak toksik, Oleh karena itu diperlukan analisis melalui pemodelan komputer untuk membandingkan efektifitas ikatan kurkuminoid dan santorizol dengan senyawa obat selekoksib yang beredar di pasaran.
Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh informasi model interaksi ikatan senyawa kurkuminoid dan santorizol dengan enzim COX-2, membandingkan afinitas ikatan senyawa aktif dengan obat komersial yaitu selekoksib, serta mengetahui senyawa aktif yang paling potensial sebagai non steroidal anti-inflammatory drug (NSAID) atau sebagai inhibitor COX-2.
Ruang Lingkup
Manfaat Penelitian
Penelitian ini diharapkan dapat membantu dalam mendesain senyawa obat kanker payudara yang berasal dari senyawa aktif kurkuminoid dan santorizol sebagai antikanker payudara menggunakan pendekatan in silico yaitu metode
penambatan molekuler.
2 METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2014-Maret 2015 di Laboratorium Komputasi Biofisika, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB), Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini adalah struktur ligan uji kurkumin, demetosikurkumin, bisdemetoksikurkumin, santorizol dan obat komersial inhibitor enzim siklooksigenase 2 yaitu selekoksib. Struktur 3 dimensi Protein diperoleh dari bank data protein yang bisa diakses pada situs (http://www.rcsb.org) dengan ID 3LN1.
Alat-alat yang digunakan adalah berupa perangkat keras dan perangkat lunak komputer. Perangkat kerasnya yaitu komputer dengan spesifikasi prosesor Quad Core (Intel Core I7, Amerika), RAM delapan Gigabyte, Kartu Grafis
NVIDIA Ge Force GTS 9400 (Taiwan). Sedangkan perangkat lunak yang digunakan adalah, sistem operasi Windows 8 (Amerika). Perangkat lunak LigPlot+ 1.5.4 (Roman Lawkowski), PyMOL 1.3 (Delano Scientific LLC, Italia), Autodock Vina, Autodock Tools 1.5.6 (The Scripps Research Institute, Amerika). Open
Babel 2.3.1. Discovery Studio 4.0.PyRx.
Prosedur Penelitian
Preparasi Struktur Ligan (Arwansyah 2014)
Preparasi struktur ligan dibuat dalam struktur dua dimensi (2D) kemudian ditransformasikan menjadi struktur tiga dimensi (3D) dengan menggunakan program Marvinsketch 6.0. Struktur 3D kemudian dioptimasi dengan
menambahkan atom hidrogen menggunakan software open babel 2.3.1. Analisis daya serap ligan dilakukan dengan filter Lipinski. Ligan yang memenuhi kriteria Lipinski kemudian diuji toksisitasnya dengan metode ADMET.
Preparasi Struktur Makromolekul (Wang 2010)
COX-2 diperoleh dari basis data protein (PDB) pada situs
http/www/pdbbeta.rscb.org/pdb. Kode identifikasi enzim adalah 3LN1. Format
4
Simulasi penambatan molekuler ligan uji dan ligan pembanding terhadap reseptor (Trott 2010)
COX-2 dan ligan dipreparasi menggunakan perangkat lunak Open Babel 2.3.1 dan Autodock Tools 1.5.6 (shi et al 2012). Open Bable 2.3.1 untuk
menambahkan gugus hidrogen pada ligan dan Autodock tools1.5.6 untuk memberikan ikatan hidrogen dan muatan Gasteiger, penghilangan molekul air, serta penambahan sudut torsi. Hasil preparasi disimpan dalam format PDBQT.
Area penambatan (Grid) dimuat dengan menyesuaikan area penambatan
obat pada protein danparameter penambatan dilakukan dengan ADT 1.5.6 dan penambatan molekuler dilakukan dengan Autodock Vina (Scripps Research Institute, USA) diasumsikan semua rotatable bond (ikatan siklik) dari molekul
kecil dapat berotasi (fleksibel) dan makromolekul adalah tetap (rigid) (Morris et al.1998). Area Penambatan dibagi menjadi 2 yaitu area penambatan yang ditarget
dan area penambatan yang mencakupi semua enzim COX-2 (penambatan molekular tak tertarget). Jumlah ulangan (Exaustiveness) dilakukan sebanyak 100
kali. Proses penambatan molekuler dilakukan dengan menggunakan PyRx. Enzim COX-2 dan ligan analisis berupa kurkuminoid dan santorizol dalam format *.pdb diubah ke dalam format *.pdbqt melalui program Auto Dock Tools 1.5.6 (Shi et al 2012). Masing-masing ligan berada pada kondisi fleksibel
yang akan berinteraksi dengan biomakromolekul pada kondisi rigid (Kumar et al
2012). Autodock Vina digunakan pada simulasi penambatan molekuler ligan analisis dan ligan pembanding terhadap COX-2. Hasil penambatan molekuler diberi peringkat dan diperoleh nilai terbaik (ΔG paling negatif) diamati pada area penambatan ligan terhadap COX-2. Area COX-2dalam format *.pdbqt dikonversi ke dalam format*.pdb melalui program Auto Dock Tools 1.5.6. Interaksi berupa ikatan hidrogen, interaksi hidrofobik, dan jarak ikatan dapat divisualisasikan dengan menggunakan LigPLot+ 1.5.4 dan PyMOL 1.3 dengan radius interaksi 5Å dari posisi ligan tertambat. Penambatan kurkuminoid dan santorizol selanjutnya dibandingkan dengan selekoksib.
Proses penambatan molekuler dilakukan dengan memasukkan data area penambatan ligan dan reseptor agar bisa disimulasikan menggunakan software PyRx. Hasil penambatan molekuler akan memberikan informasi 10 nilai energi bebas Gibbs (∆G) dengan nilai yang negatif tertinggi pada energi bebas Gibbs (∆G) urutan pertama. Hasil penambatan molekuler kemudian dipilih yang paling negatif energi bebas Gibbsnya (∆G) kemudian dikonversi ke format PDB menggunakan software Discovery Studio 4.0. Selanjutnya dilakukan analisis 2
3 HASIL
Hasil Preparasi Struktur Enzim COX-2 dan Ligan
Enzim target dan ligan merupakan 2 komponen paling penting dalam penambatan molekuler. Kedua komponen ini harus memiliki format file yang sama agar bisa diproses oleh perangkat lunak. Enzim COX-2 diperoleh dari hasil penelitan laboratorium dengan cara kristalisasi menggunakan alatX-ray difraction
(XRD). Data hasil kristalisasi berupa koordinat 3 dimensi dalam format PDB. Koordinat ini merupakan data yang bisa diolah oleh sistem perangkat lunak penambatan molekuler. Data ini didapatkan dari basis data Research Collaboratory for Structural Bioinformatics(RCSB) dengan kode akses 3LN1.
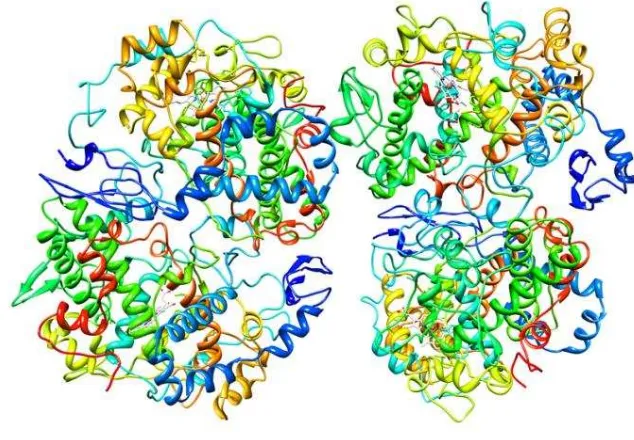
Enzim COX-2 yang didapatkan teridiri atas heterodimer yang berisfat identik (Gambar 1). Pada penelitian ini digunakan satu monomer yang mewakili semua struktur COX-2.
Gambar 1. Struktur 3D enzim COX-2 (RCSB 2015)
6
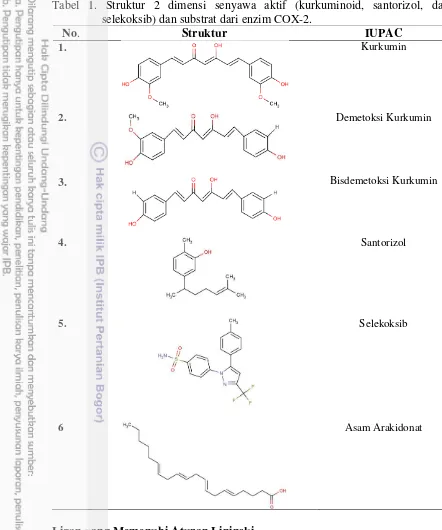
Tabel 1. Struktur 2 dimensi senyawa aktif (kurkuminoid, santorizol, dan selekoksib) dan substrat dari enzim COX-2.
No. Struktur IUPAC
1. Kurkumin
2. Demetoksi Kurkumin
3. Bisdemetoksi Kurkumin
4. Santorizol
5. Selekoksib
6 Asam Arakidonat
Ligan yang Memenuhi Aturan Lipinski
Tabel 2.Aturan Lipinski senyawa kurkuminoid dan santorizol.
Aturan Lipinski Kurkumin Demetoksi
kurkumin Bidemetoksi Kurkumin Santorizol Selekoksib
Berat Molekul 366 340 310 216 312
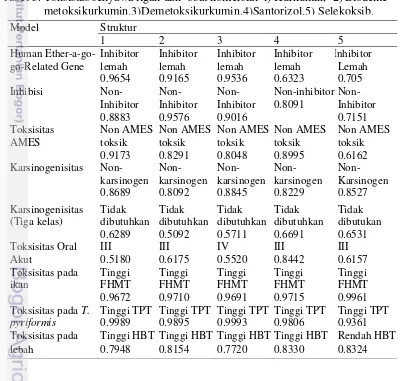
Senyawa kandidat obat harus memiliki sifat non toksik terhadap manusia dan lingkungan oleh karena itu dilakukan simulasi toksisitas menggunakan perangkat lunak ADMET. Semua ligan uji (kurkuminoid dan santorizol) memenuhi kriteria ADMET (Tabel 3). Terdapat 7 parameter uji keamananan suatu senyawa kandidat obat yaitu potensi terhadap serangan jantung, mutagenitas, karsinogenitas, toksisitas terhadap lebah, ikan, T pyyriformis. Parameter sifat
suatu senyawa ditentukan dari gugus fungsi penyusun dan direpresentasikan dalam bentuk presentase. Semakin tinggi presentase maka semakin besar sifat model dari senyawa ligan.
Model Struktur
1 2 3 4 5
Human
Ether-a-go-go-Related Gene Inhibitor lemah 0.9654
(Tiga kelas) Tidak dibutuhkan 0.6289
8
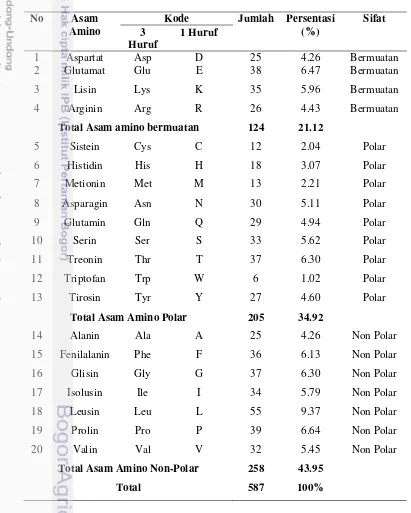
Karakterisasi Enzim Siklooksigenase-2 Asam Amino Penyusun COX-2
Enzim tersusun oleh asam-amino tertentu yang berpengaruh terhadap aktifitas reaksi yang dikatalisisnya. Enzim COX-2 tersusun atas asam amino bermuatan, tidak bermuatan, polar dan non polar (Tabel 4). Penentuan asam amino penyusun COX-2 dilakukan menggunakan perangkat lunak MEGA 5 dari basis data Research Collaboratory for Structural Bioinformatics (RCSB). Enzim
COX-2 memiliki 124 asam amino yang bermuatan, 205 asam amino polar, 258 asam amino non polar dengan struktur sekunder penyusun asam amino sebanyak 253 residu memiliki struktur heliks dan 52 residu memiliki struktur β Sheet. Tabel4.Asam amino penyusun struktur enzim COX-2.
No Asam Amino
Kode Jumlah Persentasi (%)
Total Asam amino bermuatan 124 21.12
5 Sistein Cys C 12 2.04 Polar
Total Asam Amino Non-Polar 258 43.95
Gambar 2. Struktur sekunder COX-2 menggunakan klasifikasi Dictionary of Secondary Structure of Proteins(DSSP)
= Sisi pengikatan selekoksib 243% Heliks(31 helik; 253 residu)
8% Lembaran Beta (32 Untai; 52 residu)
Struktur Sekunder : DSSP (Dictionary of Secondary Structure of Protein) Struktur Sekunder COX-2
Sisi pengikatan senyawa obat dengan COX-2 bisa diketahui dari visualisasi struktur sekunder asam amino COX-2. Struktur COX-2 didominasi oleh struktur alfa heliks yaitu sebanyak 26, 10 jenis struktur β sheet (Gambar 2),
22 struktur β bridge, 7 rangkaian struktur 3/10 heliks, dan 29 Turn. Struktur
sekunder berkaitan erat dengan jenis katalisis dari suatu enzim. Enzim COX-2 memiliki sifat sebagai enzim oksireduktase. Struktur sekunder merupakan dasar untuk membentuk struktur tersier dan kuartener. Sisi aktif tempat pengikatan obat komersial selekoksib ditandai dengan lingkaran berwarna kuning yang terdapat pada wilayah heliks 106,335,338,339,499,512,513,518, Turn 178.
E: Rantai beta T: Turn
Wilayah kosong tidak ada struktur sekunder G: Rantai heliks 3/10
10
Stabilitas Enzim COX-2
Akurasi hasil simulasi sangat dipengaruhi oleh kestabilan enzim. Enzim yang stabil memiliki kecendrungan menyerupai keadaan dialam yaitu memiliki asam amino penting yang lengkap dan memiliki struktur yang menyerupai keadaan alami. Hasil analisis enzim COX-2 menggunakan plot Ramachandran menunjukkan bahwa COX-2 memiliki stabilitas yang baik. Asam amino tersebar pada 4 wilayah kuadran. Asam amino ditandai dengan warna titik pada setiap kuadran. Terdapat 3 karakteristik wilayah yaitu wilayah yang diizinkan, wilayah yang diizinkan sebagian dan wilayah yang tidak dizinkan sebagian. Protein yang tidak stabil memiliki kecenderungan asam amino yang tersebar pada wilayah kuadran ke 4. Enzim COX-2 memiliki asam amino pada wilayah yang diizinkan sebanyak 96%, asam amino diizinkan sebagian sebanyak 4% dan tidak ada asam amino pada wilayah yang tidak diizinkan (Gambar3).
Gambar 3. Plot Ramachandran COX-2 PDB ID: 3LN1
Validasi Metode Penambatan
Hasil uji penambatan molekuler dengan Autodock Vina memerlukan uji keabsahan metode baik itu terhadap area penambatan dan jumlah ulangan yang digunakan dalam proses penambatan molekuler. Hal ini dilakukan dengan cara melakukan penambatan ulang senyawa selekoksib yang sudah tertambat dengan kompleks enzim COX-2. Hasil penambatan ulang kemudian dibandingkan dengan saat proses pembuatan data PDB hasil penelitian di laboratorium.
Ligan uji ditandai dengan warna kuning, ligan asli hasil penambatan uji laboratorium ditandai dengan warna coklat. Ligan uji ditambatkan ulang dengan dua metode penambatan, yaitu penambatan tertarget dan penambatan menyeluruh. Penambatan tertarget dibatasi pada sisi aktif enzim dengan menggunakan wilayah penambatan (grid) dengan pusat center_x=30.60, center_y=-22.56, center_z=
-16.76. Penambatan menyeluruh mencakupi semua area enzim COX-2. Hasil penambatan menunjukkan bahwa penambatan terarah memberikan kemiripan visualisasi 3 dimensi yang lebih besar jika dibandingkan dengan penambatan
I
II
menyeluruh (Gambar 4). Namun demikian, penambatan menyeluruh juga berhasil tertambat kesisi aktif enzim. Penambatan menyeluruh baik digunakan jika sisi aktif enzim tidak diketahui secara pasti. Jumlah ulangan yang optimal adalah sebanyak 100 kali ulangan. Semakin tinggi nilai ulangan maka semakin akurat data yang dihasilkan. Namun pada batas optimal data yang dihasilkan dari pengulangan tidak memberikan hasil yang berbeda nyata.
A B
Gambar4. Validasi metode ; A) interaksi selekoksib dengan residu asam amino COX-2 pada penambatan menyeluruh B) interaksi selekoksib dengan residu asam amino COX-2 pada hasil penambatan terarah. (keterangan: Ligan berwarna kuning: hasil penambatan ulang, Abu-abu: Ligan bawaan protein).
Afinitas Ikatan dengan Menggunakan Autodock Vina
Kekuatan interaksi antara ligan dengan sisi aktif enzim bisa diketahui dengan indikator energi bebas Gibbs. Nilai negatif pada energi bebas Gibbs menunjukkan bahwa reaksi yang terjadi adalah reaksi yang bersifat spontan. Reaksi yang berlansung secara spontan merupakan indikasi bahwa terjadinya interaksi yang setimbang dialam jika senyawa ligan dan enzim tersebut direaksikan. Nilai energi bebas Gibbs yang positif menunjukkan bahwa reaksi tersebut tidak terjadi secara spontan, yaitu memerlukan energi eksternal untuk bisa terbentuknya kesetimbangan reaksi. Hasil penambatan molekuler menggunakan Autodock Vina menunjukkan nilai energi bebas Gibbs seluruh ligan uji bernilai negatif. Hasil ini didapatkan dari simulasi menggunakan Autodock Vina pada ulangan 100 kali menggunakan emulator PyRx.
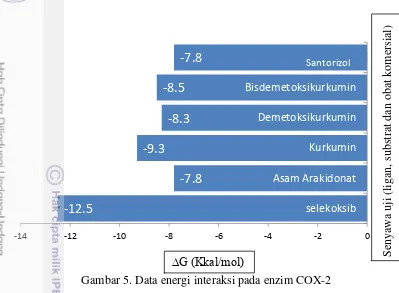
Kurkumin memiliki nilai energi bebas ΔG = -9.3 Kkal/mol, bisdemetoksikurkumin ΔG = -8.5 Kkal/mol, demetoksikurkumin ΔG = -8.3 Kkal/mol, santorizol ΔG = -7.8 Kkal/mol. Semua ligan memiliki interaksi yang terarah ke sisi aktif enzim COX-2 pada semua ligan. Substrat alami enzim COX-2 yaitu asam arakidonat memiliki ΔG = -7.8 Kkal/mol. Kurkuminoid dan santorizol memiliki nilai energi bebas yang tinggi dibandingkan dengan substrat alami, hal ini menunjukkan bahwa senyawa kandidat obat dapat berkompetisi dengan substrat asam arakidonat dan menghambat aktifitas enzim COX-2. Kurkumin memiliki energi bebas Gibbs tertinggi dibandingkan dengan senyawa kurkuminoid yang lainnya. Nilai ini yang paling mendekati dengan energi bebas Gibbs obat komersial selekoksib ΔG = -12,6 Kkal/mol (Gambar 5).
Senyawa awal Senyawa redocking
Senyawa redocking
12
Gambar 5. Data energi interaksi pada enzim COX-2
Visualisasi Interaksi Hidrogen yang Terdapat Pada Ligandan COX-2
Semua senyawa ligan uji memiliki kesamaan interaksi dengan selekoksib berdasarkan analisis Ligplus. Atom ligan ditandai dengan ikatan berwarna biru sedangkan atom asam amino ditandai dengan ikatan berwarna coklat. Analisis Ligplus memberikan data interaksi ikatan hidrogen yang ditandai dengan garis putus-putus berwarna hijau. Selanjutnya interaksi hidrofobik dengan tanda merah yang bergaris. Kesamaan interaksi yang terjadi dapat diketahui dengan pola lingkaran yang terbentuk antar asam amino. Interaksi ini divisualisasikan dengan rentang maksimal 5 Å (Gambar 6,7).
Pada penambatan terarah kurkumin terdapat 3 ikatan hidrogen pada asam amino Arg106, Tyr341, His75 (Gambar 6).
a) Selekoksib b) Kurkumin
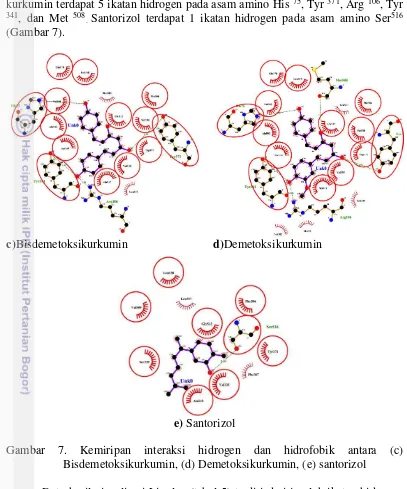
Senyawa kurkuminoid lainnya yaitu bisdemetoksikurkumin terdapat 4 ikatan hidrogen pada asam amino His 75, Tyr 371, Arg 106, dan Tyr 341. Demetoksi kurkumin terdapat 5 ikatan hidrogen pada asam amino His 75, Tyr 371, Arg 106, Tyr 341, dan Met 508
. Santorizol terdapat 1 ikatan hidrogen pada asam amino Ser516 (Gambar 7).
c)Bisdemetoksikurkumin d)Demetoksikurkumin
e) Santorizol
Gambar 7. Kemiripan interaksi hidrogen dan hidrofobik antara (c) Bisdemetoksikurkumin, (d) Demetoksikurkumin, (e) santorizol
14
Jarak ikatan juga menjadi indikator kekuatan suatu interaksi. Jarak ikatan melebihi 3 Å cenderung memberikan kekuatan ikatan yang lemah. Selekoksib memiliki 3 ikatan sedang dan satu ikatan lemah, kurkumin memiliki 3 ikatan sedang, demetoksikurkumin memiliki 5 ikatan sedang, bisdemetoksikurkumin memiliki 4 ikatan sedang, santorizol memiliki 1 ikatan hirogen sedang.
Tabel5. Interaksi hidrogen yang terbentuk antara senyawa aktif (kurkuminoid, Santorizol) dan substrat alami asam arakidonat.
Senyawa Jumlah
Santorizol 1 Ser516 -OH -OH 3.04 Sedang
Analisis Kesamaan Ikatan Hidrogen dan Interaksi Hidrofobik
Analisis ikatan elektrostatik, Pi dan Sigma
Ikatan Pi dan Sigma divisualisasikan dengan menggunakan perangkat lunak Discovery Studio 4.0. Interaksi hidrogen ditandai dengan garis putus-putus berwarna biru. Interaksi elektrostatik ditandai dengan lingkaran berwarna ungu, Interaksi van der Waals ditandai dengan lingkaran berwarna hijau. Interaksi sigma dan Pi diketahui dari garis ikatan yang berwarna orange.
Senyawa obat komersil selekoksib memiliki 1 ikatan sigma pada gugus fenolik dan 1 ikatan Pi pada gugus penta siklik. Senyawa kurkumin memiliki 1 ikatan sigma dan 1 ikatan Pi sebagai penstabil interaksi dengan sisi aktif enzim. Ikatan Pi dan sigma yang terbentuk pada kurkumin terdapat pada gugus fenil. bisdemetoksikurkumin dan demetoksikurkumin memiliki ikatan Pi pada gugus fenil (Gambar 7,8,& 9).
16
a) b)
Gambar 8. Interaksi Sigma dan pi yang terdapat pada a) Selekoksib, b) Kurkumin
a) b)
Gambar 9. Interaksi Sigma dan pi yang terdapat pada a) Bisdemetoksikurkumin, b) Demetoksikurkumin
a) b)
Gambar 9. Interaksi Sigma dan pi yang terdapat pada a) Santorizol, b)
b Asam arakidonat Keterangan:
A B
B
A B
A
A B
Gugus aktif
Elektrostatik Interaksi Residu
Visualisasi 3D dengan Discovery Studio 4 Ligan Terhadap Sisi Aktif COX-2
COX-2 merupakan heterodimer yang memiliki 2 monomer. Penelitian ini digunakan satu monomer COX-2 karena sudah mewakili secara utuh struktur enzim COX-2. Heterodimer memiliki monomer dengan penyusun asam amino yang bersifat identik. Setiap monomer mempunyai dua sisi pengikatan yaitu sisi alosterik dan sisi aktif. Substrat enzim COX-2 yaitu asam arakidonat berikatan pada sisi aktif enzim maupun sisi regulator. Selekoksib terikat pada sisi aktif enzim COX-2. Sisi aktif pengikatan ini divisualisasikan dengan membentuk awan molekuler ikatan hidrogen yang melingkupi ligan.
Sisi pengikatan selekoksib terhadap sisi aktif merupakan patokan yang digunakan untuk proses penambatan molekuler karena telah diketahui sebelumnya bahwa selekoksib terbukti secara empiris dapat menghambat aktifitas dari COX-2. Oleh karena itu penambatan difokuskan pada area sisi aktif sebagai target pengikatan. Sisi pengikatan obat terdapat pada sisi aktif yang menjorok kedalam dari struktur enzim (Gambar 11). Hasil analisis dengan ruang lingkup spesifik ini akan meningkatkan akurasi data penambatan.
Gambar 11. Situs pengikatan senyawa aktif kurkuminoid dan santorizol
Superimpose semua senyawa aktif dilakukan dengan menggunakan
18
karena semua ikatan terjadi pada sisi aktif enzim dan memiliki kemiripan gugus yang berikatan. Gugus ini saling menggantikan tergantung dengan kekuatan ikatan gugus pengganti.
a) b)
Gambar 12. Superimpose struktur tiga dimensi interaksi ligan dan Selekoksib (a)
Kurkumin, (b) Demetoksikurkumin
a) b)
Gambar 13. Superimpose struktur tiga dimensi interaksi ligan dan Selekoksib c
4 PEMBAHASAN Preparasi Ligan
Molekul obat yang digunakan pada penelitian ini adalah kurkuminoid yang terdiri atas kurkumin, bisdemetoksikurkumin dan demetoksikurkumin dan santorizol. Senyawa ini terdapat pada tanaman obat Temulawak (Curcuma xanthoriza). Senyawa ini juga dikenal berurutan dengan nama kurkumin I,
kurkumin II, dan kurkumin III. Senyawa ini banyak ditemukan di rimpang kunyit, temulawak, dan temu hitam (Wahyuni 2004). Kurkumin terdiri atas asam ferulat yang terikat melalui jembatan metilen pada atom C karbonil dengan rumus molekul C12H20O6dan berat molekul 368.67. Titik lebur kurkumin sekitar 183 oC. Kurkumin kurang larut di dalam air, namun larut dalam pelarut organik (Seafast 2012).
Senyawa aktif kurkumin terdiri atas cincin aromatik yang memiliki fenol yang terikat pada gugus karbonil α,β-tak jenuh (Retno 2009). Demetoksi kurkumin adalah senyawa turunan kurkumin yang terdapat dialam, senyawa ini kehilangan gugus metil pada salah satu rantai fenol sedangkan yang memiliki fenol yang terikat pada gugus karbonil α,β-tak jenuh senyawa bisdemetoksi kurkumin merupakan senyawa aktif yang kehilangan kedua gugus metil pada kedua gugus fenolnya (Gambar 2). Selain kurkuminoid, juga terdapat senyawa aktif santorizol dengan struktur metil fenol yang memiliki aktifitas sebagai agen antioksidan dan antiproliferasi (Cheah 2006).
Ligan yang Memenuhi Aturan Lipinski
Untuk mengetahui senyawa kurkuminoid memiliki kemampuan untuk menembus membran dan mudah diserap oleh tubuh, maka digunakan aturan Lipinski. Aturan ini ditetapkan berdasarkan uji coba 90% kandidat obat yang diserap melalui mulut yang diuji oleh Lipinski (1997) melewati 5 aturan. Aturan ini berlaku untuk obat yang ditransfer secara difusi pasif, namun tidak berlaku untuk obat yang dibawa ke membran sel melalui protein transport.
Aturan ini terdiri dari 5 kriteria yaitu memiliki berat molekul kurang dari 500, molekul dengan berat kurang dari 500 akan mudah menembus pembatas pembuluh darah otak dan saluran usus. Daya larut dalam lipid atau Log P (perbandingan kelarutan oktanol dan air) kurang dari 5, nilai Log P menentukan daya serap dari ligan didalam tubuh. Nilai Log P merupakan nilai perbandingan dari konsentrasi pada dua fase cair yang setimbang (Leo et al 1971). Jumlah
gugus yang mendonorkan atom hidrogen terhadap ikatan hidrogen kurang dari 5. Donor hidrogen merupakan jumlah gugus hidroksil dan amina dalam suatu senyawa obat. Jumlah donor atom hidrogen yang lebih dari 5 dapat mengganggu daya serap melewati membran bilayer. Jumlah akseptor hidrogen kurang dari 10.
Jumlah akseptor hidrogen dihitung dari jumlah atom oksigen dan atom nitrogen), terlalu banyak akseptor hidrogen juga menggangu serapan melewati membran
bilayer. Kriteria terakhir adalah refraktifitas molar 40 -130. Nilai ini merupakan
ukuran total polarisasi 1 mol substansi terhadap suhu, tekanan dan indeks refraksi (Born et al. 1999). Nilai ini adalah indikator kepolaran secara umum. Senyawa
20
dikonsumsi secara oral. Senyawa selekoksib memiliki kelarutan yang minimal pada pelarut air namun masih bisa dikonsumsi secara oral (Drugbank 2015).
Uji Toksisitas Senyawa Aktif Menggunakan ADMET
hERG (the Human Ether-a-go-go-Related Gen) merupakan gen yang
mengkodekan protein kanal kalium yang berkontribusi untuk aktivitas detak jantung. Penghambatan pada produksi protein dapat menyebabkan ganguan yang fatal pada jantung. Obat yang dapat mengakibatkan penghambatan kuat pada gen ini dapat mengakibatkan kematian secara tiba-tiba (Ekins et al 2006).
Kurkuminoid dan santorizol tidak merupakan inhibitor dari hERG (Tabel 3). Berdasarkan data pada Tabel 3 diketahui bahwa kurkuminoid dan santorizol merupakan senyawa yang termasuk inhibitor lemah berdasarkan klasifikasi Robinson (2011). Klasifikasi ini terbagi menjadi 3 bagian yaitu senyawa dengan sifat inhibitor kuat (IC ≤ 1 µM) inhibitor sedang (IC=1-10 µM) dan inhibtor
lemah (IC ≥ 10 µM). Senyawa dengan sifat inhibisi lemah merupakan senyawa
yang memenuhi kriteria sebagai kandidat obat yang aman dari efek samping serangan jantung. Data ini juga didukung oleh klasifikasi Wang (2012). Klasifikasi ini diambil berdasarkan basis data 803 senyawa yang terdiri atas 433 senyawa inhibitor (IC50>50 µM) dan 373 senyawa noninhibitor hERG
(pIC50≤50 μM). Berdarkan klasifikasi ini kurkuminoid dan santorizol termasuk senyawa noninhibitor hERG. Data uji senyawa mutagen dianalisis dengan menggunakan metode Ames dengan menggunakan basis data dari Xu (2012). Basis data ini terdiri atas 7617 senyawa yang berbeda yang terdiri atas 4252 mutagen dan 3365 senyawa yang tidak mutagen menggunakan model yang dapat memprediksi senyawa mutagen secara akurat. Data ini menunjukkan bahwa kurkuminoid dan santorizol memiliki sifat yang tidak mutagen. Sedangkan untuk mengetahui potensi suatu senyawa memiliki sifat karsinogen atau tidak maka dilakukan pengujian dengan klasifikasi Lagunin (2005), yaitu dengan melihat struktur dasar dari senyawa karsinogen pada hewan pengerat. Data ini juga didukung oleh klasifikasi senyawa potensial karsinogenik menggunakan hewan model tikus. Semua senyawa uji dengan klasifikasi ini merupakan senyawa yang tidak bersifat karsinogenik.
hal ini dibuktikan dengan prediksi hewan coba lebah (LD50 lebih dari 100 µg/lebah) dan Fathead minnow (LC50 lebih besar dari 0.5 mmol/L).
Karakterisasi Enzim Siklooksigenase 2
Siklooksigenase 2 (COX-2) adalah enzim yang terlibat dalam proses inflamasi. Enzim ini membentuk prostaglandin dari asam arakidonat (Gambar 14) (Emanuela & Garret 2011). COX terbagi dalam 2 isoform yaitu 1 dan COX-2. Kedua isoform enzim ini memiliki kerja yang berlawanan. COX 1 berperan untuk menjaga fungsi fisiologi jaringan agar tetap normal. COX-1 banyak diekspresikan dalam jaringan. Sedangkan isoformnya COX-2 hanya ditemukan pada jaringan yang diinduksi oleh faktor tubuh, sitokin pro-inflamasi, promotor tumor dan toksin bakteria. Ekspresi COX-2 ini juga ditemukan pada sel kanker payudara (Howe 2001). Asam amino penyusun COX-2 terdiri dari 352 asam amino dengan proporsi terbesar pada asam amino leusin sebanyak 55 residu dengan jenis penyusun asam amino terbanyak terdapat pada asam amino nonpolar dengan jumlah 258 asam amino (Tabel 4).
Gambar 14. Mekanisme Inflamasi, angiogenesis, proliferasi, dan migrasi yang diinduksi oleh enzim COX-2
22
Preparasi Enzim
Struktur yang digunakan dalam penambatan molekuler harus memiliki komposisi yang baik, yaitu dengan struktur 3 dimensi yang akurat. Struktur 3 dimensi dengan akurasi terbaik bisa didapatkan dengan metode X-Ray kromatografi dan NMR. Detail struktur yang baik diketahui dari resolusi protein, protein dengan resolusi dibawah 3 Amstrong (Gambar 16) memiliki pola difraksi yang lebih teratur dan mudah dilihat setiap atomnya pada saat visualisasi (RSCB 2015).
Gambar 16. Resolusi Ligan yang digunakan dalam metode penambatan molekuler tidak lebih dari 3 Å.
Enzim COX-2 yang diperoleh dari RCSB memenuhi kriteria sebagai protein dengan resolusi tinggi. Komposisi asam amino masing-masing protein ditentukan dengan menggunakan software MEGA 6. Enzim COX-2 mempunyai total asam amino 352 dengan jumlah asam amino terbanyak yaitu leusin sebanyak 55 residu dengan presentasi 9,36 %. Sedangkan asam amino paling sedikit adalah asam aminotriptofan dengan jumlah residu 6 asam amino atau dengan presentase 1,02%. Jenis asam amino yang terbanyak terdapat pada enzim COX-2 adalah asam amino non polar yaitu sebanyak 258 asam amino dengan presentase 43,95 %, disusul dengan asam amino polar sebanyak 205 residu dengan presentase 34,92 % dan asam amino bermuatan 124 residu dengan persentase 21,12% (Tabel 4).
Struktur sekunder protein dianalisis dengan menggunakan basis data DSSP Secondary Structure (Kabsch W& Sander 1983) basis data ini memberikan
informasi interaksi non kovalen antar asam amino, bentuk interaksi berupa ikatan hidrogen (Gambar 2). Anotasi struktur ini ditampilkan secara visual komponen struktur sekunder yaitu α-helix, β-sheet, turn, bend, β-bridge, dan 3/10 helix,
namun data kuantitatif yang ditampilkan hanya data helix dan β-sheet. Berdasarkan
data Tabel 4 diketahui bahwa struktur sekunder penyusun asam amino COX-2 banyak disusun oleh struktur helix (α-helix dan 3/10 helix) dengan jumlah residu
masing-masing berurutan (150,160, 253 residu) residu helix yang terkandung lebih
Kestabilan Struktur COX-2
Verifikasi struktur sekunder dan protein dilakukan menggunakan plot Ramachandran, kestabilan struktur 3 dimensi dari protein ditentukan oleh nilai sudut perputaran (Torsi) polipeptida antara atom N dan C alfa (phi) dan sudut perputaran antara atom C alfa dan C penyusun asam amino (psi). Prediksi nilai torsi penting untuk mengetahui pelipatan protein dari susunan asam aminonya. Sudut perputaran suatu asam amino dibatasi oleh nilai sterik hidran antara atom pada rantai utama dan rantai samping polipeptida. Perputaran atom asam amino yang menyebabkan tumbukan antar atom tidak diizinkan dalam plot Ramachandran. Asam amino yang terdapat secara alami akan memiliki nilai torsi yang diizinkan pada plot ramachandran, pengecualian dari aturan ini adalah asam amino glisin. Hal ini disebabkan karena asam amino glisin tidak memiliki rantai samping sehingga asam amino jenis ini mampu untuk berputar secara bebas (Ramachandran 1963).
Plot Ramachandran terdiri dari garis horizontal pada grafik yang menunjukkan nilai phi sedangkan garis vertikal menunjukkan nilai psi. Plot ini terdiri dari 4 kuadran dengan sudut putaran -180 sampai +180. Kuadran I dan II terdiri dari asam amino yang menyusun struktur sekunder yaitu struktur heliks dan β-sheet pada rantai protein. Kuadran ini memiliki efek sterik yang rendah. Kuadran IV merupakan wilayah yang tidak diizinkan, wilayah ini tidak diizinkan untuk semua asam amino kecuali glisin karena tidak memiliki rantai samping, sehingga memiliki efek sterik yang tinggi. Hasil analisis plot Ramachandran pada enzim siklooksigenase 2 diketahui bahwa 96% yaitu sebanyak 528 asam amino penyusun protein terdapat pada wilayah kuadran yang diizinkan. Terdapat 4% yaitu 22 asam amino yang diizinkan sebagian dan 0% asam amino selain glisin terdapat pada kudran IV (Gambar 3).
Asam amino selain glisin yang menyusun protein uji pada penelitian ini telah diketahui memiliki kestabilan yang baik. Wilayah dengan kestabilan yang baik terdapat pada phi = -120O and psi = +135o(Geourjon & Deleage 1994). Berdasarkan data Tabel 2 sebagian besar asam amino berada pada daerah yang diizinkan (besar dari 90%). Hal ini menunjukkan bahwa data XRD yang digunakan pada penelitian ini adalah data yang akurat yaitu sesuai dengan kondisi asam amino penyusun protein ketika ada di alam. Informasi ini penting untuk menentukan struktur protein hasil XRD yang akan digunakan dalam proses penambatan molekuler. Protein yang memiliki sebaran asam amino terbanyak pada daerah yang diizinkan adalah protein yang berpotensi memberikan hasil yang akurat dalam proses penambatan molekuler.
Validasi Metode Penambatan
24
Hasil penambatan ulang kemudian dibandingkan dengan penambatan dengan menggunakan senyawa uji. Pada penelitian ini digunakan 2 pendekatan metode penambatan. Pertama adalah dengan grid menyeluruh dan selanjutnya menggunakan grid tertarget. Penambatan grid menyeluruh memberikan hasil yang ligan yang tertambat sisi aktif protein. Begitu juga dengan penambatan tertarget yang menghasilkan ligan yang tertambat di sisi aktif protein. Penambatan tertarget memberikan hasil yang lebih mendekati dengan ligan uji
Analisis Afinitas ikatan (∆G) Kurkuminoid dan santorizol dengan Enzim Siklooksigenase 2
Metode penambatan molekuler banyak digunakan untuk mencari senyawa kandidat obat yang baru dalam bidang farmasi. Prinsipnya yaitu dengan mengukur afinitas ikatan antara molekul kecil dengan struktur protein (Rupper 1997). Untuk mencari senyawa kandidat obat maka dilakukan pengenalan reseptor, interaksinya, dan interaksi antara substrat dan inhibitor. Terdapat 2 pendekatan umum yang digunakan dalam metode penambatan molekuler. Pendekatan pertama adalah menganalisis kecocokan antara ligan dan protein. Sedangkan yang kedua adalah dengan mengukur interaksi energi. Untuk mengukur afinitas dan orientasi ligan maka digunakan algoritma pemograman.
Simulasi penambatan molekuler berhasil dilakukan pada COX-2 (ID: 3LN1) dengan menggunakan Autodock Vina dan emulator PyRx. Autodock Vina adalah perangkat lunak yang dikembangkan oleh Trott & Olson (2010). Perangkat lunak yang dikembangkan oleh The Script Institute ini memiliki keunggulan pada akurasi data, tampilan grafis yang mudah digunakan dan kemampuannya melakukan simulasi secara cepat. Untuk melakukan proses simulasi dalam jumlah ulangan yang besar dan berbagai ligan sekaligus, maka digunakan sebuah perangkat lunak yang berfungsi sebagai emulator atau yang disebut juga dengan PyRx. Emulator ini dikembangkan untuk mempermudah proses penambatan molekuler karena memiliki tampilan visual yang mudah dioperasikan. Emulator ini bisa menggunakan 2 jenis metode penambatan yaitu dengan Autodock vina dan Autodock tools.
Simulasi dilakukan dengan menambatkan ligan kesisi aktif pengikatan protein yang diketahui dengan Discovery Studio 4.0. Daerah pengikatan ligan tersebut adalah (Tyr40, Glu52, ASN53, His75, Arg106, Glu126, Asn130, Tyr133, Glu165, Arg170, Arg171, Gln178, Ala185, Phe186, Gln189, His193, Phe196, Lys197, Thr198, His200, Arg202, Asp225, Val281, Val335, Leu338, Ser339, Tyr341, Leu345, Asn368, Tyr 371, His372, Trp373, His374, Gln392, Leu394, Asn396, Ile399, Ile428, Gln431, Val433, Arg499, Phe 504, Val509, Gly512, Ala513, Leu517). Daerah pengujian (Grid) dengan koordinat sudut x,y,z (30.5971,-22.5604,-16.7627) dan ukuran x,y,z (29.6203,28.3615,26.8907) secara berurutan.
Nilai ∆G digunakan untuk mengetahui konstanta inhibisi yaitu konsentrasi inhibisi senyawa aktif terhadap waktu paruh reaksi enzim (Ki). Semakin kecil nilai Ki maka semakin kecil konsentrasi inhibitor yang dibutuhkan untuk menghambat substrat. Nilai Ki (konstanta inhibisi) diperoleh dengan persamaan:
Nilai Ki bersifat linear terhadap ∆G, sehingga bisa diketahui bahwa semakin baik nilai ∆G suatu ligan maka semakin kecil konsentrasi ligan yang diperlukan sebagai inhibitor enzim.
Simulasi ini menunjukkan interaksi senyawa kurkuminoid dan santorizol dengan energi yang mendekati senyawa obat yaitu selekoksib. Selekoksib adalah obat yang sudah disetujui oleh FDA (Food and Drug Administration). Ligan ini
merupakan inhibitor kompetitif enzim COX-2 (Drugbank 2015). Mekanisme inhibisi terhadap COX-2 terbagi menjadi 3 tahapan, pertama adalah interaksi antara inhibitor dengan saluran hidrofobik. Selanjutnya senyawa inhibitor akan masuk kedalam sisi aktif enzim COX-2, tahapan terakhir adalah tahap pencapaian ikatan yang stabil dari gugus. Inhibisi selekoksib spesifik terhadap enzim COX-2 karena gugus sulfonamida pada kantong hidrofilik yang lekat pada sisi aktif COX-2 (Dipiro et al. 2008).
Semua senyawa kurkuminoid dan santorizol memiliki interaksi dengan enzim COX-2. Energi Interaksi terkuat adalah senyawa kurkumin ∆G = -9.3 Kkal/mol, nilai ini mendekati energi interaksi senyawa obat selekoksib ∆G = -12.5 Kkal/mol. Senyawa ligan lainnya juga memiliki interaksi dengan nilai yang mendekati senyawa kurkumin. Perbedaan energi interaksi ini dipengaruhi oleh jumlah atom, jenis atom, dan orientasi ligan.
Analisis Interaksi Hidrogen yang Terdapat Pada Ligan dan COX-2
Interaksi hidrogen adalah interaksi yang terjadi antara atom hidrogen yang berikatan secara kovalen dengan atom elektronegatif donor dengan atom elektronegatif lainnya yang bersifat sebagai reseptor. Ikatan hidrogen antara asam amino dan ligan menunjukkan interaksi molekuler yang spesifik (Hubbard 2010). Jarak ikatan antara donor dan akseptor hidrogen juga menentukan kekuatan ikatan (Tabel 5)(Jeffery 1997). Semakin dekat jarak ikatan hidrogen, maka semakin kuat energi ikatan yang terbentuk. Selekoksib memiliki 4 interaksi hidrogen dengan asam amino pada enzym COX-2. Interaksi yaitu atom N dengan asam amino Gln 178 (N-H....O) dengan panjang ikatan 3.08 Å,Ser 339 (N-H....O) dengan panjang ikatan 2.96 Å dan Leu 338 Å (O-H....N) dengan panjang ikatan 2.71 Å. Interaksi hidrogen berikutnya adalah antara rantai oksigen Arg 499 dan atom N pada rantai samping sulfonamida (N-H....O) dengan panjang ikatan 3.34 Å. Pada senyawa kurkumin terjadi interaksi 3 interksi hidrogen dan 16 interaksi hidrofobik. Interaksi hidrogen terdapat pada gugus karbonil kurkumin dengan rantai samping Arg 106 (N-H....O) dan Tyr 341 (O-H....O). Interaksi hidrogen berikutnya yaitu antara gugus OH pada rantai samping fenil dengan His 75 (O-H....O). Situs interaksi kurkumin dan selekoksib memiliki kesamaan sebanyak 15 asam amino. Kesamaan ini mengindikasikan kemiripan mekanisme aksinya terhadap protein.
Pada senyawa aktif demetoksikurkumin terdapat interaksi hidrogen pada asam amino Tyr341 (O-H...O) dengan rantai samping OH ke 2 gugus fenil dengan
26
panjang ikatan 2.75 Å dan ikatan dengan Arg106(O-H....N). Rantai samping OH ke 5 gugus fenil (O-H....N) dengan panjang panjang ikatan 2.80 Å dengan His75, selanjutnya ikatan hidrogen antara OH gugus enol (O-H....O) dengan rantai samping Tyr371 dengan panjang ikatan 2.97 Å. Senyawa aktif bisdemetoksikurkumin memiliki interaksi gugus fenil OH ke 1 Tyr341 (O-H....O) dengan panjang ikatan 2.99 Å, dengan Arg106 (O-H....N) dengan panjang ikatan 2.80 Å pada rantai samping OH ke 1. OH ke 4 pada gugus fenil dengan rantai samping NH2 His75(O-H....N) dengan panjang ikatan 2.80 Å. Interaksi terakhir adalah dengan asam amino Tyr371 (O-H....O) dengan gugus enol OH ke 2 bisdemetoksikurkumin, panjang ikatannya adalah 3.08 Å. Sedangkan Santorizol memiliki interaksi pada gugus OH rantai samping gugus fenil dengan gugus karboksil asam amino Ser516 dengan panjang ikatan 3.04 Å.
Analisis Kesamaan Ikatan dan Interaksi Hidrofobik
Interaksi hidrofobik terjadi antara molekul nonpolar pada asam amino penyusun enzim dan atom ligan. Interaksi hidrofobik akan meningkatkan kestabilan obat yaitu kekuatan ikatan dan efek obat (Patil et al. 2010). Interaksi
yang cenderung menjauhi air ini memiliki peran dalam pelipatan protein dan menjaga agar sisi aktif protein bisa tetap aktif. Pada protein terdapat asam amino hidrofobik (alanin, valin, leusin, isoleusin, fenilalanin, triptofan, dan metionin) yang membentuk struktur cekungan yang menhindarkan sisi aktif protein terhadap air.
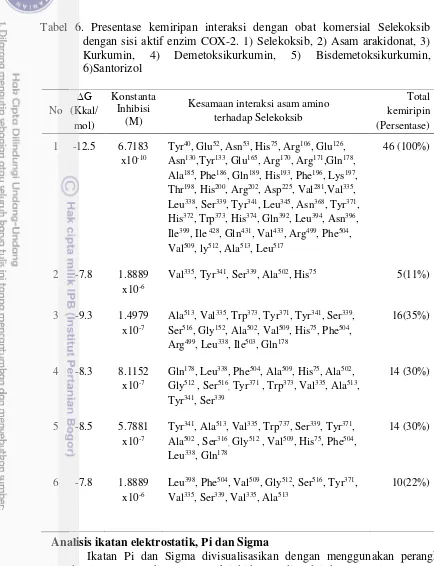
Senyawa kurkumin memiliki jumlah total asam amino yang memiliki kemiripan terbesar 16 persen dari total asam amino yang terdapat pada senyawa aktif selekoksib. Selain itu kurkumin juga berinteraksi dengan situs interaksi yang sama dengan substrat asli enzim COX-2. Interaksi ini menunjukkan bahwa kurkumin memiliki mekanisme inhibisi kompetitif terhadap substrat pada COX-2.
Analisis Ikatan Elektrostatik Pi dan Sigma
Nilai afinitas energi bebas Gibbs (∆G) yang tinggi pada kurkumin dipengaruhi oleh interaksi ikatan kovalen yaitu ikatan sigma (σ). Ikatan sigma terjadi karena tumpang tindih orbital. Ikatan sigma hanya terdapat pada ligan kurkumin dan selekoksib (Gambar7). Ikatan ini merupakan ikatan terkuat sehingga menyebabkan konformasi senyawa aktif tertambat dengan stabil terhadap ligan struktur protein.
Interaksi elektrostatik dan van der Waals divisualisasikan menggunakan perangkat lunak Discovery studio 4.0. Interaksi elekstrostatik adalah interaksi yang terjadi antara dua molekul yang bermuatan interaksi ini terbagi menjadi 3 yaitu interaksi hidrogen, ikatan ion dan interaksi air. Visualisasi interaksi elektrostatik ditampilkan secara keseluruhan namun perangkat lunak ini tidak memberikan informasi atom spesifik yang terlibat dalam interaksi. Interaksi van der Waals adalah interaksi antara dua molekuler yang berdekatan akibat perbedaan kepolaran molekul. Interaksi elektrostatik dan van der Waals merupakan ikatan non kovalen yang bersifal lemah, namun akumulasi dari interaksi ini berperan dalam kestabilan ikatan ligan dan protein (Berg 2007).
dan 11 interaksi van der Waals, Senyawa kurkumin memiliki 7 interaksi elektrostatik dan 12 interaksi van der Waals. Bisdemetoksikurkumin memiliki total 11 interaksi elektrostatik dan 10 interaksi van der Waals, Demetoksi kurkumin memiliki 10 interaksi elektrostatik dan 13 interaksi van der Waals, santorizol dengan 3 interaksi elektrostatik dan 11 interaksi van der Waals.
Setiap atom yang berinteraksi dengan asam amino memiliki kekhasan tergantung gugus fungsi spesifik yang terdapat pada atom atau senyawa terbsebut. Fungsi ini dikendalikan oleh gugus fungsi yang memiliki sifat sebagai obat. Beberapa gugus fungsi yang memiliki sifat obat seperti metoksi, keton, eter, hidroksil, amina. Pada senyawa obat selekoksib gugus yang berperan sebagai fungsi obat adalah benzenesulfonamida dengan interaksi hidrogen, pi, dan sigma, gugus benzenesulfonamida bersama dengan gugus trimetil fenil yang terdapat pada cincin ke 3 gugus pyrzol memiliki fungsi selektifitas yang tinggi terhadap COX-2 (Penning 1997). Cincin pirazol menstabilkan ikatan dengan membentuk ikatan pi dengan asam aminoArg106.
Cincin fenil Adan gugus karboksil pada kurkumin memiliki fungsi sebagai interaksi kurkumin dengan enzim COX-2, terlihat ikatan hidrogen dengan residu His75 dan Tyr341 sebagai tempat terjadinya interaksi pi dan sigma (Gambar 8). Ikatan sigma adalah ikatan kovalen yang terjadi akibat tumpang tindih atom pada elektron s+s, pz+pz, s+pz and dz2+dz2 (John et al 2010). Sedangkan ikatan phi adalah ikatan kovalen yang terjadi karena tumpang tindih elektron yang diakibatkan oleh atom pada orbitas p-p ikatan ini lebih lemah dibandingkan dengan ikatan sigma. Pada demetoksikurkumin cincin fenil A dan B berperan dalam interaksi, cincin fenil A berinteraksi dengan ikatan pi sedangkan cincin fenil B berikatan dengan rantai samping yaitu gugus hidroksil, serta gugus hidroksil pada rantai enol. Senyawa bisdemetoksikurkumin terdapat interaksi pi pada kedua gugus fenil dan pada rantai samping OH gugus enol dan gugus cincin fenil A dan B terdapat yang terkuat dalam fungsi obat berikatan dengan ikatan hidrogen. Santorizol memiliki memiliki gugus funsi obat pada gugus OH rantai samping fenil.
28
5 SIMPULAN DAN SARAN
Simpulan
Terdapat 4 macam interaksi yang terjadi antara senyawa aktif dan enzim COX-2 yaitu ikatan hidrogen, interaksi hidrofobik, ikatan pi, dan ikatan sigma. Semua senyawa aktif berhasil tertambat dengan baik pada sisi aktif enzim COX-2. Kurkumin merupakan senyawa aktif yang memiliki nilai afinitas energi bebas Gibbs terstabil (ΔG = -8,4 kkal/mol). Ikatan hidrogen yang terbentuk yaitu pada asam amino Tyr341, Arg106 ,His75. Ikatan pi dan sigma terdapat pada gugus benzen dan ikatan sigma dengan asam amino Ser339. Senyawa kurkuminoid dan santorizol yang terkandung dalam temulawak semuanya memiliki kemiripan interaksi dengan asam interaksi asam amino dengan obat. Kemiripan interaksi ini menandakan bahwa model inhibisi yang diakibatkan oleh senyawa tersebut adalah model inhibisi kompetitif. Oleh karena itu senyawa murni dari temulawak memiliki potensi sebagai kandidat obat anti kanker payudara dengan menghambat aktifitas dari enzim COX-2.
Saran
Metode penambatan molekuler secara dinamis bisa digunakan sebagai metode lanjutan untuk mensimulasikan protein dan ligan dengan prinsip inhibisiinduce fit. Untuk menguji lebih lanjut validitas hasil penambatan
molekuler maka uji in vitro menggunakan sel kanker payudara dan in vivo
DAFTAR PUSTAKA
Aggarwal BB and Harikumar KB. 2009. Potential Therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases.
Int J Biochem Cell Biol. 41(1): 40–59. DOI: 10.1016/j.biocel.2008.06.010.
Arwansyah. 2014. Simulasi docking kurkumin dan analognya sebagai inhibitor reseptor androgen pada kanker prostat. Current Biochemistry (1):11-19. Berg J, John T, Lubert S, 2007. Biochemistry. W.H. Freeman and Company. 6th
edition.
Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron JA, Bombardier C, Cannon C, Farkouh ME, FitzGerald GA. 2013. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet 382
(9894): 769–79. DOI: http://dx.doi.org/10.1016/S0140-6736(13)60900-9. Born, Max, and Wolf, Emil. 1999. Principles of Optics: Electromagnetic theory of
propagation, interference and diffraction of light (7th ed.), section 2.3.3, Cambridge University Press ISBN 0-521-64222-1.
Cheah YH, Nordin FJ, Tee TT, Azimahtol HL, Abdullah NR, Ismail Z. 2008. Antiproliferative property and apoptotic effect of xanthorrhizol on MDA-MB-231 breast cancer cells. Anticancer Res. 28(6A):3677-89.
Cheah YH1, Azimahtol HL, Abdullah NR. 2006. Xanthorrhizol exhibits antiproliferative activity on MCF-7 breast cancer cells via apoptosis induction. Anticancer Res. 26(6B):4527-34.
Darma AP. 1980. Tanaman Obat Tradisional Indonesia. Jakarta: Balai Pustaka.
Dinas Kesehatan Nasional. 2007. Data penderita kanker payudara di Indonesia.
Diakses pada tanggal 9 Mei 2014dari
[http://www.depkes.go.id/index.php/berita/press-release/1060-jikatidak-dikendalikan-26-juta-orang-di-dunia-menderita-kanker-.html].(9Mei 2014).
DiPiro, Joseph T, Robert L. Talbert, Gary CY, Matzke GR, Wells BG, and L. Posey M. 2008. Pharmacotherapy apathophysiologic approach (Pharmacotherapy (Dipiro)). New York: McGraw-Hill Medical
Ekins S1, Balakin KV, Savchuk N, Ivanenkov Y. 2006. Insights for human ether-a-go-go-related gene potassium channel inhibition using recursive partitioning and Kohonen and Sammon mapping.J Med Chem.
24;49(17):5059-71.
Faisel CT. 2012. Gambaran efek samping kemoterapi berbasis antrasiklin pada pasien kanker payudara di RSUD dokter Soedarso Pontianak. Fakultas kedokteran Universitas Tanjung pura Pontianak.
Golovin A, Dimitropoulos D, Oldfield T, Rachedi A, Henrick K. 2005. MSDsite: a database search and retrieval system for the analysis and viewing of bound Ligans and active sitesof proteins. 58(1);190-9.
Gupta SC, Prasad S,Kim JH, Patchva S, Webb LJ,Priyadarsini IK, Aggarwal BB. 2011. Multitargeting by curcumin as revealed by molecular interaction studie. Nat Prod Rep.
30
Hubbard RE, Haider MK. 2010. Hydrogen bonds in proteins: role and strengthuniversity ofuk, University of York, York, UK.
DOI:10.1002/9780470015902.a0003011.pub2.
Ibrahim, R. 2008. Penanganan Kanker Stadium Lanjut. PT.Rineka Cipta. Jakarta.
Jeffrey, G.A . 1997. An Introduction to Hydrogen Bonding.. New York: Oxford John M, Conrad SL, Peter J C. Principles of Chemistry: The Molecular Science. Kim AJ, Kim YO, Shim JS, Hwang JK. 2007. Immunostimulating activity of
crude polysaccharide extract isolated from Curcuma xanthorrhiza Roxb. Biosci Biotechnol Biochem. Jun;71(6):1428-38.
Kiefer JR, Kurumbail RG, Stallings WC, Pawlitz JL. 2010. Structure of celecoxib bound at the COX-2 active site.
Lagunin AA, Dearden JC, Filimonov DA, Poroikov VV. 2005. Computer-aided rodent carcinogenicity prediction.Mutat Res.586(2):138-46.
Leo A, Hansch C, and Elkins D. 1971. Partition coefficients and their uses. Chem Rev 71 (6): 525–616. doi:10.1021/cr60274a001.
Lipinski CA. Lombardo F. Dominy BW, Feeney PJ. 1996. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv. Drug Deliv. Rev.23,3–25.
Lovell SC, Davis IW, Arendall WB, Bakker PIW, Word JM, Prisant MG, Richardson JS, Richardson DC.2002. Structure validation by Calpha geometry: phi,psi and Cbeta deviation. Proteins: Structure, Function & Genetics. 50: 437-450.
Morris GM, Lim WM. 2008. Molecular penambatan molekuler. Department of molecular biology. Methods Mol Biol. 443:365-82. DOI:
10.1007/978-1-59745-177-2_19
Patil R, Das S, Stanley A, Yadav L, Sudhakar A, Varma AK. 2010. Optimized hydrophobic interactions and hydrogen bonding at the target-ligan interface leads the pathways of drug-designing.PLoS ONE 5(8): e12029.
doi: 10.1371/journal.pone.0012029.
Penning TD, Talley JJ, Bertenshaw SR, Carter JS, Collins PW, Docter S, Graneto MJ, Lee LF, Malecha JW, Miyashiro JM, Rogers RS, Rogier DJ, Yu SS, Burton EG, Cogburn JN, Gregory SA, Koboldt CM, Perkins WE, Seibert K, Veenhuizen AW, Zhang YY, Isakson PC. 1997. Synthesis and biological evaluation of the 1.5 diarylpyrazole class of cyclooxygenase-2 inhibitors: identification of 4-[5-(4-methylphenyl)-3-(trifluoromethyl)-1h-pyrazole-1-yl]benzenesulfonamide (sc-58634, selekoksib)". Journal of Medicinal Chemistry40 (9): 1347–1365.DOI:10.1021/jm960803q
Ramachandran GN. Ramakrishnan C. Sasisekharan, V. 1963. "Stereochemistry of polypeptide chain configurations". Journal of Molecular Biology 7: 95–9.
doi:10.1016/S0022-2836(63)80023-6.
Retno HW. 2009. Sintesis senyawa analog kurkumin 3,6-bis-(4’-hidroksi-3’,5’ -dimetilbenzilidin)- piperazin-2’,5’-dion dengan katalis Hcl. fakultas farmasi universitas muhammadiyah surakarta.
Rita DB, Jürgen V, Koen KV, Patrick L, Bart DV, Catharina VE, Marinus J B, Kristien K, Torik A, Hubert JMSet al. 2013. A randomised controlled