PENAMBAHAN PROBIOTIK CAIR KE DALAM RANSUM BERBASIS
JERAMI PADI DAN KONSENTRAT DENGAN TARAF PROTEIN
DAN ENERGI YANG BERBEDA
OCTAVIANA
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penambahan Probiotik Cair ke dalam Ransum Berbasis Jerami Padi dan Konsentrat dengan Taraf Protein dan Energi yang Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
dan Konsentrat dengan Taraf Protein dan Energi yang Berbeda. Dibimbing oleh ANITA S. TJAKRADIDJAJA dan SURYAHADI.
Jerami padi merupakan produk limbah pertanian yang dapat digunakan untuk pakan ternak ruminansia, namun dibatasi kadar SK dan silika yang cukup tinggi. Penelitian ini bertujuan untuk mempelajari efek penambahan probiotik cair terhadap fermentasi dan kecernaan pada teknik in vitro ransum berbasis jerami padi dan konsentrat dengan kadar protein dan energi yang berbeda. Percobaan menggunakan rancangan acak kelompok berpola faktorial 4×2. Faktor A : ransum yang mengandung JP dan konsentrat (60%:40%); A1 = ransum 11% PK dan 60% TDN, A2 = ransum 11% PK dan 65% TDN, A3 = ransum 14% PK dan 60% TDN, A4 = ransum 14% PK dan 65% TDN. Faktor B : Perlakuan Probiotik; B1 = tanpa probiotik, B2 = probiotik cair (0.50% v.b-1). Peubah yang diamati: konsentrasi NH3
dan VFA total, populasi bakteri total, populasi protozoa, sintesis protein mikroba, degradabilitas bahan kering dan organik serta kecernaan bahan kering dan organik. Hasil penelitian menunjukkan bahwa konsentrasi NH3 dan VFA total, degradabilitas
bahan kering dan organik, serta kecernaan bahan kering dan organik dipengaruhi oleh perlakuan ransum. Populasi bakteri total dipengaruhi oleh perlakuan ransum dan suplementasi probiotik, namun kedua perlakuan tersebut tidak mempengaruhi populasi protozoa dan sintesis protein mikroba. Ransum dengan taraf PK 14% dan TDN 65% merupakan perlakuan yang paling optimal.
Kata kunci: fermentasi, jerami padi, kecernaan, konsentrat, probiotik cair
ABSTRACT
OCTAVIANA. Addition of liquid probiotic into rice straw-concentrate base diet at different protein and energy levels. Supervised by ANITA S. TJAKRADIDJAJA and SURYAHADI.
Rice straw is an agricultural by-product which can be used as feed source for ruminants, however, it is limited by high crude fiber and silica contents. This study is aimed at evaluating effect of adding liquid probiotic into rice straw (RS)-concentrate base diet at different protein and energy levels on in vitro fermentability and digestability. The experiment used factorial randomized block design 4×2. Factor A : rice straw concentrate based diet (60%:40%); A1 = ration with 11% CP and 60% TDN, A2 = ration with 11% CP and 65% TDN, A3 = ration with 14% CP and 60% TDN, A4 = ration with 14% CP and 65% TDN. Factor B : probiotic addition; B1 = without probiotic, B2 = with liquid probiotic (0.50% v.b-1). Variables measured were NH3 and VFA concentrations, total bacterial and protozoal populations, microbial
protein synthesis, dry and organik matter degradabilities and digestabilities. The result showed that NH3 and total VFA concentrations, dry and organik matter
degradabilities and digestibilities were influenced by treatment rations. Bacterial populations were affected by treatment rations and probiotic supplementation, but the two treatments did not affect protozoal population and microbial protein synthesis. Ration with 14% CP and 65% TDN is the optimal treatment.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
PENAMBAHAN PROBIOTIK CAIR KE DALAM RANSUM BERBASIS
JERAMI PADI DAN KONSENTRAT DENGAN TARAF PROTEIN
DAN ENERGI YANG BERBEDA
OCTAVIANA
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi: Penambahan Probiotik Cair ke dalam Ransum Berbasis Jerami Padi nnnnnnnnnnn dan Konsentrat dengan Taraf Protein dan Energi yang Berbeda Nama : Octaviana
NIM : D24110089
Disetujui oleh
Ir Anita S Tjakradidjaja, MRur Sc Pembimbing I
Dr Ir Suryahadi, DEA Pembimbing II
Diketahui oleh
Prof Dr Ir Panca Dewi MHK, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Februari 2015 ialah Penambahan Probiotik Cair ke dalam Ransum Berbasis Jerami Padi dan Konsentrat dengan Taraf Protein dan Energi yang Berbeda.
Jerami padi merupakan salah satu produk limbah pertanian yang dapat digunakan sebagai alternatif pakan untuk ternak ruminansia. Namun, salah satu faktor pembatas dalam penggunaannya adalah ketersediaan nutrien yang rendah karena jerami padi mengandung serat kasar yang tinggi sehingga menyebabkan nilai kecernaannya rendah. Untuk mengatasi hal tersebut, maka dilakukan suatu upaya perbaikan dengan cara penggunaan feed additive (imbuhan pakan) berupa probiotik yang ditambahkan ke dalam ransum guna memperbaiki nutrien dan kecernaan pakan tersebut.
Penelitian ini bertujuan untuk mempelajari efek optimalisasi ransum berbasis jerami padi dan konsentrat yang diberi imbuhan pakan berupa probiotik cair terhadap fermentasi dan kecernaan pada ternak ruminansia secara in vitro. Skripsi ini merupakan salah satu syarat untuk kelulusan dan memperoleh gelar Sarjana Peternakan di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Penulis menyadari penulisan skripsi ini jauh dari kesempurnaan. Kritik, saran yang membangun sangat penulis harapkan. Semoga karya ilmiah ini bermanfaat bagi pembaca secara umumnya.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL i
DAFTAR LAMPIRAN ii
PENDAHULUAN 1
METODE 2
Alat 2
Bahan 2
Waktu dan Lokasi Penelitian 3
Prosedur Penelitian 3
Pengambilan cairan rumen 3
Pembuatan larutan McDougall 3
Pencernaan fermentatif 3
Pengukuran konsentrasi NH3 4
Pengukuran konsentrasi VFA total 4
Perhitungan populasi bakteri total 4
Perhitungan populasi protozoa 5
Pengukuran sintesis protein mikroba 5
Pengukuran degradabilitas bahan kering dan bahan organik 6 Pengukuran koefisien cerna bahan kering dan bahan organik 6
Rancangan dan Analisis Data 7
Perlakuan 7
Peubah yang diamati 7
Rancangan Percobaan 7
Analisis Data 7
HASIL DAN PEMBAHASAN 8
Karakteristik Probiotik 8
Komposisi Ransum 9
Konsentrasi NH3 11
Konsentrasi VFA Total 13
Populasi Bakteri Total 15
Populasi Protozoa Total 16
Sintesis Protein Mikroba 18
Degradabilitas Bahan Kering dan Bahan Organik 19
Kecernaan Bahan Kering dan Bahan Organik 21
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 24
DAFTAR PUSTAKA 24
RIWAYAT HIDUP 31
DAFTAR TABEL
1 Jenis dan jumlah mikroba probiotik 9
2 Persentase penggunaan jerami padi dan konsentrat (%) 10 3 Hasil analisis proksimat ransum yang digunakan 10 4 Pengaruh perlakuan terhadap konsentrasi NH3 11
5 Pengaruh perlakuan terhadap konsentrasi VFA total 13 6 Pengaruh perlakuan terhadap populasi bakteri total 15 7 Pengaruh perlakuan terhadap populasi protozoa total 17 8 Pengaruh perlakuan terhadap sintesis protein mikroba 18 9 Pengaruh perlakuan terhadap degradabilitas bahan kering (DBK) 19 10 Pengaruh perlakuan terhadap degradabilitas bahan organik (DBO) 20 11 Pengaruh perlakuan terhadap kecernaan bahan kering (KCBK) 21 12 Pengaruh perlakuan terhadap kecernaan bahan organik (KCBO) 22
DAFTAR LAMPIRAN
1 Analisis ragam (ANOVA) pengaruh perlakuan terhadap konsentrasi amonia 28 2 Analisis ragam (ANOVA) pengaruh perlakuan terhadap konsentrasi VFA total 28 3 Analisis ragam (ANOVA) pengaruh perlakuan terhadap populasi bakteri total 28 4 Analisis ragam (ANOVA) pengaruh perlakuan terhadap populasi protozoa total 29 5 Analisis ragam (ANOVA) pengaruh perlakuan terhadap sintesis
protein mikroba 29
6 Analisis ragam (ANOVA) pengaruh perlakuan terhadap degradabilitas
bahan kering (DBK) 29
7 Analisis ragam (ANOVA) pengaruh perlakuan terhadap degradabilitas
bahan organik (DBO) 30
8 Analisis ragam (ANOVA) pengaruh perlakuan terhadap koefisien cerna
bahan kering (KCBK) 30
9 Analisis ragam (ANOVA) pengaruh perlakuan terhadap koefisien cerna
PENDAHULUAN
Pakan merupakan faktor yang sangat penting dalam sebuah peternakan. Pada usaha peternakan, biaya untuk pakan menyumbang rata-rata biaya terbesar dari total biaya produksi, sehingga diperlukan adanya perhatian dalam penyediaan pakan baik dari segi kualitas maupun kuantitasnya. Kesulitan pakan di Indonesia merupakan permasalahan umum yang sering dihadapi dalam bidang peternakan. Pada musim kemarau kontinuitas dan ketersediaan pakan, terutama hijauan pakan, masih relatif rendah sehingga ternak kekurangan pakan. Penggunaan limbah pertanian yang jumlahnya cukup berlimpah merupakan upaya untuk mengatasi masalah keterbatasan hijauan. Dengan potensi produksi yang besar, 85.81% dari 51 546 297.3 ton per tahun limbah produksi pertanian (Syamsu et al. 2003), jerami padi berpotensi untuk digunakan sebagai bahan pakan, terutama pada saat ketersediaan rumput yang terbatas. Namun, kekurangan dalam penggunaan jerami padi terdapat pada kualitas nutriennya. Jerami padi memiliki kadar protein yang rendah, dan kadar serat kasar yang tinggi sehingga menyebabkan rendahnya produksi ternak. Kendala tersebut dapat dikurangi melalui upaya perbaikan dengan penggunaan feed additive (imbuhan pakan) berupa probiotik yang ditambahkan ke dalam ransum.
Probiotik didefinisikan sebagai substrat mikroorganisme, yang dapat diberikan kepada ternak melalui pakan dan memberikan efek positif dengan cara memperbaiki keseimbangan mikroorganisme alami di dalam saluran pencernaan (Shitandi et al. 2007; Dommels et al. 2009; Weichselbaum 2009). Probiotik juga memiliki manfaat lain yaitu mampu memperbaiki ekosistem rumen, meningkatkan efisiensi pakan akibat meningkatnya populasi bakteri selulolitik di dalam rumen dan meningkatkan status kesehatan ternak dengan menghambat bakteri patogen. Probiotik umumnya berasal dari golongan bakteri asam laktat (BAL), khususnya genus Lactobacillus dan Bifidobacterium, yang merupakan bagian dari flora normal di saluran pencernaan manusia (Sujaya et al. 2008b).
Penelitian mengenai pemberian imbuhan pakan berupa probiotik melalui pakan ternak ruminansia, baik in vivo maupun in vitro, telah banyak dilakukan oleh para ahli nutrisi. Beberapa hasil penelitian penggunaan probiotik berbentuk padat atau cair dipaparkan berikut ini. Siregar (2013) menyatakan bahwa suplementasi probiotik cair pada taraf pemberian 0.1% v.b-1 lebih efektif dalam
meningkatkan kecernaan bahan kering (KCBK), protein kasar (KCPK) dan serat kasar (KCSK) ransum sapi potong in vivo dibandingkan probiotik padat 0.25% b.b-1. Hasil penelitian Purwanti (2013) menunjukkan bahwa perlakuan probiotik dapat meningkatkan pertambahan bobot badan harian sapi potong sehingga dapat memberikan keuntungan secara ekonomi dibandingkan perlakuan kontrol, tetapi tidak terdapat perbedaan yang nyata antara probiotik padat dengan probiotik cair terhadap pertambahan bobot badan harian sapi potong. Muchayani (2013) melaporkan bahwa pemberian probiotik dapat menurunkan kadar NH3 feses yang
merupakan penyebab utama pencemaran lingkungan, tetapi tidak berpengaruh nyata terhadap kadar H2S feses, kadar bahan kering dan protein kasar feses. Hasil
2
total, populasi bakteri, KCBK dan KCBO dibandingkan penggunaan probiotik padat (0.25% b.b-1). Hasil yang lebih baik akan diperoleh jika taraf probiotik cair ditingkatkan menjadi 0.2% v.b-1 (Muzakki 2014). Penggunaan probiotik padat pada taraf 0.50% b.b-1 memberikan efek yang lebih baik terhadap fermentabilitas dan kecernaan in vitro ransum sapi potong berbasis jerami padi dan konsentrat (60:40%) daripada taraf 0.25% b.b-1 (Rafi 2013). Efek penggunaan probiotik terhadap fermentabilitas dan kecernaan in vitro ransum sapi potong yang mengandung rumput gajah dan konsentrat (60:40%) yang terbaik akan diperoleh jika ransum mengandung PK 12% dan TDN 60% (Septiani 2013); sedangkan Almai (2013) mendapatkan efek yang terbaik dalam menggunakan probiotik jika ransum sapi potong berbasis jerami padi dan konsentrat (60:40%) mengandung PK 14% dan TDN 60%.
Berdasarkan hasil penelitian Almai (2013) diketahui bahwa secara umum probiotik cair lebih efektif digunakan sebagai imbuhan pakan bila dibandingkan dengan probiotik padat dalam ransum berbasis jerami padi dan konsentrat. Namun demikian, efek penggunaan probiotik cair dalam ransum yang optimal dengan kadar PK dan TDN masih memungkinkan untuk diperoleh dengan menggunakan taraf 11% dan 14% PK serta 60% dan 65% TDN. Penelitian ini bertujuan untuk mempelajari efek optimalisasi ransum berbasis jerami padi dan konsentrat dengan taraf PK dan TDN berbeda yang diberi imbuhan pakan berupa probiotik cair terhadap fermentasi dan kecernaan in vitro.
METODE
Alat
Peralatan yang digunakan dalam penelitian ini adalah alat-alat percobaan fermentasi dan kecernaan in vitro seperti timbangan digital, tabung fermentor, tutup karet berventilasi, shaker waterbath, tabung gas CO2, cawan porselen, oven
105 oC, tanur listrik 600 oC, kertas saring Whatman No.41, cawan Conway, labu
Erlenmeyer, alat-alat destilasi, alat-alat titrasi, counting chamber, tabung Hungate, roller tube, autoclave dan alat sentrifugasi.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain jerami padi, konsentrat, cairan rumen segar sapi potong yang berasal dari rumah potong hewan (RPH) Bubulak, probiotik cair (Probiss, PT. Petrokimia Kayaku), plastik kemasan, label, larutan McDougall dengan pH 6.5-6.9, larutan pepsin HCl 0.2%, aquades, larutan HgCl2 jenuh, larutan Na2CO3 jenuh, larutan H2SO4 0.005N, asam
borat berindikator, indikator merah metil dan hijau bromo kresol, larutan HCl 0.5N, larutan H2SO4 15%, larutan NaOH 0.5N, larutan indikator Phenolphtalein
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan dari bulan Februari 2015 hingga Agustus 2015 di Laboratorium Biokimia, Fisiologi, dan Mikrobiologi Nutrisi, dan di Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Prosedur Penelitian
Pengambilan cairan rumen
Cairan rumen diambil dari RPH Bubulak. Termos disiapkan terlebih dahulu dengan mengisinya dengan air panas (39 oC). Isi rumen diambil kemudian disaring dengan menggunakan kain penyaring, dan dimasukkan ke dalam termos yang sebelumnya sudah dibuang air panasnya. Cairan rumen dalam termos tersebut lalu dibawa ke laboratorium untuk percobaan fermentasi dan kecernaan in vitro. Pengambilan cairan rumen dilakukan sebanyak empat kali atau dari 4 ekor sapi potong sebagai kelompok.
Pembuatan larutan McDougall
Air destilasi dimasukkan ke dalam labu takar sebanyak 1 liter, kemudian ditambah bahan-bahan sebagai berikut: NaHCO3 sebesar 9.8 g; Na2HPO4.7H2O
sebesar 3.708 g; KCl sebesar 0.97 g; NaCl sebesar 0.47 g; MgSO4.7H2O sebesar
0.12 g dan CaCl2.2H2O sebesar 0.053 g. CaCl2.2H2O ditambahkan paling akhir
setelah bahan lainnya larut dengan sempurna. Leher labu dicuci dengan menggunakan air destilasi hingga permukaan air mencapai tanda tera. Selanjutnya campuran tersebut dikocok dengan gas CO2 perlahan-lahan dengan
melewatkannya dengan tujuan menurunkan pH hingga mencapai pH 6.8. Untuk tujuan ini diperlukan waktu paling sedikitnya 3 jam. Pemeriksaan pH dilakukan pada suhu 39 oC, jika pH 6.8 belum tercapai maka larutan pH akan dialiri lagi dengan gas CO2. Pengocokan dengan gas CO2 juga dilakukan untuk
mengkondisikan larutan menjadi kondisi anaerob. Pencernaan fermentatif
Percobaan fermentatif in vitro dilakukan dengan menggunakan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979). Metode Sutardi (1979) menggunakan tabung fermentor polyetilen (kapasitas 50 ml). Sebanyak 1 g sampel, 12 ml larutan buffer McDougall dan 8 ml cairan rumen segar dimasukkan ke dalam tabung fermentor. Tabung lalu dikocok sambil dialiri CO2 (30 detik) dan
ditutup dengan karet berventilasi. Tabung kemudian dimasukkan ke dalam penangas air bergoyang pada suhu 39 oC untuk menciptakan suasana yang hampir
sama dengan kondisi di dalam rumen dan proses inkubasi dilakukan selama 4 jam. Sampel diambil untuk perhitungan populasi bakteri dan protozoa total, lalu proses fermentasi dihentikan dengan meneteskan larutan HgCl2 jenuh sebanyak 2 tetes.
Tabung fermentor disentrifugasi (kecepatan 3 000 rpm; 15 menit), lalu supernatan diambil untuk analisis konsentrasi NH3 dan VFA total, sedangkan residu diambil
4
Pengukuran Konsentrasi NH3
Metode mikrodifusi Conway digunakan untuk mengukur konsentrasi NH3
(Department of Dairy Science University of Wisconsin 1996). Bibir dan tutup cawan Conway diolesi dengan vaselin. Sebanyak 1 ml supernatan diambil, dan ditempatkan di salah satu ujung alur cawan Conway. Setelah itu 1 ml larutan Na2CO3 jenuh ditempatkan pada ujung lain cawan Conway yang bersebelahan
dengan supernatan (tidak boleh bercampur). Larutan asam borat berindikator warna merah metil dan hijau bromo-kresol sebanyak 1 ml ditempatkan di dalam cawan kecil yang terletak di tengah cawan Conway. Cawan Conway lalu ditutup rapat hingga kedap udara, larutan Na2CO3 dicampur dengan supernatan hingga
merata dengan cara menggoyang-goyangkan dan memiringkan cawan tersebut. Setelah itu cawan dibiarkan dalam suhu kamar. Setelah 24 jam, tutup cawan dibuka, asam borat berindikator dititrasi dengan larutan H2SO4 0.005N sampai
terjadi perubahan warna dari biru menjadi merah. Konsentrasi NH3 dihitung
berdasarkan rumus berikut:
Pengukuran Konsentrasti VFA Total
Konsentrasi VFA diukur dengan menggunakan Teknik Destilasi Uap (Department of Dairy Science University of Wisconsin 1996). Alat destilasi dipersiapkan yaitu dengan mendidihkan air dan mengalirkan air ke kondensor atau pendingin. Sampel supernatan yang sama untuk analisa NH3 (5 ml) dan 1 ml
larutan H2SO4 15% dimasukkan ke dalam alat destilasi. Uap air panas akan
mendesak VFA yang akan terkondensasi melalui proses pendinginan. VFA yang dihasilkan ditampung dalam labu Erlenmeyer yang berisi 5 ml NaOH 0.5 N. Setelah diperoleh jumlah destilat sebanyak 250 ml, lalu ditambahkan 2 tetes indikator PP, selanjutnya dititrasi dengan HCl 0.5 N sampai berubah warna dari merah jambu menjadi tidak berwarna atau bening. Rumus berikut digunakan untuk menghitung konsentrasi VFA:
Keterangan :
a = volume titran blanko b = volume titran contoh Perhitungan populasi bakteri total
Metode Ogimoto dan Imai (1981) digunakan untuk menghitung populasi bakteri total dengan menggunakan media tumbuh BHI. Media BHI dibuat dengan cara mencampur tepung BHI dengan bahan sumber nutrien mikroba lainnya yaitu, tepung BHI 3.7 g; glukosa 0.05 g; CMC (1%) 1 ml; pati (starch) 0.05 g; cysteine-HCl 0.05 g; hemin 0.5 ml; resazurin 0.05 ml; dan aquades sampai 100 ml. Campuran tersebut dipanaskan perlahan-lahan dengan dialiri gas CO2 sampai
selanjutnya dimasukkan ke dalam tabung Hungate masing-masing sebanyak 5 ml yang sebelumnya telah diisi agar Bacto sebanyak 0.15 g, kemudian media disterilkan dalam autoclave (suhu 121 ºC, 15 menit, tekanan 1.2 Kgf.cm-3).
Pengenceran sampel dengan media pengencer dilakukan sebelum dikulturkan. Pengenceran tersebut dilakukan dengan cara: 0.1 ml cairan rumen dimasukkan ke dalam 4.9 ml medium pengencer pertama, kemudian diambil kembali 0.1 ml lalu dimasukkan ke dalam 4.9 ml medium pengencer kedua. Hasil dari pengencer kedua diambil kembali 0.1 ml lalu dimasukkan ke dalam media pengencer ketiga. Pengenceran keempat dilakukan sama halnya seperti prosedur pengenceran sebelumnya. Di dalam masing-masing tabung pengenceran satu sampai empat masing-masing mengandung populasi bakteri sebanyak 102, 104,
106, dan 108 cfu.ml-1. Sebanyak 0.1 ml sampel dari masing-masing tabung pengencer diambil dan diinokulasikan ke media agar. Media lalu dihomogenkan dan didinginkan menggunakan air pada roller tube hingga media menjadi padat dan merata pada dinding tabung. Tabung yang telah diinokulasi lalu diinkubasi di dalam inkubator pada suhu 39 oC selama 24 jam. Populasi bakteri total dapat dihitung dengan rumus:
Keterangan:
n= jumlah koloni yang terdapat pada tabung seri pengenceran ke-x Perhitungan populasi protozoa
Metode Ogimoto dan Imai (1981) digunakan untuk menghitung populasi protozoa. Sampel hasil fermentasi dicampur dengan larutan garam formalin (TBFS) dengan rasio 1:1. Larutan TBFS% dibuat dengan mencampurkan larutan formalin dengan larutan garam NaCl fisiologis 0.9% per 100 ml larutan. Sebanyak 2 tetes sampel campuran diletakkan pada counting chamber (haemacytometer), yang kemudian diamati di bawah mikroskop dengan pembesaran 40 kali. Populasi protozoa dapat dihitung dengan rumus:
Keterangan:
C = Jumlah protozoa terhitung FP = Faktor Pengencer
Pengukuran sintesis protein mikroba
6
disentrifugasi kembali (kecepatan 3 000 rpm; 15 menit). Supernatannya dibuang dan endapannya dianalisis dengan metode mikro Kjehldal.
Pengukuran degradasi bahan kering dan bahan organik
Pengukuran degradabilitas bahan kering dan bahan organik (DBK dan DBO) dilakukan dengan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979), residu yang diperoleh masing-masing setelah 4 jam waktu inkubasi, dikeringkan di dalam oven 105 oC selama 24 jam untuk mengetahui
bobot BK residu. Setelah ditimbang, sampel residu yang dihasilkan dari pengeringan oven 105 oC, kemudian diabukan di dalam tanur 600 oC selama 6 jam. Hal ini dilakukan untuk mendapatkan bobot abu dan BO sampel residu, sebagai blanko dipakai residu asal fermentasi tanpa sampel, sedangkan BK dan BO sampel diperoleh dari penguapan menggunakan oven 105 oC dan pengabuan menggunakan tanur 600 oC pada ransum percobaan yang mendapatkan perlakuan sama, tetapi tidak difermentasikan. Degradabilitas bahan kering (DBK) dan bahan organik (DBO) dapat dihitung dengan rumus:
Pengukuran koefisien cerna bahan kering dan bahan organik
Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO) diukur dengan metode Tilley dan Terry (1963) yang dimodifikasi oleh Sutardi (1979). Proses fermentasi yang dilakukan untuk pengukuran koefisien cerna KCBK dan KCBO sama seperti dalam proses fermentasi untuk mengukur fermentabilitas dan degradabilitas, hanya proses inkubasi dilakukan selama 24 jam. Setelah 24 jam proses fermentasi dihentikan dengan menambah larutan HgCl2 jenuh (2 tetes).
Rancangan dan Analisis Data
Perlakuan
Penelitian ini terdiri atas dua faktor, yaitu Faktor A berupa perlakuan ransum, dan Faktor B yaitu pemberian probiotik. Faktor A adalah ransum sapi potong yang terdiri atas jerami padi dan konsentrat komersil (60%:40%). Ransum mengandung total digestible nutrient (TDN) sebesar 60% dan 65% dan taraf protein kasar (PK) yang terdiri dari 11% dan 14%. Adapun perlakuan ransum (Faktor A) yang diterapkan :
A1 = Ransum 11% PK, 60% TDN A2 = Ransum 11% PK, 65% TDN A3 = Ransum 14% PK, 60% TDN A4 = Ransum 14% PK, 65% TDN
Faktor B adalah perlakuan probiotik yang ditambahkan kedalam keempat ransum tersebut yaitu :
B1 = tanpa probiotik (0.0%)
B2 = probiotik cair (0.50% v.b-1 ransum) Peubah yang diamati
Peubah yang diamati yaitu konsentrasi NH3, konsentrasi VFA total, populasi
protozoa, populasi bakteri total, sintesis protein mikroba, DBK dan DBO, KCBK dan KCBO.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak kelompok (RAK) pola faktorial 4 x 2 dengan 4 ulangan. Faktor A adalah ransum berbasis jerami padi dan konsentrat dengan kadar protein dan energi yang berbeda dan Faktor B adalah perlakuan penggunaan probiotik yaitu tanpa probiotik (0.0%), dan probiotik cair (0.50% v.b-1 ransum). Model matematik dari rancangan yang digunakan adalah sebagai berikut :
Yijk= μ + τi+ αj + ßk + αjßk+ εijk
Keterangan :
Yijk = nilai pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = rataan umum
τi = pengaruh kelompok (cairan rumen) ke-i
αj = pengaruh faktor A (ransum yang digunakan) ke-j
ßk = pengaruh faktor B (pemberian probiotik) ke-k αjßk = pengaruh interaksi faktor A ke-j dan faktor B ke-k
ijk = eror penelitian untuk kelompok ke-i, faktor A ke-j, dan faktor B
ke-k Analisis Data
8
HASIL DAN PEMBAHASAN
Karakteristik Probiotik
Probiotik merupakan organisme hidup yang diberikan dalam jumlah yang cukup sehingga dapat memberikan efek yang baik bagi kesehatan inang (Tremaroli dan Bäckhed 2012). Penggunaannya yang ditambahkan melalui pakan memberikan dampak yang menguntungkan seperti meningkatkan kecernaan, meningkatkan produktivitas, meningkatkan sistem kekebalan atau imunitas dalam mencegah penyakit dan dapat memperbaiki peforma ternak (Hau et al. 2005)
Probiotik cair yang digunakan pada penelitian ini adalah probiotik dengan merek dagang Probiss. Probiss merupakan probiotik yang diproduksi oleh PT. Petrokimia Kayaku yang mengandung 1 jenis mikroba Lactobacillus sp. dan 2 jenis mikroba Bacillus sp. Pengujian pada probiotik cair yang digunakan saat penelitian dilakukan untuk mengetahui jenis mikroba, ciri atau bentuk mikroba, dan total populasi mikroba. Berdasarkan hasil pengujian diketahui bahwa mikroba yang terdapat pada probiotik tersebut memiliki bentuk basil, hasil yang didapatkan sesuai dengan Nasih (2012) yang melaporkan bahwa jenis bakteri yang terdapat pada probiotik Probiss adalah Lactobacillus plantarum, Bacillus subtilis dan Bacillus megaterium yang termasuk ke dalam bakteri positif Gram dan kategori bakteri asam laktat (BAL) homofermentatif. Arief et al. (2008) menjelaskan bahwa Lactobacillus sp. dapat menghasilkan senyawa anti mikroba yang mampu menghambat pertumbuhan bakteri patogen seperti E. coli dan Salmonella karena bakteri ini dapat bersaing dengan bakteri E. coli pada penempelan di mukosa usus sehingga dapat mencegah terjadinya diare dan membuat kondisi penyerapan nutrien lebih optimum. Bacillus sp. diketahui memiliki sifat fisiologis yang menarik karena pada setiap jenisnya memiliki kemampuan yang berbeda, diantaranya: (1) mampu mendegradasi senyawa organik seperti protein, pati, selulosa, hidrokarbon dan agar, (2) berperan dalam nitrifikasi dan dentrifikasi, (3) pengikat nitrogen, dan (4) mampu menghasilkan antibiotik atau bakteriosin (Claus dan Berkeley 1986). Salah satu syarat agar probiotik dapat memberikan efek positif bagi kesehatan inangnya dapat dilihat dari jumlah sel hidup dalam probiotik tersebut. Jumlah sel hidup bakteri yang terdapat dalam probiotik cair yang digunakan sekitar 107 cfu ml-1, sehingga produk probiotik tersebut sudah memenuhi syarat sebagai probiotik seperti yang dinyatakan oleh Tamime et al. (2005) dimana bakteri probiotik harus terdapat dalam makanan pada konsentrasi minimum 106 cfu g-1 atau konsumsi harian sekitar 109 cfu g-1. Surono (2004) juga menjelaskan bahwa produk probiotik diharapkan memiliki jumlah sel hidup sekitar 107 sampai 109 cfu ml-1.
penelitian ini, sehingga efektifitas yang dihasilkan antara kedua probiotik terhadap perlakuan juga berbeda. Nayak (2010) menjelaskan bahwa manfaat probiotik antara lain mampu meningkatkan efisiensi pakan, pertambahan bobot badan, memberikan perlindungan dengan cara kompetisi pada tempat penempelan usus terhadap patogen, membantu produksi asam organik (asam format, asam asetat dan asam laktat), hidrogen peroksida dan beberapa senyawa lain dalam tubuh, namun dengan syarat probiotik harus berada dalam keadaan hidup dan dikonsumsi dalam jumlah yang cukup oleh ternak. Selain itu, Verschuere et al. (2000) mengemukakan bahwa bakteri yang dapat digunakan sebagai probiotik harus memiliki beberapa sifat antara lain: bakteri tersebut tidak boleh merugikan inang, dapat diterima inang, memiliki sifat antimikrobia terhadap patogen, dapat mencapai lokasi target penempelan usus halus atau masih aktif dalam kondisi asam lambung dan konsentrasi garam (asam) empedu yang tinggi, dapat tumbuh dan melakukan metabolisme secara cepat dan tepat dalam jumlah yang banyak, tidak mengandung gen yang resisten dan mempunyai efek yang sama dalam uji in vitro ataupun in vivo.
Tabel 1 Jenis dan jumlah mikroba probiotik Jenis Hasil Pengujian Probiotik
Padat (cfu g-1) Cair (cfu ml-1)
Total plate count 3.9 x 108 1.5 x 1010
Lactobacillus acidophilus 7.2 x 109 1.1 x 1010
Bifidobacterium sp. 4.9 x 109 7.0 x 105
Streptococcus thermophilus
5.6 x 107 1.0 x 1010
Bacillus sp. 4.0 x 105 -
Sumber: Suryahadi dan Tjakradidjaja (2012)
Komposisi Ransum
10
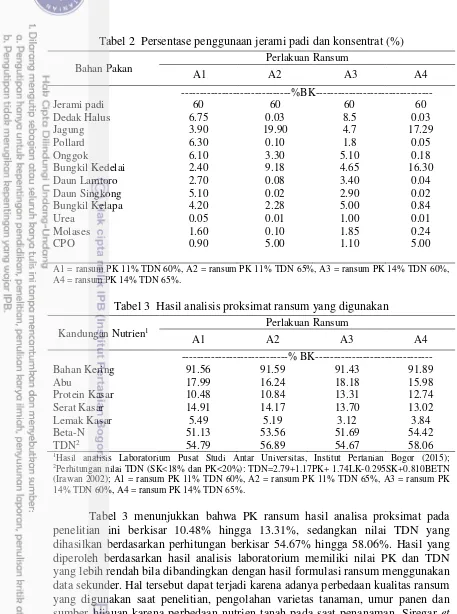
Tabel 2 Persentase penggunaan jerami padi dan konsentrat (%) Bahan Pakan
Tabel 3 Hasil analisis proksimat ransum yang digunakan Kandungan Nutrien1 Perlakuan Ransum
1Hasil analisis Laboratorium Pusat Studi Antar Universitas, Institut Pertanian Bogor (2015); 2Perhitungan nilai TDN (SK<18% dan PK<20%): TDN=2.79+1.17PK+ 1.74LK-0.295SK+0.810BETN (Irawan 2002); A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%.
teknik penyimpanan yang buruk, akan menyebabkan kualitas ransum tersebut menurun. Hal tersebut terjadi karena pakan mengalami beberapa perubahan, seperti halnya perubahan fisik, biologi, dan kimia. Selain itu, penggunaan data sekunder pada formulasi ransum memiliki kondisi yang berbeda dengan bahan pakan yang digunakan pada saat penelitian.
Konsentrasi NH3
Amonia merupakan sumber nitrogen utama dan penting untuk sintesis protein mikroba. Konsentrasi amonia merupakan cerminan dari tingkat fermentabilitas protein di dalam rumen, dimana produksi NH3 berasal dari protein
yang didegradasi oleh enzim proteolitik. Tingkat hidrolisis protein bergantung kepada daya larutnya yang akan mempengaruhi kenaikan kadar NH3 (Arora
1989). Tabel 4 memperlihatkan data konsentrasi NH3.
Tabel 4 Pengaruh perlakuan terhadap konsentrasi NH3
Ransum Probiotik Rataan ± SD
B1 B2
---mM--- A1 8.15 ± 0.47 8.30 ± 0.52 8.22 ± 0.11c A2 8.12 ± 0.78 8.40 ± 0.36 8.26 ± 0.20c A3 11.19 ± 0.99 11.51 ± 0.86 11.35 ± 0.23b A4 11.68 ± 0.55 11.96 ± 0.51 11.82 ± 0.20a Rataan ± SD 9.78 ± 1.92 10.04 ± 1.97 9.91 ± 1.81 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.01), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
Hasil sidik ragam menunjukkan bahwa Faktor A (perlakuan ransum) (P<0.01) dan kelompok (P<0.01) mempengaruhi konsentrasi amonia secara nyata, namun Faktor B (perlakuan probiotik) dan interaksi antara kedua faktor tidak berpengaruh terhadap konsentrasi NH3. Berdasarkan Tabel 4 konsentrasi amonia
yang dihasilkan pada penelitian berkisar antara 8.11 hingga 11.96 mM. Hasil yang didapatkan masih dalam kondisi optimum untuk pembentukan protein mikroba karena menurut Sutardi (1979) konsentrasi NH3 untuk pembentukan protein
mikroba berkisar antara 4 hingga 12 mM, sedangkan menurut McDonald et al. (2002), berkisar 6 hingga 21 mM.
Konsentrasi amonia pada penelitian ini dipengaruhi oleh faktor A (perlakuan ransum) (P<0.01). Uji ortogonal kontras menunjukkan bahwa ransum dengan kadar protein 11% (A1 dan A2) tidak memberikan pengaruh yang nyata terhadap pembentukan NH3 di dalam rumen walaupun diberikan penambahan
12
menunjukkan bahwa pakan yang diberikan sesuai dengan acuan NRC (2000) yang menggambarkan adanya perbedaan konsentrasi amonia yang nyata di dalam rumen, dimana setiap peningkatan taraf protein (termasuk NPN) di dalam pengelompokan ransum akan meningkatkan ketersediaan protein untuk didegradasi oleh mikroba rumen. Ransum A3 menghasilkan konsentrasi amonia sebesar 11.35 mM, dan penambahan kadar TDN ransum hingga 65% pada taraf PK 14% (A4), konsentrasi amonia meningkat hingga mencapai 11.82 mM. Kondisi tersebut menggambarkan bahwa peningkatan kadar TDN ransum pada PK 14% mempengaruhi konsentrasi amonia pada ransum berbasis jerami padi. Total digestible nutrient (TDN) merupakan total nutrien tercerna di dalam tubuh yang di dalamnya meliputi protein dan energi. Semakin tinggi kandungan TDN di dalam pakan maka ketersediaan protein yang mudah didegradasi juga meningkat. Penyediaan protein dan energi yang seimbang pada perlakuan ransum A4 diduga dapat membantu memelihara rumen untuk mendegradasi protein pakan menjadi amonia dan untuk mensintesis protein mikroba. Hubber dan Kung (1981) juga menjelaskan bahwa faktor yang mempengaruhi degradasi protein dalam rumen adalah sumber protein, jumlah konsumsi energi, bentuk fisik dan kimia makanan, gerak laju makanan dalam rumen, pertumbuhan mikroba dan ukuran partikel makanan.
Peningkatan konsentrasi amonia pada taraf PK 14% juga diduga karena pengaruh ketersediaan nutrien pada bahan pakan penyusun ransum A4 lebih mudah didegradasi menjadi amonia bila dibandingkan dengan bahan pakan penyusun A3. Sumbangan bahan pakan penyusun ransum berbasis jerami padi terbesar pada ransum A4 diberikan oleh bungkil kedelai dan jagung. Persentase penggunaan bungkil kedelai yaitu sebesar 16.30%. Sedangkan pada ransum A3 penggunaan bungkil kedelai hanya sebesar 4.65%. Perbedaan jumlah penggunaan tersebut diduga sebagai salah satu faktor tingginya konsentrasi NH3 pada ransum
A4. Wahyu (1992) menyatakan bahwa bungkil kedelai merupakan sumber protein yang baik karena memiliki keseimbangan asam amino yang cukup lengkap dan tinggi dengan kandungan protein berkisar 48%. Kadar protein kasar yang tinggi pada bungkil kedelai menyebabkan bahan pakan ini sangat mudah mengalami degradasi di dalam rumen (Prasetiyono 2008). Devant et al. (2000) juga melaporkan bahwa potensial degradasi bungkil kedelai mencapai 92 ± 2.7%. Penggunaan bahan pakan jagung pada ransum A4 (17.29%) lebih tinggi dibandingkan dengan ransum A3 (4.7%). Hal tersebut dapat menjadi salah satu faktor yang menyebabkan tingginya konsentrasi NH3 pada ransum A4. Sutardi
(1980) melaporkan bahwa jagung memiliki nilai TDN sebesar 80.8% sehingga ketersediaan protein untuk didegradasi menjadi NH3 lebih tinggi. Semakin tinggi
degradasi PK dalam rumen akan meningkatkan konsentrasi NH3, demikian pula
Perlakuan penambahan probiotik pada penelitian ini belum berpengaruh terhadap konsentrasi amonia. Penelitian Saputra (2012) melaporkan bahwa pemberian probiotik Probiss dalam ransum pakan diketahui dapat meningkatkan populasi dan aktivitas mikroba rumen khususnya bakteri proteolisis. Bakteri tersebut dapat menyebabkan peningkatan perombakan protein pakan sehingga produk NH3 hasil degradasi protein semakin tinggi. Perbedaan efek pemberian
probiotik cair Probiss diduga karena pengaruh perbedaan hijauan dan konsentrat yang digunakan. Berdasarkan hasil penelitian yang didapat, perlakuan ransum berbasis jerami padi dengan penambahan taraf probiotik sebesar 0.50% v.b-1 belum mampu memberikan pengaruh yang nyata. Hal tersebut diduga karena kualitas hijauan dan konsentrat pada ransum perlakuan masih rendah sehingga dibutuhkan taraf penambahan probiotik lebih tinggi. Selain itu faktor lain dapat disebabkan oleh kurangnya jumlah sel hidup bakteri yang diberikan pada perlakuan probiotik. Pemberian taraf 0.50% v.b-1 dari probiotik cair hanya mengandung bakteri asam laktat sekitar 107 cfu.ml-1 cairan rumen, sedangkan
menurut Lee dan Salminen (2009) untuk mendapatkan hasil yang optimal, standar pemberian probiotik yang ditambahkan sebesar 1011 cfu.ml-1.
Konsentrasi VFA Total
Volatile fatty Acid (VFA) merupakan produk fermentasi zat makanan yang dihasilkan oleh aktivitas mikroba rumen, produk tersebut kemudian digunakan sebagai sumber energi dan kerangka karbon dalam sintesis protein mikroba, serta digunakan untuk memenuhi kebutuhan energi ternak ruminansia (Preston dan Leng 1987). Konsentrasi VFA dalam cairan rumen dapat digunakan sebagai tolak ukur fermentabilitas pakan terutama karbohidrat yang menjadi prekursor VFA total dan sangat erat kaitannya dengan aktivitas dan populasi mikroba rumen (Hartati 1998). Konsentrasi VFA ditampilkan di dalam Tabel 5.
Tabel 5 Pengaruh perlakuan terhadap konsentrasi VFA total Ransum Probiotik Rataan ± SD
B1 B2
---mM--- A1 101.09 ± 17.67 109.69 ± 32.20 105.39 ± 6.08c A2 106.34 ± 11.58 100.48 ± 23.44 103.41 ± 4.14c A3 112.97 ± 14.93 119.18 ± 22.33 116.07 ± 4.39b A4 138.11 ± 39.26 140.65 ± 33.61 139.38 ± 1.80a Rataan ± SD 114.63 ± 16.39 117.50 ± 17.22 116.06 ± 27.31 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.01), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
14
berkisar antara 100.48 sampai 140.65 mM. Hasil yang didapat menggambarkan bahwa konsentrasi VFA perlakuan masih dalam kondisi optimum untuk mikroba rumen karena menurut McDonald et al. (2002), normalnya konsentrasi VFA berkisar 70 sampai 150 mM.
Konsentrasi VFA total pada penelitian ini dipengaruhi oleh faktor A (perlakuan ransum) (P<0.01). Hasil uji ortogonal kontras menunjukkan bahwa perlakuan ransum dengan taraf PK 11% (A1 dan A2) tidak menghasilkan pengaruh yang nyata terhadap konsentrasi VFA di dalam cairan rumen walaupun kadar TDN ransum ditingkatkan mencapai 65%. Namun pada taraf PK 14% (A3 dan A4) (P<0.01) peningkatan kadar TDN ransum sejalan dengan peningkatan nilai konsentrasi VFA total yang dihasilkan. Konsentrasi VFA total tertinggi terdapat pada perlakuan ransum dengan taraf PK 14% dan TDN 65% (A4) (P<0.01). Hasil tersebut menunjukkan bahwa variasi konsentrasi VFA total dari keempat perlakuan ransum dipengaruhi oleh perbedaan kandungan energi dan protein pakan. Ransum dengan pemberian taraf TDN paling tinggi, paling optimal dalam meningkatkan konsentrasi VFA tertinggi, dimana setiap peningkatan taraf TDN di dalam ransum akan meningkatkan ketersediaan karbohidrat mudah tercerna untuk difermentasi oleh mikroba rumen. Kurniawati (2007) juga mendukung bahwa penambahan karbohidrat mudah terdegradasi dan protein secara bersamaan mampu meningkatkan degradasi bahan organik pakan dan meningkatkan pertumbuhan mikroba rumen yang berimplikasi terhadap peningkatan produktivitas ternak. Ransum A4 menggunakan bahan pakan jagung dalam jumlah yang cukup besar, jagung diketahui mengandung pati sebagai sumber karbohidrat yang mudah tercerna. Chalupa dan Sniffen (2000) menyatakan pati dan pektin difermentasi lebih cepat dibandingkan dengan serat kasar. Pati dan gula sederhana kemudian difermentasi sehingga menghasilkan propionat. Hal tersebut merupakan salah satu penyebab tingginya produksi VFA pada pakan tinggi karbohidrat mudah tercerna. Bahan lain seperti dedak, pollard, onggok, daun lamtoro, daun singkong dan bungkil kelapa digunakan dalam jumlah yang lebih sedikit daripada jagung dan tingkat fermentasi bahan tersebut lebih rendah, demikian juga dengan kadar energinya. France dan Dijkstra (2005) juga melaporkan bahwa faktor yang mempengaruhi proses fermentasi dan konsentrasi VFA antara lain tipe makanan (pakan basal, karbohidrat pakan), pengolahan pakan (bentuk fisik pakan), penggunaan bahan aditif kimia, tingkat konsumsi dan frekuensi pemberian makan.
Populasi Bakteri Total
Bakteri merupakan biomassa terbesar di dalam rumen, keberadaannya sekitar 50% dari total bakteri hidup bebas dalam cairan rumen dan sekitar 30-40% yang menempel pada partikel pakan, dengan fungsi dan produk yang bermacam-macam. Tabel 6 menunjukkan data rataan populasi bakteri total. Theodorou dan France (2005) menyatakan bahwa populasi bakteri dalam cairan rumen normal berkisar 109 sampai 1010 ml-1.
Tabel 6 Pengaruh perlakuan terhadap populasi bakteri total Ransum Probiotik Rataan ± SD
B1 B2
---log sel bakteri ml-1 cairan rumen ---
A1 7.83 ± 0.06 7.84 ± 0.09 7.83 ± 0.01c A2 7.81 ± 0.03 7.82 ± 0.02 7.82 ± 0.01c A3 7.83 ± 0.03 7.91 ± 0.09 7.87 ± 0.05b A4 7.87 ± 0.07 7.93 ± 0.07 7.90 ± 0.04a Rataan ± SD 7.84 ± 0.03b 7.88 ± 0.05a 7.86 ± 0.07 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.05), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
Berdasarkan hasil sidik ragam diketahui bahwa populasi bakteri total dipengaruhi oleh Faktor A (perlakuan ransum) (P<0.05), Faktor B (perlakuan pakan) (P<0.05) dan kelompok (P<0.01) yaitu cairan rumen yang digunakan. Uji ortogonal kontras memperlihatkan bahwa populasi bakteri total tertinggi terdapat pada perlakuan ransum A4 dengan taraf PK 14% dan TDN 65% (P<0.05), diikuti dengan perlakuan A3, A1 dan A2. Hasil tersebut menunjukkan bahwa pakan berbasis jerami padi lebih optimal diberikan konsentrat dengan penyediaan taraf TDN dan PK paling tinggi (A4) dibandingkan dengan kelompok ransum lainnya dalam meningkatkan populasi bakteri total. Peningkatan populasi bakteri total pada penelitian ini diduga karena pengaruh ketersediaan substrat pakan yang terkandung di dalam perlakuan ransum. Perlakuan ransum dengan taraf PK 14% dan TDN 65% (A4) diketahui menyediakan substrat yang paling baik untuk pertumbuhan bakteri di dalam rumen dari segi imbangan protein dan energi sehingga bakteri rumen dapat tumbuh dan berkembang lebih optimal. Hasil tersebut sejalan dengan pernyataan Leng (1991) efisiensi pertumbuhan mikroba dapat dipengaruhi oleh ketersediaan dan keseimbangan jumlah protein dan energi (karbohidrat) yang mengalami proses fermentasi di dalam rumen. Tingginya populasi bakteri pada perlakuan ransum A4 sejalan dengan tingginya rataan konsentrasi NH3 (Tabel 4), dan konsentrasi VFA total (Tabel 5) pada penelitian
ini. Apabila kandungan nutrien karbohidrat dalam pakan tinggi, maka populasi mikroba akan menjadi lebih efesien dalam hal produksi ATP dan sintesis protein mikroba (Russell dan Stobel 1993). Purwantari (2008) juga menjelaskan peningkatan biomassa mikroba dapat terjadi ketika konsentrasi NH3 dan VFA
16
vitro dapat digunakan kembali oleh mikroba dalam cairan rumen untuk sintesis protein tubuhnya. Wanapat dan Pimpa (1999) menambahkan bahwa meningkatnya konsentrasi N-NH3 dalam cairan rumen berpengaruh secara linier
atau kuadratik terhadap peningkatan populasi bakteri rumen.
Perlakuan probiotik pada ransum berbasis jerami padi dan konsentrat pada penelitian ini berpengaruh terhadap populasi bakteri total (P<0.05). Hasil tersebut menunjukkan bahwa penambahan probiotik cair Probiss dengan taraf 0.50% v.b-1 diduga mampu memberikan dampak positif terhadap peningkatan jumlah BAL sehingga lebih optimal dalam menstimulasi bakteri total untuk meningkatkan efektivitas dalam mendegradasi dan mencerna zat makanan dari pakan serta dapat meningkatkan jumlah konsentrasi NH3 dan VFA total yang dapat dimanfaatkan
oleh mikroba yang ada di dalam cairan rumen ternak. Salah satu faktor yang mempengaruhinya adalah akibat bakteri asam laktat (BAL) yang terdapat dalam probiotik Probiss bekerja dengan baik dalam menghambat pertumbuhan bakteri patogen. Bakteri yang digunakan pada penelitian ini salah satunya adalah Lactobacillus plantarum yang mampu membentuk asam laktat yang menyebabkan pH menjadi sedikit menurun sehingga bakteri yang bersifat menguntungkan dapat beraktivitas secara optimal dalam mendegradasi bahan pakan. L. plantarum juga merupakan penghasil hidrogen peroksida tertinggi dibandingkan dengan BAL lainnya (James et al. 1991). Selain itu bakteri ini mampu memproduksi bakteriosin yang memunyai efek bakterisidal bagi sel sensitif dan dapat menyebabkan kematian sel dengan cepat walaupun dalam konsentrasi rendah. Bakteriosin yang berasal dari Lactobacillus plantarum dapat menghambat Staphylococcus aureus dan bakteri negatif gram yang merugikan (Braneen dan Davidson 1993). Bacillus subtilis merupakan salah satu jenis bakteri termofilik yang dapat tumbuh pada suhu tinggi diatas suhu tumbuh rata-rata bakteri mesofil yaitu 45 oC - 70 oC. Keuntungan dari bakteri ini adalah mampu memiliki protein yang dapat bekerja pada kondisi lingkungan dengan suhu tinggi dimana protein atau enzim lain dapat mengalami denaturasi (Kosim 2010). Bacillus megaterium merupakan bakteri probiotik yang memiliki daya hambat tertinggi, mampu merombak karbohidrat dan bahan organik dengan mudah karena memiliki enzim ekstraseluler yang lengkap (protease, amilase dan lipase) (Triyanto 2005).
Populasi Protozoa Total
Tabel 7 Pengaruh perlakuan terhadap populasi protozoa total Ransum Probiotik Rataan ± SD
B1 B2
---log sel ml-1---
A1 5.47 ± 0.09 4.86 ± 0.28 5.16 ± 0.43 A2 4.93 ± 0.25 4.88 ± 0.35 4.91 ± 0.04 A3 4.63 ± 0.57 4.85 ± 0.43 4.74 ± 0.15 A4 4.89 ± 0.26 4.71 ± 0.24 4.80 ± 0.13 Rataan ± SD 4.98 ± 0.35 4.82 ± 0.08 4.90 ± 0.35 A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
Hasil analisis ragam memperlihatkan bahwa populasi protozoa total tidak dipengaruhi oleh Faktor A (perlakuan ransum), Faktor B (perlakuan probiotik) ataupun interaksi antara kedua faktor. Namun, populasi protozoa pada penelitian ini dipengaruhi oleh kelompok (P<0.01) yaitu cairan rumen yang digunakan. Tabel 7 menunjukkan bahwa populasi protozoa dalam penelitian ini berkisar 4 log sel ml-1 cairan rumen atau 104 sel ml-1, hasil tersebut masih sesuai dengan kisaran normal menurut Kamra (2005) yang menyatakan bahwa kisaran normal rataan populasi prozoa adalah 104 - 106 sel ml-1 cairan rumen pada ternak ruminansia.
18
Sintesis Protein Mikroba
Protein adalah salah satu nutrien yang sangat penting bagi tubuh ternak karena protein tersebut digunakan untuk pertumbuhan sel atau jaringan, pembentukan enzim, hormon serta proses metabolik lainnya. Pada ternak ruminansia sekitar 60% sumber protein berasal dari protein mikroba (Mullik 2006), dimana pertumbuhan dan perkembangannya dikendalikan oleh ketersediaan energi, kerangka karbon, nitrogen, mineral dan beberapa nutrien lainnya (Owens dan Goestch 1988). Tabel 8 memperlihatkan data sintesis protein mikroba.
Tabel 8 Pengaruh perlakuan terhadap sintesis protein mikroba Ransum Probiotik Rataan ± SD
B1 B2
--- mg N g-1 BO tercerna ---
A1 122.90 ± 24.04 110.71 ± 17.71 116.80 ± 8.62 A2 113.37 ± 36.66 105.34 ± 23.25 109.35 ± 5.68 A3 110.93 ± 23.15 115.54 ± 32.60 113.23 ± 3.26 A4 140.97 ± 43.88 116.04 ± 5.71 128.50 ± 17.63 Rataan ± SD 122.04 ± 13.63 111.91 ± 5.00 116.97 ± 26.85 A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
Hasil analisis ragam menunjukkan bahwa sintesis protein mikroba tidak dipengaruhi oleh Faktor A (perlakuan ransum), Faktor B (perlakuan probiotik) ataupun interaksi kedua faktor tersebut. Sintesis protein mikroba pada penelitian ini dipengaruhi oleh kelompok (P<0.01) yaitu cairan rumen yang digunakan. Nilai sintesis protein mikroba yang diperoleh pada kedelapan perlakuan menunjukkan nilai sintesis protein mikroba yang hampir sama. Hasil yang didapat menggambarkan bahwa komposisi perlakuan ransum (Faktor A) yang diberikan pada penelitian ini mempunyai tingkat degradasi mikroba rumen yang hampir sama. Tabel 8 menunjukkan bahwa rataan sintesis protein mikroba tertinggi terdapat pada perlakuan ransum A4 yaitu sebesar 128.50 mg N g-1 BO. Hasil tersebut sejalan dengan data populasi bakteri total (Tabel 6) yang memiliki rataan populasi bakteri total terbesar pada ransum tersebut. Diikuti dengan kondisi lingkungan rumen yang optimum, ransum A4 dapat menghasilkan konsentrasi NH3 (Tabel 4) dan VFA (Tabel 5) total tertinggi yang berkaitan dengan tingginya
sintesis protein mikroba. Pada dasarnya, perbedaan sintesis protein mikroba dipengaruhi oleh faktor ketersediaan prekursor dari masing-masing jenis pakan untuk sintesis protein mikroba. Owens dan Goestch (1998) menjelaskan bahwa prekursor penyusun mikroba antara lain NH3 sebagai sumber N, kerangka karbon,
Perlakuan probiotik pada taraf 0.50% v.b-1 belum berpengaruh terhadap
sintesis protein mikroba. Hasil yang didapatkan sejalan dengan hasil perlakuan probiotik terhadap konsentrasi NH3 (Tabel 4) dan VFA total (Tabel 5) pada
penelitian ini karena hubungan antara ketiga peubah tersebut sangat erat. NH3
merupakan sumber nitrogen utama untuk pertumbuhan mikroba rumen dalam mensintesis protein tubuhnya. Konsentrasi NH3 yang mendukung pertumbuhan
optimum mikroba rumen sekitar 4 sampai 12 mM (Sutardi 1980), dimana hasil penelitian yang didapatkan masih dalam kisaran normal yaitu sekitar 8.11 hingga 11.96 mM. Keadaan yang sama untuk VFA, semakin tinggi konsentrasi VFA total maka semakin efesien sintesis protein tubuhnya karena menurut Kalbande dan Thomas (2001) NH3 akan digunakan oleh mikroba rumen untuk dikonversi
menjadi protein mikroba dan VFA digunakan sebagai sumber energi dalam sintesis asam amino atau protein mikroba. Belum berpengaruhnya penambahan probiotik diduga karena pengaruh kualitas hijauan dan konsentrat pada ransum perlakuan membutuhkan taraf penambahan probiotik lebih tinggi (>0.50% v.b-1).
Degradabilitas Bahan Kering dan Bahan Organik
Degradabilitas merupakan suatu ukuran tingkat degradasi pakan oleh mikroba rumen, dimana daya degradasi tersebut berhubungan erat dengan penyediaan zat makanan pada ternak. Semakin mudah pakan tersebut didegradasi, maka semakin besar zat makanan yang diperoleh ternak. Rataan DBK dan DBO ditunjukkan pada Tabel 9 dan Tabel 10.
Tabel 9 Pengaruh perlakuan terhadap degradabilitas bahan kering (DBK) Ransum Probiotik Rataan ± SD
B1 B2
---%--- A1 17.70 ± 1.24 18.54 ± 0.82 18.12 ± 0.60c A2 18.56 ± 1.36 19.37 ± 0.33 18.96 ± 0.58c A3 21.02 ± 2.81 20.10 ± 2.04 20.56 ± 0.65b A4 19.84 ± 1.17 21.85 ± 2.20 20.84 ± 1.42a Rataan ± SD 19.28 ± 1.46 19.97 ± 1.41 19.62 ± 1.97 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.01), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
20
Tabel 10 Pengaruh perlakuan terhadap degradabilitas bahan organik (DBO) Ransum Probiotik Rataan ± SD
B1 B2
---%--- A1 17.69 ± 1.22 18.49 ± 1.01 18.09 ± 0.57c A2 18.53 ± 1.41 19.24 ± 0.39 18.88 ± 0.51c A3 20.76 ± 2.49 20.09 ± 1.91 20.43 ± 0.47b A4 19.79 ± 1.33 21.75 ± 2.13 20.77 ± 1.39a Rataan ± SD 19.19 ± 1.36 19.89 ± 1.40 19.54 ± 1.90 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.01), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
maka akan semakin tinggi pula jumlah ransum yang dapat tersedia bagi ternak (Suryahadi dan Piliang 1993).
Perlakuan penambahan probiotik pada ransum berbasis jerami padi dan konsentrat pada penelitian ini belum berpengaruh terhadap nilai DBK dan DBO. Harjanto (2005) menyatakan bahwa pemberian probiotik dapat memberikan banyak keuntungan, salah satunya adalah dapat menurunkan aktivitas bakteri patogen di dalam rumen. Kondisi tersebut dapat memaksimalkan perkembangan dan aktivitas mikroba rumen sehingga dapat meningkatkan aktivitas dalam mendegradasi secara fermentatif bahan organik pakan menjadi senyawa sederhana yang mudah larut, akibatnya dapat meningkatkan penyerapan zat-zat organik. Hasil yang didapatkan pada penelitian diduga karena rendahnya kualitas hijauan dan konsentrat yang digunakan, sehingga perbaikan kualitas nutrien dengan penambahan konsentrat yang baik pada bahan pakan berbasis jerami padi lebih berpengaruh. Pada ransum dengan PK dan TDN tertinggi tanpa penambahan probiotik cair diketahui sudah cukup untuk menghasilkan nilai degradabilitas bahan kering dan bahan organik paling baik, namun untuk mencapai hasil yang lebih optimal maka diperlukan peningkatan taraf penambahan probiotik berkisar 1% hingga 1.5%. Hal ini berkaitan dengan peningkatan jumlah mikroba yang dapat meningkatkan aktivitas mikroba rumen dalam mendegradasi secara fermentatif bahan organik pakan menjadi senyawa sederhana yang mudah larut, sehingga hal tersebut mengakibatkan terjadi peningkatan dalam pencernaan dan penyerapan zat-zat organik (Nasih 2012).
Kecernaan Bahan Kering dan Bahan Organik
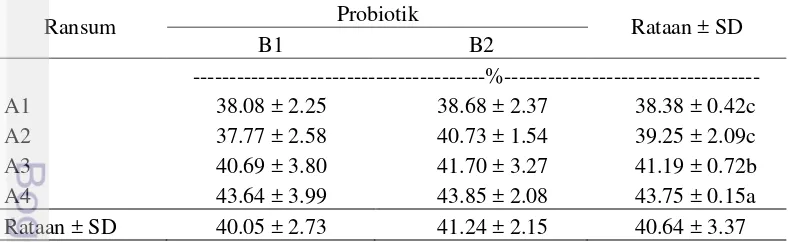
Kecernaan merupakan suatu ukuran tinggi atau rendahnya kualitas bahan pakan karena pada umumnya bahan pakan yang mengandung zat-zat makanan mudah dicerna akan memberikan nilai gizi yang tinggi. Selain itu, kecernaan yang tinggi menunjukkan sebagian besar dari zat-zat makanan yang terkandung di dalamnya dapat dimanfaatkan oleh hewan. Kecernaan pakan biasanya dinyatakan berdasarkan BK dan sebagai suatu koefisien atau persentase. Rataan KCBK dan KCBO ditampilkan pada Tabel 11 dan Tabel 12.
Tabel 11 Pengaruh perlakuan terhadap kecernaan bahan kering (KCBK) Ransum Probiotik Rataan ± SD
B1 B2
22
Tabel 12 Pengaruh perlakuan terhadap kecernaan bahan organik (KCBO) Ransum Probiotik Rataan ± SD
B1 B2
---%--- A1 37.97 ± 2.10 38.38 ± 2.10 38.17 ± 0.29c A2 37.62 ± 2.86 40.20 ± 2.30 38.91 ± 1.83c A3 40.39 ± 3.88 41.11 ± 3.61 40.75 ± 0.51b A4 42.88 ± 3.77 43.46 ± 1.44 43.17 ± 0.41a Rataan ± SD 39.71 ± 2.45 40.79 ± 2.11 40.25 ± 3.29 Nilai rataan dengan huruf yang berbeda di dalam kolom yang sama berbeda nyata pada (P<0.01), A1 = ransum PK 11% TDN 60%, A2 = ransum PK 11% TDN 65%, A3 = ransum PK 14% TDN 60%, A4 = ransum PK 14% TDN 65%, B1 = tanpa probiotik; B2 = probiotik cair (0.50% v.b-1).
Hasil sidik ragam memperlihatkan bahwa Faktor A (perlakuan ransum) dan kelompok yaitu cairan rumen yang digunakan berpengaruh sangat nyata (P<0.01) terhadap KCBK dan KCBO ransum pada uji in vitro. Namun Faktor B (perlakuan probiotik) dan interaksinya dengan Faktor A tidak memberikan pengaruh nyata. Tabel 11 dan 12 menunjukkan bahwa rataan nilai KCBK dan KCBO pada penelitian ini adalah sebesar 40.64% dan 40.25%. Hasil yang didapat masih dikatakan rendah karena menurut Hogan dan Leche (1981) komponen jerami padi tanpa perlakuan tambahan yang dapat dicerna secara in vitro adalah sebesar 45% sampai 50%. Hal tersebut diduga karena adanya variasi antara kualitas jerami padi yang digunakan, teknik pengeringan yang dilakukan, umur panen, serta lokasi pemanenan yang berbeda.
didegradasi lebih tinggi. Faktor lain dapat disebabkan oleh perbedaan kandungan serat kasar pada setiap perlakuan (Tabel 3). Ransum A4 mengandung serat kasar lebih rendah (13.02%) dibandingkan dengan perlakuan ransum lainnya sehingga hal tersebut menyebabkan TDN dan kecernaan pada ransum ini lebih tinggi. Kondisi tersebut didukung oleh Yanti et al. (2004) yang menyatakan bahwa semakin banyak konsumsi serat kasar maka semakin kecil nilai kecernaan. Faktor-faktor yang dapat mempengaruhi nilai kecernaan antara lain pakan, ternak dan lingkungan. Ditinjau dari segi pakan kecernaan dipengaruhi oleh komposisi pakan, perbandingan atau rasio bahan pakan hijauan dan konsentrat, cara penanganan pakan, serta tingkat pemberian pakan. Menurut Selly (1994), kecernaan in vitro dipengaruhi oleh pencampuran pakan, cairan rumen dan inokulan, pH fermentasi, suhu fermentasi, lamanya waktu inkubasi, ukuran partikel sampel, dan larutan penyangga. Hasil penelitian menunjukkan bahwa nilai kecernaan yang didapatkan sejalan dengan konsentrasi NH3 (Tabel 4),
konsentrasi VFA (Tabel 5), populasi bakteri (Tabel 6), DBK dan DBO (Tabel 9 dan 10) bahwa perlakuan ransum A4 merupakan ransum optimal dalam kecernaan bahan kering dan bahan organik.
Perlakuan probiotik tidak berpengaruh terhadap peningkatan nilai koefesien cerna bahan kering maupun bahan organik pada ransum berbasis jerami padi pada penelitian ini. Nasih (2012) melaporkan bahwa pemberian probiotik cair Probiss dapat meningkatkan kecernaan karena meningkatnya populasi bakteri di dalam rumen sehingga kecernaan serat pakan akan meningkat. Peningkatan kecernaan disebabkan oleh probiotik cair Probiss yang mengandung beberapa sumber mikroba menguntungkan bagi ternak. Apriyadi (1999) menjelaskan bahwa diantara spesies selulolitik ada beberapa yang berfungsi ganda dalam mencerna serat kasar yaitu sebagai pencerna selulosa juga hemiselulosa dan pati. Hasil yang didapatkan pada penelitian ini diduga karena pengaruh rendahnya kualitas jerami padi dan konsentrat yang digunakan pada saat penelitian, dimana perlakuan probiotik dengan taraf 0.05% v.b-1 belum mampu memberikan efek yang nyata pada kecernaan bahan kering dan bahan organik sehingga dibutuhkan peningkatan taraf pemberian probiotik. Nasih (2012) juga menyampaikan bahwa semakin meningkatnya taraf pemberian probiotik cair Probiss maka populasi dan aktivitas mikroba rumen akan semakin meningkat sehingga kecernaan pakan menjadi semakin tinggi.
SIMPULAN DAN SARAN
Simpulan
Perlakuan ransum dengan taraf PK 14% dan TDN 65% dapat meningkatkan konsentrasi NH3, konsentrasi VFA total, populasi bakteri total,
24
Saran
Penggunaan hijauan dengan kadar nutrien rendah seperti jerami padi, perlu diberikan suplementasi probiotik dengan taraf yang lebih besar (>0.05% v.b-1). Selain itu, perlu dilakuan penelitian lebih lanjut secara in vivo menggunakan ransum yang sama dengan penelitian ini, namun diberikan taraf probiotik yang lebih optimal sehingga kedepannya dapat diterapkan oleh peternak secara langsung.
DAFTAR PUSTAKA
Almai MI. 2013. Fermentabilitas dan kecernaan in vitro ransum berbasis jerami padi dan konsentrat yang disuplementasi dengan probiotik padat atau cair [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Apriyadi L. 1999. Pengaruh penambahan probiotik Bioplus Serat (BS) pada konsumsi dan kecernaan pakan rumput gajah (Pennisetum purpureum) yang diberikan pada domba ekor tipis (DEI) [skripsi]. Bogor (ID). Fakultas Pertanian, Jurusan Peternakan. Universitas Djuanda.
Arief II, Jenie BSL, Astawan M, Witarto AB. 2008. Efektivitas probiotik Lactobacillus plantarum 2C12 dan Lactobacillus acidophilus 2B4 sebagai pencegah diare pada tikus percobaan. Med Pet. 33(3):137-143.
Arora SP. 1989. Pencemaran Mikroba pada Ruminansia. Murwani R, penerjemah. Yogyakarta: Gajah Mada University Pr. hlm 44-49.
Branen AL, Davidson PM. 1993. Antimicrobial in food. New York: Marcel Dekker.
Chalupa W, Sniffen CJ. 2000. Balancing Rations for Milk Components. Proc Australian Soc. Anim. Sci. Sydney (AU).
Claus D, Berkeley RCW. 1986. Genus Bacillus. Di dalam: Sneath PHA et al. eds
Bergey’s Manual of Systematic Bacteriology. Baltimore: Lippincott
Wiliams dan Wilkins. 2: 1105-1139.
Devant M, Ferret A, Gasa J, Calsamiglia S, Casals R. 2000. Effects of protein concentration and degradability on performance, ruminal fermentation, and nitrogen metabolism in rapidly growing heifers fed high-concentrate diets from 100 to 230 kg body weight. J Anim Sci. 78: 1667-1676.
Dommels YEM, Kemperman RA, Zebregs YEMP, Draaisma RB. 2009. Survival of Lactobacillus reuteri DSM 17938 and Lactobacilus rhamnosus GG in the human gastrointestinal tract with daily consumption of a low fat probiotic spread. Appl Environ Microbiol. 75(19):6198-204.
France J, Dijkstra J. 2005. Volatille Fatty Acid Production. In: Dijkstra J, Forbes JM, France J (Eds). Quantitative Aspect for Ruminant Digestion and Metabolism. 2nd ed. London (GB): CABI Publishing.
Harjanto K. 2005. Pengaruh penambahan probiotik Bio H+ terhadap kecernaan bahan kering dan bahan organik pakan Sapi PFH jantan [Skripsi]. Fakultas Pertanian UNS: Surakarta (ID).
Holstein jantan [disertasi]. Program Pascasarjana Institut Pertanian Bogor. Bogor.
Hau DK, Nenobais M, Nulik J, Katipana NGF. Pengaruh probiotik terhadap kemampuan cerna mikroba rumen sapi bali. Seminar Nasional Teknologi Peternakan dan Veterinar. Bali (ID): Universitas Nusa Cendana. hlm 171-180.
Hobson PN, Stewart CS. 1997. The Rumen Microbial Ecosystem. London (GB): Blackie Academic and Professional.
Hogan JP, Leche TF. 1981. Types of fibrous residues and their characteristic. In: The Utilization of Fibrous Agricultural Residues GR Pearce, editor. Canberra (AUS): Australian Government Publishing Service.
Hoover WH, Stokes SR. 1991. Balancing carbohydrate and protein for optimum rumen microbial yield. J Dairy Sci. 74: 3630
Huber JT, Kung JR. 1981. Protein and non protein utilization in dairy cattle. J Dairy Sci. 75:2165-2174.
Irawan B. 2002. Suplemen Zn dan Cu organik pada ransum berbasis agroindustri untuk memacu pertumbuhan domba [tesis]. Bogor (ID): Institut Pertanian Bogor.
James R, Lazdunski C, Pattus F. 1992. Bacteriosins, microcins, and lantibiotics. Springer-Verlag: Berlin, Heidelberg.
Kalbanda VH, Thomas CT. 2001. Effect of feeding by pass on rumen fermentation profile of cros bred cause. Asian-Aust. J Anim Sci. 14: 974: 878.
Kamra DN. 2005. Rumen microbial ecosystem. Ind Vet Rsrch Inst. 89(1):124-135.
Kosim M. 2010. Pengaruh suhu pada protease dari Baillus subtilis [skripsi]. Surabaya (ID): Institut Teknologi Sepuluh November.
Kristina D. 2013. Kinetika fermentasi dan kecernaan in vitro ransum sapi potong yang disuplementasi probiotik padat atau cair [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kurniawati A. 2007. Teknik produksi gas in vitro untuk evaluasi pakan ternak. J Ilmiah Apl Isotop Rad. Vol 3: 1.
Lee YK, Salminen S. 2009. Handbook of Probiotics and Prebiotics. 2nd Ed. New Jersey (US): John Wiley and Sons.
Leng RA. 1991. Application of Biotechnology to Nutrition of Animals in Developing Countries. Dalam: Firsoni. 2005. Manfaat tepung daun kelor (Moringa oleifera, Lam) dan glisirida (Gliricidia sepium, Jacq) sebagai sumber protein dalam urea molasses blok (UMB) terhadap metabolisme pakan secara in vitro dan produksi susu sapi perah [tesis]. Malang (ID: Universitas Brawijaya.
McDonald P, Edwards RA, Greenhalgh JFD, Morgan CA. 2002. Animal Nutrition. 6th Ed. New York (US): Ashford Colour Pr.
Muchayani D. 2013. Efektivitas penggunaan probiotik padat dan cair untuk menurunkan kadar amonia (NH3) dan hidrogen sulfida (H2S) feses sapi
potong [skripsi]. Bogor (ID): Institut Pertanian Bogor.
26
Muzakki AF. 2014. Efektifitas pemberian probiotik cair pada taraf berbeda terhadap fermentasi dan kecernaan in vitro ransum sapi potong [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nasih M. 2012. Pengaruh penambahan probiotik dalam pakan terhadap konsumsi, kecernaan dan retensi pada sapi perah laktasi. Malang (ID): Universitas Brawijaya.
Nayak SK. 2010. Probiotics and immunity: a fish perspective. Fish dan Shellfish Immunology. 29:2-14.
National Research Council [NRC]. 2000. Nutrient Requirement of Beef Cattle. 8th Ed. New York (US): National Academy Pr.
Owens FN, Goestch AL. 1998. Ruminant Fermentation. In : D.C Church (Eds). The Ruminant Animal. Prentice Hall, Englewood Cliffs. New Jersey (UK). PP.145-171.
Prasetiyono BWHE. 2008. Rekayasa suplemen protein pada ransum sapi pedaging berbasis jerami dan dedak padi [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Preston TR, Leng RA. 1987. Matching Ruminant Production Sistems with Available Resources in the Tropic and Sub-Tropic. Queensland (AU): International Colour Production.
Purwantari T. 2008. Fermentabilitas in vitro dan produksi biomassa mikroba ransum komplit yang mengandung jerami sorgum, konsentrat dengan penambahan suplemen pakan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Purwanti D. 2013. Performa sapi potong sebagai respon dari suplementasi probiotik padat dan cair [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rafi NA. 2013. Efektifitas pemberian probiotik padat pada taraf yang berbeda
terhadap fermentasi dan kecernaan in vitro ransum sapi potong [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Russell JB, Stobel HJ. 1993. Microbial energetics, pp. 165-186. In Forbes JM and France J. Quantitative Aspects of Ruminant Digestion and Metabolism, CAB International Oxon, United Kingdom.165-186.
Saputra OA. 2012. Pengaruh penambahan probiotik pada pakan ternak ruminansia terhadap kecernaan, konsentrasi NH3, dan VFA secara in vitro. Malang
(ID): Universitas Brawijaya.
Selly. 1994. Peningkatan kualitas pakan serat bermutu rendah dengan amoniasi dan inokulasi digesta rumen [skripsi]. Bogor (ID): Institut Pertanian Bogor. Septiani R. 2013. Efek taraf protein dan suplementasi probiotik terhadap
fermentabilitas dan kecernaan ransum sapi potong in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Shitandi A, Alfred M, Symon M. 2007. Probiotic characteristic of Lactococcus strain from local fermented Amaranthus hybrydus and Solanum nigrum. African Crop Science Confrence Proceedings. 8:1809-1812.
Siregar Y. 2013. Pengaruh suplementasi probiotik padat dan cair dalam meningkatkan kecernaan zat-zat makanan ransum sapi potong [skripsi]. Bogor (ID): Institut Pertanian Bogor.