INDIKATOR OKSIGEN BERBASIS METILEN BIRU
SEBAGAI PENDETEKSI KEBOCORAN KEMASAN
ALOYSIUS BORIS RONYCAHYA
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Indikator Oksigen Berbasis Metilen Biru Sebagai Pendeteksi Kebocoran Kemasan adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Aloysius Boris Ronycahya
ABSTRAK
ALOYSIUS BORIS RONYCAHYA. Indikator Oksigen Berbasis Metilen Biru Sebagai Pendeteksi Kebocoran Kemasan. Dibimbing oleh ENDANG WARSIKI.
Oksigen merupakan salah satu faktor utama yang sering menyebabkan kerusakan makanan. Indikator oksigen merupakan kemasan cerdas yang dapat mendeteksi kebocoran kemasan sehingga dapat mencegah rusaknya makanan akibat adanya oksigen hingga di bawah 0.1%. Penelitian ini bertujuan untuk mendapatkan formulasi terbaik dalam pembuatan indikator oksigen. Bahan utama yang digunakan adalah glukosa kristal, CaOH, dan metilen biru 1%. Metilen biru ditambahkan pada campuran glukosa dan CaOH kemudian diaduk rata. Glukosa dalam kondisi alkali akan mereduksi metilen biru dari warna biru menjadi tidak berwarna dan kembali menjadi warna biru ketika kontak dengan oksigen. Penelitian ini terdiri dari beberapa tahap meliputi (i) pembuatan indikator oksigen dengan berbagai formulasi, (ii) uji karakteristik berdasarkan tekstur, warna, umur simpan, serta sifat dan kesensitifannya terhadap oksigen, (iii) pembuatan sachet indikator oksigen. Formulasi indikator oksigen yang baik memiliki karakteristik diantaranya murah, teksturnya halus dan tidak ada gumpalan, tidak beracun, bersifat irreversible
terhadap oksigen, umur simpan yang lama dan memiliki tingkat kesensitifan yang tinggi terhadap oksigen. Berdasarkan pengujian yang telah dilakukan, diperoleh kesimpulan bahwa formulasi indikator oksigen yang terbaik harus memiliki perbandingan komposisi bahan glukosa:CaOH:metilen biru sebesar 1:7:1 sampai 1:8:1.
Kata kunci: indikator oksigen, kemasan cerdas, metilen biru
ABSTRACT
ALOYSIUS BORIS RONYCAHYA. Oxygen Indicator based on Methylene Blue as a Detector of Packing Leakage. Supervised by ENDANG WARSIKI.
Oxygen is one of the main factors that often cause food deterioration. Oxygen indicator is smart packaging that can detect leaks to prevent to food as a result of the exceeded concentration of oxygen lower than 0.1%. The aim of this research was to get the best formulation in the manufacture of oxygen indicator. The main materials used were glucose, CaOH, and methylene blue 1%. Methylene blue was added to the mixture of glucose and CaOH, then glucose in alkaline medium was reduce methylene blue from blue to colorless and back into a blue colour after contact with oxygen in a certain amount. The research consisted of several stages included (i) producing oxygen indicators with various formulations, (ii) test characteristics based on texture, colour, shelf life, characteristic and oxygen sensitivity, (iii) producing of sachets oxygen indicator. The best indicator of oxygen formulation should have the characteristics of cheap, smooth texture and no lumps, non-toxic, irreversible, long shelf life and high sensitive to oxygen. Based on the testing that had been done, it was concluded that the formulation of the best indicators of oxygen had a composition ratio of glucose:CaOH:methylene blue for 1:7:1 to 1:8:1.
INDIKATOR OKSIGEN BERBASIS METILEN BIRU
SEBAGAI PENDETEKSI KEBOCORAN KEMASAN
ALOYSIUS BORIS RONYCAHYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Indikator Oksigen Berbasis Metilen Biru Sebagai Pendeteksi Kebocoran Kemasan
Nama : Aloysius Boris Ronycahya
NIM : F34100089
Disetujui oleh
Dr Endang Warsiki, STP, MSi Pembimbing
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa, karena atas segala rahmat, berkat, nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul Indikator Oksigen Berbasis Metilen Biru Sebagai Pendeteksi Kebocoran Kemasan.
Penulis menyampaikan terima kasih dan penghargaan yang teristimewa kepada:
1 Ibu Dr Endang Warsiki, STP, MSi selaku Pembimbing Akademik atas perhatian, bimbingan, nasihat, dan arahan, serta kasih sayang selama penelitian dan penyelesaian skripsi.
2 Ibu Dr Ika Amalia Kartika, STP, MSi dan Bapak Dr Prayoga Suryadarma, STP, MT selaku penguji skripsi atas kritik dan saran yang sangat bermanfaat dalam penulisan skripsi ini.
3 Prof Dr Ir Nastiti Siswi Indrasti yang telah banyak memberikan bimbingan moril selama penulis mengemban ilmu di Departemen Teknologi Industri Pertanian. 4 Seluruh dosen dan staf pengajar Departemen Teknologi Industri Pertanian yang
telah banyak memberikan ilmu dan bimbingan selama penulis menjalankan perkuliahan.
5 Staf dan laboran Departemen Teknologi Industri Pertanian atas bimbingan dan semangat yang diberikan selama penulis melakukan penelitian.
6 Ayahanda Daniel Bernadettus Sukatja dan Ibunda Sri Sumarni tercinta atas doa, semangat, nasihat dan kasih sayangnya, yang juga telah menjadi sosok paling menginspirasi bagi kehidupan penulis selama ini.
7 Mbak Piping, Adik Shinta, Adik Agasi, dan Mas Imam atas doa, semangat dan kasih sayangnya selama ini.
8 Himpunan Keluarga Rembang di Bogor, atas perhatian, kasih sayang dan motivasi yang telah diberikan.
9 Dhona Indah Kiswari tersayang atas motivasi, perhatian, semangat, dan dukungannya.
10Keluarga besar TIN 47 dan keluarga bahagia Wisma Wahda Indah atas kenangan indah dan keceriaan yang tak akan pernah terlupakan.
11Serta semua pihak yang tidak dapat disebutkan satu per satu atas segala bantuannya sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Semoga skripsi ini bermanfaat.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL v
DAFTAR GAMBAR v
DAFTAR LAMPIRAN v
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode 2
HASIL DAN PEMBAHASAN 5
Pembuatan Bubuk Indikator Oksigen 5
Karakteristik Bubuk Indikator Oksigen Terpilih 8
Sachet Aplikatif Indikator Oksigen 13
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Formulasi bubuk indikator oksigen berdasarkan variasi CaOH 3
2 Interpretasi dari nilai R2 5
3 Laju perubahan nilai RGB sebelum kontak dengan oksigen 10 4 Laju perubahan nilai RGBsetelah kontak dengan oksigen 12
DAFTAR GAMBAR
1 Diagram alir pembuatan bubuk indikator oksigen 2
2 Struktur molekul metilen biru 6
3 Skema reaksi mekanisme indikator oksigen berbasis pewarna redoks 7 4 Nilai RGB indikator oksigen A-8 terhadap waktu sebelum kontak oksigen 10 5 Nilai RGB indikator oksigen A-9 terhadap waktu sebelum kontak oksigen 10 6 Nilai RGB indikator oksigen A-8 terhadap waktu setelah kontak oksigen 11 7 Nilai RGB indikator oksigen A-9 terhadap waktu setelah kontak oksigen 12 8 Sachet indikator oksigen 14 9 Standar warna indikator oksigen sebagai pendeteksi kebocoran kemasan; (a) perubahan warna hasil dokumentasi; (b) perubahan warna sebagai
pedoman bagi konsumen 14
DAFTAR LAMPIRAN
1 Hasil formulasi bubuk indikator oksigen dengan variasi CaOH 18 2 Hasil penghitungan kecepatan glukosa mereduksi metilen biru dan uji
stabilitas umur simpan 19
3 Hasil uji sensitivitas 19
PENDAHULUAN
Latar Belakang
Kemasan merupakan suatu hal yang berperan penting menjaga kualitas makanan selama masa penyimpanan, distribusi dan penjualan. Kemasan memiliki fungsi sebagai pelindung makanan dari kondisi lingkungan, seperti cahaya, debu, etilen, kelembaban, mikroba, oksigen, dan tekanan mekanis. Kemasan secara umum memiliki beberapa syarat dasar, diantaranya mudah dipasarkan, mempunyai harga yang sesuai, dapat berhubungan langsung dengan makanan, dan dapat didaur ulang (Ahvenainen 2003). Kemasan dari tahun ke tahun berkembang semakin baik, begitu juga dengan teknologi pengemasannya. Namun masih saja terdapat faktor yang dapat merusak makanan meskipun makanan tersebut sudah dikemas.
Oksigen merupakan salah satu faktor utama yang sering menyebabkan kerusakan bahan pangan seperti oksidasi lemak yang menyebabkan ketengikan, perubahan warna dan cita rasa, penurunan nilai gizi, pertumbuhan kapang dan bakteri aerobik serta serangga pada makanan (Mills 2005). Berbagai teknik pengawetan telah dikembangkan untuk mencegah kerusakan pada makanan, seperti penyimpanan pada suhu rendah, penambahan antioksidan, pengemasan vakum dan penghembusan gas CO2 atau N2 yang bersifat inert (Rooney 1981). Namun, berbagai teknik tersebut masih kurang efisien jika diterapkan, contohnya teknik penurunan suhu yang rendah hanya menyebabkan penurunan kecepatan reaksi yang tidak terlalu besar dan teknik pengawetan dengan penambahan antioksidan sintetis seperti BHA (butylated hydroxyanisole) juga dapat menimbulkan penyakit kanker jika diberikan dalam jumlah yang berlebihan. Selain itu, teknik pengemasan dengan penghembusan gas CO2 atau N2 tidak dapat menghilangkan oksigen secara sempurna, karena konsentrasi oksigen dalam kemasan dengan menggunakan teknik tersebut hanya akan mencapai 0.5-2% (Mills 2005).
Kontak langsung oksigen dengan makanan merupakan tahap awal terjadinya kerusakan makanan oleh oksigen. Maka, hal tersebut harus dihindari agar makanan tetap aman dan memiliki umur simpan yang lebih lama. Salah satu caranya adalah penggunaan indikator oksigen atau penyerap oksigen. Indikator oksigen dapat berfungsi sebagai pendeteksi kebocoran kemasan yang merupakan penyebab masuknya oksigen ke dalam kemasan dan kontak langsung dengan makanan. Indikator oksigen juga sekaligus dapat berfungsi sebagai penyerap oksigen sehingga kadar oksigen dalam kemasan dapat ditekan hingga di bawah 0.1% (Abe 1991).
2
formulasi indikator oksigen. Pengembangan formulasi indikator oksigen pada penelitian ini difokuskan pada pembuatan indikator oksigen berbasis metilen biru dalam bentuk sachet yang ideal.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan formulasi terbaik indikator oksigen berbasis metilen biru. Selain itu juga untuk mendapatkan indikator oksigen sebagai pendeteksi kebocoran kemasan dalam bentuk sachet.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan yaitu neraca analitik, jar, pipet, sudip, sealer, dan plastisin. Selain itu alat yang digunakan dalam uji terhadap indikator oksigen diantaranya color analyzerRGB-1002 dan stopwatch. Bahan yang digunakan untuk membuat indikator oksigen yaitu metilen biru 1%, glukosa kristal (dextrose monohydrate), dan CaOH, sedangkan bahan yang digunakan untuk membuat sachet
indikator oksigen yaitu plastik LDPE (low density polyethylene), plastik PP (polypropylene) dan kertas saring.
Metode
Pembuatan Bubuk Indikator Oksigen
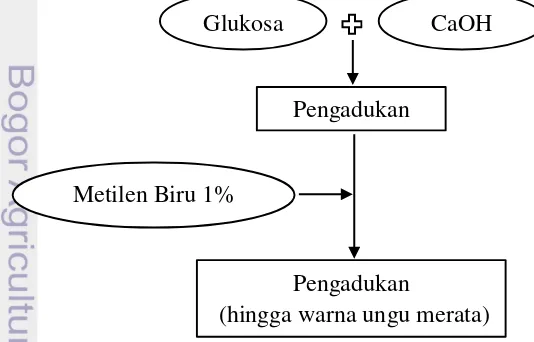
Langkah awal pada proses pembuatan bubuk indikator oksigen adalah mencampurkan glukosa kristal dengan CaOH dalam jar atau plastik. Setelah itu ditambahkan metilen biru 1% dan diaduk hingga warna ungu merata (Gambar 1). Kemudian jar atau plastik yang berfungsi sebagai wadah ditutup rapat.
Gambar 1 Diagram alir pembuatan bubuk indikator oksigen
Glukosa CaOH
Metilen Biru 1%
Pengadukan
Pengadukan
3
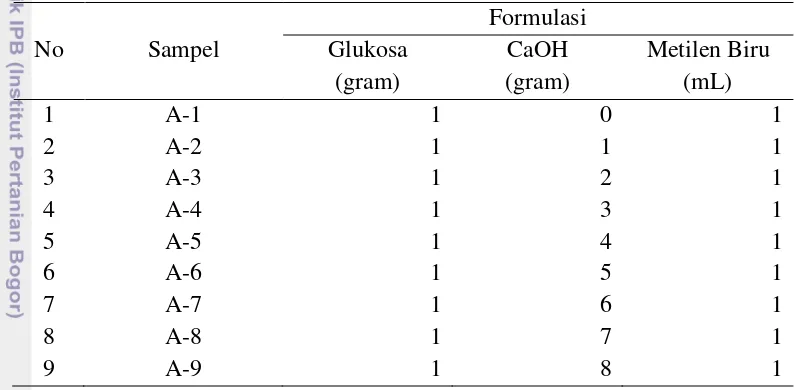
Pada tahap ini dilakukan variasi jumlah CaOH yang digunakan untuk membuat bubuk indikator oksigen. Berdasarkan penelitian pembuatan indikator oksigen yang telah dilakukan oleh Indra (1991), glukosa kristal dan metilen biru harus memiliki jumlah perbandingan yang sama pada komposisinya. Pada kondisi netral, proses glukosa kristal mereduksi metilen biru akan berjalan sangat lambat dan CaOH akan membuat kondisi menjadi basa untuk mempercepat proses tersebut. Variasi CaOH ini dilakukan dengan tujuan mencari bobot CaOH terbaik untuk dijadikan sebagai indikator oksigen. Pada uji coba dalam variasi CaOH ini, jumlah CaOH yang digunakan sebanyak 1 gram hingga 8 gram, dan perbandingan antara glukosa kristal dan metilen biru adalah 1:1. Selain itu juga dilakukan uji coba tidak menggunakan CaOH pada komposisi bubuk indikator oksigen. Pada setiap sampel digunakan glukosa kristal sebanyak 1 gram dan metilen biru sebanyak 1 mL. Daftar formulasi indikator oksigen dengan variasi CaOH disajikan pada Tabel 1.
Tabel 1 Formulasi bubuk indikator oksigen berdasarkan variasi CaOH
No Sampel
Uji Karakteristik Bubuk Indikator Oksigen
Uji karakteristik bubuk indikator oksigen dilakukan terhadap beberapa parameter pada bubuk indikator oksigen yang ideal. Beberapa syarat ideal yang harus dipenuhi jika indikator oksigen tersebut ingin diaplikasikan secara komersial diantaranya memiliki tekstur yang halus, umur simpan yang lama, memiliki sifat
irreversible, dan sensitif terhadap oksigen (Mills 2005). Oleh karena itu, beberapa uji yang dilakukan yaitu uji tekstur, pengukuran kecepatan glukosa mereduksi metilen biru, uji stabilitas dan umur simpan, uji sensitivitas, uji sifat irreversible, dan uji kuantifikasi warna.
1. Uji Tekstur
4
2. Pengukuran Kecepatan Glukosa Mereduksi Metilen Biru
Pada tahap ini yang dilakukan adalah penghitungan waktu glukosa mereduksi metilen biru. Penghitungan mulai dilakukan sesaat setelah metilen biru dicampurkan dan diaduk rata dengan bahan penyusun indikator oksigen yang lain, khususnya glukosa kristal. Secara visual, dapat diamati bahwa ketika warna bubuk indikator oksigen sudah berubah warna dari ungu menjadi putih, maka pada saat itulah metilen biru telah tereduksi oleh glukosa menjadi leukometilen biru. Sampel yang diamati pada tahap ini adalah sampel yang telah terpilih berdasarkan uji tekstur.
3. Uji Stabilitas dan Umur Simpan
Pengujian stabilitas ini dilakukan dengan pengamatan secara visual kestabilan warna putih dari bubuk indikator oksigen sebelum kontak dengan oksigen terhadap waktu. Indikator oksigen yang memiliki umur simpan yang lama, teksturnya tidak rusak dan warna putihnya akan stabil selama tidak kontak dengan oksigen. Pengujian stabilitas dan umur simpan dilakukan dengan pengamatan secara visual pada jam ke-0, jam ke-6, dan seterusnya setiap 12 jam. Sampel yang diuji pada tahap ini adalah sampel yang telah terpilih berdasarkan tekstur.
4. Uji Sensitivitas
Selain dilakukan uji stabilitas dan umur simpan, juga dilakukan uji sensitivitas. Uji sensitivitas dilakukan dengan pengamatan secara visual mulai terjadinya perubahan warna menjadi ungu yang semula berwarna putih saat indikator oksigen dikontakkan dengan oksigen. Selain pengamatan secara visual, dihitung pula waktu perubahan warna yang dibutuhkan.
5. Uji Sifat Irreversible
Pada pengujian sifat irreversible juga dilakukan dengan pengamatan secara visual. Pengujian dilakukan terhadap sampel yang sudah berwarna putih maksimal, sengaja dilubangi kemasannya, atau sengaja dikontakkan dengan oksigen, hingga akhirnya warna putih tersebut berubah seluruhnya menjadi warna ungu. Setelah itu, kemasan kembali ditutup rapat, dan diamati apakah warna ungu pada sampel kembali berwarna putih atau tidak. Jika kembali berwarna putih, dihitung pula waktu yang dibutuhkan.
6. Uji Kuantifikasi Warna
5
= + (1)
Keterangan : = waktu sebelum / sesudah kontak oksigen = hasil pengukuran komponen warna = slope garis regresi
= nilai komponen warna pada kondisi garis regresi berpotongan dengan sumbu y
Tingkat ketepatan dan ketelitian pengukuran ditunjukkan dengan melihat nilai korelasi garis regresi (kecenderungan data). Nilai pengukuran dinyatakan baik jika korelasinya lebih dari 80% (R2≥ 0.80). Menurut Usman dan Akbar (2008) nilai R2 terbesar adalah +1 dan terkecil adalah -1 sehingga dapat ditulis -1 ≤ R2 ≤ +1. Apabila nilai R2 = +1, maka disebut hubungan positif sempurna dan hubungannya linier langsung sangat tinggi. Sebaliknya jika nilai R2 = -1, maka disebut hubungan negatif sempurna dan hubungannya tidak langsung sangat tinggi. Nilai R2 tidak
Pembuatan Sachet Aplikatif Indikator Oksigen
Pada pembuatan sachet indikator oksigen ini bertujuan untuk memilih bahan
sachet terbaik yang karakteristiknya mendukung bubuk indikator oksigen dalam aplikasinya. Pemilihan bahan pembungkus indikator oksigen didasarkan pada permeabilitas suatu bahan terhadap oksigen (Scoot 1975).
HASIL DAN PEMBAHASAN
Pembuatan Bubuk Indikator Oksigen
6
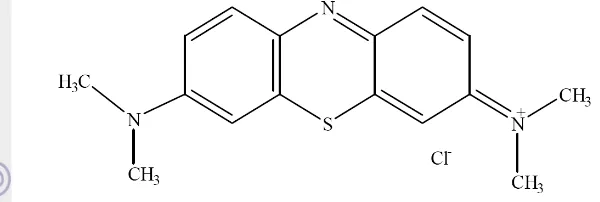
berwarna hijau tua, tidak berbau, dan menjadi berwarna biru ketika dilarutkan dalam air (Weast 1982). Struktur metilen biru ditunjukkan pada Gambar 2.
Gambar 2 Struktur molekul metilen biru (Arvand et al. 2003)
Bahan utama lainnya yang digunakan sebagai agen pereduksi adalah glukosa kristal (dextrose monohydrate) dalam kondisi alkali. Glukosa merupakan gula pereduksi, yang dicirikan dengan kondisi struktur kimianya dalam bentuk rantai terbuka. Gula pereduksi adalah semua gula yang memiliki kemampuan untuk mereduksi dikarenakan adanya gugus aldehid atau keton bebas. Selain glukosa, monosakarida yang termasuk gula pereduksi adalah fruktosa dan galaktosa, sedangkan disakarida yang termasuk gula pereduksi adalah laktosa dan maltosa. Contoh gula non-pereduksi adalah sukrosa, yang dicirikan dengan tidak adanya struktur rantai terbuka, sehingga tidak rentan terhadap proses oksidasi reduksi (Winarno 2008). Kondisi alkali dapat dibuat dengan penambahan kalsium hidroksida. Kondisi alkali akan membuat glukosa mampu mereduksi metilen biru. Kalsium hidroksida sendiri merupakan basa yang memiliki warna putih sehingga perubahan warna yang akan terjadi pada bubuk indikator oksigen dapat dilihat dengan jelas. Selain itu CaOH memiliki harga yang relatif murah, mudah didapat, dan memiliki sifat yang tidak larut dalam air sehingga tepat untuk digunakan dalam komposisi pembuatan indikator oksigen.
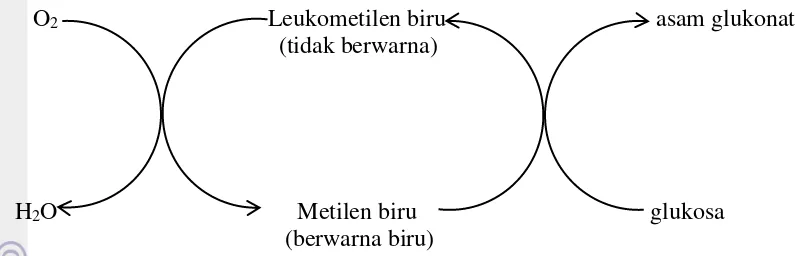
Pada kondisi alkali dan tidak kontak dengan oksigen, pewarna redoks (metilen biru) akan direduksi oleh agen pereduksi (glukosa) menjadi pewarna redoks tereduksi (leukometilen biru) dan agen pereduksi teroksidasi (asam glukonat) seperti yang ditunjukkan pada persamaan 2 (Mills 2005). Pewarna redoks dalam bentuk tereduksi akan menjadi tidak berwarna. Pada kondisi setelah kontak dengan oksigen, pewarna redoks dalam bentuk tereduksi (leukometilen biru) akan teroksidasi oleh oksigen menjadi pewarna redoks dalam bentuk teroksidasi (metilen biru) dan air seperti yang ditunjukkan pada persamaan 3 (Mills 2005). Hal ini akan membuat pewarna redoks kembali menjadi berwarna biru.
� � � � + � → � � � � � + � (2)
� � � � � + O2 → � � � � +H2O (3)
7
O2 Leukometilen biru asam glukonat (tidak berwarna)
H2O Metilen biru glukosa (berwarna biru)
Gambar 3 Skema reaksi mekanisme indikator oksigen berbasis pewarna redoks (Mills 2005)
Proses pembuatan indikator oksigen sebaiknya dilakukan dalam suatu ruangan yang memiliki kadar oksigen rendah agar hasilnya lebih optimal. Proses pembuatan juga bisa dilakukan dalam kondisi ruang terbuka, namun harus diperhatikan dalam kecepatan pembuatan. Ketika metilen biru diteteskan pada campuran glukosa dan CaOH, harus segera diaduk agar tidak menggumpal. Setelah itu ketika pada proses pengadukan, jika warna bubuk sudah menjadi ungu merata, kemasan indikator oksigen harus segera ditutup rapat, agar bubuk indikator tersebut tidak banyak kontak dengan oksigen sebelum digunakan. Pada kondisi kadar oksigen rendah akibat wadah yang ditutup rapat, maka glukosa akan segera mereduksi metilen biru dan warna bubuk yang sebelumnya ungu menjadi putih.
8
Karakteristik Bubuk Indikator Oksigen Terpilih
Tekstur
Tekstur merupakan karakteristik utama pada bubuk indikator oksigen, karena indikator oksigen pada penelitian ini pada akhirnya akan diaplikasikan dalam bentuk sachet. Tekstur yang ideal untuk dijadikan sebagai indikator oksigen adalah halus dan tidak terdapat gumpalan. Sampel A-8 dan A-9 memiliki tekstur yang halus, berwarna putih, dan tidak ada gumpalan. Dengan demikian tekstur A-8 dan A-9 sesuai dengan karakteristik bubuk indikator oksigen yang ideal. Apabila bubuk indikator oksigen memiliki tekstur yang baik, maka pengemasannya dalam bentuk
sachet menjadi lebih mudah dan menarik. Tekstur yang baik juga akan memudahkan konsumen dalam memperoleh informasi yang diberikan oleh indikator oksigen, karena perubahan warna menjadi lebih jelas terlihat.
Kecepatan Glukosa Mereduksi Metilen Biru
Hal yang menandakan bahwa metilen biru telah tereduksi oleh glukosa adalah berubahnya warna ungu menjadi putih pada bubuk indikator oksigen. Perubahan warna tersebut sebenarnya merupakan perubahan metilen biru yang berwarna biru menjadi leukometilen biru yang tidak berwarna. Hasil menunjukkan bahwa sampel A-8 dan A-9 memiliki waktu kurang dari 6 jam dalam proses mereduksi metilen biru (Lampiran 2). Salah satu contoh indikator oksigen yang diproduksi oleh Mitsubishi Gas Chemical Company yaitu Ageless-Eye™juga hanya membutuhkan waktu 2-3 jam. Semakin cepat glukosa mereduksi metilen biru, maka semakin cepat pula indikator oksigen siap untuk digunakan.
Stabilitas dan Umur Simpan
Kestabilan suatu bubuk indikator oksigen terhadap waktu perlu untuk diketahui karena terkait dengan umur simpan bubuk indikator oksigen itu sendiri. Hasil pengujian terhadap sampel A-8 dan A-9 menunjukkan bahwa sampel tersebut memiliki tingkat kestabilan yang baik dan umur simpan mencapai lebih dari 10 hari (Lampiran 2). Bubuk indikator oksigen yang memiliki tingkat kestabilan yang baik adalah tetap berwarna putih selama belum kontak dengan oksigen dan teksturnya tidak rusak. Semakin tinggi tingkat kestabilan indikator oksigen, maka semakin lama umur simpannya.
Sensitivitas
9
perubahan warna dari putih menjadi ungu setelah kontak dengan oksigen dalam waktu kurang dari 1 menit.
Sifat Irreversible
Sifat irreversible adalah sifat tidak dapat kembali seperti semula. Hasil pengujian menunjukkan bahwa sampel A-8 dan A-9 memiliki sifat irreversible atau tidak dapat kembali seperti semula. Hal ini terbukti ketika kedua sampel telah dikontakkan dengan oksigen dan bubuk indikator oksigen menjadi berwarna ungu, kemudian jar kembali ditutup rapat agar tidak kontak dengan oksigen. Hasilnya, bubuk indikator oksigen tidak dapat kembali menjadi warna putih sama seperti saat sebelum kontak dengan oksigen. Hal ini dapat disebabkan oleh kandungan air pada indikator oksigen telah menguap sehingga metilen biru menjadi tidak terlarutkan, sebagai akibatnya kemampuannya sebagai indikator redoks menjadi hilang.
Perubahan Warna Indikator Oksigen
Warna merupakan unsur penting dalam penglihatan manusia. Melalui warna, manusia dapat membedakan obyek-obyek yang dilihatnya lebih cepat daripada bentuk atau rupa. Warna-warna cerah atau dengan kekontrasan yang seimbang akan menarik perhatian jauh lebih cepat daripada warna-warna gelap. Menurut Muthmainnah (2008), warna digunakan sebagai standar dari suatu produk, sebagai penentu kualitas, indikator kerusakan biologis atau fisiko kimia, dan untuk memprediksi karakteristik parameter kualitas lainnya. Warna merupakan parameter mutu utama yang pertama dilihat konsumen dalam memilih suatu produk atau komoditi, karena dapat dilihat secara langsung dan visual.
Pada pengukuran warna suatu produk, terdapat dua metode pengukuran warna yang paling banyak digunakan, yaitu pengukuran warna secara obyektif dan pengukuran warna secara subyektif. Pengukuran warna secara obyektif dipandang sebagai sifat fisik produk tersebut sehingga pengukurannya menggunakan instrumen fisik. Sementara pengukuran warna secara subyektif dipandang sebagai sifat organoleptik sehingga pengukurannya menggunakan indera penglihatan. Instrumen fisik yang digunakan untuk pengukuran warna secara obyektif antara lain
Spectrophotometer, Color Analyzer, Colorimeter atau Chromameter, dan kamera CCD. Kemudian alat bantu yang digunakan untuk pengukuran warna secara subyektif dapat menggunakan diagram warna, Chromaticity CIE 1931, Munsell, dan Hunter (Nurmawati 2011).
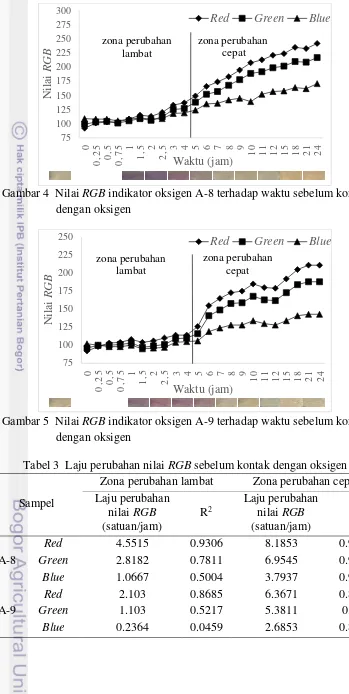
10
Gambar 4 Nilai RGB indikator oksigen A-8 terhadap waktu sebelum kontak dengan oksigen
Gambar 5 Nilai RGB indikator oksigen A-9 terhadap waktu sebelum kontak dengan oksigen
Tabel 3 Laju perubahan nilai RGB sebelum kontak dengan oksigen
Sampel
Zona perubahan lambat Zona perubahan cepat
11
Gambar 4 dan Gambar 5 menunjukkan grafik laju perubahan warna indikator sebelum kontak dengan oksigen. Berdasarkan kedua grafik tersebut dapat dilihat bahwa terjadi perubahan warna indikator oksigen dari warna ungu menjadi putih saat sebelum kontak dengan oksigen. Perubahan warna tersebut diikuti dengan perubahan nilai Red, Green, Blue yang semakin meningkat pada setiap sampel indikator oksigen. Pada kedua grafik tersebut dapat dilihat pula bahwa laju perubahan warna indikator oksigen atau laju perubahan nilai RGB dapat dibagi menjadi dua zona, yaitu zona perubahan lambat dan zona perubahan cepat. Batas zona perubahan pada sampel A-8 dan A-9 terletak di antara jam ke-4 dan jam ke-5, yang berarti laju perubahan nilai RGB berlangsung lambat saat setelah ditambahkannya metilen biru 1% hingga jam ke-4, dan setelah itu laju perubahan berlangsung cepat hingga jam ke-24. Semakin singkat laju perubahan lambat pada indikator oksigen akan semakin baik, karena semakin cepat pula indikator oksigen siap untuk digunakan.
Laju perubahan nilai RGB sebelum kontak dengan oksigen dan nilai R2 pada setiap zona disajikan pada Tabel 3. Nilai positif pada laju perubahan nilai RGB
menunjukkan perubahan tersebut cenderung meningkat. Hasil pengujian menyatakan bahwa secara keseluruhan kedua sampel yang diuji memiliki laju perubahan nilai RGB yang cenderung meningkat. Hasil pengujian juga menunjukkan bahwa pada setiap sampel memiliki laju kenaikan nilai Red > nilai
Green >nilai Blue. Pada zona perubahan lambat, nilai RGB indikator oksigen kedua sampel memiliki berbagai tingkatan korelasi terhadap waktu sebelum kontak dengan oksigen, mulai dari korelasi sangat rendah hingga tinggi. Namun pada zona perubahan cepat, nilai RGB indikator oksigen kedua sampel berkorelasi positif dan tinggi terhadap waktu sebelum kontak dengan oksigen karena nilai R2 yang dimiliki lebih dari 0.80. Seperti nilai Red sampel A-8 yang memiliki nilai R2 sebesar 0.9657 menunjukkan bahwa sebesar 96.57% hubungan antara waktu dan perubahan nilai
Red dapat dijelaskan oleh model regresi, sedangkan sisanya tidak dapat dijelaskan akibat pengaruh variabel lain.
12
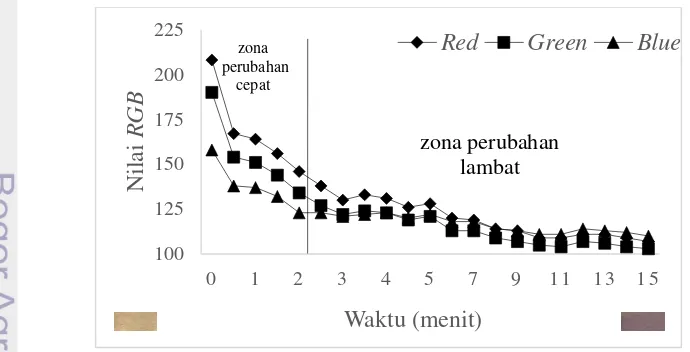
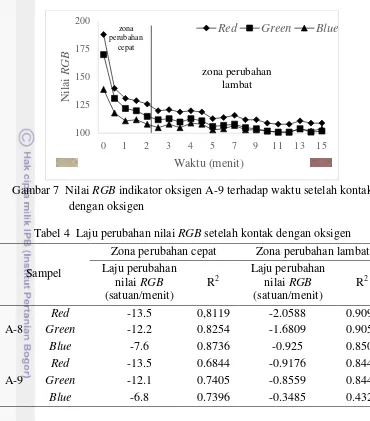
Gambar 7 Nilai RGB indikator oksigen A-9 terhadap waktu setelah kontak dengan oksigen
Tabel 4 Laju perubahan nilai RGB setelah kontak dengan oksigen
Sampel
Zona perubahan cepat Zona perubahan lambat Laju perubahan
Gambar 6 dan Gambar 7 menunjukkan grafik laju perubahan warna indikator setelah kontak dengan oksigen. Perubahan warna yang terjadi adalah dari putih menjadi ungu. Perubahan warna tersebut juga diikuti dengan perubahan nilai Red,
13
Laju perubahan nilai RGB setelah kontak dengan oksigen dan nilai R2 pada setiap zona disajikan pada Tabel 4. Berdasarkan tabel tersebut, seluruh laju perubahan nilai RGB memiliki nilai negatif, yang berarti perubahan tersebut cenderung menurun. Hasil pengujian menunjukkan bahwa pada kedua sampel memiliki laju penurunan nilai Red > nilai Green >nilai Blue. Nilai RGB indikator oksigen kedua sampel juga berkorelasi tinggi terhadap waktu setelah kontak dengan oksigen. Seperti nilai Red sampel A-8 yang memiliki nilai R2 sebesar 0.8119 menunjukkan bahwa sebesar 81.19% hubungan antara waktu dan perubahan nilai
Red dapat dijelaskan oleh model regresi, sedangkan sisanya tidak dapat dijelaskan akibat pengaruh variabel lain.
Sachet Aplikatif Indikator Oksigen
Berdasarkan uji karakteristik yang telah dilakukan, dapat disimpulkan bahwa formulasi indikator oksigen yang terbaik harus memiliki perbandingan komposisi bahan glukosa:CaOH:metilen biru sebesar 1:7:1 sampai 1:8:1. Hal yang selanjutnya dilakukan adalah pembuatan sachet indikator oksigen. Pembuatan sachet ini bertujuan agar indikator oksigen menjadi lebih aplikatif. Pemilihan bahan pembungkus indikator oksigen didasarkan pada permeabilitas bahan tersebut terhadap oksigen (Scott 1975). Bahan-bahan yang digunakan adalah plastik LDPE, PP dan kertas saring.
PP memiliki sifat yang ringan, mudah dibentuk, lebih kuat dari PE dan lebih kaku, tidak mudah sobek, tahan terhadap asam kuat dan basa, tahan terhadap suhu tinggi hingga 150°C, namun rapuh pada suhu rendah. Dibandingkan dengan LDPE, PP memiliki permeabilitas uap air dan gas lebih rendah, serta kekuatan tarik dan kejernihan yang lebih baik (Pantastico 1986). PP lebih kaku, kuat dan ringan dibandingkan dengan LDPE, stabil pada suhu tinggi. PP yang tidak mengkilap mempunyai daya tahan yang cukup rendah terhadap suhu, tetapi bukan penahan gas yang baik (Buckle et al. 1987). PP mempunyai sifat menghalangi uap air yang baik dan permeabilitasnya terhadap gas lebih rendah dibandingkan dengan LDPE (Paine 1983). Sedangkan LDPE memiliki sifat mudah dibentuk, mudah ditarik dan lemas, tidak mudah sobek, kedap air, tahan terhadap asam basa dan alkohol, memiliki titik leleh yang tinggi, cocok untuk menyimpan makanan beku, warnanya bervariasi dari transparan hingga keruh, dan permeabilitasnya terhadap gas lebih tinggi dibandingkan dengan plastik PP. Sedangkan kertas saring memiliki permeabilitas terhadap uap air dan gas lebih tinggi dibandingkan dengan LDPE maupun PP.
Semakin tinggi permeabilitas bahan, maka semakin baik untuk digunakan sebagai pembungkus agar bubuk indikator oksigen tetap sensitif terhadap oksigen (Hirst 1998). Selain berdasarkan permeabilitas bahan, yang juga harus diperhatikan adalah perubahan warna bubuk indikator oksigen harus terlihat jelas dari luar
14
Gambar 8 Sachet indikator oksigen
Standar warna pada sachet indikator oksigen juga dibuat agar memudahkan konsumen dalam memperoleh informasi mengenai bocor atau tidaknya kemasan dengan hanya melihat perubahan warna dari bubuk indikator oksigen. Ketika bubuk indikator oksigen berwarna putih, maka kemasan tersebut masih baik dan kualitas dari produk yang dikemas masih tetap terjaga. Ketika bubuk indikator oksigen berwarna ungu, maka konsumen sebaiknya mengecek ulang kondisi kemasan dan produk yang dikemas sebelum dikonsumsi. Perubahan warna pada indikator oksigen tersebut menjadi media informasi bagi konsumen sehingga dapat membantu konsumen ketika akan memilih produk yang dibeli atau dikonsumsi. Standar warna pada sachet indikator oksigen disajikan seperti pada Gambar 9.
(a) (b)
Gambar 9 Standar warna indikator oksigen sebagai pendeteksi kebocoran kemasan; (a) perubahan warna hasil dokumentasi; (b) perubahan warna sebagai pedoman bagi konsumen
SIMPULAN DAN SARAN
Simpulan
Pembuatan indikator oksigen dengan bahan dasar metilen biru terbukti efektif karena mempunyai sensitifitas tinggi terhadap oksigen. Kesensitifan tersebut terlihat dari perubahan warna dari warna putih saat sebelum kontak dengan oksigen menjadi warna ungu setelah kontak dengan oksigen. Bahan utama tambahan yang digunakan sebagai agen pereduksi yaitu glukosa kristal (dextrose monohydrate) dalam kondisi alkali. Kondisi alkali dapat dibuat dengan penambahan kalsium hidroksida (CaOH). Formulasi indikator oksigen yang terbaik harus memiliki perbandingan komposisi bahan glukosa:CaOH:metilen biru sebesar 1:7:1 sampai 1:8:1. Formulasi terpilih tersebut menghasilkan indikator oksigen yang memiliki
aman
15
tingkat kesensitifan yang baik, tekstur yang halus dan tidak ada gumpalan, memiliki umur simpan yang lama, bersifat irreversible, tidak membutuhkan biaya yang mahal, dan dapat diaplikasikan dengan baik seperti dalam bentuk sachet.
Saran
Sebaiknya dilakukan uji kuantifikasi kadar oksigen terhadap indikator oksigen tersebut dengan oxygen analyzer agar kapasitasnya semakin jelas terukur. Selain itu juga dilakukan penelitian lebih lanjut, aplikasi indikator oksigen berbasis metilen biru terhadap makanan dalam kemasan.
DAFTAR PUSTAKA
Abe Y. 1991. Oxygen absorbent: Is it the answer to shelf life problems? Asia Pacific Food Industry. 5: 66-69.
Ahvenainen. 2003. Active and intelligent packaging. Di dalam: Ahvenainen R (ed).
Novel Food Packaging Techniques. Abington: Woodhead Publising, hlm 5-21.
Arvand M, Sohrabnezhad SH, Mousavi MF, Shamsipur M, Zanjanchi MA. 2003. Electrochemical study of methylene blue incorporated into mordenite type zeolite and its application for amperometric determination of ascorbic acid in real ramples. Anal,Chim.Acta, 491.193-201.
Buckle KA, Edwards RA, Fleet GH, Wortoon. 1987. Ilmu Pangan. Terjemahan UI-Press, Jakarta.
Hirst J. 1998. Personal Communication. EMCO Packaging Systems Ltd, Worth, Kent, UK.
Indra A. 1991. Mempelajari formulasi bahan penyerap oksigen dan laju penyerapannya di udara [skripsi]. Bogor (ID): Institut Pertanian Bogor. Mills A. 2005. Oxygen indicators and intelligent inks for packaging food. Advance
Article. 34:1003-1011.doi:10.1039/b503997p.
Muthmainnah N. 2008. Mutu fisik sawo (Achras zapota L.) dalam kemasan pada simulasi transportasi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nakamura H, Hoshino J. 1983. Technique for the Preservation of Food by Employment of an Oxygen Absorber. Mitsubishi Gas Chemical Co, Inc, Tokyo.
Nurmawati R. 2011. Pengembangan metode pengukuran warna menggunakan kamera CCD (Charge Coupled Device) dan image processing [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Paine J. 1983. The principal of food packaging AVI publisher, Westport Connecticut.
Pantastico EB. 1986. Fisiologi pasca panen, penanganan dan pemanfaatan buah-buahan dan sayur-sayuran tropika dan subtropika. Terjemahan Gama University Press, Yogyakarta.
16
Scoot D. 1975. Oxidoreductases. Di dalam: G Reed (ed.). Enzymes in Food Processing. Academic Press, New York.
Usman H, Akbar PS. 2008. Pengantar statistika. PT Bumi Aksara, Jakarta.
Weast RC. 1982. CRC Handbook of Chemistry and Physics. CRC Press, Inc. Boca Raton, Florida.
17
18
Lampiran 1 Hasil formulasi bubuk indikator oksigen dengan variasi CaOH
Kode sampel Penampakan visual Karakteristik
Tekstur Warna
A-1 Cair Biru
A-2 Lembek
(----) Coklat
A-3 Lembek agak keras
(---) Coklat
A-4 Menggumpal
(--) Coklat
A-5 Menggumpal
(-) Coklat
A-6 Bubuk kasar
(+)
Putih (+)
A-7 Bubuk agak halus
(++)
Putih (++)
A-8 Bubuk halus
(+++)
Putih (+++)
A-9 Bubuk halus
(+++)
19
Lampiran 2 Hasil penghitungan kecepatan glukosa mereduksi metilen biru dan uji stabilitas umur simpan
Kode
sampel Jam ke-6 Jam ke-24 Jam ke-72 Jam ke-240
A-8
A-9
Lampiran 3 Hasil uji sensitivitas
Kode sampel
Gambar indikator oksigen Waktu
perubahan warna (detik) Sebelum kontak
dengan oksigen
Setelah kontak dengan oksigen
A-8 30
Lampiran 4 Data hasil uji kuantifikasi warna
1. Sebelum indikator oksigen kontak dengan oksigen
Formulasi Nilai Sebelum + MB*
Waktu setelah ditambahkan metilen biru (jam ke-)
0 0,25 0,5 0,75 1 1,5 2 2,5 3 4 5 6 7 8 9 10 11 12 15 18 21 24
A-8
Red 340 92 101 103 103 108 115 113 120 133 137 149 166 174 183 195 208 213 221 224 235 233 242
Green 315 99 103 104 101 105 109 106 112 125 127 138 152 157 168 178 189 192 199 202 210 209 217
Blue 258 109 108 108 105 108 110 108 109 118 119 124 135 136 142 145 139 152 157 158 164 162 171
A-9
Red 289 92 98 103 104 108 104 106 110 114 114 126 155 165 173 175 185 180 179 192 205 211 211
Green 268 96 100 100 101 103 97 99 101 109 110 116 141 149 158 159 168 163 162 173 184 188 188
Blue 218 102 100 98 98 100 95 96 97 104 105 106 119 124 128 128 134 130 128 134 141 143 143
*MB = metilen biru 1%
2. Setelah indikator oksigen kontak dengan oksigen
Formulasi Nilai Waktu setelah kontak dengan oksigen (menit ke-)
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 6 7 8 9 10 11 12 13 14 15
A-8
Red 208 167 164 156 146 138 130 133 131 126 128 120 119 114 113 109 109 111 111 109 107
Green 190 154 151 144 134 127 122 124 123 119 121 113 113 109 107 105 104 107 106 104 103
Blue 158 138 137 132 123 123 121 122 123 120 122 118 118 114 113 111 111 114 113 112 110
A-9
Red 188 140 131 129 126 120 121 119 120 119 113 114 116 112 112 109 108 108 111 109 109
Green 170 131 122 120 115 112 113 110 113 111 106 107 108 105 104 102 101 101 104 101 102
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 20 Juni 1992 dari ayah Daniel Bernadettus Sukatja dan ibu Sri Sumarni (alm). Penulis adalah putra kedua dari empat bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Rembang dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Peralatan Industri Pertanian pada tahun ajaran 2013/2014. Penulis juga pernah aktif sebagai staf Departemen Mitra Desa BEM FATETA IPB tahun 2011/2012, wakil ketua Himpunan Keluarga Rembang di Bogor tahun 2013, ketua angkatan KEMAKI 47 IPB, dan ketua UKM Tenis Lapangan IPB tahun 2013/2014, serta anggota Himpunan Mahasiswa Teknologi Industri IPB. Selain itu penulis juga pernah aktif dalam kepanitiaan sebagai penanggung jawab dekorasi MPKMB IPB 2011, ketua pelaksana sosialisasi IPB di Rembang tahun 2011, ketua pelaksana suksesi KEMAKI tahun 2012, dan ketua pelaksana Canvassing IPB di wilayah Rembang, Pati, Blora tahun 2013.
Bulan Juli - Agustus 2013 penulis melaksanakan Praktik Lapangan di PT Kebon Agung Pabrik Gula Trangkil dengan judul Mempelajari Teknologi Proses Produksi dan Pengemasan Gula di PT Kebon Agung Pabrik Gula Trangkil. Kemudian sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, penulis menyusun skripsi setelah melakukan penelitian pada bulan April hingga Juli 2014, dengan judul Indikator Oksigen Berbasis Metilen Biru Sebagai Pendeteksi Kebocoran Kemasan di bawah bimbingan Dr Endang Warsiki STP, MSi.