HIDROLISIS RUMPUT LAUT COKLAT Sargassum sp. (CP 01)
MENGGUNAKAN KAPANG LAUT DAN PENGUJIAN
HIDROLISAT SEBAGAI INHIBITOR TIROSINASE
LINA YUSTIKANINGSIH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01) Menggunakan Kapang Laut dan Pengujian Hidrolisat sebagai Inhibitor Tirosinase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi Ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Lina Yustikaningsih
NIM C34110006
ABSTRAK
LINA YUSTIKANINGSIH. Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01) Menggunakan Kapang Laut dan Pengujian Hidrolisat sebagai Inhibitor Tirosinase. Dibimbing oleh LINAWATI HARDJITO.
Potensi Sargassum di bidang kosmetik salah satunya adalah sebagai inhibitor tirosinase. Penelitian ini bertujuan untuk mendapatkan hidrolisat
Sargassum sp. (CP 01) menggunakan kapang laut, menentukan rendemen hidrolisis, dan menentukan aktivitas inhibitor tirosinase hidrolisat rumput laut coklat Sargassum sp. (CP 01). Penapisan kapang laut menunjukkan bahwa EN merupakan kapang yang sesuai untuk hidrolisis Sargassum sp. (CP 01). Hidrolisis
Sargassum sp. (CP 01) selama 96 jam dengan kapang EN menghasilkan rendemen 35,90 ± 4,10%. Nilai pH selama hidrolisis berkisar antara 5-7. Nilai IC50 hidrolisat
Sargassum sp. (CP 01) pada substrat L-DOPA adalah 364,55 ± 32,18 µg/mL dan pada substrat L-Tirosin sebesar 120,29 ± 1,86 µg/mL. Metode hidrolisis menggunakan kapang laut menghasilkan rendemen yang lebih besar dibandingkan dengan metode ekstraksi menggunakan metanol, namun aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) lebih rendah dibandingkan dengan aktivitas inhibitor tirosinase ekstrak Sargassum sp. (CP 01).
Kata kunci: hidrolisis, kapang laut, Sargassum, selulosa, tirosinase
ABSTRACT
LINA YUSTIKANINGSIH. The Hydrolysis of Brown Alga Sargassum sp. (CP 01) Using Marine Fungi and the Analysis of Hydrolisates as Tyrosinase Inhibitor. Supervised by LINAWATI HARDJITO.
The potency of Sargassum in cosmeceutical is as tyrosinase inhibitor. The aims of this research were to obtain Sargassum sp. (CP 01) hydrolisate using marine fungi, determine the yield of hydrolysates, and the tyrosinase inhibitor activity of Sargassum sp. (CP 01) hydrolysate. Preliminary study indicated that EN was an appropriate fungus for the hydrolysis of Sargassum sp. (CP 01). The hydrolysis of Sargassum sp. (CP 01) for 96 hours obtained the yield of 35.90 ± 4.10%. The pH value during hydrolysis was between 5-7. IC50 values of
Sargassum sp. (CP 01) hydrolysates using L-DOPA and L-Tyrosine substrates were 364.55 ± 32.18 µg/mL and 120.29 ± 1.86 µg/mL, respectively. The hydrolysis method using marine fungi produced a greater yield than the extraction method using methanol, but its tyrosinase inhibitors activity was lower than the tyrosinase inhibitor activity of Sargassum sp. (CP 01) extract.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
HIDROLISIS RUMPUT LAUT COKLAT Sargassum sp. (CP 01)
MENGGUNAKAN KAPANG LAUT DAN PENGUJIAN
HIDROLISAT SEBAGAI INHIBITOR TIROSINASE
LINA YUSTIKANINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01) Menggunakan Kapang Laut dan Pengujian Hidrolisat sebagai Inhibitor Tirosinase
Nama : Lina Yustikaningsih
NIM : C34110006
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Prof Dr Ir Linawati Hardjito, MS Pembimbing
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan hidayahNya sehingga penulis dapat menyelesaikan skripsi dengan judul “Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01) Menggunakan Kapang Laut dan Pengujian Hidrolisat sebagai Inhibitor Tirosinase” tepat pada waktunya. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini:
1 Prof Dr Ir Linawati Hardjito, MS selaku dosen pembimbing, atas segala bimbingan, dan pengarahan yang telah diberikan kepada penulis selama proses penelitian dan penyusunan skripsi.
2 Prof Dr Ir Joko Santoso, MSi, selaku Ketua Departemen Tekonolgi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 3 Dr Ir Iriani Setyaningsih, MS, selaku Ketua Komisi Pendidikan Departemen
Teknologi Hasil Perairan.
4 Dr Kustiariyah Tarman, SPi MSi selaku dosen penguji pada ujian skripsi penulis.
5 Dr Ir Wini Trilaksani, MSc selaku perwakilan Gugus Kendali Mutu (GKM) Departemen Teknologi Hasil Perairan.
6 Bapak Mustoyo, Ibu Musriah, Vera Dwi Apriana, dan Merinda Herdianti yang telah memberikan kasih sayang, doa, motivasi, dan semangat kepada penulis.
7 Teman-Teman seperjuangan (Ryana, Krisye, Sara, dan Christy) yang telah memberikan bantuan dan dukungan selama penelitian. Ayu A, Azah, Farah, Rika, Dewi, Konita, Ayumi, Atika, Sizu, Titin, Iman, Wekson, Najib, Eka Razak, Lastri Ayu Ningtias, Nurul, Hamzah Ihsan, dan Aulia Ranggi Pamalik yang telah memberikan dukungan, motivasi dan bantuan kepada penulis selama penelitian hingga penulisan skripsi.
Penulis menyadari bahwa masih ada kekurangan dalam penulisan skripsi ini, sehingga penulis mengharapkan masukan, kritik dan saran agar dapat digunakan sebagai bahan perbaikan.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 3
Ruang Lingkup Penelitian ... 3
METODE PENELITIAN ... 3
Waktu dan Lokasi Penelitian ... 3
Bahan Penelitian ... 3
Peralatan Penelitian ... 4
Prosedur Penelitian ... 4
Penapisan Kapang Selulolitik ... 4
Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01)... 4
Prosedur Analisis ... 5
Rendemen Hidrolisat ... 5
pH ... 5
Aktivitas Inhibitor Tirosinase Hidrolisat... 5
Data ... 6
HASIL DAN PEMBAHASAN ... 8
Penapisan Kapang Selulolitik ... 8
Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01) ... 9
Rendemen Hidrolisat Sargassum sp. (CP 01) ... 9
Perubahan pH selama Hidrolisis ... 11
Aktivitas Inhibitor Tirosinase Hidrolisat Sargassum sp. (CP 01) ... 13
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 16
UCAPAN TERIMA KASIH ... 16
DAFTAR PUSTAKA ... 17
DAFTAR TABEL
1 Aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01)
menggunakan kapang KT 19, SMH, dan EN ... 8
2 Nilai IC50 hidrolisat Sargassum sp. (CP 01), ekstrak metanol Sargassum sp. (CP 01), Kojic acid, dan arbutin ... 14
DAFTAR GAMBAR
1 Diagram alir proses penapisan kapang selulolitik ... 52 Diagram alir proses hidrolisis rumput laut coklat Sargassum sp. (CP 01) ... 6
3 Data rendemen hidrolisat Sargassum sp. (CP 01) ... 10
4 Grafik nilai pH selama proses hidrolisis ... 12
5 Alur proses melanogenesis ... 13
DAFTAR LAMPIRAN
1 Dokumentasi penelitian ... 232 Contoh perhitungan rendemen hidrolisat Sargassum sp. (CP 01) ... 24
3 Perhitungan IC50 hidrolisat Sargassum sp. (CP 01) pada substrat L-Tirosin ... 25
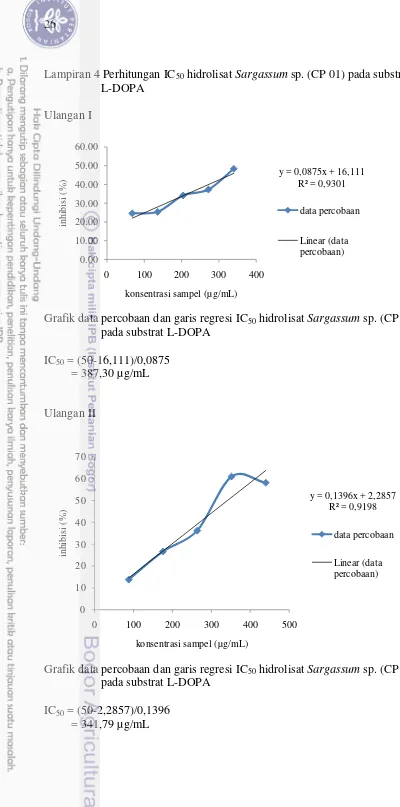
4 Perhitungan IC50 hidrolisat Sargassum sp. (CP 01) pada substrat L-DOPA ... 26
1
PENDAHULUAN
Latar Belakang
Melanin merupakan pigmen yang disintesis secara alami yang menentukan warna kulit, rambut, dan mata pada makhluk hidup. Melanin disintesis di dalam melanosom pada melanosit sebagai akibat dari berbagai faktor, salah satunya yaitu radiasi sinar ultraviolet. Pigmentasi kulit merupakan ciri fenotipe yang ditentukan oleh tipe, produksi, dan distribusi melanin. Melanin memegang peranan penting dalam mekanisme perlindungan pada kulit manusia dengan cara menyerap radikal bebas dan melindungi kulit dari sinar ultraviolet (UV). Perubahan yang tidak normal seperti produksi melanin yang berlebihan dan akumulasi pada beberapa bagian kulit menyebabkan kelainan seperti bintik hitam, penuaan, dan sindrom hiperpigmentasi lainnya (Kim et al. 2013).
Tirosinase dikenal sebagai enzim yang terdistribusi secara luas pada mikroorganisme, tanaman, dan hewan. Enzim tirosinase pada kapang dan vertebrata berfungsi mengkatalisis proses pembentukan melanin dari tirosin. Tirosinase merupakan enzim yang mengkatalisis dua langkah pertama pada proses melanogenesis pada mamalia. Tirosinase yang diekstrak dari jamur Agaricus bisporus sangat mirip dengan tirosinase pada mamalia. Oleh karena itu, tirosinase dari jamur sangat cocok digunakan dalam penelitian mengenai melanogenesis. Tirosinase telah digunakan di bidang bioteknologi termasuk aplikasinya pada sejumlah biosensor elektrokimia untuk banyak komponen fenolik. Tirosinase juga telah diaplikasikan untuk aktivasi residu tirosin pada polipeptida untuk cross-linking film kitosan. Selain itu, tirosinase dapat diaplikasikan untuk menghilangkan fenol dari air limbah dan biokonversi L-Tirosin menjadi L-DOPA (Chang 2012). Inhibisi tirosinase merupakan pendekatan terbaru yang digunakan untuk mencerahkan warna kulit.
Inhibitor tirosinase merupakan senyawa yang dapat menghambat proses pembentukan melanin. Senyawa aktif dalam bahan alam yang berfungsi sebagai inhibitor tirosinase diantaranya arbutin, asam elagat, oksiresverantrol, kloroforin, noratokarpanon, dan artokarpanon (Arung et al. 2006). Kojic acid merupakan inhibitor yang memiliki efek inhibisi dan kestabilan yang paling besar dalam suatu produk kosmetik. Selain kojic acid, senyawa lain yang banyak digunakan sebagai agen pemutih kulit pada produk kosmetik yaitu merkuri dan hidrokuinon. Penggunaan merkuri dan hidrokuinon sebagai bahan pemutih sangat berbahaya karena bahan tersebut bersifat toksin terhadap melanosit (BPOM 2015). Oleh karena itu, diperlukan alternatif inhibitor tirosinase yang aman bagi kesehatan.
Rumput laut Sargassum sp. merupakan jenis rumput laut coklat yang tersebar luas dan memiliki kelimpahan tinggi di perairan Indonesia. Rumput laut coklat ini umumnya menghasilkan senyawa kompleks diterpenoid dan senyawa campuran terpenoid aromatik yang mempunyai aktivitas biologi sebagai antibiotik dan merupakan spesies rumput laut yang tergolong dalam kelas Phaeophyceae
2
pemanfaatan yang luas baik dalam bidang pangan maupun kesehatan. Sargassum
merupakan sumber nutrisi yang baik, seperti karbohidrat, mineral, protein, asam amino esensial (arginin, triptofan, dan fenilalanin), betakaroten, dan vitamin.
Sargassum siliquosum biasanya dimanfaatkan oleh masyarakat lokal India sebagai bahan salad dan sup ikan (Kumar et al. 2015).
Ekstrak Sargassum sp. juga memiliki potensi sebagai antibakteri. Hasil penelitian Siregar et al. (2012) menunjukkan bahwa ekstrak etil asetat
Sargassum sp. merupakan ekstrak yang paling aktif terhadap bakteri
Pseudomonas aeruginosa dan Micrococcus luteus, sedangkan ekstrak metanol
Sargassum sp. merupakan ekstrak yang paling aktif terhadap bakteri
Staphylococcus epidermidis. Selain itu, ekstrak Sargassum polycystum diketahui memiliki kemampuan sebagai antimelanogenesis atau efek pencerah kulit melalui pengujian menggunakan enzim tirosinase jamur. Chan et al. (2011) melaporkan bahwa fraksi heksan dan metanolik dari Sargassum polycystum memiliki aktivitas penghambatan tirosinase seluler dan penghambatan melanogenesis pada sel B16F10.
Rumusan Masalah
Penelitian mengenai potensi Sargassum sp. sebagai inhibitor tirosinase telah dilakukan, namun sebagian besar penelitian tersebut masih menggunakan metode ekstraksi dengan pelarut organik yang relatif mahal dan rendemen yang dihasilkan sedikit. Oleh karena itu, diperlukan metode lain yang lebih efektif untuk mendapatkan senyawa aktif inhibitor tirosinase dari Sargassum sp.. Metode yang digunakan dalam penelitiaan ini yaitu hidrolisis untuk memecah dinding sel rumput laut. Enzim selulase dapat dihasilkan oleh makroorganisme dan mikroorganisme. Salah satu mikroorganisme yang dapat memproduksi enzim selulase adalah kapang. Selama ini, kapang yang banyak digunakan sebagai penghasil enzim selulase merupakan kapang terestrial seperti Trichoderma viridae
dan Aspergillus niger. Enzim selulase yang dihasilkan oleh kapang genus
Trichoderma sebagian besar adalah enzim selobiohidrolase, sedangkan enzim selulase yang berasal dari genus Aspergillus yaitu enzim β-glukosidase (Andhikawati et al. 2014). Enzim selulase yang dihasilkan oleh kapang laut belum banyak dieksplorasi, oleh karena itu proses hidrolisis rumput laut coklat pada penelitian ini menggunakan kapang laut yang memiliki aktivitas selulolitik.
Tujuan Penelitian
3
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini yaitu dapat memberikan informasi mengenai metode penyediaan inhibitor tirosinase melalui hidrolisis rumput laut coklat Sargassum sp. (CP 01) menggunakan kapang laut dan komponen bioaktif hidrolisat rumput laut coklat Sargassum sp. (CP 01) yang berperan sebagai inhibitor tirosinase.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi seleksi kapang laut untuk hidrolisis, hidrolisis Sargassum sp. (CP 01), penentuan rendemen hidrolisis, uji aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01), dan analisis data.
METODE PENELITIAN
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Januari hingga November 2015. Hidrolisis Sargassum sp. (CP 01), penentuan rendemen hidrolisis, dan analisis aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) dilakukan di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Bahan Penelitian
Bahan utama yang digunakan dalam penelitian ini adalah bubuk rumput laut coklat kering Sargassum sp. (CP 01) yang berasal dari Cipatujah, Tasikmalaya, Jawa Barat. Bahan lain yang digunakan dalam hidrolisis Sargassum sp. (CP 01) adalah akuades, kertas indikator pH, dan kapang koleksi dari Dr. Kustiariyah Tarman (Isolat EN, Veronaea sp. KT19, dan SMH). Filtrasi hidrolisat dilakukan menggunakan kain belacu dan kertas saring. Bahan yang digunakan dalam proses presipitasi yaitu etanol PA. Bahan-bahan yang digunakan dalam uji aktivitas inhibitor tirosinase antara lain hidrolisat Sargassum sp. (CP 01) bufer fosfat pH 6,8, enzim tirosinase (Sigma-Aldrich), L-Tirosin, L-DOPA (Sigma-Aldrich), arbutin (Sigma-Aldrich), dan kojic acid (Sigma-Aldrich).
Peralatan Penelitian
4
digunakan dalam analisis aktivitas inhibitor tirosinase yaitu tabung reaksi, pipet mikro, vortex, dan spektrofotometer (UV-VIS Jenwey 2030).
Prosedur Penelitian
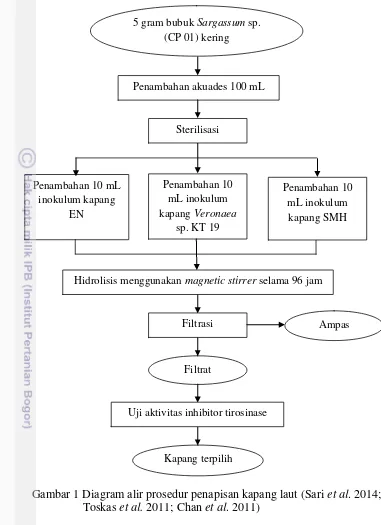
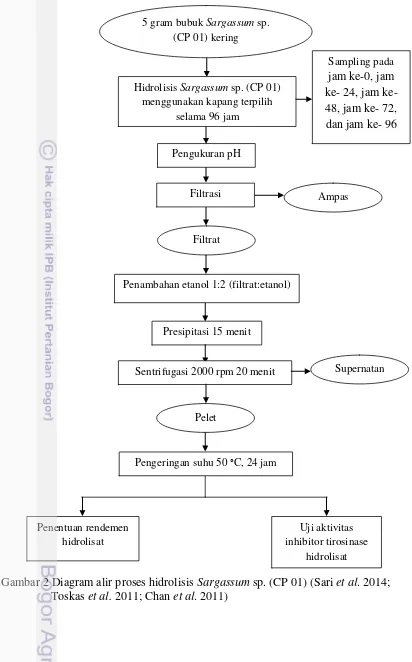
Penelitian ini dilaksanakan dalam beberapa tahap. Tahap pertama yaitu penapisan kapang selulolitik yang akan digunakan dalam proses hidrolisis. Tahap selanjutnya yaitu hidrolisis rumput laut coklat Sargassum sp. (CP 01) menggunakan kapang terpilih (Sari et al. 2014 dengan modifikasi) dan analisis hidrolisat yang meliputi penentuan rendemen (FMC 1997 dengan modifikasi)dan uji aktivitas inhibitor tirosinase (Chan et al. 2011). Proses hidrolisis dan pengujian hidrolisat dilakuan sebanyak dua kali ulangan. Diagram alir prosedur penapisan kapang selulolitik dan hidrolisis rumput laut coklat Sargassum sp. (CP 01) dapat dilihat pada Gambar 1 dan Gambar 2.
Penapisan Kapang Laut untuk Hidrolisis
Penapisan kapang dilakukan untuk menentukan kapang terbaik yang akan digunakan dalam proses hidrolisis. Proses hidrolisis Sargassum sp. mengacu pada metode Sari et al. (2014) dengan modifikasi pada jenis kapang, pH, dan lama hidrolisis. Konsentrasi sampel yang digunakan yaitu 5% (b/v). Sebanyak 5 g bubuk Sargassum sp. (CP 01) dimasukkan ke dalam labu Erlenmeyer 250 mL dan ditambahkan dengan 100 mL aquades kemudian disterilisasi, selanjutnya ditambahkan inokulum kapang laut (EN, Veronaea sp. KT 19 dan SMH) pada masing-masing labu Erlenmeyer. Hidrolisis dilakukan pada suhu ruang dengan pengadukan menggunakan magnetic stirrer selama 96 jam. Hasil hidrolisis disaring menggunakan kertas saring dan diambil filtratnya untuk dianalisis aktivitas inhibitor tirosinasenya.
Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01)
Proses hidrolisis Sargassum sp. mengacu pada metode Sari et al. (2014) dengan modifikasi pada jenis kapang, pH, dan lama hidrolisis. Hidrolisis
5
Gambar 1 Diagram alir prosedur penapisan kapang laut (Sari et al. 2014; Toskas et al. 2011; Chan et al. 2011)
5 gram bubuk Sargassum sp. (CP 01) kering
Penambahan akuades 100 mL
Penambahan 10 mL inokulum kapang Veronaea
sp. KT 19 Sterilisasi
Penambahan 10 mL inokulum kapang
EN
Penambahan 10 mL inokulum
kapang SMH
Hidrolisis menggunakan magnetic stirrer selama 96 jam
Filtrasi Ampas
Filtrat
Uji aktivitas inhibitor tirosinase
6
Gambar 2 Diagram alir proses hidrolisis Sargassum sp. (CP 01) (Sari et al. 2014; Toskas et al. 2011; Chan et al. 2011)
5 gram bubuk Sargassum sp. (CP 01) kering
Hidrolisis Sargassum sp. (CP 01) menggunakan kapang terpilih
selama 96 jam
Filtrasi
Penentuan rendemen hidrolisat
Uji aktivitas inhibitor tirosinase
hidrolisat Penambahan etanol 1:2 (filtrat:etanol)
Presipitasi 15 menit
Ampas
Filtrat
Pengeringan suhu 50 °C, 24 jam Sentrifugasi 2000 rpm 20 menit
Pelet
Supernatan Sampling pada
jam ke-0, jam ke- 24, jam ke- 48, jam ke- 72, dan jam ke- 96
7
Prosedur Analisis
Penentuan Rendemen Hidrolisis (FMC 1997 dengan modifikasi)
Hidrolisat yang diperoleh pada jam ke-0, jam ke-24, jam ke-48, jam ke-72, dan jam ke-96 ditimbang agar diketahui bobotnya. Rendemen hidrolisat dinyatakan dengan persentase bobot hidrolisat yang didapat dari bobot sampel awal. Perhitungan rendemen ekstrak Sargassum sp. (CP 01) dilakukan dengan rumus berikut:
Rendemen (%) =Rendemen (gram /mL ) x 100 mL
Bobot sampel awal (gram)
x
100%Analisis pH
Selama proses hidrolisis dilakukan pengukuran pH yang bertujuan mengetahui perubahan pH selama proses hidrolisis. Pengukuran pH dilakukan menggunakan kertas indikator pH pada jam ke-0, jam ke-24, jam ke-48, jam ke-72, dan jam ke-96.
Uji Aktivitas Inhibitor Tirosinase Hidrolisat Sargassum sp. (CP 01) (Chan et al. 2011)
Aktivitas inhibitor tirosinase dari hidrolisat Sargassum sp. (CP 01) ditentukan menggunakan metode analisis aktivitas inhibitor tirosinase yang mengacu pada penelitian Chan et al. (2011). Uji aktivitas inhibitor tirosinase menggunakan 2 macam substrat, yaitu L-DOPA dan L-Tirosin. Enzim tirosinase (25.000 unit/mL) sebanyak 40 µ L diencerkan dengan menggunakan bufer fosfat pH 6,8 sebanyak 960 µL. Hidrolisat sebanyak 12 mg dilarutkan dalam 1 mL akuades steril.
Substrat L-Tirosin dibuat dengan melarutkan L-Tirosin sebanyak 3,6 mg ke dalam 10 mL akuades, sedangkan substrat L-DOPA dibuat dengan cara melarutkan 3,3 mg L-DOPA ke dalam 10 mL bufer fosfat. Sebelum ditambahkan substrat, masing-masing tabung reaksi yang sudah berisi bufer fosfat, hidrolisat atau kojic acid (kontrol positif), atau akuades (kontrol negatif) dan enzim diinkubasi selama 10 menit pada suhu ruang. Sampel kemudian diukur nilai absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 475 nm (Bt0). Setelah itu, masing-masing tabung reaksi ditambahkan substrat
L-DOPA lalu diinkubasi pada suhu ruang selama sepuluh menit, atau ditambahkan substrat L-Tirosindan diinkubasi pada suhu ruang selama 20 menit. Masing-masing tabung reaksi kemudian diukur kembali nilai absorbansinya dengan spektrofotometer (Bt10) untuk menentukan persen inhibisi dan nilai
konsentrasi hambat 50% (IC50).
8
Inhibisi (%) = (A t10− A t0) – (B t10− B t0)
(A t10− A t0) × 100%
Keterangan: At0 = nilai absorbansi kontrol negatif pada t0
At10 = nilai absorbansi kontrol negatif pada t10
Bt0 = nilai absorbansi sampel pada t0
Bt10 = nilai absorbansi sampel pada t10
Analisis Data
Analisis data pada penelitian ini menggunakan metode analisis deskriptif dengan rataan dan standar deviasi yang diolah menggunakan Microsoft Excel 2010.
HASIL DAN PEMBAHASAN
Komponen kimia dalam rumput laut dapat diperoleh sesuai kebutuhan dengan beberapa cara, salah satunya yaitu hidrolisis. Hidrolisis adalah pemecahan suatu senyawa menggunakan air, menghasilkan molekul-molekul yang lebih kecil. Hidrolisis dapat dilakukan dengan bahan kimia maupun enzimatis (Mastuti dan Setyawardhani 2010). Selulosa dan hemiselulosa merupakan komponen penting yang terdapat pada dinding sel rumput laut (Kumar et al. 2015). Selulosa merupakan polimer berantai lurus dari α-(1,4)-D-glukosa (Winarno 2008). Selulase adalah enzim yang dapat mengkatalis terjadinya reaksi hidrolisis pada polimer organik, seperti selulosa menjadi komponen gula sederhana yaitu glukosa. Pada enzim selulase kompleks terdapat tiga enzim utama yaitu endoglukanase, eksoglukanase dan selobiose (β-glukosidase) (Winarno 2010).
Penapisan Kapang Laut untuk Hidrolisis Rumput Laut Coklat
Sargassum sp. (CP 01)
Penapisan kapang laut dilakukan untuk menentukan kapang yang sesuai untuk digunakan dalam proses hidrolisis rumput laut coklat Sargassum sp. (CP 01). Hasil uji aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) dengan tiga jenis kapang laut yang berbeda yaitu kapang EN, Veronaea sp. KT 19, dan SMH disajikan pada Tabel 1.
Tabel 1 Aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) menggunakan kapang KT 19, SMH, dan EN
Sampel Inhibisi (%)
9
Hidrolisat Sargassum sp. (CP 01) yang dihidrolisis dengan tiga jenis kapang berbeda memiliki aktivitas inhibitor tirosinase yang berbeda yang dinyatakan dalam persen inhibisi. Hidrolisat Sargassum sp. (CP 01) yang dihidrolisis menggunakan kapang EN memiliki aktivitas inhibitor tirosinase paling tinggi dibandingkan dengan kapang lainnya yaitu 22,64%. Kontrol positif (kojic acid) memiliki aktivitas inhibitor tirosinase sebesar 80,10%. Tingginya aktivitas inhibitor tirosinase Sargassum sp. (CP 01) yang dihidrolisis menggunakan kapang EN ini disebabkan kemampuan kapang EN menghidrolisis selulosa pada dinding sel Sargassum sehingga komponen aktif yang terdapat di dalam sel dapat larut dalam air. Hal ini didukung dengan hasil penelitian Andhikawati et al. (2014) yang menemukan kapang EN memiliki aktivitas selulolitik yang paling tinggi jika dibandingkan dengan kapang KT 19 dan SMH.
Kapang EN merupakan kapang endofit yang diisolasi dari lamun jenis
Enhalus sp. dari perairan Pulau Karya, Kepulauan Seribu (Oktavia et al. 2014). Kapang endofit dapat menghasilkan enzim-enzim penting, seperti enzim pendegradasi oligosakarida (selulase, xylanase, mannanase dan inulinase). Kapang laut endofit dapat menghasilkan hormon yang dapat memacu pertumbuhan inangnya, zat antibiotik dan metabolit sekunder lainnya yang bermanfaat (Ranghukumar 2008). Sebagian besar kapang endofit menghasilkan metabolit sekunder jika dikultur dan difermentasi, tetapi temperatur, komposisi media dan intensitas cahaya sangat menentukan jumlah dan komponen yang dihasilkan oleh kapang endofit (Cai et al. 2012).
Hidrolisis Rumput Laut Coklat Sargassum sp. (CP 01)
Rendemen Hidrolisat Sargassum sp. (CP 01)
Mengacu pada hasil penapisan kapang yang menunjukkan bahwa aktivitas inhibitor tirosinase paling tinggi dimiliki oleh hidrolisat Sargassum sp. (CP 01) yang dihidrolisis menggunakan kapang EN, maka pada proses hidrolisis selanjutnya yang digunakan hanya kapang EN. Kapang EN merupakan kapang endofit yang diisolasi dari lamun jenis Enhalus. Kapang ini diduga merupakan kapang laut yang fakultatif, karena dapat tumbuh pada kondisi media NaCl 3%, air tawar, dan air laut (Andhikawati et al. 2014). Kapang laut fakultatif merupakan kapang dari lingkungan tawar atau terrestrial yang mampu tumbuh dan bersporulasi di lingkungan laut (Gandjar et al. 2006).
Fase adaptasi kapang EN terjadi hingga hari ketiga, selanjutnya merupakan fase eksponensial yang terjadi hingga hari ke 12, setelah hari ke 12 kapang EN memasuki fase stasioner. Isolat kapang EN ini memiliki potensi sebagai kapang selulolitik dengan media air tawar (Andhikawati et al. 2014), maka media hidrolisis yang digunakan pada penelitian ini adalah akuades. Aklimatisasi kapang EN dengan subsrtrat Sargassum sp. (CP 01) dilakukan selama 24 jam. Kapang yang telah diaklimatisasi selanjutnya digunakan pada proses hidrolisis. Hidrolisis
10
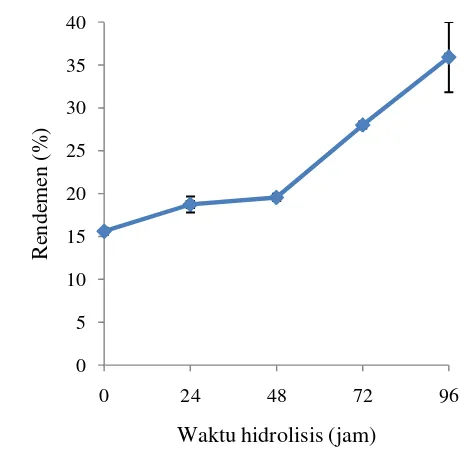
Gambar 3 Data rendemen hidrolisat Sargassum sp. (CP 01)
Rendemen hidrolisat Sargassum sp. (CP 01) terus meningkat dari 15,60 ± 0,00% pada jam ke-0 hingga 35,90 ± 4,10% pada jam ke-96. Contoh perhitungan rendemen hidrolisat Sargassum sp. (CP 01) disajikan pada Lampiran 2. Hasil tersebut lebih besar dibandingkan dengan rendemen ekstrak metanol
Sargassum sp. (CP 01) yaitu sebsar 6,02 ± 0,08% (Putri 2014). Perbedaan hasil rendemen tersebut disebabkan perbedaan metode yang digunakan. Hal ini menunjukkan bahwa metode hidrolisis lebih efektif dibandingkan dengan metode ekstraksi. Rendemen yang diperoleh pada jam ke-0 mencapai 15,60 ± 0,00% disebabkan adanya proses sterilisasi menggunakan suhu 121 °C selama 25 meni.
Hasil penelitian Toskas et al. (2011) menunjukkan bahwa hidrolisis Ulva rigida
menggunakan air dengan suhu 130 °C selama 30 menit menghasilkan rendemen
24,3%.
Rendemen yang dihasilkan selama hidrolisis terus meningkat hingga jam ke-96 akibat adanya aktivitas enzim selulase yang dihasilkan oleh kapang. Mekanisme pemotongan rantai ikatan oleh enzim selulase melibatkan sinergitas kerja 3 komponen besar yaitu endo-1,4-β-D-glukanase yang berfungsi memutuskan ikatan selulosa secara acak dengan memulai serangan pada sisi internal daerah amorf dari serat selulosa sehingga sisi yang terbuka dapat diserang oleh selobiohidrolase. Kemudian dilanjutkan oleh ekso-β-1,4- glukanase yang memotong ujung-ujung rantai selulosa. Ekso-β-1,4-glukanase atau disebut selobiohidrolase menyerang bagian luar dari selulosa sehingga dihasilkan selobiosa, kemudian dilanjutkan oleh β-glukosidase yang berfungsi memotong selobiosa menjadi molekul-molekul glukosa (Kodri et al. 2013).
Kapang mempunyai masa pertumbuhan yang bervariasi, dalam aktivitas metabolismenya kapang memiliki beberapa fase dalam pertumbuhnnya. Aktivitas metabolisme akan menurun setelah kapang melewati fase puncak pertumbuhannya. Fase pertumbuhan tersebut berpengaruh terhadap enzim yang dihasilkan oleh kapang untuk membantu mencerna makanannya. Aktivitas enzim selulase mencapai nilai maksimum pada fase logaritmik pertumbuhan kapang,
11
karena pada fase logaritmik pertumbuhan kapang akan mengurai polimer yang lebih kompleks (selulosa) sebagai nutrisi pertumbuhannya (Gandjar et al. 2006).
Selulosa pada Sargassum akan terhidrolisis menjadi polisakarida yang larut air. Polisakarida merupakan senyawa karbohidrat yang tersusun dari banyak sakarida. Sifat dari polisakarida diantaranya tidak dapat mereduksi, tidak menunjukkan mutarotasi, tidak membentuk mutanon, dan stabil pada kondisi basa (Winarno 2010). Selulosa pada Sargassum dimanfaatkan oleh isolat kapang sebagai sumber karbon untuk proses pertumbuhannya. Molekul yang terlalu besar untuk diserap akan dihancurkan oleh enzim ekstraseluler sehingga pada fase ini aktivitas enzim akan maksimum (Andhikawati et al. 2014). Da silva et al. (2005) menyatakan bahwa sistem pemecahan selulosa menjadi glukosa melibatkan tiga jenis enzim selulase yaitu endo-β-1,4-glukanase, ekso-β-1,4-glukanase, dan β-glukosidase.
Hasil rendemen menunjukkan bahwa etanol efektif untuk mengendapkan polisakarida. Etanol memiliki kemampuan melarutkan polisakarida yang relatif kecil, meskipun kemampuan dalam melarutkan zat–zat lain cukup besar (Haryani 2010). Wu et al. (2014) juga menyebutkan bahwa isolasi polisakarida dari Sargassum fusiforme dilakukan dengan metode ekstraksi panas menggunakan air, dan presipitasi dengan etanol. Dengan demikian etanol dapat digunakan dalam proses pengendapan polisakarida dari Sargassum sp. (CP 01).
Polisakarida yang diduga terdapat dalam hidrolisat Sargassum sp. (CP 01) antara lain alginat, fukoidan, dan laminaran. Sinha et al. (2010) menyatakan bahwa S. tenerrimum setidaknya mengandung dua jenis polisakarida berbeda yaitu fukoidan dan alginat yang kaya akan asam guluronat. Hasil penelitian Handayani et al. (2004) menunjukkan bahwa talus S. crassifolium mengandung
alginat 37,91%. Ekstrak LME (Laminaran Modified Extraction) dari
S. crassifolium mempunyai finger print pada bilangan gelombang 884 cm-1 yang identik dengan β-(1,3)-D-glukopiranosil atau laminaran sedangkan LAE (Laminaran Acid Extraction) dari S. crassifolium mempunyai finger print pada bilangan gelombang 833 cm-1 yang mengindikasikan adanya grup sulfat axial yang identik dengan fukoidan (Chamidah 2013). Polisakarida yang terdapat dalam hidrolisat Sargassum sp. (CP 01) merupakan jenis polisakarida larut air. Hasil penelitian Wu et al. (2014) menunjukkan bahwa polisakarida larut air yang diisolasi dari S. fusiforme tersusun dari manosa, glukosa, galaktosa, xilosa, fukosa, asam glukuronat atau asam galakturonat, dan asam uronat.
Perubahan pH Selama Hidrolisis
12
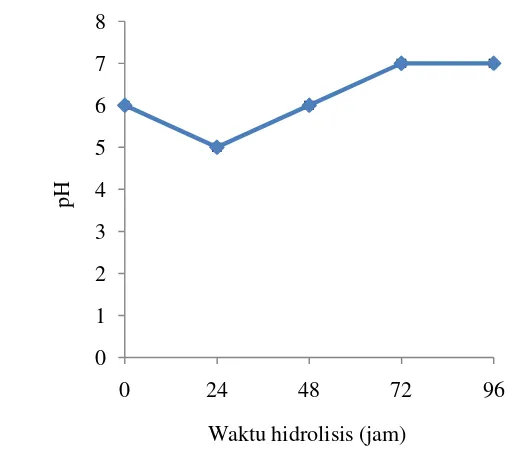
yaitu pada jam ke-0, jam ke-24, jam ke-48, jam ke-72, dan jam ke-96. Perubahan nilai pH selama hidrolisis dapat dilihat pada Gambar 4.
Gambar 4 Grafik nilai pH selama proses hidrolisis
Nilai pH mengalami penurunan pada jam ke-24 dan kembali meningkat hingga jam ke-72 dan cenderung konstan hingga jam ke-96. Perubahan pH yang terjadi selama proses hidrolisis disebabkan oleh aktivitas kapang selama proses pertumbuhannya. Rentang pH optimum pertumbuhan kapang yaitu 4-7 (Srikandace et al. 2007). Nilai pH tersebut masih berada pada rentang yang sesuai untuk aktivitas enzim selulase, sehingga enzim selulase yang dihasilkan oleh kapang EN dapat bekerja untuk menghidrolisis selulosa pada Sargassum sp. (CP 01). Menurut Harshvardhan et al. (2013), enzim selulase aktif pada kisaran pH 3-9. Yuan et al. (2012), menyatakan endoglukanase yang dihasilkan oleh
Fusarium oxysporum sangat reaktif pada pH 4,5-5,5.
Penurunan nilai pH yang terjadi pada jam ke-24 diduga disebabkan adanya pemecahan alginat menghasilkan asam uronat, asam manuronat, dan asam guluronat (Wu et al. 2014; Siswati et al. 2002). Adanya pemecahan protein pada
Sargassum menjadi asam amino juga menyebabkan turunnya nilai pH. Kapang membutuhkan nitrogen sebagai nutrisi untuk pertumbuhannya. Sebagian besar kapang dapat mengasimilasi asam amino, amina, dan amida sebagai sumber nitrogen. Kebanyakan kapang memiliki kemampuan proteolitik, yaitu dapat menghidrolisis protein menjadi asam amino menggunakan enzim protease ekstraseluler (Kavanagh 2011).
Peningkatan nilai pH yang terjadi pada jam ke-48 hingga jam ke-72 diduga disebabkan pembentukan beberapa asam amino yang bersifat basa seperti arginin dan ornitrin (Moat et al. 2002). Prusky et al. (2001) melaporkan bahwa proses deaminasi asam amino oleh kapang menghasilkan amonia juga menyebabkan naiknya nilai pH. Beberapa jamur yang memproduksi amonia antara lain
Neurospora crasa, Aspergillus fumigatus, Metarhizium anisopliae, dan Candida albicans (Barelli et al. 2015). Metabolisme protein juga menghasilkan NH3 yang
13
akan bereaksi dengan air membentuk NH4+ dan OH- yang bersifat basa
(Sakhashiri 2008).
Aktivitas Inhibitor Tirosinase Hidrolisat Sargassum sp. (CP 01)
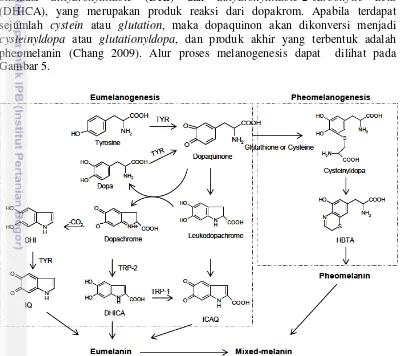
Tirosinase merupakan enzim yang terdistribusi secara luas pada mikroorganisme, tumbuhan, dan hewan. Tirosinase merupakan enzim yang terlibat dalam proses biosintesis melanin pada kulit manusia (Chang 2012). Tahap pertama dari proses melanogenesis yaitu oksidasi tirosin menjadi dopaquinon yang dikatalisis oleh enzim tirosinse. Selanjutnya, dopaquinon diubah menjadi dopa dan dopakrom melalui proses autooksidasi. Dopa juga merupakan substrat untuk enzim tirosinase dan dioksidasi menjadi dopaquinon kembali oleh enzim tirosinase. Produk akhir berupa eumelanin terbentuk melalui satu rangkaian reaksi oksidasi dihydroxylindole (DHI) dan dihydroxylindole-2-carboxylic acid
(DHICA), yang merupakan produk reaksi dari dopakrom. Apabila terdapat sejumlah cystein atau glutation, maka dopaquinon akan dikonversi menjadi
cysteinyldopa atau glutationyldopa, dan produk akhir yang terbentuk adalah pheomelanin (Chang 2009). Alur proses melanogenesis dapat dilihat pada Gambar 5.
Gambar 5 Alur proses melanogenesis (Chang 2009)
14
dihasilkan, hal ini ditandai dengan nilai absorbasi yang semakin tinggi. Chang (2012) menyatakan bahwa aktivitas inhibitor tirosinase suatu zat biasanya dinyatakan sebagai nilai IC50. Pengujian aktivitas inhibitor tirosinase dilakukan
menggunakan substrat L-Tirosin dan L-DOPA, dengan kontrol positif arbutin dan
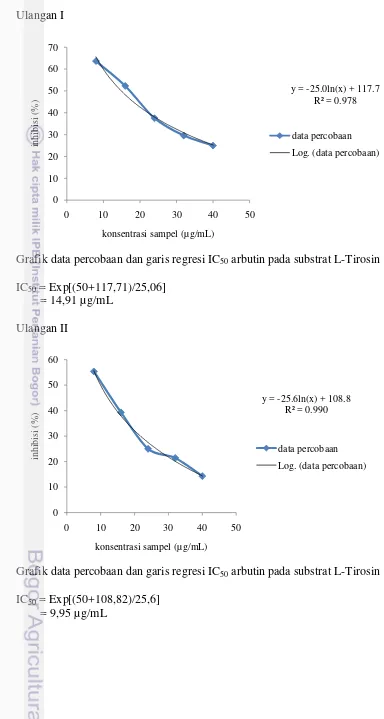
kojic acid. Hasil uji aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) dapat dilihat pada Tabel 2. Perhitungan IC50 hidrolisat Sargassum sp. (CP 01), dan
arbutin disajikan pada Lampiran 3, 4, dan 5.
Tabel 2 Nilai IC50 hidrolisat Sargassum sp. (CP 01), ekstrak metanol Sargassum
sp. (CP 01), kojic acid, dan arbutin
Sampel Nilai IC50 (µg/mL)
Substrat L-DOPA Substrat L-Tirosin Hidrolisat Sargassum sp. (CP 01) 364,55 ± 32,18 120,29 ± 1,86 Ekstrak metanol Sargassum sp. (CP 01)
Kojic acid hidrolisat Sargassum sp. (CP 01) merupakan polisakarida, hanya sedikit komponen aktif yang terikat pada polisakarida dan ikut terendapkan selama proses presipitasi menggunakan etanol. Selain itu, proses sterilisasi menggunakan suhu tinggi diduga menyebabkan rusaknya komponen aktif yang terdapat pada
Sargassum. Oleh karena itu, aktivitas penghambatan terhadap enzim tirosinase menjadi rendah. Nilai IC50 hidrolisat Sargassum sp. (CP 01) pada substrat
L-DOPA lebih tinggi dibandingkan pada substrat L-Tirosin. Hal ini menunjukkan bahwa ktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) lebih efektif pada tahap monofenolase.
Sargassum memiliki komponen fenolik yang berfungsi mengikat radikal bebas untuk melindungi talus dari photo-destruction yang disebabkan radiasi sinar ultraviolet. Komponen fenolik merupakan aneka ragam senyawa yang berasal dari tumbuhan yang memiliki ciri yang sama yaitu cincin aromatik yang mengandung satu atau dua penyulih hidroksil. Beberapa golongan fenolik telah diketahui dan salah satu yang terbesar adalah flavonoid (Harborne 1987). Beberapa faktor lingkungan yang mempengaruhi jumlah komponen fenolik pada Sargassum yaitu intensitas cahaya, lama penyinaran, kedalaman, salinitas, nutrien, musim, umur, dan tipe jaringan (Kumar et al. 2015). Hasil analisis fitokimia secara kualitatif yang dilakukan pada penelitian Putri (2014) menunjukkan bahwa ekstrak
Sargassum sp. (CP 01) mengandung komponen flavonoid, saponin, fenol, steroid dan triterpenoid.
Komponen kimia yang berperan sebagai inhibitor tirosinase dari hidrolisat
15
Chang (2012) yang menyatakan bahwa beberapa komponen fenolik bertindak sebagai alternatif substrat tirosinase. Ketika komponen fenolik menunjukkan afinitas yang baik terhadap tirosinase, pembentukan dopakrom akan dicegah. Oleh karena itu, komponen fenolik tersebut dapat berfungsi sebagai inhibitor tirosinase. Suatu inhibitor kompetitif biasanya merupakan substrat analog atau turunan L-Tirosin atau L-DOPA yang akan mengikat ion Cu+2 dari enzim tirosinase.
Komponen aktif yang terdeteksi dominan pada Sargassum sp. (CP 01) adalah flavonoid. Struktur flavonoid pada prinsipnya kompatibel dengan peran dari kedua substrat dan bersifat kompetitif sebagai inhibitor tirosinase. Penghambatan yang dilakukan salah satunya oleh flavonol, yang merupakan kelompok flavonoid yaitu sebagai inhibitor kompetitif pada oksidasi L-DOPA oleh tirosinase dan 3-hidroksi-4-keto yang merupakan bagian dari struktur flavonol yang berperan sebagai kunci dalam pengkelat logam (Chang 2009). Senyawa fenolik dari flavonoid berikatan dengan atom Cu+2 pada sisi aktif tirosinase yang menyebabkan tidak terjadi reaksi oksidasi yang dikatalisis tirosinase sehingga pembentukan senyawa dopakuinon dan dopakrom menjadi berkurang (Juwita 2011).
Saponin merupakan glikosida triterpen dan sterol yang terdeteksi pada lebih dari 90 jenis tumbuhan. Saponin merupakan senyawa yang bersifat seperti sabun yang dapat dideteksi berdasarkan kemampuan membentuk busa (Harborne 1987). Zhang dan Zhou (2013) melaporkan bahwa saponin yang diisolasi dari
Xanthoceras sorbifolia pada konsentrasi 0,96 mg/mL dapat menghambat kerja tirosinase sebesar 52%. Mekanisme saponin dalam menghambat kerja tirosinase adalah meningkatkan nilai konstanta Michaelis-Menten (Km) tetapi menurunkan laju oksidasi yang terindikasi dari rendahnya nilai kecepatan maksimum (Vmax).
Steroid merupakan golongan dari senyawa triterpenoid. Senyawa steroid dapat digunakan sebagai bahan dasar pembuatan obat. Steroid dapat diklasifikasikan menjadi steroid dengan atom karbon tidak lebih dari 21 yaitu sterol, sapogenin, glikosida jantung dan vitamin D. Steroid alami berasal dari berbagai transformasi kimia dua triterpena yaitu lanosterol dan sikloartenol (Harbone 1987). Senyawa steroid yang terdapat pada Sargassum sp. (CP 01) diduga memiliki kemampuan menghambat kerja enzim tirosinase. Chang (2009) menyatakan bahwa tiga macam steroid yang diisolasi dari Trifolium balansae
menunjukkan hasil inhibisi pada fase diphenolase yang lebih tinggi dari pada kojic acid yang merupakan kontrol positif.
Selain itu, komponen lain dari hidrolisat Sargassum sp. (CP 01) yang diduga berperan dalam menghambat proses melanogenesis yaitu fukosantin. Thomas dan Kim (2013) menyatakan bahwa fukosantin yang diisolasi dari Laminaria japonica
16
KESIMPULAN DAN SARAN
Kesimpulan
Kapang yang sesuai untuk menghidrolisis Sargassum sp. (CP 01) yaitu kapang EN. Rendemen hidrolisat Sargassum sp. (CP 01) pada jam ke-96 yaitu 35,90 ± 4,10%. Nilai IC50 hidrolisat Sargassum sp. (CP 01) pada substrat
L-DOPA yaitu 364,55 ± 32,18µg/mL, dan pada substrat L-Tirosin 120,29 ± 1,86 µg/mL. Aktivitas inhibitor tirosinase hidrolisat Sargassum sp. (CP 01) lebih tinggi pada tahap monofenolase. Hidrolisat Sargassum sp. (CP 01) memiliki aktivitas inhibitor tirosinase lebih rendah dibandingkan dengan kojic acid.
Saran
Penelitian selanjutnya perlu dilakukan menggunakan metode pemecahan dinding sel Sargassum secara fisik seperti metode sonikasi, mencari kombinasi pelarut polar dan semi polar yang efektif untuk mengisolasi komponen aktif hidrolisat Sargassum sp. (CP 01) yang berperan sebagai inhibitor tirosinase, menentukan IC50 arbutin dengan substrat L-DOPA,dan analisis komposisi
polisakaida hidrolisat Sargassum sp. (CP 01).
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada KEMENRISTEK DIKTI yang
telah mendanai penelitian ini melalui program Hibah Kompetensi atas nama Prof Dr Ir Linawati Hardjito, MS.
DAFTAR PUSTAKA
Andhikawati A, Oktavia Y, Ibrahim B, Tarman K. 2014. Isolasi dan penapisan kapang laut endofit penghasil selulase. Jurnal Ilmu dan Teknologi Kelautan Tropis. 6(1): 219-227.
Arung ET, Shimizu K, Kondo R. 2006. Inhibitory effect of artocarpanone from
Artocarpus heterophyllus on melanin biosynthesis. Biology Pharmacy Bulletin. 29: 1966-1969.
17
Boon CS, McClements DJ, Weiss J, Decker EA. 2010. Factors influencing the chemical stability of carotenoids in foods. Critical Reviews in Food Science and Nutrition. 50: 515-532.
[BPOM] Badan Pengawas Obat dan Makanan. 2015. Hidrokuinon dalam kosmetik
[internet]. [diunduh 2015 Nov 11]. Tersedia pada: ik.pom.go.id.
Cai M, Zhou X, Lu J, Fan W, Zhou J, Niu C, Kang L, Sun X, Zhang Y. 2012. An integrated control strategy for the fermentation of the marine derived fungus
Aspergillus glaucus for the production of anticancer polyketide. Journal of Marine Biotechnology. 14: 665–671.
Chamidah A. 2013. Karakteristik fisikokimia dan potensi prebiotik ekstrak dan hidrolisat enzimatik laminaran Sargassum crassifolium [disertasi]. Yogyakarta (ID): Universitas Gadjah Mada.
Chan YY, Kim KH, Cheah SH. 2011. Inhibitory effects of Sargassum polycystum
on tyrosinase activity and melanin formation in B16GF10 murine melanoma cells. Journal of Ethnopharm: 1183-1188.
Chang TM. 2012. Tyrosinase and tyrosinase inhibitors. Journal of Biocatalysis and Biotransformation. 1: 1-2.
Chang TS. 2009. An update review of tyrosinase inhibitor. International Journal Molecular Science. 10(6): 2440-2475.
Da Silva R, Lago ES, Merheb CW, Machione MM, Park YK, Gomes E. 2005. Production xylanase and CMCase on solid state fermentation in different residues by Thermoascus auranticus miehe. Braz Journal Microbiomol. 36: 235-241.
Gandjar I, W Sjamsuridzal, A Oetari. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia. hlm 23-115.
Handayani T, Sutarno, Setyawan AD, 2004. analisis komposisi rumput laut
Sargassum crassifolium J. Agardh. Jurnal Biofarmasi. 2(2): 45-52.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, penerjemah, Bandung (ID): Institut Teknologi Bandung. Terjemahan dari Phytochemical Methods.
hlm 47-158.
Harshvardhan K, Mishra A, Jha B. 2013. Purification and characterization of cellulase from a marine Bacillus sp. H1666: A potential agent for single step saccharification of seaweed biomass. Journal of Molecular Catalysis B: Enzymatic. 93:51-56.
Haryani K. 2010. Pengambilan polisakarida acemannan dari aloevera menggunakan etanol sebagai pengendap. Prosiding Seminar Nasional
Teknik Kimia “Kejuangan” ISSN 1693 – 4393 Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. hlm: 1-5.
18
Hi SW, Choong PY, Woo KK, Wong CL. 2010. Stability studies of fucoxanthin from Sargassum binderi. Australian Journal of Basic and Applied Sciences.
4(10): 4580–4584.
Indera C, Pradana, Susanti D. 2013. Analisa pengaruh komposisi graphene- tio2 terhadap unjuk kerja Dye Sensitized Solar Cell (DSSC). Jurnal Teknik Pomits. 2(1): 2337-3539.
Juwita NK. 2011.Uji penghambatan tirosinase dan stabilitas fisik sediaan krim pemutih yang mengandung ekstrak kulit batang nangka (Artocarpus heterophyllus) [skripsi]. Depok (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Kavanagh K. 2011. Fungi: Biology and Applications (Second Edition). Maynooth (IE): A John Wiley & Sons, Ltd. Publication. hlm 21-25.
Kim SC, Lee JH, Kim MH, Lee JA, Kim YB, Jung E, Kim YS, Lee J, Park D. 2013. Hordenine, a single compound produced during barley germination inhibits melanogenesis in human melanocytes. Food Chemistry. 141: 174-181.
Kim YJ, Kyung KJ, Lee JH, Chung HY. 2004. 4-4’-Dihydroxybiphenyl as a new potent tyrosinase inhibitor. Biol Pharm Bull. 28(2): 323-327.
Kodri, Argo BD, Yulianingsih R. 2013. Pemanfaatan enzim selulase dari
Trichoderma Reseei dan Aspergillus Niger sebagai katalisator hidrolisis enzimatik jerami padi dengan Pretreatment Microwave. Jurnal Bioproses Komoditas Tropis. 1(1): 36-43.
Kumar S, Sahoo D, Levine I. 2015. Assessment of nutritional value in a brown seaweed Sargassum wightii and their seasonal variations. Algal Resaearch
9:117-125.
Lehninger AL. 1982. Dasar-Dasar Biokimia Jilid 1. Thenawijaya M. Penerjemah. Jakarta (ID): Erlangga. 235-274.
Mastuti E, Setyawardhani DA. 2010. Pengaruh variasi temperatur dan konsentrasi katalis pada kinetika reaksi hidrolisis tepung kulit ketela pohon.
Ekuilibrium. 9(1): 23-27.
Moat AG, Foster JW, Spector MP. 2002. Microbial Physiology. Fourth edition. New York (US): A Wiley Interscience Publication. hlm: 18-19.
Oktavia Y, Andhikawati A, Nurhayati T, Tarman K. 2014. Karakterisasi enzim kasar selulase kapang endofit dari lamun. Jurnal Ilmu dan Teknologi Kelautan Tropis. 6(1): 209-218.
Prusky D, McEvoy JL, Leverentz B, Conway WS. 2001. Local modulation of host pH by Colletotrichum species as a mechanism to increase virulence. MPMI. 14(9): 1105–1113.
19
Ranghukumar C. 2008. Marine fungal biotechnology: an ecological perspective.
Fungal Diversity, 31: 19-35.
Sakhashiri. 2008. Amonia, NH3 [internet]. [diunduh 2016 Mar 8]. Tersedia pada:
www.scifun.org.
Sari RN, Utomo BSD, Tambunan AH. 2014. Kondisi optimum produksi bioetanol dari rumput laut coklat (Sargassum duplicatum) menggunakan Trichoderma viride dan Pichia angophorae. JPB Perikanan. 9(2): 121–132.
Sinha S, Astani A, Ghosh T, Schnitzler P, Ray B. 2010. Polysaccharides from
Sargassum tenerrimum: Structural features, chemical modification and anti-viral activity. Phytochemistry. 71: 235–242.
Siregar AF, Sabdono A, Pringgenies D. 2012. Potensi antibakteri ekstrak rumput laut terhadap bakteri penyakit kulit Pseudomonas aeruginosa,
Staphylococcus epidermidis, dan Micrococcus. Journal of Marine Research. 1(2): 152-160.
Siswati J. 2002. Kajian ekstraksi alginat dari rumput laut sargassum sp. serta aplikasinya sebagai penstabil es krim [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Srikandace Y, Hapsari Y, Simanjuntak P. 2007. Seleksi mikroba endofit Curcuma zedoaria dalam memproduksi senyawa kimia antimikroba. Jurnal Ilmu Kefarmasian Indonesia. 5(2):77-84.
Thomas NV, Kim SK. 2013. Beneficial effects of marine algal compounds in cosmeceuticals. Marine Drugs. 11: 146-164.
Toskas G, Hund RD, Laourine E, Cherif C, Smyrniotopoulos V, Roussis V. 2011. Nanofibers based on polysaccharides from the green seaweed Ulva Rigida.
Carbohydrate Polymers. 84: 1093–1102.
Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor (ID): M-Brio Press. hlm 32-33.
Winarno FG. 2010. Enzim Pangan. Bogor (ID): M-Brio Press. hlm 65-73.
Wu X, Jiang W, Lu J, Yu Y, Wu B. 2014. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry. Food Chemistry. 145: 976–983.
Yuan L, Wang W, Pei Y, Lu F. 2012. Screening and identification of cellulase-producing strain of Fusarium oxysporum. Procedia Environmental Science, 12: 1213-1219.
Yunizal. 2004. Teknologi Pengolahan Alginat. Jakarta (ID): Pusat Riset Pengolahan Produk dan Sosial Ekonomi Kelautan dan Perikanan. hlm: 1-66.
21
23
Lampiran 1 Dokumentasi penelitian
Proses hidrolisis
Pengeringan Sentrifugasi
Presipitasi Filtrasi
Hidrolisat dilarutkan dalam akuades
Hasil uji aktivitas inhibitor tirosinase hidrolisat
24
Lampiran 2 Contoh perhitungan rendemen hidrolisat Sargassum sp. (CP 01)
Bobot sampel awal (gram)
Bobot hidrolisat kering/5 mL hidrolisat cair (gram)
Rendemen (gram/mL)
Rendemen (%)
5 0,039 0,0078 15,60
5 0,0496 0,0099 19,84
Rendemen (%) =Rendemen (gram /mL ) x 100 mL
Bobot sampel awal (gram) x 100%
= 0,0078 gram /mL x 100 mL
5 gram x 100%
25
Lampiran 3 Perhitungan IC50 hidrolisat Sargassum sp. (CP 01) pada substrat
L-Tirosin
Ulangan I
Grafik data percobaan dan garis regresi IC50 hidrolisat Sargassum sp. (CP 01)
pada substrat L-Tirosin
IC50 = Exp[(50+161,07)/43,966]
= 121,60 µg/mL
Ulangan II
Grafik data percobaan dan garis regresi IC50 hidrolisat Sargassum sp. (CP 01)
26
Lampiran 4 Perhitungan IC50 hidrolisat Sargassum sp. (CP 01) pada substrat
L-DOPA
Ulangan I
Grafik data percobaan dan garis regresi IC50 hidrolisat Sargassum sp. (CP 01)
pada substrat L-DOPA
IC50 = (50-16,111)/0,0875
= 387,30 µg/mL
Ulangan II
Grafik data percobaan dan garis regresi IC50 hidrolisat Sargassum sp. (CP 01)
27
Lampiran 5 Perhitungan IC50 arbutin pada substrat L-Tirosin
Ulangan I
Grafik data percobaan dan garis regresi IC50 arbutin pada substrat L-Tirosin
IC50 = Exp[(50+117,71)/25,06]
= 14,91 µg/mL
Ulangan II
Grafik data percobaan dan garis regresi IC50 arbutin pada substrat L-Tirosin
29
RIWAYAT HIDUP
Penulis dilahirkan di Banyumas pada tanggal 28 Juli 1993 sebagai anak pertama dari tiga bersaudara dari Bapak Mustoyo dan Ibu Musriah. Tahun 2011 penulis lulus dari SMA Negeri Jatilawang dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan dan diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Bioteknologi Hasil Perairan pada tahun ajaran 2014/2015 dan 2015/2016, asisten praktikum Teknologi Industri Tumbuhan Laut tahun ajaran 2014/2015, dan asisten praktikum Dasar-Dasar Farmaseutika Hasil Perairan tahun ajaran 2014/2015. Penulis juga pernah aktif sebagai siswa pada organisasi IPB Political School (IPS) periode 2011/2012, dan pada periode 2012/2013 penulis aktif sebagai staf Divisi Kreasi di organisasi tersebut. Penulis juga aktif sebagai staf Divisi Periklanan di majalah Emulsi periode 2012/2013, dan pada periode 2013/2014 aktif sebagai Ketua Divisi Periklanan di majalah tersebut. Periode 2012/2013 penulis juga aktif sebagai staf Divisi Kajian Strategis dan Aksi BEM Fakultas Perikanan dan Ilmu Kelautan. Selain itu, penulis juga aktif sebagai staf Divisi Keilmuan Himpunan Profesi Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) periode 2013/2014.