ANALISIS KANDUNGAN NITROGEN DINDING SEL PADA
SUMBER PAKAN HIJAUAN DAN HUBUNGANNYA
DENGAN PENCERNAAN PROTEIN DI RUMEN
SECARA
IN VITRO
SARI PUTRI DEWI
ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Kandungan Nitrogen Dinding Sel pada Sumber Pakan Hijauan dan Hubungannya dengan Pencernaan Protein di Rumen secara in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Sari Putri Dewi
ABSTRAK
SARI PUTRI DEWI. Analisis Kandungan Nitrogen Dinding Sel pada Sumber Pakan Hijauan dan Hubungannya dengan Pencernaan Protein di Rumen secara in Vitro. Dibimbing oleh MUHAMMAD RIDLA dan ANURAGA JAYANEGARA.
Penelitian ini bertujuan untuk mempelajari hubungan antara kandungan nitrogen dinding sel, proksimat, dan serat Van Soest dengan kecernaan protein pakan di rumen. Hijauan yang digunakan dalam penelitian ini adalah gamal, trikantera, indigofera, kaliandra, daun pepaya, daun singkong, dan lamtoro. Analisis yang dilakukan meliputi proksimat untuk mengukur kadar air, abu, protein kasar, serat kasar, lemak kasar, Van Soest untuk mengukur NDF (Neutral Detergent Fibre) dan ADF (Acid Detergent Fibre), NDICP (Neutral Detergent Insoluble Crude Protein) dan ADICP (Acid Detergent Insoluble Crude Protein), in vitro untuk mengukur DBK (degradasi bahan kering), DBO (degradasi bahan organik), KCBK (kecernaan bahan kering), KCBO (kecernaan bahan organik), KCPK (kecernaan protein kasar), NH3 (amonia), VFA (Volatile Fatty Acid). Hasil penelitian menunjukkan bahwa daun singkong memiliki protein kasar tertinggi, kadar NDICP tertinggi, ADICP terendah serta KCPK yang cukup tinggi berarti daun singkong merupakan sumber pakan hijauan yang baik untuk ruminansia. Kata kunci: ADICP, KCPK, NDICP
ABSTRACT
SARI PUTRI DEWI. Cell Wall Nitrogen Content Analysis in Forages and Its Correlation with Protein Digestion in Rumen by in Vitro Fermentation. Supervised by MUHAMMAD RIDLA and ANURAGA JAYANEGARA.
The purpose of this experiment was to study regarding the correlation between the nitrogen content of the cell wall, proximate components, and fibre Van Soest components with feed protein digestibility in the rumen. The materials which used in this research are leaves of gamal, trikantera, indigofera, kaliandra, daun pepaya, daun singkong, and lamtoro. Proximate analysis is conducted to measure the content of water, ash, crude protein, crude fibre, and crude fat that contain in the sample. Van Soest analysis is conducted to measure the value of NDF (Neutral Detergent Fibre), ADF (Acid Detergent Fibre), NDICP (Neutral Detergent Insoluble Crude Protein), and ADICP (Acid Detergent Insoluble Crude Protein). In vitro analysis is conducted to measure the degradation and digestibility’s value of dry material and organic material, and also the value of crude protein digestibility, NH3 and VFA (Volatile Fatty Acid) components. The
result of this research showed that cassava leaves (Manihot utilisima) has the highest level of crude protein and NDICP, the lowest level of ADICP and also high enough level of KCPK. It can be concluded that cassava leaves are the best forage in this research for ruminant.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
ANALISIS KANDUNGAN NITROGEN DINDING SEL PADA
SUMBER PAKAN HIJAUAN DAN HUBUNGANNYA
DENGAN PENCERNAAN PROTEIN DI RUMEN
SECARA
IN VITRO
SARI PUTRI DEWI
ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Analisis Kandungan Nitrogen Dinding Sel pada Sumber Pakan Hijauan dan Hubungannya dengan Pencernaan Protein di Rumen secara in Vitro
Nama : Sari Putri Dewi NIM : D24100004
Disetujui oleh
Dr Ir Muhammad Ridla, MAgr Pembimbing I
Dr Anuraga Jayanegara, SPt, MSc Pembimbing II
Diketahui oleh
Prof Dr Ir Panca Dewi Manu Hara Karti, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul Analisis Kandungan Nitrogen Dinding Sel pada Sumber Pakan Hijauan dan Hubungannya dengan Pencernaan Protein di Rumen secara in Vitro berdasarkan penelitian yang dilakukan penulis bulan September 2013 hingga April 2014 di Laboratorium Ilmu dan Teknologi Pakan dan Laboratorium Nutrisi Ternak Perah, Fakultas Peternakan, Institut Pertanian Bogor.
Penelitian ini bertujuan untuk mempelajari hubungan antara kandungan nitrogen dinding sel, komponen proksimat dan komponen serat Van Soest dengan kecernaan protein pakan di rumen. Penelitian ini menggunakan tujuh jenis hijauan antara lain gamal, trikantera, indigofera, kaliandra, daun pepaya, daun singkong dan lamtoro. Skripsi ini merupakan salah satu syarat untuk kelulusan dan memperoleh gelar Sarjana Peternakan di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
PENDAHULUAN 1
MATERI DAN METODE 2
Materi 2
Bahan 2
Peralatan 2
Waktu dan Lokasi Penelitian 2
Prosedur 2
Persiapan Sampel 2
Analisis Proksimat 3
Kadar air (AOAC 2005) 3
Kadar abu (AOAC 2005) 3
Kadar protein kasar (AOAC 2005) 3
Kadar serat kasar (AOAC 2005) 4
Kadar lemak kasar (AOAC 2005) 4
Analisis Van Soest 4
Neutral Detergent Fibre (NDF) (Van Soest 1991) 4
Acid Detergent Fibre (ADF) (Van Soest 1991) 5
Neutral Detergent Insoluble Crude Protein (NDICP) 5
Acid Detergent Insoluble Crude Protein (ADICP) 5
Analisis in vitro 5
Fermentasi tahap I (Tilley dan Terry 1966) 5
Pengukuran konsentrasi NH3 (Tilley dan Terry 1966) 6 Pengukuran konsentrasi VFA (Tilley dan Terry 1966) 6 Pengukuran DBK dan DBO (Tilley dan Terry 1966) 7 Pengukuran KCBK dan KCBO (Tilley dan Terry 1966) 7
Rancangan Percobaan dan Analisis Data 8
Jenis Hijauan yang Digunakan 8
Peubah yang Diamati 8
HASIL DAN PEMBAHASAN 8
Analisis Proksimat Bahan Pakan Hijauan 8
Analisis Van Soest Bahan Pakan Hijauan 10
Analisis Kecernaan Bahan Pakan Hijauan 11
Korelasi NDICP dan ADICP dengan KCPK 13
SIMPULAN DAN SARAN 15
Simpulan 15
DAFTAR ISI (lanjutan)
DAFTAR PUSTAKA 15
LAMPIRAN 18
RIWAYAT HIDUP 25
DAFTAR TABEL
1 Hasil analisis proksimat bahan pakn hijauan 8
2 Hasil analisis Van Soest bahan pakan hijauan 10
3 Hasil analisis kecernaan bahan pakan hijauan 11
4 Produksi amonia dan VFA setelah fermentasi secara in vitro 12
DAFTAR GAMBAR
1 Hubungan NDICP dengan KCPK pada pakan hijauan 14
2 Hubungan antara ADICP dan KCPK pada pakan hijauan 14
DAFTAR LAMPIRAN
1. Pengaruh kecernaan bahan kering terhadap hijauan 18 2. pengaruh kecernaan bahan organik terhadap hijauan 19 3. pengaruh kecernaan protein kasar terhadap hijauan 20 4. pengaruh degradasi bahan kering terhadap hijauan 21 5. pengaruh degradasi bahan organik terhadap hijauan 22
6. pengaruh amonia terhadap hijauan 23
1
PENDAHULUAN
Pakan ternak dapat berupa bahan organik maupun anorganik yang sebagian atau seluruhnya dapat dicerna tanpa mengganggu kesehatan ternak dan memiliki kandungan nutrien yang sesuai dengan kebutuhan ternak (Sutardi 1980). Salah satu kandungan nutrien penting dan harus tersedia dalam bahan pakan adalah protein. Peran protein dalam pembentukan biomolekul lebih penting dibandingkan dengan makronutrien lainnya seperti karbohidrat dan lemak, maka protein dapat dipakai sebagai sumber energi ketika tubuh kekurangan energi (Sudarmadji 1989). Protein memiliki unsur utama yaitu nitrogen yang merupakan 16% dari berat protein (NRC 2001). Namun untuk senyawa protein tertentu yang telah diketahui kadar unsur N-nya, maka dapat digunakan angka yang lebih tepat seperti susu, faktor perkalian yang digunakan adalah 6.38 (Sudarmadji 1989). Kadar protein dalam pakan dapat ditera dengan menentukan jumlah nitrogen total yang dikandung suatu bahan. Penentuan kadar protein dikembangkan Kjeldahl pada tahun 1883 dan disebut dengan kadar protein kasar.
Pakan dengan kadar protein kasar tinggi diyakini sebagai pakan dengan kualitas lebih baik dibandingkan dengan pakan yang mengandung kadar protein kasar lebih rendah. Namun tidak selalu dapat dimanfaatkan oleh ternak, terutama ruminansia. Ternak ruminansia dapat memanfaatkan protein asal pakan dan mensintesis protein sendiri dengan bantuan mikroba di dalam rumen. Protein pakan dan NPN yang dikonsumsi ruminansia sebagian mengalami degradasi di dalam rumen menjadi ammonia dan sebagian protein lainnya tahan terhadap degradasi rumen dan dapat mencapai pascarumen. Protein tahan degradasi rumen yang dapat dicerna oleh enzim pencernaan pascarumen akan menyediakan asam amino untuk diserap di dalam usus dan dimanfaatkan oleh ternak (Lee at al. 2001).
Kecernaan protein bergantung pada jenis bahan dan proses dari bahan pakan tersebut. Bahan pakan sumber protein yang berkualitas namun memiliki tingkat degradasi rumen yang terlalu tinggi perlu dilakukan perlindungan seperti pelapisan tanin (Puastuti et al. 2006). Protein tahan degradasi rumen memiliki kecernaan pascarumen yang rendah atau bahkan tidak dapat dicerna tidak akan menyediakan asam amino untuk tubuh, sehingga menjadi kurang bermanfaat bagi ternak yang mengkonsumsi (Puastuti 2005). Utilisasi protein pakan dapat ditentukan apabila jumlah nitrogen yang terikat pada dinding sel pakan dianalisis dan dikuantifikasi.
2
Penelitian ini bertujuan melakukan analisis nitrogen dinding sel pada sumber pakan hijauan, melakukan analisis kecernaan pakan melalui uji in vitro
menggunakan cairan rumen berbuffer, serta melakukan studi korelasi antara kandungan nitrogen dinding sel, komponen proksimat, dan komponen serat Van Soest dengan kecernaan protein pakan di rumen.
MATERI DAN METODE
Materi Bahan
Bahan yang digunakan dalam penelitian ini antara lain tujuh sampel hijauan meliputi gamal (Gliricidia sepium), Trichantera gigantea, indigofera (Indigofera sp.), kaliandra (Calliandra calothyrsus), daun pepaya (Carica papaya), daun singkong (Manihot utilisima), dan lamtoro (Leucaena leucocephala), larutan acid detergent solution (ADS), larutan neutral detergent solution (NDS), larutan aseton, larutan McDougall, cairan rumen sapi berfistula yang diperoleh dari LIPI Cibinong, larutan pepsin HCl 0.2%, larutan HgCl2 jenuh, larutan NaCO3 jenuh, larutan H2SO4 0.005 N, asam borat berindikator, larutan HCl 0.5 N, larutan H2SO4 15%, larutan NaOH 0.5 N, larutan Indikator PP 0.1%, vaselin tawar.
Peralatan
Peralatan yang digunakan adalah oven, buret, gelas beaker, hot plate, tanur, cawan porselen, labu destruksi, vacuum pump, termos, buret 50 mL, magnetic stirrer, shaker bath, sentrifugasi, cawan Conway, gas CO2, tabung fermentor, labu erlenmeyer.
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan di Laboratorium Ilmu dan Teknologi Pakan, Laboratorium Nutrisi Ternak Perah, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor pada bulan September 2013 sampai dengan April 2014.
Prosedur Persiapan Sampel
3 Analisis Proksimat
Kadar air (AOAC 2005). Cawan sebelumnya telah dipanaskan sekitar 1 jam pada oven 105 °C kemudian didinginkan dalam eksikator dan ditimbang berat cawan. Sampel ditimbang sebanyak 5 g dan dimasukkan ke dalam cawan, lalu cawan dan sampel tersebut dimasukkan ke dalam oven 105 °C selama sekitar 4-6 jam (sampai tercapai bobot tetap). Lalu cawan diangkat dan didinginkan dalam eksikator. Setelah itu ditimbang beratnya. Kadar air ditentukan menggunakan rumus :
Kadar air (%) = (
) x 100%
Kadar abu (AOAC 2005). Cawan sebelumnya telah dipanaskan pada tanur pada tanur 400-600 °C, kemudian didinginkan dalam eksikator, lalu berat cawan ditimbang. Sampel ditimbang sebanyak 5 g dan dimasukkan ke dalam cawan lalu ditimbang. Sampel dibakar di atas hot plate sampai tidak berasap sekitar 3 jam, lalu dimasukkan ke dalam tanur. Setelah itu diangkat dan didinginkan dalam eksikator dan ditimbang beratnya. Kadar abu ditentukan menggunakan rumus : Kadar abu (%) = (
) x 100%
Kadar protein kasar (AOAC 2005). Sampel ditimbang sebanyak 0.3 g, lalu ditambahkan 1.5 g katalis selenium mixture. Lalu dimasukkan ke dalam labu Kjeldahl dan ditambahkan 20 mL H2SO4 pekat. Destruksi dilakukan sampai warna larutan menjadi hijau-kekuningan-jernih, lalu didinginkan sekitar 15 menit, kemudian ditambahkan 300 mL aquades dan didinginkan kembali. Setelah itu ditambahkan 100 mL NaOH 40%, lalu dilakukan destilasi. Hasil destilasi ditampung dengan dengan 10 mL H2SO4 0.1 N yang sudah ditambah 3 tetes indikator campuran methylen blue dan methylen red. Setelah itu dilakukan titrasi dengan NaOH 0.1 N sampai terjadi perubahan warna dari ungu menjadi biru-kehijauan. Penetapan blanko dengan cara dipipet 10 mL H2SO4 0.1 N dan ditambah 2 tetes indikator PP, lalu dititrasi dengan NaOH 0.1 N. Kadar protein kasar ditentukan menggunakan rumus :
Kadar protein kasar (%) = (
4
Kadar serat kasar (AOAC 2005). Sampel ditimbang sebanyak 1 g lalu dimasukkan ke dalam gelas piala kemudian dimasukkan ke alat heater extract. Sebanyak 50 mL H2SO4 0.3 N dipanaskan selama 30 menit. Kertas saring yang telah dipanaskan dalam oven 105 °C selama 1 jam kemudian ditimbang. Cairan disaring menggunakan kertas saring ke dalam corong Buchner. Penyaringan tersebut dilakukan dengan labu pengisap yang dihubungkan dengan pompa vakum atau pancar air. Lalu dicuci berturut-turut menggunakan 50 mL air panas, 50 mL H2SO4 0.3 N dan 25 mL aseton. Kertas saring beserta isinya dimasukkan ke dalam cawan porselen dan dimasukkan ke dalam oven 105 °C selama 1 jam. Setelah itu diangkat dan didinginkan dalam eksikator kemudian ditimbang. Setelah itu dimasukkan kembali cawan ke dalam tanur, diangkat, didinginkan, dan ditimbang. Kadar serat kasar ditentukan menggunakan rumus :
Kadar serat kasar (%) =
( –
) x 100%
Kadar lemak kasar (AOAC 2005). Labu penyari disiapkan dengan batu didih di dalamnya yang sebelunya telah dipanaskan pada suhu 105 °C dan didinginkan di dalam eksikator kemudian ditimbang labu penyari. Sampel ditimbang sebanyak 1 g, kemudian dimasukkan ke dalam selongsong penyari, lalu ditutup menggunakan kapas tidak berlemak. Setelah itu selongsong penyari dimasukkan ke dalam alat soxlet lalu disari menggunakan petroleum benzin. Selanjutnya eksikator dihubungkan dengan kondensor. Proses ini dilakukan menggunakan alat FATEX-S. Labu dimasukkan ke dalam oven 105 °C sampai bobot tetap (sekitar 4-6 jam), diangkat dan didinginkan dalam eksikator. Bobot akhir ditimbang.
Kadar lemak kasar (%) = ( –
) x 100%
Analisis Van Soest
Neutral detergent fibre (NDF) (Van Soest 1991). Sampel ditimbang sebanyak 0.5-1 g (kering udara dan sudah digiling) lalu dimasukkan ke dalam gelas beaker 600 mL dan ditambahkan sebanyak 100 mL larutan detergen netral dan 2-3 tetes dekalin. Setelah itu dipanaskan selama 5 sampai 6 menit sampai mulai panas kemudian dihitung waktu pemanasannya selama 60 menit sambil di reflux dengan aliran air. Setelah 60 menit pendidihan, beaker diambil dari pemanas dan dibiarkan sebentar supaya bahan padatan mengendap di bawahnya. Gelas saring disiapkan pada tempatnya dan dipanaskan dengan air mendidih. Bahan larutan disaring secara pelan-pelan mulai dari bahan cairan yang terlarut dengan vakum yang rendah dayanya. Pada bagian padatannya bisa dimasukkan ke saringan sambil dibilas dengan air mendidih sampai semua sampel habis masuk ke gelas saring.
5 disimpan semalam apabila analisis dilanjutkan hari berikutnya) pada suhu 105 °C dalam oven yang dilengkapi dengan sistem kipas. Setelah ditimbang akan didapatkan berat kering residu NDF, kemudian sampel dibakar dalam tanur 500 °C cukup selama 3 jam. Pindahkan ke dalam oven sampai suhunya kembali menjadi 105 °C kemudian ditimbang. Bahan yang tersisa pada gelas penyaring adalah abu dari dinding sel.
NDF (%) = ( –
) x 100%
Acid detergent fibre (ADF) (Van Soest 1991). Prosedurnya sama dengan NDF namun hanya berbeda pada pelarutnya. Pada ADF digunakan larutan detergen asam.
ADF (%) = ( –
) x 100%
Neutral detergent insoluble crude protein (NDICP). Prosedur NDF dilakukan terlebih dahulu, kemudian dilakukan uji protein kasar Kjeldahl pada residu NDF.
NDICP (BK%) = (
) x % NDF
NDICP (PK%) = (
) x 100%
Acid detergent insoluble crude protein (ADICP). Prosedur ADF dilakukan terlebih dahulu, kemudian dilakukan uji protein kasar Kjeldahl pada residu ADF.
ADICP (BK%) = (
) x % ADF
ADICP (BK%) = (
) x 100%
Analisis in vitro
6
Pengukuran konsentrasi NH3 (Tilley dan Terry 1966). Konsentrasi NH3 dalam cairan rumen menggunakan metode mikrodifusi Conway (General Laboratory Procedure 1966). Bibir cawan Conway dan tutup cawan diolesi dengan vaselin. Supernatan yang berasal dari proses fermentasi diambil 1.0 mL kemudian ditempatkan pada salah satu ujung alur cawan Conway. Larutan Na2CO3 jenuh sebanyak 1.0 mL ditempatkan pada salah satu ujung cawan Conway bersebelahan dengan supernatan (tidak boleh campur). Larutan asam borat berindikator sebanyak 1.0 mL ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway. Cawan conway yang sudah diolesi vaselin ditutup rapat hingga kedap udara, larutan Na2CO3 dicampur dengan supernatan hingga merata dengan cara menggoyang–goyangkan dan memiringkan cawan tersebut. Setelah itu dibiarkan selama 24 jam dalam suhu kamar. Setelah 24 jam suhu kamar dibuka, asam borat berindikator dititrasi dengan H2SO4 0.005 N sampai terjadi perubahan warna dari biru menjadi merah.
N NH3 ( mM ) =
Pengukuran konsentrasi VFA (Tilley dan Terry 1966). Konsentrasi total VFA ditentukan menggunakan Steam Destilation Method (General Laboratory Procedure 1966). Presscooker diisi dengan aquades sampai tanda MAX. Kemudian dipastikan air dari kran mengalir yang berfungsi sebagai pendingin. Kompor gas dinyalakan, sehingga aquades yang ada dalam panic presscooker
tersebut mendidih dan menghasilkan uap yang akan masuk ke tabung-tabung destilasi, hal ini menandakan bahwa kita bisa memulai analisis VFA. Supernatan yang sama dengan analisis NH3 diambil sebanyak 5 mL, kemudian dimasukkan ke dalam tabung destilasi. Setelah itu ditempatkan labu erlenmeyer yang berisi 5 mL NaOH 0.5 N di bawah selang tampungan. Sebanyak 1 mL H2SO4 15% ditambahkan ke tabung destilasi yang sudah ada larutan sampel, kemudian segera ditutup penutup kacanya, kemudian dibilas dengan aquades secukupnya. Uap air panas akan mendesak VFA dan akan terkondensasi dalam pendingin. Air yang terbentuk ditampung labu erlenmeyer yang berisi 5 mL NaOH 0.5N sampai mencapai 300 mL. Indikator PP (Phenol Pthalin) ditambah sebanyak 2–3 tetes dan dititrasi dengan HCl 0.5 N sampai warna titrat berubah dari merah menjadi merah muda seulas. Catatan : HCl 0,5 N sebagai titran harus distandarisasi sehingga didapat konsentrasi dengan 4 digit dibelakang koma.
mM VFA total =
Keterangan :
a = volume HCl blanko pereaksi (hanya H2SO4 dan NaOH saja, tanpa sampel)
7 Pengukuran DBK dan DBO (Tilley dan Terry 1966). Pengukuran DBK dan DBO menggunakan metode Tilley dan Terry (1966). Tabung fermentor yang telah diisi dengan 0.5 g sampel, ditambahkan 40 mL larutan McDougall. Tabung dimasukkan ke dalam shaker bath dengan suhu 39 °C, kemudian diisi cairan rumen 10 ml, tabung dikocok dengan dialiri CO2 selama 30 detik, dicek pH (6.5– 6.9) dan kemudian ditutup dengan karet berventilasi dan difermentasi selama 48 jam. Setelah 48 jam, dibuka tutup karet tabung fermentor dan diteteskan 2-3 tetes HgCl2 untuk membunuh mikroba. Tabung fermentor dimasukkan ke dalam sentrifugasi, dilakukan sentrifugasi dengan kecepatan 4 ribu rpm selama 10 menit. Substrat akan terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas. Substrat atau residu dimasukkan ke dalam cawan. Setelah 24 jam, cawan porselen dan residu dikeluarkan, dimasukkan ke dalam eksikator dan ditimbang untuk mengetahui kadar bahan keringnya. Selanjutnya bahan dalam cawan dipijarkan atau diabukan dalam tanur listrik selama 6 jam pada suhu 450–600 °C, kemudian ditimbang untuk mengetahui kadar bahan organiknya.
DBK (%) = (
) x 100%
DBO (%) =
(
)x100%
Pengukuran KCBK dan KCBO (Tilley dan Terry 1966). Kecernaan Bahan Kering (KCBK) dan Bahan Organik (KCBO) mengacu pada metode Tilley dan Terry (1966). Tabung fermentor yang telah diisi dengan 0.5 g sampel, ditambahkan 40 mL larutan McDougall. Tabung dimasukkan ke dalam shaker bath dengan suhu 39 °C, kemudian diisi cairan rumen 10 mL, tabung dikocok dengan dialiri CO2 selama 30 detik, dicek pH (6.5–6.9), kemudian ditutup dengan karet berventilasi, dan difermentasi selama 48 jam. Setelah 48 jam, dibuka tutup karet tabung fermentor, diteteskan 2-3 tetes HgCl2 untuk membunuh mikroba. Tabung fermentor dimasukkan ke dalam sentifugasi kemudian dilakukan sentrifugasi dengan kecepatan 4 ribu rpm selama 10 menit. Substrat akan terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas. Supernatan dibuang dan endapan hasil sentrifugasi pada kecepatan 4 ribu rpm selama 15 menit ditambahkan 50 mL larutan pepsin-HCl 0.2%. Campuran ini lalu diinkubasi kembali selama 48 jam tanpa tutup karet. Sisa pencernaan disaring dengan kertas saring Whatman no. 41 (yang sudah diketahui bobotnya) dengan bantuan pompa vakum. Endapan yang ada di kertas saring dimasukkan ke dalam cawan porselen, setelah itu dimasukkan ke dalam oven 105 °C selama 24 jam. Setelah 24 jam, cawan porselen dan kertas saring dan residu dikeluarkan, dimasukkan ke dalam eksikator dan ditimbang untuk mengetahui kadar bahan keringnya. Selanjutnya bahan dalam cawan dipijarkan atau diabukan dalam tanur listrik selama 6 jam pada suhu 450–600 °C, kemudian ditimbang untuk mengetahui kadar bahan organiknya. Sebagai blanko dipakai residu asal fermentasi tanpa bahan pakan.
% KCBK = (
8
% KCBO = (
) x 100%
Rancangan Percobaan dan Analisis Data
Bahan pakan yang diuji dengan analisis proksimat, Van Soest dan analisis nitrogen dinding sel menggunakan analisis data secara deskriptif.
Analisis in vitro menggunakan rancangan acak kelompok dengan 7 jenis bahan pakan dan 3 kali ulangan untuk setiap peubah yang diamati, dengan rumus :
Yij = μ + τi + βj+ εij Keterangan:
Yij = Pengamatan pada perlakuan ke-i dan kelompok ke-j μ = Rataan umum
τi = Pengaruh perlakuan ke-i βj = Pengaruh kelompok ke-j
εij = Error (galat) perlakuan ke-i kelompok ke-j Jenis Hijauan yang Digunakan
1. Gamal (Gliricidia sepium)
2. Trikantera (Trichantera gigantea) 3. Indigofera (Indigofera sp.)
4. Kaliandra (Calliandra calothyrsus) 5. Daun pepaya (Carica papaya) 6. Daun singkong (Manihot utilisima) 7. Lamtoro (Leucaena leucocephala) Peubah yang Diamati
Peubah yang diamati pada penelitian ini meliputi komposisi kimia yang terdiri atas berat kering (BK), kadar abu, protein kasar (PK), serat kasar (SK), lemak kasar (LK), NDF, ADF, NDICP, ADICP dan komponen kecernaan yang terdiri dari degradasi bahan kering (DBK), degradasi bahan organik (DBO), kecernaan bahan kering (KCBK), kecernaan bahan organik (KCBO), kecernaan protein kasar (KCPK), amonia (NH3), dan Volatile Fatty Acid (VFA). Data yang diperoleh dianalisis menggunakan Excell untuk data analisis proksimat dan Van Soest. Analisis ragam ANOVA untuk analisis in vitro, jika menunjukkan perbedaan yang signifikan dilanjutkan dengan uji lanjut Duncan. Analisis korelasi dan regresi untuk melihat hubungan kandungan nitrogen dinding sel dengan kecernaan protein pakan di rumen.
HASIL DAN PEMBAHASAN
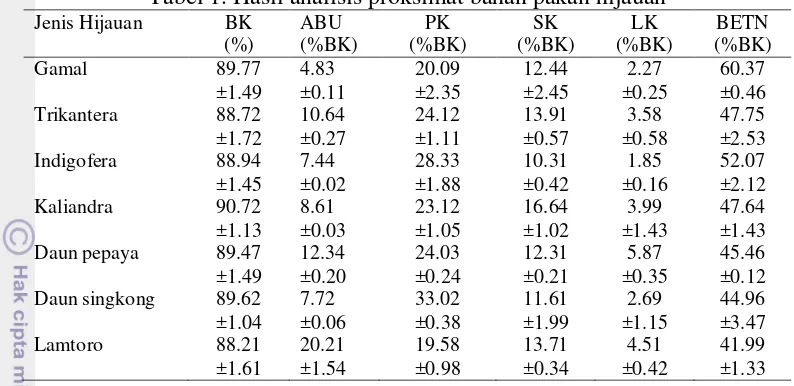
Analisis Proksimat Bahan Pakan Hijauan9 Tabel 1. Hasil analisis proksimat bahan pakan hijauan
Jenis Hijauan BK BK= bahan kering, PK = protein kasar, SK = serat kasar, LK = lemak kasar, BETN = bahan ekstrak tanpa nitrogen.
Hal ini berarti bahan kering hijauan yang digunakan pada penelitian tergolong tinggi dan memiliki kadar air yang rendah. Bahan kering hijauan yang tinggi disebabkan oleh sampel hijauan pada penelitian ini berasal dari hijauan dengan pengeringan terlebih dahulu oleh sinar matahari lalu digiling setelah itu dilakukan analisis. Sehingga kadar bahan kering sampel akan berbeda bila dibandingkan bahan kering pada kondisi segar. Analisis kadar abu bertujuan memisahkan bahan organik dan bahan anorganik. Hasil penelitian menunjukkan bahwa kadar abu yang terkandung dalam hijauan cukup tinggi dan hijauan dengan kadar abu paling tinggi adalah lamtoro. Menurut (FAO 2007) lamtoro memiliki kadar abu sekitar 19% dan paling tinggi dibandingkan dengan hijauan lain.
10
adalah kaliandra dan yang terendah adalah indigofera. Hassen et al. (2007) menyatakan indigofera memiliki serat yang rendah yaitu 10%-15%. Hendrawan (2002) mengungkapkan serat kasar kaliandra berkisar 30%-75% sehingga mampu mengungguli hijauan pakan ternak lainnya seperti gamal dan lamtoro.
Hasil penelitian menunjukkan bahwa indigofera memiliki kadar lemak paling rendah dibandingkan hijauan lain pada penelitian ini. Bahan tersebut selain mempunyai kandungan lemak yang rendah juga kandungan serat yang cukup tinggi sehingga ikatan partikel lignin di dalamnya sulit terlarut dalam petroleum. Hasil penelitian menunjukkan bahwa gamal memiliki kadar Bahan Ekstrak Tanpa Nitrogen yang paling tinggi.
Analisis Van Soest Bahan Pakan Hijauan
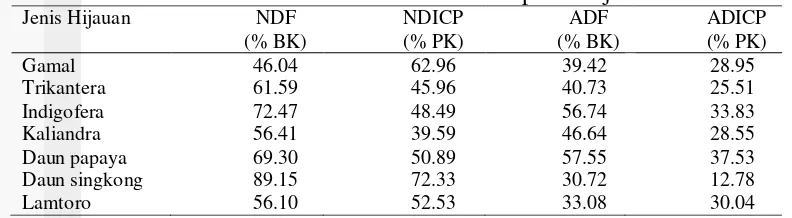
Metode analisis Van Soest mendefinisikan serat kasar sebagai bahan yang masih tertinggal setelah bahan pakan direbus dalam asam dan basa. Serat kasar mengandung fraksi-fraksi selulosa, hemiselulosa dan lignin yang dikategorikan sebagai fraksi penyusun dinding sel tanaman. Analisis Van Soest membagi fraksi hijauan berdasarkan kelarutan dalam detergen yang terdiri atas 2 bagian yaitu (1) sistem netral untuk mengukur total serat atau serat yang tidak larut dalam detergen netral (NDF), (2) sistem detergen asam digunakan untuk mengisolasi selulosa tidak larut dan lignin serta beberapa komponen lain yang terikat dengan keduanya (ADF). Hasil analisis Van Soest bahan pakan hijauan disajikan pada Tabel 2.
Tabel 2 memperlihatkan bahwa nilai ADF hijauan lebih kecil dibandingkan dengan nilai NDF. Hal ini karena ADF merupakan bagian dari NDF yang terdiri dari lignin dan selulosa. Selain itu pada ADF tidak terdapat hemiselulosa.
Tabel 2. Hasil analisis Van Soest bahan pakan hijauan
Jenis Hijauan NDF
insoluble crude protein, ADICP =acid detergent insoluble crude protein.
11
Neutral Detergent Insoluble Crude Protein (NDICP) merupakan protein dalam residu NDF, termasuk protein tahan degradasi rumen yang tersedia untuk ternak. Selain itu merupakan komponen serat yang dapat dicerna dari NDF. Hasil penelitian menunjukkan bahwa daun singkong memiliki nilai NDICP tertinggi, berarti kandungan protein yang dimiliki daun singkong tahan terhadap degradasi rumen. Ravindran (1992) mengungkapkan daun singkong memiliki hampir 85% dari fraksi protein kasar merupakan protein murni. Snifen et al. (1992) menjelaskan bahwa senyawa protein murni termasuk ke dalam kelompok yang tidak larut dan terdegradasi lebih lambat (fraksi B2). Acid Detergent Insoluble Crude Protein (ADICP) merupakan protein terikat untuk fraksi ADF pakan atau dapat juga dikatakan sebagai fraksi protein tidak larut yang tidak tersedia untuk hewan karena kerusakan panas. Hasil penelitian ini menunjukkan bahwa daun pepaya memiliki nilai ADICP tertinggi artinya daun pepaya memiliki protein yang terikat di dinding sel paling banyak dan protein yang lebih tahan terhadap degradasi rumen dibandingkan dengan hijauan lain.
Analisis Kecernaan Bahan Pakan Hijauan
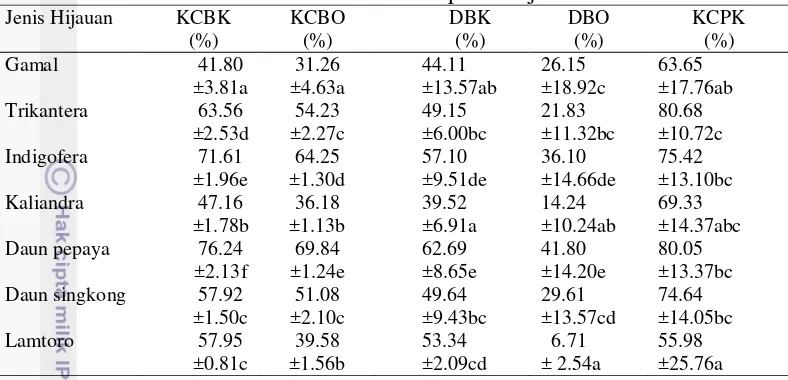
Metode in vitro Tilley dan Terry (1966) menggunakan sistem pencernaan dua tahap yaitu pertama dengan simulasi pencernaan fermentatif dalam rumen dan simulasi pencernaan di dalam organ pencernaan pascarumen. Analisis in vitro
untuk menentukan kecernaan bahan kering, kecernaan bahan organik, degradasi bahan kering, degradasi bahan organik, serta kecernaan protein kasar disajikan pada Tabel 3. Tabel 3 memperlihatkan nilai kecernaan bahan kering yang bervariasi pada kisaran 41.80%–76.24%. Perbedaan nilai kecernaan bahan kering pakan dipengaruhi kadar protein bahan karena setiap fraksi protein memiliki kelarutan dan degradasi yang berbeda sehingga mempengaruhi perombakan protein tersebut dalam rumen dan mengakibatkan perbedaan kecernaan dalam rumen serta organ pascarumen (Sutardi 1979). Hasil penelitian menunjukkan kecernaan bahan kering tertinggi diperoleh daun pepaya. Hal ini karena daun pepaya mengandung enzim papain yang berfungsi hampir sama dengan enzim protease dalam saluran pencernaan (Sarjuni 2006). Daun pepaya memiliki protein tahan degradasi rumen tinggi sehingga mikroba rumen belum mampu mendegradasinya.
12
Tabel 3. Hasil analisis kecernaan bahan pakan hijauan secara in vitro Jenis Hijauan KCBK Huruf berbeda pada setiap kolom untuk satu hasil penelitian menunjukkan berbeda nyata (P<0.05), KCBK= kecernaan bahan kering, KCBO = kecernaan bahan organik, DBK = degradasi bahan kering, DBO = degradasi bahan organik, KCPK = kecernaan protein kasar.
Orskov (1992) menyatakan bahwa umur tanaman mengakibatkan berkurangnya degradasi tanaman. Hasil penelitian menunjukkan bahwa degradasi bahan kering dan bahan organik paling tinggi adalah daun papaya. Hal ini karena daun papaya yang digunakan pada penelitian berumur muda sehingga serat yang dimilikinya masih rendah menyebabkan kecernaan dan degradasi daun pepaya masih cukup tinggi. Peningkatan nilai kecernaan bahan seiring dengan meningkatnya nilai degradasi bahan. Laju degradasi yang tinggi dapat menunjukkan kecernaan bahan kering tinggi (Despal 1993). Tinggi rendahnya DBK hijauan tropis ditentukan oleh kandungan tanin, serat kasar, dan nilai ADF yang terdapat dalam hijauan. Persentase kecernaan bahan kering dan bahan organik lebih tinggi dibandingkan dengan persentase degradasi bahan kering dan bahan organik karena pada analisis in vitro Tilley dan Terry (1966) perlakuan untuk mendapatkan nilai kecernaan bahan kering dan bahan organik memerlukan waktu inkubasi yang lebih lama dibandingkan dengan perlakuan degradasi bahan kering dan bahan organik sehingga residu yang didapat lebih sedikit namun bernilai tinggi. Hadi et al. (2011) menambahkan bahwa waktu tinggal bahan pakan di dalam rumen yang semakin lama akan mengakibatkan meningkatnya kontak antara pakan dengan mikroba rumen, hal ini akan meningkatkan aktivitas mikroba dalam mendegradasi pakan. Berdasarkan analisis ragam, kelompok pengambilan rumen yang berbeda dan jenis hijauan memberikan pengaruh yang nyata terhadap nilai degradasi bahan kering dan degradasi bahan organik. Ulya (2007) menyatakan degradasi bahan kering tidak dipengaruhi oleh perbedaan cairan rumen. Hasil penelitian berbeda dengan literatur disebabkan perbedaan konsumsi bahan pakan oleh jenis sapi yang berbeda pula.
13
Trichantera gigantea. Dilihat dari kadar protein kasar yang dimilikinya tergolong cukup tinggi. Hal ini berarti banyaknya kandungan protein kasar yang dimiliki suatu bahan pakan akan meningkatkan kecernaan protein kasar. Selain itu NDICP dan ADICP T. gigantea juga rendah sehingga kecernaan proteinnya tinggi. Berdasarkan analisis ragam, perbedaan jenis hijauan dan pengambilan rumen yang berbeda memberi pengaruh yang nyata terhadap kecernaan protein kasar. Hal ini disebabkan oleh jenis hijauan memiliki kandungan protein berbeda-beda dan jenis pakan yang dikonsumsi oleh sapi berfistula pada setiap pengambilan rumen juga berbeda-beda. Fermentasi secara in vitro menghasilkan gas amonia atau NH3 dan VFA (Volatile Fatty Acid). Produksi gas amonia dan VFA disajikan pada Tabel 4.
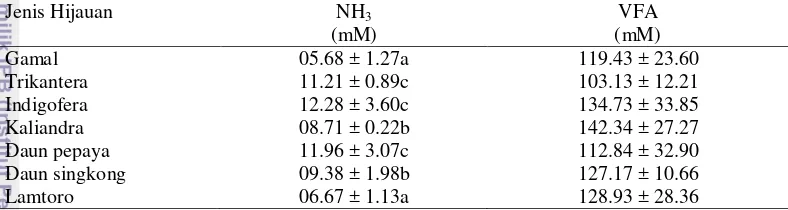
Tabel 4. Produksi amonia (mM) dan VFA (mM) setelah fermentasi secara in vitro pada bahan pakan hijauan
Jenis Hijauan NH3
(mM)
VFA (mM) Gamal 05.68 ± 1.27a 119.43 ± 23.60 Trikantera 11.21 ± 0.89c 103.13 ± 12.21 Indigofera 12.28 ± 3.60c 134.73 ± 33.85 Kaliandra 08.71 ± 0.22b 142.34 ± 27.27 Daun pepaya 11.96 ± 3.07c 112.84 ± 32.90 Daun singkong 09.38 ± 1.98b 127.17 ± 10.66 Lamtoro 06.67 ± 1.13a 128.93 ± 28.36
Huruf berbeda pada setiap kolom untuk satu hasil penelitian menunjukkan berbeda nyata (P<0.05), NH3 = amonia, VFA = volatile fatty acid.
Produksi amonia dan VFA pada rumen menunjukkan nilai kecernaan bahan organik ransum yang dikonsumsi, semakin tinggi produksi amonia dan VFA dalam rumen menunjukkan bahwa kecernaan bahan organik ransum semakin tinggi. Produksi gas yang dihasilkan dapat diprediksi dengan persentase DBK dengan asumsi bahwa jumlah gas yang diproduksi mencerminkan jumlah bahan pakan yang terdegradasi. Hasil penelitian menunjukkan bahwa produksi amonia tertinggi pada indigofera dan produksi VFA tertinggi pada kaliandra. Berdasarkan analisis ragam, perbedaan jenis hijauan dan pengambilan rumen yang berbeda memberi pengaruh yang nyata terhadap produksi amonia. Namun berdasarkan analisis ragam, perbedaan jenis hijauan tidak memberi pengaruh yang nyata terhadap produksi VFA sedangkan pengambilan rumen yang berbeda memberi pengaruh yang nyata terhadap produksi VFA. Produksi amonia yang tinggi pada indigofera akibat kecernaan bahan organik yang tinggi yaitu 64.25%. Produksi VFA yang tinggi pada kaliandra diduga akibat kecernaan protein kasar yang tinggi yaitu 69.33%.
Korelasi NDICP dan ADICP dengan KCPK
14
Gambar 1. Hubungan antara Neutral Detergent Insoluble Crude Protein (NDICP) dengan Kecernaan Protein Kasar (KCPK) pada bahan pakan hijauan, G = gamal, T = trikantera, I = indigofera, K = kaliandra, P = daun pepaya, S = daun singkong, L = lamtoro
Gambar 1 memperlihatkan bahwa NDICP tidak memiliki korelasi dengan KCPK. Hal tersebut dapat dilihat dari daun singkong yang memiliki nilai NDICP paling tinggi dan namun tidak memiliki nilai KCPK yang paling rendah. Seharusnya nilai NDICP yang tinggi akan menurunkan KCPK karena bila protein yang terikat di dinding sel tinggi, maka akan sulit mencerna protein kasar tersebut sehingga kecernaan protein kasar akan rendah. Tidak adanya korelasi tersebut diduga akibat jumlah sampel yang terlalu sedikit sehingga memiliki variasi yang besar, kesalahan dalam sistem in vitro yang dilakukan, dan terdapat faktor lain yang mempengaruhi KCPK seperti konsumsi protein oleh sapi berfistula pada waktu pengambilan rumen di hari yang berbeda dan kandungan tanin dalam hijauan.
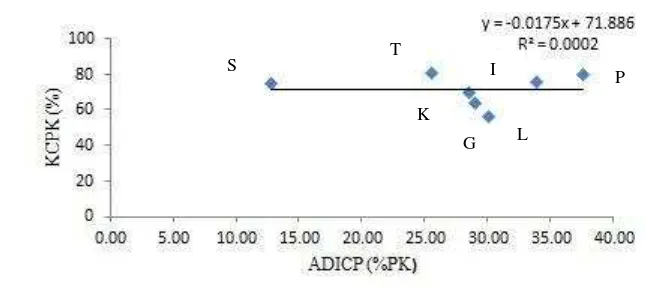
Gambar 2. Hubungan antara Acid Detergent Insoluble Crude Protein (ADICP) dan Kecernaan Protein Kasar (KCPK) pada bahan pakan hijauan, G = gamal, T = trikantera, I = indigofera, K = kaliandra, P = daun pepaya, S = daun singkong, L = lamtoro
Gambar 2 memperlihatkan bahwa ADICP tidak memiliki korelasi dengan KCPK. Hal tersebut dapat dilihat dari daun pepaya yang memiliki nilai ADICP tinggi namun memiliki nilai KCPK yang tinggi. Seharusnya meningkatnya ADICP akan menurunkan KCPK. ADICP tidak berkorelasi dengan KCPK karena
G T I
K
P
S
L
G T
I
K
P S
15 jumlah sampel yang digunkaan terlalu sedikit sehingga memiliki variasi yang besar, kesalahan dalam sistem in vitro, dan terdapat faktor lain yang mempengaruhi KCPK seperti kandungan tanin dalam hijauan dan konsumsi protein oleh sapi berfistula pada waktu pengambilan rumen di hari yang berbeda-beda.
SIMPULAN DAN SARAN
SimpulanKadar NDICP dan ADICP yang diperoleh dari pengujian nitrogen dinding sel merupakan protein yang terikat pada NDF dan ADF yang dapat menurunkan kecernaan protein pakan di rumen. Daun singkong memiliki protein kasar tertinggi, kadar NDICP tertinggi, kadar ADICP terendah serta KCPK yang cukup tinggi, menunjukkan bahwa daun singkong merupakan sumber pakan hijauan yang baik untuk ternak ruminansia. Berdasarkan hasil penelitian ini, kadar NDICP dan ADICP tidak berkorelasi dengan kecernaan protein bahan pakan di rumen.
Saran
Perlu dilakukan pengujian lebih lanjut mengenai faktor lain yang mempengaruhi kecernaan protein kasar, seperti uji tanin.
DAFTAR PUSTAKA
AOAC. 2005. Official Methods of Analyses (17th ed.). Association of Official Analythical Chemists, Washington, DC.
Daryatmo J, Hartadi H, Orskov ER, Kustantinah A, Nurcahyo W. 2010. In vitro screening of various forages for anthelmintics activity on Haemonchus contortus eggs. Di dalam: Advances in Animal Biosciences: Food, Feed, Energy and Fibre from Land-A Vision for 2020. Proc. of the BSAS and the ARF Forum. Belfast (GB): Cambridge Univ Pr.
Despal. 1993. Evaluasi nutrisi daun kembang sepatu dengan menggunakan teknik in sacco dan in vitro dengan pembanding beberapa legume pohon [skripsi]. Bogor (ID): Institut Pertanian Bogor.
[FAO] Food Agriculture Organization. 2007. FAO technical meeting prebiotics. Italy: AGNS-FAO.
General Laboratory Procedure. 1966. Report of Dairy Science. Madison (USA): University of Wisconsin Pr.
Givens DI, Owen E, Adesogan AT. 2000. Current procedures, future requirements and the need for standardization. Givens DI, Owen E, Axford RFE and Omed HM (Eds.). Di dalam: Forage Evaluation in Ruminant Nutrition. CABI Publishing. pp . 449-474.
Hadi RF, Kustantinah, Hari H. 2011. Kecernaan in sacco hijauan leguminosa dan hijauan non-leguminosa dalam rumen sapi peranakan ongole. Bul Petern.
16
Hassen A, Rethman NFG, Van Niekerk WA, Tjelele TJ. 2007. Influence of season/year and species on chemical composition and in vitro digestibility of five Indigofera accessions. Anim Feed Sci Technol. 136:312–322. Hendrawan. 2002. Kebutuhan gizi ternak ruminansia menurut standar
fisiologisnya. Malang (ID): Brawijaya Univ Pr.
Lee MC, Hwang SY, Chiou PWS. 2001. Application of rumen undegradable protein on early lactating dairy goats. Asian-Aust J Anim Sci. 14:1549-1554.
Licitra G, Hernandez TM, Van Soest PJ. 1996. Standardization of procedures for nitrogen fractionation of ruminant feeds. Anim Feed Sci Technol. 57:347-358.
[NRC] National Research Council. 2001. Nutrient Requirement of Dairy Cattle. 8th Revised Edition. Washington (US): National Academy Pr.
Orskov ER. 1992. Protein Nutrition in Ruminant. 2nd Ed. Harcout Brace Jovanovich Publisher, London (UK): Academic Pr.
Phuc BHN, Ogle B, Linberg JE. 2008. Nutritive Value of Cassava Leaves for Monogastric Animals [Internet]. [diacu 2014 mei 3]. Tersedia pada:http://www.mekarn.org/procKK/phuc.htm.
Puastuti W. 2005. Tolak ukur mutu protein ransum dan relevansinya dengan retensi nitrogen serta pertumbuhan domba [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Puastuti W, I-W. Mathius, Yulistiani D. 2006. Bungkil kedelai terproteksi cairan batang pisang sebagai pakan imbuhan ternak domba: in sacco dan in vivo.
JITV. 11: 106-115.
Ravindran V. 1992. Utilization of cassava leaves (Manihot esculenta Crantz) in animal nutrition. J Nat Sci Count Sri Lanka. 21: 1-26.
Sarjuni S. 2006. Penggunaan tepung daun pepaya (Carica papaya) dalam ransum ayam pedaging [tesis]. Semarang (ID): Universitas Diponegoro.
Schroeder JW. 2004. Forage Nutrition for Ruminants. NDSU Extention Service. [diacu 2014 mei 3] http://www.ag.ndsu.edu/ pubs/ansci/dairy/as1250-3.gif.
Snifen GJ, O'Connor JD, Van Soest PJ, Fox DG, Russel JB. 1992. A net carbohydrate and protein system for evaluating cattle diets. II. Carbohydrate and protein availability. J Anim Sci. 70:3562-357.
Sudarmadji S. 1989. Analisa Bahan Makanan dan Pertanian. Yogyakarta (ID). Liberti.
Suparjo. 2010. Evaluasi Pakan secara in Sacco [Internet]. [diacu 2014 mei 3]. Tersedia pada: http//www.jojo66.wordpress.com.
Sutardi T. 1979. Ikhtisar ruminologi. Bahan Penataran Khusus Peternakan Sapi Perah [Kayu Ambon, Lembang]. [Dirjennak; FAO]. BLPP.
Sutardi T. 1980. Landasan Ilmu Nutrisi. Departemen Ilmu Makanan Ternak. Bogor (ID). IPB Pr.
17 Tilley JMA, Terry RA. 1966. A two stage technique for the in vitro digestion
of forage crop. J Brit Grassland Soc. 18:104–111.
Tillman AD, Hartadi H, Reksohadiprodjo S, Prawirokusumo S, Lebdosoekotjo S. 1989. Ilmu Makanan Ternak Dasar. Yogyakarta (ID): Gajah Mada University Pr.
Tillman AD, Hartadi H, Reksohadiprodjo S. 2005. Tabel Komposisi Pakan untuk Indonesia. Yogyakarta (ID): Gajah Mada University Pr.
Ulya A. 2007. Kajian in vitro mikroba rumen berbagai ternak ruminansia dalam fermentasi biji jarak pagar (Jatropha cucas L) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Umphrey JE, Staples CR. 2003. General Anatomy of The Ruminant Digestive System. [Internet]. [diacu 2014 mei 10]. Tersedia pada: http://edis.ifas.ufl.DS061.
18
LAMPIRAN
Lampiran 1 Hasil analisis ragam kecernaan bahan kering terhadap hijauan
Uji antara pengaruh subjek perlakuan
Variabel terikat : KCBK
Sumber
Tipe III Jumlah Kuadrat
Derajat bebas
(df) Rataan Kuadrat F Sig. Model terkoreksi 5349.165a 8 668.646 138.822 .000 Intercep 144414.858 1 144414.858 2.998E4 .000 Hijauan 5321.813 6 886.969 184.150 .000 Kelompok 27.351 2 13.676 2.839 .073
Eror 158.946 33 4.817 Total 149922.970 42
Total terkoreksi 5508.111 41 a. R Kuadrat = .971 (Penyesuaian R Kuadrat = .964)
KCBK
Duncan
Hijauan N
Himpunan bagian (subset)
1 2 3 4 5 6
1
6 4.11316651 190551E1 4
6 4.5983625 6555047E1 6
6 5.7066355
5353049E1 7
6 5.8199799
7710303E1 2
6 6.2915626
6407528E1 3
6 7.0311768
2506397E1 5
6 7.48591864
695268E1 Sig. 1.000 1.000 .378 1.000 1.000 1.000 Tampilan rataan kelompok dalam subset yang homogen
Berdasarkan pada rataan pengamatan.
19 Lampiran 2 Hasil analisis ragam kecernaan bahan organik terhadap hijauan
Uji antara pengaruh subjek perlakuan
Intercep 106188.294 1 106188.294 1.258E4 .000
Hijauan 7728.692 6 1288.115 152.542 .000
Kelompok 41.428 2 20.714 2.453 .102
Eror 278.662 33 8.444
Total 114237.077 42
Total terkoreksi 8048.782 41
a. R Kuadrat = .965 (Penyesuaian R Kuadrat = .957)
KCBO
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan.
20
Lampiran 3 Hasil analisis ragam kecernaan protein kasar terhadap hijauan
Uji antara pengaruh subjek perlakuan
Intercep 107035.807 1 107035.807 1.431E3 .000
Hijauan 1469.587 6 244.931 3.275 .038
Kelompok 2797.715 2 1398.857 18.703 .000
Eror 897.500 12 74.792
Total 112200.608 21
Total
terkoreksi 5164.801 20
a. R Kuadrat = .826 (Penyesuaian R Kuadrat = .710)
KCPK
2 3 8.06798137710645E1
Sig. .096 .055 .168
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan..
21 Lampiran 4 Hasil analisis ragam degradasi bahan kering terhadap hijauan
Uji antara pengaruh subjek perlakuan
Intercep 108355.650 1 108355.650 4.027E3 .000
Hijauan 2181.088 6 363.515 13.509 .000
Kelompok 1513.280 2 756.640 28.119 .000
Eror 887.970 33 26.908
Total 112937.989 42
Total terkoreksi 4582.338 41
a. R Kuadrat = .806 (Penyesuaian R Kuadrat = .759)
DBK
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan
22
Lampiran 5 Hasil analisis ragam degradasi bahan organik terhadap hijauan
Uji antara pengaruh subjek perlakuan
Model terkoreksi 9254.333a 8 1156.792 25.130 .000
Intercep 26682.499 1 26682.499 579.657 .000
Hijauan 5328.733 6 888.122 19.294 .000
Kelompok 3925.600 2 1962.800 42.640 .000
Eror 1519.040 33 46.032
Total 37455.872 42
Total terkoreksi 10773.373 41
a. R Kuadrat = .859 (Penyesuaian R Kuadrat = .825)
DBO
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan.
23 Lampiran 6 Hasil analisis ragam amonia terhadap hijauan
Uji antara pengaruh subjek perlakuan
Variabel terikat : NH3
Sumber
Tipe III Jumlah Kuadrat
Derajat bebas
(df) Rataan Kuadrat F Sig.
Model terkoreksi 302.309a 8 37.789 21.384 .000
Intercep 3721.248 1 3721.248 2.106E3 .000
Hijauan 239.350 6 39.892 22.575 .000
Kelompok 62.959 2 31.479 17.814 .000
Eror 58.315 33 1.767
Total 4081.871 42
Total terkoreksi 360.623 41
a. R Kuadrat = .838 (Penyesuaian R Kuadrat = .799)
NH3
Duncan
Hijauan N
Himpunan bagian (subset)
1 2 3
1 6 5.67999405429119E0
7 6 6.66823296046925E0
4
6 8.71382129547708E
0 6
6 9.37990202604539E
0 2
6 1.12050747741593E
1 5
6 1.19620596386450E
1 3
6 1.22806398137728E
1
Sig. .207 .392 .195
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan..
24
Lampiran 7 Hasil analisis ragam VFA terhadap hijauan
Uji antara pengaruh subjek perlakuan
Variabel terikat : VFA
Sumber
Tipe III Jumlah Kuadrat
Derajat bebas
(df) Rataan Kuadrat F Sig.
Model terkoreksi 7347.490a 8 918.436 2.185 .107
Intercep 323316.626 1 323316.626 769.207 .000
Hijauan 3199.735 6 533.289 1.269 .341
Kelompok 4147.756 2 2073.878 4.934 .027
Eror 5043.897 12 420.325
Total 335708.012 21
Total terkoreksi 12391.387 20
a. R Kuadrat = .593 (Penyesuaian R Kuadrat = .322)
VFA
Duncan
Hijauan N
Himpunan Bahian (subset) 1
2 3 1.03130864471032E2
5 3 1.12838310365742E2
1 3 1.19432666193638E2
6 3 1.27165048467788E2
7 3 1.28934860415191E2
3 3 1.34727275816954E2
4 3 1.42336147517305E2
Sig. .058
Tampilan rataan kelompok dalam subset yang homogen Berdasarkan pada rataan pengamatan
25
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 08 Juni 1992 dari Bapak Sujiyono dan Ibu Eny Sudewi. Penulis merupakan anak kedua dari dua bersaudara. Penulis menempuh pendidikan formal di SD Angkasa pada tahun 1998-2004. Penulis melanjutkan pendidikan di SMP Negeri 49 Jakarta dan lulus pada tahun 2007. Penulis melanjutkan pendidikan di SMA 81 Jakarta dan lulus pada tahun 2010.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) pada tahun 2010 melalui Undangan Seleksi Masuk Mahasiswa (USMI) di Departemen Ilmu Nutrisi dan Teknologi Pakan (INTP), Fakultas Peternakan. Penulis merupakan mahasiswa fast
track semester 2, Tahun Ajaran 2013/2014 pada Pascasarjana Ilmu dan Nutrisi Pakan, Fakultas Peternakan. Selama menjalani pendidikan akademik di Institut Pertanian Bogor penulis mengikuti berbagai kegiatan seperti panitia Masa Perkenalan Fakultas angkatan 48, Fapet Show Time 2011, Fapet Cadresation Training 2011, Dekan Cup 2012, International Feed Seminar 2012 dan aktif pada organisasi HIMASITER (Himpunan Mahasiswa Nutrisi Ternak) 2012-2013 sebagai staf Biro Komunikasi Nutrisi di Institut Pertanian Bogor, serta meraih juara 3 perkusi bersama D’Ransum pada IPB Art Contest 2012.
UCAPAN TERIMA KASIH
Terima kasih penulis ucapkan kepada Dr Ir Muhammad Ridla MAgr selaku pembimbing skripsi dan pembimbing akademik serta kepada Dr Anuraga Jayanegara, SPt, MSc selaku pembimbing skripsi yang telah sabar dan banyak memberikan saran dan selaku panitia seminar penulis pada 19 Mei 2014. Ucapan terima kasih juga penulis sampaikan kepada Dr Sri Suharti SPt, MSi selaku dosen pembahas seminar hasil penelitian penulis. Penulis mengucapkan terima kasih kepada Dr Ir Lilis Khotijah MSi dan Dr Tuti Suryati SPt, MSi sebagai dosen penguji sidang penulis dan Dr Ir Widya Hermana MSi selaku panitia sidang penulis pada 30 Juni 2014. Ucapan terima kasih juga penulis sampaikan kepada program Biaya Operasional Perguruan Tinggi Negeri tahun 2013 atas dana yang diberikan untuk penelitian penulis. Penghargaan penulis sampaikan juga kepada Staf Laboratorium Ilmu dan Teknologi Pakan dan Laboratorium Nutrisi Ternak Perah, Fakultas Peternakan, Institut Pertanian Bogor, yang telah membantu selama penelitian ini dilaksanankan.