VARIASI GENETIK DAN MORFOLOGI SERTA TINGKAT
KEKERABATAN KELINCI LAUT (PHYLLIDIIDAE) ANTARA
POPULASI PAPUA DAN AUSTRALIA
WINDA MEILINDO
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Variasi Genetik dan Morfologi serta Tingkat Kekerabatan Kelinci Laut (Phyllidiidae) antara Populasi Papua dan Australia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
WINDA MEILINDO. Variasi Genetik dan Morfologi serta Tingkat Kekerabatan Kelinci Laut (Phyllidiidae) antara Populasi Papua dan Australia. Dibimbing oleh HAWIS MADDUPPA dan BEGINER SUBHAN.
Kelinci laut adalah moluska yang tidak bercangkang dengan ordo Nudibranchia dan termasuk anggota dari subkelas Opisthobranchiata dan kelas Gastropoda. Identifikasi kelinci laut cukup sulit karena spesies ini memiliki hubungan genetik yang erat dan karakter morfologi yang hampir sama dari setiap jenisnya. Nudibranchia memiliki diversitas yang tinggi di perairan Indonesia dan Australia. Namun, kajian tentang kekerabatan jenis antara kedua daerah tersebut masih jarang. Penelitian ini bertujuan : (1) mengidentifikasi kelinci laut di Papua menggunakan karakterisasi morfologi dan molekuler, (2) mengidentifikasi keragaman genetik dan filogenetik kelinci laut antara populasi Papua dan Australia. Sampel kelinci laut yang dianalisis berjumlah 4 sampel yaitu 2 sampel (Phyllidia ocellata dan Phyllidiella pustulosa) dari Papua dan 2 sampel (Phyllidia ocellata dan Phyllidiella pustulosa) dari Australia yang diunduh dari Genbank. Nilai homologi analisis BLAST sampel kelinci laut yang didapatkan dari Papua berkisar antara 88-98 %. Pohon filogenetik yang terbentuk terbagi menjadi 2 clade besar dengan jarak genetik berkisar 0,019-0,193. Rekonstruksi filogenetik mampu mengelompokkan dan memperlihatkan kekerabatan yang erat pada dua populasi antara Papua dan Australia.
Kata kunci : Filogenetik, kelinci laut, Phyllidia ocellata, Phyllidiella pustulosa
ABSTRACT
WINDA MEILINDO. Genetic and Morphological Variation and Genetic Relationship of Sea Slugs (Phyllidiidae) between Papua and Australia Population. Supervised by HAWIS MADDUPPA and BEGINER SUBHAN.
Sea slugs are shell-less marine molluscs which is classified in the order Nudibranchia within the gastropod group and subclass Opisthobranchiata. The identification process of sea slugs is barely difficult, since they are genetically close-related and morphologically similar among their groups. Nudibranch has a high biodiversity in the Indonesia and Australia waters. However, the study of kinship between the two types are still rare. Therefore, The study was conducted : (1) to identify sea slugs in Papua using morphological and molecular characterization, (2) to identify genetic variation and to reconstruct phylogenetic tree of sea slugs from Papua and Australia population. A total of 4 samples were analyzed : 2 samples (Phyllidia ocellata and Phyllidiella pustulosa) from Papua and 2 samples (Phyllidia ocellata and Phyllidiella pustulosa) from Australia downloaded from Genbank. Homology results from BLAST analysis for Papua’s sea slug samples ranges between 88-98%. Genetic distance were formed ranged from 0.019 to 0.193. Phylogenetic reconstruction was able to classify and show the close relationship of sea slugs population in Papua and Australia.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
VARIASI GENETIK DAN MORFOLOGI SERTA TINGKAT
KEKERABATAN KELINCI LAUT (PHYLLIDIIDAE) ANTARA
POPULASI PAPUA DAN AUSTRALIA
WINDA MEILINDO
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Variasi Genetik dan Morfologi serta Tingkat Kekerabatan Kelinci Laut (Phyllidiidae) antara Populasi Papua dan Australia
Nama : Winda Meilindo NIM : C54100024
Disetujui oleh
Dr Hawis Madduppa, SPi MSi Pembimbing I
Beginer Subhan, SPi MSi Pembimbing II
Diketahui oleh
Dr Ir I Wayan Nurjaya, MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul “Variasi Genetik dan Morfologi serta Tingkat Kekerabatan Kelinci Laut (Phyllidiidae) antara Populasi Papua dan Australia”. Penelitian ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Departemen Ilmu dan Teknologi Kelautan.
Pada kesempatan kali ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan dan penyusunan skripsi ini terutama kepada :
1. Tuhan Yang Maha Esa atas segala rahmat yang diberikan kepada penulis hingga dapat menyelesaikan penulisan skripsi ini.
2. Bapak Dr. Hawis Madduppa, SPi, MSi dan Bapak Beginer Subhan, SPi MSi selaku pembimbing, yang telah banyak memberi segala saran, bimbingan, dan nasihat selama penelitian berlangsung hingga karya ilmiah ini selesai.
3. Laboratorium Indonesia Biodiversity Research Center (IBRC) dan Marine Biodiversity and Biosystematics Laboratory (MBB), atas proses pengolahaan data dalam penelitian dan penulisan skripsi ini.
4. Ibu Dr. Majariana Krisanti, SPi, MSi atas peminjaman alat dan segala fasilitas yang diberikan selama penenelitian di Labotarium Biologi Mikro 1.
5. Keluarga besar di Pagar Alam, Rahmad Hidayat dan Wisna Hartati, orang tua tercinta dan Widia Yulindo serta Wilda Destrilindo, saudara kandung tercinta atas dukungan dan semangat yang diberikan kepada penulis hingga dapat menyelesaikan penulisan skripsi ini.
6. Nurlita Putri Anggraini, I Gede Wahyu Dani Dharmawan, Yuliyana Mubarokah, dan Abudi atas ketersediaannya dalam membantu proses pengolahan data.
7. Keluarga besar Ilmu dan Teknologi Kelautan, ITK 47 Inspiration, Coraux, B19 family, beserta IKAMUSI Institut Pertanian Bogor atas dukungan dan semangat yang diberikan selama penyelesaian skripsi ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR ISI xi
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Lokasi Penelitian 2
Bahan 3
Alat 3
Prosedur Penelitian 3
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Karakterisasi Morfologi 7
Keragaman Genetik 8
Tingkat Kekerabatan 11
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Perbedaan morfologi eksternal dari famili Phyllidiidae 4 2 Hasil pengukuran morfologi individu kelinci laut di Suaka Alam
Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja
Ampat, Provinsi Papua Barat 7
3 Hasil identifikasi kelinci laut di Suaka Alam Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja Ampat, Provinsi Papua Barat
menggunakan BLAST 9
4 Komposisi basa nukleotida kelinci laut di Papua dan Australia 10 5 Matriks probabilitas substitusi nukleotida kelinci laut di Papua dan
Australia 10
6 Matriks jarak genetik spesies kelinci laut di Papua dan Australia 11
DAFTAR GAMBAR
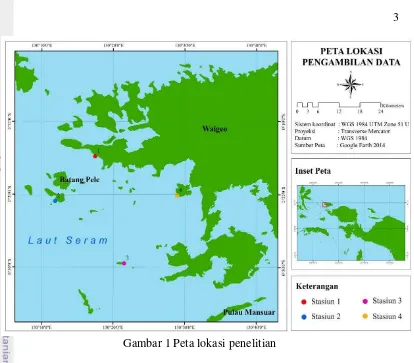
1 Peta lokasi penelitian 3
2 Karakter morfologi yang menjadi dasar pengukuran 5 3 A. Spesies Phyllidia ocellata (perbesaran 29,1x); dan B. Spesies
Phyllidiella pustulosa (perbesaran 22,2x) 8
4 Pohon Filogenetik kelinci laut di Papua, Australia, dan USA 12
DAFTAR LAMPIRAN
1 Prosedur kerja Dino-Lite (Digital Microscope) Pro 2 15 2 Komposisi Master Mix (MM) pada PCR (Hotstart) 16
3 Komposisi Master Mix (MM) pada PCR (Gold) 16
1
PENDAHULUAN
Latar Belakang
Kelinci Laut (Nudibranchia) merupakan moluska yang tidak bercangkang dengan ordo Nudibranchia dan anggota dari Subkelas Opisthobranchiata dan Kelas Gastropoda. (Dayrat 2006) terdiri dari 3000 spesies yang telah teridentifikasi di dunia. Ordo Nudibranchia terdiri dari 4 subordo, 66 famili, dan 116 genera. Keempat subordo tersebut adalah Dendronotacea (10 famili, 14 genus), Doridacea (26 famili, 56 genus), Aeolidacea (21 famili, 35 genus), dan Arminacea (9 famili, 11 genus). Famili Phyllidiidae termasuk ke dalam subordo Doridacea dan terdiri dari enam genus, yaitu Ceratophyllidia, Phyllidiopsis, Phyllidiella, Reticulidia, Fryeria, dan Phyllidia (Brunckhorst 1993). Nudibranchia telah teridentifikasi di Indonesia sebanyak 59 spesies yang terdiri dari 15 famili. Nudibranchia adalah salah satu kelompok hewan moluska laut yang menarik untuk diamati karena mempunyai warna yang mencolok dan bentuk yang bervariasi (Wagele & Klussmann – Kolb 2005).
Keanekaragaman Nudibranchia dapat diketahui dengan melihat faktor-faktor yang mempengaruhi keberadaannya di lautan antara lain perbedaan habitat, seperti tutupan karang, ketersediaan dan jenis makanan. Ketiga hal ini berkaitan karena diketahui bahwa banyak Nudibranchia makan dan hidup dalam asosiasi yang dekat dengan spesies karang (Godfrey 2001). Nudibranchia pada umumnya memakan algae, sponge, karang keras dan lunak, bryozoans dan hydroids (Allen dan Steene 1999). Jenis makanan Nudibranchia ini biasanya tersedia di daerah yang memiliki terumbu karang. Nudibranchia yang didapat di Papua yaitu provinsi bagian barat negara Indonesia terdapat di habitat terumbu karang, dan Nudibranchia yang didapat di negara Australia juga terdapat pada habitat yang sama yaitu terumbu karang.
Kelinci laut (Nudibranchia) memiliki organ respirasi yaitu insang yang muncul seperti jambul pada bagian punggung agak ke belakang (Holland 2008). Nudibranchia juga memiliki organ seperti mata yang mungil hanya mampu membedakan antara terang dan gelap sebagai gantinya Nudibranchia menggunakan tonjolan sensor di kepala (rinophore) dan tentakelnya untuk mencium, mengecap dan merasakan lingkungan. Kurangnya pengetahuan tentang kelinci laut masih sangat banyak sehingga sulit untuk diidentifikasi secara konvensional dan beberapa spesies nudibranchia memiliki kemiripan morfologi yang dapat menimbulkan kesalahan identifikasi secara visual sehingga diperlukannya juga adanya kajian molekuler dengan menggunakan teknik DNA Barcoding agar dapat membantu proses identifikasi karena hanya membutuhkan sedikit jaringan tubuh dari kelinci laut tersebut.
2
Nudibranchia memiliki diversitas yang cukup tinggi di perairan Indonesia dengan diversitas yang ada dengan menggabungkan teknik identifikasi morfologi dan molekuler dengan pendekatan DNA Barcoding semua organisme akan dapat diidentifikasi dan dikuantifikasi. Struktur genetik DNA pada suatu organisme dibentuk oleh basa nukleotida DNA yaitu adenin, guanin, tinin dan sitosin. Filogenetik merupakan suatu metode yang digunakan untuk melihat dan memodelkan kedekatan suatu spesies dengan spesies lainnya. Analisis filogenetik digunakan untuk mengkontruksi dengan tepat hubungan antara organisme dan mengestimasi perbedaan yang terjadi dari satu nenek moyang kepada keturunannya (Li et al. 1999). Nudibranchia juga memiliki potensi sebagai antivirus dan antikanker. Hal ini telah menarik para peneliti untuk mengeksplorasinya (Murniasih 2005). Saat ini di Indonesia, belum ada data pasti mengenai keanekaragaman Nudibranchia dan penelitian mengenai Nudibranchia belum banyak dilakukan. maka penelitian mengenai Nudibranchia perlu lebih banyak lagi dilakukan, supaya pengetahuan mengenai invertebrata laut ini menjadi lebih baik (Ampou 2006).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi spesies kelinci laut di Papua menggunakan karakterisasi morfologi dan molekuler; merekonstruksi keragaman genetik dan filogenetik antar spesies kelinci laut antara Populasi Papua dan Australia.
METODE
Waktu dan Lokasi Peneltian
3
Gambar 1 Peta lokasi penelitian Bahan
Bahan yang digunakan dalam penelitian yaitu data primer (sampel kelinci laut dari Papua), data sekunder (sekuen DNA Australia kelinci laut yang diunduh pada genbank (http://blast.ncbi.nlm.nih.-gov)), etanol, chelex 10 %, ddH2O, larutan buffer, dNTP, loading dye, low mass ladder, enzim taq polymerase, MgCl2 , primer (JGHCO dan JGLCO), agarosa, dan EtBr.
Alat
Alat yang digunakan dalam penelitian yaitu alat tulis, gunting, cutter, tube (2 ml, 0.6 ml, 0.3 ml, dan 0.2 ml), cawan petri, gloves, bunsen, vortex, microsentrifuges, heating block, forceps, pippettemen (10, 20, 200 μl), pippet tips, tabung erlenmeyer, gelas ukur, parafilm, microwave, mesin elektroforesis, mesin UV, komputer, kamera, perangkat Lunak Mega 5.05, Dino-Lite Digital Microscope dilengkapi dengan perangkat lunak Dino-Lite Capture 2.0.
Prosedur Penelitian Preparasi Pengambilan Contoh
4
Identifikasi Morfologi
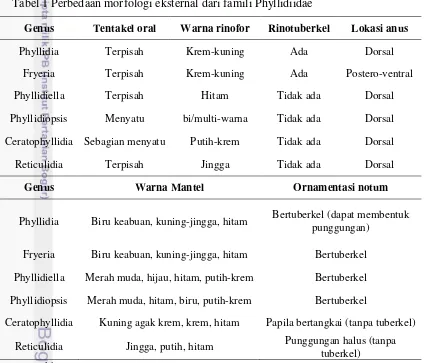
Karakteristik morfologi kelinci laut diamati dan dicocokkan dengan karakteristik yang terdapat pada jurnal kelinci laut (Brunckhorst 1993). Karakteristik yang dicocokkan berupa perbedaan morfologi eksternal. Identifikasi secara morfologi mencakup karakteristik dari famili Phyllidiidae yang meliputi parameter panjang total (mm), jumlah tuberkel, warna mantel, rinotuberkel, rinofor bergelambir, warna rinofor, dan lokasi anusnya. Terdapat enam genus dari famili Phyllidiidae yang dapat dibedakan melalui morfologi ekternalnya, yaitu tentakel oral, warna rinofor, keberadaan rinotuberkel, lokasi anus, warna mantel, dan ornamentasi notum (permukaan dorsal dari mantel) (Brunckhorst 1993). Tabel 1 menunjukkan perbedaan morfologi eksternal genus-genus tersebut.
Tabel 1 Perbedaan morfologi eksternal dari famili Phyllidiidae
Genus Tentakel oral Warna rinofor Rinotuberkel Lokasi anus
Phyllidia Terpisah Krem-kuning Ada Dorsal
Fryeria Terpisah Krem-kuning Ada Postero-ventral
Phyllidiella Terpisah Hitam Tidak ada Dorsal
Phyllidiopsis Menyatu bi/multi-warna Tidak ada Dorsal
Ceratophyllidia Sebagian menyatu Putih-krem Tidak ada Dorsal
Reticulidia Terpisah Jingga Tidak ada Dorsal
Genus Warna Mantel Ornamentasi notum
Phyllidia Biru keabuan, kuning-jingga, hitam Bertuberkel (dapat membentuk
punggungan)
Fryeria Biru keabuan, kuning-jingga, hitam Bertuberkel
Phyllidiella Merah muda, hijau, hitam, putih-krem Bertuberkel
Phyllidiopsis Merah muda, hitam, biru, putih-krem Bertuberkel
Ceratophyllidia Kuning agak krem, krem, hitam Papila bertangkai (tanpa tuberkel)
Reticulidia Jingga, putih, hitam Punggungan halus (tanpa
tuberkel)
[Brunckhorst 1993]
5
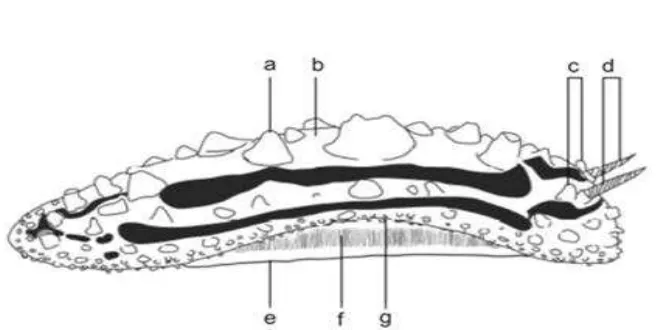
Gambar 2 Karakter morfologi yang menjadi dasar pengukuran
Keterangan a. Tuberkel; b. Notum (mantel dasar); c. Rinotuberkel; d.Rinofor bergelambir; e. Kaki; f. Insang ventrolateral; g. Tepi mantel. [Dominguez et al. 2007]
Proses pengukuran karakter morfologi pada penelitian ini dilakukan dengan menggunakan alat Dino-Lite (Digital Microscope) Pro 2 dengan perangkat lunak Dino-Lite Capture 2.0 yang dihubungkan pada laptop atau PC (Lampiran 1).
Koleksi Sampel
Koleksi sampel adalah tahapan awal dalam analisis DNA dengan cara mengambil dan memotong sedikit bagian tubuh kelinci laut. Bagian tubuh yang didapatkan disimpan dalam microtube berukuran 0.5 ml yang berisikan ethanol 96% dan diberi label pada masing-masing tube untuk identitas sampel. Jumlah sampel yang didapatkan sebanyak 2 sampel.
Ekstraksi dan Amplifikasi DNA Mitokondria
Ekstraksi DNA bertujuan untuk menghancurkan sel dan memisahkan DNA pada sampel. Metode yang digunakan pada ekstraksi ini yaitu metode chelex (Walsh et al. 1991). Pengekstraksian dilakukan dengan cara pemanasan 105°C selama 60 menit. Tahapan ini harus dalam keadaan steril untuk mencegah kontaminasi pada sampel.
Amplifikasi DNA menggunakan metode Polymerize Chain Reaction (PCR) Hotstart merupakan reaksi untuk memperbanyak (replikasi) DNA secara enzimatik pada suhu 80°C (Lampiran 2) dan PCR Gold yang dapat mempertahankan reaksi enzim sampai suhu reaksi (Lampiran 3).
6
Elektroforesis
Elektroforesis merupakan teknik untuk memisahkan molekul bermuatan yang bertujuan untuk mengetahui ada tidaknya hasil amplifikasi DNA dari produk PCR. Tahap awal elektroforesis adalah pembuatan gel agarosa 1% dengan pewarna Etidium Bromida (4 µL) yang digunakan untuk media elektroforesis. Hasil PCR dicampurkan dengan loading dye kemudian disisipkan dalam sumuran agarosa. Elektroforesis menggunakan mesin elektroforesis tegangan 100 V dan arus 400 mA dengan waktu 30 menit. Hasil elektroforesis dilihat dan difoto pada mesin ultraviolet.
Siklus Pengurutan Nukleotida
Siklus pengurutan nukleotida (DNA sequencing) merupakan metode untuk menentukan urutan basa nukleotida dalam DNA. DNA yang akan ditentukan urutan basa ACGT-nya dijadikan sebagai cetakan yang kemudian akan diamplifikasikan menggunakan enzim dan bahan-bahan reaksi PCR (Lampiran 4). Produk PCR yang berupa DNA positif di pindahkan dalam plate PCR dan dikirim ke Sequencing Facility UC Berkeley, California USA untuk pengurutan nukleotida (Zein dan Prawiradilaga 2013).
Analisis Data Identifikasi Spesies
Identifikasi spesies dilakukan dengan proses BLAST (Basic Local Alignment Search Tool) pada program MEGA 5.05 (Molecular Evolutionary Genetic Analysis) (Tamura et al. 2011). Data yang digunakan dalam proses BLAST yaitu hasil pembacaan urutan basa nukleotida. Data tersebut disejajarkan menggunakan CustalW pada program MEGA 5.05 untuk melihat keragaman basa nukleotida. Dalam menentukan hasil spesiesnya dilakukan perbandingan dengan database sekuen DNA pada genbank yang terhubung dengan genbank (http://blast.ncbi.nlm.nih.-gov). Sebagai ingroup, sekuen yang digunakan dari famili yang sama yaitu Phyllidiidae dengan spesies Phyllidia ocellata dan Phyllidiella pustulosa dari Papua dan Australia. Sebagai outgroup, sekuen yang digunakan dari Famili yang berbeda yaitu Acanthochitonidae dengan spesies Cryptochiton stelleri yang diunduh dari data genbank dengan taksa yang tidak jauh atau dekat yang difungsikan sebagai pembanding dalam menentukan spesies yang berada dalam ingroup sehingga dapat membentuk filogenetik yang kuat dan jelas untuk diklasifikasi kekerabatannya.
Struktur Genetik
7 Analisis Filogenetik
Analisis filogenetik digunakan untuk mengetahui kekerabatan dan jarak genetik spesies kelinci laut. Sedangkan jarak genetik digunakan untuk mengetahui ukuran perbedaan genetik antar populasi karena mutasi, seleksi, persilangan acak dan penghanyutan gen yang akan menyebabkan terjadinya evolusi. Pembuatan pohon filogenetik yang digunakan yaitu menggunakan metode Neighbor Joining tree dengan nilai bootstrap 100 dan model p – distance. Data sekuens spesies outgrup yang digunakan pada data pohon filogenetik diunduh dari genbank pada website www.ncbi.com. Sedangkan Pembuatan jarak genetik spesies dihitung dan dimodelkan dengan menggunakan model p – distance.
HASIL DAN PEMBAHASAN
Karakterisasi Morfologi
Berdasarkan hasil dari pengukuran morfologi individu kelinci laut (Nudibranchia) dari Papua diperoleh 1 famili yaitu Phyllidiidae dan 2 spesies yang telah diidentifikasi yaitu Phyllidia ocellata dan Phyllidiella pustulosa. Hasil pengukuran menunjukkan bahwa ukuran kelinci laut Phyllidiella pustulosa lebih besar dibandingkan dengan Phyllidia ocellata. Hasil morfologi pada setiap individu kelinci laut dapat dilihat pada Tabel 2. Perbedaan morfologi dari kedua spesies tersebut yaitu warna mantel, warna rinofor, keberadaan rinotuberkel, dan jumlah tuberkel.
Tabel 2 Hasil pengukuran morfologi individu kelinci laut di Suaka Alam Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja Ampat, Provinsi Papua Barat
Keterangan Individu 1 Individu 2
Panjang Total 16,030 mm 23,451 mm
Jumlah Tuberkel 28 28 (menumpuk)
Warna Mantel Hitam, abu-abu Hitam
Rinotuberkel Ada Tidak ada
Rinofor Bergelambir Ada Ada
Warna Rinofor Krem-kuning Hitam
Lokasi Anus Dorsal Dorsal
Spesies Phyllidia ocellata Phyllidiella pustulosa
8
(A)
(B)
Gambar 3 A. Spesies Phyllidia ocellata (perbesaran 29,1x); dan B. Spesies Phyllidiella pustulosa (perbesaran 22,2x)
Kedua gambar diatas diidentifikasi berdasarkan tampak dorsal. Perbedaan dari kedua gambar tersebut yaitu Pada Gambar 3A dengan Spesies Phyllidia ocellata dengan perbesaran 29,1x memiliki tuberkel, mantel, rinotuberkel, dan rinofor bergelambir. Sedangkan pada Gambar 3B dengan Spesies Phyllidiella pustulosa dengan perbesaran 22,2x hanya memiliki tuberkel, mantel, dan rinofor bergelambir.
Keragaman Genetik
Hasil Pengurutan Basa Nukleotida dan Identifikasi Spesies
9 Tabel 3 Hasil identifikasi kelinci laut di Suaka Alam Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja Ampat, Provinsi Papua Barat menggunakan BLAST
Kode Famili Analisis BLAST Maksimal
BLAST
MBB0604068 Phyllidiidae Phyllidia ocellata 88 %
MBB0604070 Phyllidiidae Phyllidiella pustulosa 98 %
Tabel 3 merupakan hasil BLAST kelinci laut di Suaka Alam Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja Ampat, Provinsi Papua Barat. Hasil menunjukkan terdapat 2 spesies kelinci laut yang teridentifikasi dan tergolong dalam satu famili yaitu Phyllidiidae yang dianalisis DNA mitokondria berjumlah 2 individu yaitu yang pertama kode MBB0604068 dengan spesies Phyllidia ocellata sebanyak 1 individu dan tingkat kemiripan mencapai 88 %, yang kedua kode MBB0604070 dengan Phyllidiella pustulosa sebanyak 1 individu dan tingkat kemiripan mencapai 98 %.
Spesies Phyllidia ocellata hidup berkisar panjang 16-17 mm dan rata-rata panjang 39 mm. Warna utama dari spesies ini adalah hitam, putih, dan emas. Permukaan ventral berwarna abu-abu. Rinophore berwarna emas dan organ reproduksi umumnya berwarna krim pucat. Phyllidia ocellata memiliki khas yaitu pola dorsal yang terdiri dari 4-10 cincin hitam yang berbatasan dengan warna putih, memiliki tuberkel berwarna emas atau putih (Brunckhorst 1993). Distribusi spesies ini umumnya diseluruh daerah tropis Samudera Indo-Pasifik Barat, termasuk juga laut merah. Spesies ini juga cenderung memangsa spons Acanthella cavernosa (Fusetani dkk, 1992).
Spesies Phyllidiella pustulosa merupakan salah satu spesies yang paling umum di seluruh Indo-Pasifik Barat. Spesies ini hidup berkisar panjang 8-69 mm dan rata-rata ukuran adalah 30 mm. Phyllidiella pustulosa memiliki ciri-ciri dorsal dengan latar belakang sebagian besar hitam dan memiliki tuberkel berwarna merah muda dan putih (Rudman WB 1999). Spesies ini cenderung memangsa spons Halcandria sp dan Acanthella cavernosa (Cimino dan Ghiselin 1999). Struktur Genetik Kelinci Laut
Urutan nukleotida dalam proses alignment menghasilkan urutan yang bervariasi yaitu pada spesies Phyllidia ocellata dan Phyllidiella pustulosa yang masing-masing sampel kelinci laut dari Papua dan Australia.
10
Tabel 4 Komposisi basa nukleotida kelinci laut di Papua dan Australia.
Sampel
Hasil analisis komposisi nukleotida DNA mitokondria diperoleh rata-rata frekuensi spesies Phyllidia ocellata dari Australia yaitu A=24,9%; T/U=40,0%; C=16,1% dan G=19,0%, komposisi nukleotida spesies Phyllidiella pustulosa dari Australia yaitu A=25,5%; T/U=39,2%; C=16,7% dan G=18,5%, komposisi nukleotida spesies Phyllidia ocellata dari Papua yaitu A=23,0%; T/U=41,2%; C=17,0% dan G=18,8%, sedangkan komposisi nukleotida spesies Phyllidiella pustulosa dari Papua yaitu A=26,1%; T/U=39,5%; C=17,2% dan G=17,2%.
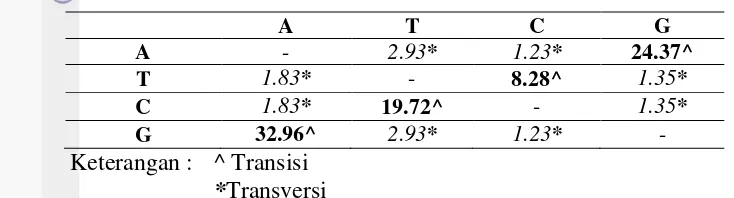
Tabel 5 Matriks probabilitas substitusi nukleotida kelinci laut di Papua dan Australia.
11 Hasil analisis matriks probabilitas substitusi nukleotida yaitu angka yang bercetak tebal disebut substitusi transisi sedangkan angka yang bercetak miring disebut substitusi transversi (Tabel 5). Mutasi substitusi transversi lebih kecil dan lebih jarang terjadi dibandingkan substitusi transisi. Nilai mutasi substitusi paling tinggi ditemukan pada basa A, diikuti oleh basa G, T dan C. Hal ini berkaitan erat dengan frekuensi masing-masing nukleotida.
Tingkat Kekerabatan
Jarak genetik digunakan untuk melihat kedekatan hubungan spesies Nudibranchia antara populasi Papua dan Australia. Matriks perbedaan jarak genetik terdiri dari 2 spesies dari Papua dan 2 spesies dari Australia yang dapat dilihat pada Tabel 6.
Tabel 6 Matriks jarak genetik spesies kelinci laut di Papua dan Australia. Phyllidia
Phyllidia ocellata Papua 0,125 0,190
Phyllidiella pustulosa Papua 0,182 0,019 0,193
Nilai jarak genetik pada tabel 6 diatas yaitu berkisar antara 0,019-0,193. Jarak genetik menggambarkan hubungan kekerabatan antar spesies. Data dari matriks tersebut digunakan untuk analisis hubungan kekerabatan berdasarkan pohon filogeni. Perbedaan jarak genetik terendah dimiliki oleh spesies Phyllidiella pustulosa Papua dengan spesies Phyllidiella pustulosa Australia yaitu sebesar 0,019. Hal ini menunjukkan bahwa spesies Phyllidiella pustulosa Papua dengan spesies Phyllidiella pustulosa Australia memiliki hubungan kekerabatan yang dekat. Sedangkan jarak genetik terbesar dimiliki oleh spesies Phyllidia ocellata Papua dengan spesies Phyllidiella pustulosa Papua yang menunjukkan bahwa kedua spesies tersebut memiliki hubungan kekerabatan yang jauh. Semakin besar jarak genetik, semakin jauh hubungan kekerabatan dan perbedaan basa nukleotida. Semakin rendah nilai dari jarak genetik menandakan adanya hubungan genetik yang sangat dekat (Nei 1972).
12
Gambar 4 Pohon Filogenetik kelinci laut di Papua, Australia, dan USA. Hasil analisis Gambar 4 menggambarkan hubungan kekerabatan spesies kelinci laut di Papua, Australia, dan USA. Hasil analisis juga digunakan untuk mengidentifikasi spesies yang terdapat dua kelas besar yaitu kelas besar pertama yang terdiri dari Phyllidia ocellata Australia dan Phyllidia ocellata Papua, sedangkan kelas besar kedua terdiri dari Phyllidiella pustulosa Australia dan Phyllidiella pustulosa Papua serta terdapat 1 spesies outgroup Cryptochiton stelleri USA. Pohon filogeni yang dibangun didukung oleh nilai bootstraps yang tinggi pada setiap cabang pada kelompok populasi diatas. Hal ini menunjukkan bahwa konstruksi pohon kekerabatan yang dibangun memiliki tingkat keakuratan yang tinggi. Sehingga dapat menjelaskan bahwa meskipun setiap populasi terpisah antara satu dengan yang lain tetapi perbedaan populasi ini (setiap clade) menjelaskan berasal dari satu nenek moyang asal.
13
SIMPULAN DAN SARAN
Simpulan
Hasil identifikasi kelinci laut menggunakan karakterisasi morfologi dan molekuler yaitu 2 sampel yang diperoleh dari Suaka Alam Perikanan Kepulauan Raja Ampat dan Laut di Sekitarnya di Raja Ampat, Provinsi Papua Barat dapat mencapai tingkat spesies yaitu Phyllidia ocellata dan Phyllidiella pustulosa (famili : Phyllidiidae). Komposisi nilai basa nukleotida masing-masing spesies tidak memiliki perbedaan yang besar. Jarak genetik yang terbentuk berkisar antara 0,019-0,193. Rekonstruksi filogenetik mampu mengelompokkan berdasarkan hubungan kekerabatan sehingga dapat diketahui spesies kelinci laut yang di analisis dan memperlihatkan kekerabatan yang erat pada dua populasi antara Papua dan Australia.
Saran
Sangat minimnya penelitian Nudibranchia terutama di Indonesia sehingga diperlukan adanya penelitian lanjutan yang berhubungan dengan genetika dan identifikasi morfologi yang masih segar dan utuh, sehingga lebih mudah melakukan pengukuran dan hasil yang didapatkan akan lebih baik. Diperlukan juga penelitian lanjutan dengan lokasi yang berbeda dan spesies yang berbeda agar lebih banyak informasi dan pengetahuan yang didapat.
DAFTAR PUSTAKA
Allen GR, Steene R. 1999. Indo-Pacific Coral Reef Guide. Singapore : Tropical Reef Research.
Ampou, E.E. 2006. Similarity Distribution of Nudibranch (Chromodorididae, Phyllidiidae, Facelinidae) in Siladen Island North Sulawesi-Indonesia. Unsrat Online, Manado.
Brunckhorst DJ. 1993. The systematic and phylogeny of phyllidiid nudibranchs (Doridoidea). Record of the Australian Museum Supplement. 16(1):1-107. Cimino G, Ghiselin MT. 1999. Chemical defense and evolutionary trends in
biosynthetic capacity among dorid nudibranch (Mollusca: Gastropoda: Opistobranchia). Chemoecology. 9:187-207.
Dayrat B. 2006. A Taxonomic Revision Of Paradoris Sea Slugs (Mollusca: Gastropoda: Nudibranchia: Doridina). Zoological journal of the linnaean society. 147:125-238.
Dominguez MP, Quintas, Troncoso JS. 2007. Phyllidiidae (Opisthobranchia: Nudibranchia) from Papua New Guinea with the description of a new species of Phyllidiella. American Malacological Bulletin. 22(1):89-117. Fusetani N, Wolstenholme HJ, Shinoda K, Asai N, Matsunaga S. 1992. Two
14
Godfrey S. 2001. Factors Affecting Nudibranch Diversity in The Wakatobi Marine National Park,<URL :
http//www.opwall.com/.../Invertebrates/Godfrey,%20S%20Factors%affectin g%20nudibranch%20distribution.pdf>. Diakses pada tanggal 24 September 2014, pukul 21.00 WIB.
Lehninger. 1982. Dasar-dasar Biokimia Jilid 3. Tenawijaya M, penerjemah. Jakarta (ID): Erlangga.
Li S, Pearl DK, Doss H. 1999. Phylogenetic tree construction using Markov Chain Monte Carlo. Fred Huntchinson Cancer Research Center Washington. Fred Hutchinson Cancer Research Center Washington. 29 pp.
Molcard R. Feux M. Syamsudin F. 2011, The Indonesian Throughflow Within Ombai Strait. J. Deepsea. Res. 48:1237-1253.
Murniasih T. 2005. “Substansi Kimia untuk Pertahanan Diri dari Hewan Laut Tak Bertulang Belakang”. Oseana, Volume XXX, Nomor 2 : 19-27.
Nei M. 1972. Genetic Distance Between Population. American Nature, 106 : 283– 292.
Puterbaugh MN, Burleugh JG. 2001. Investigating Evolutionary Question Using Online Molecular Databases. American Biology Teacher. 63(6):422-431. Rudman WB. 1999. Phyllidiella pustulosa Cuvier 1804. [internet]. [diunduh 2014
Sep 12]. Tersedia pada: http://www.seaslugforum.net/factsheet/phylpust. Schwagele F. 2005. Traceability from a European perpective. Meat Science
71(1):164-173.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. Mega 5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Molecular Biological Evolution. 28(2).doi:10.1093/molbev/msr121.
Teletchea F, Celia M, Catherine H. 2005. Food and forensic molecular identification : update and challenges. Trends in Biotecnology. 23(7):359-366.
Wagele H. Klussmann-Kolb AK. 2005. Opistobranchia (Mollusca: Gastropoda) – More Than Just Slimy Slugs. Shell Reduction And Its Implications On Defence And Foraging Frontiers In Zoology. 2(3):1-18.
Walsh PS, DA Metzger, R Higuchi. 1991. Chelex 100 as a medium for simple extraction of DNA for PCR-Based Typing from Forensic material. Biotechnique. 10(4): 506-513.
15 LAMPIRAN
Lampiran 1 Prosedur kerja Dino-Lite (Digital Microscope) Pro 2
Sebelum melakukan pengukuran dengan menggunakan Dino-Lite Pro2, terlebih dahulu dilakukan pengkalibrasi pada alat ini. Tujuannya adalah untuk menyesuaikan nilai kebenaran pada alat dengan ukuran standar agar meminimalisir error saat melakukan pengukuran.Adapun langkah-langkah untuk melakukan kalibrasi sebagai berikut :
1. Langkah pertama adalah pasang Dino-Lite Calibration Sampel untuk mulai melakukan kalibrasi, kemudian atur perbesarannya sampai mendapatkan fokus yang sesuai. Seperti contoh gambar dibawah ini : 2. Klik icon (calibration) kemudian pilih New Calibration Profile 3. Ketik “nama” pada Profile Name , selanjutnya klik Continue Calibration. 4. Ketik angka sesuai dengan perbesaran yang digunakan misalnya “35”
kemudian tekan Enter.
5. Pada layout Dino-Lite akan muncul tanda garis putus-putus. 6. Sesuaikan garis tersebut dengan angka 0 dan 5.
7. Pada ”please enter to known distance” ketik angka 5 dan pada unit pilih mm.
8. Kemudian klik Finish dan kalibarasi pun selesai.
Selanjutnya untuk langkah-langkah pengukuran morfologi sebagai berikut :
1. Sebelum menggunakan Dino-Lite Pro 2, terlebih dahulu lakukan penginstalan perangkat lunak Dino Caputer 2.0 pada laptop atau PC, kemudian sambungkan Dino-Lite Pro 2 pada laptop atau PC.
2. Jalankan perangkat lunak Dino-Lite Pro 2 pada laptop atau PC, kemudian lampu akan menyala pada Dino-Lite Pro 2 yang menandakan alat tersebut siap digunakan.
3. Setelah itu, kalibrasi Dino-Lite Pro 2 menggunakan calibration sampel agar ukurannya sesuai. Simpan kalibrasi yang telah dilakukan sesuai dengan nama yang diinginkan.
4. Ambil objek yang akan diamati dan letakkan pada alas yang akan menjadi background pada hasil foto, atur fokusnya sesuai keinginan. Apabila sudah mendapatkan fokus pada objek yang akan diambil gambarnya tekan tombol snapshot pada Dino-Lite.
5. Sebelum pengukuran dimulai, pada icon tulis angka sesuai dengan perbesaran yang dipakai saat pengambilan gambar di Dino-Lite misalnya 50.
16
Lampiran 2 Komposisi Master Mix (MM) pada PCR (Hotstart) Master mix ... tabung
STANDAR PROTOCOL ( 1μL DNA template)
MM 1 MM 2
Lampiran 3 Komposisi Master Mix (MM) pada PCR (Gold)
STANDAR PROTOCOL laut yang didapatkan di Papua, Australia, dan USA melalui BLAST #MBB0604068 Phyllidia ocellata Papua
17 #MBB0604070 Phyllidiella pustulosa Papua
TTTTTAGGAGACGATCATTTCTATAATGTAATTGTAACAGCTCATGCTT # Phyllidia ocellata Australia
GACATTATATATTGTTTTTGGTATGTGATGTGGTCTCCTAGGAACTGGT # Phyllidiella pustulosa Australia
18
# Cryptochiton stelleri USA
19
RIWAYAT HIDUP
Penulis dilahirkan di Muara pinang, Palembang, Sumatera Selatan pada tanggal 23 Mei 1993 sebagai anak pertama dari tiga bersaudara pasangan Bapak Rahmad Hidayat dan Ibunda Wisna Hartati. Pada tahun 2010 penulis lulus dari SMA Negeri 1 Pagaralam, Sumatera Selatan dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Selam Ilmiah pada tahun ajaran 2012/2013 dan 2013/2014. Penulis melaksanakan Praktek Kerja Lapang (PKL) pada bulan Juli-Agustus 2013 di PPP Muncar, Banyuwangi, Jawa Timur. Penulis aktif sebagai anggota Keluarga Mahasiswa Bumi Sriwijaya (IKAMUSI) IPB Tahun 2010/2011 hingga 2013/2014. Penulis mengikuti pendidikan dan pelatihan selam sertifikasi A1 tahun 2012/2013 dan Sertifikasi A2 tahun 2013/2014.
Penulis juga aktif dibeberapa organisasi/kelembagaan mahasiswa antara lain Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (BEM FPIK) departemen Pengembangan Bakat Olaraga dan Seni (PBOS) tahun 2011/2012 dan sebagai pengurus Sekretaris Biro Corp tahun 2012/2013, Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) tahun 2012-2013 sebagai anggota divisi Kaderisasi dan Kebijakan. Di luar bidang akademik penulis berprestasi dalam kegiatan kompetisi di bidang olahraga dan seni seperti Aerobik, Atletik lari, Voli, Bulutangkis, Tari tradisional dan alat musik Drum.