PENGARUH RADIASI ULTRA VIOLET TERHADAP VIRULENSI Fusarium oxysporum f.sp passiflora DI LABORATORIUM
SKRIPSI OLEH :
MUKLIS ADI PUTRA 080302017
HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
PENGARUH RADIASI ULTRA VIOLET TERHADAP VIRULENSI Fusarium oxysporum f.sp passiflora DI LABORATORIUM
SKRIPSI
OLEH :
MUKLIS ADI PUTRA 080302017
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana Pertanian di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan.
Disetujui Oleh Komisi Pembimbing
Dr. Ir. Hasanuddin, MS. Dr. Lisnawita, S.P., M.Si. Ketua Anggota
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
ABSTRACT
Muklis Adi Putra. 2013. “Ultra violet irradiation effect toward Fusarium oxysporum f.sp passiflora’s virulency in laboratory” supervised by Hasanuddin and Lisnawita. This research aims to determine Fusarium oxysporum f.sp passiflora’s virulency result ultra violet irradiatied in laboratory. The research was conducted at Plant Pathology Laboratory, Agroecotechnology Program Study, Faculty of Agriculture Universitas Sumatera Utara, Medan from August to November 2012. It was done by using Completely Randomized Design (CRD) Non Factorial with ten treatments and three replications.
The result showed that the highest percentage of inhibiting zones contained in 60 minutes UV irradiated isolate (M9) at 54.45% and the lowest were
in without UV irradiated isolate (M0) at 39.27%. Macroscopis and microscopis
morfology from all isolated are completely same, highest extensive growth of mycelium from wild F. oxysporum was founded at 60 minutes UV irradiated isolate (M9) at 35.05 cm2 and the lowest were 12 minutes UV irradiated (M5) at
25.36 cm2. The highest colony diameter was founded at 60 minutes UV irradiated isolate (M9) at 5.53 cm and the lowest were 12 minutes UV irradiated (M5) at
4.67 cm. The highest disease severity was founded at without UV irradiation (M0), 1 minutes (M1), 6 minutes (M3) and 15 minutes (M6) UV irradiation at
100.00% and the lowest was founded at 12 minutes UV irradiated (M5) at
66.67%, the disease incident is same for all UV irradiation at 100.00%.
ABSTRAK
Muklis Adi Putra. 2013. “Pengaruh radiasi ultra violet terhadap virulensi Fusarium oxysporum f.sp passiflora di laboratorium” dibawah bimbingan Hasanuddin dan Lisnawita. Penelitian ini bertujuan untuk mengetahui virulensi F. oxysporum f.sp. passiflora akibat radiasi ultra violet di laboratorium. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan Agustus sampai Nopember 2012. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan sepuluh perlakuan dan tiga ulangan.
Hasil penelitian menunjukkan persentase daerah hambatan tertinggi terdapat pada isolat yang dipapari UV 60 menit (M9) sebesar 54,45% dan
terendah tanpa pemaparan UV (M0) sebesar 39,27%, morfologi makroskopis dan
mikroskopis seluruh isolat adalah sama, luas pertumbuhan miselium F. oxysporum tipe liar tertinggi adalah pada pengujian dengan isolat yang dipapari
UV 60 menit (M9) sebesar 35,05 cm2 dan terendah pada pemaparan UV 12 menit
(M5) sebesar 25,36 cm2. Diameter koloni tertinggi terdapat pada isolat yang
dipapari UV 60 menit (M9) sebesar 5,53 cm dan diameter terendah pada
pemaparan UV 12 menit (M5) sebesar 4,67 cm. Keparahan penyakit tertinggi
terdapat pada tanpa pemaparan UV (M0), 1 menit (M1), 6 menit (M3), dan 15
menit (M6) sebesar 100,00% dan terendah pada pemaparan UV 12 menit (M5)
sebesar 66,67%, kejadian penyakit adalah sama pada seluruh pemaparan UV yaitu sebesar 100,00%.
RIWAYAT HIDUP
Penulis (Muklis Adi Putra) lahir di Sipirok pada tanggal 16 Januari 1990. Anak terakhir dari lima bersaudara, dengan Ayahanda Abdul Hakim Tobing dan Ibunda Rosidah Siregar. Adapun riwayat pendidikan penulis adalah sebagai berikut:
Pendidikan Formal:
- Tahun 2002 penulis lulus dari SD Negeri 1 Sipirok - Tahun 2005 penulis lulus dari SMP Negeri 1 Sipirok - Tahun 2008 penulis lulus dari SMA Negeri 1 Sipirok
- Tahun 2008 penulis diterima sebagai mahasiswa Universitas Sumatera Utara melalui jalur Ujian Masuk Bersama (UMB) di Fakultas Pertanian, Program Studi Hama dan Penyakit Tumbuhan.
Pendidikan Informal:
- Tahun 2008-2013 sebagai anggota Ikatan Mahasiswa Pelindung Tanaman (IMAPTAN) Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2008-2012 aktif dalam organisasi Komunikasi Muslim Hama dan Penyakit Tumbuhan (KOMUS HPT) Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2009-2011 aktif dalam organisasi Unit Kegiatan Mahasiswa Merpati Putih (UKM MP) Universitas Sumatera Utara, Kesatuan Aksi Mahasiswa (KAM) RABBANI, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2010-2012 sebagai asisten Mikrobiologi Pertanian, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2012 sebagai asisten laboratorium Dasar Perlindungan Tanaman, laboratorium Mikrobiologi Akuatik, laboratorium Hama dan Penyakit Ikan, laboratorium Pestisida dan Teknik Aplikasi, laboratorium Hama dan Penyakit Pasca Panen, Fakultas Pertanian Universitas Sumatera Utara. - Tahun 2010 mengikuti Seminar Pertanian dengan tema “Meningkatkan
Ketahanan Pangan Nasional” yang dilaksanakan oleh Syngenta Group. - Tahun 2011 mengikuti Seminar Pertanian dengan tema “Meningkatkan
Ketahanan Pangan Nasional” yang dilaksanakan oleh BKM Al- Mukhlisin Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2011 melaksanakan Praktek Kerja Lapangan (PKL) di PT. Perkebunan Nusantara IV (PERSERO) Unit Kebun Dolok Ilir, Pematang Siantar.
- Tahun 2012 mengikuti seminar Karantina Pertanian dengan tema “Sosialisasi dan Penyebaran Informasi Karantina Pertanian” yang dilaksanakan oleh Kementerian Pertanian, BKP, Balai Karantina Petanian Kelas II Medan.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena Rahmat dan Kasih-Nya penulis dapat menyelesaikan skripsi ini dengan baik.
Adapun judul dari skripsi ini adalah “Pengaruh radiasi ultra violet terhadap virulensi Fusarium oxysporum f.sp passiflora di laboratorium”, disusun untuk mengembangkan ilmu pengetahuan tentang F. oxysporum pada tanaman markisa, dan selanjutnya sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Dr. Ir. Hasanuddin, MS. dan Dr. Lisnawita, S.P., M.Si. sebagai komisi
pembimbing skripsi yang telah banyak membimbing penulis dalam menyelesaikan skripsi ini, kepada Prof. Dr. Ir. Darma Bakti, MS. selaku dosen penilai yang telah memberikan banyak saran yang sifatnya membangun serta Ir. Mukhtar Iskandar Pinem, M.Agr selaku moderator dalam seminar hasil penelitian penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang membantu. Semoga bermanfaat bagi pihak yang membutuhkan.
Medan, April 2013
DAFTAR ISI
ABSTRACT ... i
ABSTRAK ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... v
DAFTAR ISI ... vi
DAFTAR GAMBAR ...viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN Latar belakang ... 1
Tujuan penelitian ... 4
Hipotesis penelitian ... 4
Kegunaan penelitian ... 4
TINJAUAN PUSTAKA Tanaman markisa (P. Edulis) ... 5
Fusarium oxysporum f.sp. passiflora ... 6
Gejala serangan ... 8
Faktor-faktor yang mempengaruhi penyakit ... 9
Pengendalian penyakit ... 9
Mutasi genetik mikroorganisme ... 10
METODOLOGI PENELITIAN Tempat dan waktu penelitian ... 14
Bahan dan alat ... 14
Bahan ... 14
Alat ... 14
Metode penelitian ... 14
Pelaksanaan penelitian ... 16
Pembuatan media PDA... 16
Penyediaan sumber inokulum ... 16
Fusarium oxsysporum tipe liar ... 16
Fusarium oxsysporum f.sp. passiflora tipe mutasian . 17 Uji antagonisme F. oxysporum f.sp. passiflora tipe mutasian terhadap F. oxysporum tipe liar di laboratorium ... 18
Uji patogenesitas F. oxysporum f.sp. passiflora tipe mutasian terhadap bibit markisa (bio assay) ... 18
Penanaman benih markisa ... 18
Pemeliharaan tanaman ... 19
Perbanyakan isolat F. oxysporum f.sp. passiflora tipe mutasian ... 19
Aplikasi isolat F. oxysporum f.sp. passiflora tipe mutasian ... 19
Peubah amatan ... 19
Daerah hambatan (inhibiting zone) ... 19
Pengamatan makroskopis dan mikroskopis F. oxysporum tipe mutasian dan tipe liar... 20
Luas pertumbuhan koloni F. oxysporum tipe liar ... 20
Diameter koloni F. oxysporum tipe liar ... 20
Keparahan penyakit ... 20
Kejadian penyakit ... 21
HASIL DAN PEMBAHASAN Daerah hambatan (inhibiting zone) ... 22
Pengamatan makroskopis dan mikroskopis ... 25
Makroskopis ... 25
Mikroskopis ... 28
Pengaruh F. oxysporum f.sp. passiflora tipe mutasian terhadap luas pertumbuhan koloni F. oxysporum tipe liar ... 30
Pengaruh F. oxysporum f.sp. passiflora tipe mutasian terhadap diameter pertumbuhan koloni F. oxysporum tipe liar ... 31
Keparahan penyakit ... 33
Kejadian penyakit ... 36
KESIMPULAN DAN SARAN Kesimpulan ... 43
Saran ... 44
DAFTAR GAMBAR
No Judul Hal
1. Buah markisa jenis markisa ungu ... 5
2. Fotomikrograf F. oxysporum ... 6
3. Lampu UV ... 11
4. Fotomikrograf spora tunggal pada media WA setelah 20 jam Perbesaran 1000x ... 17
5. Bagan pengujian antagonis metode dual culture ... 18
6. Pengujian antagonis metode dual culture ... 24
7. Histogram pertumbuhan koloni jamur setelah pemaparan sinar UV 26 8. Pertumbuhan hasil paparan UV ... 27
9. Fotomikrograf F. oxysporum f.sp. passiflora ... 28
10. Mating Type ... 29
11. Histogram keparahan penyakit ...34
12. Histogram kejadian penyakit... 37
13. Gejala serangan F. oxysporum f.sp. passiflora pada tanaman ... 39
DAFTAR TABEL
No Judul Hal
1. Daerah hambatan F. oxysporum f.sp. passiflora tipe mutasian
terhadap F. oxysporum tipe liar. ... 22 2. Morfologi isolat sebelum dipapari UV (M0
sinar UV (M
) dan setelah pemaparan
1-9) ... 25
3. Pertumbuhan koloni jamur setelah pemaparan UV (koloni)... 26 4. Luas pertumbuhan koloni F. oxysporum tipe liar
pada 1-8 hsi (cm2
5. Panjang diameter koloni F. oxysporum tipe liar
) ...30
pada 1-8 hsi (cm) ... 32 6. Keparahan penyakit F. oxysporum f.sp. passiflora tipe mutasian
terhadap tanaman markisa pada 1-4 hsa (%)... 33 7. Kejadian penyakit F. oxysporum f.sp. passiflora tipe mutasian
DAFTAR LAMPIRAN
No Judul Hal
1. Bagan penelitian ... 48
2. Daerah hambatan (inhibiting zone) data pengamatan 5 hsi ... 51
3. Daerah hambatan (inhibiting zone) data pengamatan 6 hsi ... 53
4. Daerah hambatan (inhibiting zone) data pengamatan 7 hsi ... 55
5. Daerah hambatan (inhibiting zone) data pengamatan 8 hsi ... 57
6. Panjang diameter, data pengamatan 1 hsi ... 59
7. Panjang diameter, data pengamatan 2 hsi ... 61
8. Panjang diameter, data pengamatan 3 hsi ... 63
9. Panjang diameter, data pengamatan 4 hsi ... 65
10. Panjang diameter, data pengamatan 5 hsi ... 67
11. Panjang diameter, data pengamatan 6 hsi ... 69
12. Panjang diameter, data pengamatan 7 hsi ... 71
13. Panjang diameter, data pengamatan 8 hsi ... 73
14. Luas pertumbuhan, data pengamatan 1 hsi ... 75
15. Luas pertumbuhan, data pengamatan 2 hsi ... 77
16. Luas pertumbuhan, data pengamatan 3 hsi ... 79
17. Luas pertumbuhan, data pengamatan 4 hsi ... 81
18. Luas pertumbuhan, data pengamatan 5 hsi ... 83
19. Luas pertumbuhan, data pengamatan 6 hsi ... 85
20. Luas pertumbuhan, data pengamatan 7 hsi ... 87
22. Keparahan penyakit, data pengamatan 1 hsi ... 91
23. Keparahan penyakit, data pengamatan 2 hsi ... 93
24. Keparahan penyakit, data pengamatan 3 hsi ... 95
25. Keparahan penyakit, data pengamatan 4 hsi ... 97
26. Kejadian penyakit, data pengamatan 1 hsi ... 99
27. Kejadian penyakit, data pengamatan 2 hsi ...101
28. Kejadian penyakit, data pengamatan 3 hsi ...103
29. Kejadian penyakit, data pengamatan 4 hsi ...105
30. Uji patogenesitas ...107
ABSTRACT
Muklis Adi Putra. 2013. “Ultra violet irradiation effect toward Fusarium oxysporum f.sp passiflora’s virulency in laboratory” supervised by Hasanuddin and Lisnawita. This research aims to determine Fusarium oxysporum f.sp passiflora’s virulency result ultra violet irradiatied in laboratory. The research was conducted at Plant Pathology Laboratory, Agroecotechnology Program Study, Faculty of Agriculture Universitas Sumatera Utara, Medan from August to November 2012. It was done by using Completely Randomized Design (CRD) Non Factorial with ten treatments and three replications.
The result showed that the highest percentage of inhibiting zones contained in 60 minutes UV irradiated isolate (M9) at 54.45% and the lowest were
in without UV irradiated isolate (M0) at 39.27%. Macroscopis and microscopis
morfology from all isolated are completely same, highest extensive growth of mycelium from wild F. oxysporum was founded at 60 minutes UV irradiated isolate (M9) at 35.05 cm2 and the lowest were 12 minutes UV irradiated (M5) at
25.36 cm2. The highest colony diameter was founded at 60 minutes UV irradiated isolate (M9) at 5.53 cm and the lowest were 12 minutes UV irradiated (M5) at
4.67 cm. The highest disease severity was founded at without UV irradiation (M0), 1 minutes (M1), 6 minutes (M3) and 15 minutes (M6) UV irradiation at
100.00% and the lowest was founded at 12 minutes UV irradiated (M5) at
66.67%, the disease incident is same for all UV irradiation at 100.00%.
ABSTRAK
Muklis Adi Putra. 2013. “Pengaruh radiasi ultra violet terhadap virulensi Fusarium oxysporum f.sp passiflora di laboratorium” dibawah bimbingan Hasanuddin dan Lisnawita. Penelitian ini bertujuan untuk mengetahui virulensi F. oxysporum f.sp. passiflora akibat radiasi ultra violet di laboratorium. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan Agustus sampai Nopember 2012. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan sepuluh perlakuan dan tiga ulangan.
Hasil penelitian menunjukkan persentase daerah hambatan tertinggi terdapat pada isolat yang dipapari UV 60 menit (M9) sebesar 54,45% dan
terendah tanpa pemaparan UV (M0) sebesar 39,27%, morfologi makroskopis dan
mikroskopis seluruh isolat adalah sama, luas pertumbuhan miselium F. oxysporum tipe liar tertinggi adalah pada pengujian dengan isolat yang dipapari
UV 60 menit (M9) sebesar 35,05 cm2 dan terendah pada pemaparan UV 12 menit
(M5) sebesar 25,36 cm2. Diameter koloni tertinggi terdapat pada isolat yang
dipapari UV 60 menit (M9) sebesar 5,53 cm dan diameter terendah pada
pemaparan UV 12 menit (M5) sebesar 4,67 cm. Keparahan penyakit tertinggi
terdapat pada tanpa pemaparan UV (M0), 1 menit (M1), 6 menit (M3), dan 15
menit (M6) sebesar 100,00% dan terendah pada pemaparan UV 12 menit (M5)
sebesar 66,67%, kejadian penyakit adalah sama pada seluruh pemaparan UV yaitu sebesar 100,00%.
PENDAHULUAN
Latar belakang
Tanaman Markisa (Passiflora edulis) merupakan salah satu jenis tanaman buah subtropis. Berasal dari Amerika Selatan yaitu Brazil. Tanaman ini telah dibudidayakan di berbagai negara, antara lain Australia (Queensland), Amerika Selatan (Hawaii), Fiji, Kenya, Tanzania dan Indonesia (Semangun, 2000). Di Indonesia Markisa telah dikembangkan di beberapa Propinsi terutama di Sumatera Utara, Sumatera Barat, Lampung dan Sulawesi Selatan (BBPHP, 2004).
Terdapat 4 (empat) jenis Markisa yang dibudidayakan di Indonesia, yaitu
1. Markisa Ungu (P. edulis var. edulis), 2. Markisa Konyal (P. lingularis), 3. Markisa Kuning (P. edulis var. flavicarpa), dan 4. Markisa Erbis (P. quadrangularis) (BBPHP, 2004).
Markisa menghasilkan sari buah beraroma unik, spesifik, sangat menyengat sehingga banyak diproduksi menjadi produk olahan seperti sirup. Beberapa peneliti melaporkan bahwa selain aroma dan sari buahnya yang menarik, Markisa juga mengandung zat gizi yang tinggi seperti glikosida passiflorine dan alkaloid yang berguna untuk menenangkan syaraf. Oleh karena itu, proyeksi kebutuhan Markisa akan meningkat seiring kesadaran masyarakat tentang makanan sehat dan aromatik alami, sehingga mempunyai potensi besar dalam pengembangan agroindustri baik dalam bentuk Markisa segar maupun olahan (Pertiwi, 2012).
masih cukup rendah dan cenderung semakin menurun. Di Sumatera Utara, penurunan tersebut dapat dilihat dari areal tanam yang berkurang dari 748 ha pada tahun 2003 menjadi 358 ha pada tahun 2004 (Saragih et al. 2006).
Salah satu penghambat dalam meningkatkan produksi Markisa adalah penyakit yang disebabkan oleh jamur patogen, seperti penyakit layu Fusarium yang disebabkan Fusarium oxysporum f.sp. passiflora. Gejala yang mencolok dari penyakit layu Fusarium adalah terjadinya penguningan tepi daun tua sampai daun muda. Secara berangsur-angsur tangkai daun layu dan pangkal daun menjadi patah. Ukuran daun yang baru muncul menjadi semakin lebih kecil, tampak berkerut dan rusak. Akhirnya tanaman mati (Hermanto & Setyawati, 2002 dalam Saragih et al. 2006).
Saat ini banyak metode yang dapat dilakukan untuk mengisolasi strain non-patogenik, diantaranya dengan mengisolasi dari tanah supresif terhadap penyakit layu (Alabouvette & Couteaudier 1992), dari jaringan akar tanaman (Yamaguchi et al. 1992) atau dari tipe liar (wild type) patogen itu sendiri yang
dibuat menjadi mutan melalui berbagai perlakuan mutasi (Freeman et al. 2002). Penggunaan sinar UV untuk memutasi strain patogenik (liar) menjadi strain non-patogenik (mutasian) sudah dipraktekkan sejak lama. Sinar UV diketahui mampu menginduksi terjadinya mutasi pada mikroba, baik pada kondisi alamiah maupun laboratorium (Pelczar & Chan, 1986).
Dari hasil penelitian Susanti et al. (2009) diperoleh bahwa FOL mutasian mengalami kehilangan patogenesitasnya dalam menginfeksi tanaman dibandingkan dengan FOL liar. Hal ini dapat dilihat dengan gejala browning yang kecil dan bahkan tidak menimbulkan gejala browning pada pembuluh vaskuler batang. Kemampuan isolat mutasian untuk tidak menginfeksi tanaman akan menguntungkan dalam mengendalikan dan menghambat perkembangan isolat patogenik jika isolat mutasian lebih dahulu menginfeksi dan mengolonisasi jaringan tanaman, sehingga isolat FOL mutasian akan mampu menjadi agens antagonis terhadap isolat FOL liar.
Tujuan penelitian
Untuk mengetahui virulensi F. oxysporum f.sp. passiflora akibat radiasi sinar ultra violet di laboratorium.
Hipotesis penelitian
Terdapat perbedaan virulensi Fusarium oxysporum f.sp. passiflora akibat radiasi sinar ultra violet terhadap F. oxysporum tipe liar.
Kegunaan penelitian
− Sebagai salah satu syarat untuk memperoleh gelar sarjana pertanian di
Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Tanaman markisa (P. edulis)
Tanaman Markisa (Gambar 1) termasuk tanaman subtropis. Jika ditanam di Indonesia harus di daerah yang mempunyai ketinggian antara 700-2.000 meter di atas permukaan laut dengan curah hujan minimal 2.000-3.000 mm per tahun, suhu lingkungan antara 18-25o C, dan tidak banyak angin. Markisa dapat tumbuh di berbagai jenis tanah. Markisa tumbuh subur pada tanah gembur, mengandung banyak humus, mempunyai pH antara 5,5-7,5 berdrainase dan aerasi yang baik. Sebaliknya jika tanah tersebut masam, maka perlu ditambahkan kapur pertanian yaitu dolomit. Jika lahan mempunyai kemiringan lebih dari 15%, harus dibuat terasering (Karsinah et al. 2010; Jayaputra, 2008).
Gambar 1. Buah markisa jenis markisa ungu
Jarak tanam yang digunakan untuk tanaman Markisa adalah 3x4 sampai 4x5 meter. Dengan demikian jumlah tanaman adalah 500-833 pohon/ha. Jika satu
Fusarium oxysporum f.sp. passiflora
Genus Fusarium (Gambar 2) adalah salah satu genus jamur yang sangat penting secara ekonomi dan merupakan spesies patogen yang menyebabkan penyakit layu pada berbagai tanaman (Saragih & Silalahi, 2006). Menurut Agrios (2005) klasifikasi jamur ini adalah sebagai berikut:
Kingdom : Mycetae Divisio : Mycota
Sub Divisi : Deuteromycotina Class : Hyphomycetes
Ordo : Hyphales (Moniliales) Family : Tuberculariaceae Genus : Fusarium
Species : F. oxysporum f.sp. pasiflora
Gambar 2. Fotomikrograf F. oxysporum (a) spora, (b) konidofor perbesaran 1000 x
Koloni F. oxysporum f.sp. passiflora tumbuh dengan cepat, mencapai diameter 4,5-6,5 cm dalam waktu empat hari pada suhu 25°C pada inkubator. Permukaan miselium jarang sampai berlimpah. Pada Media Potato Dextrose Agar
(PDA) mula-mula miselium berwarna putih, semakin tua warna menjadi semakin
a
krem atau kuning pucat. Dalam keadaan tertentu berwarna merah muda atau ungu. Beberapa isolat mempunyai aroma seperti bunga bungur. Beberapa isolat lainnya menghasilkan sporodokium dengan lendir orange dari makrokonidiumnya (Soesanto, 2008; Djaenuddin, 2011).
Jumlah mikrokonidium pada Fusarium umumnya berlimpah dan tidak bersekat, berbentuk bulat panjang atau silinder, lurus atau sering lengkung dan berukuran (5-12) x (2,3-3,5) μm. Makrokonidium agak lengkung, runcing di kedua ujungnya, mempunyai 3-5 sekat, berukuran (20-60) x (3,0-5,0) μm. Klamidospora terbentuk di ujung atau tengah hifa serta pada konidia, berwarna hialin, berdinding halus atau kasar dan berdiameter 5-15 μm, berbentuk semi bulat, terletak terminal atau interkalar, dan berpasangan atau tunggal (Soesanto, 2008).
Daur hidup F. oxysporum f.sp. passiflora mengalami fase patogenesis dan saprogenesis. Pada fase patogenesis jamur hidup sebagai parasit pada tanaman inang. Apabila tidak ada tanaman inang, patogen hidup di dalam tanah sebagai saprofit pada sisa tanaman dan masuk fase saprogenesis, yang dapat menjadi sumber inokulum untuk menimbulkan penyakit pada tanaman lain. Penyebaran propagul dapat terjadi melalui angin, air tanah, tanah terinfeksi, terbawa oleh alat pertanian dan manusia. Jamur dapat bertahan lama di dalam tanah hingga beberapa tahun sebagai klamidospora yang banyak terdapat di dalam akar yang sakit, bermacam-macam rumput, dan pada tanaman jenis Heliconia (Djaenuddin, 2011).
kawin (mating type) yang berbeda bersentuhan, kemudian melebur membentuk zigot. Hifa jantan atau betina dari Fusarium tidak dapat dibedakan secara visual maupun morfologis, hanya dapat dibedakan menjadi tipe kawin berdasarkan struktur genetiknya. Sedangkan perkembangbiakan secara aseksual terjadi dengan cara membelah diri (terbelahnya hifa) atau dengan pertumbuhan spora haploid (Schooley, 1997)
Gejala serangan
Gejala awal yang ditimbulkan penyakit ini adalah daun tua layu diikuti oleh daun yang lebih muda. Kadang-kadang kelayuan didahului dengan menguningnya daun terutama daun bawah. Gejala lebih lanjut adalah daun tiba-tiba jatuh dan akhirnya menggantung pada batang pohon, dan tangkai daun patah (Semangun, 2000; Djaenuddin, 2011).
Faktor-faktor yang mempengaruhi penyakit
Suhu optimum untuk pertumbuhan jamur Fusarium adalah 20-30oC, maksimum pada 37oC dan minimum sekitar 5o
Jamur F. oxysporum f.sp. passiflora tumbuh baik pada media biakan dengan kisaran pH 3,6-8,4. Dan akan tumbuh baik pada tanah dengan kisaran pH 4,5-6,0. Sedangkan untuk pensporaan pH optimum sekitar 5,0. Pensporaan yang terjadi dengan pH di bawah 7,0 adalah 5-20 kali lebih besar dan terjadi secara melimpah pada semua jenis tanah, tetapi tidak akan terjadi pada pH di bawah 3,6 atau di atas 8,8 (Djaenuddin, 2011).
C (Djaenuddin, 2011). Suhu titik kematian jamur F. oxysporum f.sp. passiflora antara 57,5-60°C selama 30 menit dalam tanah (Soesanto, 2008).
Pengendalian penyakit
Strategi manajeman pengendalian penyakit layu telah banyak digunakan, misalnya perlakuan benih (seed treatment) dengan menggunakan pestisida, teknik budidaya tanaman seperti rotasi tanaman, pemilihan benih yang berkualitas tinggi, dan pemanfaatan lahan dengan pemupukan yang baik (Nelson, 1999). Perlindungan tanaman terhadap patogen penyakit tanah F. oxysporum f.sp.
passiflora dengan fungisida harus dihindari karena banyak menimbulkan masalah
berupa bioakumulasi residu bahan kimia pada organisme bukan sasaran, meningkatkan ketahanan patogen terhadap fungisida serta pencemaran lingkungan
Di era globalisasi sekarang ini, konsumen menghendaki produk pertanian yang bebas residu bahan kimia berbahaya. Oleh karena itu, perlu dikembangkan teknologi ramah lingkungan dengan komponen berupa benih sehat dan tahan terhadap penyakit layu (Tombe, 2010; Beckman, 1987). Pengendalian hayati patogen tanaman dapat dilakukan dengan pemanfaatan mikroorganisme antagonis yang dapat menekan atau menghambat perkembangan patogen tanaman (Riswanto et al.
Salah satu mikroorganisme yang masuk dalam komponen pengendalian hayati yang ramah lingkungan atau golongan Plant Growth Promotion
Microorganism (PGPM) yaitu F. oxysporum non-patogenik. Kelompok F. oxysporum non-patogenik dilaporkan dapat menginduksi ketahanan tanaman
terhadap penyakit layu Fusarium, busuk Phytophthora, dan layu Verticilium (Mariano et al. 1997; Yamaguchi et al. 1992; Hyakumamachi, 1997 dalam Tombe, 2010). Efektivitas F. oxysporum non-patogenik sama dengan benomil untuk mengendalikan penyakit layu Fusarium pada ubi jalar (Tombe, 2010). Strain F. oxysporum non-patogenik ketika diterapkan pada beberapa perakaran tanaman dapat menunda gejala penyakit yang diakibatkan oleh patogen (Soesanto, 2008).
2010).
Mutasi genetik mikroorganisme
seperti sinar UV, X-rays, γ-rays, temperatur ekstrim, atau reaksi bahan kimia yang tinggi seperti nitrogen dan sulfur bubuk, epoksida, peroksida, penol dan alkaloid (Agrios, 2005).
Gambar 3. Lampu UV, (a) Lampu UV, (b) sinar UV panjang gelombang 254 nm
Penggunaan sinar UV untuk mutasi strain patogenik (liar) menjadi strain Sinar UV (Gambar 3) diketahui merupakan salah satu sinar dengan daya radiasi yang dapat bersifat letal bagi mikroorganisme. Sinar UV mempunyai panjang gelombang mulai 4 nm hingga 400 nm dengan efisiensi tertinggi untuk pengendalian mikroorganisme adalah pada 365 nm. Karena bersifat letal maka radiasi UV sering digunakan di tempat-tempat yang menuntut kondisi aseptik seperti laboratorium, ruang operasi rumah sakit, ruang produksi industri makanan dan minuman, farmasi (Suwahyono et al. 2005) serta vaksin dan air (Hart, 1960; Ricks, at al. 1955; Collier et al. 1955 dalam Abshire & Dunton, 1981). Salah satu sifat sinar UV adalah daya penetrasi yang sangat rendah. Selapis kaca tipis pun sudah mampu menahan sebagian besar sinar UV. Oleh karena itu, sinar UV hanya dapat efektif untuk mengendalikan mikroorganisme pada permukaan yang terpapar langsung oleh sinar UV, atau mikroba berada di dekat permukaan medium yang transparan (Atlas, 1981).
non-patogenik (mutan) sudah dipraktekkan sejak lama. Sinar UV diketahui mampu menginduksi terjadinya mutasi pada mikroba, baik pada kondisi alamiah maupun laboratorium (Pelczar & Chan, 1986). Absorbsi maksimal sinar UV di dalam sel terjadi pada asam nukleat, maka diperkirakan mekanisme utama perusakan sel oleh sinar UV pada ribosom dan membran sel, sehingga mengakibatkan terjadinya mutasi atau kematian sel (Atlas, 1981; Cahyonugroho, 2010). Snider et al. (1991) dalam Cahyonugroho (2010) menyatakan bahwa absorbsi UV oleh DNA (atau RNA pada beberapa virus) dapat menyebabkan mikroorganisme tersebut tidak mampu melakukan replikasi akibat pembentukan ikatan rangkap dua pada molekul-molekul pirimidin.
Mekanisme yang menyebabkan patogen berubah menjadi non-patogenik adalah karena adanya perubahan biokimia secara genetis pada strain patogenik. Pada proses ini produksi enzim Pektik Lyase Ekstraseluler berkurang aktifitas Polygalacturonase menurun, dan terjadinya defisiensi sekresi enzim Ekstraseluler (Yamaguchi et al. 1992; Freeman et al. 2002). Perubahan pigmen hasil mutasi ada yang bersifat genetis dan ada yang bersifat sementara, yang mungkin hanya disebabkan oleh kerusakan pigmen karena adanya pengaruh dari radiasi sinar UV, sehingga tidak diwariskan ke keturunannya (Susanti et al. 2009).
METODOLOGI PENELITIAN
Tempat dan waktu penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, pada ketinggian tempat ± 25 meter di atas permukaan laut pada bulan Agustus sampai Nopember 2012.
Bahan dan alat Bahan
Adapun bahan yang digunakan selama melaksanakan penelitian adalah media Potato Dextrose Agar (PDA), media Water Agar (WA), NaOCl 2%, bibit markisa sehat, patogen F. oxysporum f.sp. passiflora, cling wrap, kapas, alumunium foil, kertas stensil, air steril, aquades, alkohol 70 dan 96%, beras.
Alat
Adapun alat yang digunakan pada penelitian ini adalah lampu UV short wave ultra violet 254 nm (230 Volts, 50 Hz 17 Amps), cawan petri diameter 9 cm, erlemeyer, gelas ukur, tabung reaksi, batang L, hot plate, jarum inokulum, pipet volumetrik, mikroskop binokuler, autoclave, timbangan analitik, Laminar Air Flow (LAF), haemocytometer, inkubator, oven, kulkas, jangka sorong, kamera digital, Leaf Area Meter.
Metode penelitian
1. M0
2. M
: tanpa pemaparan UV
1
3. M
: pemaparan UV selama 1 menit
2
4. M
: pemaparan UV selama 3 menit
3
5. M
: pemaparan UV selama 6 menit
4
6. M
: pemaparan UV selama 9 menit
5
7. M
: pemaparan UV selama 12 menit
6
8. M
: pemaparan UV selama 15 menit
7
9. M
: pemaparan UV selama 30 menit
8
10.M
: pemaparan UV selama 45 menit
9
Ulangan yang digunakan adalah sebanyak 3 ulangan, yaitu ulangan A, B dan C. Sehingga total unit percobaan adalah 10 x 3 = 30 unit
: pemaparan UV selama 60 menit
Kombinasi perlakuan yang diperoleh adalah adalah sebagai berikut: M0A M0B M0
M
C
1A M1B M1
M
C
2A M2B M2
M
C
3A M3B M3
M
C
4A M4B M4
M
C
5A M5B M5
M
C
6A M6B M6
M
C
7A M7B M7
M
C
8A M8B M8
M
C
Data hasil penelitian dianalisis dengan menggunakan sidik ragam berdasarkan model linier sebagai berikut :
Yij Dimana :
= µ + αi + ∑ij
Yij
µ = efek nilai tengah
= respon atau nilai pengamatan pada perlakuan ke-i αi = efek dari perlakuan taraf ke-i
∑ij = efek error (Sastrosupadi, 2000).
Pelaksanaan penelitian Pembuatan media PDA
Kentang 250 g dipotong dadu kecil kemudian direbus dalam 1 l air, Setelah
air mendidih dan kentang matang, disaring dan diambil air saringannya. Dekstrosa
20 g dan agar 20 g dimasukkan dalam air hasil saringan. Dipanaskan lagi sampai agar
larut dan homogen. Setelah mendidih disaring dan ditambah air sampai volume akhir
1 l, dimasukkan dalam erlemeyer kemudian disumbat kapas dan ditutup dengan
alumunium foil, disterilkan dengan autoclave pada suhu 121°C dengan tekanan 15 psi
selama 15 menit (Nasikhah, 2008).
Penyediaan sumber inokulum 1. Fusarium oxysporum tipe liar
b
a
Gambar 4. Fotomikrograf spora tunggal pada media WA setelah 20 jam perbesaran 1000x (a) spora, (b) buluh kecambah.
Spora tunggal (Gambar 4) diperoleh dengan mengencerkan suspensi spora yang berasal dari kultur murni F. oxysporum f.sp. passiflora berumur 7 hari pada media PDA. Pada pengenceran 10-3 dan 10-4,masing-masing disebar 0,5 ml pada permukaan media WA dan diinkubasi selama 16-20 jam pada suhu kamar. Spora yang berkecambah diamati dibawah mikroskop binokuler, ditandai dan spora langsung dipindahkan pada media PDA. Diinkubasi selama 7 hari pada suhu kamar. Biakan murni hasil spora tunggal akan menjadi sumber inokulum yang digunakan pada penelitian ini.
2. Fusarium oxsysporum f.sp. passiflora tipe mutasian
Uji antagonisme F. oxysporum f.sp. passiflora tipe mutasian terhadap F. oxsysporumf.sp. passifloratipe liar di laboratorium
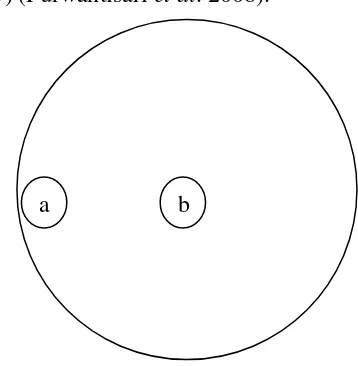
[image:33.595.235.414.274.457.2]Isolat F. oxysporum f.sp. passiflora tipe liar dan tipe mutasian yang telah dibiakkan selama 5x24 jam pada suhu kamar diuji dengan metode dual culture. Pada media PDA dibuat cakram dengan bor gabus berdiameter 0,8 cm. Satu cakram koloni F. oxysporum f.sp. passiflora tipe mutasian diletakkan 1 cm dari tepi cawan petri, sedangkan cakram koloni F. oxysporum tipe liar diletakkan tepat di tengah petri (Gambar 5) (Purwantisari et al. 2008).
Gambar 5. Bagan pengujian antagonis metode dual culture (a) F. oxysporum f.sp.
passiflora tipe mutasian (b) F. oxysporum f.sp. fassiflora tipe liar
Uji patogenesitas F. oxysporum f.sp. passiflora tipe mutasian terhadap bibit markisa (bio assay)
1. Persiapan media pembibitan
Media pembibitan yang digunakan adalah tanah top soil steril, dimasukkan ke dalam polibeg ukuran ¼ kg.
2. Penanaman benih markisa
Ditanam dua benih Markisa setiap satu polibeg, setelah tumbuh hanya digunakan satu bibit yang paling sehat untuk pengujian.
3. Pemeliharaan tanaman
Bibit Markisa yang telah tumbuh disiram setiap pagi dan sore hari, serta dilakukan satu kali pemupukan dengan menggunakan pupuk urea setiap polibeg dengan dosis yang dianjurkan, yaitu 0,25-1 g/bibit (Rukmana, 2012).
4. Perbanyakan isolat F. oxysporum f.sp. passiflora tipe mutasian
Fusarium oxysporum f.sp. passiflora tipe mutasian diperbanyak pada media beras steril masing-masing 10 g dan diinkubasikan selama 7 hari suhu kamar (Nasikhah, 2008).
5. Aplikasi isolat F. oxysporum f.sp. passiflora tipe mutasian
Aplikasi isolat F. oxysporum f.sp. passiflora tipe mutasian dilakukan saat tanaman Markisa berumur 1,5 bulan dengan menabur substrat pada daerah perakaran yang telah dilakukan pelukaan (Astiko et al. 2009).
Peubah amatan
Daerah hambatan (inhibiting zone)
Pengamatan dilakukan dengan mengukur daerah hambatan yang
dihasilkan F. oxysporum f.sp. passiflora tipe mutasian terhadap F. oxsysporumtipe liar. Pengukuran dilakukan dengan menggunakan rumus yang
dikemukakan oleh Fokkema (1973) dalam Dharmaputra et al. (1990), yaitu: r1 – r
I = x 100%
2
r dimana :
1
I = persentasi hambatan
r1 = jari-jari F. oxsysporumtipe liar yang menjauhi F. oxysporum
r2 = jari-jari F. oxsysporum tipe liar yang mendekati F. oxysporum
f.sp. passiflora tipe mutasian
Pengamatan makroskopis dan mikroskopis F. oxysporum Tipe Mutasian dan Tipe Liar
Pengamatan makroskopis dilakukan dengan mengamati morfologi, bentuk dan warna F. oxysporum f.sp. passiflora tipe mutasian secara langsung. Sedangkan untuk pengamatan mikroskopis diamati dengan menggunakan bantuan mikroskop binokuler.
Luas pertumbuhan koloni F. oxysporum tipe liar
Pengukuran luas pertumbuhan koloni isolat tipe liar dilakukan dengan cara menggambar pola luas pertumbuhan jamur tipe liar pada plastik transparan, digunting sesuai pertumbuhan dan dihitamkan, dan diukur dengan menggunakan leaf area meter.
Diameter koloni F. oxysporum tipe liar
Pengukuran diameter koloni dilakukan dengan mengukur panjang diameter koloni F. oxysporum tipe liar sejajar dengan F. oxysporum f.sp. passiflora tipe mutasian yang terbentuk akibat hambatan dari koloni isolat tipe mutasian.
Keparahan penyakit
Pengamatan keparahan penyakit dilakukan mulai 1 hsi sampai terdapat
tanaman mati, yaitu dengan mengamati respon layu tanaman akibat inokulasi F. oxysporum f.sp. passiflora tipe mutasian. Persentase keparahan penyakit dapat
∑ (ni x vi
I = x 100% )
N x Z Dimana :
I : intensitas serangan penyakit (keparahan penyakit) ni
v
: jumlah tanaman yang terserang
i
N : nilai kategori tertinggi
: nilai kategori dari tanaman terserang
Z : jumlah seluruh tanaman yang diamati ( Saragih et al. 2006). Skala intensitas penyakit layu Fusarium markisa adalah:
0 : tidak ada gejala layu 1 : gejala layu ringan 2 : gejala layu sedang 3 : gejala layu berat
4 : tanaman mati ( Saragih et al. 2006).
Kejadian penyakit
Pengamatan kejadian penyakit dilakukan mulai 1 hsi, yaitu dengan mengamati tanaman terserang akibat patogen F. oxysporum f.sp. passiflora tipe mutasian pada tanaman. Persentase kejadian penyakit dapat dihitung dengan menggunakan rumus:
a
P = x 100% a + b
Dimana :
P : persentase serangan penyakit (kejadian penyakit) a : jumlah tanaman yang terserang penyakit
HASIL DAN PEMBAHASAN
1. Daerah hambatan (inhibiting zone)
Analisis sidik ragam menunjukkan bahwa F. oxysporum f.sp. passiflora
tipe mutasian berpengaruh nyata dalam menghambat pertumbuhan F. oxysporum f.sp. passiflora tipe liar. Selengkapnya dapat dilihat pada Tabel 1
[image:37.595.114.502.283.500.2]dan Lampiran 2-5.
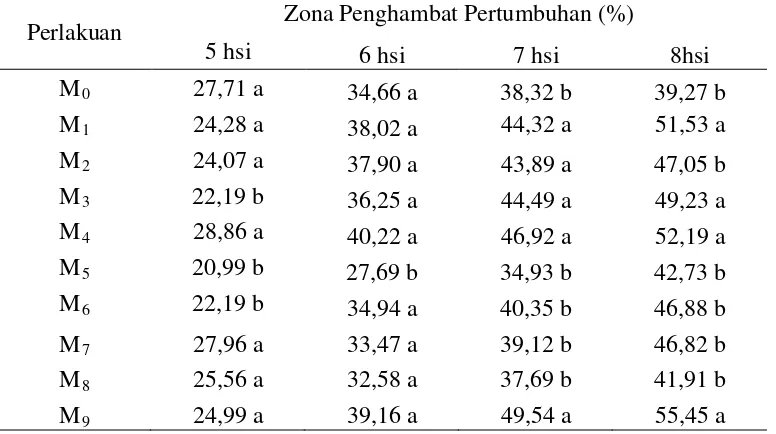
Tabel 1. Daerah hambatan F. oxysporum f.sp. passiflora tipe mutasian terhadap
F. oxysporum tipe liar.
Perlakuan Zona Penghambat Pertumbuhan (%)
5 hsi 6 hsi 7 hsi 8hsi
M0 27,71 a 34,66 a 38,32 b 39,27 b M1 24,28 a 38,02 a 44,32 a 51,53 a M2 24,07 a 37,90 a 43,89 a 47,05 b M3 22,19 b 36,25 a 44,49 a 49,23 a M4 28,86 a 40,22 a 46,92 a 52,19 a M5 20,99 b 27,69 b 34,93 b 42,73 b M6 22,19 b 34,94 a 40,35 b 46,88 b M7 27,96 a 33,47 a 39,12 b 46,82 b M8 25,56 a 32,58 a 37,69 b 41,91 b M9 24,99 a 39,16 a 49,54 a 55,45 a
Keterangan : angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%
hsi: hari setelah inokulasi
Tabel 1 menunjukkan bahwa F. oxysporum tipe liar mengalami hambatan pertumbuhan. Hal ini disebabkan karena adanya pertumbuhan miselium F. oxysporum f.sp. passiflora tipe mutasian yang mampu menghambat pertumbuhan F. oxysporum tipe liar. Persenase daerah hambatan tertinggi pada 5 dan 6 hsi terdapat pada perlakuan pemaparan isolat selama 9 menit (M4) masing-masing
dan 27,69%. Persentase daerah hambatan tertinggi pada 7 dan 8 hsi terdapat pada perlakuan pemaparan selama 60 menit (M9) yaitu sebesar 49,54% dan 55,54%.
Sedangkan persentase daerah hambatan terendah pada 7 hsi terdapat pada pemaparan selama 12 menit (M5) yaitu sebesar 34,93% dan daerah hambatan
terendah pada 8 hsi terdapat pada perlakuan tanpa pemaparan (M0
Dari data diatas dapat dilihat bahwa pertumbuhan persentase hambatan tidak stabil sesuai dengan lamanya pemaparan UV. Persentase pertumbuhan yang bervasiasi dari 5 hsi sampai 8 hsi menunjukkan keragaman hasil mutasi yang random. Yaitu terdapat suatu isolat dengan persentase hambatan yang tinggi dengan lama pemaparan yang rendah dan terdapat persentase hambatan yang rendah pada lama pemaparan yang lebih tinggi, begitu juga sebaliknya. Misalnya pada perlakuan pemaparan selama 1 menit (M
) yaitu sebesar 39,27%.
1) dan pemaparan 3 menit (M2),
dengan persentase hambatan masing-masing 51,53% dan 47,05%. Dari hasil ini dapat disimpulkan terjadi penurunan persentase hambatan. Tetapi penurunan tersebut tidak linear untuk lama pemaparan selanjutnya. Misalnya bila dibandingkan antara lama pemaparan 3 menit (M2) dan pemaparan 6 menit (M3
Pengambilan data daerah hambatan dilakukan saat terjadi pertemuan
miselium antara koloni isolat tipe liar dan isolat tipe mutasian. Pertumbuhan F. oxysporum tipe liar mendekati F. oxysporum f.sp. passiflora tipe mutasian dan
F. oxysporum f.sp. passiflora tipe mutasian terhambat pertumbuhannya dikarenakan bertemunya kedua miselium dari kedua isolat. Penghambatan ini
dikarenakan adanya persaingan yang dibentuk dari kedua isolat, baik persaingan ruang tumbuh, nutrisi dan sebagainya (Gambar 6).
Gambar 6. Pengujian antagonis metode dual culture (a) jamur uji belum mencapai zona hambatan, (b) jamur ujitelah mencapai zona hambatan .
Tabel diatas menunjukkan bahwa terdapat persentase daerah hambatan yang bervariasi antara berbagai isolat hasil pemaparan UV. Persentase hambatan yang tinggi pada suatu perlakuan dibandingkan dengan isolat mutasian yang lain memungkinkan terjadinya perbedaan kecepatan pertumbuhan antara seluruh isolat tipe mutasian. Semakin cepat pertumbuhannya maka semakin cepat pula dalam menghambat isolat tipe liar, dan persentase hambatan juga akan semakin meningkat. Hal ini dapat terjadi karena morfologi isolat yang sama sehingga cara hidup, cara memperoleh makanan, cara tumbuh pada media PDA juga pasti akan sama. Perbedaan kecepatan pertumbuhan membuktikan bahwa sinar UV mampu
merubah isolat tipe liar menjadi mutasian. Hal ini sesuai dengan literatur Agrios (2005) yang menyatakan bahwa mutasi dikatakan berhasil bila keturunan
dari individu yang dimutasi menunjukkan perbedaan karakter morfologi atau fisiologi dari individu sebelumnya. Freeman et al. (2002) menyatakan bahwa
pengaruh radiasi sinar UV ini pada proses mutagenesis disebabkan oleh kemampuan sinar UV dalam menginduksi perubahan secara genetis pada patogen, sehingga dapat mengubah patogen menjadi non-patogenik.
2. Pengamatan makroskopis dan mikroskopis a. Makroskopis
[image:40.595.114.488.317.510.2]Pengamatan morfologi koloni jamur F. oxysporum f.sp. passiflora tipe mutasian secara makroskopis dapat dilihat pada Tabel 2.
Tabel 2. Morfologi isolat sebelum dipapari UV (M0) dan setelah pemaparan sinar UV
(M1-M9 Perlakuan
)
Morfologi isolat
Warna koloni Bentuk Margin Elevasi M0 Putih kekuningan Circular Entire Raised M1 Putih kekuningan Circular Entire Raised M2 Putih kekuningan Circular Entire Raised M3 Putih kekuningan Circular Entire Raised M4 Putih kekuningan Circular Entire Raised M5 Putih kekuningan Circular Entire Raised M6 Putih kekuningan Circular Entire Raised M7 Putih kekuningan Circular Entire Raised M8 Putih kekuningan Circular Entire Raised M9 Putih kekuningan Circular Entire Raised
menyatakan bahwa pencirian F. oxysporum non-patogenik mengacu kepada F. oxysporum patogen, yaitu morfologinya sama sedangkan mekanisme kerjanya berbeda (Gambar 7).
Gambar 7. Pertumbuhan hasil pemaparan UV, berturut dari kiri ke kanan (tanpa pemaparan, 1 menit, 3 menit, 6 menit, 9 menit, 12 menit, 15 menit, 30 menit, 45 menit, 60 menit)
[image:41.595.132.492.236.406.2]Perbedaan kecepatan pertumbuhan dan jumlah koloni jamur yang tumbuh pada setiap perlakuan dapat dilihat pada Tabel 3.
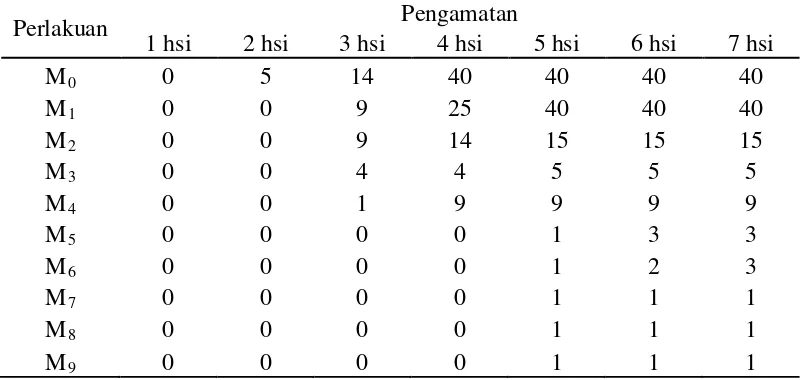
Tabel 3. Pertumbuhan koloni jamur setelah pemaparan sinar UV (koloni)
Perlakuan Pengamatan
1 hsi 2 hsi 3 hsi 4 hsi 5 hsi 6 hsi 7 hsi
M0 0 5 14 40 40 40 40
M1 0 0 9 25 40 40 40
M2 0 0 9 14 15 15 15
M3 0 0 4 4 5 5 5
M4 0 0 1 9 9 9 9
M5 0 0 0 0 1 3 3
M6 0 0 0 0 1 2 3
M7 0 0 0 0 1 1 1
M8 0 0 0 0 1 1 1
M9 0 0 0 0 1 1 1
Keterangan : hsi = hari setelah inokulasi
M0 M1 M2 M3 M4
[image:41.595.112.516.518.708.2]Tabel 3 dan Gambar 8 menunjukkan bahwa semakin lama suspensi F. oxysporum f.sp. passiflora dipapari, maka kemampuan spora jamur tersebut
[image:42.595.125.504.229.412.2]untuk tumbuh kembali lebih rendah. Pada 1 hsi tidak ada jamur yang tumbuh pada seluruh perlakuan. Sedangkan pada 2 hsi hanya isolat pada perlakuan tanpa pemaparan (M0) telah tumbuh, yaitu sebanyak 5 koloni pertumbuhan.
Gambar 8. Histogram pertumbuhan koloni jamur setelah pemaparan sinar UV
Pada 3 dan 4 hsi, isolat hasil pemaparan 1 menit (M1), 3 menit (M2), 6
menit (M3) dan 9 menit (M4) telah tumbuh, sedangkan suspensi paparan selama
12 menit (M5), 15 menit (M6), 30 menit (M7), 45 menit (M8) dan 60 menit (M9)
belum menunjukkan pertumbuhan koloni. Namun, pada 5 hsi seluruh jamur telah tumbuh. Koloni pertumbuhan jamur terbanyak dan tercepat terdapat pada perlakuan M0 (tanpa pemaparan) sebanyak >40 titik koloni (seluruh luas petridish
panjang diameter 9 cm telah ditumbuhi koloni jamur) dan terendah pada M7, M8,
dan M9 yaitu sebanyak 1 titik koloni. Hal ini disebabkan oleh daya sinar UV yang
mampu merusak materi genetik spora dan sel spora, dan mempengaruhi perumbuhan jamur tersebut. Sebagaimana disebutkan oleh Cahyonugroho (2010) bahwa radiasi UV yang diabsorbsi oleh protein pada membran sel akan
0 5 10 15 20 25 30 35 40 45
M0 M1 M2 M3 M4 M5 M6 M7 M8 M9
menyebabkan kerusakan membran sel dan kematian sel. Freeman et al. (2002) dan Yamaguchi et al. (1992) menyatakan bahwa sinar UV mampu menginduksi perubahan secara genetis pada patogen, sehingga dapat mengubah patogen menjadi non-patogenik. Agrios (2005) menyatakan bahwa mutasi adalah perubahan secara spontan dari material genetik dari sel. Mutasi dapat terjadi pada laju buatan yang tinggi dengan mengekspose organisme ke agen fisik lainnya misalnya ultra violet.
b. Mikroskopis
Hasil pengamatan diketahui bahwa pada F. oxysporum f.sp. passiflora tipe liar dan tipe mutasian tetap menghasilkan miselium yang bersepta, membenntuk konidiofor, klamidospora terdapat pada hifa, makrospora yang berbentuk ellips dengan ukuran yang lebih besar dibanding mikrospora dan keduanya hialin (Gambar 9).
Gambar 9. Fotomikrograf F. oxysporum f.sp. passiflora a. (1) mikrospora, (2) makrospora, (3) miselium perbesaran 400x; b. Klamidospora perbesaran 1000x
3 2
1
Hasil pengamtan mikroskopis yang sama antara tipe liar dengan tipe mutasian menunjukkan tidak ada perbedaan morfologi secara mikroskopis walaupun terjadi perbedaan pada persentase daerah hambatan. Hasil yang diperoleh diatas sesuai dengan literatur Weber, 1973 dalam Semangun (2000); Tombe (2010) yang menyatakan bahwa konidiofor dibentuk pada sporodokium. Rata-rata mikrokonidium berukuran 5-12 x 2-3,5 µm. Makrokonidium hialin, bersekat 3-4, bentuk sabit, berukuran 40-50 x 3-4,5 µm dan membentuk klamidospora. Selain ciri diatas terdapat juga hifa yang melakukan mating type pada isolat tipe mutasian dan isolat tipe liar. Hal ini sesuai dengan Agrios (2005) yang menyatakan bahwa mutasi dapat bereproduksi secara seksual atau aseksual.
Dari pengamatan mikroskopis diketahui bahwa terjadi perkawinan pada miselium isolat tipe liar itu sendiri, isolat tipe mutasian itu sendiri serta pada pertemuan kedua hifa jamur uji (Gambar 10).
Gambar 10. Matting type (a) Daerah pertemuan miselium antara F. oxysporum f.sp. passiflora tipe liar dan tipe mutasian (b) fotomikrograf matting type hifa perbesaran 1000x
Perkawinan yang terjadi pada koloni jamur merupakan perkembangan biakan secara seksual yang biasa terjadi pada kelompok jamur, dimana akan terjadi bila hifa yang berbeda bersentuhan dan selanjutnya akan melakukan penggabungan zigot dari keduanya. Hal ini sesuai dengan pernyataan Schooley (1997) yang
menyatakan bahwa fungi dapat berkembang biak secara seksual maupun aseksual. Perkembangan secara seksual terjadi ketika hifa dengan tipe perkawinan yang berbeda bersentuhan, kemudian melebur membentuk zigot. Hifa fungi tidak dapat dibedakan secara visual maupun morfologis menjadi jantan ataupun betina, hanya dapat dibedakan menjadi tipe perkawinan berdasarkan struktur genetiknya.
3. Pengaruh F. oxysporum f.sp. passiflora tipe mutasian terhadap luas pertumbuhan koloni F. oxysporum tipe liar
Analisis sidik ragam menunjukkan bahwa pertumbuhan koloni F. oxysporum f.sp. passiflora tipe mutasian berpengaruh nyata terhadap luas
[image:45.595.86.561.398.599.2]pertumbuhan koloni F. oxysporum tipe liar. Hal ini dapat dilihat pada Tabel 4 dan Lampiran 14-21.
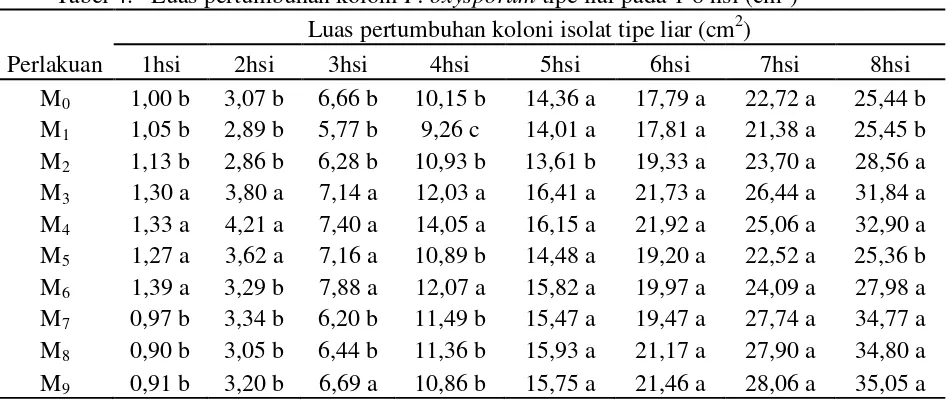
Tabel 4. Luas pertumbuhan koloni F. oxysporum tipe liar pada 1-8 hsi (cm2
Perlakuan
) Luas pertumbuhan koloni isolat tipe liar (cm2)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi 7hsi 8hsi M0 1,00 b 3,07 b 6,66 b 10,15 b 14,36 a 17,79 a 22,72 a 25,44 b M1 1,05 b 2,89 b 5,77 b 9,26 c 14,01 a 17,81 a 21,38 a 25,45 b M2 1,13 b 2,86 b 6,28 b 10,93 b 13,61 b 19,33 a 23,70 a 28,56 a M3 1,30 a 3,80 a 7,14 a 12,03 a 16,41 a 21,73 a 26,44 a 31,84 a M4 1,33 a 4,21 a 7,40 a 14,05 a 16,15 a 21,92 a 25,06 a 32,90 a M5 1,27 a 3,62 a 7,16 a 10,89 b 14,48 a 19,20 a 22,52 a 25,36 b M6 1,39 a 3,29 b 7,88 a 12,07 a 15,82 a 19,97 a 24,09 a 27,98 a M7 0,97 b 3,34 b 6,20 b 11,49 b 15,47 a 19,47 a 27,74 a 34,77 a M8 0,90 b 3,05 b 6,44 b 11,36 b 15,93 a 21,17 a 27,90 a 34,80 a M9 0,91 b 3,20 b 6,69 a 10,86 b 15,75 a 21,46 a 28,06 a 35,05 a
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%
Tabel 4 menunjukkan bahwa luas pertumbuhan koloni F. oxysporum f.sp. passiflora tipe liar tertinggi pada terdapat pada pemaparan
selama 60 menit (M9) yaitu sebesar 35,05 cm2. Sedangkan luas pertumbuhan
Kemampuan isolat tipe mutasian menghambat pertumbuhan isolat tipe liar dapat dilihat dari terhambatnya luas pertumbuhan isolat tipe liar secara in vitro. Hambatan pertumbuhan isolat tipe mutasian terhadap isolat tipe liar tidak linear terhadap lama pemaparan. Bahkan luas pertumbuhan yang terbentuk adalah random antara lama pemaparan yang satu dengan yang lain.
Pada perlakuan M9 memiliki luas pertumbuhan koloni isolat tipe liar
tertinggi dan M5 menjadi luas pertumbuhan terendah. Bila dibandingkan antara
M5 dengan M0 maka diperoleh selisih perbedaan luas sebesar 0,08 cm2. Namun
jika dibandingkan antara M5 dengan M9 maka diperoleh selisih luas pertumbuhan sebesar 9,69 cm2. Perbedaan hasil luas pertumbuhan ini dapat disebabkan kemampuan setiap isolat tipe mutasian dalam memberikan mekanisme dalam pertumbuhannya, yang menyebabkan isolat tipe liar memberikan reaksi untuk menjadi perumbuhan yang lebih cepat atau lebih lambat. Sebagaimana yang disebutkan Soesanto (2008) bahwa pencirian F. oxysporum non-patogenik mengacu kepada F. oxysporum patogen, morfologinya sama sedangkan mekanisme kerjanya berbeda.
4. Pengaruh F. oxysporum f.sp. passiflora tipe mutasian terhadap diameter koloni F. oxysporum tipe liar
Berdasarkan analisis sidik ragam diketahui bahwa koloni F. oxysporum f.sp. passiflora tipe mutasian berpengaruh nyata terhadap panjang
Tabel 5. Panjang diameter koloni F. oxysporum tipe liar pada 1-8 hsi (cm) Perlakuan Diameter koloni isolat tipe liar (cm)
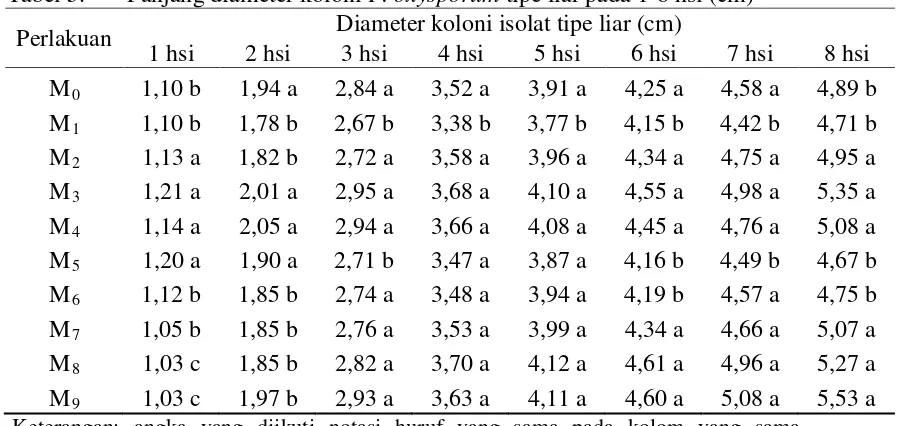
1 hsi 2 hsi 3 hsi 4 hsi 5 hsi 6 hsi 7 hsi 8 hsi M0 1,10 b 1,94 a 2,84 a 3,52 a 3,91 a 4,25 a 4,58 a 4,89 b M1 1,10 b 1,78 b 2,67 b 3,38 b 3,77 b 4,15 b 4,42 b 4,71 b M2 1,13 a 1,82 b 2,72 a 3,58 a 3,96 a 4,34 a 4,75 a 4,95 a M3 1,21 a 2,01 a 2,95 a 3,68 a 4,10 a 4,55 a 4,98 a 5,35 a M4 1,14 a 2,05 a 2,94 a 3,66 a 4,08 a 4,45 a 4,76 a 5,08 a M5 1,20 a 1,90 a 2,71 b 3,47 a 3,87 a 4,16 b 4,49 b 4,67 b M6 1,12 b 1,85 b 2,74 a 3,48 a 3,94 a 4,19 b 4,57 a 4,75 b M7 1,05 b 1,85 b 2,76 a 3,53 a 3,99 a 4,34 a 4,66 a 5,07 a M8 1,03 c 1,85 b 2,82 a 3,70 a 4,12 a 4,61 a 4,96 a 5,27 a M9 1,03 c 1,97 b 2,93 a 3,63 a 4,11 a 4,60 a 5,08 a 5,53 a
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsi = hari setelah inokulasi
Tabel 5 menunjukkan panjang diameter tertinggi pada 5 dan 6 hsi terdapat pada perlakuan pemaparan selama 45 menit (M8) yaitu sebesar 4,12 cm dan 4,61
cm. Sedangkan pada pengamatan 7 dan 8 hsi panjang diameter tertinggi terdapat pada pemaparan selama 60 menit (M9) yaitu sebesar 5,08 cm dan 5,53 cm.
Panjang diameter terendah pada 5 sampai 7 hsi terdapat pada pemaparan selama 1 menit (M1) yaitu sebesar 3,77 cm, 4,15 cm, 4,42 cm, sedangkan pada 8 hsi
panjang diameter terendah terdapat pada perlakuan pemaparan 12 menit (M5)
Dari hasil pertumbuhan diameter koloni isolat tipe liar, dapat disimpulkan bahwa hasil pemaparan memberikan mekanisme yang berbeda antara isolat hasil pemaparan. Hasil pemaparan tidak memberikan pengaruh yang bersifat linear terhadap diameter luas koloni isolat tipe liar, hal ini sejalan dengan luas pertumbuhan yang dihasilkannya sebagaimana telah disebutkan sebelumnya. Hasil mutasi yang random pada seluruh hasil paparan UV menjadikan diameter yang terbentuk jua akan random. Hal ini dikarenakan kemampuan setiap isolat tipe mutasian dalam memberikan mekanisme dalam pertumbuhannya, yang menyebabkan isolat tipe liar memberikan reaksi untuk menjadi perumbuhan yang lebih cepat atau lebih lambat. Sebagaimana yang disebutkan Soesanto (2008) bahwa pencirian F. oxysporum non-patogenik mengacu kepada F. oxysporum patogen, morfologinya sama sedangkan mekanisme kerjanya berbeda.
5. Keparahan penyakit
[image:48.595.114.509.538.742.2]Persentase keparahan penyakit tidak linear untuk seluruh perlakuan. Hasil selengkapnya dapat dilihat pada Tabel 6 dan Lampiran 22-25.
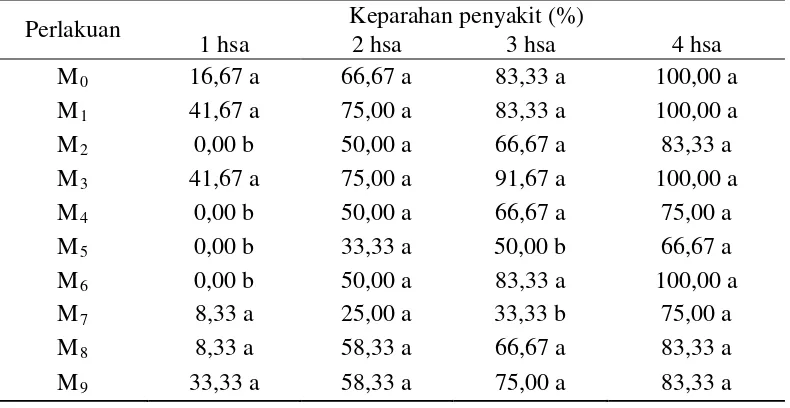
Tabel 6. Keparahan penyakit F. oxysporum f.sp. passiflora tipe mutasian terhadap tanaman markisa pada 1-4 hsa (%)
Perlakuan Keparahan penyakit (%)
1 hsa 2 hsa 3 hsa 4 hsa
M0 16,67 a 66,67 a 83,33 a 100,00 a M1 41,67 a 75,00 a 83,33 a 100,00 a
M2 0,00 b 50,00 a 66,67 a 83,33 a
M3 41,67 a 75,00 a 91,67 a 100,00 a
M4 0,00 b 50,00 a 66,67 a 75,00 a
M5 0,00 b 33,33 a 50,00 b 66,67 a
M6 0,00 b 50,00 a 83,33 a 100,00 a
M7 8,33 a 25,00 a 33,33 b 75,00 a
M8 8,33 a 58,33 a 66,67 a 83,33 a
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsa = hari setelah aplikasi
Tabel 6 menunjukkan bahwa terdapat perbedaan yang nyata respon tanaman terhadap aplikasi F. oxysporum f.sp. passiflora tipe mutasian pada 1 dan 3 hsa, sedangkan pada 2 dan 4 hsa tidak terdapat perbedaan. Persentase keparahan penyakit tertinggi pada 1 hsa terdapat pada perlakuan M1 dan M3 yaitu sebesar
41,67%. Persentase keparahan terendah terdapat pada perlakuan M2, M4, M5, dan
M6
Hasil pengamatan yang dilakukan diketahui bahwa pada perlakuan dengan pemaparan 30 menit (M
yaitu sebesar 0.00%.
7) terdapat peningkatan keparah penyakit yang signifikan
pada 3 hsa ke 4 hsa. Peningkatan keparahan penyakit ini diakibatkan pada 3 hsa masih terdapat 1 tanaman yang belum terinfeksi, sedangkan pada 4 hsa seluruh tanaman uji telah terinfeksi. Persentase keparahan penyakit tertinggi pada 4 hsa terdapat pada perlakuan M0, M1, M3 dan M6 yaitu sebesar 100,00%. Sedangkan
persentase keparahan penyakit terendah terdapat pada perlakuan M5 yaitu sebesar
66,67%.
Gambar 11 diketahui bahwa seluruh perlakuan memberikan tingkat patogenesitas yang berbeda. Tidak terjadinya kestabilan perubahan genetik pada hasil pemaparan telah menyebabkan beberapa isolat F. oxysporum f.sp. pasiflora tipe mutasian menjadi lebih patogenik atau sebaliknya dibandingkan dengan tipe liar. Hal ini sesuai dengan literatur Agrios (2005) yang menyatakan bahwa mutasi dikatakan berhasil bila keturunan dari individu yang dimutasi menunjukkan perbedaan karakter morfologi atau fisiologi dari individu sebelumnya (turunannya).
Perlakuan pemaparan dengan UV merupakan perlakuan fisik yang mampu merubah materi genetik patogen tersebut. Diharapkan dengan perubahan materi genetik tersebut maka akan menjadikan isolat tipe liar menjadi non-patogenik. Tetapi pada pengujian keparahan penyakit, diketahui bahwa terjadi penurunan keparahan penyakit pada isolat M5 dengan tingkat keparahan yang rendah
dibandingkan dengan tanpa dipapari UV. Tetapi terdapat juga suatu isolat dengan keparahan penyakit yang tidak berbeda dengan isolat yang masih liar yaitu pemaparan 1 menit dan 12 menit (M1 dan M6)
Perubahan keparahan penyakit tersebut bisa dikarenakan kemampuan isolat dalam menghasilkan pektin dan asam fusarat menjadi lebih rendah (M
.
5)
atau bahkan tidak dipengaruhi sama sekali (M1 dan M6) dengan keparahan
patogenik disebabkan oleh adanya perubahan biokimia pada strain non-patogenik tersebut, yaitu berkurangnya produksi enzim pektik lyase ekstraseluler, menurunnya aktifitas polygalacturonase, dan terjadinya defisiensi sekresi enzim ekstraseluler.
6. Kejadian penyakit
Persentase kejadian penyakit akibat inokulasi F. oxysporum f.sp. passiflora tipe mutasian terhadap tanaman markisa berbeda untuk setiap perlakuan. Kejadian penyakit tertinggi pada 1 hsa terdapat pada perlakuan pemaparan selama 60 menit (M9
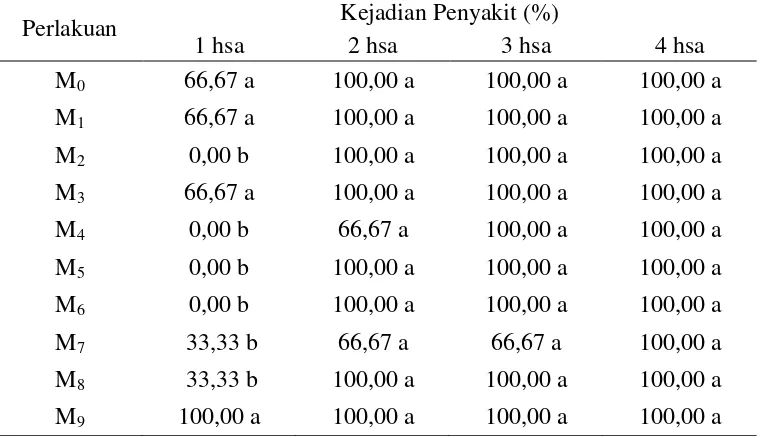
Tabel 7. Kejadian penyakit F. oxysporum f.sp. passiflora tipe mutasian terhadap tanaman markisa pada 1-4 hsa (%)
) yaitu 100,00% sedangkan pada 4 hsa seluruh perlakuan mengalami kejadian penyakit 100,00%. Hasil selengkapnya dapat dilihat pada Tabel 7 dan pada Lampiran 26-29.
Perlakuan Kejadian Penyakit (%)
1 hsa 2 hsa 3 hsa 4 hsa
M0 66,67 a 100,00 a 100,00 a 100,00 a M1 66,67 a 100,00 a 100,00 a 100,00 a M2 0,00 b 100,00 a 100,00 a 100,00 a M3 66,67 a 100,00 a 100,00 a 100,00 a M4 0,00 b 66,67 a 100,00 a 100,00 a M5 0,00 b 100,00 a 100,00 a 100,00 a M6 0,00 b 100,00 a 100,00 a 100,00 a M7 33,33 b 66,67 a 66,67 a 100,00 a M8 33,33 b 100,00 a 100,00 a 100,00 a M9 100,00 a 100,00 a 100,00 a 100,00 a
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
hsa = hari setelah aplikasi
[image:51.595.114.496.432.651.2]100,00% dan perlakuan paling lama untuk menginfeksi tanaman adalah perlakuan M2, M4, M5 dan M6 dengan kejadian penyakit sebesar 0,00%. Pada 4 hsa, seluruh
perlakuan telah menunjukkan kejadian penyakit 100,00%, ini berarti seluruh tanaman telah terinfeksi oleh patogen. Tingkat patogenitas yang dihasilkan setiap perlakuan tidak sejalan dengan peningkatan lama penyinaran. Hal ini disebabkan tidak terbentuk kestabilan perubahan genetik pada hasil pemaparan telah menyebabkan beberapa isolat menjadi lebih kuat atau lebih lemah dalam menginfeksi tanaman. Agrios (2005) menyatakan bahwa mutasi dikatakan berhasil bila keturunan dari individu yang dimutasi menunjukkan perbedaan karakter morfologi atau fisiologi dari individu sebelumnya (turunannya), misalnya pada perbedaan karakteristik (seperti warna, patogenesitas) dari yang telah dimutasi.
Gambar 12. Histogram kejadian penyakit
Dari Gambar 13 diatas dapat dilihat bahwa pada perlakuan M9 pada 1 hsa
kejadian penyakit tertinggi. Pada 4 hsa seluruh perlakuan mengalami kejadian menyakit yang sama yaitu sebesar 100%. Hasil penelitian ini membuktikan bahwa isolat F. oxysporum f.sp. passiflora tipe mutasian masih dapat menginfeksi tanaman. Perlakuan pemaparan dengan menggunakan sinar UV merupakan salah satu cara untuk menciptakan suatu strein non-patogenik dengan perlakuan fisik. Sehingga isolat tersebut masih mungkin untuk menjadi lebih patogenik atau bahkan tidak patogenik dibandingkan isolat asli yang masih liar. Sebagaimana yang disebutkan oleh Agrios (2005) bahwa mutasi dikatakan berhasil bila keturunan dari individu yang dimutasi menunjukkan perbedaan karakter morfologi atau fisiologi dari individu sebeumnya. Soesanto (2008) menyatakan bahwa F. oxysporum non-patogenik dikatakan berhasil bila mekanisme kerjanya berbeda.
Gambar 13. Gejala serangan F. oxysporum f.sp. passiflora pada tanaman (a) akar
tanaman sehat, (b) akar tanaman terinfeksi F. oxysporum f.sp. passiflora, (1) pangkal batang, (2) akar
Respon tanaman terhadap ketersediaan air dan unsur hara menjadikan tanaman menggugurkan daun untuk mengurangi evaporasi. Hal ini sesuai dengan literatur Pandey, 1982 yang menyatakan bahwa akibat dari serangan Fusarium akan berakibat pada daun dengan mengalami klorosis, gugurnya petiole, dan lamina daun akan menggantung dan layu.
Selain air dan nutrisi, enzim juga berperan dalam pelayuan tanaman. Fusarium itu sendiri menghasilkan pektin (Pektin Metil Esterase, dan Dipolimerase) yang berfungsi dalam melakukan degradasi sel. Hal ini sesuai dengan literatur Beckman (1987); Beckman et al. (1989) yang menyatakan bahwa jamur Fusarium yang berada dalam pembuluh menyebabkan kelayuan akibat enzim. Hal lain juga disebutkan Walker, 1957; Waggoner & Diamond, 1955 dalam Semangun (1996); Sanchez-Pena et al. (2010) yang menyatakan bahwa enzim-enzim memecah bahan pektin dalam dinding sel pembuluh kayu, yang juga masuk ke dalam dinding parenkim xilem. Fragmen-fragmen asam pektat masuk ke dalam pembuluh kayu dan membentuk massa koloidal, yang mungkin
1
1
2
2
mengandung bahan nonpektin, yang dapat menyumbat pembuluh. Pencoklatan berkas pembuluh disebabkan karena fenol-fenol yang terlepas, yang masuk ke dalam pembuluh dan segera mengalami polimerasi menjadi melanin yang berwarna coklat oleh sistem fenol oksidase tumbuhan inang. Bahan berwarna ini terutama diserap oleh pembuluh kayu yang berlignin yang menyebabkan warna coklat yang khas pada layu Fusarium.
Selain enzim diatas kelayuan juga dapat terjadi akibat produksi asam fusarat yang dihasilkan oleh Fusarium yang memang dikirimkan ke daun. Produksi asam fusarat yang tinggi atau rendah mungkin saja terbentuk pada hasil mutasi. Karena dalam pemaparan UV hanya perlakuan fisik yang dilakukan untuk merusak inti sel Fusarium tersebut. Sehingga produksi asam fusarat belum dapat disumpulkan semakin menurun akibat pemaparan UV. Semangun (1996) menyebutkan bahwa F. oxysporum f.sp. lycopersici membentuk senyawa yang lebih sederhana, yaitu asam fusarat (fusaric acid). Jika toksin-toksin ini diberikan kepada potongan ranting dan daun maka akan layu, tetapi kelayuan tidak sama dengan gejala kelayuan yang terjadi secara alami
Gambar 14. Histopatologi. (a) Jaringan pangkal batang markisa sehat, (b) Jaringan pangkal batang terinfeksi F. oxysporum f.sp. passiflora, perbesaran 400x
Gambar 14 diketahui bahwa pada tanaman yang masih sehat (Gambar 14-a), epidermis, floem, kambium, xilem dan empelur masih bagus.
Sedangkan pada jaringan tanaman yang terserang Fusarium (Gambar 14-b) terdapat empelur sudah rusak dan miselium sudah masuk ke dalam empelur, berarti telah menembus xilem dan floem. Bila telah terjadi demikian maka miselium akan menyebar dan bekembang untuk melakukan penyumbatan di jaringan angkut. Hal ini sesuai dengan literatur Gothoskar et al. dalam Walker (1957) yang menyatakan bahwa F. oxysporum f.sp. lycopersici menghasilkan enzim pektolitik segera pada media buatan, dedak, dan subtrat yang lain. Terutama pektin-metil-esterase untuk menghasilkan asam pektat dan depolimerase untuk memecah rantai asam pektat menjadi pilogalakturonida dengan bermacam-macam berat molekul. Semangun (1996) menyebutkan bahwa gejala yang paling khas akibat serangan Fusarium adalah jika tanaman yang sakit itu dipotong membujur dengan pisau dekat pangkal batang akan terlihat suatu cincin coklat atau merah dari berkas pembuluh. Pada serangan berat gejala demikian juga terdapat pada bagian tanaman sebelah atas. Pada tanaman yang
KESIMPULAN DAN SARAN
Kesimpulan
1. Terjadi perbedaan virulensi yang tidak linear (random) sesuai dengan peningkatan lama pemaparan UV.
2. Persentase daerah hambatan (inhibiting zone) tertinggi terdapat pada perlakuan pemaparan selama 60 menit (M9) yaitu sebesar 55,45% dan
terendah tedapat pada perlakuan perlakuan tanpa pemaparan (M0
3. Bentuk morfologi F. oxysporum f.sp. passiflora tipe mutasian dan tipe liar tetap sama.
) sebesar 39,27%.
4. Luas pertumbuhan koloni F. oxysporum f.sp. passiflora tipe liar tertinggi adalah pada perlakuan pemaparan selama 60 menit (M9) yaitu sebesar
35,05 cm2 dan terendah pada perlakuan pemaparan selama 12 menit (M5)
yaitu sebesar 25,36 cm2
5. Panjang diameter koloni F. oxysporum f.sp. passiflora tipe liar tertinggi adalah pada perlakuan pemaparan selama 60 menit (M
.
9) yaitu sebesar
5,53 cm dan terendah pada perlakuan pemaparan selama 12 menit (M5
6. Keparahan penyakit tertinggi terdapat pada perlakuan tanpa pemaparan (M ) yaitu 4,67 cm.
0),
pemaparan selama 1 menit (M1), pemaparan selama 6 menit (M3) dan
pemaparan selama 15 menit (M6) yaitu sebesar 100,00%, sedangkan
keparahan penyakit terendah terdapat pada pemaparan selama 12 menit (M5)
7. Kejadian penyakit tertinggi pada 1 hsi terdapat pada perlakuan pemaparan selama 60 menit (M9) yaitu sebesar 100,00%, sedangkan terendah
pada perlakuan pemaparan selama 3 menit (M2), pemaparan selama 9 menit
(M4), pemaparan selama 12 menit (M5) dan pemaparan selama 60 menit (M6
8. Semakin lama penyinaran UV terhadap F. oxysporum f.sp. passiflora maka jumlah spora dan tingkat kecepatan pertumbuhan spora semakin menurun.
) yaitu sebesar 0,00%. Pada 4 hsa kejadian penyakit seluruh perlakuan adalah sama yaitu 100,00%.
9. Bentuk morfologi hasil pemaparan UV dengan tidak dipapari UV adalah sama.
Saran
1. Perlu dilakukan peningkatan lama pemaparan untuk melihat tingkat patogenesitas lebih lanjut.
2. Perlu dilakukan penelitian lanjutan untuk mengetahui kandungan senyawa kimia dan susunan DNA dari F. oxysporum f.sp. passiflora tipe mutasian dan dibandingkan dengan F. oxysporum f.sp. passiflora tipe liar.
3. Perlu dilakukan penelitian lanjutan untuk melihat pengaruh F. oxysporum f.sp. passiflora tipe mutasian terhadap usia tanaman markisa yang lebih tua.
4. Perlu dilakukan penelitian lanjutan untuk mengetahui kemampuan F. oxysporum f.sp. passiflora tipe mutasian dalam menghambat F. oxysporum
DAFTAR PUSTAKA
Abshire, R.L. & H. Dunton. 1981. Resistance of Selected Strains of Pseudomonas aeruginosa to Low-Intensity Ultraviolet Radiation. 41(6):1419-1423.
Agrios, G. N. 2005. Plant Pathology. Academic Press, New York.
Alabouvette, C. and Couteaudier, Y. 1992. Biological Control of Fusarium Wilts With Nonpathogenic Fusaria. Pages 415-426. In: Biological Control of Plant Disease E.C. Tjamos, G.C. Paparizas and R.J. Cook. eds Plenum press. New York.
Astiko, W., Irwan. M., Yuni, F. 2009. Uji Ketahanan Beberapa Varietas Kacang Tanah Lokal Bima Terhadap Penyakit Sclerotium rolfsii Sacc. Crop Agro. 2(1):44-50.
Atlas, R. M. 1994. Microorganism in Our World. University of Louisville. Louisville. Kentucky.
Badan Pusat Statistik. 2011. Produksi Hortikultura & Buah-Buahan. BPS, Jakarta. Beckman, C. H. 1987. The Nature of Wilt Diseases of Plants. The American
Phytopathological Society, St. Paul, MN.
Beckman, C. H., Verdier, P. A. & Mueller, W. C. 1989. A System of Defence In Depth Provided by Vascular Parenchyma Cells of Tomato In Response To Vascular Infection With Fusarium oxysporum f. Sp. Lycopersici, Race 1. Physiol. Mol. Plant Pathol. 34:227-239.
BPPHP. 2004. Edisi 70 (Juni 2004). Sub Direktoreat Teknologi Pengolahan Hasil Hortikultura. Jl. Harsono RM No. 3 Ragunan Kanpus Deptan, Gd. D Lantai III.
Cahyonugroho, O.K. 2010. Pengaruh Intensitas Sinar Ultraviolet dan Pengadukan Terhadap Reduksi Jumlah Bakteri E.coli. Jurnal Ilmiah Teknik Lingkungan. 2(1):18-23.
De Weger, L.A., van der Bij, A.J., Dekkers, L.C., Simons, M., Wijffelman, C.A. & Lugtenberg, B.J.J. 1995. Colonization of The Rhizosphere of Crop Plants By Plant-Beneficial Pseudomonads. FEMS Microbiol. Ecol. 17:221-228.
Dickinson, C.H. & J.A. Lucas. 1982. Plant Pathology and Plant Pathogens. Blackwell Scientific Publications, Oxfor