Lampiran 1.Gambar alat pencetak kapsul dan pengering kapsul
Gambar alat pencetak kapsul
Lampiran 2. Gambar alat-alat uji spesifikasi cangkang kapsul
Gambar mikrometer skrup
Gambar jangka sorong
Gambar pH meter Gambar termometer
Gambar alat disolusi
Lampiran 4. Gambar alat uji kerapuhan
Untuk cangkang kapsul kosong (a)kotak akrilik dengan ukuran 9 x 9 x 13 cm (b)pipa plastik dengan diameter 3 cm dan tinggi 10 cm (c)anak timbangan 50 g
dengan diameter 1,8 cm dan tinggi 2,8 cm
Untuk cangkang kapsul berisi (a)kotak akrilik dengan ukuran 9 x 9 x 13 cm (b)anak timbangan 2 kg dengan diameter 5,8 cm dan tinggi 11,2 cm
a b c
Lampiran 5.Gambar alat uji aktivitas antibakteri
Mikropipet
Oven Inkubator
Lampiran 6. Kurva serapan larutan amoksisilin dalam medium lambung buatan
Lampiran 7. Kurva kalibrasi larutan amoksisilin pada panjang gelombang 277
Lampiran 8. Data pelepasan amoksisilin dari cangkang kapsul alginat 80-120 cP
dalam medium lambung buatan pH 1,2 Percobaan 1
Dosis Amoksisilin: 500 mg
Lampiran 8. (Lanjutan)
Percobaan 2
Dosis Amoksisilin: 500 mg
Lampiran 8. (Lanjutan)
Percobaan 3
Dosis Amoksisilin: 500 mg
Lampiran 9.Data %kumulatif pelepasan amoksisilin dari cangkang kapsul alginat Disolusi 1 Disolusi 2 Disolusi 3
Lampiran 10. Grafik kinetika pelepasan amoksisilin 500 mg dari cangkang
kapsul alginat 80-120 cP
y = 0,002x - 0,051
0,00 5,00 10,00 15,00 20,00 25,00 30,00
Lampiran 11. Data pelepasan dispersi padat amoksisilin:PVP K30 (1:1) dari
cangkang kapsul alginat 80-120 cP dalam medium lambung buatan pH 1,2
Percobaan 1
Dosis dispersi padat amoksisilin:PVP K30 (1:1): 1000 mg
Lampiran 11. (Lanjutan)
Percobaan 2
Dosis dispersi padat amoksisilin:PVP K30 (1:1): 1000 mg
Lampiran 11. (Lanjutan)
Percobaan 3
Dosis dispersi padat amoksisilin:PVP K30 (1:1): 1000 mg
Lampiran 12. Data % kumulatif pelepasan dispersi padat amoksisilin:PVP (1:1)
dari cangkang kapsul alginat 80-120 cP
Waktu (menit)
Disolusi
Rata-rata STDV Disolusi 1 Disolusi 2 Disolusi 3
Lampiran 13.Grafik kinetika pelepasan amoksisilin-PVP K30 (1:1) dari
cangkang kapsul alginat 80-120 cP
y = 0,002x + 0,525
0,00 5,00 10,00 15,00 20,00 25,00 30,00
%
0,00 0,50 1,00 1,50 2,00 2,50 3,00
Lampiran 14. Data AUC pelepasan amoksisilin dari cangkang kapsul alginat 690-720 1255,35 1161,88 1072,43
Total 13126,38 11187,59 9497,79
Lampiran 15. Data AUC pelepasan dispersi padat amoksisilin:PVP K30 (1:1) dari
cangkang kapsul alginat 80-120 cP
Lampiran 16. Data pengujian aktivitas antibakteri larutan standar amoksisilin
terhadap Staphylococcus aureus
Konsentrasi (ppm) (c)
Diameter Daerah Hambat
(mm) (x) Rata-rata STDEV
1 2 3
0 0,0 0,0 0,0 0,000 0,00
0,5 6,1 6,0 6,1 6,067 0,06
1 6,2 6,1 6,2 6,167 0,06
2 7,9 7,8 8,1 7,933 0,15
3 8,7 8,6 8,6 8,633 0,06
4 9,2 8,7 9,3 9,067 0,32
5 9,5 9,2 9,5 9,400 0,17
10 10,2 10,1 9,6 9,967 0,32
20 10,6 10,4 10,5 10,500 0,10
40 10,8 10,9 11,2 10,967 0,21
60 11,1 10,8 11,4 11,100 0,30
80 11,2 11,1 11,5 11,267 0,21
100 11,4 11,5 11,7 11,533 0,15
120 11,5 11,6 11,6 11,567 0,06
140 11,6 11,7 11,6 11,633 0,06
160 11,7 11,6 11,7 11,667 0,06
180 11,6 11,7 11,8 11,700 0,10
Lampiran 17. Data pengujian aktivitas antibakteri larutan standar amoksisilin
terhadap Eschericia coli
Konsentrasi (ppm) (c)
Diameter Daerah Hambat
(mm) (x) Rata-rata STDEV
1 2 3
0 0,0 0,0 0,0 0,0 0,00
0,5 6,0 6,1 6,0 0,0 0,06
1 6,4 6,3 6,2 6,4 0,10
2 7,8 7,8 7,9 6,8 0,06
3 8,1 8,2 8,4 8,1 0,15
4 8,5 8,6 8,7 8,5 0,10
5 8,8 8,7 8,9 8,8 0,10
10 9,7 9,6 9,5 9,7 0,10
20 10,2 10,3 9,8 10,2 0,26
40 10,6 10,4 10,7 10,6 0,15
60 10,8 10,7 10,8 10,8 0,06
80 11,0 11,1 10,9 11,0 0,10
100 11,2 11,2 11,0 11,2 0,12
120 11,3 11,2 11,2 11,3 0,06
140 11,4 11,3 11,3 11,4 0,06
160 11,3 11,5 11,4 11,3 0,10
180 11,4 11,5 11,5 11,4 0,06
Lampiran 18. Data pengujian aktivitas antibakteri aliquot disolusi sediaan
floating dispersi padat amoksisilin terhadap Staphylococcus aureus
Disolusi 1 Waktu
(jam)
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 6,0 6,0 6,0 6,00 0,00
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
Lampiran 18. (Lanjutan)
Disolusi 3 Waktu
(jam)
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 6,0 6,0 6,0 6,00 6,0
0,5 6,2 6,3 6,4 6,30 6,2
1 6,5 6,7 6,6 6,60 6,5
2 6,5 6,9 6,8 6,73 6,5
3 8,1 8,3 8,0 8,13 8,1
4 8,6 8,7 8,4 8,57 8,6
5 9,3 8,8 8,9 9,00 9,3
6 9,5 9,1 9,2 9,27 9,5
7 10,0 9,8 9,7 9,83 10,0
8 10,1 10,5 10,0 10,20 10,1
9 10,8 11,1 10,5 10,80 10,8
10 11,8 11,5 11,0 11,43 11,8
11 12,0 12,2 11,7 11,97 12,0
Lampiran 19. Data pengujian aktivitas antibakteri aliquot disolusi sediaan
floating dispersi padat amoksisilin terhadap Eschericia coli Disolusi 1
Waktu (jam)
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 6,0 6,0 6,0 6,00 6,0
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
Lampiran 19. (Lanjutan)
Disolusi 3 Waktu
(jam)
Diameter Daerah Hambat (mm)
Rata-rata STDEV Perlakuan I Perlakuan II Perlakuan III
0 6,0 6,0 6,0 6,00 0,00
0,5 6,3 6,2 6,1 6,20 0,10
1 6,6 6,5 6,7 6,60 0,10
2 6,8 8,2 7,2 7,40 0,72
3 7,4 8,5 7,9 7,93 0,55
4 8,2 8,7 8,9 8,60 0,36
5 9,3 9,2 9,4 9,30 0,10
6 10,4 10,4 10 10,27 0,23
7 10,6 11,1 10,8 10,83 0,25
8 10,8 11,7 11,1 11,20 0,46
9 11,0 11,4 11,5 11,30 0,26
10 11,3 11,9 11,9 11,70 0,35
11 11,8 12,0 12,4 12,07 0,31
DAFTAR PUSTAKA
Agoes, G. (2008) Sistem Penghantaran Obat Pelepasan Terkendali Seri Farmasi Industri 3. Bandung: Penerbit ITB: Halaman 95-99
Akil (2009). Tukak Duodenum. Buku Ajar Ilmu Penyakit Ilmu Dalam.Edisi V. Jilid I. Jakarta: Interna Publishing. Halaman 523-527.
Anggono, J. (2015). Formulasi dan Evaluasi Pemakaian Cangkang Kapsul Alginat untuk Pembuatan Sediaan Floating dari Dispersi Padat Aspirin.Skripsi. Medan: Universitas Sumatera Utara. Halaman 6; 46-49.
Ansel, H. C. (2005). Pengantar Bentuk Sediaan Farmasi. Edisi IV. Jakarta: UI Press. Halaman 217-218.
Bangun, H., Simanjuntak, M.T., Tarigan, P., dan Ismanelly, T. (2005).Pembuatan dan Karakterisasi Kapsul Alginat yang Tahan terhadap Asam Lambung.Media Farmasi13(1): 70-79.
Balouiri, M., Sadiki, M., Ibnsouda, S.K. (2016). Method for in vitro evaluation antimikrobial activity: A review. Journal of Pharmaceutical Analysis.(6):71-79
Bardonnet, P.L., Faivre, V., Pugh, W. J., Piffaretti, J. C.,Falson, F. (2006). Gastroretentive dosage forms: Overview andspecial case of Helicobacter pylori. Journal of Control Release.111(1-2): 1-18.
Beg, S., Amit, K.N., Kanchan, K., Suryakanta, S., Hasnain, M.S., (2012).Antimicrobial Activity Assessment of Time-Dependent Release Bilayer Tablets of Amoxicillin Trihydrate.Brazilian Journal of Pharmaceutical Sciences.48 (2): 265-272.
Berardi, R.R. dan Welage, L.S. (2005). Peptic Ulcer Disease. Dalam: Pharmacotherapy: A Pathophysiologic Approach. Sixth Edition. Editor Joseph T. Dipiro. Halaman 145-149
Clinical and Laboratory Standards Institute (CLSI).(2012). Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Fourth Informational Supplement.M100-S22.32(3): 1-184
Clinical and Laboratory Standards Institute (CLSI).(2014). Performance Standards
for Antimicrobial Susceptibility Testing; Twenty-Fourth Informational Supplement.M100-S24.34(1): 1-73
Davis, W.W., dan Stout, T.R. (1971). Disc Plate Method Of Microbiological Antibiotic Essay. Journal Of Microbiology. 22(4): 664.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Depkes RI. Halaman 1066, 1084-1085, 1143-1144.
Ditjen POM. (2014). Farmakope Indonesia. Edisi V. Jakarta: Depkes RI. Halaman 120; 1238-1240
Draget, K.I., Smidsrod, O., dan Gudmund S. (2005). Alginate from Algae. Weinheim: WILEY-VCH Verlag GmbH and Co. Halaman 3-4.
Dufton, J. (2012). The Pathophisiology and Pharmaceutical Treatment of Gastric Ulcers.PharmCon Inc 2: 23-34
Emara, L.H., Aya, R.A., Ahmed, A.E.,Rania, M.B., Nesrin, F.T., dan Nadia M.M. (2013). In Vitro Release Evaluation ofGastroretentive Amoxicillin FloatingTablets Employing a Specific Design ofthe Flow-Through Cell.Dissolution Technologies: 27-34.
Fransiska, E. (2015). Pembuatan dan Evaluasi Sediaan Gastroretentif Metronidazol dari Flim Alginat-Kitosan yang Ditambahkan HPMC.Tesis. Medan: Universitas Sumatera Utara. Halaman 32-33.
Fock, K.M. dan Tiing, L.A. (2010).Epidemiology of Helicobacter pylori infection and gastric cancer in Asia.Journal of Gastroenterology and Hepatology(25): 479-486.
Ganong, W.F. (2008). Buku Ajar Fisiologi Kedokteran. Edisi XXII. Penerjemah: M. Djuhari Widjajakusumah. Jakarta: Penerbit EGC. Halaman 253-266. Garg, R., dan Gupta, G.D. (2008).Progress in Controlled Gastroretentive Delivery
Systems.Tropical Journal of Pharmaceutical Research.7(3): 1055-1066. Gennaro, R.A. (2000). Remington: The Science and Practice of Pharmacy. Edisi
XX. New York. Lippincott Williams & Wilkins.Halaman 885.
Gopalakrishnan, dan Chenthilnathan. (2011). Floating Drug Delivery System: A Review. Journal of Pharmaceutical Science and Technology3(2): 548-554. Goyal, M., Rajesh, P., Kapil, K. P., dan Mehta, S. C. (2011).Floating Drug
Delivery System.Journal of Current Pharmaceutical Research.5(1): 7-18. Hu, L.D., Xing, Q.B., Shang, C., Liu, W., Liu, C., Luo, Z.L. dan Xu, H.X.
(2010).Preparationof Rosiglitazone Maleate Sustained-Release Floating Microspheres for ImprovedBioavailability.Pharmazie.65(7): 477-480. Irianto, K. (2006). Mikrobiologi Menguak Dunia Mikroorganisme. Jilid I.
Bandung: Yrama Widya. Halaman 56-58
Jorgensen, J.H. dan Ferraro, M.J. (2009)
Antimicrobialsusceptibilitytesting:areviewof
Kaur, S.P., Rekha R., dan Sanju, N. (2011). Amoxicilin: A Broad Spectrum Antibiotic. International Journal of Pharmaceutical Sciences Volume
3(3): 30-37.
Lay, B.W. (1994). Analis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Halaman 57-58.
Malfertheiner, P., Megraud, F., O’Morain, C.A., Atherton, J., Axon, A.T.R. dan Bazzoli, F. (2012) Management of H.pylori Infection the Maastricht IV/Florence consensus report.(61): 646-654.
Martin, A., Swarbrik, J., dan Cammarata, A. (2008).Dasar–dasar Farmasi Fisik dalam Ilmu Farmasetik. Alih Bahasa Yoshita. Edisi III. Jakarta: UI Press. Halaman 1170-1171, 1174.
McGuigan, J.E. (2001). Ulkus Peptikum dan Gastritis dalam Isselbacher J.K, Braunwald E.,Wilson J.D., Martin J.B., Harrison. Prinsip-Prinsip Ilmu Penyakit Dalam.Volume 4. Edisi XIII. EGC. Halaman 1532-1534.
Murakami, K., Okimoto, T., Kodama, M., Sato, R., Miyajima, H., Ono, M., Inoue, K., Watanabe, K., Otsu, S., dan Fujioka, T. (2006).Helicobacter.11(5): 436-440.
Murthy, P.N., Anjar, K.M., Tapan, K.N., dan Diptanu, D. (2015). Rivie Article: Formulation, characterization and drug release kinetics of floating drug delivery systems. Journal of Chemical and Pharmaceutical Research.7(6): 781-792.
Nagata, S. (2002). Advantages to HPMC Capsules: A New Generation’s. Pharm Tech. 2(2): 5-10.
Nayak, A.K., Maji, R. dan Das, B. (2010). Gastroretentive drug delivery systems: a review. Asian Journal of Pharmaceutical and Clinical Research.3(1): 3-4.
Neal, M.J. (2007). At A Galnce Farmakologi Medis. Edisi V. Penerjemah Juwalita Surapsari. Jakarta: Penerbit Erlangga. Halaman 8-15.
Potter dan Perry. (2005). Buku Ajar Fundamental Keperawatan: Konsep, Proses & Praktek. Edisi V. Volume 1. Jakarta : EGC. Halaman 34.
Pratiwi, S.T. (2008) Mikrobiologi Farmasi. Jakarta: Penerbit Erlanga. Halaman 106-108; 188-191.
Rani, A.A., dan Fauzi, A. (2009). Tukak Gaster. Buku Ajar Ilmu Penyakit Ilmu Dalam.Edisi VJilid I. Jakarta: Interna Publishing. Halaman 501-507. Robbins, S. L., Ramzi, S. C., dan Vinay, K., (1995). Pathologic Basis of Disease
Shah, S.H., Patel, J.K., dan Patel, N.V. (1999). Stomach Specific Floating Drug Delivery System: A Review. International Journal of PharmTech Research.1(3): 623-633.
Shargel, L., dan Yu, A. (2005). Biofarmasetika dan Farmakokinetika Terapan. Penerjemah: Fasich dan Siti Sjamsijah. Edisi II. Surabaya: Airlangga University Press. Halaman 86-112.
Sharma, N., Dilip, A., Gupta, M. K., dan Mahaveer, P. K. (2011).A Comprehensive Review on Floating Drug Delivery System.International Journal of Research in Pharmaceutical and Biomedical Sciences. 2(2): 428-429.
Simamora, E.R.F. (2014). Studi Pemakaian Cangkang Kapsul Alginat sebagai Sediaan Floating dari Metronidazol.Skripsi. Medan: Universitas Sumatera Utara. Halaman 41-54.
Siswandono dan Soekarjo, B. (1995). Kimia Medisinal. Edisi II. Surabaya: Airlangga University Press. Halaman 300, 303.
Sukandar, Y.E., Andrajati, R., Setiadi, P., dan Kusnandar. (2008). ISO Farmakoterapi. Jakarta: Penerbit PT. ISFI Penerbitan. Halaman 756-757. Swetha, S., Allena, R.T., dan Gowda, D.V. (2012).A Comprehensive Review on
Gastroretentive Drug Delivery System.International Journal of Research in Pharmaceutical and Biomedical Science.3(3): 1285-1293.
Syam, A.F., Miftahussurur, M., Dadang, M., Iswan, A.N., Lukman, H.Z., Zulkhairi, Fardah, A., Will, B.U., Simanjuntak, D., Uchida, T., Adi, P., Utari, A.P., Yudith, A.A.R., Phawinee, S., Nasronudin, Suzuki, R., Yoshio, Y. (2015). Risk Factors and Prevalence of Helicobacter pylori in Five Largest Islands of Indonesia: A Preliminary Study. Plos One: 1-14. Tarigan, P. (2009). Tukak Gaster. Buku Ajar Ilmu Penyakit Ilmu Dalam.Edisi
VJilid I. Jakarta: Interna Publishing. Halaman 513-522.
Thom, D., Toft, K., dan Walsh, M. J. (1981). Interchain Associations of Alginates and Pectins. Program Food Nutrition Science.6(8): 97-108.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan secara eksperimental yang meliputi pembuatan cangkang kapsul alginat, dispersi padat amoksislin, evaluasi cangkang kapsul, uji in vitro dan uji efek antibakteri di Laboratorium Farmasi Fisik Fakultas Farmasi USU dan Laboratorium Mikrobiologi Farmasi Fakultas Farmasi USU.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat pencetak kapsul yang terbuat dari batang stainless steel berbentuk silindris dengan panjang 10 cm serta berdiameter 5,5 mm untuk bagian badan cangkang kapsul dan berdiameter 6,0 mm untuk bagian tutup cangkang kapsul, alat disolusi metode dayung (Erweka), batang pengaduk, buret (Pyrex), cawan petri, cawan porselen, desikator, erlenmeyer (Pyrex), gelas beker (Pyrex), gelas ukur (Pyrex), jangka sorong (Tricle), kamera digital, labu tentukur (Pyrex), lemari pengering, mikrometer (Delta), mikropipet (Oppendorf), neraca analitis (Ohaus Pioneer), otoklaf, oven (Marment), penunjuk waktu (Stopwatch), pH meter (Eutech Instrument), pipet mat (MBL), pipet volum (MBL), spektrofotometer (Shimadzu UV 1800), termometer, dan termostat.
3.2 Bahan-bahan
HCl(p) (Merck), kalsium klorida dihidrat (Merck), muller hinton agar (Pronadisa),
nutrient agar (Merck), natrium alginat 80-120 cP (Wako pure chemical industries, Ltd Japan), nutrient broth (Merck), natrium klorida (Merck), natrium metabisulfit, nipagin, polivinilpirolidon K30 (Wako pure chemical industries, Ltd Japan) dan titanium dioksida.
3.3. Pembuatan Pereaksi
3.3.1. Pembuatan larutan kalsium klorida 0,15 M
Kalsium klorida dihidrat (CaCl2.2H2O) sebanyak 22,05 g dilarutkan dalam
akuades bebas CO2 hingga 1000 mL (Ditjen POM, 1995).
3.3.2 Medium cairan lambung buatan tanpa enzim (medium pH 1,2)
Larutkan 2 g natrium klorida dalam 7 mL asam klorida pekat dan akuades secukupnya hingga 1000 mL (Ditjen POM, 1995).
3.4 Pembuatan Kurva Serapan dan Kurva Kalibrasi Amoksisilin
3.4.1 Pembuatan larutan induk bakuamoksisilin
Ditimbang sebanyak 25 mg amoksislin dan dimasukkan kedalam labu tentukur 100 mL, dilarutkan dengan medium cairan lambung buatan pH 1,2 dan dicukupkan sampai garis tanda. Diperoleh konsentrasi 250 mcg/mL (250 ppm).
3.4.2 Pembuatan kurva serapan larutan amoksisilin
Dipipet sebanyak 1,9 mL larutan induk baku, dimasukkan kedalam labu tentukur 25 mL. Dicukupkan dengan medium cairan lambung buatan pH 1,2 sampai garis tanda dan dikocok homogen. Serapan diukur dengan menggunakan spektrofotometer UV pada panjang gelombang 200-400 nm
Larutan induk baku dibuat dalam berbagai konsentrasi yaitu 1; 10; 20; 30; 40; 50; 60; 70; 80; dan 90 ppm, dengan cara memipet larutan induk baku masing-masing sebanyak 0,1; 1; 2; 3; 4; 5; 6; 7; 8; dan 9 mL. Dimasukkan kedalam labu tentukur 25 mL dan dicukupkan dengan medium cairan lambung buatan pH 1,2 sampai garis tanda. Dikocok homogen, diukur menggunakan spektrofotometer UV pada panjang gelombang maksimum yang telah ditentukan sebelumnya.
3.5 Pembuatan Dispersi Padat
Sistem dispersi padat dibuat dengan metode pelarutan dengan perbandingan amoksislin dan PVP K30 adalah 1:1.Ditimbang masing-masing bahan sebanyak 3 g, lalu dicampurkan kedua bahan.Selanjutnya dilarutkan menggunakan alkohol sebanyak 100 mL. Diuapkan pelarut dengan udara panas di oven (40-50oC) hingga di peroleh berat konstan, disimpan selama 24 jam didalam desikator. Dikerok dan digerus kemudian diayak menggunakan ayakan no. 12.
3.6 Pembuatan Cangkang Kapsul Alginat
Cangkang kapsul alginat dibuat dengan metode pencelupan (Voight, 1994), yaitu dengan mencelupkan alat pencetak kapsul kedalam larutan alginat.
3.6.1 Pembuatan larutan alginat
Natrium alginat 80-120 cp 4,5 g
Gliserin 2 g
Nipagin 0,25 g
TiO2 0,4 g
Natrium metabisulfit 0,1 g
Ditimbang masing-masing bahan yang diperlukan.Dikalibrasi gelas beker 100 mL. Nipagin dilarutkan dalam sebagian akuades yang telah dipanaskan terlebih dahulu, setelah dingin dilarutkan gliserin dan natrium metabisulfit dalam larutan tersebut (massa I). Didispersikan TiO2 dalam sebagian akuades (massa II).
Selanjutnya kedalam beker glass yang sudah dikalibrasi ditambahkan massa I dan massa II sedikit demi sedikit, kemudian ditaburkan serbuk alginat, didiamkan selama 24 jam lalu diaduk dan dicukupkan dengan akuades sampai 100 mL. Larutan didiamkan selama beberapa saat sampai tidak ada lagi gelembung udara.
3.6.2 Pembuatan badan cangkang kapsul alginat
Alat pencetak kapsul terbuat dari bahan stainless steel dengan panjang 10 cm dan diameter 6 mm. Dicelupkan kedalam larutan natrium alginat sedalam 3 cm, batang stainless steel yang telah dilapisi larutan natrium alginat direndam dalam larutan CaCl2 0,15 M selama 75 menit. Setelah itu cangkang kapsul yang
telah mengeras dilepaskan dari batang stainless steel tersebut lalu direndam dalam akuades selama beberapa jam untuk menghilangkan kalsium yang menempel pada cangkang kapsul dan selanjutnya dikeringkan di lemari pengering.
3.6.3 Pembuatan tutup cangkang kapsul alginat
Alat pencetak kapsul terbuat dari bahan stainless steel dengan panjang 10 cm dan diameter 6,2 mm dicelupkan kedalam larutan natrium alginat sedalam 2,5 cm, lalu batang stainless steel yang telah dilapisi larutan natrium alginat tersebut direndam dalam larutan CaCl2 0,15 M selama 75 menit.Setelah itu cangkang
3.6.4 Pengeringan cangkang kapsul alginat
Pengeringan cangkang kapsul alginat tersebut dilakukan dengan cara mengeringkannya dalam lemari pengering selama 4 jam. Cangkang kapsul alginat yang basah ditempatkan pada batang stainless steel yang telah diolesi oleh minyak silikon lalu dimasukkan kedalam lemari pengering.Setelah kering, cangkang kapsul alginat dilepaskan dari batang stainless steel dan cangkang kaspul alginat tersebut disimpan.
3.7 Pengisian Cangkang Kapsul Alginat
Amoksisilin sebanyak 500 mg dan dispersi padat amoksisilin yang setara 500 mg ditimbang dengan tepat menggunakan neraca analitik, lalu diisikan kedalam bagian badan cangkang kapsul alginat melalui bagian ujung yang terbuka. Setelah itu ditutup dengan bagian tutup cangkang kapsul alginat dengan mendorong bagian tutup ke bagian badan cangkang kapsul alginat yang terbuka sehingga bagian tutup kapsul dengan bagian badan kapsul menyatu dengan baik.Diberi perekat larutan natrium alginat pada kapsul.
3.8 Penentuan Spesifikasi Cangkang Kapsul Alginat
3.8.1 Pengukuran panjang dan diameter cangkang kapsul alginat
Pengukuran panjang dan diameter cangkang kapsul alginat dilakukan dengan menggunakan jangka sorong.
3.8.2 Pengukuran ketebalan cangkang kapsul alginat
masing-masing sampel, satu kali di pusat dan 4 kali di perimeter sekitarnya, kemudian diambil rata-ratanya.
3.8.3 Penimbangan berat cangkang kapsul alginat
Penimbangan berat cangkang kapsul alginat dilakukan dengan menggunakan neraca analitik.
3.8.4 Pengamatan warna cangkang kapsul alginat
Pengamatan warna cangkang kapsul alginat diamati secara visual.
3.8.5 Pengukuran volume cangkang kapsul alginat
Pengukuran volume cangkang kapsul alginat dilakukan dengan menggunakan buret dimana bagian badan cangkang kapsul diisi dengan air sampai penuh.
3.9 Uji Waktu Floating
Sediaan cangkang kapsul alginat 80-120 cP yang telah dibuat dilakukan uji
waktu floating dengan cara menempatkan cangkang kapsul tersebut ke dalam gelas beaker berisi medium lambung buatan pH 1,2.
Floating lag time sebagai waktu yang dibutuhkan sediaan cangkang kapsul alginat mulai mengapung dan Floating Time sebagai lamanya waktu dimana sediaan cangkang kapsul alginat dapat mengapung.
3.10 Uji Kerapuhan
3.10.1 Cangkang kapsul kosong
Cangkang kapsul kosong dijatuhi beban seberat 50 g dari ketinggian 10 cm. Kemudian diamati kerapuhan cangkang kapsul tersebut.Pengujian dilakukan terhadap 6 cangkang kapsul (Nagata, 2002).
Cangkang kapsul diisikan dengan dispersi padat amoksisilin, kemudian ditekan beban seberat 2 kg.Diamati kerapuhan cangkang kapsul.Pengujian dilakukan terhadap 6 cangkang kapsul (Nagata, 2002).
3.11 Uji Disolusi
Medium disolusi : Cairan lambung buatan tanpa enzim pH 1,2 Kecepatan pengadukan : 100 rpm
Volume medium : 900 mL
Suhu medium : 37 ± 0,5oC
Metode : Dayung
Sampel : 1. Cangkang kapsul alginat 80-120 cP berisi amoksisilin 500 mg.
2. Cangkang kapsul alginat 80-120 cP berisi dispersi padat dengan amoksisilin : PVP K30 (1:1).
diganti dengan medium cairan lambung buatan pH 1,2 dengan kondisi dan jumlah yang sama. Konsentrasi obat diukur dengan menggunakan spektrofotometer UV pada panjang gelombang maksimumnya.Penetapan dilakukan sebanyak 3 kali.
3.12 Uji Aktivitas Antibakteri Sediaan Floating
3.12.1 Sterilisasi alat dan bahan
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C selama 15 menit. Jarum ose dengan lampu bunsen.
3.12.2 Pembuatan media
3.12.2.1 Media Nutrient Agar (NA)
Komposisi: Peptone 5 g
Meat extract 2 g
Agar-agar 12 g
Distilled water 1 L
pH: 7.0 ± 0,2 pada suhu 250C
Cara pembuatan: Sebanyak 20 g serbuk NA dilarutkan dalam air suling hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut sempurna lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Merck, 2005).
3.12.2.2 Media Nutrient Broth (NB)
Komposisi : Peptone 5 g
Meat extract 3 g
Distilled water 1 L
Cara pembuatan: Sebanyak 8 g serbuk NB dilarutkan dalam air suling hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut sempurna, lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Merck, 2005).
3.12.2.3 Media Muller Hinton Agar (MHA)
Komposisi: Acid casein peptone 17,5 g
Beef Infusion 2 g
Starch 1.5 g
Bacteriological agar 17 g Distilled water 1 L pH: 7.4 ± 0,2 pada suhu 250C
Cara pembuatan: Sebanyak 38 g serbuk MHA dilarutkan dalam air suling hingga 1 liter dengan bantuan pemanasan sampai semua bahan larut sempurna, lalu disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Pronadisa, 1993).
3.12.3 Pembuatan agar miring
Sebanyak 10 ml media nutrient agar yang sudah dicairkan dimasukkan ke dalam tabung reaksi steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45o. Kemudian disimpan dalam lemari pendingin pada suhu 5oC (Lay, 1994).
3.13.4 Pembuatan stok kultur bakteri
3.12.5 Pembuatan standar kekeruhan larutan (larutan Mc. Farland)
Larutan H2SO4 1% sebanyak 9,95 mLdicampurkan dengan larutan BaCl2
1% sebanyak 0,05 mL dalam tabung reaksi (konsentrasi 1,5 x 108 CFU/mL).Kemudian dikocok sampai terbentuk larutanyang keruh. Kekeruhan ini dipakai sebagaistandar kekeruhan inokulum bakteri uji (Mc Farland, 1907).
3.12.6 Pembuatan inokulum bakteri uji
Bakteri Staphylococcus aureus diambildengan kawat ose steril lalu disuspensikankedalam tabung yang berisi 2 mLnutrient broth hingga di peroleh kekeruhan yang samadengan standar kekeruhan larutan Mc.Farland. Perlakuan yang sama dilakukan padabakteri Escherichia coli.
3.12.7 Pembuatan kurva larutan standar amoksisilin
Larutan standar amoksisilin dibuat dalam berbagai konsentrasi (0-200 μg) dengan melarutkan amoksislin menggunakan medium lambung butan pH 1,2. Masing-masing larutan dimasukkan ke dalam vial. Dimasukkan pencadang kertas ke dalam masing-masing larutan dan dibiarkan selama 30 menit. Kedalam cawan petri dimasukkan 0,1 mL inokulum, ditambahkan 15 mL media MHA steril yang telah dicairkan dan ditunggu hingga suhu mencapai 45oC, dihomogenkan dan dibiarkan sampai media memadat. Selanjutnya, dimasukkan pencadang kertas yang telah direndam ke dalam petri. Diinkubasi pada suhu 36-37oC selama 18 jam. Selanjutnya diameter daerah hambat di sekitar pencadangkertas diukur dengan menggunakan jangka sorong. Pengujian dilakukan sebanyak 3 kali.
3.12.8 Pengujian aktivitas antibakteri sediaan floating
BAB IV
HASIL DAN PEMBAHASAN
Cangkang kapsul alginat yang telah dibuat dari natrium alginat 80-120 cP dilakukan penentuan spesifikasi, pengujian waktu floating dan uji kerapuhan.Selanjutnya, cangkang kapsul alginat diisi dengan bahan obat amoksisilin dilakukan uji disolusi dan uji aktivitas antibakteri dari alikuot hasil uji disolusi.
4.1 Hasil Penentuan Spesifikasi Cangkang Kapsul Alginat 80-120 cP
Penentuan spesifikasi cangkang kapsul alginat 80-120 cP No.0 dilakukan terhadap bagian badan cangkang kapsul, bagian tutup cangkang kapsul dan cangkang kapsul secara keseluruhan yang meliputi pengukuran panjang, diameter, berat, volume, ketebalan dan pengamatan warna. Pengukuran ketebalan dilakukan terhadap badan dan tutup cangkang kapsul.Pengukuran volume dilakukan hanya terhadap bagian badan cangkang kapsul, karena umumnya bahan obat hanya diisikan ke dalam bagian badan cangkang kapsul.Pengukuran volume dilakukan menggunakan air, dimana air diisi kebagian badan cangkang kapsul alginat sampai meniskus atas menyentuh ujung kapsul.
Gambar 4.1 Cangkang kapsul alginat 80-120cP No. 0
Hasil penentuan spesifikasi cangkang kapsul alginat 80-120 cP yang di peroleh dibandingkan dengan spesifikasi cangkang kapsul menurut Capsugel Division. Hasil penentuan spesifikasi cangkang kapsul alginat 80-120 cP dapat dilihat pada Tabel 4.1 dan spesifikasi cangkang kapsul menurut Capsugel Division dapat dilihat pada Tabel 4.2.
Tabel 4.1 Spesifikasi cangkang kapsul alginat 80-120 cP No. 0
No Spesifikasi Tutup
cangkang
Tabel 4.2 Spesifikasi cangkang kapsul ukuran No. 0 menurut Capsugel Division
No Spesifikasi Tutup kapsul Badan kapsul Cangkang Kapsul keseluruhan 1 Panjang (mm) 10,72 ± 0,46 18,44 ± 0,46 21,7 ±0,30
2 Diameter (mm) 7,64 7,34 -
3 Volume (ml) - 0,68 -
4 Berat (mg) - - 96 ± 6
Pada tabel dapat dilihat bahwa cangkang kapsul yang dibuat dari natrium alginat 80-120 cP memliki panjang, diameter, volume dan berat yang tidak jauh berbeda dengan spesifikasi cangkang menurut Capsugel Division.
rendah didalam air.Warna putih dari cangkang kapsul alginat bertujuan untuk melindungi bahan obat dari cahaya oleh karena itu digunakan TiO2 dalam
formulasi cangkang kapsul alginat 80-120 cP.
4.2 Hasil Uji Waktu Floating
Uji waktu mengapungterdiri dan floating lag time dan floating time.Floating lag timeadalah waktu yang dibutuhkan oleh cangkang kapsul untuk dapat mengapung dan floating time adalah lamanya cangkang kapsul dapat mengapung pada medium lambung buatan.
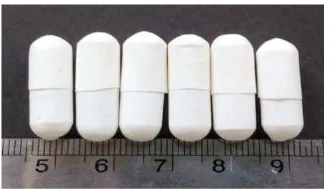
Uji floating lag time dari cangkang kapsul alginat 80-120 cP no.0 kosong menunjukkan hasil 0 detik, dimana cangkang kapsul alginat langsung mengapung ketika pertama kali diletakkan kedalam medium lambung buatan. Hal ini karena cangkang kapsul alginat memiliki berat jenis yang lebih rendah jika dibandingkan dengan berat jenis medium lambung buatan pH 1,2. Sedangkan floating time cangkang kapsul alginat lebih dari 12 jam.
Pengujian floating time untuk cangkang kapsul alginat 80-120 cP dalam medium cairan lambung buatan pH 1,2 dapat dilihat pada Gambar 4.2.
(a) (b) (c) (d)
Gambar 4.2 Uji waktu floating cangkang kapsul alginat 80-120 cP
(d) Pada waktu 720 menit
Pada gambar dapat dilihat bahwa cangkang kapsul alginat 80-120 cP dapat tetap mengapung mulai dari waktu 0 menit sampai 720 menit, bahkan cangkang kapsul alginat 80-120 cP ini dapat bertahan tetap mengapung selama lebih dari 720 menit.
4.3 Hasil Uji Kerapuhan
4.3.1 Uji kerapuhan cangkang kapsul kosong
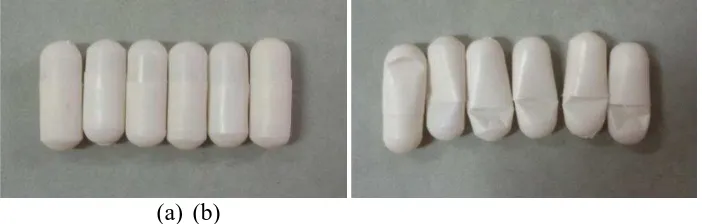
Pengujian kerapuhan cangkang kapsul alginat 80-120 cP kosong dilakukan dengan cara menjatuhkan beban seberat 50 g dari ketinggian 10 cm, dimana beban seberat 50 g diibaratkan sebagai tekanan yang terjadi saat membuka kemasan kapsul. Kapsul kosong tersebut dikatakan rapuh apabila setelah dijatuhkan beban, cangkang kapsul kosong tersebut retak atau pecah (Nagata, 2002).Hasil pengujian kerapuhan cangkang kapsul alginat 80-120 cP kosong dapat dilihat pada Gambar 4.3.
(a) (b)
Gambar 4.3 Uji kerapuhan cangkang kapsul alginat 80-120 cP kosong
Keterangan: (a) Sebelum uji kerapuhan (b) Sesudah uji kerapuhan
sebelumnya juga tidak menunjukkan adanya cangkang kapsul yang retak atau pecah (Simamora, 2014).
4.3.2 Uji kerapuhan cangkang kapsul berisi (uji ketahanan terhadap tekanan)
Pengujiandilakukan terhadap cangkang kapsul alginat 80-120 cP berisi bahan obat.Pada penelitian ini bahan obat yang digunakan adalah amoksisilin.Amoksisilin merupakan salah satu antibiotik yang digunakan dalam terapi eradikasi Helicobacter pylori.
Pengujian dilakukan dengan cara menekan cangkang kapsul alginat berisi dengan beban seberat 2 kg (Nagata, 2002). Beban ini diibaratkan seperti tekanan yang mungkin terjadi selama proses pengisian kapsul sampai pada tahap pengemasan kapsul. Hasil pengujian kerapuhan cangkang kapsul alginat 80-120 cP berisi dispersi padat amoksisilin dapat dilihat pada Gambar 4.4.
(a) (b)
Gambar 4.4 Uji kerapuhan cangkang kapsul alginat 80-120 cP berisi dispersi
padat amoksisilin
Keterangan: (a) Sebelum uji kerapuhan
(a) Sesudah uji kerapuhan (pipih pada lokasi tertentu)
tersebut sedikit. Sebaliknya jika kadar uap airnya terlalu banyak, kapsul cenderung akan menjadi melunak. Akan tetapi, kisaran kadar uap air dalam cangkang kapsul berbeda antara satu bahan dengan bahan yang lain.
4.4 Hasil Uji Disolusi
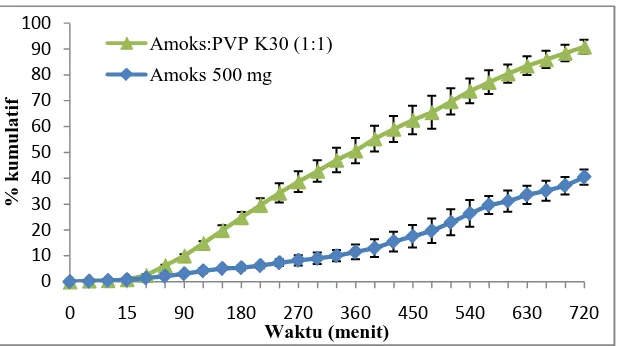
Uji disolusi dilakukan untuk mengetahui profil pelepasan amoksisillin dari cangkang kapsul alginat 80-120 cP dalam medium lambung buatan pH 1,2 selama 12 jam. Pada penelitian ini uji disolusi pertama kali dilakukan terhadap cangkang kapsul alginat yang berisi amoksisilin 500 mg kemudian terhadap cangkang kapsul alginat berisi dispersi padat amoksisilin. Profil pelepasan amoksisilin dalam medium lambung buatan pH 1,2 selama 12 jam dapat dilihat pada Gambar 4.5.
Gambar 4.5 Grafik pelepasan dari amoksisilin dalam medium lambung buatan
pH 1,2 selama 12 jam.
Pada grafik dapat dilihat hasil pelepasan amoksisilin 500 mg dari cangkang kapsul alginat, dimana amoksisilin yang terlepes pada menit ke-720 hanya sebanyak 40,44%. Selanjutnya uji disolusi dilakukan terhadap amoksisilin yang diformulasi dalam bentuk dispersi padat dengan pembawa polivinilpirolidon
(PVP) K30 (1:1) sebanyak 1000 mg. Cangkang kapsul alginat no.0 hanya dapat diisi bahan obat sebanyak 500 mg maka uji disolusi dispersi padat amoksisilin dilakukan menggunakan dua cangkang kapsul.
Pada garfik dapat dilihat adanya peningkatan laju pelepasan amoksisilin setelah diformulasi dalam bentuk dispersi padat dengan pembawa PVP K30. Laju pelepasan amoksisilin dalam bentuk dispersi padat dengan pembawa PVP K30 pada menit ke-180 melepaskan sebanyak 24,84% bahan obat, menit ke-360 sebanyak 50,65% dan pada menit ke-720 sebanyak 90,80% amoksisilin telah terlepas. Hal ini menunjukkan bahwa amoksisilin yang diformulasi dalam bentuk dipersi padat dengan pembawa PVP K30 dalam cangkang kapsul alginat 80-120 cp dapat memberikan pelepasan yang memenuhi syarat sustained release menurut Murthy dan Ghebre (1993).
Interval
pemberian Waktu (jam)
Jumlah yang
Keterangan: D (interval pemberian)= 12 jam
Peningkatan laju disolusi amoksisilin terjadi karena adanya penambahan polivinilpirolidon (PVP) K30 sebagai pembawa dalam sistem dispersi padat yang merupakan polimer mudah larut dalam air (Ditjen POM, 1979) sehingga dapat meningkatkan proses pelarutan dan proses pembasan dari bahan obat (Voigt, 1995). Selain itu, modifikasi bahan obat dalam bentuk dispersi padat akan
Gambar uji disolusi sediaan floating dispersi padat amoksisilin menggunakan cangkang kapsul alginat dapat dilihat pada Gambar 4.6.
(a) (b) (c) (d)
Gambar 4.6 Uji disolusidari sediaan floating dispersi padat amoksisilin
menggunakan cangkang kapsul alginat 80-120 cP Keterangan: a. Pada waktu 0 menit
b. Pada waktu 180 menit c. Pada waktu 360 menit d. Pada waktu 720 menit
Pada gambar dapat dilihat cangkang kapsul tetap utuh dan mengapung sampai 720 menit. Cangkang kapsul alginat yang tetap utuh di dalam medium lambung buatan selama waktu pengujian dikarenakan kalsium alginat (kalsium guluronat) yang terbentuk dari natrium alginat dan kalsium klorida akan berikatan dengan asam dari medium lambung buatan pH 1,2 menghasilkan asam alginat.
2Na-alginat + CaCl2 Ca-alginat + 2NaCl
Ca-alginat + H+ Ca2+ + H-alginat
Asam alginat yang terbentuk bersifat hidrofob sehingga menjadi sukar larut dan tetap utuh dalam medium lambung pH 1,2 (Bangun, et al., 2005).
4.5 Kinetika Orde Pelepasan
Korsmeyer-peppas sedangkan kinetika pelepasan amoksisilin hanya dilakukan terhadap tiga model kinematika tanpa Krormayer-peppas. Penentuan kinetika pelepasan amoksisillin dari cangkang kapsul alginat dilakukan untuk mengetahui berapa persen obat yang dilepaskan dari waktu ke waktu selama penujian dengan memplotkan hasil uji pelepasan amoksisillin dalam grafik waktu versus persen kumulatif, logaritma persen kumulatif versus waktu, persen kumulatif versus akar waktu dan logaritma persen kumulatif versus logaritma waktu maka dapat diperoleh nilai korelasi (R2). Kinetika pelepasan amoksisilin dan dispersi padat amoksisilin dari cangkang kapsul alginat 80-120 cP dalam medium lambung buatan pH 1,2 selama 12 jam dapat dilihat pada Tabel 4.3 dan 4.4.
Tabel 4.3 Kinetika pelepasan amoksisilin 500 mg dari cangkang kapsul alginat
80-120 cP
Persamaan Regresi R2
Orde Nol y = 0,055x - 4,737 0,898
Orde Satu y = 0,002x - 0,051 0,894
Higuchi y = 1,553x - 12,02 0,751
Tabel 4.4 Kinetika pelepasan amoksisilin : PVP K30 (1:1) dari cangkang kapsul
alginat 80-120 cP
Persamaan Regresi R2
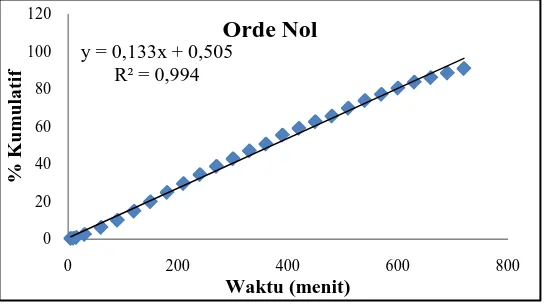
Orde Nol y = 0,133x + 0,505 0,994
Orde Satu y = 0,002x + 0,525 0,698
Higuchi y = 3,994x - 21,69 0,966
Korsmeyer-Peppas y = 1,234x - 1,425 0,993
kapsul alginat berdasarkan Tabel 4.4 juga memiliki pelepasan yang mengikuti kinetika pelepasan Orde Nol dengan nilai persamaan regresi y=0,133x + 0,50 dan R²=0,994, artinya laju pelepasan amoksisilin dalam bentuk dispersi padat dari cangkang kapsul alginat tetap konstan selama 12 jam, dengan %kumulatif amoksisilin terlepas berbanding lurus dengan bertambahnya waktu.Grafik kinetika pelepasan amoksisilin dan dispersi padat amoksisilin dari cangkang kapsul alginat dapat dilihat pada Gambar 4.7 dan 4.8.
Gambar 4.7 Grafik kinetika pelepasan orde nol amoksisilin dari cangkang
kapsul alginat80-120 cP
Gambar 4.8 Grafik kinetika pelepasan orde nol dispersi padat amoksisillin dari
cangkang kapsul alginat 80-120 cP
Pada tabel dapat dilihat bahwa pelapasan amoksisilin saja dari cangkang kapsul alginat 80-120 cP memiliki grafik yang tidak linear jika dibandingkan
dengan grafik kinetika peleasan amoksisilin dalam bentuk dispersi padat dari cangkang yang sama. Hal ini menunjukkan bahwa sediaan floating dispersi padat amoksiislin dengan menggunakan cangkang kapsul alginat 80-120 cP memiliki pelepasan dengan kinetika pelepasan orde nol yang lebih baik.
4.6 Hasil Uji Aktivitas Antibaktri
4.6.1 Pembuatan kurva larutan standar amoksisilin
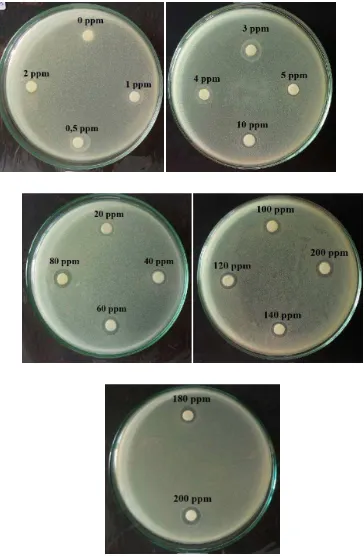
Hasil uji larutan standar amoksisilin dengan konsentrasi 0-200 µg/mL terhadap pertumbuhan bakteri Staphylococcus aureus danEscherichia coli yang diinkunbasi pada suhu 37oC selama 18 jam ditunjukkan pada Tabel 4.5 danGambar 4.9; 4.10.
Tabel 4.5 Aktivitas antibakteri dari larutan standar amoksisilin
Konsentrasi
(µg/mL) (c) ln (c)
Gambar 4.9 Hasil pengujian daerah hambat dari larutan standar amoksisilin
Gambar 4.10 Hasil pengujian daerah hambat dari larutan standar amoksisilin
terhadap bakteri Escherichia coli
4.6.2 Penentuan konsentrasi hambat minimum (KHM) amoksisilin
ln (KHM) = ln (c) – x 2
4�� ….………. (1)
Keterangan: KHM = Konsentrasi Hambat Minimum c = Konsentrasi larutan
x2 = Daerah hambat D = Koefisien difusi t = Waktu difusi
Persamaan (1) kemudian diturunkan menjadi: ln (c) = ln (KHM) – x
2
4�� ….………. (2)
berdasarkan persamaan (2) dibuat plot antara ln (c) vs x2. Intersept dari persamaan garis tersebut merupakan ln(KHM) yang kemudian digunakan untuk mencari nilai Konsentrasi Hambat Minimum (KHM) dari larutan standar amoksisilin. Grafik plot ln(c) vs x2 larutan standart amoksisilin terhadap bakteri Staphylococcus aureus dan Escherichia coli dapat dilihat pada Gambar 4.11 dan 4.12.
Gambar 4.11 Plot ln (c) vs x2 larutan standar amoksislin terhadap bakteri Staphylococcus aureus
Pada Gambar 4.11 plot garis yang didapat memiliki koefisien korelasi sebesar 0,990, hal ini menunjukkan hubungan lineritas yang baik antara logaritma natural dari konsentrasi larutan amoksisilin dengan kuadrat daerah hambat yang dihasilkan. Nilai intersept dari persamaan garis (ln KHM) adalah -0,018, maka berdasarkan persamaan (2) diperoleh nilai KHM amoksisilin terhadap bakteri Staphylococcus aureus adalah 0,982 µg/mL.
Gambar 4.12 Plot ln (c) vs x2 larutan standar amoksislin terhadap bakteri Escherichia coli
Sedangkan dari Gambar 4.12 plot garis yang didapat memiliki koefisien korelasi sebesar 0,993, hal ini juga menunjukkan hubungan linearitas yang baik. Nilai intersept persamaan garis (ln KHM) adalah -0,096, maka nilai KHM amoksisilin terhadap bakteri Escherichia coli adalah 0,909 µg/mL.
Menurut Clinical and Laboratory Standard Institude (2014)konsentrasi hambat minimum amoksisilin menggunakan metode difusi agar terhadap bakteri Staphylococcus aureus, dikatakan sensitif apabila nilai KHM ≤0,12 μg/ml dan dikatakan resisten apabila ≥0,25 μg/ml, dan terhadap bakteri Escherichia coli dikatakan sensitif dengan nilai KHM ≤8 μg/ml, intermediet yaitu 8μg/ml dan resisten ≥32 μg/ml. Berdasarkan hasil pengujian yang diperoleh, dapat dilihat bahwa amoksisilin yang diformulasi dalam bentuk sediaan mengapung resisten terhadap bakteri Staphylococcus aureus, tetapi sensitif terhadap bakteri Escherichia coli.
4.6.3 Uji aktivitas antibakteri alikuot disolusi
Hasil pengujiaan aktivitas antibakteri alikuot hasil disolusi sediaan floating dispersi padat amoksisilin dengan metode difusi terhadappertumbuhan bakteri Staphylococcuc aureus dan Escherichia coliditunjukkan pada Tabel 4.6.
Tabel 4.6 Pengujian alikuot disolusi terhadap pertumbuhan bakteriStaphylococcus aureus dan Escherichia coli
Menurut Davis dan Stout (1971) apabila zona hambat yang terbentuk pada uji difusi agar berukuran kurang dari 5 mm, maka aktivitas penghambatannya dikategorikan lemah. Apabila zona hambat berukuran 5-10 mm dikategorikan sedang, 10-19 mm dikategorikan kuat dan 20 mm atau lebih dikategorikan sangat kuat. Berdasarkan Tabel 4.7 terlihat bahwa alikuot hasil disolusi sediaan floating dispersi padat amoksisilin pada waktu 12 jam memiliki potensi yang sedang dalam menghambat pertumbuhan bakteri Staphylococcus aureusdan Escherichia colidengan Daerah hambat 06,94 ± 0,48 mm dan 6,04± 0,84 mm.
Daerah hambat dari sediaan floating dispersi padat amoksisilin yang dihasilkan dari uji aktivitas antibakteri terhadappertumbuhan bakteri Staphylococcus aureusdan bakteriEscherichia coli terus bertambah dengan meningkatnya waktu, peningkatan diamter daerah hambat vs waktu dapat dilihat di grafik pada Gambar 4.13; 4.14 dan gambar hasil pengujian dapat dilihat pada Gambar 4.15; 4.16.
Waktu (jam) Daerah hambat (mm)
Staphylococcus aureus Escherichia coli
Gambar 4.13 Grafik daerah hambatalikuot disolusi sediaan floating dispersi
padat amoksisilin terhadap pertumbuhan bakteriS.aureus
Gambar 4.14 Grafik daerah hambatalikuot disolusi sediaan floating dispersi
padat amoksisilin terhadap pertumbuhan bakteriE.coli
Gambar 4.15 Hasil pengujian daerah hambatalikuot disolusi sediaan floating
dispersi padat amoksisilin terhadap bakteri S. aureus
Gambar 4.16 Hasil pengujian daerah hambatalikuot disolusi sediaan floating
dispersi padat amoksisilin terhadap bakteri E.coli
Hasil pengujian aktivitas antibakterisediaan floating dispersi padat amoksisilin terhadap pertumbuhan bakteri Staphylococcus aureus dan pertumbuhan bakteri Escherichia coli diperoleh hasil yang sama, menurut Kaur dan kawan-kawan (2011) amoksisilin merupakan antibiotik golongan β -laktamberspektrum luas yang efektif melawan bakteri baik bakteri Gram negatif maupun bakteri Gram positif, dengan cara menghambat sistesis dinding sel bakteri.
4.6.4 Korelasi daerah hambatalikuot disolusi dan Daerah hambat larutan standar (hitung)
Gambar 4.11 dan 4.12. Hasil daerah hambat larutan standar secara perhitungdapat dilihat pada Tabel 4.7 dan 4.8. Selanjutnya, hasil daerah hambat berdasarkan perhitungan diplot dengan hasil daerah hambat yang diperoleh secara praktek. Grafik plot daerah hambat praktek vs daerah hambat hitung dapat dilihat pada Gambar 4.17 dan 4.18.
Tabel 4.7 Korelasi pengujian daerah hambatalikuot disolusi sediaan floating dispersi padat dan daerah hambat larutan standar (hitung) terhadap bakteri Sthapylococcus aureus
Gambar 4.17 Grafik plotdaerah hambat alikuot disolusi praktek vs Daerah
hambat hitung terhadap bakteri Sthapylococcus aureus
Tabel 4.8 Korelasi pengujian daerah hambatalikuot disolusi sediaan floating dispersi padat dan daerah hambat larutan standar (hitung) terhadap bakteri Escherichia coli
Alikuot disolusi Larutan standar (hitung) Waktu
Gambar 4.18 Grafik plotdaerah hambat alikuot disolusi praktek vs daerah
hambat hitung terhadap bakteri Escherichia coli
Berdasarkan Gambar 4.17 dan 4.18 grafik antara daerah hambat alikuot hasil disolusi sediaan dispersi padat amoksisilin praktek dengan daerah hambat berdasarkan perhitungan diperoleh nilai R2 terhadap bakteri S.aureus dan E.coli
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
a. Cangkang kapsul alginat dapat digunakan sebagai sediaan floating yang bertahan dilambung karena cangkang kapsul alginat memiliki kemampuan untuk tetap utuh dan mengapung dalam medium lambung buatan pH 1,2. b. Pelepasan sediaan floatingdispersi padat amoksisilin dengan
polivinilpirolidon (PVP) K30 (1:1) memberikan pelepasan sustained releasedalam medium pH 1,2 selama 12 jam. Dimana pelepasannya pada waktu 3 jam 24,84%, 6 jam 50,68%, dan pada waktu 12 jam adalah 90,80%.
c. Sedian floating dispersi padat amoksisilin dengan PVP K30 (1:1) memiliki potensi sedang menghambat pertumbuhan bakteri Staphylococcus aureusdan Escherichia coliyang ditunjukkan dengan adanya diameter daerah hambat dari aliquot uji disolusi.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Ulkus Peptikum
Ulkus peptikum adalah luka yang berkembang di dalam lapisan mukosa pada saluran pencernaan, khususunya pada bagian atas saluran pencernaan usus halu (doedenum), esofagus, dan lambung (Dufton, 2012).Secara klinis, ulkus peptikum adalah keadaan hilangnya epitel superfisian atau lapisan lebih dalam dengan diameter ≥ 5 mm yang dapat diamati secara endoskopis d an radiologis (Akil, 2009).
Penyakit ulkus peptikum kebanyakan disebabkan karena adanya asam lambung dan enzim pepsin ketika bakteri Helicobacter pylori, obat anti inflamasi nonsteroid (AINS), atau faktor lainnya mengganggu sistem pertahanan mukosa dan penyembuhan mukosa. Hipersekresi dari asam lambung dan pepsin ini yang menghambat mekanisme pertahanan mukosa dan proses penyembuhannya (Berardi dan Welage, 2005).
Menurut Robbins dan kawan-kawan (1995), ulkus peptikum terjadi karena adanya ketidakseimbangan antara mekanisme pertahanan mukosa lambung (faktor defensif) dengan tekanan yang merusak lambung (faktor agresif).
a) Faktor agresifyang merusak pertahanan mukosa adalah Helicobacter pylori, obat anti inflamasi non-steroid, asam lambung/pepsin serta faktor-faktor lingkungan serta kelainan satu atau beberapa faktor pertahanan yang berpengaruh pada kejadian tukak lambung.
a. Faktor preepitel, terdiri dari:
- Mukus dan bikarbonat yang berguna untuk menahan pengaruh asam lambung/pepsin
- Lapisan mukoid, yaitu suatu struktur yang yang terdiri dari mukus dan fibrin, yang terbentuk sebagai respon terhadap ransangan inflamasi
- Permukaan aktif fosfolipid, yang berperan untuk meningkatkan hidrofobisitas membran sel dan meningkatkan viskositas mukus
b. Faktor epitel
- Kecepatan perbaikan mukosa yang rusak, dimana terjadi migrasi sel –sel yang sehat ke daerah yang rusak untuk perbaikan
- Pertahanan selpengauler, kemampuan untuk memelihara elektrik gradien dan mencegah pengasaman sel.
- Kemampuan transporter asam-basa untuk mengangkut bikarbonat kedalam lapisan mukus dan jaringan subepitel dan untuk mendorong asam keluar jaringan.
- Faktor pertumbuha, prostaglandin dan nitrit oksida. c. Faktor subepitel
- Aliran darah (mikrosirkulasi) yang berperan mengangkut nutrisi, oksigen dan bikarbonat ke epitel sel.
- Prostaglandin endogen menekan perlekatan dan ekstravariasi leukosit yang merangsang reaksi inflamasi jaringan.
bentuk gastritis akut pada kronik. Organisme ini melekat pada epitel lambung dan merusak lapisan mukosa perlindungan dan meninggalkan daerah-daerah epitel yang rusak (Mc Guigan, 2001).
2.2 Helicobacter pylori
Helicobacter pylori adalah suatu basilus Gram-negatif, spiral dengan flagela multipel lebih menyukai lingkungan mikroaerofilik. Helicobacter pylori tidak menyerang jaringan tetapi menghuni bagian gel lendir yang melapisi sel epitelial, dengan bagian kecil dari Helicobacter pylori melekat langsung pada sel epitelial. Kebanyakan orang yang terinfeksi Helicobacter pylori mempunyai neutrofil- neutrofil dalam lamina propia dan kelenjar epitel dan suatu peningkatan dalam sel radang kronik pada lamina propia.Kolonisasi Helicobacter pylori dalam duodenum terbatas pada daerah metaplasia lambung dan ditemukan dalam epitelium pasien dengan ulkus duodeni (Mc Guigan, 2001). BakteriHelicobacter pylori bersifat mikroaerofilik dan hidup di lingkungan yang unik, di bawah mukus dinding lambung yang bersuasana asam. Bakteri ini mempunyai enzim urease yang dapat memecah ureum menjadi amonia yang bersifat basa, sehingga tercipta lingkungan memungkinkan bakteri ini dapat bertahan hidup di dalam lambung (Rani dan Fauzi, 2009).
Bakteri Helicobacter pylori adalah bakteri yang sangat suka pada kondisi
kelembapan yang tinggi, memerlukan karbondioksida yang lumayan banyak, butuh
sedikit oksigen, dan bersifat sangat patogenik. Infeksi Helicobacter pylori pada
saluran cerna bagian atas mempunyai variasi klinis yang luas, mulai dari kelompok
asimtomatik sampai tukak peptik, bahkan dihubungkan dengan keganasan dilambung
Bakteri ini juga mempunyai keunggulan yakni bertahan dan berkembang biak
dalam lambung. Secara umum, ada 3 mekanisme infeksi bakteri H. pylori yang
menyebabkan tukak lambung. Pertama, H. pylori menginfeksi bagian bawah
lambung antrum. Kedua, setelah infeksi akan terjadi peradangan bakteri yang
mengakibatkan peradangan lendir lambung (gastritis), peristiwa ini seringkali
terjadi tanpa penampakan gejala (asimptomotik). Ketiga, terjadinya peradangan
dapat berimplikasi terjadinya tukak lambung atau usus 12 jari. Hal ini bisa terjadi
komplikasi akut, yaitu luka dengan pendarahan dan luka berlubang (Ranidan Fauzi,
2009).
2.3 Terapi Eradikasi Helicobacter pylori
Sasaran terapi adalah menghilangkan nyeri tukak, mengobati ulkus,
mencegah kekambuhan dan mengurangi komplikasi yang berkaitan dengan tukak.
Pada penderita dengan Helicobacter pylori positif, tujuan terapi adalah mengatasi
mikroba dan menyembuhkan penyakit dengan obat yang efektif secara ekonomi
(Sukandar, et.al., 2008).
Terapi eradikasi Helicobacter pylori direkomendasikan untuk semua pasien
yang terinfeksi Helicobacter pylori dengan tukak aktif, tukak yang sudah ada
sebelumnya, atau dengan komplikasi tukak.Regimen individual harus diseleksi
berdasarkan efikasi, toleransi, interaksi obat yang potensial, resistensi antibiotik,
biaya dan kepatuhan pasien.Pengobatan harus diawali dengan regimen 3 obat, karena
pengobatan dengan regimaen 2 obat kurang efektif dan dapat menyebabkan resistensi.
Pengobatan dengan regimen 3 terapi yaitu menggunakan kombinasi dari dua
antibiotik klaritomisin, amoksisilin dan pompa proton inhibitor. Amoksisilin diganti
dengan metroniazol atau pun kombinasi antara metronidazol dan amoksisilin yang
2.4 Amoksisillin trihidrat
2.4.1 Uraian bahan
Gambar 2.1Struktur amoksisilin(Ditjen POM, 2014)
Amoksisilin mengandung tidak kurang dari 90,0% C16H19N3O5S.3H20,
dihitung terhadap zat anhidrat. Mempunyai potensi setara dengan tidak kurang dari 900 μg dan tidak lebih dari 1050 μg per mg C16H19N3O5S, dihitung terhadap
zat anhidrat.
Nama Kimia : Asam (2S,5R,6R)-(-)-2-amino-2-(p-hidroksifenil) asetamido]-3,3 dimetil-7-okso-4-tia-1-azabisiklo[3.2.0]-heptan-2-karboksilat trihidrat
Berat Molekul : 419,45
Pemerian : Serbuk hablur; putih; praktis tidak berbau
2.4.2 Farmakologi
Amoksisilin adalah antibiotika golongan β-laktam dengan spektrum luas,
digunakan untuk pengobatan infeksi pada saluran napas, saluran empedu dan saluran
seni, gonorhu, gastroenteritis, meningitis dan infeksi karena Salmonella sp., seperti
demam tipoid. Amoksisilin merupakan turunan penisilin yang tahan asam tetapi tidak
tahan terhadap penisilanase (Siswandono dan Soekardjo, 1995).
Amoksisilin antibakteri berisifat bakterisid yang sensitif terhadap mikroorganisme dengan mekanisme kerja yaitu menghabat sintesis mukopeptida dinding sel bakteri selama proses multipikasi bakteri. Dengan cara berikatan dangan penisilin-binding-protein 1A (PBP-1A) yang berlokasi di dalam dinding sel bakteri. Amoksisilin lebih efektif menghambat mikroorganisme Gram positif dibandingkan dengan bakteri Gram negatif (Kaur, et al., 2011). Menurut Neal (2005) amoksisilin lebih efektif melawan bakteri Gram-positif yang tidak
menghasilkan β-laktamase sedangkan pada bakteri Gram-negatif, amoksisilin
melawan dengan cara menembus pori–pori dalam membran fosfolipid luar.
2.4.3 Farmakokinetik
hati, prostad, empedu, dan cairan senovial, cairan okular, tetapi penetrasinya buruk terhadap sistem saraf pusat kecuali jika terjadi inflamasi. Kadar obat sangat rendah ditemukan di dalam cairan aqueous humor, dan kadar obat rendah di mata, keringat dan ludah. Sekitar 17-20% obat berikatan dengan protein plasma manusia, secara umum albumin. Amoksisilin diekskresikan atau dibuang terutama melalui ginjal, dalam air kemih terdapat dalm bentuk aktif. Waktu paruh (t1/2) nya
adalah 1-1,5 jam (Kaur, et al., 2011).
2.5 Sistem Penghantaran Obat Tertahan di Lambung
Sistem gastroretentifadalah sistem yang dapat tertahan didalam lambung untuk beberapa jam dan oleh karena itu secara siknifikan dapat memperpanjang waktu tinggal obat. Perpanjangan waktu tinggal obat didalam lambung dapat mempengaruhi bioavabilitas, mengurangi obat yang terbuang, dan mempengaruhi kelarutan untuk obat-obat yang memiliki kelarutan rendah di lingkungan dengan pH yang tinggi, juga dapat digunakan untuk penghantaran obat yang bekerja lokal di lambung dan bagian proksimal usus halus (Sharma, et al.,2011).
Banyak teknik yang telah dikembangkan untuk mendapatkan sistem penghantaran obat yang dapat tertahan dilambung.Beberapa teknik seperti sistem pengapungan, sistem pengembangan dan pembesaran, sistem bioadhesif, dan sistem yang berdensitas tinggi merupakan teknik yang banyak dikembangkan untuk mendapatkan sistem gastroretentif ini (Sharma, et al.,2011).
Kandidat obat yang sesuai untuk sediaan yang tertahan di lambung (Garg dan Gupta, 2008; Swetha, et al., 2012):
b. Obat-obat yang kelarutan rendah dalam pH alkalis misalnya: furosemida, diazepam, verapamil, dan klordiazepoksida.
c. Obat-obat yang terutama diabsorbsi dalam lambung atau bagian atas dari saluran pencernaan misalnya: amoksisilin.
d. Obat-obat yang mempunyai rentang absorpsi yang sempit di dalam saluran pencernaan misalnya seperti: siklosporin, metotreksat, levodopa, dan riboflavin.
e. Obat-obat yang diabsorbsi cepat dari saluran pencernaan misalnya: metronidazol, dan tetrasikilin.
f. Obat-obat yang tidak stabil dan terdegradasi didalam kolon misalnya ranitidin, metronidazol, dan metformin HCl.
g. Obat-obat yang mengganggu mikroba kolon misalnya antibiotik untuk Helicobacter pylori.
2.6 Sistem Pengahantaran Obat Mengapung (Floating Drug Delivery System)
2011).Sistem penghantaran mengapungdalam lambung dapat dilihat pada Gambar 2.2.
Gambar 2.2Sistem mengapung di dalam lambung (Bardonnet, et al., 2006)
Sistem penghantaran obat mengapung diklasifikasikan dalam tiga variabel mekanisme yaitu sistem effervescent, sistem non-effervescent, dan sistem pembentuk rakit (Murthy, et al, 2015).
a. Sistem effervescent
Sistem ini dibuat dalam bentuk matriks dengan menggunakan polimer yang dapat mengembang seperti HPMC, senyawa polisakarida lain, kitosan, dan berbagai komponen effervescent seperti natrium bikarbonat, kalsium karbonat, asam sitrat atau asam tartrat. Sediaan ini dirancang sedemikian rupa, sehingga ketika kontak dengan cairan lambung, maka gas karbondioksida (CO2) akan
terlepas dan terperangkap dalam sistem hidrokoloid yang mengembang. Hal ini membantu sediaan untuk mengapung (Goyal, et al., 2011).
b. Sistem non-effervescent
Sistem non-effervescent ini mengembang apabila terjadi kontak yang cukup lama dengan cairan lambung sehingga mencegah keluarnya obat dari lambung.Sistem ini cenderung menyangkut di daerah mendekati spinkter pilori.Salah satu metode formulasi yang dilakukan untuk membuat sistem ini adalah dengan mencampurkan obat dengan gel, yang mengembang ketika kontak dengan cairan lambung.Contoh dari tipe sistem penghantaran obat ini adalah sistem koloid gel, sistem kompartemen mikroporos, beadsalginat, dan mikrobalon (Murthy, et al., 2015).
Pada umumnya dalam formulasi sistem non-effervescent ini menggunakan bahan yang mampu membentuk gel atau memiliki kemampuan mengembang yang baik seperti senyawa hidrokoloid, polisakarida. Juga biasa digunakan bentuk matriks dari polimer-polimer seperti polimetaakrilat, poliakrilat, polistiren dan bioadesif polimer yaitu: kitosan dan karbopol (Gopalakrishnan dan Chenthilnathan, 2011).
c. Sistem pembentuk rakit
Sistem pembentuk rakit atau raft forming telah menarik banyak perhatian para peneliti sebagai salah satu sistem dalam penghantaran obat yang dapat tertahan dilambung, dimana mekanisme sistem ini melibatkan kontak antara gelyang bersifat kohesive dengan cairan lambung. Gel tersebut akan mengembang dan membentuk lapisan yang kontiniu atau berlapis-lapis, hal inilah yang disebut dengan rakit. Rakitini mengembang dikarenakan adanya gas CO2 yang
2.6.1 Keuntungan sistem penghantaran obat mengapung
Sistem penghantaran obat melalui sistem mengapung ini merupakan teknologi penghantaran obat dengan retensi lambung yang lebih lama dan memiliki beberapa keuntungan dalam pemberian obat. Menurut Sharma dan kawan-kawan (2011) beberapa keuntungan tersebut meliputi:
a. Peningkatan penyerapan obat, karena peningkatan waktu tinggal di lambung dan peningkatan waktu kontak obat dengan daerah penyerapan.
b. Penghantaran obat yang dapat dikendalikan pelepasannya. c. Penghantaran obat secara lokal untuk daerah kerja di lambung.
d..Meminimalkan terjadinya iritasi pada mukosa lambung karena obat-obatan tertentu, dengan cara melepaskan obat secara lambat pada tingkat terkendali. e. Digunakan untuk pengobatan gangguan pencernaan.
f. Menggunakan peralatan yang sederhana dan konvensional dalam formulasinya. g. Kemudahan dalam penggunaannya dan meningkatkan faktor kepatuhan pasien
menjadi lebih baik.
h. Penghantaran obat pada daerah tertentu
2.6.2 Kekurangan sistem penghantaran obat mengapung
Disamping memiliki banyak keuntungan sistem penghantaran obat mengapungini, terdapat pula kekurangan dari sistem ini yaitu (Sharma, et al., 2011):
a. Retensi lambung dipengaruhi oleh banyak faktor seperti makanan, pH dan motilitas lambung. Faktor-faktor ini tidak pernah tetap dan karenanya daya apung sediaan tidak dapat diprediksi.
c. Variabilitas tinggi dalam waktu pengosongan lambung serta membutuhkan cairan lambung yang cukup untuk mempertahankan sediaan tetap berada di lambung.
d. Pengosongan lambung untuk pasien dalam keadaan tidur tidak dapat diprediksi dan bergantung pula pada diameter dan ukuran sediaan floatingtersebut. Oleh karena itu sebaiknya tidak diberikan sediaan ini saat pasien akan tidur.
Daftar beberapa obat yang diformulasi dalam bentuk sistem penghantaran obat mengapung dapat dilihat pada tabel di bawah ini:
Tabel 2.1 Daftar obat dalam bentuksistem penghantaran obat mengapung
(Sharma, et al., 2011)
Obat Bentuk sediaan
Verapamil Hidroklorida Floating Microparticles
Ketoprofen Floating Microparticles
Ranitidin Hidroklorida Floating Granules
Metronidazol Floating Beads Low density
multiparticulate System
Lansoprazole Floating Micropellets
Diltiazem Hydrochloride, Theophylline
and Verapamil Hydrochloride Foam Based Floating Microparticles Nifedipine Hollow Microsphere
Acetohydroxamic Acid Floating Microsphere
Piroxicam Floating Microsphere
Residronate Sodium Granules
Diltiazem Hydrochloride Granules Granules
2.7 Kapsul
juga keras.Kebanyakan kapsul-kapsul yang diedarkan di pasaran adalah kapsul yang semuanya dapat ditelan oleh pasien, untuk keuntungan dalam pengobatan.Kapsul gelatin yang keras merupakan jenis yang digunakan oleh ahli farmasi masyarakat dalam menggabungkan obat-obat secara mendadak dan di lingkungan para pembuat sediaan farmasi dalam memproduksi kapsul pada umumnya (Ansel, 2008).
2.8 Natrium Alginat
Gambar 2.4Struktur kimia alginat (Thom, et al., 1981)
Asam alginat adalah kopolimer biner yang terdiri dari residu β -D-mannuronat (M) dan α-L-asam guluronat (G) yang tersusun dalam blok-blok yang membentuk rantai linear. Kedua unit tersebut berikatan pada atom C1 dan C4 dengan susunan homopolimer dari masing-masing residu (MM dan GG) dan suatu blok heteropolimer dari dua residu (MG) (Thom, et al., 1981).
buatan pH 1,2 disebabkan komponen penyusun cangkang kapsul alginat yaitu kalsium guluronat (Bangun, et.al., 2005).
2.9 Uji Pelepasan
Uji pelepasan dilakukan dengan uji disolusi menggunakan seperangkat alat uji disolusi. Disolusi merupakan proses dimana suatu bahan kimia atau bahan obat menjadi terlarut dalam suatu pelarut. Dalam sistem biologik, pelarut atau disolusi obat dalam media air merupakan suatu bagian penting sebelum kondisi absorpsi sistemik (Shargel dan Yu, 1988).
Pelepasan obat dari bentuk sediaan dan absorbsi dalam tubuh dikontrol oleh sifat fisika kimia dari obat dan bentuk yang diberikan, serta sifat-sifat fisika kimia dan fisiologis dari sistem biologis. Konsentrasi obat, kelarutan dalam air, ukuran molekul, bentuk kristal, ikatan protein, dan pKa adalah faktor-faktor fisiko kimia yang harus dipahami untuk mendesain sediaan pelepasan terkontrol atau terkendali (Martin, et al., 2008).
Sejumlah metode untuk menguji disolusi secara in vitro telah dilakukan.Bila suatu sediaan obat dimasukkan kedalam beaker glass yang berisi air atau dimasukkan kedalam saluran cerna (saluran gastrointestin), obat tersebut mulai masuk kedalam larutan dari bentuk padatnya.Disintegrasi, deagregasi dan disolusi bisa berlangsung secara serentak dengan melepasnya suatu obat dari bentuk dimana obat tersebut diberikan (Martin, et al., 2008).
Faktor-faktor yang mempengaruhi disolusi dibagi atas 3 kategori yaitu: a. Faktor-faktor yang berhubungan dengan sifat fisikokimia obat, meliputi:
ii. Efek ukuran parrtikel, ukuran partikel berkurang dapat memperbesar luas permukaan obat yang berhubungan dengan medium, sehingga laju disolusi akan meningkat.
b. Faktor-faktor yang berhubungan dengan sediaan obat, meliputi:
i. Efek formulasi, laju disolusi suatu bahan obat dapat dipengaruhi bila dicampur dengan bahan tambahan. Bahan pengisi, pengikat dan penghancur yang bersifat hidrofil dapat memberikan sifat hidrofil pada bahan obat yang hidrofob, oleh karena itu disolusi bertambah. Sedangkan bahan tambahan yang hidrofob dapat mengurangi laju disolusi. Hal ini kaitannya dengan kelarutan bahan tambahan yang digunakan.
ii. Efek faktor pembuatan sediaan, metode granulasi dapat mempercepat laju disolusi obat-obat yang kurang larut. Penggunaan bahan pengisi yang bersifat hidrofil seperti laktosa dapat menambah hidrofilisitas bahan aktif dan dapat menambah laju disolusi.
c. Faktor-faktor yang berhubungan dengan uji disolusi, meliputi:
i. Tegangan permukaan medium disolusi, tegangan permukaan mempunyai pengaruh nyata terhadap laju disolusi bahan obat. Surfaktan dapat menurunkan sudut kontak, sehingga dapat meningkatkan proses penetrasi medium disolusi ke matriks. Formulasi tablet dan kapsul konvensional juga menunjukkan penambahan laju disolusi obat-obat yang sukar larut dengan penambahan surfaktan kedalam medium disolusi.
ii. Viskositas medium, semakin tinggi viskostas medium, semakin kecil laju disolusi bahan obat.
Farmakope Indonesia edisi V (2014) menuliskan beberapa alat yang dapat digunakan untuk melakukan uji disolusi yaitu:
a. Tipe keranjang
Alat terdiri dari sebuah wadah bertutup yang terbuat dari kaca atau bahan transparan lain yang inert; sebuah motor; batang logam yang digerakkan oleh motor dan keranjang berbentuk silinder.Wadah tercelup sebagian di dalam suatu tangas air yang sesuai, berukuran sedemikian sehingga dapat mempertahankan suhu didalam wadah (37o±0,5o) selama pengujian berlangsung dan menjaga agar gerakan air dalam tangas air halus dan tetap. Wadah disolusi memiliki kapasitas 1000 ml, memiliki tinggi 160-210 mm, diameter 98-106 mm. Untuk mencegah penguapan dapat digunakan suatu penutup yang sesuai. Suatu alat pengatur kecepatan digunakan untuk mengatur kecepatan putaran yang dikehendaki dan mempertahankan kecepatan sesuai dengan yang tertera di monografi dalam batas kurang lebih 4%.
b. Tipe dayung
Sama seperti alat tipe keranjang, kecuali pada alat ini digunakan dayung yang terdiri dari daun dan batang sebagai pengaduk. Batang berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus tampa goyangan yang berarti. Jarak 25±2 mm antara daun dan bagian dalam dasar wadah dipertahankan selama pengujian berlangsung.
c. Silinder kaca bolak-balik