UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Asam
p
-Metoksi Sinamat
Melalui Proses Nitrasi Serta Uji Aktivitas Sebagai Anti
Inflamasi
SKRIPSI
MUHAMAD SYAHID ALI
NIM: 1111102000115
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Asam
p
-Metoksi Sinamat
Melalui Proses Nitrasi Serta Uji Aktivitas Sebagai Anti
Inflamasi
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Mendapat Gelar Sarjana Farmasi
MUHAMAD SYAHID ALI
NIM: 1111102000115
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Skripsi ini adalah hasil karya saya sendiri
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Muhamad Syahid Ali
Nim : 1111102000115
Tanda Tangan :
Program Studi : Strata-1 Farmasi
Judul : Modifikasi Struktur Senyawa Asam p-Metoksi Sinamat Melalui Proses Nitrasi Serta Uji Aktivitas Sebagai Anti Inflamasi.
Etil p-metoksisinamat merupakan senyawa utama yang terdapat dalam rimpang kencur. Tujuan dari penelitian ini adalah memodifikasi struktur asam p-metoksisinamat (APMS) yang dihidrolisis dari etil p-metoksinamat (EPMS) dan menilai terhadap aktivitas antiinflamasi. Modifikasi senyawa Etil p-metoksisinamat dilakukan melalui reaksi hidrolisis menggunakan NaOH sebagai katalis, etanol sebagai pelarut yang selanjutnya menghasilkan senyawa asam p-metoksisinamat. Senyawa asam p-metoksisinamat selanjutnya direaksikan melalui reaksi nitrasi dengan menggunakan HNO3 sebagai reagen dan menggunakan
metode cold microwave menghasilkan senyawa asam p-metoksisinamat yang mengandung gugus nitro. Hasil modifikasi diidentifikasi menggunakan GCMS, IR, 1H-NMR, 13C-NMR dan HSQC. Uji aktivitas antiinflamasi dilakukan dengan menggunakan metode antidenaturasi Bovine Serum Albumin (BSA). Senyawa Asam p-metoksisinamat dapat menginhibisi denaturasi protein pada konsentrasi 10 ppm ( 0,115%) dan pada konsentrasi 100 ppm (0,325%) serta tidak mampu menginhibisi pada konsentrasi 0,1 ppm ( -0, 54) dan 1 ppm (-0,34). Senyawa hasil modifikasi Asam p-motoksisinamat menginhibisi denaturasi protein pada konsentrasi 0,1 ppm (36,71%), 1 ppm (29,65%) dan 10 ppm ( 15,32 %), akan tetapi pada konsentrasi 100 ppm (-7,93) tidak dapat menginhibisi denaturasi protein. Hasil ini menunjukan bahwa terjadi peningkatan aktivitas antiinflamasi pada senyawa nitrasi APMS dibandingkan pada senyawa APMS.
Name : Muhamad Syahid Ali Study Program : Bachelor of Pharmacy
Title : Structure Modification of p-Metoxycinnamate Acid Through Nitration Process and Deternination of Anti-inflammatory Activity
Kencur contains a large amount of ethyl p-methoxycinnamate compound. The aims of this study were to modified the ethyl p-methoxycinnamate into p-methoxycinnamate acid through hydrolysis reaction and determined the anti-inflammatory activity. Ethyl p-methoxycinnamate was modified into p-methoxycinnamate through hydrolysis reaction using NaOH as a catalyst,and ethanol as a solvent. Then, p-methoxycinnamate was modified into p-methoxycinnamate acid nitro derivative through nitration process using cold microwave method and HNO3 as a reagent. The resuls were identified using GCMS, IR, 1H-NMR. 13C-NMR, and HSQC. The determination of anti-inflammatory activity was performed using Bovine Serum Albumin (BSA). p-Methoxycinnamate acid 10 ppm (0.115%) and 100 ppm (0.325%) inhibits the protein denaturation, while the 0.1 ppm (-0,54) and 1 ppm (-0,34) showed no inhibition. And the p-methoxycinnamate nitro derivative 0.1 ppm (36.71%), 1 ppm (29.65%), and 10 ppm (15.32%) inhibits the protein denaturation, while the 100 ppm (-7,93) showed no inhibition. This results showed that anti-inflammatory activity of p-methoxycinnamate acid nitro derivative was increased compared to p-methoxycinnamate acid.
melimpahkan rahmat dan karunia-Nya, serta shalawat dan salam selalu tercurah kepada junjungan kita Nabi Muhamad SAW karena dengan segala rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan
judul “Modifikasi Struktur Senyawa Asam p-metoksisinamat Melalui Proses
Nitrasi Serta Uji Aktivitas Sebagai Antiinflamasi”. Skripsi ini disusun untuk memenuhi tugas akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Kesehatan Program Studi Farmasi UIN Syarif Hidayatullah, Jakarta.
Pada kesempatan ini perkenankanlah penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Kedua orang tua ayah Yayan Taryana dan ibu Lia Nurhaliah tercinta yang telah memberikan kasih sayangnya, doa, semangat, dukungan moril maupun materi, tiada yang bisa aku balas atas semua pemberiannya, hanya ucapan terimakasih ini yang bisa aku sampaikan. Kepada keduan kaka tercinta A Edi & A Dede, kepada adik-adik tersayang Fanji, Piki, dan adik kesayanganku Gangan & Gingin yang selalu menyemangatiku dalam menuntun ilmu.
2. Ibu Ismiarni Komala, M.Sc.,Ph.D.,Apt sebagai pembimbing I dan bapak Supandi, M.Si.,Apt sebagai pembimbing II yang telah memberikan ilmu, nasihat, waktu, tenaga, dan pikirannya selama penelitian dan penulisan skripsi.
3. Bapak Dr.H. Arif Sumantri, SKM.,M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Bapak Yardi.,Ph.D., Apt, selaku Kepala Program Studi Farmasi dan Ibu Nelly Suryani., Ph.D., Apt selaku sekertaris Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
7. Teman-teman seperjuangan “KENCUR” : Reza, Indri, Nova, Aziz, Sutar, Indah, Mida, BTR, & Adyt yang telah saling membantu menyelesaikan permasalah baik saat penelitian maupun saat penulisan skripsi dan tidak lupa kepada ka Ipho dan Ka Fikri yang telah membimbing penelitian ini. 8. Nicky yang banyak membantu dalam penelitian dan belajar.
9. Teman-teman yang suka membantu dalam belajar : Fio (gembul), Rhesa (Uni), Rianisa (achi), Reza (Abang), puspita dll yang selalu membantu belajar dari awal kuliah sampai perkuliahan berakhir dan kepada ayu DG, wina, henny, Icho yang telah membantu dalam berbagai hal sehingga saya bisa menyelesaikan kuliah di farmasi UIN Jakarta.
10.Teman-teman satu kontrakan dan teman bermain : Wahidin mamet, Rijal, Mozer, Andis, Akas, Haidar dll.
11. Teman-teman Farmasi 2011 dan spesial untuk kelas C yang telah memberikan memori yang indah selama perkuliahan di pinggiran ibukota Jakarta ini. Tanpa kalian perjalanan mencari ilmu ini tidak akan berwarna. 12.Para staf dan karyawan program studi farmasi, staf laboran, ka Eris, ka
Tiwi, ka Lisna, Ka liken, Mb Rani, dan pak Rahmadi yang banyak membantu selama penelitian berlangsung.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna. Oleh karena itu kritik dan saran yang bersifat membangun sangat penulis harapkan guna tercapainya kesempurnaan skripsi ini.
Akhirnya, dengan segala kerendahan hati, penulis berharap semoga hasil penelitian ini dapat bermanfaat baik bagi kalangan akademis, khususnya bagi mahasiswa Farmasi, Masyarakat pada umumnya dan bagi dunia ilmu pengetahuan.
Ciputat, Juni 2015
Sebagai sivitas akademika Universitas Islam Negeri ( UIN ) Syarif Hidayatullah Jakarta, saya yang bertandatangan dibawah ini :
Nama : Muhamad Syahid Ali
Nim : 1111102000115
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/ karya ilmiah saya, dengan judul :
MODIFIKASI STRUKTUR SENYAWA ASAM P-METOKSISINAMAT MELALUI PROSES NITRASI SERTA UJI AKTIVITAS SEBAGAI ANTIINFLAMASI
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri ( UIN ) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Dibuat di : Jakarta
Pada tanggal : april 2015
Yang menyatakan
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
KATA PENGANTAR ...viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... x
DAFTAR ISI ... xi
1.3Tujuan Penelitian ... 3
1.4Hipotesa ... 3
1.5Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA ... 4
2.1Etil p-metoksisinamat ... 4
2.2Asam Nitrat... 5
2.3Hidrolisis ... 5
2.4Nitrasi ... 7
2.5Kromatografi ... 9
2.5.1 Kromatografi Lapis Tipis ... 10
2.5.2 Kromatografi Kolom ... 11
2.5.3 kromatografi gas... 12
2.6Spektroskopi ... 13
2.6.1 Spektroskopi UV-Visible ... 13
2.6.2 Spektroskopi Infra Merah ... 13
2.6.3 Spektrofotometri Resonansi Magnetik ... 14
2.7Uji inVitro Antiinflamasi dengan Bovine Serum Albumin ... 15
BAB 3 METODOLOGI PENELITIAN ... 16
3.1 Lokasi dan Waktu ... 16
3.2 Alat dan Bahan ... 16
Alat ... 16
Bahan ... 16
3.3 Prosedur Penelitiaan ... 16
3.3.1 Hidrolisis Etil p-metoksisinamat ... 16
3.3.2 Nitrasi Asam p-metoksisinamat ... 17
3.3.3 Identifikasi ... 17
3.3.4 Pembuatan Reagen untuk Uji Antiinflamasi ... 18
3.3.5 Uji Invitro Antiinflamasi ... 19
BAB 4 HASIL DAN PEMBAHASAN ... 20
4.1 Modifikasi Senyawa Etil p-metoksi Sinamat dengan reaksi Hidrolisis ... 20
4.2 Modifikasi Senyawa Asam p-metoksi Sinamat Dengan Reaksi Nitrasi ... 21
4.3 Identifikasi Senyawa Hasil Modifikasi ... 23
4.3.1 Senyawa Hasil Hidrolisis Etil p-metoksisinamat...24
4.3.2 Senyawa Hasil Nitrasi Asam p-metoksisinamat...25
4.4 Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas Senyawa Hasil Modofikasi...32
BAB 5 KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan... 36
5.2 Saran ... 36
1. Gambar jalur sikimat dalam biosintesa fenilpropaoid
untuk menganalisa etil p-metoksisinamat ... 4
2. Gambar mekanisme reaksi hidrolisis pada ester ... 6
3. Gambar mekanisme reaksi hidrolisis ester dengan katalis basa 7 4. Gambar prinsip subtitusi elektrofilik pada aromatis ... 8
5. Gambar Mekanisme nitrasi aromatik ... 9
6. Gambar KLT senyawa hasil Hidrolisis ... 20
7. Gambar Reaksi Hidrolisis... 21
8. Gambar KLT Optimasi Reaksi Nitrasi ... 22
9. Gambar Reaksi Nitrasi Hasil Hidrolisis ... 22
10.Gambar Hasil KLT senyawa dengan eluen heksan:etil (3:2) ... 23
11.Gambar Serbuk APMS ... 24
12.Gambar Fragmentasi Senyawa Hasil Hidrolisis EPMS ... 25
13.Gambar Struktur Senyawa Asam p-metoksisinamat ... 25
14.Gambar Senyawa Hasil Nitrasi Nitrasi 4-Metoksi-2-Nitro-beta-Nitrostirena ... 25
15.Gambar Spektrum IR ... 26
16.Gambar Spektrum GCMS Senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena ... 27
17.Gambar Fragmentasi Massa Senyawa Hasil Nitrasi APMS ... 28
18.Gambar Asam p-metoksisinamat & senyawa hasil modifikasi nitras ... 28
19.Gambar H-NMR Senyawa Hasil Nitras ... 28
20.Gambar C-NMR Senyawa Hasil Nitrasi ... 30
21.Gambar HSQC Senyawa Hasil Nitrasi ... 31
22.Gambar Diagram Aktivitas Antiinflamasi ... 34
1. Tabel enafsiran IR ... 26
2. Tabel Data Pergeseran Kimia (ὁ) Spektrum 1H NMR Senyawa
4-Metoksi-2-Nitro-beta-Nitrostirena ( CDCl3, 500 MHz) ... 2
3. Tabel C-NMR senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena .... 32
4. Hasil Uji Antiinflamasi Senyawa Kontrol dan Senyawa Hasil
Lampiran 1: Kerangka Penelitian ... 40
Lampiran 2: Skema Identifikasi Senyawa Hasil Modifikasi ... 41
Lampiran 3: Identifikasi Senyawa Etil p-metoksisinamat ... 42
Lampiran 4: Spektrum IR Etil p-metoksisinamat ... 43
Lampiran 5: Spektrum GC-MS Etil p-metoksisinamat ... 44
Lampiran 6: Spektrum 1H-NMR Etil p-metoksisinamat ... 46
Lampiran 7: Spektrum GC-MS Senyawa Asam p-metoksisinamat ... 49
Lampiran 8: Spektrum IR Senyawa Reaksi Nitrasi ... 50
Lampiran 9: Spektrum GC-MS senyawa Reaksi Nitrasi ... 51
Lampiran 10: Spektrum NMR Senyawa Hasil Reaksi Nitrasi ... 52
Lampiran 11: Perhitungan Reaksi ... 63
Lampiran 12: Hasil Perhitungan Uji Antiinflamasi ... 65
Lampiran 13: Kurva Uji Antiiflamasi ... 66
Lampiran 14 : Gambar Senyawa ... 67
AINS Anti Inflamasi Non Steroid COX Siklooksigenase
g gram
IR Infra Red
KLT Kromatografi Lapis Tipis
NMR Nuclear Magnetic Resonance
UV Ultra Violet
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Indonesia dikenal sebagai negara dengan sumber daya hayati kedua terbesar didunia yang tersebar dari Sabang hingga Merauke. Di Indonesia terdapat lebih kurang 30.000 jenis tumbuh-tumbuhan, lebih kurang 7.500 jenis diantaranya termasuk tanaman berkhasiat obat lebih dari 1.800 jenis tanaman telah diidentifikasi dari beberapa formasi hutan, namun hingga saat ini pemanfaatannya belum optimal. Jumlah tanaman obat yang dimanfaatkan oleh masyarakat baru sekitar 1.000 hingga 1.200 jenis, dan yang digunakan secara rutin dalam industri obat tradisional baru sekitar 300 jenis (BPOM, 2014).
Salah satu tanaman tradisional yang dimanfaatkan untuk obat-obatan adalah Kencur (Kaempferia galanga L.). Kencur diketahui mengandung minyak atsiri dan merupakan salah satu tanaman Suku Zingiberaceae. Secara empirik rimpang kencur sering digunakan sebagai obat tradisional, salah satunya sebagai anti inflamasi (Hasanah et al, JMS 2011). Kandungan metabolit sekunder dalam ekstrak kencur diantaranya ialah asam propionat (4,7%), pentadekan (2,08%), asam tridekanoat (1,81%), 1,21-decosadiene (1,47%), beta sitosterol (9,88%), dan komponen terbesarnya adalah etil p-metoksisinamat (80,05%) (Umar et al, 2012). Dalam studi in vitro, etil p-metoksisinamat secara non-selektif menghambat aktivitas COX-1 dan COX-2, dengan masing-masing nilai IC50 1,12 μM dan 0,83
μM. Hasil ini memvalidasi aktivitas antiinflamasi kencur yang dihasilkan oleh
penghambatan COX-1 dan COX-2 (Umar et al, 2012). Dari berbagai penelitian, epidemiologi, dan studi klinis menunjukkan bahwa AINS mempunyai prospek yang menjanjikan sebagai agen antikanker (Kashfi, 2002). Etil p-metoksisinamat terdapat pada kencur (Kaempferia galangal Linn) dalam jumlah yang besar. Etil p-metoksisinamat dapat diisolasi dan dimurnikan dengan mudah (Barus, 2009)
(Nurhayati, 2010) tanpa dilakukan uji aktivitas senyawa, modifikasi dengan proses hidrolisis (Mufidah, 2014). Senyawa asam p-metoksisinamat (APMS) merupakan senyawa turunan dari etil p-metoksisinamat yang direaksikan melalui proses hidrolisis. Menurut hasil penelitian sebelumnya asam p-metoksisinamat yang dihasilkan dari proses hidrolisis etil p-metoksisinamat tidak memiliki aktivitas antiinflamasi (Mufidah, 2014).
Salah satu kelemahan dari senyawa antiinflamasi non steroid adalah kurang selektif karena menghambat COX-1 dan COX-2 dengan efek samping yang sering terjadi adalah induksi tukak peptik (Nazeruddin G. M. et al, 2010) yang sering disertai dengan anemia sekunder akibat perdarahan saluran cerna (Farmakologi, 2007). Dalam rangka mengeksplorasi hubungan struktur aktivitas senyawa asam p-metoksisinamat, maka akan dilakukan penelitian tentang pengaruh penambahan
atau pengurangan gugus tertentu pada struktur aromatis yakni dengan melakukan substitusi gugus NO2, dengan adanya substitusi NO2 pada APMS diharapkan
dapat meningkatkan aktivitas antiinflamasi dan alasan di balik pengembangan kelas obat ini adalah bahwa gugus NO2 dapat mempertahankan aliran darah
mukosa lambung dan mencegah leukosit pada endotel vaskular sirkulasi splanknikus (salah satu peristiwa paling awal setelah pemberian AINS) sehingga dapat melawan efek merugikan dari COX-1 dan cedera mukosa tidak terjadi (Halen et al, 2009). Uji antiinflamasi dilakukan secara in vitro menggunakan Bovine Serum Albumin (BSA) dengan melihat efek denaturasi pada BSA. Pengujian ini dipilih karena mempunyai banyak keuntungan yaitu mudah dalam pengerjaan, membutuhkan sampel yang sedikit, cepat, dan merupakan uji pendahuluan dalam pengujian antiinflamasi
1.2 Rumusan Masalah
a. Apakah gugus fungsi pada senyawa asam p-metoksisinamat yang dihidrolisis dari etil p-metoksisinamat dapat ditransformasi melalui reaksi nitrasi?
1.3 Tujuan Penelitian
a. Melakukan modifikasi struktur senyawa asam p-metoksisinamat yang dihidrolisis dari etil p-metoksisinamat
b. menilai analisa hubungan struktur aktivitas antiinflamasi senyawa yang dihasilkan proses nitrasi asam p-metoksisinamat.
1.4 Hipotesa
a. Mendapatkan senyawa turunan asam p-metoksisinamat yang mengandung gugus nitro yang diharapkan dapat memberikan informasi baru mengenai hubungan struktur aktivitas senyawa etil p-metoksisinamat sebagai agen antiinflamasi.
b. Memberikan informasi untuk proses modifikasi struktur dan uji aktivitas dari senyawa asam p-metoksisinamat lebih lanjut, khususnya yang melalui proses nitrasi.
1.5 Manfaat Penelitian
a. Proses nitrasi dapat menghasilkan senyawa turunan yang mengandung NO2.
b. Penambahan gugus NO2 pada senyawa asam p-metoksisinamat akan
BAB 2
TINJAUAN PUSTAKA
2.1 Etil p-metoksisinamat
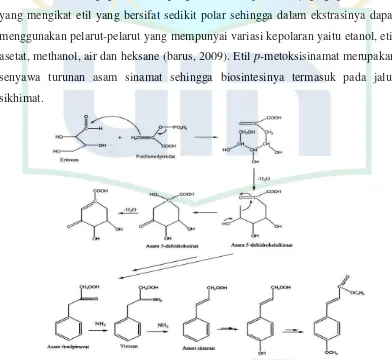
Etil p-metoksisinamat adalah salah satu senyawa hasil isolasi rimpang kencur yang merupakan bahan dasar tabir surya yaitu pelindung kulit dari sengatan sinar matahari. EPMS merupakan senyawa aktif yang ditambahkan pada lotion atau pun pada bedak setelah mengalami sedikit modifikasi yaitu perpanjangan rantai dimana etil dari ester ini diganti oleh oktil, etil heksil ataupun melalui heptil melalui transesterifikasi maupun esterifikasi bertahap (Barus, 2009).
Etil p-metoksisinamat termasuk kedalam senyawa ester yang mengandung cincin benzene dan gugus metoksi yang bersifat nonpolar dan juga gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga dalam ekstrasinya dapat menggunakan pelarut-pelarut yang mempunyai variasi kepolaran yaitu etanol, etil asetat, methanol, air dan heksane (barus, 2009). Etil p-metoksisinamat merupakan senyawa turunan asam sinamat sehingga biosintesinya termasuk pada jalur sikhimat.
Gambar 2.1 Jalur asam sikhimat dalam biosintesa fenilpropanoid untuk
2.2 Asam Nitrat Kelarutan (dalam 100 bagian)
- air dingin : ∞ (tak terhingga)
- air panas : ∞ (tak terhingga)
Meledak dalam pelarut etanol
Viskositas (25ºC), Cp : 0,761 Panas peleburan (Hfus),Kj/mol : 10,48 Panas pembentukan (Hf), (25ºC), Kj/mol: -174,10 Panas penguapan (25ºC), Kj/mol : 39,04 Energi bebas pembentukan (25ºC), Kj/mol: -80,71
Sifat Kimia
Asam nitrat merupakan suatu asam monobasa yang kuat, mudah bereaksi dengan alkali, oksida dan senyawa basa dalam bentuk garam. Asam nitrat merupakan senyawa yang berperan dalam proses nitrasi sebagai nitrating agent. (Yulianto, 2010)
2.3 Hidrolisis
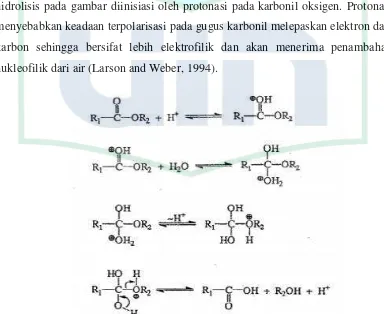
Hidrolisis ester dan amida terjadi sebagai hasil serangan nukleofilik pada karbon gugus karbonil dan pemecahan lebih lanjut ikatan tunggal karbon-oksigen atau karbon-nitrogen. Karbon pada gugus karbonil lebih positif daripada yang diperkirakan akibat tingginya elektronegativitas oksigen yang didekatnya. Pembagian electron-elektron ikatan yang tidak seimbang menyebabkan terjadinya polarisasi ikatan sehingga karbon bermuatan positif parsial, sedangkan oksigen bermuatan negatif parsial (Donald , 2009).
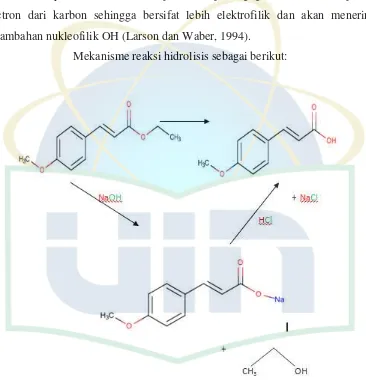
Reaksi hidrolisis dapat terjadi dengan katalis basa atau asam. Mekanisme reaksi hidrolisis sendiri dikelompokkan berdasarkan tipe reaksi dasar seperti subtitusi nukleofilik, gugus fungsi yang ditransformasikan dengan reaksi substitusi nukleofilik, substitusi asil nukelofilik, gugus fungsi yang ditransformasikan dengan reaksi substitusi asil nukleofilik. Hidrolisis untuk turunan asam karboksilat masuk ke dalam kategori terakhir yakni gugus fungsi yang ditransformasikan dengan reaksi subtitusi asil nukleofilik. Mekanisme hidrolisis pada gambar diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik dari air (Larson and Weber, 1994).
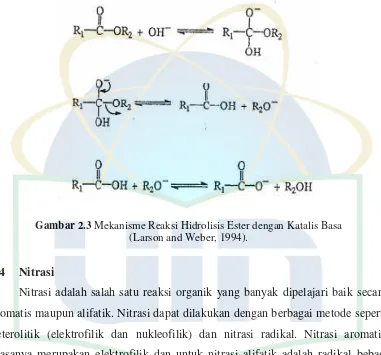
Hidrolisis ester dengan katalis basa melalui mekanisme penambahan nukleofilik OH (gambar 2.5) secara langsung kepada gugus karbonil. Hidrolisis ester berkatalis basa terjadi karena ion OH merupakan nukleofil yang lebih kuat dibandingkan air (Larson dan Weber, 1994).
Gambar 2.3 Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa (Larson and Weber, 1994).
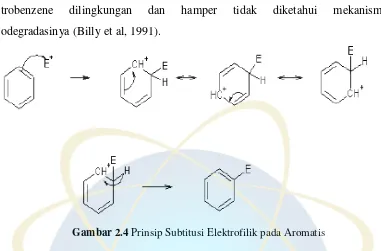
2.4 Nitrasi
Nitrasi adalah salah satu reaksi organik yang banyak dipelajari baik secara aromatis maupun alifatik. Nitrasi dapat dilakukan dengan berbagai metode seperti heterolitik (elektrofilik dan nukleofilik) dan nitrasi radikal. Nitrasi aromatik biasanya merupakan elektrofilik dan untuk nitrasi alifatik adalah radikal bebas. Senyawa nitroaromatik biasa digunakan sebagai senyawa intermediet dalam sintesis plastik, insektisida, bahan peledak, dan juga farmasetik. Sedangkan untuk nitroalifatik biasa digunakan sebagai pelarut dan hasil sintesis dalam sintesis organik (Olah, 1982).
nitrobenzene dilingkungan dan hamper tidak diketahui mekanisme biodegradasinya (Billy et al, 1991).
Gambar 2.4 Prinsip Subtitusi Elektrofilik pada Aromatis
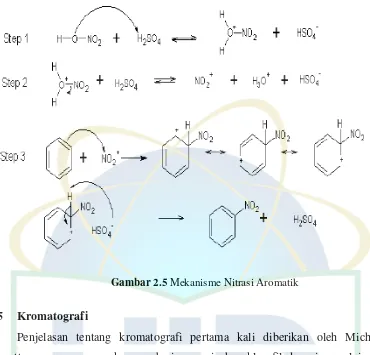
Reaksi nitrasi berlangsung dengan penggantian satu atau lebih gugus nitro (-NO2) menjadi molekul yang reaktif. Gugus nitro akan menyerang karbon
membentuk nitro aromatik atau nitro parafin. Jika menyerang nitrogen membentuk nitramin dan bila menyerang oksigen membentuk nitrat ester. Pada proses nitrasi masuknya gugus (-NO2) ke dalam senyawa dapat terjadi dengan
menggantikan kedudukan beberapa atom atau gugus yang ada dalam senyawa. Umumnya nitrasi yang banyak dijumpai adalah nitrasi –NO2 menggantikan atom
H (Yulianto, 2010).
Nitrating agent adalah reaktan elektrofilik, dimana reaksi akan terjadi pada
atom karbon dari cincin aromatik yang mempunyai kepadatan elektron terbesar. Gugus NO2 yang masuk dapat membentuk posisi ortho, para, dan meta. Jumlah
isomer pada produk tergantung pada subtituen ini. Subtituen meta menyebabkan kepadatan elektron menjadi lebih besar dibandingkan subtituen ortho dan para, sehingga yield produk nitrasi akan didominasi isomer meta (Yulianto, 2010).
Gambar 2.5 Mekanisme Nitrasi Aromatik
2.5 Kromatografi
Penjelasan tentang kromatografi pertama kali diberikan oleh Michael Tswett, yang mengumumkan pemberian pemisahan klorofil dan pigmen lainnya dalam suatu seri tanaman. Sekarang kromatografi mencakup berbagai proses yang berdasarkan pada perbedaan distribusi dari penyusunan cuplikan antara dua fase.
Kromatografi merupakan suatu cara pemisahan fisik dengan unsur-unsur yang akan dipisahkan terdistribusikan antara dua fasa, satu dari fasa-fasa ini membentuk lapisan stasioner dengan luas permukaan yang besar dan fasa lainnya merupakan cairan yang merembes lewat. Fasa stasioner mungkin suatu zat padat atau suatu cairan dan fasa yang bergerak mungkin suatu cairan atau suatu gas (Underwood, 1981).
Pemisahan secara kromatografi dilakukan dengan mempertimbangkan beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat ialah:
- Kecenderungan molekul untuk melarut dalam cairan (kelarutan)
- Kecenderungan molekul untuk menguap atau berubah ke keadaan uap (keatsirian)
Pada sistem kromatografi, campuran yang akan dipisahkan ditempatkan dalam keadaan demikian rupa sehingga komponen-komponennya harus menunjukkan dua dari ketiga sifat tersebut. Hal ini melibatkan dua sifat berlainan, misalnya penjerapan dan kelarutan, misalnya kelarutan di dalam dua cairan yang tidak bercampur.
Walaupun kromatografi melibatkan proses saling mempengaruhi antara beberapa sifat. Misalnya memasukkan senyawa ke dalam corong pisah yang berisi dua pelarut yang masing-masing mempunyai kelarutan yang terbatas dalam pelarut pasangannya (misalnya eter dan air), Senyawa itu cenderung terdistribusi atau terpartisi di antara kedua cairan itu atau fase bergantung kepada sifat kelarutannya. Partisi yang demikian merupakan persaingan antara kelarutan di dalam cairan. Jikadimasukkan linarut ke dalam labu yang berisi cairan dan serbuk bahan padat (misalnya arang), linarut akan terdistribusi di antara permukaan bahan padat (dalam hal kedua ini, linarut menunjukkan sifat kejerapannya). Pada akhirnya dimasukkan linarut ke dalam labu yang sedikit mengandung cairan yang tidak atsiri, linarut akan menunjukkan sifat kelarutan dan keatsirian. Dalam sistem kromatografi, mungkin saja dapat memperbesar perbedaan itu, walaupun perbedaan itu sangat kecil, dan menjadikannya sebagai dasar pemisahan (Gritter, 1991).
2.5.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis menandai puncak perkembangan kromatografi adsorpsi yang dicetuskan kali pertama oleh Izamailov dan Shraiber pada tahun 1938. Sebagai fase diam adalah bahan padat yang diletakkan pada plat gelas secara seragam, dengan ketebalan lebih kurang 0,250 mm. Disamping plat gelas juga sudah umum digunakan plat dari logam atau plastik.
atau campuran yang dikenal sebagai pelarut pengembang atau pelarut pengembang campur. KLT merupakan metode pemisahan komponen-komponen atas dasar perbedaan adsorpsi partisi oleh fase diam dibawah gerakan pelarut pengembang atau pelarut pengembang campur. Pemilihan pelarut sangat dipengaruhi oleh macam dan polaritas zat-zat kimia yang dipisahkan. (Mulja, 1995) KLT dapat dipakai dengan dua tujuan. Pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi (Gritter, 1991). Nilai Rf dapat dihitung dengan menggunakan perbandingan sebagaimana dalam persamaan :
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solute mempunyai
perbandingan distribusi (D) dan faktor retensi (k’) sama dengan 0 yang berisi
solute bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal permukaan fase diam.
2.5.2 Kromatografi Kolom
Kromatografi kolom adalah kromatografi yang menggunakan kolom sebagai alat untuk memisahkan komponen-komponen dalam campuran. Alat tersebut berupa pipa gelas yang dilengkapi suatu kran di bagian bawah kolom untuk mengendalikan aliran zat cair. Ukuran kolom tergantung dari banyaknya zat yang akan dipindahkan. Pemisahan tergantung kepada kesetimbangan yang terbentuk pada bidang antar muka di antara butiran-butiran adsorben dan fase bergerak serta kelarutan relatif komponen pada fase bergeraknya (Yazid, E., 2005).
karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoida (berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti selulosa, silika, atau poliamida), dilanjutkan dengan elusi beruntun setiap komponen menggunakan pelarut yang cocok. Kolom hanya berupa tabung kaca yang dilengkapi dengan keran pada salah satu ujung. Menempatkan larutan cuplikan pada kolom sedemikian rupa sehingga terbentuk pita yang siap dielusi lebih lanjut (Markham, 1988).
Pengisian kolom harus dikerjakan seragam, setelah adsorben dimasukkan dapat diseragamkan kerapatannya dalam kolom dengan menggunakan vibrator. Selain itu dapat juga dikerjakan dengan memasukkan adsorben dalam bentuk larutan dan partikelnya dibiarkan mengendap. Pengisian kolom yang tidak seragam dapat menghasilkan rongga-rongga ditengah-tengah kolom. Pada bagian bawah dan atas dari isian kolom diberi wool untuk menyangga isian. Bila kolom telah diisi bahan isian permukaan cairan tidak boleh dibiarkan turun dibawah permukaan bahan isian bagian atas, karena akan memberikan peluang masuknya gelembung-gelembung udara masuk kedalam kolom (Hosttetman, 1995).
2.5.3 kromatografi Gas
Kromatografi gas dan spektrometri massa dapat digunakan untuk memisahkan komponen dengan memberikan waktu retensi dan puncak elusi yang dapat dimasukkan ke dalam spektrofotometer massa untuk memperoleh berat molekul, karakteristik dan informasi fragmentasi (Heinrich, 2004). Teknik ini juga dapat digunakan untuk komponen yang polar (senyawa yang larut dalam air) seperti calistegines dan polihidroksil alkaloid jika dibuat turunannya dengan komponen yang sesuai (trimetilsilil klorida) untuk meningkatkan volatilitasnya (Heinrich, 2004).
massa sebagai metode deteksi yang memberikan data yang bermakna, yang diperoleh dari penentuan langsung molekul zat atau fragmen (Heinrich, 2004).
2.6 Spektroskopi
2.6.1 Spektroskopi UV-Visible
Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blanko pelarut serta menggunakan spektrofotometer yang merekam otomatis. Senyawa tanwarna diukur pada jangka 200-400 nm, senyawa berwarna pada jangka 200-700 nm. Prinsip kerja spektrofotometer UV-Vis ialah interaksi sinar ultraviolet atau tampak dengan molekul sampel. Energi cahaya akan mengeksitasi elektron terluar molekul ke orbital lebih tinggi (Harborne, 1987).
Pada kondisi ini, elektron tidak stabil dan dapat melepas energi untuk kembali ke tingkat dasar, dengan disertai emisi cahaya. Besarnya penyerapan cahaya sebanding dengan molekul, sesuai dengan hukum lambert-Beer :
A= ɛ B C
Sumber radiasi pada spektrofotometer UV-Vis berdasarkan panjang gelombang terbagi menjadi 2, yaitu lampu deuterium dan tungstent. Lampu deuterium menghasilkan sinar 160-500 nm. Lampu tungstent digunakan di daerah sinar tampak 350-3500 nm. Sumber radiasi dikatakan ideal jika memancarkan sperktrum radiasi yang kontinyu, intensitasnya tinggi dan stabil pada semua panjang gelombang (Day & Underwood, 1980).
2.6.2 SpektroskopiInfra Merah
cm-1. Spektrofotometri inframerah merupakan alat untuk mendeteksi gugus fungsional, mengidentifikasi senyawa dan menganalisis campuran. Banyak pita
absorpsi yang terdapat dalam daerah yang di sebut daerah “sidik jari” spektrum
(Harborne, 1987).
Spektrum inframerah suatu sampel dapat di ketahui letak pita serapan yang dikaitkan dengan adanya suatu gugus fungsional tertentu (Underwood, 1999). Spektroskopi inframerah digunakan sebagai analisis kualitatif untuk menentukan gugus fungsi. Gugus fungsi dapat diintepretasi dengan memeriksa puncak absorbsi dari spektrum inframerah.
Daerah pada spektrum inframerah diatas 1200 cm-1 menunjukkan pita spektrum atau puncak yang disebabkan oleh getaran ikatan kimia atau gugus fungsi dalam molekul yang telah ditelaah. Daerah dibawah 1200 cm-1 menunjukkan pita yang disebabkan oleh getaran seluruh molekul, dan karena kerumitannya dikenal sebagai daerah sidik jari. Intensitas berbagai pita direkam secara subjektif pada skala sederhana: kuat, menengah atau lemah (Harborne, 1987).
2.6.3 Spektrofotometri Resonansi Magnetik
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance) NMR merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul. Struktur NMR memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen.(Cresswell and Campbell. 1982)
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua proton–proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa kadang–kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa memberikan penaikan menjadi puncak absorpsi tunggal dalam spektrum NMR. (Silverstein. 1981).
elektromagnet, biasanya dalam jangkau frekuensi radio 107-108 Hz. Sebuah inti yang berpusing yang disearahkan dengan medan magnet itu dapat dibalikkan arahnya dengan cara menyerap sebuah proton yang energinya tepat sesuai. Inti yang berlainan atau inti yang serupa tetapi terikat pada lingkungan yang berlainan, menyerap foton pada panjang gelombang yang berlainan. Pola frekuensi radio yang diserap merupakan spektrum NMR dari senyawa itu. (Cresswell and Campbell.1982).
Di dalam medan magnet, perputaran elektron–elektron valensi dari proton menghasilkan medan magnet yang melawan medan magnet yang digunakan. Hingga setiap proton dalam molekul dilindungi dari medan magnet yang digunakan mengenai dan bahwa besarnya perlindungan ini tergantung pada kerapatan elektron yang mengelilinginya.Makin besar kerapatan elektron yang mengelilingi inti, maka makin besar pula medan yang dihasilkan yang melawan medan magnet yang digunakan. Akibat secara keseluruhan/ proton merasakan adanya pengurangan medan yang mengenainya. Karena inti merasakan medan magnet yang dirasakan lebih kecil, maka ia akan mengalami presesi pada frekuensi yang lebih rendah. Setiap proton dalam molekul mempunyai lingkungan kimia yang sedikit berbeda yang akan mengakibatkan dalam frekuensi yang sedikit berbeda. ( Sastrohamidjojo. 1991 ).
2.7 Uji inVitro Antiinflamasi dengan Bovine Serum Albumin
BAB 3
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu
Penelitian dilaksanakan di Laboratorium Farmakognosi dan Fitokimia, Laboratorium Penelitian I, Laboratorium Penelitian II, Laboratorium Kimia Obat Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan. Penelitian dimulai pada bulan Februari sampai April 2015.
3.2 Alat dan Bahan
Alat
Spektrofotometer H-NMR(500 MHz, JEOL), Spektrofotometer UV-vis (HITACHI), GCMS (Agilent Technologies), Spektrofotometer Inframerah Transformasi Fourier, seperangkat alat Kromatografi Lapis Tipis, Seperangkat alat Kromatografi Kolom, timbangan analitik, microwave, Penangas air, rotary evaporator (Eyela), gelas kimia, pipet tetes, pipet ukur, kertas saring, magnetic stirrer (Wiggen Hauser).
Bahan
Senyawa etil p-metoksisinamat, HCl 15%, NaOH, HNO3 69%, metanol,
aseton, n-Heksan, etil asetat, akuades, es batu, Basa Tris, Bovine Serum Albumin.
3.3 Prosedur Penelitiaan
3.3.1 Hidrolisis Etil p-metoksisinamat
keringkan dengan suhu ruang, setelah kering dihitung rendemen senyawa apms yang didapat dengan menggunakan rumus berikut.
% rendemen
3.3.2 Nitrasi Asam p-metoksisinamat
Sebanyak 3 gram hasil hidrolisis Etil p-metoksisinamat yaitu apms dimasukkan ke dalam erlemeyer dengan dikondisikan dingin pada suhu -15ºC. Lalu dimasukkan 12 ml HNO3, aduk hingga asam p-metoksisinamat larut.
Dimasukkan dalam microwave dengan suhu 450ºC selama 2 menit. Hasil yang didapat dicampur dengan akuades sebenyak 30 ml lalu saring dengan kertas saring, setelah itu keringkan dengan suhu ruang (Ajay et al., 2006). Setelah kering hitung rendemen hasil reaksi dengan menggunakan rumus berikut
% rendemen
3.3.3 Identifikasi
a. Identifikasi Organoleptis
Senyawa yang didapat baik senyawa murni etil p-metoksisinamat maupun senyawa hasil modifikasi diidentifikasi warna, bentuk dan juga bau.
b. Identifikasi Senyawa Dengan KLT
Dilarutkan sedikit hasil reaksi nitrasi, APMS standar, EPMS standar dalam vial terpisah kira-kira 2 mg dalam etil asetat 1 ml, eluen yang digunakan adalah etil asetat:heksan dengan perbandingan 1:4, ditotolkan senyawa yang akan diuji pada KLT lalu lihat hasilnya menggunakan UV dengan panjang gelombang 254 nm.
c. Identifikasi Senyawa Menggunakan FTIR
d. Identifikasi Senyawa Menggunakan GCMS
Kolom yang digunakan adalah HP-5MS (30 m × 0,25 mm ID × 0,25 µm); suhu awal 70oC selama 2 menit, dinaikkan ke suhu 285oC dengan kecepatan 20oC/menit selama 20 menit. Suhu MSD 285oC. Kecepatan aliran 1,2 mL/menit dengan split 1:100. Parameter scanning dilakukan dari massa paling rendah yakni 35 sampai paling tinggi 550 (Umar et al, 2012).
e. Identifikasi Senyawa Menggunakan 1H-NMR dan 13C-NMR
Sedikit sampel padat (±10mg), kemudian dilarutkan dalam pelarut kloroform bebas proton (khusus NMR), setelah dilarutkan kemudian dimasukkan ke dalam tabung khusus NMR untuk kemudian dianalisis.
3.3.4 Pembuatan Reagen untuk Uji Antiinflamasi
a. Larutan TBS (TrisBuffer Saline)pH 6.3
Sebanyak 1,21 g Trisbase dan 8,7 g NaCl dilarutkan dalam 1000 mL aquades. Didapatkan larutan dengan pH 9,7. Kemudian adjust pH sampai 6,3 menggunakan asam asetat glasial (Mohan, 2003)
b. Penyiapan variat konsentrasi NaDiklofenak
Pembuatan larutan induk sebesar 10000 ppm Na diklofenak dengan pelarut metanol, yaitu 50 mg NaDiklofenak dilarutkan dalam 5mL methanol. Kemudian dilakukan pengenceran menjadi 1000, 100, 10 dan 1 ppm.
c. Penyiapan variat konsentrasi APMS dan senyawa hasil modifikasi
(sampel).
d. Pembuatan Larutan BSA 0,2 %(w/v)
Sebanyak 0.2g BSA dilarutkan dalam TBS 100mL (William set al., 2008).
3.3.5 Uji Invitro Antiinflamasi
Pengujian Aktivitas Senyawa Hasil Modifikasi Terhadap Denaturasi BSA :
a. Pembuatan Larutan Uji
Larutan Uji (5 mL) terdiri dari 50 µ L larutan sampel yang kemudian ditambah dengan larutan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi larutan 100, 10, 1, dan 0,1ppm
b. Pembuatan Larutan Kontrol Positif
Larutan kontrol positif (5 mL) terdiri dari 50 µ L larutan natrium diklofenak yang kemudian ditambah dengan larutan BSA hingga volume 5 mL sehingga didapatkan variat konsentrasi menjadi 100, 10, 1, dan 0,1 ppm
c. Pembuatan Larutan Kontrol Negatif
Larutan kontrol negatif (5 mL) terdiri dari 50 µ L metanol yang kemudian ditambah dengan larutan BSA hingga volume 5 mL. Kemudian diinkubasi pada suhu ruang 27ºC s/d 28ºC selama 30 menit. Lalu setiap larutan diatas dipanaskan selama 5 menit pada suhu 73ºC. Lalu dibiarkan dingin selama 25 menit dan diukur turbiditasnya dengan spektrofotometer diukur pada gelombang 660 nm.
Persentase inhibisi dari denaturasi atau presipitasi BSA dikalkulasikan dengan rumus berikut:
BAB 4
HASIL DAN PEMBAHASAN
Pada penelitian ini dilakukan modifikasi asam p-metoksisinamat hasil hidrolisis dari etil p-metoksisinamat melalui reaksi nitrasi.
4.1 Modifikasi Senyawa Etil p-metoksi Sinamat dengan Reaksi Hidrolisis
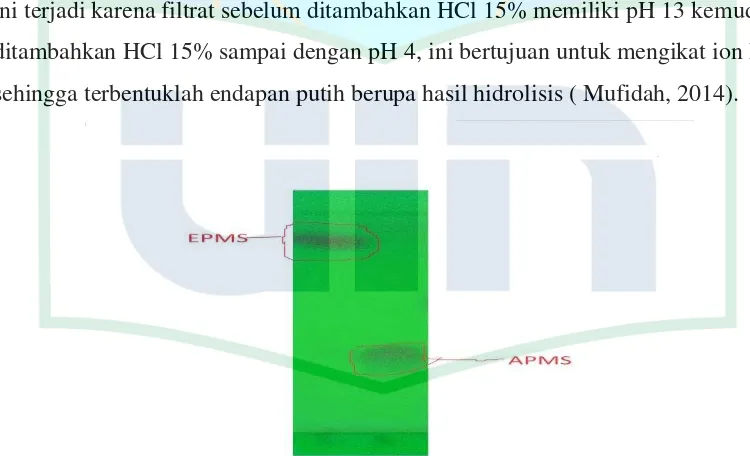
Reaksi hidrolisis dilakukan dengan mereaksikan EPMS sebanyak 5 gram (0,024 Mol) dalam etanol dan direaksikan dengan bantuan katalis basa NaOH 1.5 gram (0.0375 mol) dan dipanaskan pada suhu 60oC selama tiga jam sampai terbentuknya serbuk berwarna putih. Setelah reaksi berlangsung, hasil reaksi berupa filtrat lalu ditambahkan akuades yang berguna untuk pencucian filtrat. Kemudian ditambahkan HCl 15% tetes demi tetes sehingga akan terbentuk endapan putih berupa hasil hidrolisis yaitu Asam p-metoksisinamat (APMS) hal ini terjadi karena filtrat sebelum ditambahkan HCl 15% memiliki pH 13 kemudian ditambahkan HCl 15% sampai dengan pH 4, ini bertujuan untuk mengikat ion Na+ sehingga terbentuklah endapan putih berupa hasil hidrolisis ( Mufidah, 2014).
Gambar 4.1 KLT senyawa hasil Hidrolisis
Residu yang didapat dicuci lagi dengan akuades untuk menghilangkan garam yang terbentuk kemudian residu dikeringkan. Residu yang didapat berwarna putih.
% rendemen hidrolisis
= 82,304%
Mekanisme reaksi hidrolisis diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan terpolarisasi pada gugus karbonil melepaskan electron dari karbon sehingga bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik OH (Larson dan Waber, 1994).
Mekanisme reaksi hidrolisis sebagai berikut:
Gambar 4.2 Reaksi Hidrolisis
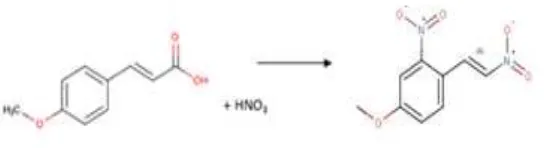
4.2 Modifikasi Senyawa Asam p-metoksi Sinamat Dengan Reaksi Nitrasi
Reaksi nitrasi dilakukan dengan mereaksikan APMS dengan HNO3 dengan
menggunakan metode cold microwave. Keuntungan dari metode cold microwave adalah waktu reaksinya yang cepat dan tidak diperlukannya H2SO4 sebagai katalis.
menyerang muatan positif atom nitrogen dari elektrofil, yang mana ikatan N=O lepas pada waktu yang sama. Hal ini diikuti dengan lepasnya proton untuk menstabilkan gugus aromatik (Zulfa, 2012).
Tujuan reaksi nitrasi adalah menambahkan gugus NO2 pada senyawa asam
p-metoksisinamat, sehingga dengan bertambahnya gugus NO2 akan diuji aktivitas
antiinflamasinya. Optimasi dilakukan dengan menggunakan 3 keadaan yaitu 300 watt, 450 watt dan 600 watt. Hasil KLT senyawa optimasi terlihat pada gambar
4.3.
Gambar 4.3 KLT Optimasi Reaksi Nitrasi A. 300 Watt, B. 450 Watt, C. APMS
Dari hasil tersebut menunjukan bahwa untuk reaksi dengan menggunakan 450 watt karena spot yang terbentuk lebih tebal sehingga bisa diasumsikan bahwa reaksi dengan 450 watt menghasilkan lebih banyak senyawa hasil reaksi nitro. Untuk 600 watt hasil reaksi tidak didapatkan, hal ini karena untuk reaksi dengan 600 watt didapatkan hasil reaksi yang hangus, sehingga tidak bisa digunakan. Hal ini bisa disebabkan karena reaksi berjalan terlalu panas, sehingga mendapatkan hasil yang hangus.
Karena senyawa masih terdapat beberapa spot maka dilakukan pemisahan dengan menggunakan kolom kromatografi, dimana setelah di lakukan kolom kromatografi didapatkan senyawa murni dengan spot tunggal sebagai berikut
Gambar 4.5. Hasil KLT senyawa dengan eluen heksan:etil (3:2)
Hasil rendemen senyawa nitrasi dari 3000 mg campuran hasil reaksi didapat senyawa murni sebanyak 412 mg dan rendemen dapat dihitung dengan persamaan berikut
%rendemen
= 13,73%
4.3 Identifikasi Senyawa Hasil Modifikasi
Identifikasi senyawa hasil modifikasi dimulai dengan melihat perbandingan nilai Rf seluruh senyawa yang di KLT menggunakan eluen heksan:etil asetat dengan perbandingan 3:2 (lihat gambar 4.5)
Etil p-metoksisinamat : 0,875 Asam p-metoksisinamat : 0.35 Hasil Nitrasi : 0.6
senyawa Asam p-metoksisinamat yang artinya terjadi penurunan polaritas, hal ini terjadi karena adanya pemasukan gugus NO2 pada cincin benzen senyawa Asam
p-metoksisinamat.
4.3.1 Senyawa Hasil Hidrolisis Etil p-metoksisinamat
Senyawa hasil hidrolisis etil p-metoksisinamat memiliki karakteristik sebagai berikut:
1.Warna : Putih
2.Bau :Tidak berbau 3.Bentuk : Serbuk
Gambar 4.6. Serbuk APMS
Gambar 4.7. Fragmentasi Senyawa Hasil Hidrolisis EPMS
Dari data GCMS dan nilai Rf ternyata hasil yang diperoleh sama seperti yang dilakukan Mufidah (2014), sehingga senyawa hasil hidrolisis Etil p-metoksisinamat adalah Asam p-p-metoksisinamat.
Gambar 4.8. Struktur Senyawa Asam p-metoksisinamat
4.3.2 Senyawa Hasil Nitrasi Asam p-metoksisinamat
Senyawa hasil nitrasi asam p-metoksi sinamat memiliki karakteritik sebagai berikut:
1. Warna : kuning 2. Bau : bau khas 3. Bentuk : serbuk
Elusidasi struktur senyawa hasil modifikasi dilakukan dengan menggunakan IR, GCMS, dan NMR
Tabel 4.1. Penafsiran IR
Gambar 4.10. Spektrum IR
Penafsiran spektrum IR Senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena ditunjukan pada table 4.1 yaitu ditemukan pita serapan pada bilangan gelombang v3098,78 cm-1adalah serapan spesifik vibrasi ulur ikatan antar atom C-H pada
Ikatan Daerah Absorbansi (V,cm-1)
Aromatik posisi para 903,69
gugus aromatik. Keberadaan aromatik juga ditunjukan dengan adanya C=C pada bilangan gelombang v 1619, 49 cm-1. Aromatik disubsitusi para juga ditunjukan dengan munculnya serapan pada bilangan gelombang v903,69 cm-1. C-H Alifatik ditemukan pada bilangan gelombang 2974,36-2882,74 cm-. dan pada bilangan gelombang 1210, 38 cm-1 terdapat C-O yang berikatan pada aromatik. Serapan vibrasi C-O ditemukan pada pita v1349,26 cm-1. Lalu terdapatnya gugus nitro pada posisi aromatik dapat ditunjukan dengan adanya pita serapan pada bilangan gelombang v 1526,72 cm-1.
Elusidasi senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena selanjutnya yaitu menggunakan analisa GCMS. Dari data kromatogram GCMS dari trasi
4-Metoksi-2-Nitro-beta-Nitrostirena, muncul kromatogram pada waktu retensi 11,9 dengan berat molekul (BM) 224 dengan fragmentasi massa pada 224; 177; 147; 102; dan
Gambar 4.12. Fragmentasi Massa Senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena
Berdasarkan interpretasi GCMS yang dengan BM 224 menunjukan telah masuknya gugus NO2 pada gugus benzene dan karboksilat, sehingga gugus
karboksilat hilang dan diganti dengan gugus NO2. Hal ini sesuai dengan aturan
nitrogen yang menyatakan bahwa jika jumlah atom nitrogen didalam suatu senyawa ada 1 maka berat molekul senyawa adalah ganjil, sedangkan jika atom nitrogen dalam suatu senyawa adalah dua maka berat molekul adalah genap (pavia et al. 2001)
Gambar 4.13. 1. APMS, 2. 2 nitro-4-metoksi-beta-nitrostirena
Tabel 4.2. Data Pergeseran Kimia Spektrum 1H NMR Senyawa
4-Metoksi-2-Nitro-beta-Interpretasi NMR pada penelitian ini dibandingkan dengan hasil interpretasi NMR pada senyawa Asam p-metoksisinamat pada penelitian Mufidah (2014). Spektrum H1NMR memberikan sinyal pergeseran kimia 4,04 ( 3H ) dan muncul dengan bentuk singlet. Sinyal ini lebih kearah downfield karena berikatan dengan oksigen (-OCH3, metoksi), sedangkan pada H-NMR senyawa APMS pergeseran
kimia terjadi pada 3, 82 (3H) dan memiliki bentuk dan sinyal yang sama seperti senyawa Asam 5nitro p-metoksisinamat . Pergeseran kimia 7,95 (1H) berbentuk doublet memiliki hubungan dengan pergeseran kimia 7,55 (1H) berbentuk doublet
berkonfigurasi trans. Kemudian pada pergeseran kimia 8,05 ppm (1H), 7,72 (1H), dan 7,18 (1H) adalah proton-proton yang tersubsitusi. Sinyal pada pergeseran kimia 7,72 ppm menunjukan bahwa satu proton terkopling secara metha dengan satu proton pada sinyal 8,05 ppm dengan nilai konstanta kopling 1,95 Hz Hz. Selanjutnya terkopling secara ortho dengan proton pada sinyal 7,18 ppm dan nilai konstanta kopling 9,1 Hz. Hal ini dibandingkan dengan H-NMR APMS pada pergeseran kimia 6,95 ppm dan 7,54 ppm (4H) yang merupakan proton-proton dari benzen dengan dua substitusi yaitu menunjukan bahwa dua proton yang ekivalen terkopling secara ortho dengan dua proton yang ekivalen lainnya (Mufidah, 2014). Perbedaan APMS dengan Asam 5nitro p-metoksisinamat yaitu terletak pada H di posisi 5 yang mana Asam 5nitro p-metoksisinamat tidak terdapat H pada posisi 5 karena sudah disubstitusi oleh NO2 pada posisi 1. .
C
Gambar 4.16 HSQC senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena
pada pergeseran kimia 8,05 ppm. Sinyal karbon 13C-NMR memberikan pergeseran kimia pada 137,45 ppm dan membentuk korelasi dengan H-NMR pada pergeseran kimia 7,55 ppm, yaitu H pada posisi 3, sehingga dapat diartikan bahwa terjadi ikatan antara C & H diposisi 3. Sinyal karbon lainnya yaitu pada pergeseran kimia 155,53 ppm merupakan karbon tersier (C3) yang dapat berikatan dengan atom oksigen dari metoksi. Sinyal karbon terakhir yaitu pada pergeseran kimia 122,68 yaitu karbon kuartener (4C).
Tabel 4.3 C-NMR senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena
4.4 Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas
Senyawa Hasil Modofikasi
Uji aktivitas antiinflamasi dilakukan pada dua senyawa yang didapatkan yaitu Asam p-metoksisinamat dan senyawa hasil reaksi nitrasi dan Na Diklofenak sebagai kontrol positif. Pada uji inhibisi denaturasi BSA dengan rentang konsentrasi uji 50-0,035 ppm dapat memberikan % inhibisi >20% maka dianggap memiliki aktivitasi sebagai antiinflamasi (William et al,.2008).
Tabel 4.4. Hasil Uji Antiinflamasi Senyawa Kontrol dan Senyawa Hasil Modifikasi
Gambar 4.17. diagram aktivitas antiinflamasi
Natrium diklofenak aktif dalam memberikan aktivitas antiinflamasi dimulai dari konsentrasi 10 ppm dengan persen inhibisi 26,75 %dan pada konsentrasi 100 ppm dapat menghambat denaturasi protein sebesar 98,85%. Senyawa EPMS aktif sebagai antiinflamasi dimulai dari konsentrasi 0,1 ppm sampai dengan konsentrasi 100 ppm, terlihat dari hasil yang didapat yaitu pada konsentrasi 0,1 ppm memberikan persen inhibisi sebesar 30,9 %, 1 ppm 36,46%, 10 ppm 46,76 % dan 100 ppm sebesar 54,93. Artinya semakin tinggi konsentrasi, maka semakin tinggi aktvitas sebagai antiinflamasi. Senyawa Asam p-metoksisinamat yang merupakan hasil dari hidrolisis sebelumnya telah diteliti efek aktivitas antiinflamasi oleh mufidah (2014), bahwa senyawa Asam p-metoksisinamat tidak mempunyai aktivitas sebagai antiinflamasi. Pada pengujian kali ini juga mendapatkan hasil yang sama dimana senyawa Asam p-metoksisinamat sama sekali tidak memiliki aktivitas sebagai antiinflamasi, terlihat dari persen inhibisi yang dihasilkan baik pada konsentrasi terendah sampai konsentrasi tertinggi menghasilkan persen inhibisi negative dan <20%.
Senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena dengan konsentrasi 0,1
ppm, 1 ppm, dan 10 ppm mengalami peningkatan aktivitas antiinflamasi dibandingkan dengan senyawa APMS pada konsentrasi 0,1 ppm, 1 ppm dan 10 ppm, sedangkan pada konsentrasi 100 ppm tidak menghasilkan peningkatan aktivitas sebagai antiinflamasi, hal ini terlihat dari persen inhibisi yang dihasilkan
dimana persen inihibisi senyawa ini yaitu pada konsentrasi 0.1 ppm sebesar 36.71%, 1 ppm sebesar 29,65%, 10 ppm sebesar 15,32% dan pada konsentrasi 100 ppm -7,93%. Artinya penambahan gugus NO2 pada senyawa Asam
p-metoksisinamat memberikan efek peningkatan efek antiinflamasi. Dari data tersebut terlihat semakin kecil konsentrasi maka semakin besar aktivitas antiinflamasi, hal yang sama juga terjadi pada penelitian uji antiinflamasi senyawa hasil isolasi Butea monosperma (Ningappa et al, 2012) dan ektrak Annona cherimola mempunyai aktivitas antiinflamasi pada konsentrasi yang rendah, sedangkan semakin tinggi konsentrasi, semakin rendah aktivitas antiinflamasi (Verma et al, 2011).
1 2
Gambar 4.18. 1. Asam p-metoksisinamat, 2.
4-Metoksi-2-Nitro-beta-Nitrostirena
Untuk senyawa hasil modifikasi melalui reaksi nitrasi, dapat dianalisa bahwa penambahan gugus NO2 pada gugus aromatik senyawa Asam
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Transformasi gugus fungsi pada etil p-metoksisinamat berhasil dilakukan melalui proses hidrolisis menjadi asam p-metoksisinamat, lalu dinitrasi menghasilkan senyawa 4-Metoksi-2-Nitro-beta-Nitrostirena
2. Hubungan struktur aktivitas hasil modifikasi asam p-metoksisinamat terhadap antiinflamasi menunjukan bahwa penambahan gugus NO2 dapat
meningkatkan aktivitas antiinflamasi pada konsentrasi 0,1 ppm, 1 ppm, 10 ppm.
5.2 Saran
1. Perlu dilakukan optimasi lebih lanjut tentang reaksi dan pereaksi, kondisi reaksi dan waktu reaksi sehingga dapat diperoleh rendemen senyawa yang lebih baik.
2. Perlu dilakukan uji invivo pada senyawa hasil modifikasi untuk penelitian lebih lanjut.
DAFTAR PUSTAKA
Aliya nur hasanah.et al. 2011. Analisis Kandungan Minyak Atsiri dan Uji Aktivitas Antiinflamasi Ekstrak Rimpang Kencur (Kaempferia galanga L.). Jurnal matematika & sains, Vol.16 Nomor 3, Hal 147-152.
Bangun, Robijanto. 2011. Semi Sintesis N,N-Bis(2-Hidroksietil)-3-(4-Metoksifenil) Akrilamida Dari Etil P-Metoksisinamat Hasil Isolasi Rimpang Kencur (Kaempferia Galanga, L) Melalui Amidasi Dengan Dietanolamin. Medan: Universitas Sumetra Utara.
Barus, Rosbina. 2009. Amidasi Etil p-Metoksisinamat yang Diisolasi dari Kencur (Kaempferia Galanga, Linn). Medan: Sekolah Pasca Sarjana Universitas Sumatera Utara.
Billy E. Haigler and Jim C Spain. 1991. Biotransformation of Nitrobenzene by Bacterial Containing toluene Degradative Pathways.
Bose, K ajay et al. 2006. Cold Microwave Chemistry: Synthesis Using Pre-Cooled Rearents.
BPOM RI. 2014. Kebun Tanaman Obat Badan POM RI.
Chandra et all india, 2012. Evaluation of in vitro anti-inflammatory activity of coffee against the denaturation of protein
Cairns, Donald. Intisari Kimia Farmasi. 2004. EGC. jakarta
Cresswell ,C. J.,Runquist dan Campbell. 1982. Analisis Spektrum Senyawa Organik. . Edisi kedua. Bandung: Penerbit ITB.
Day,R. A., dan Underwood, A. L., 1999, Analisis Kimia Kuantitatif (Penerjemah Aloysius Hadyana Pudjaatmaka,), Penerbit Erlangga, Jakarta, hal: 491.
Ernawati Teni et al. 2012. Synthesis of a Cnadidate Anti-Cancer Inhibitor Compound:N,N-Diethylcinnamide. Intrnational Confrence and Alternative Medicine In Health Care: Surakarta
Farmakologi dan Terapi UI. 2007. Departemen Farmakologi dan Terapeutik Fakultas Kedokteran Universitas Indonesia. Jakarta
Harborne, J.B. 1987. Metode Fitokimia: penuntun Cara Modern Menganalisis Tumbuhan. Penerjemah: Kosasih P., Soediro Iwang. Bandung: Penerbit ITB.
Heinrich, M. Barnes, J. Gibbons, S. Williansom, M, E. Fundamental Of Pharmacognosy and Phytotherapy. Philadelpia: Penerbit Elsevier.
Hidayati, Nur et al. 2012. Isolasi Dan Identifikasi Senyawa Antifungal Akar Acacia Mangium Dan Aktivitasnya Terhadap Ganoderma Lucidum. Sekolah Pasca Sarjana : Universitas Gadjah Mada.
Hostettman, K. 1995. Cara Kromatografi Preparatif “Penggunaan pada Isolasi Senyawa Alam”.. Penerbit ITB. Bandung
Schiefer Isaac T et al. 2012. Inhibition of amyloidogonesis by non-steroidal anti – inflamatmatory drugs and their hybrid nitrates.
Griter,. 1991. Pengantar Kromatografi. ITB. Bandung
Khoirunni’mah, zulfa. 2012. Modifikasi Senyawa Metil Sinamat melalui Proses Nitrasi Serta Uji Toksisitas BSLT (Brine Shrimp lethality Test) Terhadap HasilSenyawa Modifikasi
Khosrow kashfi et al. 2002. Nitric Oxide-Donating Nonsteroidal Anti-Inflammatory Drugs Inhibit the Growth of Various Cultured Human Cancer Cells: Evidence of a Tissue Type-Independent Effect
Larson, Richard A.; Eric J. Weber. 1994. Reaction Mechanisms In Environmental Organic Chemistry. Lewis Publisher : United States of America.
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasi. Padmawinata.: ITB Press. Bandung
Mohan, Chandra. 2003. Calbiochem; Buffer. CALBIOCHEM® and Oncegene Research Products.
Mufidah, syarfatul. 2014. Modifikasi struktur senyawa etil P-metoksisinamat Yang Diisolasi dari Kencur (Kaemferia galangal Linn) melalui transformasi gugus fungsi serta Uji Aktivitsa Sebagai Antiinflamasi
Mulja, M,. 1995. Analisis Instrumental. ITB. Bandung.
Nazeruddin, G. M. dan S. B. Suryawanshi. 2010. Sythesis of Novel Mutual Pro-drugs by Coupling of Ibuprofen (NSAID) with Sulfa Drugs. J. Chem. Pharm. Res., 2010, 2(4):508-512.
Olah, George A et al. 1982. Recent aspects of nitration : New Preparative Methods and Mechanism studies (A Review). Proc. Natl. Acad. Sci. USA Vol. 79 4487-4494.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Cetakan Pertama. Yongyakarta : Penerbit Liberty
Silverstein, R. M. 1984. Penyidikan Spektometrik senyawa Organik. Jakarta : Penerbit Erlangga.
Taufikurohmah, T.; Rusmini; Nurhayati. 2008. Pemilihan Pelarut Optimasi Suhu Pada Isolasi Senyawa Etil P-metoksisinamat (EPMS) Dari Rimpang Kencur Sebagai Bahan Tabir Surya Pada Industri Kosmetik.
Ullah et al. 2014. Evaluation of antinociceptive, in-vivo & in-vitro anti-inflammatory activity of ethanolic extract of Curcuma zedoaria rhizome (Research Article). BMC Complementary and Alternative Medicine. Bangladesh
Umar, Muhammad I et al. 2012. Bioactivity-Guided Isolation of Ethyl-p-methoxycinnamate, an Anti-inflammatory Constituent, from Kaempferia galanga L. Extracts. Molecules, 17, 8720-8734.
Verma, adarsh. M, Ajay kumar, Kavitha and Anurag. Kb3. 2011. Activities of
annona cherimola in-vitro anti denaturation and antioxidant.
Williams, LAD et al. 2008. The In Vitro Anti-denaturation Effects Induced by Natural Product and Non-steroidal Compounds in Heat Treated (Immunogenic) Bovine Serum Albumin is Proposed as a Screening Assay for the Detection of Anti-inflammatory compounds, without the Use of Animals, in the Early Stages of The Drug Discovery Process. West Indian Medical Journal 57 (4):327.
Yazid, E. 2005. Kimia Fisika untuk Paramedis. Penerbit Andi. Yogyakarta.
Lampiran 1. Kerangka Penelitian
Reaksi hidrolisis
Reaksi Nitrasi Dengan menggun akan HNO3
Senyawa Etil
p-metoksisinamat
Asam p-metoksisinamat
Senyawa Hasil Reaksi Nitrasi
Identifikasi menggunakan kromatografi (KLT dan kolom), GCMS dan spektrofotometri (IR dan NMR).
Identifikasi
Uji Invitro Antiinflamasi
Lampiran 2: Skema Identifikasi Senyawa Hasil Modifikasi
Senyawa Hasil Modifikasi
Pemisahan Senyawa Hasil
Kromatografi
Kromatografi Lapis Tipis Kromatografi Kolom
Fraksi-Fraksi Senyawa Hasil Modifikasi
GCMS Spektrofotometer IR H-NMR
Analisa Data
Lampiran 3. Identifikasi Etil p-metoksisinamat (Mufidah, 2014)
Organoleptis Etil p-metoksisinamat
Lampiran 4: Spektrum IR Etil p-metoksisinamat
Hasil analisis Spektrofotometri IR menunjukkan penafsiran spektrum IR senyawa isolat kencur (Etil p-metoksisinamat ) dari berbagai bilangan gelombang absorbansi gugus fungsi yang spesifik seperti yang tertera pada gambar dan tabel berikut:
Ikatan Daerah Absorbansi
(�,��−�)
C=O 1704,18
C-O 1367,59-1321,3
C-H Aril 3007,15-3045,73
C=C Aril 1629,92-1573,02
C-H Alifatik 2979,18-2842,23
C-O Aril 1252,82-1210,38; 1029,07
Lampiran 5: Spektrum GC-MS Etil p-metoksisinamat
Hasil analisis 1H-NMR menggunakan pelarut CDCl3 menunjukkan nilai
pergeseran kimia (δ) sebagai berikut:
Posisi Pergeseran Kimia
(δ, ppm) (CDCl3)
12 1,33 (t, 3H, Ј=7,15) 11 4,25 (q, 2H, Ј=7,15) 8 6,31 (d, 1H, Ј=15,6) 7 7,65 (d, 1H, Ј=16,25) 5 6,90 (d, 1H, Ј=9,05) 4 7,47 (d, 1H, Ј=8,45) 2 7,47 (d, 1H, Ј=8,45) 1 6,90 (d, 1H, Ј=9,05) 15 3,82 (s, 3H)
Struktur Etil p-metoksisinamat
Spektrum 1H-NMR memberikan sinyal pada pergeseran kimia 1,33 ppm (3H) berbentuk triplet dan juga pada 4,25 ppm (2H) berbentuk quartet. Sinyal ini lebih downfield karena berikatan dengan oksigen. Spektrum 1H-NMR juga memberikan
sinyal pada pergeseran kimia 3,82 ppm (3H) berbentuk singlet. Sinyal ini lebih downfield karena berikatan dengan Oksigen (-OCH3, metoksi). Pergeseran kimia
Pola sinyal ini menunjukkan bahwa 2 proton yang ekivalen terkopling secara ortho dengan 2 proton yang ekivalen lainnya, yang kemudian menunjukkan bahwa sinyal ini adalah sinhyal H 7/11 dan H 8/10.
Lampiran 11: Perhitungan Reaksi
a. Perhitungan Bahan untuk Reaksi Hidrolisis
1. Etil p-metoksisinamat
- Terpakai = 5 gram, BM=206,24 gr/mol
- Mol
b. Perhitungan Bahan Reaksi Nitrasi
= 0,2704 X 63,01 = 17,5612
- Volume (mL)
-
= mol
Lampiran 12: Hasil Perhitungan Uji Antiinflamasi
Konsentrasi % inhibisi SD
Lampiran 13: Kurva Uji Antiiflamasi
-20 0 20 40 60 80 100 120
0.1 ppm 1 ppm 10 ppm 100 ppm
Na diklofenak
EPMS
APMS
Lampiran 14 : Gambar Senyawa
Lampiran 15: Gambar Analisis Senyawa
Gambar 1: Analisa dengan IR
Gambar 2: Analisa dengan GCMS