KAJIAN POLA DAN MEKANISME INAKTIVASI
BAKTERI OLEH EKSTRAK ETIL ASETAT
BIJI ATUNG (Parinarium glaberimum Hassk)
LAVLINESIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2007
Dengan ini saya menyatakan bahwa disertasi KAJIAN POLA DAN
MEKANISME INAKTIVASI BAKTERI OLEH EKSTRAK ETIL ASETAT BIJI
ATUNG (Parinarium glaberimum Hassk) adalah karya saya sendiri dan belum
diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber
informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak
diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam
Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2007
Abstrak
LAVLINESIA. KAJIAN POLA DAN MEKANISME INAKTIVASI
BAKTERI OLEH EKSTRAK ETIL ASETAT BIJI ATUNG (Parinarium
glaberimum HASSK). Di bawah bimbingan Soewarno T. Soekarto sebagai ketua, dan Betty Sri Laksmi Jenie, Dedi Fardiaz dan Purwiyatno Hariyadi sebagai anggota.
Atung adalah sejenis tanaman hutan yang bijinya sejak lama secara tradisional digunakan sebagai bahan pengawet pangan di Maluku,bubuk dan ekstrak biji atung telah terbukti dapat mengawetkan udang, berbagai jenis ikan dan berbagai produk dari ikan. Ekstrak etil asetat biji atung bebas lemak mempunyai penghambatan yang tinggi dengan spektrum penghambatan yang luas terhadap bakteri patogen dan perusak pangan.. Agar ekstrak etil asetat biji atung ini dapat digunakan secara tepat dan efisien dalam memperpanjang umur simpan dan dapat menjamin keawetan pangan perlu dipelajari pola dan mekanisme inaktivasi bakteri oleh ekstrak etil asetat biji atung.
Dalam penelitian ini, (1) dipelajari nilai MIC dari pada 5 jenis bakteri yaitu Staphylococcus aureus, Pseudomonas fluorescens,Lactobacillus plantarum, Bacillus subtilis dan Escherichia coli, (2) dipelajari pola inaktivasi bakteri S. aureus dan P. fluorescens pada dosis di atas dan di bawah MIC, (3) dikaji pengunaan nilai D dan Z untuk pola kematian yang bersifat logaritmik, pada media cair dan pada pangan model padat, dan (4) dipelajari pola kerusakan sel melalui pengamatan perubahan morfologi dan ultrastruktur menggunakan scanning electron microscope (SEM) dan transmission electron microscope (TEM) (5) dan di analisa pola kebocoran sel.
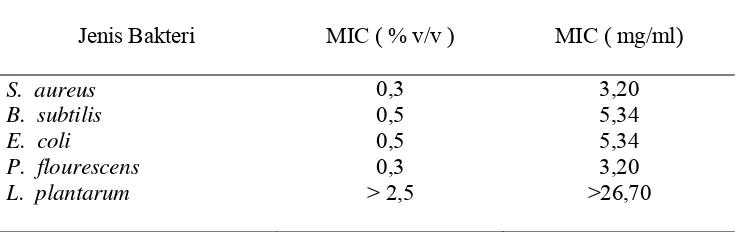
Hasil penelitian menunjukkan bahwa bakteri S. aureus dan P. fluorescens mempunyai kepekaan yang sama terhadap ekstrak etil asetat biji atung dengan nilai MIC 3,2 mg/ml, E. coli lebih tahan dari P. fluorescens yang sama-sama Gram negatif dengan nilai MIC 5,34 mg/ml. Nilai MIC E. coli ini sama dengan nilai MIC B. subtilis yaitu bakteri Gram positif penghasil spora. L. plantarum menunjukkan resitensi terhadap ekstrak etil asetat biji atung sampai dengan penambahan 26,70 mg/ml ekstrak tidak menunjukkan penghambatan.
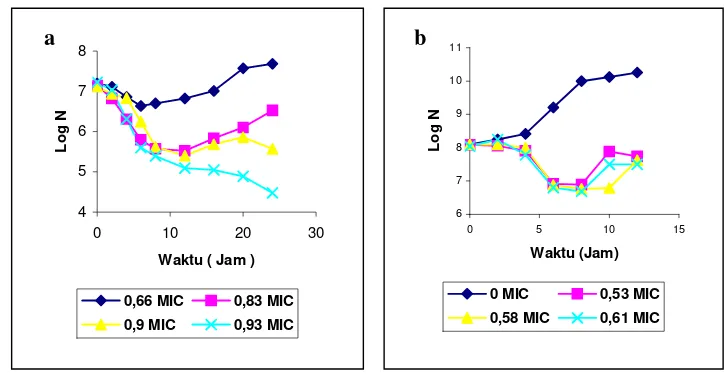
Hasil pengamatan pola inaktivasi bakteri S. aureus dan P. fluorescens pada dosis di bawah MIC menunjukkan pola regenerasi, akan tetapi pola regenerasi P. fluorescens terjadi pada kisaran dosis yang sempit (0,53-0,61 MIC). Terdapatnya pola regenerasi pada kedua jenis bakteri ini menunjukkan bahwa ekstrak etil asetat menyebabkan bakteri S. aureus dan P. fluorescens menjadi sakit. Dari hasil penelitian ini sel S. aureus yang sakit dapat dideteksi menggunakan media TSA-YE sebagai media non selektif dan TSAS-YE sebagai media selektif.
seperti S. aureus, pada E. coli ini tidak ditemukan ekor.
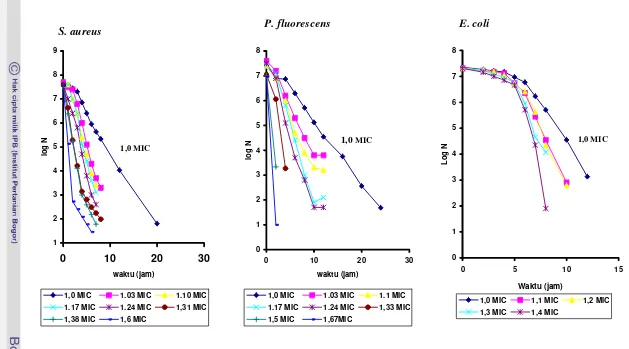
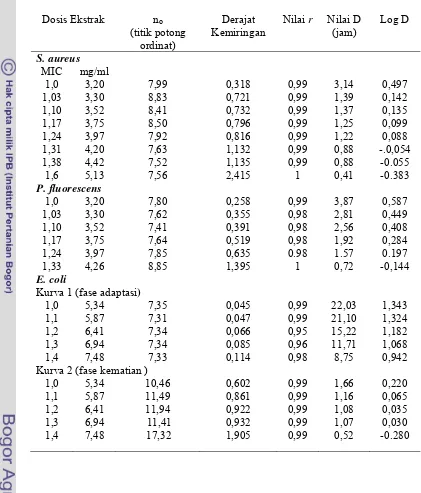
Dari kurva kematian yang bersifat logaritmik dari ke tiga jenis bakteri (S. aureus , P. fluorescens dan E. coli) tersebut dihasilkan nilai D dan z untuk masing-masing bakteri pengaruh dosis ekstrak etil asetat biji atung. Untuk menghitung nilai D dari bakteri E. coli karena mempunyai bahu yang panjang, kurva kematiannya dibagi atas dua garis lurus, garis pertama adalah fase bahu (adaptasi) dan garis lurus kedua adalah fase kematian. Dari 8 tingkat dosis yang diperlakukan dari bakteri S. aureus dengan tidak memasukan data ekor , dan 6 tingkat dosis P. fluorescens serta 5 tingkat dosis dari E coli menunjukkansemakin tinggi dosis ekstrak etil asetat biji atung semakin kecil nilai D. Nilai D S. aureus pada dosis 1,0 MIC (3,20 mg/ml) adalah 3,14 jam, lebih kecil dari nilai D P. fluorescens pada dosis yang sama yaitu 3,87 jam. E. coli mempunyai nilai D yang lebih besar dari nilai D bakteri S. aureus dan P. fluorescens yaitu untuk fase adaptasi 22.03 jam dan untuk fase kematian 1,66 jam. Nilai D S. aureus pada setiap dosis yang sama lebih kecil dari nilai D P. fluorescens, akan tetapi pada dosis yang tinggi (5,34 mg/ml) nilai D S. aureus lebih besar dari P. fluorescens. E. coli mempunyai nilai D lebih besar untuk dosis yang sama baik untuk fase adaptasi (bahu) maupun fase kematian. Dari hubungan log D dengan dosis diperoleh nilai z S. aureus 3,45 mg/ml lebih besar dari nilai z P. fluorescens yaitu 1,65 mg/ml. Nilai z E. coli paling besar diantara ketiga bakteri yang diuji yaitu 5,05 mg/ml untuk fase adaptasi dan 5,16 mg/ml untuk fase kematian.
Pola kematian bakteri S. aureus di dalam pangan model padat dengan kandungan protein 9,08 %, karbohidrat 48,7 %, lemak 25,6 % dan kadar air 12,18 % (aw = 0,76-0,78) pada suhu penyimpanan 29,9oC bersifat logaritmik dengan penyimpangan pada awal kurva. Bentuk penyimpangannya berbeda dari pola kematian S. aureus dalam media cair (NB). Pada`media cair fase adaptasi pada awal kurva kematian mendatar berbentuk bahu. Pada pangan model padat fase adaptasinya cekung dengan derajat kemiringan yang lebih besar dibandingkan dari fase kematian. Dengan mengasumsikan pola kematian S. aureus pada pangan model padat bersifat logaritmik didapat nilai D dan z yang jauh lebih besar daripada dalam media cair. Nilai D S. aureus pada media cair NB 3,14 jam, di dalam media padat menjadi 76,9 jam pada dosis 1,0 MIC (3,2 mg/ml) dengan nilai z 3,45 mg/ml menjadi 34,1 mg/g.
THE BACTERIAL INACTIVATION PATTERN AND ANTIBACTERIAL MECHANISM BY ETHYL ACETATE EXTRACT OF ATUNG SEED
(PARINARIUM GLABERIMUM HASSK).
LAVLINESIA
Under the advisory guidance of SOEWARNO T. SOEKARTO as the chairman of advisory committee and BETTY SRI LAKSMI JENIE, DEDI
FARDIAZ and PURWIYATNO HARIYADI as members of the advisory committee.
Abstract
Recently, people avoid synthetic material for food preservation because of health reasons. Atung (Parinarium glaberimum Hask) is forest plant species. In Maluku, atung seed is traditional used as food preservatives. Many researches demonstrated that atung seed can be used for fish and fish products preservation. The ethyl acetate extract of atung seed could inhibit a wide range of bacteria effectively. Information about bacterial inactivation pattern of ethyl acetate extract of atung seed and its mechanism are important for efficient and save use of the atung seed extract.
The objectives of this research were to investigate the pattern of bacterial inactivation and the mechanisms of ethyl acetate extract of atung seed. This research were consisted of 6 experiments are: (1) to acquire MIC (minimum inhibition concentration) value of its antimicrobial activities (2) to study the inactivation pattern of S. aureus (Gram positive), P. fluorescens (Gram negative) of ethyl acetate extract at doses below MIC (3) to study the time killing curve of S. aureus, P. fluorescens and E. coli of ethyl acetate extract at doses above MIC (4) to study the application of kinetic parameter ( D and z value) in broth and solid food model (5) to study the damage of S. aureus (Gram positive) and P. fluorescens (Gram negative) upon exposed of ethyl acetate extract of atung seed (6) to study the leakage of S. aureus (Gram positive) and P. fluorescens (Gram negative) upon exposed of ethyl acetate extract of atung seed.
value of S. aureus was higher than P. fluorescens and E. coli. The D and z value on solid food model was shifting. The D value of S. aureus on liquid medium was 3.14 hour on on solid medium to 76.9 hour on 1.0 MIC (3.2mg/ml), while the z value on liquid medium 3.4 mg/ml was increasing on solid medium to 34.1 mg/ml . The resistancy of S. aureus and P. fluorescens was different due to the difference of their defence mechanism. On S. aureus, ethyl acetate extract worked by disturbing the membranes protein thus the membrane cell were leaked. On the P. fluorescens, the extract worked by lysing the outer membrane of the cell that the membrane could not overcome the cytoplasma pressure that the cell would be leak. The leaked cells were excreting protein, nucleic acid, calcium ions and potassium ions within the cell.
96, teman diskusi yaitu Novelina dan semua pihak yang tidak tersebutkan
diucapkan terima kasih.
Semoga bantuan, dukungan dan perhatian yang telah bapak dan ibu
berikan mendapat balasan yang berlipat ganda dari Allah SWT. Akhir kata
semoga disertasi ini bermanfaat bagi yang memerlukan.
Bogor, Februari 2007
© Hak cipta milik Lavlinesia, tahun 2007
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik
cetak, fotokopi, microfilm, dan sebagainya.
KAJIAN POLA DAN MEKANISME INAKTIVASI
BAKTERI OLEH EKSTRAK ETIL ASETAT
BIJI ATUNG (Parinarium glaberimum Hassk)
LAVLINESIA
DISERTASI
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Disetujui Komisi Pembimbing
Prof. Dr. Soekarno T. Soekarto, M.Sc. Prof. Dr. Ir. Dedi Fardiaz, M.Sc. Ketua Anggota
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S. Dr. Ir. Purwiyatno Hariyadi, M.Sc. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S. Dr. Ir. Kairil A. Notodiputro, M.S.
Tanggal ujian: 9 Februari 2004 Tanggal lulus :
Nama mahasiswa
:
LavlinesiaNomor pokok : IPN 965044
PRAKATA
Syukur alhamdulillah penulis panjatkan ke hadirat Allah SWT, dengan
selesainya penulisan disertasi yang berjudul : Kajian Pola dan Mekanisme
Inaktivasi Bakteri oleh Ekstrak Etil asetat Biji atung (Parinarium glaberimum Hassk), sebagai salah satu syarat untuk memperoleh gelar doktor di Program Studi
Ilmu Pangan, Sekolah Pascasarjana IPB.
Pada kesempatan ini, penulis mengucapkan terimakasih yang
sebesar-besarnya kepada komisi pembimbing yaitu Bapak Prof. Dr. Soewarno T.
Soekarto, M.Sc. sebagai ketua komisi pembimbing atas petunjuk dan saran mulai
dari perencanaan, pelaksanaan penelitian dan penulisan. Ucapan terimakasih yang
sama penulis aturkan kepada Ibu Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S.,
Bapak Prof. Dr. Ir. Dedi Fardiaz, M.Sc. dan Bapak Dr. Ir. Purwiyatno Hariyadi,
M.Sc. sebagai anggota komisi pembimbing atas sumbangan pikiran berupa
konsep-konsep yang berarti kearah penyempurnaan tulisan ini.
Kepada kedua orang tua, Ayahanda Drs. Syamsir Alam dan Ibunda Asma
yang telah menghantarkan penulis sampai pada jenjang pendidikan terakhir S3, kepada adik-adik semua terutama At dan Hadi yang telah membantu baik moril
maupun materil penulis ucapkan terima kasih yang tak terhingga atas semangat
dan doa yang telah diberikan selama ini.
Terima kasih kepada kepada Pimpinan IPB, terutama Pimpinan Sekolah
Pascasarjana, khususnya Pimpinan Program Studi Ilmu Pangan atas kesempatan
yang diberikan kepada penulis untuk menempuh pendidikan pada jenjang S3. Terima kasih kepada Tim Manajemen Program Doktor (TMPD) Dikti atas
bantuan pembiayaan selama masa belajar. Terima kasih kepada Pusat Studi
Pangan dan Gizi IPB, NAMRU, Lembaga Eijkman dan Laboratorium Genetika
Fak. Perikanan IPB atas bantuan dan fasilitas dalam pelaksanaan penelitian.
Kepada Mbak Ari yang selama penelitian siang malam menemani, kepada
Mas Yoyo di NAMRU, Ine di Eijkman dan kepada teman-teman satu kos
Hamzah, Yatno, Mairizal dan Eri diucapkan terimakasih banyak atas bantuan dan
Penulis dilahirkan pada tanggal 21 Juli 1960 di Bukitingggi, Sumatera
Barat, merupakan anak pertama dari ayahanda Drs. Syamsir Alam dengan
ibunda Asma.
Penulis menamatkan sekolah dasar di SD negeri no. 6 Lubuk Sikaping,
Sumatera Barat pada tahun 1972, sekolah menengah pertama di SMP negeri V
Padang pada tahun 1975 dan menamat sekolah menengah atas di SMA negeri I
Jakarta pada tahun 1979. Pada tahun 1980, penulis melanjutkan pendidikan tinggi
di Universitas Andalas Padang jurusan Teknologi Hasil Pertanian, tamat tahun
1985. Pada tahun 1992, penulis berkesempatan melanjutkan pendidikan magister
sains di Institut Pertanian Bogor jurusan Teknologi Pascapanen di bawah
bimbingan Prof. Dr. Soewarno T. Soekarto, M.Sc, Prof. Dr. Ir. Rizal Syarief
DESS dan Dr. Ir. Rosmawati Peranginangin, APU yang berhasil diselesaikan pada
tahun 1995. Selanjutnya pada tahun 1996, penulis memasuki program doktor di
Institut Pertanian Bogor dengan program studi Ilmu Pangan.
Sejak tahun 1987 sampai saat ini penulis bekerja sebagai staf pengajar di
DAFTAR ISI
Halaman DAFTAR ISI……… DAFTAR TABEL……… DAFTAR GAMBAR………... DAFTAR LAMPIRAN……… i ii iii ivI. PENDAHULUAN………. 1
1 3 4 5 5 A B. C.
LATAR BELAKANG ………..…..…….. RUANG LINGKUP PENELITIAN………..…………. TUJUAN DAN MANFAAT PENELITIAN………….………....
II. TINJAUAN PUSTAKA………
A. ATUNG (Parinarium glaberimum Hassk)……… 1. 2. 3. 4. 5. Tanaman Atung………. Buah dan Biji Atung………. Komposisi Kimia Biji Atung……… Potensi Atung sebagai Pengawet Pangan…...……….. Aktivitas Antibakteri Buah Atung……….
5 5 6 7 8
B. STRUKTUR SEL BAKTERI……… 10
1. 2. 3. 4. 5. Dinding Sel……… Membran Sel……… Inti Sel………... Ribosom……….... Kapsul………... 11 15 15 16 16 17
C. SENYAWA ANTIMIKROBA………..
1. Pengertian Agen Antimikroba……….. 17 18 19 19 20 20 21 21 23 24 25 2. Stres Mikroba Oleh Senyawa Antimikroba……….. D. MEKANISME KERJA SENYAWA ANTIMIKROBA………… 1.
2. 3.
Merusak Dinding Sel……….………… Menganggu Membran Sitoplasma……….………... Menganggu Protein dan Asam Nukleat………….………... E. PERUBAHAN STRUKTUR SEL MIKROBA……… 1.
2. 3. 4.
Pembentukan Filamen………..…… Pembentukan Septum dan Peningkatan Ukuran Sel…….... Penebalan Dinding Sel……….… Terbentuk Tonjolan (Blebs) ………
34 3. Kinetika Inaktivasi Bakteri oleh Bahan Kimia………...
III. METODOLOGI………. 36
A. B.
TEMPAT DAN WAKTU PENELITIAN……… BAHAN DAN ALAT………..
36 36 36 36 37 37 38 1. 2. 3. 4. Bahan Utama………... Bahan Pembantu………. Kultur Mikroba………... Peralatan……….. C. PERSIAPAN……… 1. 2. Ekstraksi BijiAtung……… Kultur Bakteri ………
38 39
D. METODE PERCOBAAN……… 39
40 40 41 41 42 45 47 47 49 50 51 52 53 . 1. 2. 3. 4. 5. 6.
Percobaan 1. Konsentrasi Minimum Penghambatan (MIC)………...
Percobaan 2. Inaktivasi Bakteri S. aureus dan
P. fluorescens Menggunakan Ekstrak Biji Atung pada Dosis di bawah MIC………... Percobaan 3. Inaktivasi S. aureus dan P. fluorescens oleh Ekstrak Biji Atung pada Dosis di atas MIC……… Percobaan 4. Inaktivasi S. aureus oleh Ekstrak Biji Atung pada Pangan Model Padat……… Percobaan 5. Pengamatan Morfologi dan Ultrastruktur S. aureus dan P. fluorescens oleh Ekstrak Biji Atung Percobaan 6. Analisa Kebocoran Sel………...
IV. HASIL DAN PEMBAHASAN………...
A.
B.
AKTIVITAS ANTIMIKROBA EKSTRAK ETIL ASETAT BIJI ATUNG……… KONSENTRASI MINIMUM PENGHAMBATAN (MIC)… 1.
2. 3. 4.
S. aureus dan P.fluorescens………... Escherichia coli………... Lactobacillus plantarum………. Bacillus subtilis………...
C. POLA INAKTIVASI BAKTERI S. aureus dan
P. fluorescens PADA DOSIS DI BAWAH MIC………. 54
56 56 59 61 1. 2. 3.
Pola umum Inaktivasi S. aureus dan P. fluorescens di bawah Nilai MIC……….. Regenerasi Sel S. aureus dan P. fluorescens……… Penyembuhan S. aureus ……….. D. KINETIKA INAKTIVASI BAKTERI S. aureus dan
P. fluorescens PADA DOSIS DI ATAS MIC……….. . 1.
2. 3.
Pola Kematian Bakteri………. Laju Inaktivasi Bakteri………. Parameter Laju Inaktivasi……….
61 64 67 E. KINETIKA INAKTIVASI BAKTERI S. aureus
PADA PANGAN MODEL PADAT……… 73
74 74 76 80 81 92 99 99 101 103 104 108 108 110 111 121 1. 2. 3.
Pola Kematian Bakteri pada Pangan Model Padat…... Perubahan Pola Inaktivasi Bakteri……… Perubahan Parameter Laju Inaktivasi……….. F. PERUBAHAN STRUKTUR SELULER BAKTERI
S. aureus DAN P. fluorescens PENGARUH EKSTRAK ETIL ASETAT BII ATUNG……… 1.
2.
Staphylococcus aureus……… Pseudomonas fluorescens………..
G. KEBOCORAN SEL S. aureus DAN P. fluorescens PENGARUH EKSTRAK ETIL ASETAT BII ATUNG…….
1.
2. 3.
Kebocoran Bahan-bahan yang Dapat Menyerap Sinar UV pada OD 260 dan 280 nm……….
Perubahan Kandungan Ion K+………. Kebocoran Ca++………
H. PEMBAHASAN UMUM………
V. KESIMPULAN DAN SARAN………...
A. B.
KESIMPULAN……… SARAN………
DAFTAR PUSTAKA………..
LAMPIRAN……….
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
9.
Diameter zona penghambatan ( daerah bening) beberapa jenis
bakteri oleh ekstrak etil asetat biji atung ...
Konsentrasi minimum penghambatan ( MIC) ektrak biji atung
untuk 5 jenis bakteri...
Persentase
S. aureus
sehat, sakit dan mati oleh ekstrak etil asetat
biji atung pada dosis 0,8 MIC selama 48 jam ...
Hasil analisis parameter laju kematian bakteri
S. aureus
,
P. fluorescens
dan
E. coli
...
Nilai D dan z dari bakteri
S. aureus
,
P. fluorescens
dan
E. coli
pada
dosis ekstrak etil asetat biji atung 5.34 mg/ml...
Nilai aktivitas air (a
w) pangan model padat dari beberapa tingkat
dosis ekstrak etil asetat biji atung...
Nilai n
odan nilai D
S. aureus
pada pangan model padat pada
beberapa dosis ekstrak biji atung...
Pengaruh ekstrak etil asetat biji atung terhadap ketebalan
dinding sel
S.aureus
...
Panjang dan lebar sel
P. fluorescens
pengaruh ekstrak etil asetat
biji atung...
57
60
74
84
88
89
94
103
DAFTAR GAMBAR
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
Perbedaan struktur dinding sel bakteri Gram positif dan negatif...
Bentuk penyimpangan kurva kematian mikroba oleh panas...
Kurva kematian logaritmik dari sel mikroba pada proses termal...
Penentuan nilai D menurut Pflug dan Holcom (1983)...
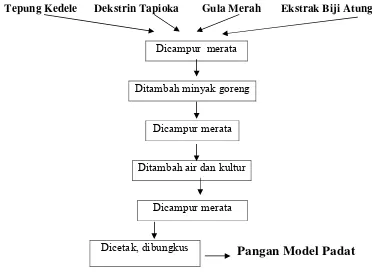
Skema proses pembuatan pangan model padat...
Zona hambat ekstrak etil asetat biji atung pada berbagai ...
Pola inaktivasi bakteri
S. aureus
(a) dan
P. fluorescens
(b)... .
oleh ekstrak biji atung pada dosis di bawah nilai MIC...
Pola regenerasi bakteri
S. aureus
dan
P. fluorescens
oleh ekstrak ...
Pertumbuhan
S. aureus
di dalam media TSA-YE dan TSAS-YE ...
Kurva kematian
S. aureus
(a),
P. flourescens
(b) dan
E. coli
...
Kurva resistensi dosis dari bakteri
S. aureus, P. fluorescens
...
Produk pangan semi basah yang digunakan sebagai pangan model....
Pola kematian
S. aureus
dalam medium cair NB
(a) dan di pangan....
Kurva resistensi dosis dari
S. aureus
pada pangan model padat ...
Scanning electron microscope
(SEM) dari sel
S. aureus
...
Transmission electron microscope
(TEM) dari
S. aureus
...
Transmission electron microscope
(TEM) dari
S. aureus
...
Transmission electron microscope
(TEM) dari
S. aureus
pada ...
Scanning electron microscope
(SEM) dari sel
P. fluorescens
...
Transmission electron microscope
(TEM
)
dari
P. fluorescens
...
Transmission electron microscope
(TEM
)
dari
P. fluorescens
...
Absorbansi dari bahan-bahan yang dilepaskan dan diserap UV...
Peningkatan jumlah ion K
+dan Ca
++yang dibebaskan sel ...
1. Bagan alir proses ekstraksi senyawa antimikroba biji atung…………..…..122
2. Pertumbuhan bakteri S. aureus selama 24 jam pada medium NB
pada konsentrasi ekstrak atung 0 sampai dengan 0.6 % (v/v)…………....122
3. Pertumbuhan bakteri S. aureus selama 24 jam pada medium NB
pada konsentrasi ekstrak atung 0 sampai dengan 0.4 % (v/v)……….…...122
4. Pertumbuhan bakteri P. fluorescens selama 24 jam pada medium NB
pada konsentrasi ekstrak atung 0 sampai dengan 0.6 % (v/v)…………....122
5. Pertumbuhan bakteri P. fluorescens selama 24 jam pada medium NB
pada konsentrasi ekstrak atung 0 sampai dengan 0.4% (v/v)…………... 123
6. Pertumbuhan bakteri L. plantarum selama 24 jam pada medium cair MRS pada konsentrasi ekstrak atung 0, 0.45, 0.5, 0.55 dan 0.6 % (v/v)…….….123
7. Pertumbuhan bakteri L. plantarum selama 24 jam pada medium cair MRS pada konsentrasi ekstrak 0, 0.65, 0.70, 0.75 dan 0.8 % (v/v)………...123
8. Pertumbuhan bakteri L. plantarum selama 24 jam pada medium MRS cair pada konsentrasi ekstrak 0, 1.0, 1.5, 2.0 dan 2.5 % (v/v)……….……124
9. Pertumbuhan bakteri B. subtilis selama 24 jam pada medium NB pada konsentrasi ekstrak 0, 0.45, 0.5, 0.55 dan 0.6 % (v/v)……….…124
10 Pertumbuhan E. coli selama 24 jam pada medium NB pada
konsentrasi ekstrak 0, s/d 0.6 % (v/v), ………..…124
11. Pengaruh ekstrak biji atung pada dosis di bawah MIC pada
pertumbuhan bakteri S. aureus pada medium cair NB, ………..….125
12. Pengaruh ekstrak etil asetat biji atung pada dosis di bawah MIC pada pertumbuhan bakteri P. flourescens pada medium NB ………....126
13. Pengaruh ekstrak biji atung pada dosis yang menyebabkan bakteri S. aureus stres pada medium cair NB……….………...127
14. Pengaruh ekstrak biji atung pada dosis yang menyebabkan bakteri P.
15. Pengaruh ekstrak etil asetat biji atung pada dosis di atas MIC pada
pertumbuhan bakteri S. aureus pada medium cair ………....128
16. Pengaruh ekstrak etil asetat biji atung pada dosis di atas MIC
pada pertumbuhan bakteri P. fluorescens pada medium NB……….….129
17. Pengaruh ekstrak etil asetat biji atung pada dosis di atas MIC pada
pertumbuhan bakteri E. coli pada medium cair...130
18. Skema proses pembuatan dekstrin tapioka (Mukodiningsih, (1991)…...131
19. Skema proses pembuatan tepung kedele (Koeswara, 1995)………..…….132
20. Pengaruh ekstrak etil asetat biji atung pada pertumbuhan bakteri
S. aureus pada pangan model padat ………..……….133
21 Data absorbansi dari bahan yang dilepaskan oleh sel S. aureus dan P.
fluorescens pengaruh ekstrak biji atung pada OD 260 dan 280 nm……...133
A. LATAR BELAKANG
Kesadaran masyarakat terhadap kesehatan kian hari semakin meningkat
sementara masyarakat dihadapkan akan tuntutan kebutuhan pangan yang praktis,
mudah diolah, siap saji dan tahan lama. Untuk mendapatkan bahan pangan
tersebut diperlukan bahan pengawet yang aman untuk dikonsumsi. Bahan
pengawet sintetis banyak ditemui dan dapat digunakan akan tetapi keamanannya
masih diragukan. Pada saat ini bahan pengawet alami diyakini lebih aman untuk
digunakan.
Atung (Parinarium glaberimum Hassk) merupakan tanaman hutan yang bijinya sejak lama secara tradisional digunakan oleh masyarakat Maluku untuk
mengawetkan ikan tangkapan jauh sebelum es balok dikenal (Moniharapon,
1991). Parutan biji atung digunakan masyarakat Maluku sebagai bahan
pencampur bahan makanan yang terbuat dari cacahan ikan mentah yang dibumbui
jahe, cabe, bawang dan air limun, makanan tradisional ini dikenal dengan nama
kohu-kohu (Moniharapon, 1991). Selain itu biji atung dapat digunakan sebagai
obat diare, menghentikan keputihan dan bubur biji atung yang dioleskan pada
kayu dapat mencegah serangan hama bubuk (Heyne, 1987).
Penelitian terhadap bubuk dan ekstrak air biji atung telah terbukti dapat
meningkatkan kesegaran dan umur simpan udang windu (Moniharapon,1991),
ikan kembung dan ikan mujair segar (Tilapia mossambica Peters) (Saragih, 1998),
pindang ikan mujair (Soeherman, 1997), dengan tekstur daging ikan menjadi lebih
padat dan kompak.
Aktivitas antimikroba ekstrak etil asetat biji atung mempunyai spektrum
penghambatan yang luas (Moniharapon, 1998) dan tinggi (Adawiyah, 1998).
Ekstrak ini mengandung senyawa fenolik (Adawiyah, 1998), terpenoid (Syamsir,
2002) dan senyawa dari golongan amina, ester, asam karboksilat, monoterpena
(limonena) dan tiol yang ditemukan dalam jumlah kecil yang dikenal memiliki
2
Untuk memanfaatkan ekstrak etil asetat biji atung sebagai bahan pengawet
pangan secara tepat dan efisien dalam memperpanjang umur simpan dan
menjamin keamanan pangan agar dapat digunakan dalam merancang operasi
pengolahan pangan, perlu dipelajari pola dan mekanisme inaktivasi mikroba.
Melalui pola inaktivasi, informasi kuantitatif dari kematian patogen dan perusak
makanan dapat diketahui untuk menunjukkan mekanisme kematian oleh senyawa
antimikroba. Melalui pola ini pengetahuan mikroba yang sakit (injury) dapat
diketahui untuk menghindari salah perkiraan terhadap mikroorganisme yang
masih hidup.
Inaktivasi bakteri merupakan hasil interaksi senyawa antimikroba dengan
bagian tertentu pada sel mikroba (Gilbert, 1984). Interaksi senyawa antimikroba
tersebut dapat menyebabkan sejumlah perubahan atau kerusakan pada sel bakteri
yang berpengaruh pada kelangsungan hidup bakteri. Kebanyakan senyawa
antimikroba bisa bersifat menghambat (bakteriostatik) atau mematikan
(bakterisidal), yang aktivitasnya tergantung pada konsentrasi yang digunakan
(Hugo dan Russel, 1983). Pada umumnya, pola inaktivasi bakteri oleh agen
antimikroba pada dosis yang mematikan kurva inaktivasi mengikuti reaksi kimia
ordo I bersifat eksponensial, sementara pola inaktivasi di bawah dosis mematikan
mikroba uji, secara umum memperlihatkan pola resistensi .
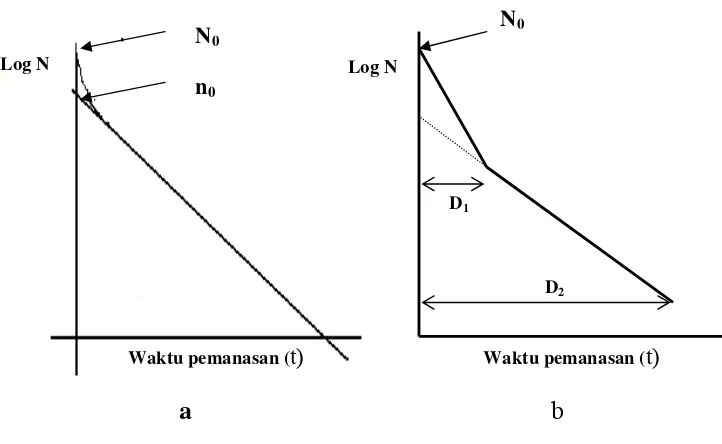
Pola inaktivasi bakteri oleh senyawa antimikroba pada dosis yang
mematikan tidak selalu bersifat logaritmik tergantung jenis antimikroba dan
mikroba yang dihambat, kebanyakan bersifat sigmoid (Soper dan Davis, 1994).
Dari hasil penelitian Moniharapon (1998) kurva kematian bakteri Pseudomonas
aeruginosa oleh ekstrak etil asetat biji atung berbentuk garis lurus bersifat eksponensial mengikuti reaksi kimia ordo pertama. Beberapa penyimpangan dari
garis lurus juga dapat terjadi tergantung dari jenis mikroorganisme yang diserang,
adakalanya terbentuk bahu (shoulder) pada awal kurva kematian bakteri atau ekor
(tail) pada akhir kurva (Stumbo, 1973; Pflug dan Holcomb, 1983; Soper dan
Davies, 1994).
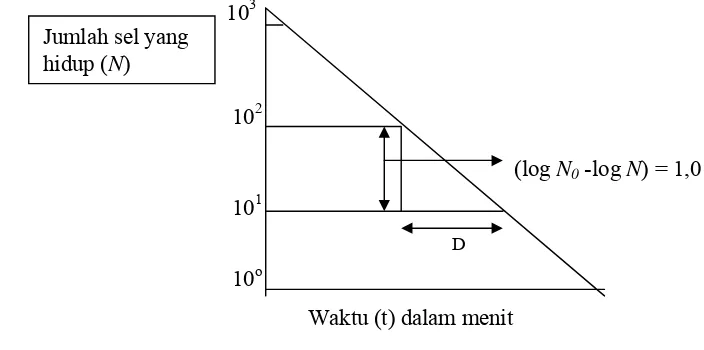
Kurva kematian bakteri digunakan sebagai dasar untuk menentukan
ketahanan mikroba oleh senyawa antimikroba, yang dinyatakan dengan nilai D
suatu populasi bakteri) dan z (peningkatan konsentrasi yang diperlukan untuk
menurunkan satu siklus log D pada kurva resisten dosis). Nilai D dan z diperoleh
dari kurva kematian yang bersifat eksponensial, membentuk garis lurus mengikuti
reaksi kimia orde pertama (Stumbo, 1973, Pflug dan Holcomb, 1983; Soper dan
Davies, 1994). Penentuan nilai D dan z untuk senyawa antimikroba pangan masih
sedikit dilakukan yaitu pada ekstrak biji atung (Moniharapon, 1998), ozon ( Kim
dan Yousef, 2000), CO2 dan tekanan hidrostatik (Park et al, 2003).
Pada dosis yang tidak mematikan mikroba akan sakit, terjadi sejumlah
perubahan dan kerusakan struktur sel bakteri yang akhirnya dapat mempengaruhi
fungsi metabolisme sel, pada kerusakan yang parah menyebabkan kematian.
Bentuk dan besarnya perubahan atau kerusakan struktur sel dipengaruhi oleh jenis
senyawa antimikroba, jenis mikroba dan besarnya konsentrasi yang digunakan
(Gemmel dan Lorian, 1996). Perubahan dan kerusakan struktur sel oleh senyawa
antimikroba dapat berupa perubahan morfologi sel, perubahan ultrastruktur sel,
ukuran sel, kebocoran dinding dan membran sel, ketebalan dinding, penampakan
sitoplasma dan lain-lain (Suganuma, 1972; Fass dan Prior, 1974; Gemmel dan
Lorian, 1996).
B. RUANG LINGKUP PENELITIAN
Lingkup penelitian ini meliputi : (1) Percobaan konsentrasi minimum
penghambatan (MIC) 5 jenis bakteri yaitu : Staphylococcus aureus, Pseudomonas fluorescens, Lactobacillus plantarum, Bacillus subtilis dan
Escherichia coli dengan ekstrak etil asetat biji atung, (2) percobaan inaktivasi bakteri S. aureus (Gram positif) dan P. fluorescens (Gram negatif) oleh ekstrak etil asetat biji atung pada beberapa dosis ekstrak etil asetat biji atung di bawah
nilai MIC (3) percobaan inaktivasi bakteri S. aureus, P. fluorescens dan E. coli
oleh ekstrak etil asetat biji atung pada beberapa dosis ekstrak etil asetat biji atung
di atas nilai MIC (4) percobaan inaktivasi bakteri S. aureus oleh ekstrak etil asetat biji atung pada beberapa dosis ekstrak etil asetat biji atung pada pangan model
4
menggunakan scanning electron microscopy (SEM) dan transmissi electron microscopy (TEM) (6) percobaan analisa kebocoran sel oleh ekstrak etil asetat biji atung.
C. TUJUAN DAN MANFAAT HASIL PENELITIAN
Penelitian ini secara umum bertujuan untuk mempelajari pola
penghambatan dan pola kerusakan sel bakteri oleh ekstrak etil asetat biji atung
(Parinarium glaberimum Hassk)..
Tujuan khusus dari penelitian ini adalah untuk :
1. Memperoleh dan membandingkan nilai MIC serta resistensi bakteri dari
ekstrak etil asetat biji atung untuk 5 jenis bakteri yaitu : S. aureus, P. fluorescens, L. plantarum, B. subtilis dan E. coli.
2. Menemukan pola regenerasi dan fenomena sakit dari bakteri S. aureus dan P. fluorescens oleh ekstrak etil asetat biji atung pada dosis di bawah nilai MIC.
3. Menemukan pola kematian pada dosis di atas nilai MIC, berdasarkan pola
kematian dipelajari kinetika inaktivasi (D dan z) S. aureus, P. fluorescens dan E.coli oleh ekstrak etil asetat biji atung.
4. Mengkaji penerapan nilai D pada pengawetan produk pangan model padat.
5. Menemukan mekanisme kerusakan sel bakteri S. aureus dan P. fluorescens oleh ekstrak etil asetat biji atung.
6. Menemukan bahan-bahan yang dikeluarkan oleh sel S. aureus dan P. fluorescens pengaruh ekstrak etil asetat biji atung.
Manfaat Hasil Penelitian
Dari hasil penelitian ini diharapkan dapat digunakan untuk menentukan
efektifitas dan merancang penggunaan atung sebagai pengawet secara tepat pada
A. ATUNG (Parinarium glaberrimum Hassk)
Atung adalah sejenis tanaman hutan tropis yang tumbuh secara alami di
Kawasan Timur Indonesia. Hampir di semua tempat di Maluku tanaman ini
ditemukan terutama di Maluku Tengah (Moniharapon, 1991), namun di Pulau
Jawa tidak ditemukan ( Heyne, 1987). Atung mempunyai nama yang
berbeda-beda di setiap daerah, di Aceh bernama Pele kambing, di Maluku, atung, Lomo di
Makasar orang Bugis menamakan Samaka dan di Ternate Saya ( Heyne, 1987).
1. Tanaman Atung
Tanaman atung memiliki pohon yang besar dan tumbuh lebat, setelah
tanaman agak berumur batangnya berlubang dengan kayu yang keras tetapi getas
dan tidak awet (Heyne, 1987). Tinggi pohon dapat mencapai ketinggian 10 m
dengan diameter pohon mencapai 40 cm, dengan kulit kayu berwarna coklat gelap
(Koorders dan Valeton, 1913 dalam Murhadi, 2002).
2. Buah dan Biji Atung
Bentuk dan besarnya buah atung menyerupai telur bebek, berwarna merah
gading pudar, mempunyai kulit luar yang keras dengan tebal kulit sebesar jari
tangan (Heyne, 1987 dan Adawiyah, 1998). Berat rata-rata satu buah atung
berkisar antara 31,3 - 48,7 gram dan apabila buah sudah kering kulit buah
menjadi retak (Adawiyah, 1998). Di bagian kulit buah terdapat mesokarp tebal
yang memiliki struktur berserat dengan arah vertikal dengan tekstur yang sangat
keras, bagian kulit dan mesokarp ini merupakan bagian terbesar dari buah
mencapai dua pertiga (68 %) berat utuh dengan berat antara 18,7 - 36,5 gram
(Adawiyah. 1998).
Di bawah kulit buah atung terdapat biji tunggal, memiliki jalur-jalur keriput,
dengan besar biji kira-kira sebesar telur ayam tetapi pipih dan sangat keras. Biji
ini menimbulkan suara gemeretak ketika buah utuh diguncang, biji berwarna
6
terhadap keseluruhan buah utuh rata-rata 31.8 % atau kira-kira sepertiga berat
buah utuh (Adawiyah.1988).
3. Komposisi Kimia Biji Atung
Hasil penelitian Adawiyah (1998), lemak merupakan komponen terbesar
(42,7 %) dari biji atung diikuti oleh air ( 8-13,2 % ), protein (5,4 %), serat kasar
(4,3 %), abu (2,1 %), pati (2,3 %) dan tannin (1,7 %). Kadar air biji atung
dipe-ngaruhi oleh umur simpan buah, semakin lama disimpan biji semakin kering dan
keras sehingga sulit untuk dihancurkan dan adanya kandungan tanin merupakan
penyebab rasa atung menjadi agak sepat.
Selanjutnya dari hasil penelitian Adawiyah (1998), tipe asam-asam lemak
yang mendominasi lemak biji atung terutama adalah asam lemak rantai panjang
yaitu bahenat (27,98 mg/g asam lemak), palmitat (24,61 mg/g lemak), linoleat
(21,68 mg/ g lemak), stearat (19,70 mg/lemak), oleat (19,24 mg/g lemak) serta
sejumlah kecil asam dokosaheksaenoat/ DHA (4,27 mg/g lemak), gadoleat (4,83
mg/g lemak), arakhidat (2,72 mg/g lemak ) dan linolenat (0,87 mg/g lemak).
Menurut Greshoff biji atung mengandung 31 % lemak (Heyne, 1987).
Lemak atung terdiri dari beberapa jenis asam lemak rantai panjang dalam bentuk
ester asil gliserol, termasuk asam parinarat yaitu asam lemak tidak jenuh C18:4 dengan 4 ikatan rangkap terkojugasi pada posisi ikatan 9,11,13 dan 15 (Skalar et al ,1981 dalam Murhadi, 2002), dalam bentuk dua isomer geometris yaitu (1) cis-asam parinarat (9,11,13,15- cis, trans, trans, cis-cis-asam oktadekatetraenoat) atau
disingkat cis-PnA dan (2) trans-asam parinarat (9.11,13,15-trans, trans, trans,
trans-asamoktadeka tetraenoat) atau disingkat trans-PnA (Skalar et al, 1989, 1981 dalam Murhadi, 2002).
Biji atung memiliki aroma khas atung terutama setelah berbentuk serbuk
biji atung. Murhadi (2002) telah mengidentifikasi aroma khas yang berupa
komponen volatil dari serbuk biji atung utuh, komponen volatil dari serbuk biji
atung yang telah dikurangi lemak minyaknya dan komponen volatil dari serbuk
biji atung yang telah dikurangi komponen polarnya. Dari ke tiga isolat volatil
tersebut Murhadi (2002) memperoleh 70 komponen volatil secara komulatif yang
halida (1), alkena (5), alkena siklik (3), alkuna (3), aromatik (1), amina (2), tiol
(1), ester (3), asam karboksilat (2), alkohol (5), aldehida (24), ester (1), alkil furan
(1), keton (4) dan senyawa lain (2). Komponen volatil golongan aldehida
merupakan golongan komponen volatil yang dominan, jumlahnya 34 % yaitu 24
dari 70 komponen volatil gabungan, komponen utamanya adalah : 2,4-dekadienal,
heksanal, 2-heptenal, 2,4-nonadienal, (E,E)-2,4-nonadienal dan (z)-2-dekenal.
Komponen aldehida ini masih ditemukan pada serbuk biji atung yang diekstraksi
dengan alat sokhlet menggunakan pelarut heksana selama 3 x 8 jam. Hal ini
menunjukkan bahwa ekstraksi dengan menggunakan pelarut heksana
menggu-nakan sokhlet selama 3 x 8 jam belum mampu menghilangkan seluruh kandungan
lemak minyak di dalam serbuk biji atung.
Selain senyawa dari golongan aldehida, senyawa-senyawa seperti golongan :
amina (2-propana amina dan N-metil-2-propuna-1-amina), ester (ester pentil asam
format dan ester butil asam asetat), asam karboksilat (asam propionat dan 2-metil
–2-asam propenoat), monoterpena (limonena) dan tiol (2-metil-2-undekanatiol)
teridentifikasi dalam jumlah kecil yang dikenal memiliki aktivitas bakteri
(Murhadi, 2002).
4. Potensi Atung Sebagai Bahan Pengawet Pangan
Daya antibakteri biji atung pertama kali diketahui dari kemampuan biji
atung yang dapat mengawetkan makanan tradisional dari Ambon yang dikenal
dengan nama kohu-kohu. Masyarakat biasa menambahkan parutan atung ke
dalam cincangan ikan mentah yang dibumbui jahe, bawang, cabe dan air limun
(Moniharapon, 1998). Atung juga dapat digunakan sebagai obat diare,
menghentikan murus-murus, menghentikan keputihan dan olesan bubur biji atung
pada kayu dapat mencegah serangan hama bubuk (Heyne, 1987). Bubuk biji
atung juga telah lama dan populer digunakan oleh nelayan di Maluku jauh
sebelum es balok dikenal sebagai pengawet ikan tangkapan (Moniharapon, 1991).
Mutu ikan tangkapan dapat dipertahankan beberapa hari sampai nelayan kembali
ke pelabuhan dan memasarkannya.
Penelitian atung sebagai pengawet pangan pertama kali diteliti oleh
8
sebanyak 3-5 % (bb) pada udang windu, ternyata mampu meningkatkan kesegaran
udang dari 4 jam menjadi 10 jam pada suhu kamar. Bila penambahan bubuk biji
atung sebesar 5 % dari berat udang (bb) dikombinasikan dengan penyimpanan
dalam bongkahan es dapat meningkatkan kesegaran sampai 2 hari dan bila
dikombinasikan dengan penyimpanan dingin dalam lemari es bersuhu 4oC dapat meningkatkan kesegaran mencapai 9 hari. Pada umur penyimpanan tersebut
rupa, tekstur, rasa, pH dan kadar air udang tidak berbeda dari kontrol, dan dapat
menahan pertumbuhan mikroba dan mengurangi susut bobot selama
penyimpanan.
Aplikasi bubuk biji atung sebesar 5-15 % pada ikan mujair (Tilapia mossambica Peters ) dapat memperpanjang umur simpan dari 3 hari menjadi 7 hari, pada ikan kembung penambahan sebesar 15 % meningkatkan umur simpan
dari 8 hari menjadi 13 hari (Saragih, 1998). Pada akhir penyimpanan total koloni
mikroba kedua jenis ikan masih di bawah batas kerusakan ikan yaitu kurang dari
5x105 koloni/gram ikan.
Soeherman (1998), membuktikan bahwa penggunaan bubuk biji atung
atau ekstrak air biji atung pada pindang ikan mujair mampu memperpanjang
umur simpan dari satu hari menjadi empat hari dengan tekstur daging ikan
menjadi lebih padat dan kompak.
5. Aktivitas Antibakteri Buah Atung
Hasil penelitian Moniharapon (1998), seluruh bagian buah atung
mengandung zat antimikroba akan tetapi bagian biji aktivitas antibakterinya jauh
lebih kuat (7 kali) daripada daging buah. Daging buah tidak efektif digunakan
sebagai antibakteri. Hal ini menguntungkan karena penyiapan biji untuk
dijadikan ekstrak jauh lebih mudah dibandingkan daging buah biji.
Selanjutnya dikatakan oleh Moniharapon (1998), ekstrak biji atung tua
mempunyai ativitas antibakteri 2 – 3 kali lebih kuat dari biji muda. Biji atung
segar memiliki aktivitas antibakteri 1,2 –1,5 kali lebih tinggi dari biji atung yang
disimpan pada suhu ruang selama 3 bulan namun biji atung simpan ini masih jauh
baik segar maupun yang telah disimpan keduanya baik sebagai bahan untuk
produksi bahan pengawet pangan (Moniharapon, 1998).
Metode ekstraksi dan jenis pelarut mempengaruhi aktivitas antibakteri biji
atung. Hasil penelitian (Moniharapon, 1998), metode ekstraksi cara refluks
menggunakan heksana menghasilkan aktivitas antimikroba lebih kuat (24,9 UIB)
dari pada metode maserasi metanol 100 % (9,8 UIB), kemudian metode maserasi
100 % lebih kuat dari refluks metanol 80 % (7,8 UIB). Selanjutnya dari hasil
penelitian Moniharapon (1998), ekstraksi buah atung dengan metode maserasi
menggunakan metanol, lalu ekstraknya diseparasi dengan heksana dan residunya
diseparasi lagi dengan etil asetat, menghasilkan ekstrak etil asetat dengan aktivitas
yang cukup tinggi dengan zona penghambatan yang lebih besar dari ekstrak
heksana. Ekstrak etil asetat dari biji atung ini mempunyai spektrum penghambatan
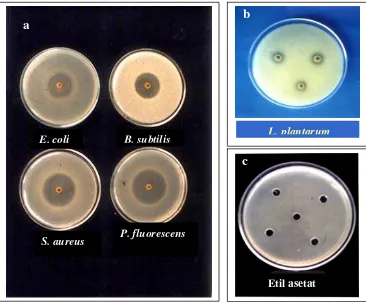
yang luas dan cukup kuat untuk 9 jenis bakteri pembentuk dan non pembentuk
spora, patogen dan pembusuk, Gram positif, Gram negatif, bentuk batang dan
kokus. Daya antibakteri biji atung ini secara konsisten sangat kuat terhadap 6 jenis
bakteri penting pada produk pangan yaitu S. aureus, S. enteritidis, S. typhimurium, E. coli, B. subtilis dan P. aeruginosa.
Ekstraksi biji atung secara tunggal, menggunakan pelarut polar yaitu
etanol 95 %, etanol 50 % dan air menghasilkan ekstrak dengan aktivitas
anti-mikroba yang rendah, ekstraksi tunggal dengan pelarut heksana (non polar) tidak
menunjukkan penghambatan akan tetapi dengan pelarut etil asetat menghasilkan
aktivitas tertinggi terhadap P. aeruginosa (Adawiyah, 1998).
Ekstraksi dengan cara bertingkat, menunjukkan aktivitas antimikroba yang
lebih tinggi dari ekstraksi tunggal (Adawiyah, 1998). Ekstraksi bertingkat dua
tahap yang dimulai dengan pelarut nonpolar (heksana) dilanjutkan dengan etil
asetat menghasilkan aktivitas yang lebih tinggi dari ekstraksi tunggal
menggunakan pelarut etil asetat saja dan ekstraksi bertingkat tiga tahap yaitu
dimulai dengan pelarut nonpolar (heksana) diikuti dengan pelarut semipolar (etil
asetat) dan terakhir dengan etanol (polar) menghasilkan ekstrak etanol yang
memiliki aktivitas antimikroba yang rendah. Ekstrak heksana etil asetat dari
metoda ekstraksi bertingkat dua tahap merupakan cara ekstraksi yang terbaik akan
10
diperoleh adalah ekstrak berwarna jingga, mengandung total fenol 47,6 ppm, berat
jenis 0,9876 g/cm3 dan indeks refraksi 1,44.
Dalam rangka untuk memperoleh ekstrak yang mempunyai aktivitas
antibakteri dan rendemen yang tinggi Murhadi (2003) menggunakan beberapa
pelarut nonpolar, semipolar dan polar. Hasilnya menunjukkan bahwa ekstraksi
serbuk biji atung kering yang didahului dengan petroleum eter pada suhu 40-60oC disokhlet selama 8 jam dan residunya diekstraksi (sokhlet, 3 x 8 jam) dengan
heksana lalu residunya direfluks pada suhu 60oC menggunakan pelarut polar yaitu metanol, ekstrak yang diperoleh menghasilkan aktivitas antibakteri (S. aureus) paling tinggi dengan diameter penghambatan 99,20 mm pergram biji atung
dengan rendemen 11,58 % (bb). Ekstrak metanol ini mempunyai potensi sebagai
pengawet pangan, hanya saja perlu dipertimbangkan kembali untuk
memi-nimalkan residu karena metanol bersifat toksik.
B. STRUKTUR SEL BAKTERI
Bakteri mempunyai ukuran yang bervariasi dengan panjang 0,2-60 μm
dengan diameter satu sampai beberapa mikron, kebanyakan bakteri yang
menginfeksi manusia mempunyai ukuran panjang 1-3 μm (Boyd, 1995). Secara
morfologi bakteri mempunyai struktur yang tidak sempurna, tidak mempunyai
dinding inti (membran nukleus), mitokondria dan retikulum endoplasma (Davis
et al , 1976).
Bakteri mempunyai 4 bentuk dasar yaitu batang (jamak: basili), bulat atau
kokus (jamak: koki), bentuk spiral dan persegi (Boyd, 1995). Bakteri berbentuk
bulat dapat dibedakan atas diplokoki (berpasangan), streptokoki (bentuk rantai),
tetrad (4 sel membentuk segi empat), stapilokoki ( tidak beraturan menyerupai
anggur) dan sarcinae (kumpulan sel berbentuk kubus) (Fardiaz, 1989). Bakteri
berbentuk batang terdapat dalam bentuk berpasangan (diplobasili) atau
membentuk rantai (streptobasili). Pengelompokan ini pada beberapa keadaan
bukan merupakan sifat morfologinya, melainkan dipengaruhi oleh tahap
1. Dinding Sel
Hampir semua sel prokariot mempunyai dinding sel kecuali mikoplasma
(Nikaido dan Vaara, 1985 dan Fardiaz, 1989). Dinding sel ini sangat penting bagi
bakteri dan dari segi kimiawi tidak sama dengan struktur jaringan hewan.
Dinding sel bakteri tebal dan relatif kaku terletak disebelah luar membran
sitoplasma, berfungsi melindungi membran sitoplasma yang rapuh dan menjaga
bentuk sel bakteri. Semua dinding sel bakteri mempunyai komponen struktural
yang sama yang dinamakan mukopolisakarida dinding sel yaitu peptidoglikan
(murein) (Volk dan Wheeler, 1988; Moat dan Foster, 1988). Komponen dinding
memberikan kekakuan yang diperlukan untuk mempertahankan keutuhan sel.
Peptidoglikan adalah molekul yang sangat besar meliputi seluruh sel, tersusun
dari N-asetilglukosamin dan asam N-asetilmuramat serta beberapa asam amino
L-alanin, D-L-alanin, D-glutamat dan lisin atau asam diamino pimelat (ADP). Asam
amino ini menempel pada N-asetilmuramat yang bisa berbeda untuk setiap
organisme. Struktur peptidoglikan ini hanya terdapat pada sel prokariot,
N-asetilmuramat tidak pernah ditemukan pada sel eukariot (Fardiaz, 1989).
Berdasarkan komposisi dinding sel dan sifat pewarnaan, bakteri dibedakan
atas dua kelompok yaitu bakteri Gram positif dan bakteri Gram negatif (Moat dan
Foster, 1988; Fardiaz, 1989). Pemberian zat warna yang sama pada kedua bakteri
ini memberikan hasil yang berbeda. Bakteri Gram positif dan bakteri Garam
negatif sama-sama diberi zat warna kristal violet, kelebihan zat warna dicuci
dengan air kemudian diberi larutan yodium (Lugol), kompleks kristal violet
dengan yodium yang terbentuk berwarna violet biru. Setelah itu dilakukan
pencucian dengan alkohol, pada bakteri Gram negatif dinding sel menjadi tidak
berwarna dan diberi pewarna safranin warnanya berubah menjadi merah
sedangkan pada bakteri Gram positif setelah dicuci dengan alkohol tetap berwarna
violet biru dengan penambahan safranin dan tidak berpengaruh terhadap warna
biru. Perbedaan struktur dan dinding sel bakteri Gram positif dan bakteri Gram
negatif disajikan pada Gambar 1.
12
Gambar 1. Perbedaan struktur dinding sel bakteri Gam positif dan bakteri Gram
a. Bakteri Gram Positif
Dinding sel bakteri Gram positif cukup tebal (20-80 nm) (Volk dan
Wheeler, 1988), 90 % dinding selnya terdiri dari lapisan peptidoglikan dan
sisa-nya adalah asam teikoat dan asam teikuronat (Roger et al, 1980). Peptidoglikan adalah polimer liner dari asam N-asetilglukosamin dan N-asetilmuramat secara
berganti-ganti. Rantai peptida menempel pada asam muramat. Komposisi
polipeptida dari peptidoglikan yang menempel pada asam muramat bisa berbeda
dari satu organisme ke organisme lain (Moat dan Foster, 1989). Kebanyakan
bakteri Gram positif berbentuk kokus (bulat) mengandung lisin sebagai pengganti
ADP, sedangkan Gram positif lainnya mengandung asam amino lainnya (Fardiaz,
1989). Pada S. aureus rantai peptida yang menempel pada asam muramat adalah L-alanin, D-glutamat, L-lisin dan D-alanin, antar tetrapeptida terdapat ikatan
silang yang terdiri dari 5 unit glisin membentuk jembatan dari D-alanin pada
posisi 4 dari suatu tetrapeptida ke asam amino pada posisi 2 atau 3 pada peptida
tetangga (Moat dan Foster, 1989). Pada S. aureus derajat ikatan silang antar peptida yang berdekatan sangat tinggi (100 %), berlawanan dengan E. coli derajat silangnya rendah kira-kira 30 %. Menurut Franklin dan Snow (1989), dinding sel
bakteri Gram positif banyak mengandung asam amino alanin, asam amino ini
bersifat hidrofobik.
Asam teikoat adalah rantai panjang gliserol (alkohol gula dengan tiga atom
C) atau ribitol ( alkohol gula dengan lima atom C ) yang terikat satu sama lain
oleh ester fosfat dan semua gugus hidroksil dikaitkan dengan berbagai gula atau
asam amino yang memberikan variasi pada struktur (Moat dan Foster, 1988).
Istilah asam teikoat, juga mencakup semua polimer yang mengandung gliserol
atau ribitol fosfat yang terdapat pada dinding sel, membran dan kapsul. Asam
teikoat bermuatan negatif, yang mempengaruhi muatan pada permukaan sel (Volk
dan Wheeler, 1988). Asam teikoat yang terdapat pada lapisan peptidoglikan
berikatan kovalen melalui asam muramat dan gugus fosfat dari ribitol atau gliserol
fosfat (Moat dan Foster, 1988). Asam teikoat yang terikat pada membran sel
selalu dalam bentuk polimer gliserol fosfat dan berikatan kovalen dengan lipid
disebut dengan asam lipoteikoat (Moat dan Foster, 1988). Asam teikoat dinding
14
dengan dua polimer dari isomeri glukosilgliserol fosfat (Moat dan Foster, 1988).
Asam lipoteikoat mempunyai rantai gliserol fosfat yang panjang dan bersifat polar
berikatan pada sejumlah kecil glikolipid yang bersifat hidrofobik. Pada beberapa
organisme, asam lipoteikoat ini tidak hanya terdapat pada dinding sel, juga bisa
muncul pada permukaan dinding sel. Pada L. plantarum pemberian antiserum khusus pada bagian gliserol fosfat yang berguna sebagai penanda muncul pada
permukaan dan berikatan pada bagian luar sel (Volk dan Wheeler, 1988). Asam
teikoat ini hanya terdapat pada bakteri Gram positif dan tidak terdapat pada
bakteri Gram negatif (Moat dan Foster, 1988).
b. Bakteri Gram Negatif
Dinding sel bakteri Gram negatif mempunyai susunan kimia yang lebih
rumit dari pada bakteri Gram positif (Gambar 1). Dinding sel bakteri Gram
negatif berlapis-lapis dengan lapisan peptidoglikan hanya 5-20 % dari dinding sel,
lapisan lainnya terdiri dari protein, lipopolisakarida dan lipoprotein (Fardiaz,
1989).
Pada bagian luar peptidoglikan terdapat lapisan dinding sel yang kompleks
yang disebut membran luar (outer membran ) (Boyd, 1995). Membran luar ini
menempel pada peptidoglikan dan dihubungkan oleh molekul lipoprotein, disusun
oleh fosfolipid 20-30 %, lipopolisakarida 30 % dan protein 40-50 %. Rongga
antara membran luar dan lapisan peptidoglikan disebut ruang periplasma berisi
enzim-enzim periplasma yang tergolong dalam enzim ekstraseluler (Fardiaz,
1989), ruang ini merupakan tempat lewatnya bermacam-macam enzim dan protein
(Moat dan Foster, 1989) .
Fosfolipid dari membran luar susunannya mirip dengan membran bilayer
pada membran sitoplasma. Protein yang terdapat pada fosfolipid berupa saluran
disebut porin, protein ini berfungsi sebagai pengangkut zat makanan (Boyd,
1995). Permukaan luar Gram negatif mengandung lemak yang relatif tinggi
berada dalam bentuk lipopolisakarida (Moat dan Foster, 1988). Komponen lipid
dari lipopolisakarida melekat pada fosfolipid sementara bagian polisakarida
muncul pada permukaan sel. Komponen lipid dari lipopolisakarida disebut lipid
2. Membran Sitoplasma
Membran sitoplasma terletak diantara sitoplasma dan dinding sel dengan
ketebalan kira-kira 7,5 nm (Fardiaz, 1989). Membran ini rapuh tepat terletak di
bawah dinding sel yang kaku, merupakan 8-10 % dari bobot kering sel (Volk dan
Wheeler, 1988). Membran sitoplasma baik Gram positif maupun Gram negatif
terdiri dari dua lapis lipid (lipid bilayer) disusun dari unsur dasar yang sama yaitu
fosfolipid, glikolipid dan bermacam-macam protein ( Moat dan Foster,1988).
Protein merupakan komponen utama dari dinding sel (60 - 80 %), yang
dikelom-pokkan menjadi protein periferal ( protein dekat membran berikatan secara
elek-trostatik atau interaksi hidrofobik) dan protein integral (protein yang sebagian
melekat pada membran dan sebagian muncul pada permukaan membran (Beuchat,
1978).
Membran sitoplasma berfungsi sebagai barier untuk beberapa molekul besar
sementara molekul-molekul seperti air dan oksigen dapat masuk secara pasif ke
dalam sitoplasma (Boyd, 1995). Protein yang terdapat pada membran selain
berfungsi sebagai penguat membran juga berfungsi sebagai transport gula, asam
amino dan metabolit lainnya, protein disini berfungsi sebagai carrier ( pembawa)
melalui proses difusi yang difasilitasi (Boyd, 1995). Protein sitoplasma juga
dihubungkan dengan fungsi respirasi yang terjadi dalam sitoplasma. Di dalam
membran sel terdapat enzim-enzim yang terlibat dalam pemasangan komponen
dinding sel.
3. Inti Sel (Nukleus)
Sel prokariot tidak mempunyai nukleus sejati seperti pada sel eukariot.
Komponen genetik DNA disimpan dalam organ nukleus yaitu kromosom dan
pada sel prokariot bentuknya seperti benang tidak dikelilingi oleh membran
(Fardiaz, 1989). Tempat atau daerah dimana benang-benang ini terkosentrasi
disebut nukleoid, benang ini dalam bentuk melingkar-lingkar terletak pada pusat
sel dan tempat sel membelah dan tidak berhubungan dengan protein (Boyd, 1995).
Panjang benang ini bila diluruskan mencapai 1100 sampai 1400 μm sehingga
kelihatan memadati nukleoid di dalam sel ( Fardiaz, 1989 dan Boyd, 1995).
16
pertumbuhan sel (Boyd, 1995). Bila bakteri membelah sangat cepat dapat dilihat
4 nukleoid pada setiap bakteri, tetapi pada sel yang sangat lambat membelah
hanya satu nukleoid bisa diamati.
4. Ribosoma
Ribosoma merupakan komponen penting untuk sintesa protein di dalam
sel, terdiri dari 60 % RNA dan 40 % protein ( Davis et al, 1976 ; Fardiaz, 1989 dan Boyd, 1995 ). Ribosom terletak di dalam sel dan mengisi sitoplasma dengan
beratnya mencapai 50 % dari berat kering sel. Di bawah mikroskop elektron,
potongan tipis ribosoma terlihat sebagai granula-granula halus, pada perbesaran
tinggi ribosoma berbentuk bulat ( Boyd, 1995).
5. Kapsul
Beberapa bakteri pada permukaan sel mengeluarkan komponen berlendir
yang dapat dilihat di bawah mikroskop setelah diwarnai dengan pewarna negatif
atau tinta india (Moat dan Foster, 1988). Komponen berlendir tersebut disebut
kapsul jika terdapat dalam bentuk kompak mengelilingi permukaan sel, sedangkan
jika tidak terlalu kompak dan mudah terlepas disebut lapisan lendir. Kapsul dan
lapisan lendir ini terdiri dari polisakarida, polipeptida atau kompleks
polisakarida-protein.
Pembentukan kapsul oleh bakteri dipengaruhi oleh medium pertumbuhan
dan kondisi lingkungannya (Fardiaz, 1989). Bakteri pembentuk kapsul jika
tumbuh pada suatu medium akan membentuk koloni yang bersifat mukoid,
sedangkan jika tumbuh pada makanan menjadi berlendir. Pembentukan kapsul
oleh bakteri meningkatkan ketahanan bakteri terhadap panas, bahan kimia
C. SENYAWA ANTIMIKROBA
1. Pengertian
Russel (1983) menyatakan semua perlakuan yang berhubungan dengan
inaktivasi mikroba dikelompokkan ke dalam senyawa antimikroba. Perlakuan
tersebut dapat berupa proses fisik, kimia atau dapat berupa kombinasi kedua
perlakuan tersebut. Senyawa kimia yang digunakan untuk menginaktifkan
mikroba dapat dikelompokan atas 3 kelompok yaitu senyawa antibiotik, senyawa
non antibiotik dan produk-produk immunologi (Hugo dan Russel, 1983). Ke
dalam senyawa non antibiotik termasuk senyawa yang bersifat desinfektan,
antiseptik, sanitiser, kemoterapi, pengawet (Hugo dan Russel, 1983), bahan
tambahan makanan (food aditif), pengawet pangan dan pengawet farmasi (Russel,
1991).
Dalam ilmu pangan yang dimaksud dengan senyawa antimikroba adalah
sejenis bahan tambahan makanan yang digunakan untuk mencegah kerusakan atau
kebusukan yang disebabkan oleh mikroorganisme pada bahan pangan (Branen
dan Davidson, 1983). Senyawa antimikroba bisa berupa senyawa pengawet kimia
dan pengawet alami termasuk ke dalamnya garam, gula, vinegar, rempah-rempah,
ekstrak minyak dari rempah-rempah, zat-zat dari pengasapan, H2O2, sistem laktoperoksidase dari susu ( kandungan lainnya seperti casein, laktoferin) dan
lain-lain. Garam, gula, berbagai rempah-rempah, esensial oil, proses pengasapan
yang sering ditambahkan pada bahan makanan secara tradisional tanpa disengaja,
yang tujuannya untuk penambah flavor, mempunyai aktivitas antimikroba.
Beberapa senyawa kimia yang bersifat antimikroba adalah asam organik dan dan
asam lemak rantai medium (asam benzoat dan garamnya, asam laktat, asetat,
propionat, askorbat, sorbat, sitrat, format), beberapa gas ( sulfur dioksida, sulfit,
nitrit, karbon dioksida, nitrogen, ozon, klorin), beberapa antibiotik (nisin, subtilin,
18
2. Stres Mikroba oleh Senyawa Antimikroba
Berbagai perlakuan dalam proses pengolahan atau pengawetan pangan ditujukan untuk membunuh atau menghambat pertumbuhan sel mikroorganisme. Perlakuan tersebut jika diberikan dalam dosis subletal yaitu dosis yang tidak mematikan dapat mengakibatkan sel mengalami kerusakan subletal sehingga sel menderita stres atau sakit (injury) ( Russell, 1984, Jay, 1986 dan Fardiaz, 1992). Sel yang sakit tidak dapat dideteksi dengan media pertumbuhan mikroba rutin dan sel ini dapat tumbuh kembali pada keadaan lingkungan yang memungkinkan untuk tumbuh setelah lingkungan stres hilang. Hal ini dapat menyebabkan salah perkiraan terhadap umur simpan produk dan sangat berbahaya terhadap kesehatan terutama untuk bakteri patogen. Perlakuan tersebut dapat berupa pemanasan (Hurst, 1984; Jay, 1986; Murano dan Pierson, 1993), aw (Gilbert, 1984),
pendi-nginan dan pembekuan (Mackey, 1984), irradiasi (Moseley,1984), penambahan senyawa antimikroba atau pengawet (Gilbert, 1984) atau kombinasi perlakuan-perlakuan tersebut (Bunduki et al, 1995).
Bakteri dikatakan stres atau sakit jika kehilangan salah satu atau lebih sifat-sifat atau aktivitasnya pada kondisi yang dapat dilakukan oleh sel-sel normal. Sel yang sakit tidak mampu menyerap nutrien secara normal dan tidak mampu tumbuh di dalam medium yang mengandung agen antimikroba lain atau sejenis. Bila sel yang sakit dikeluarkan dari kondisi (lingkungan) stres maka sel akan sembuh kembali dan dapat membentuk koloni.
D. MEKANISME KERJA SENYAWA ANTIMIKROBA
Dinding sel, membran sitoplasma dan sitoplasma merupakan target utama dari senyawa antimikroba.
1. Merusak Dinding Sel
Dinding sel pada bakteri Gram positif terdiri dari peptidoglikan yang berikatan dengan asam teikoat. Pada bakteri Gram negatif, yang dimaksud dengan dinding sel adalah lapisan paling luar dari sel yang disebut membran luar (outer membrane) yang terdiri dari fosfolipid, lipopolisakarida (LPS) dan protein (Russel, 1984).
Beberapa senyawa kimia bekerja pada dinding sel yaitu menghambat sintesis peptidoglikan bakteri Gram positif dan Gram negatif. Antibiotik β-laktam seperti penisilin dan sepalosporin mengganggu enzim-enzim yang sensitif terhadap penisilin yang berfungsi mensintesis peptidoglikan, yang dapat diukur dari jumlah protein yang dapat berikatan dengan penisilin (PBPs) yang terdapat pada membran sitoplasma (Russel, 1983 dan 1984). D-sikloserin bekerja pada tahap awal sintesis dinding sel bersaing dengan enzim alanin rasemase dan alanin sintetase, vankomisin juga mempengaruhi sintesis dinding sel. Polimiksin bekerja pada bagian luar dan dalam membran sitoplasma bakteri Gram negatif, LPS dan fosfolipid pada bagian luar membran terlibat dalam sisi pengikatan.
20
2. Menggangu Membran Sitoplasma
Membran sitoplasma berperan dalam mempertahankan keutuhan struktur sel dan berfungsi dalam transport nutrien secara selektif ke dalam sel. Membran juga tempat terletaknya enzim-enzim yang terlibat dalam biosintesis dinding sel. Bila membran rusak maka fungsinya akan terganggu yang mengakibatkan pertumbuhan sel terhambat atau sel menjadi mati (Russel, 1983; Fardiaz, 1988 dan Brooks et al. 1989). Agen fisik maupun senyawa kimia pada organisme prokariot maupun eukariot dapat menyebabkan kematian dengan rusaknya membran (Russel, 1984).
Manifestasi dari kerusakan membran adalah kebocoran kandungan intraseluler berupa pentosa atau asam-asam amino atau ion K+ (Russell,1984). Beberapa senyawa yang merusak membran adalah fenol, klorheksidin, amonium kuartener, paraben (Russel, 1984). Klorheksidin pada konsentrasi rendah menye-babkan kebocoran sel, sementara pada konsentrasi tinggi dapat menggumpalkan sitoplasma (Russel, 1983 dan 1984).
3. Menganggu Protein dan Asam Nukleat
Kematian dan kerusakan sel dipengaruhi oleh keutuhan alami molekul protein dan asam nukleat (Fardiaz, 1988). Denaturasi protein dan asam nukleat oleh senyawa antimikroba dapat menyebabkan kerusakan sel yang fatal dan tidak dapat disembuhkan.
Beberapa senyawa antibiotik dan senyawa kimia yang merusak DNA adalah akridin merusak DNA dengan cara berinterkalasi dengan DNA, etilen oksida dan formaldehid merusak DNA dengan cara alkilasi dari asam amino dengan grup fosfat dari asam nukleat, rifampisin menghambat polimerase RNA, mitomisin menghambat DNA dengan cara membentuk ikatan kovalen dengan DNA.
E. PERUBAHAN STRUKTUR SEL MIKROBA
Efek senyawa antimikroba pada morfologi dan ultrastruktur sel bakteri dapat dikelompokkan menurut target dimana perubahan sel terjadi. Misalnya antibiotik, perubahan pada dinding sel disebabkan oleh ß-laktam, polimiksin menyebabkan perubahan pada membran plasma, kloramfenikol, tetrasiklin dan aminoglikosidase meyebabkan perubahan pada ribosom (Gemmel dan Lorian, 1996).
Perubahan struktur tergantung dari aktivitas antimikroba, seperti β-laktam mempunyai kisaran yang berbeda aktivitasnya di bawah atau di atas MIC (Gemmel dan Lorian, 1996). Penisilin menghasilkan perubahan morfologi pada konsentrasi rendah (1/16 MIC), sefaloridin aktif hanya pada 1/3 MIC. Destruksi sel bakteri terjadi dengan sefaloridin pada 2 kali MIC tetapi ampisilin memerlukan konsentrasi yang lebih tinggi untuk menghasilkan lisis yang sempurna. Pada konsentrasi antibiotik mendekati MIC, terjadi lisis pada bagian sel yang memanjang. Lisis dapat terjadi pada bagian dinding sel yang mengakibatkan membran sel pecah dan sitoplasma keluar. Pada konsentrasi di atas MIC filamen berhenti tumbuh dan sel lisis. Beberapa β-laktam pada konsentrasi lebih besar dari MIC menyebabkan pembentukan protoplas tanpa perpanjangan.
1. Pembentukan Filamen
22
membelah menjadi individu baru, dan bila dipindahkan pada medium yang bebas stres akan memisah menjadi individu.
Filamen dihasilkan pada pemberian antibiotik pada konsentrasi rendah (Gemmel dan Lorian, 1996). Amoksilin menghasilkan filamen yang pendek pada E. coli sementara sefalesin atau sefositin menghasilkan filamen yang panjang pada P. aeruginosa. Pada konsentrasi yang lebih tinggi, dinding sel menjadi lebih tidak teratur dan berombak. Pada konsetrasi lebih tinggi ini dinding sel tidak bersambung, hasil lisis filamen. Pada beberapa organisme yang membentuk filamen perpanjangan terjadi pada bagian tengah yang sering diamati pada E. coli dan P mirabilis yang kontak dengan ampisilin.
Pada dosis di bawah MIC, efek morfologi dari antibiotik yang sama berbeda dengan berbedanya spesies (Gemmel dan Lorian, 1996). Misal, penisilin dapat menyebabkan penghambatan inisiasi septum pada E. coli oleh karenanya terbentuk filamen, pada E. faecalis terbentuk rantai panjang bentuk koki yang tidak beraturan yang mengandung beberapa septa yang tidak lengkap karena penghambatan penyelesaian septum, pada staphylococci penghambatan lisis septum menyebabkan berkembangnya sel dengan septa yang banyak.
Pembentukan filamen juga diamati pada L. monocytogenes yang ditumbuhkan dalam 1,5 mol/l NaCl panjangnya menjadi 50 kali (Jorgensen et al., 1995). Sebelumnya Brazin (1973 dalam Rowan, 1999) juga menemukan peru-bahan morfologi L. monocytogenes di dalam makanan yang mengandung kadar garam tinggi (8-9 %). Menurut Isom et al (1995) pembentukan filamen dimulai pada konsentrasi garam di atas 1,000 mM dan panjangnya meningkat dengan meningkatnya konsentrasi.
Brandi et al ( 1989) melaporkan E. coli juga membentuk filamen pada perlakuan hidrogen peroksida (H2O2), panjang filamen meningkat dengan
lamanya waktu kontak. Perlakuan H2O2 pada konsentrasi tinggi menghasilkan
kerusakan yang ekstensif terhadap membran sitoplasma dan terbentuk jarak (gaps) antara sitoplasma dan dinding sel. Imlay dan Linn (1987) melaporkan efek H2O2
luka. Fenomena yang sama diamati pada pH 5,0-6,0 yang diatur dengan asam sitrat dan pada pH.9 dengan NaOH.
Panas pada suhu di atas optimal, pada L. monocytogenes menyebabkan pertumbuhannya tidak stabil, membentuk filamen yang panjangnya sampai 110
m, terjadi perubahan morfologi yang tidak khas; koloni tidak beraturan, kemilauannya hilang dan terjadi perubahan fisiologi (Rowan, 1999). Mikro-organisme yang membentuk filamen lebih tahan panas karenanya terdapatnya bahu dan ekor yang jelas pada respon kinetika kematian.
2. Pembentukan Septum dan Peningkatan Ukuran Sel
Semua β-laktam mempunyai efek morfologi yang sama pada stafilokoki dan Gram positif kecuali stafilokoki yang resisten terhadap metisilin (Gemmel dan Lorian, 1996). Penisilin menyebabkan sel-sel stafilokoki menjadi besar yang diamati pada mikroskop cahaya, TEM dan SEM. Setelah kontak pada waktu yang relatif pendek pada konsentrasi yang sama atau lebih besar dari MIC septa kehilangan densitas dan bentuk menjadi tidak beraturan dan keliling dinding sel lebih tipis. Penebalan septa dengan dinding sel yang normal diamati setelah kontak pada penisilin pada dosis di bawah MIC, tetapi efek ini tergantung pada medium, tekhnik kultivasi yang digunakan dan ada atau tidak adanya lisozim dan tripsin (Gemmel dan Lorian, 1996).
Stafilokoki di dalam media bebas obat akan membelah, berpisah dalam bentuk cluster karena pembelahan dalam banyak arah. Bila stafilokoki dikon-takkan pada penisilin pada dosis di bawah MIC memperlihatkan sejumlah nuklei tetapi tidak memisah. Penghambatan pemisahan septa bersifat reversible. Bila diinkubasi pada medium bebas obat, cluster dari staphylococcus memisah menjadi cluster yang lebih kecil dan nampak seperti normal.
24
membran sitoplasma dan dinding sel tidak rusak. Kejadian ini menunjukkan bahwa antimikroba bekerja pada sitosol. Hal ini kemungkinan disebabkan oleh penghambatan DNA, sementara makromolekul yang lain seperti RNA, protein, dan lipid terus disintesis tanpa membelah akibatnya ukuran sel menjadi besar. .
Ekstrak air teh hijau (Camellia sinensis) menyebabkan perubahan morfo-logi yang ekstensif pada S. aureus yang resisten terhadap metisilin (MRSA) galur US12 (Hamilton-Miller dan Shah, 1999). Pada konsentrasi 256 g/l (1/2 MIC) pembelahan sel dan pemisahan sel menjadi sangat kacau, sehingga sel menjadi besar dengan terbentuk septa yang banyak sampai 14 koki ditemukan dan tidak terpisah. Pada keadaan ini dinding sel bagian luar normal sementara pada bagian dalam menebal. Perubahan morfologi seperti ini tidak ditemukan pada perlakuan ekstrak yang sama pada S. aureus yang sensitif terhadap metisilin
3. Penebalan Dinding Sel
Kloramfenikol, tetrasiklin dan rifampisin menyebabkan penebalan dinding sel 3-4 kali dari normal pada sel S. aureus (Gemmel dan Lorian, 1996). Staphylococcus yang ditumbuhkan di dalam rifampisin terjadi perubahan ultra-struktur pada konsenrasi 3-20 kali MIC. Dinding sel periferal meningkat ketebalannya 3-4 kali dari normal dengan permukaan luar yang berombak dan ketebalan septa 2-10 kali dari normal. Rifampisin menghambat sintesis protein. Kloramfenikol menghasilkan perubahan dengan karakteristik : ribosom hilang dari pusat sel, agregasi mengarah ke membran sitoplasma, sementara agregat material inti mengarah ke pusat sel. Bila Gram positif bentuk batang seperti B. cereus dikontakkan pada kloramfenikol dinding sel menebal, mirip dengan perubahan yang diamati pada sel S. aureus.
4. Terbentuknya Tonjolan (Blebs) pada Permukaan Sel
Melalui scanning electron microscope (SEM) S. aureus yang kontak dengan 0,1 MIC sefalotin selama 3 jam perubahan yang terjadi adalah terbentuk tonjolan pada permukaan sel dengan letak yang tidak beraturan (Klainer, 1974). Kontak sefalotin selama 90 jam, efek yang lebih besar ditemukan terbentuk tonjolan seperti batu, dinding sel rusak, ukuran sel menjadi lebih besar dengan permukaan yang kasar seperti mosaik. Sel berbentuk batu dengan permukaan kasar ditemukan semakin banyak pada sel yang dikontakkan dengan 10 MIC sefalotin selama 3 jam. Metisilin juga memperlihatkan bentuk kerusakan yang sama berupa kerusakan dinding sel berbentuk batu yang besar. Perubahan sel ini menunjukkan bahwa senyawa antimikroba bekerja pada dinding sel mempe-ngaruhi sintesis dinding sel. Hal ini juga ditemui pada streptomisin, eritromisin, kloramfenikol dan tetrasiklin.
Bermacam-macam senyawa antimikroba diketahui mengganggu sintesis protein